Bệnh tim mạch
Thuốc điều trị rối loạn nhịp tim: Phân loại và lưu ý khi sửa dụng
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nguồn: Sách Thuốc tim mạch trong thực hành lâm sàng (PGS.TS.BS. Phạm Mạnh Hùng – Ths. BSNT. Phạm Trần Linh)
Tác giả
Trần Văn Đồng
Lê Văn Tuấn
Nhà thuốc Ngọc Anh xin giới thiệu đến bạn đọc về chủ đề thuốc điều trị rối loạn nhịp tim trong điều trị tim mạch qua bài viết sau đây.
PHẦN I. GIỚI THIỆU CHUNG VỀ NHÓM THUỐC ĐIỀU TRỊ RỐI LOẠN NHỊP TIM
GIỚI THIỆU
Các thuốc sử dụng để điều trị và dự phòng các rối loạn nhịp tim được gọi là thuốc chống rối loạn nhịp tim. Các thuốc điều trị rối loạn nhịp (Antiarrhythmic drugs – AADs) ức chế các rối loạn nhịp thông qua tác dụng trên các kênh ion và các thụ thể. Mặc dù ban đầu, các thuốc này được phát triển với mục tiêu cải thiện tỷ lệ sống còn ở bệnh nhân có bệnh tim cấu trúc có rối loạn nhịp nhưng các thử nghiệm ngẫu nhiên lớn đã cho thấy AADs không đạt được những hiệu quả mong muốn.
Vai trò của các thuốc điều trị rối loạn nhịp tim đã có những thay đổi đáng kể từ khi có nhiều phương pháp điều trị rối loạn nhịp mới được phát triển, lợi ích – nguy cơ của các thuốc này trên lâm sàng được hiểu biết rõ ràng hơn. AADs có vai trò quan trọng trong việc điều trị bệnh nhân bị rối loạn nhịp nhĩ và thất, hỗ trợ cho các biện pháp điều trị triệt để như triệt đốt qua đường ống thông.
Trong mục tiêu dự phòng nguyên phát và thứ phát đột tử do nguyên nhân tim mạch, AADs đã được chứng minh không hiệu quả bằng máy phá rung tự động (ICD). Rất nhiều thuốc điều trị rối loạn nhịp tim cũ đã bị rút khỏi thị trường, các thuốc mới hơn và an toàn hơn đã được đưa vào thay thế.
Mối quan tâm lớn nhất của các thầy thuốc lâm sàng gặp phải khi quyết định khởi trị và duy trì các thuốc chống rối loạn nhịp tim là:
- Nguy cơ xuất hiện các rối loạn nhịp mới.
- Rối loạn nhịp cũ xuất hiện lại với tần số dày hơn.
- Tình trạng ngộ độc các thuốc AADs.
Có rất ít các thuốc điều trị rối loạn nhịp tim được xếp vào nhóm an toàn khi khởi trị trong các khuyến cáo. Sự hiểu biết rõ hơn về lợi ích và nguy cơ của AADs đã giúp việc sử dụng nhóm thuốc này hiệu quả và an toàn hơn. Việc cân nhắc cẩn thận tác động làm nặng lên các rối loạn nhịp và tác dụng gây độc đã dẫn đến việc nhiều loại AADs bị rút khỏi thị trường (procainamid, tocainide và bretylium đường uống) và một số thuốc ít được sử dụng (quinidine, phenytoin, mexiletine, disopyramide).
Chương này sẽ mô tả lược đồ phân loại, dược lý lâm sàng, tác dụng không mong muốn và tương tác của từng loại thuốc. Một phần đáng kể của chương sẽ được dành để thảo luận về vai trò lâm sàng của các thuốc này trong thời kỳ y học hiện đại. Chúng tôi cũng sẽ tập trung vào khả năng ứng dụng lâm sàng của từng thuốc dựa trên dữ liệu lâm sàng về AADs đã có và cũng như đang được nghiên cứu. Hai nhóm thuốc chẹn beta và chẹn kênh canxi có rất nhiều tác dụng bên cạnh tác dụng chống loạn nhịp nên cũng sẽ được thảo luận ở nhiều chương khác trong cuốn sách này.
ĐIỆN THẾ HOẠT ĐỘNG CỦA TIM
Xung động điện học của tim thực tế là tổng hợp của hàng nghìn dòng điện nhỏ do hàng nghìn tế bào riêng rẽ của tim tạo ra. Hoạt động điện học của một tế bào riêng biệt được gọi là điện thế hoạt động của tim. Các tế bào của các tổ chức, cơ tim khác nhau như cơ nhĩ, cơ thất, His, Purkinje, nút nhĩ thất (AVN) và nút xoang (SAN) có kiểu điện thế hoạt động khác nhau. Điện thế hoạt động chia thành 5 giai đoạn: 0, 1, 2, 3 và 4 để mô tả sự hoạt động của các kênh ion khác nhau hoặc được chia thành giai đoạn khử cực, giai đoạn tái cực và giai đoạn nghỉ. Các tế bào tự động như tế bào nút xoang, nút nhĩ thất có kiểu điện thế hoạt động khác điện thế hoạt động của tế bào cơ nhĩ, cơ thất và hệ thống His – Purkinje (tế bào đáp ứng nhanh).
Các giai đoạn của điện thế hoạt động (ĐTHĐ) của tế bào :
Giai đoạn 4: Điện thế qua màng lúc nghỉ
Do sự chênh lệch nồng độ ion Na+, Ca++ và K+ ở trong và ngoài tế bào (nồng độ Na+ ở ngoài tế bào cao gấp 10 lần ở trong tế bào, Ca++ ngoài tế bào cao gấp 1000 lần trong tế bào và K+ trong tế bào cao gấp 30 lần ngoài tế bào), làm cho tế bào ở trạng thái phân cực: mặt ngoài màng tế bào mang điện thế (+) và mặt trong mang điện (-) và điều đó tạo thành trạng thái nội môi hằng định phù hợp với sự sống bình thường. Sự chênh lệch điện thế qua màng tế bào ở giai đoạn này được gọi là điện thế qua màng lúc nghỉ. Điện thế qua màng lúc nghỉ của các tổ chức tim khác nhau sẽ khác nhau và của các tế bào cơ thất vào khoảng -80 đến -90mV.
Giai đoạn 0: Khử cực nhanh
Khi có tác động của các xung kích thích lên màng tế bào làm cho các kênh natri được mở ra, ion Na+ từ ngoài tế bào ào ạt đi vào trong tế bào làm cho điện thế qua màng từ -90mV tăng vọt nhanh lên tới +20mV và tế bào được khử cực. Trên điện tâm đồ bề mặt tương ứng với phức bộ QRS.
Độ dốc của giai đoạn 0 thể hiện tốc độ khử cực tối đa (Vmax) của tế bào và nó ảnh hưởng tới tốc độ dẫn truyền xung động của tổ chức cơ tim. Các thuốc chống rối loạn nhịp tim nhóm I làm thay đổi tốc độ pha 0 nên làm chậm tốc độ dẫn truyền và tốc độ khử cực tối đa.
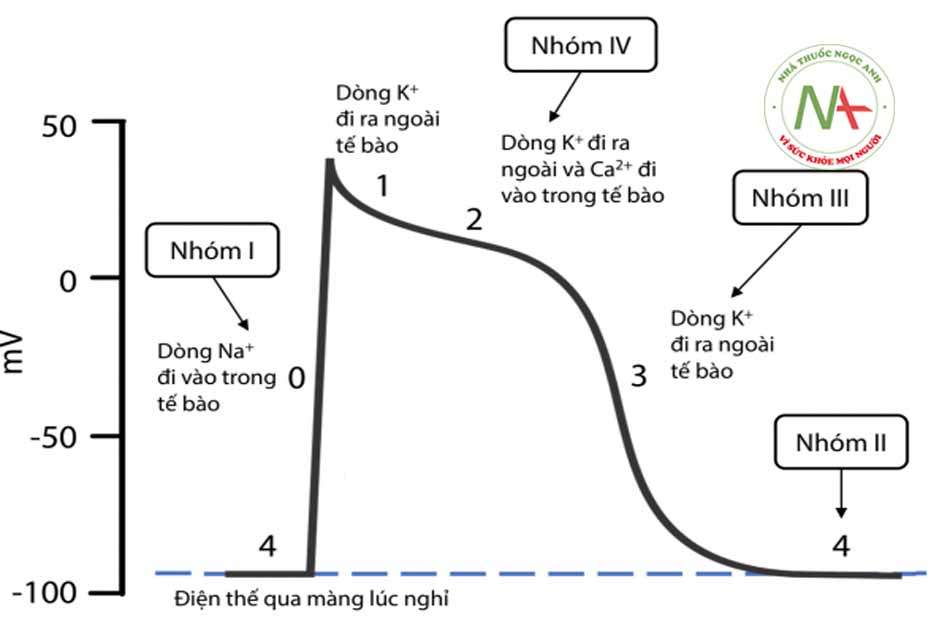
Giai đoạn 1: Tái cực nhanh-sớm
Giai đoạn này là thời kỳ đầu của quá trình tái cực của tế bào và chủ yếu là do đóng các kênh natri nhanh. Tuy nhiên, nó cũng còn do dòng kali đi ra ngoài tế bào khi kênh kali mở ra và sau đó đóng lại.
Giai đoạn 2: Pha cao nguyên của điện thế hoạt động
Đây là giai đoạn dài nhất của điện thế hoạt động và là sự khác biệt trong điện thế hoạt động của tế bào cơ tim với tế bào cơ xương và tế bào thần kinh. Giai đoạn này là kết quả của sự cân bằng giữa dòng natri, canxi đi vào và dòng kali đi ra ngoài tế bào. Giai đoạn này thường tương ứng với đoạn ST trên điện tâm đồ bề mặt.
Giai đoạn 3: Tái cực nhanh
Các kênh Ca++ đóng lại, trong khi các kênh K+ chậm một chiều được mở ra và khởi phát việc mở các kênh khác như kênh kali nhanh một chiều dẫn đến dòng ion dương đi ra ngoài tế bào làm cho tế bào tái cực nhanh chóng. Kênh K+ một chiều nhanh được hoạt hóa và mở ra ở phần cuối của giai đoạn 3 và tiếp tục sau đó để duy trì điện thế nghỉ qua màng ở giai đoạn 4.
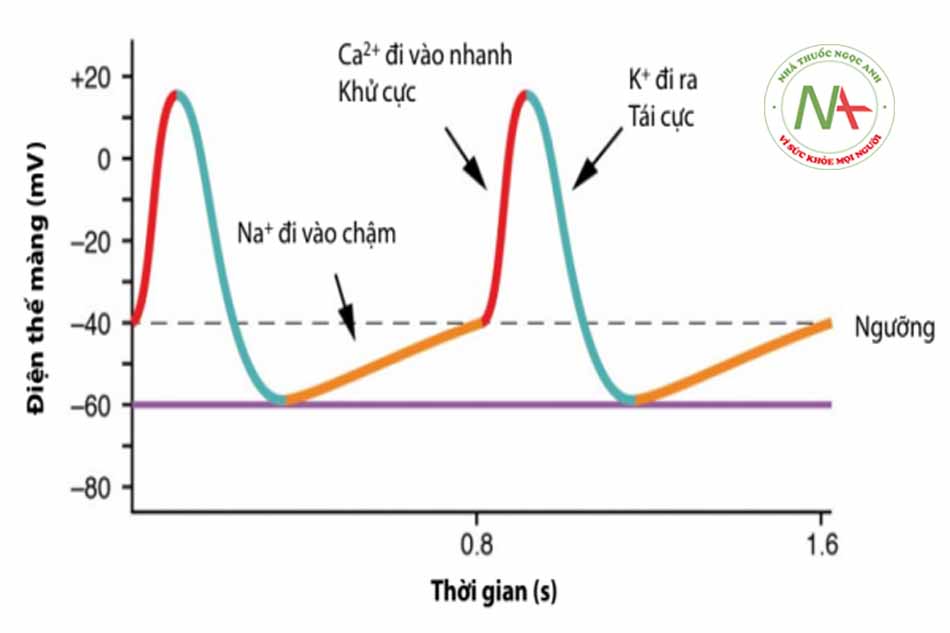
Điện thế hoạt động của nút xoang và nút nhĩ thất
– Điện thế hoạt động của nút xoang và nút nhĩ thất khá giống nhau và chỉ khác nhau chút ít ở giai đoạn 0 và có sự khác biệt đáng kể với điện thế hoạt động của tế bào đáp ứng nhanh.
– Điện thế hoạt động của nút xoang và nút nhĩ thất (còn gọi là tế bào có điện thế đáp ứng chậm) được chia thành ba giai đoạn: 0, 3 và 4.
Giai đoạn 4: Khử cực tự phát (Điện thế tạo nhịp)
– Điện thế qua màng lúc nghỉ của các tế bào tạo nhịp vào khoảng -60 mV đến -70 mV.
– Dòng ion K+ đi ra giảm dần, làm cho sự khử cực chậm cùng với dòng Na+ chậm đi vào và Ca++ đi vào qua kênh canxi loại L (ICaT) làm cho điện thế qua màng tế bào trở lên dương tính hơn và khi đạt tới điện thế ngưỡng (-40 mV đến -50 mV), tế bào bước vào pha khử cực).
Giai đoạn 0: Khử cực
– Hoạt động điện học chủ yếu trong giai đoạn này phụ thuộc vào dòng canxi đi vào qua kênh canxi loại L, tương phản với dòng natri đi vào ở các tế bào đáp ứng nhanh. Thực tế là các kênh natri đi vào hầu như không có ở các tổ chức này.
– Nhánh lên của điện thế hoạt động không đi thẳng đứng như ở tế bào đáp ứng nhanh mà tăng lên từ từ nên tốc độ dẫn truyền ở tổ chức tạo nhịp cũng chậm hơn đáng kể so với tổ chức có tế bào đáp ứng nhanh.
– Điện thế hoạt động của nút nhĩ-thất có tốc độ nhánh lên (Vmax) nhanh hơn đôi chút so với nút xoang.
Giai đoạn 3: Tái cực
Dòng K+ đi ra tăng lên, các kênh canxi bất hoạt nhanh cùng với sự giảm đồng thời của dòng natri đi vào.
Sự phân bố thần kinh tự động
– Nút xoang và nút nhĩ thất có rất nhiều sợi thần kinh giao cảm và phó giao cảm, còn ở các tổ chức tế bào đáp ứng nhanh có rất ít các sợi thần kinh phó giao cảm. Bởi vậy có sự thay đổi trương lực phó giao cảm ở nút xoang và nút nhĩ thất nhưng lại không có hoặc rất ít ở các tổ chức tế bào đáp ứng nhanh.
– Trương lực giao cảm tăng dẫn tới tăng tính tự động, tăng tốc độ dẫn truyền (Vmax) và giảm thời gian giai đoạn trơ. Ngược lại, tăng trương lực phó giao cảm dẫn tới giảm tính tự động, giảm tốc độ dẫn truyền và kéo dài giai đoạn trơ.
Như vậy, sự hiểu biết về vai trò của các kênh ion khác nhau trong các giai đoạn khác nhau của điện thế hoạt động của các tế bào đáp ứng nhanh cũng như tế bào đáp ứng chậm giúp cho chúng ta hiểu và nắm được cơ chế và vị trí tác động chính của các thuốc chống rối loạn nhịp, qua đó có sự lựa chọn thuốc thích hợp với từng loại rối loạn nhịp khác nhau.
Cơ chế của các thuốc chống rối loạn nhịp tim
Cơ chế chính làm khởi phát rối loạn nhịp tim là: rối loạn hình thành xung động và rối loạn dẫn truyền xung động. AADs chủ yếu tác động vào các kênh ion (và/hoặc các thụ thể) ở tim và có thể tác động đến nhiều cơ chế rối loạn nhịp khác nhau bằng cách thay đổi tính kích thích, khả năng dẫn truyền và tính trơ của tim. Một số AADs có thể ảnh hưởng đến nhiều hơn một kênh ion tim (và/hoặc thụ thể) và do đó có thể ảnh hưởng đến nhiều hơn một cơ chế rối loạn nhịp tim, trong khi một số AADs mới hơn có thể có cơ chế hoạt động hoàn toàn mới. Một số AADs đặc hiệu cho một số mô tim nhất định, chẳng hạn như tâm nhĩ, tâm thất hoặc nút xoang hoặc nút nhĩ thất, trong khi một số thuốc khác lại có tác dụng chung hơn.
Tác dụng gây ra hoặc làm nặng các rối loạn nhịp tim của các thuốc chống rối loạn nhịp tim
Tất cả các thuốc chống rối loạn nhịp tim có tác dụng dự phòng hoặc ức chế các rối loạn nhịp tim nhưng cũng có thể làm khởi phát các rối loạn nhịp mới hoặc làm cho các rối loạn nhịp vốn có nặng lên (proarrhythmias). Do đó cần sử dụng các thuốc chống rối loạn nhịp một cách thận trọng. Tùy thuộc vào các đặc tính của thuốc, tương tác với các thuốc được sử dụng đồng thời, cũng như các yếu tố người bệnh, các tác dụng làm nặng lên các rối loạn nhịp sau đây có thể gặp:
– Làm xuất hiện các rối loạn nhịp mới như: nhịp nhanh thất đơn dạng, bền bỉ; nhịp nhanh thất đa dạng (polymorphology), xoắn đỉnh liên quan tới kéo dài khoảng QT, rung thất, các rối loạn nhịp trên thất hoặc nhịp chậm như nhịp chậm xoang hoặc block nhĩ thất các mức độ khác nhau.
– Làm nặng lên các rối loạn nhịp đã có như: số lượng ngoại tâm thu nhĩ, thất tăng lên, hoặc chùm đôi…; chuyển nhịp nhanh thất không bền bỉ thành bền bỉ; các rối loạn nhịp tim vốn có từ trước trở nên bền bỉ hoặc không thể cắt được cơn; nhịp nhanh thất có tần số nhanh hơn và huyết động không ổn định.
– Làm chậm dần tần số nhịp nhanh nhĩ dẫn tới dẫn truyền 1:1 qua nút nhĩ-thất, dẫn đến tần số đáp ứng thất tăng lên, mà điều này không có trước khi dùng thuốc hoặc các rối loạn nhịp tim dễ dàng xuất hiện hơn khi thăm dò điện sinh lý tim.
Sự nặng lên của các rối loạn nhịp do các thuốc chống loạn nhịp tim gây ra thường xuất hiện một vài ngày sau khi sử dụng thuốc chống rối loạn nhịp hoặc tăng liều thuốc.
PHÂN LOẠI
Hiện đang có hai sơ đồ phân loại chính các thuốc chống rối loạn nhịp tim. Sơ đồ phân loại của Vaugham Williams phân loại AADs dựa trên những đặc tính điện sinh lý nổi bật nhất của chúng và phù hợp nhất về mặt lâm sàng (Bảng 5.1). Sơ đồ Sicilian Gambit phân loại AADs dựa trên cơ chế tác động lên tế bào của các thuốc, rất phức tạp và chỉ được sử dụng nhiều trong nghiên cứu và phát triển thuốc. Hầu hết các AADs và các chất chuyển hóa của chúng có nhiều tác dụng dược lý, một số tác dụng đó còn chưa được hiểu rõ, do vậy khó có thể xây dựng được một sơ đồ phù hợp cho tất cả.
Bảng 5.1: Phân loại các thuốc chống rối loạn nhịp tim của Vaughan William
| Thuốc | Cơ chế tác dụng (tác động lên các kênh ion) | Tác dụng điện sinh lý | |
| Nhóm I: Các thuốc ức chế kênh natri | |||
| IA | • Quinidine • Procainamide • Disopyramide | Ức chế kết hợp các kênh natri và kali, tác động ở mức độ trung bình tới sự liên kết và phân ly. | Làm giảm dẫn truyền ở mức độ trung bình (tác động chủ yếu) và làm tăng tính trơ. |
| IB | • Lidocaine• Mexiletine | Ức chế kênh natri, tác động nhanh tới sự liên kết và phân ly. | Rút ngắn thời gian điện thế hoạt động, đặc biệt là ở các tế bào tổn thương bệnh lý. |
| IC | • Flecainide• Propafenone | Ức chế kênh natri, tác động chậm tới sự liên kết và phân ly. | Làm chậm rõ rệt khả năng dẫn truyền (có tác dụng không đáng kể tới giai đoạn trơ). |
| Nhóm II: Các thuốc chẹn thụ thể beta giao cảm | |||
| Ức chế chọn lọc thụ thể beta 1 | • Acebutolol (ổn định màng tế bào)• Atenolol
• Esmolol (chỉ có dạng sử dụng đường tĩnh mạch) |
||
| Ức chế không chọn lọc thụ thể beta 1 | • Nadolol• Propranolol | _ | _ |
| Ức chế không chọn lọc thụ thể beta và ức chế thụ thể alpha | • Carvedilol• Labetalol | _ | _ |
| Nhóm III: Các thuốc ức chế kênh kali | |||
| • Sotalol | Ức chế IKr và thụ thể β | Kéo dài thời gian điện thế hoạt động (APD) và thời kỳ trơ | |
| • Amiodarone | Ức chế nhiều kênh kali, kênh Na+ , kênh Ca2+ , thụ thể beta | Kéo dài thời gian điện thế hoạt động (APD) và thời kỳ trơ | |
| • Dronedarone | Ức chế nhiều kênh kali, kênh Na+ , kênh Ca2+ , thụ thể beta | Kéo dài APD và thời kỳ trơ | |
| • Ibutilide | Ức chế IKr và dòng Na muộn | Kéo dài thời kỳ trơ và APD | |
| • Dofetilide | Ức chế IKr | Kéo dài thời kỳ trơ và APD | |
| • Azimilide | Ức chế IKr và IKs | Kéo dài thời kỳ trơ và APD | |
| Nhóm IV: Các thuốc chẹn kênh canxi | |||
| • Verapamil• Diltiazem | Ức chế kênh Ca2+ loại L | Tác dụng làm chậm nhịp tim và giảm sức bóp cơ tim | |
APD: thời gian điện thế hoạt động; Na+: Natri; Ca2+: Canxi; IKr: Dòng kali nhanh một chiều ; IKs:Dòng kali chậm một chiều.
DƯỢC ĐỘNG HỌC
Bảng 5.2: Các đặc tính dược động học của các thuốc chống rối loạn nhịp tim thường sử dụng
| Thuốc | Liều dùng hằng ngày (mg/24h) | Đường dùng | Hoạt tính sinh học đường uống (%) | Kết hợp với protein (%) | Đường đào thải chính | Thời gian bán hủy | Chất chuyển hóa có hoạt tính |
| Quinidine | 600–1600 | Đường uống | 80 | 80 | Gan | 6-12 giờ | 3-hydroxyquinidine |
| Procainamide | – | TM | – | 15-20 | Gan và thận | 3-4 giờ | N-acetyl procainamide |
| Disopyramide | 400-600 | Đường uống | 80 | 50-65(Bão hòa) | Thận và gan | 6-9 giờ | Mono-N-dealkyldisopyramide |
| Lidocaine | — | TM, tiêm bắp | — | 60-80 | Gan | 2 giờ | Monoethylglycinexylidide and glycinexylidide |
| Mexiletine | 450-900 | Đường uống | 90-100 | 50-60 | Gan | 9-12 giờ | Không |
| Flecainide | 200-400 | Đường uống | 95 | 40 | Gan và thận | 10-17 giờ | Không |
| Propafenone | 450-675 | Đường uống | 5-50 | 85-97 | Gan | 2-10 giờ | 5-hydroxy propafenone |
| Metoprolol | 25-200 | Uống, TM | 95 | 5-15 | Gan | 3-7,5 giờ | Không |
| Sotalol | 160-320 | Đường uống | 100 | 0 | Thận | 12-16 giờ | Không |
| Dofetilide | 0,5-1 | Đường uống | 90 | 60-70 | Thận | 8-10 giờ | Không |
| Ibutilide | 1 mg trong10 phút | TM | — | — | Gan và thận | 6-9 giờ | Không |
| Amiodarone | 200-400 | Uống, TM | 35-50 | 95 | Gan | 12-103 ngày | Desethylamiodarone |
| Dronedarone | 800 | Đường uống | 15-20 | 98 | Gan | 24 giờ | N-debutyl metabolite |
| Azimilide | 75-125 | Uống, TM | 95 | 94 | Gan và thận | 4-5 ngày | Không đo được |
| Verapamil | 120-480 | Uống, TM | 20-35 | 90 | Gan | 3-7 giờ | Norverapamil |
| Diltiazem | 120-360 | Uống, TM | 40 | 70-80 | Gan | 4 giờ | Desacetyl diltiazem; desmethyl diltiazem |
| Ranolazine | 1.000-2,000 | Đường uống | 35-50 | 61-65 | Gan và thận | 1,4-1,9 giờ | – |
| Vernakalant | 3 mg/kg trọng lượng cơ thể | TM | — | — | Gan | 1,7-5,4 giờ | Không |
TM: tĩnh mạch.
CHỈ ĐỊNH VÀ TÁC DỤNG KHÔNG MONG MUỐN
Chỉ định sử dụng thuốc chống rối loạn nhịp tim
Trong kỷ nguyên y học hiện đại, chỉ định thường gặp nhất của AADs là rung nhĩ (AF). Dự phòng thứ phát rối loạn nhịp thất cũng như điều trị các rối loạn nhịp trên thất là các chỉ định quan trọng khác. Đôi khi, AADs được sử dụng để điều trị các rối loạn nhịp thất và nhĩ, bao gồm cả nhịp nhanh thất không bền bỉ (nhịp nhanh thất).
Mục tiêu chính của điều trị bằng AADs trong rung nhĩ là giảm các triệu chứng và cải thiện chất lượng cuộc sống, mặc dù đã có nhiều kỳ vọng được đưa ra với AADs nhóm III dronedarone, qua nhiều dữ liệu mới đây cho thấy thuốc có lợi ích làm giảm tỷ lệ tử vong ở nhóm bệnh nhân nguy cơ thấp có rung nhĩ kịch phát.
Bảng 5.3. Chỉ định và các tác dụng không mong muốn các thuốc chống rối loạn nhịp tim uống hiện có
| Thuốc Tác dụng | Tác dụng không mong muốn | Chỉ định | ||
| Nhóm IA | ||||
| Quinidine | • Dạ dày ruột
• Ù tai, giảm thính lực, rối loạn thị giác và nhầm lẫn (quá liều quinidin) • Giảm tiểu cầu và thiếu máu huyết tán • Tụt huyết áp và shock phản vệ • QRS giãn rộng, QT dài, xoắn đỉnh |
• Dự phòng thứ phát nhịp nhanh thất và rung thất (ở bệnh nhân cấy ICD)
• Hội chứng QT ngắn • Hội chứng Brugada |
||
| Procainamide | • Nổi ban đau cơ và viêm mạch
• Lupus do thuốc • Sốt và giảm bạch cầu hạt • Tụt huyết áp, nhịp chậm, QT dài, xoắn đỉnh |
• Nhịp nhanh thất bền bỉ
• Hội chứng Brugada bị che giấu • Hội chứng Brugada • Rung nhĩ trên hội chứng WPW |
||
| Disopyramide | • Bí tiểu, táo bón, tăng nhãn áp và khô miệng kéo dài
• QT dài và xoắn đỉnh • Giảm sức bóp cơ tim |
• Bệnh cơ tim phì đại có triệu chứng
• Rung nhĩ qua trung gian thần kinh phế vị |
•Bệnh cơ tim phì đại có triệu chứng
•Rung nhĩ qua trung gian qua thần kinh 10 |
|
| Nhóm IB | ||||
| Mexiletine | • Run rẩy, lo lắng, rối loạn tiêu hóa, chóng mặt
•Tụt huyết áp và nhịp chậm |
• Nhịp nhanh thất
• Giảm các nhát sốc của máy ICD • LQT3 |
||
| Nhóm IC | ||||
| Flecainide | • Giảm sức co bóp cơ tim
• Block nhĩ-thất; Nhịp chậm • Giảm ngưỡng tạo nhịp • Nhầm lẫn, kích thích |
• Rung nhĩ kịch phát
• Nhịp nhanh trên thất • Ngoại tâm thu thất • Nhịp nhanh thất tự phát |
||
| Propafenone | • Chóng mặt, mờ mắt
• Co thắt phế quản (trên các bệnh nhân chuyển hóa chậm) • Block nhĩ-thất, nhịp chậm và suy tim nặng lên • Giảm ngưỡng máy tạo nhịp |
• Rung nhĩ kịch phát
• Nhịp nhanh trên thất • Ngoại tâm thu thất • Nhịp nhanh thất tự phát |
||
| Nhóm II: Chẹn thụ thể beta | ||||
| Các thuốc chẹn thụ thể giao cảm beta (thuốc chẹn beta) | • Tụt huyết áp, nhịp chậm, rối loạn dẫn truyền, suy tim nặng lên
• Co thắt phế quản • Trầm cảm • Suy giảm chức năng sinh dục |
• Rối loạn nhịp nhĩ
• Kiểm soát tần số thất trong rung nhĩ • Nhịp nhanh trên thất • Ngoại tâm thu thất • Nhịp nhanh thất |
||
| Nhóm III | ||||
| Amiodarone | • Xơ hóa phổi
• Rối loạn chức năng gan • Cường hoặc suy giáp • Nhịp chậm và suy tim nặng lên • Run và dị cảm • Tăng nhạy cảm với ánh sáng • Dày sừng |
• Nhịp nhanh thất
• Rung thất • Giảm các nhát sốc của máy ICD • Rung nhĩ • Cuồng nhĩ |
||
| Sotalol | • Nhịp chậm và xoắn đỉnh | • Nhịp nhanh thất trên ARVD
• Giảm số nhát sốc của máy ICD • Rung nhĩ, cuồng nhĩ |
||
| Dofetilide | Xoắn đỉnh | • Kiểm soát nhịp trong rung nhĩ | ||
| Dronedarone | • Tác dụng không mong muốn tại đường tiêu hóa
• Suy gan tối cấp (hiếm) • Làm nặng lên tình trạng suy tim (ở các bệnh nhân suy tim trái nặng) |
• Để giảm nguy cơ nhập viện do tim mạch ở những bệnh nhân bị rung nhĩ kịch phát và dai dẳng có nguy cơ tim mạch thấp
• Kiểm soát nhịp ở bệnh nhân rung nhĩ có nguy cơ thấp |
||
| Nhóm IV: Chẹn kênh canxi | ||||
| Verapamil | • Tụt huyết áp, nhịp chậm và block nhĩ-thất | • Nhịp nhanh thất tự phát
• Ngoại tâm thu thất • Kiểm soát nhịp ở bệnh nhân rung nhĩ • Nhịp nhanh trên thất |
||
ICD: máy phá rung tự động; WPW: Wolff-Parkinson-White; ARVD: loạn sản thất phải sinh loạn nhịp; LQT3: hội chứng QT dài type 3; SVT: nhịp nhanh trên thất; PVC: ngoại tâm thu thất
CÁC TƯƠNG TÁC THUỐC CHÍNH CỦA THUỐC ĐIỀU TRỊ RỐI LOẠN NHỊP TIM
Bảng 5.4: Các tương tác thuốc chính của thuốc điều trị rối loạn nhịp tim
| Thuốc | Các thuốc tương tác | Tương tác |
| Quinidine | Phenytoin | ↓ Nồng độ quinidine |
| Phenobarbital | ↓ Nồng độ quinidine | |
| Rifampicin | ↓ Nồng độ quinidine | |
| Ketoconazole | ↑ Nồng độ quinidine | |
| Verapamil | ↑ Nồng độ quinidine | |
| Propafenone | ↑ Nồng độ propafenone | |
| β-blockers | ↑ Nồng độ chẹn β-blockers | |
| Digoxin | ↑ Nồng độ digoxin | |
| Mexiletine | Phenytoin | ↓ Nồng độ mexiletine |
| Phenobarbital | ↓ Nồng độ mexiletine | |
| Rifampicin | ↓ Nồng độ mexiletine | |
| Ketoconazole | ↑ Nồng độ mexiletine | |
| Isoniazid | ↑ Nồng độ mexiletine | |
| Theophylline | ↑ Nồng độ theophyline | |
| Flecainide | Digoxin | ↑ Nồng độ digoxin |
| Amiodarone | ↑ Nồng độ flecainide | |
| Quinidine | ↑ Nồng độ flecainide | |
| Propafenone | Digoxin | ↑ Nồng độ digoxin |
| Warfarin | ↓ Thanh thải warfarin | |
| Cyclosporine | ↑ Nồng độ cyclosporine | |
| Quinidine | ↑ Nồng độ propafenone | |
| Amiodarone | Digoxin | ↑ Tác dụng của digoxin |
| Warfarin | ↑ Tác dụng của warfarin | |
| Các thuốc kéo dài QT | ↑ Nguy cơ xoắn đỉnh | |
| β-blockers | Nhịp chậm và block dẫn truyền nhĩ thất | |
| Diltiazem and verapamil | Nhịp chậm và block dẫn truyền nhĩ thất | |
| Thuốc gây mê | Tụt huyết áp và nhịp chậm | |
| Cyclosporine | ↑ Nồng độ cyclosporine | |
| Sotalol | Các thuốc kéo dài QT | ↑ Nguy cơ xoắn đỉnh |
| Dofetilide | Các thuốc kéo dài QT | ↑ Nguy cơ xoắn đỉnh |
| Dronedarone | Digoxin | ↑ Tác dụng của digoxin |
| Cyclosporine | ↑ Nồng độ cyclosporine | |
| Simvastatin | ↑ Nguy cơ viêm cơ tim | |
| Thuốc ức chế thụ thể β | Quinidine | ↑ tác dụng thuốc ức chế thụ thể β |
| Amiodarone, digoxin, diltiazem, verapamil | Nhịp chậm | |
| CCBs (verapamil) | Digoxin | ↑ Nồng độ digoxin |
CCBs: chẹn kênh canxi
PHẦN II: CÁC NHÓM THUỐC CHỐNG RỐI LOẠN NHỊP TIM
CƠ CHẾ THUỐC CHỐNG RỐI LOẠN NHỊP TIM NHÓM I
Cơ chế tác dụng của các thuốc nhóm I chủ yếu là ức chế các kênh natri tại tế bào cơ tim. Do đó các thuốc này làm giảm đáng kể khả năng dẫn truyền xung động do tác động vào pha khử cực của điện thế hoạt động của tế bào cơ tim (pha 0) và đồng thời giảm tính kích thích (giảm Vmax). Mức độ phong tỏa kênh Na+ sẽ tùy thuộc vào các đặc tính của từng thuốc, tần số tim, điện thế qua màng và hoạt tính thần kinh tự động (giao cảm và phó giao cảm), và một số yếu tố khác.
Dựa trên ái lực của các thuốc với kênh natri tại tim, ảnh hưởng của thuốc lên tính dẫn truyền và thời kỳ trơ, thuốc nhóm I được phân thành các phân nhóm IA, IB và IC. Các thuốc thuộc phân nhóm IA có tác dụng ức chế các kênh natri ở mức trung bình (bao gồm: quinidine, procainamide và disopyramide), phân nhóm IB ức chế nhẹ các kênh Na+, (mexiletine và lidocaine) và phân nhóm IC ức chế các kênh Na+ ở mức độ mạnh nhất (flecainide và propafenone). Các đặc tính dược động học của các thuốc nhóm I được thể hiện trong Bảng 5.5. Các công trình của Hodgkin và Huxley đã chứng minh rằng các kênh natri thường ở ba trạng thái riêng biệt là trạng thái mở, bất hoạt và đóng.
Thuốc nhóm I thể hiện tác dụng phụ thuộc vào tình trạng sử dụng. Nhịp tim nhanh làm tăng số lượng kênh natri ở trạng thái mở và bất hoạt và vì thuốc chẹn kênh natri có ái lực lớn hơn với các kênh mở và bất hoạt nên mức độ phong tỏa kênh natri tăng lên và kết quả là làm chậm dẫn truyền mạnh hơn khi nhịp tim nhanh. Hiện tượng này được gọi là “phụ thuộc tình trạng sử dụng” (“use dependence” hoặc “frequency dependence”).
Chỉ các kênh mở mới cho dòng natri đi qua. Các thuốc ức chế kênh natri tương tác với các kênh ở trạng thái mở cũng như bất hoạt nhưng thường không liên kết với các kênh ở trạng thái đóng. Do đó, việc phong tỏa kênh natri là tùy thuộc vào pha và phụ thuộc vào tình trạng hình thái của kênh. Tác dụng của các thuốc chẹn kênh natri còn phụ thuộc vào tốc độ phục hồi của kênh natri. Các thuốc thuộc phân nhóm IC (flecainide và propafenone) làm chậm đáng kể sự dẫn truyền, chủ yếu do sự phục hồi rất chậm các kênh natri bị ức chế. Ngoài ra, các tình trạng bệnh, như thiếu máu cục bộ có thể làm chậm quá trình phục hồi kênh natri và có thể làm tăng sự phong tỏa kênh natri.
Một loạt các tác dụng không mong muốn nghiêm trọng đã làm hạn chế việc sử dụng AADs nhóm IA. Quan trọng nhất là tất cả các thuốc thuộc nhóm này đều ức chế kênh kali nhanh một chiều (IKr) nên có thể dẫn đến kéo dài thời gian QT không phụ thuộc vào liều và có khả năng gây ra xoắn đỉnh. Do hiệu quả khiêm tốn đối với các rối loạn nhịp nhĩ và thất và khả năng gây độc tính nặng nề nên các thuốc này không được sử dụng như liệu pháp đầu tiên nữa.
THUỐC CHỐNG RỐI LOẠN NHỊP PHÂN NHÓM IA
Các thuốc phân nhóm IA ức chế kênh Na+ ở mức độ trung bình nên làm chậm dẫn truyền vừa phải và có tác dụng trên cả cơ tâm nhĩ và tâm thất. Chúng còn có đặc tính ức chế kênh kali và có thể kéo dài quá trình tái cực. Disopyramide còn có tác dụng kháng cholinergic rõ rệt.
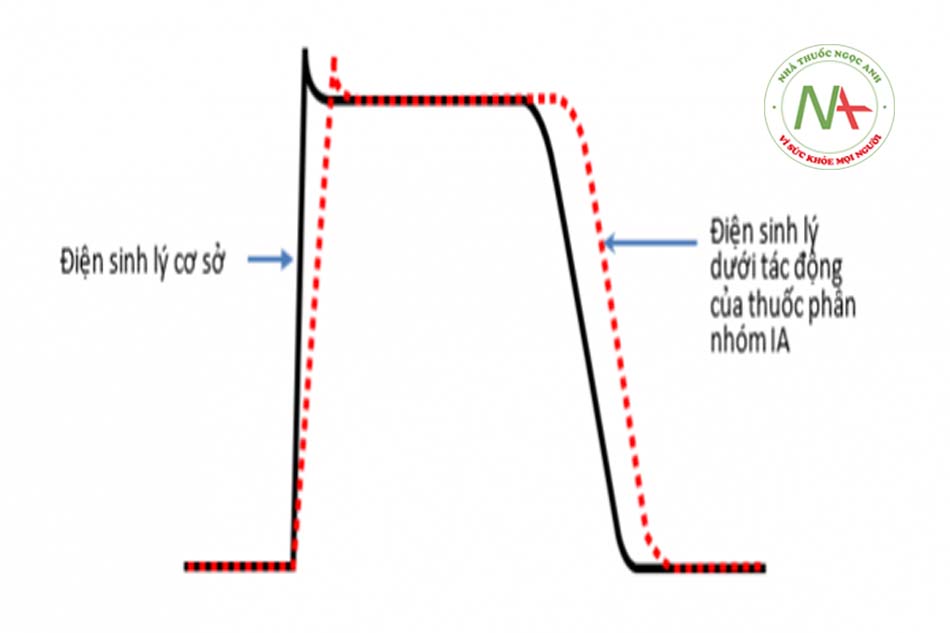
Quinidine
Quinidine có nguồn gốc từ quinine, một thuốc chống sốt rét được chiết xuất từ vỏ cây canhkina và là một trong những thuốc chống rối loạn nhịp tim được sử dụng đầu tiên trong lâm sàng. Quinidine có đầy đủ các tính chất dược lý của quinine như chống sốt rét, giảm sốt và tác dụng giãn cơ xương. Nhưng do tác dụng gây loạn nhịp và các tác dụng không mong muốn khác đã làm hạn chế đáng kể vai trò của quinidine trong việc điều trị rối loạn nhịp tim.
Biệt dược:
– Quinidine sulfate (Quinicardine): viên 200 mg.
– Quinidine monosulfate (Quinidine durule): viên 250 mg.
– Quinidine chlorhydrate (Hydroquinidine) viên 150 mg; và 300 mg SR.
– Quinidine gluconate.
Dược động học
– Thuốc được hấp thu tốt qua đường uống và nồng độ đỉnh trong huyết tương đạt được sau khoảng 2h.
– Có tới >80% quinidine được gắn vào protein huyết tương cũng như α1 acid glycoprotein. Do đó, có thể cần thiết liều cao hơn bình thường để giữ nồng độ quinidine ở mức điều trị trong tình trạng khử cực, chẳng hạn như nhồi máu cơ tim cấp tính.
– Quinidine được chuyển hóa chủ yếu bởi hệ thống cytochrom P450 3A4 (CYP3A4) trong gan với thời gian bán hủy 6-12h và khoảng 20% được đào thải qua thận ở dạng không thay đổi.
– Chất chuyển hóa có hoạt tính chính của quinidine là 3-hydroxyquinidine, có đặc tính chủ yếu là ức chế kênh natri và kênh kali nhanh một chiều (IKr) và có vai trò nhất định đối với các tác dụng trên lâm sàng của quinidine.
Cơ chế tác dụng và tính chất dược lý
Tác dụng lên điện sinh lý tế bào tim
– Quinidine ức chế dòng natri nhanh cũng như nhiều dòng kali bao gồm các các dòng kali nhanh (IKr) và chậm (IKs) một chiều, dòng kali một chiều đi vào trong tế bào (IKI), kênh kali nhạy cảm ATP (adenosine triphosphate) (IKATP) và dòng đi ra bên ngoài thoáng qua (Ito).
– Tác dụng của quinidine trên kênh natri dẫn đến làm chậm dẫn truyền vừa phải. Quinidine có thể ức chế IKr ở nồng độ rất thấp dẫn tới kéo dài điện thế hoạt động, khoảng QT nên có khả năng gây ra xoắn đỉnh không phụ thuộc nồng độ. Do vậy, quinidine tốt nhất nên được khởi trị trong bệnh viện. Ở liều cao hơn, tác động ức chế kênh IKr bị giảm bớt, vì sự phong tỏa kênh natri trở nên chiếm ưu thế.
– Quinidine phong tỏa dòng Ito, dẫn tới làm giảm sự đồng nhất của quá trình tái cực ở đường ra thất phải và do đó làm giảm sự chênh lên của đoạn ST ở chuyển đạo trước tim trong hội chứng Brugada. Quinidine đã được chứng minh là làm giảm rối loạn nhịp thất và ức chế cơn bão điện học ở bệnh nhân mắc hội chứng Brugada. Bởi vậy, Quinidine đã được sử dụng như một thuốc bổ sung nhưng không phải là phương pháp thay thế cho liệu pháp ICD ở bệnh nhân mắc hội chứng Brugada có nguy cơ cao. Quinidine cũng có hiệu quả đối với hội chứng QT ngắn và đối với rung thất vô căn. Quinidine cũng đã được sử dụng để điều trị rối loạn nhịp thất trong bệnh tim cấu trúc khi AADs khác đã được dùng thử và thất bại. Nhìn chung, tác dụng làm nặng lên các rối loạn nhịp và các tác dụng không mong muốn khác của quinidine đã làm hạn chế đáng kể vai trò của quinidine trong việc điều trị rối loạn nhịp nhĩ và thất.
– Quinidine còn là một thuốc ức chế thụ thể α nên có thể gây hạ huyết áp khi dùng đường tĩnh mạch.
– Tác dụng của quinidine phụ thuộc vào liều lượng và trương lực phó giao cảm. Tác dụng hủy phó giao cảm của quinidin chủ yếu xảy ra ở nồng độ thấp và làm tăng dẫn truyền qua nút AV. Tác dụng điện sinh lý của quinidine lên các tổ chức của tim:
Trên nút xoang và tổ chức cơ nhĩ: ở nồng độ thấp, quinidine làm tăng nhẹ tần số nút xoang do tác dụng hủy phó giao cảm. Ở nồng độ cao hơn, thuốc làm chậm quá trình khử cực tự phát ở pha 4 nên làm tần số nút xoang chậm đi. Quinidine làm chậm dẫn truyền và kéo dài thời kỳ trơ ở cơ nhĩ do làm giảm độ dốc pha 0.
Trên nút nhĩ thất: Tác dụng điện sinh lý trực tiếp của quinidine lên nút nhĩ thất là làm giảm tốc độ dẫn truyền và kéo dài giai đoạn trơ có hiệu quả. Tác dụng hủy phó giao cảm của thuốc lại làm tăng dẫn truyền qua nút nhĩ thất.
Trên hệ thống His-Purkinje và cơ thất: Quinidine là giảm độ dốc của quá trình khử cực tự phát ở pha 4 nên làm giảm tính tự động. Tác dụng làm giảm tính tự động ở hệ thống His-Purkinje mạnh mẽ hơn ở nút xoang. Thuốc cũng kéo dài quá trình tái cực ở cơ thất dẫn đến tăng thời gian điện thế hoạt động và kéo dài QT trên điện tâm đồ do ức chế kênh kali chậm một chiều.
Các tác dụng dược lý khác
– Làm giảm nhẹ sức bóp cơ tim nên ở bệnh nhân có chức năng thất trái giảm có thể làm suy tim nặng lên.
– Thuốc còn có tác dụng ức chế thụ thể α nên có thể gây hạ huyết áp khi dùng liều cao hoặc đường tĩnh mạch; thuốc không có ảnh hưởng đến tuần hoàn mạch vành.
– Thuốc có tác dụng làm tăng nhu động ruột và tăng co bóp tử cung.
– Có tác dụng gây tê tại chỗ nhẹ.
Những thay đổi trên điện tâm đồ
– Quinidine làm kéo dài thời gian phức bộ QRS, khoảng PR và QT với thời gian QRS và khoảng QT bị kéo dài nhiều hơn so với các thuốc chống rối loạn nhịp khác.
– Ở liều thấp, thuốc làm cho nhịp xoang nhanh lên do tác dụng hủy phó giao cảm.
Các ảnh hưởng lên huyết động
Ức chế cơ tim không nhiều ở những bệnh nhân có chức năng tim bình thường nhưng ở những bệnh nhân có chức năng tim bị tổn thương thì thuốc sẽ làm giảm chức năng tim. Quinidine làm giãn cơ trơn mạch máu bằng tác dụng trực tiếp cũng như gián tiếp qua ức chế thụ thể giao cảm α1.
Những tác dụng không mong muốn:
– Tiêu chảy là tác dụng không mong muốn thường gặp nhất, xảy ra ở 30-50% bệnh nhân và cơ chế còn chưa được hiểu rõ. Trong những năm trước đây, Amphojel đã được sử dụng để giải quyết tác dụng không mong muốn này nhưng hiện nay nó không còn được sử dụng thường xuyên do lo ngại về nhiễm độc.
– Giảm tiểu cầu có thể xảy ra và có cơ chế miễn dịch.
– Nhức đầu và ù tai là những tác dụng không mong muốn phụ thuộc liều và là một phần của phức hợp các triệu chứng được gọi là ngộ độc canhkina.
– Quinidine có thể gây ra QT dài và xoắn đỉnh đặc trưng, tỷ lệ này được ước tính là khoảng xấp xỉ 2-4%. Nồng độ quinidine trong huyết tương cao có thể dẫn đến nhịp nhanh thất đơn dạng do phong tỏa kênh natri. Quinidine có thể làm tăng và thậm chí tăng gấp đôi nồng độ digoxin. Gần đây đã có cuộc thảo luận nghiêm túc về việc loại bỏ quinidine khỏi thị trường mặc dù vai trò quan trọng của nó trong điều trị bệnh lý rối loạn các kênh ion đặc thù.
Chỉ định
Do hiệu quả điều trị rối loạn nhịp chỉ ở mức trung bình nhưng những tác dụng gây loạn nhịp và các tác dụng không mong muốn khác của quinidine cũng như có nhiều thuốc và các biện pháp điều trị khác có hiệu quả hơn đã làm hạn chế đáng kể vai trò của thuốc trong việc điều trị rối loạn nhịp nhĩ và thất. Hiện nay những chỉ định chính của quinidine trong lâm sàng là:
- Dự phòng thứ phát nhịp nhanh thất và rung thất ở bệnh nhân cấy ICD.
- Dự phòng các rối loạn nhịp thất ở bệnh nhân có hội chứng QT ngắn.
- Dự phòng rối loạn nhịp thất hoặc cơn bão điện học trong hội chứng Brugada.
- Điều trị rối loạn nhịp thất trong bệnh tim cấu trúc khi AADs khác đã được dùng thử và thất bại.
Chống chỉ định
– Block nhĩ thất.
– Hội chứng suy nút xoang.
– QT dài bẩm sinh hoặc mắc phải vì dễ dẫn tới xoắn đỉnh.
– Do tác dụng giảm sức bóp cơ tim, Quinidine không được sử dụng ở bệnh nhân suy tim ứ trệ và huyết áp thấp.
– Không sử dụng quinidine cho bệnh nhân nhiễm độc digitalis hoặc có tăng kali máu vì nguy cơ các tình trạng này làm tăng ảnh hưởng của quinidine lên dẫn truyền.
Liều lượng và cách dùng
– Quinidine sulfate: viên 200mg; sử dụng đường uống; liều 24h: 3-6 viên
– Quinidine durule: viên 250mg, có tác dụng kéo dài; sử dụng đường uống; liều 24h: 3-4 viên
Để tránh những tác dụng không mong muốn hoặc gây rối loạn nhịp của thuốc nên bắt đầu bằng 1 viên cho bệnh nhân trong bệnh viện để theo dõi đánh giá đáp ứng của thuốc. Trong những giờ đầu hoặc ngày đầu nếu thấy dấu hiệu nổi ban, sốt, hạ huyết áp hoặc trên ĐTĐ thấy thời gian QT hoặc QRS kéo dài >25% hoặc có ngoại tâm thu nhiều lên hoặc NTT đa dạng thì phải ngừng thuốc. Nếu các biến đổi điện tâm đồ chỉ xảy ra sau 48h, không có dấu hiệu lâm sàng thì chỉ cần giảm liều.
Tương tác thuốc: Quinidine cũng là một chất ức chế mạnh CYP2D6, làm giảm độ thanh thải của các thuốc, như propafenone.
– Thuốc cũng ức chế p-glycoprotein, dẫn đến tăng nồng độ digoxin trong huyết thanh nên phải giảm liều digoxin khi sử dụng đồng thời. Không được dùng quinidine cho các rối loạn nhịp do nhiễm độc digitalis vì có thể làm nặng thêm các rối loạn nhịp này.
– Các thuốc ức chế chuyển hóa của quinidine tại gan như các thuốc ức chế thụ thể beta, các thuốc chẹn kênh canxi, acetazolamide, natri bicarbonate, magnesium và cimetidine. Khi sử dụng đồng thời với các thuốc ức chế thụ thể beta, chẹn kênh canxi, thuốc làm tăng tác dụng giảm sức bóp cơ tim và giảm dẫn truyền nên phải giảm liều.
– Quinidine làm tăng tác dụng của các thuốc kháng cholinergic, kháng vitamin K và thuốc curare.
– Phenytoin, rifampicin và barbiturate làm tăng chuyển hóa của quinidine tại gan nên làm giảm nồng độ của quinidine trong huyết tương. Nồng độ điều trị hiệu quả của quinidine trong huyết tương nằm trong khoảng từ 2 – 5 µg/mL và không cần điều chỉnh liều trong trường hợp có suy thận hoặc suy tim ứ trệ.
Bảng 5.5: Đặc tính dược động học của thuốc chống loạn nhịp nhóm I
| Nhóm thuốc | Sự hồi phục kênh natri | Ức chế các kênh ion khác | Các đặc tính khác | |
| Nhóm Ia | ||||
| Quinidine | Trung bình | Ito, IKr, IKs, IKATP, IKi | • Giãn mạch • Hủy phó giao cảm | |
| Procainamide | Trung bình | IKr | • Chất chuyển hóa có hoạt tính, N-acetyl Procainamide là một thuốc nhóm III thuần khiết | |
| • Đặc tính ức chế thụ thể β và hủy phó giao cảm | ||||
| • Giãn mạch (procainamide đường tĩnh mạch) | ||||
| Disopyramide | Trung bình | Ito, IKr, IKACh | • Hủy phó giao cảm • Giảm sức co bóp cơ tim | |
| Nhóm Ib | ||||
| Lidocaine | Nhanh | — | — | |
| Mexiletine | Nhanh | — | — | |
| Nhóm Ic | ||||
| Flecainide | Chậm | IKr, IKur | • Đặc tính ức chế thụ thể β | |
| Propafenone | Chậm | IKr, IKur | • Đặc tính ức chế thụ thể β | |
Ito: Dòng kali đi ra thoáng qua; IKr: Dòng kali nhanh một chiều; IKs:Dòng kali chậm một chiều; IKATP : Dòng kali nhạy cảm adenosine-triphosphate; IKI: Dòng kali một chiều đi vào; IKACh: Kênh kali phụ thuộc acetylcholine.
Procainamide
Procainamide là một dẫn chất của Procain một thuốc gây tê tại chỗ. So với procain, procainamide có thời gian bán hủy dài hơn và ở nồng độ điều trị thuốc không gây nhiễm độc hệ thần kinh trung ương (CNS). Năm 1951, procainamide được chứng minh là có hiệu quả trong điều trị các rối loạn nhịp tim. Procainamide được xếp vào phân nhóm IA trong hệ thống phân loại của Vaughan William. Thuốc cũng có tác dụng gây tê tại chỗ nhưng yếu.
Biệt dược:
Pronestyl viên 250 mg; ống tiêm 10mL, chứa 100 mg/mL
Dược động học
– Procainamide được hấp thu nhanh qua đường tiêu hóa và đạt được nồng độ đỉnh trong huyết tương sau 1-2h. Khi tiêm tĩnh mạch, nồng độ đỉnh đạt được sau 5-10 phút, còn với tiêm bắp thì sau 20-30 phút.
– Khoảng 15-20% lượng thuốc được hấp thu sẽ liên kết với protein huyết tương, phần còn lại được tích lũy trong các mô được tưới máu nhiều như gan, thận, lách, tim, phổi, cơ.
– Thuốc được chuyển hóa ở gan thành N-acetyl-procainamide (NAPA), có các đặc tính của thuốc chống rối loạn nhịp nhóm III, kéo dài thời kỳ trơ nhưng thiếu khả năng ức chế kênh natri.
– Thời gian bán hủy của thuốc ngắn, khoảng 3-4h, nồng độ của thuốc trong huyết tương giảm 15-20% mỗi giờ, nên cần cho thuốc nhiều lần trong ngày. NAPA có thời gian bán hủy dài hơn procainamide.
– Thải trừ chủ yếu qua thận, 40-60% ở dạng chưa biến đổi và khả năng đào thải giảm nếu nước tiểu bị kiềm hóa. NAPA được thải trừ hoàn toàn qua thận. Do đặc tính ức chế kênh IKr của NAPA, có thể gây kéo dài thời gian QT và xoắn đỉnh phụ thuộc vào liều ở bệnh nhân suy thận.
Cơ chế tác dụng và tính chất dược lý
Tác dụng lên điện sinh lý tế bào tim
– Tác dụng điện sinh lý trực tiếp của procainamide gần giống như tác dụng của quinidine, nhưng tác dụng hủy phó giao cảm lại yếu hơn đáng kể so với quinidine.
– Procainamide ức chế các kênh natri mở và có sự phục hồi thoát ức chế ở mức độ trung bình. Thuốc cũng ức chế IKr, kéo dài thời gian điện thế hoạt động giống như quinidine.
– Làm chậm dẫn truyền trong tâm nhĩ và tâm thất và nút nhĩ thất do làm giảm độ dốc và tốc độ của pha 0 của điện thế hoạt động.
– Kéo dài thời gian điện thế hoạt động và thời gian thời kỳ trơ có hiệu quả.
– Chất chuyển hóa chính của procainamide, là N-acetyl procainamide (NAPA), có đặc tính của AADs nhóm III, kéo dài thời gian trơ nhưng thiếu khả năng ức chế kênh natri.
– Làm giảm tính tự động do giảm độ dốc khử cực tâm trương ở pha 4 và nâng cao điện thế ngưỡng. Tác dụng rõ rệt với các tổ chức bị tổn thương.
Các tác dụng dược lý khác
– Làm giảm nhẹ sức bóp của cơ tim nhưng không làm thay đổi cung lượng tim.
– Làm giãn mạch ngoại vi và có thể gây hạ huyết áp khi sử dụng liều cao đường tĩnh mạch.
-Tác dụng gây tê tại chỗ mức độ nhẹ.
Những thay đổi trên điện tâm đồ
– Procainamide làm kéo dài thời gian phức bộ QRS, khoảng PR và QT.
– Giảm nhẹ tần số nhịp xoang.
Ảnh hưởng lên huyết động của procainamide ít nặng nề hơn so với quinidine.
Tác dụng không mong muốn
– Procainamide làm giảm sức co bóp của cơ tim không đáng kể nhưng là một thuốc chẹn hạch giao cảm, có thể dẫn đến hạ huyết áp khi sử dụng đường tĩnh mạch.
– Làm chậm sự dẫn truyền rõ rệt và ức chế dẫn truyền trong bó His (đặc biệt khi có bệnh hệ thống dẫn truyền) có thể gây block nhĩ-thất, rối loạn dẫn truyền trong thất, nhịp nhanh thất. Liều lượng thuốc phải giảm đi hoặc ngừng lại nếu có dấu hiệu ức chế dẫn truyền nặng như QRS giãn rộng hoặc thời gian QT dài nhiều.
– Kéo dài QT, gây nhịp nhanh thất đơn dạng và hạ huyết áp có thể xảy ra khi tiêm truyền tĩnh mạch.
– Buồn nôn, nôn mửa, ỉa chảy, chán ăn, choáng váng, ảo giác lẫn lộn.
– Mất bạch cầu hạt là tác dụng không mong muốn ít gặp.
– Sử dụng thuốc lâu dài có thể gây ra hội chứng giống lupus và biến mất khi dừng thuốc.
Giống như quinidin, các tác dụng không mong muốn cũng như khả năng gây và làm nặng lên các rối loạn nhịp của procainamide nhiều hơn là hiệu quả trong nhiều ca lâm sàng, do đó loại thuốc này hiếm khi được sử dụng.
Chỉ định
– Procainamide sử dụng đường tĩnh mạch thường rất hiệu quả trong điều trị rối loạn nhịp trung gian qua đường dẫn truyền phụ, đặc biệt là rung nhĩ có tần số đáp ứng thất nhanh và cuồng nhĩ ở bệnh nhân có hội chứng WPW.
– Dùng để hỗ trợ cho việc cắt các cơn rối loạn nhịp nhĩ bằng tạo nhịp dễ dàng hơn.
– Sử dụng truyền tĩnh mạch trong thăm dò điện sinh lý để làm bộc lộ hội chứng Brugada ở bệnh nhân bị ngừng tim được cấp cứu ngừng tuần hoàn thành công hoặc những bệnh nhân có triệu chứng ngất không tìm được nguyên nhân và có điện tâm đồ bất thường.
– Thuốc đôi khi được sử dụng trong điều trị nhịp nhanh thất đơn dạng bền bỉ nhưng vai trò này thường được thay thế bằng amiodarone.
Một điều cần lưu ý khi bắt đầu điều trị cuồng nhĩ bằng procainamide là thuốc làm chậm tần số của cuồng nhĩ và có thể dẫn tới dẫn truyền nhĩ-thất 1:1, làm tăng tần số thất lên đáng kể và dẫn tới tình trạng huyết động xấu đi. Thuốc cũng có thể làm chậm dẫn truyền trong các vòng vào lại lớn khác như trong nhịp nhanh vào lại nhĩ thất (AVRT) và chuyển nhịp nhanh này thành loại nhịp nhanh không ngừng.
Chống chỉ định
Chống chỉ định tương tự như của quinidine gồm:
– Block nhĩ thất.
– Hội chứng suy nút xoang.
– QT dài bẩm sinh hoặc mắc phải vì dễ dẫn tới xoắn đỉnh.
– Do tác dụng giảm sức bóp cơ tim nên không được sử dụng cho những bệnh nhân suy tim ứ trệ và huyết áp thấp.
Liều lượng và cách sử dụng
– Tiêm tĩnh mạch: nồng độ thuốc trong huyết tương tăng nhanh nhưng dễ gây giảm huyết áp, block nhánh tạm thời trên ĐTĐ, vì vậy cần tiêm thật chậm không quá 100 mg trong 2 phút. Trong quá trình tiêm truyền phải theo dõi huyết áp và điện tâm đồ nếu xuất hiện các biến chứng phải dừng thuốc ngay. Có thể tiêm nhắc lại 3-5 phút một lần nhưng không quá 1000 mg để cắt rối loạn nhịp cấp tính.
– Truyền tĩnh mạch: liều 10-15 mg/kg, tốc độ 20 mg/phút. Sau đó duy trì liều 1-4 mg/phút.
– Tiêm bắp: cứ 4-6h cho 0,5 g cho đến khi chuyển sang dạng thuốc uống.
– Uống: Liều không vượt quá 50 mg/kg/24h, chia đều trong ngày hoặc uống cách 3h một lần. Một số trường hợp cần phải tăng liều mới đạt được hiệu quả.
Tương tác thuốc
– Cimetidine làm giảm chuyển hóa procainamide nên làm tăng nồng độ thuốc.
– Amiodarone và quinidine làm tăng nồng độ của thuốc trong huyết tương.
Disopyramide
Disopyramide được sử dụng để điều trị rối loạn nhịp tim từ những năm 1960. Thuốc có cấu trúc hóa học gần giống isopropamide một chất liệt phế vị được dùng để chống sự co thắt. Thuốc được xếp vào phân nhóm IA trong hệ thống phân loại của Vaughan Williams
Biệt dược
- Rythmodan, viên nang 100 mg hoặc viên LP 250 mg, ống tiêm 50 mg.
Dược động học
– Disopyramide được hấp thu tốt qua đường uống (khả dụng sinh học là 80-90%) và được chuyển hóa ở gan, bởi hệ thống CYP3A4, để thành chất chuyển hóa chính của nó là mono-Ndealkyldisopyramide và được đào thải qua thận .
– Thuốc được gắn kết với protein huyết tương (50-65%) và do đó, việc đo nồng độ disopyramide trong huyết tương không hữu dụng trên lâm sàng. Thời gian bán hủy của thuốc khoảng 6-9h. Disopyramide có thể được loại bỏ bằng lọc máu.
Cơ chế tác dụng và tính chất dược lý
Tác dụng lên điện sinh lý tế bào tim
– Disopyramide ức chế kênh natri dẫn đến làm chậm dẫn truyền vừa phải và có đặc tính kháng cholinergic và giảm rõ rệt sức co bóp cơ tim.
– Giảm tính tự động do giảm độ dốc khử cực tâm trương tự phát ở pha 4 của điện thế hoạt động nhất là ở các sợi purkinje.
– Tác dụng hủy phó giao cảm nên làm tăng tần số nhịp xoang và làm tăng dẫn truyền trong nút nhĩ-thất.
– Giảm tính dẫn truyền trong cơ nhĩ và thất ở mức độ vừa phải do ức chế kênh natri dẫn đến làm giảm độ dốc và tốc độ của pha 0.
– Kéo dài thời gian điện thế hoạt động và kéo dài thời kỳ trơ có hiệu quả của tế bào cơ nhĩ và thất.
Các tác dụng dược lý khác
– Tăng nhẹ sức cản ngoại vi, ít làm thay đổi huyết áp.
– Giảm nhẹ sức co bóp cơ tim ở người có chức năng tim bình thường nhưng làm giảm đáng kể sức bóp cơ tim khi sử dụng liều cao (>1,5 mg/kg) và truyền tĩnh mạch nhất là ở bệnh nhân có suy tim.
Tác dụng không mong muốn
– Việc sử dụng lâu dài disopyramide bị hạn chế do ảnh hưởng của tác dụng hủy phó giao cảm (như gây táo bón, khô miệng và bí tiểu). Thuốc không được sử dụng cho nam giới cao tuổi do vấn đề bí tiểu.
– Thuốc cũng có thể gây kéo dài thời gian QT và xoắn đỉnh.
– Disopyramide được chống chỉ định cho những bệnh nhân suy tim do đặc tính giảm đáng kể sức co bóp cơ tim.
Chỉ định
– Chỉ định chính của disopyramide là ở những bệnh nhân mắc bệnh cơ tim phì đại và tắc nghẽn đường ra thất trái có triệu chứng.
– Điều trị rung nhĩ khởi phát qua trung gian phế vị.
Một nghiên cứu đa trung tâm về bệnh cơ tim phì đại tắc nghẽn có triệu chứng cho thấy, disopyramide giúp 66% bệnh nhân duy trì không có triệu chứng trong 3 năm với giảm 50% chênh áp đường ra thất trái. Thuốc không làm cải thiện tiên lượng tử vong, tuy nhiên disopyramide nếu dung nạp nên được xem xét sử dụng trước khi lựa chọn phương pháp xâm lấn như triệt đốt vách liên thất bằng cồn hoặc phẫu thuật làm mỏng vách liên thất.
Chống chỉ định
– Block nhĩ thất cấp II-III, block hai nhánh.
– Các bệnh nhân có QT dài.
– Suy tim.
– Không dùng cho bệnh nhân rối loạn tiểu tiện, suy thận.
– Không dùng cho phụ nữ có thai, cho con bú.
Liều lượng và cách sử dụng
Disopyramide thường được sử dụng với dạng tác dụng kéo dài với liều lượng khoảng 400 – 600 mg/24h. Chia làm 2-3 lần/24h. Khi đã đạt được hiệu quả, chuyển dùng liều duy trì. Nên giảm liều ở bệnh nhân cao tuổi.
THUỐC CHỐNG RỐI LOẠN NHỊP PHÂN NHÓM IB
Các thuốc thuộc phân nhóm IB hiện có và được sử dụng là lidocaine và mexiletine. Là những thuốc thuộc nhóm I nói chung, các thuốc trong phân nhóm IB ức chế các kênh natri ở cả trạng thái mở và bất hoạt nhưng có tốc độ phục hồi kênh khá nhanh. Các thuốc này làm chậm dẫn truyền chủ yếu là ở cơ tâm thất và có tác dụng rất ít ở cơ tâm nhĩ hoặc trên dẫn truyền qua nút nhĩ-thất. Kết quả là làm rút ngắn thời gian điện thế hoạt động và thời kỳ trơ. Tác dụng của các thuốc này biểu hiện sự phụ thuộc vào tình trạng sử dụng và có tác dụng rõ rệt trong các mô bệnh lý, làm cho chúng có hiệu quả trong việc ức chế nhịp nhanh thất trong thiếu máu cục bộ cơ tim.
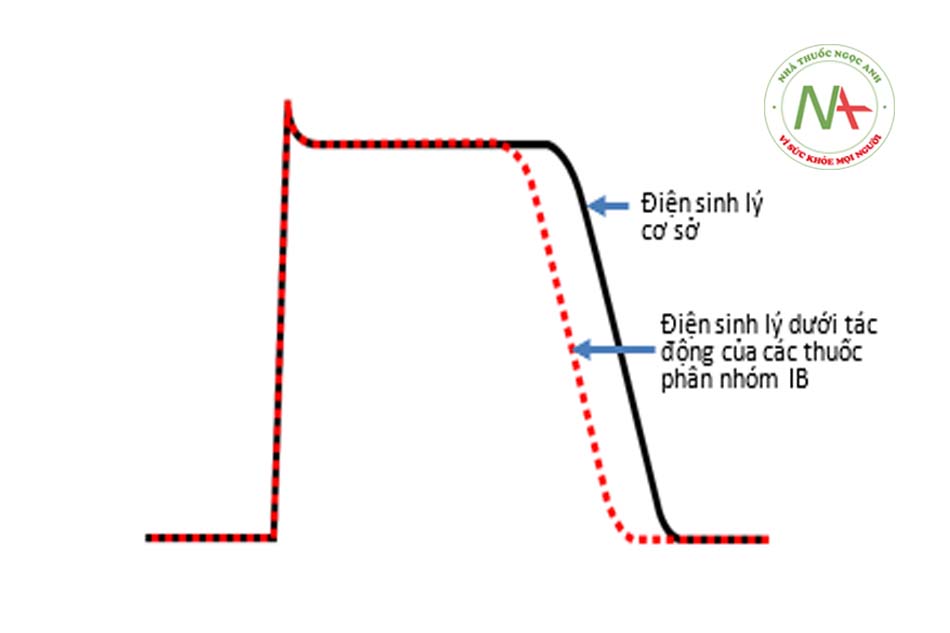
Lidocaine
Lidocaine được tổng hợp năm 1943 và ban đầu được sử dụng là thuốc gây tê tại chỗ. Năm 1950, thuốc được phát hiện có tác dụng điều trị rối loạn nhịp thất và sau đó nhiều nghiên cứu được tiến hành và đã xác nhận thuốc có hiệu quả trong việc dự phòng và điều trị các rối loạn nhịp thất. Lidocaine được xếp vào phân nhóm IB trong hệ thống phân loại thuốc chống rối loạn nhịp tim của Vaughan Williams.
Biệt dược
- Xylocaine, Xylocard, ống tiêm 2%.
Dược động học
– Dược động học và liều lượng của thuốc khá phức tạp. Do thuốc trải qua quá trình chuyển hóa mạnh mẽ đầu tiên ở gan làm cho sinh khả dụng chỉ còn <30% qua đường uống, nên nó chỉ có thể được sử dụng đường tĩnh mạch.
– Lidocaine được phân bố ban đầu rất nhanh do thuốc hòa tan nhiều trong lipid nên đi vào trong các mô và tế bào rất nhanh chóng, do đó thuốc nên được sử dụng với liều đổ đầy sau đó là truyền tĩnh mạch để duy trì nồng độ trong giới hạn điều trị hiệu quả. Thuốc có hai chất chuyển hóa có hoạt tính là mono-ethylglycinexylidide và glycinexylidide có tác dụng ức chế kênh natri ở mức vừa phải.
– Lidocaine có thời gian bán hủy khi tiêm tĩnh mạch khoảng 20-30 phút, còn khi truyền tĩnh mạch vào khoảng 2h và nồng độ trong huyết tương ở trạng thái ổn định đạt được trong 8-10h. Nồng độ ở trạng thái ổn định được quyết định bởi lưu lượng máu tới gan. Vì vậy nên giảm liều lidocaine duy trì trong cả suy gan và suy tim ứ trệ, khi lưu lượng máu tới gan giảm. Không cần chỉnh liều ở bệnh nhân suy thận.
– Có tới 70% thuốc được gắn với protein và con số này tăng lên trong giai đoạn cấp của nhồi máu cơ tim khi chất phản ứng giai đoạn cấp α-1-glycoprotein acid tăng. Do vậy, nồng độ lidocain có xu hướng tăng chậm sau nhồi máu cơ tim.
– Trong suy tim ứ trệ, khi sự phân bố thuốc vào các tổ chức giảm, lidocain đạt được nồng độ cao hơn nồng độ bình thường ban đầu và do đó cần giảm liều đổ đầy để tránh nhiễm độc. Tương tự như vậy, sự gắn kết tích cực của lidocaine với α glycoprotein acid-1, có xu hướng tăng trong suy tim, có thể dẫn đến giảm hoạt tính của thuốc trong suy tim.
– Thuốc được đào thải qua thận, 90% dưới dạng đã chuyển hóa, 10% nguyên dạng.
Cơ chế tác dụng và tính chất dược lý
Lidocaine ức chế kênh natri làm cản trở dòng Na+ nhanh đi vào trong tế bào, làm giảm tính tự động, giảm tính kích thích nhưng ít ảnh hưởng tới tính dẫn truyền.
Tác dụng điện sinh lý tế bào tim: Lidocaine có những tác dụng khác nhau lên các tổ chức khác nhau của tim:
- Nút xoang và cơ nhĩ: ở liều điều trị 1- 4 mg/phút lidocaine không ảnh hưởng tới tần số của nút xoang và có tác dụng yếu đến cơ nhĩ.
- Nút nhĩ thất: thuốc ít ảnh hưởng đến tốc độ dẫn truyền và giai đoạn trơ của nút nhĩ thất.
- Hệ thống His-Purkinje và cơ thất:
- Giảm khả năng đáp ứng của màng tế bào và giảm tính tự động của các ổ kích thích bất thường lạc chỗ ở tâm thất, nhất là tổ chức cơ tim thiếu máu cục bộ, do làm giảm độ dốc khử cực tâm trương tự phát ở pha 4 của điện thế hoạt động và tăng ngưỡng kích thích.
- Ở nồng độ thấp, lidocaine làm chậm sự khử cực tự phát nhưng ở nồng độ cao hơn thuốc ức chế tính tự động.
- Thuốc có tác dụng không đáng kể đối với cơ nhĩ, có thể là do thời gian điện thế hoạt động của cơ nhĩ rất ngắn khiến cho các kênh natri của tâm nhĩ ở trạng thái mở và bất hoạt trong thời gian ngắn. Lidocaine làm chậm dẫn truyền trong cơ tim thiếu máu cục bộ và có thể ức chế các rối loạn nhịp do vòng vào lại. Thuốc có thể làm thay đổi ngưỡng kích thích và giảm độ dốc của pha 4 giai đoạn khử cực, do đó, làm giảm tính tự động. Thời gian điện thế hoạt động không bị ảnh hưởng hoặc rút ngắn.
Các tính chất dược lý khác
– Ở liều điều trị, lidocaine không làm ảnh hưởng đến huyết động nhưng ở liều độc, thuốc giảm sức bóp cơ tim, làm giảm tần số tim và sức cản ngoại vi.
– Có tác dụng gây tê tại chỗ mạnh.
Những thay đổi trên điện tâm đồ
Các khoảng PR và thời gian QRS, khoảng QT thường không thay đổi, tuy nhiên khoảng QT có thể rút ngắn lại ở một số bệnh nhân. Những thay đổi nhỏ trên điện tâm đồ là do lidocaine không ảnh hưởng lên cơ tim và tổ chức dẫn truyền lành.
Ảnh hưởng lên huyết động
Ở liều điều trị lidocaine không ức chế sức co bóp của cơ tim nên có thể sử dụng ở bệnh nhân suy tim.
Các tác dụng không mong muốn
– Các tác dụng không mong muốn thường gặp nhất của lidocaine có liên quan đến hệ thần kinh trung ương như dị cảm, nhầm lẫn, buồn ngủ, tê liệt, viễn thị, mất định hướng ảo giác, giật cơ. Khi đạt đến nồng độ gây độc có thể gây ra các dấu hiệu nghiêm trọng hơn như loạn thần, co giật và hôn mê, ức chế hô hấp và giảm sức bóp cơ tim.
– Lidocaine có thể làm xấu đi tình trạng dẫn truyền ở bệnh nhân có bất thường dẫn truyền dưới nút trước đó.
Chỉ định
– Lidocaine thường được sử dụng để điều trị các rối loạn nhịp thất có khả năng đe dọa tính mạng người bệnh như ngoại tâm thu thất, nhịp nhanh thất hoặc rung thất, đặc biệt là trong bối cảnh thiếu máu cơ tim cục bộ cấp tính.
– Sử dụng lidocaine trong trường hợp này chủ yếu dựa nhiều vào kinh nghiệm điều trị hơn là các thử nghiệm lâm sàng ngẫu nhiên có đối chứng. Lidocaine thường không hiệu quả, có phạm vi điều trị hẹp và thường liên quan đến nhiễm độc thần kinh. Một phân tích tổng hợp các thử nghiệm ngẫu nhiên đã cho thấy lidocaine không cải thiện tiên lượng tử vong trong bối cảnh này.
– Chỉ định điều trị rối loạn nhịp thất trong nhồi máu cơ tim cấp:
- Ngoại tâm thu thất: Đến sớm dạng R/T, nhiều ổ, nhiều dạng, xuất hiện với tần suất dày (>10 NTT/phút) hoặc ngoại tâm thu thất chùm: dễ chuyển thành nhịp nhanh thất hoặc rung thất.
- Nhịp nhanh thất: Nếu lidocaine không có hiệu quả và ảnh hưởng đến huyết động thì phải sốc điện.
- Rung thất: Tiến hành sốc điện ngay và sau đó dùng lidocaine để duy trì nhịp xoang.
- Lưu ý:
Nếu ngoại tâm thu thất xảy ra kèm theo nhịp chậm xoang hoặc rối loạn dẫn truyền do cường phế vị thì phải dùng atropine trước để nhịp nhanh hơn hoặc hết rối loạn dẫn truyền rồi dùng lidocaine để điều trị ngoại tâm thu thất.
Nếu ngoại tâm thu xảy ra kèm theo rối loạn dẫn truyền do tổn thương nhồi máu thì phải thận trọng hơn. Nếu có block nhĩ thất cấp II và III thì phải đặt máy tạo nhịp tạm thời sau đó mới sử dụng lidocaine vì nếu không thuốc sẽ ức chế các ổ nhịp thoát thất dẫn đến ngừng tim.
Trong trường hợp rối loạn nhịp thất xảy ra trong suy tim thì lidocaine là thuốc được lựa chọn vì không làm giảm sức co bóp cơ tim.
- Rối loạn nhịp thất xảy ra sau phẫu thuật tim hoặc phẫu thuật chung, hoặc trong các thủ thuật can thiệp tim mạch (thông tim, thăm dò điện sinh lý tim, can thiệp động mạch vành…) và trong nhiễm độc digitalis.
- Lidocaine ít ảnh hưởng đến cơ nhĩ nên không có hiệu quả đối với các rối loạn nhịp trên thất và các rối loạn nhịp trong hội chứng Wolff-Parkinson-White.
- Tuy nhiên, thuốc lại được chứng minh là không có hiệu quả hoặc có lợi (và có thể có hại) khi sử dụng như là một biện pháp dự phòng cho bệnh nhân bị nhồi máu cơ tim.
Liều lượng và cách sử dụng
– Lidocaine thường được sử dụng với liều đổ đầy ban đầu, sau đó là liều duy trì đường tĩnh mạch.
– Một phác đồ thường được sử dụng là cho liều nạp ban đầu là 1 mg/kg tiêm tĩnh mạch chậm, sau đó là ba liều 0,5-0,75 mg/kg trong khoảng thời gian mỗi 5 phút với tổng liều đổ đầy không quá 3 mg/kg. Phương pháp này thường đạt được và duy trì nồng độ trong huyết tương trong giới hạn điều trị 1,55 μg/mL. Sau đó duy trì truyền tĩnh mạch liên tục 1-4 mg/phút. Tổng liều có thể tới 1000-1500 mg/24h.
– Phác đồ điều trị như trên kéo dài trong nhiều giờ hoặc vài ngày tùy theo diễn biến lâm sàng, rồi thay bằng thuốc chống rối loạn nhịp đường uống khác.
– Theo dõi sát lâm sàng để phát hiện sớm các dấu hiệu nhiễm độc licocaine.
Chống chỉ định
– Tăng mẫn cảm với các thuốc gây tê tại chỗ (hiếm xảy ra).
– Rối loạn chức năng gan nặng nề.
– Tiền sử có co giật nghiêm trọng khi sử dụng lidocaine.
– Block nhĩ – thất cấp 2 và 3 vì thuốc có thể làm tăng mức block hoặc ức chế hoàn toàn tất cả các ổ tạo nhịp tự thất gây ngừng tim.
Tương tác thuốc
– Propranolol, metoprolol và cimetidine có thể làm giảm lưu lượng máu tới gan, giảm độ thanh thải của lidocaine và nếu sử dụng đồng thời có thể dẫn đến ngộ độc lidocaine.
– Phenobarbital, phenytoin, rifampicin làm giảm nồng độ lidocaine huyết tương do làm tăng chuyển hóa thuốc ở gan.
Mexiletine
Mexiletine có cấu trúc hóa học gần giống với lidocaine nhưng không bị chuyển hóa mạnh mẽ đầu tiên ở gan nên sử dụng được ở dạng uống. Thuốc ít ảnh hưởng đến điện sinh lý tâm nhĩ, huyết động và chức năng co bóp của tâm thất và được xếp vào phân nhóm IB trong hệ thống phân loại của Vaughan Williams.
Biệt dược: Mexitil, viên 150 mg và 200 mg.
Dược động học
– Mexiletine, được hấp thu gần như hoàn toàn khi uống, nồng độ đỉnh trong huyết tương đạt được sau khoảng 2h và bắt đầu giảm sau 6h. Liên kết với protein huyết tương tới 50-60%.
– Thuốc được chuyển hóa chủ yếu ở gan (90%) qua hệ thống CYP2D6 thành dạng chuyển hóa không hoạt tính và thải trừ qua nước tiểu.
– Bài tiết qua thận phụ thuộc pH với độ thanh thải thận tăng khi nước tiểu có tính acid. Độ thanh thải giảm khi có xơ gan.
– Thời gian bán hủy trong huyết tương là 9 -12h.
Cơ chế tác dụng và tính chất dược lý
Tác dụng lên điện sinh lý tế bào cơ tim
– Mexiletine có tác dụng ức chế kênh natri kiểu phụ thuộc tần số với đặc tính khởi phát tác dụng và hồi phục ức chế nhanh.
– Không làm thay đổi điện thế qua màng khi nghỉ, làm giảm nhẹ thời gian điện thế hoạt động và rút ngắn nhẹ thời kỳ trơ có hiệu quả của hệ thống His Purkinje và cơ thất.
– Làm giảm nhẹ dẫn truyền ở cơ tim và nút nhĩ thất.
– Không làm thay đổi tần số tim và chỉ làm giảm nhẹ sức co bóp của cơ tim trên bệnh nhân đã có suy tim.
– Có tác dụng tốt trong điều trị các rối loạn nhịp thất như lidocaine.
Các tác dụng không mong muốn
– Các tác dụng không mong muốn phổ biến nhất với mexiletine là tiêu hóa và thần kinh và có thể rất trầm trọng. Run rẩy, buồn nôn và nôn là những biểu hiện khá phổ biến, còn chóng mặt, nhầm lẫn, mờ mắt và mất điều hòa cũng có thể xảy ra. Tác dụng không mong muốn về thần kinh phụ thuộc vào liều dùng. Tác dụng không mong muốn đường tiêu hóa có thể được cải thiện bằng cách dùng thuốc trong khi ăn.
– Chứng run do mexiletine có thể đáp ứng với thuốc chẹn beta.
– Giảm tiểu cầu là một tác dụng không mong muốn ít gặp.
– Nhịp tim chậm nghiêm trọng và thời gian phục hồi nút xoang bất thường cũng có thể xảy ra.
Chỉ định
– Mexiletine chủ yếu được sử dụng để điều trị các rối loạn nhịp thất.
– Điều trị và dự phòng các rối loạn nhịp thất nhằm giảm số nhát sốc của ICD ở bệnh nhân mắc bệnh tim cấu trúc, bằng đơn trị liệu hoặc kết hợp với AADs khác, như amiodarone.
– Các rối loạn nhịp ở hội chứng QT dài: LQT3. Mexiletine có khả năng rút ngắn thời gian khoảng QT và đã được sử dụng để ức chế các rối loạn nhịp tim ở những bệnh nhân mắc hội chứng QT dài type 3 (LQT3) và ở những bệnh nhân có tiền sử xoắn đỉnh do thuốc gây ra.
Mexiletine không làm cải thiện khả năng sống còn ở những bệnh nhân có nguy cơ cao và hiệu quả của mexiletine trong việc ức chế các rối loạn nhịp thất rất khác nhau và dao động từ 6% đến 60% và phần lớn các nghiên cứu cho thấy tỷ lệ thành công vào khoảng 20%.
Chống chỉ định
– Sốc tim.
– Block nhĩ thất độ 2 hoặc 3 mà không có tạo nhịp.
– Thận trọng khi bệnh nhân có rối loạn chức năng nút xoang hoặc rối loạn dẫn truyền trong thất.
Liều lượng và cách sử dụng
– Mexiletine thường được bắt đầu với liều 150 – 200 mg mỗi 8 giờ, tăng liều chậm để đạt đến liều dung nạp và hiệu quả tối đa. Liều tối đa được đề nghị để duy trì là 300mg 3-4 lần mỗi 24h.
– Bệnh nhân bị suy thận nên khởi trị ở liều thấp hơn. Liều lượng thuốc cũng cần được điều chỉnh ở bệnh nhân suy gan.
– Mexiletine đã được sử dụng phối hợp với quinidine. Sự kết hợp này đã từng được cho là có hiệu quả cao và ít gây loạn nhịp. Đôi khi, mexiletine được sử dụng kết hợp với amiodarone như một thuốc hỗ trợ ở những bệnh nhân bị nhịp nhanh thất tái phát, nhưng có rất ít các dữ liệu khoa học ủng hộ cách kết hợp này.
Các tương tác thuốc
– Các tương tác thuốc chính của mexiletine được trình bày trong Bảng 5.4. Các chất gây kích ứng và ức chế hệ thống CYP2D6 có thể ảnh hưởng đến quá trình chuyển hóa mexiletine và có thể ảnh hưởng đến hiệu quả và/hoặc độc tính của thuốc.
– Nồng độ theophylin trong huyết tương tăng lên khi được dùng đồng thời với mexiletine do làm giảm độ thanh thải theophylin. Nồng độ digoxin và warfarin không bị ảnh hưởng.
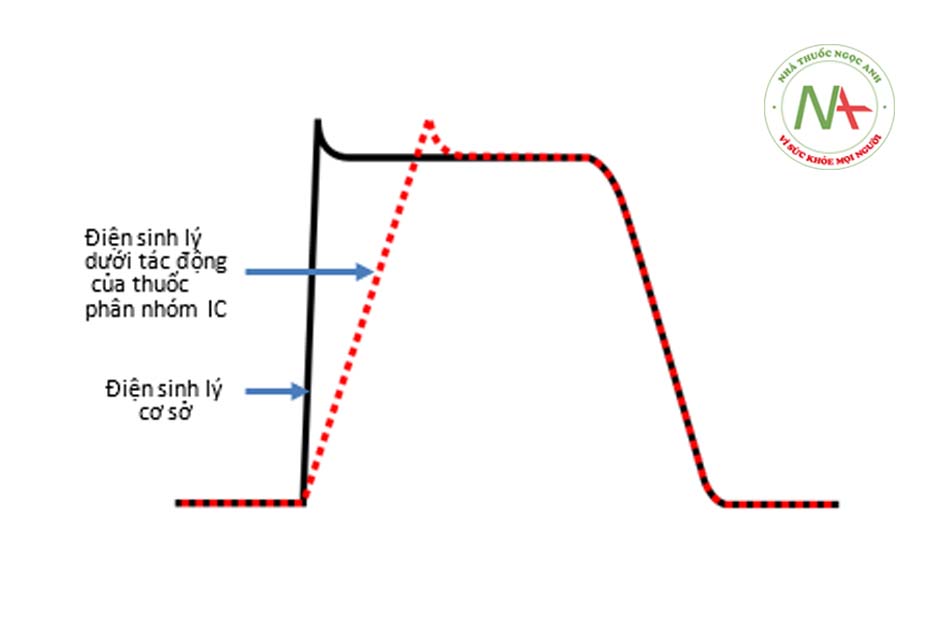
THUỐC CHỐNG RỐI LOẠN NHỊP PHÂN NHÓM IC
Flecainide và propafenone, các thuốc thuộc phân nhóm IC hiện có, là các thuốc ức chế kênh natri mạnh với đặc tính “bù đắp chậm” từ kênh natri, dẫn đến làm chậm dẫn truyền trong các mô tim. Cả hai loại thuốc đều có biểu hiện phụ thuộc liều rõ rệt, khiến chúng trở thành loại thuốc được kỳ vọng trong việc phục hồi và kiểm soát nhịp xoang trong rung nhĩ. Ở liều điều trị, các thuốc phân nhóm IC làm kéo dài khoảng PR và QRS mà không có bất kỳ ảnh hưởng đáng kể nào đến khoảng QTc. Ngoài ra, chúng thể hiện tác dụng giảm sức co bóp cơ tim và có thể làm suy tim nặng hơn ở những bệnh nhân có rối loạn chức năng thất trái. Các thuốc này được chống chỉ định ở những bệnh nhân có rối loạn chức năng thất trái, chứng phì đại thất trái hoặc có bất kỳ bằng chứng nào về bệnh tim thiếu máu cục bộ.
Flecainide
Flecainide là một dẫn chất fluo của procainamide nhưng có có các đặc tính điện sinh lý và dược động học khác nhau. Thuốc được phát hiện năm 1970 và được xếp vào phân nhóm IC theo hệ thống phân loại của Vaughan Williams.
Biệt dược:
- Flecainide, Tambocor : viên 50, 100 và 150mg,
Dược động học
– Flecainide đường uống được hấp thu tốt > 90%, nồng độ đỉnh trong huyết tương đạt được sau khi uống khoảng 2,5h còn khi tiêm tĩnh mạch nồng độ đỉnh đạt được sau 10 phút.
– Thuốc được phân tán nhanh đến các mô, mức liên kết với protein huyết tương thấp (40%).
– Được chuyển hóa chủ yếu bởi CYP2D6 ở gan thành các chất chuyển hóa không hoạt tính.
– Thuốc cũng được bài tiết một phần qua thận và do vậy, các biến thể di truyền trong CYP2D6 không ảnh hưởng đáng kể đến các tác dụng dược lý của thuốc.
– Thời gian bán hủy của flecainide dao động từ 10-17h, cho phép dùng hai lần/24h.
– Các sản phẩm sữa làm giảm sự hấp thụ flecainide. Loại bỏ sữa hoặc các sản phẩm sữa khỏi chế độ ăn uống có thể dẫn đến nồng độ thuốc trong huyết thanh tăng và gây nhiễm độc.
Tác dụng lên điện sinh lý tế bào cơ tim
– Nút xoang và cơ nhĩ: làm giảm tần số nhịp xoang; còn đối với cơ nhĩ, thuốc làm giảm tốc độ dẫn truyền, kéo dài thời gian thời kỳ trơ có hiệu quả theo kiểu phụ thuộc tình trạng sử dụng.
– Tại nút nhĩ-thất: làm chậm dẫn truyền qua nút nhĩ thất, kéo dài thời kỳ trơ có hiệu quả.
– His-purkinje và cơ thất: làm chậm dẫn truyền tại hệ thống His-Purkinje và cơ thất nhiều hơn so với ở cơ nhĩ. Thuốc cũng kéo dài thời kỳ trơ có hiệu quả nên có thể gây block dẫn truyền xung động qua đường dẫn truyền bất thường nhĩ-thất (cầu Kent) và đây là cơ chế chính trong điều trị cắt cơn nhịp nhanh vào lại nhĩ thất (AVRT).
Những thay đổi trên điện tâm đồ
- Kéo dài khoảng PR và QRS giãn rộng, còn khoảng QTc bị kéo dài ít hơn. Thuốc không ảnh hưởng đến tốc độ tái cực nên khoảng QT bị kéo dài chủ yếu do tăng thời gian phức bộ QRS.
Ảnh hưởng lên huyết động
- Flecainide làm giảm sức bóp cơ tim ở mức độ vừa phải, tuy nhiên ở những bệnh nhân có rối loạn chức năng thất trái tác động này trở lên nặng nề hơn và làm cho suy tim nặng lên.
Tác dụng không mong muốn:
– Tác dụng không mong muốn thường phụ thuộc vào liều và bao gồm đau đầu, buồn nôn, mất điều hòa và mờ mắt.
– Tác dụng giảm sức co bóp cơ tim có thể làm nặng thêm suy tim ở những bệnh nhân có rối loạn chức năng thất trái.
– Thuốc có thể làm tăng đáng kể ngưỡng tạo nhịp và khử rung tim và do đó nên được sử dụng thận trọng.
– Một số dạng nặng lên của các rối loạn nhịp có thể xảy ra với flecainide như:
- Ở những bệnh nhân bị nhịp nhanh thất đơn dạng, đặc biệt là nếu có bệnh tim cấu trúc, flecainide có thể làm xuất hiện một loại nhịp nhanh thất bền bỉ mà không thể chuyển nhịp được.
- Với các bệnh nhân bị rung nhĩ: rung nhĩ có thể biến thành cuồng động nhĩ và vì tần số của cuồng nhĩ thường chậm nên có thể có dẫn truyền nhĩ-thất 1:1 gây ra một dạng nhịp nhanh có phức bộ QRS giãn rộng do bất thường dẫn truyền nhánh phải. Để ngăn chặn mối lo ngại này của các thuốc “IC”, các thuốc kiểm soát tần số, ví dụ như chẹn beta giao cảm hoặc chẹn kênh canxi được khuyến cáo sử dụng cho những bệnh nhân bị rung nhĩ đang dùng flecainide.
Chỉ định
– Nhịp nhanh kịch phát trên thất, nhất là ở bệnh nhân có hội chứng WPW.
– Hiện nay, flecainide được sử dụng phổ biến nhất để phục hồi và duy trì nhịp xoang ở bệnh nhân rung nhĩ kịch phát và có cấu trúc tim bình thường.
– Thuốc cũng có hiệu quả và được chỉ định trong rung nhĩ qua trung gian phó giao cảm. Flecainide cũng có hiệu quả như là một loại thuốc sử dụng theo kiểu “ thuốc mang trong túi” dùng để cắt cơn rung nhĩ.
– Thuốc cũng được chỉ định để điều trị các rối loạn nhịp khởi phát từ đường ra thất phải và thất trái (ngoại tâm thu thất, nhịp nhanh thất) có triệu chứng.
– Flecainide gần đây đã được chứng minh là có hiệu quả trong việc ức chế ngoại tâm thu đa dạng và nhịp nhanh thất đa dạng do catecholamine (CPVT), một số rối loạn nhịp tim di truyền, có khả năng gây tử vong do đột biến gen mã hóa thụ thể ryanodine và calsequetin, gây ra sự bất thường điều hòa canxi. Các thực nghiệm đã chứng minh rằng flecainide có tác dụng ức chế trực tiếp lên sự giải phóng canxi qua trung gian thụ thể ryanodine bị khiếm khuyết. Tác dụng ức chế kênh natri đã làm giảm hoạt động nảy cò.
Trong một nghiên cứu tiến cứu đa trung tâm trên 29 bệnh nhân bị nhịp nhanh thất đa dạng do catecholamine (CPVT) có triệu chứng được sử dụng flecainide bổ sung thêm vào ngoài các thuốc điều trị thường quy, 22 bệnh nhân (76%) đã được ức chế một phần (n=8) hoặc hoàn toàn (n=14) các NTT và/hoặc nhịp nhanh thất đa dạng khởi phát do gắng sức. Liều trung bình hằng ngày của flecainide là 150 mg ở những người có đáp ứng. Một bệnh nhân vẫn có nhiều nhát sốc của ICD khi dùng flecainide được phát hiện có nồng độ flecainide huyết thanh thấp. Mặc dù không phải thử nghiệm ngẫu nhiên, nhưng những kết quả này đã ủng hộ việc sử dụng flecainide trong nhịp nhanh thất đa dạng do catecholamine (CPVT). Flecainide cũng có thể có lợi cho những bệnh nhân mắc hội chứng QT dài type 3 với đột biến gen đặc hiệu SCN5A (D1790G). Flecainide cũng được sử dụng trong thăm dò điện sinh lý để làm bộc lộ những dấu hiệu bất thường bị che giấu trên điện tâm đồ ở những bệnh nhân nghi ngờ có hội chứng Brugada.
Thử nghiệm ức chế rối loạn nhịp tim I (CAST I) đã cho thấy rằng flecainide, khi được sử dụng cho những bệnh nhân sau nhồi máu cơ tim, đã làm tăng tỷ lệ tử vong so với giả dược. Những kết quả tương tự cũng được ghi nhận với một loại thuốc chống rối loạn nhịp khác thuộc phân nhóm IC và hiện đã lỗi thời là encainide. Trong thử nghiệm CAST II, moricizine, một AADs khác thuốc nhóm I, đã cho thấy có thể có tác động làm nặng lên các rối loạn nhịp. Dựa trên những kết quả này, các thuốc phân nhóm IC loại này bị chống chỉ định ở bệnh nhân thiếu máu cục bộ và bệnh tim cấu trúc.
Chống chỉ định
– Bệnh tim thực tổn như nhồi máu cơ tim và sau nhồi máu cơ tim, bệnh cơ tim…
– Suy tim.
– Block nhánh trái hoàn toàn, block hai nhánh, block nhĩ thất độ 2 và 3.
– Cần thận trọng ở những bệnh nhân mắc bệnh hệ thống dẫn truyền His-Purkinje tiến triển, vì block dẫn truyền trong bó His có thể xảy ra.
– Flecainide cũng được chống chỉ định ở những bệnh nhân nghi ngờ mắc bệnh lý kênh natri như hội chứng Brugada, vì nó có thể làm xấu đi tình trạng này.
– Những chỉ dẫn về điều trị rung nhĩ của Trường môn Tim mạch Hoa Kỳ/ Hội Tim mạch Hoa Kỳ/ Hội Nhịp tim (ACC/AHA/HRS) đã khuyến cáo không nên sử dụng flecainide ở những bệnh nhân bị phì đại thất trái đáng kể.
– Flecainide cũng có thể làm tăng ngưỡng tạo nhịp.
Liều lượng và cách sử dụng
– Flecainide đường uống thường được bắt đầu với liều 50 – 100mg hai lần/24h và điều chỉnh dần đến liều tối đa 300mg mỗi 24h. Thời gian QRS có thể tăng tới 25% ở liều hiệu quả và thường được đánh giá bằng nghiệm pháp gắng sức bằng thảm chạy ở nhịp tim cao.
– Một liều duy nhất 300 hoặc 600mg flecainide cũng được sử dụng như “một liều thuốc mang trong túi”.
– Liều dùng ban đầu thấp hơn và chỉnh liều tăng dần dần được khuyến cáo cho những bệnh nhân có rối loạn chức năng gan và thận.
Các tương tác thuốc
– Cimetidine làm giảm chuyển hóa thuốc ở gan nên làm tăng nguy cơ nhiễm độc.
– Làm tăng nồng độ digoxin.
Propafenone
Propafenone có cấu trúc tương tự propranolol nhưng có tác dụng điện sinh lý tương tự flecainide. Ngoài việc là một thuốc ức chế kênh natri mạnh, propafenone còn có tác dụng ức chế thụ thể β giao cảm (bằng khoảng 1/30 hiệu lực của propranolol) và tính chất ức chế kênh canxi. Tác dụng ức chế thụ thể β giao cảm đáng kể ở các bệnh nhân có chuyển hóa chậm propafenone. Thuốc được xếp vào phân nhóm IC theo hệ thống phân loại của Vaughan Williams.
Biệt dược: Rythmol, viên 300 mg; Rythmonorm viên 150 mg.
Dược động học
– Thuốc được hấp thu tới 95-100 % sau khi uống, nồng độ đỉnh trong huyết tương đạt được sau 2-3h.
– Liên kết với protein huyết tương lên tới 85-90 %.
– Thời gian bán hủy của thuốc vào khoảng 2-10h.
– Chuyển hóa ở gan thành chất 5-hydroxypropafenone và N-depropyl-propafenone có hoạt tính. Gần 1/3 thuốc được thải trừ ở dạng không đổi qua nước tiểu.
– Propafenone được chuyển hóa qua con đường CYP2D6 ở gan thành 5-hydroxypropafenone, có tác dụng ức chế các kênh natri ở mức độ tương tự như hợp chất gốc, nhưng thiếu các đặc tính ức chế đáng kể thụ thể β. Tuy nhiên, quá trình này phần lớn được quyết định bởi di truyền. Khoảng 7% dân số Hoa Kỳ bị thiếu CYP2D6, dẫn đến việc chuyển hóa propafenone thành 5-hydroxypropafenone rất chậm, do đó làm tích lũy propafenone và có tác dụng đối kháng thụ thể β đáng kể ở các bệnh nhân chuyển hóa kém.
Cơ chế tác dụng và tính chất dược lý
Ngoài tác dụng chủ yếu là ức chế kênh natri theo kiểu phụ thuộc tình trạng sử dụng, propafenone còn có tác dụng ức chế các thụ thể giao cảm beta nhưng ở mức yếu.
Tác dụng lên điện sinh lý tế bào cơ tim
+ Nút xoang: làm chậm tần số nhịp xoang do giảm tính tự động của nút xoang.
+ Cơ nhĩ: Propafenone kéo dài thời gian giai đoạn trơ có hiệu quả.
– Giảm tốc độ dẫn truyền nên làm chậm tần số cuồng nhĩ và có thể dẫn đến dẫn truyền nhĩ thất thành 1:1, làm cho tần số thất đột ngột tăng lên đáng kể và có thể làm xấu đi tình trạng huyết động.
+ Nút nhĩ thất: làm chậm dẫn truyền qua nút nhĩ thất và kéo dài thời kỳ trơ có hiệu quả.
+ Hệ thống His-Purkinje và cơ thất: làm chậm dẫn truyền và kéo dài thời kỳ trơ có hiệu quả tại hệ thống His-Purkinje, cơ thất và đường dẫn truyền bất thường.
Các tính chất dược lý khác
– Làm giảm sức bóp cơ tim nhất là trên bệnh nhân có bệnh tim thực tổn.
– Tác dụng ức chế thụ thể β ở mức yếu.
Những thay đổi trên điện tâm đồ
Làm kéo dài thời gian khoảng PR và phức bộ QRS kiểu phụ thuộc liều lượng; không ảnh hưởng tới thời gian khoảng QT.
Ảnh hưởng lên huyết động
– Không làm ảnh hưởng đáng kể đến sức bóp cơ tim ở bệnh nhân không có bệnh tim thực tổn.
– Làm giảm đáng kể sức bóp cơ tim ở bệnh nhân có bệnh tim thực tổn hoặc có rối loạn chức năng thất trái.
Tác dụng không mong muốn:
– Các tác dụng không mong muốn phổ biến nhất là buồn nôn, chóng mặt và mùi vị kim loại.
– Tác dụng không mong muốn về thần kinh như dị cảm và mờ mắt phụ thuộc vào liều và phổ biến hơn ở các đối tượng chuyển hóa kém.
– Sự ức chế β tăng do chuyển hóa kém có thể dẫn đến co thắt phế quản và hen suyễn nặng lên.
– Nhịp nhanh thất bền bỉ là một tác dụng gây loạn nhịp khi phong tỏa kênh natri đã được báo cáo xảy ra ở những bệnh nhân mắc bệnh tim cấu trúc và tiền sử có nhịp nhanh thất. Điều này ít xảy ra do thuốc này hiện nay không còn được sử dụng trong các bệnh cảnh nói trên.
– Propafenone có thể chuyển rung nhĩ thành cuồng nhĩ chậm, và dẫn truyền nhĩ-thất 1:1 có thể xảy ra. Do đó, khi được sử dụng cho rung nhĩ, nên sử dụng thuốc ức chế nút nhĩ-thất cùng với propafenone.
Chỉ định
– Điều trị các rối loạn nhịp trên thất, duy trì nhịp xoang ở những bệnh nhân bị rung nhĩ kịch phát hoặc dai dẳng và không có bệnh tim thực tổn.
– Điều trị các rối loạn nhịp thất đe dọa tính mạng ở bệnh nhân không có bệnh tim thực tổn.
– Sử dụng thận trọng ở bệnh nhân có bệnh tim bẩm sinh do thuốc có nguy cơ làm nặng lên các rối loạn nhịp thất.
– Thuốc nên được khởi trị ở bệnh nhân nằm viện.
Chống chỉ định
– Nhịp chậm xoang < 50 nhịp/phút, hội chứng suy nút xoang, block nhánh, block nhĩ-thất độ 2, 3.
– Suy tim, sốc tim, hạ huyết áp.
– Những bệnh nhân bị nhồi máu cơ tim trước đó, bệnh tim thiếu máu cục bộ, phì đại tâm thất nặng và tiền sử nhịp nhanh thất kéo dài hoặc bệnh tim cấu trúc nặng.
– Suy gan, suy thận, rối loạn điện giải, nhiễm độc digoxin.
– Hen phế quản, bệnh phổi tắc nghẽn mạn tính vì tác dụng ức chế thụ thể beta của thuốc có thể gây co thắt phế quản.
– Phụ nữ có thai.
Liều lượng và cách sử dụng
– Liều dùng đường uống dao động từ 150mg – 300mg, 2-3 lần/24h (đã có dạng tác dụng dài). Giảm liều ở người già.
– Nếu xuất hiện các dấu hiệu rối loạn dẫn truyền: block xoang nhĩ, block nhĩ thất có độ cao hơn thì ngừng thuốc.
Tương tác thuốc
– Propafenone ức chế CYP2C9 nên làm tăng tác dụng chống đông máu của warfarin do làm giảm độ thanh thải của warfarin.
– Thuốc làm tăng đáng kể nồng độ digoxin bằng cách giảm độ thanh thải không qua thận của digoxin và không nên dùng đồng thời với thuốc này.
– Nồng độ metoprolol và propranolol, thuốc cũng được chuyển hóa bởi CYP2D6, tăng lên với sự hiện diện của propafenone.
– Quinidine, cimetidine và thuốc chống trầm cảm như fluoxetine và paroxetine đều có thể ức chế CYP2D6, do đó làm tăng nồng độ propafenone.
THUỐC CHỐNG LOẠN NHỊP NHÓM II
Thuốc chẹn thụ thể giao cảm beta (gọi tắt là thuốc chẹn β) là một trong những thuốc thường được sử dụng nhất trong thực hành lâm sàng tim mạch. Các thuốc chẹn β có đặc tính chống loạn nhịp tim và có thể làm giảm nguy cơ đột tử tim mạch và rối loạn nhịp thất, ức chế rung nhĩ qua trung gian giao cảm, ngăn ngừa cơn nhịp nhanh kịch phát trên thất với nhiều cơ chế khác nhau và có tác dụng hiệp đồng với các loại AADs khác. Cụ thể, các thuốc chẹn β có hiệu quả trong rung nhĩ sau phẫu thuật, rối loạn nhịp tim trong nhiễm độc giáp trạng, ức chế các rối loạn nhịp tim khởi phát qua trung gian catecholamine, ức chế nhịp nhanh thất đường ra vô căn khởi phát qua trung gian hậu khử cực muộn và nhịp nhanh thất đa dạng ở những bệnh nhân mắc hội chứng QT dài type 1. Thuốc cũng được sử dụng để làm chậm dẫn truyền nút nhĩ-thất ở bệnh nhân nhịp nhanh nhĩ. Ngoài ra, các thuốc chẹn β còn thể hiện tác dụng đa diện nên làm tăng lợi ích sống còn ở bệnh nhân suy tim, nhồi máu cơ tim và bệnh tim thiếu máu cục bộ.
Bằng cách ức chế dẫn truyền qua nút nhĩ-thất, các thuốc chẹn β can thiệp vào vòng vào lại ở các bệnh nhân có cơn tim nhanh do vòng vào lại nhĩ-thất hoặc vòng vào lại nút nhĩ-thất. Thuốc có thể ức chế tính tự động và hoạt động nảy cò khởi phát nhịp nhanh nhĩ, rung nhĩ và rung thất. Các thuốc chẹn β có thể làm tăng tác dụng của AADs nhóm I. Hơn nữa, sự kết hợp giữa AADs nhóm III, amiodarone và các thuốc chẹn β đem lại hiệu quả cao trong việc ngăn ngừa các rối loạn nhịp tim có khả năng đe dọa đến tính mạng trong nhóm bệnh nhân được cấy ICD, mặc dù cơ chế của tác dụng này còn chưa hoàn toàn được hiểu rõ.
Một số thuốc chẹn β có tác dụng lên hệ thần kinh trung ương và tác dụng này phụ thuộc vào tính hòa tan trong lipid của chúng. Các thuốc chẹn β tan trong nước và bài tiết qua thận (atenolol, nadolol, sotalol và pindolol) hiếm khi vượt qua hàng rào máu não, trong khi các thuốc chẹn β tan trong lipid (propranolol, metoprolol, acebutolol và carvedilol) dễ dàng vượt qua hàng rào máu – não. Ngoài ra, các thuốc, chẳng hạn như carvedilol, ngoài các đặc tính chẹn β và đối kháng α1, có thể ức chế IKr, IKs, Ito và canxi loại L. Các tính chất dược lý và các đặc tính cụ thể của các thuốc chẹn β sẽ được trình bày chi tiết ở một chương riêng.
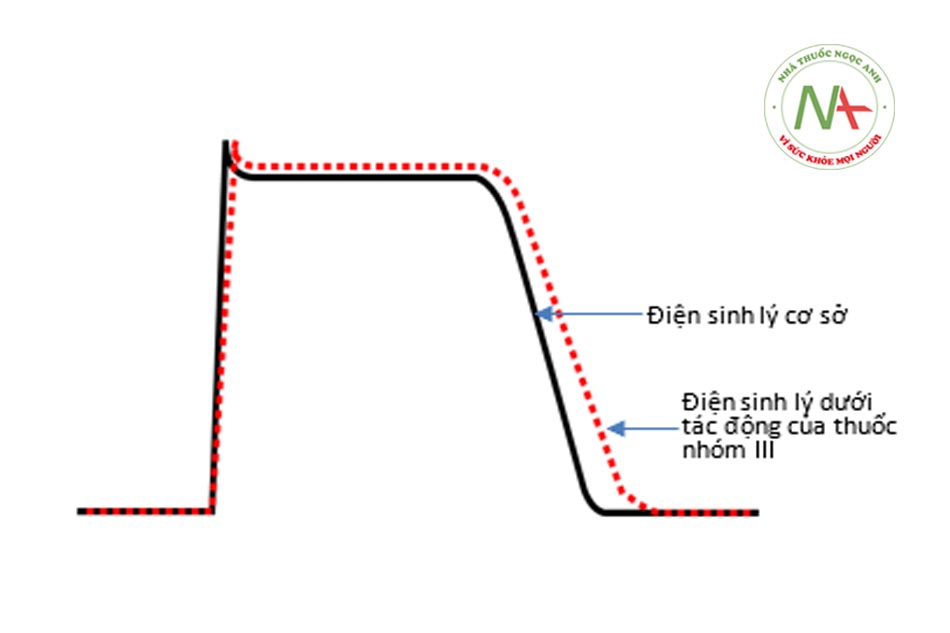
THUỐC CHỐNG RỐI LOẠN NHỊP NHÓM III
AADs nhóm III kéo dài quá trình tái cực. Các thuốc thuộc nhóm này chủ yếu ức chế các kênh kali ở tim [chủ yếu là kênh kali nhanh một chiều (IKr) và ở mức độ thấp hơn, kênh kali chậm một chiều (IKs)] (như vậy chủ yếu tác động vào pha 3 điện thế hoạt động), dẫn đến kéo dài thời gian điện thế hoạt động và thời kỳ trơ ở các mô tim khác nhau. Những tác dụng này làm cho các thuốc nhóm III rất có hiệu quả trong việc phá vỡ vòng vào lại, mà sự tồn tại của vòng vào lại phụ thuộc vào sự cân bằng quan trọng giữa tốc độ dẫn truyền và thời gian trơ. Các thuốc nhóm III, chẳng hạn như D, L-sotalol (đồng phân dextro và levo) và NAPA, thể hiện tác dụng nghịch chiều phụ thuộc tình trạng kênh điện học, trong đó hiệu quả của AADs rõ rệt nhất khi nhịp tim chậm. Quinidine, mặc dù được phân loại là AADs nhóm I, nhưng có thể có tác dụng phụ thuộc nghịch tình trạng sử dụng đối với kênh kali nhưng lại có tác dụng phụ thuộc thuận tình trạng sử dụng với kênh natri.
Amiodarone là thuốc nhóm III nhưng không thể hiện tác dụng nghịch chiều phụ thuộc tình trạng kênh điện học. Hiện nay các thuốc chống rối loạn nhịp nhóm III đã được sử dụng nhiều hơn để điều trị các rối loạn nhịp nhĩ và thất, trong khi các thuốc chống rối loạn nhịp nhóm I đã dần không được sử dụng nhiều như trước.
Sotalol
Sotalol là thuốc chống rối loạn nhịp nhóm III ngoài tác dụng ức chế các kênh kali ở giai đoạn III của điện thế hoạt động, còn có đặc tính ức chế không chọn lọc thụ thể β. Các dạng thuốc hiện có là một hỗn hợp của đồng phân lập thể D và L. Đồng phân quay phải (D) của sotalol là một thuốc thuần nhóm III, trong khi đồng phân quay trái (L) lại có đặc tính ức chế các thụ thể β. Do đó, sự kết hợp này dẫn đến làm chậm nhịp xoang, giảm dẫn truyền nút AV [kéo dài khoảng PR và khoảng Nhĩ-His (AH)] và kéo dài thời gian điện thế hoạt động và thời kỳ trơ có hiệu quả ở tâm nhĩ, nút AV, tâm thất (kéo dài khoảng QT) và đường dẫn truyền phụ. Sotalol là một thuốc ức chế cạnh tranh thụ thể β và đặc tính ức chế thụ thể xuất hiện ở cả liều rất thấp. Sotalol gây giảm nhẹ sức co bóp cơ tim.
Biệt dược:
Sotalex: viên 80mg, 160 mg.
Dược động học:
Sinh khả dụng đường uống sotalol là gần 100%. Nồng độ đỉnh đạt được khoảng 2,5-4h sau mỗi liều dùng. Thời gian bán hủy vào khoảng 12-16h và thuốc được bài xuất dưới dạng không thay đổi qua thận. Suy giảm chức năng thận gây ra hậu quả tăng nồng độ thuốc, tăng nguy cơ xoắn đỉnh.
Cơ chế tác dụng và tính chất dược lý
Tác dụng lên điện sinh lý tế bào tim
Do tác dụng ức chế các kênh kali chủ yếu ở giai đoạn III của điện thế hoạt động và ức chế thụ thể β nên tác dụng chủ yếu của sotalol là:
- Nút xoang và cơ nhĩ:
- Làm giảm tính tự động của nút xoang nên làm giảm tần số nhịp xoang.
- Kéo dài thời gian điện thế hoạt động và thời kỳ trơ có hiệu quả của cơ nhĩ.
- Nút nhĩ thất: Giảm tốc độ dẫn truyền và kéo dài thời kỳ trơ có hiệu quả của nút nhĩ thất.
- Hệ thống His-Purkinje và cơ thất:
- Giảm tính tự động của hệ thống His-purkinje.
- Kéo dài thời gian điện thế hoạt động và thời kỳ trơ có hiệu quả của His-Purkinje và cơ thất do ức chế kênh kali chậm một chiều.
Các tác dụng dược lý khác
- Giảm sức bóp cơ tim.
- Giảm huyết áp mức độ vừa phải.
Thay đổi trên điện tâm đồ
- Làm giảm tần số nhịp xoang và kéo dài khoảng PR và QTc phụ thuộc liều lượng.
- Thời gian phức bộ QRS không bị ảnh hưởng khi nồng độ thuốc trong huyết tương ở trong giới hạn điều trị.
Ảnh hưởng lên huyết động
Sotalol làm giảm vừa phải huyết áp tâm thu và cung lượng tim do tác dụng đối kháng thụ thể giao cảm beta. Ở những bệnh nhân có chức năng tim bình thường, cung lượng tim vẫn được duy trì mặc dù tần số tim giảm nhưng có sự tăng của thể tích nhát bóp.
Tác dụng không mong muốn
– Nhịp tim chậm.
– Kéo dài thời gian QT nên có nguy cơ gây xoắn đỉnh.
– Giảm sức bóp cơ tim.
– Gây co thắt phế quản do ức chế thụ thể β2.
– Mệt mỏi, mất ngủ, buồn nôn, nôn.
Chỉ định
– Nhờ sự phối hợp của cả những đặc tính chung của các thuốc nhóm III và đặc tính ức chế thụ thể β làm sotalol trở nên hiệu quả với nhiều loại rối loạn nhịp cả thất và trên thất.
– Sotalol thường được sử dụng nhất để duy trì nhịp xoang ở bệnh nhân rung nhĩ.
– Điều trị và dự phòng các rối loạn nhịp thất.
– Giảm các nhát sốc ở bệnh nhân đã cấy ICDs. Sotalol, không như amiodarone, có xu hướng làm giảm nhẹ ngưỡng phá rung.
Thử nghiệm sống còn bằng d-sotalol đường uống (SWORD) đã đánh giá tác dụng của d-sotalol, một thuốc thuần nhóm III và hiện nay không còn có trên thị trường, so sánh với giả dược về tỷ lệ tử vong ở bệnh nhân bị nhồi máu cơ tim trước đó, có phân suất tống máu thất trái ≤ 40%. Thử nghiệm đã bị dừng sớm do tỷ lệ tử vong tăng, chủ yếu là tử vong do rối loạn nhịp ở nhóm dùng d-sotalol. Trong một nghiên cứu đa trung tâm, mù đôi trên 1.456 bệnh nhân bị nhồi máu cơ tim mới đây được phân ngẫu nhiên thành nhóm dùng d,l-sotalol 320 mg mỗi 24h một lần so với giả dược, tỷ lệ tử vong sau 1 năm không khác biệt về mặt thống kê (8,9% trong nhóm sotalol so với 7,3% trong nhóm giả dược). Tuy nhiên, tỷ lệ tái nhồi máu cơ tim là 41%, thấp hơn ở nhóm dùng sotalol (P<0.05) và được cho là do đặc tính ức chế β của d,l sotalol.
Trong thử nghiệm so sánh thăm dò điện sinh lý học và theo dõi điện tâm đồ (ESVEM), một thử nghiệm ngẫu nhiên, đa trung tâm, được thiết kế chủ yếu để xác định phương pháp tốt nhất để hướng dẫn trị liệu bằng AADs cho bệnh nhân bị rối loạn nhịp thất ác tính, sotalol có hiệu quả ở 31% bệnh nhân, đó là tốt nhất trong số AADs khác nhau được thử nghiệm ESVEM, tuy nhiên, đã không đánh giá so sánh với amiodarone hoặc ICD. Sotalol đã được chứng minh là có hiệu quả trong nhóm bệnh nhân cấy ICD, khi so sánh với giả dược, nó làm giảm đáng kể số lượng các nhát sốc thích hợp hoặc không thích hợp của ICD và vẫn là một trong những thuốc thường được sử dụng để phòng ngừa cấp hai nhịp nhanh thất trong nhóm bệnh nhân cấy ICD.
Thử nghiệm đánh giá hiệu quả của sotalol, amiodarone trong rung nhĩ (SAFE-T), một thử nghiệm ngẫu nhiên, mù đôi, có đối chứng giả dược, so sánh sotalol với amiodarone trong phục hồi và duy trì nhịp xoang ở bệnh nhân rung nhĩ dai dẳng, ngẫu nhiên 665 bệnh nhân với sotalol (n = 261), amiodarone (n=261) và giả dược (n=137) đã được theo dõi trong 1-4,5 năm với theo dõi đánh giá hằng tuần. Sotalol và amiodarone có hiệu quả tương đương trong việc chuyển rung nhĩ về nhịp xoang (24% ở nhóm sotalol so với 27% ở nhóm amiodarone) và cả hai đều vượt trội so với giả dược. Thời gian trung bình xuất hiện tái phát rung nhĩ, kết quả cuối là 487 ngày trong nhóm amiodarone khi so sánh với 74 ngày trong nhóm sotalol và 6 ngày trong nhóm giả dược. Amiodarone rõ ràng là vượt trội so với sotalol và giả dược trong việc duy trì nhịp xoang, ngoại trừ nhóm bệnh tim thiếu máu cục bộ, sotalol có hiệu quả tương đương với amiodarone.
Sotalol có thể làm kéo dài thời gian QTc từ 10-40ms với liều từ 160mg – 240mg/24h. Trong thực tế, độc tính sotalol thường gặp khi dùng cùng thuốc lợi tiểu với liều lượng thay đổi và không bù đủ kali. Tỷ lệ xoắn đỉnh nói chung khoảng 2% và thường xảy ra hơn ở nữ giới, có bệnh tim cấu trúc và được tạo thuận do hạ kali máu, suy thận, sử dụng liều hơn 320 mg/24h, shock điện chuyển nhịp gần đây, nhịp tim chậm và sử dụng đồng thời các thuốc AADs hoặc thuốc kéo dài QT khác.
Chống chỉ định
– Nhịp chậm xoang, hội chứng suy nút xoang.
– Rối loạn dẫn truyền nhĩ thất: block độ II hoặc III.
– Suy tim hoặc rối loạn chức năng thất trái nặng.
– Sốc tim, hạ huyết áp nặng (HATT < 90 mmHg).
– Hen phế quản, bệnh phổi tắc nghẽn mạn tính.
– Hạ kali máu hoặc QT dài vì có thể làm tăng nguy cơ xuất hiện các biến cố gây hoặc làm nặng lên các rối loạn nhịp.
Tác dụng ức chế thụ thể giao cảm β đáng kể làm cho loại thuốc này trở nên không phù hợp ở các bệnh nhân suy tim với suy giảm chức năng thất trái nặng, với khoảng 3,3% xảy ra biến cố suy tim hoặc phù phổi.
Liều lượng và cách sử dụng:
Liều khởi đầu thông thường của sotalol thường là 80 mg hai lần mỗi 24h và tăng liều dần dần tới 240-320 mg mỗi 24h, nếu khoảng QTc vẫn nằm trong giới hạn chấp nhận được [<500 ms]. Tác dụng trên tái cực phụ thuộc vào nồng độ và có xu hướng xuất hiện khi liều dùng vượt quá 80mg hai lần mỗi 24h ở các bệnh nhân có chức năng thận bình thường.
Do có nguy cơ gây xoắn đỉnh, sotalol nên được khởi trị trong bệnh viện, và công thức chỉnh liều sau đây nên được áp dụng ở các bệnh nhân suy thận (bảng 5.6). Không cần chỉnh liều ở các bệnh nhân suy gan.
Bảng 5.6: Chỉnh liều sotalol theo mức lọc cầu thận
| Mức lọc cầu thận (mL/phút)(tính theo công thức Cockcroft-Gault) | Tần suất liều |
| >60 | Mỗi 1h |
| 30-60 | Mỗi 24h |
| 10-30 | Mỗi 36 – 48h |
| <10 | Cá thể hóa |
Thuốc chẹn beta có thể gây ra các tác dụng không mong muốn như như co thắt phế quản, che giấu hạ đường huyết, cũng như nhịp nhanh và tăng huyết áp bùng phát có thể xuất hiện khi ngừng sotalol.
Dofetilide
Dofetilide là một thuốc đường uống có tác dụng ức chế mạnh và chọn lọc IKr, kéo dài thời gian điện thế hoạt động và thời kỳ trơ, tác dụng tại tâm nhĩ nhiều hơn tâm thất. Sự ức chế IKr của dofetilide thể hiện sự phụ thuộc nghịch đảo tình trạng sử dụng. Dofetilide không gây giảm co bóp cơ tim và không có ảnh hưởng đến tốc độ dẫn truyền hoặc huyết động.
Dược động học
– Sinh khả dụng đường uống của dofetilide đạt trên 90%. Nồng độ đỉnh trong huyết tương đạt được trong 2-3h sau khi uống và lâu hơn một chút nếu thuốc được dùng cùng với thức ăn.
– Dofetilide được bài tiết chủ yếu (80%) qua nước tiểu ở dạng không đổi với thời gian bán hủy khoảng 8-10h và được chuyển hóa một phần bởi CYP3A4 ở gan thành các chất chuyển hóa không hoạt tính.
– Tích lũy thuốc có thể xảy ra ở bệnh nhân suy thận, nên cần điều chỉnh liều và/hoặc ngừng thuốc. Tương tự, thuốc ức chế CYP3A4 ở gan, nên có thể làm tăng nồng độ dofetilide và có khả năng gây ra các tác dụng không mong muốn.
Cơ chế tác dụng và tính chất dược lý
Tác dụng lên điện sinh lý tế bào tim
– Ức chế kênh kali nhanh một chiều (IKr).
– Ở nồng độ điều trị, dofetilide ảnh hưởng không đáng kể đến các kênh kali tái cực khác.
– Tác dụng của thuốc tăng lên đáng kể khi kali máu giảm và giảm đi khi kali máu tăng.
– Thể hiện tác dụng phụ thuộc nghịch tình trạng sử dụng, như ít bị ảnh đến ĐTHĐ ở tần số tim nhanh hơn. Tác dụng lên điện sinh lý tế bào của các tổ chức tim:
Nút xoang và cơ nhĩ:
– Làm giảm nhẹ tính tự động của nút xoang do làm giảm độ dốc pha 4 của điện thế hoạt động dẫn đến giảm nhẹ tần số nhịp xoang.
– Kéo dài pha cao nguyên của ĐTHĐ nên kéo dài thời kỳ trơ có hiệu quả của cơ nhĩ. Các tác dụng trên cơ nhĩ rõ rệt hơn trên cơ thất.
Nút nhĩ thất: Dofetilide không có ảnh hưởng đến dẫn truyền qua nút nhĩ-thất.
Hệ thống His-Purkinje và cơ thất:
Dofetilide kéo dài thời gian điện thế hoạt động và giai đoạn trơ có hiệu quả của His-Purkinje và cơ thất. Tác dụng kéo dài giai đoạn trơ trên cơ thất hơi ít hơn trên cơ nhĩ.
Những thay đổi trên điện tâm đồ
– Không có thay đổi thời gian khoảng PR và thời gian phức bộ QRS
– Kéo dài khoảng QTc và mức độ kéo dài phụ thuộc vào liều lượng và nồng độ huyết tương.
Thay đổi huyết động: Dofetilide không làm thay đổi đáng kể huyết áp trung bình động mạch, cung lượng tim, thể tích nhát bóp hoặc sức cản hệ thống. Có sự tăng nhẹ chỉ số dP/dt ở tâm thất.
Tác dụng không mong muốn
– Tác dụng không mong muốn chủ yếu của dofetilide là nguy cơ gây xoắn đỉnh do kéo dài khoảng QTc và tỷ lệ gây xoắn đỉnh phụ thuộc vào liều lượng và cũng bị ảnh hưởng bởi tình trạng: bệnh tim cấu trúc, suy thận và sử dụng đồng thời các thuốc kéo dài QT. Tỷ lệ mắc xoắn đỉnh trong khi dùng liều duy trì 500µg hai lần/24h là vào khoảng 1,7-3%.
– Do hầu hết các biến cố gây hoặc làm nặng lên các rối loạn nhịp xảy ra trong 3 ngày đầu, nên các bệnh nhân phải được khởi trị trong bệnh viện.
Chỉ định
– Dofetilide chủ yếu được chỉ định để phục hồi và duy trì nhịp xoang trong rung nhĩ, đặc biệt ở những bệnh nhân mắc bệnh tim cấu trúc.
– Do không ảnh hưởng đáng kể đến huyết động nên thuốc có thể chỉ định cho bệnh nhân bị rối loạn nhịp nhanh trên thất có suy tim.
– Chỉ định sử dụng cho một số bệnh nhân sau phẫu thuật Fontan bị nhịp nhanh vào lại trong tâm nhĩ [(Intraatrial reentrant tachycardia (IART)].
Dofetilide, giống như amiodarone có tác dụng trung tính đối với tỷ lệ tử vong khi được sử dụng ở những bệnh nhân mắc bệnh tim cấu trúc và rối loạn chức năng thất trái. Các nghiên cứu của Đan Mạch về rối loạn nhịp tim và tử vong ở bệnh nhân dùng dofetilide (DIAMOND), đã đánh giá so sánh dofetilide với giả dược về tỷ lệ tử vong do mọi nguyên nhân ở 1.518 bệnh nhân bị suy tim ứ trệ có triệu chứng và rối loạn chức năng thất trái nặng, kết quả quả cho thấy không có sự khác biệt về tỷ lệ tử vong do mọi nguyên nhân giữa hai nhóm. Có sự giảm đáng kể nguy cơ nhập viện do suy tim ở nhóm dofetilide. Ở những bệnh nhân bị rung nhĩ, dofetilide có hiệu quả rõ rệt hơn trong việc duy trì nhịp xoang so với giả dược [(HR) 0,35; Khoảng tin cậy 95% (CI) 0,22 – 0,57; p <0,001]. Tỷ lệ xoắn đỉnh ở nhóm dùng dofetilide (3,3%; n = 25) cao hơn so với nhóm giả dược.
Chống chỉ định
– QT dài (QT > 440ms hoặc 500ms ở bệnh nhân có bất thường dẫn truyền nhĩ thất).
– Suy thận nặng (mức lọc cầu thận < 20mL/phút).
– Phụ nữ có thai hoặc cho con bú.
Liều lượng và cách sử dụng
– Do nguy cơ xoắn đỉnh, việc sử dụng dofetilide được kiểm soát chặt chẽ và các bác sĩ cần được đào tạo đặc biệt trước khi kê đơn dofetilide.
– Liều lượng khuyến cáo của dofetilide là 500µg hai lần/24h nhưng liều lượng thực tế được quyết định bởi chức năng thận nền. Thuốc phải được khởi trị trong bệnh viện và theo dõi điện tâm đồ liên tục trong 3 ngày hoặc 12h sau khi rung nhĩ chuyển về nhịp xoang.
– Cần tính toán mức lọc cầu thận trước khi khởi trị. Chỉ sử dụng liều khởi trị 500 µg, hai lần mỗi 24h khi mức lọc cầu thận của bệnh nhân đạt trên 60 mL/phút.
Bảng 5.7: Chỉnh liều dofetilide theo mức lọc cầu thận
| Mức lọc cầu thận (mL/phút)(công thức Cockroft-Gault) | Tần suất liều |
| >60 | 500 µg hai lần mỗi 24h |
| 40-60 | 250 µg hai lần mỗi 24h |
| 20-39 | 125 µg hai lần mỗi 24h |
| <20 | Chống chỉ định |
| Lọc máu | Chống chỉ định |
Chỉnh liều theo mức lọc cầu thận được trình bày trong bảng 5.7. Sau khi bắt đầu dùng thuốc, nếu QTc ở thời điểm 2-3h sau liều đầu tiên lớn hơn 15% so với QTc cơ sở hoặc hơn 500 ms (>550 ms đối với bệnh nhân có block nhánh phải hoặc chậm trễ dẫn truyền trong thất), thì liều lượng tiếp theo cần giảm đi một nửa. Nếu QTc lớn hơn 500 ms (>550 ms đối với bệnh nhân có block nhánh phải hoặc chậm dẫn truyền trong thất) bất cứ lúc nào sau khi dùng 2-6h, cần ngừng sử dụng dofetilide và tìm kiếm một thuốc khác thay thế.
Tương tác thuốc
– Verapamil, trimethoprim, thiazide, thuốc chống nấm azole và cimetidine làm tăng nồng độ dofetilide và làm tăng nguy cơ xoắn đỉnh, nên được ngừng sử dụng trước khi bắt đầu điều trị bằng dofetilide.
– Các thuốc làm tăng CYP3A4, như phenobarbital và rifampicin, có thể tăng cường chuyển hóa dofetilide và làm giảm hiệu quả của nó. Dofetilide không tương tác với digoxin hoặc warfarin.
Ibutilide
Ibutilide là một dẫn chất methanesulfonamide có cấu trúc tương tự sotalol và có tác dụng điện sinh lý như các thuốc chống rối loạn nhịp nhóm III khác, là một chất ức chế mạnh kênh kali nhanh một chiều (IKr), dẫn đến kéo dài thời gian điện thế hoạt động và thời kỳ trơ có hiệu quả. Do thuốc được chuyển hóa đáng kể khi qua gan kỳ đầu nên hiện nay chỉ có dạng sử dụng đường tĩnh mạch.
Biệt dược: Corvert: ống 0,87 mg/10mL.
Dược động học
– Dược động học của thuốc thay đổi rất nhiều giữa các bệnh nhân. Do được chuyển hóa đáng kể ở kỳ đầu qua gan nên Ibutilide không có dạng uống.
– Thuốc được chuyển hóa chủ yếu ở gan và thải trừ qua nước tiểu.
– Khoảng 40% gắn vào protein huyết tương và có thời gian bán hủy khoảng 6h (trong khoảng 2-12h).
Cơ chế tác dụng và tính chất dược lý
Tác dụng lên điện sinh lý tế bào tim
– Ibutilide là một chất ức chế mạnh dòng K+ đi ra một chiều mà chủ yếu là dòng K+ nhanh một chiều (IKr) ở giai đoạn 3 của ĐTHĐ, dẫn đến kéo dài thời gian điện thế hoạt động và thời kỳ trơ có hiệu quả.
– Kích hoạt dòng ion chậm đi vào trong tế bào mà chủ yếu là dòng Na+ chậm. Các tác dụng kéo dài thời gian đi vào của dòng Na+ ở giai đoạn khử cực và ức chế dòng kali nhanh đi ra một chiều ở giai đoạn 3 ĐTHĐ, dẫn đến làm kéo dài thời gian điện thế hoạt động và thời kỳ trơ có hiệu quả của cả cơ nhĩ và cơ thất.
Đối với nút xoang và cơ nhĩ
– Không làm thay đổi đáng kể tần số nhịp xoang.
– Làm kéo dài thời gian giai đoạn trơ có hiệu quả của cơ nhĩ và rất ít tác dụng phụ thuộc ngược tình trạng sử dụng hoặc mất tác dụng ở tần số tạo nhịp nhanh. Đây là điều khác biệt với các thuốc nhóm III khác.
Nút nhĩ thất: làm kéo dài thời kỳ trơ và làm chậm dẫn truyền qua nút nhĩ thất, tuy nhiên không có thay đổi khoảng PR trên điện tâm đồ.
Hệ thống His-Purkinje và cơ thất: ibutilide làm kéo dài thời gian điện thế hoạt động và tăng thời gian thời kỳ trơ có hiệu quả của hệ thống His-Purkinje, cơ thất và đường dẫn truyền bất thường.
Làm giảm ngưỡng năng lượng cần thiết để phá rung trong rung thất.
Những thay đổi trên điện tâm đồ
– Làm thay đổi không đáng kể tần số tim.
– Không làm thay đổi thời gian khoảng PR và phức bộ QRS.
– Kéo dài thời gian khoảng QTc. Mức độ kéo dài QT phụ thuộc vào liều lượng thuốc, tốc độ truyền và nồng độ thuốc trong huyết tương.
Ảnh hưởng huyết động
Ibutilide có ảnh hưởng không đáng kể đến cung lượng tim, áp lực động mạch phổi trung bình, áp lực mao mạch phổi bít ở những bệnh nhân có hoặc không có rối loạn chức năng thất trái.
Tác dụng không mong muốn
Tác dụng không mong muốn chính của ibutilide là kéo dài QTc và xoắn đỉnh, gặp ở 8,3% bệnh nhân trong nghiên cứu Liều lặp lại Ibutilide. Vì vậy, bệnh nhân được sử dụng ibutilide cần phải được theo dõi điện tâm đồ liên tục trong ít nhất 4-6h sau khi khởi trị, cùng với sự sẵn sàng của nhóm nhân viên y tế lành nghề và thiết bị hồi sức. Do nguy cơ xoắn đỉnh cao hơn, nên tránh dùng ibutilide cho những bệnh nhân có QTc cơ sở kéo dài (> 440ms), bệnh tim cấu trúc tiến triển và hạ kali máu hoặc hạ magie máu.
Chỉ định
– Chuyển nhịp rung nhĩ và cuồng nhĩ mới khởi phát về nhịp xoang.
– Ibutilide cũng rất hiệu quả trong cải thiện khả năng thành công của chuyển nhịp bằng sốc điện, nếu ở lần chuyển nhịp trước đó không thành công hoặc rung nhĩ tái phát lại ngay.
– Ibutilide cũng rất hiệu quả với rung nhĩ trong hội chứng WPW có dẫn truyền nhanh qua đường phụ bằng cách chuyển rung nhĩ về nhịp xoang và tăng thời gian trơ của đường phụ.
Nghiên cứu liều lặp lại ibutilide (The Ibutilide Repeat Dose Study), một thử nghiệm đa trung tâm đã chia ngẫu nhiên 266 bệnh nhân bị rung nhĩ hoặc cuồng nhĩ mới khởi phát (3-45 ngày) vào nhóm được điều trị bằng ibutilide hoặc giả dược, đã cho thấy kết quả tỷ lệ chuyển nhịp là 47% với ibutilide so với 2% với giả dược (p <0,0001), và thuốc có hiệu quả hơn trong cuồng nhĩ so với rung nhĩ (63% so với 31%; p <0,0001). Sau khi truyền tĩnh mạch, thời gian chuyển nhịp trung bình là khoảng 27 phút. Tuy nhiên, điều đáng lo ngại là tỷ lệ xảy ra xoắn đỉnh cao (8.3%) ở nhóm dùng ibutilide.
Sử dụng Ibutilide để chuyển nhịp điều trị rung nhĩ và cuồng nhĩ ngày càng ít đi, do hiệu quả khiêm tốn, nguy cơ bị xoắn đỉnh và cần theo dõi chặt chẽ sau khi dùng thuốc. Sử dụng đồng thời magie tiêm tĩnh mạch dường như cải thiện hiệu quả và độ an toàn của ibutilide. Một phương pháp tốt hơn để cải thiện tính an toàn và hiệu quả của ibutilide đã được đề cập trong một thử nghiệm ngẫu nhiên gần đây cho bệnh nhân mắc rung nhĩ mới khởi phát, dùng ibutilide đơn độc hoặc dùng phối hợp ibutilide và esmolol. Nghiên cứu đã chứng minh rằng sử dụng đường tĩnh mạch chất ức chế thụ thể giao cảm β phối hợp đã cải thiện đáng kể tỷ lệ chuyển nhịp thành công (67% cho liệu pháp phối hợp so với 46% khi dùng ibutilide đơn độc) cùng với sự cải thiện rõ rệt trong lĩnh vực an toàn (không có trường hợp nhịp nhanh thất đa hình thái trong nhóm kết hợp so với 6,5% trong nhóm ibutilide đơn độc). Sự kết hợp ibutilide và esmolol, cùng với các thuốc mới hơn như vernakalant, có thể mở rộng vai trò của chuyển nhịp bằng thuốc ở những bệnh nhân rung nhĩ nhanh.
Chống chỉ định
– QT cơ sở kéo dài > 440 ms (hoặc > 500 ms ở bệnh nhân có bất thường dẫn truyền).
– Đang sử dụng các thuốc khác có tác dụng kéo dài QT.
– Tiền sử có xoắn đỉnh.
– Tăng nhạy cảm với ibutilide.
– Hạ kali và magie máu.
– Phụ nữ có thai và cho con bú.
Liều lượng và cách sử dụng
– Ở những bệnh nhân ≥ 60 kg: liều lượng ibutilide đường tĩnh mạch được khuyến cáo là 1 mg tiêm tĩnh mạch trong vòng 10 phút. Sau 10 phút nếu rung nhĩ hoặc cuồng nhĩ vẫn còn tồn tại, một liều nhắc lại 1 mg tiêm tĩnh mạch trong 10 phút.
– Ở những bệnh nhân < 60 kg, liều lượng thuốc giảm đi 0,01 mg/kg.
– Dừng tiêm truyền ngay khi nhịp xoang được phục hồi hoặc QTc bị kéo dài rõ rệt hoặc xuất hiện xoắn đỉnh.
– Không cần chỉnh liều ở bệnh nhân suy gan, thận.
Amiodarone
Amiodarone có cấu trúc tương tự như thyroxine và là một dẫn xuất có iode của benzofuran iode. Ban đầu thuốc được xác định và trở nên phổ biến như là một thuốc chống đau thắt ngực ở châu Âu trong những năm 1960. Thuốc được xếp vào nhóm III theo hệ thống phân loại của Vaughan Williams do tác dụng chủ yếu là ức chế các kênh kali ở giai đoạn 3 của điện thế hoạt động nên làm kéo dài thời gian điện thế hoạt động cũng như thời kỳ trơ có hiệu quả.
Biệt dược
- Cordarone: ống 150mg, viên 200mg.
Dược động học
– Amiodarone rất ưa lipid nên thuốc dễ thấm vào và tích lũy trong các mô mỡ, gan, phổi, da…và được giải phóng trở lại huyết tương dần dần nên thuốc có tác dụng kéo dài.
– Thuốc gần như liên kết toàn bộ với protein huyết tương và tập trung ở cơ tim (gấp 10-50 lần nồng độ trong huyết tương) cũng như ở tổ chức mỡ, gan, phổi (gấp 100 lần nồng độ huyết tương).
– Sinh khả dụng đường uống rất thay đổi và vào khoảng từ 35% đến 65% và nồng độ đỉnh trong huyết tương đạt được 3-7h sau khi uống. Một liều trên 10g, thường là cần thiết để bão hòa toàn bộ tổ chức béo nên cần phải mất nhiều tuần trước khi đạt được trạng thái ổn định.
– Thuốc được đào thải qua gan vào đường mật. Amiodarone được chuyển hóa ở gan thành chất chuyển hóa chính của nó là desethylamiodarone. Thời gian bán hủy trong huyết tương sau khi sử dụng đường tĩnh mạch từ 4,8h đến 68,2h. Nồng độ trị liệu trong huyết tương dao động từ 1 µg/mL đến 2,5 µg/mL, có thể đo được nhưng không có sự tương ứng với hiệu quả lâm sàng. Đào thải chậm và cực kỳ thay đổi với thời gian bán hủy từ 13 ngày đến 103 ngày (trung bình là 60 ngày). Thuốc cũng được bài tiết không đáng kể qua thận và do đó không cần điều chỉnh liều ở bệnh nhân suy thận. Amiodarone và desethylamiodarone không thể được loại bỏ bằng thẩm phân phúc mạc hoặc lọc máu.
Cơ chế tác dụng và tính chất dược lý
Tác dụng lên điện sinh lý tế bào tim
– Mặc dù được phân loại là AADs nhóm III nhưng amiodarone là một loại thuốc có tác dụng điện sinh lý rất phức tạp. Thực ra nó là một nhóm riêng biệt do các đặc tính điện sinh lý bao gồm cả 4 nhóm theo phân loại của Vaughan Williams. Ngoài các đặc tính ức chế đa kênh, amiodarone còn tương tác và có thể ức chế các thụ thể trên bề mặt tế bào và các phân tử khác.
– Một đặc điểm khá thú vị là tác dụng cấp tính của thuốc (sử dụng đường tĩnh mạch) khác biệt đáng kể so với tác dụng lâu dài (sử dụng đường uống). Khi sử dụng lâu dài, tác dụng điện sinh lý đáng chú ý nhất của amiodarone là kéo dài tái cực và thời kỳ trơ có hiệu quả của tất cả các tổ chức của tim, một tác dụng đặc trưng của các thuốc chống rối loạn nhịp nhóm III.
– Cho đến nay, cơ chế chính xác tác dụng chống loạn nhịp của amiodarone vẫn còn chưa rõ ràng. Các thí nghiệm trên động vật đã cho thấy amiodarone kéo dài thời gian điện thế hoạt động và thời kỳ trơ ở tâm nhĩ, tâm thất, nút nhĩ thất và hệ thống His-Purkinje. Amiodarone có xu hướng tác dụng mạnh trong việc kéo dài điện thế hoạt động và tái cực đồng đều, và có lẽ vì lý do này, nguy cơ xoắn đỉnh là thấp. Nó cũng phong tỏa các kênh natri ở trạng thái bất hoạt, làm chậm quá trình khử cực giai đoạn 4 ở nút xoang và làm chậm sự dẫn truyền nút nhĩ thất. Amiodarone còn ức chế các thụ thể α và β theo cơ chế không cạnh tranh, ức chế các kênh canxi loại L và ngăn cản chuyển đổi thyroxine thành triiodothyronine. Khi dùng đường tĩnh mạch, thuốc có thể gây giãn mạch vành và mạch ngoại biên.
– Amiodarone có dạng uống và dạng sử dụng đường tĩnh mạch và mỗi dạng có các đặc tính điện sinh lý khác nhau. Khi sử dụng đường tĩnh mạch, amiodarone thể hiện đặc tính ức chế kênh natri và canxi, biểu hiện sự phụ thuộc vào tình trạng sử dụng và có tác dụng lớn hơn tại các mô đã được khử cực, nên thuốc rất hiệu quả trong điều trị các rối loạn nhịp thất do thiếu máu cục bộ. Khi điều trị duy trì bằng amiodarone đường uống, thuốc chủ yếu kéo dài thời gian điện thế hoạt động và thời kỳ trơ nhưng không thể hiện sự phụ thuộc nghịch đảo tình trạng sử dụng.
Tác dụng điện sinh lý của amiodarone lên các tổ chức tim:
Nút xoang và cơ nhĩ: làm chậm tần số nhịp xoang. Kéo dài thời gian điện thế hoạt động và thời kỳ trơ có hiệu quả của cơ nhĩ.
Nút nhĩ thất: làm chậm dẫn truyền và kéo dài thời kỳ trơ có hiệu quả của nút nhĩ thất.
Hệ thống His-Purkinje và cơ thất: kéo dài thời gian điện thế hoạt động và thời kỳ trơ có hiệu quả của hệ thống His-Purkinje và cơ thất. Giảm tính tự động và tốc độ dẫn truyền của các tổ chức này.
Những thay đổi điện tâm đồ
Những thay đổi chủ yếu trên ĐTĐ gồm: kéo dài khoảng PR và khoảng QTc, làm xuất hiện sóng U và thay đổi hình dạng sóng T.
Ảnh hưởng huyết động
– Làm giãn cơ trơn mạch máu và cải thiện dòng máu trong mạch vành tới cơ tim.
– Tác dụng lên các mạch máu ngoại biên dẫn tới làm giảm tiêu thụ oxy và công co bóp của thất trái.
– Khi sử dụng đường tĩnh mạch, thuốc có thể gây hạ huyết áp do tác dụng giãn mạch.
Tác dụng không mong muốn
– Tác dụng không mong muốn khá thường gặp và có thể dao động từ 15% trong năm đầu tiên đến 50% khi sử dụng lâu dài. Amiodarone kéo dài khoảng PR, QRS và QT, nhưng tỷ lệ bị xoắn đỉnh là rất hiếm, có lẽ, do các đặc tính ức chế đa kênh và ức chế thụ thể β. Không thấy tác dụng giảm sức co bóp cơ tim đáng kể nào ở liều duy trì. Nhịp chậm xoang và block nhĩ thất cũng có thể xảy ra.
– Hạ huyết áp hay gặp khi sử dụng đường tĩnh mạch do tác dụng giãn mạch và cần được theo dõi chặt chẽ.
– Amiodarone có khá nhiều tác dụng không mong muốn ngoài tim, trong đó nghiêm trọng nhất là viêm phổi kẽ dẫn đến xơ phổi. Tỷ lệ xơ hóa phổi dao động từ 1% đến 7% và rất khó dự đoán và khó phát hiện. Đánh giá khả năng khuếch tán carbon monoxide (DLCO) là xét nghiệm sàng lọc tốt nhất.
– Tác dụng không mong muốn tại tuyến giáp cũng rất thường gặp, cả cường giáp và suy giáp đều có thể xảy ra.
– Nhiễm độc gan có thể xảy ra nhưng ít khi tiến triển thành xơ gan.
– Các tác dụng không mong muốn ngoài tim đáng kể khác bao gồm tăng mẫn cảm với ánh nắng mặt trời, đổi màu da hơi xanh, ảnh hưởng thần kinh trung ương và ngoại biên (yếu, khó đi lại đặc biệt ở người cao tuổi) và hiếm gặp hơn, viêm thần kinh thị giác dẫn đến mất thị lực. Hầu hết tất cả các bệnh nhân đang điều trị amiodarone lâu dài đều xuất hiện các vi hạt lắng đọng lớp sừng, nhưng chúng ít quan trọng về lâm sàng.
Phần lớn các phản ứng bất lợi thứ phát của amiodarone có thể được xử lý dễ dàng và không cần phải ngừng thuốc. Vì hầu hết các tác dụng không mong muốn của amiodarone, phụ thuộc vào liều lượng và thời gian điều trị, vì vậy nên sử dụng liều thấp nhất có hiệu quả để điều trị duy trì lâu dài. Mặc dù vậy, sàng lọc thường xuyên các tác dụng không mong muốn là rất cần thiết. Khi bắt đầu điều trị, tất cả bệnh nhân nên được ghi điện tâm đồ 12 chuyển đạo, chụp X quang phổi, đánh giá chức năng hô hấp, xét nghiệm điện giải đồ và chức năng gan, thận và tuyến giáp. Khám mắt định kỳ hoặc khi có giảm thị lực. Kiểm tra chức năng gan và chức năng tuyến giáp mỗi 6 tháng. Điện tâm đồ và Xquang ngực thẳng nên được làm hằng năm. Các thăm dò đánh giá chức năng hô hấp nên được thực hiện đối với những bệnh nhân mới xuất hiện triệu chứng khó thở hoặc không giải thích được hoặc nếu có bất thường trên Xquang ngực mà trước đó không có.
Chỉ định
Amiodarone hiện được chỉ định rộng rãi để điều trị rối loạn nhịp nhĩ và thất mặc dù thực tế là loại thuốc này hiện chỉ được FDA phê chuẩn cho các rối loạn nhịp thất trơ và nguy hiểm đến tính mạng. Hiện nay thuốc được chỉ định chủ yếu trong:
- Rung thất.
- Nhịp nhanh thất: Nhịp nhanh thất mất mạch, nhịp nhanh thất có dung nạp huyết động tốt hơn, nhịp nhanh thất đơn dạng hoặc nhiều dạng (không phải xoắn đỉnh), nhịp nhanh thất không bền bỉ có triệu chứng.
- Giảm các nhát sốc của máy ICD do các rối loạn nhịp thất.
- Nhịp nhanh trên thất, nhịp nhanh nhĩ do vòng vào lại, nhịp nhanh bộ nối ổ ngoại vị.
- Rung nhĩ, cuồng nhĩ ở bệnh nhân không có hội chứng Wolff-Parkinson-White.
- Duy trì nhịp xoang và dự phòng các rối loạn nhịp nhĩ sau phục hồi nhịp xoang nhất là sau phẫu thuật.
Những dữ liệu lâm sàng ủng hộ việc sử dụng amiodarone cho cả rối loạn nhịp nhĩ và tâm thất cũng như phòng ngừa tiên phát và thứ phát tử vong do tim đột ngột được thảo luận dưới đây.
Sự ảnh hưởng của amiodarone đến tiên lượng sau nhồi máu cơ tim được đánh giá trong các thử nghiệm: Amiodarone trong nhồi máu cơ tim ở châu Âu (EMIAT) và thử nghiệm Amiodarone trong rối loạn nhịp tim trong nhồi máu cơ tim ở Canada (CAMIAT). EMIAT đã chọn ngẫu nhiên 1.486 bệnh nhân sau nhồi máu cơ tim với phân suất tống máu thất trái dưới 40% để nhận amiodarone (n=743) hoặc giả dược phù hợp (n=743). Sự hiện diện của rối loạn nhịp thất không nhất thiết phải có trong tiêu chuẩn lựa chọn. Sau thời gian theo dõi trung bình là 21 tháng, kết quả thấy có sự giảm 35% nguy cơ (p < 0,05) tử vong do rối loạn nhịp tim ở nhóm dùng amiodarone nhưng không thấy sự khác biệt tỷ lệ tử vong do mọi nguyên nhân hoặc tử vong do tim mạch giữa hai nhóm.
Trong thử nghiệm CAMIAT, 1.202 bệnh nhân sau nhồi máu cơ tim từ 6-45 ngày và có trung bình ít nhất 10 ngoại tâm thu (PVC)/giờ được chỉ định ngẫu nhiên cho amiodarone (n=606) hoặc giả dược (n=596) và theo dõi trung bình 1,8 năm. Khi so sánh với giả dược, bệnh nhân trong nhóm amiodarone đã giảm 48,5% (p=0,016) các biến cố phải hồi sinh tim phổi do rung thất hoặc tử vong do rối loạn nhịp tim (3,3% ở nhóm amiodarone so với 6,6% ở nhóm giả dược). Giống như EMIAT, không có sự khác biệt đáng kể về tỷ lệ tử vong do mọi nguyên nhân (p=0,13) giữa hai nhóm.
EMIAT và CAMIAT đã chứng minh rằng điều trị bằng amiodarone sau nhồi máu cơ tim có thể làm giảm tử vong do rối loạn nhịp tim và không ảnh hưởng đến tỷ lệ tử vong toàn bộ. Một phân tích tổng hợp sau EMIAT và CAMIAT đã chứng minh rằng sự phối hợp giữa amiodarone với một thuốc ức chế thụ thể beta đã cải thiện đáng kể tình trạng rối loạn nhịp tim hoặc ngừng tim cần hồi sức khi so sánh với các thuốc ức chế β đơn thuần, amiodarone đơn độc hoặc giả dược. Không có sự khác biệt về tỷ lệ tử vong toàn bộ giữa nhóm kết hợp và không kết hợp với thuốc chẹn beta.
Các thử nghiệm EPAMSA, GESICA và thử nghiệm điều trị rối loạn nhịp ở bệnh nhân suy tim ứ trệ (CHF-STAT) là các thử nghiệm ngẫu nhiên đánh giá vai trò của amiodarone trên các bệnh nhân suy tim ứ trệ. EPAMSA chọn ngẫu nhiên các bệnh nhân có phân suất tống máu thất trái ≤35% và rối loạn nhịp thất không triệu chứng để nhận amiodarone (n=66) hoặc giả dược (n=61) và nhận thấy có sự giảm đáng kể tỷ lệ tử vong toàn bộ (10,6 so với 28,8%, p=0,02) và đột tử (7 so với 20,4%, p=0,04) ở nhóm bệnh nhân dùng amiodarone so với giả dược.
GESICA là một thử nghiệm ngẫu nhiên đa trung tâm trên 516 bệnh nhân ở Argentina bị suy tim ứ trệ và rối loạn chức năng tâm thất trái EF ≤ 35% nhưng không có tiền sử rối loạn nhịp thất có triệu chứng. Chỉ có 39% số bệnh nhân mắc bệnh tim thiếu máu cục bộ. So với giả dược, amiodarone giúp giảm 28% nguy cơ tử vong và giảm 31% nguy cơ nhập viện do suy tim.
Trong nghiên cứu CHF-STAT, 647 bệnh nhân bị suy tim ứ trệ, phân suất tống máu thất trái ≤40% và có ít nhất 10 NTT/T /giờ, được chọn ngẫu nhiên thành nhóm dùng amiodarone (n=336) hoặc giả dược (n=338). Trong thời gian theo dõi trung bình 45 tháng, amiodarone có hiệu quả ức chế NTT/T và cải thiện chức năng tâm thất trái nhưng không có sự khác biệt đáng kể về tổng tỷ lệ tử vong hoặc đột tử giữa hai nhóm. Tỷ lệ ngừng sử dụng amiodarone trong các nghiên cứu này dao động từ 20 % đến 40%. Tỷ lệ mắc bệnh cơ tim thiếu máu cục bộ cao hơn ở CHF-STAT có thể là một lý do cho sự khác biệt về kết quả của CHF-STAT so với EPAMA và GESICA.
Một phân tích gộp 15 thử nghiệm ngẫu nhiên có đối chứng (n = 8,522) so sánh amiodarone với giả dược trong phòng ngừa đột tử do tim đã chứng minh rằng amiodarone có hiệu quả giảm 29% nguy cơ đột tử tim mạch (7,1 so với 9,7%; OR 0,72; p <0,001) và giảm 18% nguy cơ tử vong do tim mạch (14,0 so với 16,3%; OR 0,82, p=0,004). Không có sự khác biệt đáng kể về tỷ lệ tử vong do mọi nguyên nhân. Sự cải thiện khiêm tốn về tử vong do tim mạch và rối loạn nhịp tim phải trả giá khi bệnh nhân dùng amiodarone có tỷ lệ mắc các vấn đề về tuyến giáp cao hơn đáng kể (OR 5.68; p <0,0001), nhiễm độc gan (OR 2.1; p = 0,015), nhiễm độc phổi (OR 1,97; p=0,002) và rối loạn nhịp chậm (OR 1,78; p=0,008) khi so sánh với nhóm đối chứng.
Tóm lại, Amiodarone có lợi trong điều trị rối loạn nhịp thất ở bệnh nhân mắc bệnh tim cấu trúc và là một lựa chọn hợp lý để phòng ngừa thứ phát đột tử tim mạch ở những bệnh nhân từ chối hoặc không phải là ứng cử viên cho cấy ICD. Tuy nhiên, hiện nay chỉ định phổ biến nhất của amiodarone ở những bệnh nhân mắc bệnh tim cấu trúc là để ngăn chặn các cơn tái phát của nhịp nhanh thất và rung thất dẫn đến các nhát sốc của máy ICD. Amiodarone có thể làm tăng ngưỡng khử rung ở bệnh nhân cấy ICD, nhưng tác dụng này có thể chỉ ở mức vừa phải. Amiodarone cũng có thể làm chậm tần số của nhịp nhanh thất xuống dưới giới hạn phát hiện được của ICD.
Amiodarone vẫn là AADs có hiệu quả nhất để duy trì nhịp xoang ở bệnh nhân rung nhĩ. Điều này đã được chứng minh rõ trong thử nghiệm rung nhĩ của Canada (CTAF), một thử nghiệm đa trung tâm, tiến cứu, chọn ngẫu nhiên 403 bệnh nhân có ít nhất một cơn rung nhĩ trong 6 tháng qua để nhận amiodarone hoặc sotalol hoặc propafenone. Bệnh nhân được theo dõi trung bình 16 tháng với tiêu chí chính là lần tái phát đầu tiên của rung nhĩ. Tiêu chí chính gặp ở 35% bệnh nhân trong nhóm amiodarone so với 63% ở nhóm sotalol hoặc propafenone (p <0,001). Tỷ lệ tác dụng không mong muốn ở nhóm amiodarone cao hơn (18 so với 11% ở nhóm sotalol/propafenone) nhưng không có ý nghĩa thống kê.
Amiodarone có hiệu quả tương đương với sotalol trong việc phục hồi nhịp xoang nhưng vượt trội hơn hẳn so với sotalol trong việc duy trì nhịp xoang, với các tác dụng không mong muốn chính tương đương với giả dược. Một phân tích tổng hợp các dữ liệu của 45 nghiên cứu ngẫu nhiên có đối chứng (n=12.559) của Cochrane đã đánh giá các AADs khác nhau được sử dụng để kiểm soát nhịp trong rung nhĩ đã chứng minh rằng các loại thuốc nhóm IA, IC và các thuốc nhóm III đều làm giảm đáng kể sự tái phát của rung nhĩ (tỷ lệ chênh lệch 0,19-0,60; số cần điều trị: 2-9) so với giả dược nhưng không làm cải thiện tỷ lệ tử vong. Thuốc nhóm IA thực ra làm tăng tỷ lệ tử vong và tất cả các loại thuốc, ngoại trừ propafenone và amiodarone, làm tăng nguy cơ làm nặng lên các rối loạn nhịp tim.
Liều lượng và cách sử dụng
– Do được phân bố và tích lũy ở hầu hết các tổ chức trong cơ thể, nên sử dụng liều nạp là rất cần thiết để đảm bảo hiệu quả khởi trị trong khung thời gian hợp lý. Liều nạp đều có thể sử dụng khi sử dụng đường tĩnh mạch hoặc đường uống.
– Nhà sản xuất khuyến cáo liều lượng tiêm truyền tĩnh mạch theo ba giai đoạn trong 24h: 150 mg trong 10 phút (với liều bolus bổ sung 150 mg cho bệnh nhân nhịp nhanh thất tái phát), sau đó là 1 mg/phút trong 6h tiếp theo, tiếp theo là 0,5 mg/phút trong 18h tiếp theo.
– Một liều lượng khác thường được sử dụng là truyền tĩnh mạch với liều lượng 5 mg/kg, truyền nhanh trong 30-60 phút.
– Ngay cả khi sử dụng liều đổ đầy đường tĩnh mạch, các tác dụng điện sinh lý của thuốc nhóm III thực tế không nhất thiết phải xảy ra trong vài ngày. Ngoài ra, nếu có thể, sử dụng liều đổ đầy bằng đường uống với liều lượng cao hơn có thể hữu ích cho những bệnh nhân nhịp nhanh thất tái phát. Trong bệnh viện, sử dụng liều đổ đầy bằng đường uống có thể được bắt đầu với liều cao tới 600 mg hai đến ba lần/24h trong tối đa 7-10 ngày. Ở liều cao này, có thể gặp nhiều tác dụng không mong muốn về thần kinh và đường tiêu hóa.
– Để bắt đầu điều trị cho bệnh nhân ngoại trú, có thể sử dụng chế độ liều nạp (400 mg hai đến ba lần/24h) để đảm bảo tổng liều là 10-15 g trong vòng 7-10 ngày sau khi khởi trị. Sau khi hoàn thành giai đoạn đổ đầy, bệnh nhân được chuyển sang liều duy trì 200 mg/24h đối với rung nhĩ và 400 mg/24h để phòng ngừa thứ phát nhịp nhanh thất.
– Truyền amiodarone đường tĩnh mạch tốt nhất nên qua một catheter tĩnh mạch trung tâm để tránh nguy cơ viêm tĩnh mạch và viêm mô tế bào trong trường hợp thuốc thoát mạch. Biến cố tụt huyết áp hay gặp khi sử dụng đường tĩnh mạch và cần được theo dõi chặt chẽ. Điều trị amiodarone đường uống lâu dài thường dung nạp tốt nhưng cần theo dõi chặt chẽ để phát hiện sớm các tác dụng không mong muốn.
Chống chỉ định
– Hội chứng suy nút xoang vì gây nhịp chậm nặng nề và phải cấy máy tạo nhịp.
– Block xoang nhĩ, block nhĩ thất cấp 2 và 3.
– QT dài.
– Hạ huyết áp, trụy tim mạch.
– Rung nhĩ ở bệnh nhân có hội chứng Wolff-Parkinson-White (dạng tiêm truyền).
– Rối loạn chức năng tuyến giáp: cường giáp hoặc suy giáp.
– Amiodarone đi qua rau thai nên có thể gây nhịp chậm và bất thường tuyến giáp cho thai nhi, vì vậy không được sử dụng cho phụ nữ mang thai.
– Thuốc được bài tiết qua sữa nên không được sử dụng cho phụ nữ cho con bú.
Tương tác thuốc
Amiodarone làm tăng nồng độ trong huyết thanh của digoxin, quinidine, procainamide, flecainide, cyclosporine và warfarin. Nó cũng làm giảm chuyển hóa statin thông qua CYP3A4, dẫn đến tăng nồng độ statin và tăng nguy cơ bệnh tiêu cơ vân. Warfarin, digoxin cũng như statin nên giảm một nửa liều nếu bệnh nhân bắt đầu dùng amiodarone.
Các tương tác thuốc chính của amiodarone được liệt kê trong bảng 5.4.
Dronedarone
Dronedarone là một dẫn chất của benzofuran và có cấu trúc tương tự như amiodarone, ngoại trừ nó không có các phân tử iode và được phát triển với mong muốn vẫn duy trì được hiệu lực trong khi loại bỏ các độc tính toàn thân do các phân tử iode của amiodarone gây ra. Mặc dù thuốc có đặc tính ức chế nhiều kênh tương tự như amiodarone, nhưng nó kém hiệu quả hơn trong việc duy trì nhịp xoang trong rung nhĩ. Với các kết quả lâm sàng, dronedarone được phân loại là AADs nhóm III theo bảng phân loại của Vaughan Williams, nhưng lại thể hiện vô số các đặc tính điện sinh lý, bao gồm các tác dụng ức chế các kênh kali nhanh một chiều, kênh kali chậm một chiều, kênh kali được kích hoạt bởi acetylcholine, kênh kali một chiều đi vào trong, dòng natri đi vào trong tế bào, kênh canxi loại L và T và các thụ thể giao cảm α và β.
Biệt dược
Multaq: viên 400mg.
Dược động học
– Dronedarone do được chuyển hóa mạnh mẽ kỳ đầu khi qua gan nên hoạt tính sinh học của thuốc rất thấp, chỉ vào khoảng 4% khi uống lúc đói và 15% khi uống trong bữa ăn.
– Nồng độ đỉnh đạt được sau uống khoảng 3-6h.
– Dronedarone và chất chuyển hóa gắn với protein huyết tương tới >98%.
– Được chuyển hóa bởi men CYP3A4 và chất chuyển hóa chính là N-Debutyl dronedarone có hoạt tính bằng 1/10-1/3 lần của dronedarone.
– Thời gian bán hủy vào khoảng 13-19h và bài tiết chủ yếu qua phân khoảng 84%, còn chỉ 6% qua thận và đều ở dưới dạng chất chuyển hóa.
– Dronedarone ức chế sự vận chuyển creatinine qua ống thận nên có thể làm tăng nồng độ creatinine lên 10-20% nhưng không làm giảm mức lọc cầu thận.
Cơ chế tác dụng và tính chất dược lý
Tác dụng lên điện sinh lý tim
– Là một thuốc ức chế nhiều kênh nhưng chưa rõ tác dụng lên kênh nào đóng vai trò then chốt trong hiệu quả của thuốc.
– Ức chế nhiều kênh kali đi ra, gồm: Kênh kali đi ra nhanh một chiều (IKr), kênh kali đi ra chậm một chiều (IKs) và kênh kali một chiều được hoạt hóa bởi acetylcholine. Tác dụng này chủ yếu xảy ra ở pha 3 ĐTHĐ nên làm kéo dài thời gian điện thế hoạt động và thời kỳ trơ có hiệu quả.
– Thuốc cũng ức chế kênh natri đi vào làm giảm độ dốc và tốc độ khử cực (pha 0 của ĐTHĐ) nên giảm tốc độ dẫn truyền (tác dụng của thuốc nhóm I).
– Ức chế kênh canxi loại L (tác dụng của thuốc nhóm IV). Thuốc cũng có tác dụng hủy giao cảm, giảm tính tự động (tác dụng của thuốc nhóm II).
Tác dụng của dronedarone lên các tổ chức tim:
Nút xoang và cơ nhĩ: làm chậm nhẹ tần số nhịp xoang. Kéo dài thời gian điện thế hoạt động và thời kỳ trơ có hiệu quả của cơ nhĩ.
Nút nhĩ thất: làm chậm dẫn truyền và kéo dài thời kỳ trơ có hiệu quả của nút nhĩ thất.
Hệ thống His-Purkinje và cơ thất: kéo dài thời gian điện thế hoạt động và thời kỳ trơ có hiệu quả của hệ thống His-Purkinje và cơ thất. Giảm tính tự động và tốc độ dẫn truyền của các tổ chức này.
Sự ức chế tính tự động của nút xoang và làm thay đổi độ dốc của quá trình khử cực giai đoạn 4 trong nút xoang dẫn đến làm chậm nhịp xoang. Dronedarone cũng làm chậm dẫn truyền AV, kéo dài thời kỳ trơ hiệu quả của tâm thất và làm giảm nhịp nhanh thất và ngoại tâm thu thất trong bệnh tim thiếu máu cục bộ khi thử nghiệm trên động vật.
Những thay đổi trên điện tâm đồ
– Tần số tim: ít thay đổi ở liều 400mg, 2 lần/24h. Giảm nhẹ (khoảng 4 nhịp/phút) khi sử dụng liều 800mg, 2 lần/24h
– Khoảng PR: sự thay đổi khoảng PR phụ thuộc rõ rệt liều sử dụng. Khoảng PR dài thêm 5 ms ở liều 400mg, 2 lần/24h nhưng ở liều 1600mg, 2 lần/24h khoảng PR dài hơn đến 50 ms.
–Khoảng QT: sự thay đổi khoảng QTc phụ thuộc liều lượng ở mức độ vừa phải. Khoảng QTc tăng thêm 10 ms khi sử dụng liều 400mg, 2 lần/24h và 25 ms với liều 1600 ms, 2 lần/24h.
Tác dụng không mong muốn
– Làm cho suy tim nặng lên hoặc xuất hiện đợt suy tim mất bù mới.
– Hạ kali hoặc hạ magie ở bệnh nhân dùng thuốc lợi tiểu.
– Kéo dài thời gian khoảng QT.
– Đau bụng, ỉa chảy, buồn nôn, nôn.
Nguy cơ làm nặng lên các rối loạn nhịp tim của dronedarone là không đáng kể nhưng thuốc đã được chứng minh là làm tăng tỷ lệ tử vong và nhập viện do suy tim ở những bệnh nhân suy tim cấp, rối loạn chức năng thất trái nặng và bệnh nhân rung nhĩ mạn tính có nguy cơ cao. Khi so sánh với amiodarone, dronedarone không gây độc phổi, gan, tuyến giáp và thần kinh. Giống như amiodarone, dronedarone gây ra sự gia tăng nhẹ creatinine huyết thanh mà không ảnh hưởng đến mức lọc cầu thận. Hiện tượng này là do ức chế kênh vận chuyển ion dương tại ống thận.
Chỉ định
Dronedarone được chỉ định để duy trì nhịp xoang cho những bệnh nhân đã có rung nhĩ kịch phát hoặc rung nhĩ bền bỉ và đã được chuyển về nhịp xoang nhằm giảm nguy cơ nhập viện của những bệnh nhân này.
Một số thử nghiệm ngẫu nhiên đã đánh giá vai trò của dronedarone trong rung nhĩ và suy tim. Các thử nghiệm này được được tóm tắt dưới đây:
Thử nghiệm ATHENA (Thử nghiệm mù đôi có đối chứng giả dược để đánh giá hiệu quả của Dronedarone 400mg hai lần/24h để dự phòng nhập viện do nguyên nhân tim mạch hoặc tử vong do mọi nguyên nhân ở những bệnh nhân bị rung nhĩ/cuồng nhĩ). Thử nghiệm đánh giá hiệu quả của dronedarone làm giảm tử vong hoặc nhập viện do nguyên nhân tim mạch ở 4.628 bệnh nhân rung nhĩ kịch phát hoặc bền bỉ có các yếu tố nguy cơ đột quỵ và/hoặc tử vong. Bệnh nhân được chọn ngẫu nhiên dùng dronedarone hoặc giả dược và được theo dõi trung bình khoảng 21 ± 5 tháng. Tỷ lệ tử vong do tim mạch thấp hơn (HR=0.71; 95%; CI 0.51-0,98; p=0.03) cũng như tỷ lệ nhập viện do tim mạch ở nhóm dronedarone cũng thấp hơn so với nhóm giả dược. Một phân tích sâu về ATHENA đã cho thấy rằng những bệnh nhân được điều trị ngẫu nhiên bằng dronedarone có tỷ lệ đột quỵ hoặc các cơn thiếu máu não thoáng qua ít hơn đáng kể so với giả dược. ATHENA là thử nghiệm đầu tiên chứng minh lợi ích về tử vong của AADs trong rung nhĩ. Dựa trên kết quả nghiên cứu, dronedarone đã được phê duyệt để sử dụng tại Hoa Kỳ.
Tuy nhiên thử nghiệm ANDROMEDA (Thử nghiệm chống loạn nhịp bằng dronedarone trong suy tim ứ trệ trung bình đến nặng – Đánh giá giảm tỷ lệ tử vong) lại có kết quả hoàn toàn khác khi so sánh dronedarone với giả dược ở bệnh nhân rung nhĩ nhập viện vì suy tim ứ trệ mới xuất hiện hoặc nặng lên với phân suất tống máu thất trái dưới 35%. Nghiên cứu đã kết thúc sớm sau thời gian theo dõi trung bình khoảng 2 tháng, do có sự tăng đáng kể tỷ lệ tử vong ở nhóm dùng dronedarone (8.1% so với 3.8% ở nhóm dùng giả dược) do tình trạng suy tim nặng lên và điều trị bằng dronedarone sẽ làm tăng nguy cơ tử vong. Thử nghiệm ANDROMEDA đã dẫn đến một cảnh báo không được sử dụng dronedarone cho những bệnh nhân suy tim độ IV theo phân độ của Hội tim mạch New York (NYHA) hoặc suy tim NYHA loại II và III với mất bù gần đây phải nhập viện.
Các nhà sản xuất thuốc gần đây đã đưa ra các dữ liệu theo dõi báo cáo một số trường hợp tổn thương tế bào gan và ít nhất hai trường hợp suy gan cấp tính cần ghép gan. Những trường hợp này xảy ra sau 4,5 tháng đến 6 tháng sau khi bắt đầu dùng thuốc, khiến nhà sản xuất khuyến nghị nên theo dõi men gan định kỳ ít nhất trong 6 tháng đầu khi điều trị bằng dronedarone.
Bảng 5.8: Tóm tắt các thử nghiệm lâm sàng ngẫu nhiên đánh giá hiệu quả và độ an toàn của dronedarone ở bệnh nhân rung nhĩ và suy tim.
| Thử nghiệm lâm sàng | Đặc điểm bệnh nhân | Số lượng bệnh nhân | Can thiệp (mg) | Tiêu chí chính | Thời gian theo dõi | Kết quả |
| DAFNE | Sau chuyển nhịp rung nhĩ bền bỉ | 270 | Dronedarone (400–800 mg 2 lần/24h)So sánh với giả dược | Thời gian tái phát cơn rung nhĩ | 6 tháng | • Nhóm sử dụng dronedarone thời gian trung bình tái phát rung nhĩ dài hơn (60 ngày ở nhóm dronedarone so với 5,3 ngày ở nhóm giả dược; Giảm nguy cơ tương đối 55%.• Tỷ lệ bệnh nhân được duy trì nhịp xoang ở nhóm dronedarone cao hơn so với bệnh nhân dùng giả dược. |
| EURIDIS/ ADONIS | Rung nhĩ kịch phát | 1.237 | Dronedarone (400 mg, 2 lần/24h) So sánh với giả dược | Thời gian tái phát cơn rung nhĩ | 6 tháng | • Dronedarone kéo dài đáng kể thời gian tái phát rung nhĩ.• Tần số thất trong rung nhĩ bị tái phát cũng thấp hơn đáng kể ở nhóm dronedarone |
| DIONYSOS | Rung nhĩ bền bỉ trong vòng >3 ngày | 504 | Dronedarone (400 mg, 2 lần/24h) so sánh với amiodarone (600 mg và sau đó 200 mg/24h) | Rung nhĩ tái phát hoặc không dung nạp thuốc dẫn đến ngừng thuốc | 7 tháng | • Nhiều bệnh nhân dùng dronedarone bị tái phát rung nhĩ hoặc ngừng thuốc do không dung nạp hoặc thiếu hiệu quả so với bệnh nhân dùng amiodarone (75,1% đối với dronedarone so với 58,8% với amiodarone) |
| ERATO | Rung nhĩ vĩnh viễn với tần số thất> 80 nhịp/phút khi đang dùng các thuốc kiểm soát nhịp | 630 | Dronedarone(400 mg, 2 lần/24h) so sánh với giả dược | Tần số thất trung bình sau 2 tuần | 1 tháng | • Dronedarone có tác dụng làm giảm tần số thất khi nghỉ ngơi (12,3 nhịp/phút ở nhóm dronedarone so với 0,2 nhịp/phút ở nhóm giả dược) và khi gắng sức(25,6 nhịp/phút ở nhóm dronedarone so với 2.2 nhịp/phút ở nhóm giả dược) |
| ATHENA | rung nhĩ kịch phát hoặc bền bỉ hoặc cuồng nhĩ với một hoặc nhiều các yếu tố nguy cơ kết hợp | 4.628 | Dronedarone (400 mg, 2 lần/24h) so sánh với giả dược | Tỷ lệ tử vong do tất cả các nguyên nhân và nhập viện do bệnh lý tim mạch | 21 ± 5 tháng | • Dronedarone làm giảm tỷ lệ tử vong do tim mạch và do rối loạn nhịp tim so với giả dược.• Giảm tỷ lệ nhập viện do rung nhĩ hoặc hội chứng vành cấp ở những bệnh nhân dùng dronedarone so với giả dược. |
| ANDROMEDA | Suy tim ứ trệ (NYHA Độ 3-4); phân suất tống máu thất trái thất trái <35% | 67 | Dronedarone 400 mg, 2 lần /24h) so sánh với giả dược | Tử vong do tất cả các nguyên nhân hoặc nhập viện vì suy tim | 2 tháng | Thử nghiệm bị dừng lại sớm. Dronedarone làm tăng tỷ lệ tử vong do mọi nguyên nhân (8.1% ở nhóm dùng dronedarone 3.8% ở nhóm dùng giả dược, HR 2.13) |
| PALLAS | Rung nhĩ mạn tính có nguy cơ cao bị các biến cố mạch máu | 3.236 | Dronedarone(400 mg, 2 lần /24h ) so sánh với giả dược | Bao gồm đột quỵ, nhồi máu cơ tim, tắc mạch đại tuần hoàn, tử vong do tim mạch | ~1 năm | • Thử nghiệm dừng sớm vì vấn đề an toànCác biến cố chính xảy ra ở 43 bệnh nhân trong nhóm dung Dronedarone so với 19 ở nhóm giả dược.
• Tử vong do tim mạch, tử vong do rối loạn nhịp tim, đột quỵ, nhập viện vì suy tim, ở nhóm dronedarone cao hơn so với nhóm giả dược |
Hiệu quả của dronedarone trong việc cải thiện các tiêu chí lâm sàng trong nhóm rung nhĩ có nguy cơ thấp ở thử nghiệm ATHENA đã thúc đẩy tiến hành thử nghiệm để đánh giá hiệu quả của dronedarone ở bệnh nhân rung nhĩ mạn tính (PALLAS), với giả thuyết rằng dronedarone sẽ làm giảm các biến cố mạch máu lớn ở bệnh nhân rung nhĩ mạn tính có nguy cơ cao đối với các biến cố mạch máu. Nghiên cứu này phân ngẫu nhiên các bệnh nhân ≥ 65 tuổi và bị rung nhĩ trên 6 tháng và có các yếu tố nguy cơ đối với các biến cố mạch máu lớn thành hai nhóm dùng dronedarone hoặc giả dược. Tiêu chí đánh giá chính là tổng hợp tỷ lệ đột quỵ, nhồi máu cơ tim, thuyên tắc mạch hệ thống hoặc tử vong do nguyên nhân tim mạch. Sau khi chọn 3.236 bệnh nhân vào nghiên cứu, thử nghiệm đã bị dừng do những vấn đề về độ an toàn, vì các biến cố xảy ra ở 43 bệnh nhân ở nhánh dronedarone khi so sánh với 19 ở nhánh giả dược (HR 2.29; 95% CI 1.34 – 3.94; p = 0,002). Tử vong tim mạch, tử vong do rối loạn nhịp, đột quỵ và nhập viện vì suy tim cao hơn đáng kể ở nhóm dùng dronedarone khi so sánh với nhóm dùng giả dược. Nghiên cứu đã kết luận rằng không nên sử dụng dronedarone ở những bệnh nhân rung nhĩ mãn tính có nguy cơ cao. Dựa trên những kết quả của nghiên cứu này tháng 12 năm 2011 cơ quan quản lý thuốc và thực phẩm Hoa kỳ (USFDA) đã đưa ra những sửa đổi về việc sử dụng dronedarone. Những thay đổi sau đây đã được đề xuất:
- Không nên kê dronedarone cho những bệnh nhân bị rung nhĩ không thể hoặc sẽ không chuyển về nhịp xoang bình thường (rung nhĩ vĩnh viễn), vì dronedarone làm tăng gấp đôi tỷ lệ tử vong do tim mạch, đột quỵ và suy tim ở những bệnh nhân này.
- Nên theo dõi nhịp tim bằng điện tâm đồ ít nhất một lần mỗi 3 tháng. Nếu bệnh nhân đang rung nhĩ nên ngừng dronedarone hoặc nếu có chỉ định lâm sàng, bệnh nhân nên được chuyển nhịp bằng sốc điện. Dronedarone được chỉ định để giảm nhập viện vì rung nhĩ ở những bệnh nhân nhịp xoang không có tiền sử rung nhĩ mạn tính.
- Bệnh nhân được kê dronedarone cần được điều trị chống đông thích hợp.
Sẽ là công bằng khi nói rằng hiện nay dronedarone đang ở ngã ba đường về vai trò của nó trong rung nhĩ. Mặc dù bản thân nó không phải là một thuốc kiểm soát nhịp quá hiệu quả nhưng đây là AADs đầu tiên cho thấy giảm tỷ lệ tử vong do tim mạch trong nhóm nguy cơ thấp, chủ yếu là bệnh nhân rung nhĩ kịch phát. Điều này dẫn đến bản cập nhật của ACC/AHA/HRS năm 2011 về hướng dẫn điều trị rung nhĩ, bao gồm dronedarone là thuốc hàng đầu trong kiểm soát nhịp cho rung nhĩ kịch phát ở bệnh nhân không mắc bệnh tim cấu trúc.
Những dữ liệu về sự an toàn cũng như thực tế là không cần dùng liều nạp đã khiến dronedarone trở thành một loại thuốc lý tưởng để bắt đầu cho bệnh nhân ngoại trú. Thực tế là thuốc cải thiện tỷ lệ tử vong và giảm nhập viện do nguyên nhân tim mạch ở bệnh nhân rung nhĩ làm cho thuốc hấp dẫn từ quan điểm tiêu chí chăm sóc sức khỏe. Tuy nhiên, các báo cáo về suy gan tối cấp đã đặt ra những nghi ngờ về sự an toàn của thuốc. Tranh luận cũng xoay quanh việc liệu giảm tỷ lệ tử vong, so với giảm triệu chứng cũng như cải thiện chất lượng cuộc sống, có phải là một tiêu chí có nhiều ý nghĩa lâm sàng trong điều trị rung nhĩ.
Hơn nữa, thử nghiệm ANDROMEDA đã chứng minh rõ ràng rằng dronedarone không được dùng cho những bệnh nhân rung nhĩ có suy tim ứ trệ và rối loạn chức năng thất trái nặng. Với kết quả gần đây của thử nghiệm PALLAS cho thấy tỷ lệ tử vong cao ở bệnh nhân mắc rung nhĩ mạn tính có nguy cơ cao. Ở thời điểm hiện tại còn chưa có sự hiểu biết rõ ràng về các cơ chế phía sau những tác dụng khác biệt rõ rệt của dronedarone tùy thuộc vào các nguy cơ mạch máu của bệnh nhân.
Chống chỉ định
– Suy tim NYHA IV hoặc suy tim NYHA II-III mất bù phải nhập viện mới đây.
– Rung nhĩ vĩnh viễn: dronedarone làm tăng gấp đôi nguy cơ tử vong, nhập viện do đột quỵ nên được chống chỉ định ở các bệnh nhân rung nhĩ sẽ không thể chuyển về nhịp xoang.
– Block nhĩ-thất cấp II hoặc cấp III, hoặc hội chứng suy nút xoang.
– Nhịp chậm xoang rõ rệt <50 nhịp/phút.
– Nhiễm độc gan, phổi liên quan tới sử dụng amiodarone trước đó.
– Tổn thương gan nặng.
– QTc ≥ 500ms hoặc sử dụng cùng với các thuốc khác gây kéo dài thời gian QT như các thuốc chống rối loạn nhịp tim nhóm I và III.
– Không sử dụng đồng thời với các thuốc ức chế mạnh men CYP3A hoặc với các sản phẩm thảo dược gây QT dài vì có thể gây xoắn đỉnh.
– Phụ nữ có thai, sẽ có thai hoặc cho con bú.
Tương tác thuốc
– Dronedarone được chuyển hóa bởi men CYP3A và là chất ức chế mức độ vừa phải men CYP3A và CYP2D6 không nên sử dụng cùng các thuốc ức chế mạnh CYP3A như các kháng sinh nhóm macrolide, clarithromycin, cyclosporine, telithromycin, ketoconazole, itraconazole, voriconazole, nefazodone, và ritonavir các thuốc kháng nấm khác vì chúng làm tăng nồng độ và tác dụng của dronedarone.
– Khi sử dụng cùng verapamil, diltiazem nên giảm liều dronedarone.
– Dronedarone làm tăng nồng độ digoxin lên 1,7-2,5 lần.
– Làm tăng nguy cơ gây bệnh cơ do các thuốc statin.
Tóm lại: Mặc dù dronedarone đã mở rộng các sự lựa chọn để điều trị rung nhĩ nhưng cần nhiều nghiên cứu thêm để hiểu các cơ chế gây ra những tác động khác nhau của thuốc này ở bệnh nhân rung nhĩ có nguy cơ thấp so với bệnh nhân có nguy cơ cao.
Azimilide
Azimilide dihydrochloride là AADs nhóm III. Thuốc có tác dụng ức chế cả kênh kali nhanh một chiều (IKr) và kênh kali chậm một chiều (IKs). Không giống như các thuốc nhóm III khác, azimilide không có tác dụng phụ thuộc tình trạng sử dụng ngược và điều này được xem là do khả năng phong tỏa IKs.
Azimilide kéo dài thời gian điện thế hoạt động và thời kỳ trơ trong cơ tâm nhĩ và tâm thất và gây ra kéo dài QTc phụ thuộc vào liều lượng. Trong một nghiên cứu thử nghiệm ngẫu nhiên 3173 bệnh nhân, 1-3 tuần sau nhồi máu cơ tim và EF khoảng 15-35%, azimilide không cho thấy bất kỳ lợi ích cải thiện tỷ lệ sống còn nào khi so sánh với giả dược. Tỷ lệ mắc xoắn đỉnh và giảm bạch cầu nghiêm trọng lần lượt là 0,3% và 0,9% và cao hơn một chút so với nhóm giả dược.
Hiệu quả của azimilide trong việc giảm các liệu pháp điều trị của ICD đã được đánh giá trong thử nghiệm đánh giá sự giảm các nhát sốc của ICD bằng azimilide (SHIELD). SHIELD đã chọn ngẫu nhiên 633 bệnh nhân điều trị bằng azimilide, 75mg (n=220) hoặc 125mg (n=199) mỗi 24h hoặc giả dược (n=214). Tất cả các bệnh nhân được lựa chọn đều đã được cấy ICD vì đã có một lần ngừng tim hoặc một cơn nhịp nhanh thất tự phát bền bỉ với phân suất tống máu thất trái ≤ 40% trong 42 ngày trước khi cấy ICD đầu tiên hoặc có nhát sốc ICD vì nhịp nhanh thất tự phát hoặc rung thất trong vòng 180 ngày trước đó. Bệnh nhân được theo dõi trung bình 1 năm và tiêu chí đánh giá ban đầu là tất cả các nguyên nhân gây nhát sốc và cơn nhịp nhanh có triệu chứng được cắt cơn bằng phương thức tạo nhịp chống nhịp nhanh và điều trị bằng ICD phù hợp. Azimilide ở liều 75mg/24h cho thấy giảm 57% tiêu chí ban đầu so với giả dược (HR=0,43; p=0,0006), trong khi đó ở nhóm azimilide 125mg/24h giảm được 47% (HR=0,53; p=0,0053). Khi so sánh với giả dược, azimilide 75 và 125mg/24h đã giảm các nhát sốc của ICD và tạo nhịp chống nhịp nhanh (ATP) lần lượt là 48% (p=0,017) và 62% (p=0,0004). Tỷ lệ ngừng thuốc cao (35-40%) nhưng tương đương ở cả nhóm dùng thuốc và nhóm giả dược. Bốn bệnh nhân trong nhóm azimilide và một bệnh nhân trong nhóm giả dược bị xoắn đỉnh. Do đó, có vẻ như azimilide có tác dụng có lợi trong việc ngăn ngừa rối loạn nhịp thất ở bệnh nhân ICD và hiện được chấp thuận cho sử dụng lâm sàng ở châu Âu nhưng chưa được chấp thuận ở Hoa Kỳ. Một thử nghiệm ngẫu nhiên có đối chứng giả dược đa trung tâm (SHIELD 2) để đánh giá hiệu quả của azimilide trong việc giảm nhập viện/cấp cứu do nguyên nhân tim mạch đã bị nhà tài trợ dừng sớm.
Hai thử nghiệm đã đánh giá hiệu quả của azimilide trong việc duy trì nhịp xoang ở bệnh nhân rung nhĩ. Thử nghiệm duy trì nhịp xoang sau sốc điện chuyển nhịp bằng Azimilide ở Bắc Mỹ (A-COMET II) đã so sánh azimilide (125mg mỗi 24h một lần) với sotalol (160mg hai lần/24h) hoặc giả dược để duy trì nhịp xoang ở 658 bệnh nhân bị rung nhĩ bền bỉ. Azimilide có tác dụng vượt trội so với giả dược nhưng kém hơn đáng kể so với sotalol trong việc ngăn ngừa tái phát rung nhĩ. Thử nghiệm giảm rối loạn nhịp nhanh trên thất bằng Azimilide (A-STAR) chọn ngẫu nhiên 220 bệnh nhân sử dụng azimilide (125mg mỗi 24h một lần) so sánh với giả dược tương ứng. Không có sự khác biệt đáng kể giữa các nhóm azimilide và giả dược về thời gian tái phát rung nhĩ lần đầu tiên. Có sự gia tăng xoắn đỉnh phụ thuộc liều lượng azimilide với tỷ lệ mắc dao động từ 0,3% với liều 75mg đến 1,2% với liều 100mg. Do đó, về mặt kiểm soát nhịp trong rung nhĩ, cân bằng giữa lợi ích và rủi ro đã không ủng hộ azimilide và thuốc này đã dần mờ nhạt trong điều trị rung nhĩ.
THUỐC CHỐNG LOẠN NHỊP NHÓM IV
Verapamil và diltiazem là những loại thuốc trong nhóm chẹn kênh canxi hay được dùng nhất để điều trị rối loạn nhịp tim. Cả verapamil và diltiazem đều ức chế kênh canxi chậm và làm giảm dòng canxi loại L trong tất cả các tế bào cơ tim. Tác dụng điện sinh lý bao gồm giảm chiều cao pha cao nguyên của điện thế hoạt động mà không làm thay đổi đáng kể về biên độ điện thế động hoặc tốc độ tăng của pha 0. Verapamil và diltiazem ức chế nút xoang và dẫn truyền nút AV, do đó được sử dụng để kiểm soát đáp ứng tần số thất trong cuồng nhĩ và rung nhĩ cũng như để điều trị rối loạn nhịp nhanh trên thất phụ thuộc vào nút nhĩ thất. Hơn nữa, những thuốc này có thể ngăn ngừa hoạt động hậu khử cực chậm và có thể khống chế nhịp nhanh thất đường ra vô căn cũng như các cơn nhịp tim nhanh nhĩ ổ có cùng cơ chế này. Một loại nhịp nhanh thất do vòng vào lại đặc biệt, nhịp nhanh thất vô căn khởi phát từ vùng vách liên thất bên trái, đặc biệt nhạy cảm với verapamil.
ĐTHĐ: Điện thế hoạt động
Verapamil
Biệt dược: Isoptin: ống 5 mg; viên 40; 80,120 mg
Calan: 120, 180, 240 mg
Dược động học:
– Verapamil được hấp thu gần như hoàn toàn khi uống, nhưng trải qua chuyển hóa mạnh mẽ kỳ đầu qua gan và chỉ còn 10-20% liều uống có trong tuần hoàn hệ thống. Nồng độ đỉnh trong huyết tương đạt được sau khi uống 1-2h, với dạng phóng thích chậm (SR) khoảng 4-6h.
– Liên kết với protein huyết tương tới 90%.
– Hoạt tính sinh học tăng lên nhiều ở những bệnh nhân có rối loạn chức năng gan hoặc dòng máu tới gan giảm.
– Thuốc được chuyển hóa bởi hệ thống cytochrome P450 trong đó có CYP3A4 và chủ yếu được thải trừ qua nước tiểu.
– Thời gian bán hủy của thuốc vào khoảng 3-7h.
Cơ chế tác dụng và tính chất dược lý
Tác dụng trên điện sinh lý tim
Verapamil ức chế dòng Ca++ đi vào trong tế bào (qua kênh canxi loại L). Tác dụng điện sinh lý rõ rệt nhất ở các tế bào tim phụ thuộc kênh canxi để khởi phát điện thế hoạt động mà các tế bào loại này chủ yếu có ở nút xoang và nút nhĩ thất.
Nút xoang và cơ nhĩ:
– Làm giảm tính tự động nên làm giảm tần số phát xung của nhịp xoang.
– Giảm tính dẫn truyền và kéo dài thời kỳ trơ của nút xoang.
– Không có tác dụng điện sinh lý đáng kể trên cơ nhĩ.
Nút nhĩ thất: làm chậm dẫn truyền và kéo dài thời kỳ trơ có hiệu quả của nút nhĩ thất.
Hệ thống His-Purkinje và cơ thất:
– Không ảnh hưởng đến dẫn truyền và thời kỳ trơ của hệ thống His-Purkinje và cơ thất.
Các tính chất dược lý khác:
– Làm giảm sức bóp cơ tim nhưng cung lượng tim không bị giảm do có giảm sức cản ngoại vi đi kèm. Chức năng thất trái chỉ bị giảm trên bệnh nhân đã bị suy tim hoặc khi dùng cùng các thuốc ức chế thụ thể β hoặc các thuốc khác làm giảm sức bóp cơ tim.
– Ức chế các thụ thể giao cảm α nên làm giãn cơ trơn thành mạch gây giãn mạch và làm giảm sức cản ngoại vi, giảm huyết áp. Thuốc cũng làm giãn động mạch vành nên làm tăng cung lượng vành.
Thay đổi trên điện tâm đồ
– Giảm tần số nhịp xoang.
– Kéo dài khoảng PR, không làm kéo dài thời gian QRS và thời gian QT.
Ảnh hưởng huyết động:
- Ở liều điều trị thông thường, verapamil ít làm thay đổi đáng kể huyết áp, sức cản mạch ngoại vi, tần số tim và áp lực cuối tâm trương thất trái hoặc sức bóp cơ tim ở người lớn và trẻ em khỏe mạnh. Liều cao thuốc gây giảm huyết áp do giãn mạch và giảm sức cản ngoại vi.
Chỉ định
– Dùng để cắt cơn và dự phòng các cơn nhịp nhanh trên thất có sự tham gia của nút nhĩ thất trong cơ chế vòng vào lại như nhịp nhanh vào lại nút nhĩ thất (AVNRT) và nhịp nhanh vào lại nhĩ thất qua trung gian đường dẫn truyền phụ (AVRT).
– Sử dụng trong rung nhĩ, cuồng nhĩ, nhịp nhanh nhĩ với mục đích làm giảm đáp ứng tần số thất do thuốc làm giảm dẫn truyền và kéo dài thời kỳ trơ ở nút nhĩ thất.
– Một số rối loạn nhịp khởi phát trung gian qua hậu khử cực liên quan tới tăng Ca++ trong tế bào như một số dạng nhịp nhanh thất đường ra vô căn, nhịp nhanh nhĩ ổ có cơ chế này.
– Ngoài ra do đặc tính ức chế thụ thể giao cảm α nên làm giãn cơ trơn mạch máu, giảm sức cản ngoại vi nên thuốc còn chỉ định trong điều trị tăng huyết áp. Verapamil cũng làm giảm sức bóp cơ tim, giảm tiêu thụ oxy cơ tim và tăng lưu lượng máu qua mạch vành nên còn chỉ định điều trị đau thắt ngực.
Chống chỉ định
– Suy tim, rối loạn chức năng thất trái.
– Hạ huyết áp: huyết áp tâm thu <90 mmHg hoặc sốc tim.
– Nhịp chậm, block nhĩ thất độ II và III, hội chứng suy nút xoang.
– Rung nhĩ hoặc cuồng nhĩ ở bệnh nhân có hội chứng WPW vì thuốc làm rút ngắn giai đoạn trơ có hiệu quả của đường phụ dẫn đến tần số thất quá nhanh và có thể thoái triển thành rung thất.
– Không sử dụng cho phụ nữ có thai và cho con bú.
– Không được sử dụng hoặc sử dụng với sự thận trọng cao khi kết hợp với các thuốc ức chế thụ thể giao cảm β vì tác dụng hiệp đồng làm nặng hơn tác dụng làm chậm nhịp tim, giảm dẫn truyền nhĩ-thất, giảm sức co bóp cơ tim.
Liều lượng và cách sử dụng
– Đường uống: 120-360 mg/24h chia làm 2-3 lần.
– Trong trường hợp cần tác dụng nhanh như cắt cơn nhịp nhanh trên thất, giảm nhanh tần số thất trong rung nhĩ, cuồng nhĩ có thể tiêm tĩnh mạch chậm 5 mg trong 2-3 phút. Có thể cho liều lặp lại sau 10 phút nếu cần. Liều truyền duy trì là 0,005 mg/kg/phút khi bệnh nhân không thể sử dụng thuốc uống.
Tương tác thuốc
– Sử dụng cùng thuốc ức chế thụ thể giao cảm β sẽ hiệp đồng làm tăng tác dụng gây nhịp chậm, giảm dẫn truyền nhĩ thất có thể gây block nhĩ thất hoặc đáp ứng tần số thất quá chậm trong rung nhĩ, cuồng nhĩ, đặc biệt là giảm sức bóp cơ tim gây suy tim.
– Sử dụng cùng với digitalis sẽ làm chậm nhịp tim, giảm dẫn truyền qua nút nhĩ thất tăng lên và có thể gây block nhĩ thất, đáp ứng tần số thất quá chậm trong rung nhĩ, cuồng nhĩ.
– Không nên sử dụng đồng thời verapamil với: disopyramide, flecainide vì làm tăng tác dụng giảm sức bóp cơ tim dẫn đến suy tim và giảm dẫn truyền qua nút nhĩ thất gây block nhĩ thất.
– Verapamil làm tăng nồng độ các thuốc: digoxin, cyclosporine, carbamazepine.
Diltiazem
Diltiazem là thuốc trong nhóm chẹn kênh canxi hay được dùng để điều trị rối loạn nhịp tim.
Biệt dược: Tildiem: viên 30, 60, 90, 120 mg.
Herbesser: viên 30, 60, 100, 200 mg.
Ống tiêm: Diltiazem HCl: 50mg/10mL (5 mg/mL).
Dược động học
– Sau khi uống, diltiazem được chuyển hóa mạnh mẽ kỳ đầu khi qua gan, hoạt tính sinh học khoảng 40%. 70-80% được gắn vào protein huyết tương.
– Thời gian bán hủy khoảng 2-7h (trung bình 4,5h).
Cơ chế tác dụng và tính chất dược lý
Tác dụng lên điện sinh lý tế bào tim
Diltiazem ức chế kênh canxi chậm và làm giảm dòng canxi loại L trong các tế bào cơ tim. Tác dụng điện sinh lý rõ rệt nhất ở các tế bào tim phụ thuộc kênh canxi để khởi phát điện thế hoạt động mà các tế bào loại này chủ yếu có ở nút xoang và nút nhĩ thất.
Nút xoang và cơ nhĩ:
– Làm giảm tính tự động nên làm giảm tần số phát xung của nhịp xoang.
– Không có tác dụng điện sinh lý đáng kể trên cơ nhĩ.
Nút nhĩ thất: làm chậm dẫn truyền và kéo dài thời kỳ trơ có hiệu quả của nút nhĩ thất.
Hệ thống His-Purkinje và cơ thất:
-Không ảnh hưởng đến dẫn truyền và thời kỳ trơ của hệ thống His-Purkinje và cơ thất.
Các tính chất dược lý khác:
– Làm giảm sức bóp cơ tim nhưng cung lượng tim không bị giảm do có giảm sức cản ngoại vi đi kèm. Chức năng thất trái chỉ bị giảm trên bệnh nhân đã bị suy tim hoặc khi dùng cùng các thuốc ức chế thụ thể β hoặc các thuốc khác làm giảm sức bóp cơ tim.
– Ức chế các thụ thể giao cảm α nên làm giãn cơ trơn thành mạch gây giãn mạch và làm giảm sức cản ngoại vi, giảm huyết áp. Thuốc cũng làm giãn động mạch vành nên làm tăng cung lượng vành.
Thay đổi trên điện tâm đồ
– Giảm tần số nhịp xoang.
– Kéo dài khoảng PR. Không làm kéo dài thời gian QRS và thời gian QT.
Ảnh hưởng huyết động:
Ở liều điều trị thông thường cho rối loạn nhịp tim, diltiazem không làm thay đổi đáng kể huyết áp, sức cản mạch ngoại vi, tần số tim và áp lực cuối tâm trương thất trái hoặc sức bóp cơ tim ở người lớn khỏe mạnh. Liều cao thuốc gây giảm huyết áp do gây giãn mạch, giảm sức cản ngoại vi.
Chỉ định
Diltiazem ức chế nút xoang và dẫn truyền nút nhĩ thất, do đó được sử dụng để kiểm soát đáp ứng tần số thất trong cuồng nhĩ và rung nhĩ cũng như để điều trị rối loạn nhịp nhanh trên thất phụ thuộc vào nút nhĩ thất. Hơn nữa, những thuốc này có thể ngăn ngừa hoạt động hậu khử cực chậm và có thể khống chế nhịp nhanh thất đường ra vô căn cũng như các cơn nhịp tim nhanh nhĩ ổ có cùng cơ chế này.
– Dùng để cắt cơn và dự phòng các cơn nhịp nhanh trên thất có sự tham gia của nút nhĩ thất trong cơ chế vòng vào lại như nhịp nhanh vào lại nút nhĩ thất (AVNRT) và nhịp nhanh vào lại nhĩ thất qua trung gian đường dẫn truyền phụ (AVRT).
– Sử dụng trong rung nhĩ, cuồng nhĩ, nhịp nhanh nhĩ với mục đích làm giảm đáp ứng tần số thất do thuốc làm giảm dẫn truyền và kéo dài thời kỳ trơ ở nút nhĩ thất.
– Một số rối loạn nhịp khởi phát trung gian qua hậu khử cực liên quan tới tăng Ca++ trong tế bào như một số dạng nhịp nhanh thất đường ra vô căn, nhịp nhanh nhĩ ổ có cơ chế này.
– Ngoài ra do đặc tính ức chế thụ thể giao cảm α nên làm giãn cơ trơn mạch máu, giảm sức cản ngoại vi nên thuốc còn chỉ định trong điều trị tăng huyết áp.
– Diltiazem cũng làm giảm sức bóp cơ tim, giảm tiêu thụ oxy cơ tim và tăng lưu lượng máu qua mạch vành nên còn chỉ định điều trị đau thắt ngực.
Chống chỉ định
– Suy tim, rối loạn chức năng thất trái.
– Hạ huyết áp: huyết áp tâm thu < 90 mmHg hoặc sốc tim.
– Nhịp chậm, block nhĩ thất độ II và III, hội chứng suy nút xoang.
– Rung nhĩ hoặc cuồng nhĩ ở bệnh nhân có hội chứng WPW vì thuốc làm rút ngắn giai đoạn trơ có hiệu quả của đường phụ dẫn đến tần số thất quá nhanh và có thể thoái triển thành rung thất.
– Không sử dụng cho phụ nữ có thai và cho con bú.
– Không được sử dụng hoặc sử dụng với sự thận trọng cao khi kết hợp với các thuốc ức chế thụ thể giao cảm β vì tác dụng hiệp đồng làm nặng hơn tác dụng làm chậm nhịp tim, giảm dẫn truyền nhĩ-thất, giảm sức co bóp cơ tim.
Liều lượng và cách sử dụng
– Đường uống: 120-360 mg/24h chia làm 2-3 lần.
– Trong trường hợp cần tác dụng nhanh như cắt cơn nhịp nhanh trên thất, giảm nhanh tần số thất trong rung nhĩ, cuồng nhĩ có thể tiêm tĩnh mạch chậm 0,25 mg/kg trong 2-3 phút. Có thể cho liều lặp lại sau 15 phút với liều 0,35 mg/kg trong 2-3 phút nếu liều đầu dung nạp tốt nhưng chưa có hiệu quả. Liều truyền duy trì truyền TM liều 10mg/giờ khi bệnh nhân không thể sử dụng thuốc uống.
Tương tác thuốc
– Sử dụng cùng thuốc ức chế thụ thể giao cảm β sẽ hiệp đồng làm tăng tác dụng gây nhịp chậm, giảm dẫn truyền nhĩ thất có thể gây block nhĩ thất hoặc đáp ứng tần số thất quá chậm trong rung nhĩ, cuồng nhĩ, đặc biệt là giảm sức bóp cơ tim gây suy tim.
– Sử dụng cùng với digitalis sẽ làm chậm nhịp tim, giảm dẫn truyền qua nút nhĩ thất tăng lên và có thể gây block nhĩ thất, đáp ứng tần số thất quá chậm trong rung nhĩ, cuồng nhĩ.
– Không nên sử dụng đồng thời với: disopyramide, flecainide vì làm tăng tác dụng giảm sức bóp cơ tim dẫn đến suy tim và giảm dẫn truyền qua nút nhĩ thất gây block nhĩ thất.
CÁC NHÓM THUỐC KHÁC
Adenosine
Adenosine là một chất chủ vận nucleoside purine nội sinh được tạo ra trong cơ thể bằng cách loại bỏ các gốc phosphate của Adenosine triphosphate (ATP). Thuốc có tác dụng cực ngắn, được sử dụng để cắt các cơn rối loạn nhịp trên thất có triệu chứng và một số loại nhanh thất vô căn.
Biệt dược
Adenosine; Adenocard; Adenocor… ống tiêm: 6 mg.
Dược động học
– Được vận chuyển vào và chuyển hóa rất nhanh trong hồng cầu và các tế bào nội mạc thành AMP.
– Thời gian bán hủy trong huyết tương rất ngắn <10 giây.
Cơ chế tác dụng và tính chất dược lý
– Tác dụng của adenosine phụ thuộc nhiều vào tốc độ và đường nhận. Tiêm tĩnh mạch nhanh vào tĩnh mạch trung tâm, thuốc ban đầu thường gây tăng huyết áp lên 10-15 mmHg, rồi tiếp sau là giảm nhẹ và thoáng qua.
– Tiêm bolus cũng gây ra tác dụng hai pha trên tần số tim: khoảng 20 giây sau tiêm, nhịp chậm xoang xảy ra trong 10-15 giây, sau đó là nhịp nhanh xoang do tác dụng kích hoạt thụ thể mạch cảnh.
– Thuốc có tác dụng cường phó giao cảm mạnh.
– Adenosine tác động lên các tổ chức cơ tim bằng cách liên kết với các thụ thể adenosine A1 trên bề mặt phía ngoài của các tế bào cơ tim, lần lượt kích hoạt các kênh kali phụ thuộc acetylcholine và nhạy cảm với adenosine (IKACh/IKAdo). Điều này dẫn đến tăng dòng kali đi ra ngoài tế bào và làm rút ngắn thời gian điện thế hoạt động của tâm nhĩ và tăng phân cực qua màng, ức chế nút nhĩ thất và nút xoang thoáng qua. Các kênh IKA do không có trong các tế bào cơ tâm thất và do đó adenosine không ảnh hưởng nhiều đến tế bào cơ thất.
– Một cách gián tiếp, adenosine có tác dụng chống giao cảm do ức chế adenylate cyclase, dẫn đến giảm AMP vòng và giảm dòng canxi đi vào loại L cũng như giảm dòng đi vào thoáng qua (Ito). Đặc tính này giải thích tác dụng của nó đối với nhịp nhanh thất đường ra tâm thất cũng như một loại nhịp nhanh nhĩ ổ được khởi phát qua trung gian hậu khử cực muộn do tăng canxi trong tế bào. Adenosine cũng ức chế kênh “funny” (If) dẫn đến làm giảm dòng natri đi qua kênh “bất thường” (funny channel) trong các tế bào nút xoang và nút nhĩ thất và làm giảm tính tự động của các tổ chức này nên có đặc tính giảm nhịp. Các tác dụng tương tự cũng được thấy ở nút AV dẫn đến tăng khoảng AH và ức chế nút AV mạnh mẽ và thoáng qua. Tác dụng chống giao cảm này có thể đóng vai trò chủ yếu trong đặc tính chống rối loạn nhịp của thuốc.
– Dẫn truyền tại bó His – Purkinje thường ít bị ảnh hưởng. Mặc dù không có tác dụng trực tiếp trên hệ thống His-Purkinje nhưng nó làm giảm tác động của catecholamine và ở bệnh nhân có block nhĩ-thất, nó có thể làm ức chế sự gia tốc tần số nhịp thoát thất của isoproterenol.
– Adenosine thường không ảnh hưởng đến dẫn truyền xuôi và ngược qua đường dẫn truyền phụ. Nhưng các đường dẫn truyền có đặc tính dẫn truyền giảm tiến thường đáp ứng tốt với adenosine, có thể do đường dẫn truyền được khử cực từng phần và có thể do tăng phân cực của adenosine.
– Tiêm chậm adenosine đường tĩnh mạch ngoại vi không làm thay đổi huyết áp và tần số tim và thường không có tác dụng điều trị vì thời gian bán huỷ thuốc rất ngắn.
Chỉ định
– Adenosine khởi phát tác dụng nhanh chóng sau khi tiêm tĩnh mạch và gây ra nhịp chậm xoang tức thì và ức chế nút nhĩ thất thoáng qua, chính vì vậy thuốc được ưu tiên lựa chọn để cắt cơn nhịp nhanh trên thất phụ thuộc nút nhĩ thất, như cơn nhịp nhanh do vòng vào lại tại nút nhĩ thất và cơn nhịp nhanh do vòng vào lại nhĩ thất chiều xuôi.
– Adenosine cũng có thể sử dụng để cắt cơn nhịp nhanh thất vô căn có vị trí khởi phát từ đường ra tâm thất cũng như một số nhịp nhanh nhĩ ổ có cơ chế khởi phát là hoạt động nảy cò.
– Adenosine thường không ảnh hưởng đến dẫn truyền qua đường dẫn truyền bất thường, và tính chất này được sử dụng trong phòng thăm dò điện sinh lý để chẩn đoán các đường dẫn truyền bất thường ẩn.
– Adenosine còn có đặc tính giãn mạch nên nó trở thành một thuốc thích hợp dùng trong nghiệm pháp gắng sức bằng thuốc để chẩn đoán bệnh tim thiếu máu cục bộ.
– Việc rút ngắn thời gian trơ của cơ nhĩ có thể dẫn đến rung nhĩ ở 10 – 15% bệnh nhân và thuốc đôi khi được sử dụng để kiểm tra hiệu quả của thủ thuật cô lập tĩnh mạch phổi trong rung nhĩ
Chống chỉ định
Các chống chỉ định của adenosine gồm:
– Hen phế quản.
– Suy tim mất bù.
– Hội chứng QT dài.
– Nhịp nhanh do thuốc hoặc do ngộ độc.
– Block nhĩ thất độ II hoặc độ III.
– Tăng huyết áp nặng.
– Hội chứng suy nút xoang.
Khi sử dụng qua đường catheter tĩnh mạch trung tâm, adenosine có thể gây rung nhĩ do tác dụng của thuốc trên cơ nhĩ. Ở những bệnh nhân có hội chứng WPW, nếu khởi phát rung nhĩ có thể dẫn đến đáp ứng tần số thất rất nhanh và gây rối loạn huyết động hoặc có thể dẫn đến rung thất. Tuy nhiên, adenosine vẫn có thể sử dụng nếu có máy sốc điện chuyển nhịp sẵn sàng dự phòng.
Tác dụng không mong muốn
– Tác dụng không mong muốn thường gặp của adenosine do tác động lên các thụ thể mạch máu gây giãn mạch và thường bao gồm các dấu hiệu khó thở, đỏ bừng mặt và co thắt phế quản. Đây là các tác dụng ngắn và tự hết nhanh chóng.
– Adenosine cần được sử dụng thận trọng trên các bệnh nhân có bệnh lý phế quản.
– Các tác dụng không mong muốn ở tim thường là các rối loạn nhịp như ngoại tâm thu nhĩ và thất, block nhĩ thất, đau thắt ngực do thiếu máu cơ tim, hạ huyết áp.
– Việc rút ngắn thời gian trơ của cơ nhĩ có thể dẫn đến rung nhĩ ở 10 – 15% bệnh nhân.
Liều lượng và cách sử dụng
– Adenosine được dùng phổ biến dưới dạng bolus tiêm tĩnh mạch ngoại biên: 6 mg trong 1-2 giây, sau đó bơm 20 mL dịch muối sinh lý hoặc cho dịch chảy nhanh. Nếu thuốc được tiêm qua đường tĩnh mạch trung tâm, một liều nhỏ hơn (3mg) được khuyến cáo.
– Nếu không có hiệu quả, cơn nhịp nhanh vẫn tồn tại có thể sử dụng liều 12mg, sau 1-2 phút, tiêm nhanh và sau đó là bơm 20 mL dịch muối đẳng trương. Liều này có thể tiêm lặp lại lần thứ 3, nhưng không nên sử dụng liều cao hơn 12 mg.
– Một chế độ liều lượng khác cũng được khuyến cáo sử dụng: bắt đầu liều 50 μg/kg và được tăng dần 50 μg cho đến khi cắt được cơn nhịp nhanh trên thất hoặc xuất hiện tác dụng không mong muốn không dung nạp.
– Liều lượng cao hơn có thể cần cho bệnh nhân dùng caffeine hoặc theophylline vì tác dụng đối kháng của các thuốc này trên thụ thể A1.
– Liều lượng thấp hơn nên được sử dụng cho bệnh nhân đang dùng dipyridamole hoặc carbamazepine vì tác dụng đồng vận trên thụ thể A1.
– Liều dùng cho trẻ em là 0,1-0,3 mg/kg tiêm tĩnh mạch. Adenosine được loại trừ nhanh chóng khỏi khoảng gian bào bằng nhiều cơ chế khác nhau, bao gồm bị phân hủy bởi enzyme, phosphoryl hóa hoặc tái hấp thu vào tế bào với thời gian bán hủy trong vài giây.
– Tim được cấy ghép rất nhạy cảm với adenosine nên được khuyến cáo giảm liều tới 1 mg.
Tương tác thuốc
– Methylxanthine (caffeine và theophylline) phong tỏa thụ thể adenosine nên ngăn cản tác dụng của adenosine.
– Dipyridamole làm giảm sự hấp thụ adenosine, do đó làm kéo dài tác dụng của adenosine và vì vậy những người đang sử dụng dipyridamole đường uống cần làm các nghiệm pháp gắng sức bằng thuốc không nên dùng adenosine mà thay vào đó nên dùng dipyridamole tiêm tĩnh mạch.
Digoxin
Digoxin là một glycoside trợ tim được chiết xuất từ cây mao địa hoàng (digitalis lanata)
Biệt dược: Digoxin, Lanoxin
Dược động học
– Digoxin được hấp thu khoảng 60-80% sau uống và nồng độ đỉnh đạt được sau 1-3h. Khi uống sau bữa ăn, sự hấp thu thuốc chậm đi nhưng tổng lượng thuốc được hấp thu vẫn không đổi.
– Vào khoảng 25% digoxin trong huyết tương gắn với protein huyết tương.
– Chỉ một lượng nhỏ (16%) digoxin được chuyển hóa và sự chuyển hóa không phụ thuộc vào cytochrome P450. Thuốc cũng không ức chế và sinh ra P450.
– Thuốc được bài tiết qua thận dưới dạng không đổi và thời gian bán hủy 36-48h.
– Digoxin đi qua hàng rào máu não và rau thai, nồng độ digoxin ở thai nhi tương đương với ở người mẹ.
Cơ chế tác dụng và tính chất dược lý
– Digoxin gắn vào enzyme Na+/K+ ATPase ở màng tế bào, một enzyme điều phối lượng Na+ và K+ ở trong tế bào và ức chế hoạt động của enzyme dẫn tới làm suy giảm sự vận chuyển chủ động Na+ đi ra và K+ đi vào trong tế bào (tỷ lệ 3:2), kết quả là Na+ dần dần tăng và K+ giảm nhẹ ở trong tế bào. Sự tăng Na+ ở trong tế bào gây ra giảm trao đổi Na+ và Ca++ qua màng tế bào mà bình thường sự trao đổi này có tỷ lệ 3:1 nghĩa là có 3 ion Na+ từ ngoài đi vào trong tế bào đổi 1 ion Ca++ từ trong tế bào đi ra ngoài tế bào. Kết quả là làm tăng nồng độ Ca++ trong tế bào.
– Digoxin làm giảm điện thế nghỉ qua màng hoặc điện thế tâm trương tối đa (pha 4), dẫn tới làm chậm tốc độ khử cực pha 0 và tốc độ dẫn truyền.
– Giảm thời gian điện thế hoạt động dẫn tới làm rút ngắn thời gian QT và tăng đáp ứng của cơ tim với các kích thích.
– Tác dụng có lợi của digoxin thông qua tác dụng trực tiếp đến tác tổ chức của tim và tác dụng gián tiếp đến hệ tim mạch qua trung gian tác dụng của hệ thần kinh tự động và thần kinh-nội tiết. Tác dụng của hệ thần kinh tự động gồm:
- Tác dụng cường thần kinh phế vị: chủ yếu đối với nút xoang và nút nhĩ thất, làm giảm tính tự động, giảm tính dẫn truyền và kéo dài thời kỳ trơ của các tổ chức này.
- Tăng nhận cảm của thụ thể nhận áp của xoang cảnh, dẫn tới tăng hoạt tính phó giao cảm và giảm hoạt tính của hệ thần kinh giao cảm và hệ renine-angiotensine (tác dụng hủy hoạt thần kinh – hormone). Ở liều điều trị (0,5-0,9 ng/mL), tác dụng trực tiếp và gián tiếp của digoxin là:
Nút xoang và cơ nhĩ: làm giảm nhẹ tần số nhịp xoang.
Với cơ nhĩ: digoxin rút ngắn thời gian điện thế hoạt động và giảm thời kỳ trơ có hiệu quả.
Nút nhĩ thất: làm giảm tốc độ dẫn truyền, kéo dài thời kỳ trơ có hiệu quả nên phá vỡ vòng vào lại có sử dụng nút nhĩ thất trong cơ chế của cơn nhịp nhanh trên thất (Cơn AVNRT, AVRT) và làm chậm đáp ứng tần số thất trong rung nhĩ.
Hệ thống His-Purkinje và cơ thất: Ở liều điều trị thuốc ít ảnh hưởng đến dẫn truyền cũng như tính tự động của His-Purkinje và cơ thất. Thuốc gây rút ngắn thời gian điện thế hoạt động và giai đoạn trơ của His-Purkinje và cơ thất dẫn đến rút ngắn thời gian khoảng QT.
Đường dẫn truyền phụ nhĩ-thất (cầu Kent): digoxin làm rút ngắn thời kỳ trơ của đường phụ trong hội chứng Wolff-Parkinson-White nên làm cho xung động của rung nhĩ đi xuống thất qua đường phụ tăng dẫn tới đáp ứng tần số thất tăng và có nguy cơ thoái triển thành rung thất.
Ở nồng độ cao hơn 1ng/mL hoặc nồng độ gây nhiễm độc, digoxin có thể gây: nhịp chậm xoang hoặc ngừng xoang, kéo dài thời gian dẫn truyền nhĩ thất hoặc block nhĩ thất. Ở mức nhiễm độc, digoxin cũng có thể gây tăng hoạt tính thần kinh giao cảm và có thể góp phần vào gây ra rối loạn nhịp tim.
– Tăng Ca++ trong tế bào và tăng trương lực thần kinh giao cảm sẽ góp vào làm tăng tốc độ khử cực tâm trương tự phát (pha 4) và tăng nguy cơ xuất hiện hậu khử cực muộn và như vậy tăng nguy cơ khởi phát rối loạn nhịp qua trung gian hậu khử cực.
– Sự kết hợp của tăng tính tự động và ức chế dẫn truyền trong hệ thống His-Purkinje có nguy cơ sinh ra các rối loạn nhịp như: nhịp nhanh thất, xoắn đỉnh và rung thất.
Nghiên cứu DIG (Digitalis investigation Group Trial) đã cho thấy khi nồng độ digoxin huyết tương >1 ng/mL thường kết hợp với tỷ lệ tử vong tăng.
Thay đổi trên điện tâm đồ: ở nồng độ điều trị những thay đổi trên điện tâm đồ có thể gồm:
– Tần số nhịp xoang giảm nhẹ hoặc không đổi.
– Kéo dài khoảng PR do tác dụng làm chậm dẫn truyền trong nút nhĩ thất.
– Thời gian QRS ít thay đổi nhưng khoảng QT thường ngắn lại.
– Ở liều ngấm digoxin có thể thấy thay đổi của đoạn ST cong võng hình đáy chén và cong trái chiều QRS. Dấu hiệu ngấm thuốc chưa phải là nhiễm độc nhưng cần phải theo dõi chặt chẽ hơn đề phòng nhiễm độc.
Tác dụng không mong muốn
– Mệt mỏi, đau cơ, chán ăn.
– Nôn, buồn nôn.
– Nhịp chậm quá mức, block nhĩ thất độ II, III.
– Rối loạn nhịp thất như: ngoại tâm thu thất (NTT/T), NTT/T nhịp đôi, nhịp nhanh thất, rung thất… nhất là ở bệnh nhân có giảm kali, magie máu.
Chỉ định
Trong những năm gần đây, qua những dữ liệu phân tích tổng hợp từ những nghiên cứu đã cho thấy sử dụng digoxin trong rung nhĩ có nguy cơ làm tăng tỷ lệ tử vong, cho nên chỉ định của digoxin đã có những thu hẹp đáng kể:
– Giảm đáp ứng tần số thất cấp trong rung nhĩ, cuồng nhĩ: Digoxin chỉ là thuốc được lựa chọn hàng thứ 2 bổ sung thêm vào khi các thuốc được lựa chọn đầu tiên (first line) như chẹn beta, verapamil, diltiazem chưa đạt hiệu quả kiểm soát tần số tim ở bệnh nhân có EF ≥ 40% hoặc chẹn beta liều thấp hoặc amiodarone ở bệnh nhân có EF ≤ 40% (theo khuyến cáo của ESC 2016).
– Trong kiểm soát tần số thất lâu dài trong rung nhĩ, cuồng nhĩ: digoxin có thể được lựa chọn là thuốc đầu tiên hoặc là thuốc thứ 2 kết hợp bổ sung khi thuốc đầu tiên (chẹn beta hoặc verapamil hoặc diltiazem) chưa đạt hiệu quả kiểm soát tần số mong muốn.
– Điều trị dự phòng nhịp nhanh trên thất ở bệnh nhân không có WPW.
– Digoxin được xem xét để kiểm soát tần số trong nhịp nhanh nhĩ ở bệnh nhân có thai, nếu các thuốc chẹn beta thất bại và BN không có hội chứng WPW.
Chống chỉ định
– Nhồi máu cơ tim cấp.
– Block nhĩ thất độ II, III, nhịp chậm.
– Rung nhĩ ở bệnh nhân có hội chứng Wolff-Parkinson-White: digoxin rút ngắn thời kỳ trơ của đường phụ dẫn tới tăng số xung động của rung nhĩ đi qua đường phụ xuống tâm thất và như vậy tần số thất rất nhanh và có thể thoái triển thành rung thất.
– Hội chứng suy nút xoang.
Liều lượng và cách sử dụng
Liều lượng đường tĩnh mạch: 1,0-1,5 mg/24h, chia làm 2-3 lần, mỗi lần 1 ống 0,5 mg và cách nhau 8h. Sau khi đạt được hiệu quả, nên chuyển sang sử dụng thuốc đường uống để duy trì.
Liều lượng đường uống:từ 0,25-0,5 mg/24h chia làm 1-2 lần, khi đã đạt được hiệu quả kiểm soát tần số thất có thể chuyển sang liều duy trì.
Tương tác thuốc
– Các thuốc làm tăng nồng độ digoxin huyết thanh: amiodarone, quinidine, verapamil, propafenone, itraconazole, alprazolam, and spironolactone: khi sử dụng đồng thời phải xem xét giảm liều digoxin.
– Erythromycin, clarithromycin và tetracycline làm tăng sự hấp thu digoxin.
– Rifampicin làm tăng bài tiết digoxin qua thận.
– Các thuốc chẹn thụ thể beta giao cảm, chẹn kênh canxi nondihydropyridine, flecainide, disopyramide làm giảm dẫn truyền qua nút nhĩ thất nên khi sử dụng cùng digoxin có thể làm tăng nguy cơ block nhĩ-thất.
CÁC THUỐC CHỐNG RỐI LOẠN NHỊP MỚI
Vernakalant
Vernakalant là thế hệ đầu tiên trong AADs thế hệ mới, có các tác dụng điện sinh lý ưu tiên trên tâm nhĩ mà không có ở tâm thất. Các thuốc có tác dụng chọn lọc trên tâm nhĩ hiện đang được phát triển để khôi phục và duy trì nhịp xoang trong rung nhĩ, nhưng lại tránh được các tác dụng không mong muốn trên tâm thất, chẳng hạn như kéo dài thời gian QTc và xoắn đỉnh.
Biệt dược: Kynapid và Brinavess: ống 200 mg/10 mL.
Dược động học
Hoạt tính sinh học khả dụng: 50-60%
Được chuyển hóa chủ yếu bởi CYP2D6 và thải trừ chủ yếu qua thận
Thời gian bán hủy vào khoảng 3-5h.
Cơ chế tác dụng và tính chất dược lý
– Vernakalant có tác dụng chọn lọc trên tâm nhĩ và tác động vào nhiều kênh ion. Nổi trội hơn trong cơ chế tác dụng của vernakalant là khả năng ức chế các kênh kali, đặc biệt là nó ức chế chọn lọc kênh kali siêu nhanh (IKur) ở cơ nhĩ là kênh tham gia vào tái cực cơ nhĩ. Hơn nữa, ở nồng độ thấp, vernakalant ức chế dòng K+ chọn lọc nhĩ khác: kênh kali phụ thuộc acetylcholine (IKAch), qua trung gian Adenosine (IKATP), dòng Ito và dòng natri muộn (Ina). Những cơ chế này dẫn đến kéo dài thời gian điện thế hoạt động và kéo dài pha cao nguyên của ĐTHĐ cơ nhĩ.
– Vernakalant kéo dài đáng kể thời kỳ trơ có hiệu quả của cơ nhĩ nhưng ảnh hưởng không đáng kể tới giai đoạn trơ có hiệu quả của cơ thất.
– Thuốc cũng kéo dài thời kỳ trơ có hiệu quả của nút xoang và nút nhĩ-thất.
– Thuốc có hiệu quả khi tần số tim nhanh.
Tác dụng không mong muốn
– Vernakalant được dung nạp tốt, các tác dụng không mong muốn thường gặp là buồn nôn, rối loạn vị giác, dị cảm và hạ huyết áp, nhịp chậm.
– Không có biến cố xoắn đỉnh do thuốc gây ra trong các thử nghiệm ACT.
Chỉ định
– Hiện tại vernakalant sử dụng đường tĩnh mạch đã được phê chuẩn ở châu Âu để chuyển nhịp đối với rung nhĩ mới khởi phát về nhịp xoang ở người lớn (thời gian ≤ 7 ngày đối với bệnh nhân không phẫu thuật và thời gian ≤ 3 ngày đối với bệnh nhân sau phẫu thuật tim).
– Ở Hoa Kỳ, mặc dù FDA khuyến nghị chấp thuận vernakalant vào năm 2007, tuy nhiên loại thuốc này hiện nay không có sẵn cho sử dụng lâm sàng vì các dữ liệu về hiệu quả và an toàn đang được thu thập thêm.
– Ba thử nghiệm ngẫu nhiên, có đối chứng giả dược, mù đôi về tác dụng chuyển nhịp đối với các rối loạn nhịp nhĩ (ACT) đã đánh giá hiệu quả và độ an toàn của vernakalant truyền tĩnh mạch (dùng dưới dạng truyền tĩnh mạch trong 10 phút với liều 3 mg/kg, nếu sau 15 phút mà chưa cắt được cơn rung nhĩ, tiếp tục truyền trong 10 phút thứ hai với liều 2 mg/kg) để điều trị rung nhĩ. Các thử nghiệm ACT I và ACT III đã nghiên cứu vernakalant trong điều trị bệnh nhân bị rung nhĩ bền bỉ (thời gian > 3h, nhưng không quá 45 ngày). Hai thử nghiệm này bao gồm 612 bệnh nhân và nhận thấy rằng vernakalant có hiệu quả rõ rệt hơn so với giả dược để chuyển rung nhĩ về nhịp xoang. Trong thử nghiệm ACT I, 62% bệnh nhân sử dụng vernakalant đã chuyển về nhịp xoang so với 4,9% bệnh nhân dùng giả dược, trong 3-48h. Trong thử nghiệm ACT III, 51,2% bệnh nhân dùng vernakalant chuyển về nhịp xoang so với 3,6% bệnh nhân dùng giả dược trong 3h đến 7 ngày. Thời gian phục hồi nhịp xoang trung bình là 10 phút kể từ khi bắt đầu truyền và nhịp xoang được duy trì hơn 24h ở 97% bệnh nhân. Thử nghiệm ACT II đã đánh giá hiệu quả của vernakalant tiêm tĩnh mạch ở 150 bệnh nhân mắc rung nhĩ bền bỉ (thời gian 3-72h) xảy ra trong khoảng từ 24h đến 7 ngày sau phẫu thuật bắc cầu nối mạch vành và/hoặc phẫu thuật van tim và cho thấy rằng vernakalant có tác dụng chuyển rung nhĩ về nhịp xoang ở 47% số bệnh nhân so với 14% đối với giả dược.
– Thử nghiệm AVRO – Một nghiên cứu pha III đánh giá tác dụng của Vernakalant so với Amiodarone ở các đối tượng mắc rung nhĩ mới khởi phát) đã chia ngẫu nhiên 254 bệnh nhân bị rung nhĩ mới khởi phát gần đây (thời gian 3-48h) để điều trị bằng phương pháp tiêm truyền tĩnh mạch vernakalant hoặc tiêm truyền tĩnh mạch amiodarone đã chứng minh vernakalant đạt tỷ lệ chuyển nhịp vượt trội so với amiodarone (51,7% bệnh nhân sử dụng vernakalant chuyển về nhịp xoang sau 90 phút, so với amiodarone chỉ có 5,2%).
– Các dữ liệu hiện có cho thấy rằng vernakalant dường như không có hiệu quả trong cuồng động nhĩ hoặc rung nhĩ trong thời gian dài hơn (> 7 ngày). Các nghiên cứu đang được tiến hành để xác định hiệu quả và độ an toàn của chế phẩm dạng uống (5mg/kg).
Nghiên cứu, có tên là ACT 5, hiện nay đang bị đình chỉ do một bệnh nhân xuất hiện sốc tim. Nghiên cứu vẫn chưa được khởi động lại. Do vậy, vernakalant, nhờ vào tính chọn lọc trên tâm nhĩ, tỷ lệ chuyển nhịp cao và khía cạnh an toàn tuyệt vời, dường như là một thuốc quan trọng để chuyển nhịp bằng thuốc trong rung nhĩ, mặc dù vẫn chưa rõ liệu đã đến lúc ”phấn khích với ACT” ngay cả khi dạng uống vernakalant có trên thị trường.
Chống chỉ định
-Huyết áp tâm thu <100 mmHg.
-Suy tim nặng (NYHA III hoặc IV) hoặc EF <35% hoặc hẹp van ĐMC nặng.
-Hội chứng mạch vành cấp mới xảy ra trong vòng 30 ngày.
-Các thuốc chống RLNT nhóm I hoặc III được sử dụng đường TM <4h trước đó.
-Bệnh cơ tim phì đại tắc nghẽn hoặc bệnh cơ tim hạn chế.
-Tổn thương gan nặng nề.
Liều lượng và cách sử dụng
Liều khuyến cáo là tiêm truyền tĩnh mạch một liều 3 mg/kg, trong 10 phút. Sau 15 phút nếu rung nhĩ vẫn còn tồn tại có thể cho liều tiếp theo 2 mg/kg tiêm tĩnh mạch chậm trong 10 phút. Không cần chỉnh liều theo đặc điểm bệnh nhân hay thuốc dùng kèm theo.
Tedisamil
Tedisamil ức chế nhiều kênh kali, bao gồm IKr, IKs, IKur, Ito và IKATP và được phân loại là AADs nhóm III theo bảng phân loại của Vaughan Williams. Các kênh ion này có tác dụng kéo dài thời gian điện thế hoạt động và thời kỳ trơ của tâm nhĩ và tâm thất. Tuy nhiên, tác dụng của tedisamil dường như rõ rệt hơn ở tâm nhĩ. Tedisamil cũng làm chậm nhịp xoang và dường như có đặc tính chống đau ngực. Thời gian bán hủy của tedisamil là 8-13h. Thuốc không được chuyển hóa và được đào thải qua thận.
Một nghiên cứu nhỏ, ngẫu nhiên, có đối chứng với giả dược về đáp ứng liều ở 175 bệnh nhân đã chứng tỏ rằng tedisamil ở liều 0,4 và 0,6 mg/kg là vượt trội so với giả dược trong việc chuyển rung nhĩ mới khởi phát trở về nhịp xoang, với tỷ lệ chuyển nhịp là 41% cho nhóm được sử dụng liều 0,4 mg/kg và 51% cho nhóm được sử dụng liều 0,6 mg/kg. Hai bệnh nhân trong nhóm sử dụng tedisamil bị rối loạn nhịp thất (một trường hợp xoắn đỉnh và một trường hợp nhịp nhanh thất đơn dạng). Tedisamil có vẻ đầy hứa hẹn nhưng cần nhiều nghiên cứu hơn để đánh giá thêm về tính an toàn và hiệu quả của nó.
ivabradine" class="ftwp-heading">Ivabradine
Biệt dược: Procoralan, Corlanor: viên 5 mg; và 7,5 mg.
Dược động học
– Ivabradine có với giới hạn liều từ 0,5-24mg. Sau khi uống thuốc được hấp thu nhanh chóng và gần như hoàn toàn từ đường tiêu hóa. Nồng độ đỉnh trong huyết tương đạt được sau uống khoảng 1h. Hoạt tính sinh học khoảng 20-40 % vì thuốc được chuyển hóa mạnh kỳ đầu qua gan và ruột. Thức ăn làm chậm hấp thu ivabradine và làm tăng nồng độ trong huyết tương lên 20-40%. Thuốc liên kết với protein huyết tương khoảng 70%.
– Được chuyển hóa mạnh bằng cách oxy hóa ở gan và ruột bởi hệ thống Cytochrome P450 3A4. Chất chuyển hóa có hoạt tính của nó là N-desmethylate cũng được chuyển hóa bởi hệ thống CYP2A4.
– Ivabradine có ái lực thấp với CYP3A4 nên ít ảnh hưởng đến chuyển hóa của các thuốc khác. Tuy nhiên, các thuốc ức chế hoặc sinh CYP2A4 mạnh có thể ảnh hưởng đến nồng độ huyết tương và tác dụng của ivabradine và không nên sử dụng đồng thời.
– Đường thải trừ các chất chuyển hóa chủ yếu qua phân và thận. Chỉ 4% thải trừ dưới dạng không thay đổi qua nước tiểu.
– Thời gian bán hủy khoảng 2h.
Cơ chế tác dụng và tính chất dược lý
Tác dụng trên điện sinh lý tim
– Ivabradine ức chế chọn lọc kênh “bất thường” (funny channels) (kênh If) ở tim theo kiểu phụ thuộc nồng độ mà không ảnh hưởng đến các kênh ion khác như kênh kali và canxi.
– Các kênh If mở trong thì tái cực và đóng trong thì khử cực nên tác dụng của ivabradine phụ thuộc vào sự đóng mở của các kênh If và tần số tim. Bởi vậy thuốc thể hiện tác dụng kiểu phụ thuộc tình trạng sử dụng và có hiệu quả tốt hơn ở tần số tim nhanh.
– Ivabradine gắn vào bên trong kênh hoặc ở vị trí lỗ kênh phía bên ngoài tế bào dẫn đến làm giảm dòng Na+ đi qua kênh If dẫn tới giảm độ dốc điện thế tâm trương (pha 4) của nút xoang và làm chậm tần số phát xung của nút xoang.
– Dòng If khu trú ở nút xoang và là nơi giữ vai trò chủ nhịp của tim bởi vậy ivabradine là giảm sự phát xung của nút xoang dẫn đến giảm tần số tim, giảm tiêu thụ oxy cơ tim. Điều này cho phép cải thiện sự cung cấp oxy cho tim và làm giảm tình trạng thiếu máu, cho phép khả năng gắng sức tăng lên và giảm cơn đau thắt ngực.
– Ivabradine thể hiện tác dụng làm chậm tần số tim phụ thuộc liều kiểu đường thẳng cho đến liều 15-20 mg, hai lần/24h. Ở liều lượng cao hơn, tác dụng của ivabradine có xu hướng đi ngang nên làm giảm nguy cơ gây nhịp chậm nặng nề.
– Ivabradine kéo dài thời gian QT do nhịp tim chậm nhưng không làm kéo dài khoảng QTc.
– Không ảnh hưởng đến huyết áp, dẫn truyền trong tim, sức bóp cơ tim và tái cực thất.
Chỉ định
Ivabradine được chỉ định để:
– Giảm nguy cơ nhập viện vì suy tim ở những bệnh nhân người lớn bị suy tim mạn tính có triệu chứng, ổn định với phân số tống máu EF ≤ 35% và có nhịp xoang với tần số tim lúc nghỉ ≥ 70 nhịp/phút và đã được sử dụng liều dung nạp tối đa thuốc chẹn thụ thể beta giao cảm hoặc có chống chỉ định sử dụng thuốc chẹn thụ thể giao cảm beta.
– Thuốc cũng được chỉ định để điều trị suy tim có triệu chứng, ổn định do bệnh cơ tim giãn ở những bệnh nhân nhi từ 6 tháng tuổi trở lên.
– Điều trị nhịp nhanh xoang không tương thích.
– Điều trị đau thắt ngực cho những bệnh nhân có chống chỉ định thuốc chẹn thụ thể beta.
Nhịp nhanh xoang khi nghỉ ngơi có liên quan độc lập với tỷ lệ tử vong và các biến cố tim mạch lớn. Ivabradine là thuốc ức chế dòng If chọn lọc trong nút xoang, dẫn đến làm chậm nhịp xoang, mà không phụ thuộc vào trương lực hệ thần kinh thực vật.
Những kết quả từ thử nghiệm tiến cứu, ngẫu nhiên, mù đôi, có đối chứng giả dược trong điều trị suy tim tâm thu bằng bằng thuốc ức chế If ivabradine (SHIFT) cho những bệnh nhân bị suy tim ứ trệ (phân suất tống máu thất trái ≤ 35% và nhịp tim ≥ 70 nhịp/phút mặc dù đã được điều trị chuẩn bằng thuốc) đã chỉ ra rằng ivabradine (được điều chỉnh liều tối đa là 7,5mg hai lần/24h) có thể hạ thấp nhịp tim thường xuyên trong thời gian dài khi so sánh với giả dược phù hợp và đã cải thiện đáng kể tiêu chí chính của nghiên cứu là tử vong do tim mạch hoặc nhập viện vì suy tim nặng hơn.
– Trong nghiên cứu khá lớn này (n=6.558), số bệnh nhân nhập viện vì suy tim nặng lên (672 ở nhóm giả dược so với 514 ở nhóm sử dụng ivabradine; HR 0,74; 0,66-0,83; p <0,0001) và tử vong do suy tim (151 ở nhóm giả dược so với 113 ở nhóm sử dụng ivabradine; HR 0,74; 0,58-0,94; p= 0,014), rõ ràng là tốt hơn ở nhóm sử dụng ivabradine và có ít tác dụng không mong muốn nghiêm trọng.
-Nhóm dùng ivabradin có một vài tác dụng không mong muốn nghiêm trọng, như nhiều bệnh nhân trong nhóm ivabradine (5%) bị nhịp tim chậm có triệu chứng hơn so với nhóm giả dược (1%), p <0,0001.
Ivabradine, làm cho nhịp tim chậm hơn, có thể không có lợi cho tất cả các bệnh nhân có nguy cơ. Trong thử nghiệm ngẫu nhiên, tiến cứu, mù đôi, có đối chứng giả dược – BEAUTIFUL (Đánh giá tỷ lệ mắc bệnh – tử vong của thuốc ức chế If , ivabradine ở bệnh nhân mắc bệnh mạch vành và rối loạn chức năng thất trái), trong số 10.917 bệnh nhân bị bệnh động mạch vành và có phân suất tống máu thất trái dưới 40%, các kết quả không được cải thiện rõ ràng bằng ivabradine. Xem xét tiêu chí tổng hợp chính bao gồm tử vong do tim mạch, nhập viện vì nhồi máu cơ tim cấp và nhập viện vì khởi phát mới hoặc suy tim nặng hơn, ivabradine không ảnh hưởng đến tiêu chí tổng hợp chính nhưng ở những bệnh nhân có nhịp tim ≥ 70 nhịp/phút (bpm), điều trị bằng ivabradine đã làm giảm các tiêu chí phụ như: nhập viện vì nhồi máu cơ tim gây tử vong và nhồi máu cơ tim không tử vong (0,64; 95% CI 0,49-0,84; p=0,001) và tái thông mạch vành (0.70; 95% CI 0.52–0.93; p=0.016).
– Ivabradine, khi kết hợp với một thuốc ức chế thụ thể β, có thể có hiệu quả để ngăn ngừa đau thắt ngực.
– Ivabradine đã nổi lên như một phương pháp điều trị đầy hứa hẹn cho nhịp nhanh xoang không thích hợp (IST), bệnh lý đôi khi có thể gây suy nhược và không đáp ứng với các phương pháp điều trị khác. Trong một nghiên cứu tiến cứu, ngẫu nhiên, chéo của 21 bệnh nhân mắc IST có nhiều triệu chứng, sử dụng ivabradine (5 mg hai lần mỗi 24h) dẫn đến giảm tần số tim đáng kể khi nghỉ ngơi, khi đứng và hoạt động thể lực vừa phải và có đến hơn 70 % triệu chứng được giải quyết ở tất cả các bệnh nhân và loại bỏ hoàn toàn các triệu chứng ở 47% bệnh nhân. Ở những bệnh nhân đã sử dụng liều metoprolol dung nạp tốt, thêm ivabradine có vai trò hiệp đồng trong việc giảm tần số tim và giảm đáng kể các triệu chứng và cải thiện khả năng gắng sức. Khi so sánh với metoprolol, ivabradine làm giảm nhịp tim tương tự như metoprolol nhưng bệnh nhân dùng ivabradine có sự giảm đáng kể các triệu chứng, ivabradine cũng được chứng minh là có hiệu quả trong hội chứng nhịp nhanh tư thế (POTS).
Mặc dù vai trò chính xác của việc giảm nhịp tim bằng ivabradine vẫn còn chưa rõ ràng nhưng đối với những đối tượng phù hợp, có lẽ đã đến lúc nhìn nhận lại về ảnh hưởng của thuốc với điều trị nhịp tim nhanh.
Chống chỉ định
– Suy tim cấp mất bù.
– Hạ huyết áp rõ rệt hoặc sốc tim.
– Nhịp chậm rõ rệt.
– Hội chứng suy nút xoang, Block nhĩ thất độ II và III.
– Rối loạn chức năng gan nặng nề.
– Nhịp tim (nhịp nhĩ) phụ thuộc máy tạo nhịp.
– Sử dụng đồng thời với các thuốc ức chế mạnh CYP3A4
Thận trọng
– Ivabradine làm tăng nguy cơ gây rung nhĩ nên cần theo dõi nhịp tim đều đặn và ngừng thuốc nếu rung nhĩ xảy ra.
– Có thể gây nhiễm độc thai nhi khi dùng cho phụ nữ có thai nên những phụ nữ trong độ tuổi mang thai cần sử dụng các biện pháp tránh thai có hiệu quả khi sử dụng thuốc.
– Nhịp chậm và rối loạn dẫn truyền: Nhịp chậm có thể tăng nguy cơ kéo dài QT, dẫn tới rối loạn nhịp thất như xoắn đỉnh, đặc biệt ở những bệnh nhân có yếu tố nguy cơ như: rối loạn chức năng nút xoang, rối loạn dẫn truyền (Block nhĩ thất độ I, block nhánh); sử dụng các thuốc gây giảm nhịp tim như thuốc chẹn β, digoxin, diltiazem, verapamil, amiodarone, clonidine…
Liều lượng và cách sử dụng
– Liều lượng khởi đầu được khuyến cáo là 5 mg, 2 lần/24h, uống trong bữa ăn.
– Đánh giá lại bệnh nhân sau 2 tuần và chỉnh liều thuốc để đạt được tần số tim lúc nghỉ từ 50-60 nhịp/phút (Bảng 5.9). Việc điều chỉnh liều lượng (nếu cần thiết) nên dựa vào tần số tim lúc nghỉ và khả năng dung nạp thuốc.
Bảng 5.9: Điều chỉnh liều ivabradine.
| Tần số tim | Điều chỉnh liều lượng |
| >60 nhịp/phút | Tăng liều thêm 2,5 mg, 2 lần/24h. Liều tối đa 7,5 mg, 2 lần/24h – nếu cần thiết. |
| 50-60 nhịp/phút | Duy trì liều đang sử dụng. |
| <50 nhịp/phút | Giảm liều 2,5 mg, 2 lần/24h. Nếu liều hiện tại đang sử dụng là 2,5 mg, 2 lần/24h thì dừng thuốc. |
Tác dụng không mong muốn: Tác dụng không mong muốn xảy ra ở 1-10%, gồm:
– Nhịp chậm.
– Tăng huyết áp.
– Rung nhĩ.
– Giảm thị lực, phù mạch, ban đỏ, ngứa, chóng mặt.
– Hạ huyết áp.
– Xoắn đỉnh.
Tương tác thuốc
–Tương tác qua hệ thống CYP: Ivabradine được chuyển hóa chủ yếu bởi hệ thống CYP 3A4. Sử dụng đồng thời các thuốc ức chế CYP3A4 làm tăng nồng độ ivabradine và có thể gây nhịp chậm nặng nề. Các thuốc ức chế mạnh CYP3A4 được chống chỉ định sử dụng đồng thời với ivabradine như các thuốc chống nấm azole (ví dụ như itraconazole), các kháng sinh macrolide (clarithromycin) và nefazodone. Các thuốc ức chế CYP3A4 mức độ trung bình như verapamil, diltiazem và nước nho nên tránh sử dụng cùng ivabradine. Các thuốc sinh CYP3A4 như rifampicin, bacbiturate làm tăng nồng độ ivabradine.
–Tương tác giảm nhịp tim: Sử dụng đồng thời các thuốc làm giảm nhịp tim (như digoxin, amiodarone, chẹn thụ thể giao cảm β) làm tăng tác dụng làm chậm nhịp tim của ivabradine vì vậy cần theo dõi chặt chẽ tần số tim khi sử dụng đồng thời các thuốc này.
–Tương tác với máy tạo nhịp tim: Ivabradine làm giảm nhịp tim tới đích là 50-60 nhịp/phút. Bởi vậy không khuyến cáo sử dụng ivabradine cho bệnh nhân có máy tạo nhịp có đáp ứng tần số được cài đặt ở tần số >60 nhịp/phút.
Ranolazine
Ranolazine là một loại thuốc chống đau ngực được phê chuẩn để điều trị đau thắt ngực mạn tính ở những bệnh nhân không đáp ứng theo điều trị chống đau ngực tiêu chuẩn.
Cơ chế chống đau ngực của ranolazine được cho là do khả năng ức chế dòng natri muộn, do đó ngăn chặn sự quá tải canxi và natri gây ra do thiếu máu cục bộ. Ái tính chọn lọc này với dòng natri muộn đã dẫn đến việc ranolazine được nghiên cứu như một AADs mới.
Biệt dược: Ranexa: viên 500 mg.
Dược động học
– Hấp thu qua đường tiêu hóa ít bị ảnh hưởng bởi thức ăn. Nồng độ đỉnh trong huyết tương đạt được sau 2-6h.
– Hoạt tính sinh học khoảng 76%. Khoảng 62% gắn với protein huyết tương.
– Thuốc được chuyển hóa nhanh ở gan và ruột bởi hệ thống CYP 3A4 và có sự tham gia của CYP2D6. Đường thải trừ chủ yếu qua nước tiểu và một phần qua phân.
-Thời gian bán hủy khoảng 7h.
Cơ chế tác dụng và tính chất dược lý
Trong cơ tâm thất, ranolazine ức chế kênh natri muộn (INa muộn) và thành phần kích hoạt nhanh của IKr. Trong cơ tâm nhĩ, ngoài INa muộn và IKr, ranolazine cũng ức chế INa đỉnh. Ranolazine không có bất kỳ tác dụng nào đến IK1 và Ito. Ranolazine cũng không ảnh hưởng đến điện thế qua màng lúc nghỉ trong tâm nhĩ cũng như trong tâm thất. Ở nồng độ điều trị, biên độ và thời gian điện thế hoạt động trong tâm thất không bị ảnh hưởng, nhưng tốc độ tăng của pha 0 của điện thế hoạt động (Vmax) trong tâm nhĩ bị giảm đáng kể và thời gian điện thế hoạt động kéo dài. Thuốc kéo dài thời gian trơ hiệu quả, tăng ngưỡng kích thích tâm trương và giảm tốc độ dẫn truyền trong cơ tâm nhĩ.
Trong thử nghiệm nghiên cứu tác dụng chuyển hóa của ranolazine nhằm giảm thiếu máu ở bệnh nhân NSTEMI và huyết khối ở bệnh nhân nhồi máu cơ tim 36 (MERLIN 36), ranolazine làm giảm đáng kể tỷ lệ nhịp nhanh thất không bền bỉ và nhịp nhanh trên thất khi so sánh với giả dược. Các kết quả mới đây từ nghiên cứu trên chuột cho thấy rằng ranolazine khi phối hợp với dronedarone là một sự phối hợp có tiềm năng tốt để làm giảm rung nhĩ. Các nghiên cứu lâm sàng đã cho thấy rằng chỉ một liều 2g ranolazine đạt hiệu quả cao như phương thức tiếp cận “viên thuốc trong túi” trong điều trị rung nhĩ, có hiệu quả chuyển nhịp ở 77% bệnh nhân mà không có các tác dụng không mong muốn đáng kể. Những bệnh nhân này bao gồm cả các đối tượng mắc bệnh tim cấu trúc, có chống chỉ định với các thuốc nhóm Ic và điều này có thể có tiềm năng mở rộng chỉ định sử dụng cho ranolazine.
Những dữ liệu hiện có cho thấy rằng ranolazine có tính an toàn cao, ngay cả ở những bệnh nhân mắc bệnh tim cấu trúc. Mặc dù thuốc có thể chặn IKr và kéo dài khoảng QT, nhưng chưa thấy xảy ra trường hợp xoắn đỉnh nào, có thể là do ức chế INa muộn. Điều đang còn thiếu là một thử nghiệm ngẫu nhiên có đối chứng giả dược đánh giá hiệu quả chống loạn nhịp của ranolazine trong cả các rối loạn nhịp nhĩ và thất. Một nghiên cứu như vậy, thử nghiệm Ranolazine ở bệnh nhân cấy ICD (RAID), trong đó ranolazine được so sánh với các điều trị tiêu chuẩn để giảm rối loạn nhịp thất và tử vong ở bệnh nhân ICD hiện đang được tiến hành.
CÁC THUỐC CŨ CÓ THỂ ĐƯỢC LÀM MỚI TRỞ LẠI
Vẫn có thể có một vai trò nhất định cho các loại thuốc cũ, do có thể tác động đến các hội chứng lâm sàng và các bệnh lý kênh ion mà tới giờ mới được hiểu rõ.
Ví dụ, mặc dù khá hiếm gặp, hội chứng QT ngắn (SQTS) không thể được điều trị tốt bằng liệu pháp AADs tiêu chuẩn. Tuy nhiên, đối với hội chứng SQTS1, quinidine (hoặc disopyramide) có thể là thuốc duy nhất có thể có hiệu quả. Đối với hội chứng SQTS2,3, AADs nhóm III có thể có hiệu quả và đối với hội chứng SQTS4,5, quinidine do tác dụng ức chế kênh Ito, có thể cũng đem lại hiệu quả. Do tác dụng trên kênh Ito, quinidine có thể có hiệu quả đối với hội chứng Brugada.
Ngoài ra, propafenone dường như có lợi ích đặc biệt để điều trị rung nhĩ ở bệnh nhân mắc chứng SQTS. Đối với bệnh nhân mắc hội chứng QT dài (LQT3), mexiletine, flecainide hoặc ranolazine có thể là những thuốc có hiệu quả.
CÁC THUỐC CÓ CƠ CHẾ CHỐNG RỐI LOẠN NHỊP MỚI
Một số thuốc mới có đặc tính chống rối loạn nhịp tim đang trong các giai đoạn nghiên cứu tiền lâm sàng khác nhau. Các thuốc này gồm nifekalant, thuốc chẹn IKr, được sử dụng trong các rối loạn nhịp thất, một số thuốc ức chế kênh IKur (và đa kênh) (AVE0118, AZD7009 và NIP- 141/142), các thuốc ức chế dòng natri (pilsicainide), các thuốc tương tự amiodarone (celivarone, ATI-2042 và PM 101), các thuốc ức chế IKs chọn lọc (HMR1556) và các thuốc ức chế Kv1.5 (XEN-D0101).
Các loại thuốc khác, hoạt động theo cơ chế mới, cũng đang được phát triển như tertiapin-Q, một chất ức chế đặc hiệu dòng kali được điều hòa bởi acetylcholine ở tâm nhĩ; (IKACh), KB-R7943 hoạt động như một chất ức chế trao đổi natri/canxi, GsMTx-4 như một chất ức chế SAC (kênh co giãn), những chất điều chỉnh mối nối khoảng trống (rotigaptide, GAP-134), những chất đối kháng thụ thể serotonin 5-hydroxytryptamine (RS-100-302) và những thuốc tác dụng kéo dài trên các thụ thể adenosine A1 (tecadenoson và selodenoson).
Xem thêm:
Rung nhĩ mới khởi phát: Nguyên nhân, chẩn đoán và hướng dẫn điều trị theo BMJ
Sốc: Nguyên nhân, triệu chứng, chẩn đoán và hướng dẫn điều trị theo BMJ
CÂU HỎI LÂM SÀNG
Câu 1
Bệnh nhân nam 64 tuổi nhập viện do đánh trống ngực và choáng váng vài ngày trước. Ông ta đã từng có cơn đánh trống ngực trước đây nhưng hiện tại cơn kéo dài hơn và có cảm giác không thoải mái. Bệnh nhân không có đau ngực hay khó thở. Ông ta có tiền sử bệnh mạch vành và đã can thiệp mạch vành qua da trước đó. Đang điều trị bằng metoprolol, lisinopril, aspirin, clopidogrel và roustatin. Siêu âm tim thấy tâm thất trái giãn, EF 30% và không có bất thường về van tim. Nồng độ Natri 4.2 mEq/L và Magie 1.9 mg/dL. Trong 2 ngày nhập viện ông ta xuất hiện cơn đánh trống ngực khởi phát đột ngột, huyết áp 122/60 mmHg, anh ta tỉnh và không xuất hiện rối loạn. Thăm khám thấy phổi trong hai bên. ECG thấy như hình dưới đây, bước điều trị tiếp theo hợp lý nhất ở bệnh nhân này là?
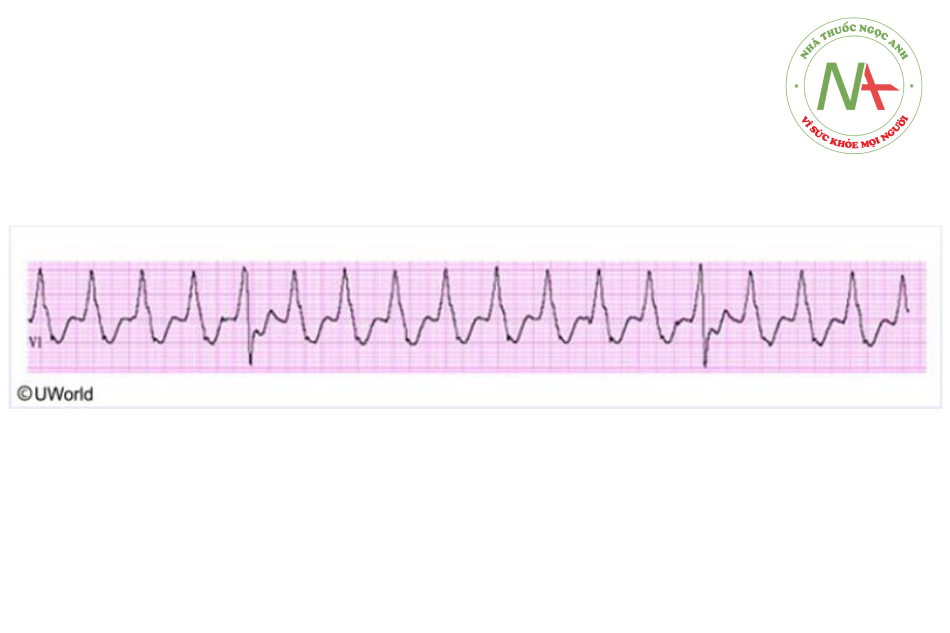
- Amiodarone.
- Xoa xoang cảnh.
- Digoxin.
- Sốc điện chuyển nhịp.
- Esmolol.
Đáp án đúng là A: Dạng sóng của bệnh nhân này thấy mạch nhanh phức bộ rộng với hai nhịp thoát thất (fusion beats), chẩn đoán ban đầu là mạch nhanh thất đơn dạng dai dẳng (Sustained monomorphic ventricular tachycardia, SVMT). Bệnh nhân mắc bệnh mạch vành và suy tâm thu tâm thất trái tăng nguy cơ rối loạn nhịp thất bao gồm nhịp nhanh thất và rung thất.
Điều trị ở bệnh nhân SVMT dựa vào triệu chứng và tình trạng huyết động. Bệnh nhân SVMT có lâm sàng và huyết động ổn định có thể bắt đầu điều trị bằng thuốc chống loạn nhịp. Truyền amiodarone thường được dùng, một số chất khác (procainamide, sotalol, lidocaine) được dùng cho bệnh nhân không có đáp ứng với amiodarone. Thuốc chống loạn nhịp có thể chuyển SVMT thành nhịp xoang và nên tránh cho việc dùng sốc điện chuyển nhịp.
Đáp án B: Xoa xoang cảnh là thủ thuật có hiệu quả trong ngừng mạch nhanh trên thất kịch phát thường là mạch đều, phức bộ hẹp và nhịp thoát thất thì không thấy.
Đáp án C: Digoxin được sử dụng để kiểm soát nhịp ở bệnh nhân rối loạn nhịp trên thất (rung nhĩ, cuồng nhĩ, mạch nhanh nhĩ) đặc biệt ở bệnh nhân hạ huyết áp và/hoặc suy tim không có đáp ứng với chẹn beta và chẹn kênh canxi. Tuy nhiên, thuốc không được chỉ định ở bệnh nhân SVMT và có thể làm tệ hơn tình trạng rối loạn nhịp thất.
Đáp án D: Bệnh nhân với loạn nhịp nhanh dai dẳng có triệu chứng nặng (thay đổi tình trạng tinh thần, suy tim cấp và phù phổi, cơn đau ngực do thiếu máu) hoặc huyết động không ổn định (hạ huyết áp, dấu hiệu sốc) nên được điều trị bằng sốc điện chuyển nhịp ngay lập tức. Bệnh nhân có VF hoặc VT vô mạch nên được điều trị bằng khử rung ngay lập tức (sốc điện không đồng bộ). Bệnh nhân này có huyết động ổn định và không cần sốc điện chuyển nhịp cấp.
Đáp án E: Esmolol là thuốc chẹn beta có tác dụng rất ngắn được sử dụng để kiểm soát nhịp nhanh trong rung nhĩ hoặc cuồng nhĩ. Không có vai trò trong điều trị SVMT.
Tổng kết:Bệnh nhân ổn định có mạch nhanh phức bộ rộng có thể bắt đầu điều trị bằng thuốc chống loạn nhịp (amiodarone, procainamide, sotalol, lidocaine). Sốc điện chuyển nhịp đồng bộ được chỉ định ở bệnh nhân có mạch nhanh kéo dài có triệu chứng nặng (mất tỉnh táo, suy tim cấp, phù phổi, đau ngực do thiếu máu) hoặc huyết động không ổn định (hạ huyết áp, shock).
Câu 2
Nam 65 tuổi mắc bệnh thiếu máu cơ tim đến viện do 2 tuần nay tăng dần những cơn khó thở và ho khan. Một tuần trước, ông ta được hướng dẫn tăng liều furosemid nhưng nó có vẻ không có tác dụng. Ông ta không có đau ngực và khó thở khi nằm. Ông ta bị nhồi máu cơ tim cách đây 5 năm và suy giảm chức năng tâm thất trái với phân suất tống máu còn 20%, được lắp một máy khử rung tự động (AICD). 6 tháng trước, bệnh nhân đến nhập viện do sốc bởi nhịp nhanh thất sau đó được điều trị dứt điểm bằng thuốc chống loạn nhịp.
Bệnh nhân không sốt, huyết áp 122/70 mmHg, mạch 68 lần/ph. Da niêm mạc ẩm, tĩnh mạch cổ xẹp khi ngồi, ran ẩm ở hai bên vào khi thở ra, tim không có tiếng thổi. Không phù ngoại biên. Xquang ngực thẳng: phổi hai bên thâm nhiễm xuất phát từ giữa phổi. Nguyên nhân có khả năng nhất gây ra các triệu chứng trên là gì?
- Suy tim tiến triển.
- Nhiễm độc thuốc chống loạn nhịp.
- Nhiễm độc thuốc lợi tiểu.
- Giảm chức năng van 3 lá.
- Viêm phổi điển hình.
Đáp án đúng là B:
| Các tác dụng phụ chính của amiodarone | |
| Tim mạch | -Nhịp chậm xoang, block tim
-Nguy cơ tiền loạn nhịp: QT kéo dài hoặc nguy cơ xoắn đỉnh. |
| Hô hấp | -Viêm phổi kẽ mạn (ho, sốt, khó thở, viêm phổi kẽ) thường gặp |
| Nội tiết | -Cường giáp
-Suy giáp |
| Đường tiêu hóa/gan | -Tăng men gan, viêm gan |
| Mắt | -Bệnh thần kinh mắt |
| Da liễu | -Biến đổi màu sắc da xanh-xám |
| Thần kinh | -Bệnh thần kinh ngoại biên |
Biểu hiện lâm sàng của bệnh nhân này: khó thở tăng dần, ho khan, ran ẩm hai bên phổi và hình ảnh xquang phù hợp với viêm phổi kẽ do dùng amiodarone. Xquang ngực hỗ trợ chẩn đoán với sự biểu hiện lan tỏa dạng lưới mờ đục. Đo chức năng hô hấp cho thấy sự giảm thiểu dung tích CO2
khuếch tán (DLCO).
Amiodarone là thuốc chống loạn nhịp nhóm 3 thường được sử dụng để điều chỉnh rối loạn nhịp thất ở bệnh nhân có bệnh động mạch vành và nhồi máu cơ tim. Nó có thể có nhiều tác dụng phụ và cần theo dõi các chỉ số liên tục (như TSH). Một số biểu hiện của nhiễm độc phổi do amiodarone bao gồm viêm phổi kẽ mãn tính (thường sau nhiều tháng), hội chứng suy hô hấp cấp, chảy máu động mạch lan tỏa, hạch phổi, và khối đơn độc.
Đáp án A: Suy tim tiến triển không giải thích được biểu hiện khó thở hay tĩnh mạch cổ nổi, phù ngoại biên và giảm đáp ứng với thuốc lợi tiểu.
Đáp án C: Nhiễm độc thuốc lợi tiểu là kết quả của mất dịch trong lòng mạch biểu hiện bằng sự mất nước (khô màng nhầy), mất cân bằng điện giải (giảm K hoặc Mg máu) có thể tiến triển và thỉnh thoảng có đánh trống ngực. Thâm nhiễm hai bên phổi cũng không được ghi nhận.
Đáp án D Suy giảm chức năng van 3 lá gây ra tiếng thổi tâm thu liên tục ở gian sườn trái và dấu hiệu của suy tim phải như gan to, phù ngoại biên, tĩnh mạch cổ nổi.
Đáp án E: Viêm phổi điển hình là một trong những chẩn đoán phân biệt ở bệnh nhân nhiễm độc amiodarone. Tuy nhiên, thiếu triệu chứng sốt, thời gian triệu chứng sau điều trị loạn nhịp và hình ảnh xquang ngực đều nghĩ tới nhiễm độc amiodarone hơn.
Tổng kết: Nhiễm độc tại phổi là một tác dụng phụ nặng do quá trình sử dụng kéo dài amiodarone có thể xảy ra vài tháng từ sau khi bắt dầu điều trị. Viêm phổi kẽ do amiodarone biểu hiện với khó thở tăng dần, ho khan, mờ đục ở hình ảnh Xquang.
TÀI LIỆU THAM KHẢO
- G.-A. Dan et al : Antiarrhythmic drugs – Clinical use and clinical decision making: a consensus document from the European Heart Rhythm Association (EHRA) and European Society of Cardiology (ESC) Working Group on Cardiovascular Pharmacology, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS) and International Society of Cardiovascular Pharmacotherapy (ISCP). Europace (2018) 20, 731–732.
- Kanu Chatterjee; Eric J Topol (2015): Drugs for Dysrhythmias in Cardiac drugs: second edition- Jaypee Brothers Medical Publishers, p.342-402; 2015.
- Peter S. Fischbach and Srikant Das (2015): Pharmacology of Antiarrhythmic Agents; in Clinical Cardiac Electrophysiology in the Young – Springer Science+Business Media; second edition; pp.336-359.
- Lionel H Opie et al: Drugs for the Heart-eighth edition -2013-Elsevier.
- Benedict M. Glover; Pedro Brugada (2016) – Clinical Handbook of Cardiac Electrophysiology – Springer – 2016.
- M. Gabriel Khan- Cardiac Drug Therapy-Springer.
- Ziad F. Issa, John M. Miller, Douglas P. Zipes (2019): Clinical arrhythmology and electrophysiology : A Companion to Braunwald’s Heart disease , Third edition, Elsevier.
- Brian Olshansky (2017):Treatment of Arrhythmias in arrhythmia essential, second edition, Elsevier.
- Douglas. P. Zipes (2018): Cardiac electrophysiology-from cell to bedside – Seventh Edition -2018 by Elsevier.
- Antidysrhythmic Electrophysiology and Pharmacotherapy in cardiac intensive care.
- Douglas P. Zipes-Braunwald’s Heart Disease – A Textbook of Cardiovascular Medicine [2018] Copyright © 2019 by Elsevier Inc.
- Clinical Use of Digitalis: A State of the Art Review-Thomas F. Whayne J -American Journal of Cardiovascular Drugs (2018); pp.
- Vernakalant hydrochloride in the treatment of atrial fibrillation: a review of the latest clinical evidence.
- Antiarrhythmic Drugs-mankad-2019-Med Clin N Am 103 (2019) 821–834.
- Pamela K. Mason, Rohit Malhotra (2019): Antidysrhythmic Electrophysiology and Pharmacotherapy- in cardiac intensive care: – David L. Brown, Third edition- 2019 by Elsevier, Inc.
- Shoshana Zevin : Pharmacologic Interactions in cardiac intensive care- David L. Brown, Third edition- 2019 by Elsevier, Inc.

