Sản xuất Dược phẩm
Các chất độc hữu cơ: Nguyên nhân gây độc, triệu chứng và cách xử trí
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: Giáo sư. Tiến sĩ Dược sĩ Thái Nguyễn Hùng Thu.
Bài viết các chất độc hữu cơ trích trong chương 4 sách độc chất học – giáo trình đào tạo dược sĩ đại học bộ môn độc chất trường Đại học Dược Hà Nội.
Mục tiêu học tập
- Trình bày được nguyên nhân gây ngộ độc và độc tính của một số hợp chất hữu cơ dễ bay hơi (cyanogen, ethanol, methanol, benzen…), dược chất và dược liệu cỏ độc tỉnh cao (barbiturat, lá ngón, strychnin và mã tiên, nicotin và thuốc lá…) và một số độc tố thường gặp trong thực phẩm (aflatoxin, cả nóc và tetrodotoxxin …).
- Giới thiệu được triệu chứng ngộ độc, cách xử trí ngộ độc và các biện pháp đề phòng nhiễm độc các hợp chất hữu cơ kể trên.
- Trình bày được nguyên tắc của những phương pháp có thể phân tích các chất độc đã nêu trên.
Khác với các chất độc vô cơ, các chất độc hữu cơ rất đa dạng về cấu trúc. Tác động của chúng trên sinh vật và cơ thể người cũng rất khác nhau. Nguồn gốc của các chất độc hữu cơ có thể có sẵn trong tự nhiên, được tổng hợp hay bán tổng hợp.
Có rất nhiều chất độc hữu cơ là các dược chất. Các hợp chất này có tác dụng dược lý nhưng dễ gây ngộ độc nếu sử dụng không đúng hoặc do liều tác dụng và liều độc quá gần nhau.
Dưới đây là nguồn gốc, các tác động, phương pháp phân tích và xử trí các trường hợp ngộ độc của một số chất độc hữu cơ thường gặp tạm chia thành các nhóm như sau:
– Một số chất độc hữu cơ dễ bay hơi (hoặc dạng khí ở nhiệt độ thường).
– Một số dược chất và dược liệu có độc tính cao phân lập bằng cách chiết xuất ở môi trường acid hay chiết xuất ở môi trường kiềm.
– Một số độc tố thường gặp trong thực phẩm.
Ma túy va hoa chất bảo vệ thực vật đa số cũng là các chất độc hữu cơ được giới thiệu riêng trong các chương tiếp theo.
1. Một số chất độc hữu cơ dễ bay hơi
1.1. Acid cyanhydric và các chất cyanogen
1.1.1. Nguồn gốc, nguyên nhân gây độc
Nguồn gốc:
Các chất cyanogen trong những điều kiện nhất đinh một chất khí rất độc.
Acid cyanhydric (HCN) là một chất lỏng linh động sôi ở 20°C, đông đặc ở -14°C. Có mùi hạnh nhân, rất dễ tan trong nước và rượu.
Trong phòng thí nghiệm có thể điều chế HCN bằng cách cho tác dụng của kali ferocyanid với H2SO4 đặc: Đun cách cát 10g kali ferocyanid với 8g H2SO4 và 14mL nước, HCN cho qua ống đựng CaCL2 để sấy và hứng vào bình.
Khi nung các base nitơ với carbonat kiềm cũng cho cyanid. Đây cũng là phản ứng phát hiện nitơ trong mẫu thử.
Trong tự nhiên một số cây chứa hợp chất hữu cơ có chứa các chất cyanogen như: hạnh nhân đăng, nhân quả mận đào, lá anh đào, sắn củ, măng tre nứa, nấm, một số bộ phận của đậu ngự Phaseolus lunatus… Các dẫn xuất cyanogen này thường là glycosid được chia thành ra làm hai nhóm chính:
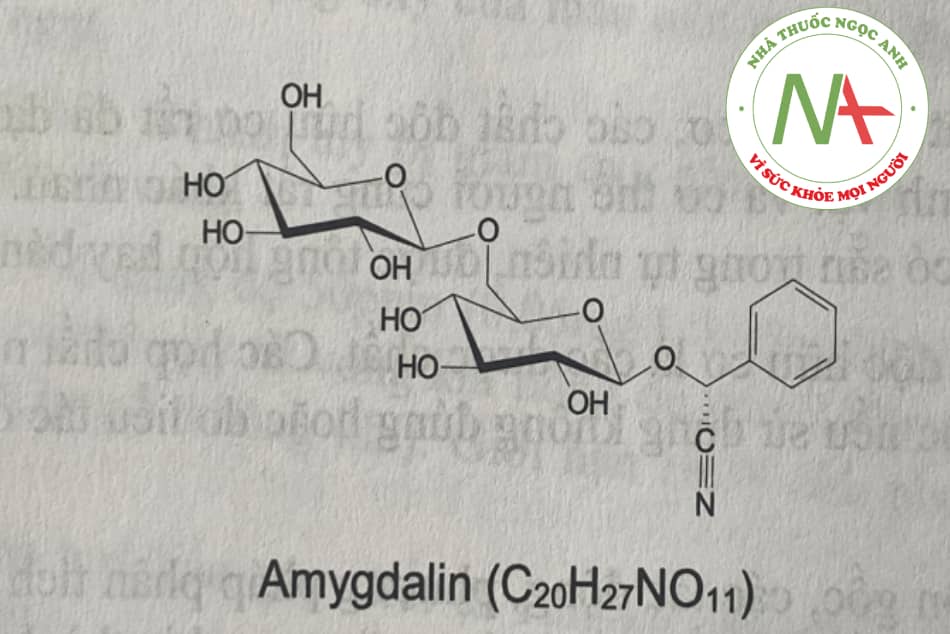
– Nhóm hạnh nhân đắng: gồm các glycosid như amygdalin, iso amygdalin, amygdonitri gluxit, prulyaurosin, sambunigrin… Khi thủy phân ngoài HCN còn tạo ra aldehyd benzoic. Tiêu biểu cho nhóm này là hạt hạnh nhân đắng chứa 1,64% dầu và có thể cho đến 0,24g acid cyanhydric. Dầu hạnh nhân đắng chứa amygdalin (C20H27NO11) dưới tác dụng của enzym emulsin (synaptase) thủy phân cho HCN, glucose và aldehyd benzoic:
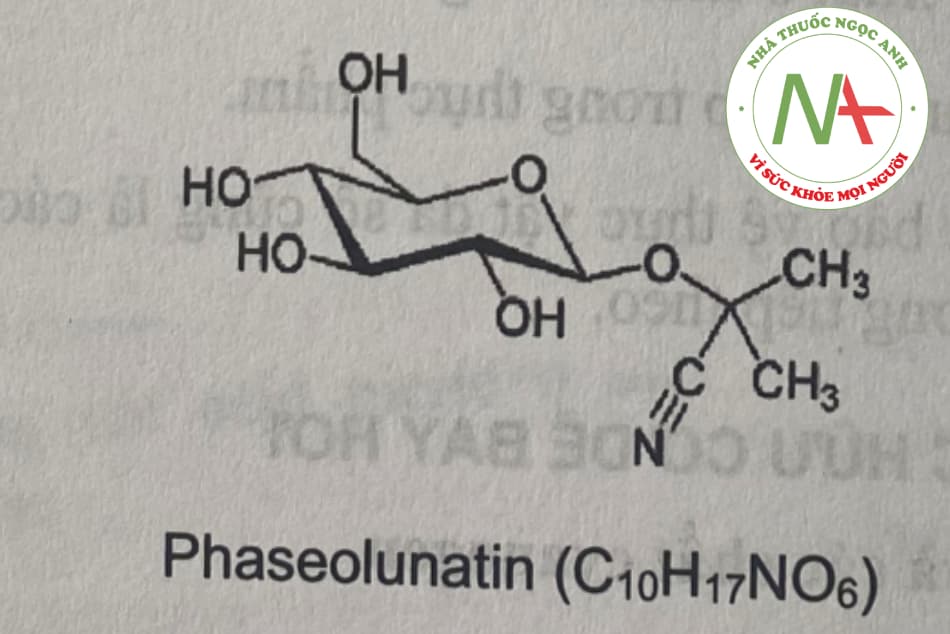
C10H17NO6 + H2O -> C6H12O6 + CH3COCH3 + HCN
Ở nước ta trong sắn củ và măng cũng chứa nhiều acid cyanhydric ở thể kết hợp. Măng tươi có thể chứa đến 0,035% HCN, nhưng sau khi luộc chỉ còn 0,027%. Ở sắn tỉ lệ rất thay đổi, có loại chứa đến 0,01% HCN (sắn độc) nhưng sắn lành chỉ chứa khoảng 0,002% HCN.
Trong công nghiệp các cyanogen có thể được dùng để luyện quặng, mạ kim loại, sản xuất chất dẻo, thủy tinh… có trong dung dịch rửa ảnh, chất đánh bóng bạc và kim loại, keo dán sắt. Các cyanid thường được dùng như: KCN, NaCN, Ca(CN)2
Trong nông nghiệp các cyanogen có thể được dùng làm thuốc trừ sâu, diệt cỏ, diệt chuột, diệt côn trùng… như calci cyanid Ca(CN)2.
Trong y học có thể gặp ở các thuốc giãn mạch, trí cao huyết áp như natri nitroprussid (Na2 [Fe(CN)5NO]), thuốc trị giang mai như Hg(CN)2, nước cất anh đào (chứa 0,1% HCN).
Trong chiến tranh thế giới thứ hai, acid cyanhydric được dùng làm vũ khí hoá học dưới tên gọi là Zyklon. Hiện nay có nhiều chất độc chiến tranh chứa cyanid.
Nguyên nhân gây ngộ độc:
– Có thể là do tự sát hoặc bị đầu độc bằng acid cyanhydric hoặc muối cyanid gây chết rất nhanh và hữu hiệu.
– Môi trường bị nhiễm độc khi dùng các cyanogen để diệt côn trùng, diệt chuột.
– Do ăn phải một số thực phẩm có hàm lượng cyanid cao như: măng, sắn, hạt hạnh nhân đắng, nấm độc…
– Do tai biến khi sử dụng các thuốc có thể giải phóng HCN như: truyền natri nitroprussid nhanh hay kéo dài.
– Do tiếp xúc nhiều với môi trường có nồng độ HCN cao nhưng thiếu các biện pháp phòng hộ.
1.1.2. Cơ chế gây độc, triệu chứng và cách xử trí
Cơ chế gây độc:
Acid cỵanhydric là chất độc cực mạnh, có tác dụng gây độc thuộc loại nhanh nhất trong các chất độc, hấp thu tốt qua nhiều đường hô hấp, da, màng nhầy…
Acid cyanhydric làm liệt hô hấp tế bào do tác dụng vào các enzym cytocromoxydase, ngăn cản sự vận chuyển electron trong chuỗi hô hấp tế bào. Cyanid tạo phức hợp với hem của cytocrom, ngăn cản sự kết hợp với oxy của hem. Tế bào bị hủy hoại do không được sử dụng oxy của máu nên máu ở tĩnh mạch vẫn đỏ tươi mất người bệnh vẫn bị ngạt.
Trung tâm hô hấp ở hành tủy bị giảm oxy nhiều nhất nên ngừng thở là nguyên nhân chủ yếu dẫn đến tử vong.
Liều độc: HCN ở nồng độ 50ppm (0,05mg/L không khí) có thể gây ngộ độc cấp qua đường hô hấp, có thể gây tử vong khi nồng độ trên 150ppm và gây diệt ngay với nồng độ 300ppm (0,3mg/L không khí). Giới hạn HCN cho phép trong không khí nơi làm việc là 5ppm. Qua đường tiêu hóa liều gây chết là 1mg/kg cân nặng. Muối KCN có LD cho người lớn là 0,15-0,20g.
Trong quá trình bảo quản, acid cyanhydric và các muối của nó không bền dễ bị phân hủy. Khí CO2 của không khí đây HCN ra khỏi muối cyanid kiềm. Trong dung dịch nước HCN bị phân hủy dần do các phản ứng sau:
HCN + 2H2O -> HCOONH4 (amoni formiat)
HCN + H2S + O -> HSCN + H2O
Các muối cyanid kiềm dễ tan trong nước, khi có mặt acid (kể cả acid yêu) sẽ giải phóng ra HCN. Ngược lại muối Hg(CN)2 rất bền, acid mạnh không giải phóng được CN nhưng khi vào cơ thể, dưới tác dụng của men, muối Hg(CN)2 bị phân huỷ tạo ra HCN cho nên rất độc đối với người và động vật.
Các muối phức như ferocyanid, fericyanid thường dùng trong phòng thí nghiệm, rất bền vững, đều rất ít độc.
Các glycosid khi vào cơ thể dưới tác dụng của enzym cũng có thể giải phóng ra HCN gây ngộ độc.
Triệu chứng ngộ độc:
Ngộ độc cấp cyanid xảy ra rất nhanh khi hít phải HCN hay uống các muối cyanid ở liều cao. Trung tâm hành tuỷ bị liệt, nạn nhân ngã ra bất tỉnh, cứng gáy, co giật, thở ngắt quãng, nhanh chóng trụy tim mạch, ngừng thở và chết rất nhanh (có thể chỉ sau 1 -2 phút).
Nếu lượng cyanid ít hơn thì gây chóng mặt, nhức đầu, buồn nôn, có cảm giác lo lắng, sợ hãi nhưng vẫn tỉnh táo. Sau đó xuất hiện triệu chứng rối loạn thần kinh, co giật, giãn đồng tử, cứng hàm, ngạt thở, nhịp thở chậm dần, mặt tái xám (hội chứng cyanogen), chân tay lạnh, trụy tim mạch. Nạn nhân có thể chết trong vòng 30 phút. Nếu sống sót cũng bị tổn thương ở tim và để lại các di chứng về thần kinh.
Ngộ độc mạn tính thì thường xuyên bị đau đầu, nôn và chóng mặt.
Xử trí ngộ độc:
Nếu ngộ độc do hơi HCN:
– Phải đeo mặt nạ phòng độc rồi đưa người bệnh ra khỏi vùng nhiễm độc.
– Làm hô hấp nhân tạo, cho thở oxy hay hỗn họp carbogen.
– Tiêm thuốc trợ tim (cafein, camphor, niketamid…), nếu có trụy tim mạch có thể tiêm thẳng uabain vào tim.
– Điều trị các triệu chứng hôn mê, hạ huyết áp, co giật… nếu có.
Ngộ độc qua đường tiêu hoá:
– Cho uống than hoạt;
– Gây nôn;
– Rửa dạ dày bằng KMnO4 0,2%, uống thêm than hoạt và thuốc tẩy nhẹ. -ộ* ngộ độc qua đường da:
– Cởi bỏ quần áo;
– Rửa vùng da bị nhiễm độc với nhiều nước và xà phòng.
Điều trị:
– Sử dụng thuốc giải độc (bộ KIT antidote) gồm amyl nitrit và natri nitrit: Hít ống chứa amyl nitrit (tạo ra methemoglobin có nồng độ 5%). Tiêm tĩnh mạch dung dịch natri nitrit với liệu để tạo ra methemoglobin có nồng độ khoảng 20-30%. Liều được đề xuất là 300mg/10mL với người lớn, 6mg/kg với trẻ em.
Cơ chế giải độc cyanid: Oxy hóa hemoglobin thành methemoglobin, chất này có kha năng kết hợp với cyanid tự do tạo thành cyanomethemoglobin. ngoài ra tác dụng giãn mạch cũng tăng cường giải độc cyanid.
Chú ý, methemoglobin cũng là chất độc đối với cơ thể nên không nên sử dụng khi triệu chứng nhẹ hay chẩn đoán chưa chắc chắn, đặc biệt nếu có nghi ngờ nhiễm độc đồng thời carbon monoxyd. Nếu cần thiết dùng thì liều natri nitrit không được tạo ra methemoglobin quá 25%.
– Tiêm tĩnh mạch 50mL natri thiosulfat 25%: thúc đẩy sự biến đổi cyanid (CN~) thành thiocyanat (SCN–) ít độc và đào thải dễ dàng hơn. Cách dùng này dựa trên kinh nghiệm và tương đồi an toàn, ngay cả khi chẩn đoán chưa chắc chắn. Đây cũng là cách làm giảm nhẹ sự ngộ độc do tiêm truyền nitroprussid.
– Ngoài ra có thể tiêm dưới da 5mL dung dịch xanh methylen 1% pha trong dung dịch glucose 30%; tiêm tĩnh mạch 20mL dung dịch natrí hyposulfit 25% hay vitamin B12a (hydroxycobalamin, chất này có thể kết hợp với cyanid để tạo thành cyanocobalamin-Vitamin B12 không còn độc tính).
1.1.3. Phương pháp phân tích
Các phản ứng định tính:
Dựa vào tính chất hoá học của cyanid, một số phản ứng được sử dụng để phát hiện sự có mặt của các cyanid như:
Phản ứng Grignard:
Nguyên tắc: Gốc cyanid có thể gắn vào các hợp chất poly nitrophenol (dinitrobenzen, acid picric…) cho sản phẩm màu. Ví dụ:
Cho HCN phản ứng với acid picric ở môi trường kiềm sẽ tạo ra hợp chất isopurpurin có màu đỏ cam:
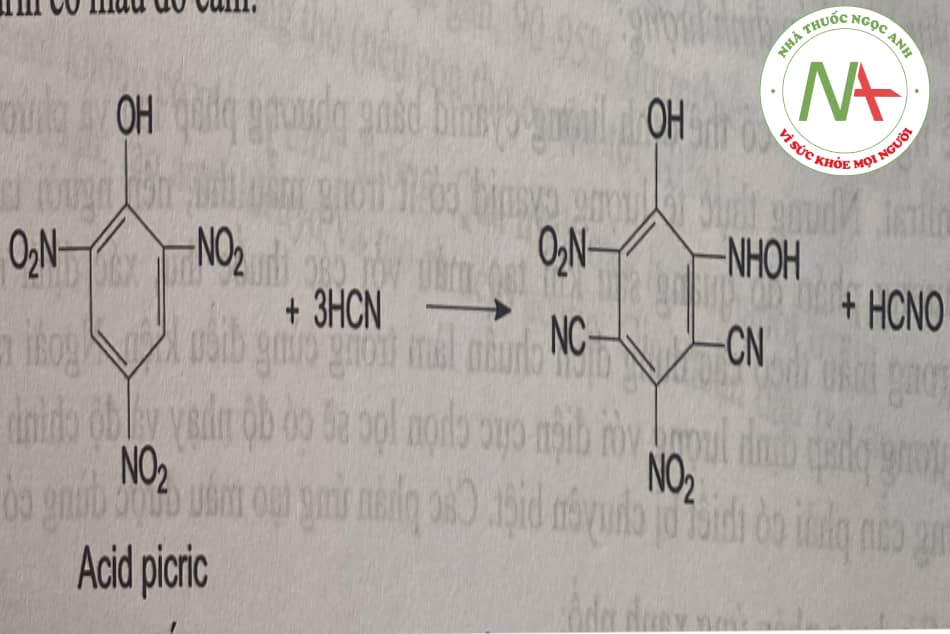
Phản ứng này rất nhạy và đặc hiệu, có thể dùng để phát hiện HCN trong không khí.
Phản ứng thường được làm trên giấy Cho bằng giấy vào dung dịch acid Diene bảo hòa, sau cho vào dung dịch Na2C03 10%. Ép khô giấy vào giữa hai tờ giấy lọc và phơi khô trong tối, giấy sẽ có màu vàng. Để dễ nhận sự chuyển màu người ta cải tiến bằng cách cho nửa băng giấy vào dung dịch acid acetic 10% để trung hòa carbonat, vùng này không nhạy với HCN để so sánh với nửa bằng giấy còn lại.
Phản ứng xanh phổ:
Nguyên tắc: Trong mồi trường kiềm, cyanid phản ứng với ion Fe2+ tạo ra Fe(CN)64-. Khi có mặt ion Fe3+ sẽ tạo ra phức feriferocyanid Fe4[Fe(CN)6]3 có màu xanh phổ (Phản ứng xanh phổ).
Lấy 1-2 mL dung dịch chứa cyanid, kiềm hoá (nếu cần) bằng vài giọt dung dịch KOH 10%. Thêm vài giọt dung dịch FeSO4 10%. Lắc đều và đun nhẹ. Để nguội, thêm dung dịch HCl 10% đến khi tan kết tủa sắt hydroxyd. Nếu có HCN sẽ có màu xanh phổ.
Để dễ nhận màu có thể thêm vài giọt dung dịch BaCl2 và H2SO4 loãng. BaSO4 kết tủa sẽ hấp phụ màu (ly tâm, quan sát màu của tủa BaSCL). Trường hợp nồng độ cyanid quá thâp màu chưa xuất hiện ngay, cần phải đợi 1-2 giờ có khi phải lâu hơn.
Phản ứng Schoenbein: (Christian Friedrich Schonbein)
Nguyên tắc: Với các muối Cu2+, HCN phản ứng tạo ra đồng cuprocyanid và giải phóng oxy:
4HCN + 3 CuSO4 + H2O -> (CNCu)2(CN)2Cu + 3H2SO4 + 1/2 O2
Oxy mới sinh phản ứng với các chất khử cho sản phẩm có màu. Một số phản ứng định tính cyanid dựa vào nguyên tắc này. Ví dụ:
Dùng giấy tẩm dung dịch đồng sulfat 0,1%, sấy khô. Khi dùng cho một giọt dung dịch nhựa gaiac mới pha 2% trong cồn, đặt băng giấy gần mẫu thử. Nếu có cyanid giấy sẽ có màu xanh.
Phản ứng này không đặc hiệu nên chỉ có giá trị khẳng định âm tính do các chất oxy hoá như H2O2, ozon, clor… các nitrogen oxyd cũng cho phản ứng tương tự.
Độ nhạy của phản ứng 0,005 mg%. Nếu nồng độ cyanid thấp thì màu chưa xuất hiện ngay, cần đợi 15-20 phút. Đê tăng độ nhạy người ta đã thay nhựa gaiac bằng dung dịch benzidin acetat. Giấy đồng benzidin có thể chuẩn bị sẵn: pha dung dịch gồm 20mL dung dịch benzidin acetat 1% với 2mL dung dịch đồng acetat 3%. Ngâm giấy vào dung dịch trên và phơi khô, khi dùng thì thấm nước.
Các phương pháp định lượng:
Về nguyên tắc có thể định lượng cyanid bằng phương pháp iod và phương pháp đo bạc nitrat. Nhưng thực tế lượng cyanid có ít trong mẫu thử, nên người ta thường dùng phương pháp đo quang sau khi tạo màu với các thuốc thử, xác định nồng đo cyanid trong mẫu theo các dung dịch chuẩn làm trong cùng điều kiện. Ngoài ra có thể dùng phương pháp định lượng với điện cực chọn lọc sẽ có độ nhạy và độ chính xác cao hơn nhưng cần phải có thiết bị chuyên biệt. Các phản ứng tạo màu được dùng có thể:
– Sử dụng phản ứng xanh phổ;
– Tạo màu với thuốc thử p-nitrobenzaldehyd và o-dinitrobenzen. Phản ứng nhạy và rất đặc hiệu Có thể định lượng được đến 30mcg% cyanid trong mẫu thử. Tiến hành như sau:
Chuẩn bị dung dịch A (0,775g p-nitrobenzaldehyd/100mL methyl cellulose) và dung dịch B (0,84g o-dinitrobenzen/100 mL methyl cellulose).
Cho 0,1 mL mẫu thử (máu, huyết tương, huyết thanh, nước tiểu, mật, dịch não tủy….) vào ống nghiệm có sẵn 5mL dung dịch A và thêm 0,5mL dung dịch B. Lắc nhẹ. Ly tâm (3000 vòng/phút trong 3 phút). Lấy 0,5 mL nước trong, thêm 0,05mL dung dịch NaOH 0,05N. Trộn đều. Sau 15 phút đo mật độ quang của dung dịch màu tím với mẫu trắng làm cùng điều kiện.
Cần chú ý:
– Ở nồng độ 50 mcg% các triệu chứng nhiễm độc cyanid thể hiện rõ rệt nên trong ngộ độc cấp cyanid người ta thấy nồng độ trong máu thường trong khoảng 50 – 200mcg%. Người hút thuốc lá nồng độ cyanid trong máu có thể lên đến 0,lmg/L, tiêm truyên nhanh nitroprussid có thể tạo ra nồng độ cyanid trong máu đến 1 mg/L.
– Trong cơ thể, nồng độ HCN có thể bị giảm rất nhanh do nhiều nguyên nhân như: các chất đường và aldehỵd phá hủy HCN, khí H2S chuyển HCN thành sulfocyanid. Cho nên lượng cyanid tìm thấy trên tử thi thường nhỏ hơn thực tế, nhiều khi không tìm thấy. Do vậy một lượng rất ít HCN tìm thấy trong tử thi cũng có một ý nghĩa rất quan trọng không thể bỏ qua.
1.2. Ethanol
1.2.1. Nguồn gốc, nguyên nhân ngộ độc
Nguồn gốc:
Ethanol (C2H5OH) là một chất lỏng không màu, mùi hắc, vị cay. Khối lượng riêng ở 15°C là 0,7943, sôi ở 80,26 °C. Ethanol tan trong nước ở bất kỳ tỷ lệ nào. Ethanol là dung môi của nhiều chất hữu cơ và vô cơ, dễ cháy ngoài không khí tạo ra CO2 và nước.
Ethanol có mặt trong tất cả các loại rượu thường dùng trong xã hội ở những tỷ lê khác nhau: 2-6% trong bia, 10-20% trong rượu vang, 25-30% trong rượu tự cat 50-70% trong rượu mạnh như rượu rum. Việc uống rượu quá liều dẫn tới say, gây ra rửiưng hậu quả tai hại (tai nạn giao thông, mất trật tự xã hội…), uống quá nhiều có thể tử vong.
Quá trính hấp thu và nguyên nhân ngộ độc:
Sau khi uống rượu 30 phút đến 1 giờ, ethanol chuyển nhanh vào máu, đi tới các cơ quan. Ngươi ta đa nhạn thay nồng độ ethanol trong máu, thân và vỏ não tương đương nhau, còn ờ gan ít hơn.
Rượu uống vào hấp thu ngay ở dạ dày 20% và ờ ruột 80%. Tỷ lệ hấp thu có thể tới 60% trong 30 phút đầu tiên và 90% trong 90 phút nếu ‘dạ dày rỗng. Nhưng nếu dạ dày có chứa chút thức ăn bánh, sữa thì tốc độ hấp thu sẽ chậm đi nhiêu. Sau khi vào máu, chuyển hóa nhanh bằng oxy hóa tại gan, 90-95% được biến đổi và thải qua thận phân còn lại loại trừ qua đường thờ (nếu còn thờ có thể tới 10%).
Ethanol không có giá trị dinh dưỡng. Quá trình oxy hóa ethanol trong cơ thể xảy qua hai giai đoạn: tạo acetaldehyd và tạo ra acid acetic. Giai đoạn đầu tạo acetaldehyd kích thích tiết adrenalin, tiết ra acid hydrocloric ở dạ dày. Vì vậy uống ít rượu thì tăng quá trình tiêu hoá (khai vị), uống nhiều rượu sẽ ức chế tiết ra pepsin (một men tiêu hóa protid ở dạ dày), cho nên người uống rượu thường xuyên hay bị đau bụng, rối loạn tiêu hoá. Giai đoạn này xảy ra rất chậm quyết định tốc độ chuyển hóa của ethanol trong cơ thể. Các thuốc ức chế quá trình oxỵ hóa này có thể điều trị cho người nghiện rượu. Giai đoạn hai tạo ra acid acetic xảy ra rất nhanh.
Về mặt hô hấp tế bào, quá trình khử hydro của ethanol là do sự tham gia của các enzym chuyển hóa hydro như: cytocrom, flavonprotein, glutation. Vitamin B1 và nhất là vitamin PP và adenin nằm trong thành phần các enzym này tham gia tích cực trong quá trình oxy hoá ethanol nên bị tiêu hao nhiều. Đó là nguyên nhân những người nghiện rượu thường gặp các bệnh viêm đa dây thần kinh.
Đa phần các trường hợp ngộ độc là do dùng quá nhiều rượu.
Liều độc của ethanol rất thay đổi, tùy từng người, ước lượng khoảng 300g uống trong một giờ.
1.2.2. Cơ chế gây độc, triệu chứng và cách xử trí
Cơ chế gây độc và triệu chứng ngộ độc:
Nồng độ ethanol táng rất nhanh trong máu, nửa giờ sau khi uống nồng độ trong máu cực đại, từ phút thứ 50, nồng độ giảm dần cho đến bình thường. Với người nặng 70kg uống 30g ethanol, sau 45 phút nồng độ trong máu là 0,06-0,09%; sau 5 giờ giảm xuống còn 0,03%; sau 8-12 giờ trở lại bình thường.
Có nhiều thuốc làm nặng thêm việc ngộ độc ethanol như: các barbiturat, morphin và opioid, cloralhydrat, thuốc chống co giật, thuốc chống trầm cảm, kháng histamin, clopropamid, tolbutamid…
Trừ trường hợp người bệnh hôn mê hoặc rối loạn chức phận gan, ethanol đào thải nhanh khỏi cơ thể sau khi bị oxy hoá. Với người uống trung binh (nong độ ethanol trong máu khoảng 0,2%), sau 4-5 giờ lượng ethanol trong máu còn lai là 75% sau 6 giờ chỉ còn 50% và sau 8 giờ còn lại khoảng 30%.
Giai đoạn đầu có trạng thái kích động, thực chất là do buông lỏng những ức chế sẵn có. Người bệnh trở nên nói nhiều, vui vẻ, cười to, cãi nhau, có khi bữa bãi, bẩn thỉu.. nhưng cũng có người bệnh khi uống rượu lại trở nên ủ rũ, ít nói… Nồng độ ethanol lúc này trong máu thường từ 50-150mg%. Giai đoạn này nguy hiểm không phải cho người bệnh mà cho người xung quanh (như người lái xe say xe).
Giai đoạn nặng hơn mất phối hợp khi nồng độ ethanol 150-250mg%: phối hợp động tác kém, người bệnh khó làm một số động tác đơn giản như xâu kim, đi thẳng, đưa tay lên mũi, viết, nói nhầm lẫn câu nọ sang câu kia…
Giai đoạn hôn mê khi nồng độ khoảng 250mg%. Hôn mê yên lặng, mất các phản xạ gân xương, đồng tử giãn, mạch nhanh, huyết áp và thân nhiệt thường hạ. Nặng hơn khi nồng độ 400-500mg% đồng tử co, thở khò khè, huyết áp tụt rồi liệt tủy. Có hai dấu hiệu quan trọng cho điều trị là nhiễm toan chuyển hóa (acid lactic và acid acetic tăng) và hạ glucose huyết. Nếu hô mê kéo dài quá 5 giờ sẽ rất nguy hiểm, tử vong thường đến trong 10 giờ đầu.
Ngộ độc: uống nhiều rượu gây say, không chủ động được động tác, gây nôn, giảm sút sự nhạy cảm tâm thần. Nếu uống liều lớn trí thông minh giảm dần, tuần hoàn giảm, tình trạng thái tê liệt, giãn đồng tử, mất phản xạ, hôn mê trong vài giờ va suy nhược.
Ngộ độc cấp có thể gây tử vong do biến chứng ngạt, viêm màng não, sung huyết
phổi.
Nếu người thường xuyên uống rượu kê cả khi uống ít, cũng co the dan bi gay xơ gan, tôn thương tim, tim to và thoái hoá mỡ.
Xử trí ngộ độc:
Trong các trường hợp nhẹ (hai giai đoạn đầu): để người bệnh ngủ khô thoáng và yên tĩnh, người bệnh sẽ tự giải độc và phục hồi nhanh chóng. Có thể cho uống cafe hay nước chè đặc, nếu cần thiết rửa dạ dày bằng natri bicarbonat 5%, tây hoặc thụt.
Trong những trường hợp nặng chủ yếu là điều trí hỗ trợ, ngoài cách săn sóc chung cần chú ý thêm:
– Hô hấp nhân tạo sẽ có thêm lợi ích tăng thải ethanol qua đường hô hấp và giảm nhiễm toan bằng thở nhiều.
– Gây nôn và rửa dạ dày.
– Truyền nhiều nước để bù lượng mất đã mất do tiểu nhiều. Nên truyền các dung dịch glucose ưu trương 20-30% để chống hạ glucose huyết, chống tăng áp lực sọ, truyền
các dung dịch kiềm như natri bicarbonat, THAM (tris hydroxymethyl amin methan) để chống toan huyết.
– Điều trị hôn mê hay co giật nếu có.
1.2.3. Phương pháp phân tích
Các phản ứng định tính:
Sau khi phân lập khỏi mẫu thử bằng cách cất có thể xác định ethanol bằng các phản ứng sau:
– Phản ứng tạo iodoform: Vầng iod trong môi trường kiềm oxy hoá ethanol thành acetaldehyd. Sau đó iod sẽ the hydro tạo ra dẫn xuất triodo acetaldehyd. Dẫn xuất này sẽ phân hủy trong môi trường kiềm tạo ra iodoform có mùi đặc biệt và khi có nhiều ethanol sẽ kết tủa màu vàng.
– Phản ứng oxy hoá ethanol bằng KMnO4: trong môi trường H2SO4, ethanol bị KMnO4 oxy hoá thành acetaldehyd. Hơi aldehyd này bay lên sẽ làm xanh giấy tẩm natri nitroprussid và pyridin.
– Phản ứng oxy hóa ethanol bằng K2Cr2O7: trong môi trường acid mạnh, ethanol bị K2Cr2O7 oxy hóa thành acid acetic. Nếu thiếu hoặc vừa đủ dicromat dung dịch có màu xanh cảu icon Cr3+. Nếu thừa dicromat dung dịch có màu xanh lơ.
Các phương pháp định lượng:
Phương pháp phù hợp nhất để định lượng ethanol trong phân tích độc chất là sử dụng săc ký khí. Túy nhiên khi không đủ điều kiện về trang thiết bị có thể dựa vào tính chất vật lý và hoá học của ethanol để định lượng. Có hai nhóm phương pháp thường dùng là dựa vào tỷ trọng và dựa vào tính chất hoá học của riêng nhóm -OH hoặc cả phân tử ethanol. Sau đây là một số phương pháp thường được sử dụng:
Phương pháp đo bằng tửu kế: Nếu có được dung dịch ethanol trong nước với nồng độ khá cao thì có thể dùng tửu kế đo độ cồn, rồi từ đó suy ra lượng ethanol.
Phương pháp này thường được áp dụng với các mẫu có nồng độ ethanol khá lớn như trong các loại rượu, các sản phẩm đông dược… Lấy một thể tích mẫu xác định đem cất cho đến khi hết ethanol. Thêm nước vào dịch cất được cho đến khi có thể tích bằng mâu ban đầu được lấy. Đo độ cồn dung dịch thu được bằng tửu kế. Độ cồn đo được cũng là độ cồn trong mẫu nghiên cứu.
Phương pháp lắng: Nguyên tắc của phương pháp cất phân đoạn nhiều lần để làm giàu ethanol. Hứng dịch cất vào ống chia độ có tinh thể kali carbonat khan và phenolphtalein. Nước trong dịch cất bị K2CO3 khan hút tạo thành dung dịch bão hoà. Ethanol không tan trong dung dịch này sẽ nổi lên trên kéo theo màu đỏ của phenolphtalein trong kiềm. độc thể tích lớp màu đỏ ở phía trên và tính ra lượng ethanol trong mẫu thử.
Để định lượng được chính xác hơn, người ta rút hết lớp rượu ở trên thêm 5mL nước. Đem cất vi phân đoạn lấy 3mL và định lượng bằng phương pháp hoá học. Khi tính toán hiệu chỉnh thể tích ethanol bị dung dịch K2CO3 giữ lại là 0,02mL.
Phương pháp lắng có ưu điểm: Đơn giản và nhanh chóng; loại trừ các chất khử khác có mặt trong mẫu thử (trừ aceton và methanol ở nồng độ trên 2%); có thể định lượng ethanol trong mẫu thử đã thối rữa mà các phương pháp khác không giải quyết được.
Tuy vậy nhược điểm của phương pháp là phải làm với lượng mẫu lớn (50mL máu, 100g mẫu thử khác…), nồng độ phải trên 0,1% mới cho kết quả tin cậy.
Phương pháp dicromat:
Ở nhiệt độ thường hơi ethanol hoặc nước tiểu của người uống rượu làm dung dịch K2Cr2Ơ7 trong H2SO4 đặc chuyển từ màu vàng qua xanh nâu. Đó chính là phản ứng oxy hoá rượu:
C2H5OH + O2 -> CH3COOH + H2O
Nhiều nghiên cứu nhằm xác định các điều kiện phản ứng để thu kết quả chính xác như: nhiệt độ, nồng độ H2SO4, thời gian phản ứng, xác định điểm kết thúc dựa vào K2Cr2O7 hoặc CH3COOH tạo thành… Sau nhiều kết quả nghiên cứu người ta đã xác định được trong phản ứng này 1 mL K2Cr2O7 0,1N ứng với 11,5mg ethanol.
Phương pháp Gettler-Umberger:
Dùng khí CO2 đi qua dung dịch ethanol (đun sôi) và dung dịch HI 70% (đun ở nhiệt độ 130-135°C), ethanol sẽ chuyển thành ethyl iodid. Dẫn xuất C2H5I này qua bình rửa đựng natri thiosulfat, sau đó qua bình đựng brom và kali acetat hoà tan trong acid acetic đặc và một ít nước. Sản phẩm thu được từ phản ứng là HIO3.
Cho thừa KI, định lượng iod được giải phóng (nhờ HIO3) bằng Na2S203. Một phân tử ethanol tạo ra 6 nguyên tử iod.
Phương pháp Friedmann- Klass: Dịch cất đầu tiên được trộn với H2SO4 và Ca(OH)2 rồi cất lại để loại aceton. Lấy một phần dịch cất cho thêm 25mL dung dịch KMnO4 0,1 N và 10mL dung dịch NaOH 5N. Để ở nhiệt độ 100°C trong 20 phút. Sau khi nguội, acid hoá thêm KI thừa và chuẩn độ bằng dung dịch natri thiosulfat.
Phương pháp Harger: Dùng KMnO4 trong H2SO4 oxy hoá ethanol ở nhiệt độ thường (1 mL KMnO4 0,05N và 10mL H2SO4 16N). Lấy dịch chất chuẩn độ thẳng bằng dung dịch KMnO4 0,05N đến màu hồng, 1 mL dung dịch KMnO4 0,05N ứng với 0,16g ethanol.
Phương pháp enzym alcohol dehydrogenase: Enzym alcohol dehydrogenase (ADH) có thể lấy từ gan hoặc men rượu, men bia. Khi có mặt diphosphopyridin nucleotid (DPN), enzym sẽ oxy hóa ethanol thành acetaldehyd và DPNH2.
Phản ứng này thuận nghịch. Để cho phản ứng hoàn toàn người ta đưa vào semicarbazid (NH2NHCONH2) liên kết với acetaldehyd và giữ pH 8,6- 9,6 (bằng dung dịch đệm). Xác định lượng DPNH2 bằng đo quang ở 340nm.
Phương pháp này rất đặc hiệu, cho kết quả tốt từ 5 – 50 μg ethanol, có thể định lượng thăng trong huyết thanh không màu. Nếu mẫu thử là máu thì phải loại protein hoặc cất.
Phương pháp nitrit:
Dùng dung dịch NaNO2 và HCl, nitroso hóa ethanol thành C2H5ONO. Chiết xuất C2H5ONO bằng CCl4.
Giải phóng nitrit từ dẫn xuất này và định lượng bằng cách cho HNO2 phản ứng với acid sulfanilic tạo ra muối diazoni sau đó ngưng tụ với a-naphthylamin tạo ra phẩm màu azoic. Bằng phương pháp đo quang xác định lượng ethanol trong mẫu thử.
Trong số các phương pháp hoá học trên, phương pháp ADH được coi là đặc hiệu nhất. Phương pháp alkyl iodid của Gettler – Umberger khá đặc hiệu, vì phản ứng do nhóm alkoxy. Phương pháp nitrit cho kết quả tương đối tốt nhưng quá trình chiết phức tạp, mất nhiều thời gian. Phương pháp dicromat chịu ảnh hưởng nhiều của chất khử, đặc biệt là aceton có thể có mặt trong máu đến 100mg%. Với nồng độ này chỉ tương ứng với 6mg% ethanol trong phương pháp dicromat. Do sai số không quá nhiều, cách làm lại đơn giản nên phương pháp dicromat được ứng dụng phổ biến trong thực tế.
Định lượng rượu trong không khí: hút không khí với tốc độ 4-5L/giờ dẫn vào hai bình nối tiếp nhau đựng dung dịch Cordebard (hoà 5g K2Cr2O7 trong 100g acid nitric). Lấy dung dịch trong hai bình gộp lại pha loãng với đồng thể tích nước cất, để yên 30 phút. Định lượng K2Cr2O7 dư bằng phương pháp iod: cho KI thừa, định lượng iod giải phóng bằng dung dịch natri thiosulfat 0,1N. lmL dung dịch Na2S203 0,1N ứng với 1,15mg ethanol. Nồng độ tối đa cho phép là 1000mg/m3.
Cách đơn giản để đo nồng độ rượu của người điều khiển phương tiện giao thông như sau: Cảnh sát lấy hơi của tài xế cho vào dụng cụ chứa sẵn hỗn hợp K2Cr2O7 và H2SO4. Nguyên tắc của phương pháp này là dựa trên sự oxy hóa ethanol có trong hơi thở bởi K2Cr2O7 và H2SO4. Áp suất riêng phần của ethanol trong hơi thở của người lái xe được oi là tỉ lệ thuận với hàm lượng ethanol trong máu. Phương trình hóa học của phản ứng như sau:
3CH3CH20H+2K2Cr2O7+8H2S04 -> 3CH3C00H + 2Cr2(S04)3+ 2K2SO4+ 8H2O

Nồng độ cồn trong hơi thở ở mức 10-100mg/100mL sẽ tương ứng với nồng độ cồn trong máu 0 1-10 g/L. Tác dụng của ethanol lên cơ thể người tùy thuộc vào đặc điểm của cơ thể vào each uống. Có người chỉ uống một ít là bị say và chóng mặt. Ngược lại có người chịu được liều rất cao. Vì vậy dựa vào nồng độ rượu trong máu hoặc trong hơi thở của người uống rượu để xác định người đó có bị say rượu hay không là việc làm không đơn giản. Tuy vậy người ta thấy nếu nồng độ trong máu 0,07-0,20% là ngộ độc thực sự, còn vùng có dấu hiệu suy nhược là 0,035-0,1%. Nếu nồng độ trong máu là 0,1% tức là ở tình trạng say; 0,2% là say và ngộ độc nhẹ; trên 0,2% là say rõ; trên 0,4% là say nặng và trên 0,5% sẽ chết vì ngộ độc cấp.
Quy định về nồng độ cho phép của ethanol trong máu của người lái xe ôtô ở các nước khác nhau cũng có sự khác nhau dao động trong khoảng 0,05% (Nauy) đên 0,15% (Đức, Mỹ).
1.3. Methanol
1.3.1. Nguồn gốc, nguyên nhân gây độc
Nguồn gốc:
Methanol (CH3OH) là một chất lỏng không màu, khối lượng riêng 0,796 ở 15°C, sôi ở 66°C. Có mùi và các tính chất lý học khác tương tự ethanol nhưng độc hơn rất nhiều.
Methanol được chế biến bằng cách cất từ gỗ. Methanol ít phổ biến hơn ethanol, chỉ được dùng trong các phòng thí nghiệm, làm nguyên liệu và dung môi trong công nghệ hoá học. Tuy nhiên vẫn thường gặp hiện tượng ngộ độc do nhiều nguyên nhân khác nhau: tiếp xúc với không khí có nhiều hơi methanol, uống nhầm hay dùng loại rượu có nhiều tạp chất là methanol….
Nguyên nhân gây ngộ độc:
Ngộ độc cấp chủ yếu là do uống nhầm (tưởng là rượu) hay uống phải rượu có lẫn methanol.
Ngộ độc trường diễn xảy ra do hít phải hơi methanol khi làm việc lâu trong môi trường có chất này.
Liều độc cho người lớn là 30-100mL methanol.
1.3.2. Cơ chế gây độc, triệu chứng và cách xử trí
Cơ chế gây độc, liều độc và triệu chứng:
Methanol sau khi xâm nhập vào cơ thể được phân bố khắp các cơ quan: tim, gan, phổi, óc và thận. Trong ngộ độc trường diễn methanol lại được tích luỹ ở ngộn các dây thần kinh thị giác làm rối loạn chức năng.
Methanol tích lũy rất lâu trong cơ thể và chuyển dần thành aldehyd formic và acid formic, sau đó mới bị oxy hóa thành CO2 và nước. Aldehyd formic liên kết với nhóm NH2 cua protem, ức chế hoạt tinh enzym. Acid formic liên kết với các enzym có nhân Fe gay ngưng hô hấp tế bào (đặc biệt là tế bào thần kinh và thị giác), ngoài ra còn có thể gây nhiễm acid cấp.
Methanol không gây ra con say như ethanol nhưng nó nguy hiểm hơn ơ hai mặt: tích lũy trong cơ thể rất iau (lâu hơn ethanol 15 lần) và các sản phẩm chuyển hóa gây ảnh hưởng đối với nhiều enzym.
Triệu chứng:
– Ngộ độc cấp tính: Nạn nhân chóng mặt, nhức đầu buồn ngủ. Sau đó nôn (có thể nôn ra máu), đau bụng, tiêu chảy, mặt và môi tím xám, huyết áp hạ, khó thở, đồng tử giãn, phù phổi. Cuối cùng nạn nhân hôn mê, co giật các cơ, nhiệt độ hạ, chết do ngạt thở.
– Ngộ độc mạn tính: ngoài các rối loạn vê tiêu hóa còn có các rối loạn về thị giác, thần kinh thị giác bị teo, giảm thị lực và có thể dẫn đến mù hẳn.
Xử trí ngộ độc:
Những trường hợp hít phải hơi methanol thường là nhẹ và không cần xử trí gì ngoài việc kéo người bệnh ra khỏi môi trường độc.
Uống phải methanol bị ngộ độc nặng hơn nhiều.
Xử trí ngộ độc cấp: Nếu không hôn mê thì gây nôn cho người bệnh, rửa dạ dày bằng NaHCO3. Để nằm chỗ ấm và tránh ánh sáng, chống nhiễm toan huyết bằng cách tiêm truyền tĩnh mạch NaHCO3 (3mL dung dịch 5% cho 1 kg cơ thể).
1.3.3. Phương pháp phân tích
Các phản ứng định tính :
Phân lập methanol từ mẫu thử bằng cất bay hơi tương tự ethanol. Lây dịch cât làm một số phản ứng sau:
– Phản ứng ester hoả: Cho methanol phản ứng với p-bromobenzyl clorid với sự có mặt của NaOH 10%. Đun nóng sẽ tạo ra methyl p-bromobenzoat, tinh thể (có độ chảy 77°C) trong khi đó ethyl p-bromobenzoat là một chất lỏng.
– Phản ứng oxy hoá:
Methanol bị oxy hoá thành acid formic dưới tác dụng của hỗn hợp sulfocromic nóng hoặc nitro cromic nguội.
Nếu dùng KMnO4 ở môi trường H2SO4 (hoặc H3PO4) cũng có thể oxy hóa bằng dây đồng đốt nóng thì sản phẩm oxy hoá chủ yếu là formaldehyd. Phản ứng này được dùng để phân biệt với ethanol, phát hiện formaldehyd tạo thành bằng:
– Phản ứng với acid cromotropic (acid 1,8 dihydroxyl naphthalen disulfonic 3,6) trong môi trường H2SO4 cho màu tím đỏ.
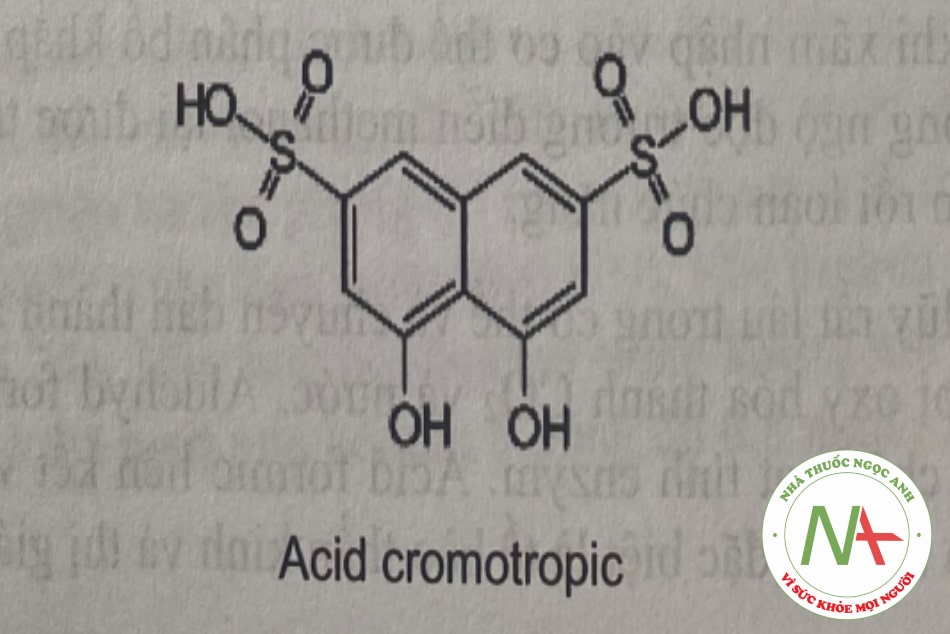
– Thuốc thử Marki (formaldehyd trong H2SO4 đặc) sẽ cho màu tím đỏ.
– Thuốc thử Schiff cho màu tím sẫm.
– Phản ứng với phenylhydrazin và natri nitroprussiat trong môi trường kiềm sẽ có màu xanh.
Các phương pháp định lượng:
Cũng tương tự như ethanol, phương pháp sắc ký khí là phương pháp định lượng thích hợp nhất với methanol trong phân tích độc chất. Các phương pháp định lượng methanol khác đều dựa vào phản ứng oxy hoá nó thành formaldehyd sau đó định lượng bằng phương pháp đo quang với thuốc thử Schiff hoặc acid cromotropic.
Ví dụ theo TCVN 9637-7:2013, quá trính định lượng dựa trên nguyên tắc: oxy hóa methanol thành formaldehyd bằng dung dịch kali permanganat trong acid phosphoric. Formaldehyd tạo thành được tạo màu với acid cromotropic. Đo quang của dung dịch màu tím thu được ở bước sóng 570 nm.
Dung dịch kali permanganat 3% trong acid phosphoric (15,5 mL dung dịch acid orthophosphoric; ρ=1,69 g/mL cho 100 mL).
Dung dịch acid cromotropic chuẩn bị tại thời điểm sử dụng. Hòa tan 0,1 g acid cromotropic hoặc muối dinatri của nó trong 10 mL nước. Trong khi làm lạnh, thêm 90 mL acid sulfuric (ρ=1,81 g/mL, dung dịch khoảng 90% (theo khối lượng) và lắc đều.
Làm phản ứng tạo màu bằng cách thêm vào mỗi ống thử 1,0 mL dung dịch kali permanganat và sau 15 phút thêm 0,6mL dung địch dinatrí disulfit. Các dung dịch này sẽ không có màu. Làm mát với đá, thêm 10,0 mL dung dịch acid cromotropic, gia nhiệt (cách thủy) kiểm soát nhiệt độ khoảng 70°c trong khoảng 20 phút. Đo mật độ quang của các đung dịch ở 570nm và tính kết quả.
Phương pháp này áp dụng cho các sản phẩm có hàm lượng methanol từ 0,01 % đến 0,20% (theo thể tích).
1.4. Benzen và các hydrocarbon thơm
1.4.1. Nguồn gốc, nguyên nhân gây độc
Hydrocarbon thơm là những sản phẩm của than đá, trong thực tế là một hỗn hợp của các chất benzen, toluen, xylen. Hỗn hợp này còn được gọi là benzol. Nó được dùng làm dung moi hoa tan cao su, mỡ, pha chế sơn, vecni, mực… và còn là nguyên liệu cho tổng hợp hữu cơ.
Benzen là một hợp chất hữu đặc biệt có công thức C6H12, tạo nên một vòng không no khá Sự bền vững của benzen và tính độc hại của chúng là một trong những nguy cơ nhiễm bẩn môi trường, đặc biệt là khi nó được dùng làm dung môi thông dụng trong công nghiệp và các phòng thí nghiệm. Benzen là một chất lỏng không màu dễ bay hơi, SÔI ở 80,2°c, nhẹ hơn nước (d=0,879). Hơi benzen nặng hơn không khí 1 lít hơi benzen nặng 3,25ẹ. Hỗn hợp hơi benzen trong không khí với tỉ lệ 1,4 – 6% có thể tạo hỗn hợp nổ. Có thể ngửi mùi benzen ở nồng độ 0,8mg/L ít tan trong nước, dễ tan trong các dung môi hữu cơ, đặc biệt benzen là dung môi rất tốt hoà tan được nhiều chất như mỡ, cao su, hắc ín…
Benzen là chất rất độc, có thể gây biến đổi gen trên người, pha huy mau, gay ung thư máu, gây quái thai. ngoài ra benzen còn phản ứng tạo ra các dẫn xuất mà độc tính còn cao hơn benzen như phenol, DDT (C6H6Cl6), 1,4-dicloro benzen…
Benzen có ứng dụng rất rộng rãi, có những ứng dụng khác nhau trong hoá hữu cơ ưhư đê sản xuất nylon và sợi tổng hợp, trong sản xuất các loại cao su, chất bôi trơn, phẩm nhuộm, chất tẩy trắng, dược phẩm và thuốc trừ sâu.
Hoạt động núi lửa và cháy rừng là nguồn thải benzen tự nhiên. Hoạt động công nghiệp là nguồn phát thải benzen ra môi trường chủ yếu nhât. Ô nhiễm benzen trong môi trường khí là do khí đốt từ dầu mỏ và than đá, sự bay hơi benzen trong quá trình sử dụng, khói thải của phương tiện giao thông… Trong khói thuốc lá cũng chứa một hàm lượng benzen tương đối cao. Việc xả thải các chất trong công nghiệp, các thùng chứa benzen sau khi sử dụng, sự rò rỉ xăng dầu từ các thùng chứa trong đất đưa benzen vào môi trường đất và nước. Benzen có thể thoát vào không khí từ nước, từ không khí có thể bị mưa và tuyết cuốn theo trở lại mặt đất. Benzen trong nước và đất phân huỷ rất chậm.
Benzen vào cơ thể thông qua hít phải không khí có nhiễm bẩn benzen hay thâm
nhập qua miệng và ruột khi ăn uống thức ăn hoặc nước có chứa benzen. ngoài ra nó còn
thâm nhập được qua da khi tiếp xúc với những sản phẩm có chứa benzen chẳng hạn như là xăng dầu…
1.4.2. Cơ chế gây độc, triệu chứng nhiễm độc và cách xử trí
Các biểu hiện nhiễm độc benzen có thể là nhiễm độc mãn tính. Sau một thời gian dài làm việc trong môi trường có chứa benzen bắt đầu có những triệu chứng suy nhược thần kinh, thiếu máu, thiếu oxy gây khó thở. Ăn thức ăn hay uống nước có benzen sẽ gây nôn oẹ, tổn hại dạ dày, hôn mê, rối loạn hô hấp và tuần hoàn và có thể dẫn đến tử vong. Khi benzen rơi lên da sẽ gây phồng rộp da, tay đỏ, đau… dính vào mắt sẽ gây kích thích và có thể làm hỏng giác mạc và từ đó có thể vào máu.
Nhiễm benzen trong một thời gian dài sẽ làm tổn hại đến mô và tế bào máu đặc
biệt là tuỷ xương. Chúng có thể phá huỷ tế bào máu dẫn đến thiếu máu máu không đông… ngoài ra benzen còn ảnh hưởng đến tế bào thần kinh.
Benzen là một trong những chất có khả năng gây ung thư ở người rất cao và được xếp vào nhóm chất gây ung thư theo Trung tâm nghiên cứu ung thư quốc tế (IARC).
Triệu chứng nhiễm độc:
Nhiễm độc cấp tính:
Tiếp xúc liều thấp, hàm lượng khoảng 20-30 mg/L không khí, gây kích thích mắt, mũi họng làm cho cơ thể khó chịu. Hàm lượng cao hơn gây choáng váng, đau đầu, chóng mặt, nôn mữa, nạn nhân bị mê man. Với hàm lượng trên 65mg/L, nạn nhân chết sau vài phút trong tình trạng hôn mê, có thể kèm co giật.
Nhiễm độc mãn tính:
– Rối loạn tiêu hóa: ăn kém ngộn, sung huyết niêm mạc miệng, nôn, hơi thở có thể có mùi benzen.
– Rối loạn thần kinh: chóng mặt, nhức đầu, dễ cáu giận, chuột rút, cảm giác kiến bò, tê cóng…
– Rối loạn huyết học: thiếu máu nhẹ, có khuynh hướng xuất huyết, thời gian chảy máu kéo dài, phụ nữ dễ rong kinh, khó thở,
– Tích lũy ở tổ chức não và tủy xương, dễ gây ung thư.
Biện pháp phòng chống:
– Hạn chế dùng benzen, nên thay thế bằng các dung môi khác nếu có thể. Khi phải sử dụng benzen đảm bảo thiết bị phải kín, có hệ thống thông gió. Nếu nồng độ cao phải làm trong tủ hút.
– Phải kiểm tra định kỳ nồng độ benzen trong không khí tại các phân xưởng.
– Rửa tay kỹ sau khi làm việc với benzen.
Xử trí:
– Khi benzen vào mắt, dùng nhiều nước sạch xối ngay liên tục ít nhất 15 phút.
– Benzen dây vào da: lập tức cởi bỏ trang bị đã bị ô nhiễm, dùng thật nhiều nước và xà phòng rửa ngay.
– Khi ngộ độc cấp phải cho thở carbogen, dùng thuốc trợ hô hấp và tim. Nếu nặng thì rửa dạ dày với nước có than hoạt.
– Nếu nạn nhân hít phải nhiều benzen, chuyển ngay nạn nhân đến nơi thoáng khí, tiến hành hô hấp nhân tạo nếu nạn nhân ngừng thở, bóp tim ngoài lồng ngực nếu nạn nhân ngừng tim.
– Sau khi sơ cứu cần chuyển ngay nạn nhân đến cơ sở y tế, theo dõi nạn nhân lâu dài.
1.4.3. Phương pháp phân tích
Benzen được phân lập bằng cất kéo hơi nước từ mẫu thử. Có thể xác định benzen bằng các cách sau:
– Lấy một lượng mẫu (máu, nước tiểu, phủ tạng nghiền nhỏ…) thích hợp, acid hoá bằng H2SO4 Ị0% và cất kéo hơi nước. Dịch cất được acid hoá bằng H2SO4 10% và cất phân đoạn lại. Dich cất đo độ hấp thụ quang tại các bước sóng hấp thụ cực đại benzen (254, 261, 249, 243 nm), toluen (262 và 268nm).
– Cho 2 lít không khí đi chậm qua mỗi bình nhỏ có chứa HNO3 và H2SO4 (đồng thể tích), trung hoà acid. Dùng butanol chiết dinitrobenzen rồi trộn với dung dịch NaOH 5% sẽ có màu tím. Đo mật độ quang, tính nồng độ dựa vào đường chuẩn. Co thể thay butanol băng ether để chiết, loại ether rồi cho thêm aceton và NaOH.
2. Một số dược chất và dược liệu có độc tính cao phân lập ở môi trường acid
Các chất độc hữu cơ không bay hơi chiết được bằng dung môi ở môi trường acid gom co: các dân xuất của acid barbituric, acid hữu cơ (như oxalic, salicylic và các dẫn xuất của chúng), dẫn xuất nitrophenol, dẫn xuất phenylpyrazolon, các glycosid… ngộ ỌC thường xảy ra với các barbiturat và các glycosid.
2.1. Các barbiturat
2.1.1. Nguồn gốc, tính chất và nguyên nhân gây độc
Acid barbituric là sản phẩm ngưng tụ của ure và acid malonic, có công thức cấu tạo như sau:
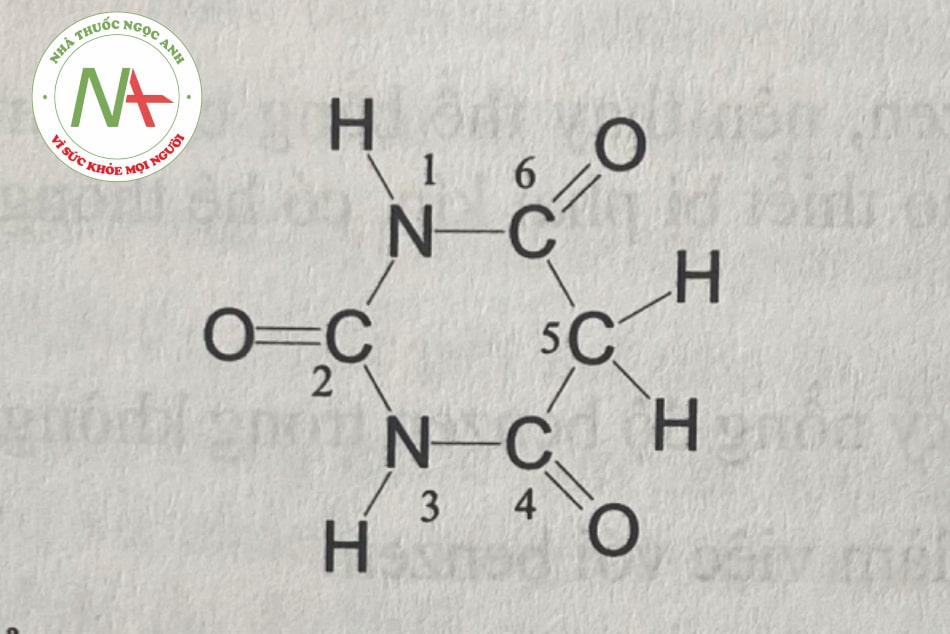
Barbiturat được dùng để chỉ các dẫn xuất của acid barbituric. Các barbiturat có cấu trúc chung khác nhau về nhóm thế ở các vị trí 1,3,5 và thường được chia thành ba loại:
– Barbiturat thế ở ba vị trí 1, 5, 5.
– Barbiturat thế ở hai vị trí 5, 5.
– Thiobarbiturat: o ở vị trí C2 được thay bằng C.
Một số tính chất lý hoá:
Các barbiturat đều là những tinh thể trắng, ít tan trong nước và ether dầu hỏa tan nhiều trong dung môi hữu cơ (alcol, ether, cloroform), dễ thăng hoa trong chân không ở 170-180°C. Điểm nóng chảy trong khoảng 100- 190°C.
Acid barbituric (các H ở Cs chưa được thế) có tính acid mạnh nhất với pK a= 4,04. Các dẫn xuất có tính acid yếu hơn pKa từ 7,4-8,6. Do có tính acid nên chúng tạo muối không tan với một số ion kim loại nặng như Ag+, Hg22+, mặt khác lại dễ tan trong dung dịch kiềm và carbonat.
Tính acid bắt nguồn từ hai nguyên tử H linh động (gắn vào vị trí N1 và N3) nằm giữa hai nhóm carbonyl, trong dung dịch tồn tại các dạng hỗ biến enol và imidol.
Các barbiturat (Bac) dễ tạo phức hỗn hợp (Bac2MeXn) với một số ion kim loại (Me) như Cu2+, Co2+, Hg2+… Phôi tử X có thể là amoniac, amin, pyridin, diphenylcarbazon… Các phức hỗn hợp này là dễ tan trong dung môi, bị phân hủy khi có nước, có màu hoặc tinh thể đặc trưng nên được ứng dụng trong phân tích các barbiturat Ví dụ phức hỗn hợp của barbiturat với Cu2+ và pyridin (Py) được hình thành như sau:
Bạc + Cu2+ + 2Py -> Bac2CuPy2
Hầu hết các barbiturat có phổ hấp thụ uv đặc trưng và phụ thuộc vào pH của dung dịch.
Nguyên nhân ngộ độc:
Ngộ độc barbiturat xảy ra chủ yếu do chủ ý tự sát hay bị đầu độc. Cũng có trường nêộ độc xảy ra trong quá trình gây mê dùng thiobarbiturat.
2.1.2. Cơ chế gây độc, triệu chứng nhiễm độc và cách xử trí
Độc tính và cơ chế gây độc:
Các dẫn xuất barbiturat có tính chất gây ngủ, dựa vào thời gian gây ngủ, người ta chia barbiturat làm các loại:
– Tác dụng dài (8-12 giờ) như: barbital, phenobarbital, butobarbital…
– Tác dụng trung bình (4-8 giờ) như: allobarbital, amobarbital, heptabarbital…
– Tác dụng ngắn (1-3 giờ) như: cyclobarbital, pentobarbital…
– Tác dụng cực ngắn (0,5-1 giờ) để gây mê như thiopental, methohexital…
Loại tác dụng dài tan nhiều trong nước hơn các loại khác. Loại tác dụng ngắn và cực ngắn tan mạnh trong lipid và nhanh chóng đi vào não gây hôn mê, sau đó nhanh chóng phân tán vào các mô khác do đó thời gian tác dụng ngắn hơn nhiều so với thời gian bán thải của chúng.
Các barbiturat hấp thu nhanh qua niêm mạc dạ dày, được chuyển hoá ở gan, sau đó đào thải qua nước tiểu ở nguyên dạng hay sản phẩm chuyển hoá. Tỷ lệ thải trừ nguyên dạng thay đổi theo từng hợp chất như: barbital thải trừ nguyên dạng qua nước tiểu 65- 80%, dial không quá 30%, hexobarbital 15-20%, pentotal 0,3%… Với các dẫn xuất thế vòng không no hoặc thế ở Ni ít được tìm thấy dạng không chuyển hóa trong nước tiểu.
Ở liều cao, các barbiturat ức chế thần kinh trung ương, ức chế trung tâm vận mạch và hô hấp, gây rối loạn ý thức, rối loạn hô hấp, hạ huyết áp, làm mất phản xạ ho. Tác dụng này còn tùy thuộc vào người dùng thuốc như: sự nhạy cảm, tuổi, tình trạng gan thận, nghiện rượu, thai nghén… Ví dụ có trường hợp uống liều điều trị nhưng không chịu được thuốc dẫn đến tử vong. Ngược lại có trường hợp uống liều rất cao vẫn bình thường như có trường hợp uống phenolbarbital liều cao (nồng độ trong máu 11, 8mg%) hay uống 30 viên amyllobarbital trong một ngày (nồng độ trong máu 4,2 mg%) nhưng vẫn tỉnh táo, vẫn sống bình thường.
Tác dụng của barbiturat tăng lên khi có mặt các thuốc ức chế thần kinh khác. Nhiều trường hợp có tác dụng kết hợp giữa barbiturat và rượu đưa đến tử vong sau cơn hôn mê sâu mặc dù nồng độ trong máu không cao (dưới lmg%). Các thuốc ức chế thần kinh khác như morphin và dẫn xuất, clorpromazin, bromid… cũng tăng tác dụng của barbiturat.
Nồng độ trong máu ở các trường hợp tử vong do uống liều cao barbiturat với cả loại thuốc tác dụng ngắn hay dài khoảng 6-10mg%. Liều uống để tự sát (hoặc đầu độc) cao hơn nhiều so với liều điều trị (thường gấp 5-10 lần) tuy nhiên với các thuốc tác dụng chậm, uống với lượng lớn sẽ tích lũy nhiều trong các cơ quan. Để phân biệt tự sát (hay bị đầu độc) với ngộ độc trường diễn có thể dựa vào tỉ lệ barbiturat trong máu và trong gan. Trong ngộ độc trường diễn tỉ lệ này có giá trí gần 1, nhưng nếu uống một liều cao barbiturat gây hôn mê rồi chết ngay thì tỉ lệ này lớn hơn rất nhiều.
Khi uông liều quá cao (do tự sát hay bị đầu độc) sẽ bị hôn mê. Sự liên quan giữa nồng độ trong máu và mức độ nhiễm độc thay đổi theo từng loại barbiturat. Người ta đã xác định được nồng độ của một số barbiturat theo các giai đoạn tác dụng của chúng. Quá trình tác dụng của các barbiturat được chia thành năm giai đoạn như sau:
– Giai đoạn 1: tỉnh táo.
– Giai đoạn 2: còn phản xạ, trả lời được nhưng không nhớ, kích thích phản ứng đứng.
– Giai đoạn 3: hồn mê, còn phản xạ, khi kích thích phản ứng không đúng; nhịp thở và huyết áp bình thường.
– Giai đoạn 4: hôn mê, mất phản xạ, kích thích không phản ứng; nhịp thở và huyết áp bình thường.
– Giai đoạn 5: hôn mê, khó thở, huyết áp hạ.
Ranh giới giữa các giai đoạn chỉ là tương đối nhưng từ giai đoạn hai trở đi được coi là đã bị ngộ độc thực sự. Khi ngộ độc sẽ gây rối loạn hô hấp, tụt lưỡi, nuốt khó, ứ đọng đờm dãi, rối loạn tuần hoàn, huyết áp hạ, suy thận cấp, hạ thân nhiệt, bội nhiễm phôi.
Ngộ độc thiobarbiturat có thể xảy ra khi gây mê. Ở giai đoạn cuối có thể bị hôn mê kèm theo hai biến chứng nguy hiểm: rối loạn hô hấp (nhịp và biên độ thay đổi có giai đoạn ngừng thở, cuối cùng là ngừng thở hẳn) và rối loạn tim mạch (hạ huyết áp, trụy mạch dẫn đến ngừng tim). Nồng độ thiobarbiturat trong huyết tương gây ngộ độc khoảng 2mg%.
Triệu chứng ngộ độc barbiturat:
– Buồn ngủ, mất dần phản xạ. Nếu nặng mất hết phản xạ gân xương, phản xạ giác mạc.
– Đồng tử giãn nhưng vẫn còn phản xạ với ánh sáng.
– Giãn mạch da và có thể hạ thân nhiệt (do giảm chuyển hóa chung)
– Giảm lưu lượng hô hấp, giảm thông khí phế nang.
– rối loạn tuần hoàn: hạ huyết áp, trụy tim mạch.
– Nạn nhân hôn mê, chết do liệt hô hấp, phù não, suy thận cấp.
Xử trí:
– Loại trừ chất độc: Rửa dạ dày bằng dung dịch NaCl 0,9% hay KMnO4 0,1%. Rửa dạ dày rất có hiệu quả khi mới ngộ độc, ngay cả khi ngộ độc lâu cũng nên rửa dạ dày. Lấy dịch rửa dạ dày tìm chất độc. Nếu người bệnh hôn mê trong 6 giờ đầu thì đặt nội khí quản và rửa dạ dày bằng ống thông (đặt sonde). Có thể cho uống than hoạt để hấp phụ chất độc hoặc uống sorbitol 1-2g/kg.
– Chống rối loạn hô hấp: hút đờm dãi, thở oxy, hô hấp nhân tạo ở giai đoạn nặng
mở khí quản nếu cần.
– Tăng đào thải chất độc: Gây lợi tiểu cưỡng bức bằng cách truyền dung dịch NaCl 0,9% hoặc glucose 5% (4-6 L/ngày). Lợi tiểu thẩm thấu bằng cách truyền tĩnh mạch chậm dung dịch manitol (100g/L) để tăng thải barbiturat. Kiềm hóa huyết tương bằng cách truyền dung dịch NaHCO3 1,4% (0,5-1 L). Người bệnh suy thận thì phải lọc máu ngoài thận. ngộ độc nặng nên chạy thận nhân tạo.
– Chống suy tuần hoàn: điều chỉnh trao đổi nước, điện giải. Nếu trụy tim mạch cân chống sốc, truyền noradrenalin, huyết tương, máu.
– Tăng sức đề kháng, dùng kháng sinh để chống bội nhiễm trong trường hợp bị hôn mê.
Xử trí khi bị ngộ độc thiobarbiturat: chống rối loạn hô hấp bằng hô hấp nhân tạo, đặt nội khí quản, cho thở máy; dùng thuốc trợ tim như noradrenalin, coramin.
2.1.3. Phương pháp phân tích
Xử lý mẫu phân tích:
Mẫu thử có thể được tiến hành phân lập sơ bộ barbiturat bằng một phương pháp thích hợp như làm khô bằng natri sulfat hoặc chiết liên tục bằng Soxhlet. Sau đó tinh chế dịch chiết bằng cách phù hợp như chiết lại bằng ether hay cloroform. Cách làm này mât nhiêu thời gian, không đáp ứng được yêu cầu của cấp cứu ngộ độc. Vì vậy nhiều tác giả đê xuât cách phân lập cấp tốc từ nước rửa dạ dày, máu hoặc nước tiểu bằng cách chuyển đôi pH và chiết bằng dung môi thích hợp nhiều lần. Ví dụ:
– Lấy một lượng mẫu thử thích hợp từ nước rửa dạ dày, acid hoá đến pH = 2 và lăc mạnh với đồng thể tích dung môi (ether hoặc cloroform). Sau khi tách lớp dung môi và rửa với dung dịch NaHC03 5%. Sau đó chiết barbiturat bằng dung dịch NaOH 1N. Cuối cùng chiết lại lần nữa với một lượng nhỏ dung môi.
– Lắp ba bình chiết nối tiếp nhau qua hai phễu lọc có bông. Cho 2mL huyết thanh hay huyết tương vào bình đầu tiên kiềm hoá bằng 1mL dung dịch NaOH 0,25N; lắc đều với 16mL cloroform. Loại bỏ phần cloroform (để loại chất màu từ mẫu thư) acid hóa phần nước bằng 1,5mL dung dịch HC1 0,5N rồi chiết với 20mL cloroform Sau khi phân lớp, cho phần cloroform chuyển sang bình chiết thứ hai. Phần nươc ơ binh dau tiên được chiết lần nữa với 1 OmL cloroform và gộp dịch chiết vào bình thứ hai.
Thêm 7mL dung dịch H2SO4 0,1N vào bình thứ hai và lắc đều. Sau khi phân lớp chuyển phần cloroform vào bình thứ ba.
Thêm 10mL dung dịch amoni hydroxyd 0,5N và lắc đều. Lấy phần dung dịch nước đem ly tâm vài phút (2000 vòng/phút). Đo phổ tử ngoại của dung dịch ở 225-290 nm với mẫu trắng là 2mL nước cất làm qua ba giai đoạn như trên.
Các phản ứng định tính:
Các barbiturat đều cho các phản ứng chung sau:
– Phản ứng với thuốc thử Millon ở môi trường trung tính hay acid cho kết tủa trắng ngả sang màu xám.
– phản ứng với AgN03 trong môi trường amoniac cho kết tủa, lấy kết tủa này hoà tan lại vào nước nóng để nguội cho các tinh thể đặc hiệu.
– Phản ứng tạo tinh thể với H2SO4: các barbiturat hoà tan trong acid sulfuric đác Khi thêm nước barbiturat kết tủa lại thành tinh thể đặc trưng cho mỗi baibnurat.
– Phản ứng Parris: tạo thành phức hỗn hợp có màu hồng với coban nitrat và diethylamin trong môi trường methanol. Phản ứng này kỵ nước, có thể phát hiện đến 0,03mg barbiturat trong mẫu thử nhưng không đặc hiệu vì các chất có nhóm CO-NH-CO đều cho phản ứng này. Có thể thực hiện phản ứng trên giây lọc: cho vài giọt dung dịch barbiturat trong ether lên một băng giấy lọc; để khô, thêm 1-2 giọt coban nitrat 3% trong methanol; làm khô giấy, để lên miệng lọ đựng amoniac sẽ xuất hiện màu hồng.
Để phân biệt các barbiturat người ta làm các phản ứng sau:
– Sắc ký lớp mỏng với silicagel G khai triển băng ba hệ dung môi: cloroform- aceton (9:1), diisopropyl ether, ethyl acetat – methanol- amoniac (85:10:5), hiện các vết barbiturat bằng dung dịch HgSCU (trong H2SO4), dung dịch diphenylcarbazon 0,01 (trong cloroform) hoặc dung dịch nước KMnO4 0,1%.
– Ghi phổ hấp thụ tử ngoại trong dung dịch NaOH 0,5N hoặc dung dịch đệm borat và so sánh với chất chuẩn.
– Dựa vào đặc điểm của nhóm thế có thể sàng lọc barbiturat như: phenobarbital có nhóm thế 5-phenyl có thể nitro hoá, sau đó khử thành amin làm phản ứng tạo phẩm màu azoic. Barbiturat có nhóm thế chưa no có thể làm mất màu dung dịch KMnO4 0,1%.
Các phương pháp định lượng:
Người ta thường định lượng barbiturat bằng cách thực hiện phản ứng tạo màu rôi đo quang, phương pháp đo phổ UV và sắc ký khí.
Phương pháp sắc ký khí:
Thường áp dụng định lượng barbiturat trong các mẫu huyết tương. Mẫu thử được chiết bằng cloroform và được tiến hành sắc ký cùng với dung dịch chuẩn cũng được chuẩn bị trong cloroform.
Phương pháp đo quang sau khi thực hiện các phản ứng tạo phức màu:
– Tạo màu bằng phản ứng Parris: cho 2mL dịch chiết cloroform vào 0,2mL dung dịch coban acetat trong methanol khan, thêm 0,6mL dung dịch isopropylamin 5% trong methanol. Trộn đều và đo mật độ quang ở 565nm với mẫu trắng trong cùng điều kiện xác định nồng độ theo phương pháp dãy chuẩn. Phương pháp này hiện nay ít dùng vì phản ứng không đặc hiệu, màu thay đổi tùy theo từng chất, kết quả khó lặp lại, khoảng nồng độ tuyến tính hẹp.
– Dựa vào phản ứng với HgSO4 và diphenylcarbazon: Một số hợp chất glutetimid, tolbutamid, clopropamid, diphenylhydantoin cũng cho phản ứng với diphenylcarbazon gây cản trở cho việc định lượng barbiturat.
Các phản ứng tạo màu nói chung có độ nhạy khoảng 0,2mg/100mL.
Phương pháp đo phổ UV: Phổ hấp thụ tử ngoại của các nhóm barbiturat có sự thay đổi hình dạng tùy theo pH dung dịch. Vì vậy có thể dựa vào dạng phổ để sàng lọc và nhân ra được đó là barbiturat thuộc nhóm nào. Ví dụ:
– Các dẫn xuất thế 5, 5 trong dung dịch NaOH 0,1N có một cực đại ở 235nm. Khi đưa pH về 10-10,5 chỉ còn một cực đại ở 240nm.
– Các dẫn xuất ở thế 1, 5, 5 trong dung dịch NaOH 0,1N có một cực đại ở khoảng 243nm, nhưng khi đưa pH về 10-10,5 cực đại không còn nữa.
– Thiobarbiturat trong dung dịch NaOH 0,1N có cực đại ở 305nm nhưng khi đưa pH về 10-10,5 có hai cực đại ở 285 và 235nm.
Để định lượng có thể đo mật độ quang ở cực đại hấp thụ, dựa vào đường chuẩn để tính ra nồng độ barbiturat. Tuy nhiên, người ta thường dùng kỹ thuật đo VI sai để hạn chế ảnh hưởng của tạp chất, theo một trong các cách sau:
– Đo vi sai theo pH: chọn bước sóng có hiệu số độ hấp thụ ở hai môi trường có pH được chọn là lớn nhất. Ví dụ với dung dịch NaOH 0,1N (pHi) và đệm borat (píỈ2) thì các dẫn xuất thế 5, 5 bước sóng được chọn để đo là 260nm, các dẫn xuất thê ở 1, 5, 5 là 245 nm, còn thiobarbiturat được đo vi sai ở 305 nm.
Trong dung dịch acid, barbiturat thường hấp thụ ánh sáng không đáng kê nên người ta còn đo ΔD trong đệm borat và dung dịch HC1 0,1N.
– Đo vi sai theo bước sóng: trong dung dịch có pH thích họp (với barbiturat thường dùng dung dịch kiềm hoặc đệm borat pH 10). Chọn hai bước sóng trên phổ hấp thụ làm sao có hiệu số mật độ quang ở các bước sóng này là lớn nhất. Ví dụ trong dung dịch NaOH 0,1N các dẫn xuất thế 5, 5 có thể đo ở 255 nm và 235 nm; các dẫn xuất thế 1, 5 5 có thể đo ở 242 nm và 270 nm; còn thiobarbiturat đo ở 305 nm và 270 nm.
Về mặt nguyên tắc có thể dùng cả hai kỹ thuật đo trên. Trong thực tế hầu hết các tác giả dùng kỹ thuật đo vi sai theo pH với ba loại dung dịch khác nhau là: dung dịch kiềm có pH =13-13,5; đệm borat pH ≈ 10 hoặc đệm amoni hydroxyd pH= 11,3 và dung dịch HCl pH=2. Trong một nhóm người ta có thể đo vi sai theo các điều kiện khác nhau: một số đo ở 260 nm trong dung dịch pH1 = 13 và pH2=10, một số khác dùng pH1=10 và pH2=2 đo tại 240 nm như với các barbiturat thế 5, 5.
Độ nhạy với từng barbiturat có khác nhau và có thể định lượng được 6-10pg trong mẫu thử.
2.2. Glycosid
2.2.1. Một số glycosid thường gặp
Glycosid có nhiều trong thực vật, có cấu trúc đặc trưng bởi dây nối ether kiểu acetal giữa phần đường và phần không đường. Phần đường có thể là đường đơn (như D- glucose, D và L-arabinose, D-ribose…) hoặc nhiều đường liên kết thành chuỗi. Đa số các chất có phân đường là glucose nên trước đây còn được gọi là glucosid. Phần không đường gọi là aglycol thuộc nhiêu loại hợp chất khác nhau (vòng thơm hay không thơm, dị vòng…). Dựa theo tính chất, tác dụng đặc trưng hoặc cấu trúc của khung aglycol mà người ta thường xếp thành các nhóm: glycosid tim, saponin, anthranoid (anthraglycosid), flavonoid…
Glycosid tim:
Một số cây thuốc cho glycosid tim như:
— Digitalis purpurea L: dùng bột lá, rượu thuốc digitalis hoạc hai glycosid quan trọng thường gặp là digitoxin và digoxin.
— Digitalis lanata chứa các glycosid là lanatosid A,B,C.
— Strophantus gratus, Strophantus kombe chứa strophantin G, strophantin K.
— Strophantus divaricatus (cây Sừng trâu) chứa divaricosid, sinosid, candosid….
— Nerium oleander (cây Trúc đào) chứa neriolin.
— Thevetia nerilfolia (cây Thông thiên) chứa thevetin.
Anthraglycosid: Phần aglycol của nhóm này là các sản phẩm oxy hoá của anthracene như anthron, anthranol. Anthraglycosid thường được dùng làm thuốc nhuận tràng, thuốc tây. Ví dụ dịch chiết lá lô hội (Aloe) chủ yếu chứa anthraglycosid…
Saponin (saponosid):
Saponosid thường được gọi là saponin với hai đặc tính chủ yếu là tạo bọt mạnh và phá huyết. Độc tính của nó thay đôi theo loại động vật và cách sử dụng. Nói chung saponin độc với động vật thở bằng mang. Với động vật máu nóng qua đường tiêu hoá thì ít độc, còn khi tiêm tĩnh mạch thì độc tính cao do tính phá huyết. Tuy vậy người ta vẫn chưa khẳng định được mối quan hệ giữa độc tính và chỉ số phá huyết của saponin.
Độc tính của glycosid rất khác nhau có thể là do toàn bộ phân tử, độc tính có thể giảm sau khi bị thủy phân. Ngược lại có khi thủy phân mới giải phóng ra chất độc (các glycosid giải phóng cyanogen). Các công trình nghiên cứu về mặt độc chất thường tập trung vào glycosid trợ tim và chủ yếu là Digitalis.
2.2.2. Digitoxin và glycosid của Digitalis
Digitoxin (còn gọi là digitalin) có trong lá Digitalis purpurea. Digitoxin là chất kết tinh mảnh hình chữ nhật, hầu như không tan trong nước, ether dầu hoa ít tan trong alcol, benzen, tan tốt trong cloroform. Digitoxin có vị đắng, bị thuỷ phân nhanh bởi các acid vô cơ.
Khi bị ngộ độc thì người bệnh buồn nôn và nôn. Nôn kéo dài vài ngày gây mất nước, có lúc còn kèm tiêu chảy.
Trong điều trị thường xảy ra rối loạn thị giác. Ngoài ra còn gây ù tai, chóng mặt, nhức đầu. Sau 3-4 giờ bị ngộ độc các triệu chứng trên xuất hiện. Người bệnh có thể chết sau vài ngày.
Xử trí:
– Loại trừ chất độc bằng rửa dạ dày và dùng thuốc tẩy.
– Truyền dung dịch NaCl đẳng trương để bù nước.
– Tiêm liều nhỏ các thuốc kích thích tim như long não, cafein.
Phương pháp phân tích:
Chiết digitoxin ở môi trường acid bằng cloroform. Hoà tan cặn vào ether dầu hoả rồi chiết lại bằng dung môi sau khi acid hóa.
Nếu cần phân lập digitoxin từ phủ tạng thì trộn đều mẫu thử đã nghiền nát với hai thể tích cồn 80°, để yên 50°c trong bốn giờ. Lọc, rửa bã bằng cồn. Gộp dịch lọc cất thu hồi cồn, lọc trong. Thêm chì acetat thừa, loại chì thừa bằng H2SO4 loãng rồi chiết bằng cloroform.
Các phản ứng định tính:
– Đun nhẹ cắn dịch chiết cloroform với hỗn họp đồng thể tích của H2SO4 và C2H5OH. Khi hỗn hợp có màu sáng, cho một giọt dung dịch FeCb 10% sẽ có màu xanh lục hay xanh lơ bền (phản ứng Lafon).
– Trộn cắn dịch chiết cloroform với lmL dung dịch acid picric 1% mới pha trong ethanol và lmL dung dịch NaOH (không có Na2CƠ3) sẽ cho màu đỏ cam.
– Kết tinh lại từ dung dịch cloroform và so sánh tinh thể vứLdigitoxin chuẩn.
– Thử trên tim ếch: do các phản ứng hoá học kém nhạy nên người ta thử thêm tác
dụng dược lý: hoà tan cặn trong dung dịch Ringer đẳng trương rồi tiêm vào tim ếch. Ghi
nhịp đập của tim để xác định sự có mặt của digitalin. Ghi thời gian làm ngừng chức phận của tim.
Các phương pháp định lượng digitoxin:
– Thử trên tim ếch: với ếch nặng 40g, liều độc là 4mg, có thể căn cứ vào điều này để ước lượng digitalin đã chiết xuất được.
– Phương pháp sắc ký lớp mỏng: Khai trên với hệ dung môi thích hợp, cạo vết digitoxin cho vào ống ly tâm có 5mL thuốc thử xanthydrol mới điều chế. Lắc nhẹ/ Để vào bình làm lạnh (bằng nước đá). Ly tâm 10 phút. Lấy dung dịch đo quang (duns dich có màu đỏ vàng), độ nhạy 20pg digitoxin.
Thuốc thử xanthydrol được chuẩn bị bằng cách hoà tan 30mg xanthydrol trong 100 mL acid acetic băng, sau đó thêm 1 mL acid clohydric.
– Phương pháp phóng xạ miễn dịch: lấy digitoxin đã đánh dấu bằng 3H trộn với kháng thể đặc hiệu của nó trong môi trường đệm thích hợp. Sau đó lấy mẫu thử cho vào hỗn hợp này. Do phản ứng tranh chấp, digitoxin đã đánh dấu bị đay ra bởi digitoxin co trong mẫu thử và dùng máy đếm để đo số lượng phóng xạ. Nồng độ digitoxin được tính từ đường chuẩn làm trong cùng điêu kiện.
Digoxin cũng được định lượng bằng phương pháp này.
2.2.3. Trúc đào và neriolin

Trúc đào có chứa đến 17 glycosid. Những glycosid đáng chú ý là neriolin (oleandrin) làm thuốc trợ tim, deacetyloleandrin, neriantin…
Nhựa trúc đào có thể gây tấy rát da, sưng, tấy rát mắt nghiêm trọng. Ăn phải trúc đào có thể gây ra các triệu chứng buồn nôn và nôn mửa, tiết nhiều nước bọt, loạn nhịp tim dẫn đến tử vong.
Cây trúc đào rất độc nhưng lại được trồng rất nhiều trên các con phố. sấy khô và đun sôi không làm mất độc tính của trúc đào. Trúc đào là loại cây bụi, thân gỗ, dễ trồng và dễ lên, hoa có màu rất đẹp như trăng, vàng, đỏ thắm, hồng, nở thành từng chùm đẹp mắt.
Khi bị ngộ độc rất mệt mỏi, đau dạ dày; rối loạn tim và hô hấp, co giật như uốn ván, mạch nhỏ và thất thường.
Khi có triệu chứng ngộ độc trúc đào, cần lập tức tìm đến cơ sở y tế gần nhất để được rửa ruột.
3. Một số dược liệu và dược chất có độc tính cao phân lập ở môi trường kiềm
Các chất độc mang tính base và trung tính được phân lập bằng cách chiết với dung môi hữu cơ ở trong môi trường kiềm như: các alcaloid, các dẫn xuất phenothiazin một số dẫn xuất của benzodiazepin… Một số ma túy cũng thuộc nhóm này nhưng tính chất nguy hiểm khá khác biệt được xem xét riêng ở chương V. Các trường hợp ngộ độc thường gặp ở nhóm này có thể kể đến các alcaloid từ lá ngón, mã tiền, phụ tử belladon thuốc lá…
Alcaloid là những base nito có độc tính cao, không tan trong nước, tan trong dung dịch acid. Có thể dùng một số phản ứng với thuốc thử chung của alcaloid và dựa vào màu sắc, hình dáng tinh thể tạo thành để có thể sàng lọc, định hướng chất độc.
– Phản ứng kết tủa: Lấy dịch chiết cloroform ở môi trường kiềm đã làm sạch, loại dung môi, thêm 0,5mL dung dịch acid acetic 2%. Sau đó làm phản ứng với: thuốc thử Mayer (HgCl2 và KI trong nước, cho kết tủa trắng), dung dịch acid picric bão hòa trong nước (cho tủa vàng), acid phosphotungstic, thuốc thử Dragendroff…
– Phản ứng màu: nhiều alcaloid cho phản ứng màu đặc trưng với một số thuốc thử như H2SO4 đặc, HNO3 đặc, thuốc thử Frohde (acid sulfomolypdic), thuốc thử Mandelin (acid sulfovanadic), thuốc thử Marquis (formalin trong H2SO4 đặc)… rồi quan sát màu và sự chuyển màu.
– Nhiều alcaloid cho phổ hấp thụ UV đặc trưng. Lấy dịch chiết đã làm sạch; chiết lại với 5mL H2SO4 0,5N. Ghi phổ hấp thụ. So sánh với chất chuẩn hoặc phổ chuẩn.
Cần chú ý các phản ứng này đòi hỏi dịch chiết phải sạch, đặc biệt là phản ứng kết tủa và dựa vào phổ hấp thụ tử ngoại.
3.1. Lá ngón và các alcaloid có trong lá ngón
3.1.1. Nguồn gốc, nguyên nhân gây độc
Lá ngón còn có các tên khác như: cây rút ruột, hồ mạn trường, hồ mạn đằng, đoạn trường thảo, câu vẫn… Tên khoa học: Gelsemium elegans Benth. Trước đây được phân vào họ Mã tiền (Loganiaceae) nhưng từ năm 1994 đến nay được phân vào họ mới là họ Hoàng đằng (Gelcemiaceae).
Dây leo thân quấn, thân cây cso khía, màu xanh, lá mọc đối, hình trứng hoặc hình trứng mũi mác, đầu nhọn, dài 7-2mm. Hoa mọc đầu cành hay kẽ lá. Năm cánh hoa màu vàng, trành hoa hình phếu, ra hoa từ tháng 5-12. Qủa nang thon hay elip, nâu nhạt.
Bản chất là cây ưa sáng nên hay mọc chỗ quang đãng như ven đường và bìa rừng núi ở khu vực Đông Nam Á và Trung Quốc.
Trước đây lá ngón được sử dụng để điều trị eczema, bệnh trí, nhiễm trùng răng, phong, nhọt ngoài da, không tổn thương và co thắt nhưng do độc tính cao nên chỉ hạn chế trong các ứng dụng ngoài da.
Nguyên nhân gây độc chủ yếu là do chủ ý tự tử hay bị đầu độc.

Một số trường hợp khác do dùng nhầm chè vằng với lá ngón, Nhìn thoáng qua, cây chè vằng và cây lá ngón hao hao như nhau, vì lá hai cây đều mọc đối, có hình trứng thuôn dài, hoa đều mọc thành xim… Hình dạng bên ngoài, thân, cành chè vằng tương đối giống với thân cành lá ngón, nhất là khi đã chặt khỏi gốc và bỏ hết lá. Cây chè vằng có thể phân biệt với cây lá ngón nhờ vào đặc điểm lá, hoa và quả. La chè vằng có ba gân dọc trong đó hai gân bên uốn cong theo mép lá, rõ rệt. Hoa chè vằng màu trắng với mười cánh hoa trong khi hoa lá ngón mọc thành chùm, phân nhánh nhiều lần (từ 2 đến 3 lần) màu vàng. Qủa chè vằng hình cầu cỡ hạt ngô, chín màu vàng, có một hạt rắn chắc trong khi quả cây lá ngón hình trụ, khi chín tự mở, nhiều hạt nhỏ (tới 40 hạt), có diềm mỏng, phát tán theo gió.
3.1.2. Độc tính, cơ chế gây độc, triệu chứng ngộ độc và cách xử trí.
Độc tính và triệu chứng ngộ độc:
Các alcaloid chứa trong toàn bộ cây, độc tính giảm dần theo thứ tự rễ, lá, hoa, quả và thân cây. Các alcaloid trong cây lá ngón gồm: Koumin (nhiều nhất), gelsenicin (độc nhất), gelsamydin, gelsemoxonin, 19-α hydroxygelsamydin…
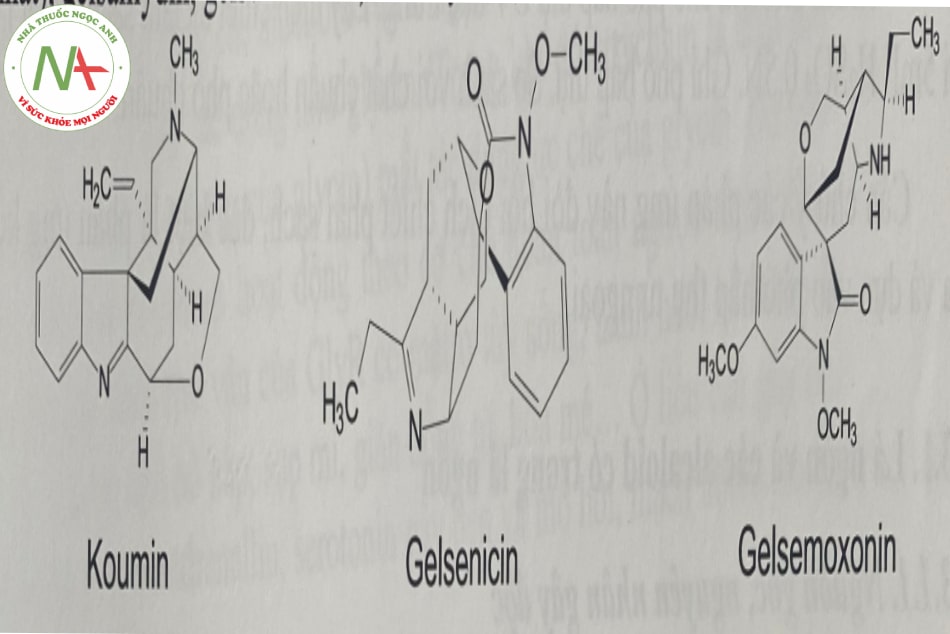
Có rất ít nghiên cứu về độc học lâm sàng. Ví dụ một nghiên cứu tiến hành giã lá ngón thành nước (10 g lá, 10 mL nước) cho chuột uống 3 giọt, sau 9 phút chuột chết vì co giật.
Người bị ngộ độc lá ngón có các triệu chứng khát nước, đau họng, chóng mặt, hoa mắt, buồn nôn… sau đó bị mỏi cơ, thân nhiệt hạ, huyết áp hạ, răng căng chất, sùi bọt mép, đau bụng dữ dội, tim đập yếu, khó thở, đồng tử giãn và chết rất nhanh do ngừng hô hấp.
Ngay sau khi ăn hoặc uống nước giã lá, rễ, thân, hoa và quả, xuất hiện các triệu chứng:
– Đau bụng, buồn nôn, khó chịu, mệt mỏi, bí đái;
– Da lạnh, vã mồ hôi;
– Yếu mệt cơ tay chân khó vận động, nặng liệt cơ hoàn toàn;
– Giãn đồng tử dẫn đến nhạy cảm với ánh áng, chói mắt;
– Sụp mi và liệt cơ hàm dưới dẫn đến rơi hàm dưới không khép được vài miệng;
– Thở yếu, thở chậm dẫn đến suy hô hấp;
– Nhịp tim chậm, huyết áp tụt có thể dẫn đến ngừng tim;
– Tăng phản xạ gân xương, co giật;
– Tử vong: do liệt cơ, suy hô hấp và ngừng tuần hoàn.
Cơ chế gây độc:
Trước đây người ta cho rằng các alcaloid của lá ngộn tác động tương tự như strychnin trên neuron vận động ở tủy sống và tăng trương lực cơ và co giật, cứng hàm, hậu quả là suy hô hấp và suy tuần hoàn. Xử trí bằng cách cho nạn nhân thở máy và dùng thuốc chống co giật. Quan niệm này không giải thích được các triệu chứng của ngộ độc lá ngón một cách đầy đủ, thậm chí hoàn toàn không phù hợp như: da tái lạnh, vã nhiều mồ hôi; liệt cơ toàn thân, sụp mi, giãn đồng tử; liệt cơ hô hấp (thở chậm, ngừng thở…); nhịp tim chậm và ngừng tim; rối loạn ý thức (hôn mê).
Hiện nay người ta cho rằng các alcalloid của lá ngón là chất đồng vận tác động lên glycin receptor (GlyR) và gây tác dụng như glycin. Trong khi đó strychnin là chất đối vận của GlyR (cạnh tranh vị trí gắn của glycin) mất tác dụng ức chế của glycine. Do vậy alcaloid của lá ngón và strychnin hoạt động theo cơ chế hoàn toàn ngược nhau. Các alcaloid của lá ngộn là chất chủ vận của GlyR có mặt ở tủy sống, hành não, hệ lưới và vỏ não: liệt cơ tứ chi, ức chế hô hấp, sụp mi, giãn đồng tử, hôn mê… Ở liều cao gây ức chế tái hấp thu dopamin, noradrenalin, serotonin gây nên vã mồ hôi, mạch nhanh, tăng phản xạ gân xương, co giật.
Các alcaloid trong lá ngộn được hấp thu rất nhanh qua đường tiêu hóa (vài phút đến 30 phút). Ngộ độc đến muộn nhất là với dê và ngỗng trong vòng 24 giờ sau khi ăn nhầm lá ngón lẫn trong cỏ. Sau khi động vật chết thường phát hiện còn tồn dư lá ngón trong dạ dày. Thời gian tử vong trung bình là 1 – 7,5 giờ.
Xử trí:
– Giải độc: giã nhiều rau má hoặc rau muống lấy nước cốt, sau đó cho người bị ngộ độc uống để làm giảm độc tính rồi chuyển đến bệnh viện cấp cứu.
– Ổn định chức năng sống của người bệnh: đặt ống nội khí quản, thở máy, chống co giật bằng barbiturat.
– Các biện pháp hạn chế hấp thu: Nếu người bệnh đến sớm (trong vòng 1 giờ): gây nôn, rửa dạ dày bằng nước ấm, uống than hoạt. Do nguy cơ bị sặc dẫn đến suy hô hấp nên đặt ống nội khí quản trước khi tiến hành rửa dạ dày.
3.1.3. Phương pháp phân tích chất độc
– Chiết các alcaloid bằng cloroform ở môi trường kiềm và làm các phản ứng đặc trưng của alcaloid: với H2SO4 đặc cho màu đỏ, với K2Cr2O7 và H2SO4 cho màu tím giống strychnin.
– Sắc ký lớp mỏng đối chiếu các vết alcaloid chính với dịch chiết lá ngón.
3.2. Mã tiền, strychnin và các alcaloid của mã tiền
3.2.1. Nguồn gốc và nguyên nhân ngộ độc
Mã tiền là hạt phơi khô của cây mã tiền (Strychnos nux-vomỉcd) thuộc họ Mã tiền (Loganiaceae). Ở nước ta cây mã tiền mọc nhiều ở các vùng rừng núi với nhiều loài khác nhau. Cây mã tiền mọc hoang rất nhiều ở miền Nam nước ta, là một cây nhỏ, vỏ xám, cây non có gai. Một số mã tiền được khai thác ở miền Bắc là dây leo, có đường kính thân 10-15 cm, chiều dài có thể 30-40m. Lá mọc đối, phiến lá hình bầu dục. Hoa nhỏ, màu hồng, họp thành xim thành tán. Quả mọng hình cầu, to bằng quả cam, có chứa cơm màu trắng và nhiễu hạt hình khuy áo.
Với hình dạng rất giống quả cam, quả mã tiền là một thứ độc dược cực mạnh. Hạt của chúng chứa nhiều alcaloid, chất độc có khả năng gây co quắp toàn thân và tê liệt cơ hô hấp gây ngạt thở dẫn đến tử vong. Người ta thường dùng quả mã tiền để diệt chuột, song chung cũng gây nên nhiều vụ ngộ độc khủng khiếp đối với người.

Hạt mã tiền thường được dùng ở dạng hạt (ngâm rượu làm thuốc xoa bóp) hay bột trong các bài thuốc nam. Alcaloid chính trong hạt mã tiền là strychnin và brucin. Trong ngành dược dùng bột của hạt mã tiền để bảo chế thành rượu mã tiền (0,25% alcaloid) và cao mã tiền (16% alcaloid toàn phần).
Hạt mã tiền được bảo phủ một lớp lông đặc biệt nên khi muốn xác định có phải ngộ độc do mã tiền không thường lấy các mẫu tìm được trong thức ăn ở dạ dày, làm vi phẫu tìm dạng lông đặc biệt này. ngoài ra có thể lấy mảnh hạt làm hai phản ứng phát hiện brucin (nhỏ acid nitric đặc vào vùng phôi nhũ sẽ có màu đỏ thâm) và strychnin (thuốc thử sulfovanadat làm cho phôi nhũ có màu tím).
Strychnin (C21H22N2O3) là các tinh thể hình lăng trụ, tròn thẳng, không màu, điểm chảy 265°C. Vị rất đắng, để lại cảm giác lâu. Không tan trong nước lạnh. Tan ít trong ether, ethanol, benzen. Tan tốt trong cloroform. Strychnin là một base yếu, với các acid cho muối kết tinh. Dạng thường dùng trong y học là muối sulfat (C2iH22N2O2)2.H2S04.5H20. Nếu có thừa acid muối trung tính biến thành muối acid ít tan trong nước hơn.
Brucin (C23H26N2O4.4H2O) là các tinh thể lăng trụ, vị rất đắng. Điểm chảy 105°C. ít tan trong nước lạnh, trong ether; rất dễ tan trong ethanol và nhất là trong cloroform. Với acid cho muối kết tinh dễ tan trong nước.
Strychnin và brucin có một số phản ứng sau:
– Kiềm và NH4OH kết tủa chậm strychnin base từ dung dịch muối. Nếu có thừa NH4OH strychnin sẽ hoà tan, nhưng dần dần kết tủa lại ở thể kết tinh và sẽ hoàn toàn không tan (khác với brucin đê lâu không kết tủa trở lại).
– NaHC03 không kết tủa strychnin từ các dung dịch muối nhưng có thể chiết được bằng dung môi.
– Cho kết tủa với thuốc thử Bouchardat, Mayer và Dragendorff.
3.2.2. Độc tính,triệu chứng ngộ độc và xử trí
Strychnin là chất độc gây co giật do tác dụng kích thích các neuron đệm của tủy. LD của strychnin cho người lớn 0,050g.
Người bị ngộ độc lúc đầu sợ hãi, lo lắng, sợ ánh sáng, tiếng động. Sau đó xuất hiện cơn co giật uốn ván. Đồng tử giãn, mất phản xạ ánh sáng, hàm cứng. Mặt tím tái, cơ hô hấp co lại, nhịp thở thành từng cơn. Sau đó giảm co giật một thời gian tiêp theo cơn co giật tăng lên, người bệnh chết vì ngạt.
Ngộ độc brucin các triệu chứng tương tự strychnin.
Xử trí:
– Để người bệnh yên tĩnh trong bóng tối.
– Tiêm apomorphin để gây nôn, tiêm truyền huyết thanh mặn ưu trương để loại strychnin qua nước tiểu.
– Hô hấp nhân tạo, thở oxy để chống ngạt.
3.2.3. Phương pháp phân tích
Strychnin tương đối bền vững, cho phản ứng hoá học khá rõ ràng nên dễ dàng phát hiện nhất trong số các alcaloid. Bản thân strychnin không phải là thành phần tự nhiên trong cơ thể vì vậy sự có mặt của nó là do đưa từ ngoài vào nên có ý nghĩa quan trọng về mặt độc chất. Cũng cần chú ý là strychnin thường được dùng làm thuốc giải độc khi ngộ độc barbiturat.
Strychnin: chiết bằng cloroform ở môi trường kiềm nhẹ (NH4OH hoặc NaHCCb). Đuổi dung môi của dịch chiết và làm các phản ứng tìm strychnin như:
– Với K2Cr2O7 và H2SO4 đặc: Lấy cặn khô dịch chiết thêm 2 giọt H2SO4 đặc và vài tinh thể K2Cr2O7, dùng đũa thủy tinh khuấy nhẹ strychnin có màu tím xanh -> tím đỏ —> đỏ với độ nhạy cỡ 1mg.
– Với thuốc thử Mandelin (acid sulfovanadic): strychnin cho màu xanh tím, độ nhạy 1mg.
– Lấy cắn khô thêm 4mL HC1 20% và vài viên kẽm hạt. Đun sôi để 5 phút, lấy 1 mL dung dịch trộn với 1-2 giọt dung dịch NaNO2 0,1%. Lắc đều sẽ có phản ứng màu đỏ (phản ứng Deniges).
– Thử co giật trên ếch: lấy cặn khô hoà tan trong ethanol, nhỏ lên da ếch. Sau 15- 30 phút sẽ thấy cơn co giật uốn ván rất đặc hiệu.
Brucin: Lấy cắn khô oxy hoá bằng HNO3 đặc nguội, sẽ tạo ra nitroorthoquinon của acid brucinic (cacothelin) có màu đỏ thâm (phản ứng cacothelin). Màu đỏ chuyển dần sang da cam rồi vàng (đun nóng chuyển nhanh hơn). Thêm 2 giọt SnCL2 hay (NH4)2S sẽ có màu tím. Độ nhạy 1 pg.
ngoài ra có thể nhận ra strychnin và brucin bằng sắc ký lớp mỏng và phổ hấp thụ UV-VIS. Phổ hấp thụ của strychnin trong ethanol có cực đại ở 255 nm (với độ hấp thụ riêng là 380), còn brucin có cực đại ở 264 nm (với độ hấp thụ riêng là 300).
Có thể định lượng strychnin bằng quang phổ UV-VIS sau khi phản ứng với thuốc thử Mandelin.
3.3. Nicotin và thuốc lá
3.3.1. Nguồn gốc và độc tính
Nicotin là chất dạng dầu, bị chuyển màu ngoài không khí, sôi ở 246°c và phân hủy, đến 100°c đã tỏa ra khói trắng và kéo theo hơi nước rất dễ dàng. Hơi nicotin gây kích thích mạnh. Nicotin tan được trong nước, cồn, dầu, ether, các dung dịch nước có phản ứng kiềm, tạo muối với các acid.
Nicotin là alcaloid có trong các cây họ Cà (/Solanaceae) và trong một số loài cây khác. Đặc biệt trong cây thuốc lá nicotin chiếm 0,6 đến 3% trọng lượng cây thuốc lá khô. Nicotin là một chất độc thần kinh rất mạnh với ảnh hưởng rõ rệt đến các loài côn trùng, do vậy trước đây nicotin được sử dụng rộng rãi như là một loại thuốc trừ sâu. Hiện nay các dẫn xuất của nicotin như imidacloprid được sử dụng thay thế.
Trung bình một điếu thuốc chứa một lượng khoảng 1 mg nicotin, hút một điếu thuốc có thể hấp thu 0,l-0,4mg nicotin. chất này hoạt động như một chất kích thích đối với động vật có vú và là một trong những nhân tố gây nghiện. Nghiện nicotin đã và đang là những thói nghiện ngập khó bỏ và với liều lượng 30 – 60mg có thể gây tử vong cho người lớn có cân nặng 50kg.
Nicotin làm tăng huyết áp và nhịp tim ở người. Nicotin cũng có thể gây ra khả năng xơ vữa tế bào nội mô động mạch vành ở người. Tổn thương vi mạch có thể xảy ra do tác động của nó lên các thụ thể nicotinic acetylcholin (nAChRs).
Khi nicotin được đưa vào cơ thể, nó được hấp thu nhanh vào máu và có thể vượt qua hàng rào máu não. Chỉ sau 10-20 giây kể từ khi hít vào, nicotin đã có thể tới được não. Lượng nicotin hít vào cùng với khói thuốc là một phần nhỏ chất này có trên lá của cây thuốc lá (hầu hết chất này bị cháy hết khi đốt thuốc). Lượng nicotin ngấm vào cơ thể thông qua việc hút thuộc phụ thuộc vào nhiều yếu tố, bảo gồm: loại thuốc lá, việc có hít khói vào phổi hay không, có đầu lọc hay không…
Khi nhai thuốc lá, lượng thuốc ngấm qua môi và lợi vào cơ thể có xu hướng cao hơn nhiều so với việc hút thuốc. Nicotin bị chuyển hóa ở gan bởi enzym cytochrom P450. Phổi và thận cũng là nơi nicotin bị chuyển hóa. Một trong các chất chuyển hóa chính từ nicotin là cotinin. Các chất chuyển hóa chính khác gồm nicotin iV’-oxyd, nomicotin, nicotin isomethonium, 2-hydroxynicotin và nicotin glucuronid.
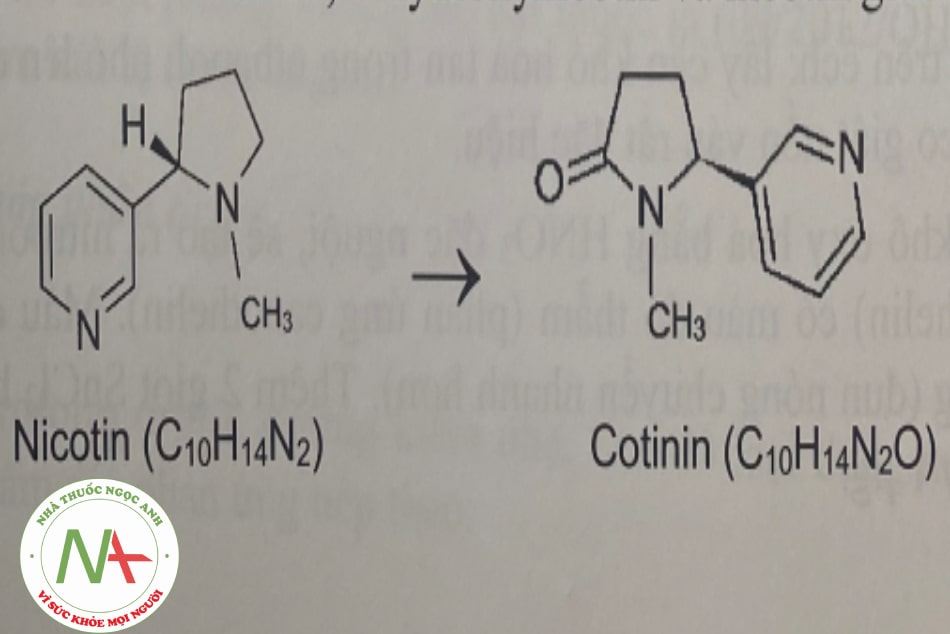
Nicotin đào thải chủ yếu qua nước tiểu (10-20% dạng không chuyển hóa). Nước bọt, mồ hôi, sữa mẹ cũng có đào thải nicotin. Thời gian bán thải của nicotin trong cơ thể vào khoảng 2 giờ. Tinh dầu bạc hà (menthol) được cho thêm vào thuốc lá để làm tăng thời gian bán thải của nicotin trong cơ thể.
Nicotin tác dụng lên các hạch của hệ thần kinh giao cảm, dẫn đến liệt. Trên hệ thần kinh trung ương, nicotin kích thích, có thể lên cơn co giật kiểu strychnin. Tác dụng độc cho người nghiện thuốc lá do ba yếu tố: nicotin, carbon oxyd và các hydrocarbon đa vòng.
3.3.2. Nguyên nhân nhiễm độc, triệu chứng và cách xử trí
Ngộ độc cấp:
Nguyên nhân có thể do uống nhầm hay bị đầu độc, hút thuốc lá hay thuốc lào lần đầu, bồi dung dịch nicotin lên đầu để diệt chấy…
Xảy ra nhanh sau khi uống: kích thích gây buồn nôn, tiết nước bọt, đau bụng, nôn và tiêu chảy; nhức đầu, chóng mặt, rối loạn thị giác và thính giác; thở nhanh, vã mồ hôi, tim đập nhanh.
Nấu nặng: rối loạn hô hấp, ngừng thở; rối loạn tim mạch, loạn nhịp, trụy tim; hôn mê, co giật kiểu tetani. Có thể tử vong trong vòng 5 phút đến 4 giờ.
Nhiễm độc mạn tính:
Nguyên nhân do nghiện thuốc lá: với ba yếu tố gây độc là nicotin, carbon oxyd (1% trong khói thuốc lá và 6-8% trong khói xì gà) và chất nhựa không cháy hết chứa các hợp chất hydrocarbon đa vòng gây ung thư.
Các bệnh liên quan đến hút thuốc gồm: bệnh mạch vành, bệnh phổi tắc nghẽn mạn tính, ung thư thanh quản, thực quản, khoang họng, túi mật, tụy, thận và ung thư phổi (với tỷ lệ chết đến 80-90%).
Xử trí:
– Rửa sạch da nếu tiếp xúc;
– Rửa dạ dày bằng thuốc tím;
– Chữa triệu chứng: hỗ trợ hô hấp, thở oxy, chống trụy mạch, chống co giật bằng barbituric uống (nếu vẫn còn co giật có thể tiêm).
– Dùng chất kháng độc của nicotin: uống mecamylamin (C11H21N).
– Điều trị triệu chứng kích thích kiểu muscarin (tim đập chậm, khò khè) có thể dùng atropin.
– Thực hiện tốt Luật phòng, chống tác hại thuốc lá (09/2012/QH13), phá bỏ thói quen hút thuốc, chấm dứt lệ thuộc nicotin.
3.3.3. Phương pháp phân tích
Xử lý mẫu:
Chiết với cloroform ở môi trường kiềm nhẹ. Sau đó loại dung môi, hoà tan cặn trong HCl 10% và làm các phản ứng tiếp theo.
Nếu mẫu thử là nước tiểu thì tiến hành kiểm hoá rồi cất kéo hơi nước, hứng vào bình có HCl 10%.
Nếu mẫu thử thuốc lá: lấy 10g mẫu, ngâm với 100mL HCl 5%. Đun cách thủy khoảng 20 phút, chiết lấy nước (chiết bốn lần). Gộp dịch chiết lại, kết tủa bằng acid silicotungstic 10%. Ly tâm lấy cặn hoà tan vào HCl 10%. Ly tâm thêm MgO vào và cất kéo hơi nước. Bình nhận có H2SO4 chuẩn và định lượng nicotin theo phương pháp acid base chỉ thị sulfoalizarin.
Các phản ứng định tính:
– Làm phản ứng kết tủa với các thuốc thử alkaloid, nhạy nhất là acid phosphomolybdic, sau đó là thuốc thử Bouchardat.
– Soi tinh thể: cho giọt dung dịch thử vào mặt kính đồng hồ. Đậy lên mặt kính này một mặt kính ở dưới có mang 1 giọt thuốc thử Dragendorff. Đem đun nóng nicotin bốc lên sẽ phản ứng với thuốc thử tạo tinh thể màu đỏ cam giống hình chim bay hay chữ K.
– Phản ứng với iod: dung dịch iod 2-3% trong ether tạo ra với nicotin trong ether một thứ dầu đỏ nâu, sau vài giờ tách ra những tinh thể trong đỏ nâu có ánh lơ.
– Sắc ký lớp mỏng với các hệ dung môi methanol-aceton-triethylamine (100:100:3) hay methanol-amoniac (100:1,5), phát hiện vết bằng đèn UV rồi phun thuốc thử Dragendorff hoặc phun H2SO4 5% rồi phun tiếp kali iodoplatinat.
– Dùng phổ hấp thụ UV trong H2SO4 0,5N có cực đại ở 259 nm (với độ hấp thụ riêng là 343) và ở 228 nm (với độ hấp thụ riêng là 51).
– Thử trên ếch: khi bị ngộ độc nicotin, ếch có tư thế đặc biệt (ngồi lên chân sau, lưng co lại, hai chân trước duỗi ra).
Các phương pháp định lượng:
– Đo quang với phản ứng tạo màu của nhân pyridin: lấy dung dịch nicotin trong ethanol trung hòa bằng acid acetic loãng. Thêm 1 mL brom cyanid (cho dung dịch KCN 10% vào nước brom bảo hoà đến khi mất màu, pha khi dùng). Đun cách thủy 80°c vài phút, thêm 3mL dung dịch benzidin trong acid acetic 1% và vài giọt acid acetic 50% sẽ có màu vàng cam. Độ nhạy cỡ microgram, có thể đo quang ở 470nm để định lượng.
– Nếu hàm lượng nicotin lớn hơn có thể dùng phương pháp chuẩn độ acid base.
3.4. Aconitin và Ô đầu – Phu tử
3.4.1. Nguồn gốc và nguyên nhân ngộ độc
Ô đầu gồm một số loài thuộc chi Aconitum như Aconitum carmichaeli Debx., Aconitum chinense Paxt., Aconitum fortunei Hemsl., thuộc họ Hoàng liên (Ranunculaceae). Còn có các tên khác là ấu tàu, thảo ô, xuyên ô, co u tàu (Thái), ú tàu (Tày), cô y (Mông). Cây mọc hoang và được trồng nhiều ở các tỉnh biên giới nước ta.Trong y học cổ truyền, ô đâu được coi là một trong số bốn vị thuốc quý: sâm, nhung, quế, phụ (tức phụ tử là dạng chê biên của ô đầu). Dạng sống (ô đầu) và dạng chín (phụ tử) đều được sử dụng phô biên. Ô đầu có vị nhạt, the, về sau gây cảm giác kiến bò, được dùng chữa bán thân bất toại, chân tay tê mỏi, gân cơ đau nhức, co quắp. Chỉ dùng rượu ngâm ô đâu với tỉ lệ 10% để xoa bóp ngoài. Dùng riêng hoặc phối hợp ô đầu với nhiều VỊ thuốc khác như nghệ trắng, mật gấu, nhân hạt gấc, mật trăn, huyết lình.
Ô đâu là một vị thuốc rất độc (trước đây thuộc bảng A). Để giảm bớt độc tính, người ta đã chế biến ô đầu (dạng sống) thành phụ tử (thuốc chín) ít độc hơn. Phụ tử lại được chế giảm độc thêm nữa dưới dạng diêm phụ tử, hắc phụ tử và bạch phụ tử.
Phụ tử có vị cay, hơi ngột, tính nóng, có thể dùng uống để “hồi dương” trong những trường hợp cấp cứu như mạch gần như không có, mô hôi ra nhiều, chân tay quờ quạng, phong hàn thấp tý, thận dương hư bất túc, cước khí, thủy thũng. Tuy độ độc có giảm nhưng những người giàu kinh nghiệm chữa bệnh vẫn phải phối hợp với các vị thuốc khác, đặc biệt là cam thảo và gừng sống, sắc kỹ, gạn lấy nước rồi uống. Có người còn nấu lại phụ tử nhiều lần với đậu đen hoặc ngâm nước vôi hoặc nước gạo đặc thật lâu rồi mới dùng.
Xưa nay, người dân ở vùng núi cao coi ô đầu là một vị thuốc quý. Họ cho rằng người già dùng ồ đâu thì nâng cao được thể lực, bớt đau mỏi, ăn ngủ tốt; giới trung niên thì tăng cường khả năng sinh lý, gân xương chắc khỏe. Dạng dùng thông thường là rượu ngâm uống hằng ngày. Phụ nữ sau khi đẻ dùng ô đầu nấu cháo sẽ chóng lại sức, lao động được ngay. Đồi khi dạng cồn xoa bóp cũng được sử dụng.
Alcaloid chính trong ô đầu, phụ tử là aconitin, ngoài ra còn có napellin, japaconitin…
Aconitin là một alcaloid cực độc có trong các loài ô đầu (thuộc chi Aconitum), chủ yếu ở loài ô đầu hoa tím Aconitum napellus L. Aconitin có công thức hóa học C34H47NO11 tinh thể không màu, không mùi, điểm chảy 198°C.
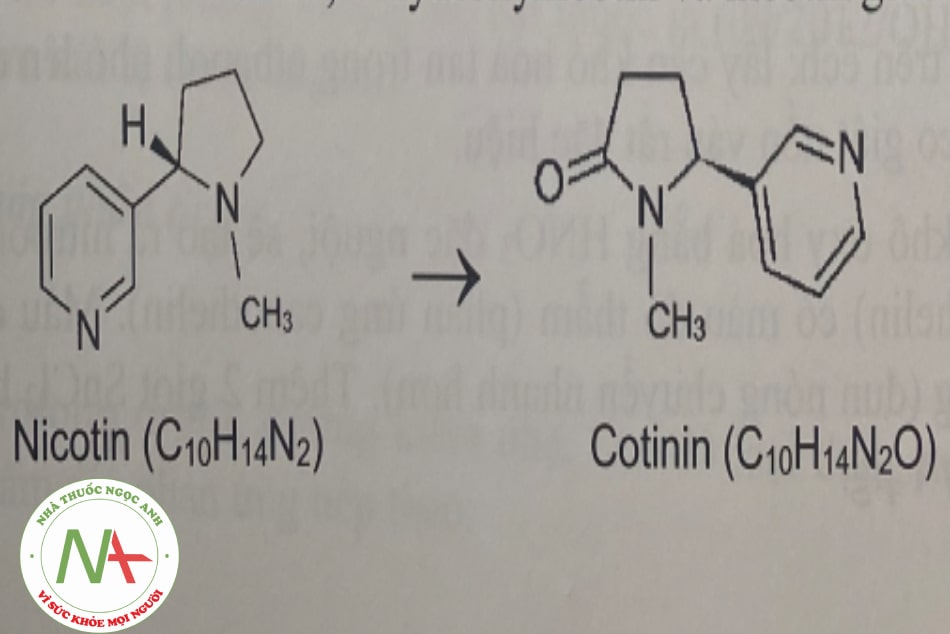
Aconitin dễ hòa tan trong cloroform hay benzen, hòa tan trong rượu hay ether và nói chung không hòa tan trong nước. Dung dịch anconitin hơi kiềm.
Với các acid, aconitin tạo muối dễ hòa tan. Ở môi trường kiềm hoặc trong dung dịch nước đun sôi để thủy phân thành acid acetic và benzoylaconin. Ở nhiệt độ thường hoặc trong dung dịch ethanol loãng cũng cho phản ứng này. Ở 150°C benzoylaconin thủy phân tiêp thành acid benzoic và aconin không độc.
Nguyên nhân ngộ độc do uống quá liều, uống nhầm thuốc hoặc cố tình tự tử hay bị đầu độc. Những vụ ngộ độc xảy ra thường là do uống rượu ngâm ô đầu. ngộ độc còn có thể gặp ở miền núi nâu cháo ô đầu cho sản phụ ăn. Nếu ăn cháo ô đầu lại uống thêm ít rượu thì ngộ độc càng nặng vì rượu giúp aconitin hòa tan tốt hơn.
3.4.2. Độc tính, cơ chế gây độc, triệu chứng ngộ độc và cần xử trí
Độc tính và triệu chứng ngộ độc:
Aconitin và các alcaloid có liên quan tới nó rất dễ bị hấp thu khi nuốt phải cũng như được hấp thu qua đường tiếp xúc với da và các màng nhầy. Aconitin làm gia tăng độ thẩm thấu của ion natri qua các màng ngăn, làm chậm lại quá trình tái phân cực. Nó có tác động tới hệ thần kinh ngoại biên cũng như trung tâm. Ở liều thấp gây ra các tác động kích thích, ở liều cao hơn một chút thì tạo cảm giác nóng bỏng, gây nôn mửa, chóng mặt còn ở liều cao hơn nữa thì gây tê liệt và dẫn tới tử vong do trụy tim.
Aconitin rất độc, liều gây tử vong với người nằm trong khoảng 2-5 mg/kg theo đường miệng, liều 2mg đã gây ngộ độc nặng. triệu chứng ngộ độc bắt đầu bằng cảm giác ngứa kim châm ở lưỡi sau lan ra họng, mặt, rôi ngứa cổ và ho, ngứa như kiến bò ở tay, ngón chân sau bị tê. Sau đó chóng mặt, nôn mửa, chân tay lạnh, toát mồ hôi, tim đập nhanh, nhỏ không đều, đại tiểu tiện ra quần, rối loạn hô hấp, có khi bất tỉnh. Nếu nặng thì thân nhiệt hạ thấp, mạch đập chậm, người xỉu đi, cuối cùng tử vong vì ngạt thở.
Đáng chú ý hơn cả là những rối loạn nhịp tim, chủ yếu là ngoại tâm thu. Từ ngoại tâm thu lẻ tẻ đến ngoại tâm thu nhiều hơn đi thành nhịp đôi, nhịp ba đến những trường hợp nặng ngoại tâm thu nhiều, đa dạng đi thành từng loạt liền nhau như những cơn kịch phát thất ngắn, đe dọa chuyển sang rung thất chết người.
Xử trí:
Không cần rửa dạ dày vì người bệnh đã nôn rất nhiều. Trường hợp nhẹ chỉ cần cho atropin 1-2mg tiêm dưới da, nếu cần 4-6 giờ sau tiêm lại.
Phải theo dõi kỹ tim mạch. Khi huyết áp tâm thu hạ dưới 70 mmHg, truyền ngay noradrenalin 4-5mg pha vào 500mL glucose 5%. Nếu cơn nhanh thất kéo dài hoặc rung thất thì sốc điện là tốt nhất. Những trường hợp nặng cần tiến hành xoa bóp tim ngoài lồng ngực và thổi ngạt trực tiếp. Xử trí nhanh chóng và kiên nhẫn chắc chắn sẽ cứu sống được nạn nhân.
Đẻ bảo đảm an toàn tốt nhất là không nên tự ý dùng ô đầu, phụ tử nấu cháo ăn, ngâm rượu để xoa bóp. Muôn vậy phải quản lý không để bán tự do ở các chợ.
3.4.3. Phương pháp phân tích
Aconitin là alcaloid khó phân tích vì liều dùng nhỏ do rất độc nên phản ứng không đặc hiệu. Mặt khác lại còn rất dễ bị thủy phân, lượng chiết ra không đủ làm phản ứng. Nếu chết vì aconitin hay phụ tử, mổ tử thi sẽ không thấy có dấu hiệu đặc biệt, ngoài xung huyết ở niêm mạc miệng, dạ dày và ruột.
Chiết aconitin bằng cloroform ở môi trường kiềm nhẹ (không dùng kiềm mạnh vì aconitin sẽ thuỷ phân), lấy dịch chiết làm phản ứng sau:
– Phản ứng với thuốc thử chung của alcaloid, với H2SO4 đặc cho màu vàng cam chuyển sang tím hoặc nâu.
– Làm khô một ít dịch chiết, thêm 5-10 giọt nước brom và HNO3 đặc. Đun cách thủy khô cặn có màu đỏ hoặc nâu. Thêm vài giọt CuSO4 sẽ có màu xanh ve.
– Làm khô một ít dịch chiết, thêm lmL H2SO4, đun vài phút. Thêm một vài tinh
thê resorcin, đun tiếp 20 phút sẽ xuất hiện màu đỏ tím. Để nguội, trung hoà bằng Na2CƠ3
bảo hoà, nếu dịch chiết không có tạp chất dung dịch sẽ có huỳnh quang xanh lơ.
– Sắc ký lớp mỏng: với các hệ dung môi benzen-ethyl acetat-diethylamin (7:2:1);
cloroform-aceton-diethylamin (5:4: 1) hay cyclohexan- cloroform- diethylamin (5: 4:1). Phát hiện vết bằng cách soi dưới đèn uv sau khi phun dung dịch fluorescein 0,2% hay dung dịch kali iodoplatinat.
– Tiêm cho chuột lang 1/40 mg aconitin, trong vòng nửa giờ chuột sẽ chết với các triệu chứng: tiếng kêu rít, hai chân trước dãy dụa, ngứa ở miệng, lông dựng ngược, mồm nhai, mình hơi run, nấc, chết do ngạt.
3.5. Atropin và các alcaloid có trong các dược liệu họ Cà
3.5.1. Nguồn gốc và nguyên nhân gây độc
Một số cây thuộc họ Cà (Solanaceae) như Atropa belladona và Datura stramonium có chứa các alcaloid độc: atropin, hyoscyamin. Ở nước ta có cây Cà độc dược (Datura metel Lour) có hàm lượng toàn phần alcaloid từ 0,2-0,5%, ngoài scopolamin là chủ yếu còn có hyoscyamin, atropin…
Atropin (C17H23NO3) có tinh thể hĩnh kim, không màu, vị rất đắng. Điểm chảy 115,5°C, ít tan trong nước, tan được trong ether, tan nhiều trong cồn ethylic, amylic và cloroform. Muối thường gặp là atropin sulfat chứa 83,3% atropin, rất dễ tan trong nước.
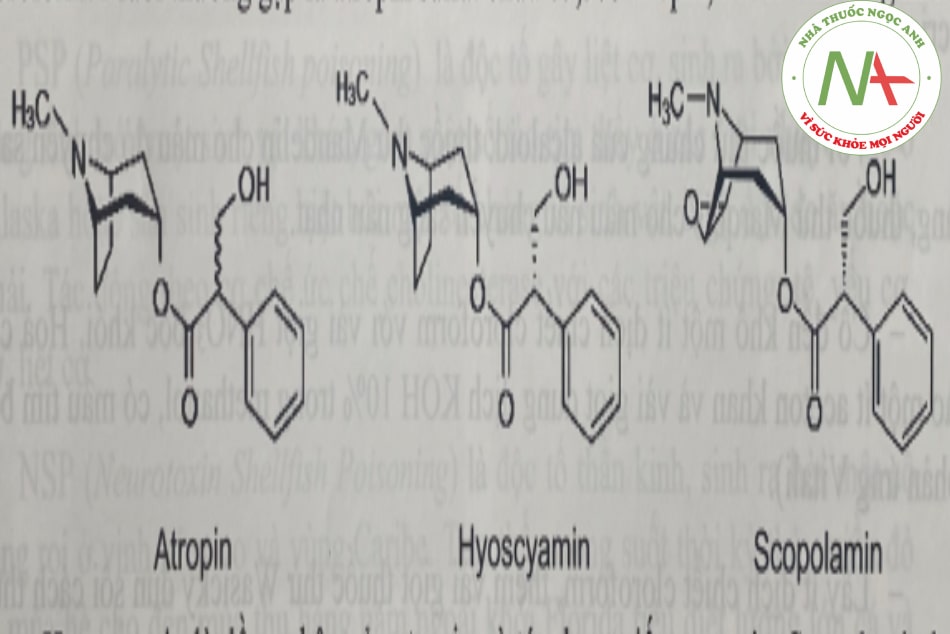
Hyoscyamin là đồng phân của atropin và tác dụng giống atropin. Scopolamin hay hyoscin có cấu trúc giống atropin.
Những trường hợp ngộ độc cấp chủ yếu do nhầm lẫn: uống phải thuốc nhỏ mắt, thuốc xoa bóp… dùng quá liều thuốc nhỏ mắt, thuốc uống, cá biệt có trường họp ngộ độc qua da do dùng quá nhiều thuốc xoa bóp có chứa atropin.
3.5.2. độc tính, triệu chứng ngộ độc và cách xử trí
Tác dụng dược lý chủ yếu là do các alcaloid: làm giãn phế quản, giãn đồng tử, giảm nhu động ruột và dạ dày nêu những cơ quan này co thắt, làm khô nước bọt, dịch vị, mồ hôi.
Atropin và các alcaloid của nhóm này có tác dụng hủy phó giao cảm, khi bị ngộ độc có các triệu chứng:
– Khô miệng rõ rệt, có khi kèm theo khó nói, khó nuốt, khát nhiều.
– Da nóng và đỏ toàn thân.
– Thân nhiệt tăng, có khi đến 40°c, tim đập nhanh dẫn tới tăng huyết áp tạm thời.
– Bí đái, có khi táo bón, chướng bụng.
– Giãn đồng tử là dấu hiệu rất quan trọng, rất có giá trị chẩn đoán nhất là những trường hợp khó. Có khi đồng tử giãn choán gần hết lòng đen. Đồng tử hai bên đều giãn nên nhìn mờ, sợ ánh sáng, không nhìn gần được. Sau đó mất phản xạ với ánh sáng.
– Rối loạn tinh thần, nói nhiều, cười nhiều, không ngủ được, nặng có thể bị ảo giác. Sau đó tê liệt và hồn mê dẫn đến tử vong sau 5-10 phút.
Xử trí:
– Nếu uống phải tốt nhất rửa dạ dày ngay. Nên pha vào nước rửa dạ dày thuốc tím, tanin, than hoạt hoặc lugol.
– Chữa triệu chứng: an thần bằng bacbiturat liều thấp, nằm nghỉ trong buồng tối. Chườm đá để hạ nhiệt. Tiêm dưới da pilocarpin 5-10mg (hoặc dùng physostigmin 1- 2mg) để làm co đồng tử, bớt khô miệng. Duy trí hô hấp, tuần hoàn và cân bằng nước điện giải.
3.5.3. Phương pháp phân tích
Atropin cho phản ứng với thuốc thử chung của alcaloid: Mayer, Dragendorff, acid picric.
– Với thuốc thử chung của alcaloid: thuốc thử Mandelin cho màu đỏ chuyển sang vàng, thuốc thử Marquis cho màu nâu chuyển sang nâu nhạt.
– Cô đến khô một ít dịch chiết cloroform với vài giọt HNƠ3 bốc khói. Hoà cặn vào một ít aceton khan và vài giọt dung dịch KOH 10% trong methanol, có màu tím bền (phản ứng Vitali).
– Lấy ít dịch chiết cloroform, thêm vài giọt thuốc thử Wasicky đun sôi cách thủy có màu tím đỏ (phản ứng Wasicky). Thuốc thử Wasicky được chuẩn bị bằng cách hòa tan 2g p-dimethylaminobenzaldehyd trong 6g H2SO4 đặc và 3mL nước.
– Phản ứng trên mắt mèo hoặc mắt thỏ: lấy ít cặn khô của dịch chiết hòa tan vào một ít HC1 loãng, trung tính hoá rồi nhỏ vào mắt mèo hoặc thỏ nếu có atropin sẽ thấy đồng tử giãn. Người ta có thể nhỏ một giọt nước tiểu của người bệnh vào mắt một con mèo để chẩn đoán ngộ độc atropin.
Cần chú ý atropin rất dễ bị thủy phân và kéo theo hơi nước cho nên cần chú ý lúc chiết chỉ dùng kiêm nhẹ như amoni hydroxyd, không để hiện tượng sủi bọt, không để lâu trong môi trường kiềm, đuổi dung môi làm ở nhiệt độ thấp.
– Sắc ký: tiến hành như với aconitin.
– Phương pháp quang phổ uv không nhạy vì độ hấp thụ riêng thấp (cỡ 9-10).
4. Một số độc tố thường gặp trong thực phẩm
4.1. Tetrodotoxin và một số thực phẩm chứa độc tố
4.1.1. Một số độc tố thường gặp trong thủy sản
Ở các vùng biển có rất nhiều loài thủy sản có khả năng tạo ra độc tố. Có sáu loại độc tố thường được tìm thấy trong thủy sản, gồm các nhóm: độc tố thần kinh (tetrodotoxin), độc tố gây tiêu chảy (CFP, DSP), độc tô gây liệt cơ (PSP), độc tố gây loạn thần kinh (NSP), độc tố gây mất trí nhớ (ASP):
– Tetrodotoxin (Puffer Fish Poisoning) là một loại độc tố thần kinh sinh ra do sự cộng sinh của vi sinh vật trên cơ thể một số loài như cá nóc, bạch tuộc…
– CFP (Ciguatera Fish Poisoning) là loại độc tố gây tiêu chảy phổ biến nhất, sinh ra bởi loài trùng roi Gambierdicus toxicus ký sinh trên cá, gôm hai độc tố chính là: ciguatoxin và maitotoxin. Vài giờ sau khi ăn phải xuất hiện triệu chứng: nôn, tiêu chảy, ngứa, yếu, mệt kéo dài 2-3 ngày có khi đến 1 năm. Có thể gây vỡ mạch máu dẫn đến tử vong. Cơ chế tác động: ciguatoxin tan trong dầu, ngăn cản kênh vận chuyển Na+ trong màng tế bào dẫn đến sự không cực của màng làm ngừng xung điện thần kinh, gây ra chứng tắc nghẽn thần kinh. Nạn nhân tử vong do tê liệt hô hấp.
– DSP (Diarrhetic Shellfish Poisoning) là nhóm gồm nhiều độc tố gây tiêu chảy, sinh ra do nhuyễn thể ăn phải tảo độc. Sau 30 phút cho đến vài giờ sau khi dùng phải nhuyễn thể có chứa độc tố xuất hiện triệu chứng rối loạn đường ruột (tiêu chảy, nôn mửa, đau bụng). Nạn nhân có thể bình phục sau 3-4 ngày không cần điều trị, ít gặp trường hợp tử vong.
– PSP (Paralytic Shellfish poisoning) là độc tố gây liệt cơ, sinh ra bởi vi sinh vật sống cộng sinh trên một sinh vật khác, gồm một số tảo tìm thấy ở các loài nhuyễn thể ở vùng Alaska hoặc sản sinh riêng biệt bởi một số chủng vi sinh vật. ngộ độc do ăn hoặc ngửi phải. Tác động theo cơ chế ức chế cholinesterase với các triệu chứng: tê, yếu cơ, khó thở, liệt cơ.
– NSP (Neurotoxin Shellfish Poisoning) là độc tố thần kinh, sinh ra bởi một số loài trùng roi ở vịnh Mexico và vùng Caribe. Tìm thấy trong suốt thời kỳ thủy triều đỏ từ cuối mùa hè cho đến mùa thu hàng năm ngoài khơi Florida tiêu diệt lượng lớn cá và chim. Gây ra các triệu chứng giống độc tố PSP theo cơ chế: giải phóng Na+ trong quá trình vận chuyển ion vào trong tế bào, phá huỷ acetylcholin gây ra sự giải phóng thần kinh, gây co cơ.
– ASP (Amnesic Shellfish Poisoning) độc tố gây mất trí nhớ, sinh ra từ một số tảo đỏ Chondỉrỉa armuta, Digenea simplex… gồm acid domoic, acid kainic và các đồng phân. Gây buồn nôn và tiêu chảy sau 3 0 phút đến 6 giờ, tác động dạ dày, thần kinh gây hoa mắt, choáng, ngất có thể bình phục sau vài ngày. Nếu nồng độ cao có thể phá huỷ tế bào thần kinh tạm thời hoặc vĩnh viễn gây mất trí nhớ, có thể dẫn đến tử vong. Tác động theo cơ chế: acid domoic làm tăng cao Ca2+ nội bảo và thương tổn não, đặc biệt trong vùng CA 1 và cA3 (vùng chịu trách nhiệm về việc học và nhớ). Tuy vậy, liều lượng gây mất trí nhớ thấp hơn mức gây độc.
4.1.2. Cóc, cá nóc và một số loài thủy sản thường có chứa độc tố
Cóc:
Trên thế giới cũng như Việt Nam đã có nhiều trường hợp ngộ độc do ăn thịt cóc, xuất phát từ quan điểm loại thịt này bổ dưỡng hơn thịt gà, bò, rất có lợi cho những người suy dinh dưỡng, còi cọc hoặc suy kiệt. Một số tài liệu Đông y có đề cập đến thịt cóc như một nguồn dinh dưỡng rất giàu đạm, là một trong những bài thuốc chữa bệnh suy dinh dưỡng ở trẻ em. Các tuyến trên da cóc bài tiết ra chất nhầy màu trắng, dính keo, dân gian gọi là “nhựa cóc”. Đây là hỗn hợp độc tố có khả năng gây ảo giác, nghẽn mạch và tăng áp suất máu. ngoài ra, một số loài cóc còn chứa cả độc tố tetrodotoxin (có ở cá nóc) thông qua cơ chế cộng sinh với một số vi khuẩn.
Cá nóc:
Cá nóc (có nơi gọi là cá cóc, cá bống biển, cá đùi gà) với hàng trăm loài trên thế giới, ở Việt Nam có gần 70 loài khác nhau. Cá nóc sống ở nước mặn nhiều hơn ở nước ngột. Loại cá nóc độc người dân ăn thường có thân 4-40cm, chắc, vây ngắn, đầu to, mắt lồi, thịt trắng.

Trong các loài thủy sản, cá nóc chứa nhiều độc tố nhất. Người ta tìm thấy nhiều chất độc có ở các bộ phận khác nhau của cá như: trong buồng trứng có tetrodonm acid tetrodonin, tetrodotoxin; trong gan có hepatoxin. Ở da và trong mau cá cũng tìm thay các loại chất độc trên. Thịt cá thường không độc, nhưng khi cá chết, cá bị ươn thối chất độc từ buồng trứng, gan sẽ ngấm vào thịt cá. Khi đó thịt cá trở nên độc chất độc của cá nóc tập trung ở da, ruột, gan, cơ bụng, tinh hoàn và nhiều nhất ở trứng cá, vì vậy con cái độc hơn con đực và đặc biệt mùa cá đẻ trứng.
Mực đốm xanh:
Mực đốm xanh thường sống ở những vùng biển nước nông, có độ sâu dưới 50m hay gặp ờ Ấn Độ Dương, Bắc úc, phía Tây của Thái Bình Dương, trong đó có khu vực biển Đông của nước ta. Mực thường sống ở các dải san hô, khe đả, có thể chúng còn ẩn mình trong vỏ trai biên, chai lọ hoặc ống bơ vứt xuống dưới biển. Maculotoxin và tetrodotoxin ở mực rất độc và rất bền vững, có thể tồn tại với nồng độ cao ngay cả khi mực đã chết và dù đã chế biến ở nhiệt độ cao. Chính vì vậy, ăn mực đốm xanh rất dễ bị ngộ độc nặng và có thể dẫn tới tử vong.
Cua mặt quỷ:
Loài cua này phần vỏ ngực rộng nhất khoảng 90mm, dài khoảng 55mm, có nhiều u lồi dẹt. Cua sống có màu xanh da trời pha xanh lá cây với những nốt màu trắng, nâu và vàng. ngộn các chân
kìm có màu nâu đen.
Cua mặt quỷ có ở các tỉnh ven biển miền Trung từ Đà Nẵng đến Vũng Tàu, thường gặp ở các vùng triều thấp.
Độc tố trong cua có dạng “Saxitonin” nằm trong thịt và trứng, nhiều nhất là trong thịt càng và chân cua. Một người ăn chỉ 0,5 g thịt càng cua loại này là có thể ngộ độc dẫn đến tử vong.
4.1.3. Tetrodotoxin
Trên thế giới hiện nay, vấn đề ngộ độc các thực phẩm chứa tetrodotoxin mà đặc biệt là ngộ độc cá nóc đã và đang là thực trạng nổi cộm, gây hậu quả nghiêm trọng vệ sức khỏe và tính mạng của người tiêu dùng. Tại Nhật Bản, có 1.962 người bị ngộ độc do ăn cá nóc trong 10 năm (1954-1963) có tới 1153 (87,76%) trường hợp bị tử vong. Cũng theo thống kê số người bị ngộ độc và chết vì cá nóc lên đến 60% trong tổng số các vụ ngộ độc do ăn các sản phẩm thuỷ sản.
Độc tố trong cá nóc có thành phần chủ yếu là từ endotoxin, thuộc nhóm độc tố thần kinh cực kỳ nguy hiểm, tỉ lệ gây tử vong khá cao. Tetrodotoxin cũng được phân lập từ một số loại vi khuẩn {Epiphytic bacterium, Pseudomonas species…), ở da và nội tạng kỳ nhông, bạch tuộc vòng xanh, cóc, cá nóc…
Tetrodotoxin (C11H17O8N3) tan trong nước. Tetrodotoxin rất bền vững, không bị nhiệt phá huỷ, nấu chín hay phơi khô, sấy, độc chất vẫn tồn tại. Chỉ bị phân hủy trong dung dịch HC1 0,2-0,3% sau 8 giờ, đun sôi (100°C) thì sau 6 giờ mới giảm được một nửa, muốn phá hủy hoàn toàn phải đun ở 200°C trong 10 phút.
Tetrodotoxin được coi là một trong những chất có độc tính mạnh nhất đối với hệ thần kinh và tim mạch. Những nghiên cứu khoa học trước đây cho thấy có thể sử dụng chất độc này để điều chế thuốc tê, hạ huyết áp, điều trị các bệnh viêm phế quản, kích thích hoạt động của hệ thần kinh, hệ tuần hoàn và hỗ trợ điều trị nghiện ma túy, rượu, thuốc lá.
Octahydro-12-(hydroxymethyl)-2-imino-5,9:7,10a-dimethano-10aH-[1,3]
dioxocino [6,5-d] pyrimidine-4,7,10,11,12-pentol
Một công ty của Canada đã tận dụng chất độc trong loài cá blowfish để giúp người bệnh ung thư vượt qua được những cơn đau hoặc giúp con nghiện heroin cat cơn. Từ chất độc tetrodotoxin trong cá blowfish, người ta đã chế ra thuốc tiêm Tectin. Quạ nghiên cứu dùng hai lần một ngày, trong bốn ngày kết quả cho thấy gần 70% số người thử nghiệm có cơn đau giảm đi. Cơn đau giảm vào ngày thứ ba và hiệu quả của thuốc còn có thể kéo dài thêm 15 ngày. Theo các chuyên gia, Tectin có thể ngăn chặn tế bào thần kinh chuyển tín hiệu đau đến não. Khác với các loại thuốc giảm đau khác, Tectin không gây ra tác dụng phụ như morphin, không xung đột với các loại thuốc khác và cũng không gây nghiện.
Nguyên nhân và triệu chứng ngộ độc:
Do quan niệm sai lầm thịt cá nóc trắng, dai và có vị thơm như thịt gà, bổ và giàu dinh dưỡng như thịt cóc, cá nóc chỉ độc nếu như không biết làm sạch (bỏ ruột, gan…) hoặc nếu được chế biến tốt (nấu thật kỹ trong vài giờ) sẽ không còn độc tính nữa, ăn sẽ không sao… Cá nóc bảo gồm nhiều loài khác nhau, độc và không độc. độc tố của cá nóc biến động khá phức tạp theo mùa vụ và theo cá thể. Trong cùng một loài có thời điểm trong năm mang độc tính cao (trong mùa màng trứng cá nóc sẽ trở nên độc hơn. độc tố cá nóc cao nhất ở gan và trứng, nhưng toàn bộ cơ the đều có chứa độc tố, do đó chỉ ăn thịt cá nóc vẫn có khả năng bị ngộ độc. Những giá trị dinh dưỡng đặc biệt của thịt cá nóc như những lời đồn đại chưa được chứng minh, còn mức độ thơm ngộn thì hoàn toàn tùy thuộc vào cảm nhận cá nhân.
Biểu hiện ngộ độc thường là chóng mặt, buồn nôn, nôn, mất tiếng mệt lả khó thở, liệt tăng dần, dẫn tới trụy tim mạch. Không ít trường hợp ngộ độc dẫn tới tử vong!
Xử trí:
Độc tố này là hợp chất bền nhiệt, không bị phân hủy trong quá trình nấu chín Người bị ngộ độc cá nóc bị ảnh hưởng lớn đến sức khỏe và tính mạng- Đặc biệt là chưa có thuốc giải đặc hiệu cho các trường hợp ngộ độc cá nóc. Biện pháp chữa trí chi la nra dạ dày hoặc dùng than hoạt tính đế thải loại bớt chất độc, hô hấp nhân tạo, tràn dịch nhằm tăng cường sức đề kháng của cơ thế…
– Ngay khi có dấu hiệu đầu tiên như tê môi, tê tay (người bệnh vẫn còn tính): gây nôn ngay nhưng phải đề phòng người bệnh bị sặc (để người bệnh nằm tư thế nghiêng, đầu thấp). Cho nạn nhân uống than hoạt với liều 30g cho người lớn trộn đều với 250mL nước sạch, 25g cho trẻ 1-2 tuổi với 100-200mL nước, 1g/kg cân nặng cho trẻ dưới 1 tuổi với 50mL nước. Sau đó chuyển ngay đến bệnh viện. Uống than hoạt sớm trong vòng 1 giờ sau khi ăn cá sẽ có hiệu quả cao, loại bỏ chất độc nhanh, không nên cho uống khi người bệnh đã hôn mê hay rối loạn ý thức.
– Nếu người bệnh có biểu hiện rối loạn ý thức, hôn mê, thở yếu hoặc ngừng thở… thì tiến hành hà hơi thổi ngạt theo đường miệng hay mũi và chuyển gấp đến bệnh viện để được cấp cứu kịp thời.
Đối với người dân, để phòng tránh ngộ độc cá nóc, biện pháp tốt nhất là không ăn cá nóc. Không được làm kho, cha hay bột cá nóc thay các loại cá khác để bán. Do đó trước mắt phải có những cảnh bảo, khuyến cáo rộng rãi không những về mức độ nguy hiểm của ngộ độc từ cá nóc mà còn về nhận dạng các loài cá nóc độc nhăm giúp người dân tránh mua hoặc sử dụng nhầm cá nóc.
4.2. Một số độc tố vi nấm thường gặp trong thực phẩm
Độc tố vi nấm (mycotoxin) là các hợp chất có độc tính được sinh ra trong tự nhiên bởi một số chủng vi nấm có khả năng sinh độc tố. Phần lớn các nấm mốc có khả năng sinh độc tố thuộc ba chi Aspergillus, Penicillium và Các nấm thuộc chi Aspergillus, Penicillium thường có tính chất hoại sinh và tấn công, gây hại cho thực phẩm trong quá trình bảo quản, tuy vậy một số chủng Aspergillus cũng có thể phát triển trong quá trình canh tác nông sản. Chi Fusarium bảo gồm các loài gây hại cho cây trồng, đồng thời có thể gây hoại sinh trên thực phẩm. Các điều kiện để vi nấm phát triển và sinh độc tố trên thực phẩm bảo gồm: độ ẩm, nhiệt độ, độ pH, cơ chất… Các loại thực phẩm thường nhiễm nấm mốc và độc tố nấm mốc gồm có ngũ cốc, lạc, ngộ, hạt sen, các loại hạt có dầu khác, hạt bông, cà phê, trái cây…
4.2.1. Aflatoxin
Aflatoxin là độc tố sinh ra bởi một số chủng nấm Aspergillus flavus và Aspergillus parasiticus.
Trong tự nhiên có sáu loại aflatoxin chính. Trong số này, bốn loại Aflatoxin Bl, Aflatoxin B2, Aflatoxin Gl, Aflatoxin G2 thường bị nhiễm trong lạc, ngô, lúa mì, hạt bông, cùi dừa, các loại hạt có dầu…
Aflatoxin BI Aflatoxin B2 Aflatoxin GI Aflatoxin G2
Còn hai loại Aflatoxin MI và Aflatoxin M2 chủ yếu chỉ bị nhiễm trong sữa và một số sản phẩm của sữa do các động vật cho sữa được nuôi bằng thức ăn chăn nuôi bị nhiễm aflatoxin.
Aflatoxin M2
Aflatoxin phơi nhiễm vào cơ thể người thông qua tiêu thụ thực phẩm bị nhiễm.
Thử nghiệm trên động vật cho thấy aflatoxin có khả năng gây nhiễm độc cho gan, tăng sản ống mật, chảy máu đường tiêu hóa và xuất huyết trên thận. Đặc biệt khả năng gây ung thư nên người của Aflatoxin BI và Aflatoxin G1 đã được chứng minh, ủy ban chuyển gia của FAO/WHO về phụ gia thực phẩm (JECFA) đã xem xét, phân tích tác động của aflatoxin lên sức khỏe con người, kết quả cho thấy trong số các aflatoxin, Aflatoxin B1 có khả năng gây ung thư gan mạnh nhất. Khả năng tác động của aflatoxin lên cá thể mang HBsAg+ cao hơn trên cá thể HBsAg- do vậy giảm lượng aflatoxin phơi nhiễm trên nhóm mang HBsAg+ sẽ làm giảm khả năng mắc ung thư gan trên nhóm này. Viện Nghiên cứu ung thư quốc tế (IARC) đã xếp Aflatoxin BI vào nhóm 1 – nhóm gây ung thư trên người.
Trong một nghiên cứu phát hiện và định lượng aflatoxin trong bệnh phẩm gan và dịch cổ trướng của người bệnh ung thư gan nguyên phát cho kết quả 100% các mẫu bệnh phẩm gan phát hiện Aflatoxin B1 dao động từ 1,1 ppb đến 3,1 ppb và 100% mẫu bệnh phẩm dịch cổ trướng phát hiện Aflatoxin BI từ 0,7 ppb đến 1,7 ppb.
4.2.2. Một số độc tố vi nấm khác
Ochratoxin
Ochratoxin là độc tố sinh ra bởi một số chủng nấm Aspergillus ochraceus và Penicillium viridicatum hoặc một số loài Penicil Khác. Trong các loại ochratoxin thì Ochratoxin A là quan trọng nhất, thường bị nhiễm trong các loại ngũ cốc (lúa mì, lúa mạch, ngộ…), đậu hạt khô, lạc, cà phê…
Ochratoxin có khả năng gây nhiễm độc thận, gan. Thử nghiệm trên động vật cho thấy ochratoxin có nguy CO lam tăng khối U tế bào gan và gây ung thư thận trên chuột.
Tuy nhiên do chưa có thể kết luận chắc chắn về khả năng ochratoxin gây ung thư trên người nên IARC chỉ phân loại ochratoxin vào nhóm 2B – có thể gây ung thư đối với người (possibly carcinogenic to humans).
Trichothecene
Trichothecene là nhóm các độc tố do vi nấm Fusarium sinh ra, trong tự nhiên nhóm này có khoảng 20 chất, thường gặp nhất là deoxynivalenol (DON) và T-2 Nhorn độc tố này thường bị nhiễm trong thức ăn chăn nuôi, ngộ và lúa mì.
Deoxynivalenol có khả năng ảnh hưởng đến hệ miễn dịch, sự phát triển và sinh sản của người. JECFA, ỈAC cho rằng DON không phải là tác nhân gây ung thư, tuy nhiên DON có thể gây ngộ độc cấp tính trên người.
Zearalenon
Zearalenon (F2) là độc tố do vi nấm Fusarium gramineraum và một số chủng Fusarium khác sinh ra, thường bị nhiễm trong ngũ cốc, ngộ do điều kiện bảo quản không đảm bảo (quá ẩm).
Zearalenon có độc tính thấp, tuy nhiên có tác dụng như hormon sinh dục nữ, thúc đẩy sự phát triển của tuyến sữa, làm teo tih hoàn, … trên chim, chuột, lợn, bò…
Fumonisin
Fumonisin (FMS) là nhóm các độc tố do vi nấm Fusarium moniliforme và Fusarium prolifilatum sinh ra, thường bị nhiễm trong ngộ.
IARC đã phân loại FMS-B1 thuộc nhóm 2B-CÓ thể gây ung thư trên người. Trên cơ sở các nghiên cứu về độc học, ủy ban khoa học thực phẩm trực thuộc Tổng Cục bảo vệ sức khỏe và người tiêu dùng của EU đã đưa ra nhận định chưa có đủ bằng chứng để kết luận FMS-B1 gây nhiễm độc gen.
CH3 CH3
H3C- (CH2)3- CH- CH- CH- CH2- CH- CH2- CH- (CH2)4- CH- CH2- CH- CH- CH3
OR1 OR1 R2 OH OH NHR3
Al: R1 = = COCH2CH(COOH)CH2COOH R2= = OH; R3= = COCH3
A2: R1 = = COCH2CH(COOH)CH3 R2= ■ft R3 = = COCH3
Bl: R1 = = COCH2CH(COOH)CH2COOH R2= = OH; R3= = H
B2: R1 = = COCH2CH(COOH)CH2COOH R2= = H; R3= = H
Patulin
Patulin (PTL) là độc tố do một số chủng nấm Penicillium, Aspergillus sinh ra trong quá trình ôi hỏng của táo. Patulin thường bị nhiễm trong các sản phẩm chế biến từ táo (nước táo, bánh táo…).
Pạtulin có khả năng ức chế hoạt động nhiều loại enzym. Dạng patulin liên kết với cystein ít độc hơn dạng không liên kết. Nó có thể gây ra loét, phù nề và xuất huyết tiêu hoá, có khả năng gây độc cho bào thai (trên chuột)7 có khả năng gây độc gen trên tế bào của động vật có vú trong khi đó không gây độc đối với tế bào của vi khuẩn.
Tuy vậy, chưa đủ bằng chứng xác định gây ung thư trên người nên patulin được IARC xếp vào nhóm 3 (Not classifiable as to its carcinogenicity to humans).
Citrinin
Citrinin (CTN) là độc tố màu vàng do một số chủng nấm Penicillium, Aspergillus và Byssochlamys nivea, Penicillium expansum sinh ra trong các loại ngũ cố (lúa mỳ, gạo, ngô, lúa mạch).
Giống như OCT-A CTN gây độc cho thận, thử nghiệm trên động vật cho thấy OCT gây bệnh thận trên ngỗng và lợn. Tuy nhiên độc tính của CTN thấp hơn OCT-A.
Hiện nay Bộ Y tế đã có quy định mức tối đa nhiễm trong thực phẩm đối với các độc tố vi nấm aflatoxin, ochratoxin, fumonisin, deoxynivalenol, patulin, zearalenon.
Câu hỏi lượng giá
1. Trình bày nguồn gốc, nguyên nhân gây ngộ độc, cơ chế gây độc, các triệu chứng và cách xử trí ngộ độc các cyanogen. Nguyên tắc của các phương pháp phân tích cyanogens.
2. Trình bày nguồn gốc, nguyên nhân gây ngộ độc, cơ chế gây độc, các triệu
chứng và cách xử trí ngộ độc ethanol. Nguyên tắc của các phương pháp phân tích ethanol.
3. Trình bày nguồn gốc, nguyên nhân gây ngộ độc, cơ chế gây độc, các triệu
chứng và cách xử trí ngộ độc methanol. Nguyên tắc của các phương pháp phân tích methanol.
4. Trình bày nguồn gốc, nguyên nhân gây ngộ độc, cơ chế gây độc, các triệu chứng và cách xử trí ngộ độc benzen.
5. Trình bày nguồn gốc, nguyên nhân gây ngộ độc, cơ chế gây độc, các triệu chứng và cách xử trí ngộ độc các barbiturat. Nguyên tắc của các phương pháp phân tích các barbiturat.
6. Trình bày nguồn gốc, nguyên nhân gây ngộ độc, cơ chế gây độc, các triệu chứng và cách xử trí ngộ độc lá ngón.
7. Trình bày nguồn gốc, nguyên nhân gây ngộ độc, cơ chế gây độc, các triệu chứng và cách xử trí ngộ độc mã tiền và strychnin.
8. Trình bày độc tính, nguyên nhân nhiễm độc, các triệu chứng và cách xử trí ngộ độc, nhiễm độc nicotin và thuốc lá. Tìm hiểu các nội chính của Luật phòng, chống tác hại thuốc lá (09/2012/QH13).
9. Trình bày độc tính, nguyên nhân ngộ độc, các triệu chứng và cách xử trí ngộ độc aconitin và ô đầu-phụ tử.
10. Trình bày độc tính, nguyên nhân ngộ độc, các triệu chứng và cách xử trí mô độc atropin.
11. Nguyên ngộ độc, các triệu chứng ngộ độc và cách xử trí ngộ độc tetrodotoxin. Kể tên một số thủy sản có chứa độc tố nay.
12. Kể tên và độc tính của một số độc tố nấm.
