Tác giả: Phó giáo sư. Tiến sĩ Dược sĩ Nguyễn Đăng Hòa.
Bài viết ĐẠI CƯƠNG VỀ BÀO CHẾ VÀ SINH DƯỢC HỌC trích trong chương 1 sách Bào chế và sinh dược học bào chế – giáo trình đào tạo dược sĩ đại học bộ môn bào chế trường Đại học Dược Hà Nội.
MỤC TIÊU HỌC TẬP:
- Nêu được các lĩnh vực nghề nghiệp cần áp dụng các kiến thức, kỹ năng về bào chế và sinh dược học bào chế.
- Trình bày được khái niệm về dạng thuốc, độ ổn định, tuổi thọ và hạn dùng của thuốc.
- Hệ thống được về cách phân loại các dạng thuốc.
- Trình bày được thành phần chung về dược chất và tá dược trong dạng thuốc.
- Nêu được chức năng và yêu cầu chung của bao bì đựng thuốc.
- Trình bày được ưu nhược điểm, thành phần, phần loại và yêu cầu kiểm tra chất lượng bao bì đựng thuốc bằng thủy tỉnh, chất dẻo, cao su, kim loại.
- Trình bày được quá trình sinh dược học của thuốc và khái niệm sinh khả dụng.
- Phân tích được ảnh hưởng của yếu tố dược học đến sinh khả dụng, vận dụng trong bào chế và hướng dẫn sử dụng các dạng thuốc.
- Phân tích được ảnh hưởng của yếu tố sinh học đến sinh khả dụng, vận dụng trong bào chế và hướng dẫn sử dụng các dạng thuốc.
- Trình bày được nguyên tắc đánh giá sinh khả dụng và nêu được ý nghĩa của sinh khả dụng.
- Nêu được một số khái niệm về tương đương và nguyên tắc đánh giá tương đương sinh học.
1. GIỚI THIỆU SƠ LƯỢC VỀ BÀO CHẾ VÀ SINH DƯỢC HỌC BÀO CHẾ
Lịch sử ghi nhận từ thời Ai Cập cổ đại (khoảng 3000 trước Công nguyên), các nhà hiền triết kiêm thầy thuốc đã biết pha chế thuốc chữa bệnh từ các nguyên liệu động vật, thực vật và khoáng vật. Nhiều sản phẩm từ cây cỏ, động vật, khoáng vật được ghi chép đến nay vẫn đang được sử dụng, ví dụ như opium, nhựa thơm, cam thảo.
Với sự cống hiến của Claudius Galenus (210 – 131 trước Công nguyên), thầy thuốc thời đế chế La Mã. Ông đã để lại hàng trăm tác phẩm về y học, trong đó có sách về phân loại thuốc và chi tiết về cách pha chế một số dạng thuốc. Từ đó, ông được coi là người sáng lập môn Bào chế học và người ta lấy tên ông đặt tên cho môn học “Pharmacie Galenique”.
Từ cuối Thế kỷ thứ XIX đầu Thế kỷ XX, nhờ sự phát triển của các ngành khoa học vật lý, hoá học, sinh học…, đã thúc đẩy cho Bào chế học phát triển mạnh mẽ. Kỹ thuật bào chế thuốc đã được xây dựng trên cơ sở vận dụng thành tựu của nhiều môn khoa học liên quan, Ngành công nghiệp dược phẩm ra đời với nhiều dạng thuốc được sản xuất công nghiệp như thuốc tiêm, viên nén, viên nang mêm…
Cách mạng khoa học kỹ thuật không ngừng phát triển, sản xuất dược phẩm cũng không ngừng phát triển với hệ thống máy, thiết bị dùng trong sản xuất dược phẩm ngày càng hiện đại, cho ra thị trường nhiều biệt dược (biệt dược là tên của nhà sản xuất đặt cho sản phẩm thuốc của họ) với hình thức trình bày đẹp, hấp dẫn, thay thế dần thuốc pha chế theo đơn, giúp cho thầy thuốc và người bệnh có nhiều lựa chọn thuốc trong điều trị.
Tuy nhiên, bắt đầu từ những năm 60 của thế kỷ 20, người ta nhận thấy rằng một sản phẩm thuốc có hình thức đẹp chưa chắc đã có tác dụng tốt. Khởi đầu từ Mỹ, qua thực tế sử dụng trên lâm sàng, thầy thuốc và người bệnh đã phát hiện ra nhiêu biệt dược của các nhà sản xuất khác nhau, tuy cùng dạng thuốc, cùng hàm lượng dược chất (tương đương về bào chế), cùng đường dùng thuốc, nhưng đáp ứng điều trị lại không tương đương nhau, thậm chí không có tác dụng. Ví dụ như viên nén aspirin 500mg, viên nang cloramphenicol 250 mg…
Nghiên cứu định lượng dược chất trong máu sau khi dùng thuốc với các thiết bị phân tích hiện đại, người ta nhận thấy: trường hợp thuốc không có tác dụng là do lượng dược chất vào được tuần hoàn máu của nhiều biệt dược thấp hơn nhiều so với biệt dược gốc (thuốc đầu tiên được cấp phép lưu hành), thậm chí thấp dưới ngưỡng nồng độ dược chất tối thiểu cần thiết để có tác dụng dược lý.
Vậy nguyên nhân của những hiện tượng không tương đương này là gì? Đi sâu vào nghiên cứu số phận của thuốc trong cơ thể, các nhà bào chế đã chỉ ra rằng hiệu quả điều trị của thuốc không chỉ phụ thuộc vào hàm lượng dược chất mà còn phụ thuộc vào dạng thuốc, thành phần tá dược đưa vào thuốc, kỹ thuật bào chế, bao bì đựng thuốc, đường dùng thuốc và người dùng thuốc. Đó chính là nội dung nghiên cứu của Sinh dược học bào chế.
Sự ra đời của Sinh dược học bào chế đã đánh dấu bước chuyển từ Bào chế quy ước (conventional pharmaceutics) sang Bào chế hiện đại (modem pharmaceutics). Trong Bào chế hiện tại, chất lượng của dạng thuốc không chỉ được đánh giá về mặt vật lý, hoá học, vi sinh học mà còn phải đánh giá về khả năng giải phóng và hấp thu dược chất từ dạng thuốc (đánh giá sinh khả dụng của thuốc).
Như vậy có thể nói:
– Nghiên cứu về bào chế và sinh dược học bào chế sẽ giúp người học có kiến thức, hình thành năng lực và kỹ năng để thực hành nghề nghiệp trong các lĩnh vực:
– Nghiên cứu xây dựng công thức (formulations):
+ Trên cơ sở thu thập các thông tin về: tính chất vật lý, tính chất hoá học, tác dụng dược lý, đặc tính dược động học của dược chất; yêu câu dự định của dạng thuốc về hàm lượng, mô hình giải phóng, vị trí giải phóng dược chất trong đường dùng thuốc; đặc điểm sinh lý của đường dùng thuốc; đối tượng dùng thuốc đặc biệt như người cao tuổi và trẻ nhỏ.
+ Phân tích, nhận định, lựa chọn loại tá dược, tá dược cụ thể, lượng dùng trong công thức, để có thể bào chế ra sản phẩm thuốc đáp ứng được các yêu cầu nêu trên, dựa vào tính chất vật lý, hoá học của từng tá dược.
+ Phân tích, nhận định, lựa chọn chất liệu, kiểu dáng bao bì đựng thuốc thích hợp với thành phần và dạng thuốc dự định bào chế, sao cho không có tương tác thuốc – bao bì và duy trì được độ ổn định của thuốc đựng trong bao bì.
+ Từ phân tích, nhận định, lựa chọn ở các bước nêu trên sẽ đưa ra công thức ban đầu.
– Nghiên cứu xây dựng quy trình bào chế (processing) và lựa chọn công thức tốt nhất:
+ Thực hiện pha chế thuốc theo công thức ban đầu, theo quy trình bào chế chung áp dụng cho dạng thuốc, với các thông số kỹ thuật được xác định phù hợp với thành phần công thức và quy mô thí nghiệm.
+ Đánh giá chất lượng của sản phẩm bào chế được, đối chiếu với mức chỉ tiêu chất lượng dự kiến cho sản phẩm, từ đó đưa ra nhận định, dự kiến điều chỉnh về công thức cũng như thông số kỹ thuật bào chế.
+ Tiếp tục thực hiện bào chế thuốc theo các công thức và quy trình đã điều chỉnh (nên áp dụng quy hoạch thực nghiệm nếu có thể) để đưa ra được công thức tốt nhất trong số các công thức đã nghiên cứu và quy trình bào chế thích hợp.
– Nghiên cứu nâng cấp, thẩm định quy trình bào chế ở quy mô pilot, rồi quy mô sản xuất. Thực hiện đúng các quy định hiện hành về thực hành tốt sản xuất.
– Đánh giá sản phẩm theo tiêu chuẩn chất lượng đã công bố (thử nghiệm về vật lý hoá học, vi sinh và khả năng giải phóng dược chất…). Nghiên cứu đánh giá độ ổn định, xác định tuổi thọ và đưa ra hạn dùng của chế phẩm thuốc. Đăng ký xin cấp phép lưu hành.
– Thực hiện tồn trữ, bảo quản và phân phối thuốc theo đúng các quy định hiện hành để duy trì và đảm bảo chất lượng thuốc trong lưu thông.
– Tư vấn lựa chọn dạng thuốc, đường dùng thuốc, hướng dẫn sử dụng cho thấy thuốc và người dùng thuốc đúng cách, đúng liều, đúng khoảng liều, đảm bảo an toàn, có hiệu quả điều trị cao, hạn chế hoặc phòng tránh được các tác dung không mong muốn của thuốc.
2. DẠNG THUỐC
2.1. Khái niệm dạng thuốc
Dược chất rất hiếm khi được dùng một mình trực tiếp cho người bệnh mà thường được dùng dưới dạng thuốc.
Dạng thuốc hay dạng bào chế là sản phẩm cuối cùng của quá trình bào chế, trong đó một hay nhiều dược chất được phối hợp với một hay nhiều tá dược thành thuốc, đóng gói trong bao bì thích hợp, thuận tiện cho việc chia sử dụng và đưa thuốc đến người bệnh. Dạng thuốc phải được kiểm nghiệm đạt các tiêu chuẩn về vật lý, hóa học, sinh học áp dụng cho dạng thuốc đó, đồng thời đạt các tiêu chuẩn chất lượng theo yêu cầu của đường dùng thuốc và chế độ liều (nêu có).
Ví dụ: Dược chất paracetamol có thể được bào chế dưới các dạng thuốc: dung dịch, hỗn dịch, viên nén, viên nang, viên sủi bọt, bột sủi bọt dùng để uống hoặc dạng thuốc đạn để đặt trực tràng hoặc dạng dung dịch để tiêm truyền.
Có một số dạng thuốc đặc biệt (specialized dosage forms) với tên gọi hệ phân phối thuốc (drug delivery systems) là dạng thuốc mà khi sử dụng cho người bệnh thì tốc độ, thời gian, vị trí giải phóng dược chất trong cơ thể được kiểm soát, làm tăng hiệu quả điều trị và độ an toàn của thuốc.
Ví dụ: Hệ trị liệu qua da chứa nitroglycerin (nitroglycerin transdermal therapeutic system), có biệt dược Nitro-Dur 0,2mg/giờ dùng dán trên da, được chỉ định để phòng nhồi máu cơ tim, duy trì tác dụng trong khoảng 12 giờ. Hệ mang thuốc cài đặt ở mặt có chứa pilocarpin (ocusert pilocarpin system), có biệt dược Ocusert Pilo-20, được chỉ định điều trị hạ nhãn áp trong bệnh glaucoma, duy trì được tác dụng điều trị trong 7 ngày.
2.2. Độ ổn định, tuổi thọ và hạn dùng của thuốc
Độ ổn định của thuốc (drug stability) là khả năng của thuốc bảo quản trong điều kiện xác định mà vẫn giữ được những đặc tính vốn có về vật lý, hóa học, vi sinh học, tác dụng dược lý và độc tính trong giới hạn được quy định trong tiêu chuẩn chất lượng của thuốc.
Độ ổn định của thuốc không chỉ phụ thuộc vào bản chất vốn có của thuốc mà còn phụ thuộc rất lớn vào điều kiện bảo quản thuốc như nhiệt độ, độ ẩm, ánh sáng của môi trường bảo quản và bao bì đựng thuốc đó.
Hội nghị quốc tế về hài hòa các thủ tục đăng kí dược phẩm dùng cho người thống nhất chia ra 5 vùng khí hậu (bảng 1.1).
Bảng 1.1. Các vùng khí hậu quy định để đánh giá độ ổn định của thuốc
| Vùng khí hậu | Loại khí hậu | Nhiệt độ | Độ ẩm tương đối |
| Vùng I | Ôn đới | 21°C ± 2°C | 45% ± 5% |
| Vùng II | Cận nhiệt đới | 25°C ± 2°C | 60% ± 5% |
| Vùng III | Nóng, khô | 30°C ± 2°C | 35% ± 5% |
| Vùng IVa | Nóng, ẩm | 30°C ± 2°C | 65% ± 5% |
| Vùng IVb | Nóng, rất ẩm | 30°C ± 2°C | 75% ± 5% |
Với một số thuốc phải bảo quản đặc biệt thì phải tiến hành đánh giá độ ổn định của thuốc ở điều kiện bảo quản yêu cầu. Bảo quản lạnh ở nhiệt độ 5°C ± 3°C, bảo quản đông lạnh ở nhiệt độ -20°C ± 5°C và không có quy định về độ ẩm.
Theo phân loại vùng khí hậu trên, Việt Nam thuộc vùng khí hậu rvb là vùng khí hậu nóng và rất ẩm. Các thuốc lưu hành ở Việt Nam phải được nghiên cứu độ ổn định dài hạn ở điều kiện nhiệt độ và độ ẩm tương đối của vùng IVb.
Tuổi thọ của thuốc (drug shelf life) là khoảng thời gian tính từ khỉ thuốc được sản xuất đến khỉ còn đáp ứng được các yêu cầu chất lượng theo tiêu chuẩn quy định, trong điều kiện bảo quản xác định.
Tuổi thọ của một thuốc được xác định dựa trên kết quả nghiên cứu đánh giá độ ổn định của ít nhất 3 lô thuốc ở quy mô pilot, được lấy mẫu và bảo quản trong điều kiện theo quy định của từng nước, phù hợp với vùng khí hậu hoặc điều kiện bảo quản đặc biệt đã xác định.
Cần lưu ý rằng, tuổi thọ của cùng một sản phẩm thuốc được bảo quản, lưu hành ở các vùng khí hậu khác nhau không như nhau. Ví dụ, một sản phẩm thuốc được lưu hành ở Pháp, thuộc khí hậu vùng II, được xác định có tuổi thọ là 60 tháng nhưng sản phẩm thuốc này khi được lưu hành ở Việt Nam, thuộc khí hậu vùng rvb, sẽ có tuổi thọ ngắn hơn, có thể chỉ bằng khoảng 2/3 thời gian khi lưu hành ở khí hậu vùng H, thậm chí còn ngắn hơn nữa (tuỳ theo từng sản phẩm thuốc).
Hạn dùng của thuốc (expiration date or expiry date) là thời gian sử dụng ấn định cho một lô thuốc mà sau thời hạn này thuốc không được phép sử dụng.
Hạn dùng của thuốc được thể hiện bằng khoảng thời gian tính từ ngày sản xuất đến ngày hết hạn hoặc thể hiện bằng ngày, tháng, năm hết hạn; trường hợp hạn dùng chỉ thể hiện tháng, năm hết hạn thì hạn dùng được tính đến ngày cuối cùng của tháng hết hạn.
Hạn dùng của thuốc do nhà sản xuất công bố căn cứ vào tuổi thọ của thuốc và phải chịu trách nhiệm về chất lượng thuốc theo hạn dùng đã công bố, với điều kiện thuốc được bảo quản đúng điều kiện như đã đăng ký với cơ quan quản lý về thuốc. Hạn dùng của thuốc phải được ghi trên bao bì của từng đơn vị đóng gói nhỏ nhất. Hạn dùng của thuốc không được dài hơn tuổi thọ của thuốc đã nghiên cứu được.
2.3. Phân loại các dạng thuốc
Các dạng thuốc có thể được phân loại theo nhiều cách.
2.3.1. Theo đường dùng thuốc
Phân loại các dạng thuốc theo đường dùng thuốc là cách phân loại được áp dụng phổ biến, gắn dạng thuốc với đường dùng. Với cách phân loại này, thuốc đồng thời phải đáp ứng các chỉ tiêu chất lượng của dạng thuốc và các chỉ tiêu chất lượng đáp ứng được các đặc điểm sinh lý của đường dùng thuốc. Dạng thuốc được thiết kế phù hợp theo đường dùng để tối ưu hoá đáp ứng điều trị, giảm thiểu tối đa tác dụng không mong muốn của thuốc.
Với cách phân loại này có:
- Các dạng thuốc dùng theo đường tiêu hoá.
- Các dạng thuốc dùng theo đường tiêm.
- Các dạng thuốc dùng ở đường hô hấp và qua đường hô hấp.
- Các dạng thuốc dùng trên da và qua da.
- Các dạng thuốc dùng cho mắt, tai.
- Các dạng thuốc dùng theo đường âm đạo.
Khi đưa thuốc vào cơ thể theo các đường dùng trên, tuỳ vào mục đích điều trị, người ta chia ra:
– Thuốc tác dụng toàn thân (systemic administration): khi đó dược chất sẽ được hấp thu từ dạng thuốc vào tuần hoàn máu, rồi phân bố đến các mô trong cơ thể, trong đồ có mô đích tác dụng. Như vậy, khi dùng các thuốc tác dụng toàn thân, tất cả mô của cơ thể đều bị phơi nhiễm với thuốc nên có thể gây ra nhiều tác dụng không mong muốn đối với người dùng thuốc.
– Thuốc tác dụng tại chỗ (local administration): khi đó dược chất có tác dụng ngay tại chỗ ở vùng mô tiếp xúc trực tiếp với thuốc, nên tăng cường được tác dụng tại chỗ của thuốc, hạn chế phơi nhiễm các mô khác với thuốc, nhờ đó có thể tránh được tác dụng không mong muốn của thuốc đối với người dùng thuốc.
2.3.2. Theo mô hình giải phóng dược chất
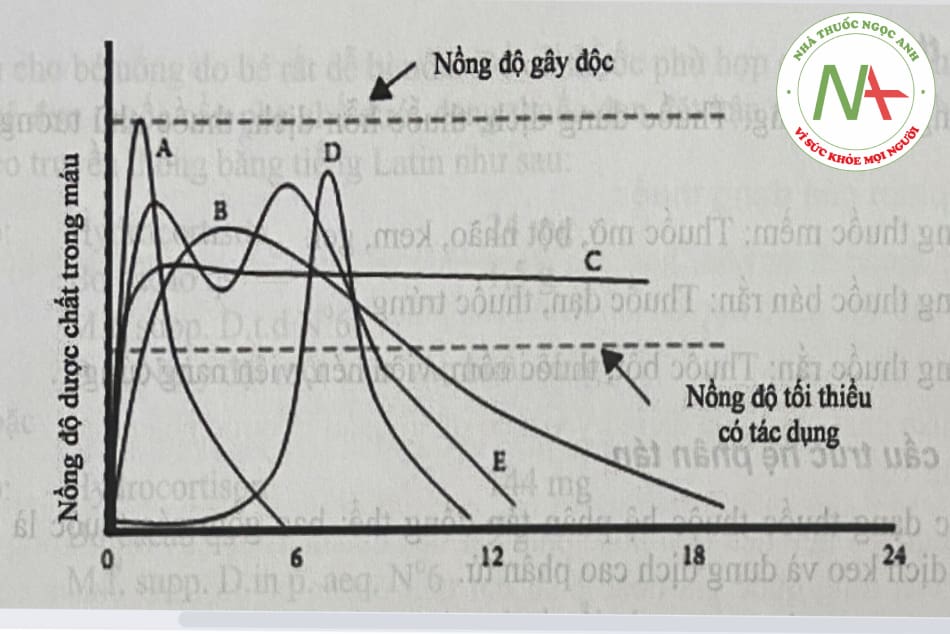
Dựa trên mô hình giải phóng và hấp thu dược chất từ dạng thuốc, có thể bào chế các dạng thuốc đáp ứng các mô hình như minh họạ ở hình 1.1:
– Dạng thuốc giải phóng ngay (immediate release): Là dạng thuốc được bào chế sử dụng những tá dược và kỹ thuật bào chế kinh điển, không có tác động chủ ý để thay đổi tốc độ giải phóng dược chất ra khỏi dạng thuốc.
Dạng thuốc giải phóng ngay có đặc trưng là nồng độ dược chất được hấp thu vào tuần hoàn máu tăng lên rất nhanh sau đó giảm đi tuỳ thuộc vào mức độ chuyển hóa và thải trừ thuốc ra khỏi cơ thể.
Đó là các dạng thuốc quy ước như viên nén, viên nang, hỗn dịch, dung dịch dùng đường uống, các dạng viên đặc biệt như viên ngậm, viên nhai, viên đặt dưới lưỡi…, và các dung dịch, hỗn dịch, nhũ tương dùng đường tiêm.
Trường hợp viên nén, viên nang có thêm hay không thêm tá dược rã không được xem là làm thay đối sự giải phóng dược chất.
- Dạng thuốc giải phóng muộn (delayed release): Là dạng thuốc được bào chế đã tác động có chủ ý, để trì hoãn sự giải phóng dược chất một khoảng thời gian sau khi dùng thuốc hoặc dược chất chỉ được giải phóng khi thuốc đã tới được vị trí nhất định của đường tiêu hoá.
Đó là các dạng thuốc bao tan ở ruột (enteric-coated), khi uống vào dạ dày, màng bao được giữ nguyên trong môi trường acid của dịch dạ dày, cản trở sự giải phóng dược chất trong dạ dày, chỉ khi thuốc di chuyển đến môi trường ruột non, màng bao bị phá vỡ, dược chất được giải phóng và hấp thu nhanh qua ruột non.
Các thuốc giải phóng tại đại tràng (colon-targeted release) cũng là dạng thuốc giải phóng muộn. Thuốc được bào chế sao cho sau khi uống, trong thời gian thuốc di chuyển trong đường tiêu hoá, dược chất hầu như không được giải phóng, chỉ khi đến đại tràng dưới tác động của pH và hệ vi sinh của đại tràng, cấu trúc của thuốc bị phá vỡ và dược chất được giải phóng ngay, tập trung tác dụng của thuốc tại đại tràng.
Các thuốc giải phóng theo nhịp (pulsatile release) cũng được xem là dạng thuốc giải phóng muộn. Thuốc được bào chế sao cho sau khi uống, quá trình giải phóng dược chất được trì hoãn khoảng 5-6 giờ.
– Dạng thuốc giải phóng kéo dài (extended release/sustained release/prolonged release): Là các dạng thuốc được bào chế đã áp dụng các tác động có chủ ý để kéo dài tốc độ giải phóng dược chất, so với tốc độ giải phóng dược chất của dạng thuốc giải phóng ngay.
Dạng thuốc giải phóng kéo dài có đặc trưng là nồng độ dược chất được hấp thu vào tuần hoàn máu tăng lên từ từ sau đó cũng giảm chậm để duy trì nồng độ dược chất có hiệu quả điều trị trong một thời gian dài, đủ để giảm số lần dùng so với dạng thuốc giải phóng ngay.
Thuốc uống giải phóng kéo dài đang lưu thông trên thị trường có loại kéo dài 12 giờ hoặc 24 giờ. Thuốc tiêm giải phóng kéo dài có thể duy trì tác dụng trong 24 giờ, trong nhiều tuần, thậm chí nhiều tháng.
– Dạng thuốc giải phóng có kiểm soát (controlled release): Là một dạng đặc biệt của dạng thuốc giải phóng kéo dài, có mô hình giải phóng khởi đầu là giải phóng ngay một phần dược chất, được hấp thu nhanh đạt tới ngưỡng điều trị, tiếp theo là sự giải phóng kéo dài và hằng định của dược chất còn lại trong khoảng thời gian được dự định.
– Dạng thuốc giải phóng hai pha (bimodal release): Là dạng thuốc được bào chế có một phần liều thuốc được giải phóng ngay, phần liều còn lại được giải phóng muộn hoặc giải phóng kéo dài.
2.3.3. Theo thể chất
- Dạng thuốc lỏng: Thuốc dung dịch, thuốc hỗn dịch, thuốc nhũ tương, cao lỏng dược liệu.
- Dạng thuốc mềm: Thuốc mỡ, bột nhão, kem, gel.
- Dạng thuốc bán rắn: Thuốc đạn, thuốc trứng.
- Dạng thuốc rắn: Thuốc bột, thuốc cốm, viên nén, viên nang cứng…
2.3.4. Theo cấu trúc hệ phân tán
– Các dạng thuốc thuộc hệ phân tán đồng thể: bao gồm các thuốc là dung dịch thật, dung dịch keo và dung dịch cao phân tử.
– Các dạng thuốc thuộc hệ phân tán dị thể: bao gồm các thuốc có cấu trúc gồm 2 pha không đồng tan với nhau, được phân tán vào nhau, hình thành pha phân tán và môi trường phân tán; trong đó kích thước của pha phân tán, tùy thuộc vào công nghệ bào chế được áp dụng mà có kích thước cỡ nanomet đến hàng trăm micromet. Đại diện là các thuốc nhũ tương và thuốc hỗn dịch, có đặc tính chung là kém ổn định về trạng thái phân tán.
– Các dạng thuốc thuộc hệ phân tán cơ học: là hệ phân tán của các tiểu phân rắn, có kích thước từ hàng chục đến hàng trăm ngàn micromet; bao gồm các dạng thuốc như thuốc bột, thuốc cốm, viên nén, viên nang cứng.
Sự phân loại trên chỉ là tương đối. Thực tế trong bào chế thuốc, một số thuốc có thể cấu trúc gồm nhiều hệ phân tán.
2.3.5. Thuốc pha chế theo đơn
Thực tế hành nghề dược ở tất cả các quốc gia trên thế giới, đặc biệt là ở các nước phát triển, thuốc được dùng trong phòng và chữa bệnh cho người bệnh đều tuân thủ theo kê đơn của thầy thuốc. Thuốc được kê đơn thông thường là các thuốc sản xuất công nghiệp, đã được cơ quan quản lý về thuốc ở từng quốc gia cấp số đăng ký lưu hành (licensed pharmaceutical products) nhưng thuốc sản xuất công nghiệp không thể phù hợp với mọi bệnh nhân trong mọi điều kiện. Chính vì thế, trong nhiều trường hợp thuốc được kê đơn là các thuốc không được cấp phép (unlicensed pharmaceutical preparations), đó là các thuốc được pha chế ngay tại khoa dược bệnh viện hoặc các phòng pha chế theo đơn của nhà thuốc, được cấp phát dùng ngay cho người bệnh. Thuốc pha chế theo đơn giúp điều chỉnh liều thuốc, chuyển đổi dạng thuốc, chuyển đường dùng thuốc cho phù hợp nhất với tình trạng bệnh, giới tính, lứa tuổi và thể trạng của từng cá thể bệnh nhân; tạo thuận lợi cho người bệnh được cá thể hóa trong chăm sóc dược (individualised pharmaceutical care) khi mà thuốc sản xuất công nghiệp không sẵn có hoặc không thoả mãn được trong tình huống đặc biệt.
Ví dụ, trường hợp một bé gái 2 tháng tuổi, mắc hội chứng bệnh liên quan đến vùng dưới đôi cân được điều trị bằng thuốc hydrocortison. Thuốc sản xuất công nghiệp sản có là thuốc tiêm hydrocortison natri succinat, viên nén và viên nang hydrocortison nhưng cha mẹ của bệnh nhi không muốn bé phải tiêm thuốc, cũng không muốn nghiền thuốc viên cho bé uống do bé rất dễ bị nôn. Để có thuốc phù hợp cho bệnh nhi này, thầy thuốc đã kê đơn thuốc cần pha chế dưới dạng thuốc đạn đặt hậu môn; thầy thuốc có thể kê đơn theo truyền thống bằng tiếng Latin như sau:
Rp:
- Hydrocortison24mg
- Bơ caca 1,5g
- M.f. supp. D.t.d N°6
- D.S: Ngày đặt một viên vào buổi sáng
Hoặc
Rp:
- Hydrocortison 144 mg
- Bơ cacao qs 9 g
- M.f. supp. D.in p. aeq. N°6
- D.S: Ngày đặt một viên ngày vào buổi sáng
Chú giải các chữ Latin viết tắt: Rp là viết tắt của recipe – lấy; qs là viết tắt của quantum sufficiat – lượng vừa đủ; M.f là viết tắt của mice – trộn lân và f là viết tắt của fiat – làm thành; supp là viết tắt của suppositoria – thuốc đạn; D.t.d N°6 là viết tắt của Dentur tales doses N°6 – cho 6 liều như thế; D.in p. aeq. N°6 là viết tắt của Dividiatur in partes aequales N°6 – chia thành 6 phần bằng nhau; D.s là viết tắt của da, signa – liều và cách dùng.
Thực tế hành nghề hiện nay, thầy thuốc thường kê đơn theo ngôn ngữ chính thức của mỗi quốc gia.
Dù là thuốc sản xuất công nghiệp hay thuốc pha chế theo đơn thì việc đảm bảo chất lượng thuốc luôn phải được chú trọng để đảm bảo hiệu quả và an toàn khi dùng thuốc cho bệnh nhân.
Do vậy, khi nhận được đơn thuốc, người dược sĩ phải kiểm tra đơn thuốc thật kỹ trước khi thực hiện pha chế thuốc về các nội dung: Đơn thuốc đã có đầy đủ các thông tin về người bệnh, người kê đơn theo quy chế hiện hành về kê đơn thuốc hay chưa; tên thuốc, nồng độ hay hàm lượng, dạng thuốc cần pha chế, đường dùng, liều dùng, các thành phần phối hợp trong dạng thuốc, các tương kỵ, tương tác… Nếu phát hiện có những điều chưa hợp lý thì phải trao đổi lại với người kê đơn.
Các loại thuốc pha chế theo đơn:
– Thuốc pha chế theo đơn có thể là thuốc được pha lại (reconstitution) từ thuốc sản xuất công nghiệp như các dạng thuốc rắn để pha dung dịch hay hỗn dịch thuốc, các dạng thuốc lỏng đậm đặc phải pha loãng trước khỉ dùng cho người bệnh.
– Thuốc pha chế theo đơn có thể dùng nguyên liệu ban đầu là thuốc sản xuất công nghiệp có dược chất được kê đơn nhưng liều lượng, dạng thuốc, đường dùng cần được thay đổi cho phù hợp với người bệnh được kê đơn.
– Thuốc pha chế theo đơn đi từ nguyên liệu là dược chất và tá dược đã được phép sử dụng làm thuốc.
Cơ sở thực hiện pha chế thuốc theo đơn phải là các phong pha chế đáp ứng yêu cầu về thực hành sản xuất tốt (Good manufacturing practice).
2.4. Thành phần của dạng thuốc
Dạng thuốc là sự phối hợp của dược chất, tá dược và bao bì, bằng kỹ thuật hay công nghệ bào chế thích hợp để tạo thành sản phẩm thuốc.
Dược chất, tá dược, bao bì sử dụng làm nguyên liệu bào chế các dạng thuốc, phải đạt tiêu chuẩn chất lượng đã đăng ký với cơ quản quản lý dược phẩm mới được đưa vào pha chế, sản xuất.
Các nguyên liệu nêu trên hoặc phải đạt tiêu chuẩn được quy định trong dược điển hiện hành của từng quốc gia hoặc phải đạt tiêu chuẩn cơ sở (tiêu chuẩn của nhà sản xuất). Tiêu chuẩn cơ sở phải có mức chất lượng cho mỗi chỉ tiêu không được thấp hơn mức chất lượng của chỉ tiêu đó được ghi trong dược điển.
2.4.1. Dược chất
Dược chất (drug substance), còn gọi là hoạt chất (active substance) hay thành phần dược phẩm có hoạt tính (active pharmaceutical ingredient – API) là chất hoặc hỗn hợp các chất dùng để bào chế thuốc, có tác dụng dược lý hoặc cổ tác dụng trực tiếp trong phòng bệnh, chẩn đoán bệnh, chữa bệnh, điều trị bệnh, giảm nhẹ bệnh, điều chỉnh chức năng sinh lý cơ thể người.
Hiện có hàng nghìn dược chất đang được sử dụng để sản xuất các dạng thuốc, đông thời người ta cũng không ngừng tìm kiếm, bổ sung các dược chất mới. Các dược chất có thể được sản xuất bằng cách chiết xuất từ dược liệu, bán tổng hợp, tổng hợp hoá học hoặc sinh tổng hợp.
Các dược chất dùng để bào chế các dạng thuốc thuộc nhiều nhóm thuốc khác nhau như: kháng khuẩn, kháng sinh, kháng ung thư, chống viêm giảm đau không steroid, orticosteroid, tim mạch, huyết áp, đường huyết, lợi tiểu, hormon, enzym, vitamin, nguyên tố vi lượng…
Để xâỵ dựng được công thức và quy trình bào chế cho một sản phẩm thuốc có chất lượng tốt, phải có nghiên cứu tiền xây dựng công thức (preformulation) về các tính chất của dược chất liên quan đến độ tan, tính thấm, độ ổn định…
Một số dược chất, tự bản thân nó có tính thâm rất kém với màng hấp thu. Để cải thiện khả năng hấp thu của các dược chất này, người ta tạo ra các tiền dược chất (prodrugs) tương ứng với dược chất ban đầu.
Tiền dược chất là các hợp chất dùng làm thuốc, không có tác dụng dược lý trực tiếp, chỉ sau khi đưa vào cơ thể, dưới tác dụng của các enzym có trong dịch sinh học của cơ thể, hợp chất đó được chuyển hoá thành dược chất có tác dụng dược lý.
Tiền dược chất cũng để được dùng để cải thiện tính hướng đích của thuốc hay làm giám tác dụng không mong muốn của thuốc.
Hiện khoảng 10% các thuốc lưu thông ở trên thị trường toàn cầu được xem là tiền dược chất. Ví dụ: fosphenytoin là tiền dược chất của phenol, bambuterol lĩtiền dược chất của terbutaline, dipiverin tiên dược chất của epinephrin, bacampicillin tiên dược chất của ampicilin…
2.4.2. Tá dược
Tá dược (excipients) là các thành phần dược dụng, không có dụng dược được thêm vào thành phần của dạng thuốc, thực vai trò khác nhau như: làm tăng độ tan tăng độ nhớt, phân tán, nhũ hoa, thay đổi khả năng giải phóng, thay đổi tính thấm, bảo quản, cải thiện tính tương hợp, dam bao độ ổn định, tạo hương vị hấp dẫn…, để có được dạng thuốc đạt tiêu chuẩn chất lượng đã định.
Sau đây là các nhóm tá dược thường gặp trong thành phần của các dạng thuốc, bao gồm:
- Các dung môi (solvents).
- Các chất sát khuẩn (antimicrobials) còn gọi là các chất bảo quản (preservatives).
- Các chất làm tăng độ tan (solubilizers).
- Các chất điều chỉnh pH và hệ đệm (pH adjusting agents and buffers).
- Các chất chống oxy hóa (antioxidants).
- Các chất đẳng trương (tonicity agents).
- Các chất nhũ hóa (emulsifiers).
- Các chất thấm ẩm (wetting agents).
- Các chất tạo độ nhớt (viscosity agents).
- Các chất tạo hương, vị (flavours and sweeteners).
- Các chất màu (colourants).
- Các tá dược độn (fillers) còn gọi là tá dược pha loãng (diluents).
- Các tá dược dính (binders).
- Các tá dược rã (disintegrants).
- Các tá dược trơn/chảy (lubricants/glidants).
- Các tá dược bao (coating agents).
- Các tá dược kiểm soát giải phóng (release controlling agents).
- Các chất làm tăng thấm (permeation enhancers).
Trong từng nhóm tá dược nêu trên có nhiều chất khác nhau. Các chất tá dược cụ thể thuộc từng nhóm tá dược trên sẽ được trình bày chi tiết trong các chương tiếp theo về từng dạng thuốc, nhưng cần lưu ý là:
– Một tá dược trong thành phần một chế phẩm thuốc có thể có nhiều vai trò khác nhau. Ví dụ, polysorbat 20 trong thành phần của thuốc hỗn dịch nhỏ mắt vừa là chất gây phân tán vừa là chất làm tăng thấm dược chất qua giác mạc.
– Cùng một tá dược có thể sử dụng cho nhiều dạng thuốc khác nhau.
2.4.3. Bao bì đựng thuốc
2.4.3.1. Chức năng của bao bì đựng thuốc

Để có các sản phẩm thuốc hoàn chỉnh, thuốc phải được đóng gói trong bao bì thích hợp. Bao bì đựng thuốc phải thực hiện được các chức năng kinh tế – kỹ thuật như: chứa đựng, bảo vệ, giới thiệu, nhận dạng (chống thuốc giả dựa trên nhận diện bao bì, nhãn, logo…), thông tin, thuận tiện và hỗ trợ bệnh nhân tuân thủ trong quá trình bảo quản và sử dụng thuốc.
Bao bì đựng thuốc phải đáp ứng được các yêu cầu bảo quản, duy trì được hiệu quả, độ an toàn, độ đồng nhất, tính nguyên vẹn, độ tinh khiết và độ ổn định của sản phẩm thuốc, trong suốt thời gian từ khi xuất xưởng cho đến hết hạn dùng đã công bố của sản phẩm thuốc.
Đặc biệt, một số bao bì đựng thuốc có vai trò rất quan trọng khi đưa thuốc vào cơ thể, đó là dụng cụ phân phối thuốc, hỗ trợ dùng thuốc đúng cách, đúng liều lượng. Ví dụ: thuốc xịt mũi, ống hít định liều, bơm tiêm đóng sẵn thuốc…
Trong bào chế thuốc, có bao bì trực tiếp (còn gọi là bao bì sơ cấp) và bao bì thứ cấp. Bao bì trực tiếp là bao bì mà mặt trong bao bì tiếp xúc trực tiếp với thuốc; ví dụ, chai thuỷ tinh và nút chai chứa dung dịch thuốc. Bao bì thứ cấp là bao bì chứa bao bì trực tiếp; ví dụ, một hộp giấy carton cho một chai thuốc và phụ kiện kèm theo như thìa, cốc đong để phân liều thuốc khi sử dụng.
Các dạng thuốc khác nhau như: thuốc bột, thuốc cốm, viên nén, viên nang, thuốc mỡ, kem, gel, thuốc dung dịch, thuốc hỗn dịch, thuốc nhũ tương…, có thể chất khác nhau, cách dùng thuốc khác nhau nên yêu cầu kiểu dáng và vật liệu làm bao bì trực tiếp rất khác nhau (xem minh hoạ ở hình 1.2).
Về kiểu dáng, bao bì trực tiếp có thể là vỉ rộp (blister), vỉ xé (strip), túi nhỏ (sachet/ pouch), chai (bottle), lọ (vial), bình/vại (jar) ống tiêm (ampoule), túi lớn (bag), tuýp (tube), bơm tiêm (syringe)… tuỳ theo yêu cầu đặc trưng của sản phẩm thuốc và chiến lược thị trường của nhà sản xuất.
Vật liệu để làm bao bì trực tiếp đựng thuốc có thể là thuỷ tinh, chất dẻo, kim loại, cao su, giấy hoặc kết hợp các vật liệu này để chế tạo được bao bì trực tiếp cho từng dạng thuốc, đường dùng thuốc và được lựa chọn thích hợp với từng sản phẩm thuốc.
Với bao bì trực tiếp là các chai, lọ, bình/vại, hộp, tuýp không tự hàn kín được phải có thêm nút (closures/stoppers), nắp xoáy (screw cap), chụp (crimp cap) là một bộ phận dùng để đậy kín cho các dạng bao bì trên và chúng có thể là phần bao bì trực tiếp với thuốc.
Nút, nắp, chụp có vai trò ngăn cản sự thâm nhập của oxy, hơi ẩm, bụi, vi sinh vật từ môi trường nhiễm vào thuốc, đồng thời giữ cho thuốc và các thành phần của thuốc không bị rò rỉ, thâm ra khỏi bao bì.
Nút, nắp còn là phương tiện để chống hàng giả hay để nhận biết việc lọ thuốc đã được mở hay chưa. Để đảm bảo chức năng này, nút, nắp cần được thiết kế, chế tạo phù hợp với từng chế phẩm.
Nút, nạp phải dễ dàng mở ra và đậy lại khi sử dụng (với bao bì đóng nhiều liều trong một đơn vị bao bì). Nút, nắp, chụp dùng trong đóng gói thuốc được chế tạo từ chất dẻo, kim loại hoặc cao su.
Về liều lượng thuốc đựng trong bao bì trực tiếp có thể chia ra: Bao bì đựng nhiêu liều là bao bì trực tiếp chứa nhiều liều thuốc trong cùng một chai/lọ/ống/tuýp/… cho phép lấy ra từng liều thuốc mà không làm thay đổi nồng độ, chất lượng, độ tinh khiết, độ an toàn của những liều thuốc còn lại trong bao bì đó. Bao bì đựng đơn liều là bao bì trực tiếp chứa một liều thuốc trong một chai/lọ/ống/túi/…/ cho một lần dùng.
2.4.3.2. Yêu cầu chung đối với bao bì trực tiếp đựng thuốc
Bao bì trực tiếp đựng thuốc lý tưởng phải:
– Tương thích với thuốc đựng trong bao bì. Không nhả tạp chất từ bao bì vào thuốc và cũng không hấp phụ/ hấp thụ bất cứ thành phần nào của thuốc, ngay cả khi tiệt khuẩn thuốc ở nhiệt độ, áp suất cao, cũng như trong suốt quá trình tồn trữ thuốc cho tới khi hết hạn sử dụng của chế phẩm thuốc. Sự hấp thụ/hấp phụ dược chất vào bao bì sẽ làm giảm nồng độ dược chất trong thuốc, ngược lại sự nhả các thành phần hoá học từ bao bì vào thuốc có thể gây ra sự phân huỷ thuốc.
– Bảo vệ thuốc đựng trong bao bì tránh được các tác động bất lợi của môi trường đến thuốc như: nhiệt độ, ánh sáng, hơi ẩm, bụi, khí oxy, khí carbon dioxyd, các vi sinh vật (vi khuẩn, nấm men, nấm mốc), côn trùng và đảm bảo độ ổn định của thuốc.
– Không để mất dung môi và các thành phần có thể bay hơi trong các chế phẩm thuốc lỏng do thấm qua bao bì ra môi trường.
– Có độ trong cần thiết (nếu có thể) đủ để phát hiện được các tiểu phân lạ, sự ô nhiễm hay các biểu hiện biến chất của thuốc đựng trong bao bì.
– Có đủ độ bền cơ học cần thiết để không bị rò rỉ, nứt, rách, vỡ do các tác động cơ học như đánh rơi, chèn ép, rung lắc, đâm, chọc…, trong khi cầm, bảo quản và vận chuyển.
– Không gây tác động xấu đến môi trường, có thể thu hồi hay tái sử dụng.
2.4.3.3. Các vật liệu dùng làm bao bì trực tiếp đựng thuốc
Bảng 1.2. So sánh khả năng đáp ứng yêu cầu làm bao bì trực tiếp của thủy tinh, kim loại và chất dẻo
| Tính chất | Vật liệu dùng làm bao bì trực tiếp | ||
| Thủy tinh | Chất dẻo | Kim loại | |
| Tương thích với thuốc | Trơ với hầu hết các hóa chất. Có thể dùng đóng nhiều dạng thuốc. | Mức độ tương thích khác nhau tùy loại chất dẻo | Có khả năng tương tác với thuốc. Khi đó phải bao về mặt tiếp xúc. |
| Khối lượng riêng | Nặng, chi phí vận chuyển cao | Nhẹ | Nhẹ vì bền cả khi dát mỏng |
| Khả năng thấm khí và hơi nước | Ngăn cản sự thấm khí oxy, dioxyd carbo, hơi nước từ môi trường vào thuốc. Ngăn cản các thành phần bay hơi thấm từ thuốc ra ngoài | Mức độ thấm khí và hơi nước phụ thuộc vào loại chất dẻo | Ngăn cản rất tốt, không cho khí và hơi nước thấm qua bao bì |
| Độ ổn định ở nhiệt độ cao | Rất ổn định, cho phép tiệt khuẩn bằng nhiệt | Phụ thuộc vào loại chất dẻo | Rất ổn định |
| Độ trong | Tong suốt, cho phép kiểm tra bằng mắt thuốc đựng trong bao bì | Mức độ trong, đục mờ hay đục tùy loại chất dẻo | Đục, không nhìn được nhưng lại cản được ánh sáng |
| Độ bền cơ | Giòn, dễ vỡ | Bền, dẻo | Bền, dẻo |
| Tái sử dụng | Có thể tái sử dụng | Không dễ tái sử dụng như thủy tinh và kim loại | Có thể tái sử dụng |
| Giá thành | Giá cao | Một số chất dẻo giá thấp, một số giá cao | Giá thấp hơn thủy tinh |
Thuỷ tinh, chất dẻo, kim loại, cao su, giấy là những vật liệu được dùng phổ biến để chế tạo bao bì trực tiếp đựng thuốc. Mỗi loại vật liệu đều có ưu điểm và nhược điểm (bảng 1.2) mà nhà bào chế cần biết để chọn được bao bì thích hợp cho mỗi sản phẩm thuốc.
2.4.3.3.1. Thành phần thuỷ tinh
a) Ưu, nhược điểm của ba bì thủy tinh
Thủy tinh là vật liệu phổ biến được dùng chế tạo bao bì trực tiếp đựng thuốc vì chúng có những ưu điểm sau:
– Gần như tơ về mặt hóa học nên có thể sử dụng để đựng nhiều dạng thuốc khác nhau.
– Ngăn cản không cho hơi ẩm và các khí như oxy, carbon dioxyd từ môi trường xâm nhập vào thuốc trong bao bì; ngăn cản các thành phần bay hơi có trong thuốc hay khí tơ như nitrogen nạp vào thuốc không thoát ra thoát ra môi trường. Vì thế, thủy tinh là bao bì rất thích hợp với các chế phẩm thuốc có dược chất dễ bị oxy hóa, dễ hút ẩm, dễ bay hơi, giữ cho thuốc ổn định.
– Ổn định ở nhiệt độ cao, cho phép tiệt khuẩn bao bì thủy tinh và thuốc đựng tong bao bì bằng nhiệt.
-Có thể tái sử dụng.
Song bao bì bằng thủy tinh cũng có nhiều nhược điểm:
– Nặng nên chi phí vận chuyển lớn hơn bao bì bằng chất deo.
-Giòn, dễ nứt, vỡ trong quá trình sản xuất, tồn trữ và lưu thông.
– Không hoàn toàn trơ về hóa học nếu là thủy tinh kiềm.
– Thuốc tiêm truyền đựng trong chai thủy tinh, khi truyền phải đối lưu không khí từ môi trường nên thuốc có thể bị nhiễm tạp từ môi trường trong khi truyền.
b) Thành phần thủy tinh
Thuỷ tinh được sản xuất bằng cách nung chảy đồng thời nhiều hợp chất vô cơ khác nhau, ở nhiệt độ cao (khoảng 1500°C), tạo thành khôi chảy lỏng đồng nhất:
- Thành phần chính là cát, có hàm lượng silic dioxyd (S1O2) khoảng 59 – 75%.
- Nhôm oxyd (0,5 – 3%) để tăng độ cứng, độ bền và độ trong của thuỷ tinh.
- Calci oxyd (5 -12%) để giảm mức độ linh động của các ion kiềm.
- Natri oxyd (12 -17%) để giảm nhiệt độ nóng chảy.
- Bo oxyd (với lượng nhỏ) để ổn định thuỷ tinh, giúp thuỷ tinh lan truyền nhiệt chậm, chống lại sốc nhiệt.
- Một lượng nhỏ oxyd kim loại để tạo màu cho thuỷ tinh như sắt oxyd cho thuỷ tinh màu nâu, mangan oxyd cho thuỷ tinh màu hổ phách, cobalt oxyd cho thuỷ tinh màu xanh, titan dioxyd cho thuỷ tinh màu trắng…
- Và có thể thêm một số thành phần khác tuỳ theo nhà sản xuất thuỷ tinh.
Từ thuỷ tinh thu được, người ta làm thành bao bì thuỷ tinh theo phương pháp thổi khuôn thành bao bì theo mẫu khuôn đúc sẵn (bao bì đa dạng về kiểu dáng) hoặc tạo ống thuỷ tinh để kéo thành ống tiêm và lọ đựng thuốc.
Khi sử dụng thuỷ tinh làm bao bì trực tiếp đựng các dung dịch thuốc có dung môi là nước, các thành phần có trong thuỷ tinh liên kết lỏng lẻo với silic như natri sẽ từ bê mặt thuỷ tinh nhả vào dung dịch thuốc, làm tăng pH của dung dịch thuốc, tác động đến độ ổn định của thuốc.
Sự nhả kiềm từ bề mặt bao bì thuỷ tinh càng tăng dưới tác động của nhiệt (khi tiệt khuẩn bằng nhiệt) và bảo quản thuốc kéo dài, thuốc càng kém ổn định.
Để hạn chế sự nhả kiềm từ bề mặt bao bì thuỷ tinh vào thuốc, người ta cọ thể xử lý bề mặt thuỷ tinh bằng khí acid như sulfur dioxyd (SO2) hoặc khí acid hydrocloric khi thuỷ tinh còn nóng đỏ.
c) Phân loại bao bì thuỷ tinh
Dược điển Việt Nam V và Dược điển Mỹ 41 đều phân loại bao bì thuỷ tinh dùng trong dược phẩm thành 4 loại:
- Bao bì thuỷ tinh loại I: là thuỷ tinh trung tính do có tỷ lệ các oxyd kiềm thấp, đây là loại thuỷ tinh tốt nhất dùng để đựng thuốc, nhưng cũng là thuỷ tinh đắt nhất trong các loại thuỷ tinh. Do trong thành phần có thêm bo oxyd nên còn được gọi là thuỷ tinh borosilicat. Thuỷ tinh loại I hầu như trơ về hoá học, có độ bền với nước cao, không nhả các thành phần của thuỷ tinh vào thuốc, dùng thích hợp để đựng các dung dịch thuốc tiêm nước, đặc biệt thích hợp với các dung dịch thuốc tiêm nước có pH kiềm.
- Bao bì thuỷ tinh loại II: là thuỷ tinh kiềm đã được xử lý bề mặt nên có độ bềnvới nước khá cao, dùng thích hợp để đựng các thuốc tiêm nước có pH acid hay trung tính.
- Bao bì thuỷ tinh loại III: là thuỷ tinh kiềm, có độ bền với nước vừa phải, dùng thích hợp để đựng các thuốc tiêm dầu, thuốc tiêm bột và các thuốc dùng ngoài đường tiêm.
- Bao bì thuỷ tinh loại IV: là thuỷ tinh kiềm có độ bền với nước ở mức thấp, chỉ dùng để đựng các thuốc không dùng để tiêm.
d) Yêu cầu kiểm tra chất lượng bao bì thuỷ tinh
Dược điển các nước như Dược điển Mỹ (USP), Dược điển Anh (BP) và Dược điển Việt Nam V đều có quy định thử nghiệm các tiêu chí sau:
- Độ bền với nước của mặt trong bao bì thuỷ tinh.
- Phân biệt thuỷ tinh loại I và loại II.
- Giới hạn asen áp dụng cho bao bì thuỷ tinh đóng thuốc tiêm nước.
Phương pháp thử và giới hạn chấp nhận theo quy định của Dược điển Việt Nam V, theo Phụ lục 17.1.
2.4.3.3.2. Chất dẻo
Chất dẻo (plastics) là các polyme khác nhau, được sử dụng rộng rãi làm bao bì đựng các sản phẩm thuốc dưới nhiều hình dạng, kiểu dáng, dung tích khác nhau.
- Chai, lọ để đựng các dạng thuốc rắn và thuốc lỏng.
- Túi để đựng các dung dịch tiêm truyền.
- Tuýp để đựng thuốc mỡ, kem, gel.
- Màng chất dẻo phối hợp với màng nhôm để ép vỉ cho từng viên thuốc đạn, thuốc trứng, viên nang, viên nén.
- Nắp, nút để đậy kín chai, lọ, bằng thuỷ tinh hay chất dẻo và tuýp nhôm.
a) Ưu, nhược điểm của bao bì chất dẻo
Bao bì đựng thuốc bằng chất dẻo có nhiều ưu điểm:
- Nhẹ, tỷ trọng bằng khoảng 1/10 tỷ trọng của thuỷ tinh, nên chi phí vận chuyển thấp hơn so với bao bì thuỷ tinh chứa cùng dung tích thuốc.
- Dẻo, dai, khó bị nứt vỡ trong quá trình sản xuất, bảo quản, vận chuyển.
- Dễ chế tạo bao bì dưới nhiều hình dạng khác nhau và dễ hàn kín.
- Thuốc tiêm truyền đựng trong các túi chất dẻo khi truyền không phải đối lưu không khí mà vẫn truyền được hết lượng thuốc, tránh được nguy cơ bị nhiễm từ môi trường vào thuốc trong khi truyền.
Bao bì chất dẻo cũng có nhiều nhược điểm:
- Không có bao bì chất dẻo nào là hoàn toàn trơ về hoá học. Vì để tạo ra các bao bì chất dẻo có các đặc tính phù hợp với chế phẩm thuốc, người ta phải thêm vào các polyme những chất phụ gia và các chất này có thể nhả vào thuốc trong khi tiếp xúc kéo dài với thuốc chứa bên trong. Các chất nhả từ bao bì vào thuốc có thể tương tác với các thành phần của thuốc làm giảm chất lượng và độ an toàn của thuốc.
- Trái ngược với bao bì thuỷ tinh, nhiều polyme làm bao bì chất dco không có khả năng ngăn cản sự thấm khí như oxy, carbon dioxyd và hơi nước từ môi trường vào thuốc chứa trong bao bì. Vì thế, không nên dùng các bao bì chất dẻo này để đựng các thuốc cần tránh ẩm, tránh khí.
- Nhiều loại polyme làm bao bì chất dẻo không ngăn được sự thấm các dung môi, các chất dễ bay hơi trong chế phẩm thuốc qua bao bì ra môi trường trong khi bảo quản thuốc. Vì thế, không nên dùng các bao bì chất dẻo này để đựng các chế phẩm thuốc có thành phần dễ bay hơi.
- Bao bì chất dẻo bị biến dạng bởi nhiệt, nhất là nhiệt khô nên không thể tiệt khuẩn bao bì chất dẻo bằng nhiệt khô trong tủ sấy hay lò sấy.
- Một số loại bao bì chất dẻo khó đạt được độ trong cần thiết để có thể kiểm tra trực tiếp bằng mắt sự biến đổi về hình thức của thuốc chứa trong bao bì.
- Bao bì chất dẻo bị già hoá theo thời gian dưới tác động của nhiệt, ánh sáng, hơi dung môi, không khí của môi trường.
b) Thành phần chất dẻo
Bao bì chất dẻo với thành phần nguyên liệu chính là các hợp chất hữu cơ có cấu trúc polyme được tạo thành từ các monome nhờ các phản ứng polyme hóa dưới những điều kiện nhất định.
- Các polyme có thể là đồng polyme (copolymers) được hình thành ít nhất từ hai loại monome, ví dụ ethylen vinyl acetat được polyme hoá từ ethylen và vinyl acetat hoặc thuần polyme (homopolymers) được tạo thành từ duy nhất một loại monome, ví dụ polyethylen được polyme hoá từ một loại monome là ethylen.
- Các chuỗi polyme trong nguyên liệu polyme hóa thường có chiều dài rất khác nhau nên khối lượng phân tử của các nguyên liệu polyme không chính xác, thường lấy giá trị trung bình. Các polyme dùng làm bao bì dược phẩm có khối lượng phân tử xấp xỉ đến 1.000.000 Da.
- Các chuỗi polyme có thể sắp xếp mạch thẳng, phân nhánh, liên kết chéo, vô định hình và/hoặc kết tinh. Trong cấu trúc của một polyme có cả vùng kết tinh và vùng vô định hình với tỷ lệ khác nhau phụ thuộc vào quy trình chế tạo polyme đó. Các polyme ở trạng thái kết tinh đục mờ, cứng chắc, giòn và có khả năng ngăn cản sự xâm nhập của hơi ẩm, không khí. Trái lại, các polyme ở trạng thái vô định hình trong suốt, xốp, mềm, dẻo, hơi ẩm và không khí có thể thâm nhập qua.
- Trong quá trình tổng hợp các polyme, nhiều chất hoá học khác nhau như dung môi, các chất xúc tác, các chất mồi (initiators), các chất gia tốc (accelerators) đã được thêm vào để thúc đẩy quá trình polyme hóa. Vì thế, trong thành phần của chất dẻo có sự hiện diện của các chất đó ở mức độ khác nhau.
- Thêm vào đó, khi chuyển chất dẻo thành các bao bì đựng thuốc, người ta phải thêm các chất phụ gia (additives) để làm tăng đặc tính của bao bì thu được và /hoặc hỗ trợ quá trình chế tạo như: chất hóa dẻo (plasticizer) làm tăng tính mềm, dẻo của bao bì; chất chống oxy hoá (antioxidant) làm chậm sự già hoá của bao bì do bị oxy hoá; chất ổn định (stabilizer) giúp ổn định bao bì chống lại các tác động của nhiệt, ánh sáng; chất màu (pigment) để tạo màu của bao bì, chất làm trơn (lubricant) để chống dính trong quá trình chế tạo bao bì, chất độn (filler) để giảm giá thành của bao bì…
- Với thành phần phức tạp như trên, bao bì chất dẻo không trơ về mặt hoá học. Trong quá trình tiếp xúc kéo dài với thuốc chứa trong bao bì, các thành phần có trong bao bì có thể nhả vào thuốc, làm biến chất thuốc, thậm chí làm tăng độc tính của thuốc. Vì vậy, bao bì chất dẻo phải được kiểm soát, kiểm nghiệm đạt các yêu cầu quy định, không được có các chất không được sử dụng hoặc được sử dụng nhưng vượt quá giới hạn cho phép.
d) Phân loại chất dẻo
Các chất dẻo có thể được chia thành hai loại:
- Loại chất dẻo hoá dẻo bởi nhiệt (thermoplastics) là những chất mềm dẻo dưới tác động của nhiệt và hóa rắn khi nguội. Các chất dẻo này có thể làm mềm và tạo hình lại nhiều lần bằng nhiệt và lực cơ học.
Ở nhiệt độ cao, các chất dẻo loại này sẽ nóng chảy thành chất lỏng, có thể rót vào khuôn hoặc dùng nhiệt làm niềm để đùn vào khuôn có hình dạng khác nhau, tạo thành bao bì như: chai, tuýp, nắp, nút, màng mỏng.
Việc chế tạo bao bì chất dẻo có thể thực hiện song song cùng với dây chuyền pha chế thuốc, bao bì tạo ra được đóng thuốc ngay (blow fill seal – BFS) mà không phải xử lý riêng biệt như với trường hợp bao bì đã chế tạo sẵn.
Thuộc nhóm này có polyethylen tỷ trọng thấp (LDPE), polyethylen tỷ trọng cao (HDPE), polystyren (PS), polypropylen (PP), polycarbonat (PC), polyethylen terephthalat (PET), polyvinyl clorid (PVC), styren-butadien-acrylonitril (SAN), styren-butadien, cyclic olefin coopolyme, polyvinyliden clorid đông polyme, polyclorotrifluoroethylen…
Bao bì chất dẻo được chế tạo từ các polyme khác nhau thể hiện tính chất cũng rất khác nhau (xem minh họạ ở bảng 1.3). Vì thế, phải căn cứ vào từng dạng thuốc, đường dùng thuốc mà chọn loại bao bì bằng chất dẻo cho phù hợp để đựng sản phẩm thuốc.
Bảng 1.3. So sánh tính chất của bao bì chất dẻo chế tạo từ polyme khác nhau
| Tính chất | HDPE | LDPE | PET | PP | PS | SAN | PC | PVC |
| Thể chất | cứng, dai | mềm, dẻo | cứng, dai | cứng, dai | cứng, dai | cứng, dai | cứng, dai | mềm, dẻo |
| Độ trong | đục | đục, mờ | trong | đục | trong | trong | trong | trong |
| Ngăn cản thấm oxy | kém | kém | tốt | kém | kém | tốt | kém | tốt |
| Ngăn cản hơi nước | rất tốt | tốt | tốt | rất tốt | kém | vừa phải | kém | vừa phải |
| Nhiệt độ gây biến dạng (°C) | 62-91 | 40-44 | 38-129 | 107-121 | 68-96 | 104-107 | 138 | 56-82 |
– – Loại chất dẻo hoá cứng bởi nhiệt (thermosetting plastics) là những chất chỉ mềm dẻo trong khi chế tạo đồ vật và trờ nên cứng vĩnh viễn chúng không thể mềm dẻo trờ lại khi làm nóng. Loại chất dẻo này không dùng làm bao bì trực tiếp đựng thuộc mà đây là vật liệu thường được dùng làm nắp, nút.
d) Yêu cầu kiểm tra chát lượng bao bì chất dẻo
Để lựa chọn được bao bì chất dẻo phù họp với thuốc chứa trong bao bì, dược điển từng nước đều có quy định cụ thể về yêu cầu thử nghiệm chất lượng bao bì bằng chất dẻo dùng cho sản xuất dược phẩm. Theo Dược điên Việt Nam V:
– Bao bì chất dẻo dùng đựng các thuốc không phải thuốc tiêm: phải thực hiện các thử nghiệm về: độ kín, độ uốn gấp, độ trong của nước chiết, cắn không bay hơi, độ thấm hơi nước. Phương pháp thử và tiêu chí chấp nhận theo quy định của Dược điển Việt Nam V, Phụ lục 17.3.1.
– Bao bì chất dẻo dùng đựng các thuốc tiêm: phải thực hiện các thử nghiệm về độ km, độ gấp uốn, độ trong, độ thấm hơi nước, giới hạn bari, kim loại nặng, thiếc, kẽm và cắn nung. Các thử nghiệm trên dịch chiết về hóa lý (độ trong, màu sắc, độ hấp thụ ánh sáng, pH của dịch chiết, cắn không bay hơi, cắn nung, kim loại nặng, dung lượng đệm và chất khử) và thử nghiệm sinh học (thử nghiệm toàn thân, thử nghiệm tiêm trong da và thử nghiệm chất gây sốt). Phương pháp thử và tiêu chí chấp nhận theo quy định của Dược điển Việt Nam V, Phụ lục 17.3.2.
– Bao bì chất dẻo dùng đựng thuốc nhỏ mắt: phải đáp ứng các yêu cầu thử nghiệm đối với bao bì chất dẻo dùng đựng các thuốc không phải thuộc tiêm, cũng như các yêu câu thử nghiệm đôi với bao bì chất dẻo dùng đựng các thuốc tiêm và thử nghiệm kích ứng mặt. Phương pháp thử và tiêu chí chấp nhận theo quy định của Dược điển Việt Nam V, Phụ lục 17 3.3.
2.4.3.3.3. Cao su
Cao su là vật liệu được dùng phổ biến để chế tạo nút cao su cho các chai, lọ thuỷ tinh đựng thuốc tiêm và thuốc tiêm truyền do tính đàn hồi cao, có khả năng tự bịt kín khe hở giữa miệng chai, lọ và nút.
a) Thành phần nút cao su
Cao su là sản phẩm lưu hoá của các chất đàn hồi (elastomers) và các chất phụ gia (additives).
– Các chất đàn hôi có thể là cao su tự nhiên (nhựa cây cao su) hay tổng hợp từ dẫn chất hoá dầu, Ịà những vật liệu có thể kéo giãn gấp hai lần chiều dài ban đầu và trở lại ngay chiêu dài ban đâu khi ngừng lực kéo. Cao su tự nhiên có mức độ thấm khí, thấm hơi nước rất cao và hấp phụ nhiều chất sát khuẩn như clorobutanol, thuỷ ngân phenyl borat. Để khắc phục nhược điểm này, người ta thường phối hợp cao su tự nhiên với cao su butyl; cao su clorobutyl hay cao su silicon là vật liệu ngăn cản thấm oxy, thấm hơi nước và không tạo hạt khi chọc kim tiêm qua nút nhiều lần.
– Các chất phụ gia hao gồm các chất lưu hoá, các chất tăng tốc độ lưu hoá, các chất hoạt hoá, các chất hoá dẻo, các chất độn, các chất chống oxy hoá, các chất màu và các chất làm trơn. Các chất phụ gia được thêm vào cùng chất đàn hồi giúp tạo ra nút cao su có các đặc tính mong muốn.
– Các chất đàn hồi và các chất phụ gia được lèn trộn thành khối đồng nhất, rồi được lưu hoá thành nút cao su có hình dạng đã định băng các khuôn dưới tác động của nhiệt và áp suất.
b) Yêu cầu kiểm tra chất lượng nút cao su
Nút cao su đậy chai, lọ thuốc tiêm phải có độ cứng, độ đàn hồi thích hợp để bịt kín giữa mặt trong của miệng chai, lọ và bê mặt xung quanh nút.
Nút cao su đậy chai, lọ thuốc tiêm, khi sử dụng sẽ phải đâm kim tiêm qua nút nên nút phải đáp ứng yêu cầu khi đâm kim qua không được tạo hạt và khi rút kim ra khỏi nút phải tự bịt kín được lỗ kim đâm để không bị nhiễm tạp từ môi trường bên ngoài vào thuốc.
Không cho hơi ẩm đi qua nút, đây là yêu cầu rất quan trọng đối với nút cao su đậy các lọ thuốc tiêm bột và thuốc tiêm đông khô.
Không bị dẻo dính khi tiệt khuẩn ở nhiệt độ cao (phương pháp thích hợp để tiệt khuẩn nút cao su là tiệt khuẩn bằng nhiệt ẩm như luộc sôi hoặc hấp ở 121°C).
Không nhả tạp chất hay hấp phụ các thành phần của thuốc vượt quá mức cho phép.
Để chọn được nút cao su đáp ứng được các yêu cầu nêu trên phải thực hiện các thử nghiệm theo quy định của dược điển từng nước.
Dược điển Việt Nam V yêu cầu thử nghiệm chất lượng nút cao su dùng cho chai lọ đựng thuốc tiêm về các chỉ tiêu: tính chất, độ bền của nút khi đâm kim, độ bền của nút khi tiệt khuẩn, khả năng tự bịt kín lỗ đâm kim, giới hạn sulfid dễ bay hơi và các phép thử với dịch chiết (giới hạn acid – kiềm, giới hạn kim loại nặng, giới hạn chất khử, giới hạn cắn khô, giới hạn amoni, giới hạn kẽm hoà tan, độ hấp thụ ánh sáng, độ đục và màu sắc của dịch chiết). Phương pháp thử và chỉ tiêu chấp nhận theo Dược điển Việt Nam V, Phu luc 17.5.
2.4.3.3.4. Kim loại
Kim loại được sử dụng phổ biến làm bao bì trực tiếp đựng thuốc là nhôm. Nhôm được dùng phổ biến dưới dạng: bình/ống đựng thuốc hít qua đường hô hấp; hộp, tuýp đựng các thuốc mỡ, kem, gel; các túi nhỏ đựng thuốc bột, thuốc cốm, thuốc đạn, thuốc lỏng; các vỉ ép/vỉ xé chứa thuốc đặt, thuốc viên; các nắp chai, lọ hay chụp trên các chai lọ đậy bằng nút cao su. Như vậy, từ nhôm có thể làm thành các bao bì cả ở dạng cứng và dạng mềm.
Bao bì nhôm đụng thuốc có ưu điểm:
– Có độ bền cơ học cao, có thể chịu được áp suất cao bên trong bao bì (ống hít định liêu chứa chất đẩy hoá lỏng, bình phun mù chứa khí nén).
– Có khả năng biến dạng cao, không bị gẫy nứt khi gập nếp (gập đáy tuýp đóng
thuốc mũ,kẹm, gel), cho phép kéo dài hay dát mỏng. Màng nhôm (aluminium form foil) có thể gan kín với màng chất dẻo (plastic form foil) dưới tác động của nhiệt thành các túi nhỏ hay các màng vật liệu để ép vỉ…
– Không cho chất lỏng, hơi ấm, không khí và các khi thấm qua.
– Ngăn cản ánh sáng.
– Chịu được cả nhiệt độ cao và nhiệt độ thấp.
– Khối lượng riêng nhẹ.
Bao bì nhôm đựng thuốc có nhược điểm:
– Bao bì nhôm đựng thuốc có thể tương tác với các thành phần của thuốc chứa trong bao bì.
– Bị ăn mòn do nhôm là một kim loại lưỡng tính, khi tiếp xúc với các dạng thuốc lỏng, mềm có pH acid hoặc kiềm sẽ xảy ra phản ứng ăn mòn, làm thủng bao bì. Để không bị ăn mòn, người ta tráng lên bề mặt trong bao bì nhôm màng chất dẻo thích hợp.
Tuỳ theo mục đích sử dụng bao bì bằng kim loại mà thực hiện các yêu cầu thử nghiệm chất lượng khác nhau theo tiêu chuẩn của dược điển hoặc theo tiêu chuẩn của nhà sản xuất.
Dược điển Việt Nam V có quy định về thử nghiệm tiểu phân kim loại với bao bì đựng thuốc mỡ tra mắt bằng kim loại. Phương pháp thử và tiêu chí chấp nhận theo quy định của Dược điển Việt Nam V, phụ lục 17.2.
2.4.3.3.5. Giấy
Giấy được làm từ sợi celulose, là vật liệu bao bì được dùng từ lâu. Khác với thuỷ tinh, chất dẻo, kim loại, giấy thường không dùng làm bao bì trực tiếp để đựng thuốc do không ngăn được thấm ẩm, thấm khí và mùi.
Giấy có ưu điểm là rất dễ in, phối màu, háng nhựa hoặc sáp để chống thấm nước. Giấy chủ yếu được dùng để in nhãn, tờ hướng dẫn sử dụng thuốc, bao bì thứ cấp như túi giấy, hộp, hòm bằng giấy carton.
Giấy được dùng làm lóp mặt ngoài khi kết họp với màng kim loại/ màng chất dẻo thành vật liệu để chế tạo các túi đựng thuốc hoặc vật liệu để ép vỉ.
3. SINH KHẢ DỤNG
3.1. Quá trình sinh dược học của thuốc trong cơ thể
Muôn bào chê được các sản phẩm thuốc có hiệu quả điều trị cao, lựa chọn đúng dạng thuốc, hướng dẫn sử dụng thuốc hợp lý, an toan và hiệu quả, người dược S1 cân phải biết rõ quá trình sinh dược học của thuốc trong cơ thể.
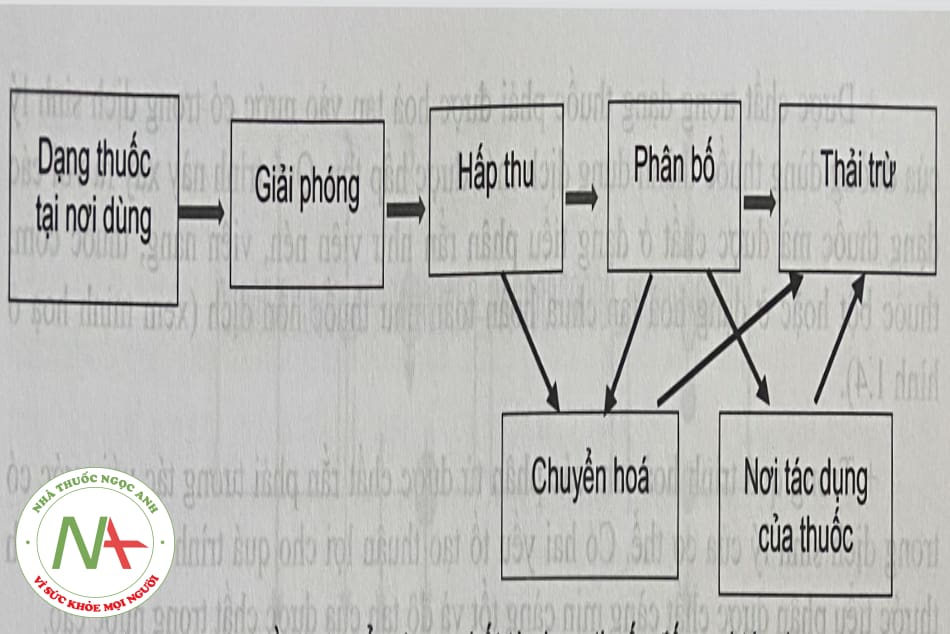
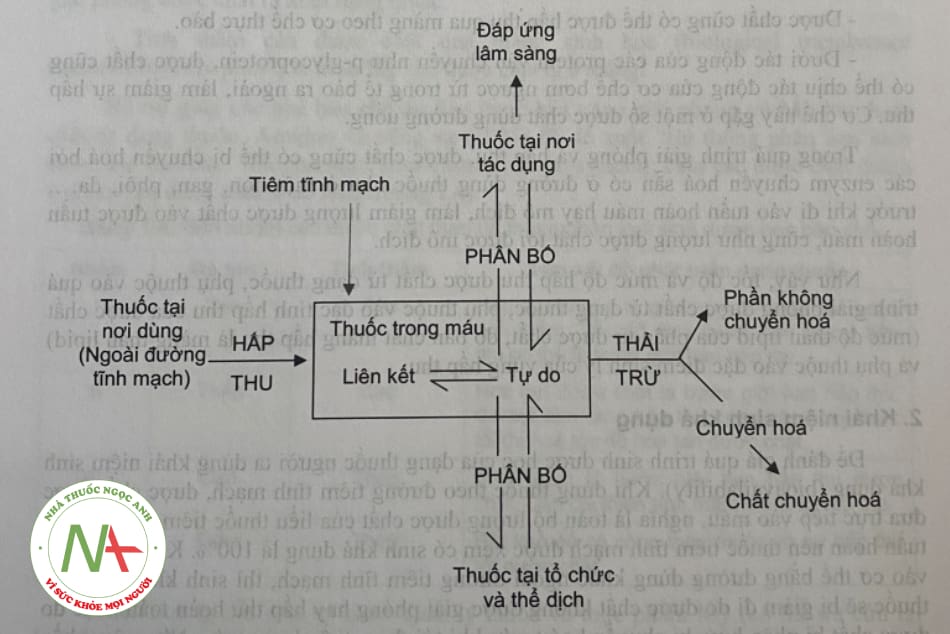
Ngoại trừ đường tiêm tĩnh mạch, dược chất trong liều thuốc được đưa trực tiếp vào tuần hoàn máu rồi được phân bố đến các tổ chức của cơ thể, trong đó có nơi tác dụng của thuốc. Còn với các đường dùng thuốc khác, khi mà nơi tác dụng của thuốc khác nơi dùng thuốc, dược chất từ dạng thuốc phải qua các bước di chuyển được mô tả ở sơ đồ hình 1.3.
Liên quan đến số phận của thuốc trong cơ thể, sinh dược học bào chế quan tâm đến quá trình giải phóng và hấp thu dược chất từ dạng thuốc. Đây là hai giai đoạn mà nhà bào chế có thể tác động trong nghiên cứu xây dựng công thức và quy trình bào chê thuốc. Trong khi dược động học quan tâm đến quá trình hấp thu, phân bô, chuyên hoá
và thải trừ thuốc.
3.1.1. Giải phóng
Giải phóng (liberation/release) là bước mở đầu cho quá trình sinh dược học, nếu dược chất không được giải phóng ra khỏi dạng thuốc thì sẽ không có bước hâp thu tiêp theo. Dược chất được giải phóng ra khỏi dạng thuốc có thể bằng quả trình hoà tan hoặc
bằng quá trình khuêch tán.
– Giải phóng dược chất bằng quá trình hoà tan (dissolution):
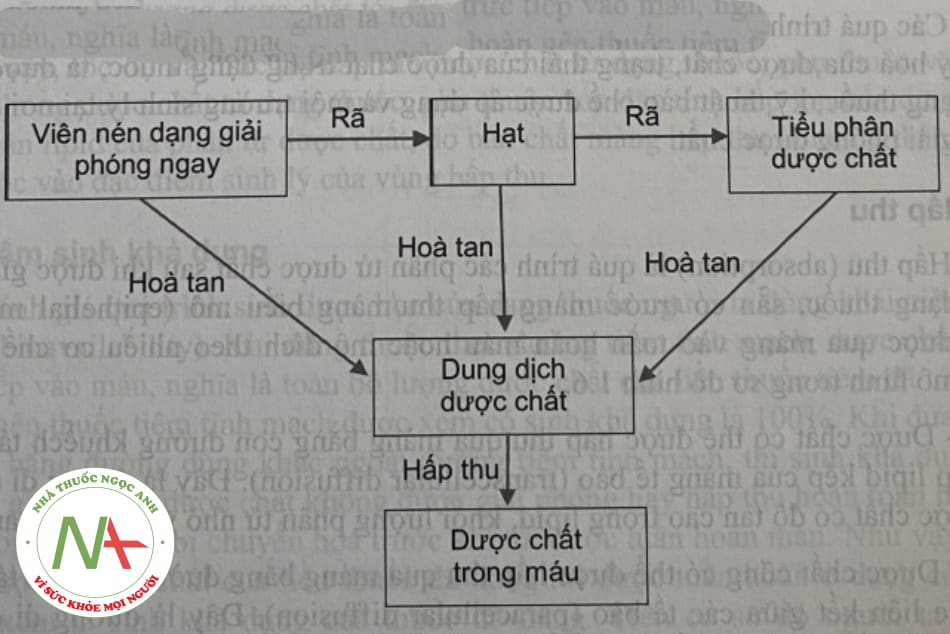
+ Dược chất trong dạng thuốc phải được hoà tan vào nước có trong dịch sinh lý của đường dùng thuốc thành dung dịch mới được hấp thu. Quá trình này xảy ra với các dạng thuốc mà dược chất ở dạng tiểu phân rắn như viên nén, viên nang, thuốc cốm, thuốc bột hoặc ở dạng hoà tan chưa hoàn toàn như thuốc hỗn dịch (xem minh họạ ở hình 1.4).
+ Trong quá trình hoà tan, các phân tử dược chất rắn phải tương tác với nước có trong dịch sinh lý của cơ thể. Có hai yếu tố tạo thuận lợi cho quá trình hoà tan là kích thước tiểu phân dược chất càng mịn càng tốt và độ tan của dược chất trong nước cao.
– Giải phóng dược chất bằng quá trình khuếch tán (diffusion):
+ Khi dùng thuốc mỡ, kem, gel hay hệ phân phối thuốc qua da, dù để gây tác dụng điều trị tại chỗ ở da hay hấp thu qua da để vào tuần hoàn gây tác dụng toàn thân, khi dược chất trong các dạng thuốc trên tồn tại ở dạng dung dịch thì dược chất sẽ được giải phóng ra khỏi dạng thuốc bằng quá trình khuếch tán (xem minh họạ ở hình 1.5).
+ Các dạng thuốc viên giải phóng kéo dài, giải phóng có kiểm soát cũng là dạng thuốc giải phóng dược chất bằng quá trình khuếch tán. Trước tiên, nước trong dịch sinh lý của cơ thể tại nơi dùng thuốc phải thấm vào trong dạng thuốc, hoà tan dược chất; khi dược chất đã hoà tan sẽ khuếch tán ra khỏi dạng thuốc để được hấp thu.
Các quá trình giải phóng dược chất ra khỏi dạng thuốc nêu trên phụ thuộc vào tính chất lý hoá của dược chất, trạng thái của dược chất trong dạng thuốc, tá dược được đưa vào dạng thuốc, kỹ thuật bào chế được áp dụng và môi trường sinh lý tại nơi diễn ra quá trình giải phóng dược chất.
3.1.2. Hấp thu
Hấp thu (absorption) là quá trình các phân tử dược chất sau khi được giải phóng ra khỏi dạng thuốc, sẵn có trước màng hấp thu/màng biêu mô (epithelial membranes), thấm được qua màng vào tuần hoàn máu hoặc mô đích theo nhiều cơ chế khác nhau được mô hình trong sơ đồ hình 1.6.
– Dược chất có thể được hấp thu qua màng bằng con đường khuếch tán thụ động qua lớp lipid kép của màng tế bào (transcellular diffusion). Đây là đường di chuyển của các dược chất có độ tan cao trong lipid, khối lượng phân tử nhỏ và không mang điện.
– Dược chất cũng có thể được hấp thu qua màng bằng đường khuếch tán thụ động qua khe liên kết giữa các tế bào (paracellular diffusion). Đây là đường di chuyển của nước, các chât tan thân nước, có khôi lượng phân tử nhỏ.
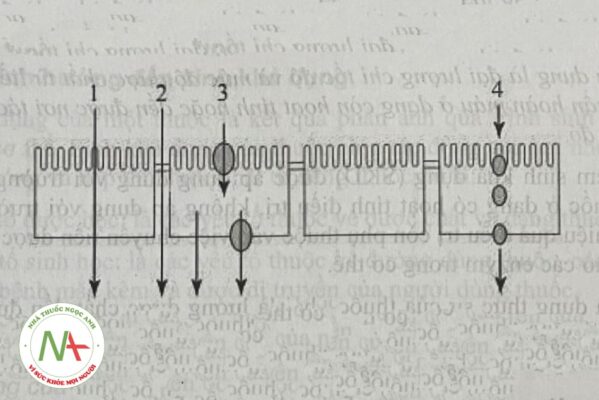
Động lực của quá trình khuếch tán thụ động chính là gradient nồng độ dược chất trước và sau màng hấp thu, nên quá trình giải phóng dược chất càng nhanh, nồng độ trước màng hấp thu càng cao, tốc độ khuếch tán càng nhanh.
– Dược chất cũng có thể được hấp thu qua màng bằng cơ chế vận chuyển trung gian có chât mang.
– Dược chất cũng có thể được hấp thu qua màng theo cơ chế thực bào.
– Dưới tác động của các protein vận chuyển như p-glycoprotein, dược chất cũng có thể chịu tác động của cơ chế bơm ngược từ trong tế bào ra ngoài, làm giảm sự hấp thu. Cơ chế này gặp ở một số dược chất dùng đường uống.
Trong quá trình giải phóng và hấp thu, dược chất cũng có thể bị chuyển hoá bởi các enzym chuyển hoá sẵn có ở đường dùng thuốc như ở ruột non, gan, phổi, da…, trước khi đi vào tuần hoàn máu hay mô đích, làm giảm lượng dược chất vào được tuần hoàn máu, cũng như lượng dược chất tới được mô đích.
Như vậy, tốc độ và mức độ hấp thu dược chất từ dạng thuốc, phụ thuộc vào quá trình giải phóng dược chất từ dạng thuốc, phụ thuộc vào đặc tính hấp thu của dược chất (mức độ thân lipid của phân tử dược chất, do bản chất màng hấp thu là màng thân lipid) và phụ thuộc vào đặc điểm sinh lý của vùng hấp thu.
3.2. Khái niệm sinh khả dụng
Để đánh giá quá trình sinh dược học của dạng thuốc người ta dùng khái niệm sinh khả dụng (bioavailability). Khi dùng thuốc theo đường tiêm tĩnh mạch, dược chất được đưa trực tiếp vào máu, nghĩa là toàn bộ lượng dược chất của liều thuốc tiêm đã tới được tuần hoàn nên thuốc tiêm tĩnh mạch được xem có sinh khả dụng là 100%. Khi đưa thuốc vào cơ thể bằng đường dùng khác ngoài đường tiêm tĩnh mạch, thì sinh khả dụng của thuốc sẽ bị giảm đi do dược chất không được giải phóng hay hấp thu hoàn toàn hoặc do dược chất bị phân hủy, bị chuyên hoá trước khi tới được tuân hoàn máu. Như vậy, phân trăm (%) lượng dược chất của liều thuốc đã dùng tới được tuần hoàn ở dạng còn hoạt tính được xem là sinh khả dụng của thuốc đã dùng. Trên cơ sở đó người ta đưa ra định nghĩa:
Sinh khả dụng là đại lượng chỉ tốc độ và mức độ dược chất từ liêu thuốc đã dùng đi được vào tuần hoàn máu ở dạng còn hoạt tỉnh hoặc đến được nơi tác dụng (mô đích) của dược chất đó.
Khái niệm sinh khả dụng (SKD) được áp dụng đúng với trường hợp dược chất trong dạng thuốc ở dạng có hoạt tính điều trị, không áp dụng với trường hợp các tiền dược chất do hiệu quả điều trị còn phụ thuộc vào việc chuyên tiên dược chất thành dạng có hoạt tính nhờ các enzym trong cơ thể.
Sinh khả dụng thực sự của thuốc phải là lượng dược chất đến được nơi tác dụng của thuốc. Song hầu hết các trường hợp, không thể định lượng được dược chất tại nơi tác dụng.
Với đường dùng thuốc toàn thân, dược chất từ dạng thuốc sau khi dùng thuốc phải được hấp thu vào tuần hoàn máu, rồi từ tuần hoàn máu phân bố đến nơi tác dụng. Vì vậy, sinh khả dụng của thuốc trong máu hay trong huyết tương được định lượng và là chỉ thị về sinh khả dụng của thuốc tại nơi tác dụng, trên cơ sở thừa nhận có một cân bằng động tồn tại, cũng như có tương quan đồng biến giữa nồng độ dược chất ở trong máu và nồng độ dược chất tại nơi tác dụng (xem minh họa ở hình 1.7).
3.3. Các yếu tố ảnh hưởng đến sinh khả dụng
Sinh khả dụng của một thuốc là kết quả phản ánh quá trình sinh dược học của thuốc đó trong cơ thể. Sinh khả dụng của thuốc chịu tác động của hai nhóm yếu tố liên quan đến giải phóng và hấp thu dược chất từ dạng thuốc đó là:
– Các yếu tố dược học: là các yếu tố thuộc về dược chất và dạng thuốc.
– Các yếu tố sinh học: là các yếu tố thuộc về đường dùng thuốc, cách dùng thuốc, tình trạng bệnh, bệnh mắc kèm và dược di truyền của người dùng thuốc.
3.3.1. Ảnh hưởng của các yếu tố dược học
3.3.1.1. Ảnh hưởng của các yêu tô thuộc vê dược chất
3.3.1.1.1. Hệ thống phân loại sình dược học bào chế
Quá trình sinh dược học của thuốc trong cơ thể chỉ ra hai tính chất của dược chất có ảnh hưởng quyết định đến sinh khả dụng của thuốc, đó là:
– Độ tan (tính tan) của dược chất trong nước (water solubility) chi phối quá trình giải phóng dược chất ra khỏi dạng thuốc.
– Tính thấm của dược chất qua màng sinh học (biological membrance permeability) chi phối quá trình hấp thu dược chất qua màng.
Để trợ giúp các nhà bào chê dự liệu được khả năng giải phóng và hấp thu dược chất từ dạng thuốc, Amidon và cộng sự (1995) đã đề xuất “Hệ thống phân loại sinh dược học bào chế” (biopharmaceutics classcification system), chia các dược chất thành 4 nhóm các dược chât khác nhau (bảng 1.4).
Bảng 1.4. Bốn nhóm các dược chất theo hệ thống phân loại sinh dược học bào chế
| Nhóm | Độ tan | Tính thấm | Xem xét để phát triển dạng thuốc |
| I | Cao | Cao | Hấp thu không bị giới hạn bởi hoàn tan hoặc tính thấm. Tốc độ đưa thuốc đến màng hấp thu có thể là bước giới hạn hấp thu |
| II | Thấp | Cao | Hòa tan dược chất là bước giới hạn hấp thu. Có thể làm tăng hấp thu bằng các công thức tối đa hóa tốc độ hòa tan dược chất. |
| III | Cao | Thấp | Tính thấm là bước giới hạn hấp thu dược chất. Cần cải thiện tính thấm để tăng hấp thu. |
| IV | Thấp | Thấp | Rất khó để có công thức thuốc có sự hấp thu tốt dược chất. |
Theo hướng dẫn của cơ quan quản lý thuốc và thực phẩm Mỹ (có thể tra cứu tại http://www.fda.gov):
– Những dược chất được xem là có độ tan cao khi mức liều một lần cao nhất của dược chất đó, hoà tan hoàn toàn trong một thể tích dưới 250 ml nước có pH từ 1,0 – 7,5 ở 37°C.
– Những dược chất được coi là có tính thấm cao khi mức độ hấp thu ở người, sau khi uống, đạt 85% liều thuốc đã dùng so với liều đối chiếu tiêm tinh mạch.
Hệ thống phân loại sinh dược học bào chế là thông tin ban đầu giúp nhà bào chế định hướng trong xây dựng công thức và lựa chọn kỹ thuật/công nghệ bào chê cân áp dụng, để tạo ra sản phẩm thuốc có mô hình giải phóng dược chất như dự định. Dựa trên hệ thống phân loại sinh dược học bào chế, cơ quan quản lý dược phẩm có thê xem xét miễn trừ không phải cung cấp số liệu về đánh giá sinh khả dụng in vivo hoặc thử tương đương sinh học khi xin phép lưu hành các dạng thuốc rắn giải phóng ngay, dùng đường uống, có chứa dược chất thuộc nhóm 1 là các dược chất dễ tan và dễ thấm.
Bảng 1.5. Danh mục một số dược chất được phân nhóm theo hệ thống phân loại sinh dược học bào chế
| Dược chất | Độ tan | Tính thấm | Liều (mg) | Thuộc nhóm |
| Abacavir | Cao | Thấp | 300 | III |
| Acyclovir | Cao | Thấp | 200 | III |
| Aspirin | Cao | Thấp | 500 | III |
| Alopurinol | Cao | Thấp | 100 | III |
| Amilorid | Cao | Cao | 5 | I |
| Atenolol | Cao | Thấp | 100 | III |
| Captopril | Cao | Thấp | 25 | III |
| Carbamazepil | Thấp | Cao | 200 | II |
| Cimetidin | Cao | Thấp | 200 | III |
| Cloroquin | Cao | Cao | 100 | I |
| Cloxacilin natri | Cao | Thấp | 500 | III |
| Codein phosphat | Cao | Thấp | 30 | III |
| Colchicin | Cao | Thấp | 0,5 | III |
| Diazepam | Cao | Cao | 5 | I |
| Digoxin | Cao | Cao | 0,25 | I |
| Doxycyclin | Cao | Cao | 100 | I |
| Ergotamin | Cao | Thấp | 1 | III |
| Fluconazol | Cao | Cao | 50 | I |
| Furosemid | Thấp | Thấp | 40 | IV |
| Griseofulvin | Thấp | Cao | 250 | II |
3.3.1.1.2. Tốc độ hòa tan dược chất
Với các thuốc tác dụng toàn thân, có dược chất được hấp thu theo cơ chế khuếch tán thụ động thì tốc độ khuếch tán các phân tử dược chất qua màng hấp thu vào máu tại vị trí hấp thu, có thể biểu diễn bằng phương trình toán học theo Định luật khuếch tán Thứ nhất của Fick:
dC/dt)= [(D.A.P)/(h)]x(Ct-Cb)
Trong đó: dc/dt biểu thị tốc độ xuất hiện dược chất trong máu tại vị trí hấp thu, D là hệ số khuếch tán của các phân tử dược chất tới màng hấp thu, A là diện tích bê mặt màng có sự khuếch tán của các phân tử dược chất, h là bê dày màng hấp thu, p là hệ số phân bố của dược chất giữa màng và pha nước của dịch mô, Ct là nồng độ dược chất tại vùng trước màng hấp thu, Cb là nồng độ dược chất trong máu tại vị trí hấp thu.
Phương trình (1.1) cho thấy, tốc độ hấp thu càng nhanh khi hiệu số (Ct – Cb) càng cao. Khi phân tử dược chất hấp thu vào máu, sẽ được dòng tuần hoàn tải ngay khỏi vị trí thu nen Cb tại vị trí hấp thu rất thấp (~ 0), có nghĩa là Ct >> Cb (điều kiện “sink”).
Như vậy, chênh lệch nồng độ hai bên màng hấp thu phụ thuộc chủ yếu vào Ct trước màng. Ct sẽ càng cao khi tốc độ hoà tan dược chất từ dạng thuốc càng nhanh, tốc độ hấp thu càng nhanh. Do đó, tốc độ hoà tan có thể là bước giới hạn tốc độ hấp thu dược chất từ các dạng thuốc chứa dược chất ở dạng các tiểu phân có độ tan thấp và hoà tan chậm.
Tốc độ hoà tan của dược chất trong dịch mô tại vùng hấp thu có thể biểu diễn bằng phương trĩnh Noyes-Whitney:
(dm/dt)=D.A. (Cts-C)/h (1.2)
Trong đó: dm/dt là tốc độ hòa tan của các tiểu phân dược chất , D là hệ số khuếch tán cảu dược chất trong dung dịch ở dịch mô, A là diện tích bề mặt của các tiểu phân dược chất tiếp xúc với dịch mô, h là bề dày của lớp khuếch tán bao quanh từng tiểu phân dược chất, Cs là độ tan của dược chất ở lớp khuếch tán, C là nồng độ dược chất trong dịch mô tại vùng hấp thu.
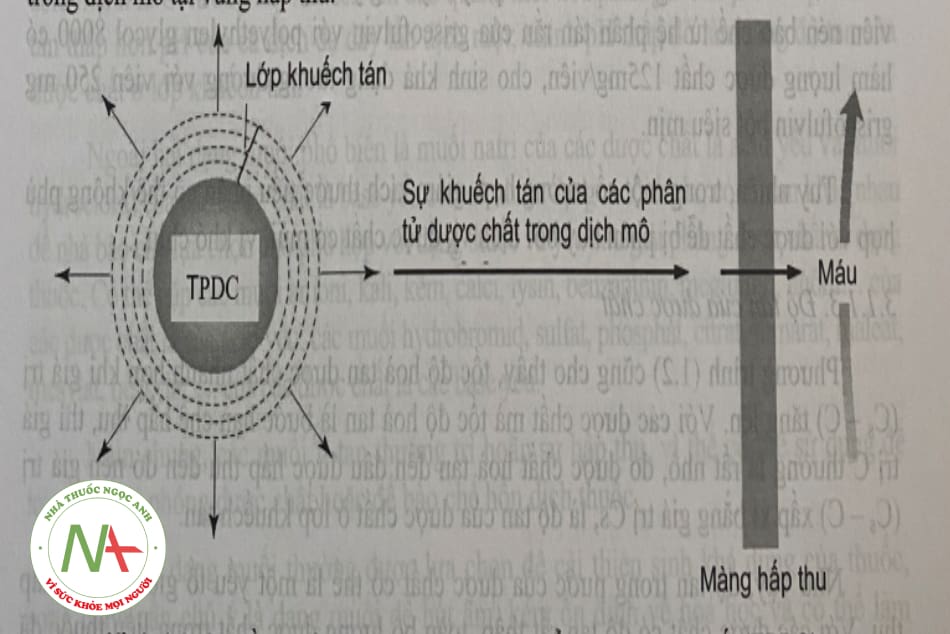
Qúa trình hòa tan dược chất trong cơ thể là quá trình động (sơ đồ hình 1.8), chịu ảnh hưởng và tác động của nhiều yếu tố như diện tích bề mặt hòa tan, bề dày cảu lớp khuếch tán và độ tan của dược chất.
Phương trình (1.2) cho thấy: Diện tích bề mặt hoà tan A càng lớn thì tốc độ hoà tan dược chất càng nhanh. Với các dược chất thân nước, dễ thấm ướt bởi dịch sinh học thì diện tích bề mặt hoà tan thực tế của dược chất sẽ liên quan trực tiếp đến kích thước tiểu phân dược chất. Cùng một lượng dược chất trong dạng thuốc, kích thước tiểu phân dược chất càng nhỏ thì bề mặt hoà tan thực tế càng lớn nên tốc độ hoà tan càng nhanh.
Các dược chất có sinh khả dụng tăng khi giảm kích thước tiểu phân thì tốc độ hoà tan dược chất chính là bước hạn chế sự hấp thu. Khi đó, giảm kích thước tiểu phân dược chất là biện pháp hữu ích để cải thiện sinh khả dụng của dạng thuốc.
Giảm kích thước tiểu phân của các dược chất (dùng dược chất dưới dạng bột siêu mịn – micronized powders) như aspirin, digoxin, danazol, fenofibrat, ibuprofen, nitrofurantoin, naporoxen, sulfadiazin, tolbutamid…, trước khi đưa vào dạng thuốc rắn dùng theo đường uống đã làm tăng sinh khả dụng của thuốc. Ví dụ, khi giảm kích thước tiểu phân griseoíulvin từ khoảng 10 pm (diện tích bề mặt riêng 0,4 m2/g) xuống khoảng 2,7 μm (diện tích bề mặt riêng 1,5 m2/g) đã cho thấy lượng dược chất được hấp thu ở người tăng gàn gấp đôi.
Một số dược chất có bề mặt sơ nước (hydrophobic), khi giảm kích thước tiểu phân bằng các kỹ thuật tạo bột siêu mịn khô có thể dẫn tới kết tập các tiểu phân, làm giảm diện tích bê mặt hoà tan thực tế của dược chất trong dịch mô, làm giảm tốc độ hoà tan dược chât, giảm sinh khả dụng của thuốc. Để khắc phục hiện tượng này, người ta làm giảm kích thước tiểu phân dược chất kết họp với các chất tăng thấm ướt bề mặt các tiểu phân dược chất là các chất diện hoạt; ví dụ dùng polysorbat 80.
Một kỹ thuật đồng thời làm giảm kích thước tiểu phân dược chất và cải thiện tính thấm ướt dịch ho à tan của tiểu phân dược chất là chế tạo hệ phân tán rắn của dươc chất ít tan với các chất mang thân nước như polyethylen glycol, polyvinyl pyrolidon… Ví du, viên nén bào chê từ hệ phân tán rắn của griseofulvin với polyethylen glycol 8000 có hàm lượng dược chât 125mg/viên, cho sinh khả dụng tương đương với viên 250 mg griseofulvin bột siêu mịn.
Tuy nhiên, trong một số trường họp, giảm kích thước tiểu phân có thể không phù họp với dược chất dễ bị phân huỷ bởi dịch vị, dược chất có mùi, vị khó chịu…
3.3.1.1.3. Độ tan của dược chất
Phương trình (1.2) cũng cho thấy, tốc độ hoà tan dược chất nhanh hơn khi giá trị (Cs — C) tăng lên. Với các dược chất mà tốc độ hoà tan là bước hạn chế hấp thu, thì giá trị c thường là rất nhỏ, do dược chất hoà tan đến đâu được hấp thu đến đó nên giá trị (Cs – C) xấp xỉ bằng giá trị Cs, là độ tan của dược chất ở lóp khuếch tán.
Như vậy, độ tan trong nước của dược chất có thể là một yếu tố giới hạn sự hấp thu. Với các dược chất có độ tan rất thấp, toàn bộ lượng dược chất trong liều thuốc đã dùng có thể không được hoà tan hết trong thời gian thuốc lưu chuyển ở vùng hấp thu, làm giảm tốc độ và mức độ hấp thu. Ví dụ, itraconazol là dược chất rất ít tan trong nước, chỉ có khoảng 40 – 50% itraconazol được hấp thu từ dạng thuốc rắn chứa dược chất này, do itraconazol không hoà tan hoàn toàn trong khoảng thời gian di chuyển qua ruột non; nhưng mức độ hấp thu itraconazol được cải thiện đến 72% khi uống dung dịch itraconazol có thêm cyclodextrin làm tác nhân hoà tan. Ngược lại, với dược chất dễ tan, hấp thu nhanh quá có thể làm tăng tác dụng không mong muốn của thuốc.
Để bào chế được dạng thuốc có sinh khả dụng đáp ứng yêu cầu điều trị, nhà bào chế cần căn cứ vào mô hình giải phóng của dạng thuốc, đặc điểm của đường dùng thuốc mà chọn dạng dược chất có độ tan thích họp để đưa vào dạng thuốc.
a) Muối của các acid và base yếu
Độ tan của các dược chất là các acid yếu tăng theo sự tăng pH nên sau khi uống, dược chất di chuyển từ dạ dày xuống ruột non thì độ tan của dược chất cũng tăng lên. Ngược lại, độ tan của các dược chất là các base yếu sẽ giảm khi pH tăng, nghĩa là khi di chuyển từ dạ dày xuống ruột non độ tan của các dược chất là base yêu sẽ giảm.
Để đảm bảo sinh khả dụng của các dược chất là các acid yếu hay base yếu, người ta có thể dùng dạng muối của nó, do dạng muối thường có độ tan cao hơn nên cải thiện được tốc độ và mức độ hấp thu dược chất. Ví dụ:
– Các barbiturat thường được dùng dưới dạng muối natri đạt được hiệu quả an thần với thời gian tiềm tàng ngắn.
– Naproxen, một thuốc chống viêm không steroid, thuốc gốc lưu hành trên thị trường dùng dược chất dạng acid tự do, hiện đã được thay thế bằng natri naproxen cho hiệu quả điều trị tốt hơn do hoà tan nhanh hơn nên được hấp thu nhanh hơn.
Uống dạng thuốc rắn chứa muối của các dược chất là base yếu với các acid mạnh đảm bảo dược chất được hoà tan trong dịch dạ dày trước khi đi xuống ruột non có môi trường pH không thuận lợi cho sự hoà tan. Ví dụ, clorpromazin hydroclorid hoà tan nhanh trong dịch dạ dày và ruột hơn clorpromazin dạng base tự do, vì có mặt của anion acid mạnh là Cl– trong lóp khuếch tán bao quanh mỗi tiểu phân giữ cho pH ở lớp khuếch tán thấp hơn pH của cả dịch dạ dày lẫn dịch ruột; chính pH thấp đó làm tăng độ tan của dược chất ở lóp khuếch tán.
Ngoài hai dạng muối phổ biến là muối natri của các dược chất là acid yếu và muối hydroclorid của các dược chất là base yếu còn có nhiều dạng muối khác, có độ tan khác nhau để nhà bào chế lựa chọn cho phù họp với dạng thuốc và yêu cầu giải phóng dược chất từ dạng thuôc. Có thê gặp các muôi amoni, kali, kẽm, calci, lysin, benzanthin, meglumin, nhôm… của các dược chất là các acid yếu; các muối hydrobromid, sulfat, phosphat, citrat, fumarat, maleat, mesylat, bensylat…, của các dược chất là các base yếu.
Nhìn chung, các muối ít tan thường trì hoãn sự hấp thu, vì thế có thể sử dụng để
kéo dài giải phóng dược chất hoặc để bào chế hỗn dịch thuốc.
Mặc dù dạng muối thường được lựa chọn để cải thiện sinh khả dụng của thuốc, song cũng cân chú ý là dạng muối dễ hút ẩm, kém ổn định về hoá học và có thể làm tăng tác dụng không mong muốn. Ví dụ, natri tolbutamid hoà tan trong dung dịch acid hydrocloric 0,1M nhanh gấp 5000 lần tobutamid dạng acid tự do. Sau khi uống natri tobutamid, đường huyêt giảm rất nhanh nên có thể gây choáng do hạ đường huyết đột ngột; trong trường họp này, nhà bào chế chọn dạng acid tolbutamid có tác dụng hạ đường huyêt chậm hơn nhưng lại duy trì được đường huyết thấp trong thời gian dài hơn.
b) Dạng kết tinh
Một dược chất có thể có nhiêu dạng kết tinh khác nhau, tinh chất này gọi là hiện tượng đa hình (polymorphism) và mỗi dạng kết tinh là một dạng thù hình (polymorph). Trong đó dạng thù hình kém bên (metastable polymorph) thương co đọ tan lơn hơn dạng bền (stable polymorph), nghĩa là dạng kém bên của một dược chất tan kem sẽ cho sinh khả dụng cao hơn dạng bên. Tuy nhiên, trong quá trình bảo quản thuốc, dạng kem bền có thể chuyển thành dạng bên lại làm giảm sinh khả dụng của thuốc.
Ví dụ cloramphenicol palmitat tồn tại ba dạng kết tinh là A, B và C. Ở điều kiện nhiệt độ va áp suất bình thường, A là dạng bền, B là dạng kém bền, c là dạng rất không bền nên không đưa được vào dạng thuốc. Nghiên cứu đường cong nồng độ cloramphenicol trong huyết tương sau khi uống hỗn dịch có tỷ lệ dạng A và B thay đổi, người ta nhận thấy mức độ hấp thu cloramphenicol tăng lên khi tỷ lệ dạng B của cloramphenicol palmitat trong mỗi hỗn dịch tăng lên. Điều này được giải thích là do tốc độ hoà tan in vivo của dạng B nhanh hơn, cloramphenicol palmitat chỉ sau khi hoà tan mới được thuỷ phân thành dạng cloramphenicol tự do trong dung dịch và được hấp thu, trong khi dạng A hoà tan chậm hơn nên hiệu quả kém hơn.
c) Dạng vô định hình
Ngoài dạng kết tinh đa hình, dược chất rắn có thể tồn tại ở dạng vô định hình. Dạng vô định hĩnh thường hoà tan nhanh hơn nhiều so với dạng kết tinh của cùng dược chất nên thường có sinh khả dụng cao hơn.
Khi sử dụng dược chất ở dạng vô định hình trong bào chế dạng thuốc, cần lưu ý dược chất có thể chuyển dần sang dạng kết tinh, là dạng ít tan, trong quá trình bảo quản thuôc, dân tới giảm hiệu quả điêu trị hay không có hiệu quả điều trị.
d) SoLvat
Phân tử dược chất có thể kết họp với phân tử dung môi trong quá trinh kết tinh để tạo ra các dạng kêt tinh solvat. Khi dung môi là nước, dạng solvat được gọi là dạng hydrat (dạng ngậm nước). Nói chung, dạng ngậm nước có độ tan và tốc độ hoà tan trong nước kém hơn dạng khan nên chúng thể hiện sinh khả dụng khác nhau, đặc biệt là với các dược chất mà tốc độ hoà tan là bước hạn chế hấp thu.
Ví dụ, kháng sinh ampicilin, dạng khan (anhydrous form) được hấp thu từ cả nang cứng và hỗn dịch nước ở mức độ lớn hơn nhiều từ dạng dược chất trihydrat, do dạng ngậm nước hoà tan chậm hơn. Indinavir hydroclorid dạng khan có tốc độ hoà tan trong nước nhanh hơn nhiêu dạng ngậm nước nên được hấp thu nhanh hơn, nhiều hơn và có sinh khả dụng gấp đôi dạng ngậm nước.
3.3.1.1.4. Mức độ ion hoá của dược chất
Bản chất màng hấp thu là màng lipid, nên khi dược chất đã hoà tan thành dung dịch san co cho hấp thu thì tốc độ và mức độ thấm dược chất qua màng hấp thu còn phu thuộc vào khả năng thấm qua màng hấp thu của dược chất.
Trước hết, với dược chất là chất điện giải yếu, khả năng hấp thu dược chất được xác định bởi mức độ dược chất ở dạng không ion hoá, là dạng dễ tan trong lipid, tại vùng hấp thu. Phấn dược chất không ion hoá cang cao thì càng được hấp thu nhanh.
Mức độ ion hoá của một dược chất là acid yếu hoặc base yếu trong dung dịch phụ thuộc vào pKa của dược chất đó và pH tại vùng hâp thu. Mức độ ion hoá của dược chât có thể được tính toán theo phương trình Henderson – Hasselbach:
Với dược chất là acid yếu như aspirin, phenobarbital, acid ascorbic…, tỷ lệ dạng ion hoá [A ] và dạng không ion hoá [HA] được tính theo phương trình:
Log [A–]/[HA–]=pH – pKa (1.3)
Theo phương trình (1.3), dược chất là acid yếu, trong môi trường pH acid sẽ tồn tại chủ yếu ở dạng khồng ion hoá [HA], là dạng dược chất dễ được hấp thu ở vùng dạ dày- tá tràng và đoạn đầu ruột non khi dùng thuôc theo đường uống.
Với dược chất là base yếu như clorpromazin, erythromycin, morphin…, tỷ lệ dạng ion hoá [BH+] và dạng không ion hoá [B] được tính theo phương trình:
Log [BH+]/[B] = pKa – pH (1.4)
Theo phương trình (1.4), dược chất là base yếu, trong môi trường pH kiềm sẽ tồn tại chủ yếu ở dạng không ion hoá [B] và sẽ được hấp thu tốt ở ruột non khi dùng thuôc theo đường uống.
3.3.1.1.5. Độ tan trong lipid của dược chất
Có một số dược chất được hấp thu rất kém từ đường dạ dày ruột mặc dù chúng tồn tại chủ yếu ở dạng không ion hoá.
Ví dụ, barbiton và thiopenton là 2 barbiturat có pKa tương ứng là 7,8 và 7,6, nghĩa là chúng có mức độ không ion hoá tương tự nhau ở pH ruột non. Nhưng thiopenton được hấp thu tốt hơn nhiều so với barbiton. Nguyên nhân khác biệt này là do sự hấp thu dược chất còn bị ảnh hưởng bởi độ tan trong lipid của dược chât. Thiopenton tan trong lipid nhiều hơn barbiton nên có ái lực với màng dạ dày ruột lớn hơn và được hấp thu tốt hơn.
Độ tan trong lipid của dược chất được xác định dựa trên khả năng phân bố của dược chất giữa một dung môi giống lipid và nước, đó là hệ số phân bố p (partition coefficient) của dược chất, thường biểu thị dưới dạng logarit.
Log P của dược chất giữa octanol và nước được áp dụng rộng rãi trong sinh dược học để dự đoán khả năng thấm hay tính thấm của một dược chất qua màng sinh học.
LogP = Log (Coctanol/Cnước) (1.5)
Trong đó: Coctanol là nồng độ dược chất phân bố trong pha octanol và Cnước là nồng độ dược chất phân bố trong pha nước.
Khi log P của dược chất tăng, khả năng khuếch tán thụ động qua màng sinh học tăng. Log p được xác định bằng thực nghiệm và đã có ngân hàng dữ liệu về log p của các dược chất, có thể tra cứu theo địa chỉ http://www.dmgbank.ca/.
Với các dược chất là các acid yếu hoặc base yếu, để phản ánh đúng tinh thần lipid của các dược chất này, người ta sử dụng logarit hệ số phân bố, log D (Log distribution coefficient) để lượng hoá sự thay đổi hệ số phân bố theo pH của các dược chất này.
Ví dụ: atorvastatin có log P là 4,23 và simvastatin CO logPp la 4,42, cho thấy 2 dược chất này có tính thân lipid tương tự nhau khi căn cứ vào log P của chung. Nhưng khi tính toán log D của simvastatin ở pH 7,0 (pH rất gần với pH ở ruột non) là 4,41 có khả năng thấm cao hơn nhiều so với atorvastatin log D ở pH 7,0 chỉ là 1,54.
Với các dược chất kém tan trong lipid, để cải thiện hấp thu đối với các dược chất này người ta có thể thực hiện các biến đổi hoá học như tạo este với các dược chất đang có, để tạo ra các tiền dược chất có độ tan trong lipid cao hơn, được hấp thu tốt hơn. Xem ví dụ minh hoạ ở bảng 1.6.
Tuy vậy, các tiền dược chất không có tác dụng dược lý, sau khi hấp thu, chúng phải được các enzym trong cơ thể thuỷ phân, trả lại dược chất ban đâu mới có tác dụng dược lý.
| Tiền dược chất | Log P | Dược chất | Log p |
| Cefuroxim axetil | 0,55 | Cefuroxim | -0,24 |
| Valaciclovir | -0,30 | Aciclovir | -1,74 |
| Pivampicilin | 1,43 | Ampicilin | 0,88 |
| Proparacetamol | 1,96 | Paracetamol | 0,51 |
| Indanylcarbenicilin | 3,68 | Carbenicilin | 1,13 |
3.3.1.1.6. Kích thước phân tử dược chất
Kích thước của phân tử dược chất được ước lượng bằng khối lượng phân tử của dược chất đó. Dược chất có khối lượng phân tử càng lớn (kích thước cồng kềnh) thì phân tử dược chất càng khó để được hấp thu theo cơ chế khuếch tán thụ động qua màng sinh học.
Nói chung, các dược chất có khối lượng phân tử < 500 Da thuận lợi hơn cho quá trình khuêch tán thụ động qua màng, các dược chất có khôi lượng phân tử lớn hơn được hấp thu kém hiệu quả hơn. Khối lượng phân tử có ảnh hưởng khác nhau đối với các đường dùng thuốc khác nhau.
Cấu trúc không gian của phân tử dược chất cũng ảnh hưởng lớn đến quá trình khuếch tán thụ động qua màng, phân tử càng cồng kềnh càng khó được hấp thu.
3.3.1.1.7. Độ ổn định hoá học của dược chất
Các dược chất, tuỳ thuộc vào cấu trúc hoá học, chúng có thể không ổn định về hoá học. Dưới tác động của hơi ẩm, oxy, ánh sáng, nhiệt độ của môi trường, dược chất có thê bị thuỷ phân, bị oxy hoá, quang hoá hoặc các biến đổi khác trong quá trình bào chế, bảo quản và sử dụng, làm giảm sinh khả dụng của chê phâm thuôc, giảm hiệu quả điêu trị, thậm chí làm tăng tác dụng không mong muốn của thuốc. Do đó, nhà bào chê phải áp dụng các biện pháp thích họp để ổn đinh dược chất, đảm bảo sinh khả dụng của thuốc.
Chẳng hạn, với các dược chất không ổn định trong dịch dạ dày ruột, lượng dược chất sẵn có cho sự hấp thu sẽ giảm, làm giảm sinh khả dụng của thuốc. Sự không ổn định của dược chất trong dịch dạ dày có thể do pH acid do các enzym thuỷ phân. Nêu hạn chế được sự phân huỷ dược chất có nghĩa là cải thiện được sinh khả dụng của thuốc. Một trong các giải pháp là duy trì thuốc ở trạng thái rắn trong dịch dạ dày và chỉ hoà tan khi đến ruột non bằng cách bao tan ở ruột (còn gọi là bao kháng dịch vị).
Ví dụ, các prazol như omeprazol, esomeprazol, pantoprazol…là những dược chất rất không bền trong môi trường acid của dịch dạ dày nên để đảm bảo sinh khả dụng của các dược chất này người ta thường bào chế các pellet bao tan ở ruột rồi đóng nang.
Cũng có thể sử dụng dẫn chất của dược chất hoặc tiền dược chất có độ tan hạn chế trong dịch dạ dày nhưng khi di chuyển xuống ruột non, dạng dẫn chất hòa tan trả lại dược chất ban đầu và được hấp thu. Ví dụ, erythromycin stearat khi đi qua dạ dày không được hòa tan, đến ruột non, erythromycn stearat hòa tàn và được thủy phân trả lại erythromycin base tự do để được hấp thu.
3.3.1.2. Ảnh hưởng của các yếu tố thuộc về dạng thuốc
Sinh khả dụng của chế phẩm thuốc, không chỉ bị ảnh hưởng bởi các tính chất lý hóa và đặc tính hấp thu của bản thân dược chất như đã nêu ở trên, mà còn bị ảnh hưởng bởi nhiều yếu tố liên quan đến dạng thuốc.
Cùng một dược chất, cùng đường dùng, nhưng các dạng thuốc khác nhau sẽ có mức độ và tốc độ hấp thu dược chất khác nhau, nghĩa là có sinh khả dụng khác nhau.
Ví dụ, khi uống cùng liều dược chất nhưng được bào chế dưới dạng dung dịch, hỗn dịch, thuốc bột, thuốc cốm hay viên nén sẽ có quá trình giải phóng dược chất khác nhau và cho sinh khả dụng khác nhau (xem minh họa ở sơ đồ hình 1.9)
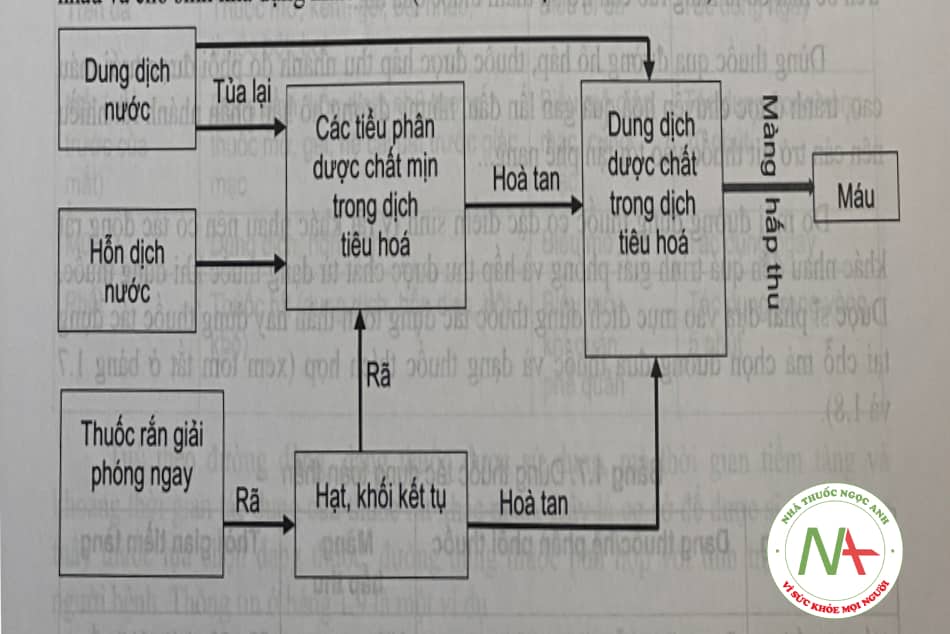
Trong thành phần các dạng thuốc khác nhau, ngoài dược chất, còn có nhiều tá dược có vai trò khác nhau (tùy theo từng công thức cụ thể), được bào chế theo các quy trình kỹ thuật/công nghệ khác nhau, đóng gói trong các bao bì thích hợp, tạo ra các sản phẩm thuốc.
Các sản phẩm thuốc bào chế ra phải đáp ứng được yêu cầu chất lượng dược phẩm của dạng thuốc (đồng nhất về khối lượng, hàm lượng, ổn định về vật lý, hóa học và vi sinh học…) và phải đáp ứng được yêu cầu chất lượng về sinh khả dụng của dạng thuốc (khả năng giải phóng và hấp thu).
Thông tin về ảnh hưởng của tá dược, của kỹ thuật/công nghệ bào chế, của bao bì đựng dạng thuốc đến sinh khả dụng của sản phẩm thuốc sẽ được nghiên cứu chi tiết trong các chương tiếp theo về từng dạng thuốc.
3.3.2. Ảnh hưởng của các yếu tố sinh học
Dùng thuốc theo đường tiêu hoá (ngậm, đặt dưới lưỡi, uống, đặt trực tràng) là đường dùng dễ dàng và thuận tiện với người dùng thuốc. Nhưng là đường dùng thuốc được hấp thu chậm, khó dự đoán được mức độ hấp thu, do tác động của các enzym tiêu hoá, sự biến đổi pH dọc theo ống tiêu hoá, chuyển hoá qua gan lần đầu, thời điểm tương đối giữa bữa ăn và uống thuốc, thời gian tháo rỗng dạ dày và tương tác thuốc thức ăn…
Dùng thuốc qua đường tiêm có thể có tác dụng nhanh hay chậm phụ thuộc vào đường tiêm (tiêm tĩnh mạch, tiêm bắp, tiêm dưới da, tiêm vào cơ quan đích…), vị trí tiêm và dạng thuốc tiêm. Dùng thuốc qua đường tiêm tránh được chuyển hoá thuốc qua gan lần đầu, thích họp với các dược chất không bền trong đường tiêu hoá hoặc không được hấp thu qua đường tiêu hoá…
Dùng thuốc qua da tránh được chuyển hoá thuốc qua gan lần đầu, nhưng lớp sừng trên bề mặt da là hàng rào cản trở sự thấm thuốc qua da…
Dùng thuốc qua đường hô hấp, thuốc được hấp thu nhanh do phổi được tưới máu cao, tránh được chuyển hoá qua gan lần đầu, nhưng đường hô hấp phân nhánh rất nhiều nên cản trở hít thuốc vào tới tận phế nang…
Do mỗi đường dùng thuốc có đặc điểm sinh lý rất khác nhau nên có tác động rất khác nhau đến quá trình giải phóng và hấp thu dược chất từ dạng thuốc khi dùng thuốc. Dược sĩ phải dựa vào mục đích dùng thuốc tác dụng toàn thân hay dùng thuốc tác dụng tại chỗ mà chọn đường đưa thuốc và dạng thuốc thích hợp (xem tóm tắt ở bảng 1.7 và 1.8).
Bảng 1.7. Dùng thuốc tác dụng toàn thân
| Đường dùng thuốc | Dạng thuốc/hệ phân phối thuốc | Màng hấp thu | Thời gian tiềm tàng |
| Uống (nuốt) | Dung dịch, hỗn dịch, nhũ tương gel, thuốc bột, thuốc cốm, viên nén, viên nang |
Niêm mạc ruột non | 30-60 phút với thuốc giải phóng ngay |
| Đặt dưới lưỡi | Viên nén, dung dịch, màng tan rã | Niêm mạc lưỡi | 1-3 phút |
| Ngậm (đặt giữa má – lợi) | Viên nén, viên kết dính sinh học, màng dán | Niêm mạc miệng | 2-3 phút |
| Tiêm tĩnh mạch | Dung dịch nước, nhũ tương D/N | Màng mao mạch | Trong vòng 60 giây |
| Tiêm bắp (cơ delta, đùi, mông)
|
Dung dịch nước, dung dịch dầu, hỗn dịch nước, hỗn dịch dầu, nhũ tương D/N hoặc N/D | Màng mao mạch ở cơ | 15-30 phút với dung dịch nước |
| Tiêm dưới da | Dung dịch nước, hỗn dịch nước, cấy dưới da | Màng mao mạch ở cơ | 15-60 phút với dung dịch nước |
| Đưa vào trực tràng | Thuốc đặt, thuốc mỡ, kem, gel, dung dịch, hỗn dịch | Niêm mạc trực tràng | 30-60 phút |
| Qua da | Thuốc mỡ, kem, gel, bột nhão, miếng dán (patch) | Lớp sừng của da | 1-4 giờ |
| Phổi | Thuốc hít (dung dịch, hỗn dịch, bột khô) | Niêm mạc đường thở | Trong vòng 5 phút |
Bảng 1.8. Dùng thuốc tác dụng tại chỗ
| Đường dùng thuốc | Dạng thuốc/hệ phân phối thuốc | Nơi tác dụng | Thời gian tiềm tàng |
| Khoang miệng | Dung dịch, hỗn dịch | Niêm mạc | Tác dụng ngay |
| Trực tràng | Thuốc đặt, thuốc mỡ, kem, gel, dung dịch, hỗn dịch | Niêm mạc trực tràng | Tác dụng ngay |
| Âm đạo | Thuốc đặt, kem, gel, viên nén, vòng | Niêm mạc âm đạo | Tác dụng ngay |
| Trên da | Thuốc mỡ, kem, gel, bột nhão, thuốc bột, bọt | Biểu bì da | Tác dụng ngay |
| Mắt (phần trước của mắt) | Dung dịch, hỗn dịch, nhũ tương, thuốc mỡ, gel, hệ cài đặt trước giác mạc | Biểu mô giác mạc, củng mạc | Tác dụng trong vòng 10 phút |
| Mũi | Dung dịch, hỗn dịch | Biểu mô mũi | Tác dụng ngay |
| Phổi | Thuốc hít (dung dịch, hỗn dịch, bột khô) | Biểu mô khí quản, phế quản | Tác dụng trong vòng 5 phút |
Tùy theo đường dùng, dạng thuốc được sử dụng, mà thời gian tiềm tàng và khoảng thời gian tác dụng của thuốc rất khác nhau. Đây là cơ sở để dược sĩ tư vấn cho thầy thuốc lựa chọn dạng thuốc, đường dùng thuốc phù hợp với tình trạng của từng người bệnh. Thông tin ở bảng 1.9 là ví dụ.
Bảng 1.9. Thời gian tiềm tàng và thời gian có hiệu quả chống co thắt mạch vành của nitroglycerin từ các dạng thuốc và đường dùng khác nhau
| Đường dùng và dạng thuốc | Thời gian tiềm tàng | Thời gian tác dụng |
| Viên đặt dưới lưỡi hoặc dung dịch xịt | 2 phút | 30 phút |
| Ngậm viên nén giải phóng kéo dài | 2-3 phút | 3-5 giờ |
| Uống viên nén giải phóng kéo dài | 1 giờ | tới 12 giờ |
| Tiêm tĩnh mạch dung dịch nước | 1-2 phút | 3-5 phút |
| Thuốc mỡ dùng qua da (transdermal ointment) | 30 phút | 3 giờ |
| Thuốc dán qua da (transdermal patch) | 60 phút | 12 giờ |
3.3.2.2. Cách dùng thuốc
Cùng liều dược chất, cùng dạng thuốc, cùng đường dùng thuốc nhưng đáp ứng với thuốc của các cá thể là rất khác nhau, thậm chí trên cùng một cá thể, ở các thời điểm khác nhau đáp ứng cũng rất khác nhau. Nguyên nhân có thể do người bệnh dùng thuốc không đúng cách.
Nếu người bệnh dùng thuốc không đúng cách có thể làm giảm sinh khả dụng của thuốc, làm giảm hiệu quả điều trị, thậm chí có thể gặp những biến cố bất lợi. Ví dụ như một số trường hợp trích dẫn ở bảng 1.10.
Bảng 1.10. Một số biến cố bất lợi do người bệnh dùng thuốc không đúng cách
| Dạng thuốc | Biến cố bất lợi do dùng thuốc không đúng cách |
| Viên nén hay viên nang | Uống thuốc không dùng nước dẫn tới thuốc dính vào thực quản và gây tổn thương niêm mạc. |
| Viên nén, viên nang giải phóng kéo dài | Cắt, bẻ, nhai (phá vỡ cấu trúc viên), không còn gây cấu trúc kéo dài giải phóng nên giải phóng ồ ạt dược chất giống viên giải phóng ngay, hấp thu quá mức, có thể gây biến cố quá liều |
| Viên nén bao tan ở ruột | Cắt, bẻ, nhai (phá vỡ cấu trúc viên), bộc lộ dược chất với pH acid của dịch dạ dày, làm phân hủy dược chất không bền ở pH acid làm giảm tác dụng của thuốc hoặc gây kích ứng tại chỗ ở dạ dày. |
| Viên đặt dưới lưỡi hay viên ngậm | Nuốt vào dạ dày ruột sẽ làm giảm mạnh sinh khả dụng của thuốc do dược chất bị chuyển hóa qua gan đầu. |
| Hỗn dịch | Không lắc kỹ trước khi phân liều dẫn tới liều lượng không đồng nhất, không đủ liều ở những liều đầu, quá liều ở những liều sau. |
| Thuốc nhỏ mắt | Nhỏ liên tục, không đợi 5 phút giữa 2 lần nhỏ vào cùng một mắt làm mất thuốc do tràn ra khỏi mắt |
| Thuốc đạn | Không bỏ màng bọc viên thuốc xem như không dùng thuốc |
| Thuốc hít định liều | Thở ra không hết trước khi hít vào hoặc bấm nút để liều thuốc phun ra không đúng nhịp hít vào hoặc không nín thở mà thở ra ngay khi ngừng hít vào sẽ làm cho lượng thuốc tới phế quản, phế nang giảm, thậm chí không đủ liều để có tác dụng. |
| Bột khô để hít đựng trong nang cứng | Không dùng để hít qua đường hô hấp mà lại dùng để uống, thuốc sẽ không có tác dụng. |
| Miếng dán trên da | Không thay đổi vị trí dán thuốc sau mỗi liều hoặc cắt nhỏ miếng dán (hệ trị liệu qua da) làm mất tác dụng duy trì hấp thu kéo dài của hệ. |
| Tình trạng bệnh | Ảnh hưởng |
| Chứng khó nuốt (bệnh nhược cơ, người cao tuổi) | Khó khăn đưa thuốc đến nơi hấp thu |
| Co thắt thực quản (không có khả năng tháo rỗng thực quản) | Khó khăn đưa thuốc đến nơi hấp thu |
| Hen phế quản/khí phế thũng làm tăng cản trở đường khí thu | Khó khăn đưa thuốc bằng cách hít đến vị trí hấp thu |
| Dạ dày vô toan; pH dịch dạ dày > 6,5 | Giảm hấp thu atazanavir, digoxin, ketoconazol, calci, vitamin B12, sắt, vitamin C |
| Bệnh gan | Chậm tháo rỗng dạ dày, chậm hấp thu thuốc uống |
| Nôn | Mất thuốc dùng đường uống |
3.3.2.3. Tình trạng bệnh mắc kèm
Giữa các cơ thể khoẻ mạnh khác nhau đã có đáp ứng khác nhau đối với thuốc thì giữa các cơ thể bị bệnh, sự khác nhau càng rõ nét hơn. Khi cơ thể bị bệnh, nhiều chức năng bị tổn thương. Tình trạng bệnh có thể tác động lên quá trình hấp thu, phân bố, chuyển hoá và thải trừ thuốc, do ảnh hưởng đến tính thấm của màng hấp thu, tốc độ tháo rỗng dạ dày, thời gian di chuyển thuốc qua ruột non, mức độ liên kết thuốc protein huyết tương, chức năng chuyển hoá và thải trừ thuốc của gan và thận.
Người dược sĩ phải nhận thức được tình trạng bệnh để có thể góp phần đưa ra dự báo về đáp ứng của thuốc, lựa chọn dạng thuốc, điều chỉnh liều sử dụng thuốc cho thích hợp. Dưới đây là ví dụ về ảnh hưởng của tình trạng bệnh đến quá trình hấp thu thuốc trong cơ thể (bảng 1.11).
Bảng 1.11. Tình trạng bệnh ảnh hưởng đến quá trình hấp thu thuốc
| Tình trạng bệnh | Ảnh hưởng |
| Chứng khó nuốt (bệnh nhược cơ, người cao tuổi) | Khó khăn đưa thuốc đến nơi hấp thu |
| Co thắt thực quản (không có khả năng tháo rỗng thực quản) | Khó khăn đưa thuốc đến nơi hấp thu |
| Hen phế quản/khí phế thũng làm tăng cản trở đường khí thu | Khó khăn đưa thuốc bằng cách hít đến vị trí hấp thu |
| Dạ dày vô toan; pH dịch dạ dày > 6,5 | Giảm hấp thu atazanavir, digoxin, ketoconazol, calci, vitamin B12, sắt, vitamin C |
| Bệnh gan | Chậm tháo rỗng dạ dày, chậm hấp thu thuốc uống |
| Nôn | Mất thuốc dùng đường uống |
Trường hợp người bệnh có thể phải dùng đồng thời các thuốc khác nhau, rất có thể xảy ra tương tác thuốc, làm thay đổi sinh khả dụng của thuốc. Chẳng hạn, người bệnh đang uống một thuốc ức chế bơm proton nên pH của dịch dạ dày tăng lên, cũng trong thời gian này, nếu người bệnh lại được chỉ định dùng các thuốc có dược chất là base yếu như ketoconazol hoặc dipyrimidol thì sinh khả dụng của các dược chất này có thể bị giảm đáng kể, do pH ở dịch dạ dày tăng nên làm giảm khả năng hòa tan các dược chất này.
3.3.2.4. Dược di truyền học
Trong cơ thể người, các protein chịu trách nhiệm đối với việc vận chuyển và chuyển hoá thuốc nhạy cảm với biến dị di truyền (genetic variation), dẫn đến làm giảm vận chuyển thuốc và làm tăng hoặc làm giảm chuyển hóa thuốc.
Biến dị về chuyển hoá được chia ra các kiểu hình: Người chuyển hoá rất nhanh (ultrarapid metabolizers), người chuyển hoá rộng (extensive metabolizers) được xem là bình thường, người chuyển hoá trung bình (intermediate metabolizers) và người chuyên hoá chậm (poor metabolizers). Bảng 1.12 ghi dự đoán tác động của các kiểu hình gen người chuyển hoá trên chuyển hoá thuốc và tiêm thuốc.
Bảng 1.12. Dự đoán tác động của các kiểu hình gen lên chuyển hoá thuốc
| Kiểu hình người chuyển hóa | Tác động trên dược chất | Hiệu quả trên người bệnh | Tác động trên tiền dược chất | Hiệu quả trên người bệnh |
| Rất nhanh | Làm mất hoạt tính rất nhanh | Giảm hiệu quả điều trị | Hoạt hoá trả lại nhanh | Tăng hiệu quả dược chất rất điều trị/tăng tác dụng phụ |
| Rộng | Làm mất hoạt tính bình thường | Có hiệu quả điều trị mong đợi | Hoạt hoá trả lại dược chất bình | Có hiệu quả điều trị mong đợi thường |
| Trung bình | Làm mất hoạt tính chậm hơn bình thường | Tăng hiệu quả điều trị/tăng tác dụng phụ | Hoạt hoá trả lại dược chất chậm | Giảm hiệu quả điều trị |
| Chậm | Làm mất hoạt tính chậm | Tăng hiệu quả điều trị/tăng tác dụng phụ | Hoạt hoá trả lại dược chất rất chậm | Giảm hiệu quả điều trị |
Như vậy, biến dị di truyền về hoạt tính cảu cá protein vận chuyển hoặc chuyển hóa có thể gây ra sự khác nhau về lượng dược chất đến được đích tác dụng, dẫn tới đáp ứng điều trị ở người bệnh cũng khác.
Biến dị di truyền trong các protein vận chuyển hiện đã được nhận dạng, nó xuất hiện giữa các cá thể trong phạm VI một cộng đồng dân cư hoặc giữa các cộng đồng dân cư khác nhau.
Ví dụ, kết quả nghiên cứu dược động học của calci rosuvastatin trên cộng đồng bệnh nhân là người châu Á (Asian patients) cho thấy mức độ hấp thu cao hơn gấp hai lần so với bên cộng đồng bệnh nhân là người Da Trắng (Caucasian patients), do đo liều rosuvastatin cân điều chỉnh giảm đi đối với các bệnh nhân là người châu Á.
Với simvastatin khi dùng liều cao, kéo dài có thể gây đau, gây tổn thương cơ vân. Tác dụng không mong muốn này tăng lên ở các bệnh nhân là người Trung Quốc (Chinese patients) nên bệnh nhân là người Trung Quốc không nên dùng liều vượt quá 40 mg/ngày.
3.4. Đánh giá sinh khả dụng
Một sản phẩm thuốc mới (thuốc phát minh) có bản quyền, để được cấp phép lưu hành, nhà sản xuất dược phẩm phải cung cấp cho cơ quan quản lý dược, các bằng chứng chi tiết chứng tỏ rằng sản phẩm thuốc đó là an toàn và hiệu quả. Một trong số các bằng chứng đó là cơ sở dữ liệu về sinh khả dụng, mô tả tốc độ và mức độ dược chất được hấp thu từ sản phẩm thuốc.
Đánh giá sinh khả dụng cũng là yêu cầu phải thực hiện đối với các công thức mới (là công thức có thay đổi về tá dược) so với sản phẩm đã được cấp phép lưu hành, để đảm bảo rằng sự thay đổi về thành phần công thức sẽ không có ảnh hưởng đáng kể đến hiệu quả điều trị của thuốc trên người bệnh.
Sinh khả dụng được đánh giá theo từng bước của quá trình sinh dược học; Sinh khả dụng in vitro và sinh khả dụng in vivo.
3.4.1. Đánh giá sinh khả dụng in vitro
Đánh giá sinh khả dụng in vitro là thử nghiệm đánh giá khả năng giải phóng dược chất từ dạng thuốc, được thực hiện bằng thử nghiệm hòa tan (dissolution test) hoặc thử nghiệm giải phóng dược chất (drug release test), sử dụng các thiết bị thử được chuẩn hoá dựa trên mô phỏng sát thực nhất với điều kiện vivo của đường dùng thuốc. Ví dụ,thuốc uống được thử ở môi trường có nhiệt độ 37°C ± 0,5°C, biến thiên pH từ 1,2 đến 6,8 tương tự trong đường tiêu hoá, có enzym, có khuấy động giống như động của đường tiêu hoá…
Dược điển các nước đều có các chuyên luận chung quy định về các loại thiết bị thử, thông số kỹ thuật của thiết bị, điều kiện thử, phạm vi áp dụng cho từng dạng thuốc.
Theo Dược điển Mỹ 41, thử nghiệm hòa tan được thực hiện với tất cả các dạng thuốc để uống, đặt dưới lưỡi không là dung dịch (non-solution) mà sự hấp thu dược chất là cần thiết để có hiệu quả điều trị mong muốn. Có 4 loại thiết bị thử hoà tan: Thiết bị 1 (thiết bị giỏ quay — basket apparatus), thiết bị 2 (thiết bị cánh khuấy – paddle apparatus), thiết bị 3 (thiết bị bơm pittông – reciprocating cylinder), thiết bị 4 (thiết bị buồng dòng chảy -flow through cell); đây là những thiết bị thử nghiệm hòa tan áp dụng cho các dạng thuốc giải phóng ngay, cũng như các dạng thuốc giải phóng biến đổi. Đối với dạng thuốc giải phóng ngay, thử nghiệm hòa tan được thực hiện không quá 60 phút và hầu hết các trường hợp chỉ lấy mẫu tại một thời điểm (tùy chuyên luận cụ thể). Đối với dạng thuốc giải phóng kéo dài, tối thiểu được lấy mẫu tại ba thời điểm: 1-2 giờ đầu để kiểm tra thuốc có bị giải phóng ồ ạt không, thời điểm giữa và thời điểm cuối để đánh giá dược chất có được giải phóng hoàn toàn hay không. Có 3 loại thiết bị để thực hiện thử nghiệm giải phóng dược chất từ các dạng thuốc qua da: Thiết bị 5 (thiết bị cánh khuấy trên đĩa lưới – paddle over disk), thiết bị 6 (thiết bị trụ quay – cylinder stirring element) và thiết bị 7 (thiết bị đĩa pitton – reciprocating disk).
Dược điển Việt Nam V có quy định về thử nghiệm hòa tan của các dạng thuốc rắn phận liêu với 3 loại thiết bị là thiết bị kiểu giỏ quay (thiết bị 1), thiết bị kiểu cánh khuấy (thiết bị 2), thiết bị kiểu buồng dòng chảy (thiết bị 3) và thử nghiệm giải phóng dược chất của thuốc dán thấm qua da bằng thiết bị kiểu cánh khuấy trên đĩa lưới inox.
Song hành với các phương pháp và thiết bị thử nghiệm đánh giá sinh khả dụng in vitro đã được thừa nhận, được chuẩn hoá trong dược điển như đề cập ở trên. Hiện nay, các nhà bào chế vẫn tiếp tục nghiên cứu phát triển các phương pháp thử nghiệm mong muốn đưa ra được phương pháp thư phù hợp với dạng thuốc và đường dùng thuốc trong nghiên cứu sinh dược học bào chế.
Chi tiết về thiết bị, điều kiện thử, cách tiến hành thử nghiệm và các tiêu chí chấp nhận sẽ được đề cập chi tiết trong các chương về kỹ thuật bào chế các dạng thuốc tương ứng.
Ý nghĩa của thử nghiệm sinh khả dụng invitro:
-
- Mặc dù kết quả đánh giá sinh khả dụng in vitro được thực hiện theo điều kiện mô phỏng sinh học nhưng vẫn rất khác với điều kiện thực trên cơ thể sống. Vì thế, sinh khả dụng in vitro chưa phải là sinh khả dụng thực sự của thuốc thử nghiệm. Nhiều trong hợp dược chất được giải phóng nhanh từ dạng thuốc nhưng chưa chắc đã được hấp thu nhanh, do sự hấp thu còn phụ thuộc vào tính thấm của dược chất đối với màng hấp thu và nhiều yếu tố khác.
- Đánh giá sinh khả dụng in vitro là công cụ hữu ích giúp các nhà bào chế nghiên cứu xây dựng, sàng lọc, lựa chọn được công thức có mô hình giải phóng dược chất tối ưu theo dự định, để tiếp tục thử nghiệm sinh khả dụng ỉn Vì đánh giá sinh khả dụng in vivo đòi hỏi chi phí khá lớn, không thể làm nghiên cứu với nhiều công thức như thử nghiệm in vitro.
- Kết quả nghiên cứu đánh giá sinh khả dụng, cùng với kết quả đánh giá sinh khả dụng in vivo có thể được xem là điểm khởi đầu để phát triển, lựa chọn điều kiện thử nghiệm in vitro có ý nghĩa, phản ánh đúng nhất thể hiện in vivo của thuốc và hỗ trợ tiêu chuẩn hoá sản phẩm thuốc.
- Đánh giá sinh khả dụng in vitro là một trong những chỉ tiêu chất lượng mà sản phẩm thuốc đã được cấp phép lưu hành phải đạt, để đảm bảo chất lượng đồng nhất giữa các lô sản xuất, giữa các nhà sản xuất.
- Đánh giá sinh khả dụng in vitro được dùng thay thế cho sinh khả dụng in vivo khi đã chứng minh được có sự tương quan đồng biến giữa sinh khả dụng vitro và in vivo (in vitro – in vivo correlation). Nghĩa là khi có sự thay đổi về thành phần công thức hay quy trình sản xuất thì chỉ cần so sánh kết quả đánh giá sinh khả dụng in vitro là đủ.
3.4.2. Đánh giá sinh khả dụng in vivo
Đánh giá sinh khả dụng in vivo là thử nghiệm được thực hiện trên cơ thể sống.
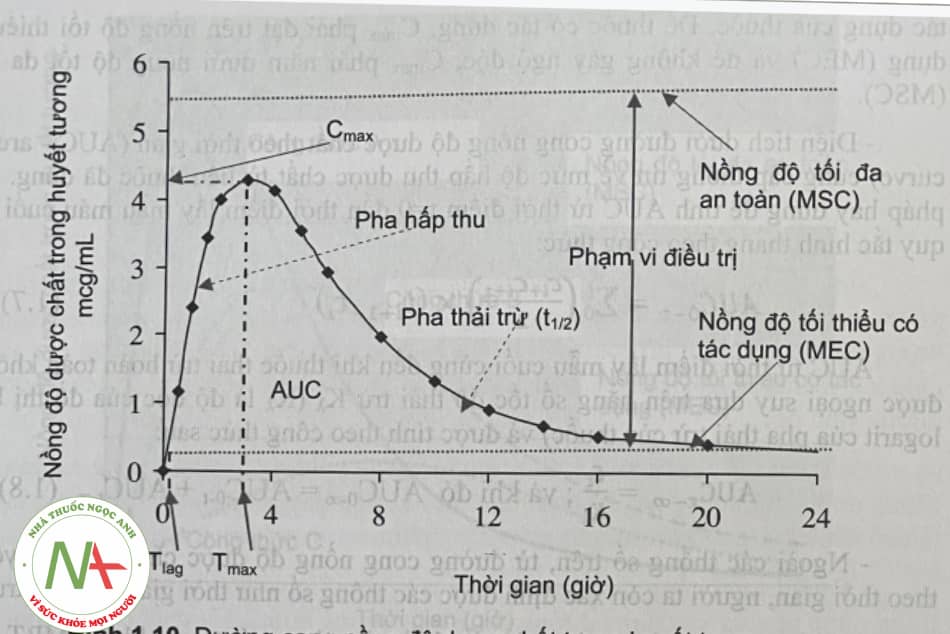
– Pha hấp thu: Ngay sau khi uống thuốc (t=0) nồng độ dược chất trong huyết tương bằng 0. Sau đó quá trình giải phóng và hấp thu dược chất diễn ra, nồng độ dược chất trong huyết tương tăng lên do tốc độ hấp thu dược chất vào tuần hoàn máu lúc này lớn hơn tốc độ dược chất đi ra khỏi tuần hoàn bởi quá trình phân bố và thải trừ. Nồng độ dược chất trong huyết tương tiếp tục tăng lên cho tới khi đạt nồng độ tối đa (Cmax).
– Pha thải trừ: Tại thời điểm đạt Cmax tốc độ xuất hiện của dược chất trong huyết tương bằng tốc độ dược chất được phân bố và thải trừ. Sau đó lượng dược chất sẵn có cho quá trình hấp thu sẽ giảm dần, nồng độ dược chất trong huyết tương sẽ giảm dần do quá trình phân bố và thải trừ dược chất vượt trội quá trình hấp thu, nồng độ dược chất trong huyết tương được kiểm soát bởi tốc độ thải trừ dược chất qua chuyển hoá và/hoặc do bài tiết. Từ đường cong nồng độ thuốc trong huyết tương theo thời gian (hình 1.10), sẽ xác định được các thông số có ý nghĩa quan trọng trong nghiên cứu sinh khả dụng invivo của thuốc, đó là:
– Thời gian tiềm tàng (Tg) là thời gian từ khi bắt đầu dùng thuốc đến khi đạt được nồng độ dược chất tối thiểu trong huyết tương có đáp ứng điều trị (minimum effectiveconcentration – MEC). Tg càng ngắn càng có ý nghĩa trong điều trị các bệnh cần thuốc có tác dụng nhanh như hạ sốt, giảm đau…
– Thời gian đạt nồng độ cực đại (Tmax) là thời gian từ khi bắt đầu dùng thuốc đến khi nồng độ dược chất trong huyết tương đạt giá trị cực đại. Tmax xác định bằng kết quả thực nghiệm. Tmax cung cấp thông tin về tốc độ hấp thu dược chất từ dạng thuốc Tmax càng ngăn tốc độ hấp thu dược chất càng nhanh.
– Nồng độ cực đại Cmax là nồng độ dược chất cao nhất đạt được trong huyết tương, Cmax được xác định bằng kết quả thực nghiệm. Cmax biểu thị tốc độ hấp thu và cường độ tác dụng của thuốc. Để thuốc có tác dụng, Cmax phải đạt trên nồng độ tối thiểu có tác dụng (MEC) và để không gây ngộ độc, Cmax phải nằm dưới nồng độ tối đa an toàn (MSC).
– Diện tích dưới đường cong nồng độ dược chất theo thời gian (AUC – area under curve) cung cấp thông tin về mức độ hấp thu dược chất từ liêu thuốc đã dùng. Phương pháp hay dùng để tính AUC từ thời điểm t=0 đến thời điểm lấy mẫu máu cuối cùng là quy tắc hình thang theo công thức 1.7:
AUC từ thời điểm lấy mẫu cuối cùng đến khi thuốc thải trừ hoàn toàn khỏi cơ thể được ngoại suy dựa trên hằng số tốc độ thải trừ Kλ. ( Kλ là độ dốc của đồ thị biến đổi logarit của pha thải trừ của thuốc) và được tính theo công thức 1.8:
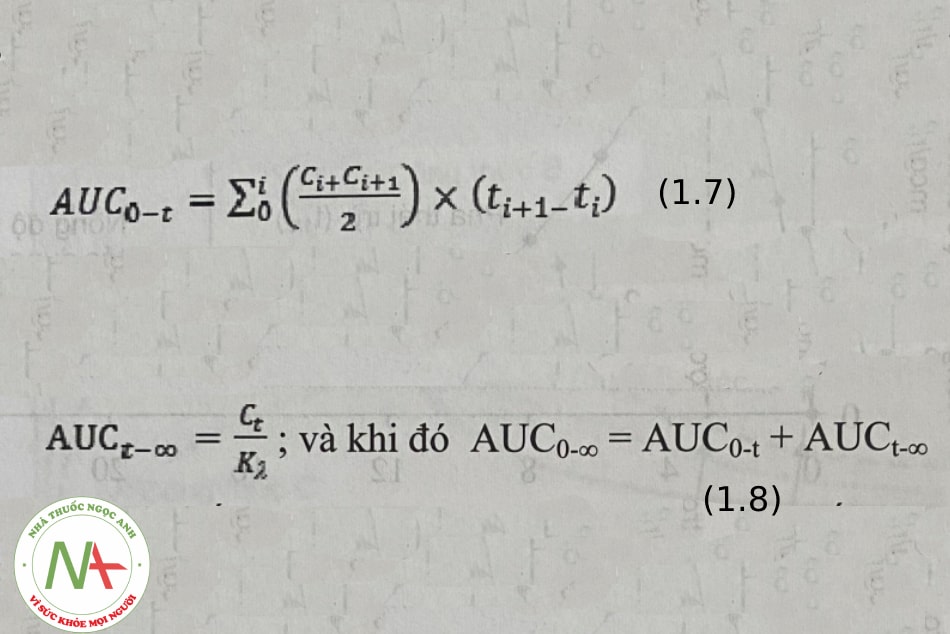
– Ngoài các thông số trên, từ đường cong nồng độ dược chất trong huyết tương theo thời gian, người ta còn xác định được các thông số như thời gian hấp thu trung bình(MAT – mean absorption time), thời gian lưu trú trung bình (MRT – mean residence time)…
– Phạm vi điều trị (therapeutic range) là khoảng nồng độ dược chất trong huyết tương có đáp ứng điều trị mong muốn mà không gây độc cho người bệnh. Nghĩa là khoảng nồng độ từ MEC đến MSC. Các công thức thuốc phải được thiết kế sao cho nồng độ dược chất đạt được trong huyết tương nằm trong phạm vi này.
Sự khác nhau giữa ba đường cong (hình 1.11) cho thấy ba công thức (có cùng hàm lượng dược chất, cùng đường dùng) nhưng có tốc độ và mức độ hấp thu dược chất từ môi cồng thức là khác nhau. Công thức A và công thức B có mức độ hấp thu tương tự nhau (AUC tương tự nhau), nhưng tốc độ hấp thu dược chất từ công thức A nhanh hơn từ công thức B, thể hiện ở Tmax ngắn hơn, Cmax cao hơn vượt cả MSC nên có xu hướng gây tác dụng độc. Công thức B hấp thu chậm hơn thể hiện ở Tmax dài hơn nhưng lại duy trì được nồng độ trong phạm vi điều trị dài hơn công thức A. Công thức C có mức độ hấp thu kém hơn (AUC nhỏ hơn công thức A và công thức B), tốc độ hấp thu cung chạm hơn thể hiện ở Tmax dài hơn so với công thức A và công thức B đồng thời Cmax đạt được thấp hơn MEC, có nghĩa là công thức c không tạo được đáp ứng điều trị. Với kết quả đánh giá sinh khả dụng invivo này, chỉ có công thức B được chọn.
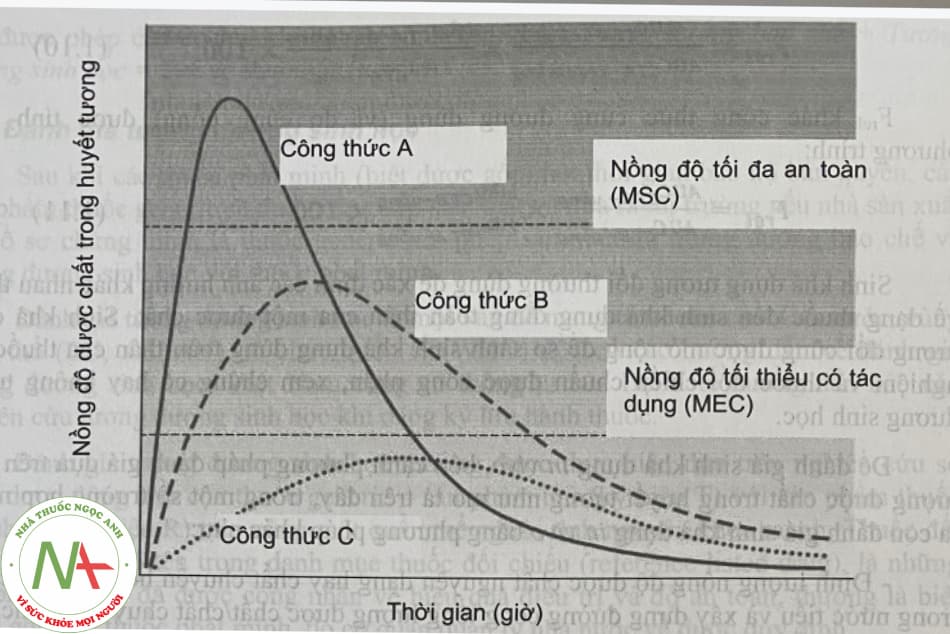
dược chất, cùng liều lượng, cùng đường dùng.
Sinh khả dụng tương đối thường dùng để xác định các ảnh hưởng khác nhau thuộc về dạng thuốc đến sinh khả dụng dùng toàn thân của một dược chất. Sinh khả dụng tương đối cũng được mở rộng để so sánh sinh khả dụng dùng toàn thân của thuốc thử nghiệm và thuốc đối chiếu chuẩn được công nhận, xem chúng có hay không tương đương sinh học.
Để đánh giá sinh khả dụng in vivo, bên cạnh phương pháp đánh giá dựa trên định lượng dược chất trong huyết tương như mô tả trên đây, trong một số trường hợp người ta còn đánh giá sinh khả dụng ỉn vivo bằng phương pháp khác như:
– Định lượng nồng độ dược chất nguyên dạng hay chất chuyển hoá của dược chất trong nước tiêu và xây dựng đường cong tổng lượng dược chất/chất chuyển hoá tích luỹ trong nước tiểu theo thời gian.
– Đánh giá sinh khả dụng invivo theo đáp ứng dược lý trên cơ thể người sau khi dùng thuốc, áp dụng với các thuốc có tác dụng dược lý đo lường được.
3.5. Tương đương sinh học
3.5.1. Một số khái niệm về tương đương
– Tương đương bào chế (Pharmaceutical equivalence): để chỉ các sản phẩm thuốc có cùng dược chất, cùng dạng thuốc, cùng hàm lượng, cùng đường dùng và các điều kiện sử dụng.
– Thế phẩm bào chế (Pharmaceutical alternatives): để chỉ những sản phẩm thuốc có chứa cùng một dược chất nhưng khác nhau về dạng hoá học (các muối, cac ester các ether, các đồng phân, hỗn hợp các đồng phân, các phức chất hoặc dẫn chất của cùng một chất…) hay khác nhau về hàm lượng hay dạng thuốc.
– Tương đương sinh học (Bioequivalcmce): để chi các sản phẩm thuốc có cùng dược chất, cùng đường dùng, cùng liều lượng, trong cùng điều kiện thử nghiệm mà có tốc độ và mức độ hấp thu dược chất về căn bản tương tự nhau.
– Tương đương điều trị (Therapeutic equivalance): để chỉ các sản phẩm thuốc tương đương bào chế hay các thế phẩm bào chế khi sử dụng trên bệnh nhân, ở cùng một mức liêu, theo cùng một đường dùng sẽ đạt được cùng hiệu quả điều trị, xét cả về hiệu lực và tính an toàn của thuốc.
Với một số sản phẩm thuốc generic vừa tương đương bào chế, vừa tương đương sinh học, dường như là tương đương điều trị và có thể dùng thay thế thuốc gốc trong điều trị khi được phép của cơ quan quản lý. Nói cách khác: Tương đương bào chế + Tương đương sinh học = Tương đương điều trị.
3.5.2. Đánh giá tương đương sinh học
Sau khi các thuốc phát minh (biệt dược gốc) hết thời gian bảo hộ bản quyền, các sản phẩm thuốc generic sẽ được cấp phép sản xuất và đưa ra thị trường nêu nhà sản xuất có hồ sơ chứng minh là thuốc generic xin phép sản xuất đó tương đương bào chế và tương đương sinh học với thuốc phát minh.
Đánh giá tương đương sinh học là một vấn đề mang tính toàn cầu. Các nước, vùng lãnh thổ (EU, ASEAN), tổ chức quốc tế (WHO) đều có các hướng dẫn về đánh giá tương đương sinh học. Việt Nam cũng có thông tư của Bộ Y tế hướng dẫn báo cáo nghiên cứu tương đương sinh học khi đăng ký lưu hành thuốc.
Đánh giá tương đương sinh học thường được thực hiện dựa trên nghiên cứu so sánh dược động học của thuốc generic – sản phẩm thử (ký hiệu T) với sản phẩm thuốc đối chiếu (ký hiệu R) trên cùng một quần thể người tình nguyện khoẻ mạnh. Thuốc đối chiếu là thuốc có tên trong danh mục thuốc đối chiếu (reference listed drug), là những sản phẩm thuốc đã được công nhận về hiệu quả điều trị và độ an toàn, thường là biệt dược gốc hay thuốc phát minh, do cơ quan quản lý nhà nước về dược quy định.
Đánh giá tương đương sinh học là yêu cầu được áp dụng với các sản phẩm thuốc mà hiệu quả điều trị tại nơi tác dụng khác với nơi hấp thu như: viên nén, viên nang, hỗn dịch để uống, thuốc qua da, qua đường hô hấp hay qua trực tràng. Các dung dịch uống nói chung không yêu cầu đánh giá tương đương sinh học vì quá trình diễn tiến in vivo được xem là không khác nhau giữa các sản phẩm.
Theo Dược điển Mỹ 41, thiết kế đánh giá tương đương sinh học thường là thử nghiệm hai giai đoạn, hai thứ tự, liều đơn, chéo ngẫu nhiên, trên cùng 18 đến 3 6 đối tượng thử, trong đó số đối tượng được xử lý thống kê phải không dưới 12.Trong thời gian thử nghiệm, lấy các mẫu máu tại những khoảng thời gian đủ để xác định Cmax, AUC và các thông số khác. Các mẫu máu/huyết tương/huyết thanh sẽ được phân tích bằng các phương pháp phân tích sinh học thích hợp đã được thẩm định đạt các yêu cầu quy định hiện hành.
Đối với dạng thuốc giải phóng ngày thử tương đương sinh học với liều đơn, mức liều cao nhất, thử chéo (với các thuốc có ti/2 dài có thể thử song song), ở trạng thái đói. Nghiên cứu ảnh hưởng của thức ăn được yêu cầu nếu có thông tin là thức ăn dùng đồng thời có thể làm tăng hay giảm sinh khả dụng của thuốc.
Đối với dạng thuốc giải phóng kéo dài tiến hành thử nghiệm đơn liều, thử chéo cả ở trạng thái đói và trạng thái no, với liều cao nhất. Trong một số trường hợp có thể thử nghiệm với mô hình đa tiêu, đánh giá ở trạng thái cân bằng (steady State).
Kết quả thực nghiệm được tính toán, xử lý thống kê. Thuốc thử T được xem là tương đương sinh học với thuốc đối chiếu R nếu các thông số đặc trưng cho sinh khả dụng (Qmax, AUC) của thuốc thử và thuốc đối chiếu nằm trong khoảng từ 80% đến 125% với độ tin cậy 90%.
Với các dạng thuốc uống mà chủ đích gây tác dụng tại chỗ, không phải để gây tác dụng toàn thân, sự hấp thu dược chất từ đường tiêu hoá vào tuần hoàn máu là tối thiểu; với những trường hợp này, không thực hiện đánh giá tương đương sinh học mà yêu cầu thử nghiệm lâm sàng so sánh và/hoặc kết hợp với thử nghiệm giải phóng in vitro đề so sánh sự giải phóng thuốc với sản phẩm đối chiếu.
Chi tiết về các dạng thuốc, các dược chất phải có báo cáo nghiên cứu tương đương sinh học hoặc được miễn trong hồ sơ xin đăng ký thuốc tại Việt Nam, người học có thể tham khảo thêm trong thông tư hiện hành của Bộ Y tế.
