Probiotic trong Viêm da cơ địa dị ứng – Cập nhật PDF tại đây.
Tác giả: Pratik Kakade, Sarika Wairkar, Shruti Lohakare, Purav Shah, Vandana Patravale
Dịch: Bs. Trương Tấn Minh Vũ
Tóm tắt
Viêm da cơ địa dị ứng (Atopic dermatitis, AD) là một rối loạn viêm mãn tính liên quan đến tình trạng da khô, có vảy và cực kỳ ngứa, có sinh lý bệnh phức tạp. Chủ yếu các phương pháp điều trị triệu chứng được dùng trong AD như kem dưỡng ẩm, kháng histamin, steroid bôi tại chỗ, v.v. Mặc dù sinh lý bệnh chính xác của AD chưa rõ, nhưng cùng với các yếu tố di truyền, rối loạn chức năng biểu bì và bất thường hệ thống miễn dịch, hệ vi sinh vật trong trục ruột- da cũng góp phần vào sự tiến triển của AD. Sự thay đổi hệ vi khuẩn đường ruột dẫn đến rối loạn sinh học, sự mất cân bằng trong hệ vi sinh vật tự nhiên gây ra nhiều vấn đề sức khỏe bao gồm AD. Probiotics là các vi sinh vật sống hỗ trợ hệ vi sinh vật đường ruột và đem lại một số lợi ích sức khỏe khi được sử dụng. Tuy nhiên, khả năng tồn tại và tính ổn định của probiotics là những mối quan tâm chính để sử dụng chúng hiệu quả. Probiotics có sẵn ở nhiều dạng bào chế khác nhau như viên nén, viên nang, gói, dung dịch, v.v. Ngoài ra, chúng cũng được kết hợp vào hệ thống phân phối có kiểm soát bằng cách sử dụng kỹ thuật bao vi nang và đông khô không chỉ cung cấp lượng probiotics cần thiết tại vị trí được nhắm mục tiêu mà còn cải thiện đáng kể tính bền vững của chúng. Hiện tại, một số thử nghiệm lâm sàng đang được tiến hành đối với các chủng probiotics khác nhau và mức độ liên quan của chúng với hệ vi sinh vật. Trong tương lai, các liều lượng và dạng bào chế mới có thể được khám phá để sử dụng hiệu quả các probiotics trong điều trị AD.
Giới thiệu
Vi sinh vật ở ruột
Ruột của con người có vai trò là giao diện lớn nhất giữa môi trường bên ngoài và các mô niêm mạc. Đặc biệt, ruột già chứa nhiều vi sinh vật cho thấy tính chất phức tạp của hệ sinh thái (Witte 2000). Do các điều kiện khác nhau đáng kể trong đường tiêu hóa (gastrointestinal, GI), sự phong phú của vi khuẩn là khác nhau ở các phần khác nhau. Ở ruột non (hỗng tràng và hồi tràng) là 104–108 CFU/ mL, và lên đến 1014 CFU/mL ở ruột già. Tổng số vi sinh vật cư trú trong cơ thể người nhiều gấp mười lần so với tế bào của con người (Bäckhed et al. 2005). Các nghiên cứu gần đây thực hiện trên hệ vi sinh vật đường ruột đã chỉ ra rằng có khoảng 2172 loài vi khuẩn khác nhau được chia thành 12 phyla khác nhau và hơn 7000 chủng khác nhau (Thứ Năm và Juge 2017). Hầu hết các chi kỵ khí phổ biến được tìm thấy trong ruột là Bacteroides, Bifidobacterium, Eubacterium, Fusobacterium, Clostridium, Lactobacillus, v.v … Khoảng 386 loài vi khuẩn có bản chất là kỵ khí nghiêm ngặt. Nhiều vi khuẩn hiếu khí cũng hiện diện phong phú như trực khuẩn đường ruột Gram âm (E. coli, Salmonella sp.), và cầu khuẩn Gram dương (Enterococcus, Staphylococcus, Streptococcus, v.v.). Ngoài ra, một số chủng nấm cũng được tìm thấy (Candida sp.). Thành phần vi khuẩn trong ruột ở trẻ sơ sinh và trẻ em đơn giản hơn nhiều, và độ phức tạp của nó tăng lên khi tuổi của từng cá thể tăng lên. Nó vẫn ổn định trong hầu hết tuổi trưởng thành. Phương pháp sinh con cũng đóng một vai trò quan trọng trong sự phát triển của hệ vi sinh đường ruột vì trẻ sinh qua ngả âm đạo cho thấy nồng độ lactobacilli cao hơn trong giai đoạn đầu của sự phát triển, trong khi trẻ sinh mổ cho thấy sự phong phú của các loài Clostridium (Thursby và Juge 2017).
Chức năng của vi sinh vật ở ruột
Mối quan hệ giữa vật chủ con người và vi sinh vật, mặc dù tương hỗ, thường được giải thích là mối quan hệ hội sinh. Hệ vi sinh đường ruột giúp điều hòa nhiều chức năng dẫn đến sức khỏe tốt hơn. Nó đóng vai trò quan trọng đối với nhiều chức năng sinh lý như:
(a) Phát triển đường ruột và cân bằng nội môi.
(b) Bảo vệ chống lại các yếu tố gây bệnh.
(c) Chuyển hóa các thành phần có hại khác nhau (tinh bột không kiêng, axit mật liên hợp).
(d) Sự phân huỷ các phức chất gốc oxalat.
(e) Tổng hợp các loại vitamin như vitamin B12, B6, B5, B9, B1, B2, K.
(f) Tác động lên niêm mạc ruột như kích thích tổng hợp vi nhung mao.
(g) Sự trưởng thành của miễn dịch bẩm sinh và miễn dịch thu được.
(h) Thu hoạch năng lượng.
Nhiều nghiên cứu đã chỉ ra tầm quan trọng của các chủng vi khuẩn khác nhau đối với sức khỏe làn da. Bảng 9.1 mô tả một số vi khuẩn đường ruột quan trọng đóng vai trò quan trọng trong sinh lý bệnh của các rối loạn da.
Bảng 9.1 Các chủng vi khuẩn để duy trì sức khỏe làn da (Thursby và Juge 2017)
| Chủng vi khuẩn | Chức năng | |
| Bifidobacterium sp. | Sản xuất folate và tổng hợp vitamin | |
| Lactobacilli sp. | Sản xuất vitamin B12, hỗ trợ tiêu hóa sữa, sản phẩm của axit lactic | |
| L. rhamnosus | Thúc đẩy đổi mới tế bào và hỗ trợ quá trình lành thương | |
| Akkermansia muciniphila | Duy trì sự toàn vẹn của biểu mô | |
| L. plantarum | Duy trì tính toàn vẹn của hàng rào biểu mô | |
| B. fragilis | Phát triển hệ thống miễn dịch thông qua việc giảm số tế bào T CD4 + | |
| F. prausnitzii | Kích hoạt con đường NF-kB, giảm phản ứng tiền viêm | |
Rối loạn sinh học đường ruột
Rối loạn sinh học đường ruột nói đến sự mất cân bằng trong thành phần của hệ vi sinh vật và sự xáo trộn trong trạng thái tồn tại cân bằng của chúng, có thể biểu hiện thành các tình trạng bệnh. Có nhiều lý do làm thay đổi hệ vi sinh tạm thời hoặc trong một số trường hợp không thể phục hồi được, bao gồm:
(a) Thay đổi chế độ ăn uống.
(b) Thay đổi điều kiện môi trường.
(c) Điều trị bằng thuốc kháng sinh kéo dài.
(d) Phẫu thuật.
(e) Hút thuốc.
(f) Điều chỉnh hệ thống miễn dịch bởi các yếu tố bên ngoài (điều trị bằng thuốc ức chế miễn dịch).
(g) Đột biến gen …
Điều thú vị là có mối liên hệ giữa rối loạn sinh học đường ruột và viêm da cơ địa dị ứng (AD). Fujimura và cộng sự thấy rằng những bệnh nhân bị AD có sự phong phú của các loài nấm Candida và Rhodotorula cao hơn và sự phong phú tương đối thấp hơn của các loài vi khuẩn như Bifidobacterium, Akkermansia và Faecalibacterium. Trong nghiên cứu này, bệnh nhân được chọn trong độ tuổi từ 1-11 tháng. Trẻ em cơ địa dị ứng cho thấy mức độ các loài Clostridium tăng lên và mức độ Bifidobacterium giảm. Penders đã thực hiện nghiên cứu đoàn hệ sinh KOALA, trong đó họ kết luận rằng trẻ mắc bệnh AD có sự xâm chiếm của E. coli và C. difficile cao hơn. Hệ vi sinh đường ruột đóng một vai trò quan trọng trong việc biến đổi các tế bào T chưa trưởng thành thành các loại tế bào T chuyên biệt khác nhau như tế bào Th1, Th2, Th17 và Treg. Tế bào Treg ngăn cản sự biệt hóa của các tế bào T chưa trưởng thành thành các tế bào Th khác. Nó ngăn chặn phản ứng miễn dịch bằng cách điều chỉnh giảm bạch cầu ái toan và tế bào mast và cũng làm giảm sản xuất IgE (Akdis 2006). Các vi khuẩn như Bifidobacterium, Lactobacillus, Streptococcus, Clostridium và Bacteroides có các sản phẩm trao đổi chất là axit propionic và axit butyric, đóng vai trò kích hoạt để điều chỉnh sản xuất tế bào Treg (Furusawa và cộng sự 2013; Round và Mazmanian 2010), trong khi Cutibacterium có liên quan sự hình thành các dẫn xuất propionat và axetat của các axit béo chuỗi ngắn (SCFA), chịu trách nhiệm kiểm soát và ngăn chặn sự phát triển của S. aureus kháng methicillin (MRSA) thường thấy trong các tổn thương dị ứng nhiễm trùng (Schwarz và cộng sự 2017). Song và cộng sự cũng báo cáo sự rối loạn sinh học chủng
F. prausnitzii trong mẫu phân của bệnh nhân AD, đóng vai trò quan trọng trong việc sản xuất SCFA (dẫn xuất butyrate). Nghiên cứu này về rối loạn sinh học của các chủng vi khuẩn khác nhau tiếp tục ủng hộ việc sử dụng probiotics trong điều trị AD.
Viêm da cơ địa dị ứng (Atopic Dermatitis, AD)
Từ “atopy” có nguồn gốc từ từ atopia trong tiếng Hy Lạp, có nghĩa là “different” hoặc “out of place”. AD thường được định nghĩa là một bệnh da mãn tính, ngứa, viêm, đặc trưng bởi da khô, có vảy và ban đỏ. Đây là bệnh viêm da mãn tính phổ biến nhất với sinh lý bệnh đa dạng (Kalamaha et al. 2019). AD được coi là nhóm nhỏ của bệnh chàm (eczema) và là dạng bệnh chàm nặng hơn. AD được thêm vào nhóm các rối loạn dị ứng vào năm 1933 trên sự liên quan của dạng chàm này cùng với bệnh hen suyễn và viêm mũi dị ứng cũng như dị ứng với thức ăn (Spergel và paller 2003). Bệnh cơ địa dị ứng đề cập đến một loạt các bệnh do dị ứng như AD, hen suyễn, viêm mũi và dị ứng thực phẩm. Bệnh cơ địa dị ứng phát triển do các yếu tố cơ bản khác nhau như rối loạn chức năng hệ thống miễn dịch và đột biến gen. AD đánh dấu sự khởi đầu của cơ địa dị ứng,thường biểu hiện lâm sàng ở lứa tuổi đầu đời (6 tháng đến 1 tuổi). Tùy thuộc vào sự khởi phát của AD, nó thường được phân loại thành ba loại khác nhau như AD ở trẻ sơ sinh, giai đoạn thơ ấu và giai đoạn trưởng thành (Spergel và paller 2003).
(a) AD ở trẻ sơ sinh: Dấu hiệu bắt đầu trong vòng 2 tuổi. Các sẩn ban đỏ và mụn nước thường bắt đầu trên má, trán hoặc da đầu và rất ngứa. Tổn thương có thể vẫn khu trú ở mặt hoặc có thể kéo dài đến thân mình hoặc đặc biệt là các mặt duỗi của tứ chi, thành các mảng rải rác, không rõ ràng, thường đối xứng.
(b) Giai đoạn thơ ấu: có thể thấy từ 2 tuổi đến tuổi dậy thì. Biểu hiện nhiều sẩn và mảng da dày cho thấy bệnh mãn tính hơn. Các vùng liên quan thường gặp ở trẻ em là bàn tay, bàn chân, cổ tay, mắt cá chân, khuỷu tay trước và vùng hố đầu gối.
(c) Giai đoạn trưởng thành: Được phát hiện từ tuổi dậy thì đến suốt tuổi trưởng thành. Các khu vực dễ bị ảnh hưởng bao gồm các nếp gấp, mặt và cổ, cánh tay trên và lưng, và lưng của bàn tay, bàn chân, ngón tay và ngón chân.
Dịch tễ học của AD
Tỷ lệ mắc AD ở các lứa tuổi và châu lục khác nhau tùy thuộc vào các yếu tố khác nhau như lối sống, yếu tố môi trường, các biến dị di truyền liên lục địa, v.v … Thông thường, tỷ lệ mắc AD thường thấy ở trẻ em mặc dù có sự xuất hiện đáng kể ở tuổi trưởng thành. AD ảnh hưởng đến ~ 20% trẻ em trong thời kỳ sơ sinh và thời thơ ấu, 60% trong số đó cho thấy sự hồi phục hoàn toàn sau những triệu chứng đó ở tuổi dậy thì (Takizawa và cộng sự 2018).
Nghiên cứu quốc tế về bệnh hen suyễn và dị ứng ở trẻ em (ISAAC) đã thực hiện tổng cộng ba cuộc khảo sát dựa trên bảng câu hỏi trong các khoảng thời gian định kỳ. Cuộc khảo sát đầu tiên được thực hiện từ năm 1994 đến 1996 gồm 256.410 trẻ em từ 6–7 tuổi tại 90 thành phố và 458.623 trẻ em từ 13–14 tuổi tại 153 thành phố của 53 quốc gia. Tỷ lệ phổ biến trung bình trên toàn cầu của các triệu chứng bệnh chàm là 7,3% và 7,4% tương ứng ở lứa tuổi 6–7 và 13–14 tuổi, trong đó có một loạt các biến thể được quan sát thấy ở các châu lục cũng như các quốc gia (Williams và cộng sự 1999). Nghiên cứu ISAAC giai đoạn II được thiết kế để tập trung vào sự phổ biến của các yếu tố khác nhau góp phần vào AD. Nó đã giúp thiết lập các dấu hiệu bệnh với các thay đổi di truyền và môi trường (Weiland et al. 2004). ISAAC giai đoạn III được thực hiện từ năm 2001 đến năm 2003 và bao phủ 60 quốc gia. Tỷ lệ hiện mắc chung toàn cầu lần lượt là 6,1% và 8,8% ở lứa tuổi 6–7 và 13–14 tuổi. Tỷ lệ hiện mắc thấp nhất là 2,7% ở Ấn Độ và cao nhất là 22,5% ở Ecuador (Odhiambo et al. 2009).
Trong một cuộc khảo sát được thực hiện bởi Barbarot và cộng sự vào năm 2018 giữa những người tham gia theo khu vực, tỷ lệ mắc AD ở người lớn trong dân số nói chung/được điều trị là 4,9% / 3,9% ở Hoa Kỳ, 3,5% / 2,6% ở Canada, 4,4% / 3,5% ở châu Âu và 2,1% / 1,5 % Ở Nhật. Tỷ lệ hiện mắc ở nam thấp hơn so với nữ và cũng cho thấy ở các nhóm tuổi cao hơn cũng thấp hơn. Nghiên cứu này được thực hiện bằng phương pháp khảo sát trực tuyến với ý nghĩa thống kê khoảng tin cậy 95%.
Nguyên nhân của AD
Nguyên nhân chính xác của AD vẫn chưa được biết rõ, và nhiều nghiên cứu đã được thực hiện để xác định các yếu tố gây bệnh của nó. Nhiều nhà khoa học đã theo dõi các nguyên nhân gây đột biến gen, rối loạn chức năng miễn dịch, cũng như các bất thường về hàng rào biểu bì. Các yếu tố môi trường khác nhau dẫn đến sự phát triển của AD hoặc các biến chứng trong AD. Những yếu tố này là chất gây kích ứng hóa học (chất tẩy rửa, xà phòng, dầu gội đầu, v.v.), chất gây dị ứng (bụi, hạt phấn, lông vật nuôi, nấm mốc và ve), sự dao động nhiệt độ đột ngột và thay đổi nội tiết tố.
Các triệu chứng của AD
AD là một loại bệnh chàm nặng, có tính chất mãn tính và có thể xấu đi theo thời gian. Nó thường xảy ra trên mặt, cổ và vùng má nhưng cũng có thể ảnh hưởng đến các bộ phận khác của cơ thể. AD có các biểu hiện lâm sàng khác nhau khiến cho việc chẩn đoán trở nên rất quan trọng. Các triệu chứng thường gặp bao gồm da khô / có vảy; đỏ; ngứa; vết nứt sau tai; phát ban trên má, cánh tay và/hoặc chân; vết loét hở, đóng vảy hoặc “chảy nước ” (thường là khi bùng phát); dày da; và mụn nước đầy mủ (trong trường hợp nhiễm trùng) (Berke và cộng sự 2012). Tuỳ theo loại AD mà các triệu chứng khác nhau như được trình bày trong Bảng 9.2 và Hình 9.1.
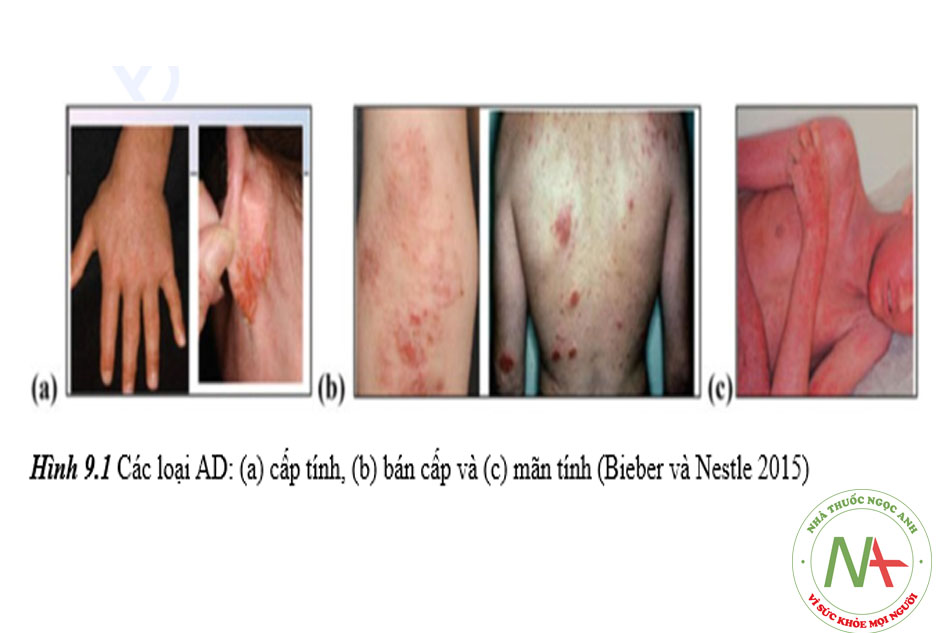
Bảng 9.2 Các triệu chứng liên quan đến các loại AD khác nhau
| Loại AD | Triệu chứng |
| AD cấp tính | Mụn nước, rỉ dịch, đóng vảy trên da |
| AD bán cấp | Sẩn khô, có vảy, ban đỏ và mảng |
| AD mãn tính | Lichen hoá do gãi nhiều
|
Chẩn đoán AD
Do sự giống nhau giữa chàm và AD nên rất khó chẩn đoán AD. Các tiêu chí đơn giản hóa bao gồm ngứa da với ít nhất ba đặc điểm sau, tiền sử bệnh hen suyễn hoặc viêm mũi dị ứng, tiền sử liên quan đến vùng gấp, tiền sử da khô toàn thân, bắt đầu phát ban trước 2 tuổi và viêm da vùng gấp có thể nhìn thấy (Berke et al. . 2012). Có nhiều phương pháp khác nhau thường được sử dụng để xác định mức độ nghiêm trọng của AD. Một số trong số những biện pháp thường được sử dụng được đề cập dưới đây.
Tiêu chuẩn Hanifin-Rajka của AD
Tiêu chuẩn Hanifin-Rajka thường được sử dụng để chẩn đoán AD và cần xuất hiện ít nhất ba triệu chứng chính, thường xảy ra như dày da, khởi phát ban đầu là ngứa, viêm da tái phát, tiền sử gia đình rối loạn dị ứng, v.v … Cùng với đó, bệnh nhân cũng nên cho thấy ít nhất ba trong số các triệu chứng phụ như da khô, phản ứng test da ichthyoids/palmar hyperlinearity/keratosis pilaris immediate (type I), tăng nồng độ IgE trong huyết thanh, nhạy cảm với nhiễm trùng, rối loạn chức năng miễn dịch qua trung gian tế bào, xu hướng viêm da tay hoặc chân không đặc hiệu, viêm kết mạc tái phát, chàm núm vú, viêm môi, nếp gấp dưới ổ mắt Dennie-Morgan, khuôn mặt xanh xao, vảy trắng, dày sừng, đục thủy tinh thể dưới bao trước, thâm quầng mắt, ngứa nếp gấp cổ khi đổ mồ hôi, không dung nạp len cũng như dung môi lipid, v.v. (Larsen và Hanifin 2002).
Chỉ số SCORAD
Phép tính đo diện tích bề mặt cơ thể trên cơ sở cường độ của AD, các triệu chứng ngứa, khó ngủ ở bệnh nhân, v.v … thường được xếp trong khoảng từ 0–103 đối với mức độ bệnh. Quy tắc số chín được sử dụng để tính toán chỉ số này trong đó các khu vực bị ảnh hưởng được xem xét dựa trên các cách nêu dưới đây (Henry và Li 2016):
• Đầu và cổ — 9%.
• Chi trên – 9% mỗi bên.
• Chi dưới — 18% mỗi bên.
• Thân trước — 18%.
• Sau — 18%.
• Bộ phận sinh dục — 1%.
Chỉ số cường độ và mức độ nghiêm trọng
Trong phương pháp này, vùng bị ảnh hưởng bởi AD được lấy làm đại diện và được phân loại trong phạm vi thang điểm từ 0–3, trong đó 0 là không, 1 nhẹ, 2 trung bình và 3 nghiêm trọng. Ngoài ra, các yếu tố như mẩn đỏ, mụn nước đóng vảy và chảy dịch, vết gãi, da dày và khô cũng được xem xét (Henry và Li 2016).
Chỉ số Chất lượng Cuộc sống Da liễu (DQLI)
Hệ thống này thường bao gồm một bảng câu hỏi bao gồm tất cả các khía cạnh của sức khỏe làn da từ ngứa và đau cho đến lựa chọn trang phục cũng như thói quen ăn uống. Nó thường được đánh giá trong khoảng 0–30 (Henry và Li 2016).
Sinh lý bệnh của AD
Tập trung vào sinh lý bệnh của AD, cơ chế chính xác vẫn chưa được hiểu rõ hoàn toàn. Nhiều nghiên cứu đã được thực hiện cho để chứng minh rằng sự phức tạp của việc điều chỉnh hàng rào da cũng như rối loạn chức năng hệ thống miễn dịch góp phần vào phần lớn sự tiến triển của AD. Lớp biểu bì tạo thành hàng rào chức năng và vật lý của da, và những bất thường trong hàng rào này là dấu hiệu bệnh lý chính trong trường hợp AD. Sự phá vỡ lớp biểu bì dẫn đến sự tiếp xúc của tế bào miễn dịch ở da với các kháng nguyên bên ngoài, gây ra các phản ứng viêm dựa trên hệ miễn dịch. Các protein khác nhau như keratin, transglutaminase, filaggrin và protein nội bào đóng vai trò quan trọng trong hoạt động bình thường của biểu bì. Khi thảo luận về sinh lý bệnh của AD, cần xem xét các khía cạnh khác nhau của bệnh như biến thể di truyền, biến thể miễn dịch, cơ chế bệnh lý thần kinh, rối loạn chức năng biểu bì, thay đổi thành phần lipid và những thay đổi liên quan đến hệ vi sinh vật của môi trường da (Kim và cộng sự 2019a, b).
Các biến thể di truyền
Lớp sừng (SC) tạo thành tuyến bảo vệ đầu tiên trong cấu trúc da như một phần ngoài cùng của biểu bì. Protein filaggrin (FLG) chủ yếu hiện diện trong SC và đóng một vai trò quan trọng trong việc duy trì các đặc tính hàng rào của nó trong liên kết với protein keratin bằng cách hình thành các bó tế bào sừng và các sợi nhỏ. Nó cũng tham gia vào việc giải phóng yếu tố giữ ẩm tự nhiên (NMF), yếu tố này chịu trách nhiệm cho quá trình hydrat hóa da và giữ nước cho biểu bì. Gen chịu trách nhiệm cho biểu hiện của protein FLG có trên nhiễm sắc thể 1q21 mã hóa để sản xuất profilaggrin, tiếp tục được chuyển đổi thành các monomer hoạt động của nó bằng cách phân cắt protein (các protease serine bao gồm serine protease/Prss kích hoạt kênh và matriptase/ matriptase) và dẫn đến quá trình khử phospho. Sự suy thoái chuyển hóa của protein FLG làm tăng axit uronic và axit pyrrolidine carboxylic và giúp duy trì độ pH của da. Sự đơn bội FLG (kiểu hình trội ở các sinh vật lưỡng bội là dị hợp tử về alen mất chức năng) tiếp tục góp phần vào AD ở các khía cạnh khác như ảnh hưởng đến sự biểu hiện cytokinin tiền viêm của pH da, sự phát triển của S. aureus, v.v. Hai đột biến mất chức năng FLG (R501X và 2282del4) được phát hiện cho đến nay cho thấy một kiểu di truyền bán nguyên tử của đột biến null với sự thâm nhập không hoàn toàn. Số lượng đột biến FLG được xác định trong các quần thể châu Âu là 20, trong đó 6 đột biến phổ biến và 14 đột biến tần số thấp. Ở các quần thể châu Á, thêm 17 dạng đột biến, trong đó 8 dạng phổ biến và 9 dạng có tần suất thấp, đã được xác định. Khoảng 10% dân số châu Âu là người mang đột biến FLG dị hợp tử, cho thấy lượng protein biểu hiện giảm 50%. Tỷ lệ mắc các đột biến gen này không phổ biến ở bệnh nhân châu Á và Hàn Quốc so với các nước phương Tây khác (Kaufman và cộng sự 2018; O’Regan và cộng sự 2008).
Ngoài ra, sự thiếu hụt corneodesmosome, corneodesmosin, và desmoglein 1 góp phần vào cơ chế bệnh sinh của AD. Sự kết dính tế bào đóng một vai trò quan trọng trong việc duy trì tính toàn vẹn của hàng rào da thông qua việc hình thành các điểm nối chặt chẽ, chủ yếu tạo thành tuyến bảo vệ thứ hai hoặc bên trong của hàng rào biểu bì. Chủ yếu có hai loại protein, cụ thể là desmoglein 1 (DSG) và Cornodesmosin (CDSN), hiện diện trong da. Desmosomes đóng vai trò như một vật liệu / keo kết dính cho bộ xương tế bào sừng và giúp duy trì rào cản đối với stress cơ học. Đột biến mất chức năng của gen mã hóa các protein này dẫn đến rối loạn chức năng hàng rào biểu bì và do đó dẫn đến AD cùng với các yếu tố khác. Mất hoàn toàn biểu hiện CDSN dẫn đến hội chứng tróc da loại B, liên quan đến chứng ngứa nghiêm trọng và teo da. Đột biến DSG-I dẫn đến viêm da nghiêm trọng, đa dị ứng và hội chứng suy giảm chuyển hóa (SAM) với nồng độ IgE tăng cao, gây ra các phản ứng miễn dịch dị ứng (Samuelov và Sprecher 2014).
Sự polyme hoá hoặc những thay đổi được thấy trong một số nhóm gen liên quan đến hệ thống miễn dịch thường dẫn đến tăng nguy cơ mắc AD thông qua việc điều chỉnh đường truyền tín hiệu cho tế bào T2 helper. Nó làm tăng biểu hiện mRNA của IL-4 và IL-13. Sự gia tăng đột ngột trong sản xuất các interleukin này dẫn đến giảm sản xuất FLG, làm mất tính toàn vẹn của biểu bì và dẫn đến AD. Cùng với đó, nhiều chemokine được điều chỉnh tăng trong AD để giúp tuyển dụng các tế bào đến các vị trí bị thương hoặc kích ứng và thúc đẩy sự phát triển của các tổn thương. Nói chung, CCL5 (RANTES), CCL13 (protein hóa trị đơn bào 4) và CCL11 (eotaxin) được gia tăng trong các tổn thương da AD và có thể giúp tuyển dụng tế bào T, đại thực bào và bạch cầu ái toan vào da. Hơn nữa, các gen liên quan đến miễn dịch có vai trò trong sự phát triển AD bao gồm IL-31, IL-33, yếu tố điều hòa interferon 2, lymphopoietin mô đệm (TSLP) và các thụ thể của nó (IL-7R và TSLPR), bộ chuyển đổi tín hiệu và chất hoạt hóa của phiên mã (STAT) 6, thụ thể giống Toll 2 và gen thụ thể IgE ái lực cao (Fc_RI) trong các quần thể cụ thể (Thyssen và Kezic 2014).
Các nghiên cứu gần đây đã cung cấp bằng chứng về mối liên hệ của các thụ thể vitamin D với bệnh AD. Phân họ CYP450 27 cũng đóng một vai trò quan trọng vì nó tham gia vào quá trình chuyển hóa vitamin D (dạng hoạt động D3). Nó cũng hữu ích cho việc điều chỉnh con đường miễn dịch cũng như hình thành hàng rào biểu bì bằng cách điều chỉnh sự hình thành và biệt hóa của tế bào sừng. Kết quả nghiên cứu cho thấy 5% dân số bị AD có biểu hiện thiếu vitamin D (Oren et al. 2008; Heine et al. 2013).
Sự biến đổi biểu sinh trong DNA thông qua tiếp xúc với môi trường cũng cho thấy tính nhạy cảm của nó đối với AD. Methyl hóa đóng một vai trò quan trọng trong sinh lý bệnh của AD thông qua biến đổi biểu sinh. Sự methyl hóa máu dây rốn tại 50- C-phosphate-G-30 vị trí IL-4R cho thấy sự tiến triển của AD khi trẻ 1 tuổi. Methyl hóa gen FLG vị trí CpG liền kề cũng dẫn đến tăng nguy cơ mắc bệnh chàm (Barton và cộng sự 2017; Bin và Leung 2016).
Sự bất thường của hệ thống miễn dịch
Miễn dịch bẩm sinh và miễn dịch thu được hoạt động theo cách bổ sung để duy trì các phản ứng miễn dịch tổng thể ở động vật có xương sống. Theo trình tự phát triển tiến hóa, khả năng miễn dịch bẩm sinh hình thành tuyến phòng thủ lâu đời nhất và đầu tiên ở mỗi cá nhân, và khả năng miễn dịch có được sẽ phát triển trong các giai đoạn sau. Nguồn gốc miễn dịch học đối với bệnh sinh AD nằm trong thực tế là khả năng miễn dịch thu được có thể là bãi bỏ điều chỉnh các phản ứng miễn dịch bẩm sinh. Hệ thống miễn dịch bẩm sinh cảm nhận vi khuẩn thông qua một nhóm protein mã hóa mầm, được đặt tên là các thụ thể nhận dạng mẫu (pattern recognition receptors, PRR). PRR nhận ra các mẫu phân tử liên quan đến mầm bệnh, bao gồm các thành phần của thành tế bào vi khuẩn (như lipopolysaccharide (LPS), peptidoglycan (PGN) và axit lipoteichoic), thành tế bào nấm (zymosan), phân tử RNA chuỗi kép của virus và DNA CpG chưa được methyl hóa , chủ yếu được tìm thấy trong vi khuẩn. Kích hoạt PRR dẫn đến việc sản xuất cytokine, chemokine và AMP, cũng như kích hoạt và tuyển dụng các tế bào miễn dịch (tế bào đuôi gai chưa trưởng thành (DC), tế bào killer tự nhiên (NK) và bạch cầu trung tính (PMN)).
Bảng 9.3 Những bất thường trong thành phần protein PPR trong cơ chế bệnh sinh dựa trên miễn dịch bẩm sinh của AD (De Benedeto et al. 2009)
| PPR | Khiếm khuyết gặp trong AD | Bất thường chức năng chính |
| Các thụ thể toll-like (TLR)
Protein NOD giàu leucine |
TLR 2 và TLR9
Miền liên kết nucleotide 1–4 N |
Sản xuất chemokine và peptide kháng khuẩn (AMP) và cytokine |
| CD14 | Sản xuất cytokine và chemokine | |
| PRR | Lecithin liên kết với mannose | Opsonization hoặc ly giải vi khuẩn |
Bảng 9.3 chứa thông tin về các loại PPR và các vấn đề liên quan đến chúng ở bệnh nhân AD (De Benedeto et al. 2009; Medzhitov và Janeway 2002).
Đáp ứng miễn dịch thu được chủ yếu thông qua các con đường tín hiệu loại 2. Sự biến đổi trong biểu hiện của những con đường này tạo thành cơ sở sinh lý bệnh của AD. Nhiều nghiên cứu cho thấy IL-4 và IL-13 đóng vai trò quan trọng trong sản xuất chemokine, ức chế peptide kháng khuẩn (AMP), rối loạn chức năng hàng rào da, viêm dị ứng và cũng ức chế các phản ứng miễn dịch bẩm sinh. IL-31 đã được cho là tăng cường giải phóng cộng với sản xuất peptit natri lợi tiểu có nguồn gốc từ não (peptit chu kỳ 32 AA, chủ yếu hiện diện trong nhóm tế bào thần kinh hướng tâm) và phối hợp giải phóng cytokine cũng như chemokine từ tế bào da, do đó gây ngứa ở bệnh nhân AD . IL-31 đóng vai trò là một liên kết miễn dịch tế bào thần kinh quan trọng giữa các tế bào TH2 và các dây thần kinh cảm giác (Meng et al. 2018). Một yếu tố khác đóng vai trò quan trọng là lymphopoietin mô đệm (TSLP) là một cytokine gây dị ứng. Thụ thể TSLP, một heterodimers của IL-7Rα và TSLPR, được biểu hiện trên tế bào Th2, tế bào đuôi gai, tế bào mast và tế bào lymphoid bẩm sinh loại 2. Biểu hiện TSLP có nguồn gốc từ tế bào sừng tăng lên trong các tổn thương cấp tính và mãn tính ở bệnh nhân AD. Sản xuất TSLP được kích hoạt bằng cách tiếp xúc với các yếu tố môi trường như vi sinh vật, chất gây dị ứng, khói thuốc lá, khí thải diesel và các chất kích ứng hóa học (Jariwala et al. 2011; Turner và Zhou 2014). Mặc dù con đường loại 2 đóng một vai trò chính trong sự tiến triển của AD, các yếu tố khác cũng cho thấy sự tiến triển của AD. IL-17 đã được báo cáo là làm giảm sự biểu hiện của FLG và involucrin. Hoạt hóa Th17 nổi bật hơn được phát hiện trong máu và tổn thương da AD cấp tính ở bệnh nhân châu Á so với bệnh nhân Âu-Mỹ. Yếu tố hoại tử khối u và TH2 làm thay đổi sự biểu hiện của các sản phẩm biệt hóa chính và cuối và làm giảm mức độ axit béo tự do chuỗi dài, dẫn đến mất nước ở biểu bì và giảm khả năng giữ nước của da, khô và ngứa sau đó (Tan et al. 2017 ; Leonardi và cộng sự 2015).
Cơ chế miễn dịch thần kinh
Các tế bào thần kinh cảm giác liên quan đến sự biểu hiện của thụ thể H1 và thụ thể H4 được kích hoạt bởi histamine, chủ yếu tham gia vào các phản ứng viêm và ngứa do dị ứng. Như đã đề cập ở trên, IL-31 gây ra sự kéo dài và phân tách dây thần kinh cảm giác, hỗ trợ vai trò của nó trong việc nhạy cảm với các kích thích không đáng kể và ngứa kéo dài ở bệnh nhân AD. Sự kích thích của STAT3 trong các tế bào hình sao của sừng lưng cột sống đã được báo cáo là có liên quan đến ngứa mãn tính thông qua việc tạo ra lipocalin2. Nhiều loại tế bào thần kinh và thụ thể do chúng điều chỉnh cho thấy biểu hiện quá mức trong AD, nhưng cơ chế chính xác vẫn chưa được biết rõ. Yếu tố tăng trưởng thần kinh (NGF) là một mitogen chính cho tế bào sừng, và nồng độ của nó trong SC đóng vai trò là chức năng của mức độ nghiêm trọng của AD. Nó hoạt động bằng cách liên kết với hai thụ thể có ái lực cao (kinase A liên quan đến tropomyosin (TrkA)) và các thụ thể khác có ái lực thấp (p75) có biểu hiện tăng lên đáng kể trong trường hợp AD và có thể là bằng chứng cho mối liên quan gián tiếp giữa NGF và AD ( Gaspar và Aidé et al. 2016).
Rối loạn chức năng biểu bì
Các interleukin khác nhau (IL-4, IL-13, IL-17, IL-31, IL-33) đã được thảo luận trước đó cho thấy sự điều hòa giảm của các protein biểu bì như filaggrin, keratins, loricrin, involucrin và các phân tử kết dính tế bào. Điều này dẫn đến sự phá vỡ hàng rào và khởi phát các triệu chứng của AD. Sự nhạy cảm với các kháng nguyên khác nhau bên ngoài cũng rất nổi bật vì nó thúc đẩy sự xâm nhập không được lọc của các kháng nguyên để tiếp xúc với các thụ thể biểu bì. Tóm tắt ngắn gọn về tất cả các yếu tố góp phần vào rối loạn chức năng biểu bì được đưa ra trong Bảng 9.4.
Lipid
Các chất béo, như ceramide, axit béo tự do chuỗi dài và cholesterol, tạo thành chất nền lipid có trong thể phiến và nằm giữa các tế bào sừng hoá ở lớp sừng. Tiền chất của những lipid này được lưu trữ ở vùng trên lớp phiến, tiếp tục được chuyển đổi thành dạng hoạt động nhờ các hoạt động enzym tiến triển giúp duy trì hàng rào biểu mô. Sự thay đổi trong các thành phần lipid này là đặc điểm chung của AD. Các ceramide ethylene oxide chuỗi dài rất cần thiết vì chúng được liên kết cộng hóa trị với các protein vỏ bị sừng hoá và bao phủ bề mặt của mỗi tế bào sừng hoá. Ngoài ra, mất nước qua biểu bì (TEWL) và nhiễm trùng S. aureus đều cho thấy mối liên hệ nghịch đảo với thành phần lipid trong da (Tan et al. 2017; Leonardi et al. 2015).
Bảng 9.4 Rối loạn chức năng biểu bì góp phần gây ra AD (Kim và cộng sự 2019a, b)
| Rối loạn chức năng biểu bì | Bất thường | Hậu quả |
| Protein lớp sừng | Filaggrin, transglutaminase, keratins, loricrin, involucrin và thiếu hụt protein gian bào | Khô da, tăng pH da, da nhạy cảm, thường xảy ra các phản ứng viêm |
| Desmosomes | Giảm bớt sản xuất claudin | Thiếu hydrat hóa biểu bì, mất nước qua biểu bì nhiều, da nhạy cảm |
| Lipid biểu bì | Giảm axit béo tự do chuỗi dài | Tăng mất nước qua biểu bì và tăng nhiễm trùng |
| Các peptide kháng khuẩn | Giảm cathelicidin (LL-37) và beta-defensins ở người | Tăng sản xuất cytokinin, tăng nhiễm trùng da |
Hệ vi sinh vật
Hệ vi sinh vật thường được coi là một trong những sự phức tạp của AD. Do rối loạn chức năng biểu bì và mất tính toàn vẹn, da rất dễ bị nhiễm trùng. Các vi khuẩn chính liên quan đến nhiễm trùng là S. aureus, Corynebacterium, và S. epidermidis. Sự phong phú của các loài S. epidermidis, Streptococcus, Corynebacterium và Propionibacterium được phát hiện được sau khi điều trị AD. Sự phong phú của S. aureus gây ra dạng AD nghiêm trọng hơn, và nhiễm S. epidermidis gây ra dạng AD nhẹ đến trung bình (Byrd et al. 2017). S. aureus gây ra sự mở rộng tế bào B không phụ thuộc vào tế bào T, làm tăng giải phóng các cytokine tiền viêm như TSLP, IL-4, IL-12 và IL-22. Điều này càng kích thích sự suy giảm tế bào mast, dẫn đến viêm da và tăng các biến chứng của AD. Bệnh nhân bị AD từ trung bình đến nặng cho thấy giảm đáng kể nhiều hệ vi sinh đường ruột thông thường, tức là Bifidobacterium, và số lượng Staphylococcus cao hơn so với những người khỏe mạnh. Sự phát triển quá mức của vi khuẩn gây bệnh, E. coli và Clostridium difficile, được giả thuyết là do có mối liên hệ với việc giảm vi khuẩn có lợi, giảm cảm ứng tế bào T (Treg) điều hòa, giảm khả năng miễn dịch và tăng tính thấm của ruột. Những quan sát này ủng hộ giả thuyết rằng thành phần vi sinh vật cụ thể trong ruột đã ngăn cản khả năng miễn dịch chuyển đổi Th2 và kích thích miễn dịch điều hòa, tạo ra tế bào đuôi gai điều hòa và tế bào Treg (Watanabe và cộng sự 2003; Penders và cộng sự 2007).
Các phương pháp tiếp cận hiện nay trong điều trị AD và mặt hạn chế của chúng
AD là một rối loạn viêm da mãn tính, tái phát, cho thấy nguồn gốc của nó là do rối loạn chức năng biểu bì và di truyền cũng như các bất thường trong hệ thống miễn dịch. Hầu hết người bị AD cho thấy mức độ nghiêm trọng ngày càng tăng khi nhiễm vi khuẩn S. aureus. Gần 60% dân số bị với AD cho thấy sự phát triển thêm của viêm mũi dị ứng hoặc hen suyễn hoặc dị ứng thực phẩm. Điều trị AD chủ yếu tập trung vào việc kiểm soát nhanh các triệu chứng và cải thiện chất lượng cuộc sống. Điều trị hiện tại hoạt động theo cách đề phòng hơn là ức chế các con đường sinh bệnh.
Điều trị chủ yếu bao gồm nhiều loại thuốc khác nhau được kê đơn hoặc đưa vào phác đồ tùy thuộc vào các yếu tố khác nhau như (1) sự tiến triển của bệnh, (2) tuổi của bệnh nhân, và (3) mức độ nghiêm trọng của tình trạng dựa trên chỉ số SCORAD, chỉ số diện tích và mức độ nghiêm trọng bệnh chàm (EASI), v.v. Do tính chất mãn tính của bệnh, phương pháp điều trị được lựa chọn nên có thể chịu đựng được về thể chất và phải tuân thủ tốt. Điều trị cơ bản của AD chủ yếu tập trung vào các khía cạnh khác nhau của sinh lý bệnh của AD như được liệt kê dưới đây (Nowicki và cộng sự 2015):
(a) Thói quen chăm sóc da thích hợp (chất làm mềm, chất giữ ẩm, phương pháp protein giữ ẩm).
(b) Điều trị chống viêm.
(c) Thuốc corticosteroid bôi tại chỗ (TCS) và thuốc ức chế calcineurin tại chỗ.
(d) Xử lý băng ướt.
(e) Đèn chiếu.
(f) Thuốc kháng histamine uống.
(g) Liệu pháp ức chế miễn dịch.
(h) Điều trị toàn thân bằng corticosteroid.
(i) Tránh yếu tố kích hoạt gây dị ứng.
Lựa chọn điều trị đầu tiên (Điều trị cơ bản)
Lựa chọn điều trị này thường được khuyến khích trong trường hợp trẻ em dưới 1 tuổi và bệnh nhân đang điều trị AD nhẹ. Điều này chủ yếu bao gồm việc sử dụng chất làm mềm và chất giữ ẩm, và việc lựa chọn chúng dựa trên sự thay đổi của từng bệnh nhân như mức độ khô da, hoạt động về đêm của da, dị ứng tiếp xúc, v.v. Giữ nước trong lớp sừng của biểu bì và ngăn ngừa khô da là mục tiêu chính của các điều trị này. Lựa chọn thành phần của chất làm mềm là chìa khóa để có hiệu quả tốt hơn, và thường tương tự như thành phần của lipid tự nhiên có sẵn trong da khỏe mạnh, điều này dẫn
đến việc vận chuyển tích cực hơn nữa thông qua các thụ thể có trong da và kéo dài thời gian lưu giữ. Các chất làm mềm thường được sử dụng trong nhóm này là ceramide, cholesterol và axit béo tự do, tocopherols, v.v … Các chế phẩm có chứa ceramide cho kết quả tốt hơn vì nó bị thiếu nhiều nhất trong AD (Chamlin và cộng sự 2001). Tiến bộ hơn nữa trong lựa chọn điều trị đầu tiên là thông qua việc sử dụng các chất làm mềm hoạt tính tạo điều kiện sản xuất lipid trong da. Các dẫn xuất của axit palmitic cho thấy kích thích sản xuất lipid nội sinh cùng với các hoạt động kháng khuẩn nhẹ cũng như chống ngứa liên quan đến histamine bằng cách ngăn chặn sự thoái hóa của tế bào mast (Eberlein et al. 2008). Urê là một chất bổ sung khác được sử dụng cùng với các chất làm mềm khác vì nó là một trong những thành phần của NMF.
Điều trị băng ướt là một biện pháp điều trị đầu tiên khác bằng chất làm mềm có thể có hoặc không dùng đến steroid tại chỗ. Nó thường được kê cho những bệnh nhân trong nhóm tuổi từ 6 tháng đến 10 tuổi bị AD loại nặng (SCORAD> 50). Nó chủ yếu dùng đến hai lớp băng, bên trong và bên ngoài. Băng bên trong luôn là loại băng ướt được thấm đẫm chất làm mềm và/hoặc thuốc (0,05% fluticasone propionate / mometasone) theo tỷ lệ 1: 5 (thoa toàn thân) và 1: 9 (thoa mặt). Quá trình điều trị này thường được chỉ định trong khoảng thời gian từ 3–14 ngày và việc điều trị bắt buộc phải được thực hiện dưới sự giám sát y tế. Băng ướt tạo thành một hàng rào vật lý chống lại môi trường bên ngoài và mang lại cảm giác mát lạnh cho da. Ngoài ra, nó tránh cho trẻ gãi vào vùng da bị kích ứng. Mặc quần áo khô bên ngoài ngăn cản sự bám dính của bụi lên băng bên trong và bảo vệ chống rò rỉ chất làm mềm từ băng bên trong (Devillers và Oranje 2012; Devillers et al. 2002).
Lựa chọn điều trị thứ hai (Điều trị chống viêm nhẹ)
Lựa chọn điều trị này bao gồm corticosteroid tại chỗ, chất ức chế calcineurin tại chỗ, thuốc kháng histamine uống, kháng sinh, điều trị duy trì và tránh tiếp xúc với chất gây dị ứng.
Steroid bôi tại chỗ (Topical Steroids, TCS)
Đây là phương pháp điều trị AD được sử dụng phổ biến nhất trong 50 năm qua. TCS phát huy tác dụng chủ yếu thông qua việc hình thành phức hợp với protein thụ thể có trong bào tương và tiếp tục cho thấy sự gắn kết hạt nhân thông qua các thụ thể steroid, dẫn đến kích thích sản xuất glycoprotein do thay đổi phiên mã mRNA. Glycoprotein (lipocortin) ức chế hoạt động của phospholipase A2 và giảm giải phóng axit arachidonic, cho thấy giảm phản ứng viêm (Hirata et al. 1980). Steroid tại chỗ thường được kê đơn là hydrocortisone acetate và hydrocortisone butyrate cho trẻ em dưới 1 tuổi. Mometasone furoate, fluticasone propionate và methylprednisolone aceponate được chấp thuận sử dụng cho trẻ em trên 2 tuổi. Các corticosteroid khác được chấp thuận sử dụng cho trẻ em trên 12 tuổi (Darsow và cộng sự 2010; Ring và cộng sự 2012).
Thuốc ức chế calcineurin bôi tại chỗ (Topical Calcineurin Inhibitors)
Các chất ức chế calcineurin phát huy tác dụng ức chế miễn dịch bằng cách giảm sản xuất IL-2 và biểu hiện thụ thể IL-2, điều này tiếp tục dẫn đến giảm hoạt hóa tế bào T2. Chúng cũng làm giảm sản xuất IL-4 và IL-13 là những chất trung gian quan trọng trong quá trình sinh bệnh AD (Greg và cộng sự 2015). Pimecrolimus ở dạng kem 1% được kê đơn như liệu pháp điều trị đầu tay ở bệnh nhân AD nhẹ (Luger et al. 2013). Thuốc mỡ tacrolimus 0,03% và 0,1% được khuyến cáo trong bệnh chàm dị ứng từ trung bình đến nặng và AD. So với pimecrolimus, tacrolimus có tác dụng nhanh hơn và mạnh hơn. So với steroid tại chỗ, các chất ức chế calcineurin tại chỗ cho thấy ít tác dụng phụ hơn và không có bất kỳ hạn chế nào liên quan đến tuổi tác đối với việc sử dụng nó (Schmitt et al. 2011).
Thuốc kháng sinh
Nhiễm trùng do vi khuẩn trong AD gây ra mức độ nghiêm trọng chính trong điều trị bệnh. Da của bệnh nhân AD bị mầm bệnh này xâm chiếm trong 90% trường hợp. Nhiễm S. aureus thường làm tăng các tình trạng AD nghiêm trọng hơn là nhiễm các loài khác. Mặc dù việc sử dụng kháng sinh được đề cập trong điều trị, nhưng nó không được sử dụng phổ biến vì nó có liên quan đến các biến chứng khác nhau của sự phát triển kháng thuốc của vi khuẩn. Các loại thuốc được kê theo danh mục này sẽ phụ thuộc chủ yếu vào chủng vi khuẩn xâm chiếm ưu thế trong AD. Một số loại thuốc được khuyến nghị dựa trên chỉ số hiệu quả của chúng như octenidine, chlorhexidine, mupirocin, axit fusidic và retapamulin (Thum et al. 2013; Kircik 2012; Huang et al. 2009). Ngoài ra, điều quan trọng cần lưu ý là các loại thuốc TCS và TCI cũng thể hiện hoạt tính kháng khuẩn (nhẹ) (Thum et al. 2013); do đó, việc sử dụng chất chống vi khuẩn thường không được chỉ định.
Thuốc kháng histamine
Thuốc kháng histamine thế hệ đầu tiên, hydroxyzine là loại thuốc hiện đang được khuyến cáo của loại này. Nó thường phục vụ mục đích kép vì nó ức chế sự suy giảm của tế bào mast dẫn đến ức chế các phản ứng viêm có nguồn gốc histamine và cũng cho thấy bản chất gây ngủ (tác dụng an thần) có thể được sử dụng để hỗ trợ cho bệnh nhân AD vì họ thường bị rối loạn giấc ngủ. Hoạt động kháng histamini cho thấy tăng tốc quá trình chữa lành hàng rào biểu bì vì histamine cho thấy giảm sản xuất filaggrin và keratin (Gschwandtner et al. 2013). Thuốc kháng histamine thế hệ thứ hai (AH2) đặc biệt hữu ích ở những bệnh nhân AD kèm theo viêm kết mạc hoặc viêm mũi dị ứng. Độ đặc hiệu cao hơn khi gắn vào thụ thể histamine H1, thời gian bán hủy dài hơn và cấu trúc ưa nước của AH2 góp phần cải thiện hiệu quả và độ an toàn của các thuốc này (Nhóm nghiên cứu Simons và Phòng ngừa sớm bệnh hen suyễn ở trẻ em dị ứng (EPAAC) 2007). Nhiều loại thuốc kháng histamine thế hệ thứ hai khác nhau được phép sử dụng ở AD được liệt kê trong Bảng 9.5 (Simons 1999, Simons và Nhóm nghiên cứu Phòng ngừa sớm bệnh hen suyễn ở trẻ em dị ứng (EPAAC) 2007; Hoare et al. 2000; Ring et al. 2012).
Bảng 9.5 Cơ sở dữ liệu phê duyệt thuốc theo tuổi bệnh nhân (Nowicki và cộng sự 2015)
Lựa chọn điều trị thứ ba (Điều trị toàn thân)
Những bệnh nhân bị loại AD nặng trong đó lựa chọn điều trị thứ nhất và thứ hai không hiệu quả như mong đợi thường phải trải qua điều trị toàn thân. Điều trị chủ yếu bằng cyclosporine A, methotrexate, azathioprine, mycophenolate mofetil, corticosteroid toàn thân, và liệu pháp ánh sáng cũng như thuốc ức chế miễn dịch.
Cyclosporine A (CsA)
Được khuyến cáo là lựa chọn điều trị đầu tiên trong trường hợp AD nặng ở người lớn mặc dù việc sử dụng thuốc này ở trẻ em bị hạn chế do tác dụng phụ nghiêm trọng. CsA làm giảm viêm, kích thước tổn thương và mức độ nghiêm trọng của ngứa và cải thiện chất lượng giấc ngủ. Sau khi cải thiện các tổn thương da, nên giảm liều CsA 0,5– 1,0 mg/ kg thể trọng / ngày sau mỗi 2 tuần. Việc ngừng thuốc có nguy cơ tái phát tổn thương da trong vòng vài tuần sau khi ngừng điều trị. Tuy nhiên, người ta ước tính rằng sau khi điều trị, tình trạng da không trở lại trạng thái trước khi điều trị CsA (Harper et al. 2000; Schmitt et al. 2007). Thuốc có thể được sử dụng trong liệu pháp liên tục kéo dài; tuy nhiên, khuyến cáo sử dụng theo chu kỳ kéo dài trung bình 12 tuần. CsA với liều 2,5–5,0 mg / kg / ngày dùng theo chu kỳ (thời gian chu kỳ 12–16 tuần) cho thấy nhanh chóng dẫn đến sự cải thiện đáng kể hoặc biến mất các tổn thương ở 80–90% bệnh nhân
(Schmitt et năm 2007).
Methotrexate
Được dùng như là lựa chọn điều trị cuối cùng, chỉ được khuyến cáo trong các biến chứng AD mà các lựa chọn điều trị khác không thể giải quyết được do tác dụng phụ nghiêm trọng của nó. Nhiều nghiên cứu đã báo cáo các khía cạnh an toàn của methotrexate trong điều trị AD, nhưng tất cả các nghiên cứu này chỉ liên quan đến đối tượng người lớn. Hiện tại, methotrexate được khuyến cáo để điều trị AD ở người lớn với liều lượng tương tự như trong điều trị bệnh vẩy nến, tức là 10–20 mg / tuần. Nó có thể được sử dụng với một liều duy nhất một lần một tuần, nhưng nó thường được áp dụng với ba liều 2,5–7,5 mg mỗi 12 giờ một lần một tuần (Nowicki và cộng sự 2015). Các tác giả khác khuyến cáo sử dụng methotrexate với liều 7,5–25 mg / tuần cho người lớn và 0,2–0,7 mg / kg / tuần ở trẻ em (Sidbury và cộng sự 2014).
Azathioprine (AZA)
Được sử dụng trong điều trị các tình trạng da bao gồm AD nghiêm trọng kháng với các phương pháp điều trị khác. Cơ chế hoạt động chính xác của AZA trong điều trị AD vẫn chưa được hiểu rõ. Các nghiên cứu in vitro cho thấy AZA có tác dụng ức chế và gây độc trên tế bào Langerhans (Liu và Wong 1997) và cũng làm giảm nồng độ IgE toàn phần trong huyết thanh. Khuyến cáo sử dụng AZA với liều 1-3 mg / kg thể trọng / ngày.
Liệu pháp ánh sáng
Quang liệu pháp lần đầu tiên được báo cáo vào năm 1925 và kể từ đó nó được sử dụng rộng rãi. Tất cả các loại quang liệu pháp có sẵn đã được chứng minh là có hiệu quả trong trường hợp AD nặng. Thông thường nhất, quang liệu pháp được kết hợp cùng với liệu pháp làm mềm hoặc liệu pháp TCS hoặc TCI. Dưới đây được đề cập là các loại quang trị liệu thường được sử dụng trong AD (Nyamai và cộng sự 2016):
1. UVB dải rộng (290–320 nm).
2. Phác đồ Goeckerman (5-methoxypsoralen, 8-methoxypsoralen — các hợp chất nhạy cảm ánh sáng dùng đường uống 1 hoặc 2 giờ trước khi chiếu xạ + UVB dải rộng).
3. UVB dải hẹp.
4. Laser Excimer (308 nm đơn sắc).
5. Kết hợp của UVA / UVB.
Không có bằng chứng về tính ưu việt của phương pháp này so với phương pháp khác do không có sẵn các nghiên cứu so sánh. UVB được sử dụng phổ biến nhất trong số tất cả (Sidbury et al. 2014). Đối với quang liệu pháp và quang hóa trị liệu cho trẻ em, NB-UVB được khuyến cáo là lựa chọn điều trị cho những bệnh nhân không đáp ứng với liệu pháp tại chỗ (Ring et al. 2012). Tần số định lượng cho các liệu pháp quang trị liệu khác nhau hoàn toàn phụ thuộc vào các yếu tố như ban đỏ tối thiểu, phản ứng của bệnh nhân với quang liệu pháp, v.v. Mặc dù các lựa chọn pháp điều trị được sử dụng hiện nay hoạt động hiệu quả, chúng có một số tác dụng phụ dẫn đến có hại tình trạng sức khỏe về lâu dài.
Mặt hạn chế của các phương pháp điều trị hiện có
Được tóm tắt trong Bảng 9.6 là những hậu quả không mong muốn của các phương pháp điều trị AD hiện đang được sử dụng (Nowicki và cộng sự 2015).
Bảng 9.6 Hạn chế của các phương pháp điều trị AD hiện tại
| Điều trị | Hạn chế | Tài liệu |
| Băng ướt | Cần nhân sự có kỹ năng, tăng chi phí điều trị, cần theo dõi y tế chặt chẽ trong trường hợp dùng thuốc steroid, ức chế tuyến thượng thận ở trẻ em |
Braham và cộng sự. (2010) |
| Corticosteroid tại chỗ | Teo da, giãn mạch, rạn da, rậm lông, giảm sắc tố da, viêm da quanh miệng, trứng cá đỏ, nhiễm trùng do vi khuẩn và / hoặc nấm, chứng sợ steroid, ức chế sự tổng hợp collagen gây mỏng biểu bì Việc dùng tại chỗ TCS mạnh trên diện tích lớn ở trẻ em, đặc biệt là trẻ sơ sinh, có thể gây ra các triệu chứng toàn thân không mong muốn: ức chế trục hạ đồi tuyến yên – thượng thận, chậm lớn và loãng xương |
Greece và cộng sự. (2005) |
| Thuốc ức chế calcineurin tại chỗ | Da bị bỏng và mẩn đỏ tại vị trí bôi thuốc, biến mất sau khi kết thúc điều trị | Schmitt và cộng sự. (2011) |
| Kháng sinh | Sử dụng lâu dài kháng sinh dẫn đến phát triển sự kháng thuốc của vi khuẩn Tùy thuộc vào loại kháng sinh, độc tính trên gan, rối loạn GI, hoặc độc tính trên thận |
Huang và cộng sự. (2009) |
| Kháng histamine | Nhiễm trùng đường hô hấp trên, rối loạn tiêu hóa và đợt cấp của các bệnh dị ứng | Simons (1999) |
| Cyclosporine A | Các tác dụng phụ thường hết sau khi ngừng điều trị. Rối loạn chức năng thận, huyết áp cao và nguy cơ nhiễm độc thận là những tác dụng phụ thường gặp trong trường hợp dùng chế độ liều cao. Các tác dụng phụ không phổ biến là các triệu chứng thần kinh như nhức đầu, co giật, dị cảm, cũng như rối loạn tiêu hóa, nhiễm trùng tăng sản nướu, rậm lông, tăng lipid máu, rối loạn điện giải, tăng nguy cơ ung thư da và rối loạn tăng sinh bạch huyết |
Schmitt và cộng sự. (2007) |
| Methotrexate | Độc gan, ức chế tủy xương, xơ phổi và suy thận. Ngoài ra, thường xuyên thấy giảm khả năng chống nhiễm trùng, giảm bạch cầu, chán ăn, chóng mặt, nhức đầu, đau bụng, viêm loét miệng, viêm và loét ruột. | Tóm tắt sản phẩm (2007) |
| Azathioprine | Suy tủy xương và rối loạn hệ thống miễn dịch. Rối loạn mạch máu (viêm mạch), rối loạn tiêu hóa (buồn nôn, nôn) và rối loạn gan |
Roekevisch và cộng sự. (2014) |
| Quang liệu pháp | Đỏ và đau sau khi chiếu xạ, ngứa, bỏng và tổn thương da do ánh sáng mặt trời. Các tác dụng ngoại ý ít phổ biến hơn gồm ung thư da, u hắc tố (chủ yếu với PUVA), lentigo, phản ứng nhạy cảm với ánh sáng (chủ yếu là phát ban đa dạng), viêm nang lông, loạn sắc tố da, tái hoạt HSV, lông mặt nhiều và đục thủy tinh thể (cũng với PUVA). Bệnh nhân sử dụng psoralens phàn nàn về cảm giác buồn nôn, nôn mửa và đau đầu | Sidbury và cộng sự. (2014) |
Các phương pháp điều trị mới nổi cho AD
Điều trị AD hiện tại tập trung vào việc giảm triệu chứng. Do những hạn chế khác nhau của các phương pháp điều trị hiện tại, chúng không được khuyến khích về lâu dài. Đối với điều trị kéo dài, các con đường sinh bệnh khác nhau của AD được khám phá và các phương pháp điều trị mới nổi được thiết kế theo cách nhắm mục tiêu cụ thể giúp giảm tỷ lệ mắc các tác dụng phụ.
Như đã thảo luận trong sinh lý bệnh của AD, IL-4 và IL-13 đóng một vai trò quan trọng trong sự tiến triển của bệnh. Việc nhắm mục tiêu cụ thể vào các thụ thể interleukin này và làm giảm tác dụng của chúng là cơ sở của việc điều trị, liên quan đến các kháng thể đơn dòng. Dupilumab là kháng thể đơn dòng được nhân bản hóa đầu tiên được FDA công nhận là dùng điều trị AD. Dupilumab chặn cả tín hiệu qua trung gian IL-4- và IL-13 thông qua thụ thể loại 2, thụ thể này yêu cầu dị đồng hóa IL-4Rα và IL-13Rα1. Dupilumab cũng ức chế tín hiệu IL-4 thông qua thụ thể loại 1 (Gooderham et al. 2018). Tralokinumab và lebrikizumab là hai kháng thể nhắm mục tiêu IL-13 vẫn đang trong quá trình thử nghiệm lâm sàng. Liệu pháp đơn trị liệu và liệu pháp kết hợp của ba loại kháng thể này vẫn đang được nghiên cứu, cho thấy khả năng dung nạp và chỉ số an toàn tốt hơn đối với steroid tại chỗ (Moyle et al. 2019).Rối loạn chức năng trong nhiều con đường miễn dịch (loại 1, 2, 17 và 22) cũng được thấy trong AD. Một số yếu tố sinh học đang trong quá trình phát triển nhắm vào các tác nhân chính (ví dụ: cytokine, thụ thể cytokine) của các phản ứng sinh học này.
Để nhắm mục tiêu IL-17A, secukinumab, một kháng thể đơn dòng IgG1κ của người, kháng IL-17A, được phát triển và được FDA chấp thuận để điều trị các bệnh như vẩy nến mảng vừa đến nặng, viêm khớp vẩy nến hoạt động và viêm cột sống dính khớp, nhưng các thử nghiệm cho AD vẫn chưa được báo cáo (Toda et al. 2003).
Một con đường khác được khám phá rộng rãi để điều trị AD là ức chế enzym phosphodiesterase-4 (PDE-4), có liên quan đến tình trạng viêm mãn tính. Sự ức chế PDE-4 làm tăng mức độ chu kỳ adenosine monophosphate (cAMP), làm trung gian các sự kiện theo dòng lên đến đỉnh điểm là ức chế bài tiết cytokine gây viêm (ví dụ, IL-12, IL-17, IL-23, IFN-γ). Mặc dù một số chất ức chế PDE-4 (ví dụ: apremilast, roflumilast) cho đến nay vẫn chưa báo cáo thành công về mặt lâm sàng, nhưng thuốc điều trị tại chỗ đã được FDA chấp thuận vào tháng 12 năm 2016 để điều trị AD nhẹ đến trung bình ở bệnh nhân từ 2 tuổi trở lên (Gisondi và Girolomoni 2016 ; Paller và cộng sự 2016).
Các lựa chọn điều trị thay thế cho AD
Điều trị thay thế cho AD thường bao gồm việc điều trị để kiểm soát tổng thể và cải thiện chất lượng cuộc sống cho bệnh nhân. Cách tiếp cận này chủ yếu liên quan đến các biện pháp khắc phục thuộc các hệ thống y học thay thế, chủ yếu liên quan đến:
(a) Châm cứu.
(b) Liệu pháp thư giãn.
(c) Tâm lý trị liệu.
(d) Probiotics.
Châm cứu
Phương pháp điều trị thay thế này có nguồn gốc từ y học Trung Quốc. Triết lý cơ bản của phương pháp này nằm ở giả thuyết rằng nhiều bệnh liên quan đến da khi nó giao tiếp giữa môi trường bên trong và bên ngoài. Sự cân bằng hoàn toàn của năng lượng được duy trì trong cơ thể khỏe mạnh. Bất kỳ sự xáo trộn nào trong trạng thái cân bằng này đều dẫn đến tình trạng bệnh phản ánh ngay trên da. Trong trường hợp AD, sự thiếu hụt năng lượng được thấy ở nơi thích hợp nhất hóa và giảm béo (kích thích nhẹ trên da). Các thử nghiệm lâm sàng có kiểm soát được thực hiện bởi Kim (2018) bao gồm 30 bệnh nhân trên 19 tuổi (SCORAD 10–40) cho thấy sự cải thiện đáng kể về SCORAD của nhóm châm cứu verum so với giả châm cứu.
Liệu pháp thư giãn
Chủ yếu nhằm mục đích kiểm soát thành phần stress trong tiến triển của AD, bao gồm những điều sau:
(a) Phản hồi sinh học — Nó là sự kết hợp của các từ sinh học và phản hồi, có nghĩa đen là “thông tin phản hồi sinh học”. Nó cho thấy kết quả tốt với việc kiểm soát yếu tố tự chủ trong AD bằng cách kiểm soát sự biểu hiện quá mức của các phản ứng giao cảm dựa trên các khái niệm như trạng thái cân bằng tâm- trí và cơ thể tạo ra sự tự kiểm soát ở bệnh nhân. Nó cũng bao gồm trách nhiệm của cá nhân trong việc điều trị bệnh, v.v. Trong liệu pháp này, bệnh nhân được huấn luyện để thay đổi phản ứng thần kinh. Trong quá trình huấn luyện, cần đặc biệt chú ý đến các phản ứng khác nhau được tạo ra trong bệnh tật và kiểm soát chúng. Điều này thường được kết hợp với đo điện cơ trong quá trình đào tạo để theo dõi các phản ứng (Sarti 1998).
(b) Thôi miên —đề cập đến trạng thái tâm trí mà bệnh nhân đạt được dưới sự hướng dẫn của một nhà trị liệu, trong đó bệnh nhân dễ dàng chấp nhận các gợi ý và tạo ra thực tế thay thế. Khả năng tự tập trung cao có thể dẫn đến cải thiện các triệu chứng của AD thông qua tâm trí của bệnh nhân với các giao tiếp cơ thể. Mặc dù cơ chế chính xác hoạt động của thôi miên vẫn chưa được biết, nhưng người ta đã giả thuyết rằng nó hoạt động trên các đường tương tự như phản hồi sinh học. Nó thường tập trung vào việc kiểm soát các thông số khác như giải mẫn cảm vùng bị ảnh hưởng và huấn luyện ác cảm. Tự huấn luyện tương tự như phương pháp tự thôi miên (Arndt et al. 2008).
(c) Liệu pháp massage — Đây là một hình thức trị liệu thư giãn được chấp nhận rộng rãi vì nó phục vụ các lợi ích như giảm căng thẳng cũng như điều trị bằng thuốc làm mềm da tại chỗ. Nghiên cứu được thực hiện bởi Eisenberg (1998) gồm một nhóm trẻ em bị AD được điều trị xoa bóp hàng ngày trong 15 phút trước khi đi ngủ. Vật liệu xoa bóp là thuốc mỡ. Tương tự, trong nhóm đối chứng, cùng một loại thuốc mỡ được bôi mà không cần xoa bóp. Sau 1 tháng hoàn thành, trẻ được massage có sự cải thiện với giảm mẩn đỏ và ngứa da so với nhóm chứng.
Tâm lý trị liệu
Ngứa ngáy và khó chịu là những đặc điểm quan trọng của AD. Gãi liên tục gây trầy xướt trên da và ảnh hưởng sự toàn vẹn của da, dẫn đến sự tiến triển của bệnh. Tâm lý trị liệu chủ yếu tập trung vào việc giảm cảm giác ngứa, cũng như cải thiện tình trạng tâm thần của bệnh nhân (Horne và cộng sự 1989). Liệu pháp nhận thức hành vi (CBT) đóng vai trò quan trọng trong việc điều chỉnh phản ứng của bệnh nhân đối với sự lo lắng và cũng cho thấy khả năng giải quyết sự thất vọng tốt hơn, v.v. Nó xem xét ý kiến
của bệnh nhân và người thân của họ về bệnh tật và cố gắng điều chỉnh và cơ cấu lại mô hình suy nghĩ của họ. Trong phương pháp điều trị này, nhà trị liệu đưa ra giả thuyết về chuỗi suy nghĩ được bệnh nhân thấm nhuần và chấp nhận, ví dụ: động lực liên tục của bệnh nhân bằng cách nói chuyện tích cực, giảm cường độ gãi khi ngứa và giải quyết mọi xáo trộn trong gia đình bằng hỗ trợ tư vấn (Arndt et al. 2008). Trong một thử nghiệm thí điểm mở do Erik Hedman-Lagerlöf và cộng sự thực hiện, chín người lớn mắc chứng AD đã trải qua liệu pháp tâm lý trong thời gian 10 tuần. Bệnh nhân cho thấy sự cải thiện có ý nghĩa thống kê đối với chỉ số SCORAD so với dữ liệu tiền xử lý và sau điều trị với p = 0,020 (Hedman-Lagerlöf et al. 2019).
Probiotics
Phương thức điều trị này liên quan đến việc sử dụng vi khuẩn cho bệnh nhân thông qua các phương thức phân phối khác nhau (uống, bôi) với số lượng được tính toán để mang lại lợi ích cho sức khỏe. Các vi khuẩn xâm chiếm trong đường ruột của con người mang lại lợi ích cho sức khỏe, và sự xáo trộn trong trạng thái cân bằng của chúng thường dẫn đến tình trạng bệnh. Việc duy trì hệ vi sinh vật này của đường ruột là rất quan trọng. Phân tích chi tiết vi khuẩn trong phân của trẻ em khỏe mạnh và người lớn so với bệnh nhân AD đã tạo ra cơ sở dữ liệu về chủng vi khuẩn có thể đóng một vai trò quan trọng trong sự tiến triển của AD. Dựa trên cơ sở dữ liệu này, các chủng vi khuẩn thường được sử dụng để điều trị AD là Lactobacilli, L .rhamnosus, Bifidobacterium lactis, L. fermentum, P. freudenreichii subsp. shermanii JS, L. reuteri,
v.v. (Yeşilova và cộng sự 2012).
Probiotics trong AD
Sử dụng vi sinh vật trong quá trình lên men thực phẩm cũng như mang lại lợi ích cho sức khỏe có từ trước ở một số nền văn minh cổ đại của châu Á và châu Âu (McGovern et al. 2004; Ozen và Dinleyici 2015). Tuy nhiên, mối liên hệ giữa sức khỏe con người và hệ vi sinh vật chỉ trở nên sâu sắc hơn vào đầu thế kỷ 19, khi tác dụng có lợi của một số vi khuẩn được nghiên cứu và báo cáo một cách có hệ thống bởi Ellie Metchnikoff – cha đẻ của miễn dịch tự nhiên. Ông đã vẽ ra mối tương quan trực tiếp giữa việc tiêu thụ sữa chua và việc làm chậm quá trình lão hóa (Gordon 2008). Cuối cùng, thuật ngữ “probiotic” được đặt ra bởi Werner Kollath và được liên kết với một loạt các vấn đề sức khỏe vì lợi ích điều trị, theranostics và thẩm mỹ của nó (Gueniche và cộng sự 2009; Danino và cộng sự 2015; Singh và cộng sự 2017a). Điều này giúp ngăn ngừa các rối loạn về tim mạch, dạ dày, phổi và thoái hóa thần kinh, ung thư, sức khỏe xương, sức khỏe
hệ sinh sản, tình trạng tâm lý, rối loạn lối sống và các bệnh về da. Các probiotic được sử dụng cho các bệnh về da và rối loạn đặc biệt về AD sẽ được thảo luận trong phần tiếp theo.
Probiotics trong sức khỏe làn da
Các vi sinh vật có mặt ở khắp nơi và trong cơ thể con người, số lượng của chúng là khoảng 1014, nhiều hơn tổng số tế bào của con người. Phần lớn trong số chúng ở đường tiêu hóa GI (đặc biệt là ruột già), sau đó là các vị trí khác nhau như khoang miệng, kết mạc, phổi, âm đạo, niệu đạo, bàng quang và da (Huttenhower et al. 2012). Là cơ quan lớn nhất của cơ thể con người với diện tích bề mặt trung bình khoảng 2 m2, da chứa một lượng lớn hệ vi sinh vật tự nhiên. Chúng góp phần duy trì cân bằng nội môi của da và thường được gọi là “lợi khuẩn”. Tuy nhiên, số lượng thay đổi tùy thuộc vào vị trí giải phẫu, thành phần cấu trúc, độ dày biểu bì, chất tiết da (mồ hôi và bã nhờn) và độ ẩm (Grice và Segre 2011). Hệ vi sinh trên da có thể thay đổi tùy thuộc vào ngưỡng của các yếu tố môi trường khác nhau bao gồm các tín hiệu nội tiết tố, thần kinh và viêm. Kết quả sinh lý của những điều này thường là thoái hóa tế bào sừng, sản xuất quá nhiều bã nhờn, suy giảm tế bào mast và sản xuất các yếu tố giãn mạch và các cytokine tiền viêm như IL-1β, IL-6 và TNF-α (Arck và cộng sự 2006; Choi và Di Nardo 2018). Kết cấu như vậy điều khiển hoạt động bình thường của hệ vi sinh vật trên da trong việc duy trì sức khỏe tốt và mở đường cho các vấn đề và bệnh về da.
Hệ vi sinh vật của nấm được cho là tiến triển ổn định so với hệ vi sinh vật của vi khuẩn, hệ vi sinh vật này thường xuyên có xu hướng thay đổi (Paulino và cộng sự 2006; Gao và cộng sự 2008). Vi khuẩn thuộc về phyla Actinobacteria, Firmicutes, Proteobacteria và Bacteroidetes thường được tìm thấy trên da. Ở cấp độ chi, vi khuẩn Proteobacteria, Propionibacteria, Corynebacteria, Staphylococcus và Streptococcus chiếm ưu thế và duy trì làn da khỏe mạnh. Tuy nhiên, hệ vi nấm da vẫn chỉ giới hạn trong chi nấm men Malassezia (Paulino và cộng sự 2006; Gao và cộng sự 2008; Grice và cộng sự 2008).
Các bệnh và rối loạn về da khác nhau cùng với liệu pháp điều trị bằng probiotic
được mô tả ngắn gọn trong phần dưới đây.
Probiotics và mụn trứng cá
Sự biểu hiện quá mức của các chất trung gian tiền viêm như cytokine làm trầm trọng thêm tình trạng viêm da ngăn chặn sự phát triển của tóc và tăng sinh tế bào sừng,
dẫn đến trứng cá đỏ hoặc mụn trứng cá. Lactobacilli reuteri BM 36301 và Bifidobacterium longum đã được chứng minh là có khả năng kích thích sự phát triển của nang lông và giảm viêm tương ứng ở các mô hình động vật và các nghiên cứu mẫu cấy trên da (A. et al. 2010; J. et al. 2016).
Staphylococcus epidermidis và L. brevis DSM 17250 đã cho thấy tác dụng ức chế sự lây lan của vi khuẩn Propionibacterium acnes, tác nhân gây ra mụn trứng cá, bằng cách giải phóng SCFAs và một số peptit nhất định kích hoạt sự tăng sinh S. epidermidis (Wang et al. 2016; Holz et al. 2017). Sự hiệp đồng cùng với việc giảm tác dụng ngoại ý đã được thấy khi dùng minocycline cùng với sự kết hợp của ba probiotics —
L. acidophilus, B. bifidum, và L. delbrueckii (Jung và cộng sự 2013). Uống Escherichia coli làm giảm viêm do sự hiện diện của immunoglobulin-A (IgA) và duy trì hệ vi khuẩn đường ruột liên quan đến bệnh da liễu (Manzhalii et al. 2016). Các nghiên cứu in vitro và tại chỗ cho Lactococcus sp. HY 449 tạo ra kết quả tích cực chống lại P. acnes bằng cách giải phóng bacteriocin (Oh et al. 2006).
Probiotics và sự lành thương
Quá trình lành vết thương hoặc vết rách da tự nhiên thường bao gồm bốn giai đoạn, đó là (a) cầm máu, lưu thông máu đến các mô bị tổn thương, (b) giải phóng chất trung gian gây viêm để ngăn chặn sự tiến triển của nhiễm trùng gây bệnh và tiếp tục duy trì sự tự nhiên hệ vi sinh vật da, (c) kích thích các yếu tố tăng trưởng để tái lập biểu mô, và (d) tăng sinh nguyên bào sợi và giải phóng các protein nền ngoại bào như collagen (Singh et al. 2017b). Probiotics hoạt động trong việc kích thích và duy trì quá trình trên ở một trong hai giai đoạn.
Sự gia tăng nồng độ collagen và yếu tố tăng trưởng biến đổi beta 1 (TGF-β1) đã được ghi nhận khi vết thương bỏng được điều trị bằng Saccharomyces cerevisiae (Tsiouris và Tsiouri 2017). MRSA thường được tìm thấy trong các vết thương nhiễm trùng đã bị ức chế bởi việc sử dụng L. acidophilus và L. casei (Sikorska và Smoragiewicz 2013). Trong một nghiên cứu khác, L. reuteri và L. rhamnosus ức chế sự bám dính và chinh phục của S. aureus trên tế bào sừng, do đó ngăn chặn sự phá hủy tế bào sừng và cuối cùng là cái chết (Prince et al. 2012). Quá trình lành vết thương qua trung gian sản xuất oxit nitric (gNO) cũng được nghiên cứu chống lại S. aureus bằng cách sử dụng chế phẩm sinh học L. fermentum (Isenberg và cộng sự 2005). Một vài nghiên cứu về việc sử dụng Kefir trong các ứng dụng tại chỗ cũng cho thấy tác dụng diệt vi khuẩn và chữa bệnh đáng kể (Huseini et al. 2012). Kefir đã đạt được nhiều tầm quan trọng về mặt khoa học do sự hiện diện của hydrogen peroxide, bacteriocin, axit lactic và axit axetic ngăn
chặn sự phát triển của vi khuẩn, đặc biệt là trên vết bỏng bị nhiễm P. aeruginosa
(Rodrigues et al. 2005).
Probiotics và lão hóa da
Có mối liên hệ không thể tránh khỏi giữa việc gia tăng mức độ căng thẳng, lối sống không lành mạnh và làn da của con người dễ xuất hiện các nếp nhăn, nếp nhăn, bề mặt sần sùi và các đốm đồi mồi. Các yếu tố bên trong (stress oxy hóa, thay đổi độ pH, v.v.) và bên ngoài (tia UV) làm suy giảm thêm hệ vi sinh vật tự nhiên của da. Rất nhiều dữ liệu tiền lâm sàng và lâm sàng hỗ trợ duy trì độ mềm mại của lớp sừng, bảo vệ da khỏi ảnh hưởng của tia UV bằng cách sử dụng probiotic. Những sinh vật thân thiện này hiện cũng đang chiếm một vai trò quan trọng trong các ứng dụng thẩm mỹ, cung cấp một phương pháp điều trị hiệu quả và an toàn hơn trong chống lão hoá.
Uống L. acidophilus và L. johnsonii làm giảm nếp nhăn da do tia UVB gây ra và giảm bớt lão hoá da do ánh sáng (Bouilly-Gauthier et al. 2010; Im et al. 2016). Một nghiên cứu khác nhấn mạnh rằng chiết xuất từ rễ Acanthopanax koreanum lên men cùng với
L. plantarum và B. bifidum làm chậm quá trình lão hóa da và giảm tổn thương do stress oxy hóa gây ra trên da người (Park và Bae 2016). Các phương pháp tiếp cận nội sinh khác bao gồm việc sử dụng Vitreoscilla filiformis làm thay đổi hoạt động của enzym dismutase oxit ty thể, giảm quá trình chết tế bào và tổn thương mô do tác hại của tia UV (Mahé và cộng sự 2006).
Trong một nghiên cứu được thực hiện bởi Baba và cộng sự, Lactobacillus helveticus cho thấy khả năng giữ ẩm được tăng cường (Baba và cộng sự 2006). Các nghiên cứu tương tự cho thấy bổ sung B. breve B-3 duy trì mức độ hydrat hóa bình thường trong da cùng với hoạt động bảo vệ da (Satoh et al. 2015).
Probiotic và bệnh vẩy nến
Các chủng probiotic điều hòa miễn dịch đang ngày càng được quan tâm đối với các bệnh tự miễn dịch như bệnh vẩy nến và AD. Probiotics cho bệnh vẩy nến hoạt động bằng cách điều chỉnh giảm các chất trung gian tiền viêm ILs và TNFs gây tăng sản biểu bì dẫn đến tổn thương vẩy nến (Hawkes et al. 2017). Sự sụt giảm của vi khuẩn thuộc phyla Actinobacteria và Proteobacteria và chi Propionibacterium càng làm trầm trọng thêm tình trạng bệnh (Gao et al. 2007). Ứng dụng của L. pentosus GMNL-77 và B. Infantis 35.624 đã cho thấy giảm các triệu chứng viêm và giảm các mảng vảy nến (Groeger et al. 2013; Chen et al. 2017).
L. sporogenes cũng cho thấy tác dụng tương tự trong bệnh vẩy nến mụn mủ
(Vijayashankar và Raghunath 2012).
Phần dưới vẽ ra mối liên hệ giữa vi khuẩn đường ruột và cơ chế gây bệnh của AD cùng với các phương pháp điều trị bằng probiotic.
Hệ vi sinh vật ở trục ruột-da trong AD
Rất nhiều vi khuẩn sống trong ruột người trong mối quan hệ cộng sinh, theo dõi và duy trì cân bằng nội môi sinh lý. Tuy nhiên, một sự thay đổi trong hệ vi sinh vật đường ruột tự nhiên này dẫn đến chứng loạn khuẩn và sức khỏe của cơ thể cũng bị ảnh hưởng. Một mối liên hệ tiềm ẩn tồn tại giữa làn da khỏe mạnh và hệ vi sinh vật đường ruột (Johnson và Ownby 2017). Tận dụng sự liên kết này, các nhà khoa học đã lần ra một cách “từ trong ra ngoài” để cung cấp các phương pháp điều trị hiệu quả cho một tình trạng da phức tạp như AD.
Bảng 9.7 Một số chủng probiotic được sử dụng với phương thức hoạt động / chức năng trong AD
| Các chủng probiotic | Phương thức hoạt động / chức năng | Tài liệu |
| Kết hợp của L. casei, L. plantarum, L. rhamnosus, B. lactis, và natri butyrate | Tăng mức Th1.
Giảm quá mẫn loại 1 |
Kim và cộng sự. (2018) |
| L. plantarum IS-10506 | Điều hòa giảm các chỉ dấu viêm như IL-4, IL-17 và interferon- γ (IFN-γ).
Tăng biểu hiện gen của |
Prakoeswa và cộng sự. (2017) |
| L. acidophilus | Giảm phản ứng viêm qua trung gian Th2 | Inoue và cộng sự. (2014) |
| L. salivarius LA307 và L. rhamnosus LA305 |
Ức chế viêm da, giảm tăng sản | Holowacz và cộng sự. (2018) |
| Lactococcus chungagensis CAU 28T | Chống viêm và chống dị ứng | Choi và cộng sự. (2016) |
| L. johnsonii NCC 533 | Tăng cường biểu hiện các peptit kháng khuẩn, ức chế sự bám dính của S. aureus | Blanchet-Réthoré và cộng sự. (2017) |
| Bifidobacterium lactis HN019 |
Giảm nhẹ tình trạng dị ứng | Wickens và cộng sự. (2008) |
Các liệu pháp thông thường bao gồm điều chỉnh sự suy giảm của tế bào mast và làm giảm các triệu chứng kiểu hình (ban đỏ, ngứa và xuất huyết). Bên cạnh đó, nghiên cứu về việc sử dụng probiotics cho AD đang tăng lên theo cấp số nhân (Bảng 9.7). Probiotics hoạt động bằng cách phục hồi hệ vi khuẩn đường ruột, bài tiết chất độc
(bacteriocin) và ngăn chặn sự bám dính của các mầm bệnh bất lợi trên thành biểu mô. Chúng điều chỉnh thêm các tín hiệu viêm và miễn dịch bằng cách giải phóng các SCFA như butyrate, propionate và acetate. Sự biểu hiện của các protein tiếp giáp chặt chẽ cũng được tăng cường. Sự ức chế các cytokine tiền viêm như IL-4, IFN-γ, và IL-17 và thúc đẩy các cytokine chống viêm (IL-10, TGF-β) được điều chỉnh bởi probiotics. Việc điều chỉnh và di chuyển các tế bào T điều hòa trên da bằng probiotics ức chế phản ứng Th2 và Th17, đảm bảo hiệu quả điều trị trong AD (Kim và cộng sự 2013; Chang và cộng sự 2016; McCusker và Sidbury 2016; Rather và cộng sự 2016).
Mức độ của Clostridia, C. difficile, E. coli và S. aureus trong ruột tăng cao ở bệnh nhân AD gây viêm bạch cầu ái toan. Mặt khác, các vi khuẩn tốt như A. muciniphila, Bifidobacteria, Bacteroidetes và Bacteroides bị giảm (Penders et al. 2006; Abrahamsson et al. 2012; Nylund et al. 2015; Lee et al. 2016a, b). Song et al. đã báo cáo mức giảm đáng kể của vi khuẩn Faecalibacterium prausnitzii ở trẻ sơ sinh bị AD (Song et al. 2016). Để bù đắp cho sự mất mát vi khuẩn tốt, các loài Lactobacillus và Bifidobacterium nằm trong số những loài được khám phá nhiều nhất để điều trị AD (Pité 2010; Enomoto và cộng sự 2014).
Theo báo cáo, các tín hiệu viêm ở trẻ sơ sinh bị AD đã giảm do mức độ gia tăng của Coprococcus eutactus, một loại vi khuẩn sản xuất butyrate (Nylund et al. 2015). Probiotics trước khi sinh và sau khi sinh đã cho thấy tác dụng tích cực trong việc kiểm soát AD. Trong một nghiên cứu lâm sàng liên quan đến phụ nữ mang thai có tiền sử gia đình bị AD và trẻ sơ sinh của họ trong 2 tháng sau khi sinh, họ được cho kết hợp
B. bifidum BGN4, B. lactis AD011 và L. acidophilus AD031. Giảm chỉ số điểm AD ở
nhóm được điều trị bằng probiotic so với nhóm dùng giả dược (Pité 2010).
Do đó, trục ruột-da đang trở thành một phương pháp điều trị tiềm năng cho bệnh nhân, liên quan đến việc giảm các tình trạng trầm trọng của AD bằng cách hài hòa hệ vi sinh vật đường ruột.
Cơ chế hoạt động
Ngoài việc phục hồi hệ vi sinh đường ruột, có ba cơ chế chính mà probiotics hoạt động trong việc điều chỉnh các triệu chứng của AD, viz., con đường điều hòa miễn dịch, chuyển hóa và thần kinh nội tiết.
Cơ chế điều hòa miễn dịch
Sự mất cân bằng miễn dịch liên quan đến tỷ lệ Th1 / Th2 (loại tế bào T helper) dẫn đến sản xuất quá mức các cytokine Th2 như IL-4, IL-5 và IL-13. Quá trình phát
tín hiệu này kích hoạt sản xuất IgE, gây ra các phản ứng quá mẫn dẫn đến AD. Điều này cũng hỗ trợ sự bám dính của S. aureus vào da gây ra sự gián đoạn biểu mô ở AD (Huang và cộng sự 2017b).
Probiotics hoạt động bằng cách điều chỉnh con đường sinh miễn dịch bằng cách tương tác với niêm mạc dạ dày và mô lympho liên quan đến ruột (GALT) (Lebeer et al. 2010). Chúng tiếp tục gắn bó và tương tác với các tế bào miễn dịch khác như đại thực bào và tế bào đuôi gai trong niêm mạc ruột, kích hoạt kích hoạt các cytokine chống viêm. Điều này bao gồm sự gia tăng IL-10 và TGF-β trong tế bào (Smits et al. 2005; Ueno et al. 2011). Do biểu hiện này, các tế bào T (Treg) điều hòa cảm ứng, đặc biệt là Foxp3
+, tăng lên, làm giảm phản ứng miễn dịch (Werfel và Kapp 2002).
Mặt khác, S. aureus với sự kết hợp của siêu gen và gen kết dính trong ruột có liên quan tiêu cực đến sự tiến triển của AD ở trẻ sơ sinh bất kể thực tế là S. aureus trên da có tác động tàn phá ở AD (Nowrouzian et al. 2017) . Tóm lại, sự điều hòa của môi trường miễn dịch bằng probiotics có liên quan đến sự liên kết của ruột và da ở AD.
Con đường trao đổi chất
Điều chỉnh AD thông qua con đường trao đổi chất thường liên quan đến việc tổng hợp SCFA bằng probiotics có tác dụng chống viêm (Reichardt và cộng sự 2014). Uống axit linoleic và axit 10-hydroxy-cis-12-octadecenoic trong các nghiên cứu tiền lâm sàng đã duy trì hệ vi sinh vật đường ruột và làm giảm các tình trạng của AD. Hơn nữa, tăng nồng độ axit kynurenic, một chất chuyển hóa được tạo ra khi uống B. animalis subsp. lactis (LKM512), làm giảm các triệu chứng ngứa trên mô hình chuột (Matsumoto et al. 2014).
Trạng thái hệ vi sinh vật đường ruột sơ sinh 3 (NGM3) trong các mẫu phân của trẻ sơ sinh cho thấy mức độ gia tăng của axit 12,13-dihydroxy-9Z-octadecenoic (12,13- diHOME), một hợp chất điều hòa miễn dịch và tiền viêm gây ra bệnh chàm hoặc AD. Bên cạnh đó, nó có chức năng bảo vệ da người trong nấm vernix caseosa (Fujimura et al. 2016; S.R. et al. 2018). Những dữ liệu này biểu thị sự hiện diện của giao tiếp qua trung gian chất chuyển hóa qua trục da ruột ở AD.
Con đường nội tiết thần kinh
Một quá trình chuyển đổi gần đây cũng đã xảy ra trong việc hiểu con đường nội tiết thần kinh trong việc điều chỉnh các tình trạng của AD (Senra và Wollenberg 2014). Sự tham gia của các chất dẫn truyền thần kinh và các hợp chất thần kinh do hệ vi sinh vật đường ruột tiết ra, tác động trực tiếp hoặc gián tiếp, đang được xem xét trong điều trị
AD. Chúng liên quan nhiều hơn đến chức năng hàng rào bảo vệ da và điều chỉnh hệ thống miễn dịch của vật chủ (Cryan và Dinan 2012; Jin et al. 2014).
Cảm giác ngứa xảy ra do vi khuẩn đường ruột sản xuất quá mức tryptophan được chống lại bằng cách giải phóng axit γ-aminobutyric (GABA). Điều này được tạo ra bởi các loài Lactobacilli và Bifidobacterium (Akiyama et al. 2011; Jin et al. 2014). Serotonin được sản xuất bởi các vết E. coli và Enterococcus điều chỉnh con đường sinh hắc tố thông qua các thụ thể serotonin trong sắc tố da. Nó trở thành một thông số quan trọng được xem xét để khắc phục tình trạng rối loạn sắc tố âm (tăng sắc tố và giảm sắc tố) xảy ra ở AD (Leung và cộng sự 2004). Đây là những ví dụ về điều chỉnh trực tiếp các triệu chứng.
Một cách gián tiếp, sự gián đoạn mạng lưới tế bào thần kinh cản trở các chức năng của não, làm tăng mức độ lo lắng và căng thẳng, là một trong những lý do làm trầm trọng thêm AD (Yokoyama và cộng sự 2015). Khi bị căng thẳng, sự giải phóng cortisol sẽ thay đổi hệ vi sinh vật trong ruột, làm thay đổi tính thấm và chức năng hàng rào của ruột (Cryan và Dinan 2012). Bên cạnh đó, mức độ của các hợp chất nội tiết thần kinh và các peptit thần kinh như serotonin, tryptamine và trimethylamine đều giảm. Tình trạng này điều chỉnh các lớp biểu mô bị phá vỡ và giảm viêm da (Jin và cộng sự 2014; O’Neill và cộng sự 2016). Do đó, các phân tử hoặc con đường này còn có thể được sử dụng làm mục tiêu hoặc tác nhân điều trị để chống lại mức độ nghiêm trọng của AD.
Các yếu tố ảnh hưởng đến khả năng tồn tại của probiotics
Những lo ngại về khả năng tồn tại của probiotics trong các cách sử dụng khác nhau đã dẫn đến số lượng lớn các nghiên cứu vì nó ảnh hưởng lớn đến hiệu quả điều trị của sản phẩm. Nó thường được đo bằng số lượng tế bào hoạt động hoặc sống trên mỗi g hoặc mL sản phẩm (Karimi et al. 2011). Theo chú ý chung, nồng độ từ 106 đến 108 cfu mL -1 tế bào sống được coi là đạt yêu cầu. Một nghiên cứu khác nhấn mạnh việc dùng 100 g sản phẩm probiotic (109 tế bào sống) như một thói quen để duy trì sức khỏe đường ruột tốt (Vinderola và cộng sự 2000; Karimi và cộng sự 2011; Mohammadi và cộng sự 2011).
Tuy nhiên, các yếu tố khác nhau góp phần ảnh hưởng đến khả năng tồn tại của tế bào. Điều này thường bao gồm nhiều thuộc tính sản xuất và điều kiện tiếp xúc trong quá trình bảo quản sản phẩm thương mại. Mối quan tâm về khả năng tồn tại cũng liên quan đến các điều kiện đường ruột khác nhau sau khi uống sản phẩm. Tóm tắt ngắn
gọn về các thông số sản xuất và điều kiện bảo quản về khả năng tồn tại của tế bào được đề cập trong Bảng 9.8.
Các thông số sản xuất là điểm kiểm tra đầu tiên trong việc đảm bảo tính bền vững của probiotic và kết thúc trong việc bảo quản sản phẩm trước khi tiêu thụ. Nó bắt đầu từ việc lựa chọn chủng chính xác để thoát khỏi các điều kiện lên men và bảo quản như pH, oxy phân tử và nhiệt độ, rã đông, các quá trình hạ nhiệt như sấy khô và ly tâm, khả năng tương thích với môi trường tăng trưởng, các sản phẩm phụ độc hại, cạnh tranh với các sinh vật khác và vật liệu và điều kiện đóng gói (Lacroix và Yildirim 2007; Tripathi và Giri 2014). Các tiêu chí sản xuất và bảo quản trong môi trường xung quanh là điều bắt buộc đối với khả năng tồn tại của tế bào và hiệu quả điều trị.
Ảnh hưởng của các điều kiện đường ruột đến khả năng tồn tại của probiotic đi đôi với sự phát triển của dạng bào chế. Điều này được thảo luận trong phần tiếp theo liên quan đến probiotic và các dạng bào chế khác nhau cho AD.
Bảng 9.8 Các yếu tố và ảnh hưởng đến khả năng tồn tại của chủng probiotic
| Thông số / điều kiện |
Ảnh hưởng đến khả năng tồn tại của tế bào |
Ví dụ | Tài liệu |
| Lựa chọn chủng đúng | Cần đảm bảo an toàn (bằng chứng lâm sàng và dữ liệu về lợi ích sức khỏe), khả năng sống trong cơ thể, tính tương thích, đặc điểm cảm quan thích hợp, chịu được các thông số lên men, thời gian lên men ngắn và chi phí thấp | Axit axetic được sản xuất bởi Bifidobacterium spp. ảnh hưởng đến vị giác cùng với việc giảm độ pH và ảnh hưởng đến khả năng tồn tại của các tế bào khác | Tuorila và Cardello (2002) |
| pH và tính axit | Độ pH thấp do sự hình thành axit hữu cơ không phân ly, ưa béo và sự xâm nhập của chúng trong tế bào, làm gián đoạn sự trao đổi chất của tế bào và ảnh hưởng đến khả năng tồn tại của chúng | Độ pH tối ưu đối với L. acidophilus là 5,5–6,0 và đối với Bifidobacterium là 6,0–7,0. Tình trạng axit của nước ép việt quất không thể duy trì cả hai loài này |
De Vuyst (2000), Sheehan et al. (2007) |
| Oxy phân tử | Tế bào bị ảnh hưởng bởi các nồng độ oxy khác nhau, cũng có thể gây ra peroxide và hình thành gốc tự do từ lipid dẫn đến chết tế bào | Lactobacilli có khả năng chịu oxy cao hơn Bifidobacteria một chút | Tamime et al. (2005), Lee và Salminen (2008), |
| Nhiệt độ | Nhiệt độ lên men cao làm vỡ tế bào. Nhiệt độ thấp duy trì khả năng sống của tế bào trong quá trình bảo quản | Nhiệt độ lên men tối ưu và điều kiện bảo quản tương ứng từ 37 – 43oC và từ 2 đến 5oC. L. acidophilus khả năng sống sót cao nhất ở 2oC |
Lee and Salminen (2008), Xiao et al. (2014) |
| Thực hiện rã đông | Sức ép cơ học của nước đá trong quá trình đóng băng có thể gây ra sự phá vỡ thành tế bào do sự ngưng tụ của chất hòa tan hoặc làm tế bào bị mất nước. Sự tan chảy gây ra stress hóa học như sự thay đổi mức độ thẩm thấu, ion hydro, oxy và các thành phần gây độc khác trong môi trường |
Các chủng vi khuẩn L. rhamnosus GG chịu được rã đông đã được phát triển bằng cách sử dụng giải trình tự bộ gen | Jay (1992), Kwon et al. (2018) |
| Quá trình làm khô | Sấy khô ảnh hưởng đến khả năng tồn tại của tế bào do nhiệt độ làm việc cao, áp suất thẩm thấu và sức ép cơ học. Đông khô là phương pháp ưa thích nhất | Bifidobacteria cho thấy khả năng tồn tại thay đổi tùy thuộc vào kiểu nguyên tử hoá, áp suất không khí và nhiệt độ đầu ra được sử dụng trong quá trình sấy khô | Champa and Møllgaard (2008) |
| Vật liệu và điều kiện đóng gói | Khả năng sống của tế bào bị ảnh hưởng nếu sản phẩm chứa các tế bào kỵ khí bị thấm oxy. Độ thấm phụ thuộc vào độ dày của vật liệu (thủy tinh hoặc nhựa) và các thành phần sản xuất của chúng |
Các tế bào Lactobacilli và Bifidobacteria giảm số lượng do hàm lượng oxy cao trong sản phẩm
|
Talwalkar and Kailasapa (2004) |
Hình thức phân phối Probiotics
Hình thức phân phối thông thường
Liệu pháp probiotic như một phương pháp điều trị bệnh viêm da cơ địa dị ứng đang tăng trong những năm gần đây. Không thể phủ nhận, do tình trạng bệnh chàm xuất hiện ngày càng nhiều và không có phương pháp chữa trị dứt điểm, bệnh nhân và bậc cha mẹ thường tìm đến các phương pháp điều trị hỗ trợ và thay thế thuốc khi họ không hài lòng với tác dụng phụ của thuốc chữa bệnh dị ứng (Astin 1998).
Nhiều hình thức khác nhau đã được phát triển để vận chuyển probiotic, bao gồm cả hệ thống probiotic thông thường và không thông thường. Probiotic thông thường bao gồm dạng bào chế dạng lỏng, viên nang, gói và viên nén có liều lượng (Bảng 9.9), trong khi sữa, thịt, sữa đông và pho mát là những probiotic không thông thường nổi tiếng đã có sẵn trên thị trường. Một số lượng lớn các nghiên cứu đã khám phá hiệu quả tiềm năng của probiotic và chứng minh probiotic rất hữu ích để điều trị viêm da cơ địa
dị ứng (Pessi và cộng sự 2000; Matsumoto và cộng sự 2007; Batc started et al. 2010). Báo cáo nghiên cứu của Wickens et al. (2012) chỉ ra rằng Lactobacillus rhamnosus GG (LGG) là dòng probiotic được nghiên cứu thường xuyên nhất và rất hữu ích để điều trị viêm da cơ địa dị ứng. Sử dụng Bifidobacterium breve M-16V và B. longum BB536 trong khoảng thời gian từ 6-18 tháng cho trẻ bị AD từ trung bình đến nặng làm giảm tỷ lệ mắc AD như đã kết luận trong một nghiên cứu do Enomoto et al. (2014). Ngoài ra, hỗn hợp bổ sung prebiotics và probiotics bằng cách dùng thông thường cho thấy kết quả tốt chống lại AD (Foolad và Armstrong 2014; Astin 1998; Goosystem et al. 2014).
Hình thức phân phối có kiểm soát
Việc đạt được tỷ lệ, số lượng và vị trí tối ưu bằng cách sử dụng các hình thức phân phối được kiểm soát hoặc nhắm mục tiêu là chiến lược hiệu quả nhất thay vì tăng cường khả năng hấp thụ / thâm nhập theo phương pháp thông thường. Dưới đây là giải thích về một số phương pháp cung cấp probiotic có kiểm soát được phát triển để điều trị AD.
Bao viên nang
Đây là hình thức phổ biến và nổi tiếng nhất để phân phối probiotics có kiểm soát. Bao viên nang là một quá trình trong đó một lớp vật liệu phủ được bao trên vật liệu lõi, tốt nhất là một gốc hoạt động được mắc trong các phân tử chất mang. Đây là phương pháp được sử dụng phổ biến nhất trong công thức có chứa vi sinh vật. Động cơ phương pháp này là cung cấp sự bảo vệ và bảo quản hoàn hảo các chủng vi khuẩn bằng cách ức chế tiếp xúc với các yếu tố bên ngoài như nhiệt, oxy, độ ẩm, bức xạ, v.v … Việc điều chỉnh cấu hình giải phóng cũng có thể đạt được bằng cách bao viên nang. Việc hạn chế sự nhân lên của vi khuẩn trong hình thức vận chuyển được thực hiện bằng quá trình bao viên nang (Maria Chavarri et al. 2012). Có nhiều cách bao viên nang khác nhau như:
(a) Loại chứa (lõi hoạt động được bao quanh bởi vật liệu phủ, ví dụ, vi bao
nang).
(b) Loại chất nền (vật liệu hoạt tính được nhúng trong chất nền của vật liệu phủ, ví dụ, hydrogel).
(c) Chất nền được bao phủ (sự kết hợp của các loại đã đề cập ở trên).
Có nhiều cách để bao viên nang. Tùy thuộc vào vật liệu hoạt động, điều kiện chế biến và vị trí nhắm mục tiêu, loại bao nang và vật liệu để bao nang, phương pháp sản xuất thường thay đổi. Các phương pháp thường được sử dụng trong trường hợp probiotics là nhũ tương, ép đùn, sấy khô (dạng chất nền của vi bao nang), phun phủ và hệ số xâm nhập (loại chứa vi nang) (Solanki và cộng sự 2013).
Lựa chọn vật liệu bao viên nang đóng một vai trò quan trọng trong việc bảo quản chủng vi khuẩn trong quá trình sử dụng cũng như trong quá trình bảo quản. Một số vật liệu sinh học thường được sử dụng cho mục đích bao viên nang là alginate, chitosan, gellan và xanthan gum (Hood và Zottola 1988).
Các vật liệu bao phủ gốc protein khác nhau cũng được sử dụng trong bao viên nang như gelatin, bột sữa và whey protein. Bột sữa là vật liệu phủ phổ biến nhất được sử dụng cho các công thức dành cho trẻ sơ sinh vì nó giúp dễ dàng vận chuyển và tránh bất kỳ biến chứng nào. Một số vật liệu bao viên nang tổng hợp cũng được sử dụng như phthalate cellulose acetate (CAP) cho thấy sự giải phóng probiotics qua đường ruột, hỗ trợ hoạt động mục tiêu của chúng.
Bao vi nang
Vận chuyển probiotics bằng đường uống thường là một việc mệt mỏi chủ yếu do sự thiếu bền vững của việc nuôi cấy vi khuẩn trong môi trường dạ dày. Sự thay đổi mạnh về độ pH, các hoạt động khắc nghiệt của enzym và chuyển động của nhu động ảnh hưởng xấu đến khả năng tồn tại của vi sinh vật. Bao vi nang đóng một vai trò quan trọng trong việc giải quyết những vấn đề này; cùng với đó, nó giúp đạt được nhiều mục tiêu khác như phân phối có mục tiêu, phân phối kết hợp đa chủng, v.v. Nhiều nghiên cứu khác nhau đã được thực hiện đối với bao vi nang vi khuẩn và sự kết hợp của chúng trong các công thức, và Bảng 9.10 liệt kê tất cả các công thức như vậy.
Bảng 9.10 Chế phẩm sinh học vi bao trong điều trị viêm da dị ứng
| Chủng vi khuẩn | Phương pháp sử dụng | Tài liệu |
| Bifidobacterium breve | Bao vi nang được thực hiện bằng sử dụng chitosan và alginate. Bột khô tiếp tục được thu được bằng máy sấy tầng (FBD). So sánh khả năng tồn tại của vi sinh đối với lô sấy khô không FBD và lô sấy khô FBD, cả hai thử nghiệm đều cho thấy khả năng tồn tại tương tự | Cook et al. (2011) |
| Lactobacillus acidophilus | Quá trình bao viên nang được thực hiện bằng sử dụng alginate và xanthan gum. Sự ổn định chống lại sự thay đổi pH được ghi nhận ở pH dạ dày |
Kim et al. (2008) |
| L. rhamnosus, B. longum, L. salivarius, L. plantarum, L. acidophilus, L. paracasei, B. lactis loại Bl-O4 và B. lactis loại Bi-07 |
Bao vi bao được thực hiện bằng sử dụng alginate bằng phương pháp nhũ tương, trong đó dầu cọ và poly-L-lysine được sử dụng làm vật liệu phủ. Các chủng vi khuẩn được đóng gói được cho là có độ ổn định tuyệt vời trong pH dạ dày và pH mật | Ding and Shah (2009) |
Đông khô
Đông khô là một quá trình khử nước thường được thực hiện trong điều kiện nhiệt độ và áp suất thấp. Đây là phương pháp ưa thích nhất đối với các chất không bền với nhiệt như protein, tế bào, sản phẩm sinh học, v.v. Đây là một quá trình được sử dụng rộng rãi vì mất nước giúp bảo toàn khả năng tồn tại của các hoạt chất và cải thiện tính chất chảy tự do của bột và tính ổn định của sản phẩm. Các sản phẩm đông khô này có thể được phân phối như các sản phẩm giải phóng thông thường cũng như các sản phẩm giải phóng đã điều chỉnh. Nhiều công thức xem xét các chủng khác nhau đã được bào chế và kiểm tra tính hiệu quả của chúng. Danh sách chi tiết của các công thức này được đưa ra trong Bảng 9.11.
Các dạng bào chế đông khô có liều lượng thường được dùng dưới dạng bột để pha dưới dạng hỗn dịch uống. Do khả năng tồn tại của các chủng kém cũng như do môi trường không thuận lợi của đường tiêu hóa, tần suất sử dụng các probiotics này là hai lần mỗi ngày. Nhiều lần, các kỹ thuật đông khô và bao vi nang được kết hợp với nhau để phục hồi tốt hơn hiệu quả và khả năng tồn tại của các chủng vi khuẩn.
Bảng 9.11 Làm đông khô vi khuẩn để điều trị AD
| Chủng vi khuẩn | Phương pháp sử dụng | Tài liệu |
| Nhiều chủng vi khuẩn gồm L. rhamnosus, S. thermophilus, B. breve, L. acidophilus, B. Infantis |
Đông khô cùng với fructooligosaccharide và phân phối trong các gói | Farid et al. (2011) |
| L. fermentum VRI003 được sử dụng vì ưu thế của nó là giảm đáng kể AD |
Quá trình đông khô được thực hiện bằng cách sử dụng chất bảo vệ lạnh như maltodextrin. Được hoàn nguyên dưới dạng hỗn dịch uống để pha trong 5-10 mL nước/sữa |
Weston (2005) et al. |
| L. rhamnosus 19070-2, L. reuteri DSM 12246 | Các chủng vi khuẩn đã được kiểm tra sự bám dính niêm mạc của nó vào thành ruột trước khi đông khô. Quá trình đông khô được thực hiện bằng cách sử dụng chất bảo vệ lạnh 1010 CFU/ g |
Rosenfeldt (2004) et al. |
| Bốn chủng vi khuẩn được kết hợp dựa trên nghiên cứu về rối loạn vi khuẩn ở AD. L. rhamnosus với plantarus, lactis và casei |
Có những chủng được nuôi cấy trong môi trường cazein, glucose và lactoza được thuỷ phân bằng enzym ở một lượng cố định nhất định ở 37oC. Được bao với protein và polysaccharide và đông khô | Yim et al. (2006) |
Hạn chế của việc phân phối probiotic
Mặc dù probiotic có nhiều lợi ích về sức khỏe, nhưng vẫn có một số hạn chế cố hữu trong các ứng dụng của chúng, được cho là do bản chất không ổn định của chúng, các mối quan tâm nhất định về an toàn và thiếu định mức quy định (Verna và Lucak 2010). Probiotics rất nhạy cảm với các yếu tố môi trường như nhiệt độ, độ ẩm, oxy, v.v. Ngoài ra, khả năng tồn tại của chúng có thể thay đổi theo loại chủng, oxy phân tử, thay đổi pH, chất phụ gia, quá trình làm khô và rã đông và có thể cần chú ý đặc biệt trong quá trình chế biến và đóng gói và cho đến thời hạn sử dụng (Cheng và cộng sự 2019).
Probiotics, nhạy cảm với pH dạ dày, phải đối mặt với rào cản chính là bị phân hủy bởi môi trường dạ dày khắc nghiệt trước khi đến ruột để tạo ra hiệu quả điều trị. Do đó, các công thức được phát triển bằng cách sử dụng các polyme bao bọc, kháng dạ dày, trong đó tính tương thích đặt ra một vấn đề quan trọng. Lý tưởng nhất là các vi sinh vật có thể tồn tại, bám dính và sau đó cư trú để tạo ra các hoạt động điều trị. Tuy nhiên, một số enzym tiêu hóa như protease, lipase và amylase có thể ảnh hưởng đến khả năng tồn tại của chúng. Cùng với độ pH có tính axit và các enzym tiêu hóa, probiotics cũng phải tồn tại với lysozyme, axit mật và các vi sinh vật khác trong cơ thể, thách thức số lượng tế bào sống sót để đến được ruột non (Sotoudegan et al. 2019).
Các công thức probiotics đông khô rất hữu ích trong việc cải thiện độ ổn định, nhưng cần phải cẩn thận trong quá trình chế biến các sản phẩm đông khô để khả năng tồn tại của vi khuẩn không bị thay đổi. Mặc dù chất bảo vệ lạnh có thể được sử dụng để tránh các vấn đề phát sinh từ các điều kiện khắc nghiệt của quá trình đông khô, nhưng loại chất bảo vệ lạnh quyết định khả năng tồn tại, điều kiện bảo quản và thời hạn sử dụng của sản phẩm. Theo truyền thống, lactose đã được sử dụng rộng rãi như một chất bảo vệ lạnh; tuy nhiên, tác dụng của lactose chỉ tồn tại trong thời gian ngắn với khả năng tồn tại của vi khuẩn giảm sau vài tháng sản xuất. Các tá dược tương tự như axit ascorbic có hiệu quả hơn để bảo vệ khả năng tồn tại của vi khuẩn; do đó, sự kết hợp của lactose và axit ascorbic có thể được sử dụng như là sự kết hợp (Gohesia et al. 2014).
Tính an toàn của probiotic phải được đánh giá một cách có hệ thống liên quan đến khả năng gây bệnh, độc lực, các hoạt động chuyển hóa, thông tin độc tính, v.v. Rủi ro liên quan đến liệu pháp probiotic có liên quan đến các mối quan tâm về an toàn ở những người bị tổn thương hệ miễn dịch (phụ nữ có thai, người cao tuổi) và bệnh nhân nặng, nằm viện. (Ayichew et al. 2017). Probiotics có khả năng tương tác với vi khuẩn hội sinh và tác động tích cực hoặc tiêu cực. Vì vậy, việc tìm hiểu cơ chế hoạt động của probiotic là một thách thức lớn. Hơn nữa, các công thức probiotic kết hợp có bán trên thị trường, trong đó việc làm sáng tỏ lợi ích sức khỏe liên quan đến từng chủng vi sinh vật là không rõ ràng và mức độ hấp thụ của nó cũng là một yếu tố hạn chế.
Probiotics được phân loại dưới nhiều danh mục khác nhau ở các quốc gia khác nhau như thực phẩm bổ sung, thực phẩm chức năng, chất dinh dưỡng, tác nhân trị liệu sinh học sống và ở một số quốc gia được coi là thuốc. Do đó, việc phân loại probiotic phổ biến là một yêu cầu thiết yếu trên toàn cầu. Là một sản phẩm bổ sung, không có tiêu chuẩn quy định nghiêm ngặt đối với probiotic giống như thuốc điều trị và các yêu cầu quy định của probiotic thay đổi theo quốc gia. Do đó, một khuôn khổ quy định
được xác định rõ ràng là rất cần thiết để quản lý lĩnh vực mới nổi này và đạt được sự phù hợp quy định tốt hơn đối với các vấn đề về an toàn, hiệu quả và ghi nhãn của chúng (Kothari và cộng sự 2019).
Xu hướng tương lai và kết luận
Việc thực hành bổ sung vi sinh đường ruột và cách sử dụng probiotic trong viêm da cơ địa dị ứng có thể được bắt nguồn từ đầu thế kỷ XX. Nghiên cứu trong lĩnh vực bổ sung probiotic đã tăng cường đáng kể trong thập kỷ qua với hơn 5000 bài báo, nêu rõ các ứng dụng và hệ thống phân phối tiếp theo của chúng để tạo điều kiện cho các tác dụng thúc đẩy sức khỏe.
Probiotics không chỉ được khuyến khích tích cực vì những lợi ích tăng cường sức khỏe bằng cách bình thường hóa hệ vi sinh vật, mà chúng còn được sử dụng rộng rãi để chữa một số biểu hiện lâm sàng bao gồm AD. Có rất nhiều thử nghiệm lâm sàng và dữ liệu tương ứng của nó xác nhận khả năng của vi khuẩn probiotic để sửa đổi chứng viêm dị ứng và thiết lập sự cân bằng trong hệ vi khuẩn đường ruột. Thêm vào đó, có bằng chứng mới nổi cho thấy probiotic là những tiên phong chính trong việc điều chỉnh và nâng cấp hệ thống miễn dịch.
Để giải quyết những hạn chế chính của probiotic, tính ổn định và khả năng tồn tại của chúng, cần có một số tiến bộ liên quan đến công thức và phát triển công nghệ. Cải tiến công nghệ sẽ dẫn đến sản phẩm probiotic ổn định có thể cung cấp đủ lượng vi sinh vật tại vị trí được nhắm mục tiêu. Ngoài khía cạnh công thức, các kỹ thuật phân tích phức tạp được yêu cầu phải được phát triển để có thể phân tích các chủng probiotic có thể sống được trên lâm sàng để thiết lập tính an toàn và hiệu quả của chúng. Ngoài ra, vật liệu đóng gói có thể được nghiên cứu và ứng biến để bảo vệ đầy đủ vi khuẩn để có khả năng tồn tại và hoạt động lâu dài trong suốt thời hạn sử dụng.
Trong tương lai, việc làm sáng tỏ một cách chi tiết và có hệ thống về cơ chế hoạt động của probiotic không chỉ giúp phân phối probiotic cụ thể hơn mà còn tạo điều kiện để khám phá các đường dùng mới. Các cơ chế cấp phân tử của probiotic đã được nghiên cứu gần đây có thể dẫn đến các sản phẩm probiotic biến đổi gen trong tương lai.
Ngoài ra, synbiotics là một cách tiếp cận sắp tới trong lĩnh vực này, trong đó sự kết hợp của prebiotic và probiotic đã được khuyến nghị. Prebiotics được phân loại thành các loại chất xơ khác nhau, cung cấp thức ăn cho hệ vi sinh vật đường ruột và giúp nuôi dưỡng sự phát triển của chúng. Sự kết hợp của prebiotic và probiotic hoạt
động hiệp đồng để cải thiện hệ vi sinh đường ruột. Mặc dù rất ít sản phẩm synbiotics được thương mại hóa, nhưng không có bằng chứng nào có sẵn cho các nghiên cứu lâm sàng và cần được điều tra chi tiết. Vì vậy, synbiotics có thể là một lựa chọn rất tốt để điều trị AD.
Toàn bộ trọng tâm của việc phân phối probiotic được tập trung vào việc sử dụng probiotic dưới dạng công thức hiệu quả nhất, trong đó vi khuẩn vẫn tồn tại trong suốt quá trình của nó trong cơ thể và có khả năng thực hiện các hành động điều trị mà không bị suy giảm.
Do đó, các nghiên cứu được báo cáo và kết quả của chúng rất khuyến khích việc sử dụng probiotic ở AD. Probiotics rất hữu ích trong việc cải thiện tình trạng da và giảm chỉ số SCORAD của AD. Mặc dù các thử nghiệm lâm sàng đối với probiotic được tiến hành trên quần thể bị AD, việc mở rộng nghiên cứu lâm sàng vẫn không đủ để chứng minh hiệu quả điều trị và tính an toàn của chúng một cách toàn diện. Do đó, sau khi có bằng chứng lâm sàng đáng kể, liệu pháp probiotic có thể được sử dụng một mình hoặc kết hợp với các liệu pháp đầu tay cho AD trong tương lai.
Tài liệu tham khảo
- Abrahamsson TR, Jakobsson HE, Andersson AF, Björkstén B, Engstrand L, Jenmalm MC (2012) Low diversity of the gut microbiota in infants with atopic eczema. J Allergy Clin Immunol 129 (2):434–440. https://doi.org/10.1016/j.jaci.2011.10.025
- Akdis M (2006) Healthy immune response to allergens: T regulatory cells and more. Curr Opin Immunol 18(6):738–744
- Akiyama T, Carstens M, Carstens E (2011) Transmitters and pathways mediating inhibition of spinal itch-signaling neurons by scratching and other counterstimuli. PLoS One 6(7):e22665. https://doi.org/10.1371/journal.pone.0022665
- Arck PC, Slominski A, Theoharides TC, Peters EMJ, Paus R (2006) Neuroimmunology of stress: skin takes center stage. J Investig Dermatol 126(8):1697–1704. https://doi.org/10.1038/sj.jid. 5700104
- Arndt J, Smith N, Tausk F (2008) Stress and atopic dermatitis. Curr Allergy Asthma Rep 8 (4):312– 317 Astin JA (1998) Why patients use alternative medicine: results of a national study. JAMA 279 (19):1548–1553. https://doi.org/10.1001/jama.279.19.1548
- Ayichew T, Belete A, Alebachew T, Tsehaye H, Berhanu H, Minwuyelet A (2017). Bacterial probiotics their importances and limitations: a review 4(2). https://doi.org/10.15744/2393-9060. 4.202
- Baba H, Masuyama A, Takano T (2006) Short communication: effects of Lactobacillus helveticusfermented milk on the differentiation of cultured normal human epidermal keratinocytes. J Dairy Sci 89(6):2072–2075. https://doi.org/10.3168/jds.S0022-0302(06)72275-5
- Bäckhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI (2005) Host-bacterial mutualism in the human intestine. Science 307(5717):1915–1920
- Baldassarre ME, Palladino V, Amoruso A, Pindinelli S, Mastromarino P, Fanelli M et al (2018) Rationale of probiotic supplementation during pregnancy and neonatal period. Nutrients 10 (11):1693. https://doi.org/10.3390/nu10111693
- Barbarot S, Auziere S, Gadkari A, Girolomoni G, Puig L, Simpson EL et al (2018) Epidemiology of atopic dermatitis in adults: results from an international survey. Allergy 73(6):1284–1293
- Barton SJ, Ngo S, Costello P, Garratt E, El-Heis S, Antoun E et al (2017) DNA methylation of Th2 lineage determination genes at birth is associated with allergic outcomes in childhood. Clin Exp Allergy 47(12):1599–1608
- Batchelor JM, Grindlay DJC, Williams HC (2010) What’s new in atopic eczema? An analysis of systematic reviews published in 2008 and 2009. Clin Exp Dermatol 35(8):823–827. https://doi. org/10.1111/j.1365-2230.2010.03901.x; quiz 827–828
- Berke R, Singh A, Guralnick M (2012) Atopic dermatitis: an overview. Am Fam Physician 86 (1):35– 42 Bieber T, Nestle F (2015) Personalized treatment options in dermatology. Springer, Berlin, pp 1– 146. https://doi.org/10.1007/978-3-662-45840-2
- Bin L, Leung DY (2016) Genetic and epigenetic studies of atopic dermatitis. Allergy Asthma Clin Immunol 12(1):52
- Blanchet-Réthoré S, Bourdès V, Mercenier A, Haddar CH, Verhoeven PO, Andres P (2017) Effect of a lotion containing the heat-treated probiotic strain Lactobacillus johnsonii NCC 533 on Staphylococcus aureus colonization in atopic dermatitis. Clin Cosmet Investig Dermatol 10:249–257. https://doi.org/10.2147/CCID.S135529
- Bouilly-Gauthier D, Jeannes C, Maubert Y, Duteil L, Queille-Roussel C, Piccardi N et al (2010) Clinical evidence of benefits of a dietary supplement containing probiotic and carotenoids on ultraviolet-induced skin damage. Br J Dermatol 163(3):536–543. https://doi.org/10.1111/j. 1365- 2133.2010.09888.
- Braham SJ, Pugashetti R, Koo J, Maibach HI (2010) Occlusive therapy in atopic dermatitis: overview. J Dermatolog Treat 21:62–72
- Byrd AL, Deming C, Cassidy SKB et al (2017) Staphylococcus aureus and Staphylococcus epidermidis strain diversity underlying pediatric atopic dermatitis. Sci Transl Med 9(397): eaal4651
- Chamlin SL, Frieden IJ, Fowler A, Williams M, Kao J, Sheu M, Elias PM (2001) Ceramidedominant, barrier-repair lipids improve childhood atopic dermatitis. Arch Dermatol 137 (8):1110–1112
- Champagne CP, Møllgaard H (2008) Production of probiotic cultures and their addition in fermented foods. In: Handbook of fermented functional foods, Second Edition.
- CRC Press, Boca Raton Chang YS, Trivedi MK, Jha A, Lin YF, Dimaano L, García-Romero MT (2016) Synbiotics for prevention and treatment of atopic dermatitis: a meta-analysis of randomized clinical trials. JAMA Pediatr 170(3):236–242. https://doi.org/10.1001/jamapediatrics.2015.3943
- Chen YH, Wu CS, Chao YH, Lin CC, Tsai HY, Li YR et al (2017) Lactobacillus pentosus GMNL- 77 inhibits skin lesions in imiquimod-induced psoriasis-like mice. J Food Drug Anal 25 (3):559–566. https://doi.org/10.1016/j.jfda.2016.06.003
- Cheng D, Song J, Xie M, Song D (2019) The bidirectional relationship between host physiology and microbiota and health benefits of probiotics: a review. Trends Food Sci Technol 91:426–435. https://doi.org/10.1016/j.tifs.2019.07.044
- Choi JE, Di Nardo A (2018) Skin neurogenic inflammation. Semin Immunopathol 40(3):249–259. https://doi.org/10.1007/s00281-018-0675-z
- Choi WJ, Konkit M, Kim Y, Kim MK, Kim W (2016) Oral administration of Lactococcus chungangensis inhibits 2,4-dinitrochlorobenzene-induced atopic-like dermatitis in NC/Nga mice. J Dairy Sci 99(9):6889–6901. https://doi.org/10.3168/jds.2016-11301
- Cook MT, Tzortzis G, Charalampopoulos D, Khutoryanskiy VV (2011) Production and evaluation of dry alginate–chitosan microcapsules as an enteric delivery vehicle for probiotic bacteria. Biomacromolecules 12:2834–2840
- Cook MT, Tzortzis G, Charalampopoulos D, Khutoryanskiy VV (2012) Microencapsulation of probiotics for gastrointestinal delivery. J Control Release 162(1):56–67
- Cryan JF, Dinan TG (2012) Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nat Rev Neurosci 13(10):701–712. https://doi.org/10.1038/nrn3346
- Danino T, Prindle A, Kwong GA, Skalak M, Li H, Allen K et al (2015) Programmable probiotics for detection of cancer in urine. Sci Transl Med 7(289):289ra84. https://doi.org/10.1126/ scitranslmed.aaa3519
- Darsow U, Wollenberg A, Simon D, Taïeb A, Werfel T, Oranje A et al (2010) ETFAD/EADV eczema task force 2009 position paper on diagnosis and treatment of atopic dermatitis. J Eur Acad Dermatol Venereol 24(3):317–328
- De Benedetto A, Agnihothri R, McGirt LY, Bankova LG, Beck LA (2009) Atopic dermatitis: a disease caused by innate immune defects? J Invest Dermatol 129(1):14–30. https://doi.org/10. 1038/jid.2008.259. PMID: 19078985
- De Vuyst L (2000) Technology aspects related to the application of functional starter cultures. Food Technol Biotechnol 38(1):105–112 Devillers AC, Oranje AP (2012) Wet-wrap treatment in children with atopic dermatitis: a practical guideline. Pediatr Dermatol 29(1):24–27
- Devillers ACA, De Waard-van der Spek FB, Mulder PGH, Oranje AP (2002) Treatment of refractory atopic dermatitis using ‘wet-wrap’ dressings and diluted corticosteroids: results of standardized treatment in both children and adults. Dermatology 204(1):50–55
- Ding WK, Shah NP (2009) An improved method of microencapsulation of probiotic bacteria for their stability in acidic and bile conditions during storage. J Food Sci 74(2):M53–M61
- Drago L, Iemoli E, Rodighiero V, Nicola L, De Vecchi E, Piconi S (2011) Effects of Lactobacillus Salivarius LS01 (DSM 22775) treatment on adult atopic dermatitis: a randomized placebocontrolled study. Int J Immunopathol Pharmacol 24(4):1037–1048. https://doi.org/10.1177/ 039463201102400421
- Eberlein B, Eicke C, Reinhardt HW, Ring J (2008) Adjuvant treatment of atopic eczema: assessment of an emollient containing N-palmitoylethanolamine (ATOPA study). J Eur Acad Dermatol Venereol 22(1):73–82
- Eisenberg DM, Davis RB, Ettner SL, Appel S, Wilkey S, Van Rompay M et al (1998) Trends in alternative medicine use in the United States. J Am Med Assoc 280:1569–1575
- Enomoto T, Sowa M, Nishimori K, Shimazu S, Yoshida A, Yamada K et al (2014) Effects of bifidobacterial supplementation to pregnant women and infants in the prevention of allergy development in infants and on fecal microbiota. Allergol Int 63(4):575–585. https://doi.org/10. 2332/allergolint.13-OA-0683
- Farid R, Ahanchian H, Jabbari F, Moghiman T (2011) Effect of a new synbiotic mixture on atopic dermatitis in children: a randomized-controlled trial. Iran J Pediatr 21(2):225
Foolad N, Armstrong AW (2014) Prebiotics and probiotics: the prevention and reduction in severity of atopic dermatitis in children. Benefic Microbes 5(2):151–160. https://doi.org/10.3920/ BM2013.0034 - Fujimura KE, Sitarik AR, Havstad S, Lin DL, Levan S, Fadrosh D et al (2016) Neonatal gut microbiota associates with childhood multisensitized atopy and T cell differentiation. Nat Med 22(10):1187
- Furusawa Y, Obata Y, Fukuda S, Endo TA, Nakato G, Takahashi D et al (2013) Commensal microbe- derived butyrate induces the differentiation of colonic regulatory T cells. Nature 504 (7480):446
- Gao Z, Tseng CH, Pei Z, Blaser MJ (2007) Molecular analysis of human forearm superficial skin bacterial biota. Proc Natl Acad Sci U S A 104(8):2927–2932. https://doi.org/10.1073/pnas. 0607077104
- Gao Z, Tseng CH, Strober BE, Pei Z, Blaser MJ (2008) Substantial alterations of the cutaneous bacterial biota in psoriatic lesions. PLoS One 3(7):e2719. https://doi.org/10.1371/journal.pone. 0002719
- Gaspar NK, Aidé MK (2016) Atopic dermatitis: allergic dermatitis or neuroimmune dermatitis? An Bras Dermatol 91(4):479–488
- Gaucher F, Bonnassie S, Rabah H, Marchand P, Blanc P, Jeantet R, Jan G (2019) Review: adaptation of beneficial Propionibacteria, lactobacilli, and Bifidobacteria improves tolerance toward technological and digestive stresses. Front Microbiol 10:841. https://doi.org/10.3389/ fmicb.2019.00841
- Gisondi P, Girolomoni G (2016) Apremilast in the therapy of moderate-to-severe chronic plaque psoriasis. Drug Des Devel Ther 10:1763
- Gooderham MJ et al (2018) Dupilumab: a review of its use in the treatment of atopic dermatitis. J Am Acad Dermatol 78(3):S28–S36
- Gordon S (2008) Elie Metchnikoff: father of natural immunity. Eur J Immunol 38(12):3257–3264. https://doi.org/10.1002/eji.200838855
- Govender M, Choonara YE, Kumar P, du Toit LC, van Vuuren S, Pillay V (2014) A review of the advancements in probiotic delivery: conventional vs. non-conventional formulations for intestinal flora supplementation. AAPS PharmSciTech 15(1):29–43. https://doi.org/10.1208/s12249- 013- 0027-1
Green C, Colquitt JL, Kirby J, Davidson P (2005) Topical corticosteroids for atopic eczema: clinical and cost effectiveness of once-daily vs. more frequent use. Br J Dermatol 152(1):130–141. https://doi.org/10.1111/j.1365-2133.2005.06410.x - Greg J. McKenna, Göran B.G. Klintmalm (2015). Induction and Maintenance of Immunosuppression. Transplantation of the Liver 3: 1264–1288, https://doi.org/10.1016/B978-1-4557-0268-8. 00091-9.
- Grice EA, Segre JA (2011) The skin microbiome. Nat Rev Microbiol 9(4):244–253. https://doi.org/ 10.1038/nrmicro2537
- Grice EA, Kong HH, Renaud G, Young AC, Bouffard GG, Blakesley RW et al (2008) A diversity profile of the human skin microbiota. Genome Res 18(7):1043–1050. https://doi.org/10.1101/ gr.075549.107
- Groeger D, O’Mahony L, Murphy EF, Bourke JF, Dinan TG, Kiely B et al (2013) Bifidobacterium infantis 35624 modulates host inflammatory processes beyond the gut. Gut Microbes 4 (4):325–339. https://doi.org/10.4161/gmic.25487
- Grüber C, Wendt M, Sulser C, Lau S, Kulig M, Wahn U et al (2007) Randomized, placebocontrolled trial of Lactobacillus rhamnosus GG as treatment of atopic dermatitis in infancy. Allergy 62(11):1270–1276. https://doi.org/10.1111/j.1398-9995.2007.01543.x
- Gschwandtner M, Mildner M, Mlitz V, Gruber F, Eckhart L, Werfel T et al (2013) Histamine suppresses epidermal keratinocyte differentiation and impairs skin barrier function in a human skin model. Allergy 68(1):37–47
- Guéniche A, Hennino A, Goujon C, Dahel K, Bastien P, Martin R et al (2006) Improvement of atopic dermatitis skin symptoms by Vitreoscilla filiformis bacterial extract. Eur J Dermatol 16 (4):380–384
- Gueniche A, Benyacoub J, Blum S, Breton L, Castiel I (2009) Probiotics for skin benefits. In: Nutritional cosmetics. Elsevier, Amsterdam. https://doi.org/10.1016/B978-0-8155-2029-0. 50029-6
- Harper JI, Ahmed I, Barclay G, Lacour M, Hoeger P, Cork MJ et al (2000) Cyclosporin for severe childhood atopic dermatitis: short course versus continuous therapy. Br J Dermatol 142 (1):52–58
- Hawkes JE, Chan TC, Krueger JG (2017) Psoriasis pathogenesis and the development of novel targeted immune therapies. J Allergy Clin Immunol 140(3):645–653. https://doi.org/10.1016/j. jaci.2017.07.004
- Hedman-Lagerlöf E, Bergman A, Lindefors N, Bradley M (2019) Exposure-based cognitive behavior therapy for atopic dermatitis: an open trial. Cogn Behav Ther 48(4):300–310
- Heine G, Hoefer N, Franke A, Nöthling U, Schumann RR, Hamann L, WormM(2013) Association of vitamin D receptor gene polymorphisms with severe atopic dermatitis in adults. Br J Dermatol 168(4):855–858
- Henry E, Li X-m (2016) Traditional Chinese medicine, Western science, and the fight against allergic disease. World Scientific, Singapore
- Hirata F, Schiffmann E, Venkatasubramanian K, Salomon D, Axelrod J (1980) A phospholipase A2 inhibitory protein in rabbit neutrophils induced by glucocorticoids. Proc Natl Acad Sci U S A 77 (5):2533–2536. https://doi.org/10.1073/pnas.77.5.2533
- Hoare C, Po ALW, Williams H (2000) Systematic review of treatments for atopic eczema. Health Technol Assess 4(37):1–191
- Holowacz S, Blondeau C, Guinobert I, Guilbot A, Hidalgo S, Bisson JF (2018) Lactobacillus salivarius LA307 and Lactobacillus rhamnosus LA305 attenuate skin inflammation in mice. Benef Microbes 9(2):299–309. https://doi.org/10.3920/BM2017.0084
- Holz C, Benning J, Schaudt M, Heilmann A, Schultchen J, Goelling D, Lang C (2017) Novel bioactive from Lactobacillus brevis DSM17250 to stimulate the growth of Staphylococcus epidermidis: a pilot study. Benefic Microbes 8(1):121–131. https://doi.org/10.3920/BM2016. 0073
- Hood SK, Zottola EA (1988) Effect of low pH on the ability of Lactobacillus-acidophilus to survive and adhere to human intestinal cells. J Food Sci 53(5):1514–1516 Horne DJ, White AE, Varigos GA (1989) A preliminary study of psychological therapy in the management of atopic eczema. Br J Med Psychol 62(3):241–248
- Huang JT, Abrams M, Tlougan B, Rademaker A, Paller AS (2009) Treatment of Staphylococcus aureus colonization in atopic dermatitis decreases disease severity. Pediatrics 123(5):e808–e814
- Huang R, Ning H, Shen M, Li J, Zhang J, Chen X (2017a) Probiotics for the treatment of atopic dermatitis in children: a systematic review and meta-analysis of randomized controlled trials. Front Cell Infect Microbiol 7:392. https://doi.org/10.3389/fcimb.2017.00392
- Huang YJ, Marsland BJ, Bunyavanich S, O’Mahony L, Leung DYM, Muraro A, Fleisher TA (2017b) The microbiome in allergic disease: current understanding and future opportunities— 2017 PRACTALL document of the American Academy of Allergy, Asthma & Immunology and the European Academy of Allergy and Clinical Immunology. J Allergy Clin Immunol 139 (4):1099– 1110. https://doi.org/10.1016/j.jaci.2017.02.007
- Huseini HF, Rahimzadeh G, Fazeli MR, Mehrazma M, Salehi M (2012) Evaluation of wound healing activities of kefir products. Burns 38(5):719–723. https://doi.org/10.1016/j.burns.2011. 12.005
- Huttenhower C, Gevers D, Knight R, Abubucker S, Badger JH, Chinwalla AT et al (2012) Structure, function and diversity of the healthy human microbiome. Nature 486 (7402):207–214. https://doi.org/10.1038/nature11234
- Im AR, Kim HS, Hyun JW, Chae S (2016) Potential for tyndalized Lactobacillus acidophilus as an effective component in moisturizing skin and anti-wrinkle products. Exp Ther Med 12 (2):759–764. https://doi.org/10.3892/etm.2016.3406
- Inoue Y, Kambara T, Murata N, Komori-Yamaguchi J, Matsukura S, Takahashi Y et al (2014) Effects of oral administration of lactobacillus acidophilus l-92 on the symptoms and serum cytokines of atopic dermatitis in Japanese adults: a double-blind, randomized, clinical trial. Int Arch Allergy Immunol 165(4):247–254. https://doi.org/10.1159/000369806
- Iravani S, Korbekandi H, Mirmohammadi SV (2015) Technology and potential applications of probiotic encapsulation in fermented milk products. J Food Sci Technol 52(8):4679–4696. https://doi.org/10.1007/s13197-014-1516-2
- Isenberg JSS, Ridnour LA, Espey MG, Wink DA, Roberts DD (2005) Nitric oxide in woundhealing. Microsurgery 25(5):442–451. https://doi.org/10.1002/micr.20168
Isolauri E, Arvola T, SUtas Y, Moilanen E, Salminen S (2000) Probiotics in the management of atopic eczema. Clin Exp Allergy 30(11):1605–1610. https://doi.org/10.1046/j.1365-2222.2000. 00943.x - Jariwala SP, Abrams E, Benson A, Fodeman J, Zheng T (2011) The role of thymic stromal lymphopoietin in the immunopathogenesis of atopic dermatitis. Clin Exp Allergy 41 (11):1515–1520
- Jay JM (1992) Modern food microbiology. Springer, Cham. https://doi.org/10.1007/978-94-011- 6480-1
- Jin UH, Lee SO, Sridharan G, Lee K, Davidson LA, Jayaraman A et al (2014) Microbiome-derived tryptophan metabolites and their aryl hydrocarbon receptor-dependent agonist and antagonist activities. Mol Pharmacol 85(5):777–788. https://doi.org/10.1124/mol.113.091165
- Johnson CC, Ownby DR (2017) The infant gut bacterial microbiota and risk of pediatric asthma and allergic diseases. Transl Res 179:60–70. https://doi.org/10.1016/j.trsl.2016.06.010
- Jung GW, Tse JE, Guiha I, Rao J (2013) Prospective, randomized, open-label trial comparing the safety, efficacy, and tolerability of an acne treatment regimen with and without a probiotic supplement and minocycline in subjects with mild to moderate acne. J Cutan Med Surg 17 (2):114–122. https://doi.org/10.2310/7750.2012.12026
- Kalamaha K, Reis E, Newton S, Roche C, Julson J, Fernandes H, Rodrigues J (2019) Atopic dermatitis: a review of evolving targeted therapies. Expert Rev Clin Immunol 15(3):275–288
- Karimi R, Mortazavian AM, Da Cruz AG (2011) Viability of probiotic microorganisms in cheese during production and storage: a review. Dairy Sci Technol 91:283–308. https://doi.org/10. 1007/s13594-011-0005-x
- Kaufman BP, Guttman-Yassky E, Alexis AF (2018) Atopic dermatitis in diverse racial and ethnic groups—variations in epidemiology, genetics, clinical presentation and treatment. Exp Dermatol 27(4):340–357
- Kim NY, Ji GE (2012) Effects of probiotics on the prevention of atopic dermatitis. Korean J Pediatr 55(6):193–201. https://doi.org/10.3345/kjp.2012.55.6.193
- Kim SJ, Cho SY, Kim SH, Song OJ, Shin IS, Cha DS, Park HJ (2008) Effect of microencapsulation on viability and other characteristics in Lactobacillus acidophilus ATCC 43121. LWT Food Sci Technol 41(3):493–500
- Kim HJ, Kim HY, Lee SY, Seo JH, Lee E, Hong SJ (2013) Clinical efficacy and mechanism of probiotics in allergic diseases. Korean J Pediatr 56(9):369–376. https://doi.org/10.3345/kjp. 2013.56.9.369
- Kim JA, Kim SH, Kim IS, Yu DY, Kim SC, Lee SH et al (2018) Anti-inflammatory effects of a mixture of lactic acid bacteria and sodium butyrate in atopic dermatitis murine model. J Med Food 21(7):716–725. https://doi.org/10.1089/jmf.2017.4116
- Kim J, Kim BE, Leung DYM (2019a) Pathophysiology of atopic dermatitis: clinical implications. Allergy Asthma Proc 40(2):84–92
- Kim W-K, Jang YJ, Han DH, Seo B, Park S, Lee CH, Ko G (2019b) Administration of Lactobacillus fermentum KBL375 causes taxonomic and functional changes in gut microbiota leading to improvement of atopic dermatitis. Front Mol Biosci 6:92. https://doi.org/10.3389/fmolb.2019. 00092
- Kiousi DE, Karapetsas A, Karolidou K, Panayiotidis MI, Pappa A, Galanis A (2019) Probiotics in extraintestinal diseases: current trends and new directions. Nutrients 11(4):788. https://doi.org/ 10.3390/nu11040788
- Kircik LH (2012) Efficacy and tolerability of retapamulin 1% ointment for the treatment of infected atopic dermatitis: a pilot study. J Drugs Dermatol 11(7):858–860
- Kothari D, Patel S, Kim S-K (2019) Probiotic supplements might not be universally-effective and safe: a review. Biomed Pharmacother 111:537–547. https://doi.org/10.1016/j.biopha.2018.12. 104
- Kwon YW, Bae JH, Kim SA, Han NS (2018) Development of freeze-thaw tolerant lactobacillus rhamnosus gg by adaptive laboratory evolution. Front Microbiol 9:2781. https://doi.org/10. 3389/fmicb.2018.02781
- Lacroix C, Yildirim S (2007) Fermentation technologies for the production of probiotics with high viability and functionality. Curr Opin Biotechnol 18(2):176–183. https://doi.org/10.1016/j. copbio.2007.02.002
- Larsen FS, Hanifin J (2002) Epidemiology of atopic dermatitis. Immunol Allergy Clin N Am 22 (1):1–24
- Lebeer S, Vanderleyden J, De Keersmaecker SCJ (2010) Host interactions of probiotic bacterial surface molecules: comparison with commensals and pathogens. Nat Rev Microbiol 8 (3):171–184. https://doi.org/10.1038/nrmicro2297
- Lee YK, Salminen S (2008) Handbook of probiotics and prebiotics: second edition. Wiley, Hoboken. https://doi.org/10.1002/9780470432624
Lee J, Yang W, Hostetler A, Schultz N, Suckow MA, Stewart KL, Kim DD, Kim HS (2016a) Characterization of the anti-inflammatory Lactobacillus reuteri BM36301 and its probiotic benefits on aged mice. BMC Microbiol 16:69. https://doi.org/10.1186/s12866-016-0686-7LK
- Lee YK, Salminen S (2008) Handbook of probiotics and prebiotics: second edition. Wiley, Hoboken. https://doi.org/10.1002/9780470432624
- Lee E, Lee SY, Kang MJ, Kim K, Won S, Kim BJ et al (2016b) Clostridia in the gut and onset of atopic dermatitis via eosinophilic inflammation. Ann Allergy Asthma Immunol 117(1):91–92. e1. https://doi.org/10.1016/j.anai.2016.04.019
- Lee NY, Ibrahim O, Khetarpal S, Gaber M, Jamas S, Gryllos I, Dover JS (2018) Dermal microflora restoration with ammonia-oxidizing bacteria Nitrosomonas Eutropha in the treatment of keratosis pilaris: a randomized clinical trial. J Drugs Dermatol 17(3):285–288
- Leonardi S, Cuppari C, Manti S, Filippelli M, Parisi GF, Borgia F et al (2015) Serum interleukin 17, interleukin 23, and interleukin 10 values in children with atopic eczema/dermatitis syndrome (AEDS): association with clinical severity and phenotype. Allergy Asthma Proc 36(1):74–81
Leung DYM, Boguniewicz M, Howell MD, Nomura I, Hamid QA (2004) New insights into atopic dermatitis. J Clin Investig 113(5):651–657. https://doi.org/10.1172/JCI21060 - Liu HN, Wong CK (1997) In vitro immunosuppressive effects of methotrexate and azathioprine on Langerhans cells. Arch Dermatol Res 289(2):94–97
- Luger T, De Raeve L, Gelmetti C, Kakourou T, Katsarou A, Lambert J et al (2013) Recommendations for pimecrolimus 1% cream in the treatment of mild-to-moderate atopic dermatitis: from medical needs to a new treatment algorithm. Eur J Dermatol 23(6):758–766
- Mahé YF, Martin R, Aubert L, Billoni N, Collin C, Pruche F et al (2006) Induction of the skin endogenous protective mitochondrial MnSOD by Vitreoscilla filiformis extract. Int J Cosmet Sci 28(4):277–287. https://doi.org/10.1111/j.1467-2494.2006.00333.
- Maria C, Izaskun M, Maria V (2012) Encapsulation technology to protect probiotic bacteria. Probiotics:501–540. https://doi.org/10.5772/50046
- Manzhalii E, Hornuss D, Stremmel W (2016) Intestinal-borne dermatoses significantly improved by oral application of Escherichia coli Nissle 1917. World J Gastroenterol 22(23):5415–5421. https://doi.org/10.3748/wjg.v22.i23.5415
- Matsumoto M, Aranami A, Ishige A, Watanabe K, Benno Y (2007) LKM512 yogurt consumption improves the intestinal environment and induces the T-helper type 1 cytokine in adult patients with intractable atopic dermatitis. Clin Exp Allergy 37(3):358–370. https://doi.org/10.1111/j. 1365- 2222.2007.02642.
- Matsumoto M, Ebata T, Hirooka J, Hosoya R, Inoue N, Itami S et al (2014) Antipruritic effects of the probiotic strain LKM512 in adults with atopic dermatitis. Ann Allergy Asthma Immunol 113 (2):209–216.e7. https://doi.org/10.1016/j.anai.2014.05.002
- McCusker M, Sidbury R (2016) Nutrition and skin: kids are not just little people. Clin Dermatol 34 (6):698–709. https://doi.org/10.1016/j.clindermatol.2016.07.004
- McGovern PE, Zhang J, Tang J, Zhang Z, Hall GR, Moreau RA et al (2004) Fermented beverages of pre- and proto-historic China. Proc Natl Acad Sci U S A 101(51):17593–17598. https://doi. org/10.1073/pnas.0407921102
- Medzhitov R, Janeway CA (2002) Decoding the patterns of self and nonself by the innate immune system. Science 296(5566):298–300
- Meng J, Moriyama M, Feld M, Buddenkotte J, Buhl T, Szöllösi A et al (2018) New mechanism underlying IL-31–induced atopic dermatitis. J Allergy Clin Immunol 141(5):1677–1689
- Mohammadi R, Mortazavian AM, Khosrokhavar R (2011) Probiotic ice cream: viability of probiotic bacteria and sensory properties. Ann Microbiol 61:411–424. https://doi.org/10.1007/ s13213-010- 0188-z
- Mottin VHM, Suyenaga ES (2018) An approach on the potential use of probiotics in the treatment of skin conditions: acne and atopic dermatitis. Int J Dermatol 57(12):1425–1432. https://doi.org/ 10.1111/ijd.13972
- Moyle M, Cevikbas F, Harden JL, Guttman-Yassky E (2019) Understanding the immune landscape in atopic dermatitis: the era of biologics and emerging therapeutic approaches. Exp Dermatol 28 (7):756–768
- Nakata J, Hirota T, Umemura H, Nakagawa T, Kando N, FutamuraMet al (2019) Additive effect of Lactobacillus acidophilus L-92 on children with atopic dermatitis concomitant with food allergy. Asia Pac Allergy 9(2):e18. https://doi.org/10.5415/apallergy.2019.9.e18
- Navarro-López V, Ramírez-Boscá A, Ramón-Vidal D, Ruzafa-Costas B, Genovés-Martínez S, Chenoll-Cuadros E et al (2018) Effect of oral administration of a mixture of probiotic strains on SCORAD index and use of topical steroids in young patients with moderate atopic dermatitis. JAMA Dermatol 154(1):37. https://doi.org/10.1001/jamadermatol.2017.3647
- Nowicki R, Trzeciak M, Wilkowska A, Sokołowska-Wojdyło M, Ługowska-Umer H, Barańska- Rybak W et al (2015) Atopic dermatitis: current treatment guidelines. Statement of the experts of the Dermatological Section, Polish Society of Allergology, and the Allergology Section, Polish Society of Dermatology. Adv Dermatol Allergology 32(4):239
- Nowrouzian FL, Lina G, Hodille E, Lindberg E, Hesselmar B, Saalman R et al (2017) Superantigens and adhesins of infant gut commensal Staphylococcus aureus strains and association with subsequent development of atopic eczema. Br J Dermatol 176(2):439–445. https:// doi.org/10.1111/bjd.15138
- Nyamai DW, Arika WM, Rachuonyo HO, Wambani JR, Ngugi MP (2016) Herbal management of benign prostatic hyperplasia. J Cancer Sci Ther 8:130–134. https://doi.org/10.4172/1948-5956. 1000404
- Nylund L, Nermes M, Isolauri E, Salminen S, De Vos WM, Satokari R (2015) Severity of atopic disease inversely correlates with intestinal microbiota diversity and butyrate-producing bacteria. Allergy 70(2):241–244. https://doi.org/10.1111/all.12549
- O’Neill CA, Monteleone G, McLaughlin JT, Paus R (2016) The gut-skin axis in health and disease: a paradigm with therapeutic implications. BioEssays 38(11):1167–1176. https://doi.org/10. 1002/bies.201600008
- Odhiambo JA, Williams HC, Clayton TO, Robertson CF, Asher MI, ISAAC Phase Three Study Group (2009) Global variations in prevalence of eczema symptoms in children from ISAAC phase three. J Allergy Clin Immunol 124(6):1251–1258
- Oh S, Kim SH, Ko Y, Sim JH, Kim KS, Lee SH et al (2006) Effect of bacteriocin produced by Lactococcus sp. HY 449 on skin-inflammatory bacteria. Food Chem Toxicol 44(4):552–559. https://doi.org/10.1016/j.fct.2005.08.008
- O’Regan GM, Sandilands A, McLean WI, Irvine AD (2008) Filaggrin in atopic dermatitis. J Allergy Clin Immunol 122(4):689–693
- Oren E, Banerji A, Camargo CA (2008) Vitamin D and atopic disorders in an obese population screened for vitamin D deficiency. J Allergy Clin Immunol 121(2):533
- Özdemir Ö (2010) Various effects of different probiotic strains in allergic disorders: an update from laboratory and clinical data. Clin Exp Immunol 160(3):295–304. https://doi.org/10.1111/j.1365- 2249.2010.04109.x
- Ozen M, Dinleyici EC (2015) The history of probiotics: the untold story. Benef Microbes 6 (2):159– 165. https://doi.org/10.3920/BM2014.0103
- Paller AS, Tom WL, Lebwohl MG, Blumenthal RL, Boguniewicz M, Call RS et al (2016) Efficacy and safety of crisaborole ointment, a novel, nonsteroidal phosphodiesterase 4 (PDE4) inhibitor for the topical treatment of atopic dermatitis (AD) in children and adults. J Am Acad Dermatol 75(3):494–503
- Paller AS, Kong HH, Seed P, Naik S, Scharschmidt TC, Gallo RL et al (2019) The microbiome in patients with atopic dermatitis. J Allergy Clin Immunol 143(1):26–35. https://doi.org/10.1016/j. jaci.2018.11.015
- Park MJ, Bae YS (2016) Fermented Acanthopanax koreanum root extract reduces UVB-and H2O2- induced senescence in human skin fibroblast cells. J Microbiol Biotechnol 26(7):1224–1233. https://doi.org/10.4014/jmb.1602.02049
- Paulino LC, Tseng CH, Strober BE, Blaser MJ (2006) Molecular analysis of fungal microbiota in samples from healthy human skin and psoriatic lesions. J Clin Microbiol 44(8):2933–2941. https://doi.org/10.1128/JCM.00785-06
- Penders J, Stobberingh EE, Thijs C, Adams H, Vink C, Van Ree R, Van Den Brandt PA (2006) Molecular fingerprinting of the intestinal microbiota of infants in whom atopic eczema was or was not developing. Clin Exp Allergy 36(12):1602–1608. https://doi.org/10.1111/j.1365-2222. 2006.02599.x
- Penders J, Thijs C, van den Brandt PA, Kummeling I, Snijders B, Stelma F et al (2007) Gut microbiota composition and development of atopic manifestations in infancy: the KOALA Birth Cohort Study. Gut 56(5):661–667
- Pessi T, Sütas Y, Hurme M, Isolauri E (2000) Interleukin-10 generation in atopic children following oral Lactobacillus rhamnosus GG. Clin Exp Allergy 30(12):1804–1808. https://doi.org/10. 1046/j.1365-2222.2000.00948.x. Physician, 86(1), 35–42
- Pité H (2010) Effect of probiotic mix (Bifidobacterium bifidum, Bifidobacterium Lactis, Lactobacillus acidophilus) in the primary prevention of eczema: a double-blind, randomized, placebocontrolled trial. Revista Portuguesa de Imunoalergologia 18:385–386
- Pizano JM, Williamson CB, Dolan KE, Gossard CM, Burns CM, Gasta MG et al (2017) Probiotics and disease: a comprehensive summary—part 7, immune disorders. Integr Med 16(5):46–57. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6438099/
- Prakoeswa CRS, Herwanto N, Prameswari R, Astari L, Sawitri S, Hidayati AN et al (2017) Lactobacillus plantarum IS-10506 supplementation reduced SCORAD in children with atopic dermatitis. Benef Microbes 8(5):833–840. https://doi.org/10.3920/BM2017.0011
- Prince T, McBain AJ, O’Neill CA (2012) Lactobacillus reuteri protects epidermal keratinocytes from Staphylococcus aureus-induced cell death by competitive exclusion. Appl Environ Microbiol 78(15):5119–5126. https://doi.org/10.1128/AEM.00595-12 Product Summary (2007) Summary of product characteristics; harm; methotrexate – ebewe – tablets – 3.12.2007
- Raone B, Raboni R, Patrizi A (2014) Probiotics reduce gut microbial translocation and improve adult atopic dermatitis. J Clin Gastroenterol 48(1):95–96. https://doi.org/10.1097/MCG. 0b013e31829e4632
- Rather IA, Bajpai VK, Kumar S, Lim J, Paek WK, Park YH (2016) Probiotics and atopic dermatitis: an overview. Front Microbiol 7:507. https://doi.org/10.3389/fmicb.2016.00507
Reddel S, Del Chierico F, Quagliariello A, Giancristoforo S, Vernocchi P, Russo A et al (2019) Gut microbiota profile in children affected by atopic dermatitis and evaluation of intestinal persistence of a probiotic mixture. Sci Rep 9(1):4996. https://doi.org/10.1038/s41598-019-41149-6 - Reichardt N, Duncan SH, Young P, Belenguer A, McWilliam Leitch C, Scott KP et al (2014) Phylogenetic distribution of three pathways for propionate production within the human gut microbiota. ISME J 8(6):1323–1335. https://doi.org/10.1038/ismej.2014.14
- Ring J, Alomar A, Bieber T, Deleuran M, Fink-Wagner A, Gelmetti C et al (2012) Guidelines for treatment of atopic eczema (atopic dermatitis) part I. J Eur Acad Dermatol Venereol 26 (8):1045– 1060
- Rodrigues KL, Gaudino Caputo LR, Tavares Carvalho JC, Evangelista J, Schneedorf JM (2005) Antimicrobial and healing activity of kefir and kefiran extract. Int J Antimicrob Agents 25 (5):404– 408. https://doi.org/10.1016/j.ijantimicag.2004.09.020
- Roekevisch E, Spuls PI, Kuester D, Limpens J, Schmitt J (2014) Efficacy and safety of systemic treatments for moderate-to-severe atopic dermatitis: a systematic review. J Allergy Clin Immunol 133(2):429–438
- Roessler A, Friedrich U, Vogelsang H, Bauer A, Kaatz M, Hipler UC et al (2007) The immune system in healthy adults and patients with atopic dermatitis seems to be affected differently by a probiotic intervention. Clin Exp Allergy 38(1):93–102. https://doi.org/10.1111/j.1365-2222. 2007.02876.x
- Rosenfeldt V, Benfeldt E, Nielsen SD, Michaelsen KF, Jeppesen DL, Valerius NH, Paerregaard A (2003) Effect of probiotic Lactobacillus strains in children with atopic dermatitis. J Allergy Clin Immunol 111(2):389–395. https://doi.org/10.1067/mai.2003.389
- Rosenfeldt V, Benfeldt E, Valerius NH, Pærregaard A, Michaelsen KF (2004) Effect of probiotics on gastrointestinal symptoms and small intestinal permeability in children with atopic dermatitis. J Pediatr 145(5):612–616. https://doi.org/10.1016/j.jpeds.2004.06.068
- Rosignoli C, Thibaut de Ménonville S, Orfila D, Béal M, Bertino B, Aubert J et al (2018) A topical treatment containing heat-treated Lactobacillus johnsonii NCC 533 reduces Staphylococcus aureus adhesion and induces antimicrobial peptide expression in an in vitro reconstructed human epidermis model. Exp Dermatol 27(4):358–365. https://doi.org/10.1111/exd.13504
- Round JL, Mazmanian SK (2010) Inducible Foxp3+ regulatory T-cell development by a commensal bacterium of the intestinal microbiota. Proc Natl Acad Sci 107(27):12204–12209
- Rusu E, Enache G, Cursaru R, Alexescu A, Radu R, Onila O et al (2019) Prebiotics and probiotics in atopic dermatitis. Exp Ther Med 18(2):926–931. https://doi.org/10.3892/etm.2019.7678
- Samuelov L, Sprecher E (2014) Peeling off the genetics of atopic dermatitis–like congenital disorders. J Allergy Clin Immunol 134(4):808–815 Sarti MG (1998) Biofeedback in dermatology. Clin Dermatol 16(6):711–714
- Satoh T, Murata M, Iwabuchi N, Odamaki T, Wakabayashi H, Yamauchi K et al (2015) Effect of Bifidobacterium breve B-3 on skin photoaging induced by chronic UV irradiation in mice. Benefic Microbes 6(4):497–504. https://doi.org/10.3920/BM2014.0134
- Schmitt J, Schmitt N, Meurer M (2007) Cyclosporin in the treatment of patients with atopic eczema– a systematic review and meta-analysis. J Eur Acad Dermatol Venereol 21(5):606–619. https:// doi.org/10.1111/j.1468-3083.2006.02023.x
- Schmitt J, von Kobyletzki L, Svensson Å, Apfelbacher C (2011) Efficacy and tolerability of proactive treatment with topical corticosteroids and calcineurin inhibitors for atopic eczema: systematic review and meta-analysis of randomized controlled trials. Br J Dermatol 164 (2):415–428
- Schwarz A, Bruhs A, Schwarz T (2017) The short-chain fatty acid sodium butyrate functions as a regulator of the skin immune system. J Investig Dermatol 137(4):855–864
Senra MS, Wollenberg A (2014) Psychodermatological aspects of atopic dermatitis. Br J Dermatol 170(Suppl 1):38–43. https://doi.org/10.1111/bjd.13084 - Sheehan VM, Ross P, Fitzgerald GF (2007) Assessing the acid tolerance and the technological robustness of probiotic cultures for fortification in fruit juices. Innov Food Sci Emerg Technol 8 (2):279–284. https://doi.org/10.1016/j.ifset.2007.01.007
- Shin J-H, Chung M-J, Seo J-G (2016) A multistrain probiotic formulation attenuates skin symptoms of atopic dermatitis in a mouse model through the generation of CD4+Foxp3+ T cells. Food Nutr Res 60:32550. https://doi.org/10.3402/fnr.v60.32550
- Sidbury R, Davis DM, Cohen DE, Cordoro KM, Berger TG, Bergman JN et al (2014) Guidelines of care for the management of atopic dermatitis: section 3. Management and treatment with phototherapy and systemic agents. J Am Acad Dermatol 71(2):327–349
- Sikorska H, Smoragiewicz W (2013) Role of probiotics in the prevention and treatment of meticillin- resistant Staphylococcus aureus infections. Int J Antimicrob Agents 42(6):475–481. https://doi.org/10.1016/j.ijantimicag.2013.08.003
- Simons FER (1999) Prospective, long-term safety evaluation of the H1-receptor antagonist cetirizine in very young children with atopic dermatitis. J Allergy Clin Immunol 104 (2):433–440
- Simons FER, Early Prevention of Asthma in Atopic Children (EPAAC) Study Group (2007) Safety of levocetirizine treatment in young atopic children: an 18-month study. Pediatr Allergy Immunol 18(6):535–542
- Singh B, Mal G, Marotta F (2017a) Designer probiotics: paving the way to living therapeutics. Trends Biotechnol 35(8):679–682. https://doi.org/10.1016/j.tibtech.2017.04.001
- Singh S, Young A, McNaught CE (2017b) The physiology of wound healing. Surgery (United Kingdom) 35:473–477. https://doi.org/10.1016/j.mpsur.2017.06.004
- Smits HH, Engering A, Van Der Kleij D, De Jong EC, Schipper K, Van Capel TMM et al (2005) Selective probiotic bacteria induce IL-10-producing regulatory T cells in vitro by modulating dendritic cell function through dendritic cell-specific intercellular adhesion molecule 3-grabbing nonintegrin. J Allergy Clin Immunol 115(6):1260–1267. https://doi.org/10.1016/j.jaci.2005.03. 036
- Solanki HK, Pawar DD, Shah DA, Prajapati VD, Jani GK, Mulla AM, Thakar PM (2013) Development of microencapsulation delivery system for long-term preservation of probiotics as biotherapeutics agent. BioMed Res Int 2013:620719
- Song H, Yoo Y, Hwang J, Na YC, Kim HS (2016) Faecalibacterium prausnitzii subspecies-level dysbiosis in the human gut microbiome underlying atopic dermatitis. J Allergy Clin Immunol 137(3):852–860. https://doi.org/10.1016/j.jaci.2015.08.021
- Sotoudegan F, Daniali M, Hassani S, Nikfar S, Abdollahi M (2019) Reappraisal of probiotics’ safety in human. Food Chem Toxicol 129:22–29. https://doi.org/10.1016/j.fct.2019.04.032
- Spergel JM, Paller AS (2003) Atopic dermatitis and the atopic march. J Allergy Clin Immunol 112 (6 Suppl):S118–S127. https://doi.org/10.1016/j.jaci.2003.09.033
- Takizawa T, Morikawa A, Arakawa H (2018) Epidemiology of atopic dermatitis in Japan, Evolution of atopic dermatitis in the 21st century. Springer, Singapore, pp 13–24
- Talwalkar A, Kailasapathy K (2004) The role of oxygen in the viability of probiotic bacteria with reference to L. acidophilus and Bifidobacterium spp. Curr Issues Intest Microbiol 5(1):1–8
- Tamime AY, Saarela M, Sondergaard AK, Mistry VV, Shah NP (2005) Production and maintenance of viability of probiotic microorganisms in dairy products. In: Probiotic dairy products.
- Blackwell, Hoboken Tan Q, Yang H, Liu E, Wang H (2017) P38/ERK MAPK signaling pathways are involved in the regulation of filaggrin and involucrin by IL 17. Mol Med Rep 16(6):8863–8867
- Thum D, Seidl HP, Hein R, Ring J, Andres C, Mempel M (2013) Current resistance patterns of Staphylococcus aureus towards topical antibiotics and relevant antiseptics in patients with atopic dermatitis and impetigo. JDDG 11(9):875–878
- Thursby E, Juge N (2017) Introduction to the human gut microbiota. Biochem J 474 (11):1823–1836. https://doi.org/10.1042/BCJ20160510
Thyssen JP, Kezic S (2014) Causes of epidermal filaggrin reduction and their role in the pathogenesis of atopic dermatitis. J Allergy Clin Immunol 134(4):792–799 - Toda M, Leung DY, Molet S, Boguniewicz M, Taha R, Christodoulopoulos P et al (2003) Polarized in vivo expression of IL-11 and IL-17 between acute and chronic skin lesions. J Allergy Clin Immunol 111(4):875–881
- Tripathi MK, Giri SK (2014) Probiotic functional foods: survival of probiotics during processing and storage. J Funct Foods 9:225–241. https://doi.org/10.1016/j.jff.2014.04.030
- Tsiouris CG, Tsiouri MG (2017) Human microflora, probiotics and wound healing. Wound Med 19:33–38. https://doi.org/10.1016/j.wndm.2017.09.006
- Tuorila H, Cardello AV (2002) Consumer responses to an off-flavor in juice in the presence of specific health claims. Food Qual Prefer 13:561–569. https://doi.org/10.1016/S0950-3293(01) 00076-3
- Turner MJ, Zhou B (2014) A new itch to scratch for TSLP. Trends Immunol 35(2):49–50
- Ueno N, Fujiya M, Segawa S, Nata T, Moriichi K, Tanabe H et al (2011) Heat-killed body of lactobacillus brevis SBC8803 ameliorates intestinal injury in a murine model of colitis by enhancing the intestinal barrier function. Inflamm Bowel Dis 17(11):2235–2250. https://doi. org/10.1002/ibd.21597
- Verna EC, Lucak S (2010) Use of probiotics in gastrointestinal disorders: what to recommend? Ther Adv Gastroenterol 3(5):307–319. https://doi.org/10.1177/1756283X10373814
- Vijayashankar M, Raghunath N (2012) Pustular psoriasis responding to probiotics—a new insight. Our Dermatology Online 3(4):326–328. https://doi.org/10.7241/ourd.20124.71
- Vinderola CG, Bailo N, Reinheimer JA (2000) Survival of probiotic microflora in Argentinian yoghurts during refrigerated storage. Food Res Int 33(2):97–102. https://doi.org/10.1016/ S0963- 9969(00)00011-9
- Wang Y, Kao MS, Yu J, Huang S, Marito S, Gallo RL, Huang CM (2016) A precision microbiome approach using sucrose for selective augmentation of Staphylococcus epidermidis fermentation against Propionibacterium acnes. Int J Mol Sci 17(11):1870. https://doi.org/10.3390/ ijms17111870
- Watanabe S, Narisawa Y, Arase S, Okamatsu H, Ikenaga T, Tajiri Y, Kumemura M (2003) Differences in fecal microflora between patients with atopic dermatitis and healthy control subjects. J Allergy Clin Immunol 111(3):587–591
- Weiland SK, Björkstén B, Brunekreef B, Cookson WOC, Von Mutius E, Strachan DP (2004) Phase II of the international study of asthma and allergies in childhood (ISAAC II): rationale and methods. Eur Respir J 24(3):406–412
- Werfel T, Kapp A (2002) T-cells in atopic dermatitis. In: Leung D, Bieber T (eds) Atopic dermatitis.
- Marcel Decker, St. Louis, pp 241–266 Weston S (2005) Effects of probiotics on atopic dermatitis: a randomised controlled trial. Arch Dis Child 90(9):892–897. https://doi.org/10.1136/adc.2004.060673
- Weston S, Halbert A, Richmond P, Prescott S (2005) Effects of probiotics on atopic dermatitis: a randomised controlled trial. Arch Dis Child 90(9):892–897. https://doi.org/10.1136/adc.2004. 060673
- Wickens K, Black PN, Stanley TV, Mitchell E, Fitzharris P, TannockGW et al (2008) A differential effect of 2 probiotics in the prevention of eczema and atopy: a double-blind, randomized, placebo- controlled trial. J Allergy Clin Immunol 122(4):788–794. https://doi.org/10.1016/j. jaci.2008.07.011
- Wickens K, Black P, Stanley TV, Mitchell E, Barthow C, Fitzharris P et al (2012) A protective effect of Lactobacillus rhamnosus HN001 against eczema in the first 2 years of life persists to age 4 years. Clin Exp Allergy 42(7):1071–1079. https://doi.org/10.1111/j.1365-2222.2012. 03975.x
- Williams H, Robertson C, Stewart A, Aït-Khaled N, Anabwani G, Anderson R et al (1999) Worldwide variations in the prevalence of symptoms of atopic eczema in the International Study of Asthma and Allergies in Childhood. J Allergy Clin Immunol 103(1):125–138
- Witte W (2000) Ecological impact of antibiotic use in animals on different complex microflora: environment. Int J Antimicrob Agents 14(4):321–325
- Xiao J, Zhang Y, Yang Z (2014) Lactic acid bacteria in health and disease. In: Lactic acid bacteria: fundamentals and practice. Springer, Cham. https://doi.org/10.1007/978-94-017-8841-0_5
- Yang G, Liu Z-Q, Yang P-C (2013) Treatment of allergic rhinitis with probiotics: an alternative approach. N Am J Med Sci 5(8):465–468. https://doi.org/10.4103/1947-2714.117299
- Yeşilova Y, Çalka Ö, Akdeniz N, BerktaşM(2012) Effect of probiotics on the treatment of children with atopic dermatitis. Ann Dermatol 24(2):189–193
- Yim JH, Kim DH, Ku JK, Kang YS, Kim MY, Kim HO et al (2006) Therapeutic effects of probiotics in patients with atopic dermatitis. J Microbiol Biotechnol 16(11):1699–1705
- Yokoyama S, Hiramoto K, Koyama M, Ooi K (2015) Impairment of skin barrier function via cholinergic signal transduction in a dextran sulphate sodium-induced colitis mouse model. Exp Dermatol 24(10):779–784. https://doi.org/10.1111/exd.12775
- Yoshida Y, Seki T, Matsunaka H, Watanabe T, Shindo M, Yamada N, Yamamoto O (2010) Clinical effects of probiotic bifidobacterium breve supplementation in adult patients with atopic dermatitis. Yonago Acta Med 53(2):37–45
- Żukiewicz-Sobczak W, Wróblewska P, Adamczuk P, Silny W (2014) Probiotic lactic acid bacteria and their potential in the prevention and treatment of allergic diseases. Central-European Journal of Immunology 39(1):104–108. https://doi.org/10.5114/ceji.2014.42134
