Bệnh da liễu, Thẩm mỹ - Làm đẹp
Peel da bằng hóa chất: Cơ chế hoạt động và phân loại các hoạt chất peel
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Để tải file pdf đầy đủ của chương 1: Peel da bằng hóa chất: Cơ chế hoạt động và phân loại các hoạt chất peel của các tác giả: Luc Dewandre, Alain Tenenbaum, Desmer Destang, vui lòng click Tại đây.
Tập sách: Quy trình kỹ thuật trong da liễu thẩm mỹ, Jeffrey S.Dover Murad Alam. Quyển: Thay da bằng hóa chất, Suzan Obagi MD. Phần 1: Tổng quan về peel da.
Peel da bằng hóa chất là một kỹ thuật điều trị được áp dụng để cải thiện và làm mịn kết cấu da mặt và/hoặc cơ thể bằng cách sử dụng một dung dịch hóa học làm cho các lớp da chết tách khỏi các lớp da phía dưới và dần bong ra. Da được tái tạo thường mịn hơn, khỏe hơn và ít nếp nhăn hơn da trước đó. Các chuyên gia như bác sĩ da liễu, bác sĩ phẫu thuật thẩm mỹ, bác sĩ tai mũi họng (bác sĩ phẫu thuật thẩm mỹ khuôn mặt) hoặc bác sĩ phẫu thuật răng hàm mặt được đào tạo về peel da là những BS được phép thực hiện peel trên từng khu vực đặc thù.
GIỚI THIỆU
Chương này đề xuất cách phân loại các chất hóa học được sử dụng để peel da dựa trên cơ chế hoạt động của chúng. Các loại hóa chất được coi là hóa chất peel đều có bản chất là các acid. Xét trên phương diện hóa học, các chất peel tác động trên da theo các cơ chế sau:
- Ăn mòn da.
- Gây độc.
- Tác động chuyển hóa da.
Các tài liệu về peel da hóa chất từ trước tới nay đã nêu đầy đủ về cơ sở khoa học, chỉ định, chống chỉ định, tác dụng phụ và kết quả của các hoạt chất peel. Trong đó, tính acid được coi là cơ chế chính gây bong tróc lớp da bề mặt. Và thông thường, tất cả các hoạt chất đều tác động trên da theo các giai đoạn sau: phá hủy, loại bỏ, tái tạo. Và tất cả các giai đoạn đều đi kèm với một quá trình viêm có kiểm soát. Một nghiên cứu ngắn về đặc tính hóa học của các phân tử và dung dịch được sử dụng để peel đã ngay lập tức đưa ra giả thuyết rằng tính axit là cơ sở duy nhất cho tác động của hoạt chất peel. Tuy nhiên, trên thực tế, ngoại trừ dung dịch axit trichloroacetic (TCA) và axit glycolic không khoáng hóa, các hoạt chất peel được sử dụng phổ biến nhất cũng chỉ có tính axit yếu, thậm chí hỗn hợp phenol và resorcinol có thể không có tính axit (pH > 7).
Chương này sẽ thảo luận về các khái niệm hóa học cơ bản, cùng với đặc tính hóa học các thành phần của da, sẽ giúp giải thích các tương tác giữa hoạt chất peel và da. Cuối cùng, chúng tôi sẽ nêu hai cách phân loại các dung dịch peel, một là theo cơ chế hoạt động của chúng (phân loại của L. Dewandre) và phân loại theo các thông số hóa học (cấu trúc của phân tử, pKa, v.v.; hoặc phân loại của A. Tenenbaum).
=> Đọc thêm: KẾT HỢP PEEL DA VÀ LĂN KIM TRONG ĐIỀU TRỊ SẸO MỤN.
TÓM LƯỢC KIẾN THỨC HÓA HỌC
Các BS cần hiểu một số khái niệm cơ bản về hóa học để đưa ra chỉ định và thực hiện peel phù hợp nhất. Mặc dù bộ môn hóa sinh đã được phổ cập đối với tất cả các chương trình y khoa nhưng hầu hết các BS lại không nắm chắc các kiến thức này sau khi tốt nghiệp.
Không chỉ vậy, các chủ đề hóa học cũng chỉ được lướt qua trong các khóa học da liễu và y học thẩm mỹ, hội thảo và hội nghị. Do đó, các thông tin dưới đây, hy vọng sẽ có ích đối với độc giả.
=> Xem thêm: Các bước chuẩn bị cho da trước khi tiến hành peel.
Tính acid
Một axit (tiếng Latinh acidus, có nghĩa là “chua”) theo lý thuyết là bất kỳ hợp chất nào mà khi hòa tan trong nước sẽ tạo ra dung dịch có hoạt độ ion hydro lớn hơn trong nước tinh khiết, tức là, có độ pH nhỏ hơn 7,0. Điều đó gần đúng với định nghĩa hiện đại của Johannes Nicolaus Bronsted và Martin Lowry, những người đã định nghĩa axit là một hợp chất nhường ion hydro (H +) cho các hợp chất khác (gọi là bazơ). Hệ thống axit-bazơ khác với phản ứng oxi hóa khử ở chỗ không có sự thay đổi trạng thái oxi hóa. Axit có thể xuất hiện ở thể rắn, lỏng, hoặc khí tùy thuộc vào nhiệt độ. Chúng có thể tồn tại dưới dạng chất tinh khiết hoặc ở dạng dung dịch. Hóa chất hoặc chất có đặc tính của axit được cho là có tính axit (tính từ).
Axit Arrhenius
Khái niệm Arrhenius là khái niệm tương đối dễ nhớ và cũng hữu ích đối với BS, vì đa phần các dung dịch peel có tính acid đều tồn tại dưới dạng các ion, tạo ra các phần từ H3O+ khi hòa tan trong nước.
Nhà hóa học Thụy Điển Svante Arrhenius đã quy các tính chất của axit cho hydro vào năm 1884 như sau: Axit Arrhenius là một chất làm tăng nồng độ của ion hydro (H3O+) khi hòa tan trong nước. Định nghĩa này bắt nguồn từ sự phân li cân bằng của nước thành các ion hydro và hydroxit (OH-):
H2O(l)+ H2O(l) = H3O+(aq)+ OH – (aq)
Trong nước tinh khiết, hầu hết các phân tử tồn tại dưới dạng H2O, nhưng một số lượng nhỏ các phân tử liên tục phân ly và liên kết lại. Nước tinh khiết là hợp chất trung tính, bởi vì nồng độ của các ion hydroxit luôn bằng nồng độ của các ion hydro. Một bazơ theo Arrhenius là một phân tử làm tăng nồng độ của ion hydroxit khi hòa tan trong nước. Lưu ý rằng các nhà hóa học thường viết H + (aq) và dùng để chỉ ion hydro khi mô tả phản ứng axit-bazơ, nhưng hạt nhân nguyên tử hydro tự do (proton) không tồn tại một mình trong nước; nó tồn tại dưới dạng ion hydronium, H3O+.
Axit Bronsted
Mặc dù khái niệm axit của Arrhenius có thể giải thích cho nhiều hiện tượng, chúng cũng có những hạn chế nhất định.
Axit theo Bronsted, khác với axit Arrhenius, có thể mô tả axit dưới dạng các phân tử, trong khi axit Arrhenius phải là hợp chất dưới dạng các ion.
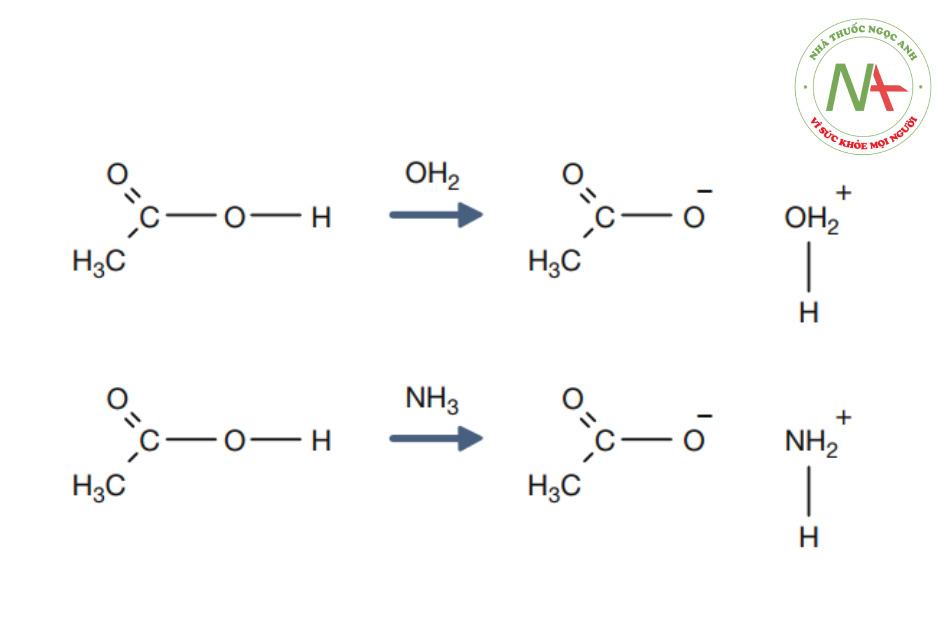
Năm 1923, các nhà hóa học Johannes Nicolaus Bronsted và Thomas Martin Lowry đã nhận ra rằng phản ứng axit-bazơ bản chất là 1 quá trình cho nhận proton. Định nghĩa axit theo Bronsted – Lowry (hoặc axit Bronsted) là một chất cho proton cho bazơ. Lý thuyết axit-bazơ của Bronsted – Lowry có một số điểm tiến bộ hơn lý thuyết Arrhenius. Hãy xem xét các phản ứng sau đây của axit axetic (CH3COOH), loại axit hữu cơ tạo cho giấm có vị đặc trưng (hình dưới):
Cả hai giả thuyết đều dễ dàng mô tả phản ứng phía đầu tiên (hình dưới): CH3COOH hoạt động như một axit Arrhenius vì nó hoạt động như một nguồn tạo H3O+ khi hòa tan trong nước, và nó hoạt động như một axit Bronsted bằng cách cho một proton vào nước. Trong ví dụ thứ hai, CH3COOH với cùng một sự biến đổi, lại chỉ cho một proton cho amoniac (NH3), trong khi không thể mô tả nó như một axit theo Arrhenius vì phản ứng không tạo ra H3O+.
Giống như phản ứng axit axetic, cả hai định nghĩa axit đều phù hợp với ví dụ đầu tiên (nước là dung môi). Phản ứng tiếp theo mặc dù không hình thành H3O+ nhưng vẫn có thể được xem như một phản ứng chuyển proton và phù hợp với khái niệm về axit.
Axit Lewis
Định nghĩa về axit của Bronsted – Lowry sử dụng rộng rãi nhất; trừ các trường hợp đặc biệt ra thì các phản ứng axit-bazơ bản chất đều là phản ứng chuyển một proton (H +) từ axit sang bazơ.
Một khái niệm khác được đề xuất bởi Gilbert N. Lewis về một phản ứng có đặc điểm axit-bazơ mà không liên quan đến sự chuyển proton. Axit Lewis là một hợp chất chấp nhận một cặp điện tử từ hợp chất khác; nói cách khác, nó là chất nhận cặp electron. Phản ứng axit-bazơ Bronsted là phản ứng chuyển proton, còn phản ứng axit-bazơ Lewis là phản ứng chuyển cặp electron. Tất cả các axit Bronsted cũng là axit Lewis, những điều ngược lại không hoàn toàn đúng. Các phản ứng dưới đây sẽ nêu rõ hơn về sự khác biệt này:
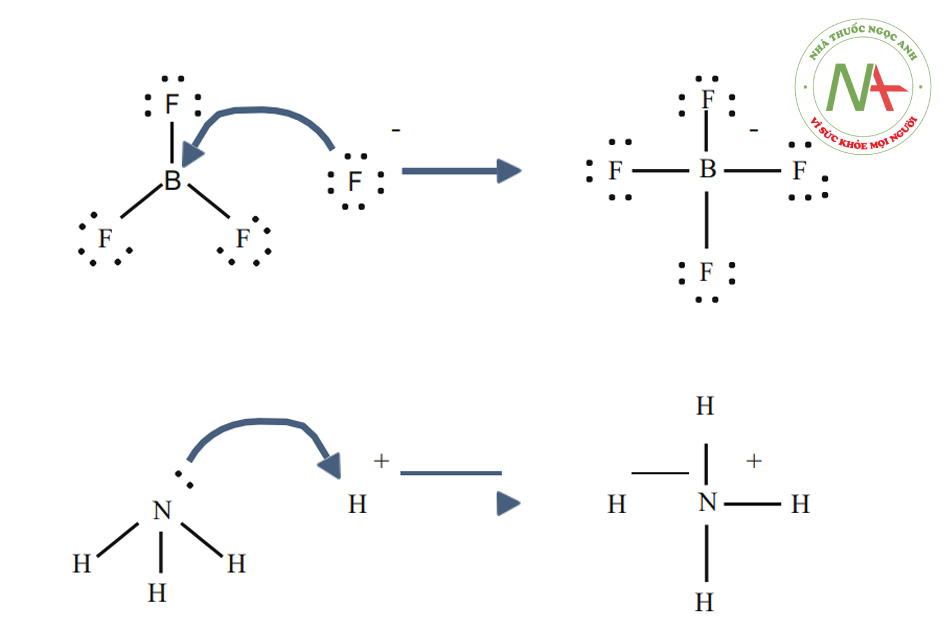
Trong phản ứng đầu tiên, một ion flo (F-), nhường một cặp electron cho borontrifloride để tạo thành sản phẩm là tetrafluoroborat. Florua “mất” một cặp electron hóa trị vì các điện tử được chia sẻ trong liên kết B – F nằm trong vùng không gian giữa hai hạt nhân nguyên tử và do đó ở xa hạt nhân nguyên tử flo hơn khi chúng ở trong nguyên tử flo đơn lẻ. BF3 là một axit Lewis vì nó nhận cặp electron từ florua. Tuy nhiên, phản ứng này lại không thể mô tả theo lý thuyết Bronsted, bởi vì không có sự chuyển proton. Phản ứng thứ hai có thể được mô tả bằng cả hai lý thuyết. Một proton được chuyển từ một axit Bronsted không xác định thành amoniac (một bazơ Bronsted). Theo cách khác, amoniac hoạt động như một bazơ Lewis và chuyển một cặp electron duy nhất để tạo liên kết với ion hydro. Hợp chất giành được cặp electron là axit Lewis; ví dụ, nguyên tử oxy trong H3O+ nhận được một cặp electron khi một trong các liên kết H-O bị phá vỡ và các electron được chia sẻ trong liên kết sẽ ‘thuộc về’ nguyên tử oxy. Tùy thuộc vào ngữ cảnh, các axit Lewis cũng có thể được mô tả như một chất khử hoặc một chất nhận electron.
=> Tham khảo thêm: Peel nông là gì, chỉ định, chống chỉ định và các bước tiến hành peel.
Phân ly và cân bằng
Các phản ứng của axit thường được khái quát dưới dạng HA H+ + A-, trong đó HA đại diện cho axit và A- là bazơ liên hợp. Các cặp liên hợp axit-bazơ khác nhau một proton và có thể được ‘chuyển’ cho nhau bằng cách thêm hoặc bớt một proton.
Lưu ý rằng axit có thể là các chất mang điện và bazơ liên hợp có thể là trung tính, trong trường hợp đó, sơ đồ phản ứng tổng quát có thể được viết là HA H+ + A-.
Trong dung dịch tồn tại trạng thái cân bằng giữa axit và bazơ liên hợp của nó. Hằng số cân bằng K là một biểu thức thể hiện sự cân bằng giữa nồng độ các
phân tử hoặc các ion trong dung dịch. Dấu ngoặc biểu thị cho nồng độ, như vậy [H2O] có nghĩa là nồng độ của H2O. Còn hằng số phân ly axit Ka thường được sử dụng trong bối cảnh của phản ứng axit-bazơ. Trị số của Ka bằng nồng độ của các chất sản phẩm chia cho nồng độ của chất phản ứng, trong đó chất phản ứng là axit (HA) và sản phẩm là bazơ liên hợp và H+.
Ka=[H+] [A-]/[HA]
Axit mạnh hơn sẽ có giá trị Ka cao hơn. Tỉ lệ ion hydro/axit ở axit mạnh cũng sẽ cao hơn vì chúng có khả năng mất proton nhiều hơn các axit yếu. Bởi vì phạm vi giá trị của Ka có thể có là rất rộng, nên trên thực tế người ta dùng một hằng số dễ quản lý hơn, đó là pKa, trong đó pKa = -log10Ka. Axit mạnh hơn có pKa nhỏ hơn các axit yếu hơn chúng. Thực nghiệm xác định pKa ở 25°C trong dung dịch nước thường được trích dẫn trong sách giáo khoa và tài liệu tham khảo.
Độ mạnh của axit
Đối với các BS lâm sàng, khái niệm về độ mạnh của axit là khái niệm cơ bản cần nắm, rằng axit mạnh hơn có Ka cao hơn và pKa thấp hơn các axit yếu.
Theo khái niệm trên, các nhà lâm sàng trước khi lựa chọn peel phải xác định được hai thông số:
- pKa (có thể gọi hình tượng là độ mạnh của axit).
- Và pH, thông số biểu thị khả năng đi sâu của axit vào các tầng da.
Đối với các nhà hóa học, độ mạnh của một axit được biểu thị bởi khả năng mất proton của chúng. Như vậy, axit mạnh là axit phân ly hoàn toàn trong nước; nói cách khác, một mol axit mạnh (HA), hòa tan trong nước sẽ tạo ra một mol H + và một mol bazơ liên hợp, (A-), và không chứa phân tử HA nào. Ngược lại, một axit yếu chỉ phân ly một phần, và ở trạng thái cân bằng, cả axit và bazơ liên hợp đều cùng tồn tại trong dung dịch. Trong nước, mỗi chất này về cơ bản ion hóa 100%. Axit càng mạnh thì càng dễ mất proton, H+.
Hai yếu tố quan trọng góp phần vào trạng thái dễ mất đi proton là độ phân cực của liên kết H – A và kích thước nguyên tử của A, yếu tố này quyết định độ bền của liên kết H – A. Độ mạnh của axit cũng thường được được quy định dựa trên tính ổn định của bazơ liên hợp.
Nên phân biệt được giữa peel thẩm mỹ với các dòng axit có pKa >3 và peel điều trị với các dòng axit có pKa < 3, vì một số axit như phenol có thể gây độc ngay cả khi pKa >3.
=> Tham khảo: Kỹ thuật Peel trung bình và TCA Blue Peel trong peel da bằng hóa chất.
Phân cực và hiệu ứng cảm ứng
Độ phân cực của liên kết H – A là yếu tố quan trọng hàng đầu để đánh giá độ mạnh của axit.
Khi mật độ electron trên nguyên tử hydro giảm, nó ‘dần’ có tính axit hơn. Di chuyển từ trái sang phải qua một hàng trên bảng tuần hoàn, các nguyên tố tăng dần tính âm điện, tức có tính axit hơn (trừ các khí hiếm).
Trong một số nhóm hợp chất, được gọi chung là axit cacbon, liên kết C – H có thể đủ tính axit để thực hiện cho proton. Các liên kết C – H bất hoạt được tìm thấy trong ankan và không nằm liền kề với dị nguyên tử (O, N, Si, v.v.). Những liên kết như vậy thường chỉ tham gia vào quá trình thế gốc tự do.
Sự phân cực dùng để chỉ sự phân bố của các electron trong một liên kết, vùng không gian giữa hai hạt nhân nguyên tử nơi một cặp electron được chia sẻ. Khi hai nguyên tử có độ âm điện gần như nhau (khả năng hút electron), các electron được chia sẻ đồng đều và dành thời gian bằng nhau ở hai đầu của liên kết. Khi có sự khác biệt đáng kể về độ âm điện của hai nguyên tử liên kết, các điện tử dành nhiều thời gian hơn ở gần hạt nhân của nguyên tố có độ âm điện nhiều hơn và xảy ra lưỡng cực điện, hoặc sự phân tách các điện tích, sao cho có một phần điện tích âm khu trú trên cực âm và ngược lại. Hydro là một nguyên tố dương điện và tích lũy điện tích dương khi nó được liên kết với một nguyên tố âm điện như oxy hoặc clo.
Nguyên tố âm điện không cần liên kết trực tiếp với hydro có tính axit để tăng tính axit của nó. Nguyên tử có độ âm điện có thể kéo một lượng electron ra khỏi liên kết axit thông qua hiệu ứng cảm ứng. Khả năng rút electron giảm đi nhanh chóng khi nguyên tử âm điện di chuyển ra khỏi liên kết axit.
Axit cacboxylic là axit hữu cơ có chứa một nhóm hydroxyl có tính axit và một cacbonyl (liên kết C – O). Axit cacboxylic có thể bị khử thành rượu tương ứng; sự thay thế một nguyên tử oxy âm điện bằng hai hydro dương điện tạo ra một sản phẩm không axit. Việc khử axit axetic thành etanol bằng cách sử dụng LiAlH4 (liti nhôm hiđrua hoặc LAH) và ete là một ví dụ của phản ứng như vậy.
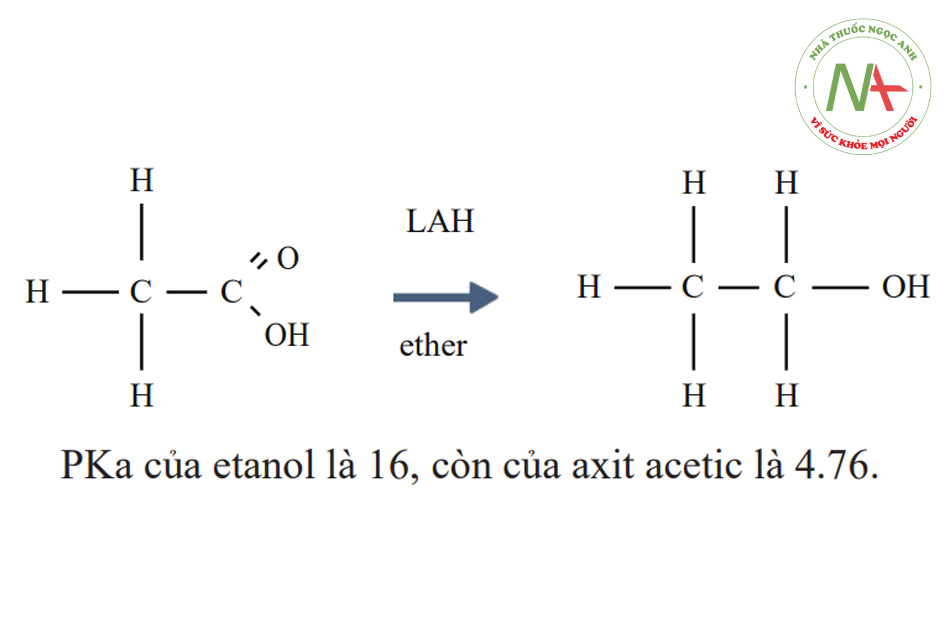
nhôm hiđrua hoặc LAH) và ete
Bán kính nguyên tử và độ bền liên kết
Kích thước của nguyên tử hoặc bán kính nguyên tử là yếu tố thứ hai góp phần vào việc tạo ra tính axit.
Di chuyển theo cột trong bảng tuần hoàn từ trên xuống dưới, các nguyên tử trở nên ít âm điện hơn nhưng cũng lớn hơn đáng kể về kích thước, và kích thước của nguyên tử lớn thì tính axit của nó lớn hơn khi so sánh với cùng các nguyên tử liên kết với hydro.
Hydro sunfua, H2S, là một axit mạnh hơn nước, mặc dù oxy có độ âm điện lớn hơn lưu huỳnh. Điều này là do lưu huỳnh có kích thước lớn hơn oxy và liên kết H – S dễ bị phá vỡ hơn liên kết H – O.
Một yếu tố khác góp phần vào khả năng mất proton của một axit là độ bền của liên kết giữa hydro và nguyên tử liên kết cùng nó. Mà độ bền liên kết lại phụ thuộc vào kích thước của nguyên tử liên kết với hydro. Đối với một phân tử HA, khi kích thước của nguyên tử A tăng lên, độ bền của liên kết giảm, nghĩa là nó dễ bị phá vỡ hơn để tạo ra chất có tính axit cao hơn.
Đặc tính hóa học
Nên nhớ các đặc trưng của axit đơn chức (có một pKa duy nhất) và axit đa chức (có hai hoặc nhiều pKa).
Axit đơn chức
Axit đơn chức là những axit có thể tặng một proton cho mỗi phân tử trong quá trình phân ly (đôi khi được gọi là ion hóa), như được biểu thị bởi phương trình bên dưới (ký hiệu là HA):
HA(aq)+ H2(1) : H3O+(aq)+A–(aq) Ka
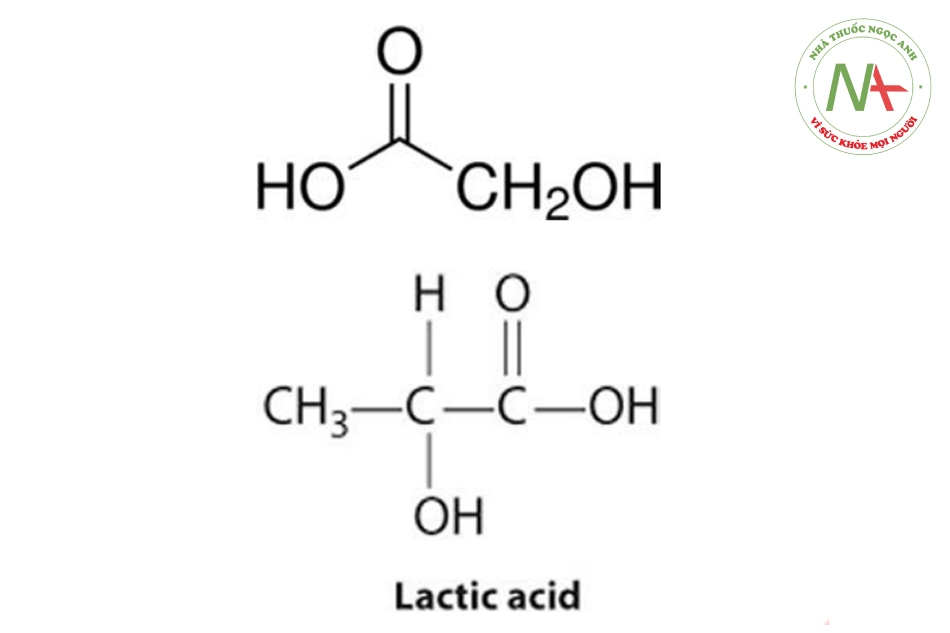
Các axit đơn chức phổ biến trong nhóm axit hữu cơ thường có một nhóm cacboxyl, và hầu hết các axit này được gọi là axit monocacboxylic. Ví dụ trong các axit hữu cơ như axit axetic (CH3COOH), axit glycolic và axit lactic.
Axit đa chức
Các axit đa chức có thể cho đi nhiều hơn một proton cho mỗi phân tử axit, khác với các axit đơn chức, chỉ cho một proton cho mỗi phân tử. Các axit đa chức được chia thành các nhóm nhỏ hơn, chẳng hạn như axit hai chức (có thể cho hai proton) và axit ba chức (có thể cho ba proton).
Axit hai chức (ở đây được ký hiệu là H2A) có thể phân ly một hay hai lần tùy thuộc vào độ pH. Mỗi phân li có hằng số phân li riêng, Ka1 và Ka2.
H2A (aq) + H2O(1) : H3O+ (aq) + HA- (aq) Ka1
HA- (aq) + H2O(l ) : H3O+(aq) + A2-(aq) Ka2
Hằng số phân ly đầu tiên thường lớn hơn hằng số thứ hai; tức là, Ka1> Ka2. Ví dụ, axit cacbonic yếu và không ổn định (H2CO3) có thể mất một proton để tạo thành 1 anion HCO3- và mất thêm một proton nữa để tạo thành anion carbonate (CO3-).
Axit hai chức được sử dụng để peel là axit malic, tartaric và azelaic.
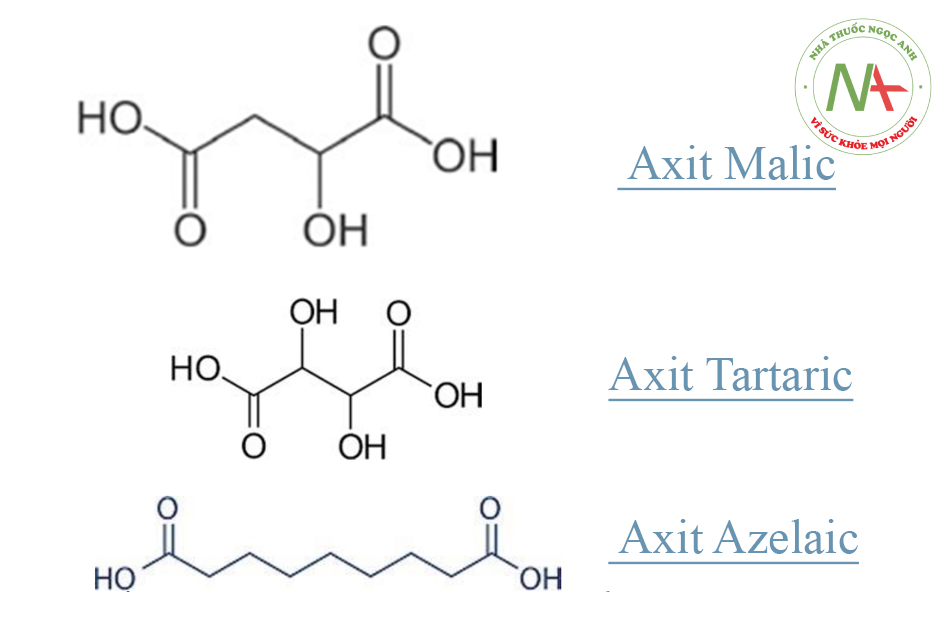
Hai lần phân ly có nghĩa là các axit như vậy có thể tạo ra hai hoạt chất peel khác nhau, tùy thuộc vào độ pH, với lần phân ly thứ hai ít tính axit hơn lần thứ nhất. Chúng ta sẽ xem xét phản ứng peel trên từng lần phân ly một.
Axit bazơ (H3A) có thể có một, hai hoặc ba lần phân ly và có ba hằng số phân ly, trong đó Ka1> Ka2> Ka3.
H3A (aq) + H2O(l) : H3O+(aq) + H2A – (aq) Ka1
2A (aq) H2O(l) H3O (aq) HA (aq) Ka2
HA2-(aq) + H2O(l) : H3O+(aq) + A3-(aq) Ka3
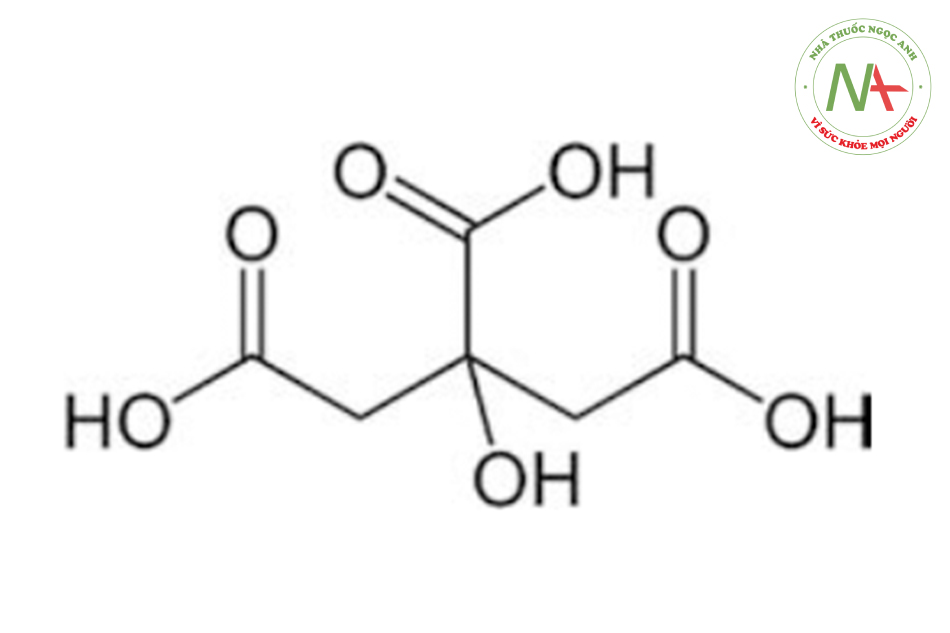
Một ví dụ của axit ba chức hữu cơ là axit citric, axit này có thể mất liên tiếp ba proton để cuối cùng tạo thành ion citrat. Mặc dù vị trí của các proton trên phân tử ban đầu có thể tương đương nhau, nhưng các giá trị Ka liên tiếp sẽ khác nhau, vì sẽ cần ít năng lượng hơn để mất một proton nếu bazo liên hợp có nhiều điện tích âm.
Cân bằng axit yếu – bazo yếu
Để mất một proton, pH của hệ phải lớn hơn pKa của axit. Nồng độ H + giảm trong dung dịch đó sẽ làm dịch chuyển cân bằng về dạng bazơ liên hợp (axit bị chuyển dạng mất proton). Còn trong các dung dịch có pH thấp (có tính axit), nồng độ H + sẽ đủ cao để làm cho axit vẫn ở dạng proton hóa của nó hoặc chuyển dạng bazo liên hợp sang dạng proton hóa.
Dung dịch của axit yếu và muối của bazơ liên hợp tương ứng sẽ tạo thành dung dịch đệm.
=> Mời bạn đọc thêm: Kỹ thuật TCA Peel vùng cổ, ngực, cánh tay và bàn tay.
Dung dịch đệm
Dung dịch đệm là dung dịch chứa hỗn hợp của một axit yếu và bazơ liên hợp của nó hoặc một bazơ yếu và axit liên hợp của nó. Đặc tính của dung dịch đệm là có thể
duy trì pH của dung dịch khi thêm một lượng nhỏ axit hoặc bazơ vào đó. Các dung dịch đệm được sử dụng như một phương tiện để giữ pH ở một giá trị gần như không đổi trong nhiều ứng dụng hóa học khác nhau. Nhiều sinh vật sống chỉ phát triển mạnh trong phạm vi pH tương đối nhỏ; dẫn tới luôn cần dung dịch đệm trong máu của chúng.
Nguyên lý Le Chatelier
Trong một dung dịch có sự cân bằng giữa một axit yếu (HA) và bazơ liên hợp của nó, A–:
HA + H2O = H3O+ + A –
- Khi các ion hydro (H +) được thêm vào dung dịch, cân bằng chuyển sang bên trái, vì lúc này có sự gia tăng ion hydro (H + hoặc H3O +) ở phía bên phải của phương trình.
- Khi các ion hydroxit (OH-) được thêm vào dung dịch, cân bằng chuyển sang phải, vì hydro sẽ giảm đi do phản ứng (H+ + OH– H2O).
Do đó, trong cả hai trường hợp, một số hợp chất được thêm vào để phản ứng chuyển dịch cân bằng theo nguyên lý của Le Chatelier và pH sẽ thay đổi ít hơn (so với dung dịch không đệm).
Phương trình Henderson – Hasselbalch
Hằng số phân ly axit đối với axit yếu, HA, được định nghĩa là:
Ka=[H+] [A-]/[HA]
Thao tác đơn giản với logarit đưa ra phương trình Henderson – Hasselbalch, mô tả pH theo pKa:
pH=pKa + log10 ([A-]/[HA])
Trong phương trình này [A-] là nồng độ của bazơ liên hợp và [HA] là nồng độ của axit. Khi nồng độ của axit và bazo liên hợp bằng nhau, thường được gọi là trạng thái bán trung hòa, thì pH = pKa. Nói chung, có thể dễ dàng tính được pH của dung dịch đệm khi biết được thành phần của hỗn hợp bằng bảng ICE. Bảng ICE (ban đầu, thay đổi, cân bằng) là một dạng ma trận đơn giản được sử dụng để đơn giản hóa việc tính toán trong các phản ứng cân bằng thuận nghịch (ví dụ: axit yếu và bazơ yếu hoặc sự hình thành ion phức).
Nên nhớ rằng độ pH được tính toán có thể khác với độ pH đo được trên thực tế.
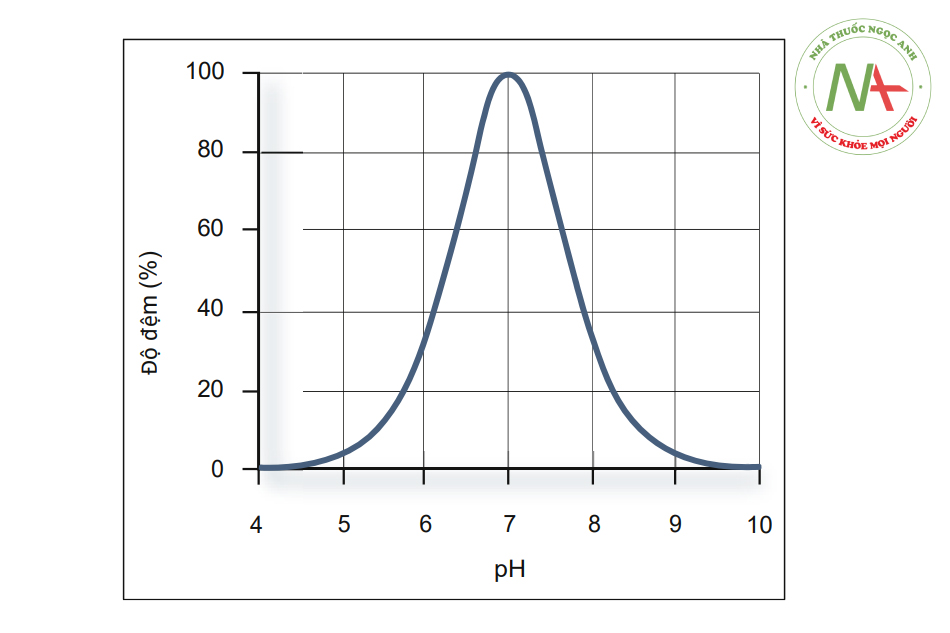
Độ đệm (Khả năng đệm)
Độ đệm (Hình.1.1) là thước đo định lượng khả năng chống lại sự thay đổi pH của dung dịch đệm khi bổ sung các ion hydroxit. Nó có thể được định nghĩa như sau:
Độ đệm = dn/d(pH)
trong đó dn là lượng (nhỏ) bazơ được thêm vào và d(pH) là sự thay đổi (vô cùng nhỏ) của pH. Với định nghĩa này, độ đệm có thể được biểu thị bằng:
dn/d(pH) = 2.303 (Kw/[H+] + [H+] + (CAKa[H+]/(Ka + [H+])2))
trong đó Kw là hằng số tự ion hóa của nước và CA là nồng độ của axit, bằng [HA] + [A-]. Thông số Kw/[H +] trở nên có ý nghĩa ở pH lớn hơn khoảng 11.5, và thông số thứ hai trở nên có ý nghĩa ở pH nhỏ hơn khoảng 2. Cả hai thông số này đều là đặc tính của nước và không phụ thuộc vào axit yếu. Xem xét thông số thứ ba, nó theo sau rằng:
- Độ đệm của một axit yếu đạt giá trị lớn nhất khi pH = pKa.
- Ở pH = pKa ± 1, độ đệm giảm xuống còn 33% giá trị lớn nhất. Đây là phạm vi gần đúng để dung dịch đệm bằng axit yếu có hiệu quả. Lưu ý: tại pH = pKa – 1, phương trình Henderson – Hasselbalch cho thấy tỷ lệ [HA]: [A-] là 10:1.
- Độ đệm tỷ lệ thuận với nồng độ của axit.
trị cực đại
Ứng dụng của dung dịch đệm
Khả năng duy trì độ pH của dung dịch đệm có ứng dụng to lớn trong sản xuất hóa chất và cần thiết cho nhiều quá trình sinh hóa. Dung dịch đệm lý tưởng cho một độ pH cụ thể có pKa bằng độ pH đó, vì dung dịch như vậy sẽ có khả năng đệm (độ đệm) tối đa.
Dung dịch đệm là cần thiết để giữ độ pH sinh lý chính xác cho các enzym trong nhiều sinh vật hoạt động. Một chất đệm gồm axit cacbonic (H2CO3) và bicacbonat (HCO3-) có trong huyết tương, để duy trì độ pH từ 7,35 đến 7,45.
Phần lớn các mẫu sinh học sử dụng trong nghiên cứu đều được nằm trong dung dịch đệm, cụ thể là nước muối đệm phosphat (PBS) có pH 7.4.
Trong da liễu thẩm mỹ, chú ý dung dịch đệm TCA có khả năng tạo ra rối loạn sắc tố.
Các dung dịch đệm thường gặp
- Citric acid, sodium citrate, pH dao động 2.5 – 5.6.
- Acetic acid, sodium acetate, pH dao động 3.7 – 5.6.
Sự trung hòa
Các bác sĩ có sự nhầm lẫn lớn giữa dung dịch peel đệm (xem ở trên) và peel trung tính. Trong hóa học, trung hòa là một phản ứng hóa học giữa axit và bazơ để tạo thành nước và muối.
Trong dung dịch, các ion hydro solvat hóa (ion hydronium, H3O +) phản ứng với các ion hydroxit (OH-) để tạo ra hai phân tử nước.
Phản ứng này cũng hình thành muối. Trong các phản ứng mà thành phần không phải dung dịch thì không phải lúc nào cũng tạo ra sản phẩm là nước, nhưng luôn luôn có sự cho đi proton (xem lý thuyết axit-bazơ Bronsted – Lowry).
Thông thường, các phản ứng trung hòa đều tỏa nhiệt (entanpi của phản ứng trung hòa). Tuy nhiên, cũng có phản ứng trung hòa thu nhiệt, là phản ứng giữa natri bicarbonat (baking soda) và bất kỳ axit yếu nào – ví dụ, axit axetic (giấm).
Trong peel da, trung hòa hóa chất peel là một bước quan trọng, được thực hiện khi quan sát thấy sương trắng trên da hoặc tính đủ thời gian tiếp xúc của chất peel với da. Đa số được trung hòa bằng cách thoa nước lạnh hoặc đắp khăn ướt, mát lên mặt sau khi xuất hiện sương trắng. Tuy nhiên, theo lý thuyết, sử dụng nước ngay sau khi xuất hiện sương trắng sẽ gây ra phản ứng tỏa nhiệt có thể gây bỏng. Lúc này người ta thường dùng các chất trung hòa khác như xịt bicarbonate hoặc chất làm sạch không xà phòng. Đối với một số hoạt chất peel như axit salicylic, dung dịch Jessner’s, TCA và phenol, hoạt chất trung hòa không quá quan trọng.
Trong các dung dịch axit alpha-hydroxy (AHA) trung hòa một phần, axit và một lượng ít bazơ được kết hợp trong một phản ứng hóa học thuận nghịch tạo ra axit không được trung hòa và muối.
Dung dịch tạo thành có ít axit tự do hơn và pH cao hơn dung dịch chưa được trung hòa. Trong các công thức peel được trung hòa 1 phần, muối có chức năng như một kho chứa axit có sẵn để tạo thành giai đoạn thứ hai. Điều này có nghĩa là các công thức peel được trung hòa 1 phần có thể cung cấp nhiều AHA hơn, nếu không muốn nói là nhiều hơn các dung dịch peel chỉ chứa axit tự do. Theo ngôn từ kỹ thuật, chúng có khả năng “giải phóng theo thời gian”. Do đó, sử dụng các dung dịch glycolic axit trung hòa 1 phần sẽ an toàn hơn.
Các nghiên cứu lâm sàng đã chỉ ra rằng chế phẩm axit lactic được trung hòa một phần giúp cải thiện làn da, cả về hình dáng và về mặt mô học. Các nghiên cứu khác sử dụng phương pháp nuôi cấy mô da cho thấy rằng axit glycolic được trung hòa một phần kích thích sự tăng sinh nguyên bào sợi – một chỉ số thể hiện sự tái tạo mô. Nhìn vào độ dẫn điện của da (một chỉ số về hàm lượng nước hoặc độ ẩm), các sản phẩm có độ pH cao hơn (những sản phẩm đã được trung hòa một phần) là chất dưỡng ẩm tốt hơn các sản phẩm có độ pH thấp hơn.
GIẢI PHẪU DA
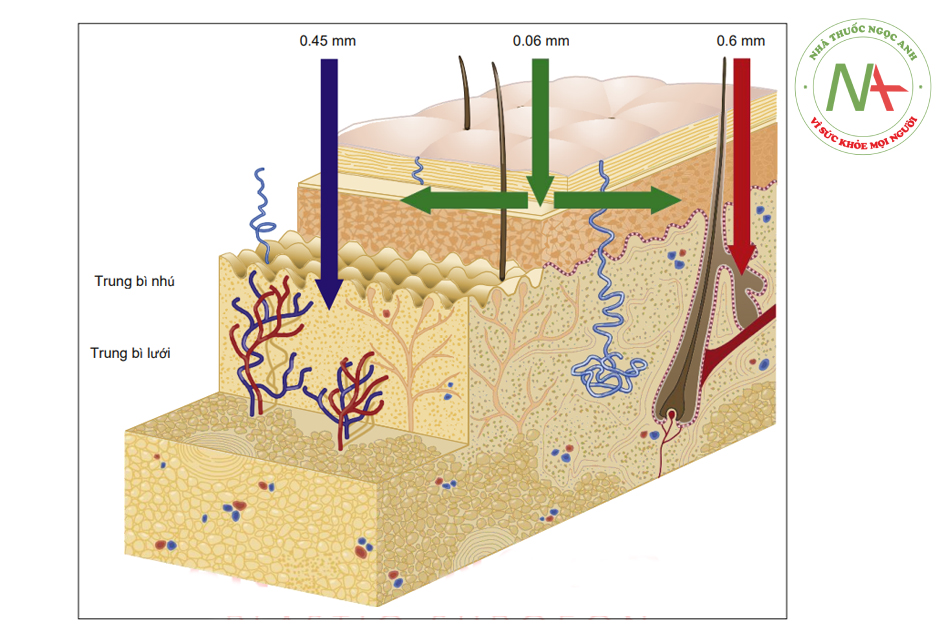
Giống như toàn bộ cơ thể con người, da có thể được coi là một dung dịch đã được hòa tan một số phân tử nhất định (Hình. 1.2). Đây là một ma trận các phân tử protein, lipid và carbohydrate với số lượng và tỷ lệ thay đổi.
Có nhiều nước trong lớp bì hơn là trong lớp thượng bì do lớp này có máu, glycosaminoglycans (GAGs) và bạch huyết, tất cả đều có hàm lượng nước cao; trong khi đó, lớp biểu bì tiếp xúc trực tiếp với môi trường nên cùng mất nước ít nhiều.
Có nhiều protein (keratin) ở lớp biểu bì hơn ở lớp bì, ngược lại, lớp bì có nhiều carbohydrate và lipid hơn và ở lớp dưới da, các thành phần này còn nhiều hơn.
Phân tử quan trọng nhất trong lớp biểu bì là một protein dạng sợi – keratin, có chức năng bảo vệ như một hàng rào vật lý, được sản xuất liên tục bởi tế bào sừng, được thay thế hoàn toàn sau mỗi 27 ngày.
Các phân tử quan trọng nhất của lớp bì là collagen, elastin, GAGs và proteoglycan. Collagen và elastin là protein, còn GAGs (ví dụ, axit hyaluronic) và proteoglycan là các polyme sinh học được hình thành chủ yếu bởi các loại đường giữ nước.
Collagen tạo nên tài nguyên cấu trúc của da và là loại protein dồi dào nhất trong cơ thể con người. Nó được hình thành chủ yếu bởi glycine, proline và hydroxyproline. Nó là một trong những protein tự nhiên có khả năng chống chịu tốt nhất và giúp hỗ trợ cấu trúc da. Elastin tương tự như collagen, nhưng nó là một loại protein có thể ‘co giãn’, biểu thị cho độ đàn hồi của da.
Elastin được cấu thành từ hai polypeptide là desmosine và isodesmosin.
GAGs chứa các loại đường cụ thể như glucosamine sulfate, N-acetylglucosamine và glucosamine hydrochloride, tất cả đều có khả năng ‘hút’ nước. Chúng
tạo thành các chuỗi phân tử dài, chẳng hạn như axit hyaluronic, keratin sulfat, heparin, dermatin và chondroitin, nhờ khả năng giữ nước mà chúng có thể tăng trọng lượng lên đến 1000 lần.
Lớp hạ bì hoặc mô dưới da chủ yếu chứa chất béo nên lớp da này có tương tác hóa học hoàn toàn khác với các dung dịch peel. Tuy nhiên các loại peel da thường không đi sâu tới lớp này.
Thành phần phân tử của các lớp da khác nhau có thể giải thích sự thay đổi của các tương tác giữa chúng và dung dịch peel cũng như kết quả thu được. Những lợi ích này tương quan với mức độ thâm nhập đạt được khi sử dụng một chất peel nhất định.
Điều này cũng đúng đối với từng độ pH trên các tầng da. Mặc dù độ pH của lớp biểu bì là một con số được xác định rõ ràng, nhưng độ pH của lớp bì không phải là một giá trị chính xác và rất khó để đo lường.
Lớp biểu bì hay lớp manti có tính axit là hệ quả của quá trình tiết bã nhờn và mồ hôi. Nó bảo vệ da và giúp da ít bị tổn thương hơn trước sự tấn công của các vi sinh vật như vi khuẩn và nấm. Lớp biểu bì khỏe mạnh có độ pH trong khoảng từ 4,2 đến 5,6 (khác nhau giữa các tầng da). Về mặt gen, da ở nam giới có pH thấp hơn.
Độ pH của lớp biểu bì cũng thay đổi tùy thuộc vào các tầng da phía dưới. Đối với độ pH “da” khoảng = 5, thì lớp sừng sẽ có độ pH rơi vào khoảng 5.6 và tầng dưới (chứa nhiều tế bào sắc tố). Một lưu ý nữa, da khô có tính axit cao hơn da dầu, có thể đạt đến độ pH = 6.
Bởi vì lớp hạ bì chứa một lượng đáng kể chất lỏng và máu, chúng ta có thể cho rằng độ pH là 6 đến 6,5 và nó có tính axit thấp hơn một chút so với biểu bì, với độ pH là 6 đối với lớp nhú bì và 7 đối với lớp trung bì lưới.
Đặc tính hóa học cơ bản của da
Thành phần hóa học của da được mô tả trong Hộp 1.1.
| Hộp 1.1: Thành phần hóa học của da người |
| Nước 70%
Proteins 25.5% Lipids 2.0% Vi khoáng chất 0.5% (e.g., Kẽm, Đồng, Selen) Carbonhydrates 2.0% (mucopolysaccharides) |
Axit và màng tế bào
Màng tế bào chứa các este axit béo (phospholipid). Axit béo và các dẫn xuất của axit béo là các axit cacboxylic đóng một vai trò quan trọng trong sinh học. Chúng chứa các chuỗi carbon dài và một nhóm axit cacboxylic ở một đầu. Màng tế bào của gần như tất cả các sinh vật chủ yếu được tạo thành từ một lớp kép phospholipid, một micelle của các este axit béo kỵ nước với các nhóm “đầu” là phốt phát phân cực, ưa nước. Màng tế bào cũng chứa các thành phần khác, một số thành phần có thể tham gia vào phản ứng axit-bazơ. Màng tế bào thường không thấm nước đối với các phân tử tích điện hoặc có kích thước lớn, phân cực vì các chuỗi acyl béo ở phía ngoài không thấm nước. Nhiều phân tử sinh học quan trọng, ví dụ như một số dược phẩm, có bản chất là các axit yếu hữu cơ, vẫn có thể đi qua màng ở dạng proton hóa, không tích điện (ví dụ là bazơ liên hợp). Tuy nhiên, dạng tích điện thường dễ hòa tan hơn trong máu và dịch bào – hai môi trường có tính nước. Khi môi trường ngoại bào có tính axit cao hơn độ pH trung tính trong tế bào, một số axit nhất định sẽ tồn tại ở dạng trung tính và sẽ hòa tan trong màng, cho phép chúng đi qua lớp phospholipid kép. Axit mất đi một proton ở pH nội bào sẽ tồn tại ở dạng hòa tan, tích điện và do đó có thể khuếch tán qua tế bào đến mục tiêu của chúng.
ĐẶC TÍNH HÓA HỌC CƠ BẢN CỦA CÁC HOẠT CHẤT THƯỜNG ĐƯỢC SỬ DỤNG TRONG PEEL DA
Phần này sẽ đánh giá các đặc tính chung của hoạt chất sử dụng trong peel da. Đối với axit alpha-hydroxy, nhóm cacboxyl của axit nằm trên cacbon đầu tiên (C1) và hydroxyl nằm trên cacbon alpha (C2). Axit salicylic là một axit beta-hydroxy với nhóm hydroxyl trên C3.
Giả thuyết về cơ chế hoạt động của các hoạt chất peel
Dựa trên các đặc tính khác nhau và cách thức hoạt động, L. Dewandre chia các hoạt chất peel thành 3 loại: chuyển hóa, ăn mòn và gây độc (BẢNG 1.1).
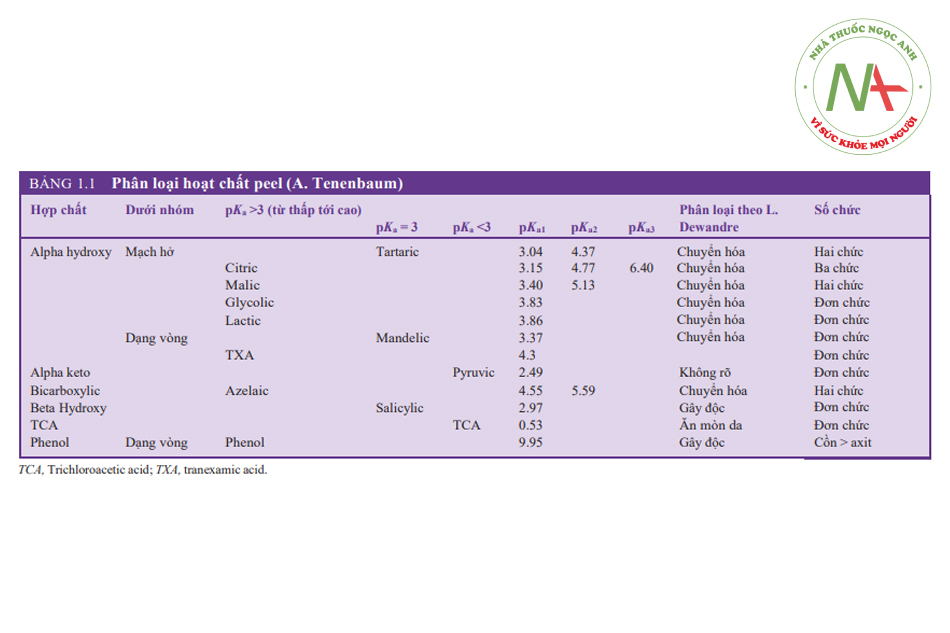
HOẠT CHẤT PEEL CHUYỂN HÓA
Ngoại trừ axit glycolic và axit lactic, các hoạt chất peel chuyển hóa được mô tả trong các phần sau đây thường ít được sử dụng trong peel da hóa chất. Ngày nay, axit glycolic và axit lactic gần như là các hợp chất phổ biến nhất trong skincare và các quy trình peel da hóa chất.
Alpha Hydroxy Acids
AHA là hợp chất hóa học được cấu tạo bởi một axit cacboxylic với một nhóm hydroxy ở cacbon liền kề. Chúng có thể là hợp chất tự nhiên hoặc tổng hợp. AHA là một hợp phần ‘nổi tiếng’ trong ngành mỹ phẩm. Chúng thường được tìm thấy trong các sản phẩm có tác dụng làm giảm nếp nhăn hoặc các dấu hiệu lão hóa và cải thiện tổng thể của làn da. Chúng cũng được sử dụng làm hoạt chất peel có sẵn trong da liễu, spa chăm sóc sức khỏe và sắc đẹp cũng như các bộ skincare tại nhà (với nồng độ thấp). Mặc dù hiệu quả của chúng đã được ghi nhận, nhưng cũng có nhiều sản phẩm xuất hiện trên thị trường với các tuyên bố vô căn cứ về hiệu quả. Nhiều AHA nổi tiếng là chất cấu thành nên các hợp chất hóa học hữu cơ có vai trò trị liệu trong da liễu: phổ biến và đơn giản nhất là axit glycolic, axit lactic, axit citric và axit mandelic.
Dung dịch AHA dùng để peel thường chứa axit béo (lactic, glycolic, tartaric và malic) hoặc cấu dạng vòng (mandelic) đã được tổng hợp. Có nhiều chế phẩm với độ đặc khác nhau, dao động từ 10% đến 70% được sử dụng để peel mặt, phổ biến nhất là 50% hoặc 70%. AHA là axit yếu, có tác động tạo ra sự chuyển hóa trên da hoặc ăn mòn da. Ở nồng độ thấp (<30%), chúng khử các nhóm sulfat và phosphat khỏi bề mặt tế bào sừng, dẫn tới giảm sự gắn kết của các tế bào sừng, và lớp này dần bị bong ra. Ở nồng độ cao hơn, tác dụng của chúng chủ yếu là phá hủy. Do tính axit của AHA thấp, chúng không tạo ra đủ sự đông tụ của các protein trên da và do đó không thể tự trung hòa. Chúng phải được trung hòa bằng cách sử dụng một bộ đệm yếu.
Để hiểu tác dụng tại chỗ của AHA, chúng ta phải có kiến thức về cấu trúc da và sự thay đổi của da trong quá trình lão hóa. Da người có hai thành phần chính, biểu bì vô mạch và lớp bì chứa mạch máu bên dưới. Lão hóa da chủ yếu liên quan đến lớp bì, được ‘hình thành’ bởi cả các yếu tố lão hóa nội tại và ngoại tại.
AHA được sử dụng phổ biến nhất trong các ứng dụng mỹ phẩm thường có nguồn gốc từ các sản phẩm trái cây bao gồm axit glycolic (đường mía), axit lactic (sữa lên men), axit malic (táo), axit citric (trái cây họ cam quýt) và axit tartaric (nho và rượu vang). Dù là loại nào thì AHA vẫn phải tiếp xúc trực tiếp với da để gây được tác động. Sinh khả dụng (bị ảnh hưởng chủ yếu bởi kích thước phân tử) là một đặc điểm quan trọng, quyết định khả năng xâm nhập vào các lớp da phía trên cùng. Axit glycolic là AHA có kích thước phân tử nhỏ nhất, nên sẽ có sinh khả dụng lớn nhất và xâm nhập vào da dễ dàng nhất; điều này cũng giải thích cho sự phổ biến của sản phẩm này trong các ứng dụng mỹ phẩm.
- Hiệu ứng trên lớp thượng bì: AHA có ảnh hưởng sâu sắc đến quá trình sừng hóa, có thể phát hiện trên lâm sàng bởi sự hình thành lớp sừng mới. Thông qua việc giảm độ kết dính tế bào giữa các lớp sừng ở tầng dưới của thượng bì, AHA gây nên tình trạng bong các lớp tế bào sừng ở phía trên.
- Hiệu ứng trên lớp bì: Các loại AHA có sinh khả dụng lớn hơn sẽ có tác dụng sâu hơn trên da. Axit glycolic, axit lactic và axit xitric, khi sử dụng tại chỗ cho vùng da bị tổn thương do ánh sáng, đã được chứng minh là làm tăng lượng mucopolysaccharide và collagen và tăng độ dày của da mà không phát hiện ra tình trạng viêm (đánh giá bằng sinh thiết da).
AHA thường an toàn khi sử dụng trên da với vai trò là một chất mỹ phẩm (liều lượng tương đối thấp). Các tác dụng phụ thường gặp nhất là kích ứng da nhẹ, mẩn đỏ và bong tróc. Mức độ nghiêm trọng thường phụ thuộc vào độ pH và nồng độ của axit được sử dụng.
Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) cũng đã cảnh báo người tiêu dùng rằng nên cẩn thận khi sử dụng AHA sau khi một nghiên cứu được tài trợ phát hiện ra rằng chúng có thể làm tăng nhạy cảm của da với ánh nắng mặt trời.
So sánh độ pH với pKa: Các tác động (trong thẩm mỹ) của axit Alpha-Hydroxy
- Đối với dung dịch có pH lớn hơn pKa, AHA về cơ bản là chất dưỡng ẩm. Sự khác biệt chính giữa tác dụng giữ ẩm và ăn mòn da liên quan đến việc trung hòa các phân tử AHA. Trung hòa AHA với natri hoặc amoni tạo ra muối có tác dụng giữ ẩm tốt hơn và ít ăn da hơn.
- Đối với dung dịch có pH nhỏ hơn hoặc bằng pKa, các AHA là chất tiêu sừng (tương tự như việc chúng ta thực hiện quá trình tẩy da chết). Trong trường hợp này, dạng axit là chất ưu tiên, được hấp thụ nhiều hơn và tạo điều kiện cho sự thâm nhập. Tác dụng chống lão hóa của chúng có thể được so sánh với retinoid, nhưng cơ chế hoạt động của chúng khác nhau. Chúng can thiệp vào một số loại enzyme (sulfotransferase, phosphotransferase, kinase) có chức năng là cố định các nhóm sulfat và photphat trên bề mặt của tế bào sừng dẫn tới giảm các nhóm này, từ đó làm giảm độ âm điện và sự kết dính của các tế bào sừng, cuối cùng dẫn đến hiện tượng bong da. Hoạt động này có thể được mô tả như một hoạt động trao đổi chất. Tuy nhiên, khi được sử dụng ở nồng độ mạnh từ 30% đến 70% để peel, tác động của chúng dựa trên tính axit là chính (phá hủy).
AHA mạch hở (Glycolic, Lactic, Malic, Tartaric, Citric) có pKa >3
Glycolic Acid (pKa = 3.83) với các nồng độ khác nhau
Viết tắt: GA
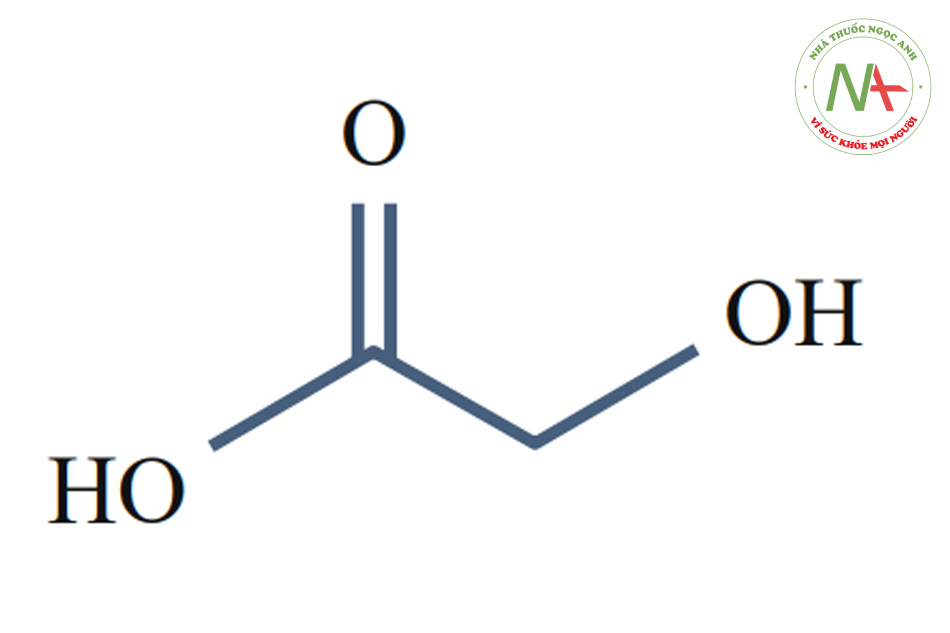
Thông số hóa học:
- Công thức: C2H4O3.
- Khối lượng mol: 76.05 g/mol.
- Chế phẩm: Chất rắn màu trắng dạng bột.
- Khối lượng riêng: 1.27 g/cm3.
- Tính hòa tan trong dd: 70% trong dung dịch.
- Hòa tan trong các dung môi khác: alcohols, acetone, acetic acid, và ethyl acetate.
- Tính axit (pKa): 3.83.
Axit glycolic (hoặc axit hydroxy axetic) là loại AHA nhỏ nhất. Chất rắn kết tinh không màu, không mùi và hút ẩm này rất dễ hòa tan trong nước.
Hình thành từ đường mía, axit glycolic có tác dụng tẩy tế bào chết nhẹ. Dung dịch axit glycolic peel hoạt động bằng cách ‘nới lỏng’ liên kết của các lớp sừng (gắn với nhau bằng các phần tử bản chất lipid), làm các lớp trên cùng bong ra. Hoạt chất peel này cũng kích thích tăng sinh collagen.
Ở nồng độ thấp, 5% đến 10%, axit glycolic làm giảm độ bền chắc các liên kết của tế bào ở lớp trên cùng của da. Hành động này thúc đẩy quá trình tẩy tế bào chết ở lớp ngoài cùng, giúp da mịn màng hơn sau khi sử dụng thường xuyên axit glycolic tại chỗ. Nồng độ axit glycolic tương đối thấp này được sử dụng hàng ngày như một liệu pháp đơn trị hoặc một phần của liệu pháp chăm sóc da toàn diện đối với các tình trạng như mụn trứng cá, tổn thương do ánh sáng và nếp nhăn. Tuy nhiên, cần phải cẩn thận để tránh kích ứng với hoạt chất, vì điều này có thể làm trầm trọng thêm các vấn đề về sắc tố trên bệnh nhân. Các công thức mới kết hợp axit glycolic với một axit amin như arginine và tạo thành một hệ thống giải phóng hoạt chất theo thời gian làm giảm nguy cơ kích ứng mà không ảnh hưởng đến hiệu quả của axit glycolic. Ngoài ra có thể sử dụng allantoin để chống dị ứng. Vì tính an toàn của nó, axit glycolic ở nồng độ dưới 10% có thể được sử dụng hàng ngày đối với hầu hết tình trạng da, ngoại trừ những người có làn da rất nhạy cảm.
Ở nồng độ trung bình, từ 10% đến 50%, lợi ích của nó rõ ràng hơn nhưng chỉ giới hạn ở việc làm mịn da tạm thời mà không có nhiều kết quả lâu dài. Tuy nhiên, ở nồng độ này có thể sử dụng AHA cho mục đích chuẩn bị da để sau này peel bằng axit glycolic nồng độ cao (50% -70%) cũng như để ‘làm mồi’ trước khi peel da bằng hóa chất tác động tầng da sâu như TCA.
Ở nồng độ cao hơn, 50% đến 70%, áp dụng trên da trong thời gian 3 đến 8 phút (thường do bác sĩ thực hiện), axit glycolic thúc đẩy sự phá vỡ liên kết giữa các tế bào sừng và có thể được sử dụng để điều trị mụn trứng cá hoặc tổn thương da do ánh sáng (chẳng hạn như rối loạn sắc tố dạng đốm, hoặc các nếp nhăn nhỏ). Việc cho da tiếp xúc với hoạt chất trong thời gian ngắn như vậy sẽ cho ra kết quả phụ thuộc vào độ pH của dung dịch (sản phẩm càng có tính axit hoặc pH thấp hơn, kết quả càng rõ rệt), nồng độ của GA (nồng độ cao hơn tạo ra phản ứng mạnh hơn) , thời gian thoa (3 – rất ngắn cho tới 8 – ngắn) và tính trạng da trước đó như có sử dụng retinoid trước đó. Mặc dù chỉ định peel AHA nồng độ từ 50% đến 70% sẽ mang lại kết quả có lợi, nhưng cần phải điều trị nhiều lần sau mỗi 2 đến 4 tuần để có kết quả tối ưu.
Lactic Acid (pKa = 3.86)
Axit lactic có nguồn gốc từ sữa lên men hoặc quả việt quất dại. Hoạt chất này sẽ loại bỏ các tế bào chết và thúc đẩy hình thành một làn da khỏe mạnh, mềm mại và rạng rỡ hơn.
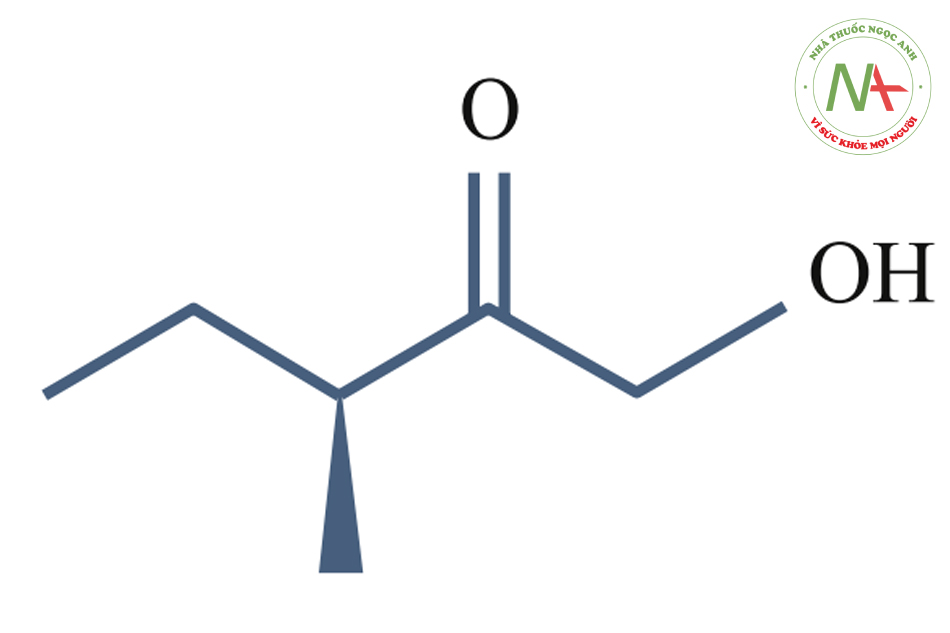
Thông số hóa học:
- Công thức: C3H6O3.
- Khối lượng mol: 90.08g/mol.
- Tính axit (pAa):^3.86 at 25°C.
Theo quan điểm của chúng tôi, dung dịch peel glycolic và lactic phải có độ pH từ 1,5 đến 2,5 để vừa có thể gây viêm, vừa có thể kích thích tăng sinh mô mới, với tác dụng chuyển hóa của chúng, về cơ bản sẽ giúp thay một lớp thượng bì cũ thành mới.
Malic Acid (pKa1 = 3.4, pKa2 = 5.13)
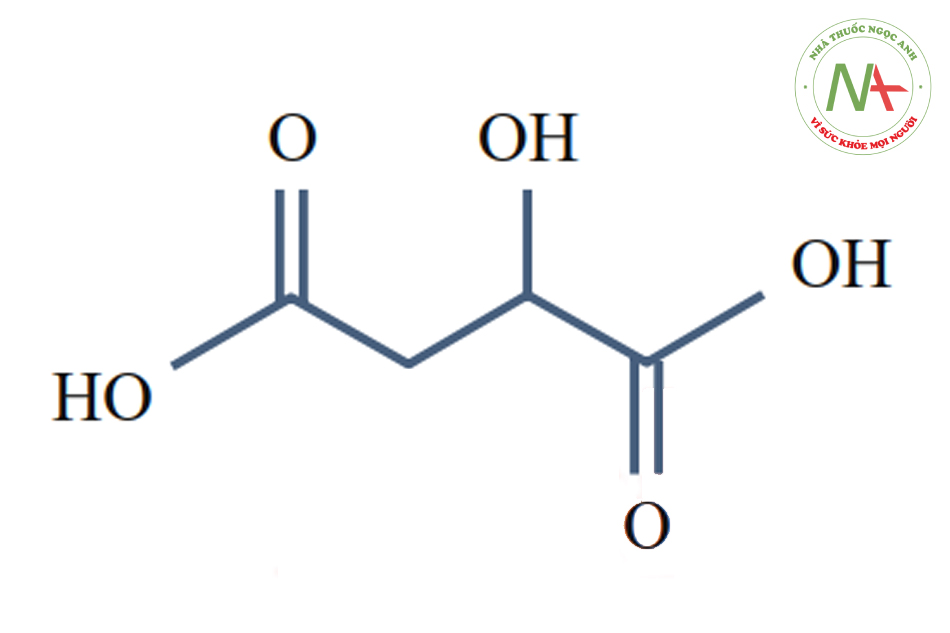
Hoạt chất này có khả năng xâm lấn nhẹ, chiết xuất từ táo. Chúng kích thích mở lỗ chân lông, cho phép các LCL đẩy chất nhờn ra ngoài và giảm mụn trứng cá.
Tartaric Acid (pKa1 = 3.04, pKa2 = 4.37)
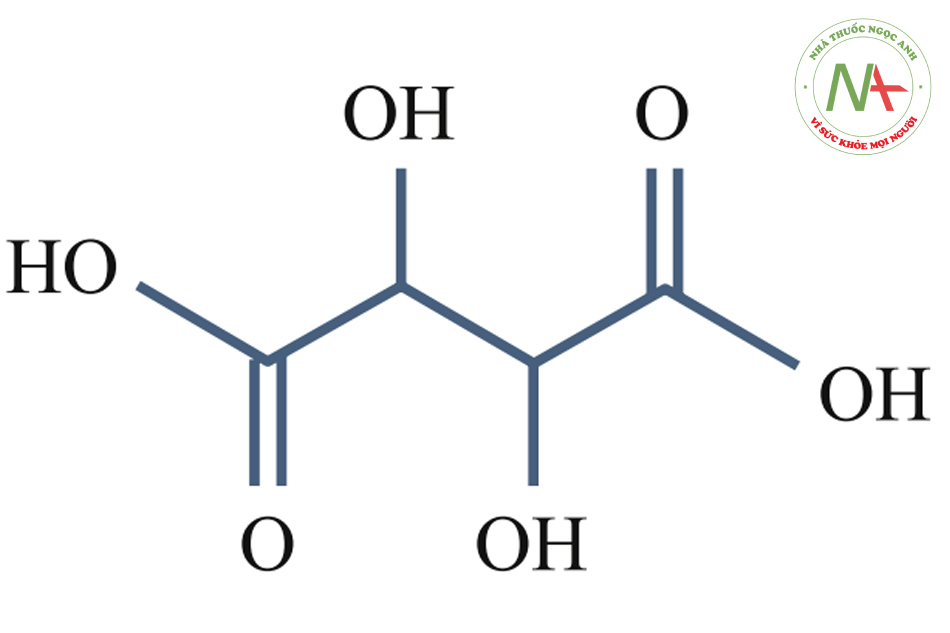
Hoạt chất này chiết xuất từ nho và có khả năng mang lại những lợi ích tương tự như các loại peel nêu trên.
Citric Acid (pKa1 = 3.15, pKa2 = 4.77, pKa3 = 6.40)
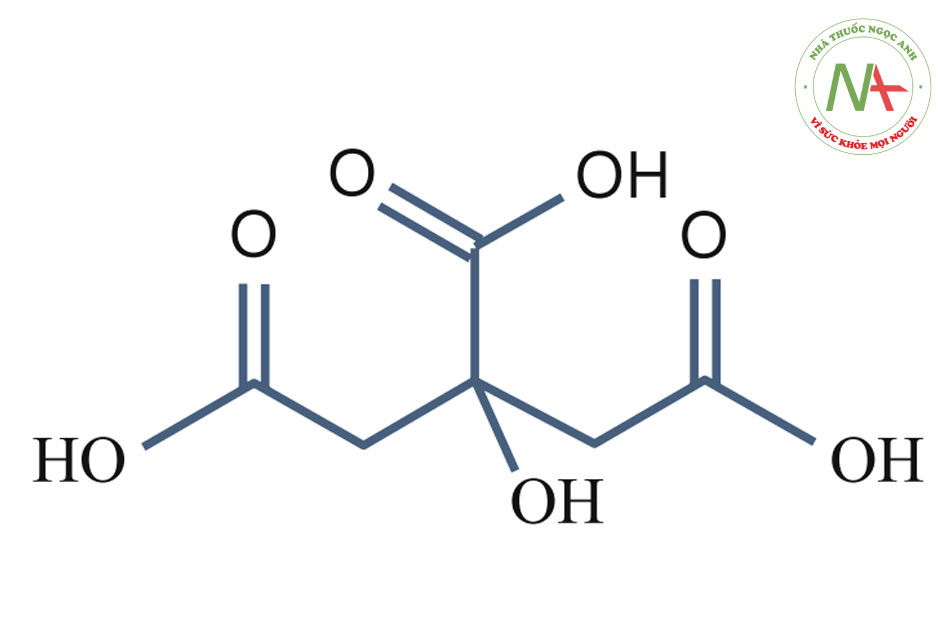
Axit citric được chiết xuất từ chanh vàng, cam, chanh và dứa. Những hoạt chất này tuy đơn giản nhưng hiệu quả. Tuy nhiên do không xâm nhập xuống tầng da sâu nên không cải thiện đáng kể với một lần điều trị.
Axit citric là axit ba chức, có ba giá trị pKa. Nó khá thú vị, bởi vì pKa đầu tiên thấp hơn pKa của axit glycolic đơn chức, và hai lần tách đầu tạo 2 dung dịch peel (pKa1 = 3,15, pKa2 = 4,77) còn lần cuối tạo ra dung dịch đệm (với pKa3 = 6,40).
Như vậy, có thể dễ dàng hiểu rằng axit citric dùng để peel mà không cần bất kỳ chất trung hòa hay chất đệm nào.
AHA thơm với pKa >3
Mandelic Acid (pKa = 3.37)
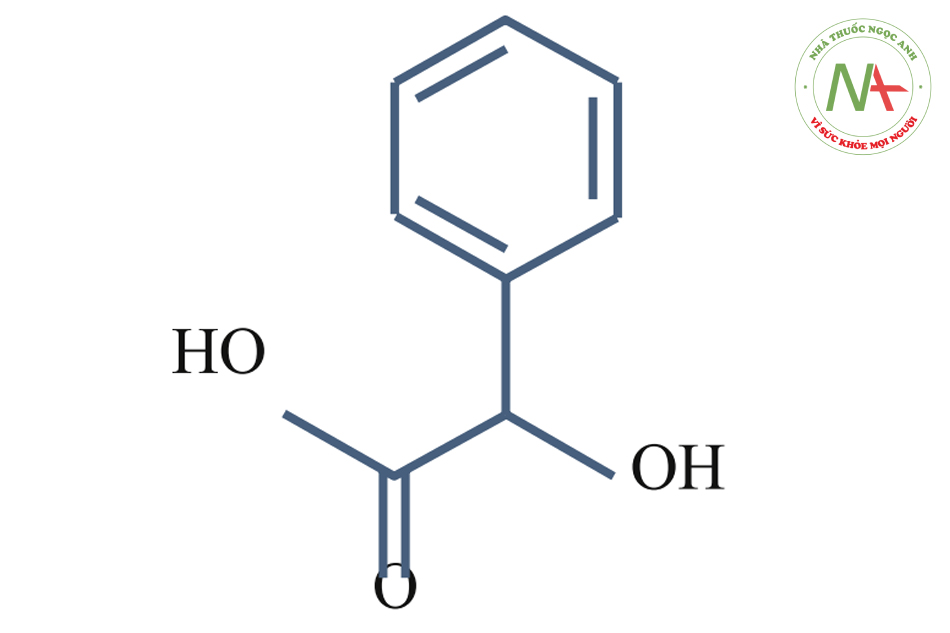
Axit Mandelic là một AHA thơm có công thức phân tử C8H8O3. Nó là một chất rắn kết tinh màu trắng có thể hòa tan trong nước và hầu hết các dung môi hữu cơ thông thường.
Axit Mandelic trước giờ được sử dụng như một chất kháng khuẩn, đặc biệt là trong điều trị nhiễm trùng đường tiết niệu. Nó cũng đã được sử dụng như một loại thuốc kháng sinh uống. Gần đây, axit mandelic nổi lên với một vai trò mới, là chất điều trị tại chỗ cho mụn trứng cá ở tuổi trưởng thành. Nó cũng được sử dụng như một chất thay thế cho axit glycolic trong các sản phẩm chăm sóc da. Acid mandelic có TLPT lớn hơn axit glycolic, có khả năng dung nạp và kháng khuẩn tốt hơn trên da.
James E. Fulton là người tiên phong sử dụng chúng Trong routine skincare. Ông cũng là người có công trong việc phát triển axit retinoic (tretinoin, Retin A) vào năm 1969 cùng với người cố vấn của mình, Albert
Kligman, tại Đại học Pennsylvania. Trên cơ sở nghiên cứu này, các chuyên gia da liễu hiện nay đã coi axit mandelic như một phương pháp điều trị cho nhiều loại bệnh lý về da, từ mụn trứng cá đến nếp nhăn; nó đặc biệt tốt trong điều trị mụn trứng cá ở tuổi trưởng thành vì chúng điều trị được cùng lúc cả hai vấn đề trên. Axit này cũng thường được sử dụng như một liệu pháp tái tạo da bề mặt trước và sau điều trị laser, vì chúng giúp giảm thời gian và mức độ kích ứng.
Dung dịch axit mandelic dùng để peel ngày nay được thương mại hóa dưới dạng gel có độ nhớt nhất định, giúp chúng thân thiện với người mới bắt đầu.
Alpha Keto Acids có pKa <3
Pyruvic Acid (pKa = 2.49)
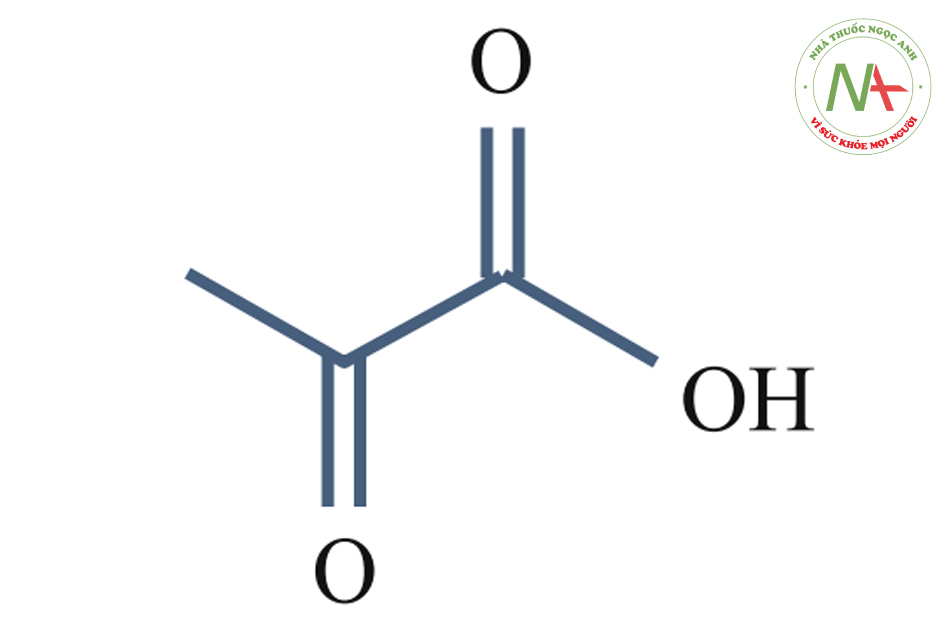
Dung dịch axit pyruvic 40% đến 50% trong etanol là loại pyruvate được sử dụng nhiều nhất trong thực tế hiện nay.
Axit pyruvic là một xeton cũng như axit alpha-keto đơn giản nhất. Ion cacboxylat (COOH) (anion) của axit pyruvic, CH3COCOO-, được gọi là pyruvate và là hợp chất chính trong một số con đường trao đổi chất.
Nó thường được sử dụng để điều trị mụn trứng cá dạng sẩn nhẹ đến trung bình với nồng độ từ 40% đến 50% mỗi 2 tuần trong thời gian 3 đến 4 tháng. Nó làm giảm tiết bã mà không làm ảnh hưởng tới độ ẩm da.
Bi Carboxylic Acid có pKa >3
Azelaic Acid (pKa1 = 4.550, pKa2 = 5.598)
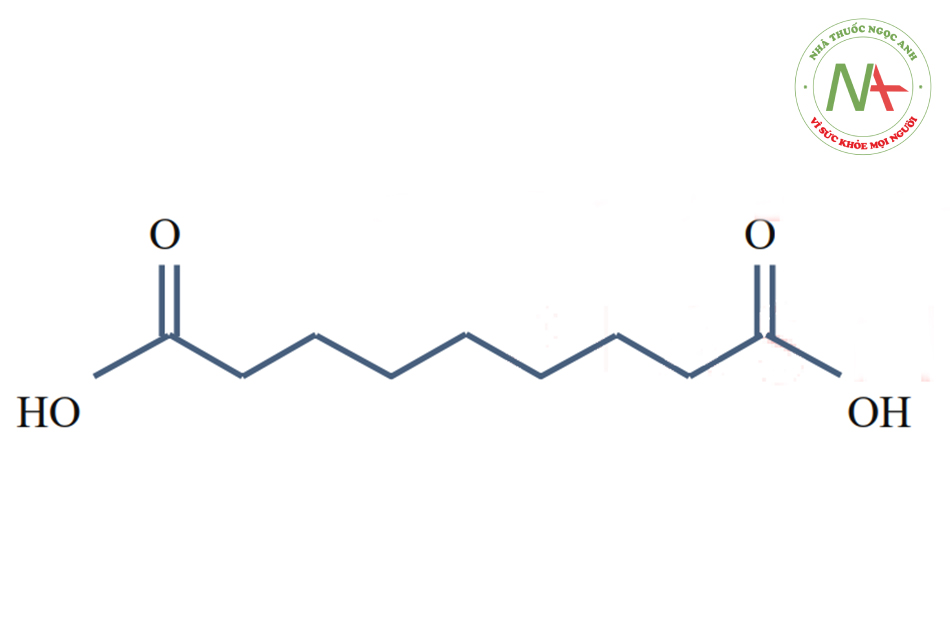
Axit azelaic hoặc axit 1,7-heptane dicacboxylic là một axit cacboxylic bão hòa được tìm thấy tự nhiên trong lúa mì, lúa mạch và lúa mạch đen. Nó có hoạt tính với nồng độ 20% trong các sản phẩm bôi ngoài da được sử dụng chủ yếu trong điều trị mụn trứng cá mức độ nhẹ đến trung bình và bệnh trứng cá đỏ dạng sẩn. Nó hoạt động bằng cách ức chế sự phát triển của vi khuẩn da gây ra mụn trứng cá và bằng cách giữ cho lỗ chân lông trên da thông thoáng.
Chúng có một số đặc tính thú vị:
- Kháng khuẩn: Giảm sự phát triển của vi khuẩn trong nang lông (Propionibacterium acnes, Staphylococcus epidermis).
- Tiêu sừng và mụn: Giải quyết tình trạng tăng sinh bất thường của các tế bào sừng thượng bì.
- Loại bỏ các gốc tự do và giảm viêm.
- Giảm sắc tố (ức chế tyrosinase yếu).
- Không gây độc và dung nạp tốt.
Axit này không dẫn tới tình trạng kháng kháng sinh, giảm tiết bã, tăng nhạy cảm với ánh sáng, gây nhuộm da hoặc quần áo; tuy nhiên dạng 20% của chúng có thể gây kích ứng trên da.
Axit azelaic là axit hai chức, có hai giá trị pKa. Nó khá thú vị, vì pKa thứ hai của nó gần bằng độ pH của da (5.5).
Như vậy, chúng ta có thể dễ dàng hiểu rằng axit azelaic dùng để peel có thể cần được trung hòa nhưng không cần bất kỳ dung dịch đệm nào.
Trong môi trường thí nghiệm, axit azelaic hoạt động như một chất gắp (bắt giữ) các gốc tự do và ức chế một số enzyme oxidoreductase, bao gồm 5-alpha reductase, enzym có khả năng biến testosterone thành dihydrotestosterone. Nó bình thường hóa quá trình sừng hóa và dẫn đến giảm hàm lượng axit nhờn tự do trong lipid trên bề mặt da.
Ngoài ra, axit azelaic có đặc tính kháng vi-rút và chống phân bào. Chúng cũng có thể hoạt động như một chất chống tăng sinh và một chất độc tế bào thông qua việc ngăn chặn quá trình hô hấp của ty thể và tổng hợp DNA.
Dung dịch peel BHA với pKa khoảng 3
Việc sử dụng dung dịch peel axit beta hydroxy (BHA) đang dần trở nên phổ biến (thay cho AHA mạnh hơn) do BHA có khả năng đi sâu vào lỗ chân lông. Các nghiên cứu chỉ ra rằng BHA giúp kiểm soát dầu và mụn cũng như loại bỏ tế bào da chết ở một mức độ nhất định tốt hơn AHAs vì BHA có tính ưa dầu hơn AHAs.
Axit salicylic (từ tiếng Latin Salix có nghĩa là: cây liễu) là một BHA hữu cơ, được tổng hợp sinh học và hiện được sử dụng phổ biến. Natri salicylat được tổng hợp bằng cách cho natri phenolat (muối natri của phenol) với carbon dioxide ở áp suất và nhiệt độ cao. Axit hóa sản phẩm bằng axit sunfuric tạo ra axit salicylic. Ngoài ra, nó có thể được điều chế bằng cách thủy phân aspirin (axit axetyl salixylic) hoặc dầu của cây lộc đề xanh (metyl salicylat) với axit/bazơ mạnh.
Salicylic Acid (pKa = 2.97)
Loại peel được sử dụng phổ biến nhất hiện nay là axit salicylic 30% trong etanol.
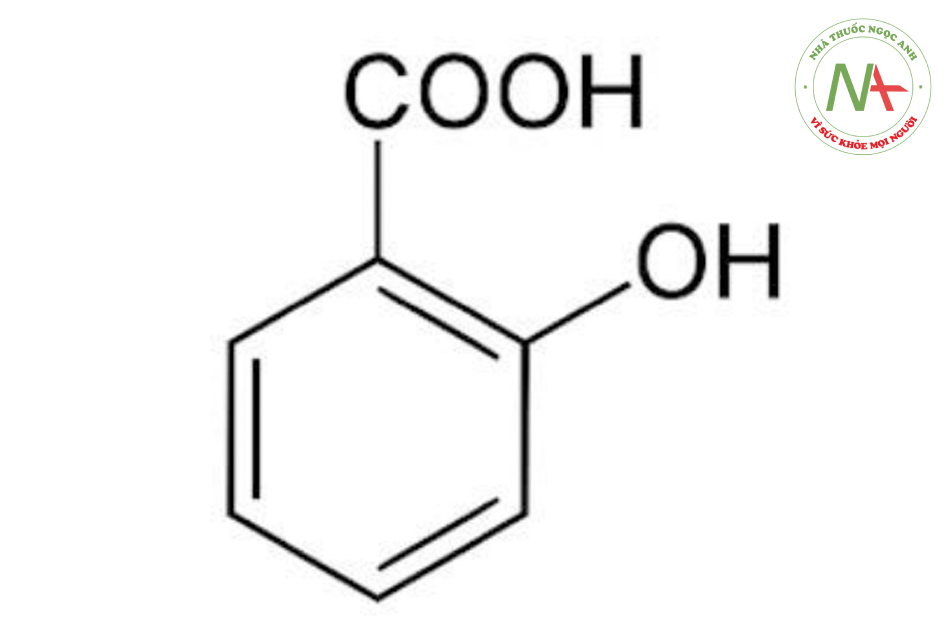
Axit salicylic hòa tan trong lipid (ưa béo); do đó nó là một chất peel tốt cho mụn trứng cá. Axit salicylic có khả năng thâm nhập vào mụn tốt hơn các axit khác. Tác dụng chống viêm và vô cảm của salicylate giúp làm giảm số lượng ban đỏ và cảm giác khó chịu sau peel da bằng hóa chất.
Axit salicylic là một thành phần quan trọng trong nhiều sản phẩm chăm sóc da, điều trị mụn trứng cá, bệnh vẩy nến, vết chai, sần, dày sừng và mụn cóc. Nó hoạt động như một tác nhân tiêu sừng và phân giải mụn bằng cách làm cho các tế bào của lớp biểu bì bong ra dễ dàng hơn, mở các lỗ chân lông bị tắc và tiêu diệt vi khuẩn bên trong, ngăn ngừa lỗ chân lông bị tắc nghẽn trở lại bằng cách thu hẹp đường kính lỗ chân lông và kích thích sự phát triển của tế bào mới. Do tác dụng của nó đối với các tế bào da, axit salicylic được sử dụng trong một số loại dầu gội đầu để điều trị gàu. Sử dụng axit salicylic nồng độ cao có thể gây tăng sắc tố da ở những bệnh nhân có làn da không bệnh lý, những người có da sẫm màu (phân loại Fitzpatrick IV, V, VI) và ở những bệnh nhân không thường xuyên sử dụng kem chống nắng phổ rộng.
Axit salicylic còn được gọi là axit 2-hydroxy benzoic, là một axit cacboxylic kết tinh và được phân loại là BHA. Axit salicylic ít tan trong nước nhưng rất dễ tan trong ethanol và ete (như phenol và resorcinol). Nó được làm từ natri phenolat, và điều này giải thích đặc tính tương tự phenol của chúng (đều gây độc khi được sử dụng với số lượng lớn và trên diện tích bề mặt lớn).
Axit salicylic được tìm thấy tự nhiên trong một số loại cây (Spiraea ulmaria, Andromeda leschenaultii), đặc biệt trong các loại hoa quả.
Dung dịch Jessner
Tiền thân là công thức Coombe’s, được BS Max Jessner thay đổi và hình thành dung dịch Jessner (Kết hợp 14% axit salicylic, 14% axit lactic và 14% resorcinol trong ethanol.) Tác dụng chính của nó là phá vỡ các cầu nối nội bào giữa các tế bào sừng, trong khi thành phần axit salicylic cũng cho phép thâm nhập tốt hơn qua làn da nhiều bã nhờn. Nó là một loại peel mạnh hơn axit salicylic 30%.
Retinoic Acid
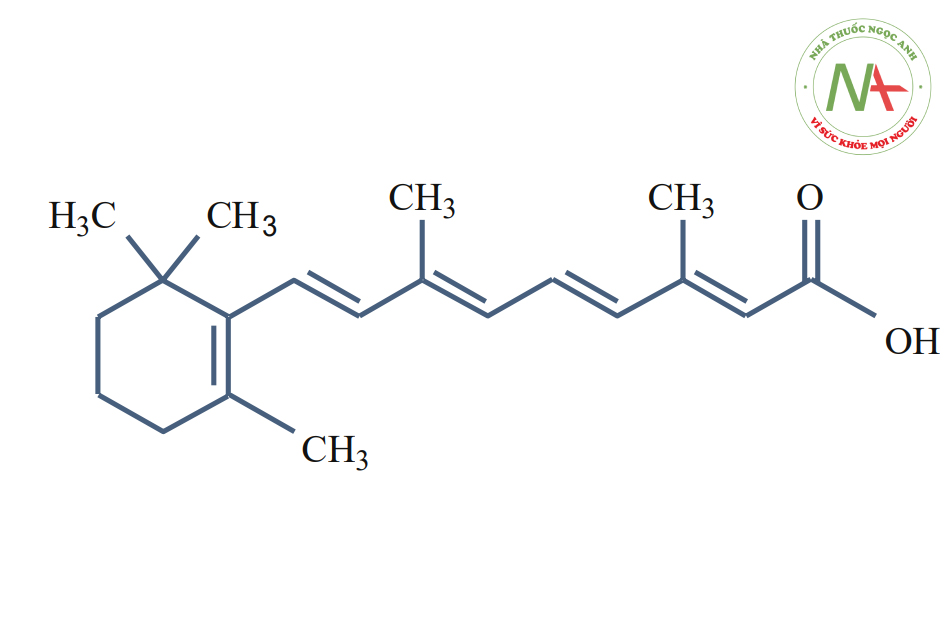
Axit retinoic là axit của vitamin A (không tan trong nước nhưng tan trong chất béo). Retinyl palmitate hoặc vitamin A palmitate là tác nhân retinoic được chọn để peel.
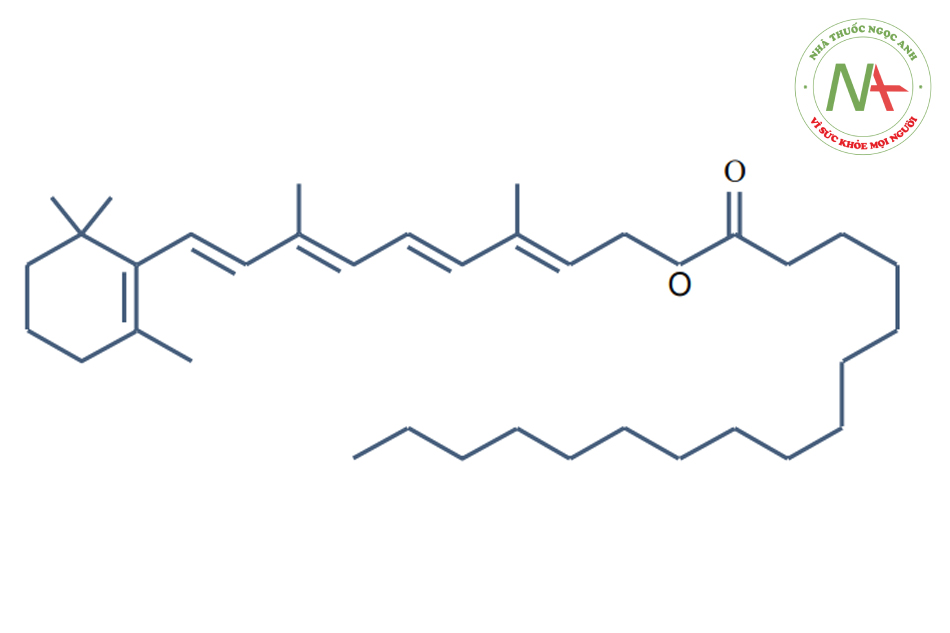
Retinyl palmitate, hoặc vitamin A palmitate, là este của retinol và axit palmitic. Tretinoin là axit hình thành từ vitamin A và còn được gọi là axit retinoic all-trans (ATRA). Nó là một loại thuốc thường được sử dụng để điều trị mụn trứng cá và dày sừng nang lông. Tretinoin là retinoid có hiệu quả nhất đối với lão hóa do ánh sáng theo kết luận của các nghiên cứu. Nó được sử dụng như một thành phần của nhiều sản phẩm thương mại được quảng cáo là có thể làm chậm lão hóa da hoặc cải thiện nếp nhăn.
Axit retinoic thuộc họ terpene, gồm nhiều hợp chất có đặc điểm chung là được tạo thành bởi một chuỗi các đơn vị isoprene CH2 = C (CH3) -CH = CH2. Terpen có kiểu công thức thô (C5Hx)n, với x phụ thuộc vào lượng liên kết đôi. Tên của họ phụ thuộc vào n:
- n = 2 æ C10: monoterpenes.
- n = 3 æ C15: sesquiterpenes.
- n = 4 æ C20: diterpenes.
- n ≈ 1000: polyterpenes (rubber).
Đại diện chính của họ diterpenes là vitamin A hoặc retinol. Retinol có trong thức ăn (beta carotene) và chuyển đổi hoàn toàn trong da thành retinaldehyde (retinal). Sau đó, 95% trong số này được chuyển hóa thành retinyl ester và 5% thành all-trans và 9-cis axit retinoic. Retinoids có nhiều đặc tính trong quá trình hình thành phôi, kiểm soát tăng trưởng và biệt hóa các mô trưởng thành, sinh sản và thị trường (mắt). Trong da liễu, chúng thường được sử dụng trong bệnh vẩy nến, rối loạn quá trình sừng hóa mang tính di truyền, mụn trứng cá và lão hóa da. Các loại retinoid được sử dụng phổ biến nhất là ATRA (tretinoin; dùng tại chỗ), 13-cis axit retinoic (isotretinoin; được sử dụng cả đường uống và tại chỗ), và retinaldehyde / retinal và retinol (cả hai đều được sử dụng tại chỗ). Ngoài ra, còn có các retinoid tổng hợp như etretinate, acitretin, adapalene và tazarotene.
Chỉ các loại retinoid tự nhiên mới được sử dụng trong peel da hóa học (Retinol, ATRA, axit retinoic).
HOẠT CHẤT PEEL ĂN MÒN
Trichloroacetic Acid
Trichloroacetic Acid (TCA) (pKa = 0.54)
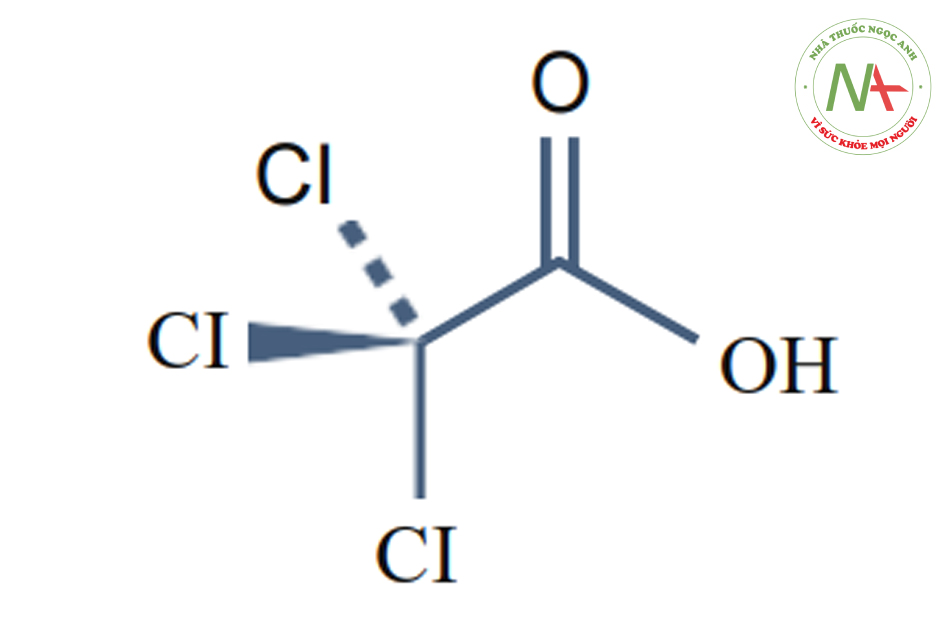
TCA còn được gọi là axit trichloroethanoic. Chúng là sản phẩm cuối cùng của quá trình chưng cất hơi axit nitric trên HCL. Nó được tìm thấy dưới dạng tinh thể khan (hút ẩm cao), màu trắng.
TCA thường được sử dụng với vai trò là một chất diệt cỏ (dưới dạng muối natri) và gián tiếp như một chất chuyển hóa có nguồn gốc từ các phản ứng khử trùng bằng clo để xử lý nước. Đồng thời, nó là chất chuyển hóa chính của per-chloroethylene (PCE), được sử dụng chủ yếu trong giặt khô. Độc tính chung của nó khi dùng liều thấp hầu như không có. Cấu trúc phân tử của nó rất gần với axit glycolic. Trong axit glycolic, carbon ở vị trí alpha có một nhóm hydroxyl và hai hydro, trái ngược với ba clo trong TCA. TCA là một axit mạnh hơn nhiều so với bất kỳ loại axit nào hiện nay được sử dụng để peel; tức là pKa của nó cũng thấp nhất. Giống như axit glycolic, TCA nói chung không gây độc hại, ngay cả khi bôi với nồng độ cao trên da.
Khi thoa lên da, nó không được vận chuyển vào hệ tuần hoàn. Hoạt động phá hủy của TCA là một chuỗi phản ứng do tính axit của nó khi pha trong dung môi nước, nhưng trong peel hóa học, axit nhanh chóng được “trung hòa” khi nó xâm nhập qua các lớp da khác nhau, dẫn đến sự đông tụ của các protein da (Hình 1.3). Khi các protein trở nên đông tụ, TCA sẽ dần hết tác dụng. Để thâm nhập sâu hơn, phải áp dụng nhiều TCA hơn (thể tích) hoặc cần sử dụng nồng độ TCA cao hơn. Tác động của TCA tương đối giống nhau với các tình trạng da, có thể lặp lại và tỷ lệ thuận với nồng độ và lượng được áp dụng. Nói chung, chỉ có TCA và phenol là chất cho biết mức độ đông tụ của các phân tử protein và độ xâm nhập của axit một cách trực quan (các nốt lốm đốm đến sương trắng) trên da ngay sau khi thoa.
TCA được sử dụng như một chất peel trung bình tới sâu với nồng độ từ 20% đến 50%. Độ thâm nhập tăng lên khi nồng độ tăng lên, với TCA 50%, hoạt chất có thể thâm nhập vào lớp trung bì lưới.
Chất lượng sản xuất của một TCA cụ thể phụ thuộc vào 14 thông số liên quan đến nguyên liệu thô và một thông số liên quan tới nhà sản xuất (vật liệu bảo vệ nếu cần thiết ví dụ như mặt nạ chống bụi, tấm che mắt, tấm
che mặt, mặt nạ phòng độc toàn mặt, găng tay, hộp đựng mặt nạ phòng độc , bộ lọc mặt nạ phòng độc):
- Tỉ trọng hơi. Ví dụ: Tỉ trọng hơi tương đối (của không khí = 1): 5.6.
- Mức độ tinh khiết.
- Chất lượng (thông số phân tích của pH).
- Chỉ số khúc xạ.
- Nhiệt độ sôi/lít.
- Tỉ trọng tính theo g/ml at 25°C.
- Nếu có anion và/hoặc cation có thể tạo sẹo do axit xâm nhập vào các lớp da (tùy theo độ mạnh ~ pH).
- Vì lý do này, chúng tôi không khuyên bạn nên sử dụng TCA làm dung dịch đệm hoặc trung hòa TCA với nước thường, có chứa các ion kim loại. Chúng tôi thường sử dụng TCA đã chuẩn bị trước, hoàn chỉnh dung dịch bằng nước cất hai lần (nước cất được chưng cất thêm 1 lần nữa) và dầu hoa hồng.
- Các hợp phần hóa học còn lại (chẳng hạn như SO4) (việc có chúng hay không liệu có ảnh hưởng tới kết quả?).
- Điểm flash (điểm flash cao thì tính an toàn cao).
- Các tạp chất (VD: tạp chất không hòa tan).
- Độ tan trong nước tính bằng mol ở nhiệt độ 20 độ C.
- Độ đục.
- Áp suất hơi (với áp suất thấp có tác dụng làm kín và bôi trơn máy hút chân không áp lực cao)
- VD: Áp suất hơi, Pa ở 51 độ C là 133.
- Thiết kế để có thể điện di, phù hợp với các dung dịch cố định (được thiết kế để sử dụng trong gel IEF và PAGE), >99%. Điện di tập trung các điểm đẳng điện (IEF) sẽ tách các protein trên cơ sở điểm đẳng điện của chúng.
Dung dịch peel TCA phải được bảo quản riêng biệt với các loại lương thực, thực phẩm; nên lưu trữ trong một khu vực mát mẻ, an toàn khô ráo trong một căn phòng thông gió tốt. Bao bì phải còn nguyên vẹn; nếu bị vỡ, nó phải được chuyển đến một thùng chứa và đóng kín. Tốt hơn là giữ dung dịch peel TCA trong chai thủy tinh mờ đục.
TCA là axit mạnh nhất (pKa thấp nhất trong số các axit được sử dụng trong peel), và độ thâm nhập sâu tỉ lệ thuận với độ pH của nó. Tác dụng của TCA trên da phụ thuộc vào thời gian, lực áp trên da, số lớp, tổng lượng sử dụng và sự trung hòa axit sau peel.
Chúng tôi thường sử dụng các loại kem, được mệnh danh là có khả năng “dừng sương trắng” thay vì nước để trung hòa TCA. Việc này giúp tránh phản ứng tỏa nhiệt, hạn chế bỏng “lạnh”. Theo quan điểm của chúng tôi, TCA được pha chế bằng tinh thể nguyên chất và được hoàn thiện bằng nước cất hai lần với dầu hoa hồng có ít khả năng kích thích rebound sắc tố da hoặc tăng sắc tố sau viêm (TCA với vai trò là dung dịch đệm dễ xuất hiện các tình trạng trên). Khuyến cáo không sử dụng nước hoặc alcohol trước hoặc sau khi sử dụng TCA (không đệm) để ngăn chặn xuất hiện phản ứng tỏa nhiệt (phản ứng thuận nghịch của quá trình este hóa).
Một số tác giả mix TCA với phenol để hạn chế cảm cảm giác nóng rát da do TCA gây ra. Thực tế, phenol ở đây có tác dụng vô cảm. Một số công thức khác cũng tương đối hiệu quả (TCA 35% + phenol 15-25% theo tỉ lệ khối lượng). Tuy nhiên, BS nên chú ý các điều sau đây:
- Cả phenol và TCA đều là chất ăn mòn da, và việc thêm cả hai tức là BN phải chịu cả 2 tác nhân.
- Phenol có thể được pha loãng trong dung dịch TCA hoặc ngược lại để giảm nồng độ cả hai. Tất cả các tính toán phải được thực hiện theo tỉ lệ khối lượng (khối lượng chất/khối lượng chất + dung môi) chứ không phải thể tích. Thử nghĩ, tại sao phải sử dụng một độc chất để làm giảm nồng độ của một độc chất khác? Nên thay vào đó, người ta sử dụng cả 2 hoạt chất này với nồng độ thấp để peel. Hơn nữa, tác dụng ăn da chính của phenol là do dầu croton chứ không phải bản thân phenol.
HOẠT CHẤT PEEL GÂY ĐỘC
Phenol ((pKa phoh2+/phoh) – 6.4 (pKa phoh/ pho-) 9.95)
Phenol còn được gọi là axit phenic, hoặc hydroxybenzene. Nó là một chất rắn kết tinh, không màu, nóng chảy ở 41 ° C và sôi ở 182 ° C, hòa tan trong etanol và ete, và tan một phần trong nước.
Ancohol là những hợp chất hữu cơ có một nhóm chức hydroxyl gắn với một nguyên tử cacbon của một chuỗi ankyl. Các dẫn xuất hydroxyl của benzen và các hydrocacbon thơm được gọi là phenol, và nhóm hydroxyl được gắn trực tiếp vào nguyên tử cacbon trong vòng benzen. Trong trường hợp này, phenol là một rượu nhưng không phải là một rượu ankyl: nhóm C6H5- được gọi là phenyl, nhưng hợp chất C6H5OH được gọi là phenol chứ không phải là rượu phenylic.
Phenol là một rượu thơm, có tính chất của một axit yếu. Cấu trúc ba chiều của nó có xu hướng giữ lại ion H+ từ nhóm hydroxyl thông qua một hiệu ứng được gọi là mesomeric. Chúng được gọi là axit carbolic khi hòa tan trong nước. Nó phản ứng với bazơ mạnh để tạo thành các muối được gọi là phenolat. PKa của phenol cao, ở mức 9,95. Phenol có đặc tính dược lý khử trùng, kháng nấm và gây mê.
Axit cacbolic có tính axit mạnh hơn phenol và có ba điểm khác biệt giữa phenol và axit cacbolic:
- Vòng thơm cho phép ổn định các anion phenoxit khi đứng gần nhau. Bằng cách này, điện tích âm trên oxy được chia sẻ bởi carbon mạch thẳng và nguyên tử cạnh carbon. Đó là lý do tại sao axit carbolic được sử dụng thay cho phenol trong các kỹ thuật endopeel.
- Tính axit tăng lên do có sự chồng lấp quỹ đạo giữa các cặp oxy đơn độc và vòng thơm.
- Hiệu ứng trội là cảm ứng từ các cacbon lai hóa sp2; hệ thống sp2 làm giảm mật độ điện tử mạnh hơn so với hệ thống sp3 cho phép oxyanion ổn định hơn.
Resorcinol (pKa = 11.27)
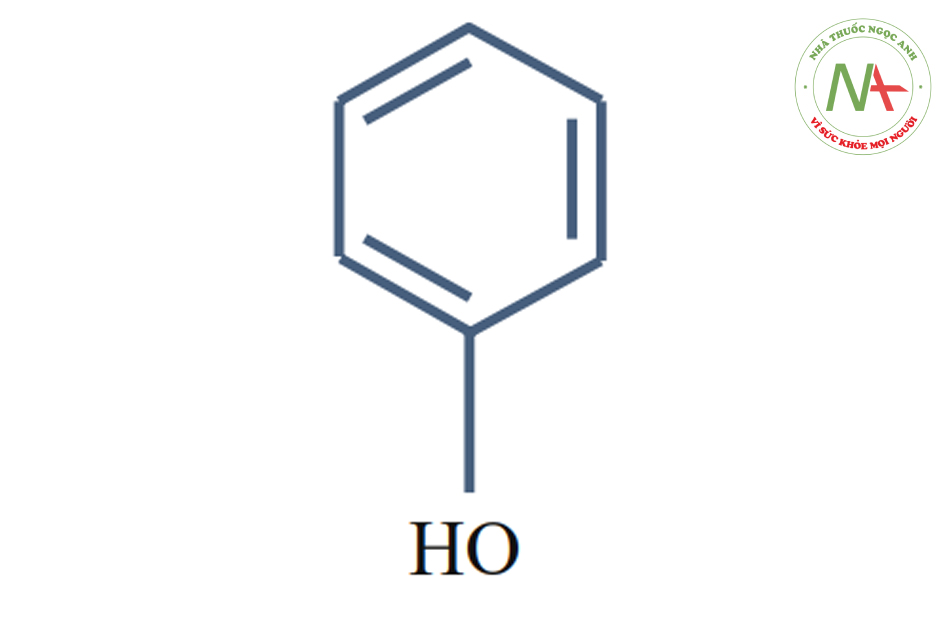
Resorcinol là một phenol được thay thế bởi một hydroxyl ở vị trí meta. Hydroquinone là một phenol được thế bởi một hydroxyl ở vị trí para; pyrocatechol là một phenol được thay thế bởi một hydroxyl ở vị trí ortho.
Resorcinol (hay resorcin, m-dihydroxybenzene, 1,3- dihydroxybenzene, hoặc benzenediol-1,3) là một loại bột tinh thể nóng chảy ở 111°C, sôi ở 281°C và có thể hòa tan.
Giống như phenol, resorcinol là một chất gây độc nguyên sinh chất tế bào, hoạt động thông qua quá trình bất hoạt enzyme và biến tính protein, tạo ra các protein không hòa tan. Ngoài ra, cả phenol và resorcinol đều hoạt động trên màng tế bào, điều chỉnh tính thấm chọn lọc của nó bằng cách thay đổi các đặc tính vật lý. Sự thay đổi tính thấm này sau đó dẫn đến chết tế bào.
Phenol gây độc mạnh hơn, có tác dụng nữa là vô cảm do ức chế các đầu tận dây thần kinh cảm giác.
Phenol và resorcinol là các chất độc đối với cơ tim, thận và gan, được thải trừ khỏi cơ thể ở nồng độ 80% ở dạng nguyên gốc hoặc kết hợp với axit glucuronic hoặc axit sulfuric.
=> Tham khảo: Công thức Peel Phenol-dầu Croton là gì? Quy trình thực hiện peel.
GIẢ THUYẾT VỀ CƠ CHẾ HOẠT ĐỘNG CỦA HOẠT CHẤT PEEL VÀ ĐƯA RA HỆ THỐNG PHÂN LOẠI TƯƠNG ỨNG
Khi nghiên cứu, thậm chí là ở lớp da nông, về các đặc tính hóa học và dược lý của các phân tử đa dạng này, chúng tôi nhận ra rằng tính axit không phải là cơ chế hoạt động duy nhất gây ra tình trạng bong tróc da đã được ghi nhận trước đây.
Chỉ đối với TCA thì pH mới là yếu tố quyết định khả năng ‘phá hủy’ mô. Các chất khác hoạt động chủ yếu thông qua các tác động gây độc (phenol, resorcinol, hoặc axit salicylic) hoặc thông qua tác động chuyển hóa như AHA, axit azelaic, retinoic hoặc bằng cách can thiệp vào cấu trúc và sự tổng hợp tế bào (biến đổi hoặc kích thích) mà không phá hủy chúng.
Vì vậy, chúng tôi có thể đề xuất phân loại các hoạt chất thành ba loại theo tác động: chuyển hóa, ăn mòn, gây độc. Hiệu ứng ăn mòn chỉ tác động khu trú tại khu vực tiếp xúc trực tiếp với hóa chất, còn tác dộng gây độc, mặc dù bản chất cũng chỉ tác động khu trú, song đôi khi cũng có ảnh hưởng tới các tế bào ở xa.
Phân loại các hợp chất hóa học dùng trong peel da (L. Dewandre)
- Ăn mòn: trichloroacetic acid.
- Chuyển hóa: AHAs, azelaic acid, retinoic acid.
- Gây độc: phenol, resorcinol, salicylic acid.
Khi tính axit không phải là cơ chế hoạt động chính, thì độ pH dường như là yếu tố cho phép một số chất khác có trong dung dịch (chủ yếu có tác động chuyển hóa) xâm nhập vào da. Da và các phân tử cấu thành của nó, cùng với nước đóng vai trò như một loại đệm cho dung dịch tiếp xúc và xâm nhập vào từng tầng da cho đến khi nó đạt đến độ sâu cần thiết. Nó hoạt động như một chất thấm ướt dung dịch peel, nhiều hay ít tùy thuộc vào độ pH và hơn hết là vào gradient pH giữa dung dịch peel và độ sâu đích của da mà dung dịch xâm nhập đến.
Tác động gây độc, đặc biệt là phenol, dường như không có tác động ăn mòn (trừ khi sử dụng các dung dịch có chứa dầu croton); dung dịch phenol có pH = 5 hoặc 6.
Chúng tôi đồng ý rằng có thể kết hợp các hoạt chất peel trong cùng một dung dịch tại một lần peel để giảm thiểu biến chứng và tận dụng các cơ chế hoạt động khác nhau (ăn mòn, gây độc và chuyển hóa). Dung dịch Jessner là một ví dụ (hỗn hợp của resorcinol, axit lactic và axit salicylic); ngoài ra cũng có thể peel theo công thức của Monheit (Dung dịch Jessner sửa đổi với resorcinol được thay thế bằng axit citric) sau đó tiếp tục peel TCA; các công thức peel phenol sửa đổi; và những công thức được các tác giả sáng tạo dựa trên kinh nghiệm lâm sàng (Fintsi, Kakowicz, De Rossi Fattaccioli, v.v..).
Tuy nhiên, phân loại A. Tenenbaum phù hợp với lâm sàng nhất, kể cả đối với người mới.
Vì vậy, người mới nên bắt đầu bằng cách sử dụng các AHAs nồng độ thấp, mạch thẳng, hai hoặc ba chức với pKa >3.
Tranexamic Acid (pKa = 4.3) và axit carboxylic dạng vòng
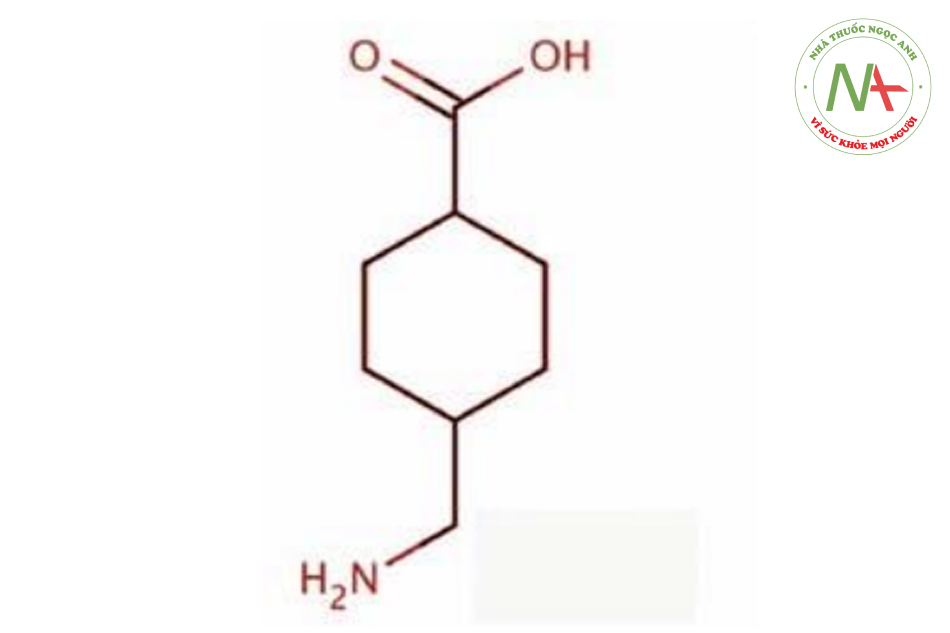
Vai trò của Tranxemic axit trong peel da hóa học
Giả thuyết về cơ chế tác động. Axit tranexamic (axit cacboxylic trans-4-aminomethyl cyclohexane; TXA) có thành phần hóa học như trong Hình. 1.4. Tác nhân này lần đầu tiên được đưa vào tài liệu y khoa vào năm 1962 bởi một nhóm nghiên cứu người Nhật Bản và lần đầu tiên được kê đơn cho các trường hợp chảy máu kinh nguyệt mức độ nhiều và chảy máu khi nhổ răng. Như vậy, trước giờ chúng chỉ được biết là dẫn xuất tổng hợp của axit amin lysine, với vai trò trên lâm sàng là chất ức chế plasmin. Tác động chống tiêu sợi huyết này thông qua cơ chế phong tỏa các vị trí liên kết lysine trên các phân tử plasminogen.
Cấu trúc phân tử của TXA (xem Hình 1.4) và vai trò ức chế của nó trong dòng plasminogen (xem Hình. 1.5). Sự hình thành plasmin bị ức chế bởi TXA, dẫn đến điều hòa giảm plasmin và không có khả năng phân tách cục máu đông fibrin.
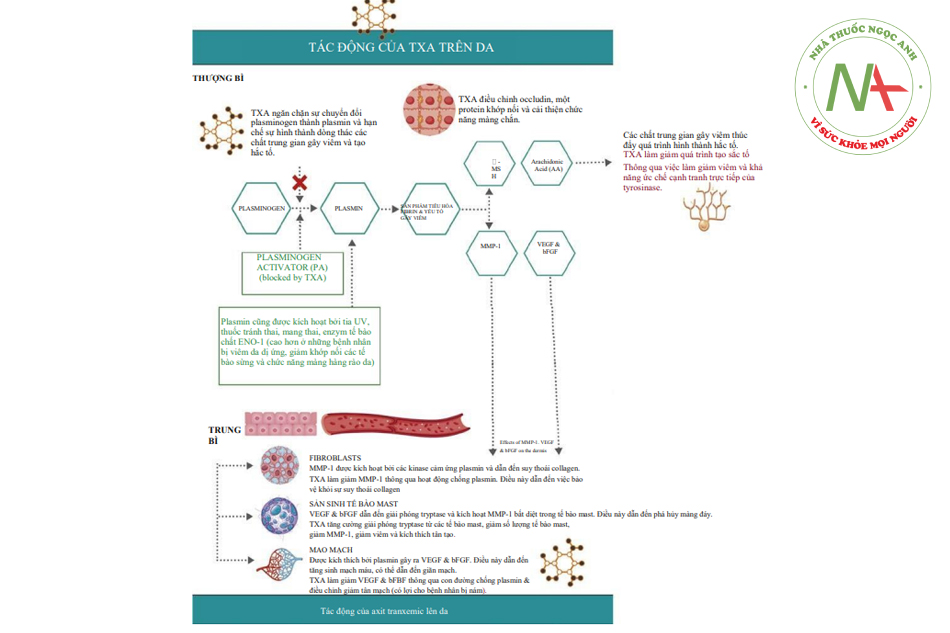
Tác động của TXA đối với việc sản xuất melanin đã được ghi nhận trong y văn; tuy nhiên, các con đường sinh hóa và cơ chế hoạt động ít được biết đến. Các nghiên cứu trên chuột lang đã chứng minh rằng TXA có thể làm giảm sắc tố da. Cơ chế hoạt động không phải bằng cách làm giảm số lượng (tuyệt đối) tế bào hắc tố, mà bằng cách giảm hoạt động tạo hắc tố của tế bào hắc tố, dẫn đến giảm tổng hợp hắc tố.(1)
Hoạt động của plasminogen cũng bị ảnh hưởng bởi TXA. Plasminogen tồn tại trong các tế bào sừng ở lớp đáy, và các nghiên cứu đã xác nhận rằng ánh sáng tia cực tím (UV) kích thích sự hoạt hóa plasminogen, hình thành plasmin kích thích a-MSH (hormone kích thích tế bào hắc tố) nhằm tạo hắc tố. TXA có khả năng tác động tới các tế bào sừng được chiếu tia UV dẫn tới làm giảm hoạt động của plasmin trong các tế bào này. Kết quả là, các yếu tố thúc đẩy quá trình hình thành hắc tố, chẳng hạn như prostaglandin, được điều chỉnh và ngăn chặn. (3,4)
Một phương thức hoạt động khác được đề xuất là TXA (có cấu trúc phân tử tương tự như tyrosine) có chức năng như một chất ức chế cạnh tranh với enzyme tyrosinase, chịu trách nhiệm sản xuất melanin. Hệ quả là chúng làm giảm sản melanin. Một phân tích mô học năm 2017 đối với những bệnh nhân bị nám da được điều trị bằng TXA đường uống cho thấy rằng không chỉ giảm sắc tố mà bệnh nhân còn bị giảm ban đỏ trên mặt do giảm số lượng mao mạch và giảm số lượng tế bào mast. (6)
Dựa trên các nghiên cứu mô hóa học hiện tại, TXA đã được chứng minh là có nhiều tác dụng trên da và thể hiện các tác động sau đây đối với các tế bào trong cả lớp bì và biểu bì:
Lớp bì
- Các nguyên bào sợi được chiếu tia UVA có sự gia tăng biểu hiện của ma trận metalloprotease 1 (MMP-1), một loại enzyme làm phân hủy collagen. Hoạt động của MMP-1 phụ thuộc vào hoạt động của plasmin. Trong các mẫu mô tiếp xúc với bức xạ UVA, mẫu có TXA có biểu hiện MMP-1 thấp nhất và do đó ‘giữ’ lại lượng collagen tốt nhất. Người ta cho rằng TXA có thể mang lại lợi ích chống lão hóa cho làn da bị tổn thương bởi tia cực tím thông qua việc giảm sự phân hủy collagen. (7)
- TXA ngăn chặn hình thành các mao mạch mới. Plasmin kích hoạt VEGF, một chất kích hoạt hình thành tân mao mạch. TXA cũng đã được chứng minh là ngăn chặn yếu tố tăng trưởng nguyên bào cơ bản (bFGF), kích thích sự hình thành mạch và tái tạo vi mạch. Do đó, tác dụng antiplasmin của TXA đã cho thấy lợi ích lâm sàng bằng cách giảm số lượng mạch máu tổng thể và giảm ban đỏ. (6,8)
Thượng bì
- TXA có chức năng như một màng ngăn. Ở lớp biểu bì, các nghiên cứu trên động vật đã chứng minh rằng TXA có thể cải thiện bệnh xơ cứng, giảm mất nước qua biểu bì (TEWL) và giảm viêm bằng cách giảm sự tăng sinh tế bào mast. (9)
- Một nghiên cứu in vitro khác đã khẳng định TXA giúp cải thiện phục hồi chức năng hàng rào vì nó cho thấy sự gia tăng điều chỉnh của protein occludin
- TXA ảnh hưởng đến tế bào sừng. Enolase-1 (ENO- 1) là một loại enzyme tế bào phổ biến ở cả nội bào và bề mặt tế bào. Nó là một thụ thể bề mặt tế bào đối với plas- minogen. Bệnh nhân bị viêm da dị ứng chứng tỏ mức độ ENO-1 và plasminogen tăng lên tế bào sừng và lớp đáy. Khi điều trị bằng TXA, người ta thấy rằng các mẫu mô trong ống nghiệm ít bị phá vỡ protein khớp nối. Điều này ngụ ý rằng điều trị bằng TXA cải thiện tính toàn vẹn của tế bào sừng trong màng đáy. (10)
- TXA ức chế sản xuất -MSH trong các tế bào hắc tố được kích thích bởi bức xạ tia cực tím B (UVB). Các nghiên cứu in vitro cho thấy TXA có thể làm giảm -MSH bằng cách giảm sản xuất prohormone convertase 2 (PC2), một loại enzyme liên quan đến sự phân tách POMC thành -MSH. PC2 được kích hoạt bởi plasmin và, thông qua hoạt động ức chế hình thành plasmin, TXA làm giảm quá trình hình thành hắc tố. Một con đường giảm hình thành hắc tố khác được đề xuất sau khi nghiên cứu các tế bào u hắc tố ác tính. Nghiên cứu này cho thấy TXA tăng cường sản xuất kinase (kinase protein hoạt hóa mitogen [MAPK] và kinase điều hòa tín hiệu ngoại bào [ERK]) liên quan đến quá trình tự thực và điều hòa giảm tyrosinase. (11)
- Một nghiên cứu về hóa mô được công bố vào năm 2017 đã xác nhận rằng TXA có thể điều chỉnh sự tổng hợp melanin thông qua việc kích thích con đường tín hiệu kinase điều hòa tín hiệu ngoại bào (ERK) và hệ thống tự thực. Điều đó có nghĩa là việc sản xuất các protein thúc đẩy quá trình hình thành hắc tố như yếu tố phiên mã liên quan đến tật mắt nhỏ (MITF), tyrosinase và protein liên quan đến tyrosinase 1 và 2 (TRP 1 & 2) có thể sẽ giảm sau khi điều trị với TXA. Kết quả nghiên cứu cho thấy TXA có thể làm giảm tổng hợp melanin bằng cách giảm sản xuất tyrosinase và TRP 1 & 2. Cùng với đó, mức protein MITF cũng giảm. (11)
Được biết, tế bào biểu bì tạo hắc tố là tế bào miễn dịch có khả năng đáp ứng cao và có thể ‘giao tiếp’ với các tế bào của lớp hạ bì và biểu bì. Do đó, hợp lý khi cho rằng TXA có tác dụng điều tiết tích cực trên các tế bào biểu bì và da có thể tạo ra một môi trường thuận lợi để kiểm soát sắc tố thông qua nhiều con đường mà nó có thể hoạt động. Do đó TXA có khả năng điều chỉnh các tương tác tế bào, đặc biệt là giữa các tế bào sừng và tế bào hắc tố.
Hình. 1.5 tóm tắt các hoạt động của TXA trên các tế bào biểu bì và bì trong việc hình thành hắc tố.
Đường dùng axit tranxemic
Như đã thảo luận, TXA có khả năng thay đổi hành vi sinh lý của mô da. TXA có thể được sử dụng thông qua các ‘con đường’ sau: bôi tại chỗ, tiêm trong da và đường uống, với các đường bôi và đường uống được nghiên cứu rộng rãi nhất. Tuy nhiên, đường đưa thuốc và cách đưa TXA vào da ‘lý tưởng’ vẫn chưa được xác định và hiện chưa có sự đồng thuận. Dựa trên các công bố hiện tại, hai phác đồ sau đây thường được sử dụng.
Đường uống: 500 mg mỗi ngày (250 mg x 2 lần / ngày). Ba nghiên cứu lâm sàng gần đây đã sử dụng liều lượng này với các kết luận rằng bệnh nhân có biểu hiện sáng da mà không có phản ứng phụ. Lee và cộng sự đã thực hiện một nghiên cứu hồi cứu lớn nhất cho đến nay về hiệu quả của TXA đường uống. Họ kết luận rằng 250 mg x 2 lần / ngày (BID) là liều lượng hiệu quả để làm sáng da trong vòng 2 tháng. Các nghiên cứu xác nhận tính hiệu quả và an toàn của liều lượng này cũng đã được báo cáo bởi Del Rosario và cộng sự (2018), Tan và cộng sự (2017), và Wu và cộng sự (2012)). (12-14)
Tại chỗ: Serum bôi tại chỗ 5% TXA, hai lần mới ngày. ‘
Các nghiên cứu trước đây đã cho thấy hiệu quả của TXA bôi tại chỗ với nồng độ 5% mà không có tác dụng phụ. Kanechorn và cộng sự đã sử dụng TXA 5% cùng với gel liposomal và Banihashemi cũng sử dụng công thức này cho thấy có hiệu quả rõ rệt.
Axit tranexamic và đặc tính ưu việt trong peel da
Hóa chất peel là hóa chất tẩy tế bào chết, với nguyên tắc cơ bản là thay đổi thành phần hóa học lớp biểu bì và / hoặc lớp bì một cách có kiểm soát. Kết quả là da sẽ bị bong ra để tái tạo lớp da mới, cải thiện rõ rệt về màu sắc và kết cấu thẩm mỹ của da. Như đã mô tả trước đây, việc sử dụng TXA có thể làm sáng da, cũng như cải thiện chức năng hàng rào bảo vệ da. Do tác dụng tích cực của nó đối với cả lớp bì và biểu bì, nên TXA có thể là một phương pháp điều trị chính cũng như bổ trợ hữu ích trong trị liệu chứng tăng sắc tố sau viêm (PIH) và rối loạn sắc tố da thẩm mỹ, đồng thời hỗ trợ sức khỏe làn da. Hàng rào bảo vệ da thường bị tổn hại trong quá trình peel da bằng hóa chất. Lúc này, TXA được bác sĩ sử dụng như một chất dưỡng da trước khi điều trị và cũng là một dưỡng chất phục hồi tuyệt vời sau khi điều trị, tạo ra kết quả nâng cao cho quá trình peel da bằng hóa chất.
KẾT LUẬN
Nếu chúng ta nhìn vào lịch sử và sự phát triển của peel da hóa học, chúng ta có thể phân biệt hai thời kỳ phát triển lớn. Giai đoạn đầu tiên là từ thế kỷ 19 đến cuối những năm 1980, là thời gian ‘phát hiện’ ra các hoạt chất peel , các công thức và hỗn hợp cổ điển, đồng thời nghiên cứu tác dụng mô học và lâm sàng của chúng.
Giai đoạn thứ hai là sự phát triển và nâng cao hiểu biết về công thức TCA sửa đổi (ảnh hưởng chủ yếu bởi Z. Obagi), và sự phát triển của AHA. Việc phát hiện lại AHAs, đặc biệt là axit glycolic, bởi Van Scott và cộng sự đã phổ biến các loại peel da hóa học ‘mức độ nhẹ’ cho đa phần dân số.
Bất chấp sự tiến bộ quan trọng này, khoa học về peel da hóa học vẫn chủ yếu mang tính kinh nghiệm, và các ứng dụng của nó thường mang tính trực quan. Chúng tôi tin rằng chúng ta có thể đang bước vào thời kỳ thứ ba, là thời kỳ mà các BS có hiểu biết tốt hơn về cơ chế hoạt động của peel. Hy vọng rằng chúng ta sẽ có bước tiến lớn trong thời kỳ này với sự xuất hiện của các phương pháp và sản phẩm mới, khoa học hơn để sử dụng cho việc peel da bằng hóa chất.
Mặc dù một số người đã dự đoán rằng tái tạo da bằng laser sẽ thay thế peel da hóa học, nhưng điều ngược lại đã xảy ra. Sự phát triển về peel trong lĩnh vực da liễu thẩm mỹ sẽ vượt bậc hơn nhiều so với các thế kỷ trước khi chúng vượt ra khỏi giới hạn của kinh nghiệm cá nhân và dựa trên bằng chứng khoa học.
TÀI LIỆU THAM KHẢO
- Li D, Shi Y, Li M, Liu J, Feng X. Tranexamic acid can treat ultraviolet radiation-induced pigmentation in guinea Eur J Dermatol. 2010;20(3):289-292.
- Handel AC, Miot LD, Miot HA. Melasma: a clini- cal and epidemiological review. An Bras Dermatol.2014;89(5):771-782. L A o I I c
- Maeda K, Naganuma M. Topical trans-4- aminomethyl- cyclohexanecarboxylic acid prevents ultraviolet radia- tion-induced pigmentation. J Photochem PhotobiolB. 1998;47(2-3):136-141.
- Hiramoto K, Yamate Y, Sugiyama D, Takahashi Y, Mafune E. Tranexamic acid suppresses ultraviolet B eye irradiation-induced melanocyte activation by decreasing the levels of prohormone convertase 2 and alpha-melanocyte-stimulating hormone. Photodermatol Photoimmu- 2014;30(6):302-307.
- Yuan C, Wang XM, Yang LJ, Wu PL. Tranexamic acid accelerates skin barrier recovery and upregulates occlu- din in damaged skin. Int J Dermatol. 2014;53(8):959- 965.
- Na JI, Choi SY, Yang SH, Choi HR, Kang HY, Park KC. Effect of tranexamic acid on melasma: a clinical trial with histological evaluation. J Eur Acad Dermatol Venereol. 2013;27(8):1035-1039.
- Sonoki A, Okano Y, Yoshitake Y. Dermal fibroblasts can activate matrix metalloproteinase-1 independent of keratinocytes via plasmin in a 3D collagen model. 2018;27(5):520-525.
- Kim EH, Kim YC, Lee ES, Kang HY. The vascular charac- teristics of melasma. J Dermatol Sci. 2007;46(2):111-116.
- Hiramoto K, Sugiyama D, Takahashi Y, Mafune E. The amelioration effect of tranexamic acid in wrinkles induced by skin dryness. Biomed Pharmacother. 2016;80:16-22.
- Tohgasaki T, Ozawa N, Yoshino T, et al. Enolase-1 expression in the stratum corneum is elevated with parakeratosis of atopic dermatitis and disrupts the cellular tight junction barrier in keratinocytes. Int J Cosmet Sci. 2018;40(2):178-186.
- Cho YH, Park JE, Lim DS, Lee JS. Tranexamic acid inhib- its melanogenesis by activating the autophagy system in cultured melanoma cells. J Dermatol Sci. 2017;88(1):96-
- Tan AWM, Sen P, Chua SH, Goh BK. Oral tranexamic acid lightens refractory melasma. Australas J Dermatol. 2017;58(3):e105-e108.
- Del Rosario E, Florez-Pollack S, Zapata Jr L, et al. Ran- domized, placebo-controlled, double-blind study of oral tranexamic acid in the treatment of moderate-to- severe J Am Acad Dermatol. 2018;78(2):363- 369.
- Wu S, Shi H, Wu H, et al. Treatment of melasma with oral administration of tranexamic acid. Aesthetic Plast 2012;36(4):964-970.
- Kanechorn Na Ayuthaya P, Niumphradit N, Manosroi A, Nakakes A. Topical 5% tranexamic acid for the treatment of melasma in Asians: a double-blind randomized con- trolled clinical trial. J Cosmet Laser Ther. 2012;14(3): 150- 154.
- Banihashemi M, Zabolinejad N, Jaafari MR, Salehi M, Jabari A. Comparison of therapeutic effects of liposomal tranexamic acid and conventional hydroquinone on melasma. 2015;14(3):174-177.

