Thông Tin Thuốc
Hóa trị liệu – Các thuốc Kháng Virus: cơ chế, lưu ý khi dùng
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nguồn: Sách bộ môn Hóa Dược – Trường Đại học Dược Hà Nội – Chủ biên PGS.TS Nguyễn Tưởng
Nhà thuốc Ngọc Anh – chủ đề: Hóa Trị Liệu – chương 1 Các thuốc Kháng Virus
PGS.TS Nguyễn Tường Vy
Bộ môn: Hóa Dược
VIRUS – Các loại virus gây bệnh
Virus là tác nhân gây nhiễm bệnh nhỏ nhất ở người, có đường kính khoảng 20- 300nm. Virus có tới hàng ngàn loại khác nhau, trong đó khoảng hơn 400 loài có thể gây bệnh cho con người. Virus liên quan đến rất nhiều bệnh, từ bệnh phổ biến như cảm lạnh thông thường cho đến những bệnh có thể dẫn đến tử vong như HIV/AIDS và ung thư.
Cấu trúc và phân loại virus
Tất cả các loại virus tồn tại như một ký sinh vật bắt buộc trong tế bào do đó chúng không cần bộ máy sinh hóa phức tạp vốn là đặc trưng của các tổ chức cấp cao hơn. Tuy nhiên, chúng có cấu trúc đại phân tử được thiết kế để tự bảo vệ khỏi các tác động của môi trường và giúp xâm nhập dễ dàng vào tế bào.
Virus là các vi sinh vật nội bào, cần có bộ máy của tế bào vật chủ để thực hiện quá trình lây nhiễm. Đơn vị cơ bản của virus là ADN hoặc ARN, chuỗi đơn hoặc chuỗi kép, dạng thẳng hoặc dạng vòng. Virus có thể được bao quanh bởi một lớp vỏ protein đối xứng gọi là capsid. Capsid được tạo thành từ các đơn vị có cấu trúc lặp lại gọi là các protomer (được tạo thành bởi các đơn vị dưới phân tử protein chưa được nhận diện). Trong một vài trường họp, cấu trúc nucleocapsid được bao quanh bởi một màng bao chứa lipid. Trên màng bao chứa các protein đặc hiệu của virus. Phân tử virus có hoặc không có màng bao được gọi là virion.
Cấu trúc của virus được chia làm 3 nhóm: đối xứng khối, đối xứng xoắn ốc hoặc cấu trúc phức tạp. Ngoài ra, virus còn được phân loại bởi hình thái, đặc tính của hệ gen (chẳng hạn ADN với ARN, chuỗi đơn với chuỗi kép, thẳng hoặc vòng, cấu trúc theo chiều xuôi (sense) hoặc theo chiều ngược (antisense), các đặc tính hóa lý, cấu trúc của các protein liên quan và quá trình nhân lên của virus. Virus được phân vào các họ chính, tên được kết thúc bằng hậu tố-viridae, sau đó là chi và kết thúc bằng virus (Bảng 1.1).
Bảng 1.1 Đặc điểm của các họ virus có khả năng gây bệnh thường gặp ở người.
| Ho virus | Tên virus gây bệnh | Cấu trúc bộ gen | Kích
thước nm-1 |
Lớp vỏ bao | Loai bệnh |
| Parvoviridae | Parvovirus BI9 | ADN
sợi đơn |
18-26 | Không | Ban đỏ nhiễm khuẩn; viêm khớp, đau đa cơ; thiếu máu bất sản, thiếu máu. |
| Papillomaviridae | Virus Human papilloma, virus polyma; sv 40 | AND sợi đôi | 55 | Không | Mụn cóc; nhiễm trùng tuyến nước bọt; bệnh não chất trắng đa ổ; khối u (ví dụ, ung thư cổ tử cung). |
| Adenoviridae | adenovirus và mastadenovirus | AND sợi đôi | 70-90 | Không | Nhiễm trùng mắt và đường hô hấp; khối u. |
| Hepadnaviridae | Hepadnavirus, hepatitis B virus | AND sợi đôi | 40-48 | Có | Bệnh viêm gan B; khối u. |
| Herpesviridae | Herpes simplex 1 và II; varicella zoster; herpes zoster; cytomegalovirus; Epstein-Barr virus | AND sợi đôi | 150-
200 |
Có | Nhiễm trùng mắt, da và sinh dục; thủy đậu; bệnh zona thần kinh; tăng bạch cầu đơn nhân; khối u. |
| Poxviridae | Variola; vaccinia | AND sợi đôi | 230-
400 |
Phức
tạp |
Bệnh đậu mùa; bệnh đậu bò; thủy đậu; khối u. |
| Picornaviridae | Hepatitis A virus; poliovirus; enterovirus; rhinovlrus, coxsackie virus A và B | ARN
sợi đơn |
28-30 | Không | Bệnh đường hô hấp; bệnh đường tiêu hóa; bệnh bại liệt; viêm màng não vò khuẩn. |
| Astrovỉridae | Astrovirus | ARN
sựi đơn |
28-30 | Không | Tiêu chảy ở trẻ sơ sinh và bệnh nhân suy giảm miễn dịch. |
| Togaviridae | Rubella virus;
alphavirus, arbovirus |
ARN
sợi đơn |
50-70 | Có | Sởi (rubella) |
| Flaviviridae | Hepatitis c virus; arbo virus; yellow fever virus; dengue virus; West Nile virus | ARN
sợi đơn |
40-60 | Có | Viêm gan C; sốt vàng da; sốt xuất huyết; viêm não; khối u. |
| Coronaviridae | Coronavirus | ARN
sợi đơn |
120-
160 |
Có | Cảm lạnh, viêm dạ dày ruột ở trẻ sơ sinh; Bệnh SARS. |
| Retroviridae | HIV I and II; Lentivirus; human T-cell;
Các lymphotropic virus |
ARN
sợi đơn |
80-100 | Có | AIDS, các bệnh liên quan đến AIDS; ung thư vú; bệnh bạch cầu tế bào T ở người; ung thư biều mô vòm họng. |
| Arenaviridae | Arenavirus | ARN
sợi đơn |
50-300 | Có | Sốt lassa; sốt xuất huyết; viêm màng não. |
| Orthomyxoviridae | Influenza virus A, B,
c |
ARN
sợi đơn |
80-120 | Có | Bệnh cúm. |
| Bunyaviridae | Hantavirus | ARN
sợi đơn |
80-120 | Có | Sốt xuất huyết. |
| Rhabdoviridae | Rhabdovirus; rabies virus; encephalitis virus | ARN
sợi đơn |
75-180 | Có | Bệnh dại, viêm não. |
| Paramyxoviridae | Syncytial virus; parainfluenza virus | ARN
sợi đơn |
150-
300 |
Có | Quai bị, bệnh sởi (rubella). |
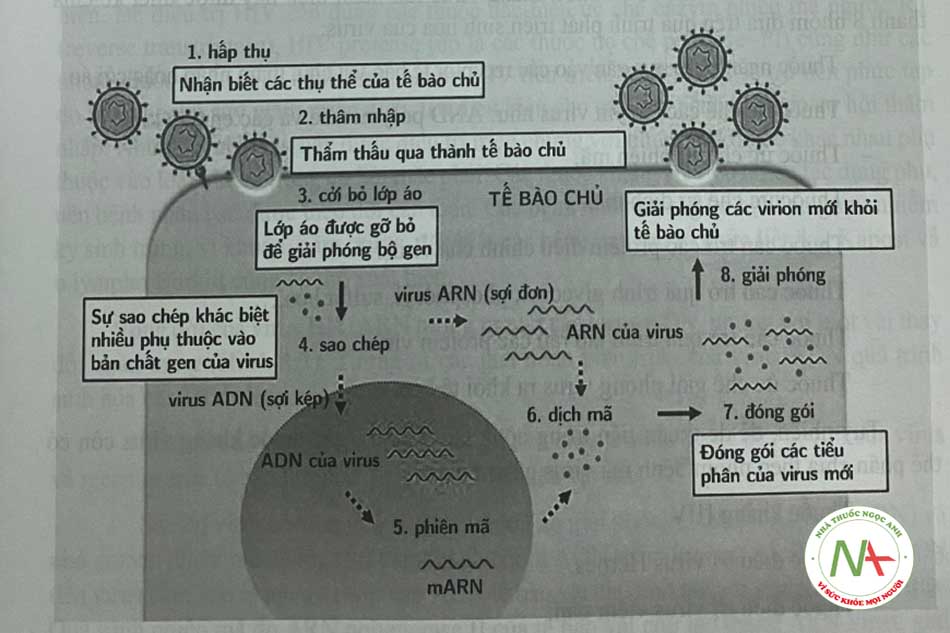
Chu trình phát triển của virus
Để virus có thể nhân lên được, các mARN cần thiết cho việc tạo thành các đại phân tử của virus phải được tổng hợp. Quá trình bắt đầu khi virus gắn vào một vị trí receptor cụ thể trên tế bào chủ. Việc gắn kết này là một hiện tượng tình cờ do có sự bổ sung về mặt cấu trúc giữa cấu trúc bên ngoài của virion và cấu trúc bề mặt tế bào bình thường của vật chủ. Khi kết thúc gắn kết, virus đi vào pha thâm nhập. Sau khi thâm nhập vào tế bào các virus phải cởi bỏ lớp áo, giải phóng ra acid nucleic trần hoặc dạng nucleocapsid chứa các enzym polymerase.
Khi đã thâm nhập vào trong tế bào và cởi bỏ lớp áo, virus bước sang giai đoạn tiếp theo trong chu kỳ sống được gọi là giai đoạn che khuất, chiều dài giai đoạn này khác nhau tùy theo loại virus. Trong suốt thời gian này, virus sử dụng các nguồn nguyên liệu của tế bào chủ đê sao chép và sản xuất ra các protein virus cân thiêt. Sự hình thành các tiêu phân virus mới là kết quả của giai đoạn này.
CÁC NHÓM THUỐC KHÁNG VIRUS
Nguyên tắc trong thiết kế thuốc kháng virus tương tự như thiết kế các thuốc khác, các thuốc nhóm này có tính hướng đích (đích là vài quá trình sinh hóa của virus mà không tồn tại ở tế bào chủ). Các thuốc kháng virus ra đời sớm không đạt được mục tiêu này và thường gây độc ở liều điều trị hoặc có phổ tác dụng hẹp. Nhiều yếu tố khiến việc thiết kế các thuốc kháng virus gặp khó khăn, do virus có khả năng thay đổi tính kháng nguyên, thời gian tiềm tàng không có triệu chứng, sự phụ thuộc của chúng vào các enzym tế bào chủ và các quá trình khác. Các thuốc kháng virus lưu hành hiện nay được thiết kế chia thành 8 nhóm dựa trên quá trình phát triển sinh hóa của virus:
- Thuốc ngăn cản virus gắn vào các receptor tế bào vật chủ, thâm nhập hoặc cởi áo.
- Thuốc ức chế các enzym virus như: AND polymerase và các enzym khác.
- Thuốc ức chế sự phiên mã.
- Thuốc ức chế sự dịch mã.
- Thuốc cản trở các protein điều chỉnh của
- Thuốc cản trở quá trình glycosyl, phosphoryl, sulfat hóa,…
- Thuốc cản trở quá trình lắp ráp các protein virus.
- Thuốc ức chế giải phóng virus ra khỏi tế bào.
Tuy nhiên, để dễ thuận tiện trong công tác điều trị, các thuốc kháng virus còn có thể phân chia theo nhóm bệnh mà virus gây ra như:
- Thuốc kháng HIV.
- Thuốc điều trị virus Herpes.
- Thuốc điều trị virus viêm gan.
Thuốc phòng và điều trị cảm cúm.
Thuốc kháng HIV
- Đại cương về HIV/AIDS
Virus gây suy giảm miễn dịch ở người (HIV) được phát hiện lần đầu tiên vào năm 1979 và được xác định là nguyên nhân gây nên hội chứng suy giảm miễn dịch (AIDS) năm 1981. Kể từ đó, AIDS đã trở thành một căn bệnh nguy hiểm trên toàn thế giới và tiếp tục lan rộng.
Virus HIV có 2 loại: HIV-1 và HIV-2. Cả hai loại đều lây truyền qua quan hệ tình dục, truyền máu, từ mẹ sang con và bệnh cảnh lâm sàng khi tiến tới giai đoạn AIDS giống nhau. Tuy nhiên, HIV-2 khó lây truyền hơn và thời kỳ giữa sơ nhiễm HIV-2 đến biểu hiện bệnh dài hơn. HIV-1 và HIV-2 chỉ khác nhau ở lớp capsid bên ngoài virus (HIV-1 là pl7 còn HIV-2 là pl8).
Trên thế giới, người bệnh chủ yếu bị nhiễm HIV-1, tương đối ít khi nhiễm HIV-2 (HIV-2 thường tập trung ở Tây Phi và khó tìm thấy ở nơi khác trên thế giới).
Mặc dù nhiều thuốc được phát triển để điều trị cho bệnh nhân AIDS, nhưng khó khăn là do virus có khả năng biến đổi, dẫn đến kháng thuốc. Không phải tất cả các loại thuốc được sử dụng để điều trị nhiễm HIV-1 đều có hiệu quả chống lại HIV-2. Đặc biệt, HIV-2 có khả năng đề kháng tự nhiên với các thuốc ức chế enzym phiên mã ngược không phải nucleotid (NNRTI) và do đó không khuyến khích dùng nhóm thuốc này.
Phương pháp điều trị AIDS lâu dài cần phòng và tránh nhiễm HIV, nhưng bệnh nhân có thể kéo dài sự sống nếu được chẩn đoán sớm và điều trị kịp thời ngay từ khi phát hiện. Để điều trị HIV cần dùng các thuốc đặc hiệu ức chế enzym phiên mã ngược RT (reverse transtriptase), HIV protease (đó là các thuốc ức chế protease -PI) cũng như các nhóm thuốc khác. Nếu bệnh nhân nhiễm HIV tiến triển, bệnh AIDS sẽ trở nên phức tạp do làm vật chủ suy giảm miễn dịch, tạo điều kiện cho các loại bệnh khác cỏ cơ hội thâm nhập. Những bệnh nhân này được điều trị triệu chứng với nhiều loại thuốc khác nhau phụ thuộc vào loại nhiễm trùng cơ hội mắc phải. Các thuốc kháng HIV có nhiều tác dụng phụ, nên bệnh nhân cần được theo dõi cẩn thận. Các bệnh nhiễm trùng cơ hội bao gồm: nhiễm ký sinh trùng, vi khuẩn, nấm, virus, đặc biệt các bệnh ung thư tổ chức liên kết Kaposi và u lympho Burkitt cũng có thể xuất hiện.
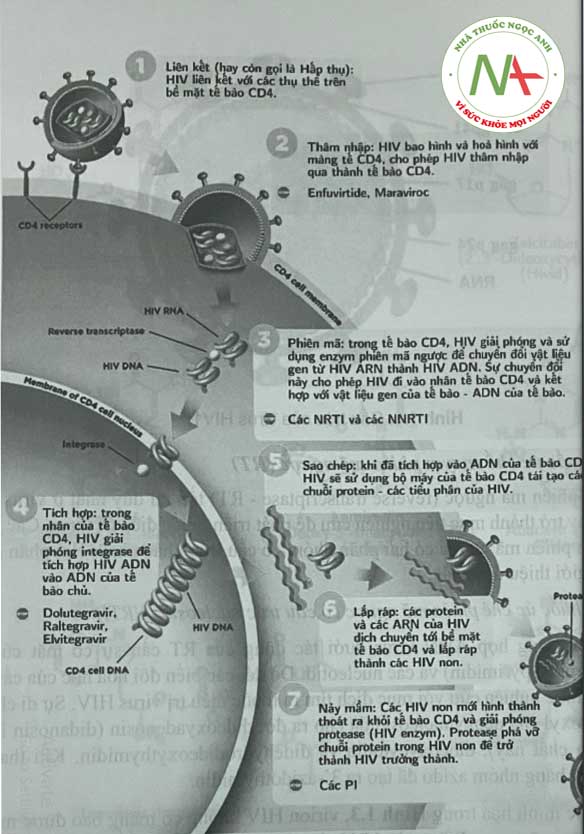
Vòng đời của virus HIV ARN tương tự như các virus ADN, nhưng với một vài thay đổi quan trọng (Hình 1.2). Tương tự các giai đoạn phát triển của virus ADN quá trình sinh hóa của HIV như sau:
- Đầu tiên có sự liên kết và hấp phụ xảy ra giữa protein ngoại bào gpl20 của virus và receptor trên tể bào lympho T (tế bào CD4) của vật chủ.
Sau đó virus sẽ xâm nhập và cởi bỏ lớp áo giải phóng ra chuỗi ARN (ssARN) và nhờ enzym phiên mã ngườc (RT) tạo thành chuỗi ADN tiền virus (proviral). Chuỗi ADN tiền virus chui vào nhân, tích hợp vào ADN tế bào vật chủ nhờ enzym integrase của virus. Quá trình phiên mã do ARN polymerase II của tế bào vật chủ tạo thành ARN virus, giải phóng khỏi nhân nơi xảy ra sự sao chép bộ gen. ARN virus và các protein được vận chuyển đến màng tế bào, chúng tập hợp lại, tạo thành một chồi virus và được giải phóng khỏi màng tế bào lympho. Virion chưa trưởng thành này được protease HIV tông hop các protein bề mặt virus và tạo ra virus trưởng thành, có thể gây nhiễm.
- Liệu pháp ARV
ARV là chữ viết tắt của Anti RetroVừus. Thuốc ARV có khả năng kháng lại virus HIV một cách hiệu quả, đồng thời giảm khả năng lây nhiễm cho người khác và làm chậm quá trình từ nhiễm HIV đến giai đoạn mắc các loại nhiễm trùng cơ hội khác (AIDS).
Mục tiêu của liệu pháp là ngăn chặn sự nhân lên của virus càng nhiều càng tốt. Hiện nay, tiêu chuẩn chăm sóc bệnh nhân là sử dụng ít nhất ba loại thuốc đồng thời trong suốt thời gian điều trị, điều trị ngay khi phát hiện nhiễm HIV bất kể số lượng CD4 ban đầu và kéo dài suốt đời.
Nhiều loại thuốc kháng retrovirus được sử dụng trong điều trị HIV, được chia thành các nhóm sau: Nhóm ức chế sự xâm nhập của HIV, nhóm ức chế một trong ba enzym HIV cần trong sự nhân lên trong tế bào chủ và nhóm ức chế sao chép ngược bằng cách ngăn chặn ARN polymerase phụ thuộc ARN hoặc phụ thuộc ADN.
- Tác dụng của ARV
Thuốc ARV hiện nay chưa có khả năng chữa khỏi bệnh HIV hoàn toàn. Nhưng việc sử dụng thuốc giúp người bệnh cải thiện cuộc sống. Nếu điều trị bằng thuốc ARV ổn định, tải lượng virus dưới ngưỡng phát hiện thì bệnh nhân có thể sống gần như người bình thường. Trong khi những người nhiễm HIV nếu không được sử dụng ARV thì thời gian từ khi phát hiện bệnh đến lúc chuyển sang giai đoạn AIDS rất nhanh.
Nhiều bằng chứng khoa học trong những năm gần đây cho thấy, việc sử dụng thuốc kháng HIV (ARV) để điều trị cho người nhiễm HIV còn có tác dụng dự phòng lây nhiễm HIV. Nói một cách khác, khi người nhiễm HIV được điều trị, sẽ kiểm soát được tải lượng virus HIV trong máu của họ, từ đó sẽ làm giảm nguy cơ hoặc không làm lây nhiễm HIV sang người khác. Ngoài ra, thuốc ARV còn có tác dụng điều trị dự phòng trước và sau phơi nhiễm HIV.
các giai đoạn
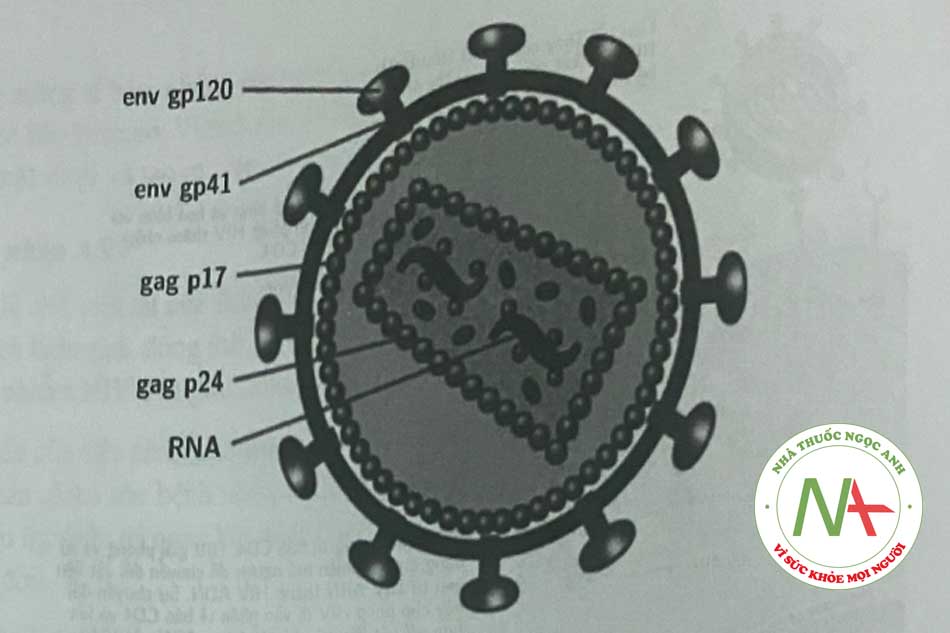
Bộ gen của HIV-1 chứa 2 phân tử ARN chuỗi đơn 9,2-kb giống hệt nhau trong virion, mỗi phân tử chứa thông tin cho 9 gen. Sau khi nhiễm vào tế bào chủ, dạng bền của bộ gen HIV-1 là ADN chuỗi kép tiền virus. Các virion HIV trưởng thành hình cầu và chứa màng lipid hai lóp bao xung quanh một nucleocapsid chứa bộ gen ARN, một protease virus, RT, một integrase và các yếu tố tế bào khác. Chu kỳ sống cùa HIV được vẽ trên Hình 1.2.
Các thuốc ức chế enzym phiên mã ngược (RT)
Enzym phiên mã ngược (reverse transcriptase IRT) tồn tại duy nhât ở virus HIV, nên enzym này trở thành mục tiêu nghiên cứu để phát triển thuốc điều trị virus. Các thuốc ức chế enzym phiên mã ngược có hai phân nhóm có cấu trúc khác nhau. Hai phân nhóm này sẽ được giới thiệu dưới đây.
- Các thuốc ức chế phiên mã ngược có cấu trúc nucleosid (NRTỈ)
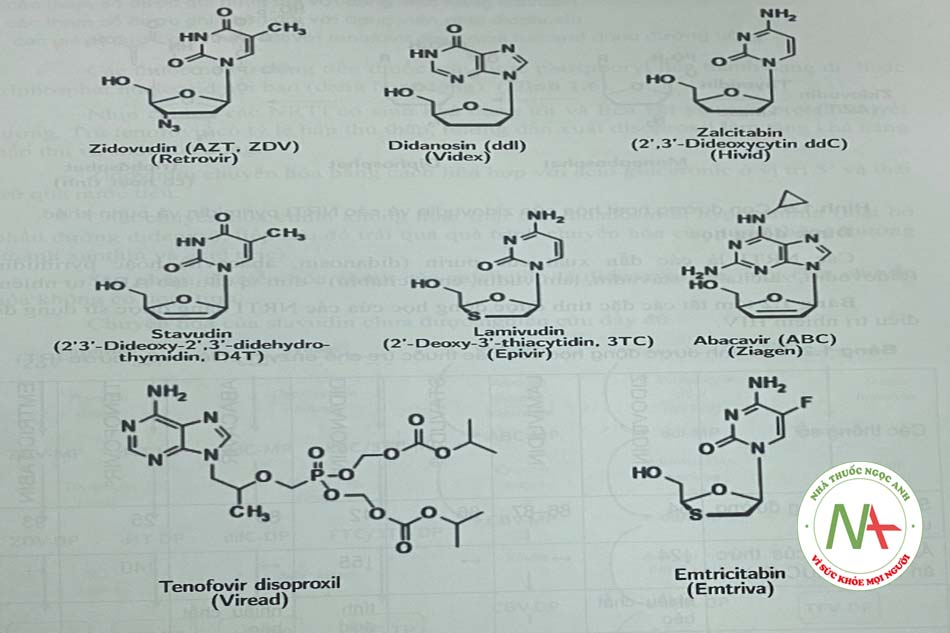
Quá trình tổng họp ADN virus dưới tác động của RT cần sự có mặt của các nucleosid (purin và pyrimidin) và các nucleotid. Do đó, các biến đổi hóa học của cấu trúc nucleosid đã được nghiên cứu với mục đích tìm ra thuốc điều trị virus HIV. Sự di chuyển nhóm 3’-hydroxyl của deoxynucleosid đã cho ra đời dideoxyadenosin (didanosin là tiền thuốc của dẫn chất này), dideoxycytodin và didehydrodideoxythymidin. Khi thay thế nhóm 3’-deoxy bằng nhóm azido đã tạo ra 3’-azidothymidin.
Như được minh họa trong Hình 1.3, virion HIV không có màng bao được mã hóa bởi enzym phiên mã ngược RT – một ARN phụ thuộc ADN polymerase, phiên mã thành ADN tiền virus, sau đó tích họp vào một ADN nhiễm sắc thể tế bào của vật chủ. cấu trúc của các NRTI được mô tả trong Hình 1.4.
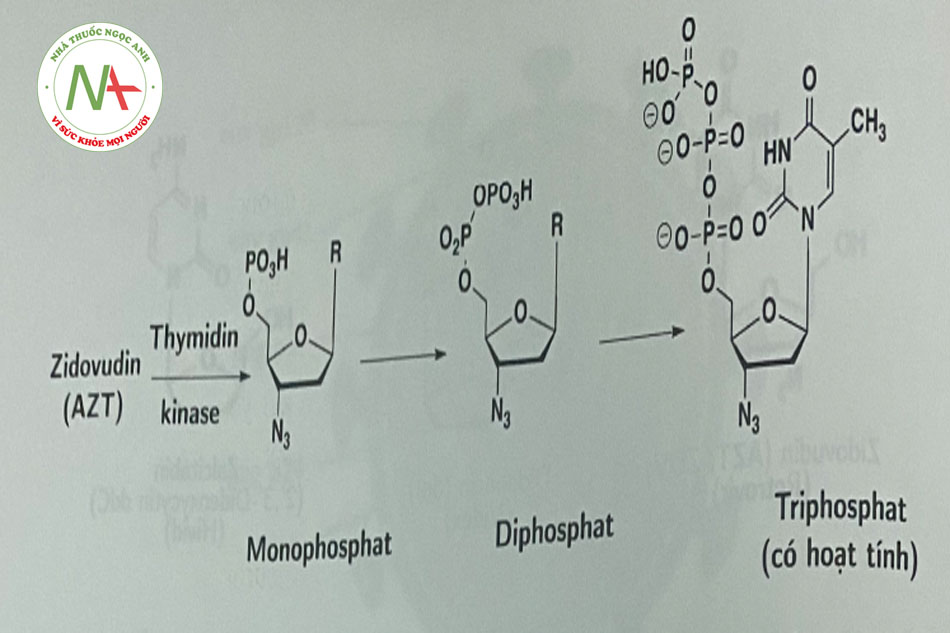
Tất cả các NRTI đều có cơ chế tác dụng tương tự nhau, do cấu trúc phần đường thiếu nhóm 3’-hydroxyl nên cùng có khả năng ức chế sự ức chế kéo dài của chuỗi ADN. Các NRTI là các tiền thuốc, chúng phải được phosphoryl hóa ở vị trí 5’ thành triphosphat, cạnh tranh với chất nền tự nhiên để tích hợp vào ADN tiền virus (Hình 1.5).
Chỉ có tenofovir disoproxil do có cấu trúc đặc biệt hơn các thuốc khác trong nhóm, được thủy phân nhanh chóng thành tenofovir, sau đó phosphoryl hóa bởi các kinase tế bào để trở thành dạng hoạt tính – tenofovir diphosphat (thực chất là triphosphat).
Dược động học
Các NRTI là các dẫn xuất của purin (didanosin, abacavứ) hoặc pyrimidin (zidovudin, zalcitabin, stavudin, lamivudin, emtricitabin) – đơn vị cấu tạo ADN tự nhiên tóm tắt các đặc tính dược động học của các NRTI đang được sử dụng để điều trị nhiễm HIV.
Bảng 1.2. Đặc tính dược động học của các thuốc ức chế enzym phiên mã ngược (RT) của virus HIV có cấu trúc nucleosid (NRTI).
| Các thông số | ZIDOVUDIN | LAMIVUDIN | STAVUDINb | DIDANOSINc | ABACAVIR | TENOFOVIRd | EMTRICITABIN | |
| Sính khả dụng đường uống (%) | 64 | 86-87 | 86 | 42 | 83 | 25 | 93 | |
| Ảnh hưởng của thức ăn đối với AUC (%) | ↓24 | ↔ | ↔ | ↓55 | ↔ | ↑40 | ↔ | |
| nhiều chất béo | tính acid |
nhiều chất béo | ||||||
| T1/2 (h) | 1,0 | 5-7 | 1,1-1,4 | n | 0,8-1,5 | 14-17 | 10 | |
| Liên kết protein (%) | 20-38 | <35 | <5 | <5 | 50 | <8 | <4 | |
| Chuyển hóa (%) | 60-80 | <36 | ND | 50 | >80 | ND | 13
|
|
| (glucuroni d hóa) | Trao đổi purin | (khử hydro;glucuronid hóa) | 86 | |||||
| Bài tiết qua thận của thuốc chính (%) | 14 | 71 | 39 | 18-36 | <5 | 70-80 | ||
T1/2: thời gian bán thải, ↑-tăng; ↓-giảm; ↔ không ảnh hưởng; ND: không được xác định.
a các giá trị trung bình được ghi nhận ở người lớn có chức năng gan thận bình thường.
b các tham số được ghi nhận đối với dạng viên nang stavudin.
c các tham số được ghi nhận đối với dạng viên nhai didanosin.
d các giá trị được ghi nhận đối với tenofovir disoproxil fumarat dùng đường uống.
- Các thuốc này ở dạng tiền thuốc cần được phosphoryl hóa thành dạng di- hoặc triphosphat nucleosid nội bào (dạng hoạt động). (Hình 1.6).
- Nhìn chung, các NRTI có sinh khả dụng tốt và liên kết yếu với protein huyết tương. Trừ tenofovir có tỷ lệ hấp thu thấp, nhưng dẫn xuất disoproxil làm tăng khả năng hấp thu và sinh khả dụng.
- Zidovudin chuyển hóa bằng cách liên hợp với acid glucuronic ở vị trí 5’ và thải trừ qua nước tiểu.
- Chất chuyển hóa chính không hoạt tính của didanosin là hypoxanthin (loại bỏ phần đường dideoxy), tiếp sau đó trải qua quá trình chuyển hóa của purin thông thường (thành xanthin và acid uric).
- Sản phẩm chuyển hóa chính của zalcitabin là dideoxyuridin, một chất chuyển hóa không có hoạt tính.
- Chuyển hóa của stavudin chưa được nghiên cứu đầy đủ.
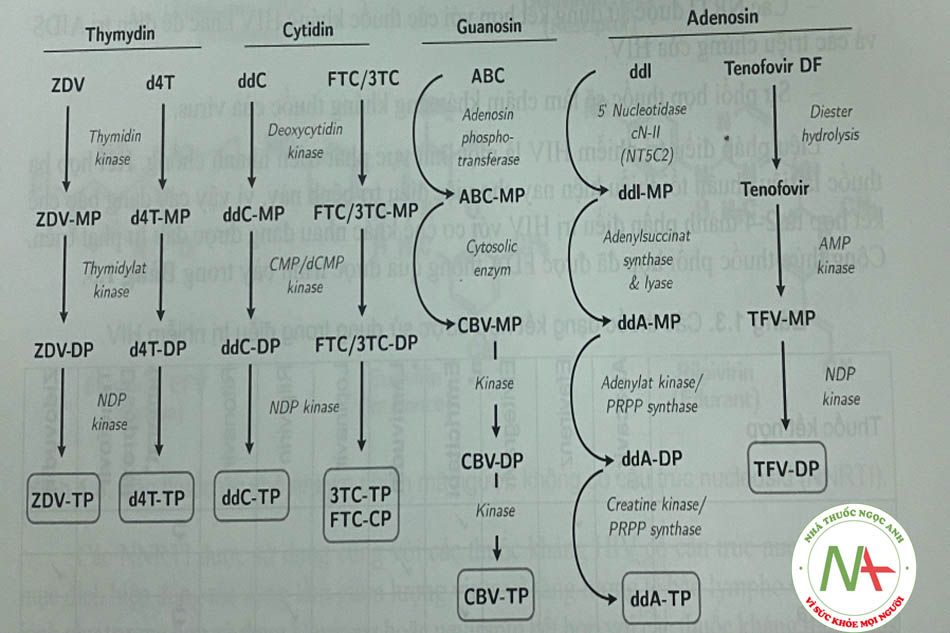
TP – triphosphat).
- Phần lớn lamivudin được thải trừ dưới dạng không biến đổi và một lượng nhỏ dạng sulfoxyd, còn tenofovir disoproxil được bài tiết chủ yếu dưới dạng không biến đổi.
- Acabavir được chuyển hóa chủ yếu thành chất chuyển hóa không hoạt tính do liên hợp với acid glucuronic và oxy hóa (Hình 1.7).
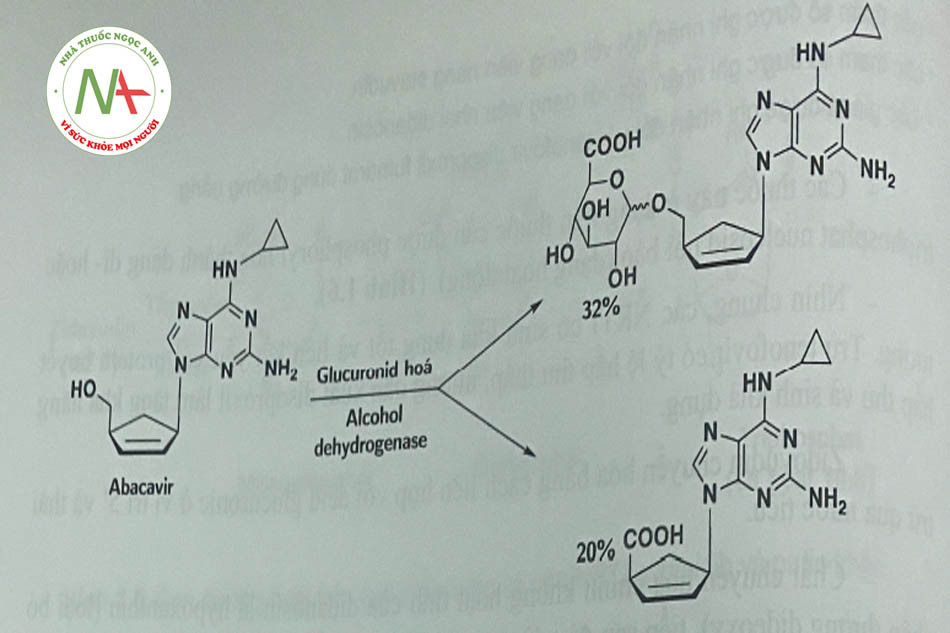
- Emtricitabin được chuyển hóa thành dạng sulfoxid và một sản phẩm liên hơp với acid glucuronic.
Ứng dụng lâm sàng
Các NRTI được sử dụng kết họp với các thuốc kháng HIV khác để điều trị AIDS và các triệu chứng của HIV.
Sự phối hợp thuốc sẽ làm chậm khả năng kháng thuốc của virus.
Liệu pháp điều trị nhiễm HIV là một lĩnh vực phát triển nhanh chóng. Kết hợp ba thuốc là tiêu chuẩn tối thiểu hiện nay cho việc điệu trị bệnh này, vì vậy các dạng bào chế kết hợp từ 2-4 thành phàn điều trị HIV với cơ chế khác nhau đang được đầu tư phát triển. Công thức thuốc phối hợp đã được FDA thông qua được trình bày trong Bảng 1.3.
Bảng 1.3. Các thuốc dạng kết hợp được sử dụng trong điều trị nhiễm HIV.
| Thuốc kết hợp | Abacavir* | Efavirenz | Elvitegravir | Emtricitabi
n* |
Lamivudin
* |
Lopinavir | Rilpivirin | Ritonavir | Tenofovir
Disoproxil fumarat* |
Zidovudin* |
| Atripla | √ | √ | ⇒ | |||||||
| Combirvir | √ | √ | ||||||||
| Complera | √ | √ | ⇒ | |||||||
| Epzicom | √ | √ | ||||||||
| Kaletra | √ | √ | ||||||||
| stribild | √ | √ | ⇒ | |||||||
| Trizivir | √ | √ | ||||||||
| Truvada | ⇒ |
Các NRTI được tô đậm.
- Các thuốc ức chế enzym phiên mã ngược không có cấu trúc nucleosid (NNRTI)
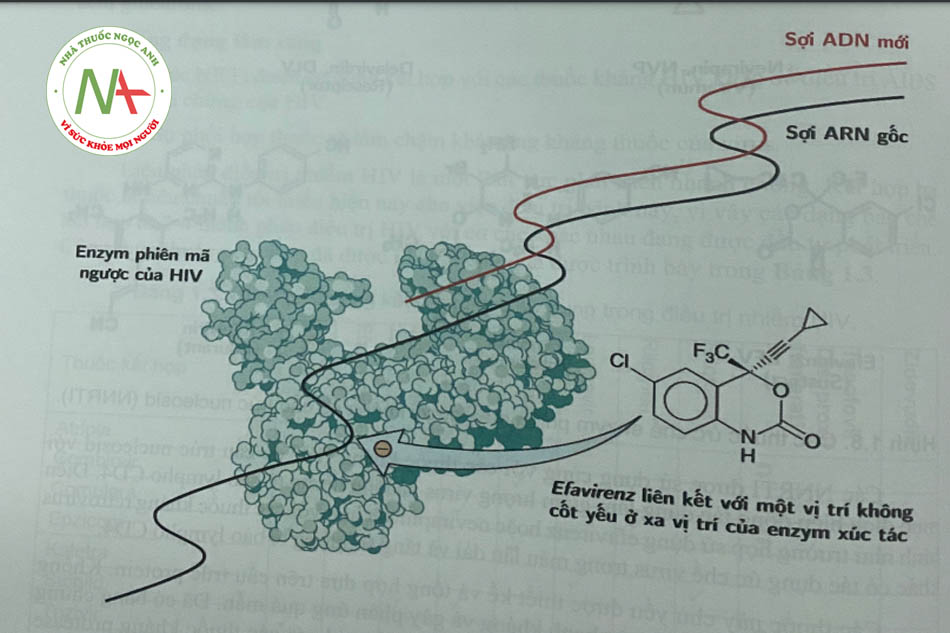
NNRTI bao gồm một số chất có cấu trúc hóa học khác nhau liên kết với túi kỵ nước trong tiểu đơn vị p66 của enzym phiên mã ngược HIV-1, tại vị trí cách xa vị trí hoạt động của enzym. Các tác nhân này làm thay đổi hình dạng cấu trúc không gian ba chiều của enzym, do đó làm giảm đáng kể hoạt động của nó và có vai trò hoạt động như chất ức chế không cạnh tranh. Các tác nhân này có hoạt tính chống lại HIV-1 nhưng không có tác dụng với HIV-2 hoặc các retrovirus khác, do đó không được chỉ định trong điều trị nhiễm HIV-2. Các hợp chất này cũng không có hoạt tính chống lại các ADN polymerase của tế bào chủ. Năm NNRTI được phê duyệt là nevirapin, efarivenz, etravirin, rilpivirin và delavirdin (Hình 1.8).
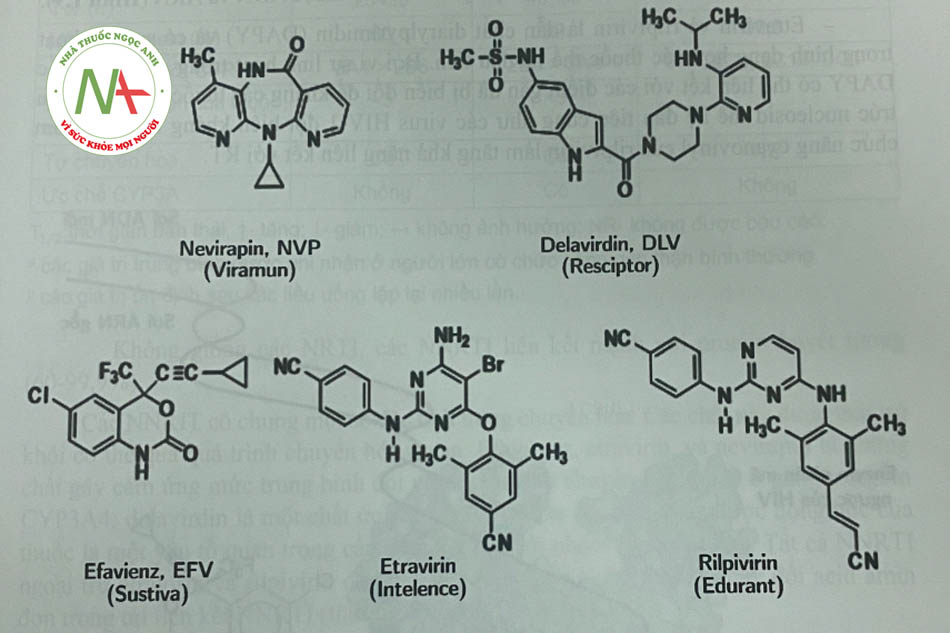
Các NNRTI được sử dụng cùng với các thuốc kháng HIV có cấu trúc nucleosid với mục đích hiệp đồng tác dụng làm giảm lượng virus và tăng lượng tế bào lympho CD4. Điển hình như trường hợp sử dụng efavirenz hoặc nevirapin kết hợp với các thuốc kháng retrovirus khác có tác dụng ức chế virus trong máu lâu dài và tăng số lượng tế bào lympho CD4.
Các thuốc này chủ yếu được thiết kế và tổng hợp dựa trên cấu trúc protein. Không nên sử dụng chúng đơn độc vì nhanh kháng và gây phản ứng quá mẫn. Đã có bằng chứng về sự tương tác của các thuốc không có cấu trúc nucleosid với các thuốc kháng protease (PI) khác như: saquinavir, indinavir và ritonavir. Ngoài ra sự tương tác của chúng với clarithromycin, ketoconazol, rifabutin và rifampin đang được nghiên cứu.
Etravirin và rilpivirin là NNRTI thế hệ thứ hai có hoạt tính chống HIV-1, cùng với các NNRIT thể hệ đầu tiên gồm nevirapin, delavirin và efavừenz. Etravirin và rilpivirin đã được FDA cấp phép (etravirin năm 2008 và rilpivirin năm 2011) để sử dụng kết hợp với các thuốc khác để điều trị HIV. Đặc biệt, etravirin được chấp thuận chỉ sử dụng cho người lớn và trẻ em từ 6 tuổi trở lên đã từng điều trị nhưng đã bị kháng với các NNRTI khác (tương tự rilpivirin được chấp thuận cho người lớn và bệnh nhi từ 12 tuổi trở lên với cân nặng ít nhất là 35 kg).
Cơ chế tác dụng
Các NNRTI thế hệ đầu tiên liên kết trực tiếp với RT và phá vỡ vị trí xúc tác. Kết quả của việc liên kết với RT này là khóa polymerase phụ thuộc ADN và ARN (Hình 1.9).
Etravirin và rilpivirin là dẫn chất diarylpyrimidin (DAPY) và có sự linh hoạt trong hình dạng hơn các thuốc thế hệ đầu tiên. Bởi vì sự linh hoạt trong cấu dạng, các DAPY có thể liên kết với các điểm gắn đã bị biến đổi để kháng các thuốc không có cấu trúc nucleosid thế hệ đầu tiên cũng như các virus HIV-1 đột biến kháng thuốc. Nhóm chức năng cyanovinyl của rilpivirin làm tăng khả năng liên kết với RT.
Dược động học
Như được chỉ ra trong Bảng 1.4, tất cả các NNRTI được sử dụng đường uống.
Bảng 1.4. Đặc tính dược động học của các thuốc ức chế enzym phiên mã ngược (RT)
của virus HIV có cấu trúc không nucleosid (NNRTI).
| Các tham số | NEVIRAPINb | EFAVIRENZb | ETRAVIRIN |
| Sinh khả dụng đường uống (%) | 90-93 | 50 | NR |
| Ảnh hưởng của thức ăn đối với AUC (%) | ↔ | ↑17-28 | ↑33-102 |
| T1/2 (h) | 25-30 | 40-55 | 41 |
| Liên kết protein (%) | 60 | 99 | 99,9 |
| Chuyển hóa bởi CYP | 3A4 > 2B6 | 2B6 > 3A4 | 3A4, 2C9, 2C19, UGT |
| Bài tiết qua thận của thuộc chính (%) | <3 | <3 | 1 |
| Tự chuyển hoá | Có | Có | NR |
| Ức chế CYP3A | Không | Cỏ | Không |
T1/2:thời gian bán thải, ↑ – tăng; ↓- giảm; ↔ không ảnh hưởng; NR- không được báo cáo. a các giá trị trung bình được ghi nhận ở người lớn có chức năng gan thận bình thường. b các giá trị ổn định sau các liều uống lặp lại nhiều lần.
- Không giống các NRTI, các NNRTI liên kết mạnh với protein huyết tương (60-99,9%).
Các NNRIT có chung một số đặc tính trong chuyển hóa. Các chất này được thải trừ khỏi cơ thể qua quá trình chuyển hóa ở gan. Efavirenz, etravirin, và nevirapin là những chất gây cảm ứng mức trung bình đối với các enzym chuyển hóa thuốc ở gan, bao gồm CYP3A4; delavirdin là một chất ức chế CYP3A4. Do đó, tương tác dược động học của thuốc là một yếu tố quan trọng cần xem xét đối với nhóm hợp chất này. Tất cả NNRTI ngoại trừ etravirin và rilpivirin dễ bị kháng thuốc gây ra bởi những thay đổi acid amin đơn trong túi liên kết NNRTI (thường ở codon 103 hoặc 181).
Nevirapin được oxy hóa chủ yếu bởi CYP3A4 và CYP2D6 dẫn đến hydroxyl hóa C2 và C12 hoặc C3 và C8 tương ứng. Nevirapin được chuyển hóa do kết hợp với acid glucuronic thành các chất chuyển hóa được thủy phân, thải trừ qua nước tiểu. Chất trung gian chuyển hóa quinon của nevirapin còn hoạt tính, gây ra phát ban, độc tính trên gan và bị bất hoạt bởi CYP3A4.
- Con đường chuyển hóa chính và bất hoạt delavirdin là phản ứng oxy hóa loại nhóm N-isopropyl bởi CYP3A4 ở gan và dược động học của thuốc không tuyến tính.
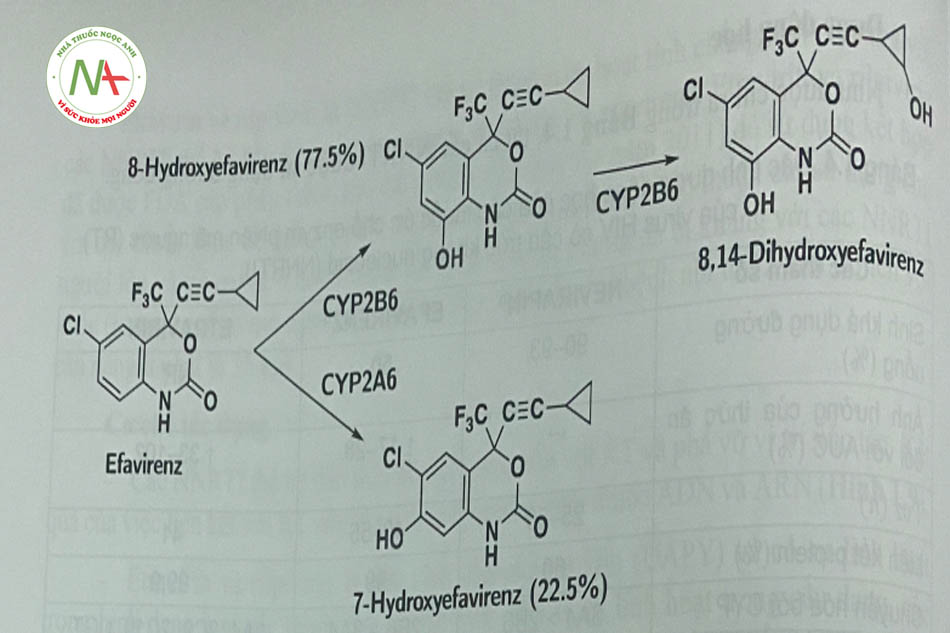
Sản phẩm chuyển hóa của efavirenz là 7-hydroxyefavirenz và 8- hydroxyefavirenz do tác dụng của CYP2A6 và CYP2B6 (Hình 1.10) tương ứng. Sau đó tiếp tục chuyển hóa thành 8,14-8 hydroxyefavirenz.
– Etravirin được chuyển hóa bởi các CYP450 khác nhau dẫn đến hydroxyl hóa monomethyl, dimethyl và nhân thơm. Etravirin hoạt hóa CYP3 A4 nên có khả năng
Tác dụng không mong muốn
Phát ban thường xuyên xảy ra với tất cả NNRTI trong 4 tuần điều trị đầu. Tăng enzym gan cũng được ghi nhận. Efavirenz cũng gây quái thai ở linh trưởng và phụ nữ, do đó không sử dụng thuốc cho phụ nữ có thai. Các tác dụng bất lợi của relpivirin tương tự như efavirenz bao gồm rối loạn hầm cảm, mất ngủ, đau đầu và phát ban. Tình trạng phát ban ở các thuốc thế hệ thứ hai nhẹ hơn các thuốc thế hệ đầu tiên.
Các thuốc ức chế protease (PI)
Các thuốc ức chế protease HIV không tác dụng lên RT nhưng có tác dụng khóa sự giải phóng của các tiểu phân virus khỏi các tế bào bị nhiễm. Sự ra đời của nhóm thuốc này là một một bước tiến quan trọng của ngành hóa dược và là bước đột phá trong sự phát triển của liệu pháp điều trị HIV khi kết họp với các thuốc ức chế RT.
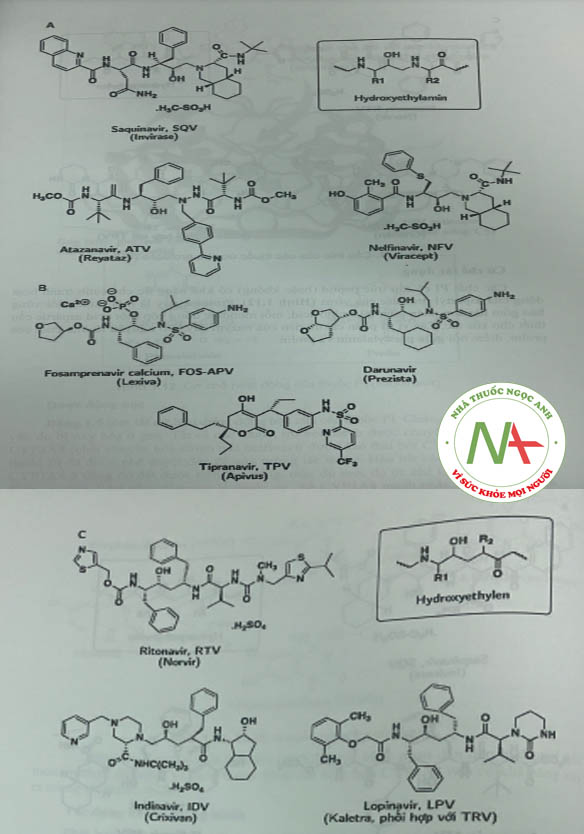
Dưới đây là cấu trúc của các thuốc ức chế protease thường được sử dụng trong điều trị (Hình 1.11).
Cơ chế tác dụng
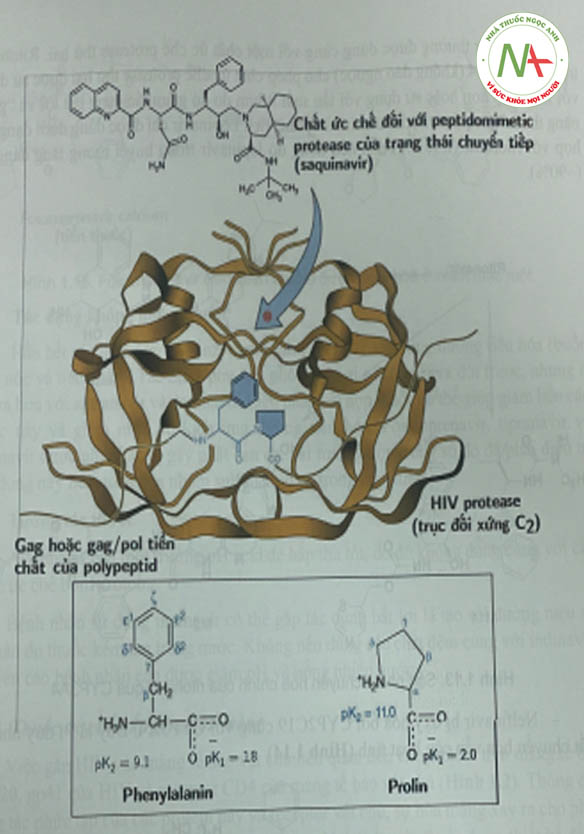
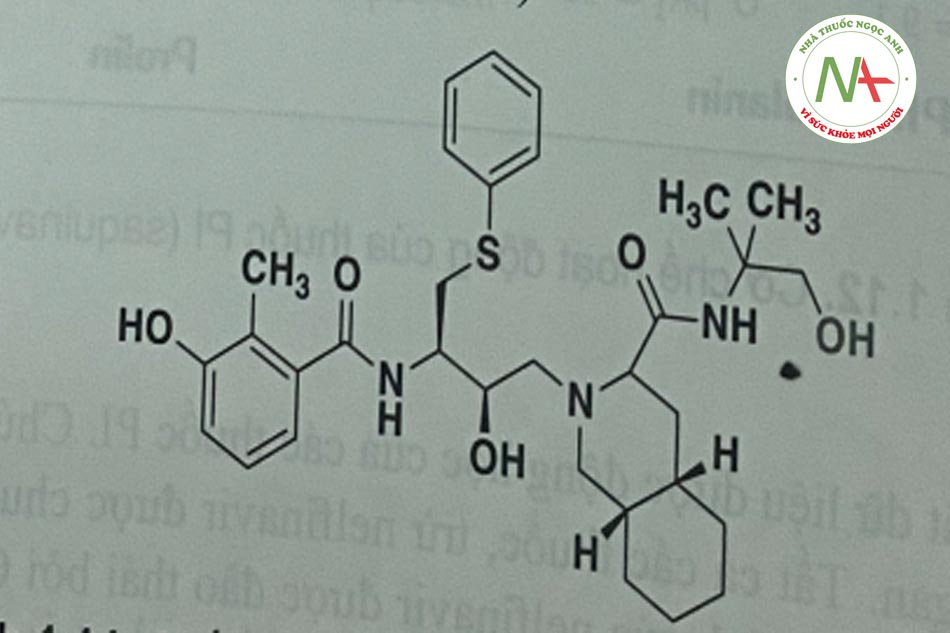
Các chất PI có cấu trúc peptid (hoặc không) có khả năng ức chế cạnh tranh hoạt động của aspartyl protease của virus (Hình 1.12). Protease này là một dimer đối xứng bao gôm hai đơn phân gồm 99 amino acid; mỗi monome đóng góp một acid aspartic cần thiết cho xúc tác. Các vị trí phân cắt ưu tiên của enzym này là ở nguyên tử nitơ cuối của prolin, điểm nối giữa phenylalanin và prolin.
Bảng 1.5 tóm tắt dữ liệu dược động học của các thuốc PI. Chúng được thải trừ chủ yếu do bị oxy hóa ở gan. Tất cả các thuốc, trừ nelfinavir được chuyển hóa chủ yếu bởi CYP3A4 (chất chuyển hóa chính của nelfinavir được đào thải bởi CYP3A4). Tất cả các thuốc PI đã được phê duyệt đều dễ gây tương tác thuốc. Hầu hết các thuốc này ức chế CYP3A4 ở nồng độ đạt được trên lâm sàng, mặc dù mức độ ức chế khác nhau khá lớn. Tính tới thời điểm này, ritonavir là thuốc ức chế CYP3A4 mạnh nhất. Trong liệu pháp điều trị HIV hiện nay người ta thường kết họp các PI với liều thấp ritonavir hoặc cobicistat để tận dụng khả năng ức chế chuyển hóa CYP3 A4 đáng kể của một trong hai loại trên.
Ritonavir thường được dùng cùng với một chất ức chế protease thứ hai. Ritonavir ức chế CYP3A4 (không đảo ngược) cho phép chất ức chế protease thứ hai được sử dụng với liều thấp hơn hoặc sử dụng với tần suất ít hơn do đó giảm tác dụng bất lợi và “gánh nặng thuốc” (saquinavir, darunavir và tipranavir). Lopinavir chỉ được dùng dưới dạng kết hợp với ritonavir (tỉ lệ 4:1) dẫn đến nồng độ lopinavir trong huyết tương tăng đáng kể (-90%).
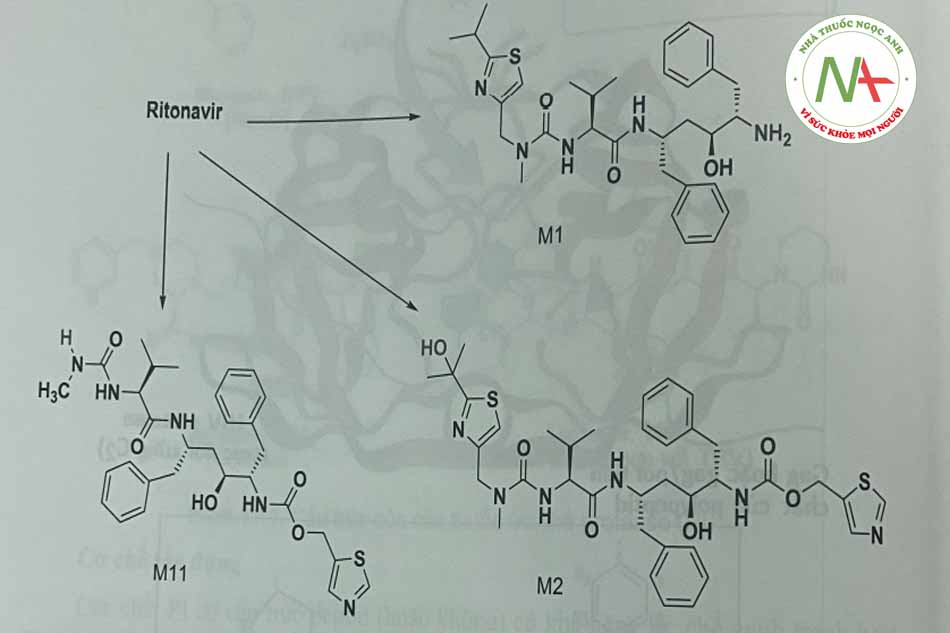
Nelfinavir bị oxy hóa bởi CYP2C19 cùng với CYP3A4. Đây la chất PI duy nhất mà chất chuyển hóa vẫn còn hoạt tính
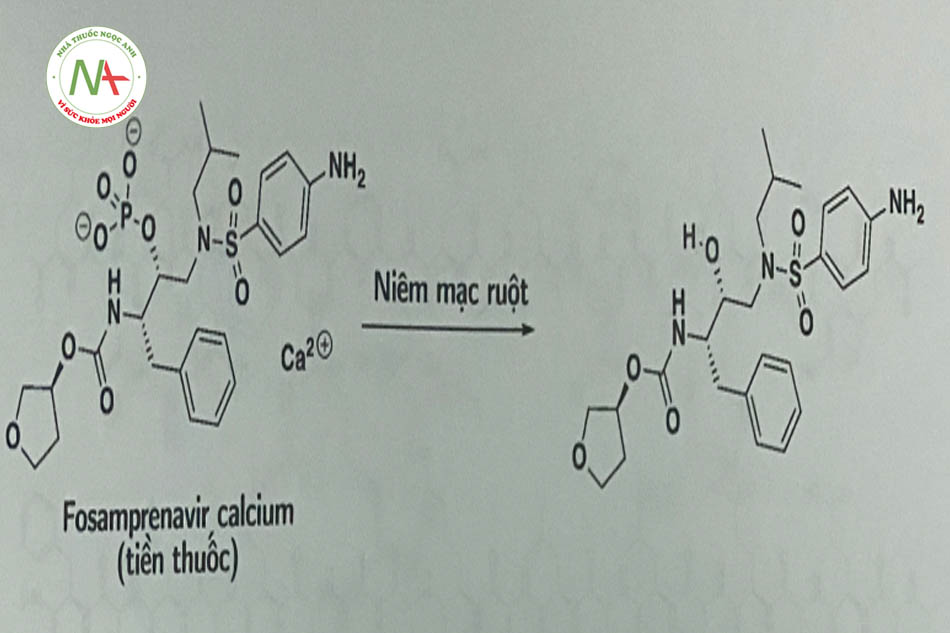
Fosamprenavir ở dạng tiền thuốc bị thủy phân bởi phosphatase, thành amprenavir là một thuốc có cấu trúc peptid với đích tác dụng là protease của HIV-1 (Hình 1.15).
Tác dụng không mong muốn
Hầu hết các thuốc ức chế enzym protease (PI) gây kích ứng đường tiêu hóa (buồn nôn, nôn và tiêu chảy). Tác dụng phụ này phổ biến với các các PI ra đời trước, nhưng ít xảy ra hơn với atazanavir và darunavir. Liệu pháp kết hợp thuốc có thể giúp giảm liều các thuốc này và giảm mức độ kích ứng đường tiêu hóa. Fosamprenavir, tipranavir và darunavir được ghi nhận là gây phát ban da, vài trường họp trong số đó đã phải điều trị (tác dụng này liên quan đến nhóm sulfonamid có trong công thức).
Tương tác thuốc
Atazanavir cần môi trường pH acid để hấp thu tốt, do đó không dùng cùng với các thuốc ức chế bơm proton.
Bệnh nhân sử dụng indinavir có thể gặp tác dụng bất lợi là tạo sỏi đường niệu và sỏi thận do thuốc kém tan trong nước. Không nên dùng các chất đệm cùng với indinavir. Khuyến cáo bệnh nhân cần được giảm pH và uống nhiều nước.
- Thuốc ức chế hấp phụ/hòa màng
Việc gắn HIV vào màng tế bào vật chủ liên quan đến các protein trên màng tế bào – gpl20, gp41 của HIV và receptor CD4 của màng tế bào vật chủ (Hình 1.2). Thông qua tương tác phức tạp của các protein này và receptor vật chủ, sự hòa màng xảy ra cho phép virion HIV xâm nhập vào tế bào vật chủ. Về mặt lý thuyết, các thuốc được thiết kế để ức chế sự hấp phụ hoặc hòa màng, do đó ngăn cản HIV đi vào trong tế bào vật chủ. Trong nhóm thuốc này có hai đại diện là enfuvirtid và maraviroc.
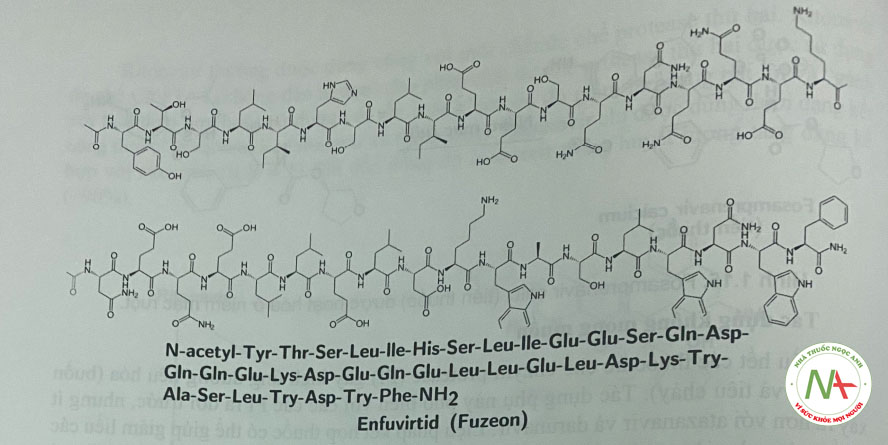
Enfuvirtid
Enfivirtid là một peptid tổng họp chứa 36 amino acid được thiết kế dựa trên cấu trúc của một phần protein bề mặt gp41 của HIV (tương tự mảnh HR2 của gp41), khóa sự hình thành của một cấu trúc bó (6 cấu trúc xoắn) đóng vai trò quan trọng trong sự dung hợp của virion HIV-1 và tế bào lympho T.
Cơ chế tác dụng
Để thâm nhập được vào tế bào vật chủ, protein gp41 của virus cần phải có sự thay đổi về hình dạng, cho phép protein gpl20 của virus liên kết được với protein receptor CD4 của tế bào vật chủ. Kết quả dẫn đến sự hòa màng của HIV với màng tế bào vật chủ. Vai trò của enfuvirtid là liên kết với protein gp41 giàu tryptophan của HIV-1 để ngăn cản sự thay đổi hình dạng do đó ngăn cản sự hòa màng.
Tuy nhiên, virus có thể đột biến 1 trong 10 amino acid bất kỳ ở một phần của gp41, dẫn đến kháng enfuvirtid.
Dược động học
Enfuvirtid có cấu trúc peptid, do đó dễ bị chuyển hóa phân giải. Thời gian bán thải là 3,8 giờ. Dạng bào chế là dung dịch để tiêm dưới da 2 lần/ngày (có thể gây ra các vấn đề về tuân thủ điều trị của bệnh nhân). Liên kết với protein huyết tương với tỷ lệ cao (92%).
Các tác dụng không mong muốn: Người bệnh hay xuất hiện phản ứng tại chỗ tiêm (ban đỏ, ngứa) và mất ngủ.
Maraviroc
Liên kết của gp41 và gpl20 trên bề mặt tế bào HIV-1 với các receptor của tế bào T của tế bào vật chủ được hỗ trợ bởi protein CCR5 ở một vài cá thể. Protein CCR5 là một chemokin được tìm thây ở tế bào vật chủ, có chức năng như một coreceptor (đông receptor) đối với sự hòa màng và xâm nhập của virion HIV. Coreceptor thứ hai liên quan đến sự xâm nhập của HIV-1 vào tế bào vật chủ là protein CXCR4, có mặt ở một vài tế bào T.
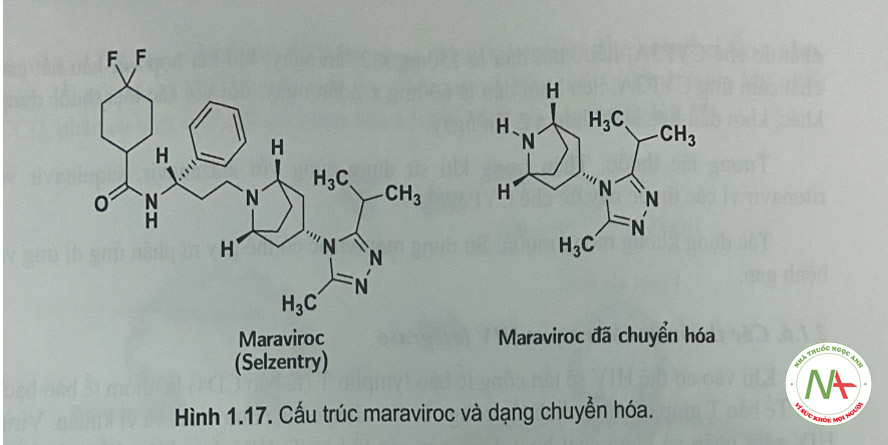
Cơ chế tác dụng
- Maraviroc liên kết chọn lọc với CCR5 ức chế sự gắn của HIV-1 với phức hợp CCR5-gpl20/gp41. Việc ức chế HIV-1 gắn với tế bào vật chủ có tác dụng ngăn cản sự hòa màng và xâm nhập vào tế bào vật chủ.
- Một số bệnh nhân có đột biến ở gen CCR5 (CCR5-Ô32) có thể sẽ không đáp ứng vói maraviroc.
- Maraviroc không có tác dụng với các tế bào có coreceptor CXCR4 (có ở virus HIV nhiệt đới), do đó cần tiến hành xét nghiệm virus nhiệt đới (khuyến cáo không sử dụng thuốc ở những bệnh nhân nhiễm HIV-1 nhiệt đới có CXCR-4).
Dược động học
- Thuốc hấp thu tốt khi dùng đường uống. Sau khi uống, nồng độ đỉnh đạt được sau 0,5 đến 4 giờ. Có sự thay đổi đáng kể giữa các cá thể trong dược động học. Sinh khả dụng thấp (23%- 33%) có thể do maraviroc là chất nền của P-glycoprotein. Liên kết cao với protein huyết tương (76%).
- Maraviroc được chuyển hóa bởi CYP3A4 tạo thành chất chuyển hóa N-dealkyl hóa không hoạt tính, càn lưu ý khả năng tương tác của maraviroc với các thuốc khác được chuyển hóa bởi CYP3A4. Maraviroc không ức chế enzym CYP450 trên lâm sàng.
Ứng dụng lâm sàng
Sử dụng maraviroc cùng với các thuốc ARV khác để điều trị cho bệnh nhân nhiễm HIV-1.
Liệu pháp kết hợp nên gồm ít nhất 3 thuốc khác nhau thuộc ít nhất 2 phân nhóm ARV khác nhau: thuốc ức chế phiên mã ngược có cấu trúc nucleosid, thuốc ức chế phiên mã ngược không có cấu trúc nucleosid, thuốc ức chế protease và ức chế xâm nhập enfuvirtid.
Maraviroc là loại thuốc kháng retrovirus duy nhất được phê duyệt với 3 liều khởi đầu khác nhau tùy thuộc vào thuốc dùng trong cùng phác đồ. Khi kết hợp với hầu hết các chất ức chế CYP3A, liều khởi đầu là 150mg X 2 lần/ngày; khi kết hợp với hầu hết các chất cảm ứng CYP3A, liều khởi đầu là 600mg X 2 lần/ngày; đối với các loại thuốc dùng khác, khởi đầu liều là 300mg X 2 lần/ngày.
Tương tác thuốc: Thận trọng khi sử dụng cùng với atazanavir, saquinavir và ritonavir vì các thuốc này ức chế CYP3A4.
Tác dụng không mong muốn: Sử dụng maraviroc có thể gây ra phản ứng dị ứng và bệnh gan.
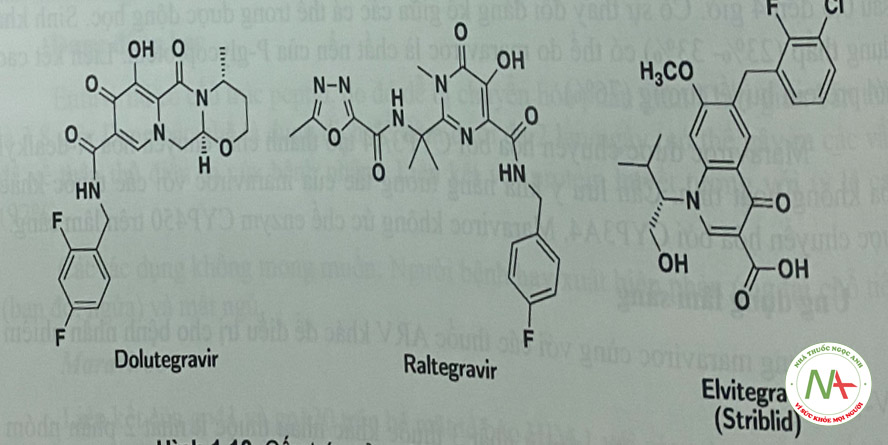
Các thuốc ức chế enzym HIViutegrase
Khi vào cơ thể HIV sẽ tấn công tế bào lympho T (tế bào CD4) là nhóm tế bào bạch cầu. Tế bào T giúp hệ miễn dịch tấn công các tác nhân có hại như virus và vi khuẩn. Virus HIV xâm nhập và kiểm soát hoạt động của các tế bào T. HIV thực hiện điều này bằng cách tạo ra một loại enzym có tên là integrase. Integrase cho phép ADN của virus hợp nhất với ADN của tế bào CD4 và sau đó Hrv có thể kiểm soát các tế bào. Nếu không được điều trị, Hrv sẽ dần dần phá hủy các tế bào CD4 và làm giảm số lượng tế bào CD4 trong cơ thể. Lúc này tế bào CD4 sẽ không còn khả năng phát tín hiệu để hệ miễn dịch chống lại nhiễm trùng, ung thư và các bệnh khác. Đó là lý do mà những người nhiễm Hrv dễ mắc thêm các bệnh nhiễm trùng cơ hội cũng như ung thư khác.
Thuốc ức chế enzym intergrase ngăn virus HIV tạo ra integrase. Khi không có sự trợ giúp của enzym này, HIV không thể xâm chiếm các tế bào CD4 để tiến hành tự sao chép và nhân lên. Khi kết họp với các loại thuốc ARV khác, thuốc ức chế integrase có thể kiểm soát hiệu quả tinh trạng nhiễn HIV. Dưới đây là mệt số loại thuốc ức chế enzym integrase hiện đang được sử dụng điều trị (Hình 1.18).
Integrase tham gia vào quá trình sinh tổng hợp virus HIV theo cơ chế: Một phức hợp từ 40-100 phân tử integrase tham gia vào quá trình tích họp ADN bổ sung của virus (cADN) vào bộ gen tế bào chủ. Sau khi enzym RT thực hiện nhiệm vụ và sản sinh cADN trong bào tương, cADN tiếp tục quá trình ở đầu 3 ’ của cADN. cADN này cùng với các protein của tế bào và virus (phức họp preintegrase) di chuyển vào nhân nơi xảy ra sự tích hợp vào ADN kép của vật chủ. HIV integrase (32-kDa protein) gồm ba miền: đầu amino, miền lõi xúc tác (CCD) và đầu carboxy. Đầu amino liên kết với kẽm, trong khi miền CCD, phần có hoạt tính của integrase liên kết với Mn2+ và Mg2+ (Hình 1.19).
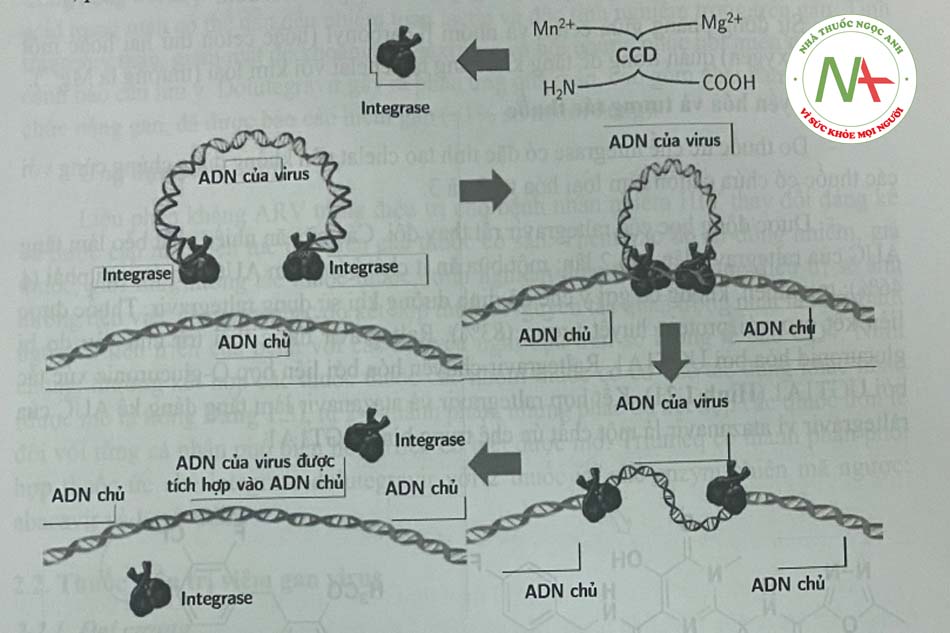
Cơ chế tác dụng: Các chất ức chế enzym tích hợp integrase của HIV ngắn chặn sự hình thành giữa ADN tế bào và ADN virus – một quá trình được gọi là chuyển chuyễn – bằng cách tạp ra phức hợp cletat với cation hoa trị 2 cở vị trí CCD của HIV (hình 1.20)
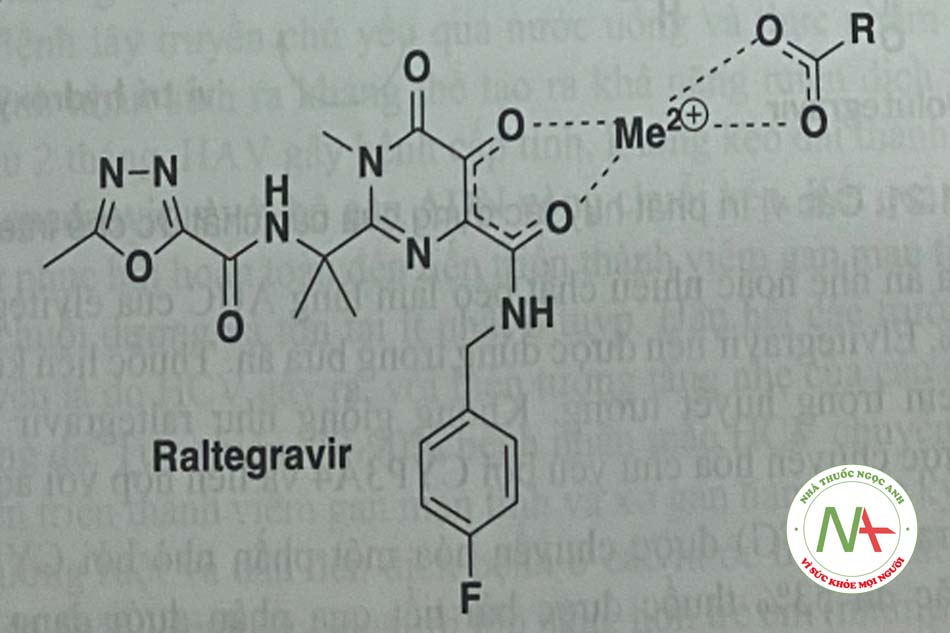
- Kết quả của sự liên kết trên là ức chế sự tích hợp cADN vào ADN vật chủ
- Giống các nhóm mang dược tính (pharmacophore), các thuốc ức chế có khả năng tạo chelat kim loại qua các nguyên tử oxy giàu
- Sự đồng phẳng giữa ceton và nhóm p-carbonyl (hoặc ceton thứ hai hoặc carboxyl oxygen) quan trọng để tăng khả năng tạo chelat với kim loại (thường là Mg 2+)
Chuyển hóa và tương tác thuốc - Do thuốc ức chế integrase có đặc tính tạo chelat nên không dùng chúng cùng với các thuốc có chứa cation kim loại hóa trị 2 và 3.
- Dược động học của raltegravir rất thay đổi. Các bữa ăn nhiều chất béo làm tăng AUC của raltegravir lên gấp 2 lần; một bữa ăn ít chất béo giảm AUC ở mức vừa phải giảm 46%); tuy nhiên, không có gợi ý chế độ dinh dưỡng khi sử dụng raltegravir. Thuốc đưoc liên kết cao với protein huyết tương (83%). Raltegravir được thải trừ chủ yếu do bi glucuronid hóa bởi UGT1 Al. Raltegravir chuyển hóa bởi liên hợp O-glucuronic xúc tác bởi UGT1 AI (Hình 1.21). Kết họp raltegravir và atazanavir làm tăng đáng kê AUC của raltegravir vì atazanavir là một chất ức chế trung bình ƯGT1 AI.
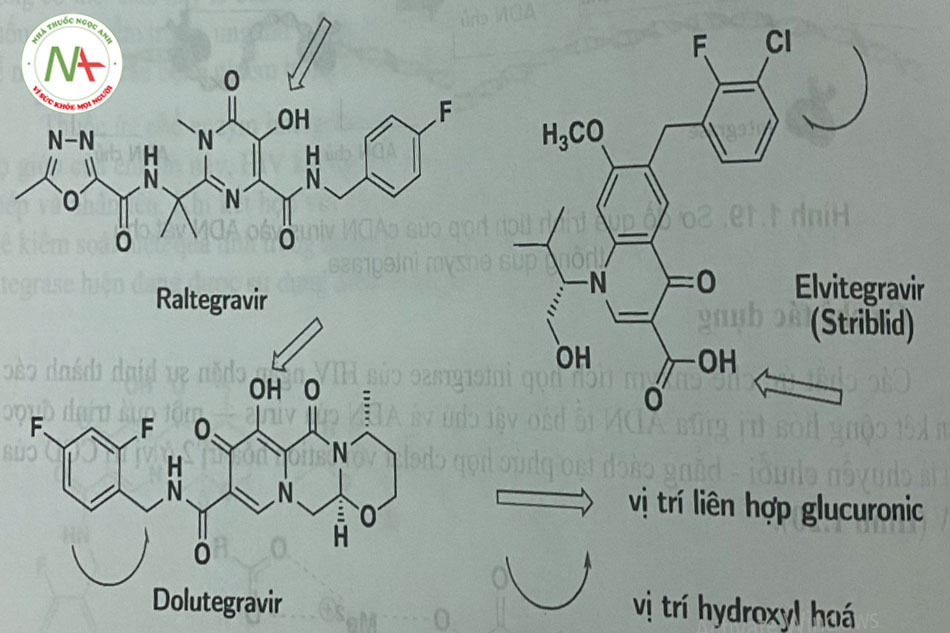
- Các bữa ăn nhẹ hoặc nhiều chất béo làm tăng Aưc của elvitegravir tương ứng là 34% hoặc 87%. Elvitegravừ nên được dùng trong bữa ăn. Thuốc liên kết phần lớn (98% -99%) vói protein trong huyết tương. Không giống như raltegravir và dolutegravir, elvitegravir là được chuyển hóa chủ yếu bởi CYP3A4 và liên hợp với acid glucuronic.- Dolutegravir (DTG) được chuyển hóa một phần nhỏ bởi CYP3A và chủ yẹu bởi UGT1A1 mặc dù 53% thuốc được bài tiết qua phân dưới dạng không biến đổi (Hình 1.21).
Tác dụng không mong muốn
Các thuốc ức chế enzym integrase: Tác dụng bất lợi đã được ghi nhận với raltegravir trong dạng kết hợp 4 thuốc (Stribild; Bảng 1.3) là gây nguy hiểm đến tính mạng. Tích tụ acid trong máu có thể dẫn đến nhiễm toan lactic và độc tính nghiêm trọng trên gan. Tình trạng suy thận, giảm mật độ khoáng trong xương và hội chứng phục hồi miễn dịch là các cảnh báo cần lưu ý. Dolutegravir gây ra phản ứng quá mẫn, bao gồm phát ban và rối loạn chức năng gan, đã được báo cáo hiếm gặp (<1% số người dùng).
Ứng dụng lâm sàng
Liệu pháp kháng ARV trong điều trị cho bệnh nhân nhiễm HIV thay đổi đáng kể và được cập nhật liên tục dựa trên các thuốc có sẵn. Thêm vào đó sự đồng nhiễm, giá thuốc, giới tính, tương tác thuốc-thuốc, kinh nghiệm điều trị, đối tượng điều trị sẽ ảnh hưởng đến việc chọn lựa phác đồ kết hợp thuốc. Nguyên tắc quan trọng nhất là làm giảm nguy cơ tiến triển của bệnh với các khuyến nghị dựa trên số lượng tế bào CD4. Nhìn chung, thường kết hợp các thuốc thuộc các nhóm thuốc có cơ chế tác dụng khác nhau (được mô tả trong Bảng 1.3), từ 2-4 thành phần, nhưng phác đồ kết hợp các thuốc đơn lẻ đối với từng cá nhân phổ biến hơn. Hiện có biệt dược mới Triumeq có thành phần phối hợp thuốc ức chế integrase dolutegravir với 2 thuốc ức chế enzym phiên mã ngược: abacavir và lamivudin.
Thuốc điều trị viêm gan virus
- Đại cương
Virus viêm gan (hepatotropic virus) gây viêm và hoại tử gan. Có 5 loại vius gây bệnh gồm Hepatitis A (HAV), Hepatitis B (HBV), Hepatitis c (HCV), ít phổ biến hơn là Hepatitis D (HDV) và Hepatitis E (HEV).
Viêm gan virus cấp tính gây sốt, buồn nôn, nôn và vàng da. Tất cả các dạng viêm gan đều gây ra các tổn thương mô bệnh học giống nhau trong giai đoạn cấp tính ở gan. HAV là thành viên của họ picomavirus, mang bộ gen ARN chuỗi đơn. Khởi phát của viêm gan HAV thường xảy ra sớm, ngược với sự khởi phát chậm của bệnh khi nhiễm HBV và HCV. Bệnh lây truyền chủ yếu qua nước uống và thực phẩm bị ô nhiễm. Hệ miễn dịch của bệnh nhân sinh ra kháng thể tạo ra khả năng miễn dịch và thường bệnh nhân phục hồi sau 2 tháng. HAV gây bệnh cấp tính, không kéo dài thành mạn tính. HBV thuộc phân lớp hepadnavirus với bộ gen ADN vòng chuỗi kép. Kết quả của nhiễm viêm gan B thay đổi từ phục hồi hoàn toàn đến tiến triển thành viêm gan mạn tính. HCV là một flavivirus ARN chuỗi dương và tồn tại ít nhất 6 tuýp. Hầu hết các trường hợp của viên gan sau tiêm truyền là do HCV gây ra, với hiện tượng tăng nhẹ của các enzym gan và có một tỷ lệ nhỏ vàng da. Tuy nhiên, 70-90% bệnh nhân mắc HCV chuyển thành viêm gan mạn và có thể tiến triển thành viêm gan mạn tính và xơ gan hàng thập kỷ sau đó. HEV bị lây nhiễm qua đường ruột và dẫn đến dịch bệnh ở các nước đang phát triển, nơi nguồn nước bị ô nhiễm do phân. Bệnh này ở người lớn nặng hơn trẻ em (những đối tượng không có biểu hiện trên lâm sàng).
Có hai điểm khác biệt đáng chú ý giữa HBV và HCV: thứ nhất, HBV là một bệnh có thể phòng ngừa bằng vaccin, trong khi không có vaccin nào có thể ngăn ngừa HCV thứ hai, HCV cổ thể được được chữa khỏi bằng phương pháp điều trị hiệu quả, trong các phương pháp điều trị HBV hiện tại là không chữa khỏi hoàn toàn.
Dưới đây là các loại vaccin đang lưu hành để phòng bệnh viêm gan virus hiện nay
- Vaccin viêm gan A (Harvix, Vaqta).
- Vaccin viêm gan B (Engerix-B, Revombivax).
- Vaccin viêm gan A và viêm gan B kết hợp (Twinrix): kết họp giữa Harvix và Engerix B.
- Liệu pháp thuốc điều trị virus viêm gan
Các loại viêm gan virus phổ biến nhất là viêm gan A, viêm gan B và viêm gan C . Tuy nhiên viêm gan virus B, C là nguyên nhân hàng đầu dẫn đến suy gan, xơ gan, ung thư gan, do đó trong phần này sẽ đề cập tới các loại thuốc điều trị viêm gan virus B và C. Hiện có khoảng hơn 30 hợp chất đang được phát triển để điều trị bệnh viêm gan B, C. Hầu hết đang trong giai đoạn phát triển ban đầu, nhưng có nhiêu hứa hẹn cho việc điều trị loại virus này.
Thuốc điều trị virus viêm gan B
Những người mắc virus viêm gan B mạn tính có thể trải qua một số giai đoạn bệnh trong suốt cuộc đời. Các liệu pháp điều trị HBV hiện tại không thể chữa khỏi hoàn toàn và chỉ một phần nhỏ (~ 10%) bệnh nhân được chữa khỏi về mặt chức năng.
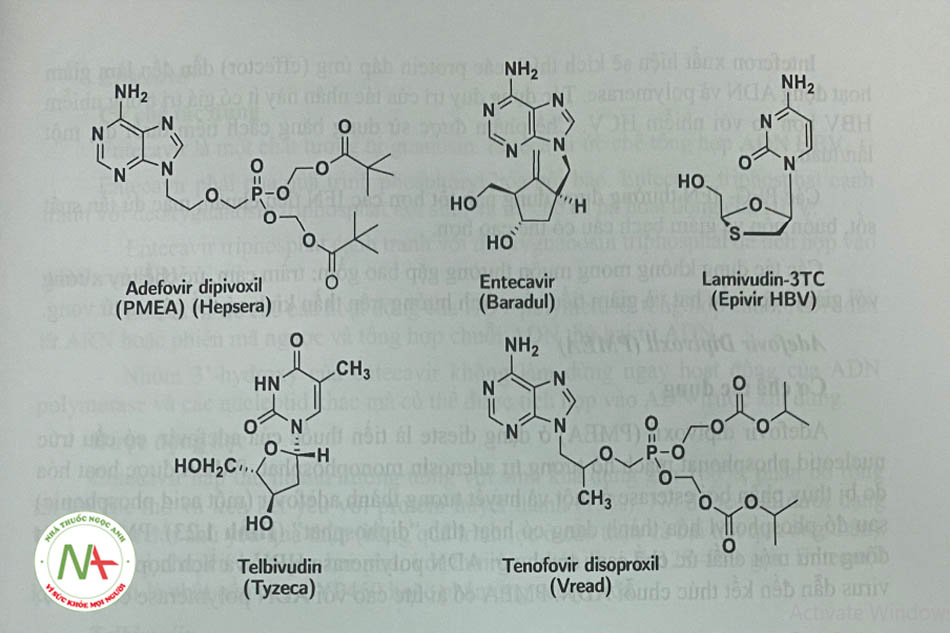
Các lựa chọn để điều trị HBV gồm pegIFN-a, có tác dụng kháng virus và điều hòa miễn dịch không đặc hiệu, hoặc các chất tương tự nucleosid/-tid như: adefovir, entecavir, lamivudin, telbivudin và tenofovir, ức chế polymerase của HBV. Điều trị IFN có thời hạn (48—52 tuần), trong khi các bệnh nhân có thể phải điều trị suốt đời với các chất tương tự nucleosid/-tid. Entecavir và tenofovir là những liệu pháp nucleosid/-tid được ưu tiên do hiệu quả tác dụng, khả năng dung nạp tốt và ít tiềm năng phát triển kháng thuốc. Cân nhắc lựa chọn giữa các liệu pháp ưu tiên cho HBV bao gồm mức độ nghiêm trọng của bệnh gan, sự tự nguyện của bệnh nhân, lịch sử điều trị, tác dụng phụ, kiểu gen/ huyết thanh HBV, bệnh đi kèm và chi phí.
Issacs và Lindenmann đã tìm ra interferon vào năm 1957. Khi interferon xâm nhập vào các tế bào có virus, nó cản trở các tác động của virus lên tế bào và bảo vệ các tế bào khỏi nhiễm nhiều virus hơn. Các interferon là một nhóm các glycoprotein với trọng lượng phân tử từ 20 đến 160 kDa. Các protein này được sinh ra bởi các tế bào khác nhau của người với đặc tính ức chế phát triển của virus, sự nhân lên của tế bào và điều hòa miễn dịch. Các interferon ở người được phân thành leukocyt interferon (IFN-a) sinh ra bởi các lympho bào và đại thực bào; fibroblast interferon (IFN-P) sinh ra bởi nguyên bào sợi, các tế bào biểu mô và đại thực bào; immune interferon (IFN-y) được tổng họp bởi các lympho bào CD4+, CD8+ và lympho bào tiêu diệt tự nhiên (NK). IFN-a và IFN-p là các interferon loại I, còn IFN-y là interferon loại II.
Để tăng cường tiềm năng và các đặc tính dược động học của các interferon, chúng thường được gắn đồng hóa trị với một phân tử polyethylen glycol (PEG). Phức họp này được gọi là pegylat (PEG-IFN). Hai PEG được sử dụng để tạo ra PEG-IFN là monomethyl PEG với trọng trọng phân tử trung bình khoảng 12kDa hoặc PEG phân nhánh lớn hơn với trọng trọng phân tử khoảng 40kDa. Dạng kết họp PEG với interferon (như PEG-IFN alpha-2b (12kDa), PEG-IFN alfa-2a (40kDa)) tăng đáng kể thời gian bán thải và nồng độ thuốc trong máu. PegIFN-a là tác nhân quan trọng để điều trị HBV.
PEG-IFN alfa-2a (40kDa) cho điều trị HBV (Pegasys)
IFN-a có thể được sản sinh trong hầu hết các tế bào để phản ứng khi nhiễm virus và nhiều tác nhân kích thích khác, bao gồm ARN sợi đôi và một số cytokin nhất định (ví dụ, interleukin 1, interleukin 2, và yếu tố hoại tử khối u).
Inteferon xuất hiện sẽ kích thích các protein đáp ứng (effector) dẫn đến làm giảm hoạt động ADN và polymerase. Tác dụng duy trì của tác nhân này ít có giá trị trong nhiễm HBV hơn so với nhiễm HCV. Chế phẩm được sử dụng bằng cách tiêm dưới da, một lần/tuần.
Các PEG- IFN thường được dung nạp tốt hơn các IFN tiêu chuẩn, mặc dù tần suất sốt, buồn nôn và giảm bạch cầu có thể cao hơn.
Các tác dụng không mong muốn thường gặp bao gồm: trầm cảm, ức chế tủy xương với giảm bạch cầu hạt và giảm tiểu cầu. Ảnh hưởng trên thần kinh có thể gây ra tử vong.
Adefovir Dipivoxil (PMEA)
Cơ chế tác dụng
Adefovir dipivoxil (PMEA) ở dạng dieste là tiền thuốc của adefovir, có cấu trúc nucleotid phosphonat mạch hở tương tự adenosin monophosphat. PMEA được hoạt hóa do bị thủy phân bởi esterase ở ruột và huyết tương thành adefovir (một acid phosphonic) sau đó phosphoryl hóa thành dạng có hoạt tính “diphosphat” (Hình 1.23). PMEA hoạt động như một chất ức chế canh tranh với ADN polymerase HBV và tích hợp vào ADN virus dẫn đến kết thúc chuỗi ADN. PMEA có ái lực cao với ADN polymerase của HBV.
Dược động học
Adefovir có sinh khả dụng đường uống thấp (<12%), trong khi tiền chất dipivoxil được hấp thu nhanh chổng và bị thủy phân bởi các esterase trong ruột, gan và máu để tạo thành adefovir (sinh khả dụng khoảng 30% -60%). Thức ăn không ảnh hưởng đến sinh khả dụng. Adefovir liên kết với protein rất yếu (<5%). Thuốc được thải trừ dưới dạng không biến đổi qua thận.
Entecavir
Cơ chế tác dụng
Entecavir là một chất tương tự guanosin. Entecavir ức chế tổng hợp ADN HBV.
Entecavir phải qua quá trình phosphoryl hóa nội bào. Entecavir triphosphat cạnh tranh với deoxyguanosin triphosphat nội sinh và ức chê cả ba hoạt động của HBV:
- Entecavir triphosphat cạnh tranh với deoxyguanosin triphosphat để tích hợp vào ADN của HBV.
- Entecavir ức chế các hoạt động của HBV polymerase, tổng hợp chuỗi ADN đầu từ ARN hoặc phiên mã ngược và tổng họp chuỗi ADN thứ hai từ ADN.
- Nhóm 3’-hydroxy của entecavir không làm dừng ngay hoạt động của ADN polymerase và các nucleotid khác mà có thể được tích họp vào ADN trước khi dừng.
Dược động học
Entecavir hấp thu nhanh đường uổng với sinh khả dụng gần 100%, phân bố rộng rãi tới các mô và liên kết yếu với protein huyết thanh (13%). Nó được thải dưới dạng không biến đổi chủ yếu qua thận (bằng quá trình lọc ở cầu thận và bài tiết qua ống thận). Entecavir bị chuyển hóa qua hai pha, với thời gian bán thải là 128-149 giờ. Entecavir không phải là chất nền của CYP450 hoặc phản ứng acetyl hóa.
Telbivudin
Cơ chế tác dụng
Telbivudin được phosphoryl hóa bởi các kinase của tế bào thành dạng hoạt động triphosphat. Telbivudin 5′-triphosphat ức chế AND polymerase HBV (men sao chép ngược) do cạnh tranh với chất nền tự nhiên- thymidin 5’-triphosphat. Sự kết hợp của telbivudin 5′-triphosphat vào chuỗi ADN virus đang phát triển làm kết thúc quá trình kéo dài chuỗi. Thuốc có tác dụng ức chế tổng hợp chuỗi ADN đầu tiên (phụ thuộc ARN), nhưng ức chế ưu tiên hơn với tổng hợp chuỗi ADN thứ hai (phụ thuộc ADN). Telbivudin có hoạt tính đối với hepa ADN virus nhưng không có hoạt tính với các virus khác.
Dược động học
Sinh khả dụng của telbivudin là 68%, thuốc được phân bố rộng rãi vào các mô, liên kết thấp với protein huyết tương (-3,3%). Thức ăn không ảnh hưởng đến dược động học của telbivudin. Thuốc đươc thải trừ dưới dạng không đổi trong nước tiểu. Nồng độ telbivudin giảm theo cấp số nhân với thời gian bán thải là 40-49 giờ.
Lamỉvudin và Tenofovir disoproxil
- Như đã trình bày ở trên (xem Các thuốc ức chế enzym phiên mã ngược có cấu trúc nucleosid), các thuốc này là tiền thuốc và cần được hoạt hóa để có tác dụng như các NRTI (Hình 1.4);
- Chúng cũng ức chế ADN polymerase của HBV làm dừng kéo dài chuỗi;
- Các đặc tính dược động học được trình bày trong Bảng 1.2.
Tác dụng không mong muốn
Liệu pháp nucleosid cho HBV: Một vài tác dụng bất lợi được thông báo bao gồm: đau đầu, buồn nôn và tiêu chảy. Một số trường hợp sau khi ngừng điều trị, tình trạng viêm gan trầm trọng hơn.
Thuốc điều trị virus viêm gan C
Khoảng 150 triệu người (tương đương 2% dân số) trên thế giới bị nhiễm HCV, trong đó châu Phi, Trung và Đông Á có tỷ lệ nhiễm HCV cao nhất. Ước tính khoảng 85% số người mắc HCV sẽ phát triển thành nhiễm virus mãn tính, có thể tiến triển thành xơ gan (WHO, 2016). Mỗi năm có khoảng 6% người xơ gan sẽ phát triển các triệu chứng của bệnh gan mất bù và 4% sẽ phát triển thành ung thư biểu mô tế bào gan. Có khoảng 700.000 trường hợp tử vong liên quan đến HCV hàng năm. Nếu không có phương pháp điều trị hiệu quả, con số này dự kiến sẽ tăng hơn 20 năm tới. Vòng đời cùa virus HCV được mô tả trong hình 1.24
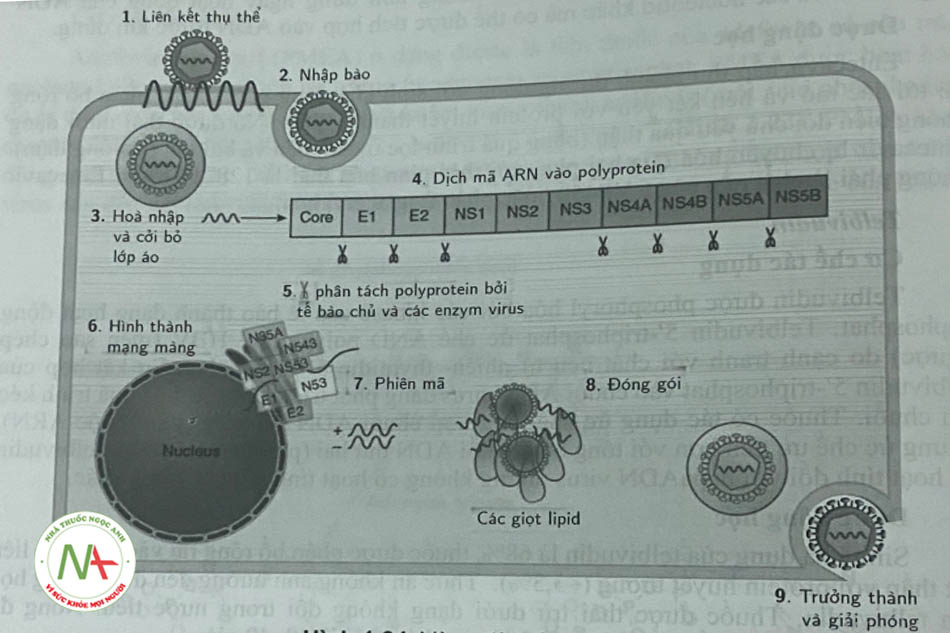
HCV là virus với có chuỗi ARN đem, có tính phân cực dương, liên kết với ribosom tế bào vật chủ và được dịch mã thành một polyprotein lớn (-3000 acid amin). Sau đó polyprotein này được phân giải thành các protein cấu trúc (cần thiết để tạo thành vỏ capsid, màng bao virus) và các protein không cấu trúc (viết tắt là NS). Các NS protein: NS2, NS3, NS4A, NS4B, NS5A, NS5B được tìm thấy trong lưới nội chất của các tế bào nhiễm virus. Vai trò của của các NS rất quan trọng, liên quan đến việc tái tạo bộ gen HCV (ARN polymerase). Trong số các protein không cấu trúc này, NS3 là một serin proteinase; NS5A là một bộ điều biến polymerase; NS5B là một ARN polymerase. Các thuốc mới dùng để điều trị HCV sẽ hướng tới các các protein không cấu trúc NS3, NS4A, NS5A, NS5B là đích tác dụng. Các thuốc điều trị HCV được chia thành 2 nhóm: các thuốc ức chế protease HCV NS3, NS4A và các thuốc ức chế protease HCV NS5A, NS5B
Trong những năm trước đây, HCV được điều trị bằng phác đồ tiêm dưới da (hoặc pegIFN-a) đơn trị liệu hoặc có phối hợp ribavirin kéo dài. Tỷ lệ đáp ứng điều trị với liệu pháp này thấp và khả năng dung nạp thuốc kém. Hiện nay, đã có một số Q thuốc kháng virus nhắm mục tiêu trực tiếp đến các các giai đoạn khác nhau trong VQ 1 đời HCV (nhóm thuốc này còn được viết tắt là DAA- direct acting antivirus) và sử dụng thường xuyên trong các liệu pháp điều trị.
Các DAA này được sử dụng đường uống, ít tác dụng phụ, với thời gian điều tri khoảng 8,12 hoặc 24 tuần. Liệu pháp này đạt được tỷ lệ thành công hơn 90% đối với cá trường hợp được sử dụng. Liệu pháp sử dụng pegIFN-a điều trị HCV đã được thay bởi các DAA, mặc dù ribavirin vẫn được sử dụng trong quá trình kết hợp với DAA để cải thiện tỷ lệ đáp ứng với liệu pháp điều trị virus HCV kéo dài trong một số trường hợp sàng nhất định.
CÁC THUỐC ỨC CHẾ NS3/4A PROTEASE
Boceprevir
Cơ chế tác dụng
- Boceprevir (a-cetoamid) và simeprevir hoặc paritaparevir (cấu trúc vòng lớn) đại diện cho hai nhóm chất ức chế NS3/4A (Hình 1.24). (NS3 có hoạt tính protease và helicase trong khi NS4A là một protein đồng yếu tố, rất cần thiết cho chức năng của NS3).
- Boceprevừ liên kết thuận nghịch với NS3/4A qua liên kết bán cetal được hình thành ở a- ceton của nhóm a ceto-amid và nhóm OH serin của NS3/4A (Hình 1.26). Sự ức chế này ngăn cản quá trình sao chép của bộ gen ARN của HCV.
- Simeprevir có cấu trúc vòng lớn 14 cạnh, liên kết vói cùng một vị trí với các cetoamid, qua liên kết tĩnh điện (không phải liên kết cộng hóa trị).
- Paritaprevir, có cấu trúc vòng lớn 15 cạnh, liên kết với NS3/4A ở cùng vị trí gắn kết với simeprevir do cấu trúc của chúng tương tự nhau. Paritaprevir được dùng phơ1 với ritonavir (một chất ức chế CPY3A4 làm tăng nồng độ của paritaprevir).
Dược động học
Boceprevir liên kết với protein huyết tương khoảng 68%, chuyển hóa đầu tiên do loại nhóm chức ceton và oxy hóa dưới tác dụng của CYP.
Sinh khả dụng của simeprevir là 62%. Thực phẩm làm tăng AUC của simeprevir khoảng 65%; do đó nên dùng thuốc này cùng với bữa ăn. Simeprevir liên kết với protein 99,9% (chủ yếu với albumin). Simeprevir bị oxy hóa bởi CYP3A4, hydroxyl hóa vòng thơm và khử o- methyl của nhóm methoxy.
Paritaprevir, ombistasvir và dasabuvir dạng phối hợp liên kết mạnh với protein huyết tương (91%- 99%). Paritaprevir trải qua quá trình chuyển hóa bởi CYP3A4/5.
Tác dụng không mong muốn
Ở người lớn thường xuất hiện mệt mỏi, thiếu máu, buồn nôn, đau đầu và rối loạn tiêu hóa khi boceprevir được sử dụng kết hợp với ribavirin và Peginterferon alfa-2a / Peginterferon alfa-2b.
Khi dùng simeprevir thường có các tác dụng phụ như mệt mỏi, nhức đầu, phát ban, ngứa ngáy và nhạy cảm với ánh sáng mặt trời.
CÁC THUỐC ỨC CHẾ NS5A/5B PROTEASE
– Sofosbuvir là tiền chất có cấu trúc nucleosid tương tự cấu trúc của uridin. Trong tế bào, sofosbuvir được chuyển hóa thành dạng hoạt động (GS-461203) cạnh tranh với uridin triphosphat để kết hợp vào ARN của HCV bởi NS5B polymerase.
Cơ chế tác dụng
Sofosbuvir là một tiền chất, dạng monophosphoryl hóa ở vị trí 5’ của uridin được gắn với một nhóm chức dễ dàng loại bỏ trong tế bào. Thuốc hoạt tính, được tạo ra trong tế bào vật chủ, ức chế ARN polymerase của HCV. Sofosbuvir cũng có khả năng hoạt động như một chất kết thúc kéo dài chuỗi.
Dược động học
Khả dụng sinh học của sofosbuvir khoảng 80%, bữa ăn giàu chất béo làm tăng AUC của sofosbuvir lên 67% —91%. Sofosbuvir có dược động học tuyến tính. Sofosbuvir liên kết với protein 63%. Con đường chuyển hóa chính của sofosbuvir là bị thủy phân thành GS-331007. Dạng sofosbuvh triphosphat ức chế mạnh NS5B của HCV.
- Tác dụng không mong muốn
Không có dấu hiệu độc tính liên quan đến việc sử dụng sofosbuvir. Các tác dụng không mong muốn xuất hiện khi sofosbuvir sử dụng kết hợp với các thuốc DAA khác.
Sofosbuvir không phải là chất nền, chất ức chế hoặc chất cảm ứng CYP và do đó khả năng xảy ra tương tác thuốc thấp. Tuy nhiên, sofosbuvir là một chất nền cho các chất vận chuyển P-gp và BCRP, do đó không nên sử dụng kết hợp với các chất cảm ứng mạnh của những chất vận chuyển này (ví dụ: rifampin, phenytoin, carbamazepin).
Ombitasvir, ledipasvir, dasabuvir
- Cơ chế tác dụng
Ombitasvir là một chất ức chế NS5A. Ledipasvir và ombitasvir cũng có tác dụng ức chế NS5A trong khi dasabuvir là chất ức chế NS5B. Ledipasvir được dùng ở dạng viên kết hợp với sofosbuvir (chất ức chế polymerase nucleotid NS5B) (LDV/SOF).
- Dasabuvir là một chất ức chế chọn lọc protein virus của ARN polymersase genotype 1 HCV (NS5B).
Dược động học
- Cả ba chất đều liên kết mạnh với protein huyết tương (99%).
- Ombitasvir được chuyển hóa chủ yếu do quá trình thủy phân amid, tiếp theo là bị oxy hóa. Paritaprevir được chuyển hóa bởi CYP3A. Dasabuvir được chuyển hóa chủ yếu bởi CYP2C8 và ở mức độ thấp hơn bởi CYP3A.
Tác dụng không mong muốn
Các tác dụng không mong muốn phổ biến nhất là buồn nôn (8%), ngứa (7%), mất ngủ (5%) và suy nhược (4%). Tần suất của những hiệu ứng này tăng gấp đôi khi bổ sung ribavirin.
- Điều trị HCV trong tương lai: Một số thuốc vẫn đang được nghiên cứu lâm sàng để điều trị HCV, bao gồm các liệu pháp kết hợp như sofosbuvir + velpatasvir+ voxilaprevir, glecaprevir + pibrentasvir và MK-3682 + grazoprevir + ruzasvir. Tuy nhiên, so với 10 năm trước sự phát triển thuốc điều trị HCV đã chậm lại. Hầu hết những người bệnh có thể tiếp cận liệu pháp HCV với các tác nhân hiện có đã được chữa khỏi (nhưng không phải 100%). Những thách thức còn lại đối với căn bệnh này là xét nghiệm và chẩn đoán, chăm sóc, tăng khả năng tiếp cận với các liệu pháp điều trị này và quản lý các nhóm bệnh nhân đặc biệt, bao gồm những người xơ gan với bệnh kiểu gen 3, những người bị xơ gan giai đoạn cuối và những người thất bại trong điều trị DAA.
Bảng 1.5. Các thuốc điều trị HBV, HCV và ứng dụng lâm sàng.
| Thuốc | Ứng dụng trị liệu | Dược lâm sàng và các lưu ý |
| Trị liệu viêm gan B | ||
| Pegylated interferon alfa |
|
Các tác dụng không mong muốn (> 40%): mệt mỏi / suy nhược, sốt nóng, đau cơ và đau đầu.
• Có thể gây ra các rối loạn thần kinh, tự miễn dịch, thiếu máu cục bộ và các bệnh nhiễm trùng. • Cần theo dõi huyết học thường xuyên. • Chống chỉ định với bệnh gan tiến triển và đang mang thai. |
| Entecavir | • Lựa chọn ưu tiên.
• Được phê duyệt để điều trị đối với các bệnh nhân lớn hơn 2 tuổi. • Điều trị vô thời hạn đối với bệnh nhân xơ gan. |
• Dùng liều cao đối với bệnh nhân xơ gan mất bù và bệnh nhân kháng lamivudin hoặc telbivudin.
• Uống lúc đói. |
| Ritonavir tăng cường tác dụng của paritaprevir, ombitasvir, and dasabuvir | • HCV kiểu gen 1b (1a kết hợp với ribavirin).
• 12 tuần trị liệu. • 24 tuần điều trị cần thiết đối với bệnh nhân có kiểu gen 1a và xơ gan. |
• Không nên dùng cho bệnh nhân xơ gan mất bù.
• Các tác dụng không to muốn (≥ 5%) buồn nôn, ngứa và mất ngủ. • Với ribavirin, các tác không mong muốn thường gặp (≥ 10%) là mệt mỏi, buồn nôn, ngứa, các phản ứng da khác, mất ngủ và suy nhược. |
| Grazoprevir/elbasvir | • Liệu pháp 12 tuần đối với bệnh nhân không có RAV NS5A ban đầu. (RAV: resistance-associated variant).
• Liệu pháp kết hợp trong 16 tuần với ribavirin đối với bệnh nhân có RAV NS5A ban đầu • Điều trị ưu tiên đối với bệnh nhân suy thận. |
• Không nên sử dụng với các chất cảm ứng CYP3A và P-gp vừa và mạnh.
• Không nên sử dụng với các chất ức chế OATP1B1. • Các tác dụng không mong muốn thường gặp: nhức đầu mệt mỏi, buồn nôn. |
| Ribavirin | • Được sử dụng kết hợp với các phác đồ HCV khác để tăng hiệu quả điều trị. | • Có thể gây thiếu máu tan huyết
• Gây quái thai. • Phân bố mô rộng. • Thời gian bán thải dài (7-10 ngày). • Cần điều chỉnh liều đối với bệnh nhân suy thận. |
Thuốc điều trị Herpes virus
- Đại cương
Herpes vims là thành viên của họ Herpesviridae gồm nhiều loại virus gây ra nhiều bệnh ở người. Họ này gồm có: herpes simplex vims 1 và 2 (HSV1 và HSV2) (tương ứng gây loét miệng và herpes sinh dục), varicella-zoster vims (gây thủy đậu và giời leo), cytomegalovirus (CMV) (gây tinh trạng giống tăng bạch cầu đơn nhân), Epstein-Barr vims (EBV) (gây tăng bạch cầu đơn nhân nhiễm khuẩn), human herpesvirus 6 (HHV-6) và herpesvirus 7 (HHV-7), và herpes virus liên quan đến u Kaposi (HHV-8). Các herpes virus là vims mang ADN chuỗi đôi tuyến tính với hệ gen mã hóa cho hơn 100 protein khác nhau được bao bởi một lớp vỏ protein. Nhiễm herpervirus khá phổ biến (>90% dân số) và mầm bệnh tồn tại suốt đời. Các virus này tác động đến nhiều loại mô bao gồm các tế bào niêm mạc, tế bào B, bạch cầu đơn nhân và các lympho bào.
- Các thuốc sử dụng trong điều trị Herpes virus
HSV-1 thường gây ra các bệnh ở miệng, mặt, da, thực quản hoặc não. HSV-2 thường gây nhiễm ở bộ phận sinh dục, trực tràng, da, tay hoặc màng não. Cả hai loại đều gây nhiễm nghiêm trọng ở trẻ sơ sinh. Các tác nhân được sử dụng trong điều trị HSV hoạt động theo một số cơ chế khác nhau nhằm ức chế sự sao chép ADN của virus trong tế bào chủ.
Các thuốc hiện đang sử dụng để điều trị Herpes virus có cấu trúc nuleosid.
- Cơ chế tác dụng
Tất cả các thuốc kháng Herpesvirus có cấu trúc nucleosid là các tiền thuốc cần được hoạt hóa nhờ phosphoryl hóa trở thành triphosphat (Bảng 1.5).
Bảng 1.6. Các dạng hoạt hóa của các thuốc điều trị herpesvirus cấu trúc nucleosid.
| Tên generic | Tên biệt dược | Tên thông thường | Dạng hoạt hóa |
| Acyclovir | Zovirax | Acyclo-G | Acyclovir triphosphat |
| Valacyclovir | Valtrex | Acyclovir triphosphat | |
| Famciclovir | Famvir | FCV | Famciclovir triphosphat |
| Penciclovir | PCV | Penciclovir triphosphat | |
| Valgancỉclovir | Ganciclovir triphosphat | ||
| Ganciclovir | Cytovene | DHPG | Ganciclovir triphosphat |
| Cidofovir | Vistid | CDV | Cidofovir diphosphat |
| Idoxuridin | Herplex stoxil | IDUR | Idoxuridin triphosphat |
| Trifluridin | Viroptic | TFT | Trifluridin monophosphate |
Chất trung gian có hoạt tính
Acyclovir là một chất tổng hợp có cấu trúc tương tự deoxyguanosin nhưng không có phần đường và quá trình hoạt hóa acyclovir được thực hiện theo 3 bước như trong Hình 1.29. Điều đặc biệt là tại bước 1 acyclovir cần thymidin kinase để chuyển thành dạng monophosphat. Nhưng thymidin kinase của virus mạnh gấp 100 lần thymidin kinase của tể bào vật chủ, nên trong tế bào bình thường hầu hết acyclovir không bị phosphoryl hóa. Đó là nguyên nhân acyclovir có tác dụng khá chọn lọc trên tế bào bị nhiễm virus
- Trifuridin triphosphat ức chế sự kết hợp của thymidin triphosphat vào ADN (trường hợp ngoại lệ của các triphosphat là chất ức chế ADN polymerase). Sự kết hợp của monophosphat giả thông qua triphosphat vào ADN virus tạo ra một nucleotid ngăn chặn sự kéo dài ADN và dẫn đến cái chết của
- Cidofovir là một nucleotid pyrimidin đóng vòng tổng hợp có cấu trúc tương tự cytosin. Dạng diphosphat của cidofovir là dạng có hoạt tính ngăn chặn sự tổng hợp ADN do đóng vai trò là chất nền cho ADN polymerase và đóng vai trò là chất ức chế cạnh tranh của deoxycytidin triphosphat (dCTP).
- Trifluorothymidine là một nucleosid pyridin được flo hóa, có cấu trúc tương tự idoxuridin. Giống các thuốc ức chế Herpes khác, nó được phosphoryl hóa bởi thymidin kinase thành mono-, di-, triphosphat sau đó được kết hợp vào ADN virus thay vai trò của thymidin để ngừng sự hình thành mARN virus muộn và quá trình tổng họp tiếp theo của các protein virion. Trifuridin monophosphate là một chất ức chế không thể đảo ngược của thymidylat synthase uong khi dạng triphosphat ức chế thymidin triphosphat kết hợp vào ADN và nó được thay thế tích hợp vào cấu trúc ADN
Dược động học
- Đặc tính dược động học được chỉ ra trong Bảng 1.7.
Bảng 1.7. Đặc tính dược động học của các thuốc ức chế Herpes cấu trúc nucleosid dùng đường uống.
| Tên generic | Sinh khả dụng (%) | T1/2(h) | Con đường thải trừ/% không biến đổi |
| Valacyclovir | 54 | ||
| Acyclovir | 20 | 3-4 | Nước tiểu/~70 |
| Famciclovir | 75 | 7-20 | |
| Penciclovir | <5 | – | Nước tiểu/—90 |
| Valganciclovir | 61 (> khi dùng cùng thức ăn) | ||
| Ganciclovir | 6-9 | – | Nước tiểu/—90 |
| Cidofovir | Thấp (2-26) | – | Nước tiều/~90 |
Do sinh khả dụng của acyclovir đường uống thấp (20%) nên valacyclovir (sinh khả dụng 54%), một tiền thuốc của acyclovir được đưa vào sử dụng để cải thiện sinh khả dụng. Valacyclovir hydroclorid là một este amino acid có tác dụng kháng virus sau khi chuyển hóa bước một ở thành ruột hoặc gan để thành acyclovir và sau đó chuyển thành triphosphat
Idoxuridin và trifluridine được sử dụng tại chỗ (thuốc mỡ bôi mắt), do đó sinh khả dụng và con đường thải trừ ít quan trọng.
- Cơ chế tác dụng
Na foscamet là một trinatri phosphoformat hexahydrat ức chế ADN polymerase của virus Herpes gồm CMV và RT của retrovirus. Thuốc không được phosphoryl hóa thành dạng hoạt động nhờ các enzym vật chủ. Do đó, foscamet có lợi thế không cần bước hoạt hóa trước khi tấn công enzym đích của virus hay nói cách khác foscamet là một chất ức chế chọn lọc ADN polymerase của virus.
– Thuốc liên kết có thể đảo ngược với vị trí thường bị chiếm bởi pyrophosphat của deoxynucleotid triphosphat cần thiết đối với ADN polymerase.
- Dược động học
Na foscamet được sử dụng đường tiêm tĩnh mạch với liều 60mg/kg, 3 lần/ngày cho liệu pháp ban đầu và 90-120mg/kg một ngày cho liệu pháp duy trì. Thời gian bán thải của thuốc là 3-6h. Na foscamet được phân bố vào dịch thủy tinh thể, dịch não tủy cũng như trong xương.
- Ứng dụng lâm sàng
Các thuốc điều trị nhiễm Herpes virus được sử dụng trên lâm sàng được chỉ ra trong Bảng 1.8.
Bảng 1.8: Các tháng kháng Herpes virus điều trị trong lâm sàng
| Tên generic | Phổ tác dụng | Dạng bào chế |
| Valacyclovir | HSV-1, VZV. | Viên nén. |
| Acyclovir | HSV-1, HSV-2, VZV. | Viên nén, viên nang, kem và thuốc mỡ dùng tạl chỗ, dung dịch tiêm, hỗn dịch. |
| Famciclovir | HSV, VZV. | Viên nén. |
| Penciclovir | HSV | Kem và thuốc mỡ dùng tại chỗ. |
| Valganciclovir | CMV | Viên nén, dung dịch. |
| Ganciclovir | CMV viêm võng mạc. | Viên nén, kem và thuốc mỡ dùng tại chỗ, dung dịch tiêm. |
| Cidofovir | CMV (ở bệnh nhân AIDS). | Tiêm (nội nhãn). |
| Idoxuridin | HSV viêm giác mạc. | Dùng tại chỗ. |
| Trifluridin | HSV-1, HSV-2. | Dung dịch tiêm. |
| Foscarnet natri | CMV viêm võng mạc, HSC, VZV. | Dung dịch tiêm. |
Tác dụng không mong muốn
Các nucleosid tổng họp điều trị Herpesvirus:
Acyclovir gây suy thận và độc tính trên thận là nặng nhất mặc dù có thể đảo ngược và thường liên quan đến các tình trạng phức tạp khác của bệnh nhân. Tác dụng trên TKTW đã được báo cáo (buồn ngủ). Các tác dụng này ít hơn với valacyclovir đường uống. Tương tự, khi tiêm tĩnh mạch, ganciclovir gây ra ức chế tủy xương và giảm bạch cầu. Với valganciclovir đường uống, các tác dụng bất lợi gồm tiêu chảy, nôn, buồn nôn và đau bụng, đau đầu, thay đổi hành vi và hôn mê. Bệnh nhân sử dụng valganciclovir có thể gặp các tác dụng bất thường như khi dùng đường tiêm. Với cidofovir, độc tính trên thận gồm protein niệu, tăng creatinin và giảm bạch cầu được báo cáo (một số trường họp phải ngừng thuốc).
Foscamet: Cung cấp đủ nước đặc biệt quan trọng khi sử dụng foscamet natri ở bệnh nhân AIDS để điều trị CMV viêm võng mạc vì có một tỷ lệ lớn bệnh nhân bị tổn thương thận. Khi được cung cấp đủ nước, số lượng những bệnh nhân gặp tình trạng này giảm đáng kể. Foscamet cũng gây ra rối loạn cấp đủ nước, loạn điện giải làm giảm calci, magie, kali máu, giảm hoặc tăng phosphat. Các tác dụng trên TKTW gồm: co giật run và (Jj. đâụ. Các tác dụng bât lợi thường gặp khác gôm buôn nôn, nôn, tiêu chày, chỏng mặt 1 cảm giác thèm ăn và tăng tiết mồ hôi.
Thuốc phòng và điều trị cúm
- Đại cương
Cúm gây ra bởi virus có bộ gen ARN sợi đơn âm, và là một thành viên cùa V orthomyxoviridae. Ba loại virus cúm được biết và xác định là cúm A, B và c. Virion chvia 9 protein cấu trúc khác nhau. Trong số các protein này có ribonucleoprotein tạo thàáh nucleocapsid của virus, ba protein liên kết với ribonucleoprotein của virus tham gia vàữ quá trình phiên mã ARN và sao chép. Dưới lớp vỏ lipid của virus là một mạng protein. Lớp vỏ chứa 2 loại glycoprotein bề mặt là hemaglutinin (HA) và neuraminidase (NA). Các đột biến gây ra những sự thay đổi kháng nguyên của các protein cấu trúc này và sự thay đổi của HA làm xuất hiện liên tục của các loài virus cúm mới. Khi sao chép virus cúm liên kết với bề mặt tế bào của vật chủ nhờ HA và các nhỏm acid sialic (acid- acetylneuraminic). Để virus có thể giải phóng khỏi các tế bào bị nhiễm, NA loại bỏ nhóm acid sialic khỏi các glycoprotein bề mặt.
- Các thuốc phòng và điều trị cúm
Năm loại thuốc hiện đang được phê duyệt để điều trị và ngăn ngừa nhiễm virus cúm gồm amantadin, rimantadin, oseltamivir, zanamivir và peramivir. Dưới đây sẽ giới thiệu các thuốc phòng và điều trị virus cúm đang lưu hành.
Bảng 1.9: Đặc điểm dược động học của các thuốc điều trị cúm
| AMANTADIN | RIMANTADIN | ZANAMIVIR | OSELTAMIVIR | PERAMIVIR | |
| Phổ tác dụng | A | A | A, B | A, B | Ạ, B |
| Dạng thuốc | Đường uống (viên nén, viên nang, si rô). | Đường uống (viên nang, si rô). | Đường thở (bột)
Tiêm tĩnh mạcha |
Đường uống (viên nang, si rô)
Tiêm tĩnh mạcha |
Tiêm tĩnh mạcha |
| Sinh khả dụng đường uống (%) | >9 | >9 | <5b | 80 | Không khả
dụng |
| Thời gian bán thải t1/2 (h) | 12-18 | 24-36 | 2.5-5 | 6-10c | 20 |
| Liên kết protein (%) | 67 | 40 | <10 | 3c | <30 |
| Chuyển hoá (%) | <10 | ~75 | 1 | – | – |
| Bài tiết qua thậne (%) | >90 | ~25 | 100 | 95c | 90 |
a Điều tra vào thời điểm hiện tại.
b Hấp thu hệ thống 4%-17% sau khi hít.
c Đối với oseltamivir carboxylat có hoạt tính kháng virus.
d Chỉ có dạng bào chế là thuốc hít.
e Tỷ lệ phần trăm của thuốc chính
Amantadin và rimantadin
- Cơ chế tác dụng
Amantadin và rimantadin ức chế bước đầu tiên của quá trình nhân lên của virus do ngăn cản sự cởi áo của bộ gen virus và chuyển acid nucleic vào trong tế bào vật chủ. Chúng có tác dụng chủ yếu trên protein M2 của virus cúm A, một protein màng tích hợp có chức năng như một kênh ion. Bằng cách khóa kênh vận chuyển protein màng cùa virus (M2), sự nhân lên của virus bị ảnh hưởng.
- Dược động học
Amantadin và rimantadin là một amin bậc 1 đối xứng ba vòng, hấp thu dễ dàng khi dùng đường uống.
Hai chất này có khác nhau ở một số điểm: Amantadin được bài tiết phần lớn không chuyển hóa qua nước tiểu (t1/2 ~ 12-18 giờ ở người trẻ, tăng gấp đôi ở người già và thậm chí nhiều hơn ở những người bị suy thận). Ngược lại, việc thải trừ rimantadin phụ thuộc vào chức năng gan; thuốc bị chuyển hóa pha 1 và pha 2 trước khi bài tiết qua thận dưới dạng đã chuyển hóa (t1/2 ~ 24-36 giờ; 60% -90% được thải trừ qua nước tiểu dưới dạng chuyển hóa). Amantadin được bài tiết qua sữa mẹ. Rimantadin được tìm thấy có nồng độ cao trong dịch mũi (nồng độ trong dịch nhầy mũi cao gấp 1,5 lần trong huyết tương) (Bảng 1.9).
- Ứng dụng lâm sàng
Việc sử dụng amantadin trong điều trị cúm đã giảm đáng kể trong khi việc sử dụng rimantadin ngày càng bị giới hạn. Rimantadin hydroclorid có tác dụng chống lại hầu hết các virus cúm A gồm H1N1, H2N2 và H3N2, nhưng không có tác dụng vói virus cúm B. Khi sử dụng các thuốc này thì người bệnh sẽ giảm thòi gian của các triệu chứng cúm.
- Tác dụng không mong muốn
Các tác dụng bất lợi ở rimatadin ít hơn so với amantadin và thường là các tác dụng nhẹ trên đường tiêu hóa và tác dụng lên TKTW (phụ thuộc liều). Hồi hộp, mất ngủ, chóng mặt, đau đầu và mệt mỏi là các tác dụng không mong muốn thường gặp.
- Các thuốc ức chế neuraminidase (zanamivir, oseltamivir và peramivir)
Vì neuraminidase đóng vai trò quan trọng trong hoạt hóa các virus mới, nên việc phát hiển của các thuốc ức chế neuraminidase trở thành công cụ tiềm năng ức chế sự lan truyền của virus cúm. Nếu không có NA và acid sialic không bị thủy phân khỏi HA, virus cúm không thể giải phóng khỏi các tế bào nhiễm.
Cơ chế tác dụng
- Zanamivh, oseltamivir và peramivir được thiết kế bắt chước trạng thái chuyển tiếp của acid sialic và liên kết với vị trí hoạt hóa của NA để ức chế enzym này.
- Khóa NA dẫn đến tích tụ virus cúm ở bề mặt tế bào của vật chủ bị nhiễm và ngăn chặn sự lây truyền của
- Các nhóm quan trọng cho liên kết với NA gồm: carboxyl ở C2, nhóm base ở C4 (amino hoặc guanidin), N-acetyl ở C5 và R ở Có (Hình 1.32).
- Este hóa với ethanol ở vị trí C2 tạo ra oseltamivir có tác dụng khi uống (nhưng phải được thủy phân khi vào cơ thể).
- Khả năng liên kết mạnh nhất với NA khi R là một chuỗi 3-pentyloxy.
Dược động học
Oseltamivir là một tiền thuốc khi vào cơ thể bị esterase thủy phân chức este tạo acid tương tự acid sialic nên có tác dụng đối kháng cạnh tranh thuận nghịch với neuramidase của virus cúm A và B.
Oseltamivir hấp thu tốt khi uống (sinh khả dụng ~80%) và thải trừ qua nước tiểu dưới dạng carboxyoseltamivir. Thí nghiệm trên chuột đã ghi nhận một chất chuyển hóa là một acid carboxylic chuỗi nhỏ không có hoạt tính, không có chuyển hóa bổ sung nào được ghi nhận ở người.
- Zanamivir và peramivir không có hoạt tính đường uống (zanamivir được sử dụng dạng bào chế hít đường miệng và peramivir dùng đường tĩnh mạch).
- Zanamivir có sinh khả dụng thấp (~17%), peramivir liên kết yếu với protein huyết tương và cả hai được thải trừ dưới dạng không biến đổi qua nước tiểu.
Ứng dụng lâm sàng
- Các thuốc ức chế neuraminidase (NA): zanamivir và oseltamivir được sử dụng để điều trị và phòng ngừa nhiễm cúm A và B, còn peramivir được chỉ định đế điều trị cúm cấp tính không biến chứng ở người trưởng thành. Khi được sử dụng trong dự phòng các thuốc trên có tỉ lệ giảm nhiễm cao. Nếu bệnh nhân nhiễm cúm được chỉ định dùng các thuốc ức chế NA thì sẽ rút ngắn thời gian phục hồi và giảm các triệu chứng bệnh.
Tác dụng không mong muốn (Zanamivir, oseltamivir và peramivir)
Nhìn chung các tác dụng bất lợi của zanamivir và oseltamivir thường nhẹ và có thể tự phục hồi. Riêng zanamivir được khuyến cáo không sử dung ở bệnh nhân có bệnh về đường thở, bao gồm hen và bệnh phổi tắc nghẽn mạn tính (COPD). Co thắt phế quản nguy hiểm đã được báo cáo, có thể phải nhập viện để điều trị. Peramivir có thể gây ra các phản ứng mẫn cảm nghiêm trọng trên da nhưng hiếm gặp.


em là sinh viên y đang làm chuyên đề về thuốc kháng virus các loại
e có hai câu hỏi mong muốn được giải đáp: 1. nguyên nhân dẫn đến lờn thuốc kháng virus. 2. cơ chế gây lờn thuốc
e xin cảm ơn ạ