Bệnh cơ xương khớp, Bệnh thần kinh
Đau cơ, yếu cơ và/hoặc rối loạn cảm giác
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Để tải file PDF của bài viết Đau cơ, yếu cơ và/hoặc rối loạn cảm giác, xin vui lòng click vào link ở đây.
Bác sĩ Phạm Hoàng Thiên
Group “Cập nhật Kiến Thức Y khoa”
Giới thiệu
Các bệnh thần kinh cơ có thể biểu hiện với giảm sức cơ khu trú hoặc lan tỏa. Đôi khi chẩn đoán bị trì hoãn vì đặc điểm này cũng có thể do một rối loạn hệ thần kinh trung ương nào đó (xem Chương 10).
Ngày nay, điều đặc biệt quan trọng là phải chẩn đoán sớm bệnh thần kinh cơ vì ngày càng có nhiều khả năng điều trị sớm và do đó, cải thiện chất lượng cuộc sống của bệnh nhân. [1].
Những thuật toán chẩn đoán, bao gồm trong chương này, cung cấp hướng dẫn chẩn đoán rối loạn thần kinh cơ thích hợp trong bối cảnh cấp cứu. Chúng tập trung vào các biểu hiện lâm sàng chính, sự khởi phát (từ vài giờ đến vài ngày), sự hiện diện của các triệu chứng và / hoặc dấu hiệu liên quan, xác định các yếu tố kích phát và chỉ định các xét nghiệm chẩn đoán thích hợp nhất.
Hãy xem xét các thuật toán khác nhau được trình bày ở đây, bởi vì có thể nhận thấy rằng có một số khía cạnh chung, ví dụ, một bệnh nhân bị yếu cơ với khởi phát cấp tính có thể bị ảnh hưởng bởi một bệnh có nguồn gốc bệnh cơ hoặc thần kinh. Đặc biệt, bệnh cảnh lâm sàng có thể thay đổi tùy theo sự hiện diện của một cơn đau cơ đơn độc hoặc có liên quan với giảm sức cơ (Bảng 13.1).
Bệnh nhân bị đau cơ lan tỏa khởi phát cấp tính
Đau cơ là một triệu chứng thường gặp và không đặc hiệu được tìm thấy trong các bệnh cơ và ngoài cơ khác nhau. Trong bệnh cơ, đau cơ có thể xuất hiện cùng với các dấu hiệu hoặc triệu chứng khác như co cứng, mệt mỏi, yếu cơ khu trú hoặc lan tỏa, không dung nạp gắng sức, tiêu cơ vân và myoglobin niệu. Để xác định chẩn đoán khi có đau nhức cơ, điều quan trọng là phải đánh giá [2]:
Bảng 13.1 Yếu cơ cấp tính: các lưu ý lâm sàng cốt yếu
| Nguồn gốc cơ |
|
| Nguồn gốc tiếp hợp thần kinh cơ |
|
| Nguồn gốc thần kinh |
|
- Khởi phát khi nghỉ ngơi, hoặc do các yếu tố kích phát như tập thể dục, nhịn ăn kéo dài, sốt, tiếp xúc với lạnh, sử dụng thuốc hoặc các chất gây tê/mê toàn thân.
- Sự hiện diện của tăng CK máu cho thấy tổn thương cơ.
- Sự phân bố đau cơ có thể khu trú, giới hạn ở một vùng cơ đơn lẻ hoặc lan tỏa liên quan đến một số nhóm cơ.
- Mối liên quan với các dấu hiệu và / hoặc triệu chứng khác như dễ mệt mỏi, nước tiểu sẫm màu (“coca cola-like” = myoglobinuria), yếu cơ gốc chi hoặc tiêu cơ vân (ví dụ hoại tử cơ với CK huyết thanh cao) [3].
Ở những bệnh nhân bị đau cơ khi nghỉ, bệnh sử lâm sàng nên đánh giá cẩn thận tình trạng tổn thương cơ mắc phải do dùng thuốc (ví dụ statin, kháng sinh, thuốc an thần kinh) [4] hoặc mắc đồng thời một bệnh ngoài cơ (ví dụ như các bệnh tự miễn, ung thư hoặc nhiễm trùng). Khám thần kinh nên tập trung vào sự hiện diện của yếu cơ với phân bố gốc hoặc ngọn.
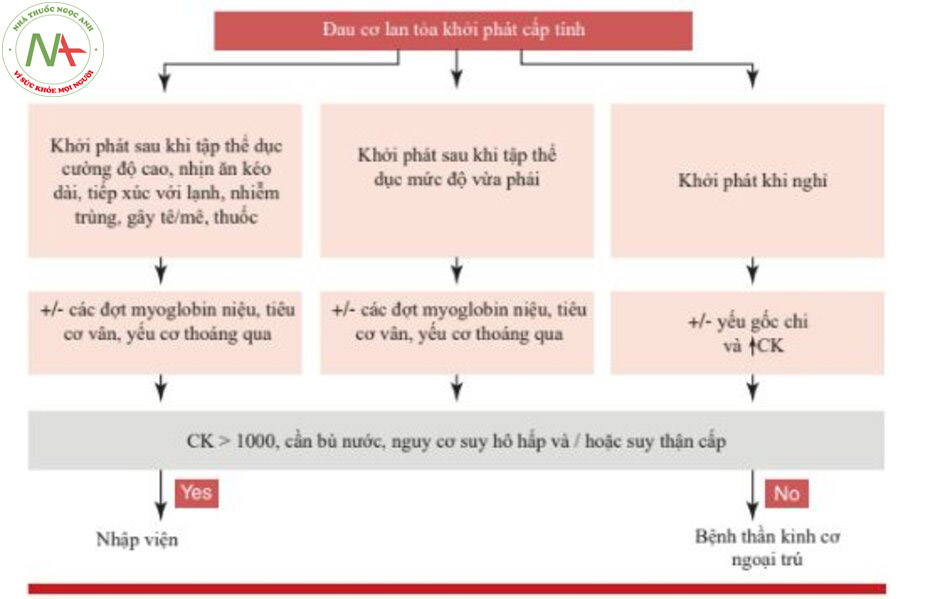
Ở những bệnh nhân đau cơ sau tập thể dục (Sơ đồ 13.1), nhịn ăn hoặc tiếp xúc lâu với lạnh, đau cơ có thể xảy ra ở tứ chi.
Trong những trường hợp này, điều quan trọng là phải kiểm tra sự hiện diện của một mối liên quan nào đó với yếu cơ, myoglobin niệu và/hoặc tiêu cơ vân [5].
Nhu cầu nhập viện chủ yếu liên quan đến nguy cơ ảnh hưởng đến các cơ hô hấp hoặc suy thận cấp sau myoglobin niệu ồ ạt [6, 7]. Trong trường hợp thứ hai, buộc phải bù nước, và nếu cần, điều trị lọc máu được khuyến khích.
Sau giai đoạn cấp tính, chẩn đoán kịp thời là cần thiết và bao gồm EMG, MRI cơ, sinh thiết cơ và các xét nghiệm sinh hóa và di truyền. Những xét nghiệm này có thể góp phần thực hiện chẩn đoán phân biệt chính xác giữa các dạng bệnh cơ khác nhau. Gần đây, MRI cơ đã trở thành một công cụ chẩn đoán rất quan trọng để xác định rõ hơn bản chất và sự phân bố của các cơ tổn thương, để chỉ ra vị trí sinh thiết và theo dõi hiệu quả điều trị. [8].
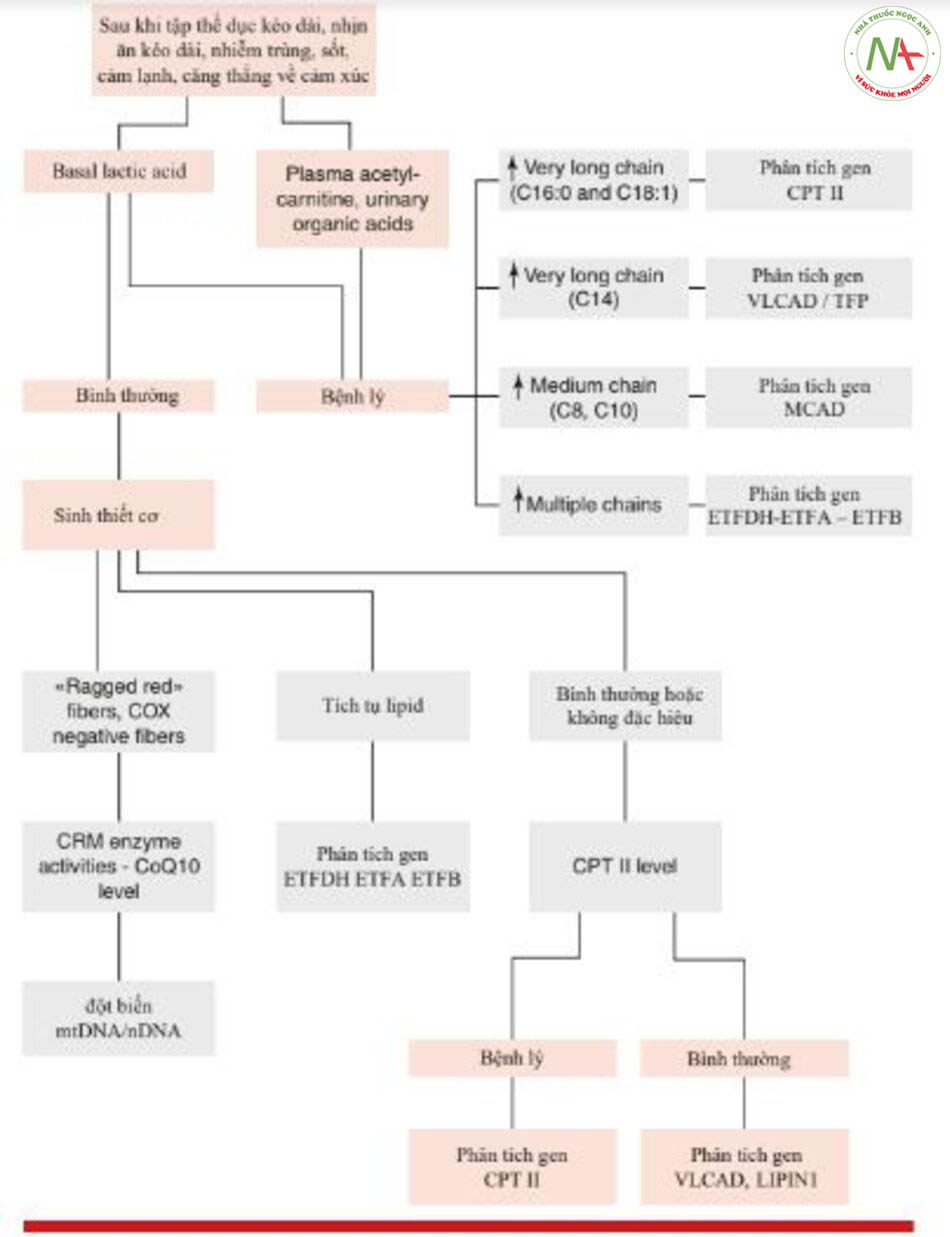
Sinh thiết cơ vẫn là phương pháp chủ yếu để phân biệt các bệnh lý cơ đã được xác định về mặt di truyền hoặc mắc phải. Cũng như trong bệnh cơ do chuyển hóa, nó có thể cho thấy dự trữ glycogen (muscle glycogenosis), tăng hàm lượng lipid (bệnh cơ dự trữ lipid) hoặc bất thường ty thể (bệnh cơ ti thể) [9] cần được xác nhận bằng cách thực hiện các xét nghiệm sinh hóa và / hoặc di truyền phân tử đặc hiệu.
Các xét nghiệm sinh hóa về homogenates của cơ giúp xác định khiếm khuyết của enzym và phân tích gen cho thấy các đột biến gây bệnh. Những kiểm tra này rất quan trọng vì một số bệnh cơ chuyển hóa có thể được điều trị thành công bằng các loại thuốc cụ thể. Đặc biệt, có những dạng bệnh cơ dự trữ lipid đáp ứng tối ưu với điều trị bằng riboflavin [10]. Liệu pháp thay thế enzym (ERT) cũng có sẵn cho bệnh glycogenosis loại II (bệnh Pompe), giai đoạn muộn của bệnh, có thể có suy hô hấp [11].
Bằng chứng về thâm nhiễm viêm trong sinh thiết cơ có thể gợi ý chẩn đoán bệnh cơ do viêm, một tình trạng có thể được điều trị thành công bằng steroid và / hoặc thuốc ức chế miễn dịch.
Một tình trạng đặc biệt được đặc trưng bởi đau cơ, tiêu cơ vân và yếu cơ cấp tính khu trú (ví dụ cơ chày trước) sau một bài tập luyện kéo dài như ở vận động viên chạy marathon (“hội chứng chèn ép khoang”). Trong những trường hợp như vậy, EMG có thể cho thấy tổn thương cơ tập trung mà không có các khu vực khác [12].
Cần phải chỉ ra rằng khi đau cơ lan tỏa là triệu chứng duy nhất, và tất cả các xét nghiệm chẩn đoán như mức CK, EMG, MRI cơ và sinh thiết cơ đều âm tính , người ta nên tính đến “bệnh tâm lý” cần phải kiểm tra tâm thần.
Cuối cùng, có vẻ thích hợp để vạch ra rằng một số bệnh nhân phàn nàn về cơn đau dữ dội và lan tỏa, nhận được chẩn đoán “đau cơ xơ hóa” (fibromyalgia), là một tình trạng cho đến nay không có tiêu chuẩn chẩn đoán cụ thể [13]. Ở một tỷ lệ nhất định, đau cơ xơ hóa có liên quan đến bệnh lý thần kinh sợi nhỏ.
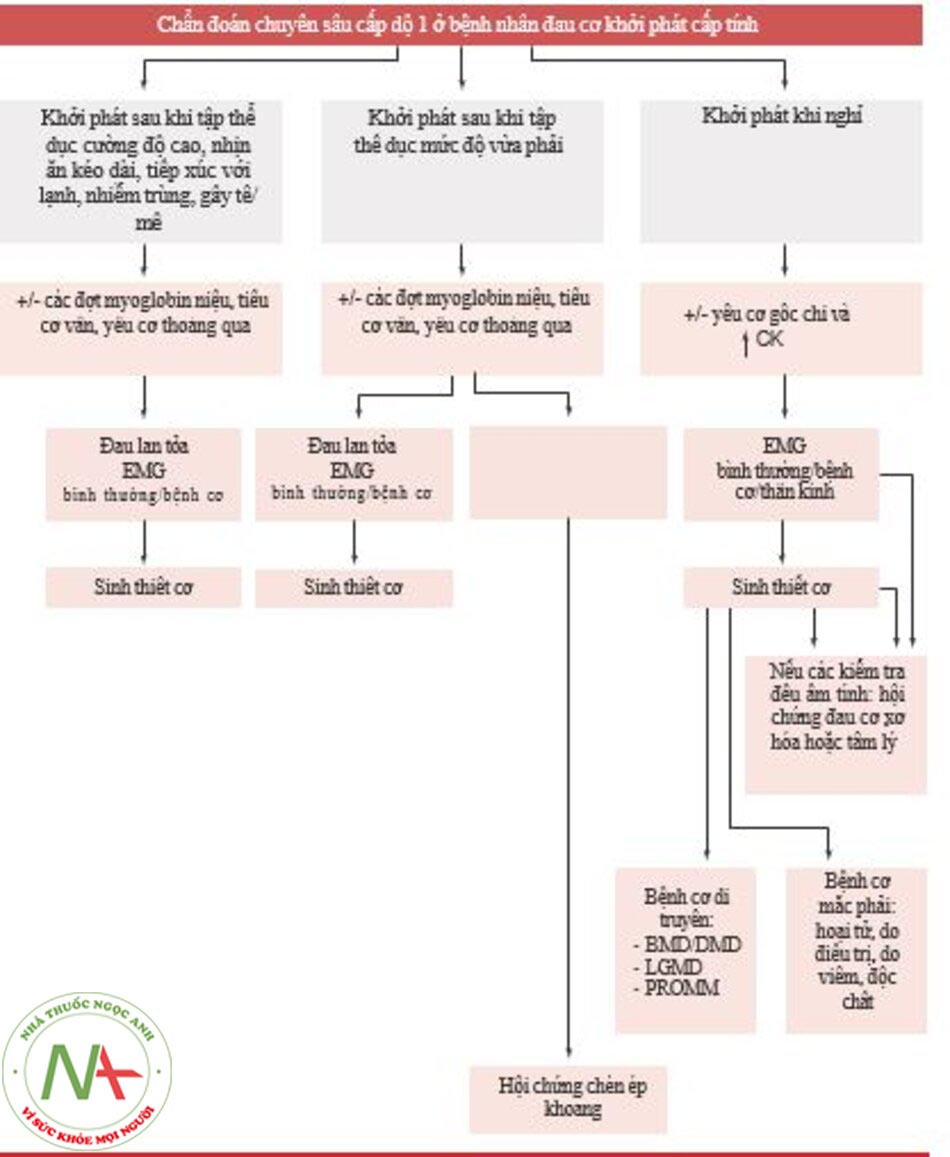
Rõ ràng là từ những cân nhắc trên rằng việc xác định nguyên nhân của đau cơ cấp tính đòi hỏi một phương pháp tiếp cận đa phương thức ở các Trung tâm lớn – nơi có thể thực hiện đầy đủ các thăm khám lâm sàng và xét nghiệm. Sơ đồ 13.2 tóm tắt các bước của kiểm tra chuyên sâu cấp độ đầu tiên cho một bệnh nhân bị đau cơ khởi phát cấp tính.
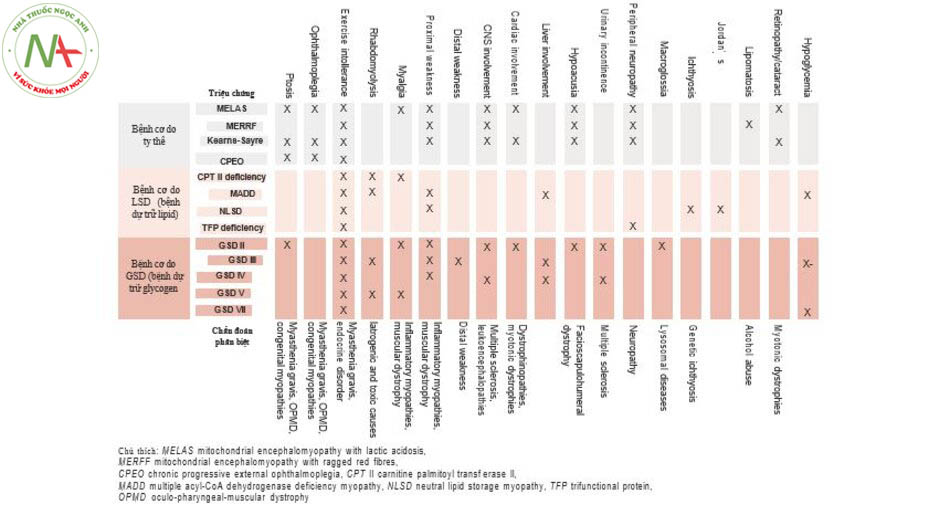
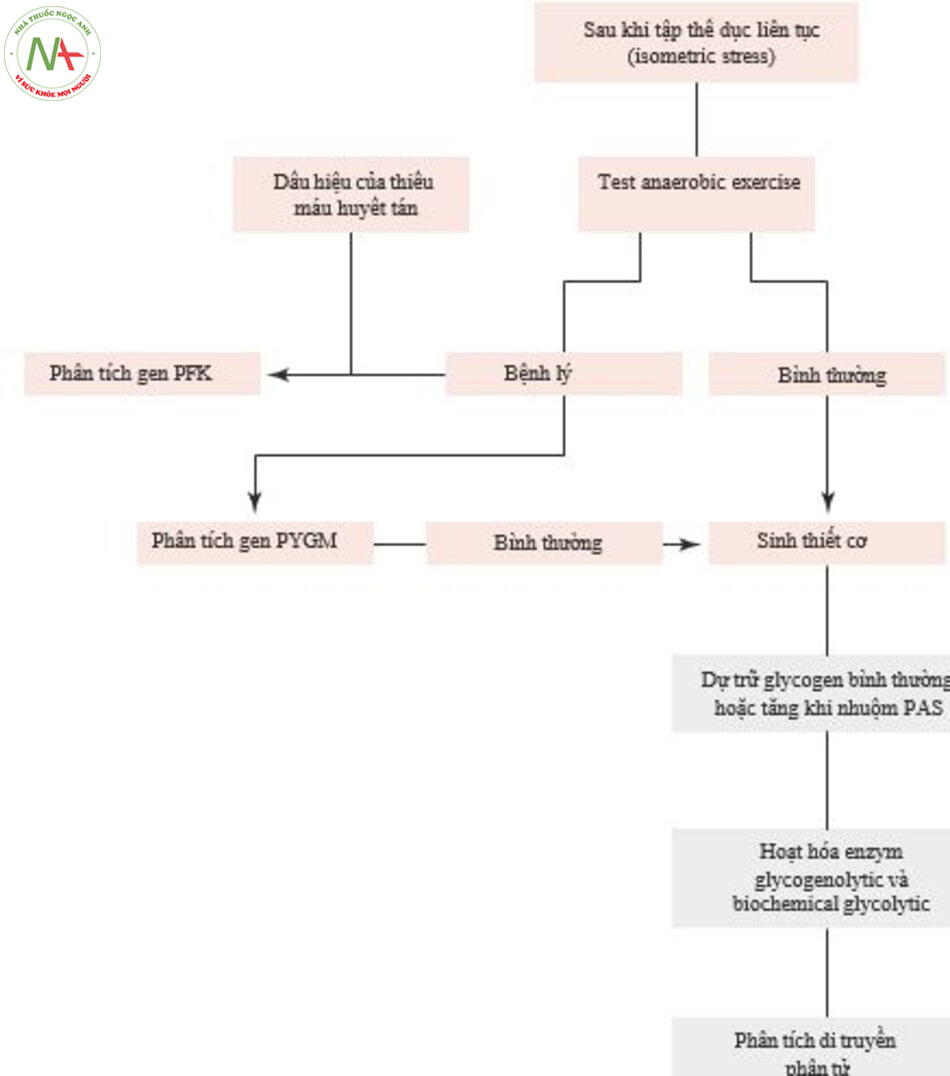
Nếu nghi ngờ bệnh cơ chuyển hóa, “Các cờ đỏ” có thể giúp đưa đến các dạng khác nhau (Hình 13.3), đặc biệt là sử dụng chẩn đoán cấp độ hai với các xét nghiệm sinh hóa và di truyền (Hình 13.4).
Bệnh nhân bị yếu cơ lan tỏa cấp tính (bệnh cơ)
Khởi phát cấp tính của yếu cơ (giờ, 1–2 ngày), do các bệnh về cơ, có liên quan đến một số tình trạng lâm sàng giới hạn. Nhìn chung, điều quan trọng là phải xem xét bối cảnh lâm sàng nơi bệnh nhân được khám (phòng cấp cứu, ICU, khu y tế) và đánh giá:
- Phân bố của yếu cơ (lan tỏa hay khu trú)
- Các triệu chứng dai dẳng hay thay đổi thất thường
- Sự tham gia của các cơ mắt và / hoặc cơ mặt dưới
- Liên quan đến đau cơ, sốt, tổn thương da
- Các yếu tố kích hoạt tiềm năng của các triệu chứng
Thuật toán đã được thiết lập để phù hợp trong các điều kiện cấp cứu/khẩn cấp. Một sự khác biệt quan trọng đầu tiên đã được xác định giữa yếu cơ xảy ra khi nghỉ ngơi (Hình 13.5) và trong hoặc sau khi hoạt động thể chất (Hình. 13.6).
Các trường hợp yếu cơ xuất hiện khi nghỉ ngơi được chia thành hai loại: trường hợp CK bình thường và CK tăng.
Một bệnh nhân bị yếu cơ cấp tính với CK bình thường; trong trường hợp này, mức hormone tuyến giáp là quan trọng và có thể dẫn đến chẩn đoán cường giáp.
Bệnh sử lâm sàng chính xác (có vết thương ngoài da, lạm dụng thuốc, v.v.), có rối loạn thần kinh tự chủ và xét nghiệm sinh lý thần kinh hoàn chỉnh với kích thích lặp đi lặp lại hoặc kiểm tra từng sợi, có thể dẫn đến chẩn đoán “ngộ độc thịt'”.
Khi yếu cơ có liên quan đến tăng CK, tình huống trở nên phức tạp hơn.
Ví dụ, nếu một bệnh nhân trong phòng cấp cứu có biểu hiện yếu cơ lan tỏa khởi phát bán cấp (vài giờ) gây ra liệt mềm hoặc liệt tứ chi mà không kèm theo các cơ hô hấp, việc xác định nhanh các ion huyết tương có thể đưa đến chẩn đoán liệt do hạ/tăng kali máu (có dạng di truyền và dạng mắc phải). Các nguyên nhân mắc phải của hạ kali máu bao gồm tiêu chảy mãn tính, sử dụng thuốc lợi tiểu kéo dài, cường aldosteron, uống quá nhiều cam thảo, uống cà phê hoặc trà. Việc phát hiện nồng độ hormone tuyến giáp tăng cao có thể dẫn đến chẩn đoán liệt do hạ kali máu do nhiễm độc giáp [14].
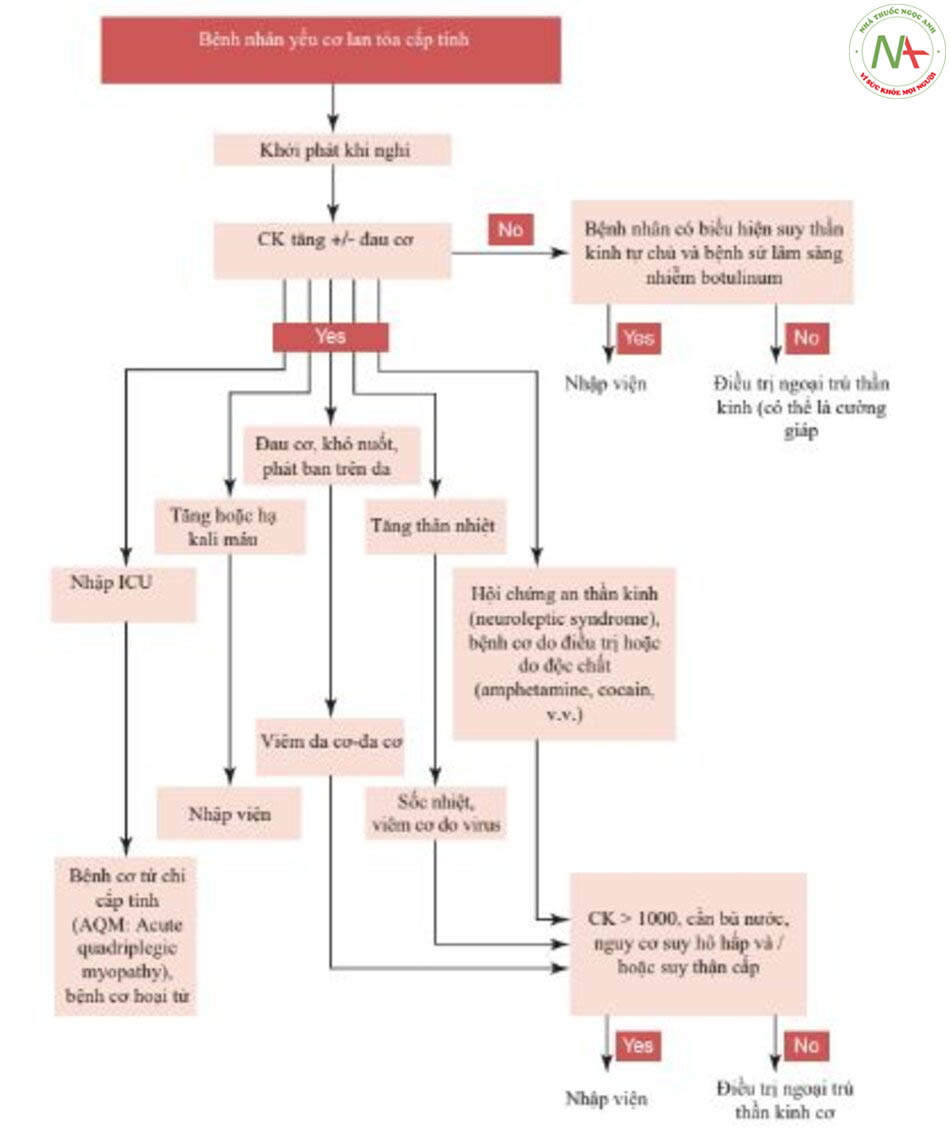
Yếu cơ với nồng độ kali thay đổi cũng được tìm thấy trong một số dạng di truyền được gọi là “bệnh lý kênh”. Việc chẩn đoán liệt chu kỳ do hạ kali máu dựa trên tiền sử có các đợt liệt mềm, kéo dài vài giờ đến vài ngày, được kích hoạt bởi thức ăn giàu carbohydrate, uống rượu hoặc truyền glucose với bằng chứng hạ kali máu trong các cơn và không có tăng trương lực cơ cả trên lâm sàng lẫn EMG. Test Fournier đã được chứng minh là một công cụ chẩn đoán rất hữu ích trong việc chẩn đoán phân biệt với các dạng bệnh cơ khác [15].
Chẩn đoán liệt chu kỳ do tăng kali máu được xác lập khi có các cơn liệt mềm có thể kết hợp với yếu cơ mắt, cơ nuốt và cơ thân, tăng kali máu (> 5 mmol / l), khởi phát trước tuổi 20. Có thể bị kích phát do ăn quá nhiều thực phẩm giàu kali sau khi nghỉ ngơi hoặc gắng sức, glucocorticoid, tiếp xúc với lạnh hoặc căng thẳng cảm xúc. Nguy cơ tim mạch do tăng kali máu hoặc hạ kali máu đòi hỏi phải có “mã đỏ” (red code) trong phòng cấp cứu.
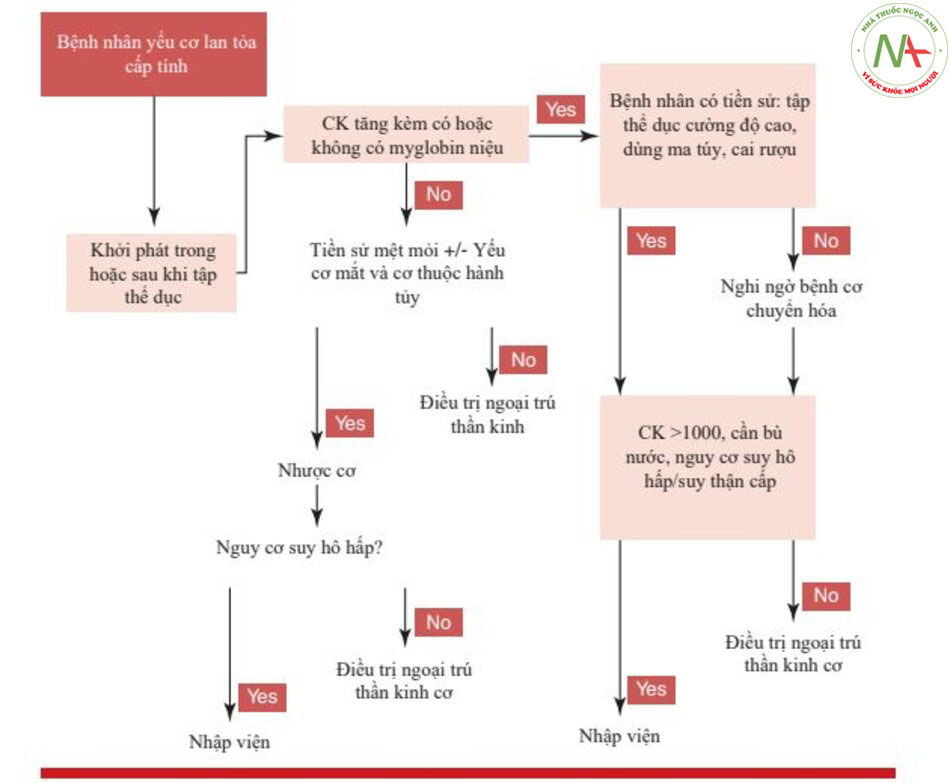
Nếu yếu cơ có liên quan đến tăng CK, đau cơ, khó nuốt, phát ban da tái phát, một “bệnh cơ do viêm”, như viêm đa cơ hoặc viêm da cơ cần được nghi ngờ [16]. Những bệnh nhân này ban đầu được khám bởi bác sĩ nội khoa, bác sĩ thấp khớp, bác sĩ da liễu, trong khi bác sĩ thần kinh sẽ được hội chẩn muộn hơn. Ở những bệnh nhân cao tuổi, bệnh cơ do viêm có thể là bệnh cận ung thư và đòi hỏi một cuộc kiểm tra rất chính xác. Xác nhận chẩn đoán bệnh cơ do viêm thường thu được bằng các xét nghiệm mô học, hóa mô học và hóa mô miễn dịch của các mẫu sinh thiết cơ.
Khi có sốt, viêm cơ do virus cũng nên được nghĩ đến. Trong những trường hợp này, ngoài các triệu chứng (đau cơ) và các dấu hiệu của bệnh cơ (yếu cơ), thường có các khía cạnh khác liên quan đến một bệnh toàn thân. Các loại virus liên quan khác nhau như cúm loại A và B (thường gặp nhất), enterovirus, EB, adenovirus và HIV. Viêm cơ do các virus này đặc trưng bởi sự khởi phát đột ngột, thường là trong những ngày đầu phục hồi (convalescence), đau cơ ở chi dưới, đi lại khó khăn. EMG cho thấy các dấu hiệu bệnh cơ; trong những trường hợp này, không có chỉ định sinh thiết cơ, điều trị theo triệu chứng [16] và bệnh khỏi sau vài ngày [17].
Nguyên nhân khác của yếu cơ cấp tính là sự thay đổi nhiệt độ cơ thể như được quan sát thấy trong sốc nhiệt, tăng thân nhiệt ác tính, hội chứng an thần kinh ác tính hoặc sau khi uống một số chất độc (amphetamine, cocaine, v.v.). Tổn thương cơ có thể rất lớn đến mức xuất hiện myoglobin niệu và có thể là một dấu hiệu đe dọa cần được điều trị nhanh chóng.
Trong ICU, có thể quan sát thấy sự khởi phát cấp tính của yếu cơ ở những bệnh nhân [18] “bệnh cơ tứ chi cấp tính”. Tình trạng này ban đầu được quan sát thấy ở bệnh nhân hen được điều trị bằng steroid và chẹn thần kinh cơ không khử cực và sau đó được báo cáo ở bệnh nhân ghép tạng. Hình ảnh lâm sàng được đặc trưng bởi tình trạng yếu nghiêm trọng của tất cả các cơ tự ý, phổ biến ở các vùng cơ gốc chi. Yếu cơ hô hấp cản trở bệnh nhân cai thở máy [19]. Sinh thiết cơ có thể thấy mất các sợi myosin. Những bệnh nhân khác có thể bị hoại tử cơ ồ ạt như bệnh hoại tử cơ cấp tính với hiện tượng tạo không bào (vacuolization) và thực bào (phagocytosis) sợi cơ.
Các trường hợp yếu cơ khởi phát bán cấp khác với CK cao đã được mô tả ở những bệnh nhân đang dùng một số loại thuốc như thuốc chống loạn thần và chống trầm cảm, thuốc an thần gây ngủ, kháng histamine, hóa trị liệu và thuốc hạ lipid (ví dụ Statins). Rối loạn cơ cũng có thể do sử dụng đồng thời nhiều loại thuốc với nhau, có khả năng gây ra tác dụng hiệp đồng [4].
Yếu cơ xuất hiện trong hoặc sau khi hoạt động thể chất Hình 13.6) có thể liên quan hoặc không liên quan đến myoglobin niệu. Một số nguyên nhân gây ra myoglobin niệu có thể là do hoạt động cơ bắp quá mức như ở vận động viên chạy marathon, co giật hoặc hội chứng cai rượu.
Bệnh cơ chuyển hóa do khiếm khuyết enzym (ví dụ thiếu carnitine palmitoyltransferase, thiếu myophosphorylase, thiếu phosphofructokinase, thiếu chuỗi enzym hô hấp) có thể biểu hiện với myoglobin niệu.
Cuối cùng, chúng ta phải nhớ rằng sự khởi phát cấp tính của bệnh nhược cơ có thể xảy ra.
Bệnh nhân bị yếu cơ cấp tính (do thần kinh và không do chấn thương)
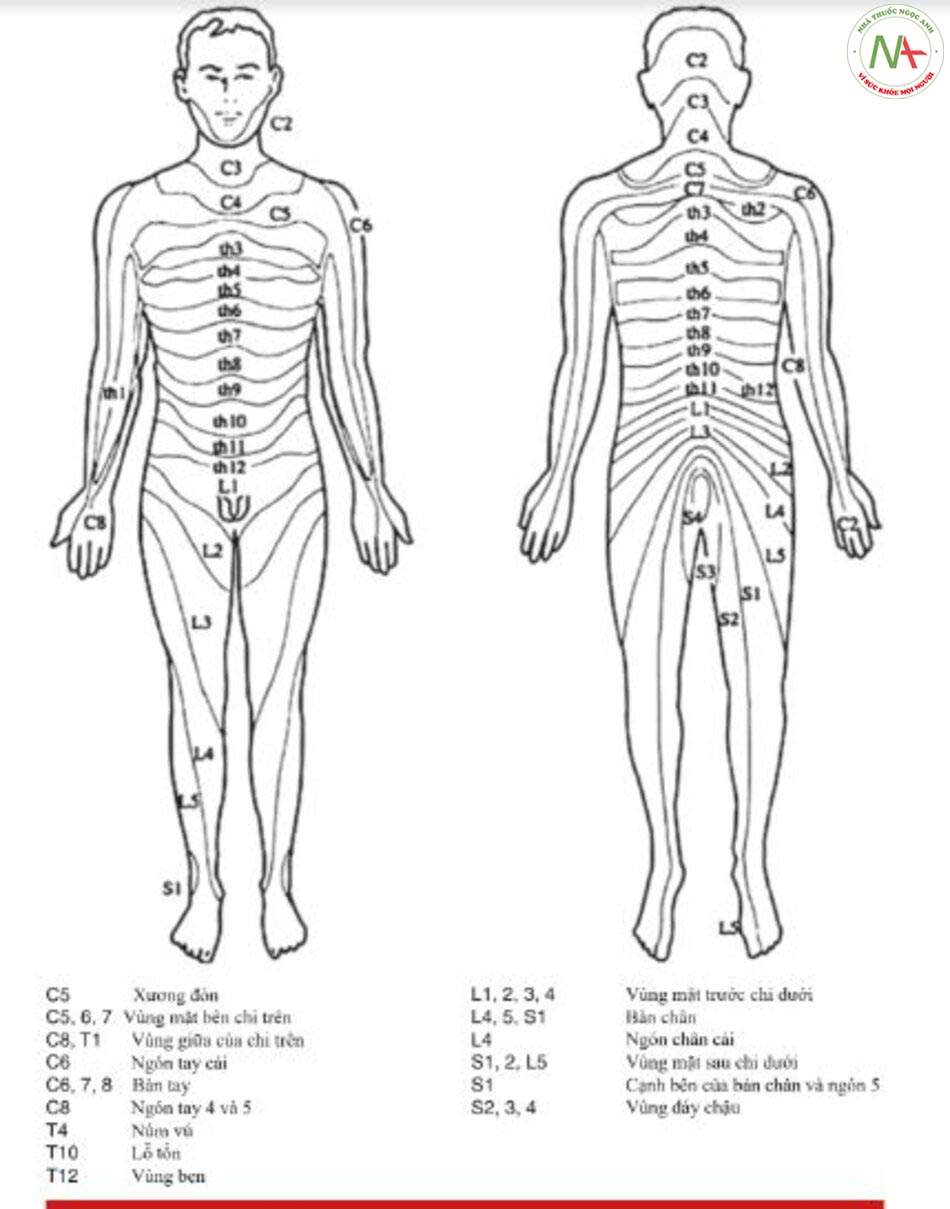
Việc phân loại các bệnh của hệ thần kinh ngoại biên được đặc trưng bởi sự không đồng nhất về mặt lâm sàng. Trên thực tế, sẽ hữu ích nếu làm theo tiêu chí phân bố lâm sàng, phân biệt các dạng bệnh lý thần kinh khu trú với lan tỏa. Phân tích bất kỳ sự liên quan hoặc rối loạn cảm giác đơn độc nào và sự phân bố của chúng sẽ cung cấp thêm dữ liệu chẩn đoán (Hình 13.7).
Việc đánh giá sự phân bố trên cơ thể của các triệu chứng và dấu hiệu là cần thiết để chẩn đoán chính xác sự suy giảm của một dây thần kinh, một hoặc nhiều rễ hay đám rối. Tuy nhiên, những bệnh nhân này nên được chuyển đến một trung tâm thần kinh cơ để thực hiện một cuộc kiểm tra lâm sàng và sinh lý thần kinh hoàn chỉnh (Hình 13.8).
Mặt khác, nếu sau khi khởi phát cấp tính, sự phân bố của các triệu chứng / dấu hiệu là hai bên và đối xứng hoặc hiếm hơn là không đối xứng, bệnh nhân phải được nhập viện vì có thể có liên quan đến hô hấp [20] (Fig. 13.9).
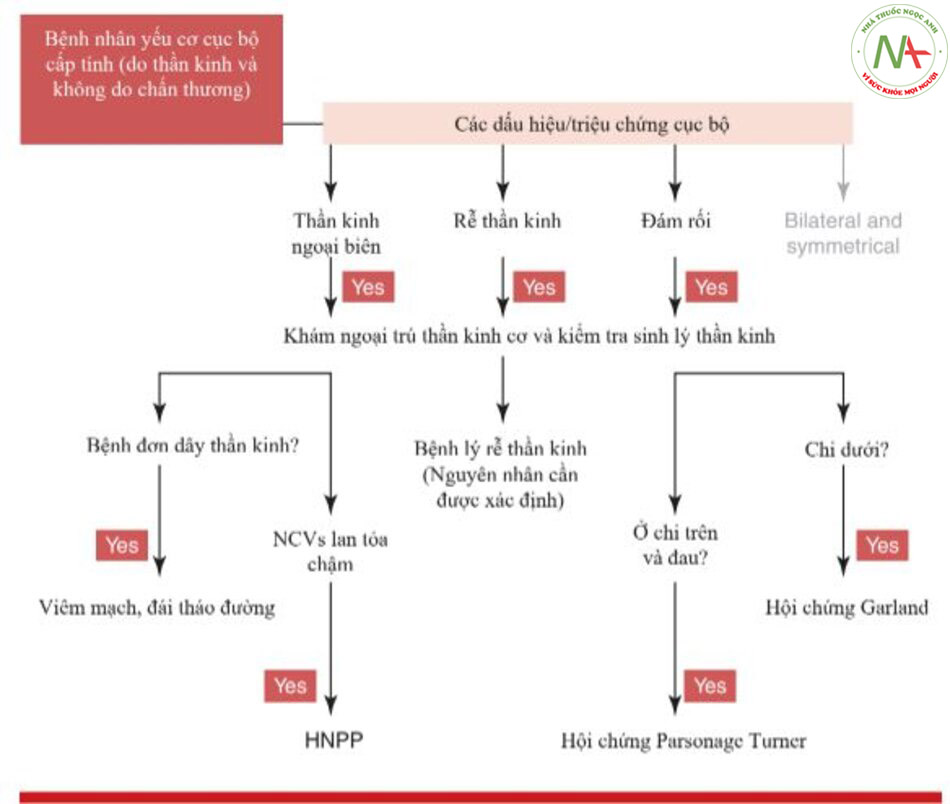
Không có nghi ngờ gì rằng hội chứng Guillain-Barrè syndrome (GBS) là nguyên nhân thường gặp nhất của yếu cơ cấp tính có nguồn gốc thần kinh. Nếu nghi ngờ dựa trên tiền sử (bệnh nhiễm trùng đường hô hấp hoặc đường ruột trước đó thường được ghi nhận), bệnh nhân phải được nhập viện và khám lâm sàng, điện sinh lý và dịch não tủy [21]. Các xét nghiệm sinh lý thần kinh đôi khi phải được lặp lại sau một vài tuần để định rõ bản chất thoái hóa sợi trục hoặc hủy myelin của bệnh. Nhập viện cũng được khuyến cáo vì 20% bệnh nhân có thể bị tổn thương cơ hô hấp và cần được chăm sóc tích cực [22, 23].
Một vấn đề khác có thể cần nhập viện là rối loạn thần kinh tự chủ kịch phát với tỷ lệ thay đổi từ 1/3 đến 2/3 số bệnh nhân GBS [24, 25]. Yếu cơ khởi phát cấp tính ít thường gặp hơn, đôi khi kèm theo đau (chủ yếu ở ngọn chi và không đối xứng ở chi trên), nhưng có thể quan sát thấy trong bệnh lý thần kinh vận động đa ổ liên quan đến đa block (multiple blocks) dẫn truyền thần kinh, hiếm khi kèm theo dây thần kinh hoành.
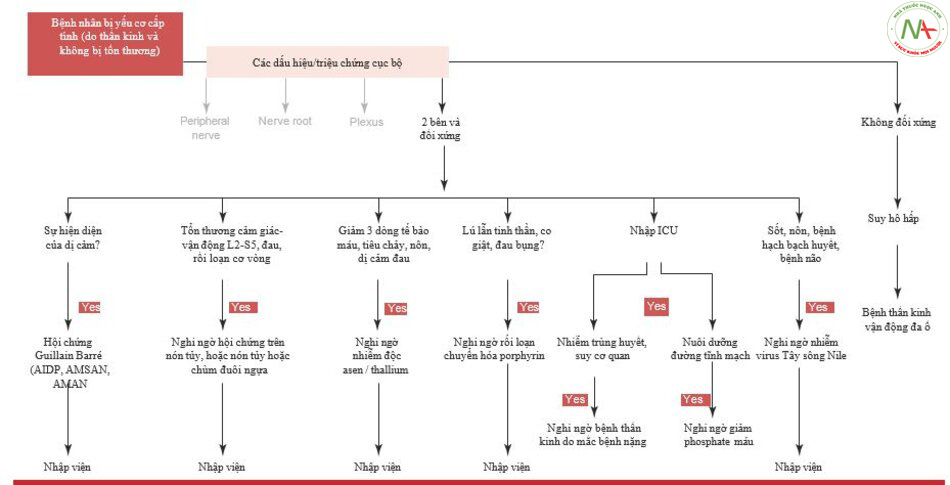
Trong trường hợp bệnh thần kinh cấp tính, chẩn đoán rối loạn chuyển hóa porphyrin phải được xem xét [26]. Chẩn đoán này có thể bị bỏ sót vì biểu hiện lâm sàng phức tạp tương tự như các bệnh lý khác. Biến thể thường gặp nhất là rối loạn chuyển hóa porphyrin cấp tính từng đợt, với tính chất di truyền trội qua NST thường, mức độ thâm nhập (penetration) thấp và tỷ lệ hiện mắc từ 1 đến 10/100.000. Biểu hiện thường gặp nhất là đau bụng cấp kèm theo buồn nôn, nôn và kích động. Trong một số trường hợp, ban đầu cũng có cảm giác đau ở lưng, có khả năng lan xuống các chi dưới, tiến triển nhanh thành bệnh thần kinh nặng, chủ yếu là vận động và tự chủ, có thể có tổn thương bộ máy hô hấp [27]. Thường có tổn thương mặt và hành tủy (facial and bulbar impairment), trong khi phản xạ gân xương thường không có, thì phản xạ gân Achilles được bảo tồn. Sự tương đồng mạnh mẽ giữa hình ảnh lâm sàng nào đó với GBS là rõ ràng; chẩn đoán phân biệt phải dựa trên bệnh sử lâm sàng (các yếu tố khởi phát có thể xảy ra), tiền sử gia đình và kiểm tra sinh hóa (lượng porphobylinogen và axit delta-aminolevulinic trong nước tiểu). Một xét nghiệm đơn giản có thể hữu ích là sự sẫm màu của nước tiểu khi tiếp xúc với ánh nắng mặt trời (sự trùng hợp- polymerization của quá nhiều porphobylinogen). Chẩn đoán sớm là rất quan trọng đối với cuộc sống của bệnh nhân, vì có thể xác định các biến cố hoặc yếu tố kích phát; trong trường hợp co giật, phải tránh dùng barbiturate!
Nhiễm độc kim loại nặng cấp tính (asen và thalium) là những ví dụ tuyệt vời về quy luật các chất độc thần kinh hiếm khi chọn lọc đối với hệ thần kinh trung ương. Trên thực tế, bệnh cảnh lâm sàng được đặc trưng bởi sự tham gia đồng thời hoặc tuần tự của một số cơ quan. Đây là một manh mối thích hợp để chẩn đoán phân biệt sớm. Cả thallium và asen đều có trong thuốc trừ sâu, và việc ăn/ uống chúng có thể tình cờ xảy ra. Trong cả hai trường hợp, giai đoạn lâm sàng trước giai đoạn bệnh thần kinh được đặc trưng bởi các triệu chứng tiêu hóa (tiêu chảy, buồn nôn, nôn) và tự chủ (nhịp tim nhanh và tăng / hạ huyết áp). Các khía cạnh bệnh lý thần kinh, xảy ra ngay sau đó, ban đầu nhạy cảm với các dị cảm bỏng rát và lan tỏa xa-gần (dysto-proximal diffusion), rất nhanh sau đó là yếu tiến triển và cũng có thể dẫn đến suy hô hấp [28, 29].
Sự khởi phát cấp tính của tình trạng yếu cơ cũng có thể ảnh hưởng đến những bệnh nhân mắc các bệnh khác và làm phức tạp thêm bệnh cảnh lâm sàng. Trên thực tế khá thường gặp, bệnh nhân trong ICU phát triển bệnh cơ và/hoặc bệnh thần kinh cấp tính (bệnh thần kinh cơ do mắc bệnh nặng) [19]. Tổn thương thần kinh cơ thường được phát hiện lúc gặp khó khăn trong việc cai máy thở cho bệnh nhân. Trên thực tế, các triệu chứng thần kinh cơ đã phát sinh, nhưng với tình trạng nguy kịch của bệnh nhân, rất khó để phát hiện ra chúng. Chẩn đoán sớm là rất quan trọng để tránh nằm ICU kéo dài và cải thiện khả năng hồi phục dài hạn. Về mặt lâm sàng, vì bệnh nhân thường có biểu hiện liệt tứ chi nặng, nên điều quan trọng là phải kiểm soát khả năng hô hấp. Theo dõi điện sinh lý, ở những bệnh nhân nguy kịch có biên độ CMAPs và điện thế cảm giác (SAPs) giảm sớm, có thể là một trợ giúp có giá trị. Các yếu tố nguy cơ làm khởi phát bệnh thần kinh-cơ do bệnh nặng (critical illness neuro-myopathy) đã được xác định, chẳng hạn như nhiễm trùng huyết, suy đa cơ quan, sử dụng steroid và / hoặc thuốc chẹn thần kinh cơ, bất động kéo dài và tăng đường huyết [30]. Căn bệnh này được cho là do thoái hóa sợi trục gây ra bởi đáp ứng viêm toàn thân với viêm vi mạch. Người ta cũng gợi ý về tính hưng phấn/dễ kích thích thoáng qua của các kênh phụ thuộc điện thế natri với hậu quả là tê liệt chức năng của các sợi trục và sợi cơ [31]. Phosphat máu (insulin chuyển phosphat vào trong tế bào) cũng cần được theo dõi chặt chẽ để tránh khởi phát liệt tứ chi mất phản xạ, mặc dù khá hiếm, nhưng nên được cân nhắc trong chẩn đoán phân biệt của bệnh nguy kịch, ở những bệnh nhân mới phẫu thuật hoặc nuôi dưỡng qua đường tĩnh mạch kéo dài [32 ]. Trong trường hợp giảm phosphat máu nặng, cũng có thể quan sát thấy lú lẫn, co giật, bệnh não và hôn mê. Thường gặp hơn là bệnh cảnh lâm sàng bao gồm sự tiến triển nhanh chóng của dị cảm quanh miệng và các chi, cũng như sự hiện diện của loạn vận ngôn (dysarthria) và liệt tứ chi.
Sốt Tây sông Nile (West Nile fever) là một bệnh do vi rút Tây sông Nile gây ra. Các ổ chứa vi rút là các loài chim và muỗi hoang dã, các vết đốt của chúng là vector trung gian truyền bệnh chính cho con người. Thời gian ủ bệnh từ khi bị muỗi đốt thay đổi từ 2 đến 14 ngày nhưng cũng có thể kéo dài đến 21 ngày ở những đối tượng bị suy giảm hệ thống miễn dịch. Hầu hết những người bị nhiễm ban đầu không biểu hiện bất kỳ triệu chứng nào, tuy nhiên, trong số các trường hợp có triệu chứng, khoảng 20% có các triệu chứng nhẹ sốt, nhức đầu, buồn nôn, nôn, nổi hạch to và phát ban trên da. Liệt mềm cấp tính giống với bệnh bại liệt do poliovirus và có thể nhanh chóng dẫn đến suy hô hấp. Các triệu chứng nghiêm trọng nhất xảy ra ở ít hơn 1% số người bị nhiễm và bao gồm sốt cao, đau đầu dữ dội, yếu cơ, mất định hướng, run, rối loạn thị giác, tê, co giật, rồi liệt và hôn mê. Một số tác động thần kinh có thể là vĩnh viễn hoặc gây tử vong; trong những trường hợp nghiêm trọng nhất (khoảng một phần nghìn), vi rút có thể gây ra bệnh viêm não tử vong. Chẩn đoán được xác nhận chủ yếu thông qua các xét nghiệm (Elisa hoặc miễn dịch huỳnh quang) được thực hiện trên huyết thanh, và trên dịch não tủy nếu được chỉ định, để phát hiện các kháng thể IgM.
Nếu khiếm khuyết vận động chỉ giới hạn ở các chi dưới kèm khiếm khuyết cảm giác, đau và rối loạn cơ vòng, chúng ta cũng phải nghi ngờ hội chứng trên nón (epiconus), nón tủy (cone) và chùm đuôi ngựa (cauda).
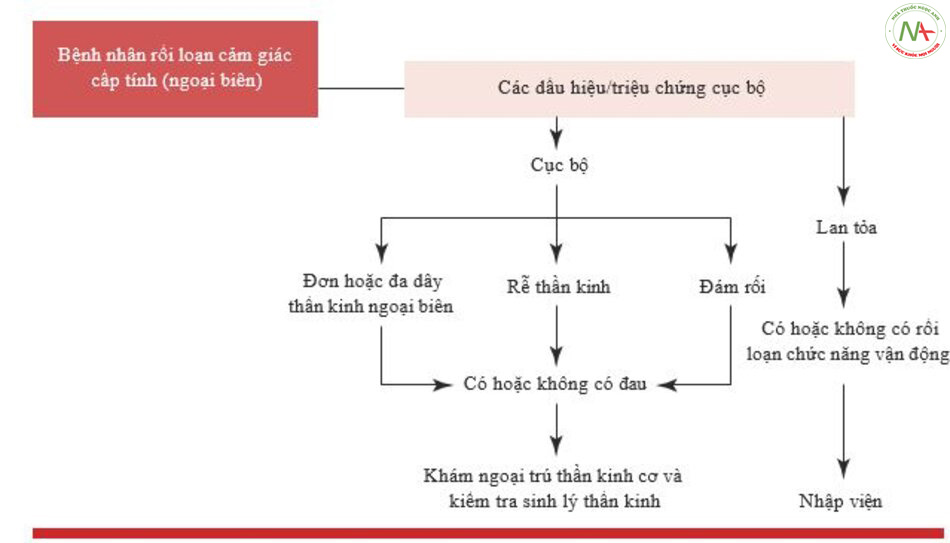
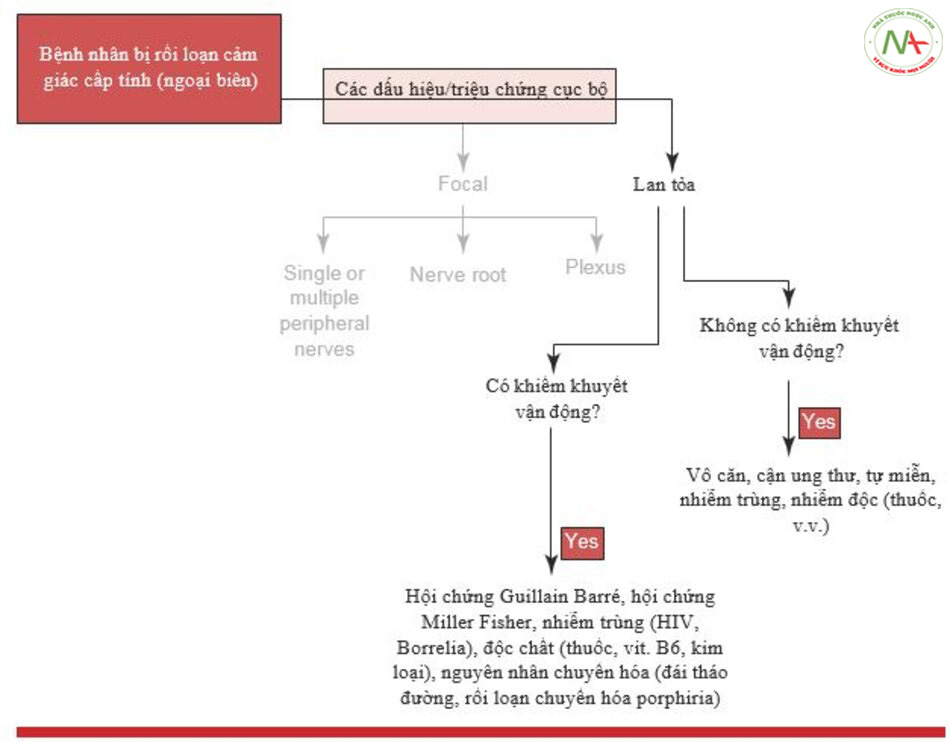
Bệnh nhân rối loạn cảm giác cấp tính (kiểu ngoại biên)
Các rối loạn cảm giác cấp tính, không do chấn thương cũng có thể được phân biệt bởi sự phân bố của chúng thành “cục bộ” và “lan tỏa”. Rối loạn “cục bộ” cũng bao gồm những rối loạn phân bố đa ổ, vì chúng có các cơ chế gây bệnh tương tự (Hình. 13.10).
Sự phân biệt giữa rối loạn cảm giác khu trú/đa ổ với lan tỏa cấp tính về cơ bản dựa trên các khía cạnh lâm sàng. Mặt khác, không có công cụ chẩn đoán bổ sung nào thường có sẵn tại phòng cấp cứu [33].
Sau đó, chẩn đoán phân biệt giữa các dạng liên quan đến một hoặc nhiều dây thần kinh, một hoặc nhiều rễ hoặc một phần của đám rối, của một hoặc cả hai bên, trong bối cảnh rối loạn lan tỏa, giữa các dạng có rối loạn chức năng vận động hay không có rối loạn chức năng vận động, dựa trên nghi ngờ lâm sàng và / hoặc đánh giá sinh lý thần kinh. Hình 13.11 tóm tắt các bước khám lâm sàng và kiểm tra sinh lý thần kinh của bệnh nhân rối loạn cảm giác cấp tính và phân bố khu trú.
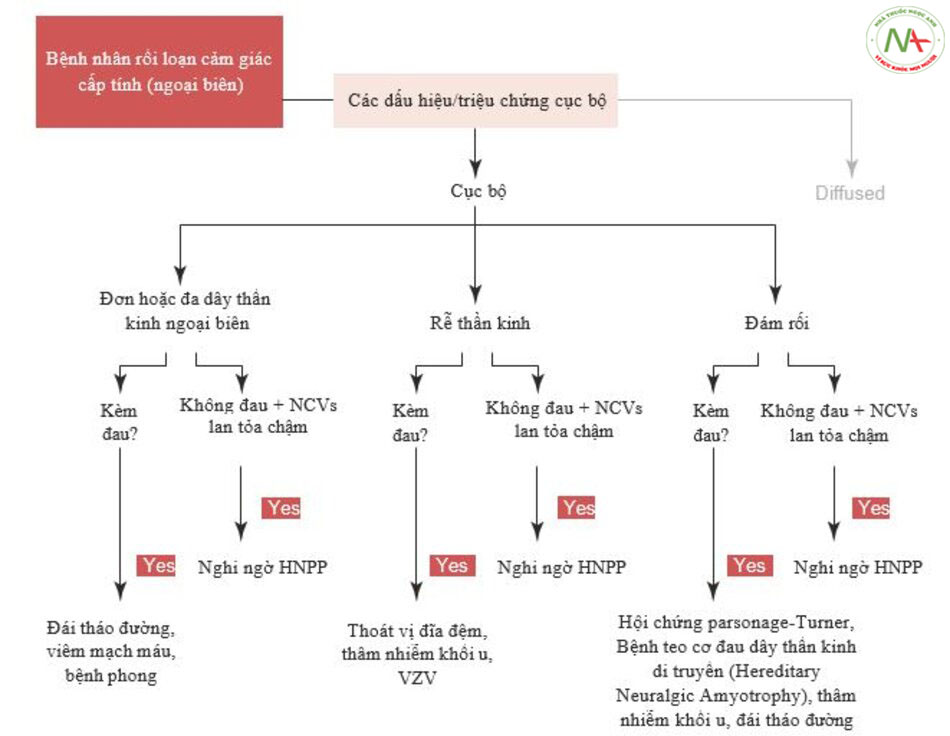
Các dạng khu trú cần được phân biệt theo sự hiện diện hoặc vắng mặt của triệu chứng đau. Trên thực tế, các rối loạn cảm giác cấp tính do chèn ép, chấn thương hoặc tổn thương mạch máu của một hoặc nhiều dây thần kinh, tổn thương chèn ép hoặc thâm nhiễm của một hoặc nhiều rễ thần kinh và tổn thương đám rối trên nền bệnh tự miễn, mạch máu hoặc di truyền thường đi kèm với mức độ đau khác nhau hoặc các triệu chứng liên quan khác có tính chất vận động.
Ngược lại, đau thường không có mặt trong các bệnh lý thần kinh di truyền với sự gia tăng tính nhạy cảm của các dây thần kinh với tổn thương do chèn ép (HNPP). HNPP biểu hiện điển hình với các rối loạn cảm giác cấp tính (giảm cảm giác và / hoặc dị cảm) và phân bố trong khu vực của một hoặc nhiều dây thần kinh hoặc rễ hoặc đám rối. HNPP cũng có thể kết hợp với các triệu chứng hoặc dấu hiệu vận động.
Rối loạn cảm giác cấp tính lan tỏa chấp nhận một cơ chế bệnh sinh khác nếu chúng có liên quan hoặc không với các triệu chứng và / hoặc dấu hiệu của rối loạn chức năng vận động. Một lần nữa, điều này có thể được xác định dựa trên lâm sàng và xét nghiệm sinh lý thần kinh. Trong trường hợp đầu tiên (với rối loạn chức năng vận động), các dạng rối loạn miễn dịch cấp tính như hội chứng Guillain- Barré và hội chứng Miller Fisher là phổ biến nhất. Loại sau được đặc trưng bởi sự hiện diện của thất điều, mất phản xạ và liệt cơ mắt (là rối loạn chức năng vận động chính) [34]. Trong chẩn đoán phân biệt (Hình 13.12), các giả thuyết khác đã được báo cáo trong các trường hợp rối loạn cảm giác cấp tính với mức độ rối loạn chức năng vận động thay đổi [35]. Sau đó, có một số loại mà theo định nghĩa, không có triệu chứng và dấu hiệu vận động và chúng có thể biểu hiện khởi phát cấp tính (thậm chí đôi khi là bán cấp tính hoặc hiếm hơn là mãn tính) [36].
Câu hỏi lâm sàng
Câu 1
Bệnh nhân nữ, 31 tuổi, đi khám vì rối loạn thị lực. Bệnh nhân là một nhà phát triển phần mềm và hầu hết thời gian làm việc trên máy tính. Lần đầu tiên cô ấy nhận thấy thị lực mờ là 2 tháng trước. Kể từ đó, cô ấy đã có nhiều đợt nhìn mờ và nhìn đôi, đặc biệt là vào cuối ngày làm việc. Hai ngày trước, cô cảm thấy khó chịu ở cổ và khó ngửa đầu lên, tình trạng này đã hết sau một đêm nghỉ ngơi. Bệnh nhân không sử dụng thuốc lá, rượu hoặc ma túy. Các dấu hiệu sinh tồn trong giới hạn bình thường. Khám thực thể ghi nhận, đồng tử 3mm, tròn và phản ứng ánh sáng. Không có sụp mi, và vận nhãn bình thường. Không có biến dạng cổ hoặc đau. Sức cơ, phản xạ gân sâu và cảm giác bình thường ở hai chi trên và dưới. Các xét nghiệm sâu hơn cho thấy các kháng thể trực tiếp chống lại các thụ thể nicotinic trên motor end plate (là một vùng đặc biệt hậu synapse của tế bào cơ). Bước nào tiếp theo là thích hợp nhất để đánh giá bệnh nhân này?
- Phân tích dịch não tủy
- Hình ảnh học cột sống cổ
- Chụp CT scan ngực
- Siêu âm tim
- MRI não
- Không cần xét nghiệm thêm
- Soi mắt với đèn khe
Đáp án C: Chụp CT ngực.
Bệnh nhân này bị chứng song thị, mệt mỏi và yếu cổ đã khỏi khi nghỉ ngơi và mắc bệnh nhược cơ (MG), một rối loạn thần kinh cơ gây ra bởi các tự kháng thể trực tiếp chống lại các thụ thể acetylcholine nicotinic tại khớp nối thần kinh cơ. Thông thường, bệnh nhân trải qua tình trạng yếu cơ dao động và mệt mỏi liên quan đến cơ mắt (ví dụ: song thị, sụp mi) và/hoặc cơ hành não(ví dụ: chứng khó nuốt, chứng khó đọc), thường nặng hơn vào cuối ngày và sẽ hết khi nghỉ ngơi. Chẩn đoán xác định bằng xét nghiệm tìm kháng thể thụ thể acetylcholine (AChR), có tính đặc hiệu cao.
Bệnh nhân đã được chẩn đoán MG nên được chụp phim ngực (ví dụ: CT scan, MRI) để đánh giá u tuyến ức. Tuyến ức tham gia vào quá trình biệt hóa tế bào T, tế bào này có thể kích thích sản xuất tế bào B/kháng thể và có thể liên kết với AChR. Bất thường tuyến ức gặp ở hầu hết bệnh nhân có kháng thể AChR, với tăng sản tuyến ức ở ~70% và u tuyến ức ở ~15% trường hợp. Hình ảnh ngực giúp lập kế hoạch phẫu thuật khả thi, vì cắt bỏ tuyến ức có liên quan đến cải thiện lâm sàng lâu dài ở cả bệnh nhân có và không có u tuyến ức (Lựa chọn F).
(Lựa chọn A và E) Phân tích dịch não tủy và chụp cộng hưởng từ não có thể được sử dụng để đánh giá các bệnh thoái hóa myelin (ví dụ: bệnh đa xơ cứng). MRI có thể được xem xét để đánh giá các tổn thương hệ thần kinh trung ương (ví dụ khối u, đột quỵ) ở bệnh nhân nhìn đôi. Tuy nhiên, kháng thể thụ thể acetylcholine không phải là đặc trưng của các bệnh này.
(Lựa chọn B) Chụp cột sống cổ có thể phát hiện bệnh thoái hóa đốt sống cổ, bệnh có thể gây đau cổ và bệnh lý rễ thần kinh cổ, dẫn đến suy yếu các cơ liên quan (thường ở cánh tay hoặc vai). Tuy nhiên, tình trạng yếu sẽ không dao động và thị lực sẽ không bị ảnh hưởng .
(Lựa chọn D) Siêu âm tim được sử dụng để đánh giá cấu trúc và chức năng của tim và van tim (phân suất tống máu). Nó không được sử dụng để đánh giá tuyến ức và ít cụ thể hơn so với hình ảnh chụp ngực,
(Lựa chọn G) Khám mắt bằng đèn khe thường được sử dụng để đánh giá các bất thường ở phần trước của mắt (ví dụ: kết mạc, giác mạc, tiền phòng, mống mắt). Bệnh nhân này khám mắt bình thường và không bị đau hoặc đỏ nên khó có khả năng xảy ra các bất thường ở phía trước mắt.
Kết luận:
Các bệnh nhân có các đặc điểm của bệnh nhược cơ (ví dụ, yếu cơ nhãn cầu/hành não dao động và mệt mỏi) nên được xét nghiệm xác nhận các kháng thể thụ thể acetylcholine, có tính đặc hiệu cao. Những người có chẩn đoán đã được xác định sau đó nên chụp hình ngực (ví dụ: chụp CT, MRI) để đánh giá u tuyến ức và lập kế hoạch phẫu thuật khả thi, vì cắt bỏ tuyến ức có liên quan đến cải thiện lâm sàng lâu dài ở cả bệnh nhân có và không có u tuyến ức.
Câu 2
Bệnh nhân nữ 44 tuổi đi khám vì yếu cơ trong vài tháng qua. Cô gặp khó khăn trong việc chải tóc và đôi khi khó ngẩng đầu lên, đặc biệt là sau khi ngồi hoặc đứng lâu. Bệnh nhân không gặp khó khăn khi đi lại hoặc đứng dậy khỏi ghế. Cô ấy cũng đã có 2 đợt nhìn đôi khi lái xe từ nơi làm việc về nhà. Bệnh nhân dùng rosuvastatin để điều trị tăng lipid máu và lisinopril để điều trị tăng huyết áp. Huyết áp là 142/84 mm Hg và mạch là 76/phút. Khám thần kinh cho thấy sụp mi nhẹ bên phải, yếu cơ gốc chi (proximal muscle) đối xứng ở chi trên và yếu cơ duỗi ở đầu. Khối lượng cơ và trương lực cơ bình thường và không có hiện tượng đau cơ. Vị trí nào sau đây có khả năng xảy ra bệnh lý nhất ở bệnh nhân này?
- Motor cortex
- Motor neuron axons
- Motor end plate
- Motor neuron cell body
- Muscle fascicles
- Subcortical nuclei
- White matter tracts
Đáp án: B. Motor end plate
Tùy thuộc vào các dấu hiệu lâm sàng, yếu cơ có thể do rối loạn của nơ-ron vận động trên, nơ-ron vận động dưới, dây thần kinh ngoại vi, khớp nối thần kinh cơ (neuromuscular junction – NMJ) hoặc sợi cơ. Bệnh nhân này bị sụp mi và yếu cơ gốc chi gây mệt mỏi nhiều hơn khi vận cơ kéo dài (ví dụ: sau khi làm việc, khi ngẩng đầu lên khi ngồi/đứng, khi chải tóc) có khả năng mắc bệnh nhược cơ.
Bệnh nhược cơ là một rối loạn NMJ gây ra bởi các tự kháng thể kháng lại các thụ thể acetylcholine ở motor end plate. Bệnh nhân thường có yếu mỏi cơ ngoài nhãn cầu dao động (ví dụ: song thị, sụp mi) và cơ hành tủy – bulbar (ví dụ: loạn vận ngôn, khó nuốt). Bệnh nhân cũng có thể bị yếu cơ gốc chi đối xứng liên quan đến cổ (ví dụ: khó giữ đầu) và các chi trên (ví dụ: khó chải tóc). Cảm giác, phản xạ, khối lượng/trương lực cơ và chức năng tự chủ thường nguyên vẹn.
(Lựa chọn A) Đột quỵ là một ví dụ về tổn thương vỏ não vận động (tế bào thần kinh vận động trên) có thể gây liệt mềm cấp tính đối bên, sau đó là liệt cứng và tăng phản xạ. Bệnh nhân thường không có yếu cơ khi mệt (fatigable weakness) hoặc sụp mi cải thiện khi nghỉ ngơi.
(Lựa chọn C) Hội chứng Guillain-Barré gây ra bởi quá trình hủy myelin do viêm (inflammination demyelination) và/hoặc bệnh lý thần kinh sợi trục vận động (motor axonal neuropathy), dẫn đến liệt cơ tăng dần đối xứng tiến triển nhanh chóng. Các triệu chứng thường xảy ra sau khi bị nhiễm trùng (ví dụ: Campylobacterjejuni, vi rút) và liên quan đến giảm/mất phản xạ và dị cảm.
(Lựa chọn D) Bệnh xơ cứng teo cơ một bên (amyotrophic lateral sclecrosis) được đặc trưng bởi sự thoái hóa nơ-ron vận động tiến triển, dẫn đến các dấu hiệu của nơ-ron vận động trên (ví dụ: liệt cứng) và nơ-ron vận động dưới (ví dụ: teo cơ, co cứng cơ). Bệnh nhân thường yếu chi không đối xứng và yếu cơ hành tủy, rung giật cơ.
(Lựa chọn E) Bệnh cơ và viêm đa cơ do statin gây ra là do viêm các bó cơ. Bệnh nhân thường có biểu hiện yếu cơ gốc chi (ví dụ, khó đứng dậy khỏi ghế) và đau nhẹ ảnh hưởng đến cả chi trên và chi dưới. Thường không có yếu cơ nhãn cầu và cơ hành tủy.
(Lựa chọn F) Tổn thương nhân dưới vỏ não (ví dụ: hạch nền) thường dẫn đến các dấu hiệu ngoại tháp (ví dụ: cứng khớp, vận động chậm, run, múa giật) chẳng hạn như các dấu hiệu gặp ở bệnh Parkinson hoặc bệnh Huntington.
(Lựa chọn G) Bệnh đa xơ cứng được đặc trưng bởi quá trình khử myelin tự miễn của các bó chất trắng trong hệ thống thần kinh trung ương. Bệnh thường ảnh hưởng đến phụ nữ dưới 50 và có biểu hiện thiếu hụt thần kinh lan tỏa theo không gian và thời gian (ví dụ: viêm dây thần kinh thị giác, liệt vận nhãn gian nhân, viêm tủy), không yếu cơ gốc chi và cơ ngọai nhãn cầu khi mệt mỏi như ở bệnh nhân này.
Kết luận:
Rối loạn khớp nối thần kinh cơ thường được đặc trưng bởi yếu cơ khi không có dấu hiệu nơ ron vận động trên hoặc dưới. Bệnh nhược cơ là một bệnh thần kinh cơ thường có biểu hiện yếu mỏi dao động cơ ngoại nhãn cầu (ví dụ: song thị, sụp mi) và cơ hành tủy (ví dụ: loạn vận ngôn, chứng khó nuốt) cũng như yếu cơ gốc chi khi mệt đối xứng ở cổ và các chi (trên nhiều hơn dưới).
Câu 3
Bệnh nhân nam 65 tuổi đi khám vì sụp mi mới khởi phát. Sáng sớm, bệnh nhân đã phẫu thuật thay khớp gối toàn bộ bên phải để điều trị thoái hóa khớp tiến triển mà không có biến chứng phẫu thuật. Khi ở trong phòng hồi sức sau phẫu thuật, ông ấy gặp khó khăn khi mở mắt trái và nói ngọng. Bệnh nhân chưa bao giờ có các triệu chứng này và khám thần kinh trước mổ không có gì đặc biệt. Ông ta không có tiền sử nhìn đôi, khó nuốt hoặc yếu tay chân. Tiền sử bệnh lý bao gồm đột quỵ do thiếu máu cục bộ không có di chứng, đái tháo đường týp 2, tăng huyết áp và tiền sử hút thuốc 20 gói.năm. Nhiệt độ là 36,7 C (98,1 F), huyết áp là 150/90 mmHg, mạch là 92 nhịp/phút và nhịp thở là 12 nhịp/phút. Khám thần kinh cho thấy sụp mi hai bên, bên trái nặng hơn bên phải. Đồng tử có kích thước bằng nhau và phản xạ ánh sáng. Một túi nước đá được đặt trên mí mắt khép kín trong 2 phút, giúp cải thiện tình trạng sụp mi. Nguyên nhân nào sau đây có khả năng nhất gây ra các triệu chứng hiện tại của bệnh nhân này?
- Acetylcholine receptor antibodies
- Disruption of the oculosympathetic chain
- Impaired presynaptic calcium channels
- Inflammation and edema of the facial nerve
- Ischemic oculomotor nerve palsy
- Posterior communicating artery aneurysm
Đáp án: A. Acetylcholine receptor antibodies.
Các triệu chứng của bệnh nhân này liên quan đến bệnh nhược cơ (MG – Myasthenia gravis), thoái hóa các thụ thể acetylcholine qua trung gian tự kháng thể tại các khớp nối thần kinh cơ. MG thường xuất hiện ở độ tuổi 60-80 ở nam giới và từ 20-30 ở nữ giới với tình trạng yếu mỏi dao động liên quan đến các cơ ngoại nhãn (ví dụ: sụp mi, nhìn đôi) và cơ hành tủy (ví dụ: chứng khó nuốt, chứng khó đọc). Tình trạng yếu có thể trầm trọng hơn do nhiều yếu tố khác nhau bao gồm thuốc (ví dụ: aminoglycoside, magiê, thuốc chẹn beta, thuốc ức chế thần kinh cơ), phẫu thuật (đặc biệt là cắt bỏ tuyến ức), mang thai hoặc nhiễm trùng. Bệnh nhân này có khả năng đã tiếp xúc với chất ức chế thần kinh cơ (ví dụ, rocuronium) trong khi đặt nội khí quản, điều này làm xuất hiện ra các triệu chứng.
Chẩn đoán MG có thể được hỗ trợ bằng test ice pack, trong đó một túi nước đá được chườm lên mí mắt trong vài phút, giúp cải thiện tình trạng sụp mi. Nhiệt độ lạnh giúp cải thiện sức mạnh cơ bắp bằng cách ức chế sự phân hủy acetylcholine tại điểm nối thần kinh cơ, do đó làm tăng khả năng cung cấp acetylcholine cho thụ thể nicotinic. Bệnh nhân có kết quả nghiệm pháp dương tính nên cần xét nghiệm xác định MG với acetylcholine receptor antibodies (đặc hiệu cao).
(Lựa chọn B) Tổn thương của chuỗi hạch giao cảm mắt (disruption of the oculosympathetic chain) gây ra hội chứng Horrner, được biểu hiện bởi sụp mi cùng bên, đồng tử co và giảm tiết mồ hôi.
(Lựa chọn C) Hội chứng nhược cơ Lambert~Eaton, một rối loạn cận ung thư liên quan đến ung thư phổi tế bào nhỏ, được gây ra bởi các tự kháng thể chống lại các kênh canxi tiền synap trong khớp nối thần kinh cơ (impaired presynaptic calcium channels), dẫn đến giảm giải phóng acetylcholine. Bệnh nhân thường có yếu cơ gốc chi tiến triển từ từ và giảm phản xạ gân sâu. Mặc dù các biểu hiện ở mắt (ví dụ: song thị, sụp mi) có thể xảy ra, nhưng chúng thường không phải là triệu chứng biểu hiện và sẽ không cải thiện khi đáp ứng với thử nghiệm chườm đá.
(Lựa chọn D) Liệt Bell được đặc trưng bởi tình trạng viêm và phù nề dây thần kinh mặt (thường do herpes simplex hoạt động) và thường có biểu hiện liệt mặt một bên khởi phát đột ngột.
(Lựa chọn E và F) Liệt dây thần kinh vận nhãn (giãn đồng tử, sụp mi, và lé ngoài và xuống dưới) có thể xảy ra khi chèn ép dây thần kinh (ví dụ, do phình động mạch thông sau hoặc thoát vị hồi móc) hoặc thiếu máu cục bộ thần kinh vi mạch ( ví dụ, do đái tháo đường). Chèn ép dây thần kinh có nhiều khả năng gây giãn đồng tử hơn, vì các sợi đối giao cảm nằm ở ngoại vi của dây thần kinh vận nhãn.
Kết luận:
Việc chẩn đoán bệnh nhược cơ có thể được hỗ trợ bằng test ice pack.. Trong nghiệm pháp này, một túi nước đá được chườm lên mí mắt trong vài phút, giúp cải thiện tình trạng sụp mi. Bệnh nhân có kết quả xét nghiệm dương tính cần được xét nghiệm xác định kháng thể thụ thể acetylcholine (độ đặc hiệu cao).
Câu 4
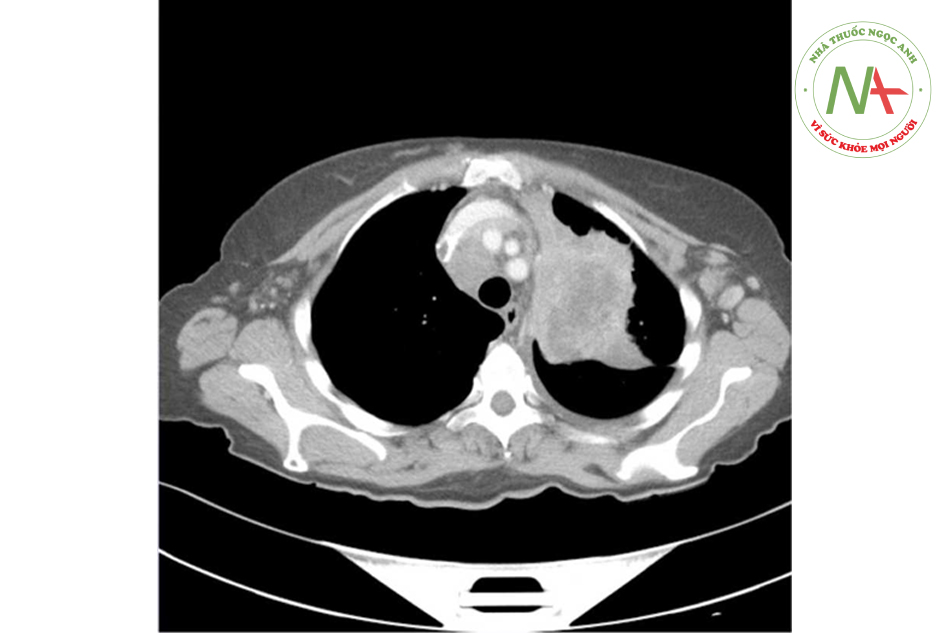
Bệnh nhân nữ 65 tuổi đi khám vì ho tiến triển trong vài tháng và yếu toàn thân. Bệnh nhân bị hạn chế vận động và khó thở do thoái hóa khớp và bệnh phổi tắc nghẽn mãn tính. Bà ấy cũng gặp khó khăn khi đứng khỏi ghế, chải đầu và đặt bát đĩa trên tủ trên cao. Tiền căn bao gồm tăng huyết áp và tăng lipid máu. Bà ấy đã bỏ thuốc lá cách đây 2 năm nhưng trước đó hút 3 gói mỗi ngày từ năm 20 tuổi. Huyết áp là 112/70 mm Hg, và mạch là 92/phút. BMl là 17 kg/m2. Khám thực thể cho thấy yếu vừa ở các cơ gốc chi ở chi trên và chi dưới và mất phản xạ gân sâu. CT scan của ngực được hiển thị dưới đây.
- Acute inflammatory demyelinating polyneuropathy
- Autoantibodies against post-synaptic receptors
- Autoantibodies to voltage-gated calcium channels
- Immune-mediated muscle inflammation
- Multicentric central nervous system inflammation and demyelination
- Upper and lower motor neuron degeneration
Đáp án: C. Autoantibodies to voltage-gated calcium channels
Biểu hiện của bệnh nhân này phù hợp với hội chứng nhược cơ Lambert-Eaton (LEMS Lambert Eaton myasthenic syndrome), một rối loạn thần kinh cơ gây ra bởi các tự kháng thể chống lại các voltage-gated calcium channels ở đầu dây thần kinh vận động trước synapse dẫn đến giảm giải phóng acetylcholine và sau đó là yếu cơ. Khoảng 50% trường hợp có liên quan đến bệnh ác tính tiềm ẩn, chủ yếu là ung thư phổi tế bào nhỏ. Tiền sử hút thuốc lâu dài của bệnh nhân này và biểu hiện gần đây với ho, yếu cơ, chỉ số BMI thấp và khối ở phổi trên CT scan ngực có liên quan đến bệnh ác tính.
Ban đầu, bệnh nhân có yếu cơ gốc chi đối xứng tiến triển (ví dụ: đứng trên ghế, chải tóc, đặt bát đĩa lên tủ trên cao). Phản xạ gân sâu bị giảm/không có, mặc dù vận động cơ bắp mạnh có thể cải thiện phản xạ và sức mạnh cơ bắp tạm thời. Rối loạn chức năng tự chủ (ví dụ khô miệng, rối loạn cương dương) cũng phổ biến.
Chẩn đoán được xác định bằng cách xét nghiệm các tự kháng thể chống lại các kênh canxi bị kiểm soát điện áp và bằng các xét nghiệm điện sinh lý. Bệnh nhân cũng nên được đánh giá và điều trị bệnh ác tính tiềm ẩn nguyên phát. Điều trị triệu chứng bao gồm guanidine hoặc 3,4-diaminopyridine để tăng mức độ acetylcholine trước synapse. Các triệu chứng kháng trị có thể đáp ứng với liệu pháp miễn dịch bằng globulin miễn dịch tiêm tĩnh mạch hoặc thuốc ức chế miễn dịch đường uống (ví dụ corticosteroid, azathioprine).
(Lựa chọn A) Bệnh viêm đa dây thần kinh hủy myelin cấp tínhh (hội chứng Guillain-Barré) được đặc trưng bởi yếu cơ cấp tính tăng dần với chứng mất phản xạ. Hầu hết bệnh nhân đều có bệnh do virus trước đó.
(Lựa chọn B) Bệnh nhược cơ (Myasthenia gravis) là do các tự kháng thể chống lại các thụ thể acetylcholine sau synapse ở khớp nối thần kinh cơ. Trái ngược với LEMS, những bệnh nhân bị nhược cơ thường có biểu hiện mỏi ở mắt (ví dụ: sụp mi, nhìn đôi) và yếu cơ hành tủy (ví dụ: thất ngôn), không thấy ở bệnh nhân này. Ngoài ra, bệnh nhược cơ sẽ không gây mất phản xạ. Cuối cùng, bệnh nhược cơ có liên quan kinh điển với u tuyến ức hơn là uphổi.
(Lựa chọn D) Viêm cơ qua trung gian miễn dịch gợi ý viêm đa cơ. Bệnh có thể xuất hiện với sự yếu cơ gốc chi. Tuy nhiên, các phản xạ thường được bảo tồn và các enzym cơ (ví dụ creatine kinase) thường tăng cao.
(Lựa chọn E) Viêm và mất myelin hệ thống thần kinh trung ương đa trung tâm là dấu hiệu của bệnh đa xơ cứng, thường xuất hiện ở phụ nữ tuổi 15-50 với các khiếm khuyết thần kinh lan tỏa theo không gian và thời gian (ví dụ: viêm dây thần kinh thị giác, liệt vận nhãn liên nhân).
Kết luận:
Hội chứng nhược cơ Lambert-Eaton thường liên quan đến bệnh ác tính tiềm ẩn (ví dụ ung thư phổi tế bào nhỏ). Bệnh được gây ra bởi các tự kháng thể trực tiếp chống lại oltage-gated calcium channels ở đầu dây thần kinh vận động trước synap dẫn đến yếu cơ gốc chi đối xứng với phản xạ gân cơ sâu bị suy giảm.
Câu 5
Bệnh nhân nữ 28 tuổi đi khám vì yếu. Bệnh nhân đang trong giai đoạn hậu sản tuần thứ 8 thì cảm thấy yếu liên tục ở chi trên và chi dưới. Chị ấy nói: “Tay tôi cảm thấy yếu sau khi bế em bé trong vài phút và tôi không thể nhấc bé lên cho đến khi tôi nghỉ ngơi một lúc. Tối hôm qua, tôi thậm chí không thể ra khỏi nhà vệ sinh, nhưng hôm nay, tôi cảm thấy khỏe.” Bệnh nhân cũng đã từng có những đợt nhìn mờ. Quá trình mang thai của cô rất phức tạp do bệnh tiểu đường thai kỳ, nhưng cô không mắc bệnh mạn tính nào. Thuốc duy nhất của bệnh nhân là vitamin tổng hợp hàng ngày. Cô ấy không sử dụng thuốc lá, rượu hoặc ma túy. Huyết áp là 120/68 mm Hg và mạch là 74 lần/phút. Khám thực thể cho thấy đồng tử trong và chuyển động ngoại nhãn bình thường. Áp lực tĩnh mạch cảnh không tăng, và nghe phổi không phát hiện bất thường. Không có phù chi. Phản xạ gân sâu và sức cơ của chi trên và chi dưới 2 bên bình thường. Chẩn đoán nào sau đây là có khả năng nhất?
- Diabetic amyotrophy
- Multiple sclerosis
- Myasthenia gravis
- Myotonic dystrophy
- Polymyositis
- Postpartum thyroiditis
Đáp án: C. Myasthenia gravis.
Người phụ nữ trẻ sau khi sinh này bị yếu cơ gốc chi khi mệt mỏi (fatigable proximal muscle weakness) và nhìn mờ từng đợt, các dấu hiệu gợi ý bệnh nhược cơ (MG – myasthenia gravis). MG là bệnh rối loạn thần kinh cơ được đặc trưng bởi các tự kháng thể nhắm vào các điểm nối thần kinh cơ sau synap, thường là các thụ thể acetylcholine. Bệnh phổ biến nhất ở phụ nữ trong độ tuổi sinh đẻ; Ngoài ra, phụ nữ mang thai và sau khi sinh có nguy cơ khởi phát và làm trầm trọng thêm bệnh. Nam giới ít bị ảnh hưởng hơn và thường xuất hiện các triệu chứng trễ hơni (tức là từ 60-80 tuổi)
MG được đặc trưng bởi sự yếu cơ khi mệt mỏi, dao động trở nên nặng hơn với các chuyển động lặp đi lặp lại (ví dụ: bế em bé trong một thời gian dài) và cải thiện khi nghỉ ngơi. Các triệu chứng thường nặng hơn vào cuối ngày hoặc sau khi tập thể dục. Sự tham gia của các cơ gần (ví dụ: cơ gậ hông, cơ tứ đầu đùi, cơ delta) có thể gây khó khăn khi ngồi hoặc nâng tay qua đầu. Cơ hành não (ví dụ, rối loạn vận ngôn, nhai mệt) và cơ nhãn cầu (ví dụ, nhìn mờ, sụp mi) cũng thường gặp. Mặc dù việc thăm khám cuối cùng thấy được sự yếu cơ khi vận động lặp đi lặp lại, nhưng nó thường là bình thường khi đánh giá ban đầu.
(Lựa chọn A) Bệnh teo cơ do đái tháo đường (Diabetic amyotrophy) thường gây đau khu trú, yếu và teo cơ ở đoạn gần của chân; bệnh có liên quan đến sụt cân. Bệnh hiếm khi gây ra triệu chứng ở chi trên và sẽ không liên quan đến thay đổi thị lực hoặc yếu dao động.
(Lựa chọn B) Bệnh đa xơ cứng (Multiple sclerosis) phổ biến ở phụ nữ trẻ và có thể gây ra các triệu chứng thần kinh (ví dụ: yếu cơ, nhìn mờ) ở các triệu chứng rời rạc. Tuy nhiên, các triệu chứng thường tái phát và giảm từ từ trong vài ngày đến vài tuần; yếu cơ khi mệt dao động trong ngày phù hợp hơn với MG.
(Lựa chọn D) Loạn dưỡng cơ (Myotonic dystrophy) thường gây ra yếu kéo dài, tăng dần và teo cơ mặt và các cơ xa (ví dụ: nhóm cơ intrinsic hand). Myotonia (chậm giãn cơ sau khi co) là thường gặp, và yếu cơ gần dao động là ngoài dự kiến.
(Lựa chọn E và F) Bệnh cơ (ví dụ, viêm đa cơ, bệnh cơ cường giáp) thường có biểu hiện yếu cơ gốc chi đối xứng, dai dẳng có thể liên quan đến đau cơ nhẹ và ấn đau. Tuy nhiên, yếu cơ khi mệt, dao động và các triệu chứng ở mắt không đặc trưng. Ngoài ra, viêm tuyến giáp sau sinh thường đi kèm với các dấu hiệu của cường giáp (ví dụ như sợ nóng, sụt cân, run).
Kết luận:
Bệnh nhược cơ được đặc trưng bởi sự yếu cơ khi mệt, dao động, nặng hơn khi cử động lặp đi lặp lại và cải thiện khi nghỉ ngơi. Các triệu chứng phổ biến bao gồm yếu cơ gần (ví dụ: khó đứng dậy khi ngồi), mắt (ví dụ: nhìn đôi, sụp mi) và cơ hành não (ví dụ: thất ngôn, khó nuốt). Bệnh nhân mang thai và sau khi sinh có nguy cơ mắc bệnh cao hơn.
Câu 6
Bệnh nhân nữ 38 tuổi đi khám vì các vấn đề về nuốt bắt đầu cách đây 1 tháng khi đang ăn tối. Bệnh nhân ăn được nửa bữa thì thấy khó nhai bít tết và không nuốt được. Từ đó bệnh nhân có 2 đợt tương tự gây trào ngược thức ăn và nước qua mũi. Cô có tiền sử bệnh trào ngược dạ dày thực quản và u màng não đã được cắt bỏ cách đây 4 năm. Bệnh nhân sử dụng omeprazole và thuốc nhỏ mắt không kê đơn khi cần thiết. Cô đã hút nửa gói thuốc lá mỗi ngày trong 16 năm và uống 1 đến 2 ly rượu mỗi ngày. Huyết áp của cô ấy là 138/76 mmHg và mạch là 82 lần/phút. Khám hầu họng bình thường. Nghe phổi là bình thường. Tiếng tim bình thường không có âm thổi. Bụng mềm và không chướng, không có tạng to. Cô ấy không yếu cơ hoặc mất cảm giác, và phản xạ bình thường. Nội soi đường tiêu hóa trên và đo áp lực thực quản bình thường. CT scan của ngực được hiển thị dưới đây. Nguyên nhân nào sau đây là có khả năng nhất gây ra các triệu chứng của bệnh nhân này?
- Decreased available acetylcholine receptors
- Decreased acetylcholine release from motor neurons
- Degeneration of myenteric plexus neurons
- Fibrous tissue replacement of smooth muscles
- Inflammatory demyelination of the axons
- Motor neuron degeneration and death
Đáp án: A. Decreased available acetylcholine receptors
Các triệu chứng của bệnh nhân này liên quan đến bệnh nhược cơ (MG – myasthenia gravis), một chứng rối loạn thần kinh cơ thường xuất hiện từ 20 đến 30 tuổi ở phụ nữ và từ 60-80 tuổi ở nam giới. Bệnh nhân thường bị yếu cơ khi mệt mỏi, dao động trở nên nặng hơn với các chuyển động lặp đi lặp lại của cùng một nhóm cơ và giảm khi nghỉ ngơi. Các triệu chứng ở mắt (ví dụ sụp mi, nhìn đôi) và rối loạn chức năng cơ hành não là những biểu hiện phổ biến nhất, gây mỏi cơ khi nhai, khó nuốt kèm theo trào ngược mũi họng và thất ngôn
MG được gây ra bởi các tự kháng thể (có nguồn gốc từ tuyến ức) trực tiếp chống lại các thụ thể nicotinic acetylcholine tại các synap thần kinh cơ. Liên kết kháng thể dẫn đến kích hoạt bổ thể với sự suy giảm thụ thể, gây ra sự giảm lan truyền điện thế hoạt động và yếu cơ. Hầu hết bệnh nhân có kháng thể thụ thể acetylcholine đều có bất thường về tuyến ức (ví dụ: u tuyến ức, tăng sản tuyến ức), có thể xuất hiện dưới dạng khối trung thất trước trên hình ảnh học. Bệnh nhân mắc bệnh MG thường được chụp CT ngực để đánh giá u tuyến ức vì việc cắt bỏ tuyến ức có thể giúp bệnh thuyên giảm lâu dài.
(Lựa chọn B) Ngộ độc thịt do thức ăn (Foodbome botulism) gây ra do giảm giải phóng acetylcholine từ đầu tận cùng trước synap thần kinh của các tế bào thần kinh vận động, dẫn đến khởi phát cấp tính các bệnh lý thần kinh sọ hai bên và liệt mềm đối xứng. Yếu cơ thường xảy ra trước triệu chứng tiêu hóa (ví dụ: buồn nôn/nôn, tiêu chảy).
(Lựa chọn C) Achalasia xảy ra do thoái hóa tế bào thần kinh trong đám rối thần kinh ruột. Bệnh nhân thường xuất hiện với sự khởi đầu từ từ, khó nuốt chất rắn và chất lỏng do không thể phối hợp nhu động và không thể giãn cơ thắt thực quản dưới (LES – lower esophageal sphincter). Đo vận động thực quản thường cho thấy tăng áp suất khi nghỉ của LES.
(Lựa chọn D) Xơ cứng hệ thống (Systemic sclerosis) là một bệnh mô liên kết được đặc trưng bởi sự xơ hóa của da và các cơ quan nội tạng. Liên quan đến đường tiêu hóa thường gây khó nuốt do mô xơ thay thế cơ trơn trong thực quản. Đo vận động thực quản cho thấy rối loạn vận động và áp lực LES thấp.
(Lựa chọn E) Bệnh đa xơ cứng (Multiple sclerosis) là một chứng rối loạn tự miễn dịch được đặc trưng bởi quá trình khử myelin gây viêm của các sợi trục trong hệ thần kinh trung ương, dẫn đến
tình trạng dấu thần kinh tiến triển theo không gian và thời gian. Viêm dây thần kinh thị giác (mất thị lực một mắt kèm theo đau khi cử động mắt) là biểu hiện ban đầu thường gặp.
(Lựa chọn F) Bệnh xơ cứng teo cơ bên (Amyotrophic lateral sclerosis) được đặc trưng bởi sự thoái hóa từ từ và chết của các tế bào thần kinh vận động. Bệnh nhân thường có các dấu hiệu nơ- ron vận động trên (ví dụ, co cứng, tăng phản xạ) và dưới (ví dụ, teo cơ, co giật).
Kết luận:
Bệnh nhược cơ (Myasthenia gravis) gây ra bởi sự thoái biến qua trung gian tự kháng thể của các thụ thể acetylcholine tại synap thần kinh cơ, thường dẫn đến yếu cơ khi mỏi của cơ nhãn cầu và cơ hành não. Hầu hết bệnh nhân có kháng thể kháng thụ thể acetylcholine đều có bất thường về tuyến ức (ví dụ: u tuyến ức, tăng sản tuyến ức), xuất hiện dưới dạng khối trung thất trước trên hình ảnh chụp ngực.
Câu 7
Bệnh nhân nữ 38 tuổi đi khám vì đau mãn tính và cứng khớp quanh cổ, vai, lưng dưới và hông. Ngay cả khi gắng sức nhẹ cũng làm cơn đau nặng hơn. Người bệnh cũng khó ngủ và thường xuyên tỉnh giấc giữa đêm. Thậm chí sau một đêm ngon giấc, cô ấy luôn cảm thấy mệt mỏi vào buổi sáng. Bệnh nhân không bị yếu cơ, sốt, sụt cân hoặc phát ban. Cô đã thử tập thể dục nhịp điệu dưới nước 3 lần một tuần nhưng không cải thiện triệu chứng. Cô có tiền sử mắc hội chứng ruột kích thích. Các dấu hiệu sinh tồn trong giới hạn bình thường. Thăm khám ghi nhận nhiều điểm đau tại các điểm bám tận và xương. Sức cơ là 5/5 ở tất cả các chi và phản xạ gân sâu là 2+ . Không có bất thường cảm giác được ghi nhận. Kết quả xét nghiệm như sau:
- Hematocrit: 43%.
- Leukocytes: 7,000/mm3.
- Platelets: 200,000/mm3.
- TSH: 3.0 μU/mL.
- Creatine kinase, serum: 60 U/L.
- Erythrocyte sedimentation rate: 9mm/h.
Liệu pháp nào sau đây là thích hợp nhất cho bệnh nhân này?
- Amitriptylin
- Colchicin
- Methotrexat
- Naproxen
- Oxycodon
- Prednisone
Đáp án: A. Amitriptylin
Biểu hiện của bệnh nhân này phù hợp với chứng đau cơ xơ hóa (FM – fibromyalgia). FM xuất hiện phổ biến nhất ở phụ nữ trẻ đến trung niên với đau lan rộng, mệt mỏi và rối loạn nhận thức/khí sắc. Bệnh nhân thường bình thường khi thăm khám ngoại trừ điểm đau ở các vùng như cơ thang đoạn giữa, lồi cầu ngoài, điểm nối sụn sườn và mấu chuyển lớn. FM không biểu hiện rõ ràng trên cận lâm sàng. Tiêu chuẩn sửa đổi năm 2010 của American College of Rheumatology đề xuất sử dụng chỉ số đau lan rộng và thang đo mức độ nặng của triệu chứng thay vì các điểm đau để chẩn đoán FM. Thang đo chỉ số và mức độ nặng nhấn mạnh tốt hơn các vấn đề về nhận thức, sự mệt mỏi và mức độ nghiêm trọng của các triệu chứng thực thể
Điều trị FM ban đầu nên tập trung vào giáo dục bệnh nhân, aerobic exercise thường xuyên và vệ sinh giấc ngủ tốt. Bệnh nhân không đáp ứng với các biện pháp bảo tồn có thể cần dùng thuốc. Thuốc chống trầm cảm ba vòng (ví dụ amitriptyline) là thuốc đầu tay được ưu tiên. Thuốc ức chế tái hấp thu serotonin và norepinephrine (ví dụ duloxetine, milnacipran) và thuốc pregabalin là những liệu pháp thay thế có thể hữu ích cho những bệnh nhân không đáp ứng với thuốc chống trầm cảm ba vòng. Bệnh nhân có các triệu chứng dai dẳng có thể cần điều trị bằng thuốc kết hợp, phục hồi chức năng có giám sát, tư vấn kiểm soát cơn đau hoặc liệu pháp hành vi nhận thức.
(Lựa chọn B và C) Colchicine được sử dụng để điều trị bệnh gút, thường biểu hiện bằng viêm 1 khớp khởi phát cấp tính. Methotrexate có thể điều trị hiệu quả các chứng viêm khớp (ví dụ: viêm khớp dạng thấp, viêm khớp vẩy nến), thường liên quan đến các dấu hiệu viêm tăng cao (ví dụ: tốc độ lắng hồng cầu [ESR], yếu tố thấp) và đau khớp. Tuy nhiên, cả hai loại thuốc đều không hiệu quả đối với FM.
(Lựa chọn D và F) Glucocorticoid (ví dụ: prednisone) và thuốc chống viêm không steroid (ví dụ: naproxen) có thể điều trị các tình trạng viêm có dấu hiệu viêm tăng cao (ví dụ: ESR, CRP). Tuy nhiên, FM không phải là tình trạng viêm và thường không đáp ứng với glucocorticoid hoặc thuốc chống viêm không steroid.
(Lựa chọn E) Opioids (ví dụ oxycodone), ngoại trừ tramadol, thường không được khuyên dùng cho FM vì có rất ít bằng chứng cho thấy chúng mang lại hiệu quả giảm đau đáng kể và nguy cơ (ví dụ: lạm dụng) lớn hơn lợi ích.
Kết luận:
Đau cơ xơ hóa là một hội chứng đau xảy ra phổ biến nhất ở phụ nữ trẻ đến trung niên và được đặc trưng bởi sự mệt mỏi, đau lan rộng và rối loạn nhận thức/khí sắc. Amitriptyline là một điều trị ban đầu hiệu quả. Pregabalin, duloxetine và milnacipran là những liệu pháp thay thế cho những bệnh nhân không đáp ứng với thuốc chống trầm cảm ba vòng.
Câu 8
Bệnh nhân nam 32 tuổi nhập viện khoa cấp cứu do đi lại khó khăn và thường xuyên bị ngã. Một tuần trước, anh ấy bị tê ở ngón chân và đầu ngón tay, tiến triển thành yếu chi dưới. Anh ta bị nhiễm trùng đường hô hấp trên 4 tuần trước và tự khỏi. Bệnh nhân không có vấn đề về đường ruột hoặc bàng quang. Tiền căng chưa ghi nhận bất thường. Thân nhiệt là 36.9° C (98.5° F), huyết áp là 130/70 mm Hg khi nằm ngửa và 100/62 mm Hg khi đứng, mạch 102 lần/phút và nhịp thở 18 lần/phút. Khám thực thể cho thấy yếu cơ ở cả hai chi dưới và mất phản xạ đầu gối và mắt cá hai bên. Kiểm tra cảm giác chưa ghi nhận bất thường. Chọc dò tủy sống được thực hiện và kết quả phân tích dịch não tủy như sau:
| Leukocytes | 3/uL |
| Glucose | 70 mg/dL |
| Protein | 120 mg/dL |
| Gram stain | No organisms |
Bước tiếp theo thích hợp nhất trong quản lý bệnh nhân này là gì?
- Cyclosporin
- Acyclovir tĩnh mạch
- Immunoglobulin tĩnh mạch
- Tiêm tĩnh mạch methylprednisolon
- Pyridostigmine
- Riluzole
Đáp án: C: Immunoglobulin tĩnh mạch
Bệnh nhân này bị yếu cơ đối xứng, tăng dần và không có phản xạ gân sâu sau khi mắc bệnh truyền nhiễm gần đây rất có thể mắc hội chứng Guillain-Barré (GBS). Bệnh nhân bị GBS cũng có thể xuất hiện các triệu chứng hành tủy (bulbar symptoms) (ví dụ, rối loạn vận ngôn) và suy hô hấp. Mặc dù GBS chủ yếu là bệnh đa dây thần kinh vận động, các triệu chứng cảm giác nhẹ như dị cảm và mất điều hòa cảm giác cũng có thể xảy ra. Bệnh nhân GBS có nguy cơ rối loạn chức năng hệ thần kinh tự chủ (ví dụ, rối loạn nhịp tim, hạ huyết áp tư thế, bí tiểu, tắc ruột, giảm tiết mồ hôi) do bệnh có ảnh hưởng đến hệ thống thần kinh tự chủ. Khoảng 2/3 bệnh nhân cũng phàn nàn về cơn đau dữ dội ở lưng hoặc tứ chi.
Chẩn đoán bằng lâm sàng cùng với chọc dò tủy sống (LP) và các xét nghiệm sinh lý thần kinh (ví dụ, điện cơ). LP cho thấy protein dịch não tủy tăng cao với số lượng bạch cầu bình thường (albuminocytologic dissociation).
Điều trị GBS bao gồm chăm sóc hỗ trợ (ví dụ: theo dõi các chức năng hô hấp và thần kinh tự động) và immunoglobulin tiêm tĩnh mạch (IVIG) hoặc lọc huyết tương. Cả IVIG và lọc huyết tương đều có lợi như nhau và việc lựa chọn phương pháp điều trị phụ thuộc vào các yếu tố nguy cơ cụ thể của bệnh nhân và điều trị.
(Lựa chọn A và E) Cyclosporine và pyridostigmine được sử dụng để điều trị bệnh nhược cơ (myasthenia gravis – MG). MG thường biểu hiện các triệu chứng ở mắt (ví dụ: sụp mi, nhìn đôi), yếu cơ dao động và nặng hơn vào cuối ngày. MG thường không liên quan đến bệnh trước đó và yếu cơ tăng dần nhanh chóng. Phản xạ gân sâu cũng bình thường ở MG.
(Lựa chọn B) Acyclovir tiêm tĩnh mạch được sử dụng để điều trị viêm não do herpes simplex, biểu hiện sốt, thay đổi tri giác, dấu thần kinh khu trú và co giật. Dịch não tủy thường cho thấy tăng tế bào lympho. Biểu hiện của bệnh nhân này không gợi ý viêm não do virus herpes simplex.
(Lựa chọn D) Glucocorticoid trước đây đã được sử dụng để điều trị GBS. Tuy nhiên, các nghiên cứu đã chỉ ra rằng chúng không có lợi và do đó không còn được khuyến cáo.
(Lựa chọn F) Riluzole được sử dụng trong điều trị bệnh xơ cứng teo cơ một bên (amyotrophic lateral sclerosis), biểu hiện bằng cả dấu hiệu neuron vận động trên và dưới. Biểu hiện cấp tính là không phổ biến vì bệnh tiến triển chậm trong một vài năm.
Kết luận:
Hội chứng Guillain-Barré (GBS) được đặc trưng bởi tình trạng yếu cơ tăng dần, các triệu chứng hành não (ví dụ, rối loạn vận ngôn) và suy hô hấp sau khi mắc bệnh trước đó như nhiễm trùng đường hô hấp hoặc đường tiêu hóa (đặc biệt là Campy/Obaderjejunr). Phân tích dịch não tủy cho thấy albuminocytologic dissociation. Điều trị GBS bao gồm globulin miễn dịch tiêm tĩnh mạch hoặc lọc huyết tương.
Câu 9
Bệnh nhân nữ 34 tuổi nhập viên khoa cấp cứu do khó thở tăng dần và ngủ gà (drowsiness) đã 2 ngày. Theo lời kể của chồng, cô gặp khó khăn trong việc nuốt thức ăn và suýt mắc nghẹn khi ăn tối ngày hôm qua. Một tuần trước, cô ấy đã được điều trị bằng ciprofloxacin vì nhiễm trùng đường tiết niệu. Bệnh nhân làm tình nguyện viên trong một thư viện địa phương và trong vài tháng qua đã phải giảm giờ làm việc do khó nâng sách lên và đặt chúng lên giá. Cô có uống rượu xã giao và không hút thuốc. Huyết áp của cô ấy là 142/90 mm Hg, mạch 92/phút, và nhịp thở 20/phút và thở nông. SpO2 93%/khí trời. Chỉ số BMI của bệnh nhân là 32 kg/m2. Bệnh nhận nói giọng mũi. Khám hô hấp ghi nhận phổi trong, thở co kéo cơ hô hấp phụ và di động thành bụng nghịch thường khi hít vào. Tiếng tim bình thường, không có âm thổi. Sức cơ giảm ở cả hai bên với phản xạ gân sâu bình thường. Không có phản xạ Babinski hai bên. Khí máu động mạch cho thấy pH 7,2, pCO2; 65 mm Hg và p02 90 mm Hg. Điều nào sau đây là chẩn đoán có khả năng nhất?
- Ngộ độc thực phẩm botulism
- Hội chứng Guillain-Barré
- Cơn nhược cơ (Myasthenic crisis)
- Hội chứng giảm thông khí do béo phì
- Viêm đa cơ (Polymyositis)
- Viêm não West Nile
Đáp án: C: Cơn nhược cơ
Bệnh nhân này rất có thể bị cơn nhược cơ như một biểu hiện sớm của bệnh nhược cơ. Bệnh nhược cơ thường xuất hiện vào năm 20 – 30 tuổi ở phụ nữ (và vào 60 -80 tuổi ở nam giới) với tình trạng yếu cơ dao động trở nên trầm trọng hơn trong ngày và thường liên quan đến bên cơ ngoài mắt (ví dụ: sụp mí mắt, nhìn đôi), nhóm cơ hành não (bulbar) (ví dụ: khó nhai, khó nuốt, nói giọng mũi), cơ gốc chi và cơ hô hấp.
Cơn nhược cơ là một biến chứng đe dọa tính mạng được đặc trưng bởi tình trạng yếu cơ hô hấp nghiêm trọng dẫn đến suy hô hấp (ví dụ: sử dụng cơ hô hấp phụ, thiếu oxy máu, nhiễm toan hô hấp). Bệnh nhân thường bị yếu cơ lan tỏa hoặc yếu nhóm cơ hành não ngày càng tăng trước khi khởi phát cơn nhược cơ. Tình trạng này có thể xảy ra do nhiễm trùng (ví dụ: nhiễm trùng đường tiết niệu), phẫu thuật, mang thai hoặc dùng thuốc (ví dụ: aminoglycoside, fluoroquinolones, macrolide, thuốc chẹn beta). Những bệnh nhân có đợt cấp nặng, suy hô hấp nên được theo dõi tại ICU và đặt nội khí quản để bảo vệ đường thở.
(Lựa chọn A) Ngộ độc botulism được đặc trưng bởi sự khởi phát đột ngột của tình trạng yếu đối xứng hai bên bắt đầu từ dây thần kinh mặt/sọ và giảm dần đến thân, các chi trên và sau đó là các chi dưới. Bệnh thường báo trước bằng 1 một triệu chứng tiêu hóa và có thể dẫn đến suy hô hấp nếu các cơ hô hấp bị ảnh hưởng.
(Lựa chọn B) Hội chứng Guillain-Barré được đặc trưng bởi tình trạng yếu đối xứng tăng dần liên quan đến giảm/mất phản xạ gân sâu và rối loạn chức năng tự chủ. Bệnh thường xảy ra sau khi nhiễm trùng đường hô hấp hoặc đường tiêu hóa trước đó (ví dụ: Campylobacterjejunr) và có thể cần hỗ trợ hô hấp nếu bệnh tiến triển đến các cơ hô hấp.
(Lựa chọn D) Mặc dù bệnh nhân này béo phì (BMl >30 kg/m2), nhưng hội chứng giảm thông khí do béo phì không liên quan đến khó nuốt hoặc yếu cơ và thường không gây suy hô hấp. Các triệu chứng (ví dụ buồn ngủ ban ngày quá mức, ngáy to) thường liên quan đến chứng ngưng thở khi ngủ do tắc nghẽn cùng xuất hiện.
(Lựa chọn E) Viêm đa cơ thường biểu hiện với sự khởi phát từ từ yếu cơ gốc chi đối xứng và đau cơ liên quan đến tăng enzym cơ (ví dụ creatine kinase). Yếu cơ hô hấp và suy hô hấp không đặc trưng.
(Lựa chọn F) Bệnh viêm não West Nile có đặc điểm là sốt, nhức đầu và lú lẫn. Nhiễm trùng West Nile xâm nhập thần kinh cũng có thể gây viêm tủy, dẫn đến hội chứng tê liệt cấp tính đặc trưng bởi sự liệt mềm không đối xứng ở các chi.
Kết luận:
Cơn nhược cơ là một biến chứng đe dọa tính mạng của bệnh nhược cơ được đặc trưng bởi sự yếu cơ hô hấp nghiêm trọng dẫn đến suy hô hấp. Các triệu chứng thường xảy ra trước khi tiến triển thành yếu cơ toàn thân hoặc nhóm cơ hành não (bulbar muscle). Tình trạng này có thể xảy ra do nhiễm trùng, phẫu thuật và một số loại thuốc (ví dụ, fluoroquinolones).
Câu 10
Bệnh nhân nam 68 tuổi bị bệnh nhược cơ nhập viện vì yếu dần. Bệnh nhân đã nhập viện trước đó 2 ngày do sốt, ho có đờm và đau ngực kiểu màng phổi. X-quang ngực cho thấy đông đặc thùy dưới phổi phải, điều trị bằng ceftriaxone và azithromycin đường tiêm tĩnh mạch. Ông ấy cũng đã được điều trị ngoại trú bằng pyridostigmine. Trong vài giờ qua, ông ấy đã trải qua tình trạng yếu cơ toàn thân tiến triển và không thể ho ra đàm. Thân nhiệt là 37,6 C (99,8 F), huyết áp là 130/70 mm Hg, mạch là 110/phút và nhịp thở là 25/phút. SpO2 là 89%/ cannula 4 lít/phút. Bệnh nhân có vẻ mệt mỏi, nhịp thở nhanh và nông, thỉnh thoảng có gurgling sound. Nghe phổi cho thấy ran nổ thô khắp phổi. Có yếu nhẹ tứ chi, nhưng phản xạ gân xương sâu bình thường. Dung tích sống của anh ấy bây giờ là 1,0 L so với 1,5 L tại thời điểm nhập viện, và khí máu động mạch cho thấy pH 7,27, pCO2 55 mm Hg và pO2 60 mmHg. Bệnh nhân được đặt nội khí quản và chuyển đến phòng ICU. Bước tiếp theo nào sau đây là tốt nhất trong quản lý bệnh nhân này?
- Chỉ the dõi kỹ
- Tăng liều pyridostigmine
- Tiêm tĩnh mạch atropin
- Thay huyết tương
- Cắt bỏ tuyến ức
Đáp án D: Thay huyết tương
Bệnh nhân bệnh nhược cơ (MG) này rất có thể bị cơn nhược cơ, đặc trưng bởi yếu cơ hô hấp nặng dẫn đến suy hô hấp. Các bệnh nhân thường bị yếu cơ toàn thân và cơ hành não ngày càng tăng (ví dụ, khó khạc đờm) trước khi bắt đầu cơn. Tình trạng này có thể khởi phát do nhiễm trùng (ví dụ: viêm phổi), phẫu thuật hoặc thuốc (ví dụ: azithromycin).
Bệnh nhân có tình trạng hô hấp xấu đi (ví dụ, giảm độ bão hòa oxy và dung tích sống) trước tiên nên được đặt nội khí quản để bảo vệ đường thở. Sau khi đặt nội khí quản, các thuốc ức chế acetylcholinesterase (ví dụ, pyridostigmine) được sử dụng trong điều trị hàng ngày đối với MG là một điều trị tạm thời giúp giảm tiết dịch dư thừa từ đường thở và nguy cơ hít sặc (Lựa chọn B).
Sau khi ổn định, bệnh nhân trong cơn nhược cơ cần được điều trị bằng globulin miễn dịch tiêm tĩnh mạch hoặc lọc huyết tương (ưu tiên) ngoài corticosteroid. Có thể xem xét liệu pháp điều hòa miễn dịch khác (ví dụ mycophenolate mofetil hoặc azathioprine), đặc biệt nếu liệu pháp corticosteroid không hiệu quả, nhưng thường cần vài tuần để đạt được hiệu quả lâm sàng.
(Lựa chọn A) Theo dõi sát và theo dõi sức cơ hô hấp (ví dụ: dung tích sống, lực hít vào tối đa) rất quan trọng trong việc kiểm soát cơn nhược cơ. Tuy nhiên, chỉ theo dõi thôi là chưa đủ vì bệnh nhân này cần được điều trị để đẩy lùi tình trạng suy hô hấp.
(Lựa chọn C) Thuốc kháng nhu động đường uống có chứa atropine có thể được sử dụng để điều trị tác dụng phụ muscarinic (ví dụ tiêu chảy) của liệu pháp kháng cholinesterase ở bệnh nhân mắc bệnh MG. Tuy nhiên, atropine tiêm tĩnh mạch không có vai trò gì trong việc điều trị nhược cơ.
(Lựa chọn E) Phẫu thuật cắt bỏ tuyến ức thường được khuyến cáo ở những bệnh nhân MG bị u tuyến ức vì nó có thể giúp cải thiện lâm sàng lâu dài. Tuy nhiên, nó không phải là lựa chọn tốt nhất tiếp theo ở bệnh nhân nguy kịch này
Kết luận:
Việc điều trị cơn nhược cơ kèm suy hô hấp bao gồm đặt nội khí quản, sau đó điều trị bằng lọc huyết tương (plasmapheresis)hoặc globulin miễn dịch tiêm tĩnh mạch) và corticosteroid.
Câu 11
Bệnh nhân nam 43 tuổi vì quay đầu không tự ý có tính chất chu kỳ và có xu hướng hướng đầu về bên phải. Khám thực thể cho thấy cơ ức đòn chũm trái phì đại. Chẩn đoán có khả năng nhất là gì?
- Bệnh Parkinson
- Run vô căn
- Múa giật (Chorea)
- Bệnh ngồi không yên (Akathisia)
- Rối loạn trương lực cơ
- Athetosis
- Hội chứng Tourette
- Hemiballismus
- Cơn giật cơ
Đáp án: E: Rối loạn trương lực cơ (Dystonia)
Bệnh nhân này bị chứng vẹo cổ (torticollis), một chứng loạn trương lực cơ của cơ ức đòn chủm (stemocleidomastoid muscle). Loạn trương lực cơ được định nghĩa là sự co cơ kéo dài dẫn đến xoắn vặn, cử động lặp đi lặp lại hoặc tư thế bất thường. Bệnh có thể là khu trú (chỉ ảnh hưởng đến một cơ) hoặc lan tỏa. Chứng vẹo cổ có thể là bẩm sinh, vô căn, thứ phát sau chấn thương hoặc viêm, hoặc do thuốc. Các loại thuốc gây ra tình trạng trên gồm thuốc chống loạn thần cổ điển, metoclopramide và prochlorperazine.
(Lựa chọn A) Bệnh Parkinson có đặc điểm là run khi nghỉ ngơi, vận động chậm, cứng cơ – rigidity và mất ổn định tư thế. Bệnh không liên quan đến loạn trương lực cơ khu trú.
(Lựa chọn B) Run vô căn là một dạng run có chủ đích ảnh hưởng đến các chi trên, đầu, giọng nói và các bộ phận khác của cơ thể. Chứng run vô căn sẽ hết trong khi ngủ và thường cải thiện khi uống rượu. Cứng cơ – rigidity và dystonia thường không có
(Lựa chọn C) Múa giật là một chứng rối loạn vận động được đặc trưng bởi các cơn co cơ ngắn, không đều và không chủ ý. Các chuyển động có xu hướng chảy từ vị trí này sang vị trí khác nhưng không lặp lại hoặc nhịp nhàng.
(Lựa chọn D) Akathisia là cảm giác bồn chồn khiến bệnh nhân phải di chuyển thường xuyên.
(Lựa chọn F) Athetosis thường là các chuyển động chậm chạp, quằn quại ảnh hưởng đến bàn tay và bàn chân. Các chuyển động của athetois là đặc trưng của bệnh Huntington. Múa giật và athetosis thường xảy ra cùng nhau.
(Lựa chọn G) Hội chứng Tourette là một chứng rối loạn được đặc trưng bởi các chuyển động và giọng nói lặp đi lặp lại, không tự ý, rập khuôn (stereotyped), được gọi là tics. Các tics thông thường bao gồm nhún vai, chớp mắt, nhăn nhó và nói tục (chửi thề).
(Lựa chọn H) Hemiballismus là hành động vung tay dữ dội một bên do tổn thương nhân dưới đồi đối bên – Hemiballismus rất gây rối nhưng có xu hướng tự giới hạn.
(Lựa chọn l) Myoclonus là hiện tượng giật cơ hoặc nhóm cơ không chủ ý. Không giống như múa giật, nó có thể nhịp nhàng hoặc theo khuôn mẫu và thường được bắt đầu bằng sự co thắt hoặc thư giãn (contraction or relaxation).
Kết luận:
Vẹo cổ là một dạng phổ biến của loạn trương lực cơ khu trú liên quan đến cơ ức đòn chũm. Bệnh có thể xảy ra vô căn nhưng thường liên quan đến thuốc. Ngừng (các) tác nhân gây bệnh có thể cải thiện các triệu chứng.
Câu 12
Bệnh sử
Bệnh nhân nam 67 tuổi đến bác sĩ thần kinh khám nhờ bác sĩ đa khoa của ông giới thiệu. Các triệu chứng gồm yếu và mất cơ bàn tay trái. Bệnh nhân nhận thấy triệu chứng yếu tay ngày càng nặng khi sử dụng bàn tay ví dụ sau khi dùng tuốt nơ vít. Bệnh nhân cũng thấy bị chuột rút các cơ cẳng tay. Gần đây đôi khi bệnh nhân thấy nghẹt thở sau khi uống chất lỏng. Tiền sử bản thân bình thường ngoại trừ tăng huyết áp 15 năm và nhồi máu cơ tim 3 năm. Các thuốc bệnh nhân sử dụng gồm simvastatin, aspirin và atenolol. Bệnh nhân là giảng viên trường đại học đã về hưu. Bệnh nhân sống cùng vợ và có 2 con đã trưởng thành. Bệnh nhân không hút thuốc và uống 1 chai rượu mỗi tuần.
Khám lâm sàng
Huyết áp 146/88 mmHg. Khám hệ tim mạch, hệ hô hấp và hệ tiêu hóa bình thường. Có sự mất các cơ chi trên, đặc biệt bàn tay trái. Quan sát thấy giật cơ 2 bên cẳng tay. Sức nặng hay trọng lực giảm hoàn toàn ở bàn tay trái và giảm nhẹ ở bàn tay phải. Trương lực cơ bình thường. Cơ nhị đầu và cơ tam đầu giật nhanh 2 bên. Không mất cảm giác. Có rối loạn ngôn ngữ nhẹ.
Câu hỏi
- Chẩn đoán là gì?
- Tiên lượng ra sao?
Trả lời
Bệnh nhân này rõ ràng có vấn đề thần kinh vận động trên bàn tay bị yéu, mất cơ và giật cơ. Chẩn đoán phù hợp nhất là bệnh thần kinh vận động. Đây là một bệnh thoái hóa có nguyên nhân không rõ ràng ảnh hưởng đén các thần kinh vận động của tủy sống, các nhân thần kinh sọ não và vỏ não vận động. Bệnh này thường xuất hiện từ 50-70 tuổi.
Yéu và mất cơ trên 1 bàn tay hoặc 1 cánh tay là triệu chứng phổ biến nhất. Yéu cơ là dấu hiệu hay gặp nhất sau gắng sức. Đau do chuột rút các cơ cẳng tay thường xuất hiện trong giai đoạn đầu của bệnh. Bệnh nhân có biểu hiện yéu chi trên, rối loạn ngôn ngữ nhẹ hoặc khó nuốt. Triệu chứng thực thể đặc trưng của bệnh cảnh này là giật cơ – sự co cơ nhanh bất thường của các đoạn cơ, gây ra do mất sức cơ vì tổn thương thần kinh vận động dưới. Như bệnh nhân này, các phản xạ có thể nhanh hơn vì mất té bào thần kinh vận động vỏ não. Không mất cảm giác.
Bệnh thần kinh vận động chia làm 5 loại:
- Xơ cứng teo cơ bên (thường gặp nhất, thần kinh vận động trên và dưới)
- Xơ cứng bên nguyên phát (thần kinh vận động trên)
- Teo cơ tiến triển (thần kinh vận động dưới)
- Tê liệt hành tủy (bulbar palsy) tiến triển (thần kinh vận động hành tủy dưới)
- Rối loạn biểu hiện cảm xúc không tự chủ (pseudobulbar palsy) (thần kinh vận động hành tủy trên)
Chẩn đoán khi bệnh nặng thì dễ dàng, nhưng trong giai đoạn đầu của bệnh khó chẩn đoán. Yéu chân tay kèm mệt mỏi có thể nhầm lẫn với bệnh nhược cơ (myasthenia gravis). Rối loạn ngôn ngữ và khó nuốt ở người lớn tuổi thường gặp hơn do rối loạn biểu hiện cảm xúc không tự chủ của bệnh lý mạch máu não. Bệnh lý tủy cổ là nguyên nhân thường gặp khác của mất và giật cơ chi trên mà không mất cảm giác. Các tổn thương đám rối thần kinh cánh tay do chấn thương hoặc xâm lấn của khối u đỉnh phổi (u Pancoast) có thể ảnh hưởng lên 1 cánh tay. Đây là một bệnh thần kinh ngoại biên vận động chiếm ưu thé gây triệu chứng yéu cơ đối xứng và giảm phản xạ.
Thật không may bệnh thần kinh vận động là bệnh diễn tiến và không thể chữa khỏi. Bệnh nhân có khuynh hướng yéu liệt co cứng chân. Tê liệt hành tủy (bulbar palsy) gây ra rối loạn ngôn ngữ và khó nuốt. Chức năng cơ vòng thường không bị ảnh hưởng. Trí tuệ nhìn chung cũng không bị ảnh hưởng.
Không thể điều trị khỏi hoàn toàn trong bệnh cảnh này. Thời gian sống trung bình từ lúc khởi phát triệu chứng là 2-4 năm. Bệnh nhân và gia đình sẽ phải được thông báo về chẩn đoán và tiên lượng bệnh. Điều trị hỗ trợ cần sự phối hợp đa ngành. Khi bệnh diễn tiến và khả năng giao tiếp kém đi, cần sự hỗ trợ từ các thiết bị máy tính. Nên cho ăn sau cắt dạ dày để cung cấp đủ năng lượng. Thông khí không xâm nhập có thể dùng để hỗ trợ khi suy hô hấp, nhưng thường tử vong do viêm phé quản phổi.
Ý chính
- Bệnh thần kinh vận động khởi đầu bằng các triệu chứng phổ biến nhất là yếu và mất cơ 1 bàn tay.
- Giật cơ là đặc trưng của bệnh cảnh này.
- Không mất cảm giác có thể giúp chẩn đoán phân biệt.
Câu 13
Bệnh sử
Bệnh nhân nữ 43 tuổi đến khám bác sĩ đa khoa của cô vì nhìn đôi, nhìn rõ hơn vào buổi tối cách đây 3 tháng. Bệnh nhân thấy khó khi ngẩn đầu lên, đặc biệt vào buổi tối. Bệnh nhân cảm thấy không thể ăn hết bữa ăn vì khó nhai. Chồng và bạn thấy giọng nói bệnh nhân trầm hơn. Bệnh nhân sụt 3kg trong 6 tháng. Bệnh nhân không có tiền sử bệnh trước đó. Bệnh nhân sống cùng chồng và 3 người con. Không hút thuốc và uống 15 đơn vị rượu mỗi tuần. Bệnh nhân không uống thuốc thường xuyên.
Khám lâm sàng
Bệnh nhân trông khỏe mạnh, khám hệ tim mạch, hệ hô hấp và hệ tiêu hóa bình thường. Sức cơ của các nhóm cơ hoàn toàn bình thường nhưng dường như giảm sau khi làm 1 nghiệm pháp lập đi lập lại. Trương lực cơ, sự phối hợp, phản xạ và cảm giác đều bình thường. Xuất hiện sa mi mắt 2 bên và nặng hơn khi nhìn lên kéo dài. Đồng tử có phản xạ, cử động mắt và soi đáy mắt bình thường.
Câu hỏi
- Chẩn đoán là gì?
- Các chẩn đoán phân biệt chính là gì?
- Điều trị bệnh nhân này thế nào?
Trả lời
Nguyên nhân yếu toàn thân của bệnh nhân nữ này là do bệnh nhược cơ. Nhược cơ do sự hiện diện của các kháng thể thụ thể acetylcholine gây suy giảm dẫn truyền thần kinh cơ. Đặc trưng của bệnh là ảnh hưởng đến cơ vận nhãn ngoài, cơ hành tủy, cổ và bả vai. Yếu cơ nặng hơn sau chuyển động lập đi lập lại, gây ra sự suy giảm acetylcholin ở các đầu tận cùng của tiền synape. Bệnh khởi phát từ từ. Sụp mi mắt trên liên quan đến nhìn đôi do yếu cơ vận nhãn ngoài. Các triệu chứng thường nặng lên vào buổi tối và cải thiện tốt hơn vào buổi sáng. Ở một số nhóm cơ xuất hiện tình trạng liệt vĩnh viễn. Trong những trường hợp nặng, bệnh nhân sẽ bị suy hô hấp.
Chẩn đoán phân biệt yếu cơ toàn thể
- Bệnh thần kinh vận động: gợi ý trên lâm sàng là giật cơ và sau đó yếu cơ rõ rệt.
- Loạn dưỡng cơ: yếu cơ chọn lọc xuất hiện trong 1 số bệnh đặc biệt (như loạn dưỡng cơ mặt vai cánh tay-facioscapulohumeral dystrophy). Thường có tiền sử gia đình.
- Loạn dưỡng cơ tăng trương lực: gây sụp mi mắt, hao mòn cơ cắn, cơ thái dương và cơ ức đòn chũm và teo cơ đoạn xa. Đặc trưng của bệnh là hói đầu vùng trán, mặt không biểu cảm và má hóp. Có thể teo tuyến sinh dục và chậm phát triển trí tuệ. Thường có tiền sử gia đình. Chẩn đoán xác định dựa vào điện cơ (EMG).
- Viêm đa cơ: khởi phát cấp hoặc mạn tính. Thường phát ban da và đau khớp. Creatine kinase tăng và chẩn đoán xác định bằng sing thiết cơ.
- Các bệnh cơ khác: nhiễm độc giáp, nhược giáp, bệnh Cushing, nghiện rượu.
- Các bệnh ác tính không di căn: u tuyến ức liên quan nhược cơ chiếm 10% số ca, hội chứng nhược cơ Eaton-Lambert liên quan ung thư biểu mô phổi tế bao nhỏ.
Một bác sĩ chuyên khoa thần kinh nên khám bệnh nhân này. Làm điện cơ (EMG) sẽ chứng minh các triệu chứng chính đáp ứng với các kích thích cực đại lập đi lập lại. Tiêm tĩnh mạch edrophonium (Tensilon) sẽ tăng sức cơ trong vài phút. Nên xét nghiệm máu để tìm kháng thể acetylcholin (chiếm 90%). Chụp cắt lớp vi tính (CT) ngực để tìm ung thư phổi hoặc u tuyến ức. Lựa chọn đầu tay là corticoide. Các thuốc kháng cholinesterase cải thiện nhiều sức cơ nhưng cũng có nhiều tác dụng phụ. Cắc tuyến ức nên được cân nhắc. Hiệu quả nhất trong vòng 5 năm sau khi được chẩn đoán và không có u tuyến ức.
Ý chính
- Nhược cơ là một nguyên nhân cúa mói cơ bất thường.
- Trong giai đoạn đầu, nhược cơ ảnh hưởng đến một số nhóm cơ đặc trưng.
References
- Bucelli R, Harms MB. Neuromuscular emergencies. Semin Neurol. 2015;35:683–9.
- Berardo A, DiMauro S, Hirano MA. Diagnostic algorithm for metabolic myopathies. Curr Neurol Neurosci Rep. 2010;10:118–26.
- Huerta-Alardín AL, Varon J, Marik PE. Bench-to-bedside review: rhab- domyolysis—an overview for clinicians. Crit Care. 2005;9:158–69.
- Filosto M, Cotti Piccinelli S, Lamperti C, et al. Muscle pain in mito- chondrial diseases: a picture from the Italian network. J Neurol. 2019;266:953–9.
- Argov Z. Drug-induced myopathies. Curr Opin Neurol. 2000;13:541–54.
- Bosch X, Poch E, Grau JM. Rhabdomyolysis and acute kidney injury. New Engl J Med. 2009;361:62–72.
- Dimauro S, Dimauro PM. Muscle carnitine palmityltransferase defi- ciency and myoglobinuria. Science. 1973;182:929–31.
- Strijkers GJ, Araujo ECA, Azzabou N, et al. Exploration of new con- trasts, targets, and MR imaging and spectroscopy techniques for neuromuscular disease—a workshop report of Working Group 3 of the Biomedicine and Molecular Biosciences COST Action BM1304 MyO MRI. J Neuromuscul Dis. 2019;6(1):1–30.
- Andreu AL, Hanna MG, Reichmann H, et al. Exercise intolerance due to mutations in the cytochrome b gene of mitochondrial DNA. N Engl J Med. 1999;341:1037–44.
- Bruno C, Dimauro S. Lipid storage myopathies. Curr Opin Neurol. 2008;21:601–6.
- van der Ploeg AT, kruijshaar ME, Toscano A, et al. European consen- sus for starting and stopping enzyme replacement therapy in adult patients with Pompe disease: a 10-year experience. Eur J Neurol. 2017;24:768–31.
- McDonald S, Bearcroft P. Compartment syndromes. Semin Musculoskelet Radiol. 2010;14:236.
- Grayston R, Czanner G, Elhadd k, et al. A systematic review and metaanalysis of the prevalence of small fiber pathology in fibromyal- gia: implications for a new paradigm in fibromyalgia etiopathogen- esis. Semin Arthritis Rheum. 2019;48(5):933–40.
- Chaudhry MA, Wayangankar S. Thyrotoxic periodic paralysis: a con- cise review of the literature. Curr Rheumatol Rev. 2016;12:190–4.
- Fournier E. Electrophysiological signs of muscle channelopathies by causal mutation. Rev Neurol. 2005;161:1251–9.
- Dalakas MC. Inflammatory muscle diseases: a critical review on pathogenesis and therapies. Curr Opin Pharmacol. 2010;10:1–7.
- Crum-Cianflone NF. Bacterial, fungal, parasitic, and viral myositis. Clin Microbiol Rev. 2008;21:473–94.
- Griffiths RD, Hall JB. Intensive care unit-acquired weakness. Crit Care Med. 2010;38:770–87.
- Upinder k, Dhand MD. Clinical approach to the weak patient in the intensive care unit. Respir Care. 2006;51:1024–41.
- Santoro L. The critical patient with acute polyneuritis. In: Proceedings of the 40th congress of the Italian Society of Neurology, Padua, 21–25 Nov 2009.
- Uncini A, yuki N. Electrophysiologic and immunopathologic cor- relates in Guillain-Barré syndrome subtypes. Expert Rev Neurother. 2009;9:869–84.
- Durand MC, Porcher R, Orlikowski D, et al. Clinical and electrophysi- ological predictors of respiratory failure in Guillain-Barré syndrome: a prospective study. Lancet Neurol. 2006;5:1021–8.
- Walgaard C, Lingsma HF, Drenthen J, et al. Prediction of respiratory insufficiency in Guillain-Barré syndrome. Ann Neurol. 2010;67:781–7.
- Bycroft J, Shergill IS, Chung EA, et al. Autonomic dysreflexia: a medi- cal emergency. Postgrad Med J. 2005;81:232–5.
- Truax BT. Autonomic dysturbances in the Guillain-Barré syndrome. Semin Neurol. 1984;4:462–8.
- Ventura P, Cappellini MD, Rocchi E. The acute porphyrias: a diagnos- tic and therapeutic challenge in internal and emergency medicine. Intern Emerg Med. 2009;4:297–308.
- Lin CS, krishnan AV, Lee MJ, et al. Nerve function and dysfunction in acute intermittent porphyria. Brain. 2008;131:2510–9.
- Greenberg SA. Acute demyelinating polyneuropathy with arsenic ingestion. Muscle Nerve. 1996;19:1611–3.
- Zhao G, Ding M, Zhang B, et al. Clinical manifestations and manage- ment of acute thallium poisoning. Eur Neurol. 2008;60:292–7.
- khan J, Morrison TB, Rich MM, et al. Early development of criti- cal illness myopathy and neuropathy in patients with severe sepsis. Neurology. 2006;67:1421–5.
- Novak kR, Nardelli P, Cofe TC, et al. Inactivation of sodium channels underlies reversible neuropathy during critical illness in rats. J Clin Invest. 2009;119:1150–8.
- Siddiqui MF, Bertorini TE. Hypophosphatemia induced neu- ropathy: clinical and electrophysiologic findings. Muscle Nerve. 1998;21:650–2.
- Thomas Pk, Ochoa J. Clinical features and differential diagnosis. In: Dyck PJ, Thomas Pk, Griffin JW, Low PA, Poduslo JF, editors. Peripheral neuropathy. 3rd ed. Philadelphia, PA: W.B. Saunders Co.; 1993. p. 749–68.
- Lo yL. Clinical and immunological spectrum of the Miller-Fisher syn- drome. Muscle Nerve. 2007;36:615–7.
- Mitsumoto H, Wilbourn AJ. Causes and diagnosis of sensory neuropa- thies: a review. J Clin Neurophysiol. 1994;11:553–67.
- koike H, Atsuda N, Adachi H, et al. Clinicopathological features of acute autonomic and sensory neuropathy. Brain. 2010;133:2881–96.

Bệnh nhân bị yếu cơ lan tỏa cấp tính có triệu chứng như thế nào?
Chào bạn, bệnh nhân bị yếu cơ lan tỏa cấp tính cso triệu chứng dai dẳng hoặc thay đổi thất thường, có liên quan đến đau cơ, sốt và tổn thương dưới da
Bệnh nhân rối loạn cảm giác cấp tính (kiểu ngoại biên) có triệu chứng như thế nào?
Chào bạn, bệnh thường đi kèm với mức độ đau khác nhau hoặc các triệu chứng liên quan khác có tính chất vận động.