Bệnh tiêu hóa, Bệnh truyền nhiễm
Viêm gan C: Nguyên nhân, chẩn đoán và hướng dẫn điều trị theo BMJ
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Để tải bài viết Viêm gan C: Nguyên nhân, chẩn đoán và hướng dẫn điều trị theo BMJ file PDF xin vui lòng click vào link ở đây.
Tóm tắt
◊ Lây truyền qua tiếp xúc qua da với máu của người nhiễm bệnh, thường gặp nhất là qua đường tiêm tiền chất gây nghiện hoặc truyền các chế phẩm máu bị nhiễm vi-rút ở các nước phát triển, hoặc qua thiết bị y tế hay nha khoa bị nhiễm vi-rút ở các nước có nguồn lực hạn chế.
◊ Sau khi phơi nhiễm cấp tính với vi-rút viêm gan C, khoảng 55% đến 85% bệnh nhân phát triển thành viêm gan C mạn tính. Hầu hết các trường hợp mắc bệnh đều không có triệu chứng; tuy nhiên, tình trạng viêm gan thường biểu hiện và có thể dẫn tới xơ hóa gan tiến triển.
◊ Mục tiêu của việc điều trị là tiêu diệt vi-rút, đạt đáp ứng virus bền vững và ngăn chặn tiến triển bệnh. Các liệu pháp kháng virus tác động trực tiếp đường uống là biện pháp điều trị tiêu chuẩn; biện pháp điều trị đang phát triển với tốc độ nhanh chóng.
◊ Biến chứng lâu dài của viêm gan C mạn tính bao gồm xơ gan hoặc ung thư biểu mô tế bào gan.
Thông tin cơ bản
Định nghĩa
Vi-rút viêm gan C (HCV) là loại vi-rút hướng gan lây nhiễm, thuộc họ Flavivirus.[1] Viêm gan C có thể có biểu hiện như bệnh cấp tính (ví dụ: mệt mỏi, đau khớp, vàng da) ở khoảng một phần ba số bệnh nhân; tuy nhiên, đa số bệnh nhân không có triệu chứng. Viêm gan C mạn tính là nguyên nhân dẫn tới tình trạng viêm gan và xơ hóa gan, trong đó có rất nhiều bệnh nhân sẽ phát triển thành xơ gan và suy gan hoặc ung thư gan sau khoảng 20 đến 50 năm. Viêm gan C hiếm khi tự khỏi ở các bệnh nhân mắc bệnh mạn tính.
Dịch tễ học
Viêm gan C dường như lưu hành dịch ở hầu hết các khu vực trên thế giới mặc dù tỷ lệ lưu hành bệnh không phân bố đều. Theo báo cáo của Tổ chức Y tế Thế giới, có khoảng 1,75 triệu người mắc mới viêm gan C năm 2015 (tỷ lệ mắc mới là 23,7 trên 100.000 người), nâng tổng số người sống chung với bệnh này lên 71 triệu người (1% dân số toàn cầu). Các khu vực châu Âu và Đông Địa Trung Hải có tỷ lệ lưu hành bệnh cao nhất (tương ứng là 2,3% và 1,5%).[6] Tỷ lệ mắc mới và tỷ lệ lưu hành bệnh và tỷ lệ lưu hành kiểu gen có khác biệt đáng kể theo khu vực địa lý và độ tuổi.[7] [8] Ở châu Âu, tỷ lệ lưu hành bệnh là từ 0,5% đến 2%.[9] Theo ước tính, ở Anh có 160.000 người đang phải sống chung với tình trạng nhiễm vi-rút viêm gan C (HCV) mạn tính.[10] Tỷ lệ lưu hành bệnh có thể cao ở mức 5% đến 15% ở một số khu vực trên thế giới và các khu vực khác nhau có dữ liệu về nguy cơ cũng như nhân khẩu học về độ tuổi khác nhau.[11] Kiểu gen 1 phổ biến nhất trên toàn thế giới, chiếm 46% tổng số ca bệnh, tiếp đến là kiểu gen 3 (22%) và các kiểu gen 2 và 4 (mỗi kiểu gen 13%).[7]
Tại Hoa Kỳ, ước tính có 4,6 triệu người đã bị mắc viêm gan C, trong đó có 3,5 triệu người hiện mắc. Các ca bệnh mới xuất hiện chủ yếu ở người da trắng trẻ tuổi, có tiền sử tiêm chích ma túy.[12] Tỷ lệ mắc mới mỗi năm giảm từ con số trung bình 240.000 người vào những năm 1980 xuống 30.500 người vào năm 2014.[12] [13] [14] Tuy nhiên, các ca bệnh cấp tính gia tăng từ năm 2010, với tỷ lệ mắc mới chung là 0,7 ca bệnh trong số 100.000 người vào năm 2014.[12]
Tại Anh Quốc, khoảng 214.000 người đang phải sống chung với viêm gan C mạn tính. Tỷ lệ lưu hành bệnh không giống nhau ở các khu vực tại Anh Quốc. Việc tiêm chích ma túy tiếp tục là yếu tố nguy cơ quan trọng nhất dẫn tới nhiễm bệnh.[10]
Tỷ lệ lưu hành bệnh cao hơn ở những nhóm đối tượng cụ thể như những người bị giam giữ hoặc sống trong các trại tập trung.[15] Các ca bệnh ở phụ nữ trong độ tuổi sinh đẻ tăng gấp đôi lên khoảng 30.000 ca bệnh tại Hoa Kỳ từ năm 2006 đến 2014, ước tính từ năm 2011 đến 2014 có 1700 trẻ sinh ra mắc HCV.[16] Trong số 36,7 triệu người đang sống chung với HIV trên toàn thế giới, có 2,3 triệu người từng mắc hoặc hiện mắc viêm gan C.[6]
Tỷ lệ mắc mới HCV thực tế có lẽ cao hơn vì những người mắc mới thường không có triệu chứng.[14]
Dự kiến số bệnh nhân mắc bệnh gan tiến triển gia tăng đáng kể, từ đó gánh nặng bệnh tật cũng tăng lên.[17] Một nghiên cứu thuần tập tại các hệ thống y tế Hoa Kỳ trên 11.000 bệnh nhân cho thấy rằng các bệnh nhân nhiễm HCV có tỷ lệ tử vong cao hơn 12 lần so với người không nhiễm HCV.[18]
Bệnh căn học
Vi-rút viêm gan C (HCV) thuộc họ Flavivirus.[1] Đây là loại vi-rút RNA sợi đơn, có vỏ ngoài, với hệ gen dài khoảng 10.000 nucleotide.
Vi-rút này lây truyền qua tiếp xúc với máu dưới da. Các thủ thuật y tế không an toàn (bao gồm quá trình thực hành tiêm không an toàn) và việc tiêm chích ma túy là những nguyên nhân hàng đầu dẫn tới các trường hợp mắc mới năm 2015.[6]
Các nguyên nhân ít gặp hơn là lây truyền qua quan hệ tình dục, trong giai đoạn chu sinh, sử dụng thuốc trong mũi, hoặc sau khi vô tình tiếp xúc với máu (ví dụ do lọc máu). Máu và các sản phẩm máu không được sàng lọc HCV cũng là những nguồn lây nhiễm. Khoảng 10% số người nhiễm HCV không ghi nhận được yếu tố nguy cơ nào.[19]
Tỷ lệ lây truyền trong giai đoạn chu sinh (lây truyền dọc) là 2,4%,[20] trong khi đó tỷ lệ lây truyền ngang là <1%.[21]
Sinh lý bệnh học
Sau khi nhiễm vi-rút cấp tính, có tới 45% bệnh nhân trẻ tuổi, khỏe mạnh có thể sản sinh một kháng thể mạnh mẽ và đáp ứng miễn dịch qua trung gian tế bào, từ đó có khả năng tự đào thải vi-rút.[22] Tuy nhiên, đa số bệnh nhân nhiễm bệnh không thể tiêu diệt vi-rút này. Điều này dẫn tới mắc bệnh mạn tính và tổn thương gan tiến triển.
Nhiễm vi-rút trong máu dai dẳng đi kèm với các mức độ viêm gan và xơ hóa gan thay đổi theo thời gian. Các nghiên cứu gần đây cho thấy khoảng hơn 50% tế bào gan có thể bị nhiễm vi-rút viêm gan C (HCV).[23] Nhiễm bệnh dai dẳng có thể do đáp ứng yếu của tế bào T CD4+ và CD8+ trong quá trình nhiễm bệnh cấp tính, khiến không thể kiểm soát sự nhân lên của vi-rút.[23] Nhiễm HCV cấp tính có đặc trưng là đồng nhiễm nhiều phân nhóm vi-rút có biểu hiện biến đổi di truyền đặc biệt đa dạng ở bệnh nhân.[24]
Khi hình thành tình trạng nhiễm mạn tính, HCV có thể không gây bệnh cho tế bào. Tổn thương gan có thể là kết quả của đáp ứng miễn dịch cục bộ mà chủ yếu là không đặc hiệu. Tình trạng viêm tại chỗ khởi phát quá trình xơ hóa, trong đó các tế bào hình sao ở gan đóng vai trò chính. Xơ gan phát triển thuận lợi nhờ các yếu tố như sử dụng rượu dài ngày, viêm gan nhiễm mỡ không do rượu và nhiễm đồng thời virus.[23]
Phân loại
Kiểu gen của vi-rút viêm gan C
Có 6 kiểu gen và hơn 50 phân nhóm.[2] [3]
- Ở Nhật Bản, Bắc Mỹ và Tây Âu, đa số các trường hợp nhiễm vi-rút có kiểu gen 1, 2 và 3. Phân nhóm 1a là kiểu gen phổ biến nhất tại Hoa Kỳ, còn phân nhóm 1b chiếm ưu thế tại châu Á và châu Âu.
- Kiểu gen 3 là kiểu gen chủ yếu ở Ấn Độ và Đông Nam Á.
- Kiểu gen 4 xuất hiện phổ biến hơn ở Trung Đông và ở Bắc và Trung Phi.
- Kiểu gen 5 được phát hiện ở Nam Phi và kiểu gen 6 ở Đông Nam Á.
Có thể dùng biện pháp xét nghiệm kiểu gen để phân biệt giữa các kiểu gen và phân nhóm. Sự khác nhau về phân nhóm có thể dẫn tới khác nhau đôi chút về khả năng đáp ứng với các liệu pháp kháng vi-rút.
Phòng ngừa
Ngăn ngừa sơ cấp
Sử dụng kim sạch/thay kim tiêm cho người tiêm chích ma túy được chứng minh giúp giảm nguy cơ lây truyền vi-rút viêm gan C (HCV).[39] Mặc dù lây truyền HCV qua đường tình dục rất ít xảy ra, tình dục an toàn là biện pháp phòng ngừa hợp lý ở những người có nhiều bạn tình và ở những người dương tính với HIV. Thực hành tiêm an toàn giúp giảm nguy cơ lây truyền và cần được khuyến khích. Cần sử dụng thiết bị y tế và nha khoa dùng một lần trong các thủ thuật y tế và nha khoa. Nguy cơ mắc HCV từ quá trình thực hành y tế không an toàn là rất thấp ở các nước phát triển.
Khám sàng lọc
Tại Anh Quốc, sàng lọc được cân nhắc đối với những người có nguy cơ nhiễm vi-rút cao (ví dụ những người tiêm chích ma túy). Khuyến cáo xét nghiệm ở những bệnh nhân: được truyền máu trước năm 1991 hoặc chế phẩm máu trước năm 1986; dùng chung kim tiêm hoặc các dụng cụ khác để tiêm thuốc; từng điều trị y tế hoặc nha khoa ở nước ngoài trong điều kiện không vô trùng; từng xăm hình, bấm khuyên, châm cứu, điện phân hoặc phun xăm thẩm mỹ sử dụng các dụng cụ có thể chưa được tiệt trùng; đã quan hệ tình dục không an toàn với người bị nhiễm (hoặc có thể nhiễm) viêm gan C; dùng chung dao cạo râu hoặc bàn chải đánh răng với người bị nhiễm (hoặc có thể nhiễm) viêm gan C.[51]
Tại Hoa Kỳ, Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ khuyến cáo xét nghiệm một lần ở các nhóm bệnh nhân sau:[45]
- Những người sinh từ năm 1945 đến 1965 (bất kể sinh ở quốc gia nào) mà không biết chắc nguy cơ trước đó
- Những người tiêm chích ma túy (đang dùng hoặc đã dùng, bao gồm cả những người chỉ từng tiêm chích một lần)
- Những người dùng tiền chất gây nghiện qua mũi (đang dùng hoặc đã dùng)
- Những người phải lọc máu trong thời gian dài (đang lọc hoặc đã lọc)
- Những người phơi nhiễm dưới da/không qua đường tiêu hóa trong trường hợp không được kiểm soát
- Nhân viên y tế, cấp cứu y tế và an toàn công cộng sau khi phơi nhiễm với kim tiêm, vật sắc nhọn hoặc phơi nhiễm niêm mạc với máu nhiễm HCV
- Trẻ sinh ra từ người mẹ nhiễm HCV
- Những người từng được truyền máu hoặc ghép tạng, bao gồm những người:
- Được thông báo rằng họ nhận được máu từ người hiến máu mà sau này có kết quả xét nghiệm dương tính với viêm gan C
- Được truyền máu/thành phần máu hoặc được ghép tạng trước tháng 7 năm 1992
- Truyền yếu tố đông máu dạng cô đặc sản xuất trước năm 1987
- Những người từng bị giam giữ
- Những người nhiễm HIV
- Những người vẫn đang có quan hệ tình dục chuẩn bị bắt đầu biện pháp dự phòng trước phơi nhiễm (PreP) với HIV
- Những người mắc bệnh gan mạn tính và/hoặc viêm gan mạn tính không rõ nguyên nhân (bao gồm tăng nồng độ alanine aminotransferase)
- Người hiến tạng đặc (đã qua đời và còn sống).
Tại Hoa Kỳ, Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh khuyến cáo nên cân nhắc sàng lọc ở những người tị nạn theo chương trình khám sức khỏe thường quy cho những người mới nhập cư.[52] Khuyến cáo xét nghiệm thường niên cho người có quan hệ đồng tính nam mà dương tính với HIV hoặc người tiêm chích ma túy. Cần xét nghiệm định kỳ cho những người khác đang có các yếu tố nguy cơ phơi nhiễm với viêm gan C.[45]
Nhóm Đặc trách về Dịch vụ Phòng bệnh của Hoa Kỳ (USPSTF) khuyến cáo không nên sàng lọc định kỳ để phát hiện nhiễm vi-rút viêm gan C (HCV), nhưng hiện đang khuyến cáo sàng lọc với những người có nguy cơ nhiễm vi-rút cao.[53] Viện Sức khỏe Quốc gia Hoa Kỳ (NIH) cũng khuyến cáo đẩy mạnh việc thực hiện xét nghiệm sàng lọc cho các nhóm đối tượng có nguy cơ nhiễm vi-rút cao, bao gồm những người tiêm chích ma túy và những người bị giam giữ.[42]
Trước đây đã từng có khuyến cáo nên sàng lọc theo quần thể cùng năm sinh (ví dụ sàng lọc tất cả những người sinh từ năm 1945 đến 1965) và phương pháp này có vẻ tiết kiệm chi phí.[54] [55] [56] CDC khuyến cáo sàng lọc một lần đối với những người được sinh ra trong khoảng từ năm 1945 đến 1965 vì đây là nhóm đối tượng có tỷ lệ lưu hành nhiễm HCV và bệnh liên quan cao một cách không tương xứng.[29] USPSTF cũng đã đưa ra khuyến cáo mức độ B về việc sàng lọc theo quần thể cùng năm sinh này, đó là cần kiểm tra HCV một lần trong đời ở các bệnh nhân được sinh ra trong khoảng từ năm 1945 đến 1965, bất kể có nhận thấy nguy cơ hay không.[53] Tuy nhiên, trong 2 năm kể từ khi khuyến cáo này được đưa ra, việc xét nghiệm ở nhóm đối tượng này về cơ bản không tăng và vẫn ở mức thấp.[57] Khuyến cáo này không áp dụng cho các nước khác do các phương pháp sàng lọc cụ thể sẽ phụ thuộc vào dịch tễ học tại địa phương.
Tất cả phụ nữ mang thai cần được xét nghiệm, lý tưởng là ngay từ khi bắt đầu chăm sóc trước sinh.[45]
Mặc dù có khuyến cáo xét nghiệm trẻ sinh ra bởi người mẹ nhiễm HCV (các hướng dẫn khuyến cáo xét nghiệm kháng thể HCV ở trẻ từ 18 tháng tuổi trở lên đã phơi nhiễm để tránh kết quả dương tính giả), một nghiên cứu thuần tập hồi cứu dựa trên quần thể đã cho thấy rằng có chưa đến một phần ba số trẻ sinh ra từ người mẹ nhiễm HCV tại một bệnh viện ở Hoa Kỳ được sàng lọc. Trong số trẻ được sàng lọc, khoảng một phần tư chưa được sàng lọc một cách tối ưu (ví dụ: các xét nghiệm kháng thể được thực hiện trước 18 tháng tuổi). Vì vậy, nhiều trường hợp trẻ em nhiễm HCV vẫn không được phát hiện.[58]
Thực hành sàng lọc có thể khác nhau giữa các quốc gia, đặc biệt, các nước phát triển có thể có các thực hành khác với các nước đang phát triển với cơ sở vật chất y tế hạn chế. Cần phải làm theo hướng dẫn tại địa phương. Ví dụ, trẻ sinh ra ở các nước có nguy cơ cao lây truyền qua điều trị y tế cần được xét nghiệm.
Ngăn ngừa thứ cấp
Viêm gan C là một bệnh cần khai báo tại Hoa Kỳ và một số quốc gia khác.
Cần kiêng rượu (kể cả việc thực hiện các biện pháp can thiệp để giúp dừng uống rượu), duy trì cân nặng cơ thể ở mức lý tưởng, tránh viêm gan A hoặc B (bằng cách tiêm vắc-xin) và tránh HIV bằng cách quan hệ tình dục an toàn. Việc uống rượu, béo phì hoặc đồng nhiễm vi-rút có thể làm tăng nhanh sự tiến triển của bệnh gan.
Các biện pháp phòng ngừa khác bao gồm:
- Tất cả các bệnh nhân bị viêm gan C và không có bằng chứng miễn dịch với viêm gan A hoặc B phải được tiêm phòng bằng các loại vắc-xin tương ứng.[42] [45] Tất cả các bệnh nhân bị xơ gan được khuyến cáo tiêm phòng vắc-xin chống phế cầu.[45]
- Bệnh nhân bị nhiễm HIV phải được khám sàng lọc viêm gan C.[42] Bệnh nhân bị nhiễm viêm gan C có nguy cơ nhiễm HIV phải được xét nghiệm HIV.
- Nguy cơ lây truyền qua đường tình dục là cực kỳ thấp (khoảng 0,3% mỗi năm) đối với các cặp một vợ một chồng mà chỉ có một người nhiễm vi-rút.[88] Do đó, CDC không khuyến cáo cụ thể nên quan hệ tình dục an toàn trong các trường hợp này.[89] Người dương tính với vi-rút viêm gan C (HCV) chỉ có một bạn tình được khuyến khích nên trao đổi với bạn tình về nguy cơ lây truyền vi-rút ở mức thấp. Tuy nhiên, người có nhiều bạn tình hoặc có nguy cơ bị bệnh lây truyền qua đường tình dục có tỷ lệ lây truyền là từ 0,4% đến 1,8% mỗi năm.[88] Nhóm có nguy cơ đặc biệt cao với lây truyền HCV qua đường tình dục là nam giới bị nhiễm HIV quan hệ tình dục với bạn tình nam bị nhiễm HIV.[90]
Chẩn đoán
Tiền sử ca bệnh
Tiền sử ca bệnh #1
Một người đàn ông 60 tuổi có biểu hiện chướng bụng tăng dần, nôn máu từng đợt và đi ngoài phân sẫm màu trong vài tháng. Bệnh nhân không bị đau ngực hay khó thở. Tiền sử bệnh và tiền sử gia đình trước đây không có gì đáng kể. Tiền sử phẫu thuật trước đây đáng chú ý là phẫu thuật lưng cần truyền máu vào năm 1990. Tiền sử xã hội đáng chú ý là thỉnh thoảng có uống rượu. Huyết áp là 110/80 mmHg. Kết quả khám lâm sàng đáng chú ý là sao mạch ở ngực trên, nữ hóa tuyến vú, nổi tĩnh mạch quanh rốn và dấu hiệu sóng vỗ. Kết quả khám các cơ quan khác bình thường.
Tiền sử ca bệnh #2
Một người đàn ông 62 tuổi tại New York ban đầu đến khám định kỳ. Thỉnh thoảng ông bị đau khớp hoặc đau cơ, và có dùng thuốc ức chế men chuyển và thuốc lợi tiểu thiazide để điều trị tăng huyết áp. Là nhân viên kế toán đã nghỉ hưu, ông không hút thuốc, uống 1 hoặc 2 cốc bia mỗi tuần và hiện không sử dụng ma túy. Kết quả khám lâm sàng bình thường, ngoại trừ tình trạng thừa cân. Kết quả sinh hóa máu thường quy bình thường nhưng kết quả xét nghiệm sàng lọc kháng thể virus viêm gan C (HCV) dương tính. Trong quá trình theo dõi, bệnh nhân lo lắng không biết mình có gặp các vấn đề về gan không. Ông từng nghe trên tivi rằng các loại thuốc uống mới dễ áp dụng hơn các phác đồ cũ sử dụng thuốc tiêm và ông hỏi về các bước chẩn đoán cũng như điều trị tiếp theo.
Các bài trình bày khác
Trong khoảng một phần ba số người nhiễm bệnh, phơi nhiễm ban đầu với vi-rút viêm gan C làm tăng khả năng bị bệnh cấp tính.[4] Thời kỳ ủ bệnh trước khi khởi phát các triệu chứng lâm sàng ở những người này là từ 15 đến 150 ngày.[5] Những người nhiễm bệnh cấp tính có thể xuất hiện triệu chứng mệt mỏi, đau khớp hoặc vàng da. Tuy nhiên, đa số các trường hợp nhiễm bệnh đều không có triệu chứng.
Cách tiếp cận chẩn đoán từng bước
Các xét nghiệm chẩn đoán vi-rút viêm gan C (HCV) được dùng để đưa ra chẩn đoán lâm sàng, ngăn chặn nhiễm vi-rút bằng cách sàng lọc máu của người hiến máu và đưa ra các quyết định liên quan đến điều trị y tế cho các bệnh nhân. Viêm gan C là một bệnh cần khai báo tại Hoa Kỳ và một số quốc gia khác.
Biểu hiện lâm sàng
Nhiễm khuẩn cấp tính
- Sau khi tiếp xúc với vi-rút, đa số bệnh nhân đều không có triệu chứng.[40]
- Khoảng 30% bệnh nhân có biểu hiện như mệt mỏi, đau khớp hoặc vàng da, đi kèm với tình trạng tăng aminotransferase huyết thanh thoáng qua, đặc biệt là alanine aminotransferase (ALT).[4]
- Suy gan tối cấp là tình trạng cực kỳ hiếm xảy ra.
- Một số bệnh nhân, đặc biệt là phụ nữ trẻ, sau đó sẽ tự thải trừ vi-rút. Tuy nhiên, đa số bệnh nhân sẽ phát triển thành nhiễm mạn tính.[41] Người da đen có khả năng tự thải trừ HCV kém nhất.[31]
Nhiễm bệnh mạn tính
- Nhiễm HCV mạn tính thường được định nghĩa là sự tồn tại RNA HCV trong máu kéo dài ít nhất 6 tháng.
- Các bệnh nhân thường không có triệu chứng nhưng có thể có biểu hiện của xơ gan mất bù (ví dụ: vàng da, cổ trướng, triệu chứng bệnh não gan) hoặc ung thư biểu mô tế bào gan. Đôi khi bệnh nhân có những biểu hiện ngoài gan (ví dụ: viêm mạch, biến chứng ở thận, rối loạn chuyển hóa porphyria).
- Cũng có thể chẩn đoán sau khi làm các xét nghiệm thường quy thấy aminotransferase huyết thanh tăng, tuy nhiên một số bệnh nhân có thể vẫn có mức aminotransferase huyết thanh bình thường.
- Các yếu tố ảnh hưởng đến sự phát triển của bệnh gan mạn tính bao gồm tuổi cao ở thời điểm nhiễm bệnh và giới tính nam.[38] Đồng mắc viêm gan B mạn tính và HIV hoặc uống nhiều rượu cũng có thể làm tăng nguy cơ mắc bệnh gan tiến triển.[42] Việc sử dụng cần sa hàng ngày liên quan chặt chẽ với xơ gan mức độ từ vừa đến nặng và gan nhiễm mỡ.[43] [44]
Các thăm dò
Khuyến cáo dùng xét nghiệm kháng thể HCV để chẩn đoán và nếu kết quả dương tính, cần xác nhận tình trạng hiện mắc bằng xét nghiệm RNA HCV nhạy. Ở các bệnh nhân nghi ngờ mắc bệnh gan và có kết quả xét nghiệm kháng thể HCV âm tính, khuyến cáo xét nghiệm RNA HCV hoặc xét nghiệm theo dõi đối với các kháng thể HCV nếu đã phơi nhiễm với vi-rút trong 6 tháng qua. Xét nghiệm RNA HCV cũng có thể được cân nhắc ở các bệnh nhân bị suy giảm miễn dịch. Xét nghiệm kháng thể HCV dương tính và RNA HCV âm tính thể hiện bệnh nhân không có bằng chứng hiện mắc (hay nhiễm vi-rút đang hoạt động). Việc đánh giá tình trạng nhiễm viêm gan B và HIV cũng được khuyến cáo.[45]
Nhiễm khuẩn cấp tính
- Sau khi phơi nhiễm với vi-rút, cơ thể có thể mất vài tuần để sinh ra các kháng thể kháng HCV. Ngoài ra, bệnh nhân cũng có thể tự thải trừ vi-rút tới 12 tuần sau khi phơi nhiễm cấp tính (ví dụ: vết thương do kim nhiễm bẩn đâm vào). Vì vậy, xét nghiệm sàng lọc như xét nghiệm miễn dịch enzym (EIA) có thể cho kết quả âm tính và cần lặp lại trong vòng 3 tháng.[42]
- Xét nghiệm RNA HCV là cần thiết để chẩn đoán nhiễm bệnh cấp tính. Xét nghiệm axit nucleic bao gồm phiên mã ngược, sau đó là PCR (phản ứng chuỗi polymerase), phân tích DNA chuỗi nhánh và khuếch đại qua trung gian phiên mã (TMA). Kết quả dương tính cho biết tình trạng nhiễm vi-rút đang hoạt động.[46] Không có xét nghiệm axit nucleic nào được ưu tiên; tuy nhiên TMA là xét nghiệm có độ nhạy cao nhất. Hầu hết các cơ sở y tế sử dụng PCR vì đây là xét nghiệm phổ biến nhất. Điều quan trọng cần nhớ là 15% đến 45% số người phơi nhiễm cuối cùng cũng có thể thải trừ vi-rút mà không cần điều trị.[22] Ở những bệnh nhân này, xét nghiệm kháng thể HCV sẽ vẫn cho kết quả dương tính, tuy nhiên do không còn nhiễm vi-rút huyết nên xét nghiệm axit nucleic sẽ trở nên âm tính.
- Aminotransferase huyết thanh, đặc biệt là ALT, có thể được dùng để đo mức độ hoạt động của bệnh, mặc dù độ nhạy và độ đặc hiệu thấp.
Nhiễm bệnh mạn tính
- Xét nghiệm sàng lọc bằng EIA giúp phát hiện các kháng thể kháng vi-rút. Các xét nghiệm axit nucleic tương tự được dùng cho tình trạng nhiễm bệnh cấp tính giúp xác nhận tình trạng nhiễm vi-rút trong máu ở bệnh nhân có EIA dương tính hoặc đánh giá hiệu quả của liệu pháp kháng vi-rút. Kết quả dương tính cho biết tình trạng nhiễm vi-rút đang hoạt động.[46] Kết quả EIA âm tính giả đôi khi xuất hiện ở các bệnh nhân bị suy giảm miễn dịch hoặc các bệnh nhân lọc máu.[42] Kết quả dương tính giả có thể xảy ra trong trường hợp bệnh tự miễn. Việc nghi ngờ kết quả dương tính giả hoặc âm tính giả đều cần phải xét nghiệm RNA HCV.
- Xét nghiệm thấm thấu miễn dịch tái tổ hợp (RIBA) đặc hiệu hơn EIA và giúp loại trừ kháng thể dương tính giả, tuy nhiên hiếm khi được sử dụng như một xét nghiệm bổ sung. Xét nghiệm này có thể được sử dụng trong các hoàn cảnh phi lâm sàng hoặc cho những người có kết quả xét nghiệm EIA dương tính và RNA HCV âm tính.[42]
- Khuyến cáo thực hiện xét nghiệm RNA HCV định lượng trước khi bắt đầu liệu pháp kháng vi-rút để ghi nhận lại lượng vi-rút trong máu ban đầu. Mỗi bệnh nhân mắc HCV cần xác định kiểu gen vi-rút trước khi điều trị để xác định phác đồ phù hợp nhất.[45]
Các xét nghiệm xơ hóa gan không xâm lấn
Các xét nghiệm xơ hoá gan không xâm lấn (dấu ấn xơ trong huyết thanh và đo độ đàn hồi thoáng qua sử dụng sóng siêu âm và tần số thấp để đo độ đàn hồi của gan)[47] có thể gợi ý hoặc loại trừ khả năng xơ hóa tiến triển.[45]
Việc chia giai đoạn vẫn quan trọng với các liệu pháp kháng vi-rút mới để giúp xác định thời gian điều trị tối ưu; tuy nhiên, các xét nghiệm không xâm lấn để dự đoán xơ hóa đang trở thành tiêu chuẩn điều trị so với phương pháp sinh thiết gan. Ở châu Âu, các xét nghiệm không xâm lấn như đo độ đàn hồi đã được chấp nhận là biện pháp thay thế cho sinh thiết gan nhiều hơn; tuy nhiên, bản thân phương pháp đo độ đàn hồi có thể không đủ để kết luận hay loại trừ xơ hóa nặng.[48] Tại Hoa Kỳ, phương pháp đo độ đàn hồi gan hiện đã được phê duyệt và, cùng với các xét nghiệm xơ hóa trong huyết thanh, về cơ bản đã thay thế nhu cầu sinh thiết gan để chia giai đoạn bệnh.
Sinh thiết gan
Sinh thiết gan không được dùng để chẩn đoán nhiễm viêm gan C nhưng rất hữu ích trong việc xác định giai đoạn xơ hóa và mức độ viêm gan. Tuy nhiên, do liệu pháp kháng virus tác động trực tiếp hiện được coi là rất hiệu quả nên sinh thiết hiếm khi được chỉ định.
Một lý do có thể khác để thực hiện sinh thiết đó là để đánh giá khả năng xơ gan và từ đó bắt đầu chương trình giám sát ung thư biểu mô tế bào gan. Khám lâm sàng hoặc xét nghiệm đơn thuần không thể chỉ ra xơ gan cho đến khi tình trạng xơ gan tiến triển.
Có thể cân nhắc tiến hành sinh thiết nếu bệnh nhân và cơ sở y tế muốn có thông tin tiên lượng điểm xơ hóa hoặc đưa ra quyết định liên quan đến điều trị.[45]
Rủi ro đi kèm với sinh thiết bao gồm chảy máu và chọc các cơ quan khác; tuy nhiên rất hiếm khi xảy ra.
Các yếu tố nguy cơ
Thường gặp
Các thực hành y khoa không an toàn
- Nguyên nhân thường gặp nhất trên thế giới là các thực hành tiêm không an toàn trong quá trình điều trị y tế.[25]
Dùng ma túy đường tĩnh mạch hoặc đường mũi
- Nhiều trường hợp nhiễm bệnh do tiêm chích ma túy trái phép[26] tuy nhiên, sử dụng ma túy qua đường mũi cũng có thể dẫn tới nhiễm bệnh.
- Kết hợp chương trình kim tiêm và bơm tiêm cùng liệu pháp thay thế opioid (ví dụ methadone) làm giảm nhiễm vi- rút viêm gan C mắc phải ở những người tiêm chích ma túy 71% so với mức giảm thiểu tác hại tối thiểu.[27]
Truyền máu hoặc ghép tạng
- Truyền máu trước năm 1992 hoặc truyền yếu tố đông máu trước năm 1987 là yếu tố nguy cơ tại Hoa Kỳ. Khung thời gian tương tự áp dụng tại các nước giàu nguồn lực khác (ví dụ: trước tháng 9 năm 1991 [truyền máu] hoặc 1986 [yếu tố đông máu] tại Anh Quốc).
- Các trường hợp nhiễm liên quan đến truyền máu xảy ra trước khi có sàng lọc hiến máu. Hiện nay, ở các nước phát triển, tình trạng nhiễm bệnh xảy ra ở dưới 1 đơn vị máu trong số 2 triệu đơn vị máu được truyền.[28]
- Bệnh nhân được cấy ghép tạng cũng có nguy cơ nhiễm bệnh.
Sinh trong khoảng từ năm 1945 đến 1965
- Trung tâm Kiểm soát và Phòng chống Dịch bệnh Hoa Kỳ (CDC) khuyến cáo sàng lọc một lần đối với những người sinh trong khoảng từ năm 1945 đến 1965 vì đây là nhóm đối tượng có tỷ lệ lưu hành HCV và bệnh liên quan cao một cách không tương xứng.[29] Khuyến cáo này không áp dụng cho các nước khác do các phương pháp sàng lọc cụ thể sẽ phụ thuộc vào dịch tễ học tại địa phương.
Uống nhiều rượu
- Làm tăng nguy cơ tiến triển thành xơ gan, mặc dù không mắc phải hoặc thanh thải vi-rút.
Đa hình gen interleukin (IL)-28B
- Chủng IL-28B có lợi (C/C) liên quan đến quá trình thanh thải vi-rút tự nhiên; các bệnh nhân có kiểu gen C/C có khả năng tự loại bỏ tình trạng nhiễm HCV cấp tính cao gấp 3 lần so với các bệnh nhân mắc các chủng ở cùng vị trí (T/T và C/T).[30]
- Người gốc Phi ít có khả năng mang kiểu gen C/C và do đó có khả năng tự thanh thải HCV thấp nhất.[31]
HIV
- Ít có khả năng thanh thải vi-rút và khả năng tiến triển bệnh gan cao hơn (đặc biệt nếu số lượng CD4 thấp).
Bị giam giữ/sống trong trại tập trung
- Tỷ lệ lưu hành bệnh cao hơn ở những người bị giam giữ hoặc sống trong trại tập trung.[15]
Không thường gặp
Lọc máu
- Tỷ lệ lưu hành viêm gan C ở các bệnh nhân lọc máu thường cao hơn ở người khỏe mạnh, cho thấy các bệnh nhân lọc máu có thể có nguy cơ nhiễm vi-rút viêm gan C (HCV) cao hơn.[32]
Công tác y tế
- Đối với các nhân viên y tế thường xuyên tiếp xúc dưới da với máu của bệnh nhân có kháng thể kháng HCV dương tính, nguy cơ truyền bệnh trung bình là 1,8% mặc dù các tỷ lệ theo báo cáo là 6% đến 10%.[33]
Hình xăm
- Việc xăm hình ở những người dùng ma túy không tiêm chích có liên quan tới nhiễm HCV (OR 5,74, 95% CI, 1,98-16,66).[34]
Nhiều bạn tình
- Nguy cơ lây truyền viêm gan C qua đường quan hệ tình dục thấp.[35]
- Tuy nhiên, phơi nhiễm qua đường tình dục chiếm khoảng 15% số ca bệnh viêm gan C.[36]
Mẹ bị nhiễm (đối với thai nhi)
- Tỷ lệ lây truyền trong giai đoạn chu sinh (lây truyền dọc) là 2,4%.[20]
- Lây truyền HCV từ mẹ sang con tăng lên nếu người mẹ đồng nhiễm HIV hoặc có nồng độ RNA HCV trong huyết thanh cao.[37]
- Cần lưu ý rằng cho con bú thường được coi là an toàn; tuy nhiên, người mẹ bị nhiễm cần tránh cho con bú nếu núm vú bị nứt và/hoặc chảy máu.
Giới tính nam
- Khả năng thanh thải vi-rút kém hơn và khả năng tiến triển thành xơ gan cao hơn so với nữ giới.[31] [38]
Các yếu tố về tiền sử và thăm khám
Các yếu tố chẩn đoán chủ yếu
Có các yếu tố nguy cơ (thường gặp)
- Các yếu tố nguy cơ chủ yếu bao gồm các thực hành y khoa không an toàn,[25] tiêm chích ma túy hoặc dùng ma túy qua đường mũi,[26] và tiền sử truyền máu hoặc ghép tạng.[28]
Các yếu tố chẩn đoán khác
Các triệu chứng thể tạng (không thường gặp)
- Viêm gan C mạn tính thường không có triệu chứng, tuy nhiên một số bệnh nhân có thể xuất hiện các triệu chứng không đặc hiệu như mệt mỏi, đau cơ hoặc đau khớp.
Chứng vàng da (không thường gặp)
- Có thể gợi ý bệnh gan tiến triển. Ít gặp trong nhiễm cấp tính.
Cổ trướng (không thường gặp)
- Cho thấy bệnh gan tiến triển.
Các dấu hiệu của bệnh não gan (không thường gặp)
- Lú lẫn, thay đổi ý thức hoặc hôn mê có thể gợi ý bệnh gan tiến triển.
Biểu hiện ngoài gan (không thường gặp)
- Đôi khi bệnh nhân có những biểu hiện ngoài gan (ví dụ: viêm mạch, biến chứng ở thận, biểu hiện ngoài da như rối loạn chuyển hóa porphyria).
Xét nghiệm chẩn đoán
Xét nghiệm thứ nhất cần yêu cầu
| Xét nghiệm | Kết quả |
| Xét nghiệm miễn dịch enzym hoặc các kháng thể viêm gan C
• Các kháng thể âm tính không loại trừ nhiễm HCV ở bệnh nhân nhiễm cấp tính hoặc ở các bệnh nhân bị suy giảm miễn dịch nặng (ví dụ: nhiễm HIV có tế bào T <100 tế bào/mL). • Xét nghiệm thấm thấu miễn dịch tái tổ hợp (RIBA) đặc hiệu hơn xét nghiệm miễn dịch enzym (EIA) và giúp loại trừ kết quả kháng thể dương tính giả. • Tuy nhiên, trong thực tế, chỉ một trong hai phương pháp EIA hoặc RIBA được thực hiện và các kết quả dương tính được xác nhận bằng khuếch đại axit nucleic. |
Dương tính có nghĩa đã phơi nhiễm với viêm gan C |
| Xét nghiệm khuếch đại axit nucleic (NAAT)
• NAAT bao gồm PCR, phân tích DNA chuỗi nhánh và khuếch đại qua trung gian phiên mã (TMA). • NAAT được dùng để xác nhận tình trạng nhiễm vi-rút trong máu ở bệnh nhân có EIA dương tính, khẳng định nhiễm bệnh sớm, hoặc đánh giá hiệu quả của liệu pháp kháng vi-rút. • RNA virus viêm gan C biến mất hoặc giảm đi có thể có nghĩa là bệnh nhân đã thanh thải vi-rút sau khi phơi nhiễm cấp tính và cũng là chỉ điểm chính cho thấy đáp ứng với liệu pháp kháng vi-rút. • NAAT cho vi-rút viêm gan C thường được định lượng. |
Kết quả dương tính cho biết tình trạng nhiễm vi-rút đảng hoạt động |
| Aminotransferase trong huyết thanh
• Aminotransferase huyết thanh, đặc biệt là alanine aminotransferase (ALT), có thể được dùng để đo mức độ hoạt động của bệnh, mặc dù độ nhạy và độ đặc hiệu thấp. • Chỉ có mối liên hệ yếu giữa mức ALT và mức độ bệnh gan mạn tính, mặc dù đo ALT liên tiếp có thể hữu ích trong việc theo dõi mức độ hoạt động của bệnh và đáp ứng điều trị ở một số bệnh nhân. • Mức ALT không phản ánh tình trạng tiến triển bệnh thành xơ gan. |
Có thể tăng |
| Xác định kiểu gen của vi-rút
• Mỗi bệnh nhân nhiễm vi-rút viêm gan C (HCV) cần xác định kiểu gen vi-rút trước khi điều trị để xác định liều và thời gian điều trị và để lựa chọn phác đồ phù hợp nhất. |
Dự đoán đáp ứng với liệu pháp kháng vi-rút |
Các xét nghiệm khác cần cân nhắc
| Xét nghiệm | Kết quả |
| Các xét nghiệm xơ hóa gan hoặc độ đàn hồi gan không xâm lấn
• Các xét nghiệm xơ hoá gan không xâm lấn (dấu ấn xơ trong huyết thanh và đo độ đàn hồi thoáng qua sử dụng sóng siêu âm và tần số thấp để đo độ đàn hồi của gan) có thể gợi ý hoặc loại trừ khả năng xơ hóa tiến triển. • Ở châu Âu, các xét nghiệm không xâm lấn như đo độ đàn hồi ngày càng được chấp nhận nhiều hơn là biện pháp thay thế cho sinh thiết gan; tuy nhiên, bản thân phương pháp đo độ đàn hồi không đủ để kết luận hay loại trừ xơ hóa gan nặng. • Tại Hoa Kỳ, phương pháp đo độ đàn hồi gan đã được phê duyệt và, cùng với các xét nghiệm xơ hóa trong huyết thanh, về cơ bản đã thay thế nhu cầu sinh thiết gan để xác định giai đoạn bệnh. |
Có thể gợi ý hoặc loại trừ xơ hóa tiến triển |
| Sinh thiết gan
• Không được dùng để chẩn đoán nhiễm viêm gan C nhưng hữu ích trong việc xác định giai đoạn xơ hóa và mức độ viêm gan. Tuy nhiên, do liệu pháp kháng vi-rút tác động trực tiếp hiện được coi là rất hiệu quả nên sinh thiết hiếm khi được chỉ định. • Một lý do có thể khác để tiến hành sinh thiết đó là để đánh giá khả năng xơ gan và từ đó đánh giá được nguy cơ ung thư biểu mô tế bào gan. • Cũng có thể được cân nhắc nếu bệnh nhân và cơ sở y tế muốn có thông tin tiên lượng điểm xơ hóa hoặc đưa ra quyết định liên quan đến điều trị. Rủi ro đi kèm với sinh thiết bao gồm chảy máu và chọc các cơ quan khác; tuy nhiên rất hiếm khi xảy ra. |
Có thể cho thấy tình trạng viêm hoặc xơ hóa |
Chẩn đoán khác biệt
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| Viêm gan B mạn tính | • Có thể không có dấu hiệu hoặc triệu chứng phân biệt. | • Xét nghiệm kháng nguyên bề mặt viêm gan B cho kết quả dương tính.
• Xét nghiệm kháng thể viêm gan C cho kết quả âm tính. |
| Viêm gan do rượu | • Có thể có các triệu chứng phụ thuộc rượu, tuy nhiên các triệu chứng này không mang tính chẩn đoán. | • Xét nghiệm kháng thể viêm gan C cho kết quả âm tính. |
| Viêm gan nhiễm mỡ | • Có thể không có dấu hiệu hoặc triệu chứng phân biệt. | • Siêu âm có thể thấy gan nhiễm mỡ.
• Xét nghiệm kháng thể viêm gan C cho kết quả âm tính. • Sinh thiết gan thấy viêm gan nhiễm mỡ. |
| Bệnh thừa sắt | • Có thể không có dấu hiệu hoặc triệu chứng phân biệt, tuy nhiên một số bệnh nhân có bệnh tiến triển cũng có thể có biểu hiện của bệnh cơ tim, viêm khớp hoặc đái tháo đường. | • Các chỉ số sắt bất thường (nhưng chú ý là các bệnh nhân mắc bệnh gan tiến triển vì bất cứ nguyên nhân nào, đặc biệt là những bệnh nhân xơ gan, có thể có độ bão hòa ferritin và transferrin rất cao). Xét nghiệm di truyền đối với gen bệnh thừa sắt (đột biến C282Y) có thể giúp ích cho việc phân biệt. |
| Các bệnh gan mạn tính khác | • Các bệnh nhân có thể có tiền sử hoặc triệu chứng thực thể gợi ý bệnh về chuyển hóa, tự miễn hoặc bệnh gan do dùng thuốc. | • Xét nghiệm kháng thể viêm gan C cho kết quả âm tính.
• Sinh hóa máu hoặc xét nghiệm huyết thanh, sàng lọc độc chất hoặc sinh thiết gan có thể khẳng định chẩn đoán thay thế. |
Các tiêu chí chẩn đoán
Trung tâm Kiểm soát và Phòng chống Bệnh tật (CDC): viêm gan C, cấp tính – định nghĩa ca bệnh năm 2016[49]
Tiêu chuẩn lâm sàng:
- Một tình trạng bệnh có khởi phát riêng rẽ bất cứ dấu hiệu hay triệu chứng nào phù hợp với viêm gan virus cấp tính (ví dụ: sốt, đau đầu, khó chịu, chán ăn, buồn nôn, nôn, tiêu chảy và đau bụng), và
- (a) vàng da, hoặc
- (b) Alanine aminotransferase (ALT) huyết thanh tăng cao đạt đỉnh >200 IU/L trong giai đoạn bệnh cấp tính.
Tiêu chuẩn xét nghiệm:
- Xét nghiệm dương tính với các kháng thể kháng vi-rút viêm gan C (kháng HCV)
- Xét nghiệm phát hiện vi-rút viêm gan C:
- Xét nghiệm axit nucleic (NAT) phát hiện dương tính với RNA HCV (bao gồm xét nghiệm định tính, định lượng hoặc kiểu gen)
- Xét nghiệm dương tính chỉ ra sự có mặt của (các) kháng nguyên HCV khi và nếu một xét nghiệm (các) kháng nguyên HCV được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt và khả dụng.
Ca bệnh có thể:
- Ca bệnh đáp ứng tiêu chuẩn lâm sàng và có kết quả xét nghiệm kháng thể kháng HCV dương tính nhưng không có báo cáo về NAT HCV dương tính hay xét nghiệm kháng nguyên HCV dương tính, và
- Không có chuyển đảo xét nghiệm trong vòng 12 tháng hoặc không có báo cáo nào về chuyển đảo xét nghiệm.
Ca bệnh được xác định:
- Ca bệnh đáp ứng tiêu chuẩn lâm sàng và xét nghiệm phát hiện viêm gan virus C dương tính (NAT HCV hoặc kháng nguyên HCV), hoặc
- Xét nghiệm kháng thể HCV, kháng nguyên HCV, hoặc NAT được ghi nhận là âm tính, sau đó chuyển thành dương tính trong vòng 12 tháng đối với bất kỳ xét nghiệm nào kể trên (chuyển đảo xét nghiệm).
Trung tâm Kiểm soát và Phòng chống Bệnh tật (CDC): viêm gan C, mạn tính – định nghĩa ca bệnh năm 2016[50]
Tiêu chuẩn lâm sàng:
- Không có bằng chứng nào về thông tin lâm sàng và xét nghiệm liên quan chỉ ra tình trạng nhiễm vi-rút cấp tính. Hầu hết những người nhiễm HCV đều không có triệu chứng; tuy nhiên, nhiều người mắc bệnh gan mạn tính từ nhẹ đến nặng.
Tiêu chuẩn xét nghiệm:
- Xét nghiệm dương tính với kháng HCV
- Xét nghiệm phát hiện vi-rút viêm gan C:
- NAT để phát hiện RNA HCV dương tính (bao gồm xét nghiệm định tính, định lượng hoặc kiểu gen)
- Xét nghiệm dương tính chỉ ra sự có mặt của (các) kháng nguyên HCV khi và nếu một xét nghiệm đối với (các) kháng nguyên HCV được FDA phê duyệt và khả dụng.
Ca bệnh có thể:
- Ca bệnh không đáp ứng tiêu chuẩn lâm sàng hoặc không có báo cáo về tiêu chuẩn lâm sàng, và
- Không có chuyển đảo xét nghiệm trong vòng 12 tháng hoặc không có báo cáo về chuyển đảo xét nghiệm, và
- Có kết quả xét nghiệm kháng thể kháng HCV dương tính, nhưng không có báo cáo về NAT HCV dương tính hay xét nghiệm kháng nguyên HCV dương tính.
Ca bệnh được xác định:
- Ca bệnh không đáp ứng tiêu chuẩn lâm sàng hoặc không có báo cáo về tiêu chuẩn lâm sàng, và
- Không có chuyển đảo xét nghiệm trong vòng 12 tháng hoặc không có báo cáo về chuyển đảo xét nghiệm, và
- Xét nghiệm NAT HCV hoặc xét nghiệm kháng nguyên HCV dương tính.
Điều trị
Cách tiếp cận điều trị từng bước
Mục tiêu điều trị là nhằm giảm tỷ lệ tử vong do mọi nguyên nhân và các hậu quả ảnh hưởng đến sức khỏe liên quan đến gan, bao gồm bệnh gan giai đoạn cuối và ung thư biểu mô tế bào gan bằng cách điều trị khỏi về mặt vi-rút (bằng chứng là đáp ứng virus bền vững).[45] [BMJ Best Practice podcast: hepatitis C – what have been our successes so far?]
Nhiễm khuẩn cấp tính
Không có biện pháp điều trị đặc hiệu nào đối với phơi nhiễm cấp tính cho đến khi tình trạng nhiễm vi-rút trong máu xuất hiện. Nếu cả bác sĩ và bệnh nhân đều quyết định chấp nhận trì hoãn bắt đầu điều trị, cần theo dõi quá trình đào thải tự nhiên của vi-rút ở bệnh nhân trong tối thiểu 6 tháng. Nếu xảy ra quá trình đào thải tự nhiên thì không cần điều trị kháng vi-rút.[45]
Thông thường mất một khoảng thời gian ít nhất 12 tuần kể từ khi phát hiện thấy RNA của vi-rút viêm gan C (HCV) trong huyết thanh. Ngay cả khi đã quyết định bắt đầu điều trị kháng vi-rút trong vòng 6 tháng đầu sau khi nhiễm vi- rút, cần theo dõi RNA HCV trong ít nhất 12 đến 16 tuần để cho phép quá trình đào thải virus tự nhiên trước khi bắt đầu điều trị.[45] Nếu không phát hiện RNA HCV trong vòng 12 đến 16 tuần sau khi phơi nhiễm cấp tính, bệnh nhân chưa chắc đã nhiễm vi-rút hoặc đã tự đào thải vi-rút.
Nếu điều trị trong 6 tháng đầu, cần điều trị tương tự như với trường hợp nhiễm vi-rút mạn tính.
Nhiễm bệnh mạn tính
Hướng dẫn của Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD)/Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo điều trị kháng vi-rút đối với tất cả các bệnh nhân nhiễm HCV mạn tính, ngoại trừ các bệnh nhân có kỳ vọng sống ngắn vì không thể điều trị bằng biện pháp điều trị HCV, ghép gan hoặc biện pháp điều trị trực tiếp khác. Các nghiên cứu cho thấy rằng điều trị ở giai đoạn đầu của bệnh đi liền với kết quả khả quan hơn so với việc chờ đến khi bệnh tiến triển thêm.[45] Các bệnh nhân có kỳ vọng sống thấp cần được điều trị bởi một bác sĩ chuyên khoa.
Sự phát triển nhanh chóng của các thuốc kháng virus mới (còn gọi là các chất kháng virus tác động trực tiếp, hay DAA) gần đây dẫn tới những thay đổi trong hướng dẫn điều trị, với các khuyến cáo đang được cập nhật liên tục bởi AASLD, và người đọc nên xem lại trang web để biết những thay đổi về khuyến cáo.[45] Các quốc gia khác nhau có thể sử dụng các hướng dẫn khác nhau và các yếu tố chi phí là yếu tố quyết định chính để đưa ra quyết định điều trị tại một số quốc gia.
[Recommendations for testing, managing, and treating hepatitis C]Khuyến cáo của AASLD đôi khi cũng gây tranh cãi do những khuyến cáo này có thể khác với thông tin ghi trên nhãn đã được phê duyệt của một số loại thuốc. Vì vậy, cần hỏi ý kiến bác sĩ chuyên khoa trước khi chọn phác đồ điều trị phù hợp nhất.
Các thành phần của phác đồ thuốc bao gồm:
- Daclatasvir cộng với sofosbuvir
- Elbasvir/grazoprevir
- Glecaprevir/pibrentasvir
- Ledipasvir/sofosbuvir
- Ombitasvir/paritaprevir/ritonavir ± dasabuvir
- Sofosbuvir cộng với simeprevir
- Sofosbuvir/velpatasvir
- Sofosbuvir/velpatasvir/voxilaprevir.
Các phác đồ này có thể được dùng kèm theo có hoặc không có ribavirin. Các phác đồ cụ thể được sử dụng chủ yếu phụ thuộc vào kiểu gen và có hay không có tình trạng xơ gan.[45] Hiện nay đã có các chất pangenotypic biểu hiện hoạt tính kháng lại các kiểu gen 1 đến 6, bao gồm sofosbuvir/velpatasvir, sofosbuvir/velpatasvir/voxilaprevir và glecaprevir/pibrentasvir. Một nghiên cứu đa trung tâm giai đoạn 3 cho thấy 99% bệnh nhân được điều trị bằng glecaprevir/pibrentasvir đạt đáp ứng virus bền vững (SVR) sau 12 tuần ở các bệnh nhân nhiễm vi-rút mạn tính (kiểu gen 1, 2, 4, 5, hoặc 6) và xơ gan còn bù chưa được điều trị trước đó.[59]
Các phác đồ sử dụng interferon không còn được khuyến cáo cho trường hợp nhiễm HCV do các chất kháng virus tác động trực tiếp đường uống hiện được coi là liệu pháp đầu tay. Có tới 30% bệnh nhân nhiễm viêm gan C được điều trị bằng interferon bị trầm cảm nặng. Một nghiên cứu thuần tập dựa trên quần thể trong 12 năm thấy rằng các bệnh nhân nhiễm viêm gan C có tiền sử trầm cảm do interferon alpha có nguy cơ tái phát trầm cảm cao hơn rất nhiều, ngay cả khi không còn tiếp tục phơi nhiễm với interferon alpha. Việc sử dụng các chất chống trầm cảm trong quá trình điều trị bằng interferon alpha không làm giảm nguy cơ tái phát.[60]
Theo một bài tổng quan của Cochrane về 138 thử nghiệm lâm sàng ngẫu nhiên (25.232 bệnh nhân) so sánh các DAA với không can thiệp hoặc giả dược, dùng đơn độc hoặc cùng với can thiệp, cho thấy rằng các DAA chủ yếu được nghiên cứu trong thời gian ngắn, với đáp ứng virus bền vững (SVR) là kết quả thay thế, và hiện tại có ít hoặc không có dữ liệu về ảnh hưởng của các DAA tới tỷ lệ mắc bệnh hoặc tỷ lệ tử vong liên quan đến viêm gan C.[61] AASLD/ IDSA không đồng tình với các kết luận trong tổng quan đó và đã đưa ra phản ứng, buộc các tác giả của bài tổng quan rút lại hoặc sửa lại kết luận của họ.[62] Hiệp hội Nghiên cứu Gan châu Âu cũng đưa ra câu trả lời của mình về bài tổng quan trên, thể hiện sự quan ngại sâu sắc về các kết luận của bài tổng quan.[63] Các kết luận của bài tổng quan được cập nhật tháng 9 năm 2017, lúc này các tác giả kết luận rằng họ không thể xác định được ảnh hưởng của việc điều trị lâu dài bằng các DAA, không chắc chắn về ảnh hưởng của việc điều trị bằng các DAA tới tỷ lệ mắc bệnh và tỷ lệ tử vong, và mặc dù các DAA có thể làm giảm số người có thể phát hiện thấy vi-rút trong máu, SVR (là một kết quả) vẫn cần được đánh giá một cách phù hợp hơn.[61] [64]
Theo dõi
Trước khi bắt đầu điều trị, khuyến cáo thực hiện các đánh giá sau:[45]
- Giai đoạn xơ hóa gan
- Công thức máu
- INR
- Các xét nghiệm về gan
- chức năng thận
- Kiểu gen HCV và phân nhóm HCV
- RNA HCV định lượng (tải lượng virus HCV)
- Tiền sử bệnh gan mất bù và mức độ nặng của bệnh gan sử dụng điểm Child-Turcotte-Pug (ở các bệnh nhân dự kiến được dùng chất ức chế protease NS3)
- Sự hiện diện của các chất thay thế liên quan đến kháng NS5A [AASLD/IDSA: HCV resistance primer]
- Xét nghiệm huyết thanh về tình trạng mang thai (ở phụ nữ trong độ tuổi sinh đẻ chuẩn bị bắt đầu phác đồ có ribavirin).
Việc đưa các chất kháng virus tác động trực tiếp vào phác đồ điều trị HCV có nghĩa là làm tăng nguy cơ xảy ra tương tác thuốc với các thuốc khác mà bệnh nhân có thể đang dùng đồng thời (ví dụ: thuốc kháng retrovirus, thuốc chống co giật, thuốc kháng nấm, corticosteroid, statin, thuốc kháng sinh, thảo dược). Cần đánh giá tương tác thuốc có thể xảy ra trước khi bắt đầu phác đồ kháng vi-rút, đặc biệt là ở các bệnh nhân đồng mắc viêm gan C/HIV đang điều trị bằng thuốc kháng retrovirus, vì một số loại thuốc nhất định bị chống chỉ định với các thuốc này hoặc có thể cần điều chỉnh liều lượng.
Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) Hoa Kỳ đã đưa ra cảnh báo về nguy cơ tái hoạt động viêm gan B ở các bệnh nhân được điều trị bằng các thuốc kháng virus tác động trực tiếp mà đang mắc hoặc từng mắc viêm gan B.[65] Mặc dù nguy cơ thấp nhưng viêm gan B tái hoạt động dẫn tới những vấn đề nghiêm trọng về gan (yêu cầu phải ghép gan) hoặc tử vong. Cần sàng lọc tất cả các bệnh nhân để tìm bằng chứng về hiện mắc hoặc từng mắc viêm gan B (tức là xét nghiệm HBsAg, kháng thể kháng kháng nguyên bề mặt viêm gan B [anti-HBs] và kháng thể kháng kháng nguyên lõi viêm gan B [anti-HBc]) trước khi bắt đầu điều trị bằng các chất kháng virus tác động trực tiếp.[45] Bệnh nhân cũng cần được theo dõi trong và sau điều trị. Ủy ban Đánh giá Nguy cơ Cảnh giác dược (PRAC) của Cơ quan Dược phẩm châu Âu đồng tình với những khuyến cáo này.[66] Khuyến cáo tiêm vắc-xin viêm gan B đối với tất cả các cá nhân dễ nhiễm vi-rút.[45]
Đáp ứng điều trị
SVR được định nghĩa là không phát hiện thấy RNA HCV trong huyết thanh trong vòng 12 tuần trở lên sau khi hoàn tất điều trị, tương quan mật thiết với việc không xuất hiện vi-rút trong thời gian dài.[45]
Một tổng quan hệ thống cho thấy tỷ lệ SVR cao đối với tất cả các phác đồ đã được FDA phê duyệt. Tỷ lệ SVR là >95% ở các bệnh nhân nhiễm kiểu gen 1 đối với hầu hết các trường hợp kết hợp thuốc và các nhóm bệnh nhân. Tỷ lệ chung của các tác dụng bất lợi nghiêm trọng và ngưng điều trị là thấp (<10%) ở tất cả các bệnh nhân.[67]
Các bệnh nhân không đạt SVR (tức là do quá trình điều trị không đào thải được vi-rút hoặc đào thải được nhưng vẫn tái phát sau khi hoàn tất điều trị) có khả năng bị tổn thương gan và lây truyền tiếp diễn sau đó và tiếp tục nhiễm virus. Các bệnh nhân này cần được theo dõi để phát hiện bệnh gan tiến triển và được xem xét tái điều trị khi có các phương án điều trị thay thế.[45] Giống như bệnh nhân chưa từng điều trị, các tùy chọn được khuyến cáo dành cho bệnh nhân đã từng điều trị sẽ khác nhau tùy theo kiểu gen và tình trạng xơ gan có hay không.[45] Tuy nhiên, phác đồ được khuyến cáo cũng phụ thuộc vào phác đồ dẫn tới thất bại trong điều trị trước đó của bệnh nhân.
Các nhóm bệnh nhân đặc biệt
Có thể cần điều chỉnh các phác đồ và liều lượng sử dụng thuốc ở một số nhóm bệnh nhân: ví dụ như phụ nữ mang thai, trẻ em, bệnh nhân suy giảm chức năng thận (hoặc bệnh nhân ghép thận), đồng mắc HCV/HIV, xơ gan mất bù và các bệnh nhân nhiễm HCV tái phát sau ghép gan. Việc điều trị cho các bệnh nhân này không nằm trong phạm vi bài viết này và cần tham khảo các tài liệu hướng dẫn.[45]
Xơ gan mất bù
Bao gồm bệnh nhân bị tổn thương gan trung bình hoặc nặng (Child Turcotte Pugh loại B hoặc C) có thể hoặc không phải là ứng viên ghép gan, kể cả những người bị ung thư biểu mô tế bào gan. Các bệnh nhân này phải được giới thiệu đến bác sĩ có kinh nghiệm trong việc điều trị các bệnh nhân này, lý tưởng nhất là ở trung tâm ghép gan. Phác đồ điều trị sẽ phụ thuộc vào kiểu gen của bệnh nhân và họ có đủ điều kiện được dùng ribavirin hay không.[45] Có thể sử dụng thuốc ngoài hướng dẫn. Bệnh nhân bị nhiễm viêm gan C tái phát sau khi ghép gan cũng phải được giới thiệu đến bác sĩ chuyên khoa để điều trị.
Tổng quan về các chi tiết điều trị
Tham khảo cơ sở dữ liệu dược địa phương của quý vị để biết thông tin toàn diện về thuốc, bao gồm các chống chỉ định, tương tác giữa các loại thuốc, và liều dùng thay thế. ( xem Tuyên bố miễn trách nhiệm )
| Bắt đầu (tóm tắt) | ||
| Mới nhiễm virus | ||
| 1 | Theo dõi bệnh nhân hoặc bắt đầu điều trị | |
| Cấp tính (tóm tắt) | ||
| Nhiễm vi-rút mạn tính: kiểu gen 1a | ||
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
| Nhiễm vi-rút mạn tính: kiểu gen 1b | ||
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
| Nhiễm vi-rút mạn tính: kiểu gen 2 | ||
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
| Nhiễm vi-rút mạn tính: kiểu gen 3 | ||
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
| Nhiễm vi-rút mạn tính: kiểu gen 4 | ||
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
| Nhiễm vi-rút mạn tính: kiểu gen 5 hoặc 6 | ||
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
|
1 | Liệu pháp kháng vi-rút |
| Tiếp diễn (tóm tắt) | ||
| Xơ gan mất bù | ||
| 1 | Giới thiệu đến bác sĩ chuyên khoa | |
Các lựa chọn điều trị
| Bắt đầu | ||
| Mới nhiễm virus | ||
| 1 | Theo dõi bệnh nhân hoặc bắt đầu điều trị | |
| » Không có biện pháp điều trị đặc hiệu nào đối với phơi nhiễm cấp tính cho đến khi tình trạng nhiễm vi- rút trong máu xuất hiện. Nếu cả bác sĩ và bệnh nhân đều quyết định chấp nhận trì hoãn bắt đầu điều trị, cần theo dõi quá trình đào thải tự nhiên của vi-rút ở bệnh nhân trong tối thiểu 6 tháng. Nếu xảy ra quá trình đào thải tự nhiên thì không cần điều trị kháng vi-rút.[45]
» Thông thường mất một khoảng thời gian ít nhất 12 tuần kể’ từ khi phát hiện thấy RNA của vi-rút viêm gan C (HCV) trong huyết thanh. Ngay cả khi đã quyết định bắt đầu điều trị kháng vi-rút trong vòng 6 tháng đầu sau khi nhiễm vi-rút, cần theo dõi RNA HCV trong ít nhất 12 đến 16 tuần để’ cho phép quá trình đào thải virus tự nhiên trước khi bắt đầu điều trị.[45] Nếu không phát hiện RNA HCV trong vòng 12 đến 16 tuần sau khi phơi nhiễm cấp tính, bệnh nhân chưa chắc đã nhiễm vi-rút hoặc đã tự đào thải vi-rút. » Nếu điều trị trong 6 tháng đầu, cần điều trị tương tự như với trường hợp nhiễm vi-rút mạn tính.[45] |
||
| Cấp tính | ||
| Nhiễm vi-rút mạn tính: kiểu gen 1a | ||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp
» elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12 tuần Có sẵn dưới dạng liều cố định Sử dụng cho các bệnh nhân không có đa hình NS5A ban đầu. » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg Được cung cấp theo dạng bào chế liều cố định. Khoảng thời gian khuyến cáo là 8 tuần đối với bệnh nhân không phải người da đen, không bị nhiễm HIV và có RNA HCV <6 triệu IU/mL. -và- |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12 tuần Có sẵn dưới dạng liều cố định Sử dụng cho các bệnh nhân không có đa hình NS5A ban đầu. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định.Hoặc» ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 16 tuần Có sẵn dưới dạng liều cố định Phác đồ thay thế đối với bệnh nhân có đa hình NS5A ban đầu. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong16 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 16 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12 tuần Có sẵn dưới dạng liều cố định Sử dụng cho các bệnh nhân không có đa hình NS5A ban đầu. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 8 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC» ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định.HOẶC» sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » ombitasvir/paritaprevir/ritonavir và dasabuvir: 25 mg (ombitasvir)/150 mg (paritaprevir)/100 mg (ritonavir) uống mỗi ngày một lần và 250 mg (dasabuvir) uống mỗi ngày hai lần trong 12 tuần Được cung cấp với tên gọi là Viekira Pak®. Mỗi hộp chứa 28 viên nén được đóng thành 7 vỉ (mỗi vỉ có 2 viên nén ombitasvir/paritaprevir/ ritonavir và 2 viên nén dasabuvir) dùng trong 1 tuần. Ombitasvir/paritaprevir/ritonavir (có hoặc không có dasabuvir) có thể gây tổn thương gan nghiêm trọng và chống chỉ định đối với các bệnh nhân bị tổn thương gan mức độ từ trung bình đến nặng. FDA drug safety communication: FDA warns of serious liver injury risk with hepatitis C treatments Viekira Pak and Technivie http:// www.fda.gov/Drugs/DrugSafety/ucm468634.htm -hoặc- » dasabuvir/ombitasvir/paritaprevir/ritonavir: 3 viên nén uống (giải phóng chậm) mỗi ngày một lần trong 12 tuần Mỗi viên nén giải phóng hai pha chứa 200 mg dasabuvir/8,33 mg ombitasvir/50 mg paritaprevir/33,33 mg ritonavir. Ombitasvir/ paritaprevir/ritonavir (có hoặc không có dasabuvir) có thể gây tổn thương gan nghiêm trọng và chống chỉ định đối với các bệnh nhân bị tổn thương gan mức độ từ trung bình đến nặng. FDA drug safety communication: FDA warns of serious liver injury risk with hepatitis C treatments Viekira Pak and Technivie http://www.fda.gov/Drugs/DrugSafety/ ucm468634.htm –VÀ– » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. HOẶC » simeprevir: 150 mg uống mỗi ngày một lần trong 12 tuần -và- » sofosbuvir: 400 mg qua uống mỗi ngày một lần trong 12 tuầnHOẶC » daclatasvir: 60 mg uống mỗi ngày một lần trong |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12 tuần Có sẵn dưới dạng liều cố định Sử dụng cho các bệnh nhân không có đa hình NS5A ban đầu. HOẶC » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶCCác lwajj chọn thứ cấp» glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định.» ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. HOẶC » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 16 tuần Có sẵn dưới dạng liều cố định Phác đồ thay thế đối với bệnh nhân có đa hình NS5A ban đầu. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong16 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 16 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶCCác lựa chọn thứ cấp» glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định.» elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12-16 tuần Có sẵn dưới dạng liều cố định Bệnh nhân thuộc kiểu gen 1a có đa hình NS5A ban đầu phải được kéo dài thời gian điều trị từ 12 tuần lên 16 tuần. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12-16 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12-16 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. » Các chất ức chế protease protein NS3 phi cấu trúc (NS3) bao gồm telaprevir, boceprevir và simeprevir. Telaprevir và boceprevir không còn được sử dụng ở Hoa Kỳ (và một số quốc gia khác); tuy nhiên, một số bệnh nhân có thể đã từng được điều trị bằng các loại thuốc này trước đây và đã tái phát. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. -và-» ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12 tuầnChống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. HOẶC » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12-16 tuần Có sẵn dưới dạng liều cố định Bệnh nhân thuộc kiểu gen 1a có đa hình NS5A ban đầu phải được kéo dài thời gian điều trị từ 12 tuần lên 16 tuần. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12-16 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12-16 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. » Các chất ức chế protease protein NS3 phi cấu trúc (NS3) bao gồm telaprevir, boceprevir và simeprevir. Telaprevir và boceprevir không còn được sử dụng ở Hoa Kỳ (và một số quốc gia khác); tuy nhiên, một số bệnh nhân có thể đã từng được điều trị bằng các loại thuốc này trước đây và đã tái phát. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir/voxilaprevir: 400 mg (sofosbuvir)/100 mg (velpatasvir)/100 mg (voxilaprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuầnĐược cung cấp theo dạng bào chế liều cố định. Không được sử dụng phác đồ này khi simeprevir không hiệu quả. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir/voxilaprevir: 400 mg (sofosbuvir)/100 mg (velpatasvir)/100 mg (voxilaprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir/voxilaprevir: 400 mg (sofosbuvir)/100 mg (velpatasvir)/100 mg (voxilaprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp» glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 16 tuần Được cung cấp theo dạng bào chế liều cố định. Trừ các phác đồ kết hợp có chất ức chế protease NS3/4 » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể’ phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để’ biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể’ sử dụng tài liệu hướng dẫn khác nhau. |
||
| Nhiễm vi-rút mạn tính: kiểu gen 1b | ||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 8 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 8-12 tuần Được cung cấp theo dạng bào chế liều cố định. Khoảng thời gian khuyến cáo là 8 tuần đối với bệnh nhân không phải người da đen, không bị nhiễm HIV và có RNA HCV <6 triệu IU/mL. HOẶC » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » ombitasvir/paritaprevir/ritonavir và dasabuvir: 25 mg (ombitasvir)/150 mg (paritaprevir)/100 mg (ritonavir) uống mỗi ngày một lần và 250 mg (dasabuvir) uống mỗi ngày hai lần trong 12 tuần Được cung cấp với tên gọi là Viekira Pak®. Mỗi hộp chứa 28 viên nén được đóng thành 7 vỉ (mỗi vỉ có 2 viên nén ombitasvir/paritaprevir/ ritonavir và 2 viên nén dasabuvir) dùng trong 1 tuần. Ombitasvir/paritaprevir/ritonavir (có hoặc không có dasabuvir) có thể gây tổn thương gan nghiêm trọng và chống chỉ định đối với các bệnh nhân bị tổn thương gan mức độ từ trung bình đến nặng. FDA drug safety communication: FDA warns of serious liver injury risk with hepatitis C treatments Viekira Pak and Technivie http:// www.fda.gov/Drugs/DrugSafety/ucm468634.htm HOẶC » dasabuvir/ombitasvir/paritaprevir/ritonavir: 3 viên nén uống (giải phóng chậm) mỗi ngày một lần trong 12 tuần Mỗi viên nén giải phóng hai pha chứa 200 mg dasabuvir/8,33 mg ombitasvir/50 mg paritaprevir/33,33 mg ritonavir. Ombitasvir/ paritaprevir/ritonavir (có hoặc không có dasabuvir) có thể gây tổn thương gan nghiêm trọng và chống chỉ định đối với các bệnh nhân bị tổn thương gan mức độ từ trung bình đến nặng. FDA drug safety communication: FDA warns of serious liver injury risk with hepatitis C treatments Viekira Pak and Technivie http://www.fda.gov/Drugs/DrugSafety/ ucm468634.htm HOẶC » simeprevir: 150 mg uống mỗi ngày một lần trong 12 tuần -và- » sofosbuvir: 400 mg qua uống mỗi ngày một lần trong 12 tuần HOẶC » daclatasvir: 60 mg uống mỗi ngày một lần trong 12 tuần Có thể cần điều chỉnh liều daclatasvir khi sử dụng đồng thời với chất cảm ứng hoặc chất ức chế CYP3A. -và- » sofosbuvir: 400 mg qua uống mỗi ngày một lần trong 12 tuần» Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » ombitasvir/paritaprevir/ritonavir và dasabuvir: 25 mg (ombitasvir)/150 mg (paritaprevir)/100 mg (ritonavir) uống mỗi ngày một lần và 250 mg (dasabuvir) uống mỗi ngày hai lần trong 12 tuần Được cung cấp với tên gọi là Viekira Pak®. Mỗi hộp chứa 28 viên nén được đóng thành 7 vỉ (mỗi vỉ có 2 viên nén ombitasvir/paritaprevir/ ritonavir và 2 viên nén dasabuvir) dùng trong 1 tuần. Ombitasvir/paritaprevir/ritonavir (có hoặc không có dasabuvir) có thể gây tổn thương gan nghiêm trọng và chống chỉ định đối với các bệnh nhân bị tổn thương gan mức độ từ trung bình đến nặng. FDA drug safety communication: FDA warns of serious liver injury risk with hepatitis C treatments Viekira Pak and Technivie http:// www.fda.gov/Drugs/DrugSafety/ucm468634.htm HOẶC» dasabuvir/ombitasvir/paritaprevir/ritonavir: 3 viên nén uống (giải phóng chậm) mỗi ngày một lần trong 12 tuần Mỗi viên nén giải phóng hai pha chứa 200 mg dasabuvir/8,33 mg ombitasvir/50 mg paritaprevir/33,33 mg ritonavir. Ombitasvir/ paritaprevir/ritonavir (có hoặc không có dasabuvir) có thể gây tổn thương gan nghiêm trọng và chống chỉ định đối với các bệnh nhân bị tổn thương gan mức độ từ trung bình đến nặng. FDA drug safety communication: FDA warns of serious liver injury risk with hepatitis C treatments Viekira Pak and Technivie http://www.fda.gov/Drugs/DrugSafety/ ucm468634.htm » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 8 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp» ombitasvir/paritaprevir/ritonavir và dasabuvir: 25 mg (ombitasvir)/150 mg (paritaprevir)/100 mg (ritonavir) uống mỗi ngày một lần và 250 mg (dasabuvir) uống mỗi ngày hai lần trong 12 tuần Được cung cấp với tên gọi là Viekira Pak®. Mỗi hộp chứa 28 viên nén được đóng thành 7 vỉ (mỗi vỉ có 2 viên nén ombitasvir/paritaprevir/ritonavir và 2 viên nén dasabuvir) dùng trong 1 tuần. HOẶC » dasabuvir/ombitasvir/paritaprevir/ritonavir: 3 viên nén uống (giải phóng chậm) mỗi ngày một lần trong 12 tuần Mỗi viên nén giải phóng hai pha chứa 200 mg dasabuvir/8,33 mg ombitasvir/50 mg paritaprevir/33,33 mg ritonavir. HOẶC » simeprevir: 150 mg uống mỗi ngày một lần trong 12 tuần -và- » sofosbuvir: 400 mg qua uống mỗi ngày một lần trong 12 tuần HOẶC » daclatasvir: 60 mg uống mỗi ngày một lần trong 12 tuần Có thể cần điều chỉnh liều daclatasvir khi sử dụng đồng thời với chất cảm ứng hoặc chất ức chế CYP3A. -và- » sofosbuvir: 400 mg qua uống mỗi ngày một lần trong 12 tuần » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp
» elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg HOẶC » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. |
||
|
1 | Liệu pháp kháng vi-rút |
| lựa chọn sơ cấp » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. » Các chất ức chế protease protein NS3 phi cấu trúc (NS3) bao gồm telaprevir, boceprevir và simeprevir. Telaprevir và boceprevir không còn được sử dụng ở Hoa Kỳ (và một số quốc gia khác); tuy nhiên, một số bệnh nhân có thể đã từng được điều trị bằng các loại thuốc này trước đây và đã tái phát |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp
» sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Không được sử dụng phác đồ này khi simeprevir không hiệu quả. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định.HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir/voxilaprevir: 400 mg (sofosbuvir)/100 mg (velpatasvir)/100 mg (voxilaprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 16 tuần Được cung cấp theo dạng bào chế liều cố định. Trừ các phác đồ kết hợp có chất ức chế protease NS3/4 » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] |
||
| Nhiễm vi-rút mạn tính: kiểu gen 2 | ||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 8 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC» sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » daclatasvir: 60 mg uống mỗi ngày một lần trong 12 tuần Có thể cần điều chỉnh liều daclatasvir khi sử dụng đồng thời với chất cảm ứng hoặc chất ức chế CYP3A. -và- » sofosbuvir: 400 mg qua uống mỗi ngày một lần trong 12 tuần » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » daclatasvir: 60 mg uống mỗi ngày một lần trong 16-24 tuần Có thể cần điều chỉnh liều daclatasvir khi sử dụng đồng thời với chất cảm ứng hoặc chất ức chế CYP3A. -và- » sofosbuvir: 400 mg uống mỗi ngày một lần trong 16-24 tuần » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp
» glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 8 tuần |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp
» sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp
» sofosbuvir/velpatasvir/voxilaprevir: 400 mg (sofosbuvir)/100 mg (velpatasvir)/100 mg (voxilaprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể’ phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để’ biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể’ sử dụng tài liệu hướng dẫn khác nhau. |
||
| Nhiễm vi-rút mạn tính: kiểu gen 3 | ||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 8 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » daclatasvir: 60 mg uống mỗi ngày một lần trong 12 tuần Có thể cần điều chỉnh liều daclatasvir khi sử dụng đồng thời với chất cảm ứng hoặc chất ức chế CYP3A. -và- » sofosbuvir: 400 mg qua uống mỗi ngày một lần trong 12 tuần » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp
» sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Khuyến cáo thực hiện xét nghiệm RAS ban đầu tìm Y93H. Nếu xác định có chất thay thế Y93H, phải sử dụng phác đồ khác hoặc phải thêm ribavirin tùy theo cân nặng làm lựa chọn thay thế. Các lựa chọn thứ cấp » daclatasvir: 60 mg uống mỗi ngày một lần trong 12 tuần Có thể cần điều chỉnh liều daclatasvir khi sử dụng đồng thời với chất cảm ứng hoặc chất ức chế CYP3A. -và- » sofosbuvir: 400 mg qua uống mỗi ngày một lần trong 12 tuần HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 16 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » sofosbuvir/velpatasvir/voxilaprevir: 400 mg (sofosbuvir)/100 mg (velpatasvir)/100 mg (voxilaprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Chỉ sử dụng nếu có đột biến Y93H. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp
» elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng kết hợp liều cố định. -và- |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir/voxilaprevir: 400 mg (sofosbuvir)/100 mg (velpatasvir)/100 mg (voxilaprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC» sofosbuvir/velpatasvir/voxilaprevir: 400 mg (sofosbuvir)/100 mg (velpatasvir)/100 mg (voxilaprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12 tuần Dành cho bệnh nhân đã thất bị trong điều trị bằng chất ức chế NS5A trước đây và bị xơ gan, khuyến cáo nên sử dụng ribavirin theo cân nặng. Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
| Nhiễm vi-rút mạn tính: kiểu gen 4 | ||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp
» glecaprevir/pibrentasvir: 300 mg » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg(sofosbuvir) uống mỗi ngày một lần trong 12 tuần. Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 8 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC» elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Khuyến cáo sử dụng phác đồ này đối với các bệnh nhân bị tái phát về mặt vi rút sau đợt điều trị trướcHOẶC» ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » ombitasvir/paritaprevir/ritonavir: 25 mg (ombitasvir)/150 mg (paritaprevir)/100 mg (ritonavir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Ombitasvir/paritaprevir/ritonavir (có hoặc không có dasabuvir) có thể gây tổn thương gan nghiêm trọng và chống chỉ định đối với các bệnh nhân bị tổn thương gan mức độ từ trung bình đến nặng. FDA drug safety communication: FDA warns of serious liver injury risk with hepatitis C treatments Viekira Pak and Technivie http://www.fda.gov/ Drugs/DrugSafety/ucm468634.htm -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. HOẶC » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 16 tuần Được cung cấp theo dạng bào chế liều cố định. Đây là phác đồ dành cho bệnh nhân có kiểu gen 4 mà trước đó đã thất bại trong điều trị vi- rút (không thể ức chế hoặc bùng phát) khi sử dụng peginterferon/ribavirin. Những người này phải được điều trị trong 16 tuần và bổ sung thêm ribavirin dựa theo cân nặng vào elbasvir/ grazoprevir. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong16 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 16 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Khuyến cáo sử dụng phác đồ này đối với các bệnh nhân bị tái phát về mặt vi rút sau đợt điều trị trước bằng peginterferon/ribavirin. HOẶC » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Các lựa chọn thứ cấp » ombitasvir/paritaprevir/ritonavir: 25 mg (ombitasvir)/150 mg (paritaprevir)/100 mg (ritonavir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. Ombitasvir/paritaprevir/ritonavir (có hoặc không có dasabuvir) có thể gây tổn thương gan nghiêm trọng và chống chỉ định đối với các bệnh nhân bị tổn thương gan mức độ từ trung bình đến nặng. FDA drug safety communication: FDA warns of serious liver injury risk with hepatitis C treatments Viekira Pak and Technivie http://www.fda.gov/ Drugs/DrugSafety/ucm468634.htm -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. HOẶC » elbasvir/grazoprevir: 50 mg (elbasvir)/100 mg (grazoprevir) uống mỗi ngày một lần trong 16 tuần Được cung cấp theo dạng bào chế liều cố định. Đây là phác đồ dành cho bệnh nhân có kiểu gen 4 mà trước đó đã thất bại trong điều trị vi- rút (không thể ức chế hoặc bùng phát) khi sử dụng peginterferon/ribavirin. Những người này phải được điều trị trong 16 tuần và bổ sung thêm ribavirin dựa theo cân nặng vào elbasvir/ grazoprevir. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong16 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 16 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. HOẶC » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. -và- » ribavirin: cân nặng <75 kg: 1000 mg/ngày chia thành 2 liều uống trong 12 tuần; cân nặng >75 kg: 1200 mg/ngày chia thành 2 liều uống trong 12 tuần Chống chỉ định đối với phụ nữ mang thai và nam giới có bạn tình nữ đang mang thai. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir/voxilaprevir: 400 mg (sofosbuvir)/100 mg (velpatasvir)/100 mg (voxilaprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
| Nhiễm vi-rút mạn tính: kiểu gen 5 hoặc 6 | ||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp
» glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 8 tuần (không xơ gan) hoặc 12 tuần (mắc xơ gan còn bù) Được cung cấp theo dạng bào chế liều cố định. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » glecaprevir/pibrentasvir: 300 mg (glecaprevir)/120 mg (pibrentasvir) uống mỗi ngày một lần trong 8 tuần (không xơ gan) hoặc 12 tuần (mắc xơ gan còn bù) Được cung cấp theo dạng bào chế liều cố định. HOẶC » ledipasvir/sofosbuvir: 90 mg (ledipasvir)/400 mg (sofosbuvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. HOẶC » sofosbuvir/velpatasvir: 400 mg (sofosbuvir)/100 mg (velpatasvir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
|
1 | Liệu pháp kháng vi-rút |
| Các lựa chọn sơ cấp » sofosbuvir/velpatasvir/voxilaprevir: 400 mg (sofosbuvir)/100 mg (velpatasvir)/100 mg (voxilaprevir) uống mỗi ngày một lần trong 12 tuần Được cung cấp theo dạng bào chế liều cố định. » Các thuốc uống tác động trực tiếp được Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) khuyến cáo. Phác đồ cụ thể phụ thuộc vào kiểu gen và việc có hay không có xơ gan. Các phác đồ theo khuyến cáo được trình bày bên dưới; tuy nhiên, do các hướng dẫn này được cập nhật thường xuyên nên cần tham khảo bản mới nhất để biết các khuyến cáo được cập nhật gần nhất.[45] Các quốc gia khác nhau có thể sử dụng tài liệu hướng dẫn khác nhau. |
||
| Tiếp diễn | ||
| Xơ gan mất bù | ||
| 1 | Giới thiệu đến bác sĩ chuyên khoa | |
| » Bao gồm bệnh nhân có tổn thương gan trung bình hoặc nặng (Child Turcotte Pugh loại B hoặc C) có thể’ hoặc không phải là ứng viên ghép gan, kể’ cả những người bị ung thư biểu mô tế bào gan. » Bệnh nhân phải được giới thiệu đến bác sĩ có kinh nghiệm trong việc điều trị các bệnh nhân này, lý tưởng nhất là ở trung tâm ghép gan. Phác đồ điều trị sẽ phụ thuộc vào kiểu gen của bệnh nhân và họ có đủ điều kiện được dùng ribavirin hay không.[45] Có thể’ sử dụng thuốc ngoài hướng dẫn. » Bệnh nhân bị nhiễm viêm gan C tái phát sau khi ghép gan cũng phải được giới thiệu đến bác sĩ chuyên khoa để’ điều trị. |
||
Giai đoạn đầu
Các phác đồ thay thế” sử dụng daclatasvir
Daclatasvir kèm theo asunaprevir (chất ức chế protease tương tự nucleoside) hiện đang được thử nghiệm ở các bệnh nhân bị nhiễm kiểu gen 1b.[68] Daclatasvir kèm theo asunaprevir cộng với beclabuvir (chất ức chế polymearase không nucleotide) hiện đang được thử nghiệm giai đoạn 3.[69] Phác đồ này cũng sẽ có tác dụng với nhiễm kiểu gen 1a.
Các phương pháp điều trị khác
Các tác nhân bảo vệ tế bào không đặc hiệu có thể giúp ngăn chặn tổn thương tế bào do nhiễm vi-rút. Các nghiên cứu đang được thực hiện sẽ đánh giá các phương pháp phân tử để điều trị viêm gan C, ví dụ như các hạt RNA can thiệp kích thước nhỏ (làm câm gen).[70]
Liên lạc theo dõi
Khuyến nghị
Giám sát
Theo dõi trong quá trình điều trị
- Công thức máu: sau 4 tuần điều trị và theo chỉ định lâm sàng, đặc biệt là ở các bệnh nhân đang dùng ribavirin.
- Chức năng thận: sau 4 tuần điều trị và theo chỉ định lâm sàng.
- Chức năng gan: sau 4 tuần điều trị và theo chỉ định lâm sàng. Mức độ hoạt động của alanine aminotransferase (ALT) tăng gấp 10 lần hoặc tăng dưới 10 lần đi kèm với tình trạng yếu, buồn nôn, nôn, vàng da hoặc bilirubin, phosphatase kiềm hoặc INR tăng mạnh ở tuần 4 cảnh báo cần dừng điều trị. Tình trạng ALT tăng dưới 10 lần và không có triệu chứng cảnh báo cần theo dõi chặt chẽ và xét nghiệm lại 2 tuần một lần. Nếu các nồng độ tăng kéo dài, cần cân nhắc dừng điều trị. Các bệnh nhân đang dùng elbasvir/grazoprevir cần được theo dõi ở tuần thứ 8 và tuần thứ 12 nếu được điều trị trong 16 tuần.
- RNA HCV (tải lượng virus HCV): khuyến cáo thực hiện sau 4 tuần điều trị và ở tuần thứ 12 sau khi hoàn tất điều trị. Có thể được cân nhắc khi kết thúc điều trị và 24 tuần hoặc lâu hơn sau khi hoàn tất điều trị. Nếu phát hiện RNA HCV ở tuần điều trị thứ 4, khuyến cáo lặp lại xét nghiệm sau điều trị thêm 2 tuần nữa. Nếu RNA HCV tăng hơn 10 lần, khuyến cáo nên dừng điều trị.[45]
- Haemoglobin: thiếu máu là tác dụng bất lợi thường gặp với ribavirin và cần theo dõi haemoglobin huyết thanh trong quá trình điều trị. Haemoglobin nền và phần trăm haemoglobin giảm (cùng với mức lọc cầu thận ước tính) đã được dùng để dự đoán nguy cơ thiếu máu trong một nghiên cứu.[86]
- Xét nghiệm mang thai: khuyến cáo thực hiện sau mỗi khoảng thời gian thích hợp, trong và 6 tháng sau khi điều trị bằng các phác đồ chứa ribavirin.
- Khác: cần theo dõi các bệnh nhân trong quá trình điều trị để biết mức độ tuân thủ, tác dụng bất lợi và tương tác thuốc. Các bệnh nhân mắc xơ gan còn bù đang điều trị bằng các phác đồ có paritaprevir/ritonavir cần được đánh giá về các dấu hiệu của bệnh gan mất bù như bệnh não hoặc cổ trướng và với bảng xét nghiệm gan ở tuần điều trị thứ 2 và thứ 4, đồng thời theo chỉ định lâm sàng. Cần ngưng sử dụng các phác đồ có paritaprevir/ ritonavir nếu bệnh nhân bị cổ trướng, bệnh não hoặc bilirubin trực tiếp, AST hoặc ALT tăng mạnh.[45]
Viêm gan B tái hoạt động
- Các ca viêm gan B tái hoạt động đã được báo cáo trong hoặc sau khi trị liệu bằng các chất kháng virus tác động trực tiếp.[65] [66]
- Cần đánh giá tình trạng nhiễm viêm gan B cho tất cả các bệnh nhân bằng cách xét nghiệm HBsAg, kháng thể kháng kháng nguyên bề mặt viêm gan B (anti-HBs) và kháng thể kháng kháng nguyên lõi viêm gan B (anti- HBc) trước khi bắt đầu điều trị bằng các chất kháng virus tác động trực tiếp. Khuyến cáo tiêm vắc-xin viêm gan B đối với tất cả các cá nhân dễ nhiễm vi-rút.[45]
- Ở các bệnh nhân dương tính với HBsAg, phải làm xét nghiệm DNA của vi-rút viêm gan B trước khi bắt đầu điều trị. Các bệnh nhân đáp ứng tiêu chuẩn điều trị viêm gan B hoạt động phải được bắt đầu trị liệu viêm gan B cùng lúc hoặc trước khi bắt đầu sử dụng các thuốc kháng virus tác động trực tiếp. Các bệnh nhân không đáp ứng tiêu chuẩn điều trị cần được: (1) bắt đầu liệu pháp kháng virus dự phòng đối với viêm gan B và tiếp tục cho đến 12 tuần sau khi hoàn tất liệu pháp kháng virus tác động trực tiếp; hoặc (2) theo dõi trong và ngay sau khi áp dụng liệu pháp kháng virus tác động trực tiếp (tải lượng DNA của vi-rút viêm gan B), và điều trị kháng vi-rút viêm gan B trong trường hợp DNA của vi-rút viêm gan B tăng >10 lần so với ban đầu hoặc lên đến >1000 IU/mL ở các bệnh nhân có tải lượng DNA của vi-rút viêm gan B trước đây không phát hiện được hoặc không định lượng được.[45]
- Ở các bệnh nhân có kết quả xét nghiệm dương tính với anti-HBs hoặc anti-HBc, cần xem xét tình trạng viêm gan B tái hoạt động trong trường hợp men gan tăng không rõ nguyên nhân trong (hoặc sau) khi điều trị bằng các thuốc kháng virus tác động trực tiếp.[45]
Theo dõi ở các bệnh nhân đạt được đáp ứng virus bền vững (SVR)
- SVR được định nghĩa là trường hợp không phát hiện được RNA HCV trong huyết thanh trong vòng 12 tuần trở lên sau khi hoàn tất điều trị, tương quan mật thiết với việc không xuất hiện vi-rút trong thời gian dài.[45]
- Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) khuyến cáo như sau:[45]
- Siêu âm: 6 tháng một lần ở các bệnh nhân bị xơ hóa gan tiến triển (giai đoạn 3 hoặc 4) để sàng lọc ung thư biểu mô tế bào gan.
- Nội soi: để sàng lọc giãn tĩnh mạch thực quản ở các bệnh nhân xơ gan.
- RNA HCV (tải lượng virus HCV): để xét nghiệm tái phát hoặc tái nhiễm ở các bệnh nhân đang có các yếu tố nguy cơ nhiễm bệnh hoặc nếu xuất hiện tình trạng rối loạn chức năng gan không rõ nguyên nhân.
- Cần đánh giá các nguyên nhân khác dẫn tới bệnh gan ở các bệnh nhân có kết quả xét nghiệm gan bất thường kéo dài sau SVR.
- Hiệp hội Tiêu hóa Hoa Kỳ khuyến cáo như sau ở các bệnh nhân đạt SVR sau khi điều trị bằng các phác đồ kháng virus tác động trực tiếp:[74]
- Đáp ứng vi-rút: xác nhận ở tuần 48 sau điều trị.
- Nội soi: tiếp tục sàng lọc giãn tĩnh mạch ở tất cả các bệnh nhân xơ gan. Nếu không bị giãn tĩnh mạch trong vòng 2 đến 3 năm, không cần theo dõi thêm ở các bệnh nhân không có nguy cơ bệnh gan tiến triển.
- Siêu âm: tiếp tục theo dõi lâu dài ung thư biểu mô tế bào gan ở các bệnh nhân bị xơ hóa giai đoạn 3 hoặc xơ gan không xác định. Không khuyến cáo theo dõi đối với các bệnh nhân bị xơ hóa ở những giai đoạn đầu.
Theo dõi ở các bệnh nhân không đạt được SVR
- Các bệnh nhân không đạt được SVR (tức là do quá trình điều trị không đào thải được vi-rút hoặc đào thải được nhưng vẫn tái phát sau khi hoàn tất điều trị) có khả năng bị tổn thương gan và lây truyền tiếp diễn sau đó và tiếp tục nhiễm vi-rút.[45]
- Công thức máu, INR và các xét nghiệm về gan: 6 đến 12 tháng một lần để đánh giá mức độ tiến triển bệnh.[45]
- Siêu âm: 6 tháng một lần ở các bệnh nhân bị xơ hóa gan tiến triển (giai đoạn 3 hoặc 4) để sàng lọc ung thư biểu mô tế bào gan.[45]
- Nội soi: để sàng lọc giãn tĩnh mạch thực quản ở các bệnh nhân xơ gan[45]
- Khuyến cáo đánh giá để tái điều trị khi có các phương án điều trị thay thế.
Hướng dẫn dành cho bệnh nhân
Bệnh nhân cần được tư vấn như sau khi sử dụng kết hợp liệu pháp kháng vi-rút chứa ribavirin:
- Yêu cầu cả nam và nữ sử dụng biện pháp tránh thai nghiêm ngặt trong quá trình điều trị và trong vòng 6 tháng sau khi kết thúc điều trị.
Bệnh nhân cũng phải được khuyến cáo rằng:
- Cần tránh tất cả các đồ uống có cồn, do một số dữ liệu cho thấy chỉ cần một lượng nhỏ 140g hàng tuần cũng có thể làm tốc độ xơ gan tăng gấp ba[87]
- Không cần hạn chế paracetamol, trừ những người bị xơ gan có thể dùng liều an toàn tối đa 2g/ngày (một nửa liều lượng tối đa ở bệnh nhân khỏe mạnh)
- Cần thận trọng khi dùng các loại thuốc mới, kể cả các loại thuốc kê theo toa và thuốc không kê theo toa cũng như thảo dược do một số các loại thuốc này có thể tương tác với liệu pháp kháng vi-rút
- Việc điều chỉnh liều lượng thuốc chỉ cần thiết ở bệnh nhân bị xơ gan, trong trường hợp này, thường có thể sử dụng hướng dẫn trên nhãn bao bì thuốc.
Tất cả các bệnh nhân cần được giáo dục về cách tránh lây truyền virus sang cho người khác cũng như cách dùng thuốc sao cho đúng (ví dụ: tần suất, phối hợp với ăn uống).[45]
Các biến chứng
| Các biên chứng | Khung thòi gian | Khả năng |
| Tái hoạt động viêm gan B liên quan đến điều trị | ngắn hạn | thấp |
| Các ca viêm gan B tái hoạt động đã được báo cáo trong hoặc sau khi trị liệu bằng các chất kháng vi-rút tác động trực tiếp.[65] [66]Tình trạng này ở các bệnh nhân đồng nhiễm viêm gan B mạn tính và viêm gan C xảy ra thường xuyên hơn so với các bệnh nhân nhiễm viêm gan B đã khỏi.[78]
Cần đánh giá tình trạng nhiễm viêm gan B cho tất cả các bệnh nhân bằng cách xét nghiệm HBsAg, kháng thể kháng kháng nguyên bề mặt viêm gan B (anti-HBs) và kháng thể kháng kháng nguyên lõi viêm gan B (anti-HBc) trước khi bắt đầu trị liệu bằng các chất kháng vi-rút tác động trực tiếp. Khuyến cáo tiêm vắc-xin viêm gan B đối với tất cả các cá nhân dễ nhiễm vi-rút.[45] Ở các bệnh nhân dương tính với HBsAg, phải làm xét nghiệm DNA viêm gan B trước khi bắt đầu trị liệu. Các bệnh nhân đáp ứng tiêu chuẩn điều trị viêm gan B hoạt động nên được bắt đầu điều trị viêm gan B cùng lúc hoặc trước khi bắt đầu sử dụng các thuốc kháng vi-rút tác động trực tiếp. Các bệnh nhân có nồng độ DNA viêm gan B thấp hoặc không phát hiện được phải được theo dõi ít nhất 4 tuần một lần để xem viêm gan B có tái hoạt động (bằng DNA viêm gan B) hay không, và, nếu nồng độ DNA viêm gan B đáp ứng tiêu chuẩn điều trị, phải bắt đầu tiến hành điều trị viêm gan B.[45] Ở các bệnh nhân có kết quả xét nghiệm dương tính với anti-HBs hoặc anti-HBc, cần xem xét tình trạng viêm gan B tái hoạt động trong trường hợp men gan tăng không rõ nguyên nhân trong (hoặc sau) khi điều trị bằng các thuốc kháng vi- rút tác động trực tiếp.[45] |
||
| Trầm cảm nghiêm trọng liên quan đến interferon | dài hạn | cao |
| Có tới 30% bệnh nhân nhiễm viêm gan C được điều trị bằng interferon bị trầm cảm nặng. Một nghiên cứu thuần tập dựa trên quần thể trong 12 năm cho thấy các bệnh nhân nhiễm viêm gan C có tiền sử trầm cảm do interferon alpha có nguy cơ tái phát trầm cảm cao hơn rất nhiều, ngay cả khi không còn tiếp tục phơi nhiễm với interferon alpha. Việc sử dụng các chất chống trầm cảm trong quá trình điều trị bằng interferon alpha không làm giảm nguy cơ tái phát.[60] | ||
| Xơ gan | dài hạn | trung bình |
| Chỉ 2% đến 20% những người bị nhiễm mạn tính tiến triển thành xơ gan, thường trong khoảng thời gian từ 20 đến 25 năm.[42] Nguy cơ tiến triển thành xơ gan tăng theo thời gian bị nhiễm mạn tính. Các bệnh nhân đồng nhiễm HIV và những người uống rượu từ mức trung bình đến nhiều có thể tiến triển thành xơ gan nhanh hơn nhiều. |
||
| Ung thư gan | dài hạn | thấp |
| Ung thư biểu mô tế bào gan thường chỉ thấy ở các bệnh nhân nhiễm vi-rút viêm gan C (HCV) bị xơ gan nhưng cũng có thể xảy ra ở các bệnh nhân không bị xơ gan.[83] Tỷ lệ mắc mới ở các nước phương Tây gia tăng trong 2 thập kỷ qua, chủ yếu do lượng người mắc viêm gan C nhiều.[84] [85] Biểu hiện bao gồm đau bụng, lơ mơ hoặc sút cân; ngoài ra, có thể phát hiện ung thư biểu mô tế bào gan qua chụp X- quang và có thể không có triệu chứng. Có thể nghi ngờ ung thư biểu mô tế bào gan ở các bệnh nhân xơ gan nếu các bệnh nhân này mất bù. | ||
| Biến chứng về khớp | biến thiên | cao |
| Các biểu hiện về khớp của viêm gan C bao gồm đau cơ, mệt mỏi, đau khớp và viêm khớp.
Các biểu hiện tự miễn gồm có hội chứng Sjogren. |
||
| Biến chứng trên da | biến thiên | trung bình |
| Tổn thương da đi kèm bao gồm rối loạn chuyển hóa porphyria và lichen phẳng. | ||
| Cryoglobulin huyết | biến thiên | trung bình |
| Cryoglobulin là các globulin miễn dịch đơn hoặc hỗn hợp trải qua quá trình lắng đọng thuận nghịch ở nhiệt độ thấp. Cryoglobulin lắng đọng ở da, thận và các khớp. Bệnh nhân có thể có biểu hiện mệt mỏi, đau khớp, bệnh lý thần kinh ngoại biên, ban xuất huyết có thể sờ thấy hoặc viêm cầu thận.[79]
Dạng thường gặp nhất ở người nhiễm viêm gan C là cryoglobulin huyết (hỗn hợp) tuýp II. Cryoglobulin huyết có khả năng không xuất hiện triệu chứng cao và khả năng xuất hiện triệu chứng thấp. |
||
| Viêm cầu thận | biến thiên | thấp |
| Bệnh thận thường gặp nhất liên quan đến nhiễm viêm gan C là viêm cầu thận màng tăng sinh, có thể biểu hiện protein niệu, tiểu máu và thậm chí phù, tăng huyết áp và suy thận.[81] | ||
| Biến chứng ở mắt | biến thiên | thấp |
| Biểu hiện ở mắt bao gồm viêm kết giác mạc khô (khô mắt), đây có thể là biểu hiện của hội chứng Sjogren và loét Mooren (tình trạng loét giác mạc tiến triển nhanh gây đau).[82] Có thể chẩn đoán bằng cách loại trừ các nguyên nhân khác gây loét giác mạc. | ||
Tiên lượng
Một nghiên cứu tại châu Âu cho thấy tỷ lệ sống sót sau 5 năm là 91% và tỷ lệ sống sót sau 10 năm là 79% ở các bệnh nhân mắc viêm gan C và xơ gan còn bù.[42] [71] Trong số các bệnh nhân mắc xơ gan còn bù, tình trạng mất bù phát triển ở 18% số bệnh nhân sau 5 năm và ở 30% sau 10 năm.[72] [73] Đối với các bệnh nhân xơ gan mất bù, tỷ lệ sống sót sau 5 năm chỉ là 50%. Mặc dù hiếm khi xảy ra nhưng tình trạng tái phát vẫn có thể xảy ra sau khi đáp ứng virus bền vững.[74]
Một nghiên cứu của Ý trên gần 200 người bị nhiễm vi-rút viêm gan C (HCV) bị xơ gan còn bù đã theo dõi tiếp trong 14 năm cho thấy nguy cơ tử vong là khoảng 2,5% mỗi năm nhưng nếu bị giãn tĩnh mạch thực quản từ đầu thì con số này sẽ tăng gấp đôi (5% mỗi năm). Ngoài ra, người ta cũng đã xác nhận được rằng kiểu gen 1b, kiểu gen phổ biến nhất trên toàn thế giới có liên quan đến nguy cơ bị ung thư biểu mô tế bào gan, mất bù gan cũng như tỷ lệ tử vong cao hơn.[75] Tương tự, kiểu gen 3 có liên quan đến nguy cơ cao hơn bị xơ gan và ung thư biểu mô tế bào gan.[76]
Tỷ lệ tử vong ngày càng cao và số lượng ca tử vong liên quan đến HCV hiện nay đã vượt qua số lượng ca tử vong liên quan đến HIV/AIDS tại Hoa Kỳ. Số ca tử vong do HCV là 19.659 ca vào năm 2014 (5 ca tử vong trên dân số 100.000 người), chủ yếu là các bệnh nhân thuộc độ tuổi từ 55 đến 64 tuổi (25 ca tử vong trên dân số 100.000 người tức 50,9% trong số tất cả các ca tử vong liên quan đến HCV). Tỷ lệ tử vong ở nam cao hơn khoảng 2,6 lần so với nữ giới.[12]
Một nghiên dựa trên quần thể tại Hoa Kỳ đã phát hiện ra rằng tỷ lệ tử vong vượt mức ở các bệnh nhân nhiễm HCV có thể là do các hành vi gây ra nguy cơ cho sức khỏe có thể điều chỉnh được (tức là hút thuốc, uống rượu hoặc sử dụng tiền chất gây nghiện, không vận động thể chất và chế độ ăn uống không lành mạnh) hơn là do nhiễm HCV.[77]
Hướng dẫn
Hướng dẫn chẩn đoán
Châu Âu
The OraQuick HCV point-of-care test for rapid detection of hepatitis C virus antibodies
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2015
Virtual Touch Quantification to diagnose and monitor liver fibrosis in chronic hepatitis B and C
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2015
United Kingdom national guideline on the management of the viral hepatitides A, B and C
Quốc tế
Guidelines on hepatitis B and C testing
Nhà xuất bản: World Health Organization
Xuất bản lần cuối: 2017
Bắc Mỹ
Recommendations for testing, managing, and treating hepatitis C
Nhà xuất bản: American Association for the Study of Liver Disease; Infectious Diseases Society of America
Xuất bản lần cuối: 2018
Recommendations on hepatitis C screening for adults
Nhà xuất bản: Canadian Task Force on Preventive Health Care
Xuất bản lần cuối: 2017
CDC health information for international travel (The Yellow Book). Chapter 3: infectious
diseases related to travel – hepatitis C
Nhà xuất bản: Centers for Disease Control and Prevention
Xuất bản lần cuối: 2017
Hướng dẫn điều trị
Châu Âu
Sofosbuvir-velpatasvir-voxilaprevir for treating chronic hepatitis C
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2018
Glecaprevir-pibrentasvir for treating chronic hepatitis C
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2018
Sofosbuvir-velpatasvir for treating chronic hepatitis C
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2017
Bloodborne viruses in healthcare workers: health clearance and management
Ombitasvir-paritaprevir-ritonavir with or without dasabuvir for treating chronic hepatitis C
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2015
Simeprevir in combination with peginterferon alfa and ribavirin for treating genotypes 1 and
4 chronic hepatitis C
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2015
United Kingdom national guideline on the management of the viral hepatitides A, B and C
Nhà xuất bản: British Association for Sexual Health and HIV
Xuất bản lần cuối: 2015
British HIV Association guidelines for the management of hepatitis viruses in adults infected with HIV
Nhà xuất bản: British HIV Association
Xuất bản lần cuối: 2014
Management of hepatitis C
Nhà xuất bản: Scottish Intercollegiate Guidelines Network Xuất bản lần cuối: 2013
Quốc tế
Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection
Nhà xuất bản: World Health Organization
Xuất bản lần cuối: 2016
Bắc Mỹ
Recommendations for testing, managing, and treating hepatitis C
Nhà xuất bản: American Association for the Study of Liver Disease; Infectious
Xuất bản lần cuối: 2018
Diseases Society of America
CDC health information for international travel (The Yellow Book). Chapter 3: infectious
Mỹ La Tinh
Protocolo clínico e diretrizes terapêuticas para hepatite C e coinfecẹões (Clinical protocol and
Simeprevir, sofosbuvir e daclatasvir no tratamento da hepatite crônica tipo C e coinfecẹões (Simeprevir, sofosbuvir and daclatasvir in the treatment of chronic hepatitis C and
coinfections)
Nhà xuất bản: Ministério da Saúde (Brazil)
Xuất bản lần cuối: 2015
Châu Đại Dương
Australian recommendations for the management of hepatitis C virus infection: consensus statement 2017
Nhà xuất bản: Gastroenterological Society of Australia
Xuất bản lần cuối: 2017
Nguồn trợ giúp trực tuyến
- CDC: hepatitis C, acute – 2016 case definition (external link)
- CDC: hepatitis C, chronic – 2016 case definition (external link)
- BMJ Best Practice podcast: hepatitis C – what have been our successes so far? (external link)
- Recommendations for testing, managing, and treating hepatitis C (external link)
- AASLD/IDSA: HCV resistance primer (external link)
- FDA drug safety communication: FDA warns of serious liver injury risk with hepatitis C treatments Viekira Pak and Technivie (external link)
Các bài báo chủ yếu
- American Association for the Study of Liver Diseases; Infectious Diseases Society of America. HCV guidance: recommendations for testing, managing, and treating hepatitis C. May 2018 [internet publication]. Toàn văn
- Falade-Nwulia O, Suarez-Cuervo C, Nelson DR, et al. Oral direct-acting agent therapy for hepatitis C virus infection: a systematic review. Ann Intern Med. 2017;166:637-648. Toàn văn Tóm lược
- Jacobson IM, Lim JK, Fried MW. American Gastroenterological Association Institute clinical practice update – expert review: care of patients who have achieved a sustained virologic response after antiviral therapy for chronic hepatitis C infection. Gastroenterology. 2017;152:1578-1587. Toàn văn Tóm lược.
Ca lâm sàng
Ca 1
Bệnh nhân nam 54 tuổi đi khám vì mệt mỏi, chán ăn và sụt ký không chủ ý (7kg) trong 6 tháng qua. Bệnh nhân cũng chú ý rằng, mặc dù sụt cân nhưng quần anh ta mặc thấy chật hơn và vớ cũng để lại vết sâu hơn trên chân. Anh ấy có tiền căn tăng huyết áp, đang điều trị bằng amlodipine. Anh ấy không biết về tiền căn gia đình khi anh ấy được nhận nuôi. Bệnh nhân đã từng hút 56 điếu cigarettes mỗi ngày và uống 1 – 2 lon bia vào cuối tuần. Anh ấy có tiền căn xa dùng ma túy đường tiêm. Huyết áp 134/82 mmHg, mạch 84 lần/phút, BMI 23 kg/m2. Áp lực tính mạch cổ bình thường. Bệnh nhân có nữ hóa tuyến vú 2 bên và một vài dấu sao mạch ở thân trên. Khám tim chưa ghi nhận bất thường. Phổi giảm âm phế bào ở 2 đáy. Bụng mềm, chướng, gõ đục vùng thấp. Phù ấn lõm 2 chân. Chẩn đoán nào sau đây phù hợp với tình trạng của bệnh nhân.
- Tác dụng phụ của thuốc.
- Nhiễm virus mạn tính.
- Tâm phế mạn (Cor pulmonale).
- Suy giáp.
- Ung thư phổi.
- Hội chứng thận hư.
Bệnh nhân nam, 54 tuổi, đi khám vì mệt mỏi
- Bệnh gan mạn: chán ăn, sụt cân, phù chânm nữ hóa tuyến vú, lòng bàn tay son
- Tăng áp lực tĩnh mạch cửa: báng bụng
- Tiền căn: tiêm chích ma túy
Hỏi: Chẩn đoán nào sau đây phù hợp với tình trạng của bệnh nhân.
Đáp án: B: nhiễm virus mạn tính
Bệnh nhân có phù chân, báng bụng, nữ hóa tuyến vú và dấu sao mạch có khả năng là xơ gan và tăng áp lực tĩnh mạch cửa. Các biểu hiện lâm sàng khác gợi ý xơ gan là lòng bàn tay son, tuần hoàn bàng hệ cửa chủ và lách to. Nguyên nhân phổ biến gây xơ gan tại Mỹ bao gồm viêm gan siêu vi (C nhiều hơn B), nghiện rượu mạn, bệnh gan không do rượu (NAFLD) và bệnh ứ sắt.
Tiếp cận ban đầu trên bệnh nhân nghi ngờ xơ gan bao gồm thu thập tiền căn bênh lý, dùng thuốc, thói quen xã hội (eg: dùng rượu bia, ma túy và hành vi quan hệ nguy cơ cao) và tiền căn gia đình (eg: loại trừ bệnh ứ sắt). Bệnh nhân có tiền căn tiêm chích ma túy, nhiều khả năng xơ gan của bệnh nhân là do nhiễm virus viêm gan. Anh ấy không có tiền căn sử dụng rượu bia đáng kể. Anh ấy cũng không thừa cân do đó ít khả năng NAFLD. Tiền căn gia đình của bệnh nhân không rõ ràng, nhưng bệnh nhân không có dấu hiệu của bệnh ứ sắt (bronze diabetes, bệnh cơ tim và bệnh khớp). Các xét nghiệm lâm sàng bao gồm, huyết thanh chẩn đoán virus và sắt. Nếu nguyên nhân vẫn không được xác định, bệnh nhân có thể cần được xét nghiệm thêm để tìm nguyên nhân gây xơ gan ít phổ biến hơn.
(Lựa chọn A) Amlodipine có thể gây phù chân nhưng methotrexate, isoniazid có thể gây xơ gan nhưng ít phổ biến.
(Lựa chọn C) Cor pulmonae có thể gây mệt mỏi và phù chân nhưng không gây nữ hóa tuyến vú và dấu sao mặt. Bệnh cũng ít có khả năng do không có một số biểu hiện khác (như khó thở khi gắng sức, đau thắt ngực, tiếng T2 lớn, …
(Lựa chọn D) Suy giáp có thể gây mệt mỏi, trà nhiên, các dấu hiệu này hiếm nếu không phải là chậm, bướu cổ). Suy giáp thường ít khả năng gây nữ hóa tuyến vú và dấu sao mạch.
(Lựa chọn E) Ung thư phổi có thể gây mệt mỏi, sụt cân, chán ăn, phù chân và báng bụng ở bệnh nhân có bệnh tiến triển (eg: di căn cản trở bạch huyết, peritoneal carcinomatosis) nhưng bếnh ít gây nữ hóa tuyến vú hoặc dấu sao mạch.
(Lựa chọn F) Hội chứng thận hư có thể gây phù nhưng thường ít liên quan đến dấu sao mạch và hội chứng thận hư.
Kết luận: Xơ gan cần được nghi ngờ ở những bệnh nhân có bằng chứng bệnh gan mạn (eg: báng bụng, sao mạch, nữ hóa tuyến vú, lách to). Viêm gan do virus, nghiện rượu, bệnh gan nhiễm mỡ không do rượu và bệnh ứ sắt là những nguyên nhân phổ biến gây xơ gan ở Mỹ.
Ca 2
Bệnh nhân nữ, 53 tuổi, đi khám vì tăng men gan. Cô ấy đôi khi có sử dụng acetaminophen cho đau lưng nhẹ, antacid cho triệu chứng ợ nóng (heartburn) và không có vấn đề sức khỏe lớn nào khác. Bệnh nhân cũng đã không đi khám bác sĩ nhiều năm. Chưa ghi nhận tiền căn sụt cân, vàng da, ban da, đau khớp, nôn ói và đi tiêu phân đen. Bệnh nhân không đi du lịch gần đây. Mỗi ngày, cô ấy đều có dùng hết 1 gói thuốc lá và uống 1-2 ly rượu. Hơn 30 năm trước, bệnh nhân có sử dụng ma túy dạng tiêm tĩnh mạch trong 2 năm, sau đó không còn dùng nữa. Huyết áp 143/94 mmHg, mạch 87 lần/phút. BMI 29 kg/m. Khám tim phổi chưa ghi nhận bất thường. Khám bụng thấy gan to nhẹ, lách không sờ chạm. Siêu âm bụng: gan tăng hồi âm không khối u. Xét nghiệm ghi nhận:
| Hct | 38% |
| PLT | |
| Creatinine | 0.8 mg/dL |
| Liver functions studies | |
| Albumin | 4g/dL |
| Total bilirubin | 1.3 mg/dL |
| ALP | 120 U/L |
| AST | 87 U/L |
| ALT | 124 U/L |
| INR | 0.8 |
| Hepatitis panel | |
| HAV antibody | Neg |
| HBs antibody | Pos |
| HBs antigen | Neg |
| HCV antibody | Pos |
| HCV RNA | 1 978 677 IU/ml |
Lời khuyên nào sau đây là phù hợp nhất cho bệnh nhân:
- Furosemide and spironolactone.
- Hepatitis A vaccination.
- Hepatitis B vaccination.
- Lamivudine.
- Prednisolone.
- Giảm cân.
Đáp án: B: Tiêm chủng vaccine HAV.
Bệnh nhân không biểu hiện triệu chứng triệu chứng có kết quả xét nghiệm tăng men gan, gan to, tăng hồi âm, HCV Ab dương tính, và HCV RNA tăng cao, tất cả các đặc điểm phù hợp với nhiễm HCV mạn tính. Nhiễm HCV mãn tính thường không có triệu chứng, và chỉ xuất huyết một số bất thường nhỏ trên cận lâm sàng. Sàng lọc nhiễm HCV nên được thực hiện ở các dân số có chọn lọc (ví dụ: tiền căn sử dụng ma túy đường tĩnh mạch).
Mặc dù đã có sự ra đời của các thuốc kháng vi-rút tác động trực tiếp (ví dụ, sofosbuvir- velpatasvir), đã giúp cho việc điều trị được cải thiện đáng kể điều trị bằng virus, điều trị HCV vẫn bao gồm các chiến lược ngăn ngừa tổn thương gan, bao gồm tránh uống rượu, chủng ngừa viêm gan A (HAV) và viêm gan B (HBV). Bệnh nhân này không có bằng chứng miễn dịch với HAV (HAV âm tính kháng thể), nên cô ấy cần được tiêm ngừa. Cô ấy có miễn dịch với HBV (kháng thể bề mặt HBV dương tính) nhưng không có bằng chứng về nhiễm HBV (kháng nguyên bề mặt HBV âm tính); do đó, cô ấy không cần tiêm phòng bổ sung hoặc điều trị HBV (Lựa chọn C).
Bệnh nhân nhiễm HCV cũng nên được đánh giá tầm soát xơ gan và các yếu tố nguy cơ liên quan khác vào thời điểm thích hợp (ví dụ, giãn tĩnh mạch thực quản).
(Lựa chọn A) Bệnh nhân có bằng chứng xơ gan (thường liên quan đến gan teo nhỏ, giảm tiểu cầu và rối loạn đông máu [ví dụ: INR tăng cao]) và báng bụng (biểu hiện dấu song vô khi khám bụng) nên được bắt đầu điều trị lợi tiểu để cải thiện chất lượng cuộc sống và giảm các biến chứng như viêm phúc mạc tự phát.
(Lựa chọn D) Lamivudine (3TC) là chất ức chế men sao chép ngược đôi khi được sử dụng để điều trị đồng nhiễm HIV và HBV mạn tính.
(Lựa chọn E) Prednisolone được sử dụng để điều trị viêm gan nặng do rượu, thường có sốt, đau bụng, vàng da, buồn nôn và nôn ói.
(Lựa chọn F) Giảm cân rất quan trọng đối với sức khỏe của bệnh nhân này và đặc biệt hữu ích trong việc kiể’m soát bệnh gan nhiễm mỡ không do rượu. Tuy nhiên, với các bệnh nhân nhiễm HCV, chùng ngừa HAV và HBV là phương pháp điều trị chính nên được thực hiện đầu tiên.
Kết luận:
Quản lý bệnh gan mạn tính bao gồm cả điều trị nguyên nhân và các chiến lược để ngăn ngừa tổn thương gan (ví dụ như hạn chế rượu bia, tiêm phòng viêm gan A và viêm gan B).
Tài liệu tham khảo
- Lingala S, Ghany MG. Natural history of hepatitis C. Gastroenterol Clin North Am. 2015;44:717-734. Tóm lược
- Dultz G, Zeuzem S. Hepatitis C virus: a European perspective. Gastroenterol Clin North Am. 2015;44:807-824. Tóm lược
- Dan YY, Lim SG. Hepatitis C: an Eastern perspective. Gastroenterol Clin North Am. 2015;44:793-805. Tóm lược
- Hoofnagle JH. Hepatitis C: the clinical spectrum of disease. Hepatology. 1997;26(suppl 1):15s-20s. Tóm lược
- Alter MJ, Margolis HS, Krawczynski K, et al.The natural history of community-acquired hepatitis C in the United States. The Sentinel Counties Chronic non-A, non-B Hepatitis Study Team. N Engl J Med. 1992;327:1899-1905. Tóm lược
- World Health Organization. Global hepatitis report, 2017. April 2017. http://apps.who.int (last accessed 27 September 2017). Toàn văn
- Messina JP, Humphreys I, Flaxman A, et al. Global distribution and prevalence of hepatitis C virus genotypes. Hepatology. 2015;61:77-87. Toàn văn Tóm lược
- Gower E, Estes C, Blach S, et al. Global epidemiology and genotype distribution of the hepatitis C virus infection. JHepatol. 2014;61(suppl):S45-S57. Toàn văn Tóm lược
- World Health Organization. Hepatitis C – global prevalence (update). Wkly Epidemiol Rec. 1999;74:425-427. Toàn văn Tóm lược
- Public Health England. Hepatitis C in the UK: 2017 report. London: PHE publications; 2017. Toàn văn
- Nouroza F, Shaheena S, Mujtaba G, et al. An overview on hepatitis C virus genotypes and its control. Egypt J Med Hum Gen. 2015;16:291-298. Toàn văn
- Centers for Disease Control and Prevention. Surveillance for viral hepatitis – United States, 2014: hepatitis C. November 2016. http://www.cdc.gov/ (last accessed 27 September 2017). Toàn văn
- Armstrong GL, Wasley A, Simard EP, et al. The prevalence of hepatitis C virus infection in the United States, 1999 through 2002. Ann Intern Med. 2006;144:705-714. Tóm lược
- Wasley A, Alter MJ. Epidemiology of hepatitis C: geographic differences and temporal trends. Semin Liver Dis. 2000;20:1-16. Tóm lược
- Mahowald MK, Larney S, Zaller ND, et al. Characterizing the burden of hepatitis C infection among entrants to Pennsylvania state prisons, 2004 to 2012. J Correct Health Care. 2016;22:41-45. Toàn văn Tóm lược
- Ly KN, Jiles RB, Teshale EH, et al. Hepatitis C virus infection among reproductive-aged women and children in the United States, 2006 to 2014. Ann Intern Med. 2017;166:775-782. Tóm lược
- Davis GL, Alter MJ, El-Serag H, et al. Aging of hepatitis C virus (HCV)-infected persons in the United States: a multiple cohort model of HCV prevalence and disease progression. Gastroenterology. 2010;138:513-521. Tóm lược
- Mahajan R, Xing J, Liu SJ, et al. Mortality among persons in care with hepatitis C virus infection: the Chronic Hepatitis Cohort Study (CHeCS), 2006-2010. Clin Infect Dis. 2014;58:1055-1061. Toàn văn Tóm lược
- Alter MJ. Prevention of spread of hepatitis C. Hepatology. 2002;36(5 Suppl 1):S93-S98. Tóm lược
- Garcia-Tejedor A, Maiques-Montesinos V, Diago-Almela VJ, et al. Risk factors for vertical transmission of hepatitis C virus: a single center experience with 710 HCV-infected mothers. Eur J Obstet Gynecol Reprod Biol. 2015;194:173-177. Tóm lược
- Indolfi G, Nesi A, Resti M. Intrafamilial transmission of hepatitis C virus. J Med Virol. 2013;85:608-614. Tóm lược
- Gerlach JT, Diepolder HM, Zachoval R. Acute hepatitis C: high rate of both spontaneous and treatment -induced viral clearance. Gastroenterology. 2003;125:80-88. Tóm lược
- Pawlotsky JM. Pathophysiology of hepatitis C virus infection and related liver disease. Trends Microbiol. 2004;12:96-102. Tóm lược
- Smith JA, Aberle JH, Fleming VM, et al. Dynamic coinfection with multiple viral subtypes in acute hepatitis C. J Infect Dis. 2010;202:1770-1779. Toàn văn Tóm lược
- World Health Organization. WHO best practices for injections and related procedures toolkit. March 2010. http:// apps.who.int/ (last accessed 27 September 2017). Toàn văn Tóm lược
- Garfein RS, Vlahov D, Galai N, et al. Viral infections in short-term injection drug users: the prevalence of the hepatitis C, hepatitis B, human immunodeficiency, and human T-lymphotropic viruses. Am J Public Health. 1996;86:655-661. Toàn văn Tóm lược
- Platt L, Minozzi S, Reed J, et al. Needle syringe programmes and opioid substitution therapy for preventing hepatitis C transmission in people who inject drugs. Cochrane Database Syst Rev. 2017 Sep 18;9:CD012021. Toàn văn Tóm lược
- Pomper GJ, Wu Y, Snyder EL. Risks of transfusion-transmitted infections: 2003. Curr Opin Hematol. 2003;10:412-418. Tóm lược
- Centers for Disease Control and Prevention. CDC announces first ever national hepatitis testing day and proposes that all baby boomers be tested once for hepatitis C. May 2012. http://www.cdc.gov/ (last accessed 27 September 2017). Toàn văn
- Thomas DL, Thio CL, Martin MP, et al. Genetic variation in IL28B and spontaneous clearance of hepatitis C virus. Nature. 2009;461:798-801. Tóm lược
- Pearlman BL. Hepatitis C virus infection in African Americans. Clin Infect Dis. 2006;42:82-91. Tóm lược
- Finelli L, Miller JT, Tokars JI, et al. National surveillance of dialysis-associated diseases in the United States, 2002. Semin Dial. 2005;18:52-61. Tóm lược
- Puro V, Petrosillo N, Ippolito G. Risk of hepatitis C seroconversion after occupational exposures in health care workers. Italian Study Group on Occupational Risk of HIV and Other Bloodborne Infections. Am J Infect Control. 1995;23:273-277. Tóm lược
- Jafari S, Copes R, Baharlou S, et al. Tattooing and the risk of transmission of hepatitis C: a systematic review and meta-analysis. Int J Infect Dis. 2010;14:928-940. Tóm lược
- Stroffolini T, Lorenzoni U, Menniti-Ippolito F, et al. Hepatitis C virus infection in spouses: sexual transmission or common exposure to the same risk factors? Am J Gastroenterol. 2001;96:3138-3141. Tóm lược
- Terrault NA, Dodge JL, Murphy EL, et al. Sexual transmission of hepatitis C virus among monogamous heterosexual couples: the HCV partners study. Hepatology. 2013;57:881-889. Toàn văn Tóm lược
- Yeung LT, King SM, Roberts EA. Mother-to-infant transmission of hepatitis C virus. Hepatology. 2001;34:223-229. Tóm lược
- Seeff LB. Natural history of hepatitis C. Hepatology. 1997;26(3 Suppl 1):21S-28S. Tóm lược
- Hagan H, Des Jarlais DC, Friedman SR, et al. Reduced risk of hepatitis B and hepatitis C among injection drug users in the Tacoma Syringe Exchange Program. Am J Public Health. 1995;85:1531-1537. Toàn văn Tóm lược
- Villano SA, Vlahov D, Nelson KE, et al. Persistence of viremia and the importance of long-term follow-up after acute hepatitis C infection. Hepatology. 1999;29:908-914. Tóm lược
- Alter HJ, Seeff LB. Recovery, persistence, and sequelae in hepatitis C virus infection: a perspective on long-term outcome. Semin Liver Dis. 2000;20:17-35. Tóm lược
- National Institutes of Health. National Institutes of Health consensus development conference statement: management of hepatitis C: 2002 – June 10-12, 2002. Hepatology. 2002;36(suppl 1):S3-S20. Tóm lược
- Hézode C, Zafrani ES, Roudot-Thoraval F, et al. Daily cannabis use: a novel risk factor of steatosis severity in patients with chronic hepatitis C. Gastroenterology. 2008;134:432-439. Toàn văn Tóm lược
- Ishida JH, Peters MG, Jin C, et al. Influence of cannabis use on severity of hepatitis C disease. Clin Gastroenterol Hepatol. 2008;6:69-75. Toàn văn Tóm lược
- American Association for the Study of Liver Diseases; Infectious Diseases Society of America. HCV guidance: recommendations for testing, managing, and treating hepatitis C. May 2018 [internet publication]. Toàn văn
- Scott JD, Gretch DR. Molecular diagnostics of hepatitis C virus infection. JAMA. 2007;297:724-732. Tóm lược
- Shaheen AA, Wan AF, Myers RP. FibroTest and FibroScan for the prediction of hepatitis C-related fibrosis: a systematic review of diagnostic test accuracy. Am J Gastroenterol. 2007;102:2589-2600. Tóm lược
- Calvaruso V, Cammà C, Di Marco V, et al. Fibrosis staging in chronic hepatitis C: analysis of discordance between transient elastography and liver biopsy. J Viral Hepat. 2010;17:469-474. Tóm lược
- Centers for Disease Control and Prevention. Hepatitis C, acute: 2016 case definition. https://wwwn.cdc.gov/ (last accessed 27 September 2017). Toàn văn
- Centers for Disease Control and Prevention. Hepatitis C, chronic: 2016 case definition. https://wwwn.cdc.gov/ (last accessed 27 September 2017). Toàn văn
- Public Health England. Public Health England encourages hepatitis C testing. 28 July 2017. https://www.gov.uk/ (last accessed 26 September 2017). Toàn văn
- Centers for Disease Control and Prevention. Screening for hepatitis during the domestic medical examination. March 2014. http://www.cdc.gov/ (last accessed 27 September 2017). Toàn văn
- Moyer VA; US Preventive Services Task Force. Screening for hepatitis C virus infection in adults: US Preventive Services Task Force recommendation statement. Ann Intern Med. 2013;159:349-357. Toàn văn Tóm lược
- Rein DB, Smith BD, Wittenborn JS, et al. The cost-effectiveness of birth-cohort screening for hepatitis C antibody in US primary care settings. Ann Intern Med. 2012;156:263-270. Tóm lược
- McGarry LJ, Pawar VS, Panchmatia HR, et al. Economic model of a birth cohort screening program for hepatitis C virus. Hepatology. 2012;55:1344-1355. Tóm lược
- Coffin PO, Scott JD, Golden MR, et al. Cost-effectiveness and population outcomes of general population screening for hepatitis C. Clin Infect Dis. 2012;54:1259-1271. Tóm lược
- Jemal A, Fedewa SA. Recent hepatitis C virus testing patterns among baby boomers. Am J Prev Med. 2017;53:e31- e33. Tóm lược
- Chappell CA, Hillier SL, Crowe D, et al. Hepatitis C virus screening among children exposed during pregnancy. Pediatrics. 2018 May 2. pii: e20173273. Tóm lược
- Forns X, Lee SS, Valdes J, et al. Glecaprevir plus pibrentasvir for chronic hepatitis C virus genotype 1, 2, 4, 5, or 6 infection in adults with compensated cirrhosis (EXPEDITION-1): a single-arm, open-label, multicentre phase 3 trial. Lancet Infect Dis. 2017 Aug 14 [epub ahead of print]. Toàn văn Tóm lược
- Chiu WC, Su YP, Su KP, et al. Recurrence of depressive disorders after interferon-induced depression. Transl Psychiatry. 2017;7:e1026. Toàn văn Tóm lược
- Jakobsen JC, Nielsen EE, Feinberg J, et al. Direct-acting antivirals for chronic hepatitis C. Cochrane Database Syst Rev. 2017;(9):CD012143. Toàn văn Tóm lược
- Powderly WG, Naggie S, Kim AY, et al. IDSA/AASLD response to Cochrane review on direct-acting antivirals for hepatitis C. Clin Infecti Dis. 17 July 2017. https://academic.oup.com/cid/ (last accessed 26 September 2017). Toàn văn
- European Association for the Study of the Liver. Response to the Cochrane systematic review on DAA-based treatment of chronic hepatitis C. June 2017. http://www.journal-of-hepatology.eu/content/pressreleases (last accessed 27 September 2017). Toàn văn
- Jakobsen JC, Nielsen EE, Koretz RL, et al. Do direct acting antivirals cure chronic hepatitis C? BMJ. 2018 May 10;361:k1382. Toàn văn Tóm lược
- US Food and Drug Administration. FDA drug safety communication: FDA warns about the risk of hepatitis B reactivating in some patients treated with direct-acting antivirals for hepatitis C. October 2016. https:// www.fda.gov/ (last accessed 27 September 2017). Toàn văn
- European Medicines Agency. PRAC warns of risk of hepatitis B re-activation with direct-acting antivirals for hepatitis C. December 2016. http://www.ema.europa.eu/ (last accessed 27 September 2017). Toàn văn
- Falade-Nwulia O, Suarez-Cuervo C, Nelson DR, et al. Oral direct-acting agent therapy for hepatitis C virus infection: a systematic review. Ann Intern Med. 2017;166:637-648. Toàn văn Tóm lược
- Sulkowski MS, Gardiner DF, Rodriguez-Torres M, et al. Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection. N Engl J Med. 2014;370:211-221. Toàn văn Tóm lược
- Friborg J, Zhou N, Han Z, et al. In vitro assessment of re-treatment options for patients with hepatitis C virus genotype 1b infection resistant to daclatasvir plus asunaprevir. Infect Dis Ther. 2015;4:137-144. Toàn văn Tóm lược
- van der Ree MH, de Vree JM, Stelma F, et al. Safety, tolerability, and antiviral effect of RG-101 in patients with chronic hepatitis C: a phase 1B, double-blind, randomised controlled trial. Lancet. 2017;389:709-717. Tóm lược
- Fattovich G, Guistina G, Degos F, et al. Morbidity and mortality in compensated cirrhosis type C: a retrospective follow-up study of 384 patients. Gastroenterology. 1997;112:463-472. Tóm lược
- Niederau C, Lange S, Heintges T, et al. Prognosis of chronic hepatitis C: results of a large, prospective cohort study. Hepatology. 1998;28:1687-1695. Tóm lược
- Planas R, Balleste B, Alvarez MA, et al. Natural history of decompensated hepatitis C virus-related cirrhosis: a study of 200 patients. J Hepatol. 2004;40:823-830. Tóm lược
- Jacobson IM, Lim JK, Fried MW. American Gastroenterological Association Institute clinical practice update – expert review: care of patients who have achieved a sustained virologic response after antiviral therapy for chronic hepatitis C infection. Gastroenterology. 2017;152:1578-1587. Toàn văn Tóm lược
- Bruno S, Zuin M, Crosignani A, et al. Predicting mortality risk in patients with compensated HCV-induced cirrhosis: a long-term prospective study. Am J Gastroenterol. 2009;104:1147-1158. Tóm lược
- Kanwal F, Kramer JR, Ilyas J, et al. HCV genotype 3 is associated with an increased risk of cirrhosis and hepatocellular cancer in a national sample of US Veterans with HCV. Hepatology. 2014;60:98-105. Tóm lược
- Innes H, McAuley A, Alavi M, et al. The contribution of health risk behaviours to excess mortality in American adults with chronic hepatitis C: A population cohort-study. Hepatology. 2017 Aug 4 [epub ahead of print]. Toàn văn Tóm lược
- Mucke MM, Backus LI, Mucke VT, et al. Hepatitis B virus reactivation during direct-acting antiviral therapy for hepatitis C: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2018 Jan 19. pii: S2468-1253(18)30002-5. Tóm lược
- Ferri C, Zignego AL, Pileri SA. Cryoglobulins. J Clin Pathol. 2002;55:4-13. Tóm lược
- Montero N, Favà A, Rodriguez E, et al. Treatment for hepatitis C virus-associated mixed cryoglobulinaemia. Cochrane Database Syst Rev. 2018 May 7;5:CD011403. Toàn văn Tóm lược
- Johnson RJ, Gretch DR, Yamabe H, et al. Membranoproliferative glomerulonephritis associated with hepatitis C virus infection. N Engl J Med. 1993;328:465-470. Toàn văn Tóm lược
- Wilson SE, Lee WM, Murakami C, et al. Mooren-type hepatitis C virus-associated corneal ulceration. Ophthalmology. 1994;101:736-745. Tóm lược
- Hu KQ, Tong MJ. The long-term outcomes of patients with compensated hepatitis C virus-related cirrhosis and history of parenteral exposure in the United States. Hepatology. 1999;29:1311-1316. Tóm lược
- Colombo M. Hepatitis C virus and hepatocellular carcinoma. Semin Liver Dis. 1999;19:263-269. Tóm lược
- El-Serag HB, Mason AC. Rising incidence of hepatocellular carcinoma in the United States. N Engl J Med. 1999;340:745-750. Tóm lược
- Molina-Cuadrado E, Mateo-Carrrasco H, Collado A, et al. Anaemia predictors in patients with chronic hepatitis C treated with ribavirin and direct-acting antiviral agents. Eur J Hosp Pharm. 2017 Jun 21 [Epub ahead of print]. Toàn văn
- Pessione F, Degos F, Marcellin P, et al. Effect of alcohol consumption on serum hepatitis C RNA and histological lesions in chronic HCV. Hepatology. 1998;27:1717-1722. Tóm lược
- Terrault NA. Sexual activity as a risk factor for HCV infection. Hepatology. 2002;36(5 Suppl 1):S99-S105. Tóm lược
- Centers for Disease Control. Recommendations for prevention and control of HCV and HCV-related chronic disease. MMWR Recomm Rep. 1998:47:1-39. Toàn văn
- Tohme RA, Holmberg SD. Is sexual contact a major mode of hepatitis C virus transmission? Hepatology. 2010;52:1497-1505. Tóm lược
Hình ảnh
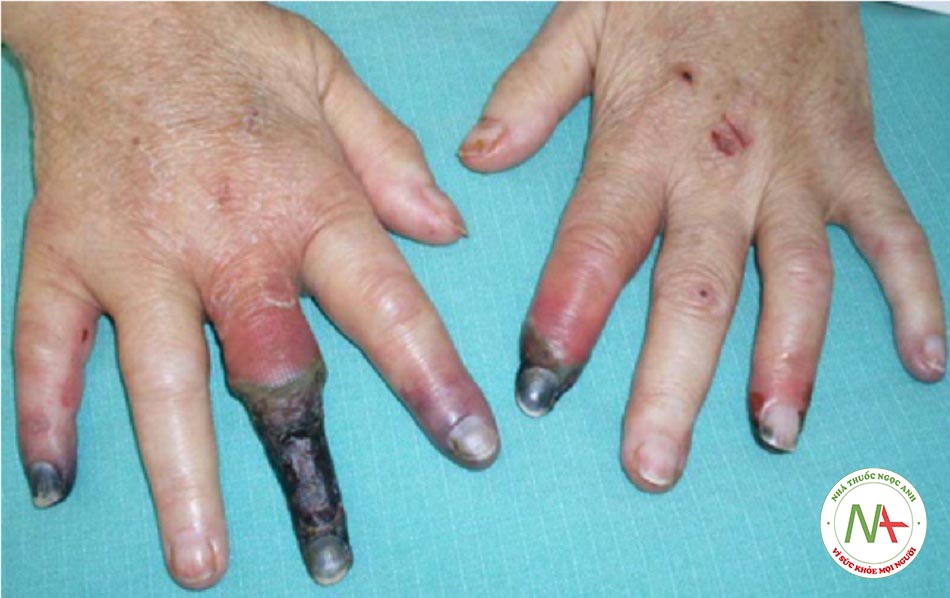
Những người có đóng góp
// Các tác giả:
Jawad Ahmad, MD, FRCP, FAASLD
Professor of Medicine
Division of Liver Diseases, Mount Sinai Hospital, New York, NY
CÔNG KHAI THÔNG TIN: JA declares that he has no competing interests.
// Lời cảm ơn:
Dr Jawad Ahmad would like to gratefully acknowledge Dr Brian L. Pearlman, the previous contributor to this monograph. BLP is on the speakers’ bureaus and serves as an advisor to Merck, Gilead, J&J, and AbbVie, and does contracted research with Boehringer Ingelheim, Tibotec/Janssen, Bristol-Myers Squibb, Gilead, and Merck. BLP is also an author of a number of references cited in this monograph. BLP wishes to acknowledge Chaithanya Mallikarjun, MD, for her help in writing the original version of the manuscript.
// Những Người Bình duyệt:
AnnMarie Liapakis, MD
Assistant Professor
Digestive Disease and Liver Transplant, Yale University, CT
CÔNG KHAI THÔNG TIN: AL has participated in an advisory board meeting with Gilead and Janssen, and is a primary investigator for Merck’s C-Surfer trial.
Benedict Maliakkal, MRCP
Director of Hepatology and Medical Director of Liver Transplantation
Associate Professor of Medicine, Strong Memorial Hospital, University of Rochester, NY
CÔNG KHAI THÔNG TIN: BM belongs to the paid speaker’s bureau for pharmaceutical companies Gilead (maker of ledipasvir/sofosbuvir), AbbVie (maker of Viekira Pak® – ombitasvir/paritaprevir/ritonavir and dasabuvir), Merck, and Salix.
Sulleman Moreea, FRCS (Glasg), FRCP
Consultant Hepatologist
Bradford Teaching Hospitals Foundation Trust, Bradford, UK
CÔNG KHAI THÔNG TIN: SM has received sponsorship and has sat on advisory boards for BMS, Gilead, AbbVie, and Merck.
Steve Ryder, DM, FRCP
Consultant Hepatologist
Nottingham University Hospitals NHS Trust, UK
CÔNG KHAI THÔNG TIN: SR is an advisory board (paid) member for AbbVie, Gilead, Janssen, and MSD.
Xem thêm:
Viêm gan A: Nguyên nhân, chẩn đoán và hướng dẫn điều trị theo BMJ
Viêm gan B: Nguyên nhân, chẩn đoán và hướng dẫn điều trị theo BMJ