Bệnh Nội tiết - chuyển hóa
U tuyến yên: Nguyên nhân, chẩn đoán và hướng dẫn điều trị theo BMJ
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Để tải bài viết U tuyến yên: Nguyên nhân, chẩn đoán và hướng dẫn điều trị theo BMJ file PDF xin vui lòng click vào link ở đây.
Tóm tắt
◊ Báo cáo này xem xét về u tuyến yên không chức năng lâm sàng (CNFPA); u tuyến yên chức năng (ví dụ như to đầu chi, hội chứng Cushing, u tiết hormon prolatin) được xem xét riêng.
◊ Khối u tuyến yên nhỏ (<4 mm) khá thường gặp và được báo cáyênhiếm 10% MRI trong quần thể nói chung. Chỉ một phần nhỏ các khối u này có các đặc điểm lâm sàng gợi ý rối loạn tuyến yên.
◊ Về mặt chẩn đoán hình ảnh, CNFPA được phân loại là u tuyến kích thước nhỏ (đường kính <1 cm) hoặc u tuyến kích thước lớn (đường kính ≥1 cm); các khối u này có thể mở rộng trên hố yên hướng tới giao thoa thị giác, mở rộng sang bên vào xoang hang, hoặc mở rộng xuống dưới vào xương bướm.
◊ Bệnh nhân mắc u tuyến yên kích thước nhỏ không chức năng không cần theo dõi nhiều, nhưng u tuyến yên kích thước lớn cần theo dõi suốt đời.
◊ U tuyến yên kích thước lớn không chức năng thường cần chú ý về y tế khi có các biểu hiện hiệu ứing khối như đau đầu, giảm thị trường, giảm chức năng tuyến yên, và hiếm gặp là liệt dây thần kinh sọ não.
◊ Prolactin có thể tăng nhẹ trong CNFPA do chèn ép cuống tuyên yên và gián đoạn con đường dẫn truyền thần kinh dopamine nội tại
◊ Phẫu thuật qua xương bướm là liệu pháp đầu tay đối với bệnh nhân mắc CNFPA và hiệu ứng khối.
 Thông tin cơ bản
Thông tin cơ bản
Định nghĩa
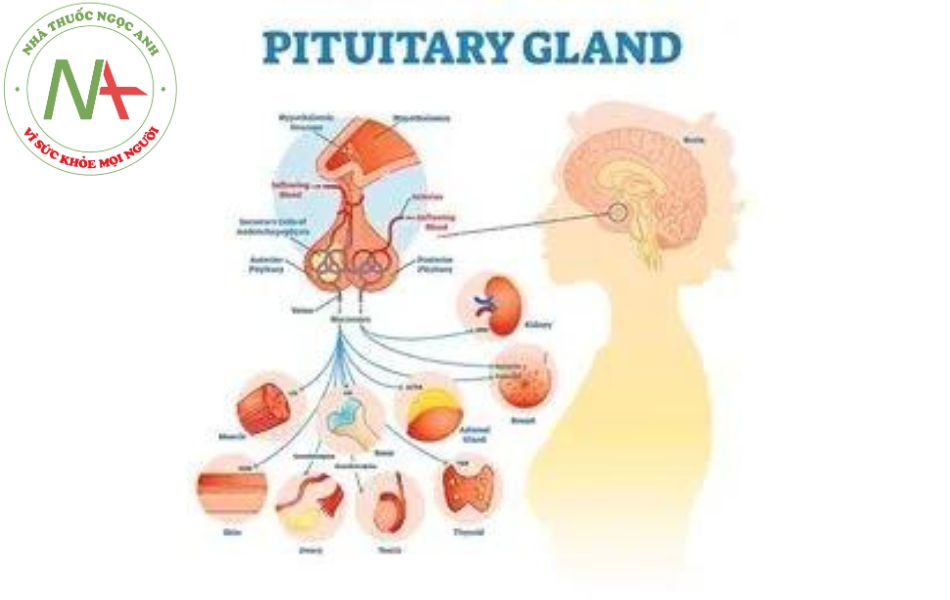
U tuyến yên là khối u nội sọ thường gặp thứ ba ở người lớn, chiếm 10% các trường hợp u nội sọ.[1] [2] Bệnh được chẩn đoán khi bệnh nhân có biểu hiện tăng tiết hormon, kết hợp với giảm thị lực, các biểu hiện thần kinh và giảm chức năng tuyến yên vốn là hậu quả của hiệu ứng khối. Bệnh cũng có thể được phát hiện ra là những khối u ngẫu nhiên vô hại. U tuyến yên không gây ra hội chứng tăng tiết hormon đặc trưng (tế bào không tiết và phần lớn các u tuyến loại hướng sinh dục) được gọi là u tuyến không chức năng lâm sàng (CNFPA). CNFPA và u tiết prolactin là 2 loại u tuyến yên phổ biến nhất. CNFPA được xem xét trong báo cáo này. U tuyến yên chức năng (ví dụ như bệnh to đầu chi, hội chứng Cushing, u tuyến prolactin) không được xem xét trong báo này.
Dịch tễ học
U tuyến yên là loại u nội sọ thường gặp thứ ba (sau u màng não và u sào bào), chiếm khoảng 10% các trường hợp u nội sọ ở người lớn.[1] Không có sự khác biệt về giới tính hay sắc tộc ở tỷ lệ mắc bệnh. Tỷ lệ mắc bệnh u tuyến yên thay đổi từ 19 đến 28 ca bệnh trong 100.000 ca tại Anh, đến 94 ca trong tổng số 100.000 tại Bỉ, với tỷ lệ mắc mới khoảng 0,4 đến 8,2 trên 100.000 người một năm.[14] [15] [16] Tỷ lệ mắc mới cao nhất ở lứa tuổi 30 đến 60, thường xảy ra sớm hơn ở phụ nữ (thường ở độ tuổi 20 đến 45) hơn là nam giới (35 đến 60 tuổi) do tần suất u tiết prolactin cao hơn ở phụ nữ trẻ.[14] [17] Tỷ lệ hiện mắc u tuyến yên tăng theo độ tuổi.[16] Cụ thể, u tuyến yên không chức năng lâm sàng (CNFPA) ước tính xảy ra với tỷ lệ mắc mới khoảng 5,6 ca bệnh trên một triệu người mỗi năm.[18] Các nghiên cứu khám nghiệm tử thi cho thấy tỷ lệ mắc khối u tuyến yên ngẫu nhiên lên tới 27%; và hình ảnh MRI sọ cho thấy tỷ lệ mắc bệnh khoảng 10%. Phần lớn (99%) các khối u tuyến yên này nhỏ và không có chức năng về mặt lâm sàng; chỉ 0,4% là u tuyến kích thước lớn.[19]
Bệnh căn học
Bệnh căn học của u tuyến yên vẫn chưa được biết rõ. Các nghiên cứu sử dụng sinh học phân tử đã gợi ý một số cơ chế tiềm năng.
Các u tuyến yên là đơn dòng về nguồn gốc, cho thấy sự thay đổi di truyền nội tại là các nguyên nhân đầu tiên.[20] [21]
[22] Hormon vùng dưới đồi và các yếu tố tăng trưởng tại chỗ khác có thể có vai trò quan trọng trong việc thúc đẩy sự tăng trưởng của dòng tế bào tuyến yên đã chuyển dạng cũng như mở rộng các u tuyến nhỏ thành các khối u kích thước lớn hoặc xâm lấn.[23] [24] Sự tăng sinh và biệt hoá tế bàovà bài tiết hormon bất thường có thể do’đạt được chức năng’ (kích hoạt đột biến gen gây ung thư) hoặc ‘mất chức năng’ (bất hoạt đột biến các gen ức chế khối u).
Sinh lý bệnh học
U tuyến yên không chức năng liên quan đến methyl hóa quá mức của p16 locus, gen 2A ức chế kinase phụ thuộc cyclin (CDKN2A), ở nhiễm sắc thể 9p21.3.n Gen CDKN2A là một gen ức chế khối u, và chế phẩm của nó, protein CDKN2A, có vai trò quan trọng trong quá trình kiểm soát chuyển tiếp giai đoạn G đến S trong chu kỳ tế bào thông qua ức chế phosphoryl hóa protein u nguyên bào võng mạc 1 (RB1) qua trung gian CDK4. Hiện tượng methyl hóa quá mức của gen này làm bất hoạt gen không tổng hợp protein CDKN2A, dẫn đến tăng trưởng tế bào không kiểm soát.[25] [26]
Các tế bào u tuyến yên, đặc biệt là u tuyến yên không chức năng lâm sàng (CNFPA), thể hiện PPAR-gamma trong ống nghiệm. Rosiglitazone, một phối tử PPAR-gamma, đã được chứng minh là làm giảm tăng sinh tế bào u và tăng trưởng khối u tuyến yên trong các mô hình động vật. Rosiglitazone gây ngừng chu kỳ tế bào G0 đến G1, giảm số lượng tế bào bước vào giai đoạn S.[27] [28] [29] Cơ quan Dược phẩm Châu Âu (EMA) đã ngừng cấp phép thị trường đối với các thuốc có chứa rosiglitazone ở EU vì việc gia tăng nguy cơ các vấn đề tim mạch.[30] Rosiglitazone không được chỉ định điều trị khối u tuyến yên.
Việc biểu hiện quá mức gen chuyển dạng khối u tuyến yên (PTTG) có liên quan đến quá trình tạo u tuyến yên. PPTG mRNA tăng lên trong các khối u không chức năng và các khối u tuyến tiết hormon tăng trưởng và prolactin. Protein PTTG liên quan đến tín hiệu nội bào.[31] PTTG gây ra biểu hiện yếu tố tăng trưởng nguyên bào sợi 2 (FGF-2), là trung gian giữa tăng trưởng tế bào và tăng sinh mạch.[32]
Phân loại
Phân loại mô bệnh học[3]
Không chức năng so với chức năng:
• Không chức năng: không tăng tiết hormon Các khối u hiếm gặp hơn, ví dụ như u tế bào tuyến mang tai dạng tế bào thoi của thuỳ trước tuyến yên, có thể phân biệt về mặt lâm sàng với u tuyến không chức năng trên lâm sàng (CNFPA).[4]
• Chức năng: tăng tiết hormon Một số khối u có thể biểu hiện như CNFPAh với hiệu ứng khối do tăng tiết hormon không đủ hoặc không hoàn toàn. Những ví dụ như vậy bao gồm u tuyến ACTH và hormon tăng trưởng tiềm ẩn, trong đó u tuyến ACTH tiềm ẩn có tiền sử tự nhiên xâm lấn mạnh hơn ở một số trường hợp với nguy cơ cao hơn bị xâm lấn khối u và tái phát. Phần lớn các trường hợp u tuyến hướng sinh dục có biểu hiện CNFPA với hiệu ứng khối bởi vì chúng chỉ tiết ra tiểu phân tử alpha hoặc beta, hoặc không đủ như trong tăng tiết hormon[5] Biểu hiện giải phẫu và thần kinh: dựa trên kích thước khối u và mức độ xâm lấn tại chỗ Biểu hiện mô học: dựa trên đặc tính hoá mô miễn dịch.
Đặc điểm siêu cấu trúc: dựa trên các đặc điểm trên kính hiển vi điện tử. Có thể nghi ngờ một số loại khối u hiếm gặp, ví dụ như u tuyến yên tiềm ẩn typ III, dựa trên các đặc điểm tiền sử và hoá mô miễn dịch, nhưng cần đánh giá siêu cấu trúc để xác nhận chẩn đoán.
Kích thước khối u[6] [7]
U tuyến kích thước nhỏ: kích thước khối u <1 cm. U tuyến kích thước lớn: kích thước khối u ≥1cm.
Phân loại u tuyến yên chức năng[6]
U tuyến tiết prolactin (35%): bắt màu và tiết prolactin (prolactin và hormon tăng trưởng [GH] đồng thời được tiết ra ở khoảng 7% u tuyến yên).
U tuyến loại hướng thân (20%): bắt màu và tiết GH (prolactin và GH đồng thời được tiết ra khoảng 7% u tuyến yên). U tuyến tế bào loại hướng vỏ thượng thận (10% đến 12%): bắt màu và tiết ACTH.
U tuyến hướng sinh dục (20%): bắt màu và tiết FSH, LH, tiểu phân tử alpha, tiểu phân tử beta. U tuyến tế bào không tiết (10%): không bắt màu và không tiết hormon.
U tuyến loại hướng tuyến giáp (1% đến 2%): bắt màu và sản xuất TSH.
Đột quỵ tuyến yên
Có triệu chứng: đi kèm với khiếm khuyết thần kinh (ví dụ như mất thị lực, trạng thái tinh thần thay đổi, song thị).
Không có triệu chứng: chụp hình ảnh cho thấy các bằng chứng trước đó của xuất huyết/nhồi máu u tuyến, mặc dù bệnh nhân không có hoặc có ít triệu chứng cơ năng nào.
Phòng ngừa
Khám sàng lọc
MEN-1
Đa u nội tiết typ 1 (MEN-1) là tình trạng trội trên nhiễm sắc thể thường liên quan đến u tuyến yên ở 40% đến 60% bệnh nhân, gây ra bởi đột biến ở gen MEN-1 trên nhiễm sắc thể 11q13. MEN-1 có thể liên quan đến các khối u tuyến yên chức năng hoặc không chức năng, trong đó u tiết prolactin là thường gặp nhất. Cần sàng lọc bệnh nhân MEN-1 hoặc có các đặc điểm tương tự (tăng sản tuyến cận giáp ± u tuyến yên ± khối u nội tiết tuyến tuỵ). Khi phát hiện đột biến, có thể dễ dàng thực hiện các xét nghiệm chuyên sâu hơn ở người thân.[49] Con cái, anh, hoặc chị em không có triệu chứng của bệnh nhân MEN-1 có khả năng 50% thừa hưởng gen và có thể được đề xuất xét nghiệm gen. Đến 40 tuổi hầu hết những người mang gen MEN-1 sẽ bị tăng canxi huyết; thực tế, khi đến khoảng 60 tuổi mà không bị tăng canxi huyết là rất trái ngược với chẩn đoán MEN-1 và trong hầu hết trường hợp không cần thực hiện thêm xét nghiệm nào nữa. U tế bào tiểu đảo tuyến tụy là triệu chứng thường gặp thứ hai của MEN-1 và sẽ xảy ra ở 80% số bệnh nhân.
Những bệnh nhân được hiểu là có đột biến gen cần được sàng lọc bằng canxi huyết thanh, chất chỉ điểm khối u thần kinh nội tiết bao gồm gastrin, prolactin huyết thanh và IGF-1, và chụp hình ảnh vùng bụng và tuyến yên định kỳ. Cường cận giáp, thường là dấu hiệu đầu tiên của MEN-1, có thể được phát hiện bằng xét nghiệm máu hàng năm trong độ tuổi từ 5 đến 50. Vì lý do này, nên sàng lọc sớm ở thời điểm 5 tuổi đối với trẻ em có nguy cơ MEN-1.
Tiền sử ca bệnh
Tiền sử ca bệnh #1
Một phụ nữ 28 tuổi có biểu hiện đau đầu trong suốt 9 tháng qua và gần đây càng trầm trọng hơn. Kết quả khám toàn thân đều bình thường ngoại trừ một số bất thường về kinh nguyệt trong năm vừa qua. Khi khám lâm sàng không thấy có dấu hiệu của hội chứng Cushing hoặc bệnh to đầu chi. Thị trường trước bình thường và không tiết sữa.
Tiền sử ca bệnh #2
Một nam giới 52 tuổi có biểu hiện gặp khó khăn khi lái xe ban đêm và nói rằng không nhìn thấy xe đi đến từ hai bên. Ông cũng mô tả mất dần ham muốn tình dục và không thể đạt được hoặc duy trì tình trạng cương cứng, bắt đầu từ khoảng 2 năm trước. Ông cũng cho biết là luôn bị va chạm vào mọi thứ. Tăng khoảng 5 kg (11 lb) trong vòng 2 đến 3 năm qua. Mệt mỏi và không thể làm các công việc vẫn làm một năm trước. Khi khám phát hiện béo phì trung bình (BMI 35) với tình trạng mất một số lượng lớn cơ bắp ở gốc cánh tay và chân. Các phát hiện rõ ràng bao gồm tình trạng nữ hoá tuyến vú hai bên nhỏ, tinh hoàn mềm (12 mL), và trường thị giác bất thường, với tình trạng bán manh hai thái dương.
Các bài trình bày khác
Song thị có thể do các tổn thương không phải của u tuyến gây ra, hoặc đôi khi bởi u tuyến yên không chức năng lâm sàng (CNFPA) do sự lan rộng khối u vào các xoang hang. Liệt dây thần kinh sọ não số ba thường gặp nhất trong liệt dây thần kinh sọ não. Đôi khi có biểu hiện đau mặt và dị cảm do liệt các nhánh V1 và V2 của dây thần kinh sọ não số năm.[6] [7] Các khối u tuyến yên có thể mở rộng lên phía trên vào não thất ba gây ra úng thuỷ.[6] [7] Thông thường sẽ xuất hiện tình trạng tăng tiết prolactin mức độ nhẹ đến trung bình (<4348 picomol/L [<100 nanogram/mL {<100 microgram/L}]) kèm theo gián đoạn hiệu ứng ức chế dopamine dưới đồi trên bài tiết prolactin tuyến yên. Đột quỵ tuyến yên có thể là bệnh cảnh lâm sàng, thường biểu hiện các cơn đau đầu nghiêm trọng và các triệu chứng khác liên quan đến hiệu ứng khối.[8] [9] Đôi khi có thể co giật do tổn thương thuỳ thái dương.[6] [7] Hiếm khi, u tuyến loại hướng sinh dục có thể biểu hiện dậy thì sớm, tăng testosterone hoặc tinh hoàn lớn ở nam giới hoặc quá kích buồng trứng ở nữ giới.[10] [11] [12] [13]
 Cách tiếp cận chẩn đoán từng bước
Cách tiếp cận chẩn đoán từng bước
Hầu hết u tuyến yên không chức năng lâm sàng (CNFPA) biểu hiện muộn bởi vì chúng không bài tiết ra bất kỳ hormon nào hoặc bài tiết các hoóc-môn chức năng không hiệu quả. Chúng hiếm khi sản xuất glycoprotein FSH và LH nguyên vẹn, nhưng thường sản xuất các tổ hợp khác nhau bao gồm tiểu phân tử FSH beta và/hoặc tiểu phân tử LH beta kèm theo tiểu phân tử alpha thường gặp.[36] [37] Độ tuổi có biểu hiện bình quân là 50 đến 55 tuổi.[38]
Tiền sử
U tuyến yên có thể được phát hiện một cách tình cờ khi chụp hình ảnh, hoặc có thể biểu hiện với triệu chứng và dấu hiệu lâm sàng của hiệu ứng khối hoặc các thay đổi nội tiết. Đau đầu là biểu hiện thường gặp (19% đến 75%) nhưng sinh lý bệnh tiềm ẩn vẫn chưa rõ ràng. Các cơ chế có thể bao gồm các nguyên nhân cấu trúc như dãn màng cứng hoặc xâm lấn xoang tĩnh mạch hang.[6] [7] Tăng trưởng khối u vào não thất thứ ba có thể gây ra não úng thủy và các triệu chứng như đau đầu, mất thăng bằng và tiểu tiện không tự chủ. Tăng trưởng khối u sang bên vào xoang hang có thể gây song thị do liệt dây thần kinh sọ não số ba, bốn và sáu, đau và dị cảm mặt do liệt các nhánh V1 và V2 của dây thần kinh sọ não số năm. Co giật có thể xảy ra khi có tổn thương thùy thái dương. Viêm xoang tái phát và sổ mũi CSF có thể do sự tăng trưởng vào xoang bướm.
Bệnh nhân có thể có các đặc điểm của giảm chức năng tuyến yên.[6] [7] Gonadotroph và somatotroph nhạy cảm nhất với tổn thương chèn ép tại chhỗ từ khối u tuyến yên không chức năng lâm sàng (CNFPA). Suy giảm chức năng sinh dục ở nam giới với biểu hiện mất các đặc tính tình dục phụ, suy giảm tâm trạng, mất ham muốn tình dục, rối loạn cương dương, vô sinh, thiếu máu, giảm khối cơ, và giảm sản xương. Ở nữ giới, biểu hiện là vô kinh, giảm ham muốn tình dục, vô sinh, bốc hỏa, giảm sản xương và teo vú. Thiếu hụt GH gây béo phì thân; mệt mỏi liên quan đến giảm khả năng chịu đựng, giảm khối cơ và tăng khối mỡ, giảm sản xương, trầm cảm, và lipid bất thường. Nhược giáp gây ra mệt mỏi, táo bón, tăng cân, không chịu được lạnh, khô da, rụng tóc, nhịp tim chậm, mất trí nhớ và trầm cảm. Suy thượng thận gây mệt mỏi, buồn nôn, chán ăn, sút cân, hạ natri máu, ốm yếu và run. Thường không tăng kali huyết vì con đường corticoid chuyển hóa muối khoáng còn nguyên vẹn và không có tăng sắc tố.
Hiếm khi, CNFPA biểu hiện bằng dậy thì sớm ở trẻ em, tinh hoàn lớn ở nam giới, hoặc quá kích buồng trứng ở phụ nữ tiền mãn kinh có khối u bài tiết FSH hoặc testosterone cao bất thường với khối u bài tiết LH.[10] [11] [12] [13]
Đái tháo nhạt hầu như không phải là biểu hiện của u tuyến yên. Đôi khi có thể do phẫu thuật u tuyến yên trước đó.
Đột quỵ tuyến yên
Có thể biểu hiện lâm sàng là đau đầu dữ dội khởi phát đột ngột, sốt, buồn nôn và nôn, triệu chứng màng não, thay đổi ý thức, rối loạn thị giác và giảm chức năng tuyến yên. Đột quỵ tuyến yên nghiêm trọng về mặt lâm sàng hiếm xảy ra với u tuyến yên kích thước nhỏ. Nguy cơ đột quỵ ước tínhkhoảng từ 0,4% đến 9,5% trong nghiên cứu theo dõi trung bình 2 đến 6 năm. Đó là do tuyến yên phì đại nhanh chóng tuyến yên do xuất huyết và/hoặc nhồi máu khối u.[8] [9] [39] [40] Mặc dù hầu hết trường hợp đột quỵ tuyến yên là nguyên phát, các yếu tố thúc đẩy có thể bao gồm tổn thương đầu, liệu pháp thuốc chống đông, chủ vận dopamine, xạ trị hoặc các xét nghiệm nội tiết động. Trong một phân tích tổng hợp gần đây đối với bệnh nhân có u tuyến yên ngẫu nhiên và CNFPA, đột quỵ tuyến yên xảy ra với tỷ lệ 0,2 trên 100 người-năm, với xu hướng không có ý nghĩa thống kê là tỷ lệ đột quỵ cao hơn với u tuyến kích thước lớn so với u tuyến kích thước nhỏ.[41]
Nếu xuất huyết hoặc nhồi máu khối u được phát hiện là đã xảy ra, bệnh nhân có thể không nhớ là đã có triệu chứng cơ năng và có thể được xem là đã bị đột quỵ tuyến yên không triệu chứng.
18% đến 78% thiếu hụt thị trường là do chèn ép con đường thị giác, với biểu hiện thường gặp nhất là bán manh hai thái dương kèm theo chèn ép giao thoa thị giác. Bệnh nhân có thể bị giảm thị lực; giảm thị trường, thường khởi đầu bằng mất thị giác phần tư trên phía thái dương. Có thể xuất hiện liệt dây thần kinh sọ não số ba, thứ tư, thứ năm (V1 và V2), và số sáu; giãn đồng tử do liệt dây thần kinh sọ não số ba. Bệnh nhân đột quỵ tuyến yên có thể có những mức độ thay đổi khác nhau về trạng thái tinh thần.
Những dấu hiệu liên quan đến nội tiết ở bệnh nhân u tuyến yên bao gồm suy giảm chức năng sinh dục (rụng lông ở mặt và thân, nữ hóa tuyến vú, giảm khối cơ, tinh hoàn mềm ở nam giới và teo vú ở nữ giới); nhược giáp (da khô, tóc xơ, mặt sưng, lông mày rụng hoặc mỏng); và thiếu hụt hormon tăng trưởng (mất khối cơ, béo phì vùng bụng). Xanh tái và da nhăn nheo là những dấu hiệu đặc trưng ở bệnh nhân suy toàn tuyến yên.
Chẩn đoán hình ảnh
MRI tuyến yên tăng cường gadoliniumtrước và sau được ưu tiên sử dụng hơn là chụp CT. MRI sẽ xác định các đặc điểm khối u, biểu hiện xâm lấn của khối u vào xoang hang, xoang bướm, và hiệu ứng khối với giao thoa thị giác.
Đánh giá thị giác
Khám mắt và thử nghiệm thị trường thông thường (thử nghiệm thị trường thị Humphrey hoặc Goldman) được chỉ định nếu chụp hình ảnh cho thấy khối u tuyến đang chèn ép hoặc có tiếp xúc với giao thoa thị giác, nhằm ghi nhận sự giảm thị lực và thị trường.
Xét nghiệm máu thường quy
Ban đầu cần thực hiện bảng chuyển hóa cơ bản và công thức máu. Có thể thấy hạ natri máu trong suy thượng thận và nhược giáp và cũng có liên quan đến các triệu chứng như buồn nôn, nôn, đau đầu và khó chịu. Thiếu máu có thể là biểu hiện của những bệnh nhân bị suy giảm chức năng sinh dục, nhược giáp, hoặc suy thượng thận kéo dài và có liên quan đến tình trạng mệt mỏi và khó chịu. Thực hiện xét nghiệm lipid xác định tăng lipid huyết và nguy cơ xơ vữa động mạch sớm trong thiếu hụt GH và suy giảm chức năng sinh dục.
Prolactin
Có thể biểu hiện tình trạng tăng prolactin huyết nhẹ đến trung bình (<4348 picomol/L [<100 nanogram/mL {<100 microgram/L}]). Ngoại trừ những bệnh nhân đang sử dụng metoclopramid và thuốc chống loạn thần, mức prolactin >4348 picomol/L (>100 nanogram/mL [>100 microgram/L] hầu như luôn chẩn đoán u tiết prolactin.
Yếu tố tăng trưởng giống insulin và GH 1 (IGF-1)
Thiếu hụt GH là một trong những hiện tượng thiếu hụt hormon thường gặp nhất liên quan đến u tuyến yên không chức năng lâm sàng (CNFPA). Mức GH ngẫu nhiên có thể thấp và IGF-1 có thể bình thường ở đến 65% bệnh nhân thiếu hụt GH. Thiếu hụt 3 hoặc nhiều hơn hormon thùy trước tuyến yên cùng với IGF-1 thấp thường chỉ ra thiếu hụt GH và do đó có thể không cần thiết phải xét nghiệm thêm.[42] Tuy nhiên, mức độ GH được kích thích bằng xét
nghiệm dung nạp insulin (ITT), glucagon, hoặc arginine/GHRH thường được thực hiện để chẩn đoán. Mặc dù ITT là tiêu chuẩn chẩn đoán, nhưng cần do chuyên gia về nội tiết có kinh nghiệm thực hiện, bởi vì những nguy cơ liên quan đến hạ đường huyết do tai biến y khoa và cần phải theo dõi glucose đến khi phục hồi. Chống chỉ định ITT ở những bệnh nhân có tiền sử co giật, bệnh động mạch vành và mạch máu não, và những bệnh nhân trên 65 tuổi. Xét nghiệm kích thích glucagon là phương pháp thay thế cho ITT để đánh giá những bệnh nhân nghi ngờ bị thiếu hụt GH.[43]
Các tiểu phân tử FSH, LH, alpha của hormon glycoprotein tuyến yên, estradiol, và testosteron ở người.
Testosteron huyết thanh thấp ở nam giới (estradiol ở phụ nữ) cùng với mức FSH và LH bình thường/thấp là phù hợp với tình trạng thiếu hụt gonadotrophin ở nam giới và mất kinh ở phụ nữ tiền mãn kinh. Không tăng FSH và LH ở phụ nữ hậu mãn kinh cũng phù hợp với tình trạng thiếu hụt gonadotrophin. Chu kỳ kinh nguyệt đều đặn luôn là chỉ ra trục gonadotrophin bình thường. Ở phụ nữ có chu kỳ kinh nguyệt không đều, việc đánh giá trục gonadotrophin có thể khó khăn và thường không được chỉ định.
Ở những bệnh nhân có u tuyến tế bào gonadotroph, FSH, LH, và/hoặc tiểu phân tử alpha có thể tăng. Hiếm khi, testosteron tăng ở những bệnh nhân u tuyến yên tiết LH.
TSH và thyroxine tự do hoặc toàn phần
Nếu có nghi ngờ về lâm sàng nhược giáp thứ phát, thì TSH và T4 tự do (hoặc chỉ số T4 tự do) cần được đánh giá đồng thời. Thông thường bệnh nhân có TSH thấp hoặc bình thường cùng với mức T4 tự do thấp, trái với bệnh nhân nhược giáp nguyên phát, khi đó TSH tăng.
ACTH và cortisol
Thử nghiệm kích thích ACTH (cosyntropin) (CST) và đo nồng độ cortisol huyết tương vào buổi sáng sớm (ví dụ: 8 giờ sáng) là những thử nghiệm ban đầu để đánh giá trục corticotropin. Nồng độ cortisol vào sáng sớm dưới 83 nanomol/L (3 microgram/dL) xác nhận suy thượng thận; trong khi giá trị cao hơn 414 nanomol/L (15 microgram/
dL) ít có khả năng chẩn đoán. Nồng độ cortisol trong khoảng 83-414 nanomol/L (3-15 microgram/dL) là không thể chẩn đoán và cần được đánh giá thêm bằng thử nghiệm kích thích ACTH vào bất kỳ thời điểm nào trong ngày. CST liều tiêu chuẩn dùng đường tiêm tĩnh mạch hoặc tiêm bắp 250 microgram cosyntropin với đo mức cortisol huyết tương trước, và sau tiêm 30 phút. Đáp ứng bình thường là nồng độ cortisol huyết tương cao hơn 497 nanomol/L (18 microgram/dL) ở thời điểm 30 phút sau tiêm. Những bệnh nhân thiếu hụt ACTHi tuyến yên hoặc thiếu hụt CRH vùng dưới đồi nhẹ, một phần, hoặc khởi phát gần đây (ví dụ trong vòng 2 đến 4 tuần sau phẫu thuật tuyến yên) có thể có đáp ứng bình thường với 250 microgram CST vì các tuyến thượng thận chưa teo hoàn toàn và vẫn đáp ứng với nồng độ kích thích ACTH rất cao. Độ nhạy của thử nghiệm kích thích ACTH để xác định suy thượng thận nhẹ, một phần, có cải thiện khi sử dụng cosyntropin liều thấp (1 microgram ACTH^1-24 tiêm tĩnh mạch). Tuy nhiên, điều này có thể dẫn đến tỷ lệ dương tính giả cao hơn.
Mức ACTH không đủ tin cậy để chẩn đoán nhưng có thể được sử dụng để phân biệt suy thượng thận nguyên phát và thứ phát ở những bệnh nhân có mức cortisol thấp.
Thử nghiệm kích thích GnRH
Được sử dụng để đánh giá trục hướng sinh dục ở một số bệnh nhân, nhưng thường không cần thiết. Đã có một số báo cáo về thử nghiệm này gây đột quỵ tuyến yên.
Nhuộm hóa mô miễn dịch
Được thực hiện sau khi cắt bỏ khối u, và có thể giúp chẩn đoán và điều trị dựa vào bài tiết hormon tiềm lâm sàng.
Các yếu tố nguy cơ
Mạnh
Đa u nội tiết typ 1 (MEN-1)
• Đa u nội tiết typ 1 (MEN-1) là tình trạng di truyền trội nhiễm sắc thể thường liên quan đến u tuyến yên ở 40% đến 60% bệnh nhân. Có đột biến dòng mầm ở gen MEN-1 trên nhiễm sắc thể 11q13. Sản phẩm của gen MEN-1 là menin, là một protein điều hòa và tương tác với dải mục tiêu rộng. MEN-1 có thể liên quan đến các khối u tuyến yên chức năng hoặc không chức năng, trong đó u tiết prolactin là thường gặp nhất. Ở khoảng 10% bệnh nhân MEN-1, không có đột biến gen nào được xác định. Giới tính nữ có liên quan đến nguy cơ u tuyến yên cao hơn. Khối u tuyến yên MEN-1 hầu hết là u tuyến kích thước lớn khi biểu hiện và có xu hướng xâm lấn mạnh hơn.[33]
u tuyến yên có yếu tố gia đình (FIPA)
• U tuyến yên có yếu tố gia đình không gặp trong MEN-1 và phức hợp Carney rất hiếm gặp. Tuy nhiên, một nghiên cứu hồi cứu các đặc tính lâm sàng của u tuyến yên có yếu tố gia đình tại 22 trung tâm trên toàn tây Âu đã cho kết quả 64 quan hệ huyết thống như vậy, với 138 cá nhân bị ảnh hưởng. Họ hàng trực hệ có liên quan trong khoảng 75% số ca bệnh. Các bệnh nhân thường biểu hiện bệnh ở độ tuổi trẻ hơn so với các ca bệnh rải rác và khoảng 20% là u tuyến yên không chức năng.[34] Đột biến bất hoạt tính liên quan đến gen protein tương tác với thụ thể aryl hydrocarbon S(AIP) đã được miêu tả trong FIPA.
Phức hợp Carney (CNC)S
• CNC là tình trạng bệnh có yếu tố gia đình hiếm gặp đặc trưng bởi nốt ruồi, u niêm, khối u tế bào Schwan, tăng sản thượng thận, và các bất thường tuyến yên. CNC có liên quan đến các đột biến ở gen tiểu phân tử điều hòa protein kinase 1-alpha (PRKAR1A) ở 60% trường hợp. Bệnh tuyến yên thường đặc trưng bởi tăng tiết prolactin và hormon tăng trưởng. Khối u tuyến yên xảy ra ở khoảng 20% số ca bệnh và có xu hướng biểu hiện tăng sản đa ổ tế bào somatomammotropin.[35]
Các yếu tố về tiền sử và thăm khám
Các yếu tố chẩn đoán chủ yếu
có các yếu tố nguy cơ (thường gặp)
• Các yếu tố nguy cơ chủ yếu bao gồm MEN-1, u tuyến yên có yếu tố gia đình và phức hợp Carney.
triệu chứng kéo dài và tiến triển (thường gặp)
• Hầu hết triệu chứng u tuyến yên là kéo dài và tiến triển chậm.
đau đầu (thường gặp)
• Đau đầu có thể không đặc hiệu.
rối loạn chức năng cương dương (thường gặp)
• Triệu chứng của suy giảm chức năng sinh dục.
tinh hoàn nhỏ mềm (thường gặp)
• Triệu chứng của suy giảm chức năng sinh dục.
Nữ hóa tuyến vú (thường gặp)
• Triệu chứng của suy giảm chức năng sinh dục.
mất kinh (thường gặp)
• Triệu chứng của suy giảm chức năng sinh dục.
vô sinh (thường gặp)
• Triệu chứng của suy giảm chức năng sinh dục.
teo vú (thường gặp)
• Triệu chứng của suy giảm chức năng sinh dục.
giảm ham muốn tình dục (thường gặp)
• Triệu chứng của suy giảm chức năng sinh dục.
bốc hỏa (thường gặp)
• Triệu chứng của suy giảm chức năng sinh dục.[44]
toát mồ hôi (thường gặp)
• Triệu chứng của suy giảm chức năng sinh dục.[44]
tăng cân (thường gặp)
• Triệu chứng của nhược giáp.
mệt mỏi (thường gặp)
• Triệu chứng của nhược giáp, suy giảm chức năng sinh dục, và suy thượng thận. Giảm năng lượng và sức sống có thể là triệu chứng của thiếu hụt GH.
Chán ăn (thường gặp)
• Triệu chứng của suy thượng thận.
Buồn nôn (thường gặp)
• Triệu chứng của suy thượng thận.
Nôn (thường gặp)
• Triệu chứng của suy thượng thận.
Ốm yếu (thường gặp)
• Triệu chứng của suy thượng thận.
giảm thị lực (thường gặp)
• Giảm thị lực trước khi phàn nàn về thị lực rất mờ như bán manh hai thái dương.
bán manh hai thái dương (thường gặp)
• Mất thị giác phần tư thị trường thái dương trên kèm theo giảm thị giác màu đỏ (nhận biết màu đỏ kém) thường là đặc điểm lâm sàng sớm nhất của chèn ép giao thoa thị giác.
đột quỵ tuyến yên (không thường gặp)
• Đau đầu nghiêm trọng khởi phát cấp tính kèm theo buồn nôn, nôn, triệu chứng màng não, thay đổi trạng thái ý thức, liệt vận nhãn, tụt huyết áp gặp trong suy thượng thận cấp.
Song thị / Nhìn đôi (không thường gặp)
• Song thị hoặc tê cứng mặt thứ phát doliệt dây thần k inh sọ não số ba, thứ tư, thứ năm (V1 và V2), và số sáu.
Các yếu tố chẩn đoán khác
béo phì trung tâm (thường gặp)
• Dấu hiệu của thiếu hụt GH và suy giảm chức năng sinh dục.
giảm khối cơ (thường gặp)
• Triệu chứng của suy giảm chức năng sinh dục ở nam giới, và thiếu hụt GH ở nam giới và nữ giới.
táo bón (thường gặp)
• Triệu chứng của nhược giáp.
không chịu được lạnh (thường gặp)
• Triệu chứng của nhược giáp.
khô da (thường gặp)
• Triệu chứng của nhược giáp.
Rụng tóc (thường gặp)
• Triệu chứng của nhược giáp.
trí nhớ suy giảm (thường gặp)
• Triệu chứng của nhược giáp, thiếu hụt GH, và khối u lan rộng vùng dưới đồi.
khí sắc giảm (thường gặp)
• Triệu chứng của nhược giáp và suy giảm chức năng sinh dục.
chứng thiểu xương (thường gặp)
• Liên quan đến suy giảm chức năng sinh dục hoặc thiếu hụt GH.
Sút cân (không thường gặp)
• Triệu chứng của suy thượng thận.
căng thẳng (không thường gặp)
• Triệu chứng của suy thượng thận; không điển hình nhưng đã được báo cáo là được gặp hơn ở những bệnh nhân suy thượng thận.[45]
tê cứng mặt (không thường gặp)
• Song thị hoặc tê cứng mặt thứ phát doliệt dây thần k inh sọ não số ba, thứ tư, thứ năm (V1 và V2), và số sáu.
mất thăng bằng (không thường gặp)
• Liên quan đến tăng trưởng khối u vào não thất ba dẫn đến não úng thủy hoặc hạ huyết áp tư thế do suy thượng thận thứ phát.
tiểu tiện không tự chủ (không thường gặp)
• Liên quan đến tăng trưởng khối u vào não thất ba hoặc thứ phát do đái tháo nhạt.
viêm xoang tái phát (không thường gặp)
• Có thể là do tăng trưởng vào xoang bướm.
Nhịp tim chậm (không thường gặp)
• Dấu hiệu của nhược giáp.
Co giật (không thường gặp)
• Có thể xảy ra thứ phát do rối loạn chuyển hóa (như hạ natri máu và hạ đường huyết) do suy thượng thận hoặc tổn thương thùy thái dương.
Xét nghiệm chẩn đoán
Xét nghiệm thứ nhất cần yêu cầu
| Xét nghiệm Kết quả | |
| prolactin
• Xét nghiệm khi đói là cần thiết. Tại các phòng thí nghiệm không sử dụng xét nghiệm đo prolactin 2 bước, cần cân nhắc pha loãng xét nghiệm ở những người bị u tuyến yên kích thước lớn (>3 cm), để loại trừ ‘hiệu ứng móc’ do mức prolactin quá cao. Mức độ cao thường cần được lặp lại trước khi đánh giá sâu hơn, trong đó cần loại trừ việc mang thai, sử dụng thuốc và các bệnh đồng thời. Các rối loạn toàn thân như nhược giáp, bệnh gan, và suy thận có thể liên quan đến tình trạng tăng prolactin aáu bất thường. Mức prolactin huyết thanh dưới 4348 picomol/L (100 microgram/L) khi có u tuyến yên kích thước lớn thường là do hiệu ứng âm thầm. Tăng prolactin huyết được miêu tả khi prolactin gắn với globulin miễn dịch hoặc polysaccharid (cường prolactin máu). Được xác định trong phòng thí nghiệm là tăng prolactin huyết khi không có các triệu chứng. Mức prolactin đơn thể, nếu được đo chính xác, sẽ là bình thường. |
có thể tăng; mức độ >4348 picomol/L (>100 microgram/
L) khi không sử dụng một số thuốc chẳng hạn như metoclopramide và thuốc chống loạn thần, hầu như luôn là chẩn đoán u tiết prolactin |
| Thử nghiệm kích thích hormon tăng trưởng (ITT hoặc GHRH/arginine)
• Thiếu hụt GH được đánh giá tốt nhất bằng xét nghiệm động bao gồm thử nghiệm dung nạp insulin (ITT), xét nghiệm kích thích glucagon, hoặc xét nghiệm kích thích GHRH/arginine. ITT được coi là xét nghiệm đặc hiệu và nhạy nhất để đánh giá trục dưới đồi-tuyến yên-thượng thận (HPA). Tuy nhiên, cần do bác sĩ có kinh nghiệm thực hiện và thường không cần thiết trong thực hành lâm sàng hàng ngày. |
Mức GH đỉnh được kích thích:<3 microgram/L (<3 nanogram/mL) (ITT hoặc kích thích glucagon); <11 microram/L (<11 nanogram/ mL) (kích thích GHRH/ arginine; BMI <25kg/m²); <8 microgram/L (<8 nanogram/ mL) (kích thích GHRH/ argine; BMI 25-30 kg/m²); <4
microgram/L (<4 nanogram/ mL) (kích thích GHRH/ arginine; BMI >30 kg/m²) |
| IGF-1
• Mức độ yếu tố tăng trưởng giống insuline 1 (IGF-1) được báo cáo phụ thuộc vào độ tuổi và giới tính. Thiếu hụt 3 hoặc nhiều hơn hormon thùy trước tuyến yên cùng với IGF-1 thấp thường cho thấy thiếu hụt GH và do đó có thể không cần thiết phải xét nghiệm thêm. Tuy nhiên, có thể thấy mức IGH-1 bình thường phù hợp với độ tuổi và giới tính ở 65% bệnh nhân thiếu hụt GH. |
thấp hoặc bình thường |
| LH, FSH
• Testosteron huyết thanh thấp ở nam giới (estradiol ở phụ nữ) cùng với mức FSH và LH bình thường/thấp là phù hợp với tình trạng thiếu hụt gonadotrophin ở nam giới và mất kinh ở phụ nữ tiền mãn kinh. Không tăng FSH và LH ở phụ nữ hậu mãn kinh cũng phù hợp với tình trạng thiếu hụt gonadotrophin. Đo mức gonadotrophin và estradiol ở phụ nữ trong độ tuổi sinh sản có kinh nguyệt không đều thường không đem lại thông tin gì thêm. Kinh nguyệt bình thường là chỉ báo tốt nhất về tình trạng nguyên vẹn của trục sinh dục ở phụ nữ trong độ tuổi sinh sản. |
mức LH và FSH thấp hoặc bình thường ở phụ nữ hậu mãn kinh, ở phụ nữ ở độ tuổi sinh sản bị mất kinh và estradiol thấp, và ở nam giới
có mức testosterone thấp (<6,9 nanomol/L [<200 nanogram/ dL]) |
| testosteron
• Testosteron được đo chính xác nhất là buổi sáng ngay sau khi ngủ dậy. Testosteron có xu hướng cao hơn buổi sáng sớm và thấp hơn trong ngày. Có thể cần phải đo hai đến 3 lần với những người có mức ranh giới <6,9-10,4 nanomol/L (200-300 nanogram/dL). |
thấp ở nam giới thiếu hụt gonadotrophin, hiếm khi cao ở u tuyến tiết LH |
| estradiol
• Đo mức gonadotrophin và estradiol ở phụ nữ trong độ tuổi sinh sản có kinh nguyệt không đều thường không đem lại thông tin gì thêm. Kinh nguyệt bình thường là chỉ báo tốt nhất về tình trạng nguyên vẹn của trục gonadotrophin ở phụ nữ trong độ tuổi sinh sản. |
thấp ở phụ nữ mất kinh trong thời kỳ tiền mãn kinh bị thiếu hụt gonadotrophin |
| TSH, thyroxine tự do
• Bệnh nhân nhập viện với tình trạng bệnh cấp tính nghiêm trọng có thể có hội chứng bình giáp giống như nhược giáp trung tâm. Những bệnh nhân này thường có mức T3 thấp hơn nhiều cùng với tiền sử mắc bệnh cấp tính. Trong những trường hợp đó, khuyến cáo đo T3 tự do cùng với TSH và T4 tự do. Ở một số ca bệnh hiếm, TSH có thể hơi tăng cao ở những bệnh nhân nhược giáp trung tâm. Tại đây TSH sinh miễn dịch nhưng không hoạt tính sinh học. |
T4 tự do và chỉ số T4 tự do thấp gặp trong nhược giáp thứ phát và TSH có thể thấp hoặc bình thường |
| cortisol buổi sáng
• Mức cortisol sáng sớm >414 nanomol/L (15 microgram/dL) ít khả năng chẩn đoán suy thượng thận. Mức cortisol huyết thanh vào sáng sớm <3 microgram/ dL thường giúp chẩn đoán suy thượng thận. Tuy nhiên, hiếm khi gặp mức cortisol vào buổi sáng trong khoảng 3 đến 15 microgram/dL. Những bệnh nhân này nên được đánh giá thêm bằng xét nghiệm kích thích ACTH vào bất kỳ thời điểm nào trong ngày. |
cortisol <83 nanomol/L (3 microgram/dL) vào buổi sáng (8 giờ sáng) cho thấy suy thượng thận |
| Xét nghiệm kích thích ACTH
• Xét nghiệm kích thích ACTH có thể thực hiện vào bất cứ thời điểm nào trong ngày. Bệnh nhân thiếu hụt CRH vùng dưới đồi hoặc ACTH tuyến yên mới khởi phát hoặc nhẹ, một phần (ví dụ như trong vòng 2 đến 4 tuần sau khi phẫu thuật tuyến yên) có thể đáp ứng bình thường với xét nghiệm kích thích ACTH bởi vì tuyến thượng thận chưa teo hoàn toàn và vẫn đáp ứng với nồng độ kích thích ACTH rất cao . Khả năng xét nghiệm phát hiện tình trạng suy thượng thận nhẹ cải thiện khi sử dụng cosyntropin liều thấp (1 microgram ACTH[1-24] đường tiêm tĩnh mạch). Tuy nhiên, điều này có thể dẫn đến tỷ lệ dương tính giả cao hơn. |
cortisol <497 nanomol/L (18 microgam/dL) tại thời điểm 30 phút sau khi tiêm bắp hoặc tĩnh mạch 250 microgram
cosytropin cho thấy suy thượng thận |
| ACTH
• Mức ACTH thường không đáng tin cậy để chẩn đoán suy thượng thận nhưng có thể sử dụng để phân biệt tình trạng suy thượng thận nguyên phát và thứ phát ở những người có mức cortisol thấp. |
thấp hoặc trong giới hạn bình thường ở bệnh nhân suy thượng thận thứ phát. |
| thử nghiệm dung nạp insulin cho cortisol
• Thử nghiệm dung nạp insulin (ITT) thường được sử dụng để đánh giá bệnh nhân nghi ngờ suy thượng thận thứ phát nhằm đánh giá tình trạng nguyên vẹn của trục vùng dưới đồi-tuyến yên-thượng thận (HPA). ITT được coi là thử nghiệm xác định để đánh giá trục HPA. Tuy nhiên, nó thường là không cần thiết bởi vì xét nghiệm kích thích ACTH dễ thực hiện hơn và ngoại trừ trong vòng 2 đến 4 tuần sau sự kiện tuyến yên cấp tính, tương quan tốt với ITT. Mức cortisol huyết thanh trên 18 microgram/dL trong ITT thường được coi là đáp ứng bình thường. Thử nghiệm này cần được bác sĩ có kinh nghiệm thực hiện và thường không cần thiết để đánh giá chức năng thượng thận trong thực hành hàng ngày. |
cortisol <18 microgram/dL được coi là bất thường |
| Bảng chuyển hóa cơ bản
• Bệnh nhân bị suy thượng thận thứ phát thường không bị tăng kali máu bởi ACTH có ít vai trò trong việc điều chỉnh aldosteron. |
có thể có tình trạng hạ natri máu trong nhược giáp và suy thượng thận |
| Công thức máu
• Thiếu máu có thể là một đặc điểm ở bệnh nhân bị suy giảm chức năng sinh dục, nhược giáp và suy thượng thận kéo dài. |
chứng thiếu máu |
| MRI tuyến yên với tăng cường gadolinium
• MRI tuyến yên được lựa chọn hơn là chụp CT. Nó mô tả các đặc điểm của khối u bao gồm bất kỳ xâm lấn nào vào xoang hang và xoang bướm, cùng với chèn ép giao thoa thị giác. Có thể giúp loại trừ các chẩn đoán khác. MRI chống chỉ định ở bệnh nhân dùng máy tạo nhịp tim vĩnh viễn và cần tránh ở bệnh nhân mắc bệnh thận giai đoạn cuối đang tiến hành chạy thận nhân tạo. |
khối hố yên |
| CT tuyến yên dùng chất cản quang
• Trong trường hợp MRI không có sẵn hoặc chống chỉ định, có thể sử dụng chụp CT để đánh giá khối u. |
khối hố yên |
Các xét nghiệm khác cần cân nhắc
| Xét nghiệm Kết quả | |
| xét nghiệm lipid
• Tăng lipid huyết có thể xảy ra khi thiếu hụt GH và suy giảm chức năng sinh dục. |
Tăng lipid huyết |
| Thử nghiệm thị trường Humphrey hoặc Goldmann
• Khám mắt và thử nghiệm thị trường thông thường (thử nghiệm thị trường thị Humphrey hoặc Goldman) được chỉ định nếu chụp hình ảnh cho thấy khối u tuyến đang chèn ép hoặc có tiếp xúc với giao thoa thị giác, nhằm ghi nhận sự giảm thị lực và thị trường. |
thiếu hụt thị trường |
| nhuộm hoá mô miễn dịch
• Có thể giúp xác định tình trạng chức năng của khối u sau khi cắt bỏ. |
nhuộm dương tính đối với bất kỳ hormon thùy trước tuyến yên và tiểu phân tử alpha |
Chẩn đoán khác biệt
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| U tuyến tiết prolactin (u tiết prolactin) | • Đa tiết sữa có thể gợi ý u tiết prolactin.
• Trong khi u tế bào tiết prolactin kích thước lớn có thể có hình ảnh lâm sàng tương tự với u tuyến yên không chức năng kích thước lớn, u tế bào tiết prolactin kích thước nhỏ ở phụ nữ tiền mãn kinh có thể biểu hiện mất kinh và đa tiết sữa, và tình trạng bất lực và thiếu ham muốn tình dục ở nam giới. Suy giảm chức năng sinh dục trong u tuyến yên không chức năng kích thước nhỏ hiếm khi xảy ra. |
• Cần xem xét pha loãng xét nghiệm với u tuyến yên kích thước lớn (>3 cm) để loại trừ hiệu ứng móc thứ phát do
mức prolactin rất cao dẫn đến tăng prolactin mức độ nhẹ đến trung bình (không cần thiết trong các phòng thí nghiệm sử dụng xét nghiệm 2 bước để đo prolactin).[47] |
| U tuyến tiết GH (bệnh to đầu chi) | • U tuyến kích thước lớn chiếm khoảng 75% các trường hợp. Bệnh nhân thường có đặc điểm mặt thô và to.
• Các dấu hiệu và triệu chứng khác bao gồm u nhú da, lưỡi to, HTN, bệnh khớp, tăng tiết mồ hôi, các triệu chứng ngừng thở khi ngủ và dung nạp glucose/đái tháo đường. |
• Mức IGF-1 theo độ tuổi và giới tính thường tăng, và bệnh nhân thường không ức chế GH thấp hơn 1 microgram/L (1 nanogram/mL) hoặc <0,4
microgram/mL (<0,4 nanogram/ mL) sử dụng xét nghiệm cực nhạy trong xét nghiệm dung nạp glucose đường uống. • Nhuộm màu khối u sẽ thấy khuếch tán nhuộm đối với GH và có thể dương tính với prolactin. |
| U tuyến tiết ACTH (hội chứng Cushing) | • Các khối u này thường là u kích thước nhỏ và gây ra các triệu chứng kinh điển của hội chứng Cushing, bao gồm teo da, dễ bầm tím, mặt ửng đỏ, béo phì trung tâm, suy mòn cơ, và vằn da màu tím rộng (>1 cm). | • Tăng cortisol huyết được ghi nhận khi tăng mức cortisol tự do trong nước tiểu 24 giờ, tăng cortisol trong nước bọt lúc nửa đêm, hoặc thiếu ức chế cortisol (<50 nanomol/L
[<1,8 microgram/dL] trong thử nghiệm ức chế dexamethasone liều thấp trong 2 ngày.
• Nhuộm miễn dịch khối u sẽ thấy khuếch tán nhuộm đối với ACTH, và bệnh nhân sẽ phát triển suy thượng thận sau khi cắt bỏ thành công u tuyến yên sản xuất ACTH. |
| U tuyến tiết TSH | • Bệnh nhân có các đặc điểm điển hình của cường giáp như đánh trống ngực, run cơ, sút cân và vã mồ hôi.
• Khối u tuyến yên thường là khối u kích thước lớn. |
• Mức T4 tự do và T3 tự do sẽ tăng trong khi mức TSH bình thường hoặc tăng. Tiểu phân tử alpha thường tăng.
• Nhuộm miễn dịch khối u sẽ thấy nhuộm khuếch tán đối với TSH. |
| Nang Rathke | • Những gì còn lại của túi Rathke có thể phát triển thành nang có kích thước khác nhau và khu trú ở khu vực hố yên hoặc trên hố yên.
• Nang Rathke thường được phát hiện một cách tình cờ nhưng hiếm khi biểu hiện là tổn thương khối choán chỗ và gây ra các hiệu ứng khối như giảm chức năng tuyến yên. |
• Đặc điểm CT của nang Rathke bao gồm mật độ thấp, bờ rõ, khối hố yên không tăng cường có thể làm mở rộng trên hố yên. Trên hình ảnh MR, nang Rathke có thể cho thấy cường độ tín hiệu khác nhau nhưng thường là cường độ cao trên hình ảnh T2. |
| U sọ hầu | • Thường gặp ở trẻ nhỏ nhưng cũng có mức cao thứ hai ở người trưởng thành độ tuổi sáu mươi.
• Bệnh nhân thường có các triệu chứng liên quan đến đái tháo nhạt, ví dụ như tiểu nhiều, khát nhiều và tiểu đêm. |
• Tổn thương dạng nang trên hố yên có thể gợi ý bệnh u sọ hầu. Có tình trạng vôi hoá, nhìn thấy rõ nhất khi chụp CT, ở đến 70% bệnh nhân giúp củng cố chẩn đoán. |
| U màng não | • U màng não gặp nhiều hơn ở phụ nữ, với độ tuổi cao điểm mắc bệnh là khoảng 40 đến 50 tuổi. | • Tăng mật độ đồng nhất trên MRI và xuất hiện tình trạng vôi hoá trên CT củng cố chẩn đoán. Có dấu hiệu đuôi màng cứng gợi ý chẩn đoán. |
| Viêm tuyến yên | • Phổ biến hơn gấp chín lần ở phụ nữ và thường ảnh hưởng đến phụ nữ trẻ trong giai đoạn cuối của thai kỳ hoặc trong giai đoạn sau khi sinh.
• Thường gây ra các rối loạn tự miễn khác như viêm tuyến giáp Hashimoto. |
• Liên quan theo thứ tự thời gian với tình trạng mang thai hoặc sau khi sinh và thiếu hụt ACTH đơn độc có thể là manh mối chẩn đoán. |
| Bệnh sarcoid | • Có thể gặp bệnh sarcoid thần kinh ở khoảng 5% đến 10% người bị bệnh sarcoid. Thường gặp hơn ở người Mỹ gốc Phi và thường ở độ tuổi từ 25 đến 50.
• Liên quan giảm chức năng tuyến yên và đái tháo nhạt với mức độ khác nhau. |
• Các dấu hiệu MRI giúp gợi ý bao gồm dày cuống tuyến yên và tăng cường màng mềm. Bệnh nhân cần chụp X-quang ngực để phát hiện bệnh toàn thân. Chẩn đoán xác định đòi hỏi phải sinh thiết. |
| Nhiễm trùng | • Phần lớn bệnh nhân bị áp-xe tuyến yên có các triệu chứng liên quan đến hiệu ứng khối (bao gồm đau đầu) mà có những thời điểm rất suy nhược.
• Hiếm khi u dạng củ tuyến yên có biểu hiện là tổn thương CNS đơnn độc, không liên quan đến toàn thân. |
• Phân biệt áp-xe tuyến yên với u tuyến không chức năng là rất
khó cả về mặt lâm sàng và chẩn đoán hình ảnh. Áp-xe tuyến yên có thể thấy như là một khối hố yên không tăng cường với thành dày trên hình ảnh MRI. |
| U tế bào mầm | • U tế bào mầm có thể phát sinh ở khu vực trên hố yên và thường gặp hơn ở trẻ em. Bệnh này thường có biểu hiện rối loạn chức năng vùng dưới đồi/tuyến yên, bao gồm đái tháo nhạt, phát triển dậy thì chậm, hoặc dậy thì sớm (ở trẻ em). | • Trên MRI, u tế bào mầm thường xuất hiện có cùng cường độ
trên chuỗi T1 và thường cho thấy tăng cường đồng nhất với gadolinium hoặc tăng cường không đồng nhất nếu có nang. Đo CSF, AFP và beta-hCG huyết thanh có thể có ích trong một số trường hợp. MRI toàn bộ cột sống là bắt buộc để xác định giai đoạn đầy đủ u tế bào mầm nhi khoa, bởi vì 10% đến 15% bệnh nhân sẽ lan đến màng mềm. |
| Tăng sản tuyến yên | • Có thể gặp tuyến yên to thứ phát do tăng sản tuyến yên ở phụ
nữ mang thai, bệnh nhân mắc nhược giáp nguyên phát, suy giảm chức năng sinh dục nguyên phát và phụ nữ sau mãn kinh. • Xác định bệnh rất quan trọng để ngăn ngừa phẫu thuật không cần thiết. |
• MRI thường cho thấy khối hố yên hình đồi rộng tăng cường một cách đồng nhất theo độ tương phản. |
| Phình mạch máu | • Phình động mạch cảnh trên hố yên hoặc trong hố yên hoặc phình động mạch thông trước và sau trên hố yên về mặt lâm sàng có thể giống các khối u tuyến yên lan rộng.
• Dựa trên vị trí của chúng, có thể có biểu hiện của hiệu ứng khối (ví dụ như giảm thị trường và giảm chức năng tuyến yên). |
• Phình mạch vùng hố yên có thể biểu hiện là các cường độ tín hiệu khác nhau trên MRI nếu bị huyết khối một phần. Chụp
mạch máu MR được sử dụng để xác nhận chẩn đoán. |
| Tổn thương di căn | • Thường có tiền sử đã biết của bệnh ác tính, điển hình liên quan đến ung thư vú, phổi và thận. | • Các dấu hiệu CT và MRI có thể gợi ý chẩn đoán với tình trạng ăn mòn xương mở rộng, cuống tuyến yên dày, và khối hố yên không đồng nhất. Đái tháo nhạt là dấu hiệu lâm sàng phổ biến
ở 70% bệnh nhân.[48] Khối u phát triển nhanh chóng trên theo dõi bằng MRI củng cố chẩn đoán. |
Điều trị
Cách tiếp cận điều trị từng bước
Mục tiêu của liệu pháp đối với u tuyến yên không chức năng trên lâm sàng (CNFPA) có hiệu ứng khối là cắt bỏ khối u tối đa nhất có thể, hồi phục giảm thị giác hoặc thiếu hụt thần kinh, hồi phục thiếu hụt hormon, và bảo tồn chức năng của tuyến yên không bị ảnh hưởng. Chỉ theo dõi đơn thuần được chỉ định đối với u tuyến yên nhỏ và u lớn không chức năng trên lâm sàng và không có hiệu ứng khối và không cận giao thoa thị giác.[50] [51] [52] [53] [54] [55]
Phương pháp tiếp cận chung
Trị liệu dựa vào kích thước khối u, sự mở rộng của cận hố yên bao gồm chèn ép con đường thị giác và/hoặc xâm lấn các xoang hang và xoang bướm, các biến chứng như đột quỵ tuyến yên và kinh nghiệm của phẫu thuật viên thần kinh. Điều trị lâm sàng đa ngành bao gồm chuyên khoa nội tiết, X-quang thần kinh, phẫu thuật thần kinh, và xạ trị ung bướu là cần thiết. Các lựa chọn trị liệu có thể bao gồm chỉ theo dõi, phẫu thuật kèm theo hoặc không kèm theo xạ trị sau phẫu thuật, và liệu pháp y khoa.
Xử trí đột quỵ tuyến yên
Đột quỵ tuyến yên là tình trạng có khả năng đe dọa tính mạng bởi vì liên quan đến suy thượng thận cấp tính.[8] [9] Phát hiện bệnh sớm cần điều trị bằng corticosteroid đường tiêm cùng với dịch đường tĩnh mạch và thuốc giảm đau đường tiêm. Nếu không điều trị có thể gây tử vong. Can thiệp phẫu thuật, tốt nhất là trong vòng 24 đến 48 giờ từ khi khởi phát, thường được khuyến cáo trong những trường hợp kèm theo mất thị lực tiến triển hoặc bệnh lý thần kinh sọ não, để giảm thiểu nguy cơ thiếu hụt thần kinh vĩnh viễn.
Theo dõi
U tuyến kích thước nhỏ thường không tăng trưởng và ngay cả khi chúng tăng trưởng, thường không làm giảm thị trường hay suy giảm chức năng tuyến yên. Trong một nghiên cứu, với 166 bệnh nhân u tuyến kích thước nhỏ, 17 (10,2%) cho thấy tăng kích thước khối u 10% (3%-40%) trong thời gian theo dõi trung bình là 4,3 năm. Phần lớn (80%) không thay đổi, trong khi đó 10% có biểu hiện giảm kích thước khối u.[56] Đối với những bệnh nhân u tuyến yên kích thước nhỏ không chức năng trên lâm sàng, ban đầu MRI có thể lặp lại sau 1 năm, và chỉ thực hiện thêm MRI nếu bệnh nhân có các triệu chứng của hiệu ứng khối.
U tuyến lớn có xu hướng tăng trưởng: trong 356 u tuyến lớn, 87 (24%) tăng về kích thước, 45 (13%) giảm, và 224 (63%) không thay đổi trong thời gian theo dõi trung bình là 4,3 năm.[56] Đối với những bệnh nhân bị u lớn tuyến yên không chức năng trên lâm sàng, theo dõi phù hợp là lặp lại MRI sau 6 tháng, và sau đó là hàng năm trong vòng 5 năm, tiếp theo là sau mỗi 2 đến 3 năm nếu ổn định. Phẫu thuật sẽ được chỉ định nếu có tăng trưởng khối u.
Phẫu thuật qua xương bướm
Phẫu thuật qua xương bướm (TSS) được chỉ định là liệu pháp đầu tay đối với:
• Những bệnh nhân bị đột quỵ tuyến yên có triệu chứng
• U lớn tuyến yên không chức năng trên lâm sàng cận giao thoa thị giác, và u kèm theo hiệu ứng khối chẳng hạn như thu hẹp thị trường
• Khối u tăng dần kích thước.
Phẫu thuật có thể được chỉ định khi việc chẩn đoán chưa chắc chắn, nhằm xác nhận chẩn đoán. Việc có mặt của bác sĩ phẫu thuật thần kinh có kinh nghiệm đã được chứng minh là giúp cải thiện kết quả phẫu thuật.[57]
Phần lớn u tuyến yên được loại bỏ bằng TSS (90%). TSS sử dụng các kỹ thuật xâm lấn tối thiểu và các thiết bị thần kinh dẫn đường bằng máy tính. Tuyến yên được tiếp cận bằng đường rạch dưới niêm mạc hoặc dưới môi qua mũi.
Nên chụp MRI trong khi phẫu thuật và có thể cải thiện kết quả phẫu thuật. Dữ liệu cho thấy phương pháp nội soi an toàn và hiệu quả.[58] Phương pháp nội soi có khả quan sát trường phẫu thuật tốt hơn so với phương pháp tiếp cận qua xương bướm dựa trên kính hiển vi truyền thống. Hầu hết nghiên cứu (nhưng không phải tất cả) có so sánh nội soi với phương pháp vi phẫu đề xuất nghiêng về nội soi nhiều hơn do tỷ lệ mắc bệnh liên quan phẫu thuật thấp hơn.[59] [60] Phương pháp nội soi cho kết quả tốt hơn đối với u lớn chức năng với tỷ lệ biến chứng tương tự.[61] Tuy nhiên, chưa có nghiên cứu ngẫu nhiên, quy mô lớn, tiến cứu nào được thực hiện để so sánh hai kỹ thuật này.
TSS là cách thức rất hiệu quả để điều trị u tuyến yên không chức năng trên lâm sàng (CNFPA). Thiếu hụt hormon được cải thiện ở 15% đến 50% bệnh nhân, và tăng prolactin huyết cải thiện trên hai phần ba bệnh nhân.[62] Phẫu thuật có thể gây tình trạng thiếu hụt hormon mới ở 2% đến 15% bệnh nhân.[62] Đái tháo nhạt (DI) tạm thời có thể gặp ở đến một phần ba số ca bệnh, nhưng nguy cơ đái tháo nhạt vĩnh viễn chỉ ở mức 0,5% đến 5%.[62] Nguy cơ tử vong khoảng 0,3% đến 0,5%.[62] Tỷ lệ tái phát khối u sau phẫu thuật dao động từ 12% đến 46%.[63] Sau TSS, suy giảm thị trường được cải thiện hoặc trở lại bình thường ở 51% đến 96% bệnh nhân.[64] [65] [66] Cải thiện chức năng thị giác thậm chí có thể tiếp tục đến tận 1 năm sau phẫu thuật ở một số bệnh nhân.[19] Dữ liệu từ các nghiên cứu về chức năng tuyến yên sau phẫu thuật khá mâu thuẫn nhau: 5 trong số 8 nghiên cứu (62%) cho thấy tình trạng cải thiện, trong khi số còn lại (38%) cho thấy không có cải thiện đáng kể hoặc suy giảm nhất định về chức năng tuyến yên sau phẫu thuật.[19] Trục hormon tăng trưởng có khả năng phục hồi thấp nhất sau TSS.[67]
Việc đánh giá hiệu quả phẫu thuật được khuyến cáo thực hiện ở thời điểm khoảng 4 tháng sau phẫu thuật, vào thời điểm đó các thay đổi sau phẫu thuật thường được giải quyết.[19] Bệnh nhân cần được theo dõi chặt chẽ bằng chụp MRI lặp lại vì nguy cơ tái phát ở 6% đến 46% số bệnh nhân.[19] Sự hiện diện của khối u tồn lưu sau phẫu thuật trên MRI là một yếu tố dự đoán độc lập của tái phát khối u.[19]
Thủ thuật mở hộp sọ chỉ dành cho những khối u với các thành phần nội sọ lớn đặc biệt ảnh hưởng đến thùy trán (mổ dưới thùy trán) hoặc thùy thái dương (mổ thóp bên).
Một nghiên cứu đã chỉ ra kết quả phẫu thuật đối với CNFPA không triệu chứng tốt hơn đối với khối u ngẫu nhiên có triệu chứng và khối u có triệu chứng không phải ngẫu nhiên được sử dụng như để đối chứng. Mặc dù nghiên cứu không ủng hộ việc cắt bỏ bằng phẫu thuật với tất cả CNFPA ngẫu nhiên không triệu chứng, nhưng dữ liệu cho thấy
khi phẫu thuật được chỉ định thì kết quả có thể tốt hơn ở những bệnh nhân CNFPA không triệu chứng. Khối u sót lại sau phẫu thuật có khả năng cao liên quan với xâm lấn vào xoang hang và đường kính khối u tối đa và khả năng thấp liên quan đến đột quỵ tuyến yên và biểu hiện ngẫu nhiên.[68]
Xạ trị
Xạ trị thường được sử dụng sau phẫu thuật khi khối u còn lại lớn, đặc biệt là khối u xâm lấn xoang hang, hoặc để điều trị tái phát. Liệu pháp này có thể được sử dụng để kiểm soát tăng trưởng khối u ở những bệnh nhân mà điều kiện sức khỏe kém không phù hợp với phẫu thuật. Xạ trị sau phẫu thuật dường như giúp giảm nguy cơ tái phát, với tỷ lệ tái phát khối u chung dao động từ 2% đến 36%.[63] Khoảng 10% trong số 224 bệnh nhân được xạ trị sau phẫu thuật, so với 25% trong số 428 bệnh nhân không được xạ trị, bị tái phát khối u.[51] Các báo cáo gần đây về kết hợp chụp MRI sớm sau phẫu thuật đã đánh giá ảnh hưởng của xạ trị sau phẫu thuật trên khối u còn sót lại. Trong số các khối u sót lại thấy rõ trên MRI, 23% trong số 83 bệnh nhân được xạ trị thường quy cho thấy tăng trưởng khối u, so với 41% trong số 200 bệnh nhân không được xạ trị.[62] Cắt bỏ gần như hoàn toàn khối u và sử dụng xạ trị sau phẫu thuật dường như làm giảm nguy cơ tái phát và/hoặc tăng trưởng lại khối u, mặc dù việc này nhìn chung thường được thực hiện sau phẫu thuật đối với khối u còn sót và để điều trị tái phát.[69] Nhóm tuổi trẻ hơn (<60 tuổi) có thể liên quan đến khối u tăng trưởng nhanh hơn do thời gian nhân đôi thể tích khối u ngắn hơn.[70] Có nhiều hình thức xạ trị có thể được sử dụng:
• Xạ trị truyền thống
• Xạ phẫu lập thể
• Xạ trị bằng chùm tia proton.
Xạ trị truyền thống sử dụng máy gia tốc tuyến tính, chia các phân liều trong 5 đến 6 tuần, chia 45 đến 50 Gy ở các phân liều <2 Gy trên một phân liều, trong 25 đến 30 phân liều.
Kỹ thuật này có thể liên quan đến các biến chứng muộn đáng kể:
• Tỷ lệ mắc bệnh giảm chức năng tuyến yên trên 50%.[62]
• Nguy cơ đột quỵ cao gấp 2 lần và nguy cơ u não thứ phát cao gấp 3 đến 4 lần.
• Tăng nguy cơ rối loạn chức năng nhận thức muộn, nguy cơ bệnh thần kinh thị giác do xạ trị là 1,5%, và nguy cơ hoại tử mô não bình thường là 0,2%.[71]
Nguy cơ giảm chức năng tuyến yên tùy thuộc vào liều xạ trị, với liều >20 Gy gây suy giảm có thể nhận biết chức năng thùy trước tuyến yên cũng như tăng prolactin huyết. Thời gian khởi phát thiếu hụt hormon ngắn hơn khi sử dụng liều cao. Các yếu tố nguy cơ khác gây phát triển giảm chức năng tuyến yên bao gồm thể tích khối u còn lại trước xạ trị, trước phẫu thuật cắt bỏ và suy tuyến yên tồn tại trước đó.[72]
Với xạ phẫu áp sát, mục tiêu là đưa liều xạ cao vào mục tiêu đã được xác định rõ hơn trong khi giảm thiểu tổn thương đến các mô xung quanh. Khía cạnh phẫu thuật liên quan đến việc sử dụng các khung cố định xâm lấn để cố định bệnh nhân. Chụp MRI và CT được sử dụng để xác định giải phẫu học khối u và lập bản đồ trường chiếu xạ. Liều xạ duy nhất được chiếu thông qua máy gia tốc tuyến tính (LINAC) hoặc thông qua đa chùm tia cobalt (dao gamma). Với xạ phẫu áp sát, các liều đơn 8 đến 10 Gy được chiếu vào khối u từ 5 mm trở lên từ bộ phận thị giác để tránh nguy cơ bệnh lý thần kinh thị giác. Kiểm soát khối u bằng xạ phẫu áp sát ước tính tỷ lệ sống sót 5 năm không tiến triển bệnh là 88% đến 96%.[71] Giảm chức năng tuyến yên xảy ra ở 4% đến 66% số bệnh nhân được điều trị sau thời gian trung bình là 64 tháng. Đã có các báo báo về bệnh lý thần kinh thị giác và tổn thương dây thần kinh sọ não do xạ trị.
Một nghiên cứu trên 600 bệnh nhân CNFPA đã trải qua xạ phẫu phát hiện tỷ lệ kiểm soát khối u là 67% đến 97% ở những bệnh nhân trước đây đã được chiếu xạ và 95% đến 100% ở những bệnh nhân được xạ trị lần đầu. Bệnh lý thần kinh sọ não xảy ra ở <1% số bệnh nhân. Thiếu hụt hormon thùy trước tuyến yên mới xảy ra ở 8% đến 10% số
bệnh nhân sau 2 đến 3 năm và ở 32% đến 42% sau 5 năm, điều này tương tự như nguy cơ sau xạ trị truyền thống.[59] Trong số 512 bệnh nhân được điều trị bằng phẫu thuật dao gamma (GKS) được theo dõi sau đó trong thời gian trung bình là 26 tháng (khoảng dao động: 1-232 tháng), tỷ lệ kiểm soát khối u lần lượt là 98%, 95%, 91%, và 85% ở thời điểm 3, 5, 8, và 10 năm sau xạ phẫu.[73] Thiếu hụt hormon mới hoặc nặng được ghi nhận ở 21% số bệnh nhân, chủ yếu ở trục tuyến giáp và thượng thận. Bệnh lý thần kinh sọ não mắc mới hoặc tiến triển được ghi nhận ở 9% số bệnh nhân, trong khi bệnh lý thần kinh thị giác mắc mới hoặc nặng được ghi nhận ở 6,6% số bệnh nhân. Thể tích khối u nhỏ và không lan rộng đến hố yên có liên quan có ý nghĩa thống kê với tỷ lệ sống sót với khối u không tiến triển cao hơn.
Hiệu quả của GKS đối với kết quả điều trị khối u tuyến yên không chức năng đã được đánh giá trong một phân tích tổng hợp, trong đó bao gồm 17 nghiên cứu với 925 bệnh nhân.[74] Nghiên cứu cho thấy thể tích khối u tỷ lệ nghịch với kết quả thành công. Tỷ lệ kiểm soát khối u là 99% nếu thể tích khối u <2 mL, 95% nếu thể tích khối u là 2 mL đến 4 mL, và 91% nếu thể tích khối u >4 mL. Tỷ lệ bệnh lý thần kinh thị giác do xạ phẫu và rối loạn nội tiết do xạ phẫu cũng tương tự là 1% khi thể tích khối u <2 mL, 0% đến 7% khi thể tích khối u là 2 mL đến 4 mL, và 2% đến 22% khi thể tích khối u >4 mL. Liều chiếu xạ là tương tự nhau trong 3 nhóm. Nghiên cứu kết luận rằng GSK dường như là hiệu quả nhất trong việc điều trị khối u có thể tích <4 mL.
Một kỹ thuật phẫu thuật mới, được gọi là chuyển vị tuyến yên hay là hypophysopexy, nhằm mục tiêu giảm liều xạ chiếu đến mô tuyến yên bình thường trong các trường hợp xạ trị được lập kế hoạch với khối u còn sót lại trong xoang hang. Kỹ thuật này bao gồm đặt mảnh ghép chất béo giữa tuyến yên bình thường và khối u còn sót lại trong xoang hang trước khi thực hiện xạ trị chia phân suất hoặc xạ phẫu áp sát. Trong một nghiên cứu không có bệnh nhân nào trong số 34 bệnh nhân (bao gồm 19 bệnh nhân bị CNFPA) được thực hiện chuyển vị tuyến yên bị suy giảm chức năng tuyến yên sau thời gian theo dõi trung bình là 4 năm.[75] Kết quả của nghiên cứu này cần được xác minh bằng nghiên cứu dài hạn hơn.
Điều trị hormon
U tuyến yên không chức năng trên lâm sàng (CNFPA) có thể liên quan đến giảm chức năng tuyến yên dẫn đến suy thượng thận trung tâm, nhược giáp, suy giảm chức năng sinh dục, và thiếu hụt hormon tăng trưởng. Thay thế hormon có thể là cần thiết dựa trên xét nghiệm sinh hóa và biểu hiện lâm sàng. Các hormon thay thế bao gồm hormon tuyến giáp, glucocorticoid, estrogen hoặc androgen, và hormon tăng trưởng (somatropin). Phụ nữ còn tử cung sử dụng estrogen hàng ngày cần bổ sung progesteron để phòng ngừa tăng sản nang của nội mạc tử cung và khả năng chuyển dạng thành ung thư.
Một nghiên cứu đánh giá tỷ lệ tử vong dài hạn của các phác đồ thay thế glucocorticoid liều thấp, trung bình và cao ở những bệnh hân CNFPA và suy thượng thận thứ phát cho thấy liều thay thế glucocorticoid cao có liên quan đến tỷ lệ tử vong chung cao hơn. Nghiên cứu chứng minh thêm tầm quan trọng của liệu pháp thay thế glucocorticoid cân bằng và điều chỉnh ở những bệnh nhân CNFPA và thiếu hụt trục HPA.[76]
Liệu pháp y khoa
Liệu pháp y khoa có thể được sử dụng là liệu pháp điều trị bậc hai với những bệnh nhân có u tuyến yên không chức năng trên lâm sàng (CNFPA) với bệnh sẵn có hoặc tái phát sau liệu pháp ban đầu bằng TSS và xạ trị. Chủ vận dopamine (bromocriptin, cabergolin) đã được sử dụng trong những nghiên cứu quy mô nhỏ cho kết quả không rõ ràng.
CNFPA thể hiện các thụ thể dopamin và somatostatin trên màng tế bào, và việc bổ sung chất chủ vận dopamin vào nuôi cấy tế bào u có nguồn gốc gonadotroph làm ức chế giải phóng và tổng hợp gonadotrophin và tiểu phân tử alpha.[77] [78] [79] [80] So với chất tương tự somatostatin, chủ vận dopamin hiệu quả hơn trong việc làm giảm thể tích khối u.[80]
Cabergoline, một chủ vận thụ thể dopamine D2 đặc hiệu mạnh, có thể được sử dụng trong xử trí y khoa sau phẫu thuật đối với khối u sót lại. Trong một nghiên cứu với 9 bệnh nhân có khối u sót lại sau TSS, cabergoline được sử dụng trong 1 năm có tác dụng cải thiện thị lực và co nhỏ khối u đáng kể ở khoảng 80% và 60%.[77] Một nghiên cứu khác đánh giá 13 bệnh nhân. Tỷ lệ khối u nhỏ lại hơn 10% được quan sát thấy ở 7 bệnh nhân (54%), và 2 trong số 9 (22%) số bệnh nhân đã cải thiện các bất thường về thị lực.[81]
Một nghiên cứu đánh giá 10 bệnh nhân CNFPA được điều trị bằng octreotid và cabergolin trong 6 tháng. Bảy bệnh nhân giảm đáng kể ít nhất 50% với mức LH, FSH, hoặc tiểu phân tử alpha và 6 trong số này có khối u nhỏ lại đáng kể ít nhất 18% và trung bình là 30%.[82]
Một đánh giá sâu hơn cho thấy việc sử dụng octreotid, trong thời gian trung bình 6 tháng, có liên quan đến giảm khối u ở 5% số bệnh nhân và cải thiện thị trường ở 32% số bệnh nhân.[80] Điều trị bằng octreotid cải thiện nhanh hơn các triệu chứng như đau đầu và suy giảm thị trường trước bất kỳ thay đổi lớn nào về kích thước khối u. Điều này được cho là có liên quan đến hiệu quả trực tiếp với võng mạc và thần kinh thị giác.[80]
Một nghiên cứu đánh giá chủ vận dopamine ở các bệnh nhân có khối u còn lại sau phẫu thuật. Trong thời gian theo dõi trung bình 40 tháng, liệu pháp chủ vận dopamin đã làm bình ổn hoặc giảm tăng trưởng khối u ở 18/20 (90%) khi được thực hiện ngay sau phẫu thuật, so với tỷ lệ bình ổn tăng trưởng khối u ở 18/47 (38%) không sử dụng liệu pháp chủ vận dopamin. Tăng trưởng khối u được bình ổn ở 8/13 (62%) số bệnh nhân sử dụng chủ vận dopamin có bằng chứng tăng trưởng khối u khi theo dõi. Tỷ lệ sống sót với khối u không tăng trưởng là 104 tháng khi chủ vận dopamin được sử dụng ngay sau khi phẫu thuật; 44 tháng khi chủ vận dopamin được sử dụng khi có bằng chứng khối u tăng trưởng trên theo dõi; và 37 tháng khi không sử dụng chủ vận dopamin sau phẫu thuật.[83] Trong một nghiên cứu khác, bao gồm 19 bệnh nhân CNFPA (11 sau phẫu thuật tuyến yên), điều trị bằng cabergolin cho kết quả giảm thể tích khối u >25% trong 31% bệnh nhân trong 6 tháng theo dõi.[84]
Liệu pháp kết hợp với chất tương tự somatostatin và chủ vận dopamin hầu như chưa được nghiên cứu ở những bệnh nhân CNFPA.[80]
Cabergolin liều cao (>3 mg một ngày) được cho là có liên quan đến bệnh van tim nghiêm trọng ở những bệnh nhân mắc bệnh Parkinson.[85] [86] [87] Hầu hết nghiên cứu không cho thấy bằng chứng về bệnh van tim với liều thấp thường được sử dụng để điều trị cho các bệnh nhân u tiết prolactin.
Tổng quan về các chi tiết điều trị
Tham khảo cơ sở dữ liệu dược địa phương của quý vị để biết thông tin toàn diện về thuốc, bao gồm các chống chỉ định, tương tác giữa các loại thuốc, và liều dùng thay thế. ( xem Tuyên bố miễn trách nhiệm )
| Cấp tính | ||
| đột quỵ tuyến yên | ||
| không có hiệu ứng khối hoặc levothyroxin thiếu hụt thần kinh | 1 | các glucocorticoid |
| thêm | theo dõi | |
| bổ sung | đánh giá phẫu thuật qua xương bướm (qua mũi hoặc qua môi hoặc nội soi) + liệu pháp thay thế hormon liên tục | |
| với hiệu ứng khối và/hoặc khuyết tật thần kinh | 1 | glucocorticoid đường tiêm |
| thêm | phẫu thuật qua xương bướm (qua mũi hoặc qua môi hoặc nội soi) + liệu pháp thay thế hormon liên tục | |
| bổ sung | thuốc giảm đau đường tiêm + bù dịch đường tĩnh mạch | |
| bổ sung | levothyroxin |
| Tiếp diễn | ||
| u tuyến kích thước nhỏ | ||
| 1 | theo dõi | |
| u tuyến kích thước lớn không có hiệu ứng khối và không tiếp giáp với giao thoa thị giác | ||
| 1 | theo | |
| bổ sung | liệu pháp thay thế hormon | |
| bổ | đánh giá phẫu thuật qua xương bướm (qua mũi hoặc qua môi hoặc nội soi) | |
| u tuyến kích thước lớn không có hiệu ứng khối nhưng tiếp giáp với giao thoa thị giác | ||
| 1 | phẫu thuật qua xương bướm (qua mũi hoặc qua môi hoặc nội soi) | |
| bổ sung | liệu pháp thay thế hormon | |
| 2 | theo dõi | |
| bổ sung | liệu pháp thay thế hormon | |
| bổ sung | Xạ trị | |
| bổ sung | chủ vận dopamin hoặc chất tương tự somotostatin | |
| u tuyến kích thước lớn với hiệu ứng khối | ||
| 1 | phẫu thuật qua xương bướm (qua mũi hoặc qua môi hoặc nội soi) | |
| bổ sung | liệu pháp thay thế hormon | |
| bổ sung | Xạ trị | |
| bổ sung | chủ vận dopamin hoặc chất tương tự somotostatin | |
| Cấp tính | ||
| đột quỵ tuyến yên | ||
| không có hiệu ứng khối hoặc thiếu hụt thần kinh | 1 | các glucocorticoid ± levothyroxin
Các lựa chọn sơ cấp » hydrocortison: 100 mg tiêm tĩnh mạch mỗi 8 giờ Và/hoặc » levothyroxin: ban đầu 1 microgram/kg/ngày, điều chỉnh tùy theo TFT » Đột quỵ tuyến yên là tình trạng có khả năng đe dọa tính mạng bởi vì liên quan đến suy thượng thận cấp tính.[8] [9] Cần điều trị kịp thời sau khi phát hiện bệnh bằng corticosteroid qua đường tiêm cùng với truyền dịch và thuốc giảm đau đường tiêm. Nếu không điều trị có thể gây tử vong. |
| thêm | Theo dõi
» MRI cần lặp lại sau 6 đến 12 tháng để đánh giá tăng trưởng khối u, và khoảng cách thời gian theo dõi sau đó tùy theo kích thước khối u. Cần đánh giá thị trường định kỳ nếu khối u tiếp giáp với giao thoa thị giác. |
|
| bổ sung | đánh giá phẫu thuật qua xương bướm (qua mũi hoặc qua môi hoặc nội soi) + liệu pháp thay thế hormon liên tục
Các lựa chọn sơ cấp » levothyroxin: ban đầu 1 microgram/kg/ngày đường uống, điều chỉnh tùy theo TFT Và/hoặc » hydrocortison: 10-20 mg/ngày đường uống chia thành 2-3 liều » testosteron: 30 mg dạng ngậm hai lần mỗi ngày liều tùy theo đáp ứng và mức testosteron trong huyết thanh, tối đa 10 g/ngày |
|
| với hiệu ứng khối và/hoặc khuyết tật thần kinh | 1 | glucocorticoid đường tiêm
Các lựa chọn sơ cấp |
| thêm | phẫu thuật qua xương bướm (qua mũi hoặc qua môi hoặc nội soi) + liệu pháp thay thế hormon liên tục.
Các lựa chọn sơ cấp » levothyroxin: ban đầu 1 microgram/kg/ngày, điều chỉnh tùy theo TFT |
|
| bổ sung | thuốc giảm đau đường tiêm + bù dịch đường tĩnh mạch
|
|
| bổ sung | levothyroxin Các lựa chọn sơ cấp» Nên tiến hành liệu pháp thay thế hormon tuyến giáp nếu bệnh nhân có mức T4 thấp sau khi đã tiến hành liệu pháp glucocorticoid. |
|
| Tiếp diễn | ||
| u tuyến kích thước nhỏ | ||
| 1 | Theo dõi
» Các dữ liệu nghiên cứu chất lượng tốt cho thấy rằng quá trình tự nhiên của các khối u này ở mức mà chỉ cần theo dõi đơn thuần là đủ trong xử trí.[55] [62] [63] [64] [65] [66] Khoảng 10% u tuyến kích thước nhỏ sẽ phát triển, 6% nhỏ lại, và 84% |
|
| u tuyến kích thước lớn không có hiệu ứng khối và không tiếp giáp với giao thoa thị giác |
||
| Theo dõi
» Đối với nhóm bệnh nhân này có thể chỉ cần theo dõi.[55] [62] [63] [64] [65] [66] Cần thảo luận về nguy cơ tăng trưởng khối u. Khoảng 20% đến 50% u tuyến kích thước lớn phát triển, 11% thu hẹp và còn lại là không thay đổi.[56] [66] [67] |
||
| bổ sung | liệu pháp thay thế hormon Các lựa chọn sơ cấp » levothyroxin: ban đầu 1 microgram/kg/ngày đường uống, điều chỉnh tùy theo TFTVà/hoặc» hydrocortison: 10-20 mg/ngày đường uống chia thành 2-3 liềuvà/hoặc» testosteron: 30 mg dạng ngậm hai lần mỗi ngày -hoặc- » testosterone cipionate: 100-200 mg tiêm bắp mỗi 1-2 tuần -hoặc- » testosteron bôi: (1%) 5 g (50 mg testosteron) ban đầu mỗi ngày một lần vào buổi sáng, điều chỉnh liều tùy theo đáp ứng và mức testosteron trong huyết thanh, tối đa 10 g/ngày -hoặc- » testosterone dán lên da: 5 mg/ngày dán da ban đầu mỗi ngày một lần, điều chỉnh liều tùy theo đáp ứng và mức testosteron trong huyết thanh, tối đa 7,5 mg/ngày –VÀ/HOẶC– » somatropin (tái tổ hợp): 0,15 đến 0,3 mg tiêm dưới da mỗi ngày một lần, tăng thêm 0,1 đến 0,2 mg/ngày sau mỗi 1-2 tháng tùy theo đáp ứng và mức IGF-1 trong huyết thanh –VÀ/HOẶC– » estradiol: 0,5 đến 2 mg đường uống mỗi ngày một lần trong 21 ngày theo chu kỳ 28 ngày; 0,025 đến 0,05 mg/ngày dán da mỗi tuần một lần –VÀ/HOẶC– » progesteron dạng mịn: 200 mg đường uống mỗi ngày một lần trong 12 ngày theo chu kỳ 28 ngày (nếu còn tử cung) -hoặc- » medroxyprogesteron: 5-10 mg đường uống mỗi ngày một lần trong 14 ngày của mỗi chu kỳ 28 ngày (nếu còn tử cung) » Cần áp dụng liệu pháp thay thế levothyroxin, corticosteroid, androgen, estrogen và hormon tăng trưởng dựa trên xét nghiệm sinh hoá. » Phụ nữ còn tử cung sử dụng estrogen hàng ngày cần uống progesteron để phòng ngừa tăng sản dạng nang của nội mạc tử cung và khả năng biến đổi thành ung thư. |
|
| bổ sung | đánh giá phẫu thuật qua xương bướm (qua mũi hoặc qua môi hoặc nội soi)
» Khối u phát triển là một chỉ định phẫu thuật nếu không có hiệu ứng khối của xâm nhập giao thoa thị giác. |
|
| u tuyến kích thước lớn không có hiệu ứng khối nhưng tiếp giáp với giao thoa thị giác | ||
| 1 | phẫu thuật qua xương bướm (qua mũi hoặc qua môi hoặc nội soi)
» Phẫu thuật luôn là phương pháp điều trị ban đầu đối với nhóm bệnh nhân này, thứ hai là theo kích thước của khối u và gần với trục thị giác với khả năng gây suy giảm thị trường trong tương lai nếu không điều trị. |
|
| bổ sung | liệu pháp thay thế hormon Các lựa chọn sơ cấp» levothyroxin: ban đầu 1 microgram/kg/ngày, điều chỉnh tùy theo TFT –VÀ/HOẶC– » hydrocortison: 10-20 mg/ngày đường uống chia thành 2-3 liều –VÀ/HOẶC– » testosteron: 30 mg dạng ngậm hai lần mỗi ngày -hoặc- » testosterone cipionate: 100-200 mg tiêm bắp mỗi 1-2 tuần -hoặc- » testosteron bôi: (1%) 5 g (50 mg testosteron) ban đầu mỗi ngày một lần vào buổi sáng, điều chỉnh liều tùy theo đáp ứng và mức testosteron trong huyết thanh, tối đa 10 g/ngày -hoặc- » testosterone dán lên da: 5 mg/ngày dán da ban đầu mỗi ngày một lần, điều chỉnh liều tùy theo đáp ứng và mức testosteron trong huyết thanh, tối đa 7,5 mg/ngày –VÀ/HOẶC– » somatropin (tái tổ hợp): 0,15 đến 0,3 mg tiêm dưới da mỗi ngày một lần, tăng thêm 0,1 đến 0,2 mg/ngày sau mỗi 1-2 tháng tùy theo đáp ứng và mức IGF-1 trong huyết thanh –VÀ/HOẶC– » estradiol: 0,5 đến 2 mg đường uống mỗi ngày một lần trong 21 ngày theo chu kỳ 28 ngày; 0,025 đến 0,05 mg/ngày dán da mỗi tuần một lần –VÀ/HOẶC– » progesteron dạng mịn: 200 mg đường uống mỗi ngày một lần trong 12 ngày theo chu kỳ 28 ngày (nếu còn tử cung) -hoặc- » medroxyprogesteron: 5-10 mg đường uống mỗi ngày một lần trong 14 ngày của mỗi chu kỳ 28 ngày (nếu còn tử cung) » Có thể cần phải tiến hành liệu pháp thay thế glucocorticoid, levothyroxin, androgen, estrogen, và hormon tăng trưởng dựa trên xét nghiệm sinh hoá. » Phụ nữ còn tử cung sử dụng estrogen hàng ngày cần uống progesteron để phòng ngừa tăng sản dạng nang của nội mạc tử cung và khả năng biến đổi thành ung thư. |
|
| bổ sung | Các lựa chọn sơ cấp
» levothyroxin: ban đầu 1 microgram/kg/ngày, điều chỉnh tùy theo TFT |
|
| thêm | Theo dõi
» Bệnh nhân không sẵn sàng phẫu thuật hoặc mắc bệnh đồng thời có thể cần theo dõi chặt chẽ. |
|
| bổ sung | liệu pháp thay thế hormon Các lựa chọn sơ cấp» levothyroxin: ban đầu 1 microgram/kg/ngày đường uống, điều chỉnh tùy theo TFT –VÀ/HOẶC– » hydrocortison: 10-20 mg/ngày đường uống chia thành 2-3 liều –VÀ/HOẶC– » testosteron: 30 mg dạng ngậm hai lần mỗi ngày -hoặc- » testosterone cipionate: 100-200 mg tiêm bắp mỗi 1-2 tuần -hoặc- » testosteron bôi: (1%) 5 g (50 mg testosteron) ban đầu mỗi ngày một lần vào buổi sáng, điều chỉnh liều tùy theo đáp ứng và mức testosteron trong huyết thanh, tối đa 10 g/ngày -hoặc- » testosterone dán lên da: 5 mg/ngày dán da ban đầu mỗi ngày một lần, điều chỉnh liều tùy theo đáp ứng và mức testosteron trong huyết thanh, tối đa 7,5 mg/ngày –VÀ/HOẶC– » somatropin (tái tổ hợp): 0,15 đến 0,3 mg tiêm dưới da mỗi ngày một lần, tăng thêm 0,1 đến 0,2 mg/ngày sau mỗi 1-2 tháng tùy theo đáp ứng và mức IGF-1 trong huyết thanh –VÀ/HOẶC– » estradiol: 0,5 đến 2 mg đường uống mỗi ngày một lần trong 21 ngày theo chu kỳ 28 ngày; 0,025 đến 0,05 mg/ngày dán da mỗi tuần một lần –VÀ/HOẶC– » progesteron dạng mịn: 200 mg đường uống mỗi ngày một lần trong 12 ngày theo chu kỳ 28 ngày (nếu còn tử cung) -hoặc- » medroxyprogesteron: 5-10 mg đường uống mỗi ngày một lần trong 14 ngày của mỗi chu kỳ 28 ngày (nếu còn tử cung) » Có thể cần phải tiến hành liệu pháp thay thế glucocorticoid, levothyroxin, androgen, estrogen, và hormon tăng trưởng dựa trên xét nghiệm sinh hoá. » Phụ nữ còn tử cung sử dụng estrogen hàng ngày cần uống progesteron để phòng ngừa tăng sản dạng nang của nội mạc tử cung và khả năng biến đổi thành ung thư. |
|
| bổ sung | Xạ trị
» Xạ trị, tốt nhất là bằng dao gamma áp sát, có thể được chỉ định nếu có khối u còn lại đáng kể sau phẫu thuật hoặc dấu hiệu đầu tiên của tái phát sau khi đã cắt bỏ khối u thành công ban đầu. |
|
| chủ vận dopamin hoặc chất tương tự somotostatin Các lựa chọn sơ cấp
» bromocriptin: 1,25 đến 2,5 mg đường uống mỗi ngày một lần trong thời gian đầu, tăng lên mức 2,5 mg/ngày mỗi 2-7 ngày tùy theo đáp ứng, tối đa 30 mg/ngày » cabergolin: 0,5 đến 1 mg đường uống mỗi tuần hai lần HOẶC » octreotide: 50 microgram tiêm dưới da mỗi ngày ba lần trong thời gian đầu, tăng dần theo đáp ứng đến 100-200 microgram mỗi ngày ba lần |
||
| chủ vận dopamin hoặc chất tương tự somotostatin Các lựa chọn sơ cấp
» bromocriptin: 1,25 đến 2,5 mg đường uống mỗi ngày một lần trong thời gian đầu, tăng lên mức 2,5 mg/ngày mỗi 2-7 ngày tùy theo đáp ứng, tối đa 30 mg/ngày HOẶC » cabergolin: 0,5 đến 1 mg đường uống mỗi tuần hai lần HOẶC » octreotide: 50 microgram tiêm dưới da mỗi ngày ba lần trong thời gian đầu, tăng dần theo đáp ứng đến 100-200 microgram mỗi ngày ba lần » Có thể xem xét chủ vận dopamin đối với bệnh nhân có khối u còn lại đáng kể hoặc tái phát sau phẫu thuật và xạ trị không kiểm soát được khối u. |
||
| u tuyến kích thước lớn với hiệu ứng khối | ||
| phẫu thuật qua xương bướm (qua mũi hoặc qua môi hoặc nội soi)
» Phẫu thuật qua xương bướm là liệu pháp đầu tay. Phương pháp xuyên sọ có thể được chỉ định đối với khối u lớn với thành phần đáng kể trên hố yên. |
||
| bổ sung | liệu pháp thay thế hormon Các lựa chọn sơ cấp» levothyroxin: ban đầu 1 microgram/kg/ngày, điều chỉnh tùy theo TFT –VÀ/HOẶC– » hydrocortison: 10-20 mg/ngày đường uống chia thành 2-3 liều –VÀ/HOẶC– » testosteron: 30 mg dạng ngậm hai lần mỗi ngày -hoặc- » testosterone cipionate: 100-200 mg tiêm bắp mỗi 1-2 tuần -hoặc- » testosteron bôi: (1%) 5 g (50 mg testosteron) ban đầu mỗi ngày một lần vào buổi sáng, điều chỉnh liều tùy theo đáp ứng và mức testosteron trong huyết thanh, tối đa 10 g/ngày -hoặc- » testosterone dán lên da: 5 mg/ngày dán da ban đầu mỗi ngày một lần, điều chỉnh liều tùy theo đáp ứng và mức testosteron trong huyết thanh, tối đa 7,5 mg/ngày –VÀ/HOẶC– » somatropin (tái tổ hợp): 0,15 đến 0,3 mg tiêm dưới da mỗi ngày một lần, tăng thêm 0,1 đến 0,2 mg/ngày sau mỗi 1-2 tháng tùy theo đáp ứng và mức IGF-1 trong huyết thanh –VÀ/HOẶC– » estradiol: 0,5 đến 2 mg đường uống mỗi ngày một lần trong 21 ngày theo chu kỳ 28 ngày; 0,025 đến 0,05 mg/ngày dán da mỗi tuần một lần –VÀ/HOẶC– » progesteron dạng mịn: 200 mg đường uống mỗi ngày một lần trong 12 ngày theo chu kỳ 28 ngày (nếu còn tử cung) -hoặc- » medroxyprogesteron: 5-10 mg đường uống mỗi ngày một lần trong 14 ngày của mỗi chu kỳ 28 ngày (nếu còn tử cung) » Có thể cần phải tiến hành liệu pháp thay thế glucocorticoid, levothyroxin, androgen, estrogen, và hormon tăng trưởng dựa trên xét nghiệm sinh hoá. » Phụ nữ còn tử cung sử dụng estrogen hàng ngày cần uống progesteron để phòng ngừa tăng sản dạng nang của nội mạc tử cung và khả năng biến đổi thành ung thư. |
|
| bổ sung | Xạ trị
» Xạ trị, tốt nhất là bằng dao gamma sáp sát, có thể được chỉ định nếu có khối u còn lại đáng kể sau khi phẫu thuật hoặc với dấu hiệu đầu tiên của tái phát sau khi đã cắt bỏ khối u thành công ban đầu. Nếu có khối u còn lại sau phẫu thuật, bao gồm dao gamma, LINAC hoặc chùm tia proton. |
|
| bổ sung | chủ vận dopamin hoặc chất tương tự somotostatin Các lựa chọn sơ cấp
» bromocriptin: 1,25 đến 2,5 mg đường uống mỗi ngày một lần trong thời gian đầu, tăng lên mức 2,5 mg/ngày mỗi 2-7 ngày tùy theo đáp ứng, tối đa 30 mg/ngày » cabergolin: 0,5 đến 1 mg đường uống mỗi tuần hai lần » octreotide: 50 microgram tiêm dưới da mỗi ngày ba lần trong thời gian đầu, tăng dần theo đáp ứng đến 100-200 microgram mỗi ngày ba lần |
|
Giai đoạn đầu
Temozolomid
Temozolomid, một tác nhân alkyl hoá thế hệ hai của nhóm imidazontetrazin, có thể được xem xét ở bệnh nhân u tuyến yên tiến triển. So với u tiết prolactin (73%) và khối u tiết ACTH (60%), CNFPA có tỷ lệ đáp ứng thấp hơn (40%).
Đáp ứng dương tính thường rõ rệt và ổn định trong 3 tháng đầu điều trị. Mức thấp của protein sửa chữa ADN, O6- methylguanine-ADN methyltransferase (MGMT), được cho là một chất chỉ điểm sinh học để dự đoán đáp ứng với temozolomid của khối u tuyến yên. Hoá mô miễn dịch MGMT, nhưng không phân tích methyl hoá MGMT, hứa hẹn là một công cụ dự đoán đáp ứng của khối u với temozolomid.[88]
Liên lạc theo dõi
Khuyến nghị
Giám sát
Theo dõi thích hợp với bệnh nhân bị u tuyến yên không chức năng trên lâm sàng (CNFPA) sau phẫu thuật qua xương bướm còn đang gây tranh cãi, không có khuyến cáo hoặc hướng dẫn dựa trên bằng chứng có sẵn. Bệnh nhân có bằng chứng khối u còn lại sau phẫu thuật cần được theo dõi chặt chẽ hơn. Một phân tích tổng hợp từ 19 nghiên cứu ở các bệnh nhân CNFPA sau phẫu thuật, sau khoảng thời gian trung bình 5,7 năm: tỷ lệ tái phát là 12% ở những người không có bằng chứng có khối u còn lại và là 46% ở bệnh nhân có khối u còn lại sau phẫu thuật.[98]
Khuyến cáo của tác giả đối với bệnh nhân u tuyến yên kích thước nhỏ, đặc biệt là với các khối u có kích thước <6 mm, là theo dõi bằng MRI trong 1 năm mà không cần kỹ thuật ghi thường quy nào khác nếu khối u ổn định, trừ khi bệnh nhân có các triệu chứng hoặc dấu hiệu sau đó cho thấy có hiệu ứng khối.[56] Hội Nội tiết khuyến cáo lặp lại MRI trong 1 năm và sau đó là sau mỗi 1 đến 2 năm trong vòng 3 năm, giảm dần mức độ thường xuyên của việc chụp hình ảnh nếu kích thước khối u vẫn ổn định.[99]
Bệnh nhân u tuyến yên không chức năng kích thước lớn cần được theo dõi suốt đời. Họ có thể có nguy cơ tử vong cao, đặc biệt là thứ phát do các bệnh tim mạch.[7]
Nguy cơ khối u phát triển ở u tuyến yên kích thước lớn cao hơn bởi vì khối u đã có xu hướng phát triển. Không có sự đồng thuận, nhưng cách tiếp cận thực dụng sẽ là MRI theo dõi sau 6 tháng và sau đó là hàng năm trong 5 năm.[56]
Có thể tiếp tục theo dõi bằng chụp hình ảnh mỗi 2 đến 3 năm nếu khối u tuyến yên ổn định. Khuyến cáo này phù hợp với khuyến cáo của Hội Nội tiết.[99] Một số bệnh nhân có thể cần can thiệp phẫu thuật và cần theo dõi chặt chẽ bằng MRI lặp lại do nguy cơ tái phát cao.
Trong một nghiên cứu thực hiện trên 50 bệnh nhân CNFPA với thời gian theo dõi trung bình là 8 năm, tất cả bệnh nhân được đánh dấu Ki-67 có chỉ số >2,2% có khối u phát triển, cho thấy cần MRI theo dõi thường xuyên hơn và/ hoặc liệu pháp bổ trợ sớm.[100]
Xem thêm: Toan hô hấp: Hướng dẫn chẩn đoán và điều trị mới nhất của Bộ Y tế
Hướng dẫn dành cho bệnh nhân
Bệnh nhân u tuyến yên không chức năng trên lâm sàng, mặc dù đang theo dõi hoặc điều trị phẫu thuật, cần được cung cấp đầy đủ thông tin về tình trạng và tiền sử tự nhiên của họ.
Bệnh nhân bị giảm chức năng tuyến yên cần đeo một vòng tay MedicAlert® có các thông tin chẩn đoán và điều trị.
Họ cần được cung cấp thông tin về ‘nguyên tắc ngày ốm’ để tăng lượng glucocorticoid cần dùng. [NIH Clinical Center: managing adrenal insufficiency]
Bệnh nhân và gia đình cần được cung cấp thông tin về dấu hiệu và triệu chứng của đột quỵ tuyến yên, để có thể được chăm sóc y tế ngay lập tức.
Các biến chứng
| Các biến chứng | Khung thời gian | Khả năng |
| Sổ mũi CSF | ngắn hạn | thấp |
| Xảy ra ở khoảng 2% bệnh nhân sau TSS và đòi hỏi phẫu thuật để điều trị khiếm khuyết.[96] | ||
| viêm màng não | ngắn hạn | thấp |
| Xảy ra ở dưới 1% bệnh nhân sau TSS.[96] | ||
| tỷ lệ tử vong liên quan phẫu thuật | ngắn hạn | thấp |
| Tỷ lệ tử vong xảy ra ở 0,3% đến 0,5% chủ yếu ở các trường hợp khối u lớn cần phẫu thuật mở hộp sọ.[62] | ||
| đái tháo nhạt (DI) | ngắn hạn | thấp |
| DI tạm thời được ghi nhận ở một phần ba bệnh nhân sau TSS, nhưng DI vĩnh viễn xảy ra ở 0,5% đến 5% bệnh nhân.[62] | ||
| Suy giảm chức năng tuyến yên | dài hạn | thấp |
| Bệnh nhân bị giảm chức năng tuyến yên cần được chẩn đoán sớm và điều trị phù hợp bằng liệu pháp thay thế hormon. Khoảng 2% đến 15% bệnh nhân cần phải áp dụng liệu pháp thay thế hormon bổ sung.[62]
Phần lớn bệnh nhân đều bị giảm chức năng tuyến yên ở một mức độ nào đó do tia xạ qua các năm.[62] Có thể có các biến chứng liên quan đến giảm chức năng tuyến yên (ví dụ như bệnh tim mạch). |
||
| khiếm khuyết thần kinh | dài hạn | thấp |
| Các thiếu hụt thần kinh mới xảy ra ở khoảng 3% và là nguyên nhân chính của tỷ lệ bệnh tật.[96] | ||
| bệnh thần kinh thị giác do tia xạ | dài hạn | thấp |
| Rất hiếm gặp với xạ trị thông thường. Được mô tả ở ít các ca bệnh xạ phẫu bằng dao gamma. Có thể tương đối thường gặp ở xạ phẫu LINAC.[97] | ||
| bệnh ác tính thứ phát do tia xạ | dài hạn | thấp |
| Bệnh nhân cần được theo dõi chặt chẽ bởi các kỹ thuật hình ảnh, tốt nhất là bằng MRI. | ||
Tiên lượng
Bệnh nhân u tuyến yên không chức năng trên lâm sàng (CNFPA) thường có tiên lượng tốt. Khả năng sống không tiến triển trong 10 năm đối với u tuyến yên là 80% đến 94%.[69] U tuyến kích thước nhỏ có thể chỉ cần theo dõi. Nguy cơ phát triển khối u ở bệnh nhân u tuyến yên kích thước nhỏ là thấp – khoảng 0% đến 14% trong thời gian theo dõi 1,8 đến 6,7 năm. Các khối u này thường là lành tính và chậm phát triển. U tuyến kích thước lớn có xu hướng phát triển, và thậm chí khi được chẩn đoán là không có triệu chứng, vẫn cần phải theo dõi rất chặt chẽ. Trong một phân tích tổng hợp các bệnh nhân có khối u tuyến yên ngẫu nhiên vô hại và u tuyến yên không chức năng, tỷ lệ phát triển khối u cao hơn đối với u kích thước lớn, ở mức 12,5 trên 100 người-năm (PY), so với mức 3,3 trên 100 PY đối với u tuyến kích thước nhỏ và 0,05 trên 100 PY ở những người có tổn thương dạng nang.[41] Một nghiên cứu hồi cứu đã ghi nhận tỷ lệ hồi phục khỏi tình trạng giảm chức năng tuyến yên cao hơn ở bệnh nhân <45 tuổi so với các bệnh nhân trong nhóm từ 45 đến 64 tuổi và trên 65 tuổi.[89] Một nghiên cứu khác đã ghi nhận kết quả hormon tốt hơn ở phụ nữ tiền mãn kinh so với nam giới và phụ nữ sau mãn kinh.[90]
Bệnh nhân bị giảm chức năng tuyến yên cần được chẩn đoán sớm và điều trị phù hợp bằng liệu pháp thay thế hormon. Đã có báo cáo về nguy cơ cao hơn mắc hội chứng chuyển hóa – cụ thể là rối loạn mỡ máu – ở bệnh nhân CNFPA khi so sánh với quần thể chung, mà chỉ được giải thích một phần bởi sự hiện diện của giảm chức năng tuyến yên hoặc liệu pháp thay thế hormon.[91] Bệnh nhân CNFPA có thể có nguy cơ tử vong cao hơn, đặc biệt thứ phát do bệnh tim mạch.[7]
Có những quan ngại về di chứng lâu dài của xạ trị, cụ thể là giảm chức năng tuyến yên, được ghi nhận ở khoảng 50% bệnh nhân trong 10 năm.[71] Các phản ứng phụ hiếm gặp khác có thể bao gồm bệnh thần kinh thị giác, tai biến mạch máu não, hoại tử não và bệnh ác tính thứ phát.[71] Bệnh nhân cần được theo dõi chặt chẽ bởi các kỹ thuật hình ảnh, tốt nhất là bằng MRI.
Bệnh nhân u tuyến yên có chất lượng sống (QoL) thấp hơn trước và sau khi phẫu thuật tuyến yên so với những người không bị u tuyến yên, mặc dù một số nghiên cứu nghi ngờ kết luận này.[18] [92] [93] [94] Một nghiên cứu báo cáo về kết quả khảo sát QoL ở 193 người CNFPA. Bệnh nhân được đánh giá bằng 3 bảng câu hỏi đã được phê duyệt về QoL liên quhan đến sức khoẻ. So với nhóm chứng khỏe mạnh ở Anh, bệnh nhân CNFPA có QoL và nhận thức về mặt sức khoẻ chủ quan không bị ảnh hưởng đáng kể. Ở phân tích đa biến nhóm nhỏ, các yếu tố sau đây làm giảm có ý nghĩa thống kê chỉ số của bảng câu hỏi QoL: độ tuổi, giới tính nữ, suy giảm chức năng sinh dục không được điều trị, khối u tái phát, và có giảm thị trường.[95]
Hướng dẫn chẩn đoán
Suspected cancer: recognition and referral
Nhà xuất bản: National Institute for Health and Care Excellence Xuất bản lần cuối: 2017
UK guidelines for the use of thyroid function tests
Nhà xuất bản: Association for Clinical Biochemistry; British Thyroid Association; British Thyroid Foundation
Xuất bản lần cuối: 2006
Pituitary incidentaloma: an Endocrine Society clinical practice guideline
Nhà xuất bản: Endocrine Society Xuất bản lần cuối: 2011
Hướng dẫn điều trị
Guidelines of the Pituitary Society for the diagnosis and management of prolactinomas
Nhà xuất bản: Pituitary Society
Xuất bản lần cuối: 2006
Stereotactic radiosurgery for patients with pituitary adenomas
Nhà xuất bản: International RadioSurgery Association
Xuất bản lần cuối: 2004
Pituitary incidentaloma: an Endocrine Society clinical practice guideline
Nhà xuất bản: Endocrine Society
Xuất bản lần cuối: 2011
Câu hỏi lâm sàng
Câu 1
Một người phụ nữ 37 tuổi đến phòng khám với tiền sử 7 tháng tiết sữa nhiều và mất kinh nguyệt. Cô cũng thấy khô âm đạo nặng nhưng không có đau đầu hoặc các triệu chứng về thị lực. Tiền sử y tế của bệnh nhân không có gì đáng kể, và cô không dùng thuốc lá, rượu hay ma túy. Cô đã kết hôn, có 2 con, và cho rằng gia đình của cô đã “hoàn thành”. Chồng của bệnh nhân đã thắt ống dẫn tinh.
Nhiệt độ của cô là 36,7C, HA 120/80 mmHg, mạch 72 l/ph, nhịp thở 14 l/ph. Kiểm tra trường thị lực bình thường. Test có thai âm tính, và nồng độ prolactin huyết thanh là 150ng/mL (154ng/mL khi đo lại), TSH và creatinin huyết thanh bình thường. MRI tuyến yên thấy tổn thương giảm tỷ trọng 6mm, như hình bên dưới, phù hợp với adenoma tuyến yên.
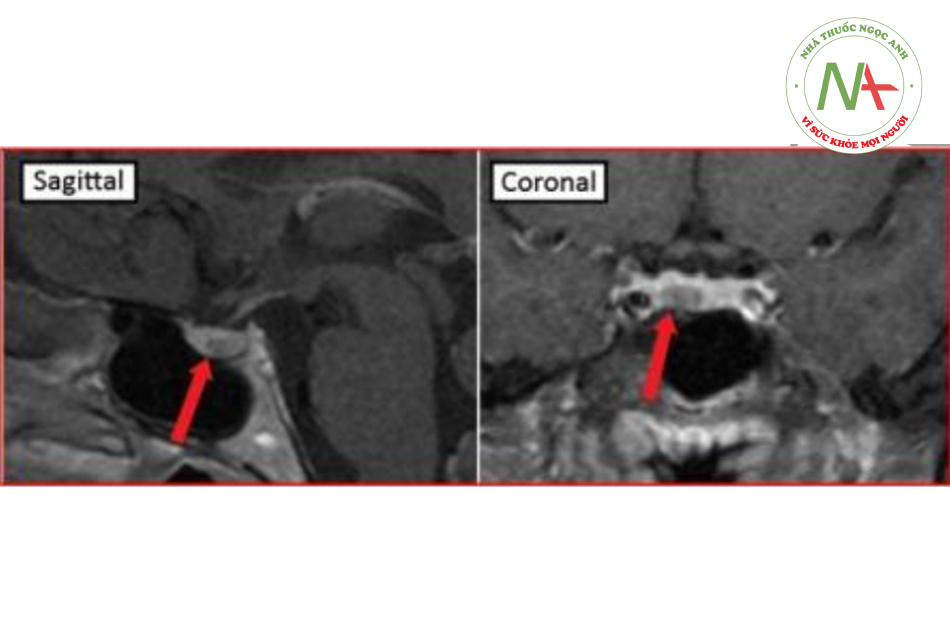
Ý nào dưới đây là bước tiếp theo phù hợp nhất trong điều trị bệnh nhân này ?
- Theo dõi prolactin huyết thanh và MRI từng đợt
- Xạ trị
- Phẫu thuật qua xương bướm
- Điều trị bằng cabergoline
- Điều trị bằng estrogen
Đáp án đúng là D:
Bệnh nhân này có một u tuyến yên bé (<10mm) đi kèm tiết nhiều sữa và các triệu chứng của estrogen thấp (vd mất kinh, khô âm đạo). Bất kỳ tổn thương khối nào trong tuyến yên cũng có thể gây tăng prolactin nhẹ do gián đoạn sự điều hòa bài tiết prolactin qua ức chế bình thường của dopamine. Tuy nhiên, tăng đáng kể nồng độ prolactin (VD nồng độ prolactin huyết thanh >200ng/mL, hoặc nồng độ lặp lại >100 ng/mL) gợi ý khối u tiết prolactin (prolactinoma). Tăng nồng độ prolactin ức chế hormone giải phóng gonadotropin (GnRH), LH, và estradiol, dẫn đến kinh nguyệt không đều-mất kinh ở phụ nữ tiền mãn kinh. Nam giới và phụ nữ tiền mãn kinh thường có các triệu chứng sớm tối thiểu và nhiều khả năng được đánh giá khi khối u đã lớn (>1cm, macroadenoma), gây ra các triệu chứng do chèn ép (vd đau đầu, khiếm khuyết trường thị lực).
Bệnh nhân không triệu chứng ứng và vô tình phát hiện microprolactinoma có thể được theo dõi theo thời gian (lựa chọn A). Bệnh nhân có macroprolactinoma hoặc khối u có triệu chứng bất kỳ kích cỡ (như bệnh nhân này) nên được điều trị với chất đồng vận dopaminergic (vd cabergoline, bromocriptine), có thể bình thường hóa nồng độ prolactin và giảm kích thích khối u. Bệnh nhân mà đáp ứng thất bại hoặc có khối u rất lớn (>3cm) nên được xem xét cắt bỏ qua xương bướm (lựa chọn C).
Lựa chọn B: Bệnh nhân vẫn sót mô tiêt prolactin sau phẫu thuật nên được xem xét xạ trị. Tuy nhiên, đáp ứng với phương pháp xạ trị thường chậm và xạ trị có thể dẫn đến suy toàn bộ tuyến yên.
Lựa chọn E: Liệu pháp thay thế estrogen có thể được đưa ra để làm giảm nguy cơ loãng xương ở phụ nữ nữ giảm oestrogen có microprolactinoma không dung nạp chất đồng vận dopamine. Tuy nhiên, estrogen không làm giảm kích thước khối u.
Mục tiêu học tâp:
Bệnh nhân có một khối u tiết prolactin lớn (>1cm) hoặc prolactinoma có triệu chứng nên được điều trị với chất đồng vân dopaminergic (VD cabergoline, bromocriptine), có thể làm giảm nồng độ prolactin và giảm kích thước khối u.
Câu 2
Một người đàn ông 56 tuổi đến gặp bác sĩ có tiền sử 7 tháng đau đầu, mất hứng thú tình dục, rối loạn cương dương, và rối loạn thị lực. Tiền sử y tế của ông không có gì đáng kể. Hiện tại ông không dùng thuốc gì. Bệnh nhân có tiền sử hút thuốc 15 bao/năm và không dùng rượu. Kiểm tra thị lực, có trường giảm thị lực nhỏ ở thái dương cả 2 bên. Kiểm tra sinh dục tiết niệu thấy teo tinh hoàn. MRI scan thấy u tuyến yên 1,5cm. Kết quả sinh hóa nào dưới đây phù hợp nhất với chẩn đoán prolactinoma của bệnh nhân này?
| Prolactin (ng/mL) (bt <15ng/mL) | LH | TSH | |
| A | 200 | Thấp | Bình thường |
| B | 45 | Thấp | Thấp |
| C | 35 | Bình thường | Bình thường |
| D | 90 | Thấp | Cao |
Đáp án đúng là A:
| Tổng quan prolactinoma | |
| Biểu hiện lâm sàng |
|
| Xét nghiệm /hình ảnh |
|
| Điều trị |
|
Adenomas lactotroph sản xuất prolactin (prolactinoma) chịu trách nhiệm cho xấp xỉ 50% các khối u tuyến yên nguyên phát, khiến chúng là loại phổ biến nhất. Prolactinomas thường được phát hiện sớm (microadenomas <10mm) ở phụ nữ tiền mãn kinh do liên quan đến các triệu chứng nội tiết (ít/mất kinh, vô sinh, tiết nhiều sữa). Tuy nhiên, ở nam giới và phụ nữ mãn kinh, prolactinoma gây ra các triệu chứng tối thiểu và không đặc hiệu ở giai đoạn sớm, và rất nhiều không được chẩn đoán cho đến khi chúng lớn hơn và gây ra các triệu chứng chèn ép như là đau đầu hoặc khiếm khuyết thị lực. Nam giới cũng có thể phát triển các triệu chứng của nhược năng sinh dục vùng dưới đồi do ức chế hormone giải phóng gonadotropin từ vùng dưới đồi bởi prolactin. Chứng vú to biểu hiện ở khoảng 1/3 nam giới có prolactinoma, tiết nhiều sữa có thể xảy ra nhưng không phổ biến.
Cường độ tăng prolactin tương ứng với kích ^thước của prolactinoma, và nồng độ >200 ng/mL hầu như giúp chẩn đoán của prolactinoma. Ở bệnh nhân này, cường prolactin máu ở nồng độ này thường sẽ gây ra nhược năng tuyến sinh dục với nồng độ Testosterone thấp và LH thấp hoặc bình thường thấp. TSH cũng có thể bình thường hoặc thấp, nó phụ thuộc vào mức chèn ép đối với các tế bào hướng tuyến giáp.
Lựa chọn B: Các khối u tuyến yên rất lớn có thể gây ra TSH và LH thấp do chèn ép bởi thyrotrophs và gonadotrophs, cùng với tăng prolactin nhẹ do chèn ép con đường dopaminergic ở cuống tuyến yên. Đây là dấu hiệu đặc trưng cho macroadenoma tuyến yên không chức năng (thường tiết tiểu phần alpha gonadotrophs trơ về mặt hóa sinh). Tuy nhiên, tăng nồng độ
prolactin nhẹ 45 ng/mL ít phù hợp với prolactinoma 1,5cm, cái mà nhiều khả năng liên quan đến nồng độ prolactin >200 ng/mL (nồng độ prolactin có thể cao đến 1000 ng/mL ở prolactinoma ~2cm).
Lựa chọn C: tăng nhẹ prolactin trong bối cảnh các chức năng tuyến yên khác bình thường điển hình do thuốc (VD một số thuốc chống rối loạn thần kinh). Các nguyên nhân khác là suy giáp và suy thận.
Lựa chọn D: Suy giáp nguyên phát có thể gây cường prolactin máu nhẹ đến trung bình, được cho là do kích thích lactotrophs do TRH gây ra. LH ở những bệnh nhân này sẽ bình thường hoặc thấp nhẹ.
Mục tiêu học tập:
Adenoma lactotrophs sản xuất prolactin (prolactinoma) là khối u tuyến yên nguyên phát phổ biến nhất. Nồng độ prolactin huyết thanh tương xứng với kích thước của prolactinoma, và nồng độ >200 ng/mL về cơ bản giúp chẩn đoán bệnh.
Câu 3
Bệnh nhân nữ 36 tuổi đến khoa cấp cứu do đau đầu dữ dội và giảm thị lực. Triệu chứng bắt đầu đột ngột 1 tiếng trước và từ đó bệnh nhân có cảm thấy mệt, chóng mặt và buồn nôn. Bệnh nhân không có triệu chứng tương tự như vậy trước đây. Tiền sử bệnh lý điển hình với u tiết prolactin được chẩn đoán 1 tháng trước và được điều trị với cabergoline. Bệnh nhân không sử dụng thuốc lá, rượu hay chất cấm. Nhiệt độ 37.6, huyết áp đo khi nằm ngửa 80/50 và giảm đến 60/40 khi đứng và mạch 110l/p. Thăm khám thực thể, bệnh nhân biểu hiện hồi hộp và suy hô hấp vừa. Có sụp mí nhẹ và giảm cử động khép ở nửa người phải. Bán manh thái dương 2 bên có xuất hiện. Các chi trên và dưới có sức cơ và cảm giác bình thường. Tĩnh mạch cổ xẹp, tim và phổi bình thường, không có ấn đau ở bụng hay phù chi. Nguyên nhân nào sau đây nhiều khả năng nhất gây ra huyết động thay đổi ở bệnh nhân này?
- Giảm nồng độ hormon thượng thận.
- Tác dụng phụ của thuốc dopaminergic
- Tăng áp lực nội sọ toàn thể
- Mất đường ly tâm của hệ giao cảm trung ương
- Co mạch dưới nhện gây ra bởi máu.
Bệnh nhân này với tiền sử u tuyến yên có đau đầu dữ dội, sụp mí, thay đổi thị lực nhiều khả năng do ngập máu tuyến yên. Ngập máu tuyến yên thường bao gồm chảy máu đột ngột vào u tuyến yên phì đại (u tiết prolactin). Nhiều trường hợp xảy ra không kèm nguyên nhân rõ ràng, mặc dù kích thước có biểu hiện yếu tố nguy cơ, có thể do sự trải rộng của khối u phát triển quá mức hoặc chèn ép nguồn máu của chính nó.
Chảy máu vào khoang giải phẫu hẹp của hõm yên có thể khởi phát đột ngột, đau đầu dữ dội cũng như rối loạn thị lực (nhìn đôi, bán manh 2 bên thái dương) và rối loạn mắt (sụp mí) do chèn ép dây thần kinh vận nhãn hoặc giao thoa thị giác. Thêm vào đó, thường có mất toàn bộ chức năng tuyến yên; trong bệnh cảnh cấp của mất ACTH là quan trọng nhất và có thể dẫn đến tốn thương cấp tuyến thượng thận (suy thượng thận cấp)
Cortisol có thể duy trì chức năng mạch bởi cho khả năng tác động co mạch của catecholamin (norepinephrine). Trong sự mất bài tiết ACTH, vỏ thượng thận dừng tổng hợp cortisol và giảm huyết áp nghiêm trọng và shock phân phối có thể xuất hiện. Hạ đường huyết có thể cũng xuất hiện. Điều trị bao gồm hồi sức tuần hoàn nhanh chóng và thực hiện truyền glucocorticoid tĩnh mạch (hydrocortisone, dexamethasone). Can thiệp phẫu thuật thần kinh có thể cũng cần thiết.
Ý B: Dopamine ức chế bài tiết prolactin, và chủ vận dopamine (cabergoline, bromocriptine) có thể được sử dụng điều trị đầu tay cho u tiết prolactin và có thể gây hạ huyết áp tư thế đứng. Các thuốc này không được ghi nhận có thúc đẩy ngập máu tuyến yên (đau đầu đột ngột, giảm thị lực, rối loạn mắt)
Ý C: Giả u não (tăng áp lực nội sọ không rõ nguyên nhân) hầu hết ảnh hưởng người thừa cân, phụ nữ trước kỳ kinh và có thể biểu hiện có đau đầu và nhìn đôi. Tuy nhiên, nó có thể không giải thích tình trạng hạ áp dữ dội và thay vào đó có xu hướng gây tăng áp và nhịp tim nhanh (thông qua phản xạ Cushing)
Ý D: Shock thần kinh gây ra bởi mất hoạt động thần kinh giao cảm do tổn thương tủy sống. Bệnh nhân xuất hiện hạ áp nghiêm trọng, nhưng bệnh thường đi kèm nhịp chậm hơn là nhịp nhanh. Shock thần kinh không có khả năng ở bệnh nhân này do có sức cơ và cảm giác bình thường ở các chi
Ý E: Xuất huyết dưới nhện hầu hết xảy ra do vỡ phình mạch não dạng túi và biểu hiện có khởi phát đột ngột cơn đau đầu dữ dội. Rối loạn thị giác có thể xuất hiện, nhưng hạ áp nghiêm trọng không xảy ra.
Mục tiêu học tập: Ngập máu tuyến yên bao gồm xuất huyết đột ngột vào u tuyến yên phì đại. Bệnh nhân thường có cơn khởi phát đột ngột đau đầu dữ đội và rối loạn thị giác. Ngoài ra còn mất chức năng tuyến yên, vì cortisol giúp duy trì hoạt động mạch máu, sự thiếu vắng cortisol gây ra bởi ACTH có thể dẫn tới tổn thương thượng thận cấp (suy thượng thận cấp) kèm hạ áp nghiêm trọng và shock phân phối.
Tài liệu tham khảo
Các bài báo chủ yếu
• Chanson P, Salenave S. Diagnosis and treatment of pituitary adenomas. Minerva Endocrinol. 2004 Dec;29(4):241-75. Tóm lược
• Sibal L, Ball SG, Connolly V, et al. Pituitary apoplexy: a review of clinical presentation, management and outcome in 45 cases. Pituitary. 2004;7(3):157-63. Tóm lược
• Dekkers OM, Pereira AM, Romijn JA, et al. Treatment and follow-up of clinically nonfunctioning pituitary macroadenomas. J Clin Endocrinol Metab. 2008 Oct;93(10):3717-26. Tóm lược
• Shomali ME, Katznelson L. Medical therapy of gonadotropin-producing and nonfunctioning pituitary adenomas. Pituitary. 2002;5(2):89-98. Tóm lược
• Dekkers OM, Hammer S, de Keizer RJ, et al. The natural course of non-functioning pituitary macroadenomas. Eur J Endocrinol. 2007 Feb;156(2):217-24. Tóm lược
• Karavitaki N, Collison K, Halliday J, et al. What is the natural history of nonoperated nonfunctioning pituitary adenomas? Clin Endocrinol (Oxf). 2007 Dec;67(6):938-43. Tóm lược
• Molitch ME. Nonfunctioning pituitary tumors and pituitary incidentalomas. Endocrinol Metab Clin North Am. 2008 Mar;37(1):151-71. Tóm lược
• Dekkers OM, Pereira AM, Roelfsema F, et al. Observation alone after transsphenoidal surgery for nonfunctioning pituitary macroadenoma. J Clin Endocrinol Metab. 2006 May;91(5):1796-1801. Tóm lược
• Mortini P, Losa M, Barzaghi R, et al. Results of transsphenoidal surgery in a large series of patients with pituitary adenoma. Neurosurgery. 2005 Jun;56(6):1222-33. Tóm lược
• Brada M, Jankowska P. Radiotherapy for pituitary adenomas. Endocrinol Metab Clin North Am. 2008 Mar;37(1):263-75. Tóm lược
• Pivonello R, Matrone C, Filippella M, et al. Dopamine receptor expression and function in clinically nonfunctioning pituitary tumors: comparison with the effectiveness of cabergoline treatment. J Clin Endocrinol Metab. 2004 Apr;89(4):1674-83. Tóm lược
Tài liệu tham khảo
1. Surawicz TS, McCarthy BJ, Kupelian V, et al. Descriptive epidemiology of primary brain and CNS tumors: results from the Central Brain Tumor Registry of the United States, 1990-1994. Neuro Oncol. 1999 Jan;1(1):14-25. Toàn văn Tóm lược
2. Freda PU, Post KD. Differential diagnosis of sellar masses. Endocrinol Metab Clin North Am. 1999 Mar;28(1):81-117. Tóm lược
3. Ironside JW. Best Practice No 172: pituitary gland pathology. J Clin Pathol. 2003 Aug;56(8):561-8. Toàn văn Tóm lược
4. Louis DN, Ohgaki H, Wiestler OD, et al, eds. WHO classification of tumours of the central nervous system. Lyon, France: IARC Press; 2016.
5. Lloyd RV, Osamura RY, Klöppel G, et al, eds. World Health Organization classification of tumours of endocrine organs. 4th ed. Lyon, France: IARC Press; 2017:39-40.
6. Arafah BM, Nasrallah MP. Pituitary tumors: pathophysiology, clinical manifestations and management. Endocr Relat Cancer. 2001 Dec;8(4):287-305. Toàn văn Tóm lược
7. Chanson P, Salenave S. Diagnosis and treatment of pituitary adenomas. Minerva Endocrinol. 2004 Dec;29(4):241-75. Tóm lược
8. Verrees M, Arafah BM, Selman WR. Pituitary tumor apoplexy: characteristics, treatment, and outcomes. Neurosurg Focus. 2004 Apr 15;16(4):E6. Tóm lược
9. Sibal L, Ball SG, Connolly V, et al. Pituitary apoplexy: a review of clinical presentation, management and outcome in 45 cases. Pituitary. 2004;7(3):157-63. Tóm lược
10. Heseltine D, White MC, Kendall-Taylor P, et al. Testicular enlargement and elevated serum inhibin concentrations occur in patients with pituitary macroadenomas secreting follicle stimulating hormone. Clin Endocrinol (Oxf). 1989 Oct;31(4):411-23. Tóm lược
11. Cooper O, Geller JL, Melmed S. Ovarian hyperstimulation syndrome caused by an FSH-secreting pituitary adenoma. Nat Clin Pract Endocrinol Metab. 2008 Apr;4(4):234-8. Tóm lược
12. Djerassi A, Coutifaris C, West VA, et al. Gonadotroph adenoma in a premenopausal woman secreting follicle- stimulating hormone and causing ovarian hyperstimulation. J Clin Endocrinol Metab. 1995 Feb;80(2):591-4. Tóm lược
13. Snyder PJ, Sterling FH. Hypersecretion of LH and FSH by a pituitary adenoma. J Clin Endocrinol Metab. 1976 Mar;42(3):544-50. Tóm lược
14. Davis JR, Farrell WE, Clayton RN. Pituitary tumours. Reproduction. 2001 Mar;121(3):363-71. Toàn văn Tóm lược
15. Daly AF, Rixhon M, Adam C, et al. High prevalence of pituitary adenomas: a cross-sectional study in the province of Liege, Belgium. J Clin Endocrinol Metab. 2006 Dec;91(12):4769-75. Tóm lược
16. Monson JP. The epidemiology of endocrine tumours. Endocr Relat Cancer. 2000 Mar;7(1):29-36. Tóm lược
17. Faglia G. Epidemiology and pathogenesis of pituitary adenomas. Acta Endocrinol (Copenh). 1993 Jul;129 Suppl 1:1-5. Tóm lược
18. Nielsen EH, Lindholm J, Laurberg P, et al. Nonfunctioning pituitary adenoma: incidence, causes of death and quality of life in relation to pituitary function. Pituitary. 2007;10(1):67-73. Tóm lược
19. Dekkers OM, Pereira AM, Romijn JA, et al. Treatment and follow-up of clinically nonfunctioning pituitary macroadenomas. J Clin Endocrinol Metab. 2008 Oct;93(10):3717-26. Tóm lược
20. Billestrup N, Swanson LW, Vale W. Growth hormone-releasing factor stimulates proliferation of somatotrophs in vitro. Proc Natl Acad Sci USA. 1986 Sep;83(18):6854-7. Toàn văn Tóm lược
21. Herman V, Fagin J, Gonsky R, et al. Clonal origin of pituitary adenomas. J Clin Endocrinol Metab. 1990 Dec;71(6):1427-33. Tóm lược
22. Alexander JM, Biller BM, Bikkal H, et al. Clinically nonfunctioning pituitary tumors are monoclonal in origin. J Clin Invest. 1990 Jul;86(1):336-40. Toàn văn Tóm lược
23. Shimon I, Melmed S. Genetic basis of endocrine disease: pituitary tumor pathogenesis. J Clin Endocrinol Metab. 1997 Jun;82(6):1675-81. Toàn văn Tóm lược
24. Melmed S. Pathogenesis of pituitary tumors. Endocrinol Metab Clin North Am. 1999 Mar;28(1):1-12. Tóm lược
25. Simpson DJ, Bicknell JE, McNicol AM, et al. Hypermethylation of the p16/CDKN2A/MTSI gene and loss of protein expression is associated with nonfunctional pituitary adenomas but not somatotrophinomas. Genes Chromosomes Cancer. 1999 Apr;24(4):328-36. Tóm lược
26. Ruebel KH, Jin L, Zhang S, et al. Inactivation of the p16 gene in human pituitary nonfunctioning tumors by hypermethylation is more common in null cell adenomas. Endocr Pathol. 2001 Fall;12(3):281-9. Tóm lược
27. Occhi G, Albiger N, Berlucchi S, et al. Peroxisome proliferator-activated receptor gamma in the human pituitary gland: expression and splicing pattern in adenomas versus normal pituitary. J Neuroendocrinol. 2007 Jul;19(7):552-9. Tóm lược
28. Emery MN, Leontiou C, Bonner SE, et al. PPAR-gamma expression in pituitary tumours and the functional activity of the glitazones: evidence that any anti-proliferative effect of the glitazones is independent of the PPAR-gamma receptor. Clin Endocrinol (Oxf). 2006 Sep;65(3):389-95. Tóm lược
29. Heaney AP, Fernando M, Melmed S. PPAR-gamma receptor ligands: novel therapy for pituitary adenomas. J Clin Invest. 2003 May;111(9):1381-8. Toàn văn Tóm lược
30. European Medicines Agency. Questions and answers on the suspension of rosiglitazone-containing medicines (Avandia, Avandamet and Avaglim). Sep 2010 [internet publication]. Toàn văn
31. Zhang X, Horwitz GA, Heaney AP, et al. Pituitary tumor transforming gene (PTTG) expression in pituitary adenomas. J Clin Endocrinol Metab. 1999 Feb;84(2):761-7. Tóm lược
32. McCabe CJ, Khaira JS, Boelaert K, et al. Expression of pituitary tumour transforming gene (PTTG) and fibroblast growth factor-2 (FGF-2) in human pituitary adenomas: relationships to clinical tumour behaviour. Clin Endocrinol (Oxf). 2003 Feb;58(2):141-50. Tóm lược
33. Levy A. Molecular and trophic mechanisms of tumorigenesis. Endocrinol Metab Clin N Am. 2008 Mar;37(1):23-50. Tóm lược
34. Daly AF, Jaffrain-Rea ML, Ciccarelli A, et al. Clinical characterization of familial isolated pituitary adenomas. J Clin Endocrinol Metab. 2006 Sep;91(9):3316-23. Tóm lược
35. Beckers A, Daly AF. The clinical, pathological, and genetic features of familial isolated pituitary adenomas. Eur J Endocrinol. 2007 Oct;157(4):371-82. Toàn văn Tóm lược
36. Katznelson L, Alexander JM, Klibanski A. Clinical review 45: Clinically nonfunctioning pituitary adenomas. J Clin Endocrinol Metab. 1993 May;76(5):1089-94. Tóm lược
37. Shomali ME, Katznelson L. Medical therapy of gonadotropin-producing and nonfunctioning pituitary adenomas. Pituitary. 2002;5(2):89-98. Tóm lược
38. Young WF Jr, Scheithauer BW, Kovacs KT, et al. Gonadotroph adenoma of the pituitary gland: a clinicopathologic analysis of 100 cases. Mayo Clin Proc. 1996 Jul;71(7):649-56. Tóm lược
39. Randeva HS, Schoebel J, Byrne J, et al. Classical pituitary apoplexy: clinical features, management and outcome. Clin Endocrinol (Oxf). 1999 Aug;51(2):181-8. Tóm lược
40. Nielsen EH, Lindholm J, Bjerre P, et al. Frequent occurrence of pituitary apoplexy in patients with non-functioning pituitary adenoma. Clin Endocrinol (Oxf). 2006 Mar;64(3):319-22. Tóm lược
41. Fernández-Balsells MM, Murad MH, Barwise A, et al. Natural history of nonfunctioning pituitary adenomas and incidentalomas: a systematic review and metaanalysis. J Clin Endocrinol Metab. 2011 Apr;96(4):905-12. Tóm lược
42. Biller BM, Samuels MH, Zagar A, et al. Sensitivity and specificity of six tests for the diagnosis of adult GH deficiency. J Clin Endocrinol Metab. 2002 May;87(5):2067-79. Tóm lược
43. Yuen KC, Biller BM, Molitch ME, et al. Clinical review: Is lack of recombinant growth hormone (GH)-releasing hormone in the United States a setback or time to consider glucagon testing for adult GH deficiency? J Clin Endocrinol Metab. 2009 Aug;94(8):2702-7. Tóm lược
44. Gordon DL, Emanuele MA. Hot flashes in patients with hypogonadism and low serum gonadotropin levels. Endocr Pract. 2003 Mar-Apr;9(2):119-23. Tóm lược
45. Bleicken B, Hahner S, Ventz M, et al. Delayed diagnosis of adrenal insufficiency is common: a cross-sectional study in 216 patients. Am J Med Sci. 2010 Jun;339(6):525-31. Tóm lược
46. Pineyro MM, Makdissi A, Faiman C, et al. Poor correlation of serum alpha-subunit concentration and magnetic resonance imaging following pituitary surgery in patients with nonfunctional pituitary macroadenomas. Endocr Pract. 2008 May-Jun;14(4):452-7. Tóm lược
47. Fleseriu M, Lee M, Pineyro MM, et al. Giant invasive pituitary prolactinoma with falsely low serum prolactin: the significance of ‘hook effect’. J Neurooncol. 2006 Aug;79(1):41-3. Tóm lược
48. Gopan T, Toms SA, Prayson RA, et al. Symptomatic pituitary metastases from renal cell carcinoma. Pituitary. 2007;10(3):251-9. Tóm lược
49. Brandi ML, Gagel RF, Angeli A, et al. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab. 2001 Dec;86(12):5658-71. Tóm lược
50. Dekkers OM, Hammer S, de Keizer RJ, et al. The natural course of non-functioning pituitary macroadenomas. Eur J Endocrinol. 2007 Feb;156(2):217-24. Tóm lược
51. Feldkamp J, Santen R, Harms E, et al. Incidentally discovered pituitary lesions: high frequency of macroadenomas and hormone-secreting adenomas – results of a prospective study. Clin Endocrinol (Oxf). 1999 Jul;51(1):109-13. Tóm lược
52. Reincke M, Allolio B, Saeger W, et al. The ‘incidentaloma’ of the pituitary gland. Is neurosurgery required? JAMA. 1990 May 23-30;263(20):2772-6. Tóm lược
53. Donovan LE, Corenblum B. The natural history of the pituitary incidentaloma. Arch Intern Med. 1995 Jan 23;155(2):181-3. Tóm lược
54. Nishizawa S, Ohta S, Yokoyama T, et al. Therapeutic strategy for incidentally found pituitary tumors (“pituitary incidentalomas”). Neurosurgery. 1998 Dec;43(6):1344-8. Tóm lược
55. Karavitaki N, Collison K, Halliday J, et al. What is the natural history of nonoperated nonfunctioning pituitary adenomas? Clin Endocrinol (Oxf). 2007 Dec;67(6):938-43. Tóm lược
56. Orija IB, Weil RJ, Hamrahian AH. Pituitary incidentaloma. Best Pract Res Clin Endocrinol Metab. 2012 Feb;26(1):47-68. Tóm lược
57. Gittoes NJ, Sheppard MC, Johnson AP, et al. Outcome of surgery for acromegaly – the experience of a dedicated pituitary surgeon. QJM. 1999 Dec;92(12):741-5. Toàn văn Tóm lược
58. Tabaee A, Anand VK, Barron Y, et al. Endoscopic pituitary surgery: a systematic review and meta-analysis. J Neurosurg. 2009 Sep;111(3):545-54. Tóm lược
59. Pereira AM, Biermasz NR. Treatment of nonfunctioning pituitary adenomas: what were the contributions of the last 10 years? A critical view. Ann Endocrinol (Paris). 2012 Apr;73(2):111-16. Tóm lược
60. DeKlotz TR, Chia SH, Lu W, et al. Meta-analysis of endoscopic versus sublabial pituitary surgery. Laryngoscope. 2012 Mar;122(3):511-18. Tóm lược
61. Dorward NL. Endocrine outcomes in endoscopic pituitary surgery: a literature review. Acta Neurochir (Wien). 2010 Aug;152(8):1275-9. Tóm lược
62. Molitch ME. Nonfunctioning pituitary tumors and pituitary incidentalomas. Endocrinol Metab Clin North Am. 2008 Mar;37(1):151-71. Tóm lược
63. Dekkers OM, Pereira AM, Roelfsema F, et al. Observation alone after transsphenoidal surgery for nonfunctioning pituitary macroadenoma. J Clin Endocrinol Metab. 2006 May;91(5):1796-1801. Tóm lược
64. Arita K, Tominaga A, Sugiyama K, et al. Natural course of incidentally found nonfunctioning pituitary adenoma, with special reference to pituitary apoplexy during follow-up examination. J Neurosurg. 2006 Jun;104(6):884-91. Tóm lược
65. Mortini P, Losa M, Barzaghi R, et al. Results of transsphenoidal surgery in a large series of patients with pituitary adenoma. Neurosurgery. 2005 Jun;56(6):1222-33. Tóm lược
66. Marazuela M, Astigarraga B, Vicente A, et al. Recovery of visual and endocrine function following transsphenoidal surgery of large nonfunctioning pituitary adenomas. J Endocrinol Invest. 1994 Oct;17(9):703-7. Tóm lược
67. Arafah BM. Reversible hypopituitarism in patients with large nonfunctioning pituitary adenomas. J Clin Endocrinol Metab. 1986 Jun;62(6):1173-9. Tóm lược
68. Losa M, Donofrio CA, Barzaghi R, et al. Presentation and surgical results of incidentally discovered non- functioning pituitary adenomas: evidence for a better outcome independently of other patients’ characteristics. Eur J Endocrinol. 2013 Oct 21;169(6):735-42. Tóm lược
69. Park P, Chandler WF, Barkan AL, et al. The role of radiation therapy after surgical resection of nonfunctional pituitary macroadenomas. Neurosurgery. 2004 Jul;55(1):100-06. Tóm lược
70. Tanaka Y, Hongo K, Tada T, et al. Growth pattern and rate in residual nonfunctioning pituitary adenomas: correlations among tumor volume doubling time, patient age, and MIB-1 index. J Neurosurg. 2003 Feb;98(2):359-65. Tóm lược
71. Brada M, Jankowska P. Radiotherapy for pituitary adenomas. Endocrinol Metab Clin North Am. 2008 Mar;37(1):263-75. Tóm lược
72. Loeffler JS, Shih HA. Radiation therapy in the management of pituitary adenomas. J Clin Endocrinol Metab. 2011 Jul;96(7):1992-2003. Tóm lược
73. Sheehan JP, Starke RM, Mathieu D, et al. Gamma Knife radiosurgery for the management of nonfunctioning pituitary adenomas: a multicenter study. J Neurosurg. 2013 Aug;119(2):446-56. Toàn văn Tóm lược
74. Chen Y, Li ZF, Zhang FX, et al. Gamma knife surgery for patients with volumetric classification of nonfunctioning pituitary adenomas: a systematic review and meta-analysis. Eur J Endocrinol. 2013 Sep 14;169(4):487-95. Toàn văn Tóm lược
75. Taussky P, Kalra R, Coppens J, et al. Endocrinological outcome after pituitary transposition (hypophysopexy) and adjuvant radiotherapy for tumors involving the cavernous sinus. J Neurosurg. 2011 Jul;115(1):55-62. Tóm lược
76. Zueger T, Kirchner P, Herren C, et al. Glucocorticoid replacement and mortality in patients with nonfunctioning pituitary adenoma. J Clin Endocrinol Metab. 2012 Oct;97(10):E1938-42. Tóm lược
77. Pivonello R, Matrone C, Filippella M, et al. Dopamine receptor expression and function in clinically nonfunctioning pituitary tumors: comparison with the effectiveness of cabergoline treatment. J Clin Endocrinol Metab. 2004 Apr;89(4):1674-83. Tóm lược
78. Bevan JS, Burke CW. Non-functioning pituitary adenomas do not regress during bromocriptine therapy but possess membrane-bound dopamine receptors which bind bromocriptine. Clin Endocrinol (Oxf). 1986 Nov;25(5):561-72. Tóm lược
79. Kwekkeboom DJ, Hofland LJ, van Koetsveld PM, et al. Bromocriptine increasingly suppresses the in vitro gonadotropin and alpha-subunit release from pituitary adenomas during long term culture. J Clin Endocrinol Metab. 1990 Sep;71(3):718-24. Tóm lược
80. Colao A, Di Somma C, Pivonello R, et al. Medical therapy for clinically non-functioning pituitary adenomas. Endocr Relat Cancer. 2008 Dec;15(4):905-15. Toàn văn Tóm lược
81. Lohmann T, Trantakis C, Biesold M, et al. Minor tumour shrinkage in nonfunctioning pituitary adenomas by long- term treatment with the dopamine agonist cabergoline. Pituitary. 2001 Aug;4(3):173-8. Tóm lược
82. Andersen M, Bjerre P, Schrøder HD, et al. In vivo secretory potential and the effect of combination therapy with octreotide and cabergoline in patients with clinically non-functioning pituitary adenomas. Clin Endocrinol (Oxf). 2001 Jan;54(1):23-30. Tóm lược
83. Greenman Y, Tordjman K, Osher E, et. al. Postoperative treatment of clinically nonfunctioning pituitary adenomas with dopamine agonists decreases tumour remnant growth. Clin Endocrinol (Oxf). 2005 Jul;63(1):39-44. Tóm lược
84. Garcia EC, Naves LA, Silva AO, et al. Short-term treatment with cabergoline can lead to tumor shrinkage in patients with nonfunctioning pituitary adenomas. Pituitary. 2013 Jun;16(2):189-94. Tóm lược
85. Schade R, Andersohn F, Suissa S, et al. Dopamine agonists and the risk of cardiac-valve regurgitation. N Engl J Med. 2007 Jan 4;356(1):29-38. Toàn văn Tóm lược
86. Zanettini R, Antonini A, Gatto G, et al. Valvular heart disease and the use of dopamine agonists for Parkinson’s disease. N Engl J Med. 2007 Jan 4;356(1):39-46. Toàn văn Tóm lược
87. Antonini A, Poewe W. Fibrotic heart-valve reactions to dopamine-agonist treatment in Parkinson’s disease. Lancet Neurol. 2007 Sep;6(9):826-9. Tóm lược
88. McCormack AI, Wass JA, Grossman AB. Aggressive pituitary tumours: the role of temozolomide and the assessment of MGMT status. Eur J Clin Invest. 2011 Oct;41(10):1133-48. Tóm lược
89. Robenshtok E, Benbassat CA, Hirsch D, et al. Clinical course and outcome of non-functioning pituitary adenomas in the elderly compared with younger age groups. Endocr Pract. 2014 Feb;20(2):159-64. Tóm lược
90. Caputo C, Sutherland T, Farish S, et al. Gender differences in presentation and outcome of nonfunctioning pituitary macroadenomas. Clin Endocrinol (Oxf). 2013 Apr;78(4):564-70. Tóm lược
91. Joustra SD, Claessen KM, Dekkers OM, et al. High prevalence of metabolic syndrome features in patients previously treated for nonfunctioning pituitary macroadenoma. PLoS One. 2014 Mar 7;9(3):e90602. Toàn văn Tóm lược
92. Johnson MD, Woodburn CJ, Vance ML. Quality of life in patients with a pituitary adenoma. Pituitary. 2003 Sep;6(2):81-7. Tóm lược
93. Dekkers OM, van der Klaauw AA, Pereira AM, et al. Quality of life is decreased after treatment for nonfunctioning pituitary macroadenoma. J Clin Endocrinol Metab. 2006 Sep;91(9):3364-9. Tóm lược
94. Soto-Ares G, Cortet-Rudelli C, Assaker R, et al. MRI protocol technique in the optimal therapeutic strategy of non- functioning pituitary adenomas. Eur J Endocrinol. 2002 Feb;146(2):179-86. Tóm lược
95. Capatina C, Christodoulides C, Fernandez A, et al. Current treatment protocols can offer a normal or near-normal quality of life in the majority of patients with non-functioning pituitary adenomas. Clin Endocrinol (Oxf). 2013 Jan;78(1):86-93. Tóm lược
96. Laws ER Jr, Thapar K. Pituitary surgery. Endocrinol Metab Clin North Am. 1999 Mar;28(1):119-31. Tóm lược
97. Jackson IM, Noren G. Role of gamma knife therapy in the management of pituitary tumors. Endocrinol Metab Clin North Am. 1999 Mar;28(1):133-42. Tóm lược
98. Chen Y, Wang CD, Su ZP, et al. Natural history of postoperative nonfunctioning pituitary adenomas: a systematic review and meta-analysis. Neuroendocrinology. 2012;96(4):333-42. Tóm lược
99. Freda PU, Beckers AM, Katznelson L, et al. Pituitary incidentaloma: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011;96:894-904. Tóm lược
100. Šteňo A, Bocko J, Rychlý B, et al. Nonfunctioning pituitary adenomas: association of Ki-67 and HMGA-1 labeling indices with residual tumor growth. Acta Neurochir (Wien). 2014 Mar;156(3):451-61. Tóm lược
101. Daly AF, Jaffrain-Rea ML, Ciccarelli A, et al. Clinical characterization of familial isolated pituitary adenomas. J Clin Endocrinol Metab. 2006 Sep;91(9):3316-23. Tóm lược
102. Beckers A, Daly AF. The clinical, pathological, and genetic features of familial isolated pituitary adenomas. Eur J Endocrinol. 2007 Oct;157(4):371-82. Toàn văn Tóm lược
103. Katznelson L, Alexander JM, Klibanski A. Clinical review 45: Clinically nonfunctioning pituitary adenomas. J Clin Endocrinol Metab. 1993 May;76(5):1089-94. Tóm lược
104. Shomali ME, Katznelson L. Medical therapy of gonadotropin-producing and nonfunctioning pituitary adenomas. Pituitary. 2002;5(2):89-98. Tóm lược
105. Young WF Jr, Scheithauer BW, Kovacs KT, et al. Gonadotroph adenoma of the pituitary gland: a clinicopathologic analysis of 100 cases. Mayo Clin Proc. 1996 Jul;71(7):649-56. Tóm lược
106. Randeva HS, Schoebel J, Byrne J, et al. Classical pituitary apoplexy: clinical features, management and outcome. Clin Endocrinol (Oxf). 1999 Aug;51(2):181-8. Tóm lược
107. Nielsen EH, Lindholm J, Bjerre P, et al. Frequent occurrence of pituitary apoplexy in patients with non-functioning pituitary adenoma. Clin Endocrinol (Oxf). 2006 Mar;64(3):319-22. Tóm lược
. Fernández-Balsells MM, Murad MH, Barwise A, et al. Natural history of nonfunctioning pituitary adenomas and incidentalomas: a systematic review and metaanalysis. J Clin Endocrinol Metab. 2011 Apr;96(4):905-12. Tóm lược
108. Biller BM, Samuels MH, Zagar A, et al. Sensitivity and specificity of six tests for the diagnosis of adult GH deficiency. J Clin Endocrinol Metab. 2002 May;87(5):2067-79. Tóm lược
109. Yuen KC, Biller BM, Molitch ME, et al. Clinical review: Is lack of recombinant growth hormone (GH)-releasing hormone in the United States a setback or time to consider glucagon testing for adult GH deficiency? J Clin Endocrinol Metab. 2009 Aug;94(8):2702-7. Tóm lược
110. Gordon DL, Emanuele MA. Hot flashes in patients with hypogonadism and low serum gonadotropin levels. Endocr Pract. 2003 Mar-Apr;9(2):119-23. Tóm lược
111. Bleicken B, Hahner S, Ventz M, et al. Delayed diagnosis of adrenal insufficiency is common: a cross-sectional study in 216 patients. Am J Med Sci. 2010 Jun;339(6):525-31. Tóm lược
112. Pineyro MM, Makdissi A, Faiman C, et al. Poor correlation of serum alpha-subunit concentration and magnetic resonance imaging following pituitary surgery in patients with nonfunctional pituitary macroadenomas. Endocr Pract. 2008 May-Jun;14(4):452-7. Tóm lược
113. Fleseriu M, Lee M, Pineyro MM, et al. Giant invasive pituitary prolactinoma with falsely low serum prolactin: the significance of ‘hook effect’. J Neurooncol. 2006 Aug;79(1):41-3. Tóm lược
114. Gopan T, Toms SA, Prayson RA, et al. Symptomatic pituitary metastases from renal cell carcinoma. Pituitary. 2007;10(3):251-9. Tóm lược
115. Brandi ML, Gagel RF, Angeli A, et al. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab. 2001 Dec;86(12):5658-71. Tóm lược
116. Dekkers OM, Pereira AM, Romijn JA, et al. Treatment and follow-up of clinically nonfunctioning pituitary macroadenomas. J Clin Endocrinol Metab. 2008 Oct;93(10):3717-26. Tóm lược
117. Billestrup N, Swanson LW, Vale W. Growth hormone-releasing factor stimulates proliferation of somatotrophs in vitro. Proc Natl Acad Sci USA. 1986 Sep;83(18):6854-7. Toàn văn Tóm lược
118. Herman V, Fagin J, Gonsky R, et al. Clonal origin of pituitary adenomas. J Clin Endocrinol Metab. 1990 Dec;71(6):1427-33. Tóm lược
119. Alexander JM, Biller BM, Bikkal H, et al. Clinically nonfunctioning pituitary tumors are monoclonal in origin. J Clin Invest. 1990 Jul;86(1):336-40. Toàn văn Tóm lược
120. Shimon I, Melmed S. Genetic basis of endocrine disease: pituitary tumor pathogenesis. J Clin Endocrinol Metab. 1997 Jun;82(6):1675-81. Toàn văn Tóm lược
121. Melmed S. Pathogenesis of pituitary tumors. Endocrinol Metab Clin North Am. 1999 Mar;28(1):1-12. Tóm lược
122. Simpson DJ, Bicknell JE, McNicol AM, et al. Hypermethylation of the p16/CDKN2A/MTSI gene and loss of protein expression is associated with nonfunctional pituitary adenomas but not somatotrophinomas. Genes Chromosomes Cancer. 1999 Apr;24(4):328-36. Tóm lược
123. Ruebel KH, Jin L, Zhang S, et al. Inactivation of the p16 gene in human pituitary nonfunctioning tumors by hypermethylation is more common in null cell adenomas. Endocr Pathol. 2001 Fall;12(3):281-9. Tóm lược
124. Occhi G, Albiger N, Berlucchi S, et al. Peroxisome proliferator-activated receptor gamma in the human pituitary gland: expression and splicing pattern in adenomas versus normal pituitary. J Neuroendocrinol. 2007 Jul;19(7):552-9. Tóm lược
125. Emery MN, Leontiou C, Bonner SE, et al. PPAR-gamma expression in pituitary tumours and the functional activity of the glitazones: evidence that any anti-proliferative effect of the glitazones is independent of the PPAR-gamma receptor. Clin Endocrinol (Oxf). 2006 Sep;65(3):389-95. Tóm lược
126. Heaney AP, Fernando M, Melmed S. PPAR-gamma receptor ligands: novel therapy for pituitary adenomas. J Clin Invest. 2003 May;111(9):1381-8. Toàn văn Tóm lược
127. European Medicines Agency. Questions and answers on the suspension of rosiglitazone-containing medicines (Avandia, Avandamet and Avaglim). Sep 2010 [internet publication]. Toàn văn
128. Zhang X, Horwitz GA, Heaney AP, et al. Pituitary tumor transforming gene (PTTG) expression in pituitary adenomas. J Clin Endocrinol Metab. 1999 Feb;84(2):761-7. Tóm lược
129. McCabe CJ, Khaira JS, Boelaert K, et al. Expression of pituitary tumour transforming gene (PTTG) and fibroblast growth factor-2 (FGF-2) in human pituitary adenomas: relationships to clinical tumour behaviour. Clin Endocrinol (Oxf). 2003 Feb;58(2):141-50. Tóm lược
130. Levy A. Molecular and trophic mechanisms of tumorigenesis. Endocrinol Metab Clin N Am. 2008 Mar;37(1):23-50. Tóm lược
131. Chanson P, Salenave S. Diagnosis and treatment of pituitary adenomas. Minerva Endocrinol. 2004 Dec;29(4):241-75. Tóm lược
132. Verrees M, Arafah BM, Selman WR. Pituitary tumor apoplexy: characteristics, treatment, and outcomes. Neurosurg Focus. 2004 Apr 15;16(4):E6. Tóm lược
133. Sibal L, Ball SG, Connolly V, et al. Pituitary apoplexy: a review of clinical presentation, management and outcome in 45 cases. Pituitary. 2004;7(3):157-63. Tóm lược
134. Heseltine D, White MC, Kendall-Taylor P, et al. Testicular enlargement and elevated serum inhibin concentrations occur in patients with pituitary macroadenomas secreting follicle stimulating hormone. Clin Endocrinol (Oxf). 1989 Oct;31(4):411-23. Tóm lược
135. Cooper O, Geller JL, Melmed S. Ovarian hyperstimulation syndrome caused by an FSH-secreting pituitary adenoma. Nat Clin Pract Endocrinol Metab. 2008 Apr;4(4):234-8. Tóm lược
136. Djerassi A, Coutifaris C, West VA, et al. Gonadotroph adenoma in a premenopausal woman secreting follicle- stimulating hormone and causing ovarian hyperstimulation. J Clin Endocrinol Metab. 1995 Feb;80(2):591-4. Tóm lược
137. Snyder PJ, Sterling FH. Hypersecretion of LH and FSH by a pituitary adenoma. J Clin Endocrinol Metab. 1976 Mar;42(3):544-50. Tóm lược
138. Davis JR, Farrell WE, Clayton RN. Pituitary tumours. Reproduction. 2001 Mar;121(3):363-71. Toàn văn Tóm lược
139. Daly AF, Rixhon M, Adam C, et al. High prevalence of pituitary adenomas: a cross-sectional study in the province of Liege, Belgium. J Clin Endocrinol Metab. 2006 Dec;91(12):4769-75. Tóm lược
140. Monson JP. The epidemiology of endocrine tumours. Endocr Relat Cancer. 2000 Mar;7(1):29-36. Tóm lược

 Thông tin cơ bản
Thông tin cơ bản Cách tiếp cận chẩn đoán từng bước
Cách tiếp cận chẩn đoán từng bước