Bệnh hô hấp
Nguyên tắc sử dụng kháng sinh trong điều trị viêm phổi bệnh viện
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Nguyên tắc sử dụng kháng sinh trong điều trị viêm phổi bệnh viện – Tải file PDF Tại đây.
Tác giả: TS.BS. NGUYỀN VĂN THÀNH
NHẬN THỨC CHUNG SỬ DỤNG KHÁNG SINH TRONG NHIỄM TRÙNG PHỔI
Phổi là cơ quan mở và liên tục trao đổi khí với môi trường bên ngoài nên vi sinh vật có thể dễ dàng xâm nhập và gây bệnh. Không có gì là ngạc nhiên khi nhiễm trùng đường hô hấp là lý do phổ biến nhất đối với việc kê đơn kháng sinh trong các bệnh lý nhiễm trùng. Bất chấp những tiến bộ về vệ sinh và sự sẵn có của thuốc kháng sinh, bệnh lao và viêm phổi vẫn là các bệnh lý đứng hàng đầu trong mô hình bệnh tật và tử vong. Chính vì vậy kỹ năng thực hành trong trị liệu kháng sinh là rất quan trọng đối với tất cả các thầy thuốc.
Trong viêm phổi, các dữ liệu nghiên cứu về điều trị kháng sinh, vì nhiều lý do, thường rất đa dạng, thiếu đồng nhất, thiếu và ít có giá trị bằng chứng cao. Trong trường hợp thiếu bằng chứng chắc chắn, nhiều tài liệu hướng dẫn về cách sử dụng kháng sinh không giống nhau trên toàn thế giới. Một bệnh nhân bị viêm phổi cộng đồng nặng ở Scandinavia có thể dùng penicillin tiêm tĩnh mạch, trong khi một bệnh nhân có cùng đặc điểm có thể dùng piperacillin-tazobactam cộng với macrolide hoặc vancomycin ở Hoa Kỳ [1]. Tính khác biệt này có thể hiểu lý do là dựa trên sự khác biệt của vi khuẩn gây bệnh phổ biến và mô hình kháng thuốc kháng sinh ở từng quốc gia, ở từng khu vực. Tuy nhiên cũng có lý do rất cơ bản là xử trí kháng sinh phụ thuộc rất nhiều vào kỹ năng thực hành của thầy thuốc, chính sách quản lý thuốc kháng sinh của từng hệ thống y tế, từng quốc gia.
Sự khác biệt về vi sinh gây bệnh phổ biến của hai thực thể lâm sàng viêm phổi cộng đồng (CAP) và viêm phổi bệnh viện (HAP) đòi hỏi các chiến lược điều trị khác nhau. Mặc dù đã có những tiến bộ gần đây trong các kỹ thuật chẩn đoán vi sinh để phát hiện các tác nhân vi sinh gây bệnh nhưng việc xác định được chính xác vi khuẩn gây bệnh vẫn còn là một thách thức. Vì lý do này, việc lựa chọn phác đồ kháng sinh điều trị viêm phổi trong thực hành thông thường là điều trị kinh nghiệm (empirical treatment), tức là chỉ định kháng sinh điều trị không dựa trên kết quả định danh vi sinh gây bệnh cùng với tính nhậy cảm kháng sinh mà dựa trên sự phân tích nguy cơ nhiễm khuẩn nhiều khả năng nhất trên người bệnh, tình trạng miễn dịch và khả năng kháng thuốc của vi khuẩn gây bệnh. Như vậy có thể nói điều trị kháng sinh kinh nghiệm là quyết định dựa trên sự đánh giá tỷ mỉ các thông tin lâm sàng đang có trên người bệnh kết hợp cùng với số liệu điều tra dịch tễ của từng cơ sở y tế, từng địa phương, từng khu vực và quốc gia. Có tới 30% CAP là do s. pneumoniae gây ra, đây là nguyên nhân thường gặp nhất ở tất cả các nhóm tuổi, tiếp theo là H. influenzae và vi khuẩn không điển hình (như Mycoplasma, Chlamydia và Legionella spp.) [2,3]. Điều này hiển nhiên xác định phác đồ kháng sinh kinh nghiệm hợp lý cần hướng tới các tác nhân vi sinh gây bệnh kể trên. Vi khuẩn Gram âm cũng nên được coi là nguyên nhân tiềm năng gây viêm phổi nặng, đặc biệt ở những bệnh nhân nhập viện ICU [4]. Ở ICU, viêm phổi là bệnh nhiễm trùng phổ biến nhất và thường xảy ra dưới dạng viêm phổi kết hợp thở máy (VAP) [5]. Mặc dù việc lựa chọn kịp thời một phác đồ điều trị kháng sinh thích hợp là hết sức quan trọng nhưng trong đa số các trường hợp, chỉ định kháng sinh vẫn cơ bản là kinh nghiệm, kể cả trong HAP và VAP [6]. Tình trạng đa kháng thuốc của vi khuẩn gây bệnh gia tăng hiện nay đang là thách thức lớn đối với việc lựa chọn kháng sinh điều trị [7]. Các kháng sinh thuộc nhóm beta-lactam, macrolide, fluoroquinolone và tetracycline được sử dụng nhiều nhất trong điều trị viêm phổi.
Nguyên lý cơ bản trong lựa chọn kháng sinh để điều trị là dựa trên phổ tác dụng của kháng sinh và tính nhậy cảm của kháng sinh. Hay nói một cách khác là kháng sinh đó có tác dụng với vi khuẩn gây bệnh hay không (phổ tác dụng) và kháng sinh đó còn hiệu quả với vi khuẩn gây bệnh hay không (tính nhậy cảm). Cũng rất cần lưu ý rằng các đánh giá tính nhậy cảm bằng xác định tính kháng khuẩn của kháng sinh trên môi trường nuôi cấy (in vitro) và đo nồng độ kháng sinh trong máu không phải lúc nào cũng phản ánh chính xác tình trạng nhậy cảm kháng sinh tại phổi và vùng tổn thương (in vivo). Hiệu quả của kháng sinh cao hay thấp tùy thuộc vào khả năng thuốc xâm nhập được vào mô bệnh. Hiệu quả của kháng sinh chỉ có khi nồng độ thuốc trong huyết thanh/mô bệnh cao hơn nồng độ ức chế tối thiểu (MIC). Khả năng thâm nhập của kháng sinh vào mô bệnh phụ thuộc nhiều vào đặc tính của kháng sinh như độ hòa tan trong mỡ, kích thước phân tử, khả năng cấp máu cho vùng bệnh và sự hiện diện của tổn thương viêm. Kháng sinh xâm nhập mô hiếm khi gặp vấn đề trong nhiễm trùng cấp tính do trong tình trạng viêm cấp tính có tăng tính thấm mao mạch. Nhưng ngược lại, trong nhiễm trùng mạn tính, trong nhiễm trùng bởi vi khuẩn nội bào, khả năng thâm nhập vào mô bệnh và tương tác với vi khuẩn gây bệnh đòi hỏi kháng sinh phải hòa tan tốt trong mỡ, có kích thước phân tử nhỏ và có khả năng vào trong tế bào. Như vậy các tổn thương ở giai đoạn xơ hóa, giảm tưới máu, hóa mủ sẽ làm cho kháng sinh khó thâm nhập. Trong trường hợp này, tác động cơ học giải phóng mủ và tổn thương xơ hóa là điều trị phối hợp cần thiết. Cũng cần lưu ý rằng hiệu quả của kháng sinh chỉ có thể đạt được tối đa khi các dị vật trên cơ thể bị nhiễm trùng như ống dẫn lưu, catheter, vật liệu ghép… đã được loại bỏ.
Đặc điểm dịch tễ vi sinh gây bệnh trong viêm phổi cộng đồng cơ bản không khác nhau giữa các địa phương và giữa các khu vực trên phạm vi toàn cầu [8-10]. Sự khác nhau giữa các kết quả nghiên cứu dịch tễ là do không đồng nhất về đối tượng nghiên cứu (bệnh nhân) và phương pháp chẩn đoán vi sinh. Tác động của kinh tế, xã hội thông qua tỷ lệ suy dinh dưỡng, nhiễm HIV, tiêm chủng có thể làm thay đổi tình hình dịch tễ cơ bản. Tuy nhiên, s. pneumoniae, H. influenzae và vi khuẩn không điển hình vẫn là các tác nhân gây bệnh phổ biến nhất trong viêm phổi cộng đồng [8] và lẽ dĩ nhiên là cần bao vây các tác nhân này trong phác đồ điều trị kháng sinh kinh nghiệm trong đa số các trường hợp.
Trên bệnh nhân CAP nhập viện, thời điểm sử dụng kháng sinh cần trước 4 giờ sau khi có chẩn đoán là khuyến cáo chung của nhiều tài liệu hướng dẫn. Tuy nhiên tác động của việc chậm chỉ định kháng sinh đối với hiệu quả điều trị vẫn còn nhiều tranh luận [13]. Một phân tích tổng quan hệ thống từ năm 2016 [14] kết luận rằng kháng sinh cần được chỉ định trong khoảng thời gian từ 4-8 tiếng sau nhập viện. Tuy nhiên chất lượng của các bằng chứng trong kết luận này thấp vì hầu hết dựa trên các nghiên cứu mô tả và hồi cứu. Cũng có những nghiên cứu không cho thấy việc chậm trễ chỉ định kháng sinh làm tăng tỷ lệ tử vong [13-16]. Trên 1.593 bệnh nhân gồm cả CAP và HCAP, A. Simonetti và cs năm 2012 [15] không cho thấy tác động của trì hoãn kháng sinh sau 4 giờ, 8 giờ trên tỷ lệ tử vong 30 ngày. Tương tự, trong một nghiên cứu được thực hiện gần đây [17], Markus Fally và cs ghi nhận trên 2.264 bệnh nhân CAP nhập viện không thấy tác động của việc chỉ định kháng sinh sau 4 giờ tác động trên kết cục điều trị (bình ổn lâm sàng và tử vong 30 ngày). Các tác giả cho rằng không nhất thiết phải áp dụng nghiêm ngặt quy tắc 4 giờ mà thay vào đó cần cân nhắc quyết định điều trị kháng sinh sớm tùy theo tuổi bệnh nhân, các bệnh đồng mắc và tình trạng nặng.
Trong viêm phổi, nguồn gốc nhiễm khuẩn tại cộng đồng (CAP) hay tại bệnh viện (HAP), cần được phân tích khi quyết định điều trị kháng sinh thích hợp. Trong thực tế, việc xác định CAP hay HAP đôi khi cũng không đơn giản, nhất là khi các chăm sóc y tế can thiệp và sử dụng kháng sinh đã được áp dụng rộng rãi ở môi trường ngoài bệnh viện cũng như khi bệnh nhân viêm phổi đã được điều trị qua nhiều bệnh viện, trong một khoảng thời gian dài. Bệnh nhân có sử dụng các dịch vụ chăm sóc y tế kéo dài (healthcare-associated pneumonia, HCAP) là một quần thể không đồng nhất về nguy cơ và không nhất thiết là giống nhau về đặc điểm vi sinh gây bệnh [18]. Như vậy có thể nói do thiếu tiêu chuẩn vàng, việc phân định CAP hay HAP trong nhiều trường hợp là không dễ dàng. Các thang điểm nguy cơ nhiễm khuẩn không phổ biến và kháng thuốc có hay không kết hợp với các biomarker cũng không phải là các chỉ dẫn đủ tin cậy để quyết định phác đồ kháng sinh kinh nghiệm mà chỉ nên xem đây là các tiêu chuẩn cảnh báo để nhanh chóng có quyết định chẩn đoán vi sinh và kháng sinh đồ trong những trường hợp này [19,20]. Giải pháp hứa hẹn trong tương lai gần là các xét nghiệm vi sinh bằng kỹ thuật sinh học phân tử giúp xác định nhanh tác nhân gây bệnh và tính nhậy cảm kháng sinh [21,22]. Tuy nhiên, để các xét nghiệm này trở thành hiện thực trong thực hành thường quy sẽ còn cần một thời gian để xác định xem test nào được chọn, đối tượng nào cần thực hiện và định hướng vi sinh gây bệnh phổ biến nào. Qua các đại dịch viêm phổi do vi-rút đã cho thấy yêu cầu xác định được tác nhân vi sinh gây bệnh để quyết định điều trị kháng sinh là rất bức thiết. Ở thời điểm hiện tại, khả năng phân tích lâm sàng của các thầy thuốc vẫn là yếu tố quyết định. Các xét nghiệm biomarker cũng có thể giúp ích song không có biomarker nào có độ nhậy và độ đặc hiệu có độ tin cậy cao.
Một số nghiên cứu RCT đã sử dụng xét nghiệm PCT nhắc lại để xác định thời gian điều trị bằng kháng sinh, cho thấy thời gian điều trị giảm. Tuy nhiên, những người tham gia nhóm kiểm soát được điều trị theo hướng dẫn bằng PCT trong các nghiên cứu này có thời gian điều trị kháng sinh kéo dài hơn 7 ngày [23-26] và vượt quá các khuyến cáo từ các tài liệu hướng dẫn.
Các hướng dẫn quốc tế hiện hành khuyến cáo bắt đầu điều trị kháng sinh dựa trên nghi ngờ lâm sàng đối với CAP được xác nhận bằng X-quang chứ không dựa trên nồng độ PCT [27]. Điều thú vị là các nghiên cứu đã báo cáo có mối tương quan giữa tăng nồng độ CRP và PCT với tăng nguy cơ biến chứng, nhập viện ICU, và tử vong ngắn hạn [28-31]. Điều này cho phép có một ngoại suy rằng CRP, PCT cần được nhìn nhận như là các marker cho tình trạng bệnh nặng. Một phân tích tổng hợp lớn của 26 nghiên cứu về thời gian điều trị kháng sinh trong nhiễm trùng đường hô hấp (CAP, HAP, VAP, đợt cấp của COPD và viêm phế quản) [32] cho thấy thời gian điều trị theo hướng dẫn của PCT có liên quan đến giảm 2,4 ngày điều trị (5,7 so với 8,1 ngày, p<0,001). Hơn nữa, tỷ lệ tử vong thấp hơn được quan sát thấy ở nhóm được điều trị bằng kháng sinh theo hướng dẫn của PCT (OR 0,83, CI 95% 0,70 đến 0,99, p=0,037). Những lợi ích này áp dụng cả cho bệnh nhân mắc CAP và VAP ở ICU. Khuyến cáo của Châu Âu đối với HAP/VAP [33] là sử dụng xét nghiệm PCT lặp lại kết hợp với đánh giá lâm sàng để rút ngắn thời gian điều trị kháng sinh trong các trường hợp viêm phổi cần một đợt điều trị kéo dài.
ĐIỀU TRỊ VIÊM PHỔI BỆNH VIỆN VÀ VIÊM Phổi thở máy
Chiến lược tiếp cận
Trong khoảng một thập kỷ vừa qua, các nghiên cứu từ Hoa Kỳ và Châu Âu đã báo cáo có sự gia tăng tỷ lệ vi khuẩn gây bệnh MDR trong VAP [193-195]. Vi khuẩn Gram âm MDR thường gặp nhất là P. aeruginosa, Acinetobacter spp và Enterobacteriaceae ESBL (+). MRSA là vi khuẩn gây bệnh MDR Gram dương thường gặp nhất. Các nhóm tác nhân này có liên quan đến kết cục lâm sàng kém, đặc biệt khi điều trị kháng sinh ban đầu không phù hợp hoặc bị trì hoãn [147,196,197]. Các hướng dẫn hiện tại năm 2016 của ATS/IDSA [198] và ERS/ESICM/ ESCMID/ALAT (Hiệp hội Hô hấp Châu Âu, Hiệp hội Y học Chăm sóc Tích cực Châu Âu, Hiệp hội Vi sinh lâm sàng và Bệnh truyền nhiễm Châu Âu và Hiệp hội Lồng ngực Mỹ La-tinh) năm 2017 [33] nhấn mạnh tầm quan trọng của việc thực hiện các phương pháp điều trị kinh nghiệm đầy đủ và nhanh chóng xác định và điều trị dựa trên nguy cơ nhiễm khuẩn MDR và dựa trên dữ liệu kháng kháng sinh và vi sinh tại địa phương (bảng 5.8). Hướng dẫn của IDSA/ATS [198] xác định năm yếu tố nguy cơ liên quan đến vi khuẩn MDR, gồm: i) Điều trị kháng sinh tiêm tĩnh mạch trước đó trong vòng 90 ngày; ii) Nhập viện >5 ngày trước khi xảy ra VAP; iii) Sốc nhiễm trùng tại thời điểm VAP; iv) ARDS trước VAP; và v) Nhu cầu điều trị thay thế thận trước khi khởi phát VAP. Thật thú vị, một nghiên cứu đoàn hệ tiến cứu [199] cũng đã phát hiện ra rằng khi sử dụng các yếu tố nguy cơ trên để phát hiện đối với vi khuẩn MDR, độ nhạy cao nhưng độ đặc hiệu lại rất thấp và hiệu quả tổng thể kém. Điều này có thể dẫn đến việc điều trị kháng sinh kinh nghiệm phổ rộng quá mức. Trong số năm yếu tố nguy cơ, chỉ có việc sử dụng kháng sinh trong 90 ngày qua (giá trị tiên đoán âm là 79%) và nhập viện >5 ngày (giá trị tiên đoán âm là 80%) trước khi bị viêm phổi có liên quan chặt chẽ với sự hiện diện của vi khuẩn đa kháng thuốc. Sự hiện diện của ARDS trước VAP có giá trị tiên đoán âm là 71% đối với nhiễm khuẩn MDR. Các hướng dẫn của Châu Âu [33] không đưa các yếu tố điều trị thay thế thận hoặc ARDS trong định nghĩa về bệnh nhân có nguy cơ cao nhiễm khuẩn MDR. Vì lý do này, ngoài các yếu tố nguy cơ của từng bệnh nhân, các hướng dẫn của Châu Âu đưa vào yếu tố nguy cơ có từ các cơ sở bệnh viện có tỷ lệ vi khuẩn MDR cao (>25% tất cả vi khuẩn ở ICU là MDR), mô hình kháng thuốc tại địa phương và có quần cư trước đó của vi khuẩn MDR như là các yếu tố quyết định nguy cơ đối với các tác nhân gây bệnh MDR. Thật không may, hai yếu tố kể trên hầu như không thể có ở Việt Nam vì chúng ta rất ít nghiên cứu đánh giá thường xuyên tình hình kháng thuốc của cơ sở điều trị và lưu thông tin xét nghiệm trên người bệnh trong quá trình theo dõi và điều trị tại các cơ sở điều trị. Do vậy, hợp lý nhất là cần xem là có yếu tố nguy cơ cao khi HAP, VAP được chẩn đoán ở ICU, xuất hiện viêm phổi sau 5 ngày nhập viện và tiền sử có điều trị kháng sinh trước đó 90 ngày. Đây là những vấn đề cần được ưu tiên nghiên cứu ở Việt Nam trong tương lai.
Bảng 5.8. Các yếu tố nguy cơ cao HAP/VAP do vi khuẩn MDR (Nguồn trích dẫn: Catia Cillóniz et al. Management of pneumonia in critically ill patients. BMJ 2021;375:e065871)
| Tài liệu hướng dẫn Hoa Kỳ (2016) | Tài liệu hướng dẫn Châu Âu (2017) |
| Đã điều trị kháng sinh trước đó 90 ngày | Đã điều trị kháng sinh trước đó |
| Nhập viện >5 ngày | Nhập viện >5 ngày |
| Sốc nhiễm trùng | Sốc nhiễm trùng |
| ARDS trước VAP | Điều trị ở cơ sở y tế có tỷ lệ MDR >25% |
| Lọc máu cấp cứu trước VAP | Đã từng phân lập được vi khuẩn quần cư MDR |
| Nguy cơ tử vong >15% |
Hầu hết các dữ liệu liên quan đến căn nguyên của viêm phổi bệnh viện đặc biệt đề cập đến dân số VAP [200]. Trong nội dung VAP/HAP, đã nhiều tài liệu hướng dẫn đưa ra khái niệm HAP sau >5 ngày nhập viện (HAP xuất hiện muộn). Ranh giới >5 ngày xuất hiện HAP được nhiều tác giả nhấn mạnh như là nguy cơ HAP nhiễm khuẩn bệnh viện. Trong một hội thảo chuyên gia với nội dung xác định HAP và nguy cơ nhiễm khuẩn bệnh viện năm 2008, các tác giả đã cho rằng nếu không có yếu tố nguy cơ nhiễm MDR, HAP nên được điều trị như CAP [201]. Các hướng dẫn thực hành gần đây đều đã loại bỏ khái niệm sớm hay muộn, tức là trước hay sau 96 giờ nhập viện hoặc đặt nội khí quản. Sự phân chia này dựa trên thực tế là trong những ngày đầu nhập viện, cầu khuẩn Gram dương vẫn chiếm ưu thế trên hệ vi khuẩn đường hô hấp. Sau 5-7 ngày bị bệnh, fibronectin vùng hầu họng biến mất và một số thụ thể cho phép vi khuẩn Gram âm xâm lấn được bộc lộ. Áp lực kháng sinh chọn lọc các chủng đa kháng và sự xâm nhập của P. aeruginosa [133]. Các nghiên cứu gần đây đã đặt câu hỏi về mối quan hệ giữa thời điểm viêm phổi bệnh viện và nguy cơ vi khuẩn gây bệnh đa kháng thuốc (MDR). Tuy nhiên, hầu hết các nghiên cứu này đều tập trung vào VAP [202,203]
Một bài viết tổng quan quan trọng của Jones và cs trong nghiên cứu SENTRY (Antimicrobial Surveillance Program 1997- 2008) [204] với mục tiêu xác định vi khuẩn gây bệnh phổ biến trong HAP/VAP, các tác giả đã cho thấy 6 loại vi khuẩn phổ biến nhất trong bệnh cảnh này là s. aureus, P. aeruginosa, Klebsiella spp, Escherichia coli, Acinetobacter spp, và Enterobacter spp. Từ năm 2008, IDSA bắt đầu sử dụng thuật ngữ ESKAPE để chỉ nhóm vi khuẩn phổ biến trong nhiễm khuẩn bệnh viện, gồm cả Gram (+) và Gram (-) MDR kể trên. Cơ chế kháng thuốc của nhóm vi khuẩn này đa dạng gồm cả tạo men để bất hoạt thuốc, thay đổi vị trí liên kết thuốc, giảm khả năng tập trung thuốc nội bào bằng giảm kênh porin trên màng ngoài tế bào cùng với tăng hiệu ứng bơm đẩy thuốc ra bên ngoài và tăng tạo màng sinh học bảo vệ. Cơ chế tạo màng sinh học được nhấn mạnh đối với các vi khuẩn S. aureus, P. aeruginosa, A. baumannii và K. pneumoniae [205]. Trong một nghiên cứu, phân tích trên bệnh nhân HAP và VAP, các yếu tố nguy cơ ESKAPE gồm: sử dụng kháng sinh trước đó, nhập viện ICU và thở máy xâm lấn, COPD, dãn phế quản, nhập viện >7 ngày, sử dụng thuốc ức chế a- xít và có nội soi phế quản [206]. Đã có nghiên cứu ghi nhận rằng trong VAP tiền sử phơi nhiễm càng nhiều loại kháng sinh thì càng có nguy cơ cao MDR [207]. Đối với HAP không thở máy, có nghiên cứu xác định điều trị kháng sinh tĩnh mạch phổ rộng trong 10 ngày trước chẩn đoán HAP là nguy cơ độc lập đối với nhiễm vi khuẩn kháng thuốc (OR 3,45; 95% CI 1,56-7,61; p=0,002) [208].
Trong VAP, quyết định điều trị kháng sinh chậm và không thích hợp sẽ làm tăng tử vong [209]. Tuy nhiên nhận định này dựa trên nghiên cứu bệnh nhân ở ICU mà chưa thể ngoại suy cho các trường hợp không ở ICU [210]. Chiến lược phân loại theo nguy cơ, điều trị kinh nghiệm bằng kháng sinh phổ rộng và xuống thang dựa trên xét nghiệm vi trùng học là giải pháp hạn chế việc chỉ định kháng sinh phổ rộng quá mức [211–212]. Liệu pháp xuống thang dựa trên kết quả vi trùng học có thể giúp giảm kháng sinh theo hướng sử dụng phổ hẹp nhất có thể và ngưng kháng sinh. Singh và cs (năm 2000) [212] cho thấy những bệnh nhân có điểm CPIS thấp (từ 1-3 điểm) có thể ngưng kháng sinh sau 3 ngày điều trị. Áp dụng phương pháp này cũng có thể rút ngắn ngày điều trị kháng sinh cho những trường hợp có chẩn đoán xác định rõ ràng.
Vì nhiều lý do lo ngại không phải là vô lý, VAP thường được bắt đầu điều trị bằng phối hợp kháng sinh. Aarts MA và cs năm 2008 đã thực hiện một phân tích gộp các nghiên cứu RCT đánh giá chế độ kháng sinh đường tiêm theo kinh nghiệm cho bệnh nhân VAP người lớn, so sánh liệu pháp đơn trị liệu so với liệu pháp phối hợp đã không cho thấy có sự khác biệt về tỷ lệ tử vong giữa bất kỳ phác đồ nào được so sánh [214]. Có bất kỳ lý do hợp lý nào để sử dụng liệu pháp kháng sinh kết hợp ở những bệnh nhân bị bệnh nặng nghi ngờ nhiễm trùng Gram âm không?. Từ các dữ liệu nghiên cứu, không có lợi ích được ghi nhận khi chỉ định liệu pháp phối hợp, ngoại trừ nhiễm trùng P. aeruginosa. Vì một liệu pháp điều trị theo kinh nghiệm thích hợp đối với nhiễm trùng P. aeruginosa là rất quan trọng trong việc giảm tỷ lệ tử vong [215], do đó, tất cả các nỗ lực nên được thực hiện để đưa ra các lựa chọn tốt nhất cho những bệnh nhân này. Một trong những điểm chính ủng hộ liệu pháp kháng sinh kết hợp theo kinh nghiệm đối với các trường hợp nghi ngờ nhiễm P.aeruginosa ở bệnh nhân nặng là tăng cường hiệu quả kháng sinh vừa trên tác dụng có hiệu lực và vừa trên hiệu quả hiệp đồng khi phối hợp kháng sinh. Điều này cũng có thể áp dụng cho các bệnh nhiễm trùng gây ra bởi các tác nhân Gram âm khó điều trị khác có khả năng kháng thuốc cao, chẳng hạn như A. baumannii và Enterobacteriaceae.
Đối với MRSA, liệu có thể yên tâm hoàn toàn với điều trị bằng vancomycin không? Bất chấp việc sử dụng vancomycin trên toàn thế giới, sự kháng thuốc của s. aureus đối với glycopeptide này còn ít gặp. Cho đến 2010 [152], chỉ có chín trường hợp s. aureus kháng vancomycin (VRSA được xác định bởi vancomycin MIC >16 mg/l), và tính đến năm 2007, có khoảng 100 trường hợp phân lập s. aureus trung gian vancomycin (VISA) (được xác định bởi vancomycin MIC là 4-8 mg/l) đã được báo cáo trên toàn thế giới [153]. Như trên đã nói, năm 2006 CLSI đã hạ ngưỡng nhạy cảm và kháng của s. aureus với vancomycin lần lượt từ 4 mg/l xuống 2 mg/l và từ 32 mg/l xuống 16 mg/l [163]. Một trong những nghiên cứu đáng lưu ý nhất, được thực hiện bởi Soriano và cs, đã mô tả mối quan hệ giữa kết quả lâm sàng của nhiễm khuẩn huyết do s. aureus và MIC của vancomycin [159]. Trong nghiên cứu lâm sàng tiến cứu này, các tác giả đã quan sát thấy trong số 168 bệnh nhân được điều trị vancomycin cho nhiễm khuẩn huyết s. aureus, MIC cao hơn đối với vancomycin (>2,0 mg/l) có liên quan độc lập với nguy cơ tử vong, cao hơn đáng kể sau 30 ngày (OR 6,39; CI 95% 1,68-24,3; p<0,001), so với MIC là 1,0 mg/l. Những phát hiện này khiến các tác giả đề xuất sự cần thiết phải đánh giá tính ưu việt có thể có của các kháng sinh chống s. aureus mới so với vancomycin khi một chủng có MIC với vancomycin đã >1 mg/l. Do đó, tập hợp các dữ liệu đã phân tích gợi ý rằng định nghĩa về tính nhạy cảm với vancomycin cần được đánh giá thêm trong các trường hợp nhiễm trùng MRSA nghiêm trọng như viêm phổi và nhiễm khuẩn huyết. Tóm lại, MIC của vancomycin đối với s. aureus thực sự đang ‘leo thang’ trên toàn thế giới và các bác sĩ lâm sàng nên thận trọng trong việc sử dụng glycopeptide cho bệnh nhân bị bệnh nặng bị nhiễm s. aureus nặng khi MIC của thuốc đã ở giới hạn trên của mức nhạy cảm. Do đó, trong điều trị VAP kinh nghiệm, nên chọn liệu pháp chống nhiễm trùng kháng vi khuẩn Gram âm dựa trên cơ sở các kiểu kháng thuốc tại chỗ của các vi khuẩn gây bệnh phổ biến chính, kết hợp với glycopeptide (trong trường hợp có hai hoặc nhiều yếu tố nguy cơ sau: thời gian nằm ICU lâu hơn, từng dùng kháng sinh trước đó, có mang s. aureus trong mũi, có cầu khuẩn Gram dương khi nhuộm Gram, hoặc trong trường hợp nhiễm trùng huyết nặng hoặc sốc nhiễm trùng) [216]. Tuy nhiên, nếu phân lập được MRSA có MIC vancomycin từ 1 mg/l trở lên thì nên chuyển sang một loại kháng sinh chống MRSA khác, chẳng hạn như linezolid [216]. Ở các cơ sở ICU nơi có tỷ lệ nhiễm MRSA cao với MIC vancomycin từ 1 mg/l trở lên, trong trường hợp nhiễm trùng nặng, có thể kết hợp với các kháng sinh còn hiệu quả đối với các chủng đã ở giới hạn cao của ngưỡng nhậy cảm, chẳng hạn như linezolid. Trong một bản tóm tắt gần đây về hướng dẫn điều trị vancomycin, Rybak và cs khuyến cáo luôn duy trì nồng độ vancomycin trong huyết thanh trên 10 mg/l để tránh phát triển các đặc điểm giống VISA [217].
Đối với các bệnh nhiễm trùng nặng do vi khuẩn Gram âm, việc lựa chọn kháng sinh phù hợp là rất quan trọng để tăng tỷ lệ sống sót. Quản lý nhiễm trùng MDR là một thách thức điều trị khó khăn đối với các bác sĩ chăm sóc tích cực vì kháng thuốc ngày càng tăng của các vi khuẩn này đối với hầu hết các loại thuốc kháng sinh và kháng thuốc thường dẫn đến thất bại lâm sàng. Các thuốc kháng sinh thế hệ mới dường như không mang lại lợi thế đáng kể để chống lại vi khuẩn P. aeruginosa MDR, mà các loại kháng sinh cũ, chẳng hạn như colistin [218], là lựa chọn khả dụng duy nhất. Liệu rằng liệu pháp phối hợp với colistin có mang lại lợi thế vượt trội so với đơn trị liệu hay không cần có các nghiên cứu lâm sàng ngẫu nhiên trong tương lai. Các carbapenem mới như doripenem và biapenem có hoạt tính tuyệt vời đối với P. aeruginosa, tuy nhiên chúng lại thiếu hoạt tính chống lại các chủng thể hiện khả năng kháng carbapenem hiện có. Trong khi đó polymyxin vẫn là kháng sinh hiệu quả nhất đối với P. aeruginosa MDR. Như vậy, việc lựa chọn thuốc kháng sinh để điều trị bệnh nhân nặng nên tính đến các khía cạnh lâm sàng, bao gồm các yếu tố nguy cơ, sự xâm nhập và mức độ nặng của bệnh và các khía cạnh dịch tễ học, bao gồm khả năng kháng thuốc trong một môi trường nhất định. Trong tương lai, các khía cạnh liên quan đến thuốc cũng cần được xem xét cẩn thận.
Đối với VAP
Lựa chọn phác đồ kháng sinh theo kinh nghiệm cho VAP khi có nghi ngờ lâm sàng là khó khăn vì quyết định của các bác sĩ lâm sàng phải cân bằng giữa lợi ích tiềm năng của việc bắt đầu dùng kháng sinh đầy đủ, sớm để giảm tỷ lệ tử vong với tác hại của việc sử dụng quá mức kháng sinh trên người bệnh và cho môi trường.
Vi khuẩn MDR và các kiểu kháng thuốc khác nhau đáng kể giữa các quốc gia, khu vực, bệnh viện, ICU trong bệnh viện và giữa các nguồn bệnh phẩm (tức là phổi so với các mẫu bệnh phẩm khác) [211,219-221]. Điều này được minh họa bằng một nghiên cứu quan sát so sánh kết quả nuôi cấy định lượng thu được bằng nội soi phế quản từ 229 bệnh nhân VAP tại 4 cơ sở khác nhau cho thấy có sự khác biệt lớn về cả tần suất vi sinh gây bệnh và mô hình kháng thuốc giữa các cơ sở điều trị [219]. Tương tự, một nghiên cứu quan sát khác trên bệnh nhân VAP đã tìm thấy sự khác biệt lớn về cả tần suất vi khuẩn gây bệnh và mô hình kháng thuốc ở các ICU khác nhau ở ngay trong cùng một cơ sở điều trị [221]. Trong trường hợp không có dữ liệu dịch tễ học vi sinh gây bệnh tại địa phương, các bác sĩ lâm sàng có thể tham khảo các cuộc điều tra lớn trong nước và quốc tế về vi sinh gây bệnh và mô hình kháng thuốc. Việc áp dụng các chiến lược dựa trên phân tích nguy cơ như đã trình bày ở các nội dung trên là rất cần thiết và có một phòng xét nghiệm vi sinh hỗ trợ ở những cơ sở điều trị có triển khai ICU là rất quan trọng.
Loại kháng sinh nào được khuyến cáo để điều trị kinh nghiệm VAP nghi ngờ trên lâm sàng? Bảng bên dưới là khuyến cáo của ATS năm 2016 các lựa chọn điều trị kinh nghiệm được đề xuất cho một trường hợp trên lâm sàng nghi ngờ VAP ở các đơn vị nơi mà chỉ định kháng sinh kháng MRSA và kết hợp 2 kháng sinh kháng Pseudomonas/vi khuẩn Gram âm là thích hợp.
Bảng 5.9. Lựa chọn kháng sinh kinh nghiệm cho VAP (Nguồn trích dẫn: Andre C. Kali et al. Management of Adults
with Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious
Diseases Society of America and the American Thoracic Society. Clinical Infectious Diseases® 2016;63(5):e61-111)
| A. Kháng sinh kháng Gram dương có hoạt tính với MRSA | B. Kháng sinh kháng Gram âm với hoạt tính kháng Pseudomonas loại beta-lactam | C. Kháng sinh kháng Gram âm với hoạt tính kháng Pseudomonas loại không-beta- lactam |
| Glycopeptidesa
– Vancomycin 15 mg/kg IV/mỗi 8- 12h (xem xét loading dose 25-30 mg/kg X 1 trong trường hợp nặng) |
Penicillinsb kháng Pseudomonas
– Piperacillin-tazobactam 4,5 g IV/mỗi 6hb |
Fluoroquinolones
– Ciprofloxacin 400 mg IV/mỗi 8h – Levofloxacin 750 mg IV/mỗi 24h |
| Hoặc | Hoặc | Hoặc |
| Oxazolidinones
– Linezolid 600 mg IV/mỗi 12h |
Cephalosporinsb
– Cefepime 2 g IV/mỗi 8h – Ceftazidime 2 g IV/mỗi 8h |
Aminoglycosidesa’ c
– Amikacin 15-20 mg/kg IV/mỗi 24h – Gentamicin 5-7 mg/kg IV/mỗi 24h – Tobramycin 5-7 mg/kg IV/mỗi 24h |
| Hoặc | Hoặc | |
| Carbapenemsb
– Imipenem 500 mg IV/mỗi 6hd – Meropenem 1 g IV/mỗi 8h |
Polymyxinsa’ e
– Colistin 5 mg/kg IV X 1 (loading dose) tiếp nối bằng 2,5 mg X (1,5 X CrCl + 30) IV/mỗi 12h (liều duy trì) – Polymyxin B 2,5-3,0 mg/kg/ngày chia 2 IV |
|
| Hoặc | ||
| Monobactams’
– Aztreonam 2 g IV/mỗi 8h |
||
| Chọn một kháng sinh Gram dương từ cột A, một kháng sinh Gram âm từ cột B và một kháng sinh Gram âm từ cột C. Lưu ý rằng các liều ban đầu được đề xuất trong bảng này có thể cần phải được sửa đổi cho bệnh nhân bị rối loạn chức năng gan hoặc thận. Chữ viết tắt: CrCl, độ thanh thải creatinine; IV, tiêm tĩnh mạch; MRSA, Staphylococcus aureus kháng methicillin. a: Mức độ thuốc và điều chỉnh liều lượng và/hoặc khoảng thời gian cần thiết.
b: Truyền dịch kéo dài có thể thích hợp. Xem phần dược động học/dược lực học của liệu pháp kháng sinh. c: Trên phân tích tổng hợp, chế độ điều trị bằng aminoglycoside có liên quan đến tỷ lệ đáp ứng lâm sàng thấp hơn mà không có sự khác biệt về tỷ lệ tử vong. d: Có thể cần giảm liều ở những bệnh nhân nặng <70 kg để ngăn ngừa co giật. e: Polymyxins nên được dành riêng cho những nơi có tỷ lệ kháng đa thuốc cao và chuyên môn địa phương trong việc sử dụng thuốc này. Liều lượng dựa trên hoạt động của colistin-base (CBA); Thí dụ: Một triệu IU colistin tương đương với khoảng 30 mg CBA, tương ứng với khoảng 80 mg tiền thuốc colistimethate. Polymyxin B (1 mg = 10.000 đơn vị). f: Trong trường hợp không có các lựa chọn khác, có thể chấp nhận sử dụng aztreonam như một chất bổ sung với một chất dựa trên beta-lactam khác vì nó có các mục tiêu khác nhau trên thành tế bào vi khuẩn. |
||
Ở những bệnh nhân nghi ngờ mắc VAP, ATS năm 2016 [198] khuyến cáo phác đồ cần bao gồm kháng sinh bao vây s. aureus, P. aeruginosa và các trực khuẩn Gram âm khác trong tất cả các chế độ điều trị kinh nghiệm. Kháng sinh điều trị kinh nghiệm bao vây MRSA khi nghi ngờ VAP khi có bất kỳ yếu tố nào sau đây: yếu tố nguy cơ nhiễm khuẩn MDR (bảng 5.9) [198], bệnh nhân được điều trị tại các đơn vị có >10%-20% s. aureus kháng methicillin và bệnh nhân ở các đơn vị không biết tỷ lệ nhiễm MRSA. Với những trường hợp không có yếu tố nguy cơ MDR và ở những nơi có <10%-20% s. aureus phân lập kháng methicillin, nên thêm một kháng sinh có hoạt tính với MSSA (chứ không phải MRSA) để điều trị kinh nghiệm. Nếu chỉ định điều trị kinh nghiệm cho MRSA, vancomycin hoặc linezolid được khuyến cáo sử dụng. Khi chỉ định điều trị kinh nghiệm đối với MSSA (không phải MRSA), phác đồ bao gồm piperacillin-tazobactam, cefepime, levofloxacin, imipenem hoặc meropenem. Oxacillin, nafcillin hoặc cefazolin là những thuốc được ưu tiên để điều trị MSSA đã được chứng minh, nhưng không nhất thiết để điều trị kinh nghiệm cho VAP.
Cũng từ tài liệu trên (IDSA/ATS 2016) [198] khuyến cáo điều trị kháng sinh kinh nghiệm khi nghi ngờ VAP để bao vây Pseudomonas nên sử dụng 2 loại kháng sinh khác nhóm khi có bất kỳ yếu tố nào sau đây: yếu tố nguy cơ nhiễm khuẩn MDR, bệnh nhân ở các đơn vị có >10% vi khuẩn Gram âm phân lập kháng với một kháng sinh đang được xem xét để đơn trị liệu và bệnh nhân ở ICU không có sẵn dữ liệu tỷ lệ nhạy cảm với kháng sinh tại chỗ. Điều trị bao vây Pseudomonas bằng 1 kháng sinh với những bệnh nhân nghi ngờ VAP nhưng không có các yếu tố nguy cơ kể trên và những nơi có dữ liệu theo dõi cho thấy <10% chủng vi khuẩn Gram âm kháng với kháng sinh đang được xem xét điều trị đơn trị liệu kháng sinh. Đối với VAP, không nên sử dụng aminoglycoside, colistin nếu có sẵn các thuốc thay thế có hoạt tính Gram âm phù hợp [198]
Trong thực hành xử trí kháng sinh cho VAP, tất cả các tài liệu hướng dẫn đều thống nhất nhấn mạnh vai trò của xét nghiệm vi sinh và yếu tố dịch tễ vi khuẩn kháng thuốc tại sơ sở điều trị (hình 5.4). Có thể nói hai thông tin này là rất cần thiết, như “đèn pha” cần cho lái xe đi trong đêm tối vậy.
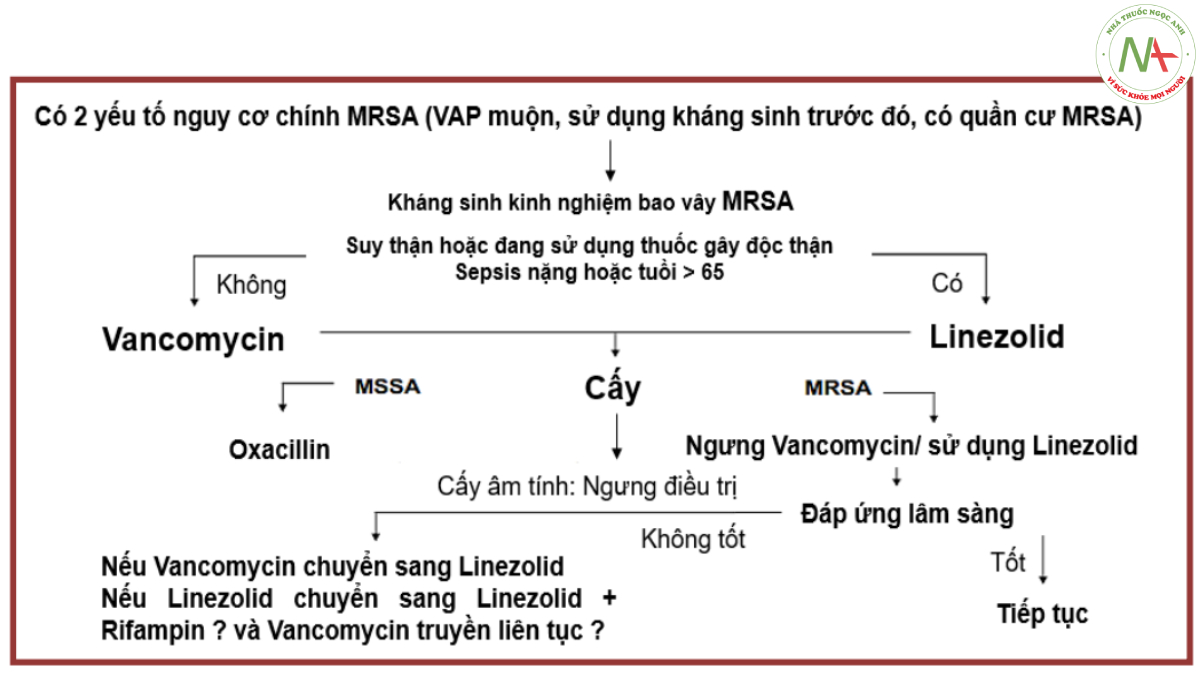
Khi lưu ý tới S. aureus, trong khi chờ phân tích kết quả vi sinh hoặc không có kết quả vi sinh, trị liệu kinh nghiệm cần dựa trên phân tích nguy cơ: VAP khởi phát muộn, có tiền sử điều trị kháng sinh trước đó, đã từng phân lập được vi khuẩn quần cư MRSA trên người bệnh. Dưới đây là lưu đồ hướng dẫn xử trí VAP nghi do S. aureus
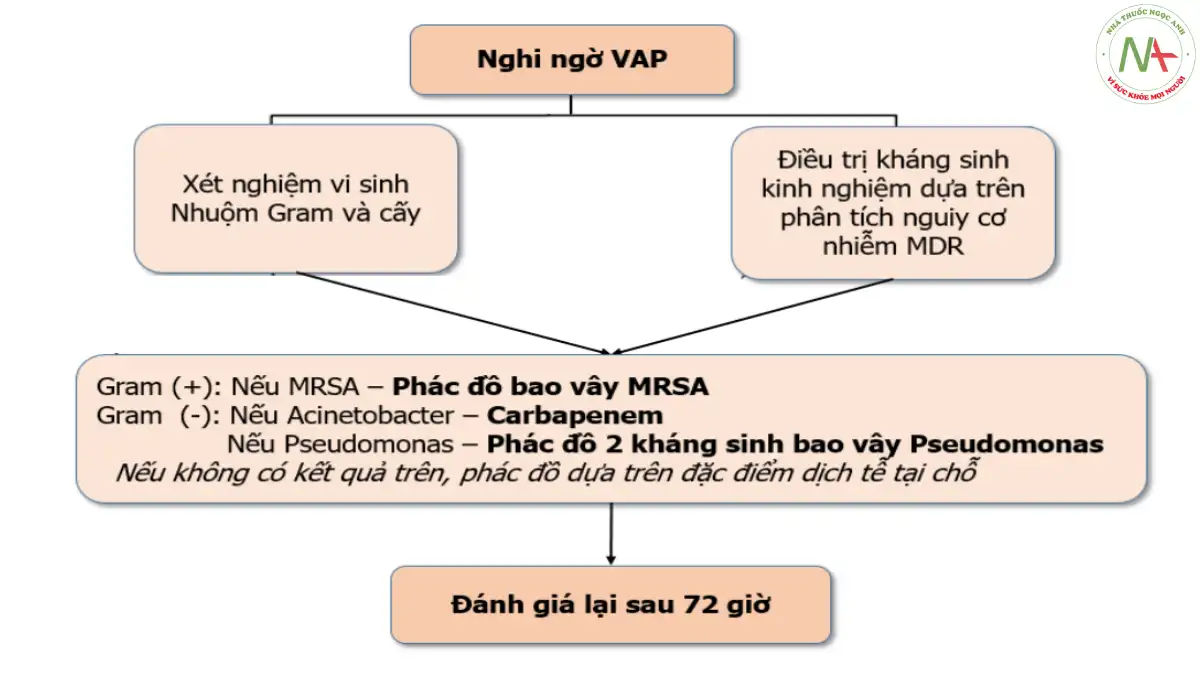
Care Med 2003;31:2548).
Có 2 yếu tó nguy Cữ chính MRSA (VAP muộn, sử dụng kháng sinh trước đó, có quần cư MRSA)
Đối với HAP
Cũng như với VAP, kháng sinh kinh nghiệm cho HAP cũng cần tham khảo dữ liệu đặc điểm nhiễm và kháng thuốc của cơ sở điều trị. Bảng 5.10 bên dưới [198] liệt kê kháng sinh được IDSA/ATS 2016 khuyến cáo trong điều trị HAP. Các kháng sinh kinh nghiệm cũng dựa trên phân tích có hay không nguy cơ nhiễm MDR và MRSA. Theo hướng dẫn của ATS, một số lưu ý cần được cân nhắc với phác đồ điều trị kinh nghiệm như sau: i) Nên chỉ định kháng sinh kháng S. aureus. Khi có yếu tố nguy cơ nhiễm MRSA (tức là đã sử dụng kháng sinh đường tĩnh mạch trước đó trong vòng 90 ngày, nhập viện tại một đơn vị có >20% chủng S. aureus kháng methicillin hoặc tỷ lệ mắc bệnh MRSA chưa được biết đến hoặc những người có nguy cơ tử vong cao) cần chỉ định kháng sinh có hoạt tính kháng MRSA, trong đó vancomycin hoặc linezolid được khuyến cáo sử dụng. Khi không có nguy cơ nhiễm MRSA và không có nguy cơ tử vong cao thì phác đồ bao gồm piperacillin-tazobactam, cefepime, levofloxacin, imipenem hoặc meropenem. Oxacillin, nafcillin, hoặc cefazolin được ưa thích hơn để điều trị MSSA đã được chứng minh nhưng không nên sử dụng trong điều trị kinh nghiệm HAP. ii) Phác đồ điều trị kinh nghiệm cần bao vây P. aeruginosa và các vi khuẩn nhóm trực khuẩn Gram âm khác khi có yếu tố nguy cơ nhiễm vi khuẩn này và/hoặc trong tình trạng nặng có nguy cơ tử vong (cần thở máy và sốc nhiễm trùng) cần chỉ định 2 kháng sinh khác nhóm. Nếu không trong tình huống trên, có thể chỉ định 1 loại kháng sinh kháng Pseudomonas nhưng không phải là aminoglycoside. Nếu bệnh nhân mắc bệnh phổi cấu trúc làm tăng nguy cơ nhiễm trùng Gram âm (như dãn phế quản hoặc xơ nang), nên dùng 2 thuốc kháng Pseudomonas. Nhuộm Gram chất lượng cao từ mẫu bệnh phẩm đường hô hấp thấy có trực khuẩn Gram âm chiếm ưu thế cũng là bằng chứng hỗ trợ thêm cho chẩn đoán viêm phổi Gram âm, bao gồm cả các vi khuẩn lên men và không lên men glucose.
Management of Adults with Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clinical Infectious Diseases® 2016;63(5):e61-111)
| Không có nguy cơ tử vong cao a và không có các yếu tố làm tăng khả năng MRSA b,c | Không có nguy cơ tử vong cao a nhưng có các yếu tố tăng khả năng mắc mRsa b’c | Nguy cơ tử vong cao hoặc tiêm tĩnh mạch kháng sinh trong 90 ngày trước a,c |
| Chọn một trong các kháng sinh sau đây: | Chọn một trong các kháng sinh sau đây: | Chọn hai trong các kháng sinh sau đây (tránh hai thuốc cùng nhóm beta- lactam): |
| Piperacillin-tazobactamd 4.5 g IV/mỗi 6h | Piperacillin-tazobactamd 4.5 g IV/mỗi 6h | Piperacillin-tazobactamd 4.5 g IV/mỗi 6h |
| Hoặc | Hoặc | Hoặc |
| Cefepimed 2 g IV/mỗi 8h | Cefepimed hoặc
ceftazidimed 2 g IV/mỗi 8h |
Cefepimed hoặc ceftazidimed 2 g
IV/mỗi 8h |
| Hoặc | Hoặc | Hoặc |
| Levofloxacin 750 mg IV ngày | – Levofloxacin 750 mg IV ngày
– Ciprofloxacin 400 mg IV/mỗi 8h |
– Levofloxacin 750 mg IV ngày
– Ciprofloxacin 400 mg IV/mỗi 8h |
| Hoặc | Hoặc | Hoặc |
| – Imipenemd 500 mg IV/mỗi 6h
– Meropenemd 1 g IV/mỗi 8h |
– Imipenemd 500 mg IV/mỗi 6h
– Meropenemd 1 g IV/mỗi 8h |
– Imipenemd 500 mg IV/mỗi 6h
– Meropenemd 1 g IV/mỗi 8h |
| Hoặc | Hoặc | Hoc |
| Aztreonam 2 g IV/mỗi 8h | Amikacin 15-20 mg/kg IV ngày Gentamicin 5-7 mg/kg IV ngày Tobramycin 5-7 mg/kg IV ngày | |
| Hoặc | ||
| Aztreoname 2 g IV q8h | ||
| Cộng với:
Vancomycin 15 mg/kg IV/mỗi 8-12h để đạt được nồng độ trũng 15-20 mg/mL (xem xét loading dose một liều 25-30 mg/kg X 1 khi tình trạng nặng) |
Cộng với:
Vancomycin 15 mg/kg IV/mỗi 8-12h để đạt được nồng độ trũng 15-20 mg/mL (xem xét loading dose một liều 25-30 mg/kg IV X 1 khi tình trạng nặng) |
|
| Hoặc | Hoặc | |
| Linezolid 600 mg IV/mỗi 12h | Linezolid 600 mg IV/mỗi 12h | |
| Nếu bao vây MSSA sử dụng các lựa chọn sau:
Piperacillin-tazobactam, Cefepime, Levofloxacin, Imipenem, Meropenem. Oxacillin, Nafcillin và Cefazolin Đây là các kháng sinh ưu tiên sử dụng trong điều trị MSSA đã được chứng minh, tuy nhiên thông thường sẽ không sử dụng trong một phác đồ điều trị HAP kinh nghiệm. |
||
| Nếu bệnh nhân bị dị ứng penicillin nặng và aztreonam được sử c beta-lactam nào, cần bao vây MSSA. | ụng thay cho bất kỳ loại kháng sinh | |
| a. Các yếu tố nguy cơ tử vong bao gồm nhu cầu thở máy do viêm phổi và sốc nhiễm trùng.
b. Các chỉ định để bao vây MRSA khi có yếu tố nguy cơ: điều trị kháng sinh tiêm tĩnh mạch trong 90 ngày trước đó và điều trị tại một đơn vị không biết tỷ lệ nhiễm MRSA trong số các chủng s. aureus phân lập được hoặc là đã biết >20%. Việc phát hiện MRSA trước đó bằng nuôi cấy hoặc sàng lọc không nuôi cấy cũng có thể làm tăng nguy cơ mắc MRSA. Ngưỡng 20% được chọn để cân bằng nhu cầu sử dụng kháng sinh ban đầu hiệu quả trị liệu so với những hệ lụy của việc sử dụng kháng sinh quá mức. Do vậy, từng đơn vị riêng có thể chọn điều chỉnh phác đồ phù hợp với các dữ liệu dịch tễ tại chỗ giá trị và điều kiện thực tế. Nếu không cần bao vây MRSA phác đồ kháng sinh nên bao vây MSSA. c. Nếu bệnh nhân có các yếu tố làm tăng khả năng nhiễm vi khuẩn Gram âm, nên dùng 2 thuốc kháng Pseudomonas. Nếu bệnh nhân mắc bệnh phổi cấu trúc làm tăng nguy cơ nhiễm Gram âm (tức là dãn phế quản hoặc xơ nang), nên dùng 2 thuốc kháng pseudomonas. Nếu nhuộm Gram từ một mẫu bệnh phẩm hô hấp chất lượng với rất nhiều và trực khuẩn Gram âm chiếm ưu thế sẽ là bằng chứng hỗ trợ thêm cho chẩn đoán viêm phổi Gram âm, bao gồm các vi khuẩn lên men và không lên men glucose. d. Truyền dịch kéo dài có thể thích hợp. e. Trong trường hợp không có các lựa chọn khác, có thể chấp nhận sử dụng aztreonam như một kháng sinh bổ sung cho một kháng sinh beta-lactam khác vì nó có đích tác động kháng sinh khác trong thành tế bào vi khuẩn. |
||
Kết hợp kháng sinh và thay đổi kháng sinh trong HAP/VAP
Năm cơ sở lý luận chính cho việc sử dụng liệu pháp kết hợp kháng sinh trong HAP và VAP mặc dù cũng phải nhấn mạnh rằng điều này không nhất thiết phải được ủng hộ bởi bằng chứng lâm sàng [222]. i) Đầu tiên, liệu pháp phối hợp có thể được sử dụng để mở rộng phổ kháng sinh ban đầu và do đó giảm thiểu khả năng không bao vây hết nhiễm trùng. Tầm quan trọng của việc bao vây đầy đủ ban đầu được nhấn mạnh bởi một số nghiên cứu cho thấy tỷ lệ tử vong gia tăng nếu điều trị theo kinh nghiệm ban đầu không đầy đủ [222]. Thí dụ, Luna và cs [223] đã tiến hành một nghiên cứu quan sát tiến cứu ở 132 bệnh nhân VAP được nội soi phế quản với BAL. Những bệnh nhân được điều trị kháng sinh ban đầu không đầy đủ có tỷ lệ tử vong là 91% so với 38% ở những bệnh nhân được điều trị đầy đủ (p<0,001). Bệnh nhân bị nhiễm vi khuẩn MDR thường được điều trị kinh nghiệm không đầy đủ và trong tình huống này tỷ lệ tử vong tăng gấp đôi [224]. ii) Tiếp theo, kết hợp thuốc tạo ra hiệu ứng hiệp đồng thuốc. Một thí dụ về sức mạnh hiệp đồng là sự kết hợp của một tác nhân có hoạt tính chống lại thành tế bào bằng một aminoglycoside để đạt được hiệu ứng hiệp đồng chống lại các trực khuẩn Gram âm. Tác dụng này bắt nguồn từ việc tăng tính thấm của thành tế bào đối với aminoglycoside khi có sự hiện diện của một kháng sinh beta-lactam. Một thí dụ kinh điển khác là sự kết hợp của một kháng sinh beta- lactam với chất ức chế beta-lactamase. Nói chung, loại thứ hai không có nhiều tác dụng chống lại vi khuẩn gây bệnh nhưng nó cho phép vô hiệu hóa beta-lactamase do một số vi khuẩn tạo ra và do đó cho phép kháng sinh beta-lactam hoạt động hiệu quả. Hiệu quả hiệp đồng cũng có thể đạt được khi hai loại kháng sinh tác động tuần tự theo lộ trình chuyển hóa của vi khuẩn [225]. iii) Thứ ba, liệu pháp phối hợp có thể được sử dụng với mục tiêu ngăn chặn sự phát triển đề kháng với một loại thuốc kháng sinh cụ thể. Thí dụ, một nghiên cứu ban đầu đã phát hiện ra rằng Staphylococcus cholermidis kháng methicillin nhanh chóng phát triển khả năng kháng rifampin trong môi trường in vitro. Tuy nhiên, khi bổ sung vancomycin hoặc cephalosporin đã ngăn chặn sự phát triển khả năng kháng thuốc này [226]. Trên lâm sàng, việc sử dụng kết hợp thuốc kháng sinh để ngăn ngừa kháng thuốc đã được chứng minh tốt trong việc phối hợp kháng sinh điều trị bệnh lao [225,227]. iv) Thứ tư, một chất kháng khuẩn thứ hai có thể được thêm vào để có tác dụng điều hòa miễn dịch. Một nghiên cứu thực nghiệm cho thấy macrolide có thể làm giảm sự di chuyển của bạch cầu đơn nhân và bạch cầu trung tính qua nội mô mao mạch. Ngoài ra, macrolide cũng có thể làm giảm sinh tổng hợp chemokine gây viêm
Macrolide điều chỉnh việc sản xuất các cytokine trên các tế bào biểu mô phế quản
Trong các tế bào biểu mô phế quản của người được nuôi cấy, sự giải phóng các chất trung gian gây viêm, chẳng hạn như IL- 6, IL-8 và phân tử kết dính giữa các tế bào 1 (Intercellular adhesion molecule-1, ICAM-1), được gây ra bởi nội độc tố influenzae. Việc bổ sung erythromycin làm giảm cả sự giải phóng các chất trung gian gây viêm kể trên và hóa ứng động của bạch cầu đa nhân trung tính [230]. Có nhiều kết quả nghiên cứu về việc sử dụng macrolide trong CAP. Các nghiên cứu quan sát cho thấy sự cải thiện hiệu quả điều trị khi sử dụng macrolide trong CAP, mặc dù các nghiên cứu lâm sàng không chứng minh được lợi ích một cách nhất quán í61‘131‘132]. Có ít nghiên cứu đánh giá vai trò của macrolide trong HAP hoặc VAP. v) Thứ năm, một chất kháng khuẩn thứ hai có thể được thêm vào để ngăn chặn sự tổng hợp độc tố của vi khuẩn. Ở một số bệnh nhân bị viêm phổi và nhiễm trùng huyết, kết quả lâm sàng kém có thể chủ yếu do vi khuẩn tạo ra độc tố. Ở những bệnh nhân này, liệu pháp phối hợp với việc bổ sung một loại kháng sinh nhằm ức chế vi khuẩn sinh tổng hợp protein có thể được chỉ định. Thí dụ trong trường hợp của clindamycin trong nhiễm s. aureus. Sự giải phóng độc tố tụ cầu in vitro của vi khuẩn khi tiếp xúc với clindamycin thấp hơn so với ceftriaxone [233]. Trong một nghiên cứu khác, cả clindamycin và linezolid đều ức chế đáng kể sự biểu hiện Panton-Valentine leukocidin (ngoại độc tố, PVL) bởi MRSA trong một nghiên cứu in vitro [234]. Gen quy định tạo độc tố này đặc biệt phổ biến ở vi khuẩn MRSA có từ cộng đồng [235].
Trong cả HAP và VAP, các hướng dẫn khuyến cáo bao vây kép chống lại P. aeruginosa nếu bệnh nhân mắc bệnh phổi cấu trúc dẫn đến nhiễm P. aeruginosa, chẳng hạn như dãn phế quản hoặc xơ hóa nang [198]. Các hướng dẫn tiếp tục khuyến cáo đơn trị liệu trong cả HAP và VAP trong bối cảnh nhiễm P. aeruginosa đã biết bằng cách sử dụng kháng sinh nhạy cảm. Tuy nhiên, nếu bệnh nhân bị sốc nhiễm trùng hoặc có nguy cơ tử vong cao, các hướng dẫn đề xuất sử dụng hai loại kháng sinh mà vi khuẩn nhạy cảm [198].
Tạo sao phải xuống thang kháng sinh? Điều trị quá liều bằng kháng sinh dẫn đến kháng thuốc và kéo theo bội nhiễm (superinfection). Điều này đã được nhấn mạnh bởi một nghiên cứu thực hiện trên bệnh nhân vào ICU với thâm nhiễm phổi mới xuất hiện nhưng ít nghi ngờ viêm phổi theo hệ thống tính điểm. Bệnh nhân được chọn ngẫu nhiên để điều trị ciprofloxacin tĩnh mạch (nhóm nghiên cứu) trong 3 ngày hoặc liệu pháp kháng sinh theo quyết định của bác sĩ điều trị (nhóm đối chứng). Trong nhóm nghiên cứu, việc đánh giá lại được thực hiện vào ngày thứ 3 và ngừng sử dụng kháng sinh nếu hệ thống tính điểm cho thấy khả năng viêm phổi thấp. Kháng sinh được tiếp tục trong hơn 3 ngày ở 97% nhóm đối chứng so với 28% nhóm nghiên cứu. Mặc dù không có sự khác biệt về tỷ lệ tử vong, bệnh nhân trong nhóm nghiên cứu ít phát triển kháng thuốc kháng sinh và/hoặc bội nhiễm hơn (15% so với 35%; p=0,017).
Ngoài ra, trong số những người sống sót, nhóm nghiên cứu có thời gian nằm ICU ngắn hơn (trung bình 9,4 so với 14,7 ngày; p=0,04) [212]. Một chiến lược để tránh tiếp xúc không cần thiết với thuốc kháng sinh là thực hiện liệu pháp xuống thang, nghĩa là thu hẹp phạm vi bao vây với phổ rộng hơn ban đầu hoặc ngừng sử dụng một hoặc nhiều loại thuốc kháng sinh, để liệu pháp kháng khuẩn nhắm đến mục tiêu là vi khuẩn gây bệnh đã xác định được từ xét nghiệm vi sinh. Trong một nghiên cứu quan sát tiến cứu trên 398 bệnh nhân ICU nghi ngờ mắc VAP, liệu pháp xuống thang được thực hiện ở 22% bệnh nhân và cho thấy có liên quan đến tỷ lệ tử vong thấp hơn (17% so với 23,7% ở nhóm không xuống thang; p=0,001) [236]. Trong một nghiên cứu quan sát tiến cứu khác ở 143 bệnh nhân VAP được xác nhận bằng nuôi cấy dịch tiết đường hô hấp dưới, liệu pháp xuống thang được thực hiện ở 58 (40,5%) bệnh nhân. Bệnh nhân được điều trị xuống thang có tỷ lệ tử vong trong 28 ngày thấp hơn (12% so với 43,5%; p<0,05) và thời gian nằm viện thấp hơn (23,7 so với 29,8 ngày; p<0,05) [237]. Một nghiên cứu quan sát tiến cứu khác cho thấy có ít cơ hội cho liệu pháp xuống thang hơn với VAP khởi phát muộn (so với VAP khởi phát sớm) và khi có vi khuẩn MDR mọc [238]. Cần lưu ý là tất cả các nghiên cứu trên đều không đồng nhất trong thiết kế và trong định nghĩa xuống thang, tuy nhiên, các nghiên cứu đã cung cấp bằng chứng cho thấy việc áp dụng xuống thang trong ICU là khả thi và dẫn đến kết quả tốt hơn với tiếp xúc với kháng sinh ít hơn.
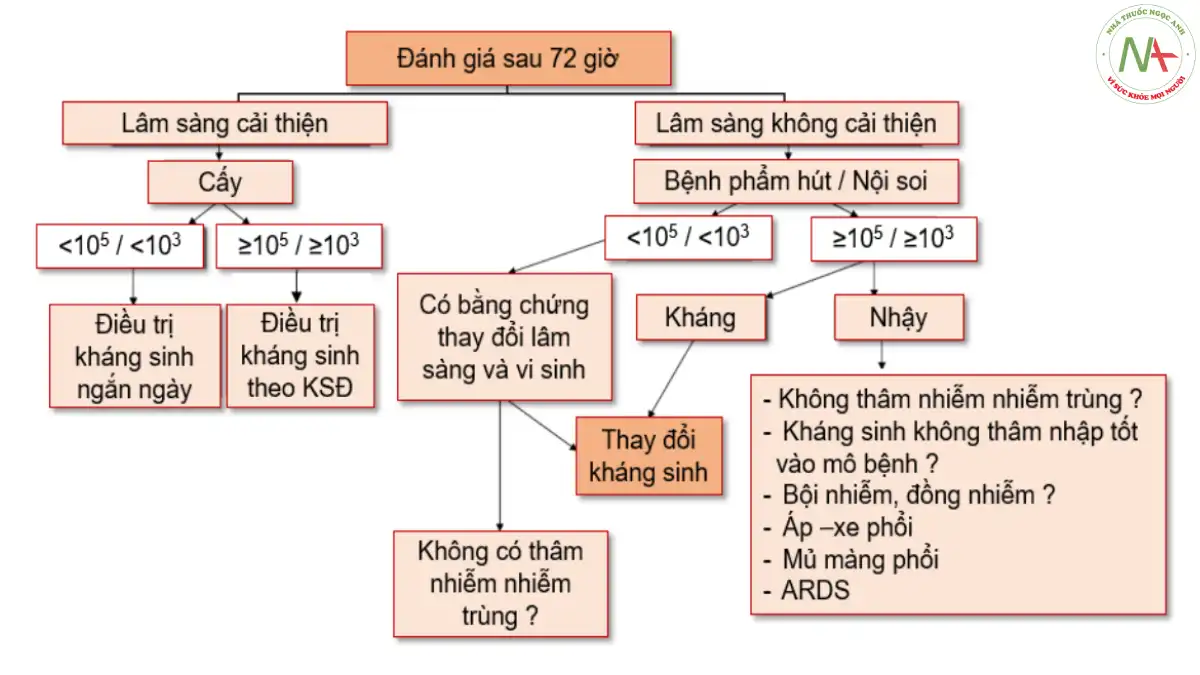
Có ba cách để xem xét liệu pháp kháng sinh đã chỉ định trước đó: chuyển sang phác đồ khác, xuống thang hoặc tiếp tục duy trì phác đồ kháng sinh ban đầu. Trong quá trình xuống thang, việc điều trị bắt đầu bằng liệu pháp kháng sinh phổ rộng, cung cấp phạm vi bao vây tối đa và giảm thiểu nguy cơ điều trị theo kinh nghiệm không phù hợp. Khi có kết quả nuôi cấy dương tính, việc xuống thang cho phép thay đổi phương pháp điều trị sang liệu pháp đặc hiệu phổ hẹp, giảm thiểu nguy cơ xuất hiện kháng thuốc khi mức độ tiếp xúc với các tác nhân phổ rộng giảm [209]. Một nghiên cứu khác [236] cho thấy xuống thang đã được thực hiện trong 22% các đợt VAP. Tỷ lệ tử vong thấp hơn ở những bệnh nhân xuống thang điều trị so với những bệnh nhân không thay đổi điều trị. Sự kết hợp giữa giải quyết lâm sàng và tính nhạy cảm với kháng sinh của các vi khuẩn gây bệnh mang đến cho các bác sĩ lâm sàng sự lựa chọn dựa trên có hay không hướng dẫn từ xét nghiệm vi sinh để tiếp tục, xuống hay lên thang. Không có dữ liệu vi sinh, theo định nghĩa, việc xuống thang là không thể, bởi vì việc điều chỉnh kháng sinh xuống không đảm bảo phạm vi bao vây chính xác. Trong tình huống này, i) nếu đạt được cải thiện lâm sàng, lựa chọn đầu tiên là duy trì phác đồ kháng sinh ban đầu. Tuy nhiên, ii) nếu khả năng giải quyết lâm sàng của VAP kém, nên xem xét điều trị lên thang, bao vây các vi khuẩn gây bệnh chưa được phát hiện và đặc biệt chú ý đến các vi khuẩn MDR. Tuy nhiên, iii) nếu có kết quả vi sinh và VAP có khả năng giải quyết thì có thể điều chỉnh phương pháp điều trị tùy theo kết quả, hoặc duy trì liệu pháp hiện tại hoặc, nếu có thể, xuống thang. Và, iv) nếu có dữ liệu vi sinh và tình trạng của bệnh nhân đang xấu đi, nên thay đổi loại kháng sinh bằng cách tăng dần thành một phác đồ phổ rộng hoặc thêm một kháng sinh bao vây vi khuẩn chưa được điều trị. Cuối cùng, toàn bộ lịch trình nên được coi là một quá trình động trong đó thông tin được cập nhật liên tục và xem xét các chẩn đoán khác như tràn mủ màng phổi và chẩn đoán ban đầu sai. Ngoài ra, mô hình giải quyết lâm sàng có thể khác nhau giữa bệnh nhân có hoặc không có ARDS [239].
Hình 5.6. Theo dõi điêu chỉnh kháng sinh điêu trị VAP theo diên biên của kêt quả vi sinh và lâm sàng (Nguồn trích dẫn: Rello J, Diaz E. Pneumonia in the intensive care unit. Crit Care Med 2003;31:2544-51)
Thời gian điêu trị kháng sinh tối ưu vẫn chưa được biêt. Các công cụ khác để giảm thời gian dùng kháng sinh không được áp dụng rộng rãi, mặc dù rửa phê quản phê nang lặp lại đã tỏ ra hữu ích ở những bệnh nhân chấn thương [240]. Một cách tiêp cận tùy chỉnh, dành riêng cho bệnh nhân dựa trên đáp ứng lâm sàng đối với điêu trị bằng kháng sinh, sử dụng các biên số lâm sàng động và dấu ấn sinh học như CRP và procalaitonin, có thể giúp tối ưu hóa thời gian điêu trị. Tuy nhiên, chiên lược này vẫn đang được xác nhận trong các nghiên cứu lâm sàng trong tương lai.
Đối với bệnh nhân HAP/VAP, IDSA/ATS [198] đê nghị nên xác định liêu lượng kháng sinh dựa trên dữ liệu PK/PD, thay vì thông tin kê đơn của nhà sản xuất. Khuyên cáo này đặt giá trị cao vào việc cải thiện kêt quả lâm sàng bằng cách tối ưu hóa liệu pháp kháng sinh và làm giảm gánh nặng và chi phí. Liêu lượng PK/PD tối ưu đê cập đên việc định lượng nồng độ kháng sinh trong máu, truyền kéo dài, truyên liên tục và liêu lượng dựa trên cân nặng bệnh nhân đối với một số loại kháng sinh [198]. Đối với bệnh nhân VAP, hướng dẫn của Hoa Kỳ năm 2016 [198]
khuyên cáo điêu trị bằng kháng sinh trong 7 ngày. Tùy thuộc vào tốc độ cải thiện các thông số lâm sàng, X-quang và xét nghiệm. Tuy nhiên, một số bệnh nhân có thể cần thời gian dùng kháng sinh ngắn hơn hoặc dài hơn. Các hướng dẫn của Châu Âu gần đây [33] khuyên cáo một đợt điêu trị kháng sinh kéo dài 7-8 ngày ở những bệnh nhân không bị suy giảm miên dịch, không bị xơ nang hoặc các biên chứng phổi khác (viêm mủ, áp-xe phổi, tạo hang hoặc viêm phổi hoại tử), xử trí kháng sinh ban đầu thích hợp, không có vi khuẩn gây bệnh kháng thuốc cao (P. aeruginosa, Acinetobacter spp kháng carbapenem, Enterobacteriaceae kháng carbapenem) và có đáp ứng tốt với điêu trị kháng sinh.
Tóm lại, việc phân loại viêm phổi ngày càng phức tạp khi dân số mắc bệnh trở nên đa dạng hơn. Ngày càng có nhiều bệnh nhân được xác định mắc bệnh viêm phổi do vi khuẩn MDR, xảy ra cả trong bệnh viện và bên ngoài bệnh viện. Điều này có khả năng liên quan đến việc mở rộng nhóm bệnh nhân có nguy cơ bị nhiễm vi khuẩn MDR. Những nhóm bệnh nhân đang gia tăng nguy cơ nhiễm khuẩn MDR này bao gồm những người cư trú tại các cơ sở chăm sóc sức khỏe không thuộc bệnh viện (thí dụ: cơ sở điều dưỡng dài hạn, môi trường sống được hỗ trợ y tế, trung tâm phục hồi chức năng), bệnh nhân đang trải qua các thủ thuật hoặc liệu pháp ngoại trú (chạy thận nhân tạo, chăm sóc vết thương, liệu pháp tiêm truyền), bệnh nhân xuất viện gần đây và những người bị ức chế đáng kể tình trạng miễn dịch cơ bản. Những bệnh nhân có các yếu tố nguy cơ ngoài bệnh viện này bị viêm phổi đã làm vấn đề viêm phổi cộng đồng trở nên phức tạp nếu nhìn từ góc độ điều trị kháng sinh kinh nghiệm. Các thuật ngữ CAP, HAP, VAP rồi tới HCAP, NHAP đã được đề xuất và có quá nhiều nghiên cứu, phân tích nguy cơ nhiễm khuẩn không phổ biến, kháng thuốc làm cho các thầy thuốc thực hành trở nên lúng túng. Đã có tác giả, về vấn đề này, đã phải nói rằng sự phân loại như vậy giống như một món “súp chữ nghĩa” (The alphabet soup”, ít có giá trị xác định vi sinh gây bệnh kháng thuốc [241]. Yếu tố nặng và nguy cơ tử vong trên nhóm bệnh nhân HCAP, NHAP liên quan nhiều tới bệnh đồng mắc và tình trạng đáp ứng miễn dịch hơn là liên quan tới vi khuẩn gây bệnh và kháng thuốc. Và tất nhiên là sẽ rất khó áp dụng trong thực tế. Như vậy, một chiến lược tiếp cận theo nguy cơ có thể là hợp lý nhất cho cả CAP, HAP, và tất nhiên là cho cả HCAP và NHAP. Trong một nghiên cứu [131] đoàn hệ đa trung tâm theo dõi trong 3 năm trên 1.089 bệnh nhân (với 656 ca CAP, 238 ca HCAP, 140 ca HAP và 55 ca VAP), các tác giả phân loại bệnh nhân viêm phổi để điều trị kháng sinh kinh nghiệm chỉ dựa trên 2 yếu tố: nặng và nguy cơ nhiễm khuẩn MDR. Nguy cơ nặng được xác định là: cần thở máy hoặc nhập ICU. Nguy cơ nhiễm khuẩn MDR bao gồm: liệu pháp kháng sinh trong 180 ngày qua, tình trạng hoạt động kém, nhập viện hơn 2 ngày trong 90 ngày qua, viêm phổi xuất hiện từ 5 ngày trở lên sau khi nhập viện cấp cứu, chạy thận nhân tạo và có tình trạng ức chế miễn dịch. Trên cơ sở hai yếu tố phân loại như trên, các tác giả điều trị kháng sinh kinh nghiệm cho những trường hợp nặng nhưng không có yếu tố nguy cơ nhiễm khuẩn MDR bằng beta-lactam kết hợp macrolide hoặc fluoroquinolone. Những trường hợp khác, nặng hoặc không nặng, nếu có yếu tố nguy cơ nhiễm khuẩn MDR được điều trị bằng phác đồ beta-lactam kháng Pseudomonas kết hợp fluoroquinolone (hoặc aminoglycoside) và linezolid (hoặc vancomycin). Các tác giả nhận thấy tử vong trong 30 ngày có liên quan tới các yếu tố nguy cơ nhiễm khuẩn MDR và mức độ nặng của viêm phổi mà không liên quan tới phân loại CAP, HCAP, HAP, VAP mặc dù vi khuẩn MDR phân phân lập được giữa các nhóm bệnh trên khác nhau có ý nghĩa (p<0,001).
Như trong nội dung phân tích đặc điểm vi sinh và kháng thuốc của chương trước đã đề cập, chúng ta cần nhấn mạnh rằng tình trạng rối loạn phân bố bình thường của hệ vi sinh trên đường hô hấp trên (dysbiosis) dễ tạo ra viêm phổi do các vi khuẩn không phổ biến. Trong khi sử dụng kháng sinh trước đó dễ tạo ra nhiễm khuẩn kháng thuốc. Các can thiệp chăm sóc và điều trị trong bệnh viện là cơ hội nhiễm khuẩn đa kháng thuốc. Các yếu tố cần xem xét ở tất cả các trường hợp viêm phổi là mức độ nặng và nguy cơ có nhiễm khuẩn bất thường. Xét nghiệm vi sinh là ngọn đèn hải đăng trong quá trình phân tích và quyết định kháng sinh hướng tới vi khuẩn đa kháng thuốc không chỉ cần thiết cho từng trường hợp mà còn là cơ sở dữ liệu quan trọng để xây dựng phác đồ kháng sinh kinh nghiệm cho từng cơ sở điều trị, cho từng khu vực và quốc gia.
Bảng 5.11. Trị liệu kháng sinh kinh nghiệm cho HAP/VAP theo tài liệu hướng dẫn của Hoa Kỳ và Châu Âu (Nguồn trích dẫn: Catia Cillóniz et al. Management of pneumonia in critically ill patients. BMJ 2021;375:e065871)
| Nguy cơ MDR | Guideline của Hoa Kỳ | Guideline của châu Âu |
| Thấp | Đơn trị liệu, phổ hẹp với hoạt tính chống lại vi khuẩn không Gram âm | (<15% nguy cơ tử vong, nguy cơ MDR thấp):
Kháng sinh phổ hẹp có hoạt tính đối với s. aureus nhạy cảm với methicillin và Gram âm không kháng thuốc: ertapenem, ceftriaxone, cefotaxime, moxifloxacin, levofloxacin. |
| Cao | Điều trị kháng sinh kết hợp chống lại vi khuẩn Gram âm. Bao phủ MRSA nếu >10- 20% số chủng s. aureus được phân lập là MRSA. | (>15% nguy cơ tử vong và/hoặc nguy cơ MDR cao):
|
CHIẾN LƯỢC SỬ DỤNG KHÁNG SINH theo’ PK/PD vÀ phối hợp KHÁNG SINH
Khái niệm và phân loại kháng sinh theo dược động và dược lực học (PK/PD) thuốc
Hiểu rõ hơn về mối quan hệ PK/PD và mô hình hoạt động diệt khuẩn của kháng sinh sẽ cho phép các bác sĩ lâm sàng xác định chế độ dùng thuốc tốt nhất cho từng nhóm thuốc khác nhau, nhất là ở những bệnh nhân bị bệnh nặng [152].
Bài học từ sự ‘leo thang’ MIC của s. aureus với vancomycin là một thí dụ về việc sử dụng kháng sinh hợp lý để khắc phục tình trạng kháng thuốc có trên kết quả từ phòng xét nghiệm (in vitro) trả về. Do đó, câu hỏi liệu MIC của vancomycin có phải là yếu tố dự đoán tốt và đáng tin cậy về kết quả lâm sàng của nhiễm khuẩn huyết do S. aureus được điều trị bằng vancomycin hay không chỉ là cách nhìn từ một phía (“phía in vitro”) trong sử dụng kháng sinh, nhất là trên bệnh nhân nặng. Pea và cs cho rằng MIC của vancomycin không thể xem là yếu tố dự đoán kết cục duy nhất đáng tin cậy và không thể sai lầm khi sử dụng thuốc này [242], bởi vì việc đánh giá tính nhạy cảm của vi khuẩn in vitro chỉ là một trong các yếu tố được tính đến khi điều trị bệnh nhân nặng [243]. Vì vậy, đối với kháng sinh phụ thuộc vào thời gian như vancomycin, câu hỏi được đặt ra là liệu truyền ngắt quãng có hiệu quả như truyền liên tục hay không?. Dữ liệu về truyền liên tục vancomycin kết hợp với liều tải (loading dose) dường như đảm bảo nồng độ vancomycin trong huyết tương đạt mục tiêu nhanh hơn so với truyền ngắt quãng [244]. Điều này rất quan trọng để duy trì nồng độ hiệu quả kháng khuẩn của thuốc tại vị trí nhiễm trùng I245,246]. Trong một nghiên cứu lâm sàng, Rello và cs quan sát thấy tỷ lệ tử vong thấp hơn ở những bệnh nhân được truyền vancomycin liên tục, so với tỷ lệ tử vong của những người được truyền không liên tục (25 so với 54,2%; p<0,02) [247]. Như vậy, chiến lược sử dụng thuốc theo đặc tính dược động và dược lực học thuốc (PK/PD) là rất cần được chú ý khi chỉ định kháng sinh.
Sự gia tăng gần đây của vi khuẩn gây bệnh đa kháng thuốc (MDR) trong bối cảnh nguồn cung cấp kháng sinh đang giảm dần đã tạo ra yêu cầu ngày càng tăng đối với việc cần tối ưu hóa trong sử dụng kháng sinh hiện có, đặc biệt là ở ICU.
Mặc dù bệnh nhân bị bệnh nặng chiếm chưa đến 10% tổng số ca nhập viện, nhưng mức tiêu thụ kháng sinh trên nhóm bệnh nhân này cao gấp 10 lần so với bệnh nhân ở tất cả các khoa khác í248-250]. Do đó, việc sử dụng tràn lan (hoặc lạm dụng) kháng sinh đã góp phần gây ra tình trạng tăng đáng báo động vi khuẩn gây bệnh MDR như beta- lactamase phổ rộng và Gram âm sinh carbapenemase. Đáng chú ý, vi khuẩn gây bệnh Gram âm như A. baumannii và P. aeruginosa, cũng như các thành viên của họ Enterobacteriaceae như E. coli và K. pneumoniae, trước đây được coi là tương đối vô hại, đã đề kháng với các loại kháng sinh hiện tại một cách ấn tượng. Các bệnh nhiễm trùng đơn giản trước đây ngày càng trở nên khó điều trị trong một thời gian ngắn [251]. Hơn nữa, các bệnh nhiễm trùng do các vi khuẩn gây bệnh này gây ra thường dẫn đến kết quả lâm sàng kém, bao gồm tỷ lệ tử vong cao hơn và thời gian nằm viện kéo dài I252-254]. Chúng ta có mối quan ngại chính đáng về sự xuất hiện của kháng thuốc có khả năng vượt xa tốc độ phát triển của kháng sinh mới. Trước triển vọng không sáng sủa như vậy, các bác sĩ lâm sàng hiện buộc phải sử dụng lại các loại kháng sinh cũ như là các lựa chọn điều trị (thí dụ: colistin và fosfomycin) và tích cực tìm kiếm các chiến lược mới có thể tối ưu hóa việc sử dụng các loại kháng sinh hiện có trong đó hiểu biết và áp dụng các đặc điểm dược động học (PK) và dược lực học (PD) của các nhóm kháng sinh khác nhau để làm tăng hiệu quả điều trị và giảm thiểu nguy cơ xuất hiện kháng thuốc.
Dược động (pharmacokinetic, PK) là những xem xét đánh giá về sự thay đổi nồng độ của thuốc trong một khoảng thời gian nhất định sau khi vào cơ thể. Sự thay đổi nồng độ được thể hiện từ tốc độ và quá trình hấp thu đến phân phối thuốc và cơ chế loại thải thông qua chuyển hóa hoặc bài tiết. Một số thông số PK quan trọng là (i) thể tích phân bố (volume of distribution, Vd), (ii) độ thanh thải (clearance, CL), (iii) nồng độ thuốc tối đa trong khoảng thời gian dùng thuốc (maximum or peak serum concentration, Cmax), (iv) nồng độ thuốc tối thiểu (hay còn gọi là nồng độ trũng) là nồng độ thấp nhất sau khi sử dụng một liều thuốc trước khi sử dụng liều tiếp theo (Cmin) và (v) diện tích dưới đường cong nồng độ-thời gian từ 0 đến 24 giờ (AUC0-24). Tuy nhiên, trong số này, Vd và CL, có lẽ là yếu tố có ảnh hưởng nhất trong việc xác định những thay đổi liều lượng và mức độ tiếp xúc với kháng sinh. Những thay đổi về Vd và CL của kháng sinh thường được chú ý theo dõi trên bệnh nhân nặng vì nó có tác động trực tiếp tới khả năng tiếp cận của thuốc tại khu vực bệnh lý để từ đó tạo ra hiệu quả kháng sinh.
Dược lực (pharmadynamic, PD) là những xem xét đánh giá về mối quan hệ giữa nồng độ thuốc với tác dụng dược lý của thuốc. Nói chung, mối quan hệ này thường được mô tả bằng cách liên kết nồng độ của một loại kháng sinh với nồng độ ức chế tối thiểu (MIC) tương ứng của vi khuẩn gây bệnh. Đối với kháng sinh, nồng độ thuốc tự do hoặc không liên kết chịu trách nhiệm cho hoạt tính của kháng sinh [255]. Nhiều nghiên cứu đã chứng minh rằng các loại kháng sinh khác nhau có đặc tính PD khác nhau và có thể dễ dàng phân loại như sau: (i) Thời gian nồng độ thuốc tự do duy trì trên MIC trong khoảng thời gian dùng thuốc (fT>MIC), (ii) Tỷ lệ Cmax trên MIC và (iii) Tỷ lệ AUC0-24 trên MIC.
Các chỉ số PK/PD cơ bản phản ánh hoạt tính của kháng sinh được minh họa rõ hơn trong hình 5.7. Cần lưu ý rằng AUC/MIC chưa bao giờ được xem xét trong các nghiên cứu trước đây và nhiều dữ liệu được lấy từ tài liệu cũ chỉ thiết lập mối quan hệ giữa Cmax/MIC và thông số tác dụng (effect parameter) [256]. Từ quan điểm lý thuyết, hầu hết các loại kháng sinh nên thể hiện mối quan hệ với AUC và tác dụng hơn là Cmax.
Dựa trên các chỉ số PK/PD, kháng sinh có thể được phân thành ba loại, nhìn chung thể hiện phương thức diệt khuẩn của các loại kháng sinh này [257-259]. Loại đầu tiên bao gồm các kháng sinh có sự khác biệt giữa tác dụng tối đa và tác dụng tối thiểu là tương đối lớn, và tăng nồng độ dẫn đến khả năng diệt khuẩn tăng dần. Do đó, đôi khi chúng còn được gọi là kháng sinh phụ thuộc vào nồng độ, bao gồm aminoglycoside và quinolone. Đối với những thuốc kháng sinh này, Cmax/MIC mô tả hoạt tính kháng sinh của chúng tốt nhất, AUC/MIC cũng có tương quan chặt chẽ với Cmax/MIC [260-261]. Loại thứ hai hoạt tính của kháng sinh phụ thuộc vào thời gian, chẳng hạn như như beta- lactam, có mối tương quan chặt chẽ với fT>MIC và do đó, việc kéo dài thời gian tiếp xúc với nồng độ thuốc có hiệu quả nên được ưu tiên khi sử dụng nhóm kháng sinh này [162,263]. Tuy nhiên, loại thứ ba, là một số kháng sinh như glycopeptide, phức tạp hơn, chúng có cả đặc tính diệt khuẩn phụ thuộc vào cả nồng độ và cả thời gian [263]. Như vậy, đối với loại kháng sinh này, tỷ lệ AUC0- 24/MIC mô tả hoạt tính kháng sinh tốt nhất và các ngưỡng cao hơn có liên quan chặt chẽ với thành công lâm sàng [264].

PK/PD và kháng thuốc
Hầu hết các nghiên cứu trước đây về việc tối ưu hóa liều lượng kháng sinh chỉ tập trung vào việc tối đa hóa hiệu quả điều trị lâm sàng và vi sinh chứ không chú ý tới mục tiêu giảm thiểu xuất hiện kháng thuốc. Cho đến nay, hầu hết các dữ liệu mô tả PK/PD và mối liên hệ của nó với tình trạng kháng kháng sinh đều mới chỉ đến từ các nghiên cứu tiền lâm sàng với việc áp dụng mô hình đánh giá PK/PD nhiễm trùng (PK/PD infection models). Tuy nhiên, mức độ tiếp xúc với kháng sinh cần thiết để có hiệu quả lâm sàng và ức chế được xuất hiện kháng thuốc là hai việc khác nhau rõ rệt. Thí dụ, mối quan hệ tiếp xúc-đáp ứng kháng sinh đối với hiệu quả lâm sàng là đơn chiều (quan hệ xích-ma, sigmoidal relationship) có thể hình dung là tăng lên khi mức độ tiếp xúc tăng tới một mức nhất định và ngược lại. Ngược lại, mối quan hệ giữa việc tiếp xúc với kháng sinh và việc lựa chọn các đột biến kháng thuốc rõ ràng là không đơn chiều và có hình chữ “U” ngược, trong đó các đột biến kháng thuốc gia tăng khi tiếp xúc với kháng sinh ban đầu và sau đó giảm dần khi đã tăng mức độ tiếp xúc lên đến mức tối ưu, ngưỡng cuối cùng ngăn cản được sự nhân lên của các vi khuẩn kháng thuốc [265-268]. Hình chữ U ngược dường như tuân theo một phân bố log chuẩn [269]. Jumbe và cs [270] nhận thấy với levofloxacin, ngưỡng AUC0- 24/MIC >110 là cần thiết để ức chế được P. aeruginosa kháng thuốc trong mô hình thực nghiệm nhưng ngưỡng này cao gấp đôi ngưỡng cần thiết để có hiệu quả diệt khuẩn tối ưu. Nhận xét này cũng giống một số quan sát tương tự khác, đã chỉ ra rằng mức độ các chỉ số PK/PD để tạo ra hiệu quả ức chế kháng thuốc nói chung là khác nhau và cao hơn ngưỡng cần thiết cho thành công lâm sàng [266,271-273]. Do đó, liều lượng kháng sinh chỉ nhằm mục đích tối ưu hóa hiệu quả lâm sàng có thể tiềm ẩn nguy cơ kích thích sự hình thành kháng thuốc bằng cách chọn lọc các chủng vi khuẩn đột biến giảm tính nhạy cảm với thuốc. Với kiến thức đang được nâng cao về PK/PD kháng sinh trong những năm gần đây, các giả thuyết và khái niệm quan trọng, chẳng hạn như cửa sổ lựa chọn đột biến (mutant selection window, MSW) và nồng độ phòng ngừa đột biến (mutant prevention concentrations, MPC), đã được đề xuất để đưa ra những lời giải thích tiềm năng về cách tiếp xúc với kháng sinh dưới mức tối ưu có thể làm gia tăng chọn lọc các chủng vi khuẩn kháng thuốc.
Cửa sổ chọn lọc kháng thuốc là thuật ngữ được Baquero sử dụng đầu tiên từ những năm 1990 [274,275] để mô tả một khoảng nồng độ thuốc mà khi tiếp xúc, vi khuẩn gây bệnh có thể được chọn lọc và nhân lên thành một quần thể chỉ gồm chủng kháng thuốc. Đường xác định ranh giới của khoảng nồng độ này về sau được gọi là cửa sổ chọn lọc kháng thuốc (mutant selection window, MSW) (vùng B, hình bên dưới). Vùng nồng độ thuốc có khả năng tạo ra đột biến kháng thuốc mạnh nhất là vùng nồng độ dưới MIC (vùng A). Vùng C là vùng nồng độ thuốc vừa tạo ra hiệu quả kháng sinh vừa không làm xuất hiện kháng thuốc, nồng độ thuốc phòng đột biến kháng thuốc (mutant preventation cencentration, MPC) (hình 5.8).

Ngược lại, thời gian càng dài bởi một loại kháng sinh trong vùng nồng độ này, thì cơ hội để các đột biến kháng thuốc
được chọn lọc và khuếch đại càng lớn. Viết tắt: Cmax: nồng độ thuốc tối đa; Cmin: nồng độ thuốc tối thiểu; MIC: nồng độ ức chế tối thiểu; MPC: nồng độ phòng đột biến; MSW: cửa sổ lựa chọn đột biến.
Hiểu biết về nồng độ cơ hội tạo ra kháng thuốc là rất quan trọng, tuy nhiên biết được nồng độ thuốc tại ví trí tổn thương và tác động của thuốc trên từng loại vi khuẩn là rất khó khăn và còn chưa được nghiên cứu nhiều [256]. Về cơ bản có thể hiểu thời gian nồng độ thuốc tạo ra vùng cửa sổ cơ hội kháng thuốc (tMSW) càng cao thì nguy cơ xuất hiện kháng thuốc càng lớn. Điều đáng lo ngại là trong thực hành hiện nay chúng ta chỉ quan tâm nhiều tới liều điều trị và chỉ chú ý lựa chọn liều điều trị mà không biết và vô tình bỏ qua thực hành chuẩn để tránh tạo ra MSW, từ đó đang hình thành cơ hội tạo ra kháng thuốc, ngày càng gia tăng, nhất là ở những nơi phải sử dụng kháng sinh nhiều, thí dụ ở ICU. Tuy nhiên, để biết và thực hành đạt được nồng độ thuốc MPC là không đơn giản vì trên nguyên tắc, nồng độ thuốc phải cao hơn nồng độ thuốc cần điều trị như đã đăng ký, một số thuốc không thể đạt được nồng này và nồng độ thuốc cao có thể làm gia tăng tác dụng phụ [276,277]. Trong những trường hợp như vậy, việc kết hợp hai hoặc ba loại kháng sinh có cùng đặc tính PD có thể giúp giải quyết khó khăn này.
Sử dụng nguyên tắc PK/PD để định liều và chọn phương pháp sử dụng thuốc hiệu quả trong điều trị bệnh nhân viêm phổi. Thuốc tiêu diệt vi khuẩn theo kiểu phụ thuộc vào nồng độ (thí dụ aminoglycoside) có hiệu quả tối đa liên quan đến nồng độ đỉnh cao mà chúng đạt được, so với nồng độ ức chế tối thiểu (MIC) của vi khuẩn gây bệnh đích, trong huyết thanh và tại vị trí nhiễm trùng. Điều này có thể được tối ưu hóa khi toàn bộ liều dùng trong 24 giờ được dùng dưới dạng một lần truyền [278,279]. Ngược lại, beta- lactam (như penicillin, cephalosporin, carbapenem) đạt được hiệu quả diệt khuẩn tối ưu tùy thuộc vào thời gian nồng độ duy trì trên MIC của vi khuẩn gây bệnh và điều này có thể được tối ưu hóa bằng cách sử dụng truyền kéo dài hoặc liên tục [280,281]. Thí dụ, truyền liên tục vancomycin có liên quan đến kết quả tốt hơn [282,283] trong khi liều cao hơn và truyền linezolid liên tục dẫn đến kết quả cải thiện, đặc biệt ở những bệnh nhân mắc ARDS và nhiễm trùng do vi khuẩn kháng thuốc [284,285].
Kéo dài thời gian liều và truyền liên tục
Trong một nghiên cứu trên tổng số 182 bệnh nhân điều trị tại ICU dùng piperacillin- tazobactam và meropenem đã được phân tích về nồng độ kháng sinh cho thấy truyền liên tục beta-lactam dẫn đến tỷ lệ sống sót sau 30 ngày tốt hơn đáng kể khi so sánh với chế độ liều tiêu chuẩn (86% so với 57%; p=0,012 và 73% so với 35%; p=0,0035,
tương ứng) [286]. Một nghiên cứu khác thực hiện ngẫu nhiên, nhãn mở, có đối chứng so sánh giữa truyền liên tục với truyền gián đoạn meropenem ở những bệnh nhân bị bệnh nặng cũng kết quả lâm sàng tương tự, nhưng hiệu quả vi sinh đạt vượt trội ở nhóm truyền liên tục, mặc dù liều meropenem hàng ngày cao hơn ở nhóm bệnh nhân không truyền liên tục (6g/ngày so với 4g/ngày) [287]. Một phân tích hệ thống gần đây trên các nghiên cứu RCT so sánh truyền liên tục với truyền gián đoạn beta- lactam để điều trị nhiễm trùng nặng cho thấy truyền liên tục có liên quan đến giảm tỷ lệ tử vong tại bệnh viện [288]. Tuy nhiên, trong các nghiên cứu kể trên nồng độ thuốc không được đo ở tất cả các bệnh nhân, điều này làm hạn chế xác định mối liên hệ giữa nồng độ thuốc được tối ưu hóa và kết quả trong tình huống này. Hơn nữa, truyền liên tục không mang lại kết quả tốt hơn trong một nghiên cứu RCT truyền vancomycin liên tục so với liệu pháp tiêu chuẩn ở những bệnh nhân bị nhiễm trùng nặng do MRSA [244]. Tỷ lệ tử vong đã được coi là tiêu chí tốt nhất trong các nghiên cứu lâm sàng ở ICU, nhưng trên thực tế, nó không phải lúc nào cũng là một biến số nhị phân rõ ràng vì tỷ lệ tử vong thường bị tác động bởi các yếu tố khác đã có tại thời điểm nhập viện ICU. Lý tưởng nhất trong trường hợp nghiên cứu so sánh truyền ngắt quãng với truyền liên tục, là loại trừ được bệnh nhân suy thận và chỉ bao gồm những bệnh nhân bị nhiễm trùng do vi khuẩn gây bệnh có MIC cao hơn. Hơn nữa, TDM (theo dõi thuốc điều trị, therapeutic drug monitoring) và phép đo MIC của vi khuẩn gây bệnh, nếu có thể, nên được đưa vào thiết kế nghiên cứu để từ đó liên kết tốt hơn giữa kết cục nghiên cứu với các mục tiêu dược động/dược lực học đã được đánh giá một cách đầy đủ.
Theo dõi thuốc điều trị (TDM)
TDM (therapeutic drug monitoring) dựa trên phép đo trực tiếp nồng độ kháng sinh trong huyết thanh và phản hồi kịp thời cho các bác sĩ lâm sàng, những người sau đó diễn giải kết quả theo phạm vi điều trị. Thông thường, TDM được sử dụng để giảm thiểu tác dụng độc hại, nhưng ở những bệnh nhân bị bệnh nặng, nó có thể được sử dụng để tối ưu hóa liều lượng khi dược động học bị thay đổi nghiêm trọng và không thể đoán trước. Để đạt TDM lý tưởng, nên có sẵn các giá trị MIC của kháng sinh đối với vi khuẩn tham chiếu. TDM thường quy ở bệnh nhân nặng được thực hiện nhiều nhất đối với aminoglycoside [289-292] và glycopeptide [293,294]. Nó ít được thực hiện hơn đối với beta-lactam [295], ciprofloxacin [296], linezolid [297] và colistin [298], mặc dù trên thực tế, một nghiên cứu về TDM của beta-lactam trên 236 bệnh nhân bị bệnh nặng cho thấy ba phần tư số bệnh nhân cần điều chỉnh liều, với 50% bệnh nhân cần tăng liều sau TDM đầu tiên để đạt được liều điều trị nhiễm trùng một cách tối ưu [299]. Trong một nghiên cứu quan sát trên 638 bệnh nhân bị viêm phổi bệnh viện (205, tức là trên 30% bệnh nhân được hưởng lợi từ TDM và xác định được MIC), dùng beta-lactam, aminoglycoside hoặc fluoroquinolones, xác suất có kết quả lâm sàng tốt và loại bỏ vi khuẩn gây bệnh cao hơn đáng kể ở những bệnh nhân được hưởng lợi từ TDM và xác định MIC hơn so với những người không [300]. Một nghiên cứu RCT so sánh việc sử dụng TDM với không TDM đã được thực hiện và cho thấy kết quả tốt hơn ở những bệnh nhân được hưởng lợi từ TDM của vancomycin [293]. Hơn nữa, một tổng quan hệ thống và phân tích gộp TDM của vancomycin (1 nghiên cứu RCT [293] và 5 nghiên cứu đoàn hệ) đã được thực hiện trên tổng số 521 bệnh nhân (249 được điều trị dựa trên TDM và 272 không TDM). Các tác giả nhận thấy rằng TDM của vancomycin giúp làm tăng đáng kể tỷ lệ hiệu quả lâm sàng và giảm tỷ lệ độc tính trên thận [301]. Mặc dù TDM có thể giúp đạt được các mục tiêu dược động học/dược lực học tốt hơn, nhưng việc tiếp xúc dưới mức tối ưu có thể vẫn tồn tại. Thay vì điều chỉnh liều chỉ dựa trên TDM và đánh giá lâm sàng, có thể dự đoán liều chính xác hơn bằng cách áp dụng các mô hình dược động học dân số. Các mô hình này mô tả mối quan hệ giữa liều lượng, nồng độ trong huyết thanh và các biến số lâm sàng trong một quần thể bệnh nhân cụ thể. Thông tin dược động học tham chiếu từ mô hình này có thể được sử dụng để ước tính các thông số dược động học của một bệnh nhân cụ thể bằng cách sử dụng các biến số lâm sàng và sau đó đưa ra dự đoán liều chính xác cho bệnh nhân [302]. Do vậy, độ chính xác của dự đoán liều sẽ phụ thuộc vào chất lượng của mô hình dược động học dân số. Nếu mô hình không mô tả chính xác nhóm bệnh nhân cụ thể, dự đoán liều lượng sẽ không chính xác. Cuối cùng, TDM cũng có thể được sử dụng rất đặc biệt để hướng dẫn điều trị nhiễm trùng do vi khuẩn gây bệnh rất kháng thuốc, như được minh họa trong một nghiên cứu loạt ca gồm 15 bệnh nhân bị bệnh nặng được điều trị bằng liệu pháp aminoglycoside liều cao kết hợp với liệu pháp thay thế thận liên tục. Mặc dù có những bệnh nhân bị bệnh rất nặng và bị nhiễm trùng do do vi khuẩn gây bệnh rất kháng thuốc, 6 bệnh nhân đã được xuất viện còn sống từ ICU [303].
PK/PD của một số thuốc điều trị cụ thể
Quinolones
Quinolon cơ bản là kháng sinh ưa mỡ và có đặc tính diệt khuẩn chủ yếu phụ thuộc vào nồng độ nhưng có một số tác dụng phụ thuộc vào thời gian. Các nghiên cứu in vitro trước đây đã chỉ ra rằng việc đạt được tỷ lệ Cmax/MIC ít nhất từ 8 đến 12 là rất quan trọng đối với hoạt tính diệt khuẩn tối ưu [304,305]. Với thời gian bán hủy của hầu hết các quinolone, tỷ lệ này cũng tương ứng với các giá trị AUC0-24/MIC và có mối tương quan với hiệu quả điều trị. Tuy nhiên, điều quan trọng hơn là chỉ số AUC0-24/MIC này cũng có liên quan đến việc giảm các đột biến kháng thuốc trong một số nghiên cứu thực nghiệm [306-308]. Một số nghiên cứu cho thấy tỷ lệ AUC0-24/MIC rất quan trọng đối với tác dụng diệt khuẩn của thuốc, thậm chí còn có ý nghĩa hơn so với tỷ lệ Cmax/MIC, và tỷ lệ >125 đã được ủng hộ cho thành công lâm sàng trong điều trị nhiễm trùng Gram âm và >30 với Gram dương [307,309-313]. Trong bối cảnh nguy cơ xuất hiện kháng thuốc, có mối quan hệ nghịch giữa AUC0- 24/MIC và khả năng phát triển kháng thuốc đã được nhận thấy [314]. Theo đó, chế độ dùng thuốc quinolone đảm bảo tỷ lệ AUC0- 24/MIC cao hơn hiện được khuyến cáo để tối đa hóa tiếp xúc kháng sinh với hiệu quả diệt khuẩn và đồng thời cũng như giảm thiểu sự phát triển kháng thuốc [267,270,314]. Một số nghiên cứu đã làm sáng tỏ thêm các ngưỡng AUC0-24/MIC quan trọng nằm trong khoảng từ >100 đến 200 để ngăn chặn sự hình thành các đột biến kháng thuốc khi các kháng sinh này được sử dụng điều trị nhiễm trùng Gram âm [270,314,316]. Tuy nhiên, do sự khác biệt phổ tác dụng giữa các quinolone với lựa chọn các chủng kháng thuốc, tỷ lệ AUC0-24/MIC được đề xuất để ức chế kháng thuốc có thể khác nhau giữa các tác nhân riêng lẻ [307,317]. AUC0-24/MPC cũng đang được nghiên cứu và những ưu điểm so với AUC0-24/MIC trong việc dự đoán sự phát triển kháng thuốc đã được ghi nhận trong một số nghiên cứu in vitro [318-320] mặc dù nhiều tác giả vẫn cho rằng cả hai các chỉ số tương tự nhau về khả năng dự đoán phát triển kháng thuốc [321,322]. Tuy nhiên, tỷ lệ AUC0-24/MPC cao hơn có liên quan đến việc giảm thiểu sự xuất hiện kháng thuốc. Gần đây, sự quan tâm và nỗ lực ngày càng tăng đã tập trung vào việc áp dụng khái niệm MSW trong việc đánh giá các chế độ dùng thuốc quinolone. Dựa trên dữ liệu hiện tại, tMSW là 30% sẽ hạn chế đột biến và chỉ số này đã được nghiên cứu trong một số nghiên cứu in vitro I323,324] và in vivo I321,325]. Quan trọng hơn, nguy cơ lựa chọn xuất hiện các chủng A. baumannii và P. aeruginosa kháng thuốc là rất cao với các phác đồ được khuyến cáo, do đó việc lựa chọn liều phù hợp thuốc ở những bệnh nhân bị bệnh nặng là rất thách thức. Khi điều trị vi khuẩn gây bệnh có MIC cao, nên cân nhắc tăng liều trong khi phải chú ý quan sát khả năng xảy ra các tác dụng phụ liên quan đến liều.
Aminoglycosides
Aminoglycoside có bản chất ưa nước và chúng thể hiện các đặc tính diệt khuẩn phụ thuộc vào nồng độ. Mặc dù các nghiên cứu trước đây chủ yếu gợi ý rằng việc đạt được tỷ lệ Cmax/MIC cao dự đoán kết quả tối ưu, Craig lập luận rằng tỷ lệ AUC0-24/ MIC sẽ phù hợp hơn trong việc mô tả hoạt động của kháng sinh này [263]. Điều quan trọng là có mối quan hệ đồng tuyến (collinearity) cao giữa Cmax và AUC. Trên cơ sở này, một số nghiên cứu đã gợi ý rằng tỷ lệ AUC0-24/MIC có nhiều khả năng là một công cụ mô tả PD “tốt hơn” cho hoạt tính của aminoglycoside [258,326] trong đó tỷ lệ AUC0-24/MIC từ 80 đến 160 đã được ủng hộ cho hiệu quả của thuốc [326,327]. Mặc dù nồng độ cao hơn giúp tăng cường hoạt tính của aminoglycoside, nhưng việc tiếp xúc kéo dài với nồng độ như vậy có thể dẫn đến độc tính của thuốc cũng như sự phát triển của vi khuẩn kháng thuốc. Loại đề kháng này được gọi là đề kháng thích ứng (adaptive resistance), kiểu đề kháng chậm nhưng vẫn xảy ra không phụ thuộc vào nồng độ [328-330]. Việc tối đa hóa tỷ lệ Cmax/MIC dường như làm giảm sự phát triển của kháng thuốc thích ứng nêu trên và mục tiêu này có thể đạt được bằng cách kéo dài thời gian của liều một lần/ngày (extended daily dosing, EDD) thay vì sử dụng thuốc nhiều lần (hai hoặc ba liều/ngày) [330]. Trong một nghiên cứu mô hình PD được thiết kế để dự đoán hoạt tính của aminoglycoside đối với A. baumannii và P. aeruginosa, Tam và cs đã định lượng tỷ lệ Cmax/MIC cần thiết để ngăn chặn sự phát triển kháng thuốc [331]. Trong nghiên cứu này, tỷ lệ Cmax/MIC là 20 chế độ liều một lần mỗi ngày với amikacin và 30 đối với chế độ liều mỗi 12 giờ với gentamicin là cần thiết để ức chế A. baumannii và P. aeruginosa tái phát triển trở lại. Dựa trên những kết quả này, có thể suy ra rằng các tỷ lệ Cmax/MIC và AUC0-24/MIC là các chỉ số PD cần xem xét để ức chế các đột biến kháng A. baumannii và P. aeruginosa tương ứng. Dựa trên dữ liệu có sẵn, EDD, thay vì sử dụng nhiều liều aminoglycoside hàng ngày, hiện đang được ủng hộ nhằm tối đa hóa tiềm năng điều trị của chúng và giảm thiểu sự phát triển kháng thuốc. Hơn nữa, nhiều nghiên cứu lâm sàng [332,333] và một số phân tích gộp [334,335] đã cho thấy khuyến cáo về liều lượng thực sự là phù hợp và có giá trị trong việc giảm độc tính của aminoglycoside và có thể làm tăng khả năng điều trị thành công. Dữ liệu lâm sàng về những ảnh hưởng của liều lượng đối với sự phát triển của kháng thuốc này hiện vẫn còn rất ít [256].
Beta-lactams
Các kháng sinh beta-lactam gồm penicillin, cephalosporin, monobactam và carbapenem. Do đặc tính phổ và PD khác nhau, carbapenem sẽ được đề cập tới riêng, trong phần sau. Các kháng sinh beta-lactam thường có bản chất ưa nước và thể hiện các đặc tính diệt khuẩn phụ thuộc vào thời gian. Tỷ lệ phần trăm fT>MIC (%fT>MIC) được coi là chỉ số PD tối ưu cho hoạt động của thuốc và do đó, việc duy trì thời gian tiếp xúc với nồng độ thuốc hiệu quả (trên MIC) nên là ưu tiên hàng đầu khi sử dụng nhóm kháng sinh này. Hiện nay, với nhóm thuốc này, khuyến cáo MIC cần thiết cho tác dụng diệt khuẩn được đề xuất lần lượt là 50, 60-70 và 40% đối với penicillin, cephalosporin và carbapenem [336,337]. Ngoài ra, ngược lại với vi khuẩn Gram dương, mức tiếp xúc fT>MIC cần cao hơn để đạt được tối đa hoạt tính chống lại vi khuẩn Gram âm. Tuy nhiên, các dữ liệu từ nghiên cứu lâm sàng trên những bệnh nhân bị bệnh nặng còn chưa nhất quán trong nhận định này [256]. Người ta cũng đã chứng minh rằng hoạt động diệt khuẩn đạt mức tối đa khi nồng độ thuốc được duy trì ở mức gấp 4 đến 5 lần MIC, với nồng độ cao hơn nồng độ trên cũng chỉ mang lại ít lợi ích thêm [338- 340]. Do đó, có ý kiến cho rằng nồng độ beta- lactam nên được duy trì ít nhất gấp 4 đến 5 lần MIC trong khoảng thời gian một liều thuốc để đảm bảo thành công về mặt lâm sàng, đặc biệt ở những bệnh nhân bị bệnh nặng [341]. Vẫn chưa thể kết luận liệu chỉ số fT>MIC có dự đoán tình trạng kháng beta- lactam hay không, mặc dù đã có mối liên hệ tiềm năng được mô tả trong một số nghiên cứu thực nghiệm in vitro [273] và in vivo [342,343]. Fantin và cs đã sử dụng mô hình động vật in vivo để gợi ý rằng sự phát triển tính kháng đối với ceftazidime có thể phát sinh nếu nồng độ thuốc giảm xuống dưới MIC trong hơn một nửa khoảng thời gian dùng thuốc [343]. Nguy cơ xuất hiện đề kháng với cephalosporin cũng có liên quan đến tỷ lệ AUC0-24/MIC thấp [344]. Điều này đã được chứng minh thêm bởi Stearne và cs khi phát hiện ra rằng AUC0-24/MIC là 1.000 là cần thiết với ceftizoxime để ngăn chặn sự xuất hiện của các chủng Enterobacter cloacae kháng thuốc [269]. Trong một mô hình thực nghiệm nhiễm trùng phổi ở chuột khác, Goessens và cs đã phát hiện rằng sự phát triển của các chủng E. cloacae kháng thuốc có mối tương quan với tMSW của ceftazidime kéo dài [346]. Dựa trên dữ liệu còn hạn chế về ức chế xuất hiện đề kháng, việc sử dụng liều beta-lactam nhắm đến nồng độ cao hơn 4 lần MIC trong thời gian dài sẽ là phù hợp nhất [347]. Điều quan trọng là mục tiêu như trên có thể đạt được thông qua cách sử dụng tiêm kéo dài hoặc bằng truyền liên tục. Tuy nhiên, các kế hoạch chia nhỏ liều này có khả năng dẫn đến sự xuất hiện của kháng thuốc do liều lượng dưới mức tối ưu, ít nhất là về lý thuyết, vì những cách tiếp cận này có xu hướng làm tăng tMSW beta-lactam. Trong một mô hình in vitro, gây nhiễm trùng trên mô hình sợi rỗng (hollow-fiber infection model, HFIM) gần đây với P. aeruginosa, Felton và cs cho rằng truyền TM kéo dài (truyền tĩnh mạch kéo dài trong thời gian 3-4 giờ, extended infusion, EI) piperacillin/ tazobactam tương đương với sử dụng liều bolus ngắt quãng nếu xét về tác dụng diệt khuẩn và ngăn ngừa kháng thuốc [348]. Tuy nhiên, nồng độ mục tiêu cho hai phương pháp phải khác nhau, trong đó tỷ lệ Cmin/MIC là 10,4 là yêu cầu của truyền kéo dài và 3,4 đối với bolus ngắt quãng để ngăn chặn các đột biến kháng thuốc.
Carbapenem
Nhìn chung, carbapenem có các đặc điểm PK/PD tương tự khi so sánh với các kháng sinh nhóm beta-lactam khác. Một số nghiên cứu cho rằng không giống như các beta- lactam khác, carbapenem có tác dụng hậu kháng sinh (thuật ngữ PK để chỉ khoảng thời gian vi khuẩn sau khi tiếp xúc với kháng sinh vẫn tiếp tục không phát triển ngay cả kháng sinh đã được loại bỏ hoàn toàn, postantibiotic effect, PAE) với trực khuẩn Gram âm, bao gồm các chủng P. aeruginosa [349] mặc dù điều này lại không được xác nhận trong một nghiên cứu khác [350]. Đặc tính PAE này của carbapenem có thể giải thích %fT>MIC ngắn hơn vẫn có hoạt tính diệt khuẩn tối ưu. Li và cs tiếp tục định lượng %fT>MIC là >54% để đạt được kết quả vi sinh tối ưu khi sử dụng meropenem ở những bệnh nhân bị nhiễm trùng đường hô hấp dưới [339]. Ngoài ra, các tác giả cũng chỉ thấy tỷ lệ Cmin/MIC >5 mới có liên quan có ý nghĩa với hiệu quả lâm sàng và vi khuẩn trên bệnh nhân trong nghiên cứu này. Hơn nữa, Tam và cs đã sử dụng mô hình HFIM thực nghiệm trên súc vật thí nghiệm để chứng minh rằng Cmin/MIC >6,2 là cần thiết để ngăn chặn sự phát triển của các đột biến P. aeruginosa kháng thuốc [340]. Cũng với nhóm tác giả nghiên cứu trên sau đó đã xác nhận kết luận trên và cho thấy %fT>MIC >40% cũng liên quan đến việc lựa chọn các thể đột biến kháng thuốc [351]. Trong một mô hình thực nghiệm với doripenem, Zinner và cs đã phát hiện các thể đột biến P. aeruginosa kháng thuốc có khả năng xảy ra chọn lọc ở nồng độ thuốc giảm >45% trong vùng MSW (>45% tMsW).
Tương tự như các kháng sinh beta-lactam khác, việc duy trì nồng độ carbapenem ở mức gấp 4 đến 6 lần MIC trong thời gian dài hiện đang được ủng hộ để ngăn chặn chọn lọc các thể đột biến kháng thuốc. Để đạt được mục tiêu này, việc kéo dài thời gian truyền thường được khuyến cáo khi sử dụng kháng sinh. Tuy nhiên, truyền tĩnh mạch kéo dài (extended infusion, EI) thay vì truyền liên tục (continuous infusion, CI) là phương pháp được ưa thích hiện nay khi sử dụng carbapenems do tính không ổn định vốn có của thuốc trong nhóm ưa nước [256]. Có ngày càng nhiều thông tin và dữ liệu mới xuất hiện nhấn mạnh sự khác biệt rõ ràng về độ ổn định giữa các thành viên của nhóm carbapenem. Hiện tại không có lý do thực tế nào để phản đối việc truyền meropenem liên tục, vì nó đã được sử dụng thành công với cách truyền trong 8 giờ (trong môi trường bệnh viện) từ nhiều nghiên cứu lâm sàng mà không có báo cáo về sự không ổn định hoặc thoái giáng của thuốc, trong khi imipenem thực sự kém ổn định hơn [353-355].
Trong một nghiên cứu thực nghiệm với mô hình HFIM về khả năng diệt vi khuẩn và ức chế kháng thuốc đối với ba chủng P. aeruginosa, Louie và cs đã chứng minh rằng phác đồ dùng liều doripenem 1g truyền trong 4 giờ là phác đồ duy nhất có khả năng ức chế hoàn toàn kháng thuốc trong toàn bộ thời gian 10 ngày đối với các chủng hoang dại [356]. Điều quan trọng là, trong nghiên cứu khác, các tác giả cũng cho thấy phác đồ thuốc tạo ra nồng độ >6,2 lần MIC có liên quan có ý nghĩa đến việc ức chế kháng thuốc tối đa [273,352]. Ngoài ra, Chastre và cs cũng quan sát thấy tỷ lệ xuất hiện các chủng P. aeruginosa kháng thuốc thấp hơn ở những bệnh nhân viêm phổi thở máy được điều trị bằng truyền tĩnh mạch kéo dài doripenem so với những bệnh nhân được điều trị imipenem liều quy ước trong một nghiên cứu RCT đa trung tâm.
Vancomycin
Vancomycin là kháng sinh nhóm glycopeptide và là một loại thuốc tương đối ưa nước. Một số nghiên cứu in vitro [358’359] và in vivo trên động vật [360] gợi ý rằng hoạt tính diệt khuẩn của kháng sinh phụ thuộc vào thời gian, trong khi một số nghiên cứu cho thấy tỷ lệ Cmax/MIC cũng quan trọng [361]. Gần đây, người ta chấp nhận rằng đạt được tỷ lệ cao của AUC0-24/MIC sẽ có tính dự báo cao hơn về thành công lâm sàng. Các nghiên cứu của Moise-Broder và cs nhận thấy tỷ lệ AUC0-24/MIC >400 là cần thiết để đạt được kết quả tối ưu lâm sàng và vi khuẩn học khi điều trị bệnh nhân bị nhiễm trùng hô hấp do s. aureus [264,362]. Các phát hiện này phù hợp với đánh giá hồi cứu của Zelenitsky và cs và họ cũng mô tả rằng cần có mức tiếp xúc với thuốc cao hơn, cụ thể là tỷ lệ AUC0-24/MIC >578, khi điều trị cho bệnh nhân bị sốc nhiễm trùng nặng [363]. Do thực hành lâm sàng phổ biến là đo nồng độ trũng khi sử dụng vancomycin, nồng độ trũng nằm trong khoảng từ 15 đến 20 mg/l được khuyến cáo để có kết quả tối ưu trong viêm phổi bệnh viện và nhiễm trùng phức tạp [217,133]. Mặc dù có rất ít dữ liệu nhưng cũng có thể cho rằng phát triển kháng vancomycin sẽ kết hợp khi tiếp xúc với thuốc dưới mức tối ưu. Thông qua mô hình PD in vitro, Tsuji và cs đã kết luận rằng sự phát triển của các chủng s. aureus nhạy cảm trung gian (VISA) với vancomycin được thúc đẩy khi tiếp xúc với vancomycin dưới mức tối ưu nếu s. aureus có điều hòa gen (accessory gene regulator, agr) bị rối loạn chức năng [364]. Ngoài ra, các nghiên cứu cũng nhận thấy rằng tỷ lệ AUC0-24/MIC cần thiết để ngăn chặn tình trạng kháng thuốc trên các chủng vi khuẩn này cao gấp 4 lần so với tỷ lệ ở các chủng bố mẹ. Charles và cs cũng đã nhận thấy VISA xuất hiện trên bệnh nhân khi nồng độ trũng vancomycin thấp (nghĩa là <10 mg/l) [365]. Dựa trên những phát hiện tương tự của một số tác giả [161,3661, một tài liệu hướng dẫn dựa trên đồng thuận của Hoa Kỳ (năm 2009) khuyến cáo nồng độ trũng của vancomycin nên được duy trì trong khoảng từ 15 đến 20 mg/l mọi lúc để ngăn chặn sự xuất hiện kháng thuốc [217]. Vì vậy, nên cân nhắc sử dụng liều nạp từ 25 đến 30 mg/kg ở những bệnh nhân bị bệnh nặng để nhanh chóng đạt được nồng độ mục tiêu. Và để chắc chắn, liều vancomycin cao hơn, lên đến 40 mg/kg, có thể rất quan trọng để giảm thiểu sự phát triển đề kháng. Ngoài ra, liều lượng vượt quá 5g/ngày được ước tính là cần thiết để đạt được tỷ lệ AUC0-24/MIC mục tiêu khi điều trị nhiễm trùng VISA [367]. Khi cần sử dụng liều cao, luôn cần sự cân nhắc giữa độc tính thuốc và làm giảm khả năng đề kháng thuốc.
Linezolid
Linezolid thuộc nhóm oxazolidinones, được phát triển để điều trị nhiễm trùng Gram dương. Trong một mô hình lây nhiễm ở chuột, Andes và cs đã chứng minh rằng hoạt tính tối ưu của linezolid tương quan tốt với tỷ lệ AUC 0-24/MIC, với tỷ lệ từ 50 đến 80 dự đoán khả năng điều trị thành công [368] Tuy nhiên, tỷ lệ thành công lâm sàng cao hơn có thể đạt được ở tỷ lệ AUC0-24/MIC từ 80 đến 120 đối với nhiễm khuẩn huyết, nhiễm trùng đường hô hấp dưới và nhiễm trùng cấu trúc da theo ghi nhận của Rayner và cs [369]. Các nghiên cứu cũng chỉ ra rằng mức độ tiếp xúc với thuốc cần thiết để đạt được kết quả điều trị tối ưu cũng phụ thuộc vào vị trí và các loại nhiễm trùng. Ngoài ra, khả năng điều trị thành công có thể có khi nồng độ linezolid duy trì được ở mức trên MIC trong toàn bộ khoảng thời gian dùng thuốc. Phát hiện này đã chứng thực hai mô hình nghiên cứu viêm nội tâm mạc ở thỏ trước đó, mô hình này mô tả linezolid là loại kháng sinh phụ thuộc vào thời gian trong đó fT>MIC 40% là cần thiết để đạt được hoạt tính kháng sinh tối ưu [368,370]. Hiện tại, liều 600 mg trong 12 giờ được đề xuất để đạt được các chỉ số hiệu quả PD như trên và do đó, dự đoán kết quả điều trị thành công. Tuy nhiên, cũng cần phải nhấn mạnh rằng PK của kháng sinh này rất hay thay đổi [255,350,371-373], đặc biệt ở những bệnh nhân bị nhiễm trùng nặng, và hiện tượng này một phần đã góp phần vào thất bại điều trị cũng như gia tăng các tác dụng phụ ở nhóm bệnh nhân bị nhiễm trùng nặng [369,374]. Như vậy, sẽ là cần thiết theo dõi thuốc điều trị (TDM) khi sử dụng linezolid và dữ liệu mới gần đây cho thấy rằng TDM nói chung có thể tối ưu hóa kết quả điều trị khi sử dụng linezolid cho những bệnh nhân bị nhiễm trùng nặng. Trong bối cảnh kháng kháng sinh, linezolid liều thấp (200 mg mỗi 12 giờ) có liên quan đến sự phát triển của các chủng E. faecium và E. Faecalis kháng thuốc [375]. Ngoài ra, việc tiếp xúc trước đó và sử dụng linezolid kéo dài được cho là làm tăng khả năng phát triển kháng thuốc [376-378]. Tuy nhiên, sự phát triển kháng thuốc kháng sinh này còn chưa phổ biến [379,380]
Daptomycin
Daptomycin là thành viên đầu tiên được phê duyệt của các lipopeptide vòng có hoạt tính mạnh chống lại các gen gây bệnh Gram dương bao gồm MRSA và cầu khuẩn đường ruột kháng vancomycin. Các nghiên cứu in vivo mô tả daptomycin là một loại kháng sinh phụ thuộc vào nồng độ. Tỷ lệ Cmax/MIC phối hợp với AUC0-24/MIC tương quan với hiệu quả của nó trong một số nghiên cứu in vivo trên động vật [381-383]. Trong mô hình gây nhiễm trùng thực nghiệm, tỷ lệ Cmax/MIC và AUC0-24/MIC cần thiết cho quá trình kìm khuẩn nằm trong khoảng từ 59-94 và 388-537 (tổng nồng độ thuốc) [381]. Các tỷ lệ tương tự để tạo ra được kìm khuẩn cũng đã được ghi nhận trong hai nghiên cứu lâm sàng khác trên người tình nguyện khỏe mạnh [384,385]. Dựa trên các chỉ số được đề xuất này, có thể mong đợi mức tiếp xúc daptomycin tối ưu ở hầu hết các bệnh nhân với liều vừa phải (4- 6 mg/kg/ngày). Tuy nhiên, sự xuất hiện của các chủng kháng daptomycin đã được báo cáo với chế độ dùng liều như vậy [386,387] và một số chuyên gia khuyến cáo sử dụng liều cao hơn để hạn chế xuất hiện kháng thuốc (thí dụ: 8-12 mg/kg/ngày) [388] đã được chứng minh là an toàn trong một nghiên cứu đánh giá hồi cứu [389] và một số báo cáo loạt ca [390,391]. Thời gian điều trị kéo dài hơn 2 tuần cũng đã được ghi nhận làm tăng khả năng kháng daptomycin [387].
Fosfomycin
Fosfomycin, được phát hiện cách đây trên 50 năm nhưng sau đó bị lãng quên, là một dẫn xuất của a-xít phosphonic có hoạt tính in vitro đầy hứa hẹn chống lại K. pneumoniae kháng carbapenem [392]. Việc đưa fosfomycin vào kho kháng sinh để điều trị nhiễm trùng đã được chào đón, nhưng với một số hoài nghi do những thất bại lớn trong đánh giá in vitro ban đầu nên ít nhiều đã góp phần làm hạn chế chấp nhận sử dụng thuốc trong lâm sàng. Mặc dù có ý kiến cho rằng khả năng diệt vi khuẩn của fosfomycin dường như được thúc đẩy bởi fT>MIC, nhưng chỉ số PK/PD tối ưu liên quan đến hoạt động của thuốc vẫn cần được xác lập và cần điều tra thêm [393]. Ngoài ra, quá trình diệt khuẩn nhanh đã được quan sát thấy từ một số nghiên cứu thời gian diệt khuẩn tĩnh (static-time kill study). Khả năng diệt khuẩn của thuốc ở nồng độ thuốc khi được duy trì ở mức cao hơn MIC từ 2 đến 8 lần. Tương tự như các beta-lactam, sự phát triển kháng fosfomycin được thúc đẩy bởi mức độ tiếp xúc thuốc ở nồng độ thấp và thời gian điều trị bằng kháng sinh kéo dài [394]. Cũng có một số tranh luận liên quan đến sự phát triển nhanh của tình trạng kháng fosfomycin khi thuốc được sử dụng như một liệu pháp đơn trị liệu, đặc biệt là ở nhiễm trùng đường tiết niệu. Trong một mô hình viêm nội tâm mạc ở chuột, Thauvin và cs đã phát hiện rằng sự kết hợp giữa fosfomycin và pefloxacin có hiệu quả hơn trong việc ngăn chặn sự xuất hiện các chủng s. aureus kháng thuốc khi so sánh với fosfomycin đơn độc [395]. Trong một số nghiên cứu thực nghiệm in vitro và in vivo, các trường hợp hiệp đồng kháng MRSA cũng đã được chứng minh khi fosfomycin được kết hợp với beta-lactam [396,397], linezolid [398] và moxifloxacin [399]. Kết hợp fosfomycin với beta-lactam cũng được ủng hộ mạnh mẽ bởi dữ liệu nghiên cứu in vitro cho thấy có tác dụng hiệp đồng của hai loại kháng sinh này kháng với P. aeruginosa [400-402]. Tuy nhiên, liệu sự phối hợp trên in vitro có giúp tăng hiệu quả lâm sàng hay không vẫn còn phải chứng minh. Trong một nghiên cứu tiến cứu cho thấy fosfomycin kết hợp với colistin, gentamicin, hoặc piperacillin/tazobactam, đã cho kết quả đầy hứa hẹn về vi khuẩn học và lâm sàng trong điều trị ở 11 bệnh nhân nguy kịch mắc các bệnh nhiễm trùng mắc phải tại ICU do K. pneumoniae kháng carbapenem [403]. Dựa trên dữ liệu lâm sàng hạn chế trong điều trị nhiễm trùng nặng ở ICU và xu hướng phát triển kháng thuốc cao, fosfomycin không nên được sử dụng như một trị liệu đơn lẻ và việc lựa chọn kháng sinh kết hợp nên được đánh giá một cách thích hợp trong các nghiên cứu tiếp theo.
Colistin
Colistin là kháng sinh thuộc nhóm polymyxin, được dùng đường tiêm dưới dạng colistin methanesulfonate (CMS). Loại kháng sinh này có các đặc tính diệt khuẩn phụ thuộc vào nồng độ với PAE in vitro đáng kể chống lại vi khuẩn gây bệnh Gram âm [404]. Các nghiên cứu in vivo trên chuột cho thấy chỉ số PD có thể dự đoán tốt nhất cho hoạt tính trên vi khuẩn, đặc biệt là đối với A. baumannii và P. aeruginosa, là AUC0- 24/MIC [405,406]. Dựa trên các nghiên cứu thực nghiệm nhiễm trùng phổi, tỷ lệ AUC0- 24/MIC trong khoảng từ 50 đến 65 đã được đề xuất là mục tiêu PD tối ưu [407]. Hiện tượng dị kháng, tình huống trong đó các phân nhóm kháng thuốc xuất hiện trong một chủng được coi là nhạy cảm dựa trên MIC, là một vấn đề mới nổi đối với kháng sinh và đã được quan sát thấy ở các chủng A. baumannii [408,409], K. pneumoniae [410] và P. aeruginosa từ các phân lập lâm sàng [411]. Ngoài ra, sự hình thành đột biến kháng thuốc nhanh chóng đã được chứng minh sau khi tiếp xúc với colistin trong hai nghiên cứu PK/PD in vitro gần đây phỏng theo chế độ dùng thuốc lâm sàng ở người [412,413]. Điều này đặc biệt đáng lo ngại vì Garonzik và cs cho rằng chế độ dùng thuốc CMS được khuyến cáo hiện nay là không tối ưu ở một phân tích PK trên một quẩn thể 105 bệnh nhân bị bệnh nặng [414] và những phát hiện này đã được chứng thực bởi các nghiên cứu khác với số lượng bệnh nhân ít hơn [415,416]. Với hiểu biết về PK của colistin ngày càng tốt hơn, Garonzik và cs [414] và Plachouras và cs [416] đã mô tả thêm các chế độ dùng thuốc CMS đạt được tối ưu trên những các mức độ chức năng thận khác nhau. Liều lượng do Plachouras và cs đề xuất hiện đã được Dalfino và cs xác nhận trong điều kiện chăm sóc tích cực điều trị các trường hợp nhiễm trùng MDR [417]. Một trong số các khuyến cáo liên quan đến liều CMS là cần có liều tải (loading dose) ban đầu, vì việc chuyển đổi thuốc từ dạng tiền chất sang dạng hoạt động của colistin rất chậm và do vậy nồng độ tạo ra tiếp xúc đầy đủ với colistin có thể bị trì hoãn trong vài ngày. Mặc dù về mặt lý thuyết là hợp lý dựa trên các đặc tính PD của thuốc, nhưng việc áp dụng kéo dài thời gian liều hàng ngày (extended daily dosing, EDD) không phù hợp do nồng độ colistin thấp kéo dài dẫn đến hình thành tính dị kháng í405’406’412]. Dựa trên dữ liệu dược động học hiện tại của bệnh nhân bị bệnh nặng í414-416’418’419] và in vivo từ các nghiên cứu thực nghiệm PK/PD í405’406], đơn trị liệu bằng colistin sẽ không có lợi trong việc đạt được hiệu quả trị liệu tối đa và ngăn ngừa kháng thuốc, đặc biệt ở những bệnh nhân có chức năng thận từ trung bình đến tốt và đối với vi khuẩn gây bệnh có MIC >1. Ngoài ra, một đợt điều trị kéo dài hơn 12 ngày đã được phát hiện là có liên quan đến sự phát triển kháng colistin trong hai nghiên cứu lâm sàng.
Thời gian sử dụng kháng sinh và kháng thuốc
Càng ngày càng nhiều các nghiên cứu tiền lâm sàng chứng minh rằng việc sử dụng kháng sinh kéo dài có thể đóng một vai trò quan trọng trong việc hình thành các đột biến kháng thuốc. Liệu pháp kháng sinh càng kéo dài thì càng khó ngăn chặn sự xuất hiện của vi khuẩn kháng thuốc. Có ý kiến cho rằng một phác đồ kháng sinh chỉ kéo dài trong 4 đến 5 ngày là đủ để tạo ra tác dụng diệt khuẩn tối đa đi kèm với lợi ích bổ sung là ức chế đề kháng. Kéo dài thời gian tiếp xúc với kháng sinh hơn 10 ngày là rất rủi ro trên cơ sở phát triển kháng thuốc, do vậy cần phải tăng cao hơn mức độ tiếp xúc của thuốc với vi khuẩn gây bệnh để ngăn chặn các đột biến kháng thuốc. Trong tình huống này, nếu không đạt được ngưỡng cao hơn thông thường, thất bại trong điều trị sẽ xảy ra khi quần thể kháng thuốc chiếm ưu thế. Hiện tượng này đã được Tam và cs mô tả trong mô hình nhiễm s. aureus in vitro. Mô hình này nghiên cứu hai phác đồ dùng liều garenoxin khác nhau. Một phác đồ có tỷ lệ AUC0-24/MIC là 280 và phác đồ kia là 100 [271]. Các tác giả của nghiên cứu đã chứng minh rằng một khi thời gian phơi nhiễm garenoxin tăng lên quá 5 ngày’ liều lượng cần thiết để có thể ức chế các đột biến kháng thuốc cũng tăng lên. Phác đồ dùng liều cao hơn có thể ngăn chặn gia tăng kháng thuốc trong 10 ngày’ trong khi phác đồ dùng liều thấp chỉ chứng minh được khả năng này trong 4 đến 5 ngày.
Thông lệ phổ biến về sử dụng kháng sinh trong 10 đến 14 ngày hiện nay dựa trên dữ liệu hạn chế và ý kiến chuyên gia hơn là cách tiếp cận dựa trên bằng chứng. Tuy nhiên, đối với một số bệnh nhiễm trùng sâu như viêm tủy xương và viêm nội tâm mạc’ việc dùng kháng sinh kéo dài là rất cần thiết. Các thí dụ về lợi ích tiềm năng từ việc rút ngắn thời gian điều trị bằng kháng sinh để làm giảm sự xuất hiện của kháng thuốc trong khi vẫn duy trì hiệu quả lâm sàng ngày càng được ghi nhận í213’422-424]. Trong số những phát hiện này, Singh và cs đã chứng minh rằng những bệnh nhân được điều trị bằng kháng sinh trong thời gian ngắn hơn (tức là <3 ngày) đã giảm thời gian nằm ICU’ tỷ lệ bội nhiễm và kháng thuốc thấp hơn, cũng như tỷ lệ tử vong thấp hơn so với những bệnh nhân được điều trị theo liệu trình tiêu chuẩn [424]. Còn cần các nghiên cứu sâu hơn để làm sáng tỏ thời gian điều trị chính xác giúp tối đa hóa kết quả điều trị và ngăn chặn sự phát triển kháng thuốc. Cho đến khi có kết luận cuối cùng’ liệu pháp kháng sinh nên “đánh mạnh” vào giai đoạn đầu của nhiễm trùng và “chấm dứt sớm” để hỗ trợ phòng ngừa kháng thuốc.
Tiếp cận liều theo PK/PD
Có 2 thuật ngữ dễ nhầm lẫn trong sử dụng thuốc để đạt PK/PD tối ưu: Liều tải (tạm dịch từ loading dose) và liều nạp (tạm dịch từ bolus). Liều tải và liều nạp đều là thuật ngữ được sử dụng để mô tả một liều thuốc duy nhất được cung cấp cho bệnh nhân, nhưng chúng có ý nghĩa và mục đích khác nhau. Liều tải là liều cao hơn ban đầu của một loại thuốc được đưa ra khi bắt đầu một đợt điều trị để nhanh chóng đạt được mức độ điều trị mong muốn của thuốc trong cơ thể. Một liều tải thường được theo sau bởi một liều duy trì thấp hơn được cung cấp thường xuyên để giữ mức thuốc ổn định. Liều tải hữu ích nhất đối với các loại thuốc có thời gian bán hủy dài, nghĩa là chúng được loại bỏ khỏi cơ thể một cách từ từ. Trong khi liều nạp là tiêm nhanh dung dịch thuốc vào tĩnh mạch, thường trong vòng vài giây hoặc vài phút. Một liều nạp được đưa ra để đạt được tác dụng nhanh chóng của thuốc, chẳng hạn như trong các tình huống khẩn cấp hoặc khi cần nồng độ cao nhất của thuốc. Một liều nạp có thể hoặc không được tiếp tục bằng truyền dung dịch thuốc chậm hơn và lâu hơn.
Việc đạt được mục tiêu PK/PD tối ưu và kịp thời có liên quan đến khả năng thành công lâm sàng và ức chế đề kháng ở những bệnh nhân nặng. Tuy nhiên, những thay đổi chức năng của các cơ quan trong quá trình bệnh lý (nhiễm trùng hoặc không nhiễm trùng) có thể làm thay đổi mức độ vi khuẩn tiếp xúc với kháng sinh. Thí dụ, sự gia tăng Vd đối với kháng sinh ưa nước như aminoglycoside [425,426], beta-lactam [427], glycopeptide [367] và linezolid [428] đã được ghi nhận ở những bệnh nhân bị bệnh nặng. Điều quan trọng là hiện tượng này dẫn đến giảm nồng độ kháng sinh dưới mức tối ưu và có thể làm giảm việc đạt được các mục tiêu PK/PD tối ưu mong muốn, đặc biệt là trong giai đoạn đầu của nhiễm trùng huyết nặng và sốc nhiễm trùng. Trong bối cảnh này, nên áp dụng liều tải kháng sinh ưa nước ban đầu cao hơn để bù đắp cho sự dãn nở thể tích. Để phòng xuất hiện kháng thuốc, phương pháp sử dụng liều tải có thể có tiềm năng giảm nhanh chóng gánh nặng vi khuẩn trong giai đoạn đầu của nhiễm trùng. Tsuji và cs gần đây đã nghiên cứu tác động của chế độ định lượng linezolid liều tải trước đối với việc tiêu diệt vi khuẩn và ức chế kháng thuốc trên nghiên cứu thực nghiệm bằng mô hình HFIM nhiễm MRSA [429]. Từ quan điểm của PD về việc loại bỏ vi khuẩn, phát hiện của các tác giả cho thấy có lợi ích tiềm năng của việc tăng liều linezolid sớm trong trị liệu, mặc dù không có sự khác biệt nào được ghi nhận về mặt ức chế kháng thuốc. Các nghiên cứu tiền lâm sàng tiếp theo là cần thiết để điều tra chiến lược dùng thuốc đầy hứa hẹn này, đặc biệt là trong bối cảnh gia tăng kháng thuốc, trước khi nó có thể được áp dụng đầy đủ trong thực hành lâm sàng.
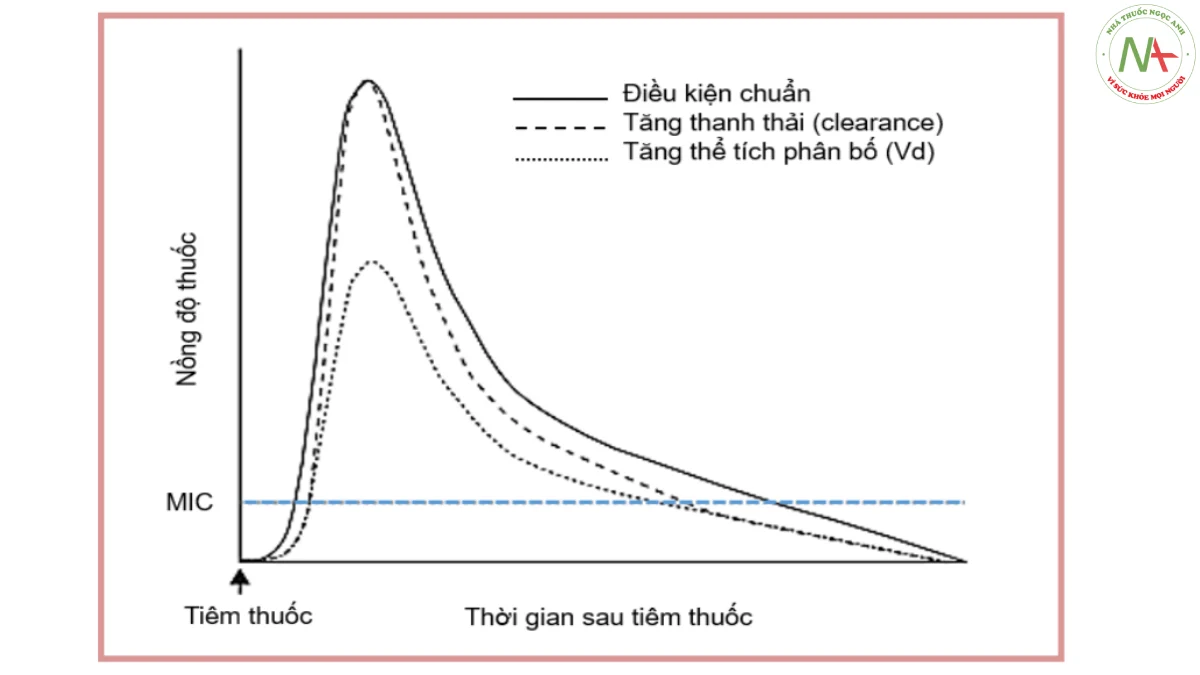
Kết hợp kháng sinh – vì sao và khi nào?
Nói chung, dựa trên đặc điểm dịch tễ tại chỗ và phân tích các yếu tô nguy cơ sẽ là cơ sở để lựa chọn giữa liệu pháp đơn trị liệu và liệu pháp phối hợp.
Những người ủng hộ liệu pháp phôi hợp sẽ đề xuất mạnh mẽ lý do rằng phương pháp này sẽ làm tăng mức độ vi khuẩn tiếp xúc với kháng sinh thông qua việc mở rộng phạm vi bao vây trên nhiều loại vi khuẩn gây bệnh tiềm năng và trong một sô đánh giá lâm sàng đã được chứng minh phôi hợp kháng sinh cải thiện khả năng sông sót ở những bệnh nhân bị bệnh nặng [430-433]. Những lý do mang tính lý thuyết mạnh mẽ hơn nữa để xem xét một cách nghiêm túc cách tiếp cận kháng sinh kết hợp bao gôm hiệp đông kháng sinh giúp tăng cường hiệu lực diệt khuẩn; Hoạt động kết hợp chông lại vi khuẩn có khả năng tạo màng sinh học (biofilm); Tăng khả năng thâm nhập mô, ức chế sản xuất độc tô và enzyme của vi khuẩn gây bệnh; Và ngăn chặn sự phát triển kháng thuôc. Tuy nhiên, cũng có bằng chứng lâm sàng chỉ ra rằng liệu pháp phôi hợp có thể không vượt trội, thậm chí có hại trong một sô trường hợp [434-436] trái ngược với liệu pháp đơn trị liệu trong điều trị nhiễm trực khuẩn Gram âm [437-439]. Dựa trên các dữ liệu có hiện tại, có thể suy luận rằng liệu pháp kháng sinh kết hợp có thể không mang lại lợi ích cho tất cả bệnh nhân mà chỉ mang lại lợi ích cho một sô bệnh nhân chọn lọc, bị nhiễm trùng chọn lọc. Mặc dù đơn trị liệu có thể đủ cho hầu hết bệnh nhân, nhưng những bệnh nhân bị bệnh nặng, bị nhiễm trùng nặng có thể được hưởng lợi nhiều nhất từ liệu pháp phôi hợp được tôi ưu hóa hợp lý. Mặc dù một sô nghiên cứu in vitro [440,441] và các nghiên cứu trên động vật thực nghiệm [442] đã cho thấy rõ ràng lợi ích của trị liệu kết hợp, nhưng thật không may, hầu hết các cách kết hợp được chọn ngẫu nhiên mà không xem xét dựa trên các yếu tố tiền lâm sàng.
Trong bối cảnh đề kháng kháng sinh, liệu pháp kết hợp được tối ưu hóa một cách hợp lý có thể hạn chế được sự gia tăng các đột biến kháng thuốc. Epstein và cs [444] gợi ý rằng sự hiện diện của hơn hai loại kháng sinh tại ổ nhiễm trùng (với nồng độ thuốc cao hơn MIC), mỗi loại có một cơ chế tiêu diệt khác nhau, sẽ “thu hẹp” cửa sổ MSW và do đó ngăn chặn sự phát triển đột biến [445- 447]. Tuy nhiên, ngoài một số các nghiên cứu tiền lâm sàng [440,442,448-450] cho đến nay không có nghiên cứu lâm sàng ngẫu nhiên nào cho thấy phương pháp này làm giảm khả năng kháng thuốc [256]. Hơn nữa, lợi ích này đặc biệt khó được chứng minh trong các đánh giá lâm sàng, vốn thường thu nhận bệnh nhân không đồng nhất và không được theo dõi đủ lâu để phát hiện sự xuất hiện của kháng thuốc. Trước hiện tượng kháng thuốc đang phát triển nhanh chóng, có khả năng chúng ta phải chuyển sự chú ý sang khái niệm về liệu pháp kháng sinh kết hợp được tối ưu hóa một cách hợp lý, đặc biệt là trong điều trị bệnh nhân nặng trong ICU. Ngoài ra, phương pháp này có thể rất quan trọng trong giai đoạn đầu của quá trình nhiễm trùng khi lượng vi khuẩn gây bệnh đang ở mức cao nhất
Theo hướng dẫn của ERS/ESICM/ESCMID/ALAT năm 2017 [33], trong điều trị HAP/VAP nếu bệnh nhân không có các yếu tố nguy cơ đối với vi khuẩn gây bệnh MDR cụ thể, chẳng hạn như P. aeruginosa hoặc MRSA, và được điều trị tại ICU với tỷ lệ vi khuẩn MDR thấp (<10%), việc sử dụng một loại thuốc kháng sinh duy nhất, phổ hẹp, có hoạt tính chống vi khuẩn Gram âm không kháng thuốc được khuyến cáo. Hướng dẫn của Châu Âu khuyến cáo sử dụng kháng sinh phổ hẹp có hoạt tính chống lại các vi khuẩn Gram âm không kháng thuốc cho những bệnh nhân có nguy cơ thấp nhiễm vi khuẩn MDR và không nặng được điều trị ở ICU với tỷ lệ MDR thấp (<25%) [33]. Các lựa chọn cụ thể sau đó được hướng dẫn bởi tình trạng huyết động của bệnh nhân. Ở những người không bị sốc nhiễm trùng khi chẩn đoán, đơn trị liệu được coi là phù hợp, với điều kiện là thuốc có hoạt tính chống lại >90% các vi khuẩn Gram âm phổ biến trong môi trường ICU. Khuyến cáo điều trị phổ rộng, phối hợp thuốc cho bệnh nhân sốc nhiễm trùng. Tuy nhiên, liệu pháp này sẽ phải bao vây được P. aeruginosa, Enterobacteriaceae ESBL(+) và A. baumannii (nếu phổ biến ở ICU). Cơ sở lý luận của liệu pháp phối hợp là cung cấp phạm vi bao vây đủ rộng để giúp cho việc điều trị thích hợp có nhiều khả năng hơn so với đơn trị liệu. Ngoài ra, liệu pháp phối hợp có thể tiêu diệt vi khuẩn nhanh hơn so với đơn trị liệu, có liên quan đến lợi thế sống sót so với đơn trị liệu đối với bệnh nhân bị sốc nhiễm trùng và nguy cơ tử vong >25% [33,432]. Các tài liệu hướng dẫn đều đồng thuận khuyến cáo điều trị kháng sinh kết hợp ở những bệnh nhân có nguy cơ cao nhiễm khuẩn MDR mặc dù còn thiếu bằng chứng đủ mạnh.
Một tổng quan hệ thống và phân tích gộp [214] đã so sánh liệu pháp đơn trị liệu và liệu pháp phối hợp khi điều trị theo kinh nghiệm cho bệnh nhân VAP. Nghiên cứu bao gồm dữ liệu của 41 nghiên cứu trên 7.015 bệnh nhân cho thấy không có sự khác biệt đáng kể nào được ghi nhận về tỷ lệ tử vong giữa cả hai phác đồ. Các tác giả chỉ ghi nhận ở 1 trong 3 phân tích gộp có sự khác biệt có ý nghĩa về tỷ lệ thất bại điều trị: kết hợp ceftazidime-aminoglycoside thấp hơn so với meropenem. Tỷ lệ tử vong và tỷ lệ thất bại điều trị đối với phác đồ đơn trị liệu và phối hợp là tương tự nhau (RR tỷ lệ tử vong đối với phác đồ đơn trị liệu là 0,94; CI 95% 0,76 đến 1,16; và RR đối với thất bại điều trị phác đồ đơn trị liệu là 0,88; KTC 95% 0,72 đến 1,07).
Một số tác giả nhấn mạnh do chỉ có một tỷ lệ nhỏ các trường hợp VAP do vi khuẩn MDR gây ra nên có thể hiểu được vì sao không thấy được rõ ràng lợi ích của liệu pháp phối hợp kháng sinh trong các nghiên cứu lâm sàng. Một nghiên cứu ngẫu nhiên có đối chứng [451] so sánh đơn trị liệu theo kinh nghiệm với meropenem so với ciprofloxacin cộng với meropenem đối với các trường hợp nghi ngờ VAP cho thấy không có sự khác biệt đáng kể, p=0,74). Hơn nữa, không có sự khác biệt nào được ghi nhận về thời gian nằm ICU và thời gian nằm viện, đáp ứng điều trị và sự xuất hiện của vi khuẩn kháng kháng sinh. Tuy nhiên, nghiên cứu này đã loại trừ những bệnh nhân có vi khuẩn quần cư (colonization) hoặc nhiễm Pseudomonas hay MRSA. Cũng trong nghiên cứu trên, các tác giả đã phân tích các trường hợp (n=56) bị nhiễm khuẩn do Pseudomonas, Acinetobacter và trực khuẩn Gram âm MDR và cho thấy khả năng điều trị ban đầu phù hợp cao hơn (84,2% so với 18,8%, p=0,001) và khả năng làm sạch khuẩn tốt hơn (64,1% so với 29,4%, p=0,05) khi sử dụng phác đồ kết hợp meropenem cộng với ciprofloxacin cho những người có vi khuẩn kháng thuốc, so với đơn trị liệu. Tương tự, một tổng quan hệ thống [452] bao gồm dữ liệu từ 12 nghiên cứu ngẫu nhiên có đối chứng trên 3.571 bệnh nhân VAP không tìm thấy sự khác biệt đáng kể về tỷ lệ tử vong do mọi nguyên nhân (OR 0,97, CI 95% 0,73 đến 1,30), hồi phục lâm sàng (OR 0,88, CI 95% 0,56 đến 1,36) và thời gian nằm trong ICU (chênh lệch trung bình 0,65, CI 95% 0,007 đến 1,23) giữa liệu pháp đơn trị liệu và liệu pháp phối hợp. Tuy nhiên, các tác giả thừa nhận rằng những dữ liệu này có thể không khái quát được cho tất cả các nhóm bệnh nhân, do nghiên cứu không xác định được những bệnh nhân có nguy cơ cao nhiễm vi khuẩn MDR. Ngoài ra, các trường hợp VAP do vi khuẩn MDR gây ra, kết quả từ các nghiên cứu mô tả [430,433,453,454] cho thấy phác đồ phối hợp bao gồm beta-lactam phổ rộng với aminoglycoside làm tăng tỷ lệ các trường hợp được điều trị thích hợp khi so sánh với phác đồ đơn trị liệu hoặc phác đồ phối hợp beta-lactam và fluoroquinolone. Liệu pháp kháng sinh kết hợp có thể giúp cải thiện hiệu quả của liệu pháp kháng sinh kinh nghiệm bằng cách cung cấp phạm vi bao phủ kháng sinh rộng hơn so với đơn trị liệu [455], bằng cách cung cấp khả năng hiệp lực kháng khuẩn (do đó dẫn đến tăng khả năng tiêu diệt vi khuẩn) [456] và bằng cách ngăn ngừa sự xuất hiện kháng thuốc [457]. Tuy nhiên, liệu pháp phối hợp cũng có thể có một số nhược điểm tiềm ẩn như: tăng nguy cơ độc tính, tăng chi phí, có thể có khả năng đối kháng (antagonist) thuốc (do đó dẫn đến giảm khả năng diệt khuẩn). Trong các nghiên cứu hồi cứu hoặc quan sát, tỷ lệ tử vong thấp hơn đáng kể ở những bệnh nhân được điều trị bằng liệu pháp kết hợp so với đơn trị liệu đối với sốc nhiễm trùng, nhiễm trùng do vi khuẩn MDR Gram âm và CAP [39,431,458,459]. Một phân tích gộp/hồi quy cho thấy liệu pháp phối hợp điều trị nhiễm trùng huyết hoặc sốc nhiễm trùng liên quan chặt chẽ đến việc cải thiện kết cục tỷ lệ tử vong [432]. Tuy nhiên, các nghiên cứu RCT đã không xác nhận những phát hiện này.
Thật vậy, meropenem và ciprofloxacin được sử dụng kết hợp không cải thiện kết quả của bệnh nhân khi so sánh với điều trị bằng meropenem đơn độc trong một nghiên cứu RCT bao gồm 740 bệnh nhân nghi ngờ mắc VAP [451], và meropenem với moxifloxacin được sử dụng kết hợp cũng không cải thiện được kết quả của bệnh nhân khi so sánh với meropenem một mình trong một ngiên cứu RCT khác trên 600 bệnh nhân nhiễm trùng huyết [460]. Trong cả hai nghiên cứu, quần thể bệnh nhân rất không đồng nhất và phần lớn vi khuẩn nhạy cảm với meropenem trong khi 20-30% chủng kháng với fluoroquinolones, gây khó khăn cho việc chứng minh lợi ích của liệu pháp phối hợp. Cuối cùng, trong một nghiên cứu RCT dành cho bệnh nhân nhập viện (nhưng không phải ICU) với CAP ở Hà Lan, bệnh nhân được dùng beta-lactam đơn độc (n=656), beta-lactam kết hợp với macrolide (n=739) hoặc đơn độc fluoroquinolones (n=888), các tác giả cho thấy không có sự khác biệt về tỷ lệ tử vong trong 90 ngày giữa các nhóm bệnh nhân, mặc dù sự ổn định lâm sàng sau 7 ngày điều trị tốt hơn (41% so với 34%; p=0,07) và tỷ lệ tái nhập viện sau 30 ngày thấp hơn (8% so với 3%; p=0,01) ở những bệnh nhân được điều trị bằng liệu pháp phối hợp so với nhóm đơn trị liệu [231]. Như vậy, điều trị kết hợp nên được xem xét ở những bệnh nhân bị sốc nhiễm trùng và CAP nặng hoặc ở những bệnh nhân nghi ngờ nhiễm trùng do vi khuẩn gây bệnh MDR. Mặc dù việc kết hợp kháng sinh là cách làm phổ biến trong quá trình điều trị nhiễm trùng nhưng sự liên quan của việc thực hành vẫn là vấn đề tranh luận với những kết luận trái ngược nhau. Liệu pháp kết hợp hiệu quả nhất vẫn còn gây tranh cãi [256]. Hướng dẫn sử dụng kháng sinh kinh nghiệm, đơn trị liệu hay kết hợp trong tình huống nặng, có nguy cơ nhiễm khuẩn MDR trong HAP/VAP đã được ERS/ESICM/ESCMID/ALAT sơ đồ hóa trong tài liệu hướng dẫn năm 2017 (hình 5.10).
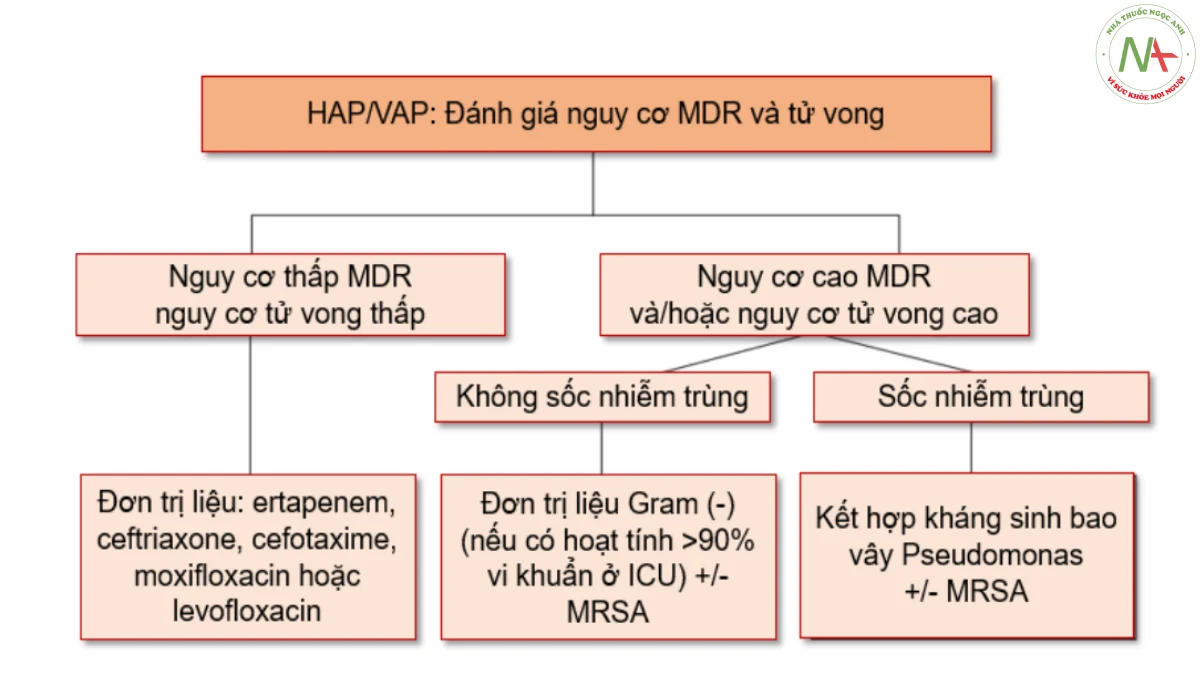
Kháng sinh khí dung (Inhaled antibiotics)
Một số nghiên cứu trên mô hình động vật gây VAP thực nghiệm đã chỉ ra rằng khí dung kháng sinh dẫn đến nồng độ kháng sinh cao vào phổi, cao hơn so với sau khi tiêm tĩnh mạch [461]. Thực nghiệm trên lợn con khỏe mạnh, Goldstein và cs [462] đã so sánh nồng độ amikacin trong mô phổi sau khi phun sương (sử dụng máy phun sương siêu âm) với nồng độ sau khi tiêm tĩnh mạch. Nồng độ amikacin trong phổi sau khi phun khí dung cao hơn 10 lần so với nồng độ trong phổi sau khi tiêm tĩnh mạch và thuốc được phân phối đồng nhất khắp nhu mô phổi. Những nồng độ này cao hơn nhiều so với MIC của hầu hết các chủng vi khuẩn Gram âm gây ra VAP [462]. Những dữ liệu này đã được xác nhận ở lợn gây viêm phổi thực nghiệm do E. coli: nồng độ amikacin trong phổi sau khi phun khí dung cao hơn 3- 30 lần so với sau khi tiêm tĩnh mạch [463]. Ở lợn được khí dung amikacin, nồng độ amikacin trong phổi ở phổi bị nhiễm bệnh (đông đặc) thấp hơn so với phổi không bị nhiễm bệnh (không đông đặc), nhưng ngay cả trong nhu mô bị nhiễm bệnh, nồng độ này cũng cao hơn so với nồng độ đạt được với tiêm tĩnh mạch amikacin. Hơn nữa, hiệu quả diệt khuẩn sau khí dung tốt hơn sau khi tiêm tĩnh mạch: tải lượng vi khuẩn giảm thấp hơn đáng kể ở những động vật nhận amikacin khí dung so với những động vật nhận amikacin tiêm tĩnh mạch [463]. Gần đây, đánh giá xâm nhập thuốc colistin tiêm tĩnh mạch ở phổi hoặc thông qua khí dung bằng máy phun sương dạng lưới rung trên động vật thí nghiệm là lợn [464] trong một nghiên cứu cho thấy colistin không được phát hiện trong mô phổi sau khi tiêm tĩnh mạch, trong khi thuốc được phát hiện trong nhu mô phổi khi dùng colistin khí dung, với nồng độ đỉnh trong mô phổi ở các phân thùy phổi bị viêm nhẹ cao hơn ở các phân thùy phổi bị viêm nặng. Theo đó, tải lượng vi khuẩn trong phổi của lợn được điều trị bằng khí dung thấp hơn trong phổi của lợn được điều trị bằng tiêm tĩnh mạch [464].
Kháng sinh dạng khí dung là một cách tiềm năng để cải thiện việc cung cấp thuốc cho những bệnh nhân bị bệnh nặng với nhiễn khuẩn Gram âm MDR hoặc VAP bên cạnh liệu pháp kháng sinh toàn thân. Các kháng sinh được sử dụng toàn thân thường xâm nhập vào nhu mô phổi không tốt, nhất là trong tình trạng bệnh nặng, do vậy tạo ra khoảng cách giữa nồng độ điều trị và nồng độ gây nhiễm độc thu hẹp. Trong khi đó, kháng sinh khí dung có thể đạt được nồng độ thuốc tại phổi, trong đường thở cao hơn 100-300 lần so với MIC với hầu hết các vi khuẩn, thậm chí cả vi khuẩn MDR [465]. Thí dụ, sử dụng colistin khí dung 2 MIU (MIU: 1 triệu đơn vị quốc tế, tương ứng với 80 mg CMS và được quy đổi tương đương khoảng 33,3 mg dạng colistin có hoạt tính) trong một nghiên cứu loạt ca viêm phổi nặng (n=12) cho thấy kết quả dược động học/dược lực học rất hứa hẹn: nồng độ colistin trong dịch lót biểu mô cao hơn so với tiêm tĩnh mạch colistimethate sodium [466]. Các aminoglycoside dạng khí dung cũng cho thấy kết quả tương tự ở những bệnh nhân điều trị VAP do vi khuẩn Gram âm (n=16): hiệu quả lâm sàng và vi sinh cao hơn đáng kể ở những bệnh nhân dùng thuốc khí dung so với bệnh nhân sử dụng thuốc toàn thân đơn độc [467]. Trong một phân tích gộp và tổng quan hệ thống từ 16 nghiên cứu trên bệnh nhân VAP, colistin dạng khí dung đã cải thiện lâm sàng và vi sinh, nhưng không ảnh hưởng đến tỷ lệ tử vong chung ở bệnh nhân [468]. Trong một tổng quan hệ thống và phân tích gộp khác từ 12 nghiên cứu RCT và các nghiên cứu quan sát bắt cặp so sánh kháng sinh dạng khí dung với tĩnh mạch đơn thuần trên bệnh nhân VAP đã cho thấy hiệu quả điều trị lâm sàng cao hơn, nhưng không có tác dụng đối với hiệu quả vi sinh, thời gian nằm viện hoặc tỷ lệ tử vong [469].
Mặc dù ý niệm về kháng sinh khí dung có thể cung cấp nồng độ kháng sinh cao hơn trong nhu mô phổi và ít độc tính toàn thân hơn so với điều trị bằng đường tĩnh mạch, nhưng không có khuyến cáo nào kêu gọi sử dụng phương pháp này như liệu pháp bổ trợ thông thường trong VAP [470]. Ba nghiên cứu ngẫu nhiên đã điều tra việc sử dụng kháng sinh khí dung bổ sung ở bệnh nhân mắc VAP [465,471-473]: Nghiên cứu IASIS (amikacin và fosfomycin bổ sung khí dung ở bệnh nhân mắc VAP và nghi ngờ MDR, vi khuẩn Gram âm); Nghiên cứu INHALE (amikacin dạng hít như liệu pháp bổ trợ ở bệnh nhân VAP và nghi ngờ MDR, vi khuẩn Gram âm); Và nghiên cứu VAPORISE (tobramycin dạng hít như một liệu pháp bổ trợ ở bệnh nhân VAP). Cả ba nghiên cứu đều cho kết quả âm tính đối với việc cải thiện kết quả lâm sàng hoặc tỷ lệ tử vong. Năm 2019, kết quả phân tích tổng hợp của ủy ban hướng dẫn ATS/IDSA cho HAP, bao gồm 9 nghiên cứu về kháng sinh dạng hít để điều trị VAP [474] cho thấy việc sử dụng kháng sinh dạng hít có lợi trong điều trị VAP do các vi khuẩn khó điều trị gây ra. Do đó, hướng dẫn của ATS/IDSA năm 2016 [198] khuyến cáo bổ sung kháng sinh dạng hít vào kháng sinh toàn thân trong trường hợp viêm phổi do vi khuẩn Gram âm MDR gây ra. Nên sử dụng colistin dạng hít thay cho polymyxin B. Kháng sinh dạng hít cũng được khuyến cáo là phương án cuối cùng cho bệnh nhân VAP và các vi khuẩn nhạy cảm hoặc kháng thuốc không đáp ứng với điều trị. Các hướng dẫn của Châu Âu năm 2017 [33] không khuyến cáo sử dụng kháng sinh dạng hít cho đến khi có thêm dữ liệu.
Về mặt lý thuyết, kháng sinh dạng khí dung cho phép tối đa hóa nồng độ thuốc trong phổi và phế quản, đồng thời giảm thiểu độc tính toàn thân. Tuy nhiên, có những vấn đề vẫn cần được xem xét. Đầu tiên, hiệu quả của kháng sinh dạng khí dung phụ thuộc vào máy tạo khí dung và máy thở, không thể áp dụng cho tất cả các bệnh nhân [475]. Thứ hai, sự lựa chọn kháng sinh và liều lượng vẫn chưa rõ ràng [476]. Cần nhiều nghiên cứu hơn để lượng giá hiệu quả trên người bệnh.
Một trong những hạn chế chính đối với việc sử dụng kháng sinh khí dung để điều trị VAP là chỉ một số ít trong số chúng có sẵn cho người sử dụng. Thí dụ, ở Pháp, các công thức cụ thể cho khí dung chỉ có sẵn cho colistin và tobramycin trong khi ở Hoa Kỳ, không có loại thuốc nào trong số này được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ chấp thuận cho khí dung và không có dạng thuốc nào có mặt trên thị trường [461]. Hầu hết các nghiên cứu được công bố đều đánh giá việc sử dụng aminoglycoside và colistin. Một phân tích tổng hợp gần đây gợi ý rằng kháng sinh khí dung có thể có lợi ở bệnh nhân VAP, tuy nhiên, các kết luận bị hạn chế do số lượng nhỏ và có nhiều tính không đồng nhất từ các số liệu của các nghiên cứu được đưa vào [469]. Dưới đây là tiến trình nghiên cứu về khí dung của một số kháng sinh cụ thể.
Khí dung aminoglycosides
Năm 1993, Le Conte và cs [477] cho thấy khí dung tobramycin một lần ở những người khỏe mạnh đã tạo ra được nồng độ nhu mô phổi cao nhưng với nồng độ huyết thanh thấp. Cũng các tác giả trên đã thực hiện nghiên cứu RCT mù đôi đánh giá khí dung tobramycin ở bệnh nhân VAP [478]. Trong số 38 bệnh nhân tham gia nghiên cứu này, 21 người dùng tobramycin và 17 người dùng giả dược. Kết luận của nghiên cứu sơ bộ đó là tobramycin được dung nạp tốt. Tuy nhiên, vì tất cả bệnh nhân đều được tiêm tĩnh mạch tobramycin nên không thể rút ra được kết luận về hiệu quả điều trị và không thu được dữ liệu dược động học [478]. Hầu hết dữ liệu về việc sử dụng các aminoglycoside khí dung đều được lấy từ các nghiên cứu hồi cứu, do đó hạn chế việc giải thích chúng. Trong một phân tích hồi cứu, Czosnowski cs [479] đã đánh giá 49 bệnh nhân được dùng kháng sinh khí dung để điều trị, tổng cộng 60 đợt VAP do P. aeruginosa và/hoặc A. baumannii gây ra. Các tác giả đã sử dụng khí dung tobramycin, amikacin và colistimethate. Kết cục nghiên cứu chính là thành công lâm sàng, đạt được ở 36 (73%) trong số 49 đợt VAP lần đầu, 8 (73%) trong số 11 VAP lần sau, 17 (85%) trong số 20 đợt thất bại với tiêm tĩnh mạch đơn trị liệu và 30 (79%) trong số 38 đợt điều trị với P. aeruginosa MDR hoặc A. baumannii. Thành công về mặt vi sinh đã đạt được ở 29 (71%) trong số 41 đợt có thể đánh giá được [479].
Năm 2008, Palmer và cs [480] chọn ngẫu nhiên 43 bệnh nhân bị viêm khí phế quản có mủ và vi khuẩn gây bệnh được xác định bằng nhuộm Gram để nhận kháng sinh dạng khí dung (n=19) hoặc giả dược (n=24) thông qua máy khí dung phun sương phản lực. Lựa chọn kháng sinh dựa trên kết quả nhuộm Gram dịch hút khí quản. Bệnh nhân được khí dung vancomycin nếu nhuộm Gram cho thấy vi khuẩn Gram dương và gentamicin khí dung nếu nhuộm Gram cho thấy vi khuẩn Gram âm. Hầu hết bệnh nhân của trong nghiên cứu này có các dấu hiệu lâm sàng của VAP tại thời điểm phân nhóm ngẫu nhiên và đang dùng kháng sinh toàn thân. Các tác giả chỉ ra rằng khí dung kháng sinh dẫn đến giải quyết các dấu hiệu viêm phổi lâm sàng nhanh hơn so với giả dược và những bệnh nhân dùng kháng sinh khí dung có ít đợt VAP tiếp theo hơn, vi khuẩn kháng thuốc thấp hơn và sử dụng kháng sinh toàn thân ít hơn. Có xu hướng ngừng thở máy nhanh hơn ở những bệnh nhân dùng kháng sinh khí dung [480]. Một số nghiên cứu đã đánh giá máy phun sương dạng lưới rung ở bệnh nhân VAP. Hai nghiên cứu dược động học đã đánh giá sự thâm nhập của amikacin vào dịch lót biểu mô phế nang bằng cách sử dụng máy phun sương lưới rung đồng bộ hóa hơi thở (breath-synchronised vibrating-mesh nebuliser) [481]. Các tác giả đã tìm thấy nồng độ amikacin cao trong chất dịch lót biểu mô ở các khu vực liên quan đến nhiễm trùng, trong khi nồng độ amikacin trong huyết thanh vẫn thấp, dưới mức độc tính, ở bệnh nhân có hoặc không có suy thận cấp í481,482]. Cũng sử dụng máy phun sương lưới rung đồng bộ hóa hơi thở, Niederman và cs [465] chọn ngẫu nhiên 69 bệnh nhân thở máy bị VAP do vi khuẩn Gram âm để điều trị như là một liệu pháp bổ trợ cho kháng sinh tiêm tĩnh mạch, 7-14 ngày khí dung amikacin 400 mg hai lần mỗi ngày (n=21), amikacin 400 mg một lần mỗi ngày và giả dược 12 giờ sau (n=26) hoặc giả dược hai lần mỗi ngày (n=22). Amikacin khí dung được dung nạp tốt, không có bất kỳ tác dụng phụ nghiêm trọng nào, và bệnh nhân dùng amikacin hai lần mỗi ngày cần ít kháng sinh hơn đáng kể so với bệnh nhân dùng giả dược khí dung (số kháng sinh toàn thân trung bình mỗi bệnh nhân mỗi ngày khi kết thúc điều trị lần lượt là 0,9 so với 1,9; p=0,02) [465]. Tuy nhiên, dữ liệu thu được ở một số lượng bệnh nhân tương đối nhỏ và cần được xác nhận trên quy mô lớn hơn. Một nghiên cứu gần đây, năm 2016, đánh giá amikacin khí dung và fosfomycin như là phương pháp điều trị bổ sung cho kháng sinh tiêm tĩnh mạch ở bệnh nhân VAP. Thuốc được khí dung bằng máy khí dung lưới rung eFlow (PARI, Starnberg, Đức) và đã cho kết quả là âm tính. Khí dung amikacin cộng với fosfomycin không kết hợp với kết quả cải thiện kết cục điều trị [471].
Khí dung colistin
Colistin khí dung đã được đánh giá, với các kết quả đáng khích lệ, ở những bệnh nhân bị viêm phổi do trực khuẩn Gram âm MDR [483]. Tuy nhiên, tất cả các nghiên cứu đều là nghiên cứu mô tả hồi cứu. Hầu hết bệnh nhân được điều trị bằng kết hợp kháng sinh tiêm tĩnh mạch với colistin khí dung. Trong nghiên cứu năm 2012, Lu và cs [484] so sánh 122 bệnh nhân VAP do P. aeruginosa nhạy cảm được điều trị bằng kháng sinh tiêm tĩnh mạch so với 43 bệnh nhân VAP do P. aeruginosa MDR điều trị bằng colistin khí dung đơn độc (n=28, 65%) hoặc kết hợp với tiêm tĩnh mạch 3 ngày với aminoglycoside (n=15, 35%) [484]. Ty lệ chữa khỏi VaP, tái phát VAP và tỷ lệ tử vong là tương tự nhau ở những bệnh nhân bị nhiễm P. aeruginosa nhạy cảm cũng như ở những bệnh nhân bị nhiễm các chủng MDR [484]. Điều thú vị là không có nghiên cứu nào trong số này báo cáo về sự xuất hiện của vi khuẩn gây bệnh kháng colistin hoặc độc tính trên thận do khí dung colistin [483-489]. Một nghiên cứu mù đôi ngẫu nhiên có đối chứng với giả dược đánh giá những bệnh nhân mắc VAP do vi khuẩn Gram âm đã dùng colistin khí dung (n=51) hoặc giả dược khí dung (n=49) cùng với kháng sinh tiêm tĩnh mạch [490]. Kết quả lâm sàng (khỏi bệnh lâm sàng, tử vong và tử vong do VAP) tương tự nhau ở hai nhóm, trong khi ty lệ làm sạch khuẩn cao hơn ở những bệnh nhân dùng colistin khí dung so với những bệnh nhân dùng giả dược. Các biến chứng tương tự nhau giữa các nhóm [490]
Khí dung các kháng sinh khác
Zarrilli và cs [491] trong một nghiên cứu năm 2008 đã chỉ ra rằng đối với những bệnh nhân thở máy được điều trị bằng vancomycin do viêm phổi MRSA, nồng độ vancomycin trong dịch hút khí quản của họ rất thấp và đôi khi dưới mức điều trị. Khi bệnh nhân được sử dụng vancomycin khí dung như một liệu pháp bổ sung cho vancomycin tiêm tĩnh mạch, nồng độ kháng sinh trong khí quản tăng lên và chúng luôn ở trên ngưỡng điều trị. Tuy nhiên, dữ liệu thu được ở một số ít bệnh nhân và cần được xác nhận trong các nghiên cứu lớn hơn. Một nghiên cứu RCT nhằm mục đích so sánh hai phương thức điều trị kháng sinh khác nhau cho bệnh nhân bị VAP do P. aeruginosa, trong đó một nhóm dựa trên kháng sinh tiêm tĩnh mạch và một nhóm được điều trị bằng kháng sinh khí dung đơn thuần [492]. Tổng cộng, 40 bệnh nhân được chọn ngẫu nhiên để nhận trị liệu tiêm tĩnh mạch hay khí dung. Trong nhóm tiêm tĩnh mạch 17 bệnh nhân sử dụng ceftazidime và amikacin, và ba bệnh nhân dùng ceftazidime và ciprofloxacin. Trong nhóm khí dung, 20 bệnh nhân được dùng ceftazidime và amikacin. Ty lệ điều trị thành công (được định nghĩa là khỏi bệnh lâm sàng), ty lệ điều trị thất bại và bội nhiễm là tương tự nhau đối với nhóm khí dung và tiêm tĩnh mạch (tương ứng là 70% so với 55%, 15% so với 30% và 15% so với 30%). Tuy nhiên, nghiên cứu có một số hạn chế là không được làm mù, hầu hết bệnh nhân ở cả hai nhóm đã được tiêm tĩnh mạch kháng sinh theo kinh nghiệm và những bệnh nhân đã dùng kháng sinh có hoạt tính chống lại P. aeruginosa trong hơn 24 giờ đã bị loại trừ. Cũng cần lưu ý rằng ở những bệnh nhân được phân bổ cho nhánh khí dung, thuốc kháng sinh được khí dung trong tổng số 8-9 giờ/ngày, cần phải dùng thuốc an thần sâu có thể dẫn đến kéo dài thời gian thở máy. Thật vậy, mặc dù không đáng kể, thời gian thở máy trung bình sau khi phân nhóm ngẫu nhiên ở nhánh khí dung dài hơn so với ở nhánh tĩnh mạch (14 so với 8 ngày) [492]
Khí dung kháng sinh cho bệnh nhân nặng
Sử dụng kháng sinh dạng khí dung cho bệnh nhân nặng cho phép nồng độ thuốc cao tại vị trí nhiễm trùng, ít nhất là theo quan điểm lý thuyết, hấp thu toàn thân thấp. Điều này có thể làm giảm độc tính, đặc biệt là độc tính trên thận của aminoglycoside và colistin [461]. Trong khi khí dung kháng sinh là một phần của thực hành thường quy ở trẻ em bị bệnh xơ hóa nang thì dữ liệu về bệnh nhân thở máy còn hiếm. Có một số lý do chính đáng cho việc ủng hộ sử dụng kháng sinh dạng hít. Điều quan trọng nhất là dược động học/dược lực học của kháng sinh ở những bệnh nhân được chăm sóc tích cực đã được biết rõ [493] và do đó, đưa kháng sinh trực tiếp đến vị trí nhiễm trùng, ít nhất là về mặt lý thuyết, tốt hơn so với tiêm tĩnh mạch. Nó tránh pha loãng thuốc trong thể tích phân bố rất lớn, chuyển hóa nhanh hoặc bài tiết qua nước tiểu [476,493,494]. Các lý do khác bao gồm những điều sau đây. Đầu tiên, tần suất VAP do vi khuẩn gây bệnh MDR gây ra đã tăng lên trong những năm gần đây và sẽ tiếp tục như vậy [133]. Đối với các chủng này, đặc biệt đối với trực khuẩn Gram âm MDR, MIC của các kháng sinh còn hoạt tính, chủ yếu là aminoglycoside, cao hơn, rất gần với ngưỡng xác định hiệu quả tiềm năng của các kháng sinh này. Để điều trị các chủng vi khuẩn này, việc tăng liều kháng sinh toàn thân có thể làm tăng độc tính và dẫn đến suy thận cấp. Khí dung mang lại lợi thế về liều lượng cao tại chỗ mà không gây tích tụ toàn thân [495-498]. Thứ hai, sự xâm nhập phổi của kháng sinh được truyền tĩnh mạch kém, đặc biệt đối với aminoglycoside. Thí dụ, hệ số thâm nhập phổi của tobramycin và gentamicin là từ 10% đến 30% sau một lần tiêm tĩnh mạch [499-501]. Mục tiêu của việc đưa kháng sinh trực tiếp đến đường hô hấp dưới là đạt được nồng độ thuốc cao ở nhu mô phổi, trong khi nồng độ trong máu vẫn thấp, do đó tránh hoặc hạn chế độc tính [497]. Thứ ba, mặc dù chưa được chứng minh, nhưng xông khí dung có lẽ tốt hơn so với nhỏ thuốc vào khí quản (một phương pháp khác để đưa kháng sinh vào đường hô hấp dưới). Trong khi nhỏ thuốc khí quản thu được nồng độ kháng sinh cao trong dịch tiết khí quản [502], nhưng sự khuếch tán chính xác trong đường thở xa và khoang phế nang vẫn chưa được biết. Hơn nữa, sự phân bố của thuốc trong phổi hầu như phụ thuộc vào trọng lực hạt thuốc và mức độ nghiêm trọng của các tổn thương nhu mô do đó có thể rất không đồng nhất. Hạn chế này của việc nhỏ thuốc vào khí quản ít nhất được khắc phục một phần bằng cách sử dụng khí dung, đặc biệt là với các thiết bị khí dung loại mới [503]. Cuối cùng, hệ vi sinh đường ruột có lẽ ít bị thay đổi hơn khi dùng kháng sinh khí dung so với kháng sinh toàn thân, điều này có thể làm giảm sự xuất hiện và phổ biến của các chủng kháng thuốc, bao gồm cả Clostridium difficile [496].
Kết quả từ các phân tích tổng hợp và tổng quan hệ thống về khí dung kháng sinh
Ba phân tích tổng hợp đã được thực hiện trong khoảng một thập niên trở lại đây với nhiều kết quả khác nhau [468,469,504]. Valachis và cs [468] đã đánh giá hiệu quả và độ an toàn của colistin khí dung như là liệu pháp bổ sung cho thuốc kháng sinh tiêm tĩnh mạch hoặc đơn trị liệu trong điều trị VAP cho thấy có sự cải thiện đáng kể về đáp ứng lâm sàng (OR 1,57; p=0,006), diệt khuẩn (OR 1,61; p=0,01) và tỷ lệ tử vong liên quan đến nhiễm trùng (OR 0,58; p=0,04) đã được quan sát thấy khi bổ sung colistin khí dung với điều trị tĩnh mạch, trong khi tỷ lệ tử vong chung (OR 0,74; p=0,06) và độc tính trên thận (OR 1,18; p=0,45) không bị ảnh hưởng. Kết quả tương đối giống nhau đã được tìm thấy bởi Liu và cs [504] trong một phân tích của 9 nghiên cứu so sánh sự kết hợp của tiêm tĩnh mạch với polymyxin khí dung so với tiêm tĩnh mạch polymyxin đơn độc trong tổng số 672 bệnh nhân cho thấy sự kết hợp của tiêm tĩnh mạch cộng với colistin khí dung có liên quan đến tỷ lệ khỏi hoặc cải thiện lâm sàng và loại bỏ vi khuẩn gây bệnh cao hơn, đồng thời giảm tỷ lệ tử vong do mọi nguyên nhân. Tuy nhiên, trong phân tích tổng hợp của Zampieri và cs [469] bao gồm sáu nghiên cứu RCT với tổng số 812 bệnh nhân, kháng sinh khí dung không liên quan đến hiệu quả làm sạch khuẩn (RR 1,24, CI 95% 0,95-1,62), tỷ lệ tử vong (RR 0,90, CI 95% 0,76-1,08), thời gian thở máy (chênh lệch trung bình chuẩn hóa -0,10 ngày, CI 95% -1,22-1,00), thời gian nằm viện ICU (chênh lệch trung bình chuẩn hóa 0,14 ngày, CI 95% -0,46-0,73) hoặc nhiễm độc thận (RR 1,05, CI 95% 0,70-1,57). Như vậy, vẫn còn nhiều vấn đề cần nghiên cứu trong đó có thể tách bạch được đâu là tác động của cơ thể người bệnh cùng với đặc điểm bệnh lý riêng và đâu là tác động của thuốc. Rào cản quan trọng nhất hiện nay trong việc đánh giá hiệu quả thuốc khí dung là vấn đề đạo đức trong nghiên cứu y học không cho phép.
Điều trị kháng sinh và PK/PD trên bệnh nhân nặng
Khi chỉ định kháng sinh cho nhiễm trùng nặng cần hiểu tại sao điều trị kháng sinh cho bệnh nhân bị bệnh nặng lại khác với những bệnh nhân khác và như thế nào là sử dụng kháng sinh hợp lý.
Thay đổi dược động thuốc trên bệnh nhân nặng
Những bệnh nhân bị bệnh nặng phải chịu những thay đổi sinh lý có thể ảnh hưởng đến nồng độ đạt được trong cả máu và các mô ngoại vi. Các tình huống như nhiễm trùng huyết được biết là làm tăng thể tích phân bố của bệnh nhân, tạo ra hiệu ứng được gọi là “khoang thứ ba,” [505] dẫn đến giảm nồng độ thuốc ưa nước trong máu và dẫn tới làm giảm nồng độ thuốc dự kiến và thiếu liều. Hơn nữa, suy thận cũng thường xảy ra trong ICU, vì việc sử dụng các thuốc gây độc cho thận như thuốc cản quang i-ốt hoặc tình trạng giảm thể tích tuần hoàn hoặc suy cơ tim là tương đối phổ biến. Việc giảm tốc độ lọc thận tạo ra sự gia tăng tỷ lệ nghịch với thời gian bán thải của các thuốc được bài tiết chủ yếu qua thận, dẫn đến nồng độ thuốc cao hơn dự kiến trong cả huyết tương và mô ngoại vi [505]. Hơn nữa, bệnh nhân sốc, thở máy thường được truyền dịch và/hoặc thuốc tăng co bóp tim như liệu pháp hồi sức. Thể tích tăng thêm và cung lượng tim tăng [506,507] dẫn đến giá trị tiền tải ở thận cao hơn, làm tăng tốc độ lọc và rút ngắn thời gian bán thải của thuốc [505]. Thuốc ưa mỡ về cơ bản được đào thải ra khỏi cơ thể bằng chuyển hóa ở gan. Độ thanh thải thuốc có thể chậm hơn khi bệnh nhân bị suy gan [508]. Những thay đổi dược động học tiềm ẩn này ở bệnh nhân nặng rất khó dự đoán. Nồng độ albumin cũng rất quan trọng, vì tỷ lệ giảm albumin máu tương đối cao ở những bệnh nhân bị bệnh nặng. Domínguez de Villota và cs [509] đã báo cáo rằng 64% bệnh nhân được nhận vào ICU của họ có nồng độ albumin thấp. Hậu quả tức thì của nó là giảm áp lực keo, về mặt sinh lý sẽ dẫn đến sự di chuyển của chất lỏng ra khoang ngoài mạch, gây ra phù nề và nồng độ thuốc trong máu thấp hơn dự kiến. Hơn nữa, thuốc có thể liên kết với protein huyết tương theo một tỷ lệ phần trăm khác nhau tùy thuộc vào đặc tính hóa lý của chúng và người ta biết rằng phần thuốc không liên kết được sẽ bị loại thải nhanh hơn. Hạ albumin máu dẫn đến nồng độ thuốc tự do cao hơn và có thể làm giảm thời gian bán thải của thuốc [510].
Đối với các beta-lactam, việc duy trì tiếp xúc với thuốc hiệu quả trong thời gian dài hoặc tăng %fT>MIC sẽ đặc biệt thích hợp trong việc ngăn ngừa kháng thuốc, đặc biệt là ở những bệnh nhân bị bệnh nặng [256]. Các nghiên cứu đã chỉ ra rằng liều nạp (bolus) theo cách truyền thống tạo ra nồng độ kháng sinh dưới mức tối ưu trong phần lớn khoảng thời gian dùng thuốc, do đó có thể tạo điều kiện thuận lợi cho sự phát triển của các chủng vi khuẩn kháng thuốc [341]. Nhiều nghiên cứu PK/PD lâm sàng và tiền lâm sàng đã chứng minh rằng có thể đạt được sự cải thiện nồng độ beta-lactam thông qua việc sử dụng thuốc EI (truyền tĩnh mạch kéo dài, extended infusion) hoặc CI (truyền tĩnh mạch liên tục, continuous infusion)
Các phương pháp dùng thuốc thay đổi này có thể đặc biệt quan trọng ở những bệnh nhân phát triển các rối loạn sinh lý bệnh nghiêm trọng và khi có vi khuẩn gây bệnh ít nhạy cảm hơn. Tuy nhiên, cần có nhiều nghiên cứu lâm sàng tốt hơn để đánh giá khả năng tương đối của EI và CI so với liều nạp ngắt quãng (intermittent bolus, IB) khi sử dụng kháng sinh beta-lactam trong việc giảm sự xuất hiện của kháng thuốc.
Tối ưu hóa liều ở những bệnh nhân nặng
Khi xem xét tối ưu hóa liệu pháp kháng sinh, điều quan trọng là phải đưa ra một số khái niệm về dược động học/dược lực học của thuốc. Nâng cao hiệu quả nhằm đạt được mục tiêu dược lực, có thể dùng kháng sinh với cách tăng liều, tăng tần suất sử dụng thuốc, truyền kéo dài hoặc truyền liên tục. Điều trị cũng có thể được hướng dẫn bởi theo dõi thuốc (TDM). Một số nghiên cứu đã chỉ ra rằng việc đạt được mục tiêu dược động học/dược lực học được cải thiện khi sử dụng glycopeptide hoặc beta-lactam dưới dạng truyền kéo dài hoặc liên tục, so với liều bolus tiêu chuẩn I512,513]. Truyền liên tục beta-lactam có thể nhanh chóng đạt được nồng độ thuốc thích hợp cho tất cả các chủng vi khuẩn Gram âm nhạy cảm, ngay cả ở những bệnh nhân nặng [514,515] (hình 5.11).
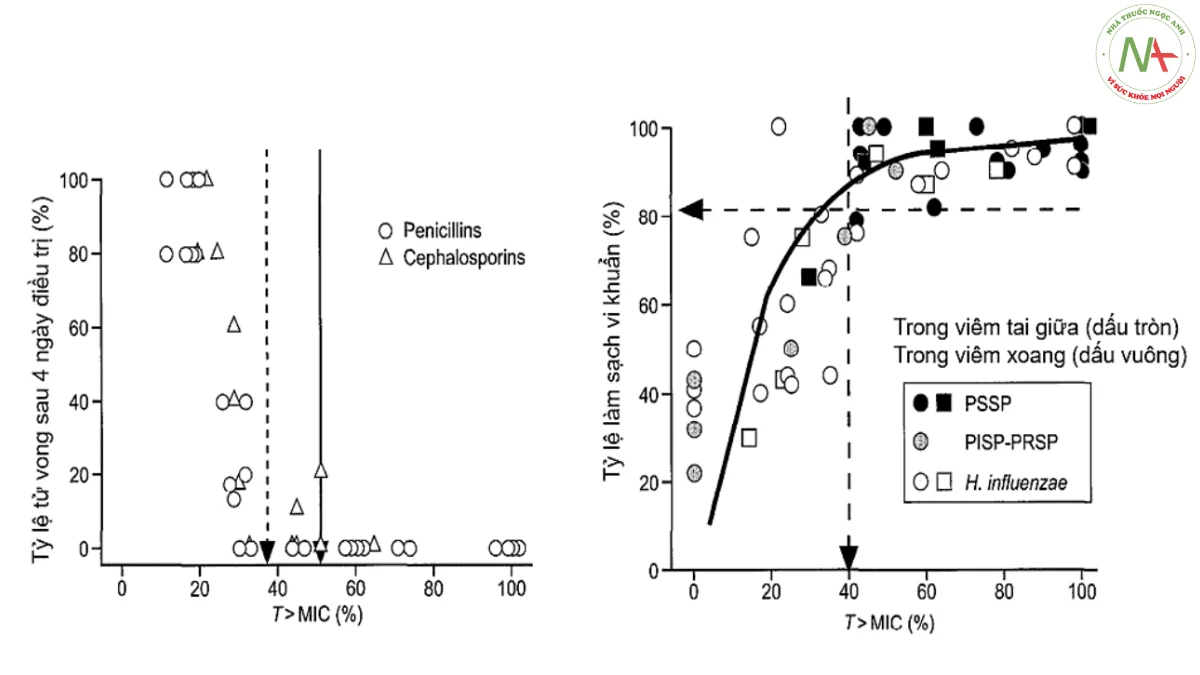
Một số nghiên cứu đã chỉ ra rằng khi đưa ra chế độ liều tiêu chuẩn, nồng độ trong huyết thanh của các loại kháng sinh khác nhau, chẳng hạn như beta-lactam [516], amikacin [425] và vancomycin [259], phần lớn là không đủ để điều trị cho bệnh nhân bị sốc nhiễm trùng. Như đã phân tích ở trên, trong tình trạng nhiễm trùng nặng, nhất là khi có sốc, các biến đổi bệnh lý trong cơ thể yêu cầu sử dụng liều nạp cao hơn để nồng độ kháng sinh và thời gian tiếp xúc đủ để diệt khuẩn. Các nghiên cứu chuẩn hóa lâm sàng đã chỉ ra rằng các mục tiêu dược động học/dược lực học đạt được nhanh hơn ở những bệnh nhân nhiễm trùng huyết dùng liều tải 25 mg/kg đối với amikacin, thay vì liều khuyến cáo trước đây là 15 mg/kg [425], và liều tải 35 mg/kg đối với vancomycin [517,518]. Tuy nhiên, chưa có nghiên cứu nào chỉ ra rằng các chế độ liều lượng mới này mang lại kết quả lâm sàng tốt hơn [519].
Nguy cơ nhiễm độc
Khi một người cố gắng đạt được mục tiêu dược lực học tốt hơn, nguy cơ nhiễm độc cũng có thể tăng lên. Thật vậy, nồng độ beta-lactam rất cao có thể là nguyên nhân gây nhiễm độc thần kinh ở những bệnh nhân bị bệnh nặng [520] và nồng độ vancomycin cao có liên quan đến nhiễm độc thận [521]. Do đó, những rủi ro và lợi ích của chế độ liều cao phải luôn được đánh giá rất cẩn thận.
CÁC KHÁNG SINH ĐIỀU TRỊ VIÊM PHỔI DO VI KHUẨN ĐA Kháng THUỐC
Kháng sinh mới
Tốc độ kháng kháng sinh tăng nhanh chóng trong 20 năm qua trên toàn thế giới khiến nhiều loại kháng sinh trở nên lỗi thời trong khi tốc độ phát triển lâm sàng chậm của các loại kháng sinh mới đã gần như làm cạn kiệt nguồn cung cấp kháng sinh dẫn tới sự lựa chọn điều trị cho nhiều bệnh nhiễm trùng trở nên ít hơn [522]. Các loại kháng sinh chính được sử dụng trong điều trị nhiễm trùng đường hô hấp dưới, như carbapenem, fluoroquinolones và colistin [407,523-525], đã bị kháng trong trạng thái đa kháng hay kháng phổ rộng đã phổ biến ở nhiều quốc gia. Thí dụ ở Hy Lạp, các chủng K. pneumoniae kháng carbapenem chiếm 62,3% trong tổng số các chủng K. pneumoniae xâm lấn phân lập được vào năm 2014 [526]. Khả năng không nhạy cảm với fluoroquinolones cũng rất cao ở cả K. pneumoniae xâm lấn (>60% ở Hy Lạp, Ba Lan, Romania và Slovakia) và các phân lập P. aeruginosa [526]. Việc sử dụng trở lại của colistin như một lựa chọn điều trị trong nhiễm trùng MDR cũng như việc sử dụng thuốc này rộng rãi trong lĩnh vực thú y đã dẫn đến sự gia tăng tỷ lệ kháng colistin [407]. Hơn nữa, người ta đã phát hiện được rằng, ngoài cơ chế kháng được mã hóa nhiễm sắc thể, còn có cơ chế kháng polymyxin qua trung gian plasmid, MCR-1 ở Enterobacteriaceae [527], cơ chế này có khả năng cao chuyển giao tính trạng kháng thuốc [528]. Kể từ đầu những năm 1960, chỉ có 4 nhóm kháng sinh mới được giới thiệu: quinolone, lincosamid, oxazolidinones và lipopeptide vòng. Thị trường kháng sinh toàn cầu cho tới nay vẫn cơ bản là các loại kháng sinh được phát hiện hơn nửa thế kỷ trước [529]. Thông thường “kháng sinh mới” là một thuật ngữ được sử dụng cho các hợp chất được phát triển từ các nhóm kháng sinh cũ [529]. Các kháng sinh mới, được phê duyệt sử dụng trong nhiễm trùng hô hấp dưới (LRTI) sẽ được đề cập tới dưới đây.
Tigecycline
Tigecycline là một loại kháng sinh glycylcycline được phê duyệt tại Hoa Kỳ vào năm 2005 và được cấp phép vào năm 2006 tại Châu Âu để điều trị cho bệnh nhân bị nhiễm trùng da và mô mềm phức tạp (cSSTI) và nhiễm trùng ổ bụng phức tạp (cIAIs). Một số nghiên cứu cũng cho thấy hiệu quả của nó ở những bệnh nhân mắc CAP và VAP [530-533]. Hoạt tính kháng khuẩn trong CAP do các vi khuẩn gây bệnh phổ biến và vi khuẩn không điển hình của tigecycline tiêm tĩnh mạch là không thua kém levofloxacin tĩnh mạch và thuốc được dung nạp tốt ở người lớn nhập viện với CAP [531]. Trong các nghiên cứu RCT trên bệnh nhân nhập viện, so sánh phác đồ điều trị tigecycline 100 mg tĩnh mạch một lần và sau đó 50 mg tĩnh mạch hai lần mỗi ngày có hiệu quả và độ an toàn tương đương với các khác sinh đối chứng [530]. Tigecycline cũng được dung nạp tốt ở liều cao hơn tiêu chuẩn ở những bệnh nhân bị bị nhiễm trùng nặng [532] và ở bệnh nhân VAP. Chế độ điều trị liều cao có kết quả tốt hơn so với chế độ điều trị thông thường [532]. Hoạt tính của tigecycline chống lại A. baumannii và các vi khuẩn Gram âm MDR/XDR khác (ngoại trừ P. aeruginosa) khiến nó trở thành một loại thuốc thích hợp được lựa chọn để điều trị LRTI do vi khuẩn MDR gây ra. Cũng có bằng chứng cho thấy kết quả điều trị bằng tigecycline tương đương với kết quả điều trị bằng colistin cho bệnh nhân mắc bệnh viêm phổi MDR/XDR do A. baumannii [533].
Ceftaroline fosamil
Ceftaroline fosamil được chấp thuận để điều trị cSSTIs và CAP ở người lớn và trẻ em. Thuốc đã có mặt trên thị trường vào năm 2012. Ceftaroline là một beta-lactam có hoạt tính chống lại MRSA và S. pneumoniae không nhạy cảm với penicillin. Trong một nghiên cứu RCT pha III ở Châu Á, ceftaroline fosamil 600 mg dùng mỗi 12 giờ vượt trội hơn so với ceftriaxone 2g dùng mỗi 24 giờ trong điều trị CAP [534]. Một nghiên cứu in vitro trên phạm vi rộng từ 39 quốc gia đã chứng minh rằng ceftaroline có hoạt tính in vitro vượt trội so với ceftriaxone [535]. Tuy nhiên, mức độ bao bao vây vi khuẩn Gram âm thấp và không có tác dụng đối với một số vi khuẩn MDR, như các vi khuẩn sinh ESBL hoặc vi khuẩn Gram âm kháng carbapenem, làm cho ceftaroline kém hấp dẫn hơn trong LRTI do các vi khuẩn này gây ra [536].
Ceftazidime-a vibactam
Ceftazidime-avibactam gần đây đã được bổ sung vào nhóm kháng sinh có sẵn sau khi được cấp phép lưu hành trên thị trường Châu Âu vào tháng 6 năm 2016, và bao gồm chỉ định điều trị cIAIs, nhiễm trùng đường tiết niệu phức tạp (cUTI) và HAP, kể cả VAP [537]. Ceftazidime là một cephalosporin thế hệ III kháng Pseudomonas, trong khi chất ức chế beta- lactamase phổ rộng avibactam bảo vệ ceftazidime khỏi một số nhóm beta- lactamase. Một số nghiên cứu lâm sàng được thực hiện cho đến nay đã báo cáo rằng ceftazidime-avibactam có hiệu quả như carbapenem trong cUTI và cIAI [538]. Trong một số nghiên cứu pha III, ceftazidime- avibactam được so sánh với liệu pháp tốt nhất hiện có và tỷ lệ khỏi lâm sàng là tương tự ở cả hai nhóm [539’541]. Trong một nghiên cứu pha III khác, ceftazidime-avibactam không thua kém meropenem trong điều trị HAP/VAP người lớn [542].
Ceftolozane-tazobactam (CEF/TAZ)
Là một cephalosporin và kháng beta- lactamase có hoạt tính in vitro chống lại MDR P. aeruginosa và Enterobacteriaceae sinh ESBL. Kết quả từ một nghiên cứu không thua kém, mù đôi có đối chứng ngẫu nhiên trên 726 bệnh nhân thở máy bị viêm phổi bệnh viện do vi khuẩn Gram âm [281] so sánh CEF/TAZ (2 g ceftolozane cộng với 1 g tazobactam được truyền trong 1 giờ cứ sau mỗi 8 giờ) trên 362 bệnh nhân so với meropenem (1 g truyền trong 1 giờ cứ sau mỗi 8 giờ) trên 364 bệnh nhân. Trong nghiên cứu, cả hai thuốc đều có hiệu quả tương đương và dung nạp tốt trên bệnh nhân viêm phổi bệnh viện do vi khuẩn Gram âm thở máy. Tuy nhiên, CEF/TAZ có lợi thế về tỷ lệ tử vong và trên những người đã được điều trị bằng kháng sinh trước đó không thành công cho đợt viêm phổi bệnh viện hiện tại. Loại kháng sinh mới này đã được FDA (Hoa Kỳ) và EMA (châu Âu) phê duyệt để điều trị HAP [543,544].
Meropenem-vaborbactam
Là thuốc kết hợp kháng sinh beta-lactam hiện có (meropenem) với boronat vòng (vaborbactam), một chất không beta-lactam ức chế men beta-lactamase. Hoạt động chống lại các vi sinh vật Gram âm, bao gồm cả những vi khuẩn tạo ra beta-lactamase phổ rộng và K. pneumoniae tạo carbapenemase. Tuy nhiên, nó không hoạt động chống lại các chủng sản xuất metallo- beta-lactamase và oxacillinase. Mặc dù không được chấp thuận cho VAP, meropenem- vaborbactam cho thấy lợi thế hồi phục lâm sàng khi so sánh với liệu pháp tốt nhất đang có (thường là colistin), trong một nghiên cứu bao gồm các bệnh nhân thở máy có Enterobacteriaceae kháng carbapenem [545].
Imipenem-relebactam (IR)
Là thuốc kết hợp kháng sinh beta-lactam hiện có (imipenem-cilastatin) với chất ức chế beta-lactamase không-beta-lactam (relebactam), có hoạt tính chống vi khuẩn Gram âm, kể cả vi khuẩn tạo beta-lactamse lớp C Ambler, beta-lactamase phổ rộng và K. pneumoniae tạo carbapenemase. Tuy nhiên, nó không hoạt động chống lại các chủng sản xuất metallo-beta-lactamase và oxacillinase. Trong một nghiên cứu pha III so sánh IR với pipercillin-tazobactam ở 537 bệnh nhân bị viêm phổi bệnh viện, với một nửa số bệnh nhân được thở máy, cả hai phương pháp điều trị đều tương đương về khả năng phục hồi lâm sàng và tỷ lệ tử vong [546]. Tuy nhiên, tỷ lệ sống sót cao hơn ở phân nhóm những người thở máy khi bắt đầu điều trị bằng IR [546].
Cefiderocol
Là một siderophore cephalosporin liên kết với sắt và xâm nhập vào tế bào vi khuẩn bằng cách sử dụng hệ thống vận chuyển sắt. Nó hoạt động chống lại nhiều loại vi khuẩn gây bệnh kháng carbapenem bao gồm Enterobacteriaceae, P. aeruginosa và A. baumanii. Nó cũng hoạt động chống lại Stenotrophomonas maltophilia. Cefiderocol được chấp thuận cho điều trị bệnh viêm phổi bệnh viện, bao gồm cả VAP, nhưng không cho thấy lợi thế sống sót hoặc tỷ lệ hồi phục cao hơn khi so với meropenem. Trong một nghiên cứu riêng trên những bệnh nhân VAP cho thấy có tỷ lệ sống sót thấp hơn so với liệu pháp điều trị tốt nhất hiện có [547,548].
Macrolides
Macrolides là nhóm thuốc được lựa chọn trong các phác đồ điều trị CAP, đợt cấp COPD [549]. Việc sử dụng không phù hợp ở ngoại trú đối với LRTI do vi-rút đã kích thích và làm gia tăng đề kháng đối với nhóm kháng sinh này. Solithromycin là một macrolide mới từ nhóm ketolide, có ít độc tính hơn so với ketolide đầu tiên (telithromycin). Có một số bằng chứng cho thấy solithromycin có đặc tính chống viêm tốt hơn so với các macrolide có trước đó, khiến nó trở thành một kháng sinh đầy hứa hẹn trong điều trị COPD [550]. Trong một nghiên cứu pha III, solithromycin không thua kém moxifloxacin đường uống trong điều trị CAP và cũng xác nhận một nghiên cứu trước đây chứng minh không thua kém levofloxacin trong điều trị CAP người lớn [551,552]. Tương tự như việc sử dụng các loại kháng sinh khác đối với nhiễm trùng phổi, chẳng hạn như tobramycin, colistin và aztreonam, liệu pháp hít macrolide có thể là một phương pháp mới trong điều trị nhiễm trùng hô hấp [553]. Đã có một số nghiên cứu in vitro và in vivo và cần có thêm bằng chứng về hiệu quả của cách sử dụng này.
Oxazolidinones
Tedizolid (tên nghiên cứu là TR700) là một trong những oxazolidinone mới hơn được phê duyệt để điều trị SSTI cấp tính do vi khuẩn ở Hoa Kỳ từ năm 2014 và ở Châu Âu từ năm 2015. Tedizolid vẫn đang được nghiên cứu để điều trị MRSA trong nhiễm trùng hô hấp dưới [554], nhưng đã được coi là một loại thuốc thay thế cho linezolid vì nguy cơ nhiễm độc tủy thấp hơn, thâm nhập cao hơn vào dịch lót biểu mô, nguy cơ tương tác thuốc-thuốc thấp hơn với các chất ức chế tái hấp thu serotonin có chọn lọc và các ưu điểm khác [555]. Một số công ty dược phẩm đang khám phá các cơ hội để thúc đẩy loại thuốc này trong điều trị nhiễm trùng hô hấp dưới. Nhiều nghiên cứu lâm sàng giai đoạn III đang diễn ra, một trong số đó đang so sánh tedizolid (TR-701 FA), với linezolid để điều trị cho các bệnh nhân thở máy nghi ngờ HAP/VAP Gram dương. Trong các mô hình thực nghiệm trên chuột, tedizolid thâm nhập tốt vào lớp dịch lót biểu mô như linezolid [556], có hiệu quả tương đương đối với bệnh viêm phổi do MRSA và thậm chí còn hiệu quả hơn đối với bệnh viêm phổi do s. pneumoniae nhạy cảm với penicillin và kháng penicillin so với linezolid [557,558].
Telavancin
Telavancin tiếp cận thị trường châu Âu vào năm 2011 với chỉ định chính là điều trị HAP/VAP do MRSA gây ra. Thuốc là một lipoglycopeptide mới, với khả năng bao phủ rộng rãi vi khuẩn gây bệnh Gram dương, bao gồm MRSA và s. pneumoniae I559,560]. Hợp chất này ức chế sự tổng hợp thành vi khuẩn và phá vỡ màng vi khuẩn để phát huy tác dụng diệt khuẩn của nó. Telavancin không thua kém vancomycin trong điều trị HAP trong hai nghiên cứu pha III, mặc dù nguy cơ nhiễm độc thận cao hơn và các tác dụng phụ nghiêm trọng đã được ghi nhận so với nhóm vancomycin [561,562].
các loại thuốc nghiên cứu trong các giai đoạn phát triển lâm sàng giai đoạn sau (được biểu thị bằng dấu hoa thị)
(Nguồn trích dẫn: Tomislav Kostyanev et al. New antibiotic development for pulmonary infections: New Drugs for Bad Bugs and beyond. In Anti-infectives and the Lung (Edited by Stefano Aliberti et al) European Respiratory Society
©2017. p.289-301)
Khôi phục sử dụng kháng sinh cũ
Như đã nhấn mạnh ở trên, mặc dù tình trạng vi khuẩn kháng kháng sinh vẫn tiếp tục xuất hiện nhưng tốc độ phát triển thuốc kháng sinh mới đang giảm dần. Trong bối cảnh này, việc sử dụng lại các loại kháng sinh cũ, đã sử dụng trước đây có hoạt tính chống lại vi khuẩn MDR là một giải pháp thay thế mới để kiểm soát tình trạng kháng thuốc [563]. Vì các loại kháng sinh cũ ít khi được đưa vào các quy trình phát triển thuốc hiện đại hoặc được so sánh với các loại kháng sinh được sử dụng phổ biến nên chúng ít được xem xét trong các hướng dẫn thực hành. Do đó, hiệu quả và độ an toàn của chúng phải được đánh giá lại để tối ưu hóa liệu pháp.
Khi đánh giá lại các thuốc kháng sinh cũ, hiệu quả-chi phí có thể được tích hợp để phân tích trong các so sánh giữa thuốc kháng sinh cũ với thuốc kháng sinh hiện đang được sử dụng. Trong quá trình đánh giá, cần tối ưu hóa liệu pháp kháng sinh về PK/PD để cải thiện kết quả điều trị nhưng giảm thiểu độc tính và nguy cơ kháng thuốc xuất hiện trong quá trình điều trị [564]. Sử dụng thuốc ở nồng độ dưới mức điều trị có thể tạo điều kiện thuận lợi cho sự phát triển kháng thuốc ở cả vi khuẩn gây bệnh lây nhiễm và hệ vi khuẩn cộng sinh [565]. Hơn nữa, điều chỉnh liều lượng, tránh sử dụng đồng thời các thuốc có khả năng gây độc khác, ngừng sử dụng kháng sinh ngay sau khi có dấu hiệu nhiễm độc ban đầu là rất quan trọng khi đánh giá lại lâm sàng các loại kháng sinh cũ. Thí dụ, các nghiên cứu gần đây cho thấy rằng tác dụng phụ với colistin không thường xuyên như báo cáo trước đây mà một phần là do kê đơn chính xác hơn [566]. Vì một số loại kháng sinh cũ (thí dụ: fosfomycin, TMP/SMX, clindamycin, pristinamycin và a-xít fusidic) cũng có thể tạo điều kiện cho sự lan truyền kháng thuốc theo chiều ngang và trong trường hợp này, liệu pháp kết hợp vẫn là một giải pháp thay thế cho việc tái sử dụng chúng. Việc tái sử dụng kháng sinh cũ là một chiến lược đầy hứa hẹn để chống lại tình trạng kháng kháng sinh. Tuy nhiên, có một số điểm quan trọng để sự hồi sinh các thuốc này một cách bền vững, còn cần đánh giá thêm về hiệu quả lâm sàng, tính an toàn, chi phí, theo dõi tỷ lệ kháng thuốc và tối ưu hóa việc sử dụng chúng.
Trong nhiễm trùng Gram âm
Tỷ lệ nhiễm trùng do vi khuẩn Gram âm đã tăng lên trên toàn thế giới trong thập kỷ qua.
Phần lớn các chủng E. coli và K. pneumoniae, được báo cáo bởi Mạng lưới giám sát kháng thuốc kháng sinh châu Âu (EARSNet, www.ecdc.europa.eu) vào năm 2012, đều kháng ít nhất một trong số các loại thuốc kháng sinh được nghiên cứu và nhiều loại kháng với cephalosporin thế hệ III, fluoroquinolones và aminoglycoside. Đặc biệt quan trọng đối với sức khỏe cộng đồng là lan truyền các beta-lactamase phổ rộng, tạo ra khả năng kháng hầu hết các beta- lactam (thậm chí cả carbapenem đối với một số chủng) và thường liên quan đến khả năng kháng các nhóm kháng sinh khác ở các chủng Enterobacteriaceae phân lập từ cộng đồng và các cơ sở chăm sóc sức khỏe [567-569]. Trong bối cảnh này, điều cần thiết là phải tối ưu hóa chiến lược sử dụng kháng sinh. Một bước quan trọng là xem xét lại các loại kháng sinh hiện đang hoạt động và có sẵn.
Polymyxin
Colistin, được tổng hợp bởi vi khuẩn Bacillus polymyxa, được phát hiện vào năm 1949 [570]. Polymyxin B và polymyxin E (colistin) là 2 polymyxin được sử dụng trong thực hành lâm sàng. Cơ chế hoạt động của chúng bao gồm gắn vào màng tế bào bên ngoài của vi khuẩn Gram âm, dẫn đến thay đổi tính thấm của màng và làm chết tế bào. Colistin ban đầu được sử dụng ở Nhật Bản và Châu Âu trong những năm 1950 và được sử dụng ở Hoa Kỳ dưới dạng colistimethate natri vào năm 1959 [571]. Các công thức tiêm tĩnh mạch của colistin và polymyxin B đã dần bị loại bỏ ở hầu hết các nơi trên thế giới vào đầu những năm 1980 do đã có các báo cáo về tỷ lệ nhiễm độc thận cao [572]. Thật vậy, phần lớn thuốc được bài tiết qua nước tiểu và cần điều chỉnh liều ở bệnh nhân suy thận. Các nghiên cứu gần đây đã chỉ ra rằng quản lý tốt hơn các công thức tiêm tĩnh mạch dẫn đến độc tính ít hơn đáng kể so với báo cáo trong các nghiên cứu trước đây [573]. Colistin dạng hít đã được đề xuất như một phương pháp thay thế, bổ sung cho liệu pháp toàn thân hoặc đơn độc, để điều trị viêm phổi hoặc nhiễm trùng phổi mạn tính do vi khuẩn Gram âm MDR [484,574]. Mặc dù các kết quả đầy hứa hẹn đã được báo cáo nhưng cũng cần có thêm dữ liệu để xác lập vai trò thích hợp của thuốc trên bệnh nhân thở máy [575]. Colistin đã được ATS/IDSA khuyến cáo như một lựa chọn điều trị cho bệnh viêm phổi thở máy (VAP) do các vi khuẩn Gram âm MDR gây ra [200]. Polymyxin tiêm tĩnh mạch đã được xem xét để điều trị các bệnh nhiễm trùng MDR nặng do P. aeruginosa, A. baumannii và Enterobacteriaceae trong nhiều tình huống nhiễm trùng khác nhau, bao gồm viêm phổi, nhiễm khuẩn huyết, nhiễm trùng ổ bụng, nhiễm trùng xương và khớp (BJI), nhiễm trùng đường tiết niệu (UTI) và viêm màng não [573]. Một vấn đề đáng lo ngại là sự xuất hiện tình trạng kháng colistin ở K. pneumoniae tạo carbapenamase (KPC), như đã thấy ở 20% các chủng phân lập ở một số quốc gia [576]. Sự lan rộng của tình trạng kháng colistin có thể liên quan đến việc sử dụng rộng rãi loại thuốc này trong điều trị và cũng do tác động sinh thái của việc sử dụng các quy trình khử trùng trong các đơn vị chăm sóc đặc biệt tạo ra sự chọn lọc [577]. Liên quan đến A. baumanii, tình trạng kháng colistin đã xuất hiện trên phạm vi toàn cầu [578]. Mặc dù vi khuẩn gây bệnh kháng thuốc có liên quan đến việc giảm độc lực in vivo [579] nhưng liệu pháp phối hợp có thể là chiến lược kháng khuẩn tốt nhất. Bên cạnh đó, việc tối ưu hóa việc sử dụng colistin sẽ ngăn chặn sự xuất hiện của các loài kháng colistin một cách tự nhiên, chẳng hạn như s. marcescens và P. mirabilis, là những loài có khả năng gây bùng phát dịch bệnh.
Fosfomycin
Fosfomycin là một chất ức chế chống chuyển hóa, ngăn chặn sự hình thành axit N-acetylmuramic, một tiền chất thiết yếu của sự hình thành chuỗi peptidoglycan trong thành vi khuẩn. Thuốc lần đầu tiên được xác định ở Tây- Ban-Nha vào năm 1969 trong môi trường lên men của một số chủng Streptomyces spp [581]. Fosfomycin có phổ hoạt tính kháng khuẩn rộng, bao gồm tác dụng diệt khuẩn nhanh đối với một số vi khuẩn hiếu khí Gram âm và Gram dương [582]. Không giống như nhiều kháng sinh lựa chọn thay thế khác, các công thức fosfomycin thường được dung nạp tốt, ít độc tính (ngoại trừ khả năng viêm tắc tĩnh mạch khi dùng qua ống thông tĩnh mạch ngoại biên). Việc sử dụng các công thức fosfomycin tiêm tĩnh mạch để điều trị các bệnh nhiễm trùng do vi khuẩn MDR đã cho thấy tỷ lệ thành công lâm sàng cao. Một trong những nghiên cứu đầu tiên về việc sử dụng rộng rãi fosfomycin ở Tây-Ban-Nha đã ghi nhận sự phát triển kháng thuốc ở 3% trong tổng số 959 trường hợp, nhưng ở mức 10% trong số 86 trường hợp nhiễm P. aeruginosa [583]. Tỷ lệ kháng thuốc này xuất hiện dường như ổn định theo thời gian ở các quốc gia đã sử dụng fosfomycin trong nhiều thập kỷ [584]. Tuy nhiên, hiện tượng kháng fosfomycin ở nhiều loài vi khuẩn do gen qua trung gian plasmid gây ra [585]. Các đột biến kháng ở nhiễm sắc thể cũng đã được thông báo [585]. Đây là mối quan tâm lớn về khả năng lựa chọn và lây lan kháng thuốc. Khi được sử dụng để điều trị nhiễm trùng toàn thân, fosfomycin tiêm tĩnh mạch có thể là một thành phần của liệu pháp phối hợp được sử dụng [586].
Trong nhiễm trùng Gram dương P.aureus và Enterococcus spp là hai trong số những vi khuẩn phổ biến nhất gây nhiễm trùng bệnh viện và thường liên quan đến tỷ lệ tử vong cao [587]. Sự đề kháng giữa các tác nhân gây bệnh này với các kháng sinh điều trị hàng đầu như methicillin và vancomycin tiếp tục gia tăng, trong khi giảm tính nhạy cảm với các kháng sinh mới hơn, bao gồm cả linezolid, cũng đang xuất hiện [588]
Trimethoprim-sulfamethoxazole (TMP/SMX)
Kết hợp hai dược chất TMP/SMX hoạt động như một kháng sinh diệt khuẩn phổ rộng và được giới thiệu trên lâm sàng vào đầu những năm 1970 [589]. Trimethoprim là một chất ức chế men khử tetrahydrofolate, khi được thêm vào sulfamethoxazole, sẽ tạo ra bước chặn thứ hai trong con đường sinh tổng hợp folate [590]. Do tính khả dụng sinh học tốt qua đường uống, chế độ điều trị TMP/SMX liều cao đại diện cho một phương pháp thay thế phù hợp đối với nhiễm trùng S. aureus kháng methicillin (MRSA) [591]. Trong một nghiên cứu gần đây với một nhóm gồm 328 bệnh nhân bị nhiễm trùng do MRSA với MIC đối với vancomycin là 2pg/ml, TMP/SMX đơn độc được so sánh thuận lợi với linezolid và daptomycin về hiệu quả điều trị, tỷ lệ tử vong và giảm chi phí kháng sinh [592]. Tình trạng thiếu dữ liệu liên quan đến điều trị TMP-SMZ đối với nhiễm trùng S. aureus nhấn mạnh sự cần thiết phải có thêm các nghiên cứu lâm sàng so sánh thuốc này với các lựa chọn sẵn có khác, cụ thể là vancomycin [593]. Một báo cáo đã cho thấy có tỷ lệ nhạy cảm cao với TMP/SMX (94%) ở các MRSA phân lập được từ nhiễm khuẩn cộng đồng (CA-MRSA) [594].
Tetracyclines
Chlortetracycline, từ đó tetracycline được tạo ra vào năm 1953, được sản xuất bởi Streptomyces aureofaciens. Vào cuối những năm 1960, các hợp chất tác dụng kéo dài thế hệ thứ hai doxycycline (năm 1966) và minocycline (năm 1967) được bán tổng hợp và thương mại hóa. Tetracycline là một nhóm kháng sinh kìm khuẩn phổ rộng có tác dụng chống lại vi khuẩn Gram dương và Gram âm, cũng như chống lại các vi khuẩn nội bào. Những đặc điểm này, cùng với chi phí thấp và hiếm gặp các tác dụng phụ nghiêm trọng, đã khiến tetracycline trở thành nhóm kháng sinh được sử dụng rộng rãi [595]. Tuy nhiên, cần lưu ý rằng nhóm thuốc này chống chỉ định ở phụ nữ mang thai, trẻ sơ sinh và trẻ nhỏ vì tác dụng đặc biệt của chúng đối với sự phát triển của xương và răng [596]. Doxycycline có hoạt tính nội sinh chống lại Enterococci, bao gồm cả VRE. Nhiễm trùng máu do VRE đã được điều trị thành công với doxycycline [597].
Chloramphenicol
Chloramphenicol, hợp chất có hoạt tính do Streptomyces venezuelae sản xuất, ức chế quá trình tổng hợp protein bằng cách gắn thuận nghịch với tiểu đơn vị 50S của ribosome vi khuẩn. Nó được chuyển hóa chủ yếu ở gan. Do đó cần điều chỉnh liều ở bệnh nhân suy gan. Chloramphenicol có sinh khả dụng đường uống tốt và khả năng thâm nhập mô tuyệt vời. Phổ hoạt động của nó rất rộng, bao gồm vi khuẩn Gram dương và Gram âm, vi khuẩn kỵ khí, xoắn khuẩn, Rickettsiae, Chlamydiae và Mycoplasma. Tuy nhiên, ngay sau khi chloramphenicol được lưu hành tại Hoa Kỳ vào năm 1949, các báo cáo đã liên kết loại thuốc này với các tác dụng phụ về huyết học hiếm gặp nhưng có khả năng gây chết người nên đã làm hạn chế sử dụng nó như liệu pháp cuối cùng. Tuy nhiên, vì sẵn có và giá thành thấp nên thuốc vẫn được sử dụng trong nhiều môi trường có hạn chế về nguồn lực [598]. Các nghiên cứu sâu hơn là cần thiết để cập nhật nguy cơ độc tính của nó với liều lượng và theo dõi chính xác hơn [599]. Chloramphenicol được phát hiện là có hiệu quả chống lại Enterococcus faecium kháng vancomycin (VREf), với hoạt tính kìm khuẩn [600]
Clindamycin
Clindamycin được tạo ra bằng cách biến đổi công thức hóa học của lincomycin, được phân lập vào năm 1962 từ Streptomyces lincolnensis [601]. Thuốc này hoạt động bằng cách liên kết với tiểu đơn vị 50S ribosome của rRNA và ức chế sự bắt đầu tổng hợp chuỗi peptide. Mặc dù lo ngại về viêm đại tràng do Clostridium difficile đã làm hạn chế sử dụng clindamycin, nhưng nó vẫn là một loại kháng sinh quan trọng trong điều trị nhiễm trùng kỵ khí nặng. Ưu điểm chính của clindamycin là hoạt tính chống ngoại độc tố tiềm ẩn trong bệnh hoại tử do độc tố Panton-Valentin leucocidin (PVL) của CA- MRSA và nó thường được sử dụng với một loại kháng sinh chống MRSA khác [602]. Vì khả năng xuất hiện kháng thuốc theo cách lan truyền theo chiều ngang bởi các yếu tố di truyền động (mobile genetic elements) [603] clindamycin nên được sử dụng kết hợp với một loại kháng sinh chống Staphylococcus khác như một liệu pháp điều trị kinh nghiệm ở những bệnh nhân nghi ngờ nhiễm Staphylococcus nặng.
Pristinamycin
Pristinamycin, có nguồn gốc từ Streptomyces pristinaespiralis, là kháng sinh đường uống được tạo thành từ hai thành phần hiệp đồng nhưng không liên quan về cấu trúc, pristinamycin IA và pristinamycin IIA (Pristinamycin IA là một macrolide, có phổ tác dụng tương tự như erythromycin. Pristinamycin IIA hay streptogramin A là một depsipeptide. PI và PII được đồng sản xuất bởi S. pristinaespiralis theo tỷ lệ 30:70). Thuốc đã được phát hiện hơn 50 năm trước [604]. Nhiều loài cầu khuẩn đường ruột, kể cả những loài kháng vancomycin mặc dù không bao gồm Enterococcus faecalis, cũng nhạy cảm với pristinamycin [605]. Ở Pháp, khả năng kháng pristinamycin vẫn ở mức thấp trong 40 năm qua và tỷ lệ nhạy cảm điển hình giữa các Staphylococcus là 98% trong cộng đồng [606] và 93% trong bệnh viện [607]. Tuy nhiên, cũng giống như với clindamycin, việc sử dụng pristinamycin có thể tạo điều kiện thuận lợi cho sự lan truyền tính kháng thuốc theo chiều ngang.
Rifampicin
Rifampicin là một hợp chất bán tổng hợp có nguồn gốc từ Streptomyces mediterranei. Nó được giới thiệu vào năm 1967 như là một thuốc chính của phác đồ điều trị lao. Rifampicin có khả năng thâm nhập mô tuyệt vời và hoạt động độc nhất đối với vi khuẩn trong màng sinh học phát triển trên bề mặt của các bộ phận giả sử dụng trong y học. Mặc dù có hoạt tính diệt khuẩn và sinh khả dụng đường uống tuyệt vời nhưng sự xuất hiện nhanh chóng tình trạng kháng thuốc ở vi khuẩn tạo thành một hạn chế lớn và do đó rifampicin nên được sử dụng kết hợp với các thuốc kháng khuẩn khác. Nguyên nhân gây đột biến kháng rifampicin ở vi khuẩn là do biến đổi gen rpoB [608]. Mặc dù thiếu nhóm đối chứng và số lượng bệnh nhân hạn chế, colistin và rifampicin dường như là một liệu pháp phối hợp hiệu quả và an toàn đối với các bệnh nhiễm trùng nặng do A. baumanii MDR [609,610] hoặc P. aeruginosa MDR [61 1]. Điều trị kết hợp rifampicin với a-xít fusidic hoặc với fluoroquinolones đã được chứng minh là có hiệu quả, khi kết hợp với phẫu thuật cắt lọc đối với nhiễm trùng sớm khớp giả (PJI) do MRSA gây ra [612]. Nhưng liệu pháp phối hợp với rifampicin để điều trị nhiễm trùng MRSA nặng cần được nghiên cứu thêm [608].
Fusidic acid (FA)
A-xít fusidic, có nguồn gốc từ nấm Fusidium coccineum, được đưa vào thực hành lâm sàng vào năm 1962 [613]. Nó ức chế sự kéo dài chuỗi polypeptide bằng cách liên kết với phức hợp yếu tố kéo dài G (EF-G)-GDP của ribosome. FA có sinh khả dụng đường uống tuyệt vời và được chuyển hóa và bài tiết qua gan. Hoạt động của FA chủ yếu là kìm khuẩn đối với vi khuẩn Gram dương, nhưng thuốc này có hoạt tính diệt khuẩn ở nồng độ cao hơn. Đáng chú ý, FA chỉ có tác dụng hạn chế đối với Streptococci và Enterococci. Nó liên kết mạnh với protein và đã được chứng minh là có nồng độ tốt trong mô mềm, xương và dịch khớp [614]. Các yếu tố quyết định tính kháng thuốc chính bao gồm đột biến gen fusA mã hóa EF-G và tính kháng thuốc qua trung gian plasmid (nghĩa là thu được gen kháng fusB) [615]. Do đó kháng sinh này phải được sử dụng kết hợp với rifampin hoặc các tác nhân khác để ngăn chặn sự xuất hiện của kháng thuốc.
KẾT LUẬN
Bất chấp những tiến bộ của y học trong chẩn đoán, quản lý, điều trị bằng kháng sinh và phòng ngừa, viêm phổi vẫn tiếp tục có tác động lớn đến các hệ thống chăm sóc sức khỏe trên toàn thế giới. Lựa chọn điều trị kháng sinh theo kinh nghiệm là nền tảng trong quản lý bệnh nhân viêm phổi. Để giảm việc lạm dụng kháng sinh, kháng kháng sinh và tác dụng phụ, cần có một phương pháp điều trị bằng kháng sinh kinh nghiệm, hiệu quả và phù hợp với từng cá nhân. Theo dõi sau khi bắt đầu điều trị bằng kháng sinh cũng rất quan trọng và việc quản lý nên bao gồm chuyển sớm sang kháng sinh đường uống, quản lý theo kết quả vi sinh và điều trị bằng kháng sinh trong thời gian ngắn dựa trên tiêu chí ổn định lâm sàng. Các phương pháp mới để chẩn đoán lâm sàng nhanh (siêu âm phổi) và chẩn đoán vi sinh (sinh học phân tử) rất hứa hẹn. Viêm phổi cộng đồng có liên quan đến tử vong sớm và muộn và tăng tỷ lệ biến cố tim mạch. Cần có những nghiên cứu tập trung vào những vấn đề các bệnh đồng mắc và nguy cơ mất bù trong viêm phổi. Trong gần 75 năm lịch sử điều trị viêm phổi bằng kháng sinh, xương sống của liệu pháp là beta-lactam. Sự xuất hiện của vi khuẩn kháng beta-lactam đã được giải quyết bằng hai chiến lược: các thế hệ hoặc loại beta-lactam mới hơn (penicillin, cephalosporin và carbapenem) và kết hợp với các chất ức chế beta-lactamase.
Sự xuất hiện của vi khuẩn gây bệnh đa kháng thuốc, tuổi dân số ngày càng tăng, số lượng bệnh nhân mắc nhiều bệnh kèm theo và sử dụng nhiều thuốc là những thách thức mà các bác sĩ lâm sàng đang phải đối diện trong việc quản lý bệnh nhân viêm phổi nặng. Mặc dù có một số khác biệt trong hướng dẫn quốc tế về quản lý CAP và HAP/VAP, nhưng việc tuân thủ các khuyến cáo này sẽ đảm bảo kết quả tốt hơn cho bệnh nhân, nhất là bệnh nhân nhập viện, nhập ICU.
Trong việc xây dựng các phác đồ điều trị hợp lý, vai trò quan trọng của xét nghiệm vi sinh luôn được nhấn mạnh. Bên cạnh đó, đối diện với vi khuẩn gây bệnh MDR, các chiến lược sử dụng thuốc đã được đề xuất trong các tài liệu hướng dẫn như kết hợp kháng sinh, ứng dụng PK/PD, khí dung thuốc và tái sử dụng các kháng sinh cũ. Tuy nhiên, cũng cần có nhiều nghiên cứu hơn để xác định tính hợp lý của các khuyến cáo này.
==>> Xem thêm: Viêm phổi bệnh viện: Nguyên nhân, triệu chứng, chẩn đoán theo BMJ
Tài liệu tham khảo
- Stefano Aliberti. Introduction. In: Anti-infectives and the Lung, Edited by Stefano Aliberti, James D. Chalmers and Mathias W. Pletz Editor in Chief Robert Bals. Published by European Respiratory Society ©2017. pp xi
- Drijkoningen JJ, Rohde GG. Pneumococcal infection in adults: burden of disease. Clin Microbiol Infect 2014; 20: Suppl. 5, 45-51.
- Howard LS, Sillis M, Pasteur MC, et al. Microbiological profile of community-acquired pneumonia in adults over the last 20 years. J Infect 2o05; 50: 107-113
- Rosenthal VD, Maki DG, Jamulitrat S, et al. International Nosocomial Infection Control Consortium (INICC) report, data summary for 2003- 2008, issued June 2009. Am J Infect Control 2010; 38: 95-104
- Di Cocco JM, Croce MA. Ventilator-associated pneumonia: an overview. Expert Opin Pharmacother 2o09; 10: 1461-1467.
- Harmanci A, Harmanci O, Akova M. Hospital- acquired pneumonia: challenges and options for diagnosis and treatment. J Hosp Infect 2002; 51: 160- 167.
- Centers for Disease Control and Prevention. Antibiotic resistance threats in the United States, 2013. cdc.gov/ drugresistance/threat-report- 2013 Date last accessed: July 28, 2016. Date last updated: July 17, 2014.
- Vergis EN, Yu VL. New directions for future studies of community-acquired pneumonia: optimizing impact on patient care. Eur J Clin Microbiol Infect Dis 1999;18(i2):847-851
- Luna CM, Famiglietti A, Absi R, et al. Community-acquired pneumonia: etiology, epidemiology, and outcome at a teaching hospital in Argentina. Chest 2000;118(5):1344-1354
- Arnold FW, Summersgill JT, Lajoie AS, et al; Community-Acquired Pneumonia Organization (CAPO) Investigators. A worldwide perspective of atypical pathogens in community-acquired pneumonia. Am J Respir Crit Care Med 2oO7;175(1O):1O86-1O93
- NICE National Clinical Guideline Centre. Diagnosis and management of community- and hospital-acquired pneumonia in adults. 2014 [Internet], https://www.nice.org.uk/https://www.nice.org.uk/guidance/cg 191.
- Lim WS, Baudouin SV, George RC, Hill AT, Jamieson C, Le Jeune I, et al. BTS guidelines for the management of community acquired pneumonia in adults: update 2009. Thorax 2009;64:1-55
- Marti C, John G, Genne D, Prendki V, Rutschmann OT, Stirnemann J, et al. Time to antibiotics administration and outcome in community- acquired pneumonia: secondary analysis of a randomized controlled trial. Eur J Intern Med 2017;43:58-61.
- Lee JS, Giesler DL, Gellad WF, Fine MJ. Antibiotic therapy for adults hospitalized with community-acquired pneumonia. JAMA 2016;315:593.
- Simonetti A, Viasus D, Garcia-Vidal C, Adamuz J, Roset A, Manresa F, et al. Timing of antibiotic administration and outcomes of hospitalized patients with community-acquired and healthcare-associated pneumonia. Clin Microbiol Infect 2012;18:1149-55.
- Maddalena Giannella et al. Time to first antibiotic dose for community-acquired pneumonia: a challenging balance. Clinical Microbiology and Infection 27 (2021) 322-324
- Markus Fally et al. Time to antibiotic administration and patient outcomes in community- acquired pneumonia: results from a prospective cohort study. Clinical Microbiology and Infection 27 (2021) 406-412
- Chalmers JD, Rother C, Salih W, Ewig S. Healthcare-associated pneumonia does not accurately identify potentially resistant pathogens: a systematic review and meta-analysis. Clin Infect Dis. 2014;58(3):330-339
- Jason P. Burnham et al. CAP, HCAP, HAP, VAP The Diachronic Linguistics of Pneumonia. Copyright 2017 American College of Chest Physicians. Published by Elsevier Inc. doi: http://dx.doi.org/10.1016Zj.chest.2017.05.002
- Kalil AC, Metersky ML, Klompas M, et al. Executive summary: man-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016;63(5):575-582.
- Gadsby NJ, Russell CD, McHugh MP, et al. Comprehensive molecular testing for respiratory pathogens in community-acquired pneumonia. Clin Infect Dis. 2016;62(7):817-823.
- Lephart P, Kaye K, Pogue J, et al. Evaluation of the Accelerate PhenoTM system in a clinical setting: comparison of identification and antibiotic susceptibility test results of 224 prospective blood cultures to standard laboratory methods at Detroit Medical Center. Paper presented at: 27th European Congress of Clinical Microbiology and Infectious Diseases (ECCMID); April 24, 2017; Vienna, Austria.
- Christ-Crain M, Stolz D, Bingisser R, et al. Procalcitonin guidance of antibiotic therapy in community-acquired pneumonia: a randomized trial. Am J Respir Crit Care Med 2006;174:84-93.
- Schuetz P, Christ-Crain M, Thomann R, et al, ProHOSP Study Group. Effect of procalcitonin-based guidelines vs standard guidelines on antibiotic use in lower respiratory tract infections: the ProHOSP randomized controlled trial. JAMA 2009;302:1059-66.
- Ito A, Ishida T, Tokumasu H, et al. Impact of procalcitonin-guided therapy for hospitalized community-acquired pneumonia on reducing antibiotic consumption and costs in Japan. J Infect Chemother 2017;23:142-7
- Akagi T, Nagata N, Wakamatsu K, et al. Procalcitonin-guided antibiotic discontinuation might shorten the duration of antibiotic treatment without increasing pneumonia recurrence. Am J Med Sci 2019;358’33-44.
- Metlay JP, Waterer GW, Long AC, et al. Diagnosis and treatment of adults with community- acquired pneumonia. An official clinical practice guideline of the American Thoracic Society and Infectious Diseases Society of America. Am J Respir Crit Care Med 2019;200:e45-67.
- Zhou H, Guo S, Lan T, Ma S, Zhang F, Zhao Z. Risk stratification and prediction value of procalcitonin and clinical severity scores for community-acquired pneumonia in ED. Am J Emerg Med 2018;36:2155-60
- Chalmers JD, Singanayagam A, Hill AT. C- reactive protein is an independent predictor of severity in community-acquired pneumonia. Am J Med 2008;121:219-25.
- Menéndez R, Cavalcanti M, Reyes S, et al. Markers of treatment failure in hospitalised community acquired pneumonia. Thorax 2008;63:447-52
- McCluskey SM, Schuetz P, Abers MS, et al. Serial Procalcitonin as a Predictor of Bacteremia and Need for Intensive Care Unit Care in Adults With Pneumonia, Including Those With Highest Severity: A Prospective Cohort Study. Open Forum Infect Dis 2017;4:ofw238.
- Schuetz P, Wirz Y, Sager R, et al. Effect of procalcitonin-guided antibiotic treatment on mortality in acute respiratory infections: a patient level meta- analysis. Lancet Infect Dis 2018;18:95-107.
- Torres A, Niederman MS, Chastre J, et al. International ERS/ESICM/ ESCMID/ALAT guidelines for the management of hospital-acquired pneumonia and ventilator-associated pneumonia: Guidelines for the management of hospital-acquired pneumonia (HAP)/ventilator-associated pneumonia (VAP) of the European Respiratory Society (ERS), European Society of Intensive Care Medicine (ESICM), European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and Asociación Latinoamericana del Tórax (ALAT). Eur Respir J 2017;50:1700582
- Fine MJ, Hough LJ, Medsger AR et al. (1997). The hospital admission decision for patients with community-acquired pneumonia. Results from the pneumonia Patient Outcomes Research Team cohort study. Arch Intern Med 157:36-44
- Meehan TP, Fine MJ, Krumholz HM et al. (1997). Quality of care, process, and outcomes in elderly patients with pneumonia. JAMA 278:2080- 2084
- Houck PM, Bratzler DW, Nsa W, Ma A, Bartlett JG (2004). Timing of antibiotic administration and outcomes for Medicare patients hospitalized with community-acquired pneumonia. Arch Intern Med 164:637-644
- Mandell LA, Wunderink RG, Anzueto A et al. (2007). Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community- acquired pneumonia in adults. Clin Infect Dis 44(Suppl 2):S2
- Niederman MS, Mandell LA, Anzueto A, et al. Guidelines for the management of adults with community-acquire pneumonia: diagnosis, assessment of severity, antimicrobial therapy, and prevention. Am J Respir Crit Care Med 2001;163(7):1730 – 54.
- Mandell LA, Bartlett JG, Dowell SF, et al. Update of practice guidelines for the management of community-acquired pneumonia in immunocompetent adults. Clin Infect Dis 2003;37(11):1405 – 33.
- Bartlett JG, Dowell SF, Mandell LA, et al. Practice guidelines for the management of community-acquired pneumonia in adults: Infectious Diseases Society of America. Clin Infect Dis 2000;31(2):347 – 82
- Mandell LA, Marrie TJ, Grossman RF, et al. Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by the Canadian Infectious Diseases Society and the Canadian Thoracic Society. The Canadian Community Acquired Pneumonia Working Group. Clin Infect Dis 2000;31(2):383 – 421.
- El-Solh AA, Sikka P, Ramadan F, et al. Etiology of severe pneumonia in the very elderly. Am J Respir Crit Care Med 2001;163(3 Pt 1):645 – 51
- Afessa B, Green B. Bacterial pneumonia in hospitalized patients with HIV infection: the Pulmonary Complications, ICU Support, and Prognostic Factors of Hospitalized Patients with HIV (PIP) Study. Chest 2000;117(4):1017 – 22.
- Leroy O, Santre C, Beuscart C, et al. A five- year study of severe community-acquired pneumonia with emphasis on prognosis in patients admitted to an intensive care unit. Intensive Care Med 1995;21(1):24 – 31.
- Moine P, Vercken JB, Chevret S, et al. Severe community-acquired pneumonia: etiology, epidemiology, and prognosis factors. French Study Group for Community-Acquired Pneumonia in the Intensive Care Unit. Chest 1994;105(5):1487 – 95.
- Gleason PP, Meehan TP, Fine JM, et al. Associations between initial antimicrobial therapy and medical outcomes for hospitalized elderly patients with pneumonia. Arch Intern Med 1999;159(21):2562 – 72.
- Burgess DS, Lewis 2nd JS. Effect of macrolides as part of initial empiric therapy on medical outcomes for hospitalized patients with community-acquired pneumonia. Clin Ther 2000;22(7):872 – 8
- Stahl JE, Barza M, DesJardin J, et al. Effect of macrolides as part of initial empiric therapy on length of stay in patients hospitalized with communityacquired pneumonia. Arch Intern Med 1999;159(21): 2576 – 80.
- Oosterheert JJ, Bonten MJ, Hak E, et al. How good is the evidence for the recommended empirical antimicrobial treatment of patients hospitalized because of community-acquired pneumonia? A systematic review. J Antimicrob Chemother 2003;52(4): 555 – 63.
- Houck PM, MacLehose RF, Niederman MS, et al. Empiric antibiotic therapy and mortality among Medicare pneumonia inpatients in 10 western states: 1993, 1995, and 1997. Chest 2001;119(5):1420 – 6.
- Dudas V, Hopefl A, Jacobs R, et al. Antimicrobial selection for hospitalized patients with presumed community-acquired pneumonia: a survey of non-teaching US community hospitals. Ann Pharmacother 2000;34(4):446 – 52
- Restrepo MI, Mortensen EM, Anzueto A, et al. Mortality in monotherapy versus combination therapy in severe community-acquired pneumonia: a systematic review. Chest 2003;124(4S):190S.
- Niederman Community-acquired pneumonia: the U.S. perspective. Semin Respir Crit Care Med 2009;30:179-188.
- Pneumonia (community-acquired): antimicrobial prescribing NICE guideline Published: 16 September 2019 www.nice.org.uk/guidance/ng138
- Luyan Shen et al. Community-acquired pneumonia: Trends in and research on drug resistance and advances in new antibiotics. BioScience Trends. 2021; 15(5):266-275.
- Wunderink RG, Waterer G. Advances in the causes and management of community acquired pneumonia in adults. BMJ. 2017; 358:j2471.
- Martin Kolditz et al. Monotherapy versus Combination Therapy in Patients Hospitalized with Community-Acquired Pneumonia. Treat Respir Med 2006; 5 (6): 371-383
- Ito A, Ishida T, Tachibana H, Tokumasu H, Yamazaki A, Washio Y. Azithromycin combination therapy for community-acquired pneumonia: propensity score analysis. Sci Rep 2019;9:18406. doi: 10.1038/541598-019-54922-4
- Martin-Loeches I, Lisboa T, Rodriguez A, et al. Combination antibiotic therapy with macrolides improves survival in intubated patients with community-acquired pneumonia. Intensive Care Med 2010;36:612- 20.
- Lodise TP, Kwa A, Cosler L, Gupta R, Smith
- Comparison of beta-lactam and macrolide combination therapy versus fluoroquinolone monotherapy in hospitalized Veterans Affairs patients with community-acquired pneumonia. Antimicrob Agents Chemother 2007;51:3977-82.
- Sligl WI, Asadi L, Eurich DT, Tjosvold L, Marrie TJ, Majumdar SR. Macrolides and mortality in critically ill patients with community-acquired pneumonia: a systematic review and meta-analysis. Crit Care Med 2014;42:420-32.
- Chen Y-X, Wang J-Y, Guo S-B. Use of CRB-65 and quick Sepsis-related Organ Failure Assessment to predict site of care and mortality in pneumonia patients in the emergency department: a retrospective study. Crit Care 2016;20:167
- Kolditz M, Scherag A, Rohde G, Ewig S, Welte T, Pletz M, CAPNETZ Study Group. Comparison of the qSOFA and CRB-65 for risk prediction in patients with community-acquired pneumonia. Intensive Care Med 2016;42:2108-10. doi: 10.1007/S00134-016-4517.
- Anderson R, Steel HC, Cockeran R, et al. Comparison of the effects of macrolides, amoxicillin, ceftriaxone, doxycycline, tobramycin and fluoroquinolones, on the production of pneumolysin by Streptococcus pneumoniae in vitro. J Antimicrob Chemother 2007;60:1155-8.
- Anderson R, Nel JG, Feldman C. Multifaceted role of pneumolysin in the pathogenesis of myocardial injury in community-acquired pneumonia. Int J Mol Sci 2018;19:1147. doi: 339o/ ijms19041147
- Waterer GW. Monotherapy versus combination antimicrobial therapy for pneumococcal pneumonia. Curr Opin Infect Dis 2005;18:157-63
- Baddour LM, Yu VL, Klugman KP, et al, International Pneumococcal Study Group. Combination antibiotic therapy lowers mortality among severely ill patients with pneumococcal bacteremia. Am J Respir Crit Care Med 2004;170:440-4.
- Roson B, Carratala J, Dorca J, et al. Etiology, reasons for hospitalization, risk classes, and outcomes of community-acquired pneumonia in patients hospitalized on the basis of conventional admission criteria. Clin Infect Dis 2001;33(2):158 – 65.
- Garcia-Ordonez MA, Garcia-Jimenez JM, Paez F, et al. Clinical aspects and prognostic factors in elderly patients hospitalised for community-acquired pneumonia. Eur J Clin Microbiol Infect Dis 2001;20(1):14 – 9.
- Meehan TP, Chua-Reyes JM, Tate J, et al. Process of care performance, patient characteristics, and outcomes in elderly patients hospitalized with communityacquired or nursing home-acquired pneumonia. Chest 2000;117(5):1378 – 85
- Pascual FE, Matthay MA, Bacchetti P, et al. Assessment of prognosis in patients with community- acquired pneumonia who require mechanical ventilation. Chest 2000;117(2):503 – 12
- Cordero E, Pachon J, Rivero A, et al. Communityacquired bacterial pneumonia in human immunodeficiency virus-infected patients: validation of severity criteria. The Grupo Andaluz para el Estudio de las Enfermedades Infecciosas. Am J Respir Crit Care Med 2000;162(6):2063 – 8
- Moroney JF, Fiore AE, Harrison LH, et al. Clinical outcomes of bacteremic pneumococcal pneumonia in the era of antibiotic resistance. Clin Infect Dis 2001; 33(6):797 – 805
- Kalin M, Ortqvist A, Almela M, et al. Prospective study of prognostic factors in community- acquired bacteremic pneumococcal disease in 5 countries. J Infect Dis 2000;182(3):840 – 7.
- Metlay JP, Hofmann J, Cetron MS, et al. Impact of penicillin susceptibility on medical outcomes for adult patients with bacteremic pneumococcal pneumonia. Clin Infect Dis 2000;30(3):520 – 8.
- Martinez JA, Horcajada JP, Almela M, et al. Addition of a macrolide to a beta-lactam-based empirical antibiotic regimen is associated with lower in-hospital mortality for patients with bacteremic pneumococcal pneumonia. Clin Infect Dis 2o03;36(4):389 – 95.
- Mufson MA, Stanek RJ. Bacteremic pneumococcal pneumonia in one American city: a 20- year longitudinal study, 1978 – 1997. Am J Med 1999;107(1A): 34S – 43S
- Nishimoto AT, Rosch JW and Tuomanen EI (2020) Pneumolysin: Pathogenesis and Therapeutic Target. Front. Microbiol. 11:1543.
- Fukuda et al. Effects of macrolides on pneumolysin of macrolide-resistant S. pneumoniae.Eur Respir J 2006; 27: 1020-1025
- Allen C. Cheng et al. Macrolide resistance in pneumococci—is it relevant?. Pneumonia (2016) Domon H, Maekawa T, Yonezawa D, Nagai K, Oda M, Yanagihara K, Terao Y. 2018. Mechanism of macrolide-induced inhibition of pneumolysin release involves impairment of autolysin release in macrolide- resistant Streptococcus pneumoniae. Antimicrob Agents Chemother 62:e00161-18.
- Wolter N, von Gottberg A, du Plessis M, de Gouveia L, Klugman KP, Group for Enteric, Respiratory and Meningeal Disease Surveillance in South Africa. Molecular basis and clonal nature of increasing pneumococcal macrolide resistance in South Africa, 2000-2005. Int J Antimicrob Agents. 2008;32:62-7. PMID:18339522,
- Song JH, Chang HH, Suh JY, Ko KS, Jung SI, Oh WS, et al. Macrolide resistance and genotypic characterization of Streptococcus pneumoniae in Asian countries: a study of the Asian Network for Surveillance of Resistant Pathogens (ANSORP). J Antimicrob Chemother. 2004;53:457-63. PMID: 14963068
- Mary PE Slack. A review of the role of H.influenzae in community-acquired pneumonia. Pneumonia 2015, 6:26-43
- Marcos I. Restrepo et al. Antimicrobial Treatment of Community-Acquired Pneumonia. Clin Chest Med 26 (2005) 65 – 73
- Christopher J. Harrison et al. Susceptibilities of Haemophilus influenzae, Streptococcus pneumoniae, including serotype 19A, and Moraxella catarrhalis paediatric isolates from 2005 to 2007 to commonly used antibiotics. Journal of Antimicrobial Chemotherapy (2009) 63, 511-519
- Siddiqui AH, Koirala J. Methicillin Resistant Staphylococcus Aureus. In: StatPearls. StatPearls Publishing, 2021, https://www.ncbi.nlm.nih. gov/books/NBK482221/.
- Baby N, Faust AC, Smith T, Sheperd LA, Knoll Goodman EL. Nasal methicillin-resistant Staphylococcus aureus (MRSA) PCR testing reduces the duration of MRSA-targeted therapy in patients with suspected MRSA pneumonia. Antimicrob Agents Chemother 2017;61:e02432. doi:10.1128/AAC.02432-16
- Brown SM, Jones BE, Jephson AR, Dean NC, Infectious Disease Society of America/American Thoracic Society 2007. Validation of the Infectious Disease Society of America/American Thoracic Society 2007 guidelines for severe community- acquired pneumonia. Crit Care Med 2009;37:3010-6. doi: 10.1097/ CCM.0b013e3181 b030d9
- Chương 6. Hướng dẫn xử trí Viêm phổi cộng đồng người lớn. Trong: Hội lao-bệnh phổi Việt Nam, ĐN Sỹ, NV Thành (chủ biên). Hướng dẫn xử trí các bệnh nhiễm trùng hô hấp dưới không do lao. Y học 2012, tr 141-169.
- Tansarli GS, Mylonakis E. Systematic review and meta-analysis of the efficacy of short-course antibiotic treatments for community-acquired pneumonia in adults. Antimicrob Agents Chemother 2018;62:e00635.
- Lan S-H, Lai C-C, Chang S-P, Lu L-C, Hung S-H, Lin W-T. Five-day antibiotic treatment for community-acquired bacterial pneumonia: A systematic review and meta-analysis of randomized controlled trials. J Glob Antimicrob Resist 2020;23:94- 9.
- Gattarello, S., Borgatta, B., Sole-Violan, J., Valles, J., Vidaur, L., Zaragoza, R.,… Rello, J. (2014). Decrease in mortality in severe community-acquired pneumococcal pneumonia: impact of improving antibiotic strategies (2000-2013). [Multicenter Study Research Support, Non-U.S. Govt]. Chest 146(1), 22-31.
- Valles, J., Diaz, E., Martin-Loeches, I., Bacelar, N., Saludes, P., Lema, J.,… Artigas, A. (2016). Evolution over a 15-year period of the clinical characteristics and outcomes of critically ill patients with severe community-acquired pneumonia. [Comparative Study]. Med. Int. 40(4), 238-245
- Choi, S. H., Chung, J. W., Sung, H., Kim, M. N., Kim, S. H., Lee, S. O.,… Woo, J. H. (2012). Impact of penicillin nonsusceptibility on clinical outcomes of patients with nonmeningeal Streptococcus pneumoniae bacteremia in the era of the 2008 clinical and laboratory standards institute penicillin breakpoints. [Research Support, Non-U. S. Gov’t]. Antimicrob. Agents Chemother. 56(9), 4650-4655
- Metersky, M. L., Waterer, G., Nsa, W., & Bratzler, D. W. (2012). Predictors of in-hospital vs postdischarge mortality in pneumonia. [Research Support, U.S. Gov’t, P.H.S.]. Chest 142(2), 476-481
- Jain, S., Self, W. H., Wunderink, R. G., Fakhran, S., Balk, R., Bramley, A. M.,… Finelli, L. (2015). Community-Acquired Pneumonia Requiring Hospitalization among U.S. Adults. [Multicenter Study Research Support, U.S. Gov’t, P.H.S.]. N. Engl. J. Med. 373 (5), 415-427
- Li, Q., Zhou, L., Zhou, M., Chen, Z., Li, F., Wu, H.,… Feng, Z. (2014). Epidemiology of human infections with avian influenza A(H7N9) virus in China. [Research Support, Non-U.S. Gov’t Research Support, U.S. Gov’t, Non-P.H.S.]. N. Engl. J. Med. 370(6), 520-532.
- MacIntyre, C. R., Chughtai, A. A., Barnes, M., Ridda, I., Seale, H., Toms, R., & Heywood, A. (2018). The role of pneumonia and secondary bacterial infection in fatal and serious outcomes of pandemic influenza a(H1N1)pdm09. [Historical Article Review]. BMC Infect. Dis. 18(1), 637
- Muscedere, J., Ofner, M., Kumar, A., Long, J., Lamontagne, F., Cook, D.,… Fowler, R. (2013). The occurrence and impact of bacterial organisms complicating critical care illness associated with 2009 influenza A(H1N1) infection. [Multicenter Study]. Chest 144(1), 39-47
- Wu, Z., & McGoogan, J. M. (2020). Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72314 Cases From the Chinese Center for Disease Control and Prevention. JAMA..
- Falguera, M., Carratala, J., Ruiz-Gonzalez, A., Garcia-Vidal, C., Gazquez, I., Dorca, J.,… Porcel, J.
- M. (2009). Risk factors and outcome of community- acquired pneumonia due to Gram-negative bacilli. [Research Support, Non-U.S. Gov’t]. Respirology 14(1), 105-111
- Prina, E., Ranzani, O. T., Polverino, E., Cilloniz, C., Ferrer, M., Fernandez, L.,… Torres, A. (2015). Risk factors associated with potentially antibiotic- resistant pathogens in community-acquired pneumonia. [Observational Study Research Support, Non-U.S. Gov’t]. Ann Am Thorac Soc 12(2), 153-160
- Deresinski, S. (2005). Methicillin-resistant Staphylococcus aureus: an evolutionary, epidemiologic, and therapeutic odyssey. [Review]. Clin. Infect. Dis. 40(4), 562-573.
- Micek, S. T., Dunne, M., & Kollef, M. H. (2005). Pleuropulmonary complications of Panton-Valentine leukocidin-positive community-acquired methicillin- resistant Staphylococcus aureus: importance of treatment with antimicrobials inhibiting exotoxin production. [Case Reports]. Chest 128(4), 2732-2738
- Aliberti, S., Reyes, L. F., Faverio, P., Sotgiu, G., Dore, S., Rodriguez, A. H.,… Restrepo, M. I. (2016). Global initiative for meticillin-resistant Staphylococcus aureus pneumonia (GLIMP): an international, observational cohort study. [Multicenter Study Observational Study]. Lancet Infect. Dis. 16(12), 1364-1376
- Marta Francesca Di Pasquale et al. Prevalence and Etiology of Community-acquired Pneumonia in Immunocompromised Patients. Clinical Infectious Diseases® 2019;68(9):1482-93
- Clavo-Sanchez, A. J., Giron-Gonzalez, J. A., Lopez-Prieto, D., Canueto-Quintero, J., SanchezPorto, A., Vergara-Campos, A.,… Cordoba- Dona, J. A. (1997). Multivariate analysis of risk factors for infection due to penicillin-resistant and multidrug-resistant Streptococcus pneumoniae: a multicenter study. [Multicenter Study Research Support, Non-U.S. Gov’t]. Clin. Infect. Dis. 24(6), 1052-1059.
- Lee, C. R., Lee, J. H., Park, K. S., Jeon, J. H., Kim, Y. B., Cha, C. J.,… Lee, S. H. (2017). Antimicrobial Resistance of Hypervirulent Klebsiella pneumoniae: Epidemiology, Hypervirulence-Associated Determinants, and Resistance Mechanisms. [Review Research Support, Non-U.S. Gov’t]. Front. Cell. Infect. Microbiol. 7, 483.
- Kumar, A., Roberts, D., Wood, K. E., Light, B., Parrillo, J. E., Sharma, S.,… Cheang, M. (2006). Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. [Comparative Study Multicenter Study Research Support, Non-U.S. Gov’t]. Crit. Care Med. 34(6), 1589-1596.
- Torres, A., Chalmers, J. D., Dela Cruz, C. S., Dominedo, C., Kollef, M., Martin-Loeches, I.,… Wunderink, R. G. (2019). Challenges in severe community-acquired pneumonia: a point-of-view review. [Review]. Intensive Care Med. 45(2), 159-171
- Weiss, K., & Tillotson, G. S. (2005). The controversy of combination vs monotherapy in the treatment of hospitalized community-acquired pneumonia. [Review]. Chest 128(2), 940-946.
- Adrie, C., Schwebel, C., Garrouste-Orgeas, M., Vignoud, L., Planquette, B., Azoulay, E.,… Timsit, J. F. (2013). Initial use of one or two antibiotics for critically ill patients with community-acquired pneumonia: impact on survival and bacterial resistance. Crit. Care 17(6), R265.
- Rodriguez, A., Mendia, A., Sirvent, J. M., Barcenilla, F., de la Torre-Prados, M. V., SoleViolan, J., & Rello, J. (2007). Combination antibiotic therapy improves survival in patients with community- acquired pneumonia and shock. [Multicenter Study Research Support, Non-U.S. Gov’t]. Crit. Care Med. 35(6), 1493-1498.
- Asadi, L., Sligl, W. I., Eurich, D. T., Colmers, I. N., Tjosvold, L., Marrie, T. J., & Majumdar, S. R. (2012). Macrolide-based regimens and mortality in hospitalized patients with community-acquired pneumonia: a systematic review and meta-analysis. [MetaAnalysis Research Support, Non-U.S. Gov’t Review Systematic Review]. Clin. Infect. Dis. 55(3), 371-380
- Vardakas, K. Z., Trigkidis, K. K., & Falagas, M. E. (2017). Fluoroquinolones or macrolides in combination with beta-lactams in adult patients hospitalized with community acquired pneumonia: a systematic review and meta-analysis. [Meta-Analysis Review Systematic Review]. Clin. Microbiol. Infect. 23(4), 234-241
- Leroy, O., Saux, P., Bedos, J. P., & Caulin, E. (2005). Comparison of levofloxacin and cefotaxime combined with ofloxacin for ICU patients with community-acquired pneumonia who do not require vasopressors. [Clinical Trial Comparative Study Multicenter Study Randomized Controlled Trial Research Support, Non-U.S. Gov’t]. Chest 128(1), 172-183.
- Farnham, A., Alleyne, L., Cimini, D., & Balter, S. (2014). Legionnaires’ disease incidence and risk factors, New York, New York, USA, 2002-2011. [Research Support, Non-U.S. Gov’t Research Support, U.S. Gov’t, P.H.S.]. Emerg. Infect. Dis. 20(11), 1795-1802.
- Yu, V. L., Greenberg, R. N., Zadeikis, N., Stout, J. E., Khashab, M. M., Olson, W. H., & Tennenberg, A. M. (2004). Levofloxacin efficacy in the treatment of community-acquired legionellosis. [Comparative Study Multicenter Study Research Support, Non-U.S. Gov’t]. Chest 125(6), 2135-2139.
- Sicot, N., Khanafer, N., Meyssonnier, V., Dumitrescu, O., Tristan, A., Bes, M.,… Gillet, Y. (2013). Methicillin resistance is not a predictor of severity in community-acquired Staphylococcus aureus necrotizing pneumonia-results of a prospective observational study. Clin. Microbiol. Infect. 19(3), E142-E148
- Michael S. Niederman et al. Updates on community acquired pneumonia management in the ICU. Pharmacology & Therapeutics 217 (2021) 107663
- Ramirez, J. A., & Bordon, J. (2001). Early switch from intravenous to oral antibiotics in hospitalized patients with bacteremic community- acquired Streptococcus pneumoniae pneumonia. Arch. Intern. Med. 161(6), 848-850.
- Muller, F., Christ-Crain, M., Bregenzer, T., Krause, M., Zimmerli, W., Mueller, B., & Schuetz, P. (2010). Procalcitonin levels predict bacteremia in patients with community-acquired pneumonia: a prospective cohort trial. [Clinical Trial Comparative Study Research Support, Non-U.S. Govt]. Chest 138(1), 121-129
- Bouadma, L., Luyt, C. E., Tubach, F., Cracco, Alvarez, A., Schwebel, C.,… Wolff, M. (2010). Use of procalcitonin to reduce patients’ exposure to antibiotics in intensive care units (PRORATA trial): a multicentre randomised controlled trial. [Multicenter Study Randomized Controlled Trial Research Support, Non-U.S. Gov’t]. Lancet 375(9713), 463-474
- Barbara Jones et al. Advances in community- acquired pneumonia. Ther Adv Infectious Dis 2020, Vol. 7: 1-11
- Falcone M, Russo A, Giannella M, Cangemi R, Scarpellini MG, Bertazzoni G, et al. Individualizing risk of multidrug-resistant pathogens in community- onset pneumonia. PLoS One 2015;10:e0119528.
- Aliberti S, Cilloniz C, Chalmers JD, Zanaboni AM, Cosentini R, Tarsia P, et al. Multidrug-resistant pathogens in hospitalised patients coming from the community with pneumonia: a European perspective. Thorax 2013;68:997-999.
- Falcone M, Daikos GL, Tiseo G, Bassoulis D, Giordano C, Galfo V, et al. Efficacy of ceftazidime- avibactam plus aztreonam in patients with bloodstream infections caused by MBL- producing Enterobacterales. Clin Infect Dis [online ahead of print] 19 May 2020;
- Yuichiro Shindo, Ryota Ito, Daisuke Kobayashi et al. Risk Factors for Drug-Resistant Pathogens in Community-acquired and Healthcare-associated Pneumonia. Am J Respir Crit Care Med Vol 188, Iss. 8, pp 985-995, Oct 15, 2013
- Takaya Maruyama et al. A Therapeutic Strategy for All Pneumonia Patients: A 3-Year Prospective Multicenter Cohort Study Using Risk Factors for Multidrug-resistant Pathogens to Select Initial Empiric Therapy
- Antoni Torres, Catia Cillóniz, Miquel Ferrer et al. Bacteraemia and antibiotic-resistant pathogens in community acquired pneumonia: risk and prognosis. Eur Respir J 2015; 45: 1353-1363 DOI: 10.1183/09031936.00152514
- American Thoracic Society Documents. Guidelines for the Management of Adults with Hospital-acquired, Ventilator-associated, and Healthcare-associated Pneumonia.Am J Respir Crit Care Med Vol 171. pp 388-416, 2005
- Kollef MH, Morrow LE, Baughman RP, et al. Health-care associated pneumonia (HCAP): a critical appraisal to improve identification, management, and outcomes-Proceedings of the HCAP summit. Clin Infect Dis 2008;46(Suppl 4):S296-334
- Brito V, Niederman MS. Healthcare-associated pneumonia is a heterogeneous disease, and all patients do not need the same broad-spectrum antibiotic therapy as complex nosocomial pneumonia. Curr Opin Infect Dis 2009;22:316-25.
- Shorr AF, Zilberberg MD, Micek ST, Kollef MH. Prediction of infection due to antibiotic-resistant bacteria by select risk factors for health care- associated pneumonia. Arch Intern Med 2008;168:2205- 10.
- Shorr AF, Zilberberg MD, Reichley R, et al. Validation of a clinical score for assessing the risk of resistant pathogens in patients with pneumonia presenting to the emergency department. Clin Infect Dis 2012;54:193-8.
- Aliberti S, Di Pasquale M, Zanaboni AM, et al. Stratifying risk factors for multidrug-resistant pathogens in hospitalized patients coming from the community with pneumonia. Clin Infect Dis 2012;54:470-8
- Shindo Y, Ryota I, Kobayashi D, et al. Risk factors for drug-resistant pathogens in community- acquired and healthcare-associated pneumonia. Am J Respir Crit Care Med 2013;188:985-95.
- Webb BJ, Dascomb K, Stenehjem E, Vikram HR, Agrwal N, Sakata K, et al. Derivation and multicenter validation of the drug resistance in pneumonia clinical prediction score. Antimicrob Agents Chemother 2016;60:265
- Cilloniz C, Dominedo C, Peroni HJ, et al. Difficult to treat microorganisms in patients aged over 80 years with community-acquired pneumonia: the prevalence of PES pathogens. Eur Respir J 2020;56:2000773.
- Cillóniz C, Dominedò C, Nicolini A, Torres A. PES pathogens in severe community-acquired pneumonia. Microorganisms 2019;7:49.
- Ishida T, Ito A, Washio Y, et al. Risk factors for drug-resistant pathogens in immunocompetent patients with pneumonia: Evaluation of PES pathogens. J Infect Chemother 2017;23:23-8.
- Kobayashi D, Shindo Y, Ito R, et al. Validation of the prediction rules identifying drug-resistant pathogens in community-onset pneumonia. Infect Drug Resist 2018;11:1703-13.
- Marco Falcone et al. Community-acquired Pneumonia Owing to Multidrug-Resistant Pathogens: A Step toward an Early Identification. AnnalsATS Volume 18 Number 2| February 2021. DOI: 10.1513/AnnalsATS.202009-1207ED
- Cillóniz C, Ewig S, Polverino E, et al. Microbial aetiology of community-acquired pneumonia and its relation to severity. Thorax. 2011;66:340-6.
- Magiorakos A-P, Srinivasan A, Carey RB, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect. 2012;18:268-81.
- Cillóniz C, Gabarrús A, Ferrer M, et al. Community-acquired pneumonia due to multidrug and non-multidrug resistant Pseudomonas aeruginosa. Chest. 2016;150:415-25.
- Catia Cillóniz et al. Multidrug Resistant Gram-Negative Bacteria in Community-Acquired Pneumonia. Critical Care (2019) 23:79
- Cao B, Huang Y, She DY, et al. Diagnosis and treatment of community-acquired pneumonia in adults: 2016 clinical practice guidelines by the Chinese thoracic society, Chinese Medical Association. Clin Respir J. 2018;12: 1320-60.
- National Health and Medical Research Council. Therapeutic guidelines antibiotic version 15. In: Australian Clinical Practice Guidelines. Canberra: National Health and Medical Research Council; 2014.
- Nicola Petrosillo et al. Management of antibiotic resistance in the intensive care unit setting. Expert Rev. Anti Infect. Ther. 8(3), 289-302 (2010)
- Morse PA, North N, Steenbergen JN, Sakoulas G. Susceptibility relationship between vancomycin and daptomycin in Staphylococcus aureus: facts and assumption. Lancet Infect. Dis. 9, 617-624 (2009).
- Moise PA, Sakoulas G, Forrest A, Schentag JJ. Vancomycin in vitro bactericidal activity and its relationship to efficacy in clearance of methicillin- resistant Staphylococcus aureus bacteremia. Antimicrob. Agents Chemother. 51, 2582-2586 (2007).
- Sakoulas G, Moise-Broder PA, Schentag J, Forrest A, Moellering RC Jr, Eliopoulos GM. Relationship of MIC and bactericidal activity to efficacy of vancomycin for treatment of methicillin- resistant Staphylococcus aureus bacteremia. J. Clin. Microbiol. 42, 2398-2402 (2004).
- Moise-Broder PA, Sakoulas G, Eliopoulos GM, Schentag JJ, Forrest A, Moellering RC Jr. Accessory gene regulator group II polymorphism in methicillin- resistant Staphylococcus aureus is predictive of failure of vancomycin therapy. Clin. Infect. Dis. 38, 1700-1705 (2004).
- Hidayat LK, Hsu DI, Quist R, Shriner KA, Wong-Beringer A. High-dose vancomycin therapy for methicillin-resistant Staphylococcus aureus infections: efficacy and toxicity. Arch. Intern. Med. 166, 2138-2144 (2006).
- Maclayton DO, Suda KJ, Coval KA, York CB, Garey KW. Case-control study of the relationship between MRSA bacteremia with a vancomycin MIC of 2ụg/ml and risk factors, costs, and outcomes in inpatients undergoing hemodialysis. Clin. Ther. 28, 1208-1216 (2006).
- Soriano A, Marco F, Martinez JA et al. Influence of vancomycin minimum inhibitory concentration on the treatment of methicillin resistant Staphylococcus aureus bacteremia. Clin. Infect. Dis. 46, 193-200 (2008).
- Lodise TP, Graves J, Evans A et al. Relationship between vancomycin MIC and íailure among patients with methicillin resistant Staphylococcus aureus bacteremia treated with vancomycin. Antimicrob. Agents Chemother. 52, 3315-3320 (2008).
- Howden BP, Ward PB, Charles PG et al. Treatment outcomes íor serious iníections caused by methicillin-resistant Staphylococcus aureus with reduced vancomycin susceptibility. Clin. Iníect. Dis. 38, 521-528 (2004).
- Szabó J. hVISA/VISA: diagnostic and therapeutic problems. Expert Rev. Anti Iníect. Ther. 7, 1-3 (2009).
- Tenover FC, Moellering RC Jr. The rationale íor revising the Clinical and Laboratory Standards Institute vancomycin minimal inhibitory concentration interpretive criteria íor Staphylococcus aureus. Clin. Iníect. Dis. 44, 1208-1215 (2007).
- Price J, Atkinson S, Llewelyn M, Paul J. Paradoxical relationship between the clinical outcome oí Staphylococcus aureus bacteremia and the minimum inhibitory concentration oí vancomycin. Clin. Iníect. Dis. 48, 996-997 (2009).
- Soriano A, Martinez JA, Mensa J. Reply to Price et al and to Pea and Viale. Clin. Iníect. Dis. 49, 643-645 (2009).
- Thomas J. Marrie. Acute Bronchitis and Community-Acquired Pneumonia. In: Fishman’s Pulmonary Diseases and Disorders. Fiíth edition. Michael A. Grippi (edit). Chapter 128. Pp 1966-1980
- Musuuza JS, Watson L, Parmasad V, Putman-Buehler N, Christensen L, Saídar N. Prevalence and outcomes oí co-iníection and superiníection with SARS-CoV-2 and other pathogens: A systematic review and meta-analysis. PLoS One 2021;16:e0251170
- Feldman C, Anderson R. The role of co- infections and secondary infections in patients with COVID-19. Pneumonia (Nathan) 2021;13:5.
- Han J, Gatheral T, Williams C. Procalcitonin íor patient stratiíication and identiíication oí bacterial co- iníection in COVID-19. Clin Med (Lond) 2020;20:e47
- Drewett GP, Smibert OC, Holmes NE, Trubiano JA. The use oí procalcitonin as an antimicrobial stewardship tool and a predictor oí disease severity in coronavirus disease 2019 (COVID-19). Iníect Control Hosp Epidemiol 2021;1-3
- National Institutes oí Health. Iníormation on Covid-19 treatment, prevention and research. Covid- 19 treatment guidelines.https://www.covid19treatmentguidelines.nih.gov/
- Beigel JH, Tomashek KM, Dodd LE, et al, ACTT-1 Study Group Members. Remdesivir íor the treatment oí covid-19—íinal report. N Engl J Med 2020;383:1813-26.
- Pan H, Peto R, Henao-Restrepo AM, et al, WHO Solidarity Trial Consortium. Repurposed antiviral drugs íor covid-19—interim WHO Solidarity Trial results. N Engl J Med 2021 ;384:497-511.
- https://www.idsociety.org/covid-19- real-time-learning-network/therapeutics-and- interventions/remdesivir/
- Martin-Loeches I, Schultz MJ, Vincent JL, Alvarez-Lerma F, Bos LD, Sole Violan J, Torres A, Rodriguez A (2017) Increased incidence oí co- iníection in critically ill patients with iníuenza. Intensive Care Med 43:48-58
- Piralla A, Rovida F, Girello A, Premoli M, Mojoli F, Belliato M, Braschi A, Iotti G, Pariani E, Bubba L, Zanetti AR, Baldanti F (2017) Frequency oí respiratory virus iníections and next-generation analysis oí iníuenza A/ H1N1pdm09 dynamics in the lower respiratory tract oí patients admitted to the ICU. PLoS ONE 12:e0178926
- Jeíerson T, Jones MA, Doshi P, Del Mar CB, Hama R, Thompson MJ, Spen cer EA, Onakpoya I, Mahtani KR, Nunan D, Howick J, Heneghan CJ (2014) Neuraminidase inhibitors for preventing and treating infuenza in healthy adults and children. Cochrane Database Syst Rev 132:Cd008965
- Jeferson T, Jones M, Doshi P, Spencer EA, Onakpoya I, Heneghan CJ (2014) Oseltamivir for infuenza in adults and children: systematic review of clinical study reports and summary of regulatory comments. BMJ 348:g2545
- Heneghan CJ, Onakpoya I, Thompson M, Spencer EA, Jones M, Jeferson T (2014) Zanamivir for infuenza in adults and children: systematic review of clinical study reports and summary of regulatory comments. BMJ 348:g2547
- Dobson J, Whitley RJ, Pocock S, Monto AS (2015) Oseltamivir treatment for infuenza in adults: a meta-analysis of randomised controlled trials. Lancet (London, England) 385:1729-1737
- Lackenby A, Besselaar TG, Daniels RS, Fry A, Gregory V, Gubareva LV, Huang W, Hurt AC, Leang SK, Lee RTC, Lo J, Lollis L, Maurer-Stroh S, Oda giri T, Pereyaslov D, Takashita E, Wang D, Zhang W, Meijer A (2018) Global update on the susceptibility of human infuenza viruses to neuramini dase inhibitors and status of novel antivirals, 2016-2017. Antiviral Res 157:38-46
- Torres A, Sibila O, Ferrer M, Polverino E, Menendez R, Mensa J, Gabarrus A, Sellares J, Restrepo MI, Anzueto A, Niederman MS, Agusti C (2015) Effect of corticosteroids on treatment failure among hospitalized patients with severe community- acquired pneumonia and high infammatory response: a randomized clinical trial. JAMA 313:677-686
- Stern A, Skalsky K, Avni T, Carrara E, Leibovici L, Paul M (2017) Corticosteroids for pneumonia. Cochrane Database Syst Rev 12:Cd007720
- Mc Mahon A, Martin-Loeches I (2017) The pharmacological management of severe infuenza infection—’existing and emerging therapies’. Expert Rev Clin Pharmacol 10:81-95
- Moreno G, Rodriguez A, Reyes LF, Gomez J, Sole-Violan J, Diaz E, Bodi M, Trefer S, Guardiola J, Yebenes JC, Soriano A, Garnacho-Montero J, Socias L, Del Valle Ortiz M, Correig E, Marin-Corral J, Vallverdu-Vidal M, Restrepo MI, Torres A, Martin- Loeches I (2018) Corticosteroid treatment in critically ill patients with severe infuenza pneumonia: a propensity score match ing study. Intensive Care Med 44:1470-1482
- Marty FM, Vidal-Puigserver J, Clark C, Gupta SK, Merino E, Garot D, Chap man MJ, Jacobs F, Rodriguez-Noriega E, Husa P, Shortino D, Watson HA, Yates PJ, Peppercorn AF (2017) Intravenous zanamivir or oral oseltamivir for hospitalised patients with infuenza: an international, randomised, double- blind, double-dummy, phase 3 trial. Lancet Respir Med 5:135-146
- Charles L. Daley et al. Treatment of Nontuberculous Mycobacterial Pulmonary Disease: An Official ATS/ERS/ESCMID/IDSA Clinical Practice Guideline. Eur Respir J. 2020 July ; 56(1)
- Gibson, R.L.; Burns, J.L.; Ramsey, B.W. Pathophysiology and management of pulmonary infections in cystic fibrosis. Am. J. Respir. Crit. Care Med. 2003, 168, 918-951
- Blumer, J.L.; Saiman, L.; Konstan, M.W.; Melnick, D. The efficacy and safety of meropenem and tobramycin vs ceftazidime and tobramycin in the treatment of acute pulmonary exacerbations in patients with cystic fibrosis. Chest 2005, 128, 2336- 2346.
- Aaron, S.D.; Ferris, W.; Henry, D.A.; Speert, Macdonald, N.E. Multiple combination bactericidal antibiotic testing for patients with cystic fibrosis infected with Burkholderia cepacia. Am. J. Respir. Crit. Care Med. 2000, 162, 1206-1212.
- Zhou, J.; Chen, Y.; Tabibi, S.; Alba, L.; Garber; Saiman, L. Antimicrobial susceptibility and synergy studies of Burkholderia cepacia complex isolated from patients with cystic fibrosis. Antimicrob. Agents Chemother. 2007, 51, 1085-1088.
- Peeters, E.; Nelis, H.J.; Coenye, T. In vitro activity of ceftazidime, ciprofloxacin, meropenem, minocycline, tobramycin and trimethoprim/sulfamethoxazole against planktonic and sessile Burkholderia cepacia complex bacteria. J. Antimicrob. Chemother. 2009, 64, 801-809
- Micek ST, Wunderink RG, Kollef MH, et al. An international multicenter retrospective study of Pseudomonas aeruginosa nosocomial pneumonia: impact of multidrug resistance. Crit Care 2015;19:219.
- Cillóniz C, Dominedò C, Torres A. An overview of guidelines for the management of hospital-acquired and ventilator-associated pneumonia caused by multidrug-resistant Gram-negative bacteria. Curr Opin Infect Dis 2019;32:656-62.
- Cerceo E, Deitelzweig SB, Sherman BM, Amin Multidrug-resistant Gram negative bacterial infections in the hospital setting: overview, implications for clinical practice, and emerging treatment options. Microb Drug Resist 2016;22:412- 31.
- Watkins RR, Van Duin D. Current trends in the treatment of pneumonia due to multidrug-resistant Gram negative bacteria. F1000Res. 2019 Jan 30;8:F1000 Faculty Rev-121.
- Bassetti M, Righi E, Vena A, Graziano E, Russo A, Peghin M. Risk stratification and treatment of ICU-acquired pneumonia caused by multidrug- resistant/extensively drug-resistant/pandrug-resistant bacteria. Curr Opin Crit Care 2018;24:385-93.
- Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis 2016;63:e61-111.
- Ekren PK, Ranzani OT, Ceccato A, et al. Evaluation of the 2016 Infectious Diseases Society of America/American Thoracic Society guideline criteria for risk of multidrug-resistant pathogens in patients with hospital-acquired and ventilator-associated pneumonia in the ICU. Am J Respir Crit Care Med 2018;197:826-30
- Miguel Vacas-Córdoba et al. Empirical treatment of adults with hospital-acquired pneumonia: lights and shadows of the 2016 Clinical Practice ATS/IDSA Guidelines
- Marin H. Kollef et al. Health Care-Associated Pneumonia (HCAP): A Critical Appraisal to Improve Identification, Management, and Outcomes Proceedings of the HCAP Summit. Clinical Infectious Diseases 2008; 46:S296-334
- Giantsou E, Liratzopoulos N, Efraimidou E, Panopoulo M, Alepopoulo E, Kartali-Ktenidou S, et al. Both early-onset and late-onset ventilator-associated pneumonia are caused mainly by potentially multiresistant bacteria. Intensive Care Med. 2005, 31, 1488-94.
- Ibrahim EH, Ward S, Sherman G, Kollef MH. A comparative analysis of patients with early-onset vs. late-onset nosocomial pneumonia in the ICU setting. Chest. 2000, 117, 1434-42.
- Jones R.N et al. Microbial etiologies of hospital- acquired bacterial pneumonia and ventilator- associated bacterial pneumonia. Clin. Infect. Dis. 2010, 51, S81-S87.
- H0iby, T. Bjarnsholt, M. Givskov, S. Molin, and O. Ciofu, Antibiotic resistance of bacterial biofilms. International Journal of Antimicrobial Agents, vol. 35, no. 4, pp. 322-332, 2010.
- Alizamin Sadigov. Risk factors for multidrug-resistant pathogens in hospital-associated and ventilator-associated pneumonia: combined therapy is helpful for treatment?. chestjournal.org. DOI: https://doi.org/10.1016/j.chest.2018.08.157 (Chest journal annual meeting 2018).
- Pieter O Depuydt et al. Determinants and impact of multidrug antibiotic resistance in pathogens causing ventilator-associated-pneumonia. Critical Care 2008, 12:R142 (doi:10.1186/cc7119)
- Renato Seligman, Luis Francisco Ramos-Lima, Vivian do Amaral Oliveira et al. Risk factors for infection with multidrug-resistant bacteria in non- ventilated patients with hospital-acquired pneumonia. J Bras Pneumol. 2013;39(3):339-348.
- Rello J, Gallego M, Mariscal D et al. (1997). The value of routine microbial investigation in ventilator-associated pneumonia. Am J Respir Crit Care Med 156:196-200
- Hien H. Nguyen. Pneumonia. In: (eds) Arch G. Mainous III et al. Management of Antimicrobials in Infectious Diseases Impact of Antibiotic Resistance. Second Edition. © Springer Science+Business Media, LLC 2010. Pp169-182
- Beardsley JR, Williamson JC, Johnson JW et al. (2006). Using local microbiologic data to develop institution-specific guidelines for the treatment of hospital-acquired pneumonia. Chest 130:787-793
- Singh N, Rogers P, Atwood CW et al. (2000). Short-course empiric antibiotic therapy for patients with pulmonary infiltrates in the intensive care unit. A proposed solution for indiscriminate antibiotic prescription. Am J Respir Crit Care Med 162:505-511
- Chastre J, Wolff M, Fagon JY et al. (2003). Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: A randomized trial. JAMA 290:2588-2598
- Aarts MA, Hancock JN, Heyland D et al. Empiric antibiotic therapy for suspected ventilator- associated pneumonia: a systematic review and meta-analysis of randomized trials. Crit. Care Med. 36, 108-117 (2008)
- Micek ST, Lloyd AE, Ritchie DJ, Reichley RM, Fraser VJ, Kollef MH. Pseudomonas aeruginosa bloodstream infection: importance of appropriate initial antimicrobial treatment. Antimicrob. Agents Chemother. 49, 1306-1311 (2005).
- Pea F, Viale P. The antimicrobial therapy puzzle: could pharmacokinetic- pharmacodynamic relationships be helpful in addressing the issue of appropriate pneumonia treatment in critically ill patients? Clin. Infect. Dis. 42, 1764-1771 (2006).
- Rybak MJ, Lomaestro BM, Rotscahfer JC et al. Vancomycin therapeutic guidelines: a summary of consensus recommendations from the infectious diseases Society of America, the American Society of Health-System Pharmacists and the Society of Infectious Diseases Pharmacists. Clin. Infect. Dis. 49, 325-327 (2009).
- Nation RL, Li J. 118a. Curr. Opin. Infect. Dis. 22, 535-543 (2009).
- Rello J, Sa-Borges M, Correa H, Leal SR, Baraibar J. Variations in etiology of ventilator- associated pneumonia across four treatment sites: implications for antimicrobial prescribing practices. Am J Respir Crit Care Med 1999; 160:608-13.
- Babcock HM, Zack JE, Garrison T, Trovillion E, Kollef MH, Fraser VJ. Ventilator-associated pneumonia in a multi-hospital system: differences in microbiology by location. Infect Control Hosp Epidemiol 2003; 24:853-8.
- Namias N, Samiian L, Nino D, et al. Incidence and susceptibility of pathogenic bacteria vary between intensive care units within a single hospital: implications for empiric antibiotic strategies. J Trauma 2000; 49:638-45; discussion 45-6.
- Rodrigo Cavallazzi et al. Combination antibiotic therapy and synergy in HAP and VAP. In: Anti- infectives and the Lung. Edited by Stefano Aliberti, James D. Chalmers and Mathias W. Pletz Editor in Chief Robert Bals. Published by European Respiratory Society ©2017. Chapter 19, p 302.
- Luna CM, Vujacich P, Niederman MS, et al. Impact of BAL data on the therapy and outcome of ventilator-associated pneumonia. Chest 1997; 111:676-685.
- Zilberberg MD, Nathanson BH, Sulham K, et al. Multidrug resistance, inappropriate empiric therapy, and hospital mortality in Acinetobacter baumannii pneumonia and sepsis. Crit Care 2016; 20: 221.
- Eliopoulos GM, Moellering RC Jr. Antibiotic synergism and antimicrobial combinations in clinical infections. Rev Infect Dis 1982; 4: 282-293.
- Ein ME, Smith NJ, Aruffo JF, et al. Susceptibility and synergy studies of methicillin- resistant Staphylococcus epidermidis. Antimicrob Agents Chemother 1979; 16: 655-659.
- Soothill G, Hu Y, Coates A. Can we prevent antimicrobial resistance by using antimicrobials better? Pathogens 2013; 2: 422-435.
- Uriarte SM, Molestina RE, Miller RD, et al. Effect of macrolide antibiotics on human endothelial cells activated by Chlamydia pneumoniae infection and tumor necrosis factor-alpha. J Infect Dis 2002; 185: 1631-1636.
- Shinkai M, Foster GH, Rubin BK. Macrolide antibiotics modulate ERK phosphorylation and IL-8 and GM-CSF production by human bronchial epithelial cells. Am J Physiol Lung Cell Mol Physiol 2006; 290: L75-L85.
- Khair OA, Devalia JL, Abdelaziz MM, et al. Effect of erythromycin on Haemophilus influenzae endotoxin-induced release of IL-6, IL-8 and sICAM-1 by cultured human bronchial epithelial cells. Eur Respir J 1995; 8: 1451-1457.
- Postma DF, van Werkhoven CH, van Elden LJ, et al. Antibiotic treatment strategies for community- acquired pneumonia in adults. N Engl J Med 2015; 372: 1312-1323.
- Garin N, Genné D, Carballo S, et al. p-Lactam monotherapy vs p-lactam-macrolide combination treatment in moderately severe community-acquired pneumonia: a randomized noninferiority trial. JAMA Intern Med 2014; 174: 1894-1901.
- Azeh I, Gerber J, Wellmer A, et al. Protein synthesis inhibiting clindamycin improves outcome in a mouse model of Staphylococcus aureus sepsis compared with the cell wall active ceftriaxone. Crit Care Med 2002; 30: 1560-1564.
- Stevens DL, Ma Y, Salmi DB, et al. Impact of antibiotics on expression of virulence-associated exotoxin genes in methicillin-sensitive and methicillin- resistant Staphylococcus aureus. J Infect Dis 2007; 195: 202-211.
- Naimi TS, LeDell KH, Como-Sabetti K, et al. Comparison of community- and health care- associated methicillin-resistant Staphylococcus aureus infection. JAMA 2003; 290: 2976-2984.
- Kollef MH, Morrow LE, Niederman MS, et al. Clinical characteristics and treatment patterns among patients with ventilator-associated pneumonia. Chest 2006; 129: 1210-1218.
- Giantsou E, Liratzopoulos N, Efraimidou E, et al. De-escalation therapy rates are significantly higher by bronchoalveolar lavage than by tracheal aspirate. Intensive Care Med 2007; 33: 1533-1540.
- Rello J, Vidaur L, Sandiumenge A, et al. De-escalation therapy in ventilator-associated pneumonia. Crit Care Med 2004; 32: 2183-2190.
- Emili Diaz et al. Management of Ventilator- Associated Pneumonia. Infect Dis Clin N Am 23 (2009) 521-533.
- Mueller EW, Croce MA, Boucher BA, et al. Repeat bronchoalveolar lavage to guide antibiotic duration of ventilator-associated pneumonia. J Trauma 2007;63: 1329-37
- Nitin Anand, Marin H. Kollef. The Alphabet Soup of Pneumonia: CAP, HAP, HCAP, NHAP, and VAP. Semin Respir Crit Care Med 2009; 30(1): 003- 009)
- Pea F, Viale P. Is the minimum inhibitory concentration of vancomycin an infallible predictor of the clinical outcome of Staphylococcus aureus bacteremia treated with vancomycin? Clin. Infect. Dis. 49, 642-643 (2009).
- Pea F, Viale P. The antimicrobial therapy puzzle: could pharmacokinetic- pharmacodynamic relationships be helpful in addressing the issue of appropriate pneumonia treatment in critically ill patients? Clin. Infect. Dis. 42, 1764-1771 (2006).
- Wysocki M, Delatour F, Faurisson F et al. Continuous versus intermittent infusion of vancomycin in severe staphylococcal infections: prospective multicenter randomized study. Antimicrob. Agents Chemother. 45,2460-2467 (2001).
- Pea F, Furlanut M, Negri C et al. Prospectively validated dosing nomograms for maximizing the pharmacodynamics of vancomycin administered by continuous infusion in the critically ill patients: the Optivanco study. Antimicrob. Agents Chemother. 53, 1863-1867 (2009).
- Roberts JA, Lipman J, Blot S, Rello J. Better outcomes through continuous infusion of time- dependent antibiotics to critically ill patients? Curr. Opin. Crit. Care. 14, 390-396 (2008).
- Rello J, Sole-Violan J, Sa-Borges M et al. Pneumonia caused by oxacillin-resistant Staphylococcus aureus treated with glycopeptides. Crit. Care Med. 33, 1983-1987 (2005).
- Dulhunty JM, Paterson D, Webb SA, Lipman J. Antimicrobial utilisation in 37 Australian and New Zealand intensive care units. Anaesth Intensive Care 2011;39(2):231-237
- Singh N, Yu VL. Rational empiric antibiotic prescription in the ICU. Chest 2000;117(5):1496-1499
- Fridkin SK, Gaynes RP. Antimicrobial resistance in intensive care units. Clin Chest Med 1999;20(2):303-316, viii
- Livermore DM. Fourteen years in resistance. Int J Antimicrob Agents 2012;39(4):283-294
- Ben-David D, Kordevani R, Keller N, et al. Outcome of carbapenem resistant Klebsiella pneumoniae bloodstream infections. Clin Microbiol Infect 2012;18(1):54-60
- Lye DC, Earnest A, Ling ML, et al. The impact of multidrug resistance in healthcare-associated and nosocomial Gram-negative bacteraemia on mortality and length of stay: cohort study. Clin Microbiol Infect 2012;18(5):502-508
- Shorr AF. Review of studies of the impact on Gram-negative bacterial resistance on outcomes in the intensive care unit. Crit Care Med 2009;37(4):1463-1469
- Zeitlinger MA, Derendorf H, Mouton JW, et al. Protein binding: do we ever learn? Antimicrob Agents Chemother 2011;55(7): 3067-3074
- Mohd H. Abdul-Aziz. Applying et al. Pharmacokinetic / Pharmacodynamic Principles in Critically Ill Patients: Optimizing Efficacy and Reducing Resistance Development. Semin Respir Crit Care Med 2015;36:136-153.
- Drusano Pharmacokinetics and pharmacodynamics of antimicrobials. Clin Infect Dis 2007;45(1, Suppl 1): S89-S95
- Mouton JW, Jacobs N, Tiddens H, Horrevorts AM. Pharmacodynamics of tobramycin in patients with cystic fibrosis. Diagn Microbiol Infect Dis 2005;52(2):123-127
- Craig WA. Pharmacokinetic/pharmacodynamic parameters: rationale for antibacterial dosing of mice and men. Clin Infect Dis 1998;26(1):1-10, quiz 11-12
- Craig WA, Redington J, Ebert SC. Pharmacodynamics of amikacin in vitro and in mouse thigh and lung infections. J Antimicrob Chemother 1991;27(Suppl C):29-40
- Moore RD, Lietman PS, Smith CR. Clinical response to aminoglycoside therapy: importance of the ratio of peak concentration to minimal inhibitory concentration. J Infect Dis 1987;155(1): 93-99
- McKinnon PS, Paladino JA, Schentag JJ. Evaluation of area under the inhibitory curve (AUIC) and time above the minimum inhibitory concentration (T>MIC) as predictors of outcome for cefepime and ceftazidime in serious bacterial infections. Int J Antimicrob Agents 2008;31(4):345-351
- Craig WA. Basic pharmacodynamics of antibacterials with clinical applications to the use of beta-lactams, glycopeptides, and linezolid. Infect Dis Clin North Am 2003;17(3):479-501
- Moise-Broder PA, Forrest A, Birmingham MC, Schentag JJ. Pharmacodynamics of vancomycin and other antimicrobials in patients with Staphylococcus aureus lower respiratory tract infections. Clin Pharmacokinet 2004;43(13):925-942
- Firsov AA, Strukova EN, Shlykova DS, et al. Bacterial resistance studies using in vitro dynamic models: the predictive power of the mutant prevention and minimum inhibitory antibiotic concentrations. Antimicrob Agents Chemother 2013;57(10): 4956-4962
- Tam VH, Louie A, Deziel MR, Liu W, Drusano; The relationship between quinolone exposures and resistance amplification is characterized by an inverted U: a new paradigm for optimizing pharmacodynamics to counterselect resistance. Antimicrob Agents Chemother 2007;51(2):744-747
- Tam VH, Louie A, Deziel MR, Liu W, Leary R, Drusano GL. Bacterial-population responses to drug- selective pressure: examination of garenoxacin’s effect on Pseudomonas aeruginosa. J Infect Dis 2005;192(3):420-428
- Firsov AA, Vostrov SN, Lubenko IY, Drlica K, Portnoy YA, Zinner SH. In vitro pharmacodynamic evaluation of the mutant selection window hypothesis using four fluoroquinolones against Staphylococcus aureus. Antimicrob Agents Chemother 2003;47(5): 1604-1613
- Stearne LE, Goessens WH, Mouton JW, Gyssens IC. Effect of dosing and dosing frequency on the efficacy of ceftizoxime and the emergence of ceftizoxime resistance during the early development of murine abscesses caused by Bacteroides fragilis and Enterobacter cloacae mixed infection. Antimicrob Agents Chemother 2007;51 (10):3605-3611
- Jumbe N, Louie A, Leary R, et al. Application of a mathematical model to prevent in vivo amplification of antibiotic-resistant bacterial populations during therapy. J Clin Invest 2003;112(2): 275-285
- Tam VH, Louie A, Fritsche TR, et al. Impact of drug-exposure intensity and duration of therapy on the emergence of Staphylococcus aureus resistance to a quinolone antimicrobial. J Infect Dis 2007;195(i2):1818-1827
- LaPlante KL, Rybak MJ, Tsuji B, Lodise TP, Kaatz GW. Fluoroquinolone resistance in Streptococcus pneumoniae: area under the concentration-time curve/MIC ratio and resistance development with gatifloxacin, gemifloxacin, levofloxacin, and moxifloxacin. Antimicrob Agents Chemother 2007;51(4):1315-1320
- Tam VH, Schilling AN, Neshat S, Poole K, Melnick DA, Coyle EA. Optimization of meropenem minimum concentration/MIC ratio to suppress in vitro resistance of Pseudomonas aeruginosa. Antimicrob Agents Chemother 2005;49(12):4920-4927
- Baquero F, Negri MC. Strategies to minimize the development of antibiotic resistance. J Chemother 1997;9(Suppl 3):29-37
- Baquero F. Resistance to quinolones in gram-negative microorganisms: mechanisms andprevention. Eur Urol 1990;17 (Suppl 1):3-12Zhao X, Drlica K. Restricting the selection of antibiotic-resistant mutants: a general strategy derived from fluoroquinolone studies. Clin Infect Dis 2001;33(3, Suppl 3):S147-S156
- Dong Y, Zhao X, Domagala J, Drlica K. Effect of fluoroquinolone concentration on selection of resistant mutants of Mycobacterium bovis BCG and Staphylococcus aureus. Antimicrob Agents Chemother 1999;43(7):1756-1758
- Welte T, Dellinger RP, Ebelt H, et al. Efficacy and safety of trimodulin, a novel polyclonal antibody preparation, in patients with severe community- acquired pneumonia: a randomized, placebo-controlled, double-blind, multicenter, phase II trial (CIGMA study). Intensive Care Med 2018;44:438-48.
- Torres A, Rank D, Melnick D, et al. Randomized trial of ceftazidime-avibactam vs meropenem for treatment of hospital-acquired and ventilator-associated bacterial pneumonia (REPROVE): analyses per US FDA-specified end points. Open Forum Infect Dis 2019;6:ofz149
- He H, Wunderink RG. Staphylococcus aureus pneumonia in the community. Semin Respir Crit Care Med 2020;41:470-9.
- Kollef MH, Novácek M, Kivistik ũ, et al. Ceftolozane-tazobactam versus meropenem for treatment of nosocomial pneumonia (ASPECT-NP): a randomised, controlled, double-blind, phase 3, non- inferiority trial. Lancet Infect Dis 2019;19:1299-311.
- Bissell BD, Bastin MT, Morris PE, Neyra JA. Continuous versus intermittent infusion of vancomycin and the risk of acute kidney injury in critically ill adults: a systematic review and meta- Analysis. Crit Care Med 2020;48:912-8.
- Hao J-J, Chen H, Zhou J-X. Continuous versus intermittent infusion of vancomycin in adult patients: A systematic review and meta-analysis. Int J Antimicrob Agents 2016;47:28-35.
- Soraluce A, Barrasa H, Asín-Prieto E, et al. Novel population pharmacokinetic model for linezolid in critically ill patients and evaluation of the adequacy of the current dosing recommendation. Pharmaceutics 2020;12:54.
- Taubert M, Zoller M, Maier B, et al. Predictors of inadequate linezolid concentrations after standard dosing in critically ill patients. Antimicrob Agents Chemother 2016;60:5254-61
- Abdul-Aziz MH, Lipman J, Akova M, et al. Is prolonged infusion of piperacillin/tazobactam and meropenem in critically ill patients associated with improved pharmacokinetic/pharmacodynamic and patient outcomes? An observation from the Defining Antibiotic Levels in Intensive care unit patients (DALI) cohort. J Antimicrob Chemother 2016; 71: 196-207.
- Chytra I, Stepan M, Benes J, et al. Clinical and microbiological efficacy of continuous versus intermittent application of meropenem in critically ill patients: a randomized open-label controlled trial. Crit Care 2012; 16: R113.
- Roberts JA, Abdul-Aziz MH, Davis JS, et al. Continuous versus intermittent p-lactam infusion in severe sepsis. A meta-analysis of individual patient data from randomized trials. Am J Respir Crit Care Med 2016; 194: 681-691.
- Gauthier T, Lacarelle B, Marre F, et al. Predictive performance of two software packages (USC*PACK PC and Abbott PKS system) for the individualization of amikacin dosage in intensive care unit patients. Int J Biomed Comput 1994; 36: 131- 134.
- Delattre IK, Musuamba FT, Verbeeck RK, et al. Empirical models for dosage optimization of four beta-lactams in critically ill septic patients based on therapeutic drug monitoring of amikacin. Clin Biochem 2010; 43: 589-598.
- Roberts JA, Field J, Visser A, et al. Using population pharmacokinetics to determine gentamicin dosing during extended daily diafiltration in critically ill patients with acute kidney injury. Antimicrob Agents Chemother 2010; 54: 3635-3640.
- Duszynska W, Taccone FS, Hurkacz M, et al. Therapeutic drug monitoring of amikacin in septic patients. Crit Care 2013; 17: R165.
- Fernández de Gatta MD, Calvo MV, Hernández JM, et al. Cost-effectiveness analysis of serum vancomycin concentration monitoring in patients with hematologic malignancies. Clin Pharmacol Ther 1996; 60: 332-340.
- Pea F, Brollo L, Viale P, et al. Teicoplanin therapeutic drug monitoring in critically ill patients: a retrospective study emphasizing the importance of a loading dose. J Antimicrob Chemother 2003; 51: 971- 975.
- Wong G, Brinkman A, Benefield RJ, et al. An international multicentre survey of p-lactam antibiotic therapeutic drug monitoring practice in intensive care units. J Antimicrob Chemother 2014; 69: 1416-1423.
- Pea F, Poz D, Viale P, et al. Which reliable pharmacodynamic breakpoint should be advised for ciprofloxacin monotherapy in the hospital setting? A TDM-based retrospective perspective. J Antimicrob Chemother 2006; 58: 380-386.
- Pea F, Furlanut M, Cojutti P, et al. Therapeutic drug monitoring of linezolid: a retrospective monocentric analysis. Antimicrob Agents Chemother 2010; 54: 4605-4610.
- Bode-Bõger SM, Schopp B, Trõger U, et al. Intravenous colistin in a patient with serious burns and borderline syndrome: the benefits of therapeutic drug monitoring. Int J Antimicrob Agents 2013; 42: 357-360
- Roberts JA, Ulldemolins M, Roberts MS, et al. Therapeutic drug monitoring of beta-lactams in critically ill patients: proof of concept. Int J Antimicrob Agents 2010; 36: 332-339
- Scaglione F, Esposito S, Leone S, et al. Feedback dose alteration significantly affects probability of pathogen eradication in nosocomial pneumonia. Eur Respir J 2009; 34: 394-400
- Ye ZK, Tang HL, Zhai SD. Benefits of therapeutic drug monitoring of vancomycin: a systematic review and meta-analysis. PLoS One 2013; 8: e77169.
- Tod MM, Padoin C, Petitjean O. Individualising aminoglycoside dosage regimens after therapeutic drug monitoring: simple or complex pharmacokinetic methods? Clin Pharmacokinet 2001; 40: 803-814.
- Brasseur A, Hites M, Roisin S, et al. A high- dose aminoglycoside regimen combined with renal replacement therapy for the treatment of MDR pathogens: a proof-of-concept study. J Antimicrob Chemother 2016; 71: 1386-1394.
- Drusano GL, Johnson DE, Rosen M, Standiford HC. Pharmacodynamics of a fluoroquinolone antimicrobial agent in a neutropenic rat model of Pseudomonas sepsis. Antimicrob Agents Chemother 1993;37(3):483-490
- Blaser J, Stone BB, Groner MC, Zinner SH. Comparative study with enoxacin and netilmicin in a pharmacodynamic model to determine importance of ratio of antibiotic peak concentration to MIC for bactericidal activity and emergence of resistance. Antimicrob Agents Chemother 1987;31(7):1054-1060
- Thorburn CE, Edwards DI. The effect of pharmacokinetics on the bactericidal activity of ciprofloxacin and sparfloxacin against Streptococcus pneumoniae and the emergence of resistance. J Antimicrob Chemother 2001;48(1):15-22
- Forrest A, Nix DE, Ballow CH, Goss TF, Birmingham MC, Schentag JJ. Pharmacodynamics of intravenous ciprofloxacin in seriously ill patients. Antimicrob Agents Chemother 1993;37(5): 1073-1081
- Peloquin CA, Cumbo TJ, Nix DE, Sands MF, Schentag JJ. Evaluation of intravenous ciprofloxacin in patients with nosocomial lower respiratory tract infections. Impact of plasma concentrations, organism, minimum inhibitory concentration, and clinical condition on bacterial eradication. Arch Intern Med 1989;149(10): 2269-2273
- Zelenitsky SA, Ariano RE. Support for higher ciprofloxacin AUC 24/MIC targets in treating Enterobacteriaceae bloodstream infection. J Antimicrob Chemother 2010;65(8):1725-1732
- Drusano GL, Preston SL, Fowler C, Corrado M, Weisinger B, Kahn J. Relationship between fluoroquinolone area under the curve: minimum inhibitory concentration ratio and the probability of eradication of the infecting pathogen, in patients with nosocomial pneumonia. J Infect Dis 2004;189(9):1590-1597
- Ambrose PG, Grasela DM, Grasela TH, Passarell J, Mayer HB, Pierce PF. Pharmacodynamics of fluoroquinolones against Streptococcus pneumoniae in patients with community-acquired respiratory tract infections. Antimicrob Agents Chemother 2001;45(10): 2793-2797
- Mattoes HM, Banevicius M, Li D, et al. Pharmacodynamic assessment of gatifloxacin against Streptococcus pneumoniae. Antimicrob Agents Chemother 2001;45(7):2092-2097
- Bédos JP, Azoulay-Dupuis E, Moine P, et al. Pharmacodynamic activities of ciprofloxacin and sparfloxacin in a murine pneumococcal pneumonia model: relevance for drug efficacy. J Pharmacol Exp Ther 1998;286(1):29-35
- Thomas JK, Forrest A, Bhavnani SM, et al. Pharmacodynamic evaluation of factors associated with the development of bacterial resistance in acutely ill patients during therapy. Antimicrob Agents Chemother 1998;42(3):521-527
- Jumbe N, Louie A, Leary R, et al. Application of a mathematical model to prevent in vivo amplification of antibiotic-resistant bacterial populations during therapy. J Clin Invest 2003;112(2): 275-285.
