Sản xuất Dược phẩm
Các tá dược và phương pháp bào chế một số tiểu phân nano
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: PGS.TS. Nguyễn Ngọc Chiến, ThS. Hồ Hoàng Nhân
Bài viết Các tá dược và phương pháp bào chế một số tiểu phân nano được trích trong chương 2 sách Công nghệ nano và ứng dụng trong sản xuất thuốc – Bộ môn Công nghiệp Dược – Trường Đại học Dược Hà Nội.
MỤC TIÊU HỌC TẬP
- Trình bày được các đặc điểm cùa một chất mang sử dụng cho các tiêu phân nano như nano polyme, nano lipid.
- Trình bày được vai trò của chất ổn định, dung môi được sử dụng trong bào chế tiểu phân nano.
- Trình bày được vai trò và đặc điểm của các quá trình biến đối bề mặt tiểu phân nano bằng acid hyaluronic, PEG hay acid folic.
- Phân tích được vai trò cảc thành phần và xây dựng được công thức bào chê tiểu phân nano.
- Xây dựng được quy trình bào chế nano tỉnh thể, nano polyme, nano lipid, nano polyme-lipid/lipid-polyme.
Chương này chỉ tập trung giới thiệu các tá dược sử dụng trong bào chế tiểu phân nano, phương pháp bào chế một số tiểu phân nano bao gồm nano tinh thể, nano polyme, nano lipid và nano polyme-lipid. Trong đó, nguyên tắc cũng như ví dụ minh họa sẽ được trinh bày ứng với từng phương pháp kèm theo mô tả một số thiết bị sử dụng trong bào chế.
1. TÁ DƯỢC CHUNG BÀO CHẾ TIỂU PHÂN NANO
Tùy thuộc vào phương pháp bào chế sử dụng và loại nano thu được, các tá dược bào chế tiểu phân nano có thể bao gồm chất mang, chất ổn định, dung môi, chất khác. Mỗi tá dược có vai trò khác nhau trong công thức. Trong đó, quan trọng nhất là chất mang, tạo giá đỡ vận chuyển.
1.1. Chất mang
Chất mang (carrier) là vật liệu được sử dụng với vai trò như một bộ phận vận chuyển, bảo vệ và đưa thuốc đến đích. Dược chất có thể được nano hóa dưới dạng phức hợp với chất mang, hoặc được nang hóa, hấp thụ lên bề mặt chất mang. Tùy thuộc vào dạng nano tạo thành, có thể sử dụng polyme, lipid hay hợp của chúng.
1.1.1.Chất mang cho nano polyme
a. Acid poly ỉactic-co-glycolic (PLGA)
PLGA là một trong những polyme tổng hợp có khả năng phân hủy sinh học được sử dụng khá phổ biến do có khả năng kiểm soát và duy trì giải phóng dược chất, độc tinh thâp, tương thích sinh học với nhiều mô và tế bào. PLGA là một trong những polyme được sử dụng nhiều nhất trong nghiên cứu và ứng dụng của tiểu phân nano.
* Cẩu trúc
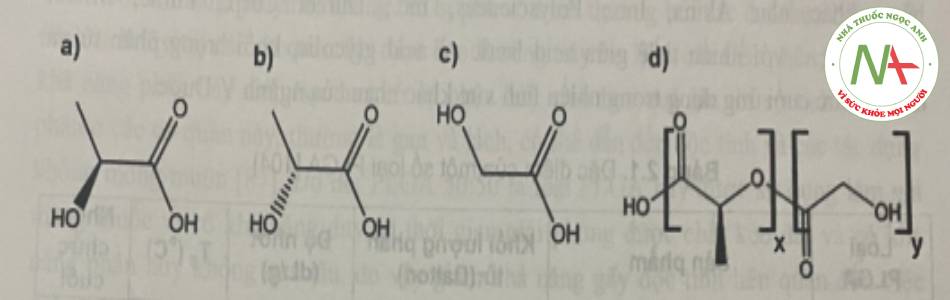
PLGA là một copolyme được polyme hóa từ 2 monome là acid glycolic và acid lactic. Do có nhóm methyl trong phân tử, nên PLA có nguyên tử C bất đối trong phân </>tử. Điều này hình thành nên cấu hình D và L của PLA, từ đó ảnh hưởng đến đặc tính vật lý của phân tử.
Các PLGA khác nhau bởi tỷ lệ các monome sử dụng và khối lượng phân tử (KLPT), ví dụ PLGA 50:50 chứa 50% acid lactic và 50% acid glycolic.
* Tính chất lý hóa
PLGA tan trong nhiều dung môi khác nhau như các dung môi chứa clo, tetrahydrofuran, aceton hoặc ethyl acetat.
Trong phân tử PLGA, phần PLA (poly acid lactic) có cấu trúc kỵ nước hơn PGA (poly acid glycolic). Do đó, nếu PLGA có tỷ lệ PLA cao hơn thì ít thân nước hơn, hấp thu ít nước hơn nên thủy phân chậm hơn. Do khả năng thủy phân của PLGA, các thông số cần kiểm soát trong công thức chứa PLGA là nhiệt độ hóa thủy tinh (Tg), hàm ẩm và KLPT. Sự thay đổi các đặc tính này ảnh hưởng đến tốc độ giải phóng và phân hủy của các phân tử dược chất được bao gói. PLGA được phân hủy bằng cách thủy phân liên kết este tạo thành acid lactic và acid glycolic. Các sản phẩm phân hủy này dễ dàng chuyển hóa trong cơ thể thông qua chu kỳ Krebs và được đào thải ra khỏi cơ thể.
Tính chất vật lý của PLGA phụ thuộc vào nhiều yếu tố bao gồm KLPT ban đầu, tỷ lệ PLA và PGA, kích thước của hệ mang thuốc, khả năng tiếp xúc với nước và nhiệt độ bảo quản. Độ bền cơ học của PLGA bị ảnh hưởng bởi các đặc tinh vật lý như KLPT và hệ số đa phân tán. Các dạng PLGA trên thị trường thường được đặc trưng bởi độ nhớt, độ nhớt thay đổi phụ thuộc vào KLPT của chúng.
Ngoài các sản phẩm PLGA của hãng Evonik, Boehringer Ingelheim, Đức (với tên thương mại là RESOMER®), hiện nay trên thị trường cũng có nhiều loại PLGA của các hãng khác như Akina, Inc.; Polysciences, Inc.; Durect Corp.; Purac; Mitsui chemicals;… với nhiều tỉ lệ giữa acid lactic và acid glycolic, khối lượng phân tử và nhóm chức cuối ứng dụng trong nhiều Bnh vực khác nhau của ngành Y Dược.
Bảng 1. Đặc điểm một số loại PLGA
| Loại PLGA | Sản phẩm | Khối lượng phân tử | Độ nhớt (dL/g) | Tg (oC) | Nhóm chức cuối |
| 50:50 | RESOMER® RG 502 | 7000-17000 | 0,16 -0,24 | 42-46 | Este |
| RESOMER® RG 502 H | 7000-17000 | 0,16 -0,24 | 42-46 | – | Acid |
| RESOMER® RG 503 | 24000-38000 | 0,32-0,44 | 44-48 | – | Este |
| RESOMER® RG 503 H | 24000-38000 | 0,32-0,44 | 44-48 | – | Acid |
| RESOMER® RG 504 | 38000-54000 | 0,45-0,6 | 46-50 | – | Este |
| RESOMER® RG 504 H | 38000-54000 | 0,45-0,6 | 46-50 | – | Acid |
| RESOMER® RG 505 | 54000-69000 | 0,61-0,74 | 48-53 | – | Este |
| 65:35 | RESOMER® RG 653 H | 24000-38000 | 0,32-0,44 | 46-50 | Acid |
| 75:25 | RESOMER® RG 752 | 4000-15000 | 0,14-0,22 | 42-46 | Acid |
| RESOMER® RG 752 | – | 0,16-0,24 | 44-50 | – | Este |
| RESOMER® RG 752 | – | 0,32-0,44 | – | – | Acid |
| RESOMER® RG 752 | – | 0,32-0,44 | 44-50 | – | Este |
| RESOMER® RG 752 | – | 0,5-0,7 | 48-54 | – | Este |
| RESOMER® RG 752 | 76000-116000 | 0,71-1,0 | 49-55 | – | Este |
| RESOMER® RG 752 | – | 0,8-1,0 | – | – | Este |
| RESOMER® RG 752 | 190000-240000 | 1,3-1,7 | – | Este |
“-” không có thông tin
Ngoài ra, độ bền cơ học, đặc tính trương nở, khả năng bị phân hủy sinh học bị ảnh hưởng trực tiếp bởi mức độ kết tinh của PLGA mà thông số này lại phụ thuộc vào loại và tỷ lệ các thành phần monome trong chuỗi copolyme. Do vậy, tỷ lệ PGA càng cao dẫn đến khả năng phân hủy càng nhanh ngoại trừ PLGA 50:50 cho khả năng phân hủy nhanh nhất, nhanh hơn so với PLGA có tỉ lệ cao của một trong hai thành phần monome. Đồng thời, nhóm chức cuối của PLGA cũng ảnh hưởng đến khả năng phân hủy như nhóm este sẽ kéo dài thời gian phân hủy hơn so với nhóm acid.
Đối với nano polyme, không thể bị phá vỡ bình thường bởi các đại thực bào, quá trình tích lũy tại các cơ quan đại thực bào thường xảy ra. Nếu các tiểu phân không có khả năng phân hủy sinh học hay có sự phân hủy sinh học quá lâu thì sự tích lũy tiểu phân ở các cơ quan này, thường là gan và lách, có thể dẫn đến độc tính và các tác dụng không mong muốn. Do đó, PLGA 50:50 là loại PLGA hay được sử dụng làm giá mang thuốc vì có khả năng duy trì thời gian giải phóng dược chất kéo dài và có khả năng phân hủy không quá lâu, do vậy giảm khả năng gây độc tính liên quan đến việc tích lũy tiểu phân tá dược và dược chất.
Vì tính đồng nhất cao trong cấu trúc chuỗi polyme nên dạng đồng phân acid poly(L-lactic) tồn tại ở dạng bán tinh thể (37%), trong khi hỗn hợp của đồng phân D và L của acid polylactic tồn tại ở dạng vô định hình do sự bất thường trong cấu trúc của polyme. Acid polyglycolic (PGA) tồn tại phần lớn ở dạng tinh thể (55%) do thiếu nhóm methyl ở mạch nhánh so với acid polylactic. PGA dạng tinh thể khi kết hợp với PLA làm giảm mức độ kết tinh của PLGA do đó làm tăng khả năng hydrat hóa và thủy phân. PLGA được tạo thành từ L-PLA và PGA có bản chất tinh thể trong khi đó, PLGA được tạo thành từ hỗn họp đồng phân D,L của acid lactic là poly(D,L-lactic-co-glycolic) tồn tại dưới dạng vô định hỉnh do bản chất bất thường của cấu trúc của chuỗi polyme. PLGA sẽ tồn tại ở dạng tinh thể nếu PLGA chứa dưới 70% PGA [60]. Mức độ kết tinh và nhiệt độ nóng chảy của polyme liên quan trực tiếp đến KLPT của chúng.
Nhiệt độ chuyển hóa thủy tinh (Tg) của PLGA ở trên nhiệt độ sinh lý của cơ thể nên PLGA tồn tại ở dạng thủy tinh. Do có cấu trúc chuỗi khá cứng nhắc nên giúp PLGA có đủ độ bền cơ học để làm các hệ đưa thuốc. Giá trị Tg giảm khi giảm lượng PLA trong chuỗi đồng polyme và giảm khi giảm khối lượng phân tử của chúng.
* Quá trình phân hủy và sự phân bố sinh học
Hiện nay, PLGA đã được Cục Quản lý Dược Mỹ (FDA) và Cơ quan quản lý Dược phẩm châu Âu (EMA) chấp nhận sử dụng trong các dạng thuốc khác nhau dùng trên người. Ngoài ra, PLGA làm chất mang cho các tiểu phân nano đang được nghiên cứu ứng dụng trong các liệu pháp chẩn đoán hình ảnh và điều trị ung thư.
Quá trình phân hủy của PLGA in vivo và bị ảnh hưởng bởi một vài yêu tố bao gồm phương pháp bào chế; sự có mặt của các hợp chất có khôi lượng phân tử thấp (monome, oligome, chất xúc tác); kích thước, hình dạng và hình thái; các đặc trưng của PLGA (KLPT, cấu trúc hóa học, độ kỵ nước, sự kết tinh, và nhiệt độ chuyển hóa thủy tinh); các thông số hóa lý (pH, nhiệt độ, lực ion của môi trường); vị trí n implant; hàm lượng và loại dược chất và cơ chế thủy phân.
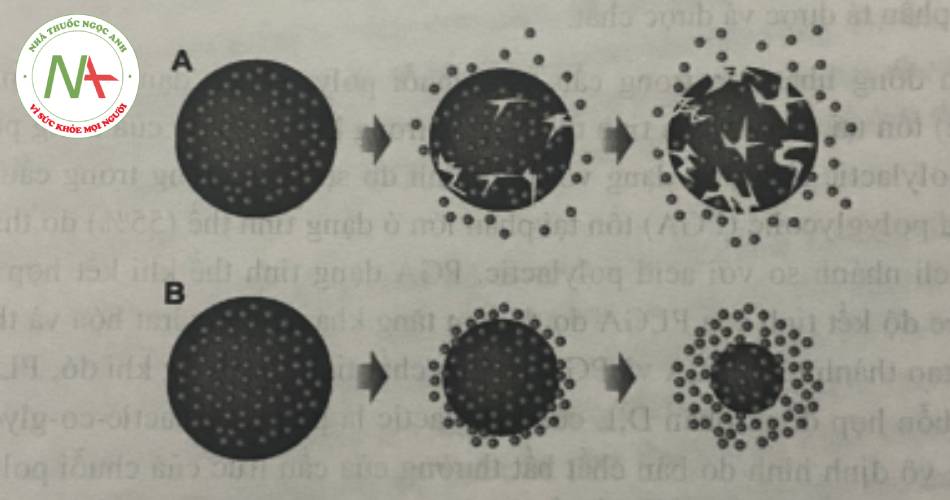
Sự ăn mòn toàn bộ (bulk erosion) là con đường phân hủy chính của PLGA thông qua quá trình cắt ngẫu nhiên liên kết este của khung polyme phân bố đồng nhất trong tiểu phân. Quá trình phân hủy sinh học của PLGA được đề xuất với cơ chế gồm ba giai đoạn. Ban đầu, có sự giảm đáng kể KLPT của polyme, nhưng không có bất kỳ sự mất khối lượng nào đáng kể cũng như không có sự tạo thành sản phẩm monome tan được. Giai đoạn này được theo sau bởi sự giảm nhanh KLPT và hình thành các sản phẩm oligome và monome tan được. Cuối cùng, các monome tan được hình thành từ các mảnh oligome tan, dẫn đến quá trình phân hủy hoàn toàn.
Hình 2. Cơ chế phá hủy của tiểu phân nano PLGA (A) sự ăn mòn toàn bộ (B) sự ăn mòn bề mặtĐể có thể ứng dụng trong điều trị, tiểu phân nano sử dụng chất mang PLGA cần có khả năng phân phối thuốc trong khoảng thời gian thích hợp, có khả năng phân bố sinh học và đạt nồng độ phù họp với tác dụng điều trị mong muốn. Do đó, những yêu câu thiết kế công thức bao gồm nguyên liệu, cấu trúc không gian (geometry) và vị trí tác dụng (location) cần đáp ứng cơ chế phân hủy và thải trừ của chất mang cũng như các thành phần có hoạt tính. Ngoài ra, các nghiên cứu trước đây chỉ ra rằng sự thải trừ khỏi tuần hoàn và bắt giữ bởi hệ thống thực bào đơn nhân có thể phụ thuộc vào liều và thành phần của hệ mang thuốc PLGA.
Về khả năng phân bố sinh học, phương pháp chụp X-quang và các thí nghiệm đã chỉ ra rằng một số công thức tiểu phân nano sừ dụng PLGA có khả năng tích lũy nhanh tại gan, tủy xương, các hạch lympho, lách và đại thực bào thuộc màng bụng. Sự phân hủy của PLGA diễn ra nhanh ở giai đoạn ban đầu (khoảng 30%) và chậm ở giai đoạn sau. Vì vậy, nồng độ thuốc có thể duy trì trong một thời gian dài, ví dụ thuốc tiêm chứa vi tiểu phân polyme với chất mang PLGA như thuốc Diphereline (thuốc điều trị ung thư tiền liệt tuyến) có thể kéo dài nồng độ thuốc từ 1 đến 6 tháng (tùy theo hàm lượng).
Ví dụ, năm 2013, Sinha và cộng sự đã bào chế tiểu phân nano PLGA (85:15, Mw = 55000-75000 Da) chứa voriconazole bằng phương pháp nhũ hóa và bốc hơi dung môi có điều chỉnh. KTTP được đánh giá qua phương pháp DLS đạt 207-605nm, có dạng hình cầu với nhiều lỗ xốp qua ảnh FE-SEM. EE dao động từ 8-63%, với LC tối đa là 31%. Đồ thị giải phóng dược chất đặc trưng với giai đoạn đầu giải phóng 20%, kéo dài giải phóng 15 ngày. Mô hình thử nghiệm in vivo trên chuột đã phát hiện thuốc trong phổi kéo dài đến 7 ngày và 5 ngày lần lượt đối với tiểu phân nano xốp và không xốp.
b. Acid poly glycolic (PGA)
PGA là một polyme có tính tương thích sinh học được sử dụng từ những năm 1950. PGA là một polyeste mạch thẳng đơn giản, có thể được điều chế từ acid glycolic bằng phương pháp trùng ngưng hoặc phản ứng polyme hóa mở vòng. Do có độ tan kém và khả năng phân hủy nhanh thành acid glycolic nên PGA ít được lựa chọn trong việc ứng dụng làm hệ phân phối thuốc dạng nano polyme, tuy nhiên có thể ứng dụng làm chỉ khâu trong phẫu thuật.
Về đặc tính vật lý, PGA có nhiệt độ chuyển hóa thủy tinh khoảng 35-40°C, nhiệt độ nóng chảy từ 224-227°C. Bởi vì cấu trúc hóa học và tính cân đồi lập thể đơn giản của nó PGA có mức độ kết tinh khác nhau từ dạng vô định hình đến tối đa khoảng 55% ở dạng kết tinh. Cũng do trạng thái kết tinh này nên PGA thường kém tan trong phần lớn các dung môi hữu cơ. Ngoài ra, độ tan còn phụ thuộc vào khối lượng phân tử của polyme. Dạng có khối lượng phân tử lớn không tan trong phần lớn các dung môi hữu cơ thông dụng như aceton, dicloromethan, cloroform, ethyl acetat,… trong khi đó, loại có khối lượng phân tử thấp có sự khác biệt đáng kể về đặc tính vật lý với khả năng dễ tan hơn. Tuy nhiên, PGA có thể tan được trong các dung môi chứa nhiều Flo như hexafluoroisopropanol (HFIP) và hexafluoroaceton sesquihydrat, do vậy có thể được sử dụng để pha các dung dịch chứa polyme có khôi lượng phân tử cao đê tạo SỢI đun chảy (melt spinning) hoặc tạo phim.
Quá trình phân hủy của PGA là quá trình ăn mòn và polyme sẽ được chuyển về lại monome ban đầu qua hai bước: đầu tiên, nước sẽ khuếch tán vào vùng vô định hình của cốt polyme, phá vỡ các liên kết este; tiếp theo sau khi các vùng vô định hình bị ăn mòn, còn lại phần kết tinh của polyme nhạy cảm với quá trình thủy phân. Khi các vùng kết tinh của polyme bị phá vỡ, chuỗi polyme còn lại sẽ hòa tan.
Trong môi trường sinh lý của cơ thể, PGA sẽ bị phân hủy thông qua quá trình thủy phân ngẫu nhiên, đồng thời cũng bị phân hủy bởi một sô men, đặc biệt cac men esterase. Sản phẩm của quá trình phân hủy là acid glycolic, không độc, và có thể đi vao chu trình acid tricarboxylic, sau đó được bài tiêt dưới dạng nước và carbon dioxyd.
Năm 1970, Herrmann và cộng sự đã tiến hành đánh giá các tinh chất của chỉ khâu PGA trên phòng thí nghiệm và trên lâm sàng. Kêt quả cho thấy chỉ khâu PGA có độ bền khi kéo căng tương đương với chỉ tổng hợp không có khả năng phân hủy là Dacron, và mạnh hơn so với các chỉ khâu có cùng kích thước băng lụa, vải cotton, nylon, dây ruột mèo khâu vét mổ. Đồng thời, chỉ khâu PGA có các đặc tinh dê thao tác và thăt nút, tương tự như chỉ bằng cotton và Dacron. Ngoài ra, chỉ khâu PGA đã thê hiện khả năng phân hủy sinh học và tương thích sinh học cao như phản ứng đôi với mô hầu như không có, phân hủy thông qua cơ chế enzyme.
c. Acid poly lactic (PLA)
PLA là polyme thân dầu hơn PGA do có nhóm methyl ở mạch nhánh và đặc tính của PLA có thể thay đổi do đổi trạng thái racemic hóa của dạng D và L. PLA tan trong dung môi chứa Clor, benzen nóng, tetrahydrofiiran và dioxan. Polyme PLLA tương ứng từ L-lactic là dạng bán tinh thể trong khi đó PDLA từ D,L-lactic là dạng vô định hình. Điều này dẫn đến làm thay đổi độ bền cơ học và mức độ phân hủy, như với PLLA cứng và trong suốt hơn với Tg = 53°C; còn PDLA có Tg = 55°c và độ bền cơ học thấp hơn. Nhiệt độ nóng chảy của PLA có thể từ 130°C-180°C. Tốc độ phân hủy của PLA bị ảnh hưởng bởi mức độ kết tinh và do tốc độ phân hủy của PLLA thấp hơn PGA nên dạng đồng polyme của nó là PLGA đã được nghiên cứu và ứng dụng nhiều trong ngành y dược.
PLA có thể được ứng dụng để tạo sợi (bằng phương pháp tạo sợi đun chảy) và tạo phim. Với năng lượng bề mặt cao, PLA có khả năng dễ in ấn nên được sử dụng rộng rãi trong in 3D. Ngoài ra, các copolyme PLDLLA (acid poly(L-lactic-co-D,L-lactic)) có thể được sử dụng như các khung trong kỹ thuật tái tạo xương.
Ngoài các ứng dụng trên, PLA còn được ứng dụng để làm các dụng cụ cấy ghép (implant), hệ giải phóng thuốc có kiểm soát. Trước những năm cuối 1980, giá thành cao đã hạn chế một phần khả năng ứng dụng của PLA ngoài lĩnh vực này. Những tiến bộ trong quá trình lên men vi khuân tạo D-glucose từ ngô đã giúp thu được acid lactic rẻ hơn nhiều so với đi từ sản phẩm có nguồn gốc hóa dầu. Ngoài ra, việc sử dụng monome acid lactic có hoạt tinh quang học còn gặp trong những ứng dụng không cần phân hủy sinh học dưới dạng các este và các dẫn chât khác, có thể bằng cách kết hợp với các monome hay polyme khác.
Quá trình phân hủy của PLA cũng tương tự như quá trình phân hủy của PGA, là quá trình ăn mòn và polyme sẽ được chuyển về lại monome ban đầu qua hai bước.
Đồng thời quá trình phân hủy PLA trong cơ thể cũng tương tự như ở PGA, thông qua quá trình thủy phân ngẫu nhiên hay bằng các men. Các sản phẩm của quá trình phân hủy sẽ đi vào chu trình acid tricarboxylic, sau đó được bài tiết dưới dạng nước và carbon dioxyd.
d. Polycaprolacton
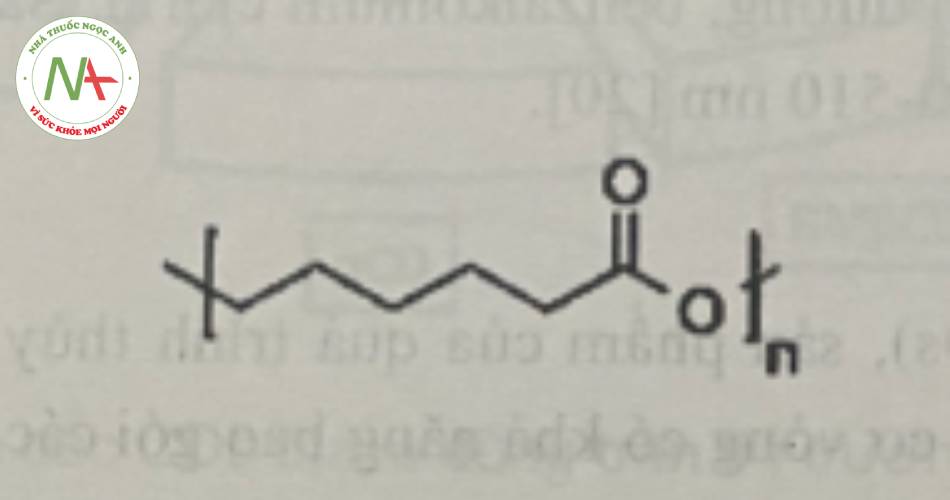
Polycaprolacton (PCL) là một polyeste có khả năng phân hủy sinh học với nhiệt độ nóng chảy khoảng 60°c và nhiệt độ chuyển hóa thủy tinh khoảng -60°c, khiến nó tồn tại ở dạng bán rắn ở nhiệt độ phòng. PCL có thể tương hợp với nhiều nguyên vật liệu khác nhau như có thể trộn lẫn với tinh bột để hạ giá thành và tăng khả năng phân hủy sinh học hoặc có thể được kết hợp với polyvinyl clorid với vai trò như một chất hóa dẻo. PCL được tổng hợp bằng cách polyme hóa mở vòng của 8-caprolacton như thiếc octoat.
PCL tan được trong tetrahydroíiiran, cloroform, methylen clorid, carbon tetraclorid, benzen, toluen, và chỉ tan một phần trong aceton, ethyl acetat, acetonitril. Trạng thái kết tinh của PCL tăng cùng với việc giảm khối lượng phân tử, ví dụ nếu KLPT là 100,000 thì tỉ lệ tinh thể là 40%, còn nếu KLPT giảm xuống 5,000 thì tỉ lệ tinh thể là 80%. Do đó PCL cũng tương tự như PGA có độ kết tinh tăng khi polyme phân hủy.
Cho đến nay, PCL được sử dụng nhiều trong ngành thiết kế mô như vật liệu tạo khung (ví dụ như in 3D) hơn là hệ phân phối thuốc dạng nano. Điều này có liên quan đến độ tan kém và tốc độ phân hủy rất chậm của PCL (2-3 năm đối với dạng PCL tinh khiết). FDA chứng nhận PCL có thể làm vật liệu dẫn thuốc, chỉ khâu y tế cho con người. PCL đặc biệt được ứng dụng trong thiết kế các dụng cụ cây ghép do có khả năng phân hủy chậm hơn polylactic.
PCL phân hủy băng cách thủy phân cầu nối este trong môi trường sinh lý cơ thể trong một số trường họp nhất định được phân hủy bằng men. Cũng tương tự như PLA quá trình phân hủy của PCL cũng trải qua hai giai đoạn, với quá trình mất khối lượng phân tử là quá trinh chính xảy ra ở giai đoạn đầu, và quá trình mất phần lớn khối lượng và câu trúc khung ở giai đoạn sau khi khối lượng phân tử khoảng 5000. Tuy nhiên PCL phân hủy chậm gần 3 làn so với PLA. Tốc độ phân hủy của PCL có thề tăng lên khi tạo copolyme với DL-lactic. Ngoài ra, quá trình phân hủy của PCL còn bị ảnh hưởng bởi điều kiện acid cũng như cơ chế phân hủy do tự xúc tác.
Ví dụ, Barbault-Foucher và cộng sự (nám 2002) thiết kế một hệ đưa thuốc nano dùng cho nhãn khoa sử dụng poly-8-caprolacton (PCL) được bao bởi một polyme bám dính sinh học là acid hyaluronic (HA). Kết quả thu được các tiểu phân có kích thước trong khoảng 200-280 nm và cho thấy HA gắn kết mạnh với siêu vi cầu tích điện dương do chất diện hoạt mang điện dương, benzalkonium clorid. Sau khi gắn HA, KTTP tăng lên và nằm trong khoảng 220-510 nm.
e. Cyclodextrin
Các cyclodextrin (CDs), sản phẩm của quá trình thủy phân tinh bột để sản xuất dextrin, là các hợp chất hữu cơ vòng có khả năng bao gói các phân từ trong khoang rỗng của chúng. Các CDs được hình thành dựa trên 6-8 đơn vị đường glucopyranose thông qua các cầu nối a-1-4-glycosid tạo ra một họ các hợp chất với nhiều ưu điểm bao gồm α-, β-, γ-CD (tương ứng với số đơn vị đường tăng dần). Các phân tử CDs gồm phần ngoài thân nước và phần bên trong là các khung carbon kỵ nước gồm các monome glycopyranose, có cấu trúc dạng hình nón. Vì vậy, với đặc điểm cấu trúc này, CDs là các chất có khả năng giúp làm tăng độ tan đối với các chất kém tan trong nước.
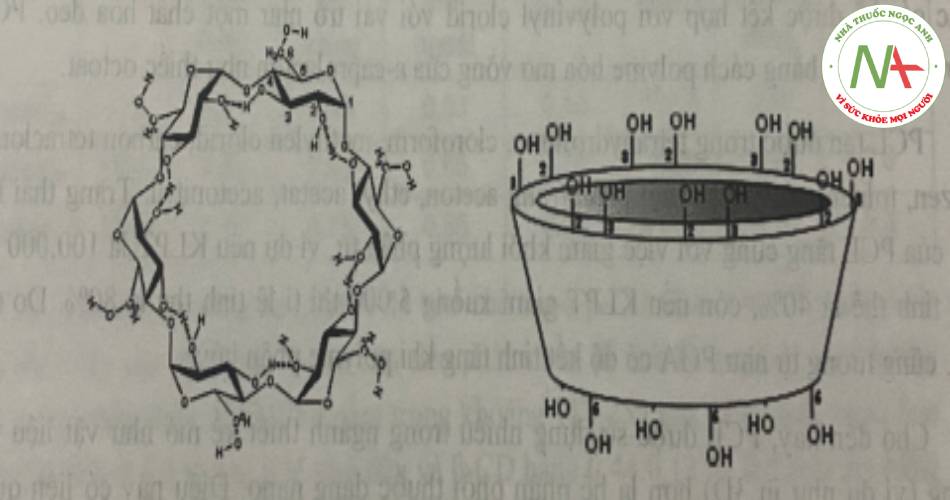
Các CDs có nhiều tính chất hóa lý và sinh học tương tự các đường dextrin, mạch thẳng tan trong nước của chúng. Tuy nhiên, do có cấu trúc vòng nên CDs ít bị thủy phân hơn so với các dextrin mạch thẳng từ 3-5 lần.
Một thông kê trên 30 sản phẩm chứa CDs cho thấy β-CD là loại được sử dụng nhiều nhất. Tuy nhiên, p-CD cũng có hạn chế của nó là độ tan thấp nên không thích hợp đối với thuốc đường tiêm. Do đó, một số dạng dẫn chất của CDs đã ra đời giúp làm tăng độ tan trong nước của chúng như 2-hydroxypropyl (HPp- CD and HPy-CD) và sulfobutylether (SBEp-CD).

Trong quá trình vận chuyển thuốc, việc bao gói phức hợp thuốc-CD giúp cải thiện độ tan, độ ổn định, sinh khả dụng của thuốc, và kéo dài tuổi thọ của chế phẩm. Đồng thời, các CDs cũng đã được ứng dụng trong việc thiết kế các nano polyme giúp làm tăng khả năng mang thuốc dùng trong cả dạng đường uống và đường tiêm.
Bảng 2. Đặc điểm của các cyclodextrin chính
| Loại CD | KLPT | Đường kính ngoài (mm) | Đường kính khoang rỗng (mm) | Thể tích khoang (ML/g)c | Độ tan (g/l nước) | Dạng hydrat (nm) | ||
| Bờ trong | Bờ ngoài | Khoang rỗng | Bên ngoài | |||||
| α, (glucose)6 | 972 | 1,52 | 0,45 | 0,53 | 0,1 | 129,5 | 2,0 | 4,4 |
| β, (glucose)7 | 1134 | 1,66 | 0,6 | 0,65 | 0,14 | 18,4 | 6,0 | 3,6 |
| γ, (glucose)8 | 1296 | 1,77 | 0,75 | 0,85 | 0,2 | 249,2 | 8,8 | 5,4 |
Ví dụ, Hadian và cộng sự (2018) đã bào chế nano p-CD chứa tinh dầu geraniol. Kết quả cho thấy các đặc tính lý hóa của tiểu phân nano bị ảnh hưởng bởi hàm lượng geraniol trong công thức với KTTP nằm trong khoảng 111-258 nm. Hiệu suất nano hóa cao nhât đạt 79,4 ± 5,4 % khi tỉ lệ tinh dầu và β-CD bằng 0,44:0,13 và thế zeta âm bằng -21,1 ± 0,5 mV. Phổ 1H-NMR đã cho thấy sự hình thành cấu trúc phức hợp. Sự hình thành phức hợp cũng đã dẫn đến sự thay đổi phổ IR, phổ DSC, hình ảnh SEM.
f. Chitosan
* Nguồn gốc và cấu trúc
Chitosan (CS) là sản phẩm deacetyl hóa (DA) của chitin, một polyme tự nhiên chuỗi dài của N-acetylglucosamin và dẫn xuất đường glucose. Chitin là thành phần chính cùa thành tế bào nấm, xương ngoài của động vật chân đôt như tôm cua, con trung, hay lưỡi bào ở động vật thân mềm. cs có độ DA > 50% hay thực tê là mọt polyme chitin/chitosan, với mức độ DA và khối lượng phân tử có thể thay đôi. Độ DA cua CS dùng trong sản xuất thường từ 60-100%.
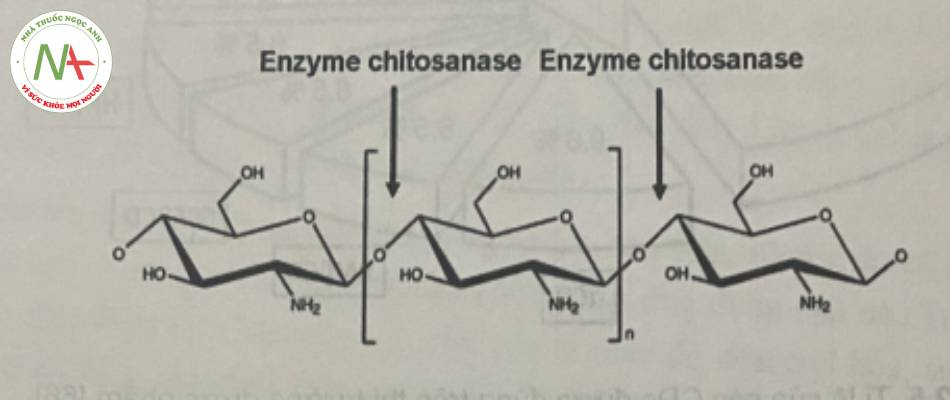
* Tính chất
Nhóm amino của cs có pKa ~ 6,5. cs mang điện dương, có tính base yêu, thâm nước, tan trong hầu hết các dung dịch acid hữu cơ ở pH < 6,5 như acid formic, acid acetic, acid tartric và acid citric, nhưng không tan hong acid sulfuric và phosphoric.
Do các monome của CS được nối với nhau bởi các liên kết β-( 1-4)-glycosid nên dễ bị cắt mạch bởi các chất hóa học như: acid, base, tác nhân oxy hóa và các men thủy phân.
Bảng 3. Một số loại chitosan trên thị trường
| Loại CS | Độ deactyl hóa (%) | Độ nhớt (cP) | Khối lượng Mv (kDa) |
| Sigma-Aldrich | |||
| CS KLPT thấp | 75-85 | 20-300 | 50-190 |
| CS KLPT cao | >75 | 800-2000 | 310-375 |
| CS KLPT trung bình | 75-85 | 200-800 | – |
| HEPPE Medical Chitosan GmH | |||
| Chitoscience CS 80/200 | 77,6-82,5 | 151-350 | – |
| Chitoscience CS 80/100 | 77,6-82,5 | 71-150 | – |
| Chitoscience CS 80/3000 | 77,6-82,5 | 2751-3250 | – |
| Chitoscience CS 75/200 | 72,6-77,5 | 151-350 | – |
| Chitoscience CS 75/100 | 72,6-77,5 | 71-150 | – |
Mv: KLPT trung bình lliênquan độ nhớt [63]
CS là một polyme thu hút nhiều sự quan tâm trong các ngành dược học, y học, răng hàm mặt, kỹ thuật mô liên quan đến nhiều tác dụng sinh học của nó như không độc hại, hoạt tính kháng vi sinh vật, tính tương thích sinh học, sự phân hủy sinh học, khả năng bám dính màng nhầy và khả năng mở tạm thời các khe hở hẹp của biểu mô, từ đó tạo điều kiện cho sự thâm nhập của thuốc. Tính chất tích điện dương giúp cho CS hoạt động như một chất bám dính sinh học, có khả năng bám vào các bề mặt tích điện âm như màng nhầy. Ngoài ra nhiều nghiên cứu cho thấy cs có tác dụng độc tính in vitro kháng lại nhiều dòng tế bào ung thư người.
Mặc dù, CS có những đặc tính đáng chú ý nêu trên, nhưng do có độ tan bị giới hạn trong môi trường khá acid làm hạn chế những ứng dụng của nó. Tuy nhiên, việc kiểm soát đặc điểm cấu trúc của CS, chủ yếu là mức độ deacetyl hóa, sự phân bố của các đơn vị đã được deacetyl hóa, cũng như KLPT trung bình và khả năng phân tán có thể tạo các loại CS khác nhau với các đặc tính tốt, bao gồm độ tan cao trong môi trường sinh lý. Ngoài ra, việc biến đổi hóa học đã được thực hiện để tạo ra các dẫn xuất của CS với các đặc tính được tăng cường trong đó có độ tan, giúp tăng khả năng ứng dụng của CS. Do có nhóm hydroxyl và amin, cs có thể tạo ra các dẫn chất bằng các phản ứng alkyl hóa, acyl hóa, tạo dẫn chất amin bậc 4,…
Các dẫn chất lưỡng thân của CS được tạo ra bằng cách kết hợp các nhóm kỵ nước như các nhóm alkyl hay acyl vào khung cs dẫn đến khả năng hình thành các micell và nano do quá trình tự kết hợp trong môi trường nước. Ví dụ một số dẫn chất của cs như N-naphthyl-N,0-succinyl chitosan, N-octyl-N,O-succinyl chitosan, và N-benzyl-N,O-succinyl chitosan, deoxycholic acid-phosphorylcholin chitosan, N-octyl-O-sulfat chitosan, N-palmitoyl chitosan đã được ứng dụng trong bào chế các micell và nano polyme mang thuốc.
Ví dụ, Chen Y. và cộng sự (năm 2009) đã sử dụng các polyme phân huỷ sinh học để tạo hệ nano chứa artemisinin giải phóng kéo dài với mục tiêu là hệ phân phối thuốc điều trị ung thư. Tinh thể dược chất được bao bởi chitosan, gelatin và alginat bằng kỹ thuật bao nhiều lớp với phân bố kích thước khoảng 766nm. Trong đó alginat bao ở lớp đầu tiên và lớp ngoài cùng và hai lóp gelatin/alginat (4 phần) và chitosan/alginat (6 phần) ở giữa. Các đặc tính của hệ nano được đánh giá bao gồm phân bố KTTP, thế zeta, hiệu suất nano hóa dược chất, tỷ lệ dược chất nano, mức độ hút ẩm, đánh giá bề cấu trúc và bề mặt tiểu phân (TEM/SEM).
Dương Thị Ánh Tuyết và cộng sự (2011) đã nghiên cứu chế tạo vật liệu nano chitosan làm chất hấp phụ protein ứng dụng trong dẫn truyền thuốc. Hạt nano chitosan (CS)-tripolyphosphat (TPP) đã được nghiên cứu chế tạo làm chất hấp phụ protein ứng dụng trong dẫn thuốc. Nghiên cứu đã đánh giá ảnh hưởng của các yếu tố đến kích thước hạt như các tác nhân tạo nối ngang, tỷ lệ CS/TPP, pH lên các đặc tính hoá lý của tiểu phân. Hiệu suất và khả năng hấp phụ protein của nano chitosan chế tạo được là 96,41% và l,93mg/mg tại 0,5mg hạt nano chitosan.
1.1.2. Chất mang cho nano
a. Lipid rắn
Lipid rắn thường được sử dụng là những lipid không độc với cơ thể, và có cấu tạo gần giống với lipid sinh lý. Lipid rắn bao gồm nhiều loại: glycerid (tristearin, glyceryl monostearat, glyceryl behenat, glyceryl palmitostearat…), acid béo (acid stearic, acid palmitic), steroid (cholesterol), sáp (cetyl palmitat).
Ví dụ, Baig và cộng sự (2016) đã bào chế nano lipid rắn chứa levofloxacin dùng trong nhãn khoa. Các lipid đã được khảo sát bao gồm acid stearic, glyceryl monosterat, Gelucire 39/1, Gelucire 50/13, Gelucire 54/14 (các triglycerid của các acid béo có nguồn gốc từ thực vật), Compritol 888 ATO (glyceryl behenat). Trong đó, acid stearic đã được sử dụng làm chất mang do có khả năng hòa tan levofloxacin với tỉ lệ lớn nhất. Tiêu phân được bào chế theo phương pháp bốc hơi dung môi với kết quả KTTP là 236 nm.
b. Lipid lỏng
Các triglycerid mạch trung bình (Medium chain triglycerides – MCT) và acid oleic, α-tocopherol/Vitamin E thường được sử dụng để bào chế giá mang lipid cấu trúc nano (NLC). Các triglycerid mạch trung bình thường là các phân đoạn của các dầu tự nhiên như dầu dừa hay dầu hạt cọ. Ngoài ra, một số loại dầu khác có thể được sử dụng như dầu bắp, dầu đậu nành, dầu hạt hướng dương như các loại lipid lỏng để tạo NLC.
Ví dụ, Chen-yu và cộng sự (2012) đã sử dụng các tá dược lipid như acid stearic, glyceryl monostearat, triglycerid mạch trung bình và chất diện hoạt là lecithin dầu đậu nành để bào chế nano NLC chứa quercetin. Hay Eiras và cộng sự (2017) đã sử dụng các tá dược lipid như Precirol ATO 5, vitamin E và chất diện hoạt là Tween 80 để bào chế nano NLC chứa vitamin E. – Các lipid rắn, lỏng là các tá dược thông dụng trong bào chế thuốc mỡ, thuốc đạn, hay trong hệ màng bao. Người đọc có thể tham khảo các đặc điểm lý hóa của các tá dược này ở các giáo trình bào chế đã xuất bản. .
1.1.3. Chất mang cho tiểu phân nano khác
Các chất mang được sử dụng để bào chế liposome có thể là các phospholipid tự nhiên hay tổng hợp.
Phospholipid tự nhiên: thường dùng là phosphatidylcholin (từ lecithin của trứng hoặc đậu tương), phosphatidylethanolamin, phosphatidylglycerol,…
Phospholipid tổng hợp: distearoyl phosphatidylcholin, dioleoyl phosphatidylethanolamin, distearoyl phosphatidylethanolamin…
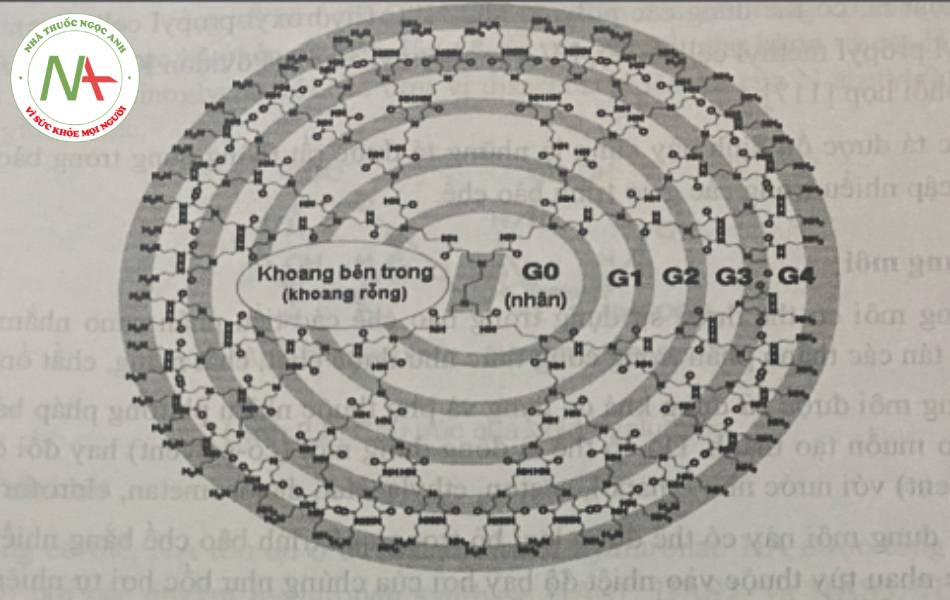
Đối với các phân tử dendrime, cấu trúc của chúng bắt đầu với một nguyên tử hoặc một nhóm nguyên tử trung tâm được đánh dấu là nhân. Từ cấu trúc trung tâm này, các nhánh của các nguyên tử khác gọi là dendron được phát triển thông qua nhiều phản ứng hóa học khác nhau
1.2. Chất ổn định
Chất ổn định sử dụng trong các tiểu phân nano là các chất thường được sử dụng với vai trò nhũ hóa để hình thành nhũ tương, ngăn cản sự kết tập của các tiểu phân nano, giúp ổn định hỗn dịch tiểu phân nano tạo thành. Trong đó, thường sử dụng các chất diện hoạt ion hóa hoặc không ion hóa như poloxame, polysorbat, lecithin, natri lauryl sulfat,… Sự phối hợp nhiều chất nhũ hóa có hiệu quả trong ngăn chặn sự kết tụ của các tiểu phân hơn là sử dụng một chất nhũ hóa. Loại chất nhũ hóa được lựa chọn phụ thuộc rất nhiều vào đường dùng và bị giới hạn với đường tiêm.
Ngoài ra, có thể dùng các polyme như HPC (hydroxyl propyl cellulose), HPMC (hydroxyl propyl methyl cellulose), PVA (polyvinyl alcol), Povidon K15… ở dạng riêng lẻ hoặc phối hợp.
Các tá dược ổn định này cũng là những tá dược rất thông dụng trong bào chế đã được đề cập nhiều trong các giáo trình bào chế.
1.3. Dung môi
Dung môi có thể được sử dụng trong bào chế các tiểu phân nano nhằm hòa tan hay phân tán các thành phần trong công thức như dược chất, chất mang, chất ổn đinh.
Dung môi được sử dụng khá đa dạng và phụ thuộc nhiều phương pháp bào chế và dạng nano muốn tạo thành. Đó có thể là đồng dung môi (co-solvent) hay đối dung môi (non-solvent) với nước như ethanol, aceton, ethylacetat, diclorometan, cloroform,…
Các dung môi này có thể được loại bỏ trong quá trình bào chế bằng nhiều phương pháp khác nhau tùy thuộc vào nhiệt độ bay hơi của chúng như bốc hơi tự nhiên, bốc hơi dưới áp suất giảm, phun sấy, đông khô.
1.4. Chất khác
Ngoài thành phần là chất mang và chất ổn đinh cũng như dung môi, công thức bào chế tiểu phân nano còn có thể chứa một số chất khác như chất cải biến bề mặt (surface modification), các tá dược tạo khung, các ion tích điện trái dấu hay ion đối (counterions),…
1.4.1. Chất biến đổi bề mặt tiểu phân nano
Các chất biến đổi bề mặt đã được sử dụng để thay đổi các đặc tính bề mặt của tiểu phân nano so với ban đầu nhằm tăng cường sự bám dính sinh học, giảm sự hoạt hóa của bổ thể, giảm sự tương tác bắt giữ bởi đại thực bào, gắn kết đặc hiệu với các kháng nguyên trên bề mặt tế bào,… từ đó giúp tăng cường khả năng hướng đích và hiệu quả điều trị của tiểu phân nano.
Về phương pháp gắn kết với chất biến đổi bề mặt, có thể thực hiện bằng phương pháp vật lý hoặc phương pháp hóa học. So với phương pháp hóa học, phương pháp gắn kết “không hóa trị” thông qua các liên kết vật lý giữa phối tử và bề mặt của chất mang có ưu điểm là tránh được các tác nhân phản ứng mãnh liệt, có khả năng gây phá hủy cấu trúc. Tuy nhiên, phương pháp vật lý cũng có những hạn chế như liên kết yếu, khả năng kiểm soát phản ứng thấp. Ngoài ra, các phối tử có thể không sắp xếp theo trật tự như mong muốn sau quá trình cải biến bề mặt.
a. Acid hyaluronic (HA)
* Nguồn gốc và cấu trúc
HA là một carbohydrat, hay cụ thể hơn là một polysaccharid, tồn tại tự nhiên trong các cơ thể sống, đặc biệt cần thiết cho chất nhờn bôi trơn cho sức khỏe của sụn và khớp, da và mắt. Trong số các chức năng, chức năng của nó trong cơ thể là liên kết nước và bôi trơn các bộ phận chuyển động được của cơ thể, như khớp và cơ. HA là một phân tử glycosaminoglycan với các đơn vị disaccharid lặp lại của N-acetylglucosamin và acid glucuronic.
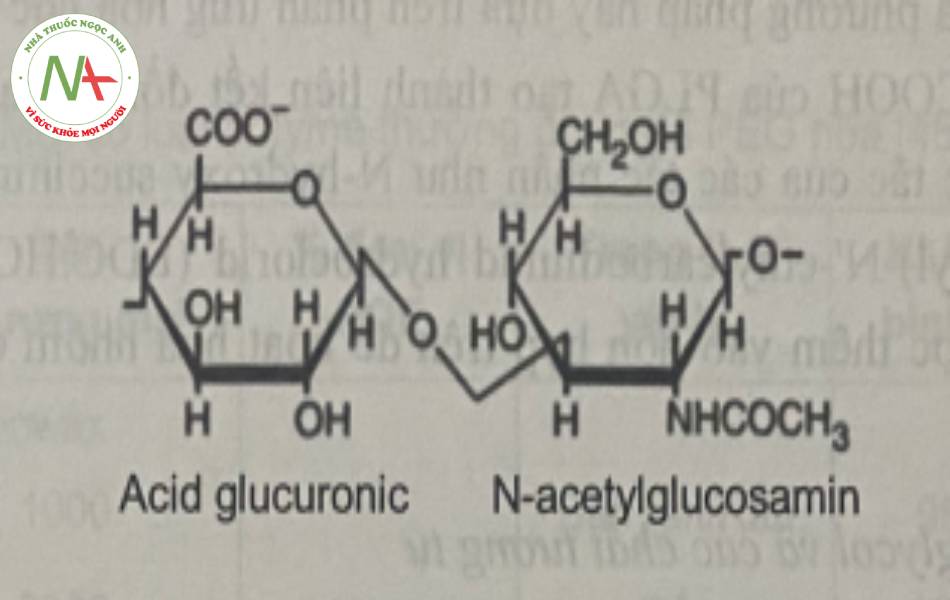
* Tính chất</>
Trong cơ thể, HA tồn tại ở dưới dạng muối hyaluronat. HA được tổng hợp ở bộ máy Golgi bởi các enzym hyaluronan synthase HAS1, HAS2, và HAS3. HA chịu sự phân hủy bởi các enzym hyaluronidase (hyase), b-d-glucuronidase và p-N-acetyl-hexo saminidase.
HA đóng vai trò tổ chức quan trọng trong cấu trúc nền ngoại bào bằng cách gắn với tế bào và các thành phần khác thông qua các tương tác đặc hiệu hoặc không đặc hiệu.
Với khả năng gắn kết đặc hiệu vào CD44, HA là một polyme tiềm năng đối với việc thiết kế thuốc hướng đích bởi vì CD44 là một thụ thể nằm trên bề mặt tế bào và được bộc lộ nhiều ở các tế bào của khối u như tế bào ung thư phổi, ung thư dạ dày, ung thư vú, ung thư đại tràng.
* Phương pháp gắn kết
– Gắn kết vật lý
Do bản chất là một polysaccharid có điện tích âm, nên nó có thể tương tác với các nguyên liệu có điện tích dương để hình thành các phức hợp và giúp tăng cường khả năng tương thích sinh học và ổn định cho các phức hợp.
Ví dụ, để có thể hấp phụ vật lý lên bề mặt của nano PLGA có bản chất điện thế zeta âm thông qua lực tương tác tĩnh điện cần phải thay đổi điện thế của bề mặt nano PLGA sang dương bằng một số phương pháp như kết hợp với một chất diện hoạt dạng ion dương (ví dụ: DDAB – Didodecyl dimethyl ammonium bromid), tạo tiểu phân nano lai có bản chất dương điện (ví dụ: tạo tiểu phân nano lai polyme-lipid PLGA-DOTAP (l,2-dioleoyl-3-trimethyl ammonium-propan – DOTAP)).
– Gắn kết hóa học
HA có 4 nhóm chức như acetamid, carboxyl, hydroxyl và aldehyd nên có thể thực hiện nhiều các phản ứng để hình thành các liên kết.
Nguyên tắc của phương pháp này dựa trên phản ứng hóa học giữa các nhóm -OH của HA và nhóm -COOH của PLGA tạo thành liên kết đồng hóa trị. Phản ứng được thực hiện với sự xúc tác của các tác nhân như N-hydroxy succinimid (NHS) và N-(3- dimethyl aminopropyl)-N’-ethylcarbodiimid hydroclorid (EDC.HC1) là tác nhân hoạt hóa và loại nước được thêm vào hỗn hợp trên để hoạt hóa nhóm carboxyl trên PLGA.
b. Polyethylen glycol và các chắt tương tự
Quá trình gắn PEG (hay còn gọi là PEG hóa) là quá trình liên quan đến việc thay đổi bề mặt của các tiểu phân nano bằng cách liên kết cộng hóa trị, bao gói hoặc hấp phụ các chuỗi PEG.
Mục đích của các chuỗi PEG này là tạo ra lớp hàng rào để ngăn cản sự kết dính của các opsonin trong huyết tương, từ đó các tiểu phân có thể “ngụy trang” hoặc “ẩn” đối với các thực bào. Các nghiên cứu thực nghiệm sử dụng phương pháp kính hiển vi điện tử truyền qua tách mâu kêt đông (freeze-fracture transmission electron microscopy) đã cho thấy khả năng “chống lại” các protein opsonin của các bề mặt được PEG hóa.
* Cấu trúc
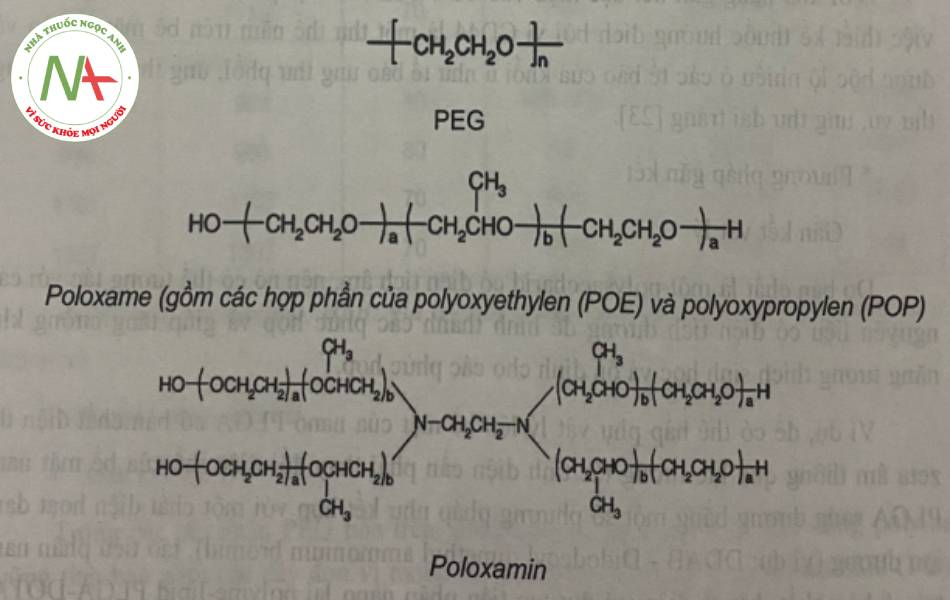
Trong đó, mồi loại PEG, poloxame, poloxamin bao gồm nhiều loại khác nhau. Do sự khác nhau về số lượng monome trong thành phần nên chúng lại có những tính chất vật lý khác nhau
Bảng 4. Một số loại polyme thường dùng để PEG hóa
| Chất PEG hóa | Tên thương mại | % đơn vị POE | Trạng thái vật lý | Trạng thái vật lýKLPT trung 1 bình (g/mol) | HLB |
| PEG
1000 2000 4000 6000 |
Carbowax
1000 2000 4000 6000 |
Bán rắn/Rắn
Rắn Rắn Rắn |
950-1050 1800-2200 3000-4800 5100-7000
|
–
– – –
|
|
| Poloxame
124 188 237 338 407 |
Pluronic
L-44 F-68 F-87 F-108 F-127 |
40
80 70 80 70 |
Lỏng
Rắn Rắn Rắn Rắn |
2090-2360
7680-9510 6840-8830 12700-17400 9840-14600 |
12-18
>24 >24 >24 18-23 |
| Poloxamin
904 908 1107 1307 |
Tetronic
904 908 1107 1307 |
40
80 70 70 |
Bột nhão
Rắn Rắn Rắn |
6700
25000 15000 18000 |
12-18
>24 18-23 >24 |
(POE: polyoxyethylen), HLB: giá trị cân bằng dầu nước (Hydrophilic Lipophilic Balance)
* Phương pháp gắn kết
– Gắn kết vật lý
Trong các tác nhân PEG hóa trên, poloxame và poloxamin là các đồng polyme lưỡng tính bao gồm các dãy đơn vị monome ethylen oxid (EO) và propylen oxid (PO), trong đó, càng nhiều đơn vị PO thì tính thân dầu của polyme càng tăng. Do đó, phần thân dầu của các polyme với các đơn vị PO có thể được sử dụng để hấp phụ và giữ các phân tử chất diện hoạt ở bề mặt của nano, trong khi đó, các polyme chứa phần EO thân nước hoặc phần PEG có thể hướng về phía dung dịch và bảo vệ bề mặt của tiểu phân.
Phương pháp này có thuận lợi là dễ thực hiện và có thể tạo đặc tính tránh quá trình thực bào cho các tiểu phân. Ngược lại, nó cũng có nhược điểm là các polyme PEG được hấp phụ ở bề mặt có thể bị phản hấp phụ, tạo ra các lỗ trên lớp bao phủ bề mặt nơi các opsonin có thể gắn vào. Trong trường hợp các polyme được hấp phụ trên các tiểu phân nano có khả năng phân hủy sinh học, không chỉ quá trình phản hấp phụ xảy ra mà quá trình phân hủy của tiểu phân cũng có thể làm tăng sự mất mát của phần PEG được găn vào bề mặt tiểu phân.
– Gắn kết hóa học
Các nghiên cứu đã chỉ ra rằng các tiểu phân với các chuỗi PEG được gắn kết hóa trị đạt thời gian tuần hoàn trong máu dài hơn so với tiểu phân tương tự chỉ với PEG hấp phụ ở bề mặt.
Tuy vậy, phương pháp này cũng có những hạn chế nhất định như thường khó để đảm bảo quá trình gắn kết hóa trị của chuỗi PEG xảy ra trên bề mặt và do đó rất khó kiêm soát và tối ưu hóa mật độ của lớp che phủ bề mặt và cấu hình của chuỗi PEG. Ngoài ra, sự gắn kết hóa trị của PEG trên toàn bộ tiểu phân thích hợp hơn đối với các tiểu phân có khả năng phân hủy sinh học vì vẫn giữ được những lợi ích của chuỗi PEG găn trên bê mặt tiêu phân trong toàn bộ quá trình phân hủy và ăn mòn chất mang.
Quá trình polyme hóa tạo phức hợp PLGA-PEG từ các monome có thể thực hiện thông qua các phản ứng sau:
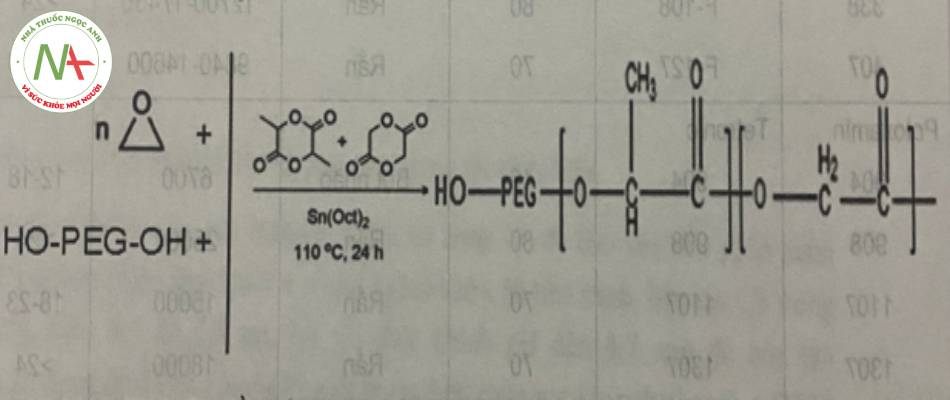
c. Acid folic
*Cấu trúc
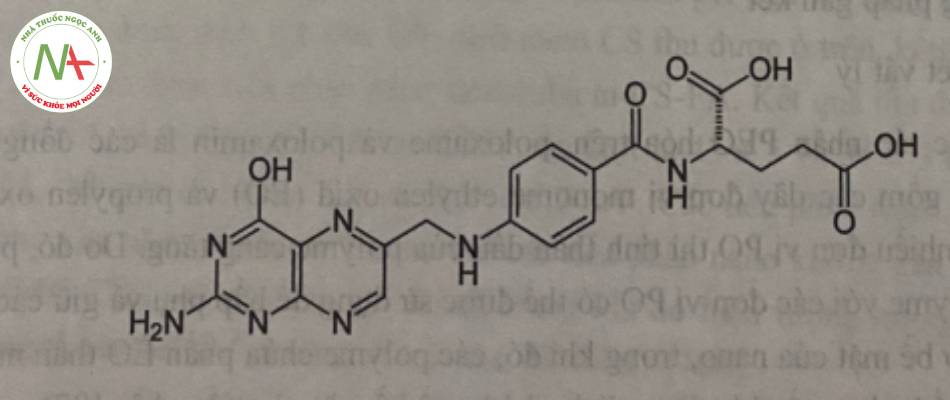
* Nguồn gốc:
Acid folic (FA) hay muối folat là một vitamin trong nhóm B tan trong nước, có vai trò quan trọng trong sinh tổng hợp tế bào. Trong cơ thể, FA ảnh hưởng lên tông hợp ADN. Acid folic là yếu tố không thể thiếu được cho quá trình sinh tổng hợp nucleoprotein và tạo hồng cầu bình thường. Acid folic cũng tham gia vào một sô quá trình như biến đổi acid amin, sự tạo thành và sử dụng format.
Acid folic trong chế độ ăn bình thường được hấp thu rất nhanh và phân bố ở các mô trong cơ thể. Acid folic được tích trữ chủ yếu ở gan và được tập trung nhiều trong dịch não tủy.
* Tính chất
Bột kết tinh màu hơi vàng, không mùi, không tan trong nước lạnh, tan tốt trong kiềm, acid, nhiệt độ nóng chảy 250°c. Acid folic dễ bị phân hủy mất hoạt tính dưới tác dụng của ánh sáng, chất oxy hóa, chất khử, acid, kiềm hoặc khi đun nóng.
Acid folic là một trong những phối tử (ligand) được sử dụng phổ biến với mục đích hướng đích nhờ gắn với các thụ thể folat trên tế bào ung thư.
*Phương pháp kết hợp
Gắn kết vật lý:
Đó là tạo phức hợp với FA thông qua các tương tác tĩnh điện.
Ví dụ trong nghiên cứu của Huijuan Song và cộng sự, để bào chế tiều phân nano chứa doxorubicin bao phức hợp CS-FA nhóm nghiên cứu đã tiến hành: hòa tan CS trong acid acetic 2%, siêu âm để CS tan hết rồi điều chỉnh pH đến 4,7, sau đó hòa tan doxorubicin vào dung dịch CS. Chuẩn bị một dung dịch chứa natri tripolyphosphat (TPP) đã lọc qua màng lọc 0,45 um. Thí nghiệm được tiến hành ở 2-8°C. Phối hợp dung dịch TPP vào dung dịch CS bằng cách nhỏ giọt, tiếp tục khuấy trộn 60 phút. Thu được hỗn dịch nano. FA được hòa tan vào dung dịch NaOH 20%, điều chỉnh pH đến 7,4 bằng đệm phosphat. Sau đó phối hợp dung dịch FA vào hỗn dịch nano CS thu được ở trên, kết hợp khuấy trộn trong 30 phút thu được tiêu phân nano doxorubicin-CS-FA. Kết quả thu được các tiểu phân nano gắn FA và không gắn FA có KTTP lần lượt là 43 +5 và 31 +3 nm, PDI là 0,084 và 0,052, thế zeta là 19,2 +6,9 và 30,4 + 8,7 mV. Các tiểu phân nano gắn FA đã giúp tăng cường khả năng đi vào tế bào so với các tiểu phân nano không gắn FA trên dòng tế bào SMMC-7721 (có các thụ thể folat), trong khi đó hiện tượng tương tự không xảy ra trên dòng tế bào MCF-7 (không có các thụ thể folat).
– Gắn kết hóa học:
Việc tạo phức hợp với FA được thực hiện thông qua các phản ứng hóa học.
Ví dụ như trong nghiên cứu của Stella Barbara và cộng sự, nhóm tác giả đã tông họp poly (H2NPEGCA-co-HCDA) sau đó bào chế nano PEG bằng phưcmg pháp kết tủa, rồi phối hợp với NHS-folat để tạo nano liên kết PEG-FA.
Một nghiên cửu khác của Dhas và cộng sự về thiết kế, tối ưu hóa và thừ giải phóng in vitro của nano bicatulamid bao phức hợp CS-FA trong điều trị ung thư tuyến tiền liệt. Để bào chế nano bicatulamid bao phức họp CS-FA nhóm nghiên cứu đã tiến hành: bào chế phức hợp CS-FA bằng phương pháp tổng hợp hóa học sử dụng các tác nhân tạo phản ứng như dicyclohexylcarbodiimid (DCC), triethylamin, N-hydroxy succinimid. Sau đó, bào chế nano bicatulamid bằng phương pháp kết tủa. Tiếp tục phối hợp phức hợp CS-FA vào nano bicatulamid thu được nano bicatulamid bao phức hợp CS-FA.
Ngoài các tá dược đã nêu, còn một số các tá dược khác có thể dùng để hướng đích điều trị của các tiểu phân nano.
1.4.2. Tá dược tạo khung
Để bảo vệ các đặc tính của tiểu phân nano trong quá trình bảo quản, đặc biệt các tiểu phân nano không ổn định dưới dạng hỗn dịch, quá trình đông khô đã được áp dụng. Đông khô là một quá trình làm khô dung dịch nước đã được đông lạnh ở nhiệt độ thấp hơn nhiệt độ eutectic của dung dịch, dung môi được loại trực tiếp từ pha rắn, không qua pha lỏng dưới áp suất giảm (thường dưới 100 μm Hg), cho ra sản phẩm khô.
Do đó, khi tiến hành quá trình lạnh sâu trong chu trình đông khô, nano có sự tăng KTTP ở mức độ khác nhau. Có thể do trong quá trình lạnh sâu có sự tách thành nhiều pha: pha kết tinh của các phân tử nước, pha còn lại gồm các tiểu phân nano, dược chất tự do, các tá dược khác. Sự tách pha dẫn đến hỗn dịch nano bị cô đặc làm cho nano dễ bị kết tụ và trong nhiều trường họp sự kết tụ này là phản ứng không thuận nghịch hoặc có thể do các tinh thể băng gây áp lực làm mất sự ổn định của các tiểu phân nano.
Các tá dược tạo khung thường là các loại đường đã được sử dụng như saccharose, manitol, ttrehalose.., Cơ chế bảo vệ của các đường trong quá trình lạnh sâu là do chúng tạo nên pha vô định hình giữa các tinh thể băng, cô lập các tiểu phân nano trong phân không đóng băng, ngăn cản sự kết tụ giữa các tiểu phân nano hoặc ứng suất cơ học gây ra bởi các tinh thể băng.
Ngoài quá trình đông khô, các tá dược tạo khung này còn được sử dụng trong kỹ thuật phun sấy, đặc biệt kỹ thuật phun sấy lạnh (spray freeze drying) cũng với mục đích bảo vệ các đặc tính của tiểu phân nano.
1.4.3. Các ion trái dấu
Đối với các nano lipid được thiết kế để bao gói các dược chất có điện tích dương, tan trong nước có thể chứa các ion trái dấu để giúp thuận lợi trong quá trình bao gói dược chất như các ion âm hữu cơ hay các polyme tích điện âm như mono-octyl phosphat, mono-hexadecyl phosphat, mono-decyl phosphat, natri hexadecyl phosphat, hay muối natri dextran sulphat.
1.4.4. Các chất khác
Ngoài các thành phần kể trên, trong bào chế các tiểu phân nano còn có thể sử dụng các thành phần khác nhằm hướng đích tác dụng dưới tác động của môi trường bên ngoài như từ trường, nhiệt độ,… trong đó, oxyd sắt được sử dụng khá phổ biến với mục đích hỗ trợ chẩn đoán và điều trị.
– Sắt
* Nguồn gốc và cấu trúc
Fe3O4 hay quặng sắt từ (quặng ma-nhe-tỉt hay magnetite) là một ion sắt từ phổ biến, có cấu trúc khối lập phương spinel, trong đó ion Fe chiếm các vị trí tứ diện và bát diện trong cấu trúc phân tử. Ở cấu trúc này, điện tử có thể nhảy (hop) giữa các ion Fe2+ và Fe3+ trong mặt bát diện của oxyđ sắt từ tại nhiệt độ phòng.
Nếu được bao bề mặt, các tiểu phân nano từ tính có thể phân tán vào dung môi phù hợp, tạo ra hỗn dịch sắt từ (ferro-fluid). Các hệ này có thể tương tác với các nguồn từ trường bên ngoài, di chuyển trong cơ thể bệnh nhân, hỗ trợ trong chẩn đoán (chụp chiếu hình ảnh) và điều trị ung thư (magnetic field-assisted cancer therapy).
Các oxyd (Fe3O4 hoặc Fe2O3) có thể được tổng hợp thông qua kết tủa đồng thời Fe2+ và Fe3+ trong dung dịch thân nước, có các muối phù hjơp.
Việc kiểm soát kích thước, hình dạng và thành phần nano chứa các oxyd sắt phụ thuộc vào loại muối sử dụng (clorid, sulphat, nitrat, perclorat,..), tỷ lệ Fe2+ va Fe3+ pH và hàm lượng ion trong dung dịch.
Thông thường, các hạt từ trường được bào chế thông qua việc thêm các dung dịch FeCl2 và FeCl3 (tỷ lệ mol 1:2). Sản phẩm thu được thường có màu đen.
Việc ứng dụng oxyd sắt trong chẩn đoán, điều trị đã được thực hiện từ 40 năm nay. Trong đó, từ 10 năm nay, ngày càng có nhiều nghiên cứu về nano kết hợp với oxyd sắt từ (chủ yếu là các quặng Fe3Ọ4, hoặc Fe203, tạo ra tiểu phân có kích thước 5-20 mn). Có nhiều phương pháp điều chế khác nhau dựa trên nguyên tắc kết tủa đã được phát triên bao gôm phương pháp bào chế so 1-gel, phương pháp tổng hợp qua trung gian cốt polyme, phương pháp kết tủa sử dụng vi nhũ tương và hệ chứa thuốc (vescile).
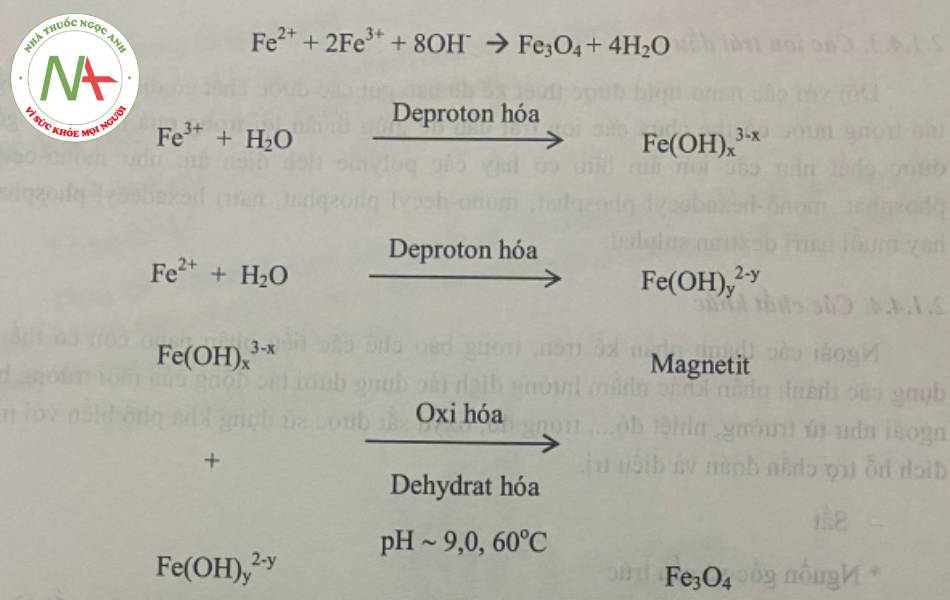
Ví dụ, vi nhũ tương nước trong dầu đã được sử dụng để tổng hợp các tiểu phân nano chứa oxyd sắt bằng cách sử dụng micell đảo (reverse micelles) trong n-hexan với chất nhũ hóa là AOT (Aerosolo OT – Aerosolf Sodium dioctyl sulfosuccinat). Các
micell đảo này có phần nhân thân nước bên trong có khả năng hòa tan các hợp chất thân nước như các dung dịch muối của ion Fe” hay Fe”. Tiến hành phản ứng kết tủa bằng cách sử dụng dung dịch natri hydroxyd.
2. PHƯƠNG PHÁP BÀO CHẾ
2.1. Bào chế nano tinh thể
2.1.1. Tá dược sử dụng
Nano tinh thể bao gồm 100% hàm lượng dược chất, không chứa chất mang như hệ
mang thuốc nano. Hệ phân tán của nano tinh thể trong môi trường lỏng hay hỗn dịch nano cần được ổn định bởi các chất diện hoạt hay các chất ổn định polyme. Môi trường phân tán có thể là nước, dung dịch thân nước hoặc không thân nước (ví dụ: PEG dạng lỏng, các loại dầu).
2.1.2. Thiết bị sử dụng
Tùy thuộc vào nguyên tắc của mỗi phương pháp bào chế, có thể sử dụng các thiết bị khác nhau để bào chế các nano tinh thể. Do đó, để thuận tiện cho người đọc, các thiết bị sử dụng trong bào chế nano tinh thể sẽ được trình bày trong phần tiếptheo ứng với từng phương pháp bào chế.
2.2.3. Các phương pháp bào chế
Nano tinh thể có thể được tạo thành dựa trên nguyên lý của một trong hai kỹ thuật là kỹ thuật phân chia hoặc kỹ thuật kết tụ tiểu phân.
a. Kỹ thuật phân chia
* Nguyên tắc
Dùng các biện pháp giảm kích thước từ tiểu phân thô ban đâu đê tạo thành các tiểu phân có kích thước nano. Bao gồm các phương pháp: phương pháp nghiền, phương pháp đồng nhất hóa ở áp suất cao.
– Phương pháp nghiền
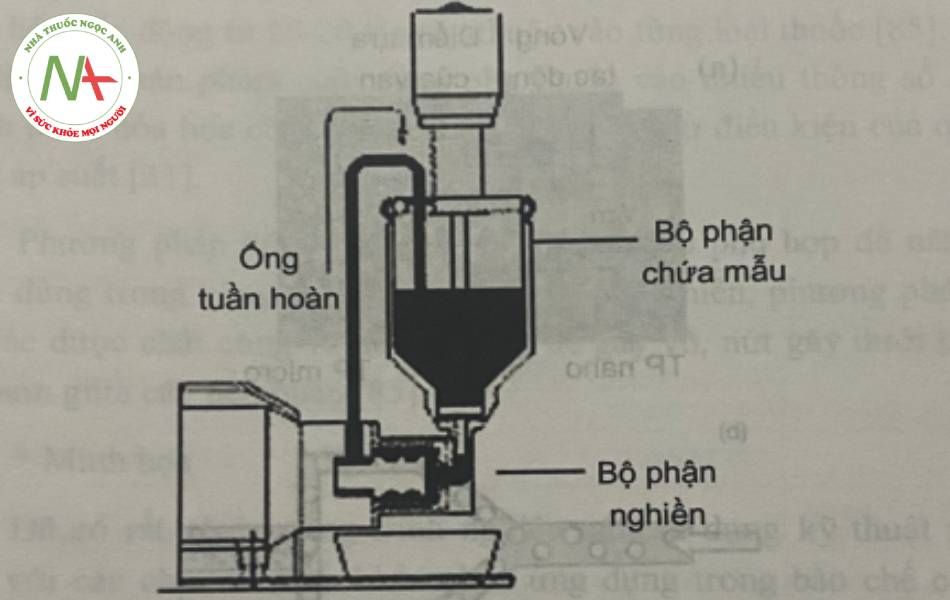
Dược chất siêu mịn được đưa vào các máy nghiền bi chuyên dụng với năng lượng cao được làm từ các vật liệu nghiền bền chắc, đặc biệt như thép không rỉ mạ bề mặt, zirconi oxyd, polystyren… Tốc độ và hiệu suất nghiền phụ thuộc vào độ bền cơ học của dược chất, vật liệu nghiền và tốc độ quay của thiết bị. Phương pháp này bao gồm nghiền khô và nghiền ướt.
Phương pháp nghiền khô được áp dụng cho các dược chất có cấu tạo bền chắc, chịu được nhiệt độ cao (tiểu phân kim loại), sử dụng trong những trường hợp cần thu được chất dưới dạng bột khô.
Phương pháp nghiền ướt được dùng phổ biến hơn nghiền khô vì dược chất ít bị tác động của nhiệt và thời gian nghiền ngắn, đồng thời trực tiếp tạo ra dạng bào chế (hỗn dịch nano). Dược chất được nghiền trong môi trường lỏng chứa các chất ổn định. Sau khi nghiền 30 đến 60 phút có thể thu được hỗn dịch có kích thước tiểu phân trung bình dưới 200 nm. Môi trường là nước tinh khiết, với dược chất không bền trong nước có thể dùng các dung môi khác (dầu, PEG, triglycerid,…). Sau khi nghiên, có thể cho hỗn dịch qua máy đồng nhất hóa để đồng nhất KTTP. Để tránh sinh nhiệt, máy nghiền thường được trang bị bộ phận làm lạnh bên ngoài.
Ngoài ra, chất diện hoạt hay chất ổn định có thể được thêm vào để đảm bảo độ ổn định vật lý của hỗn dịch nano tạo thành. Việc lựa chọn chất diện hoạt hay chất ổn định không những phụ thuộc vào đặc tính của tiểu phân được nghiền (như ái lực của chất diện hoạt đối với bề mặt tinh thể) mà còn phụ thuộc vào các nguyên tắc vật lý (như ổn định tũih điện hay không gian) và đường sử dụng (uống, tiêm, xông hít,…).
– Phương pháp đồng nhất hóa ở áp suất cao
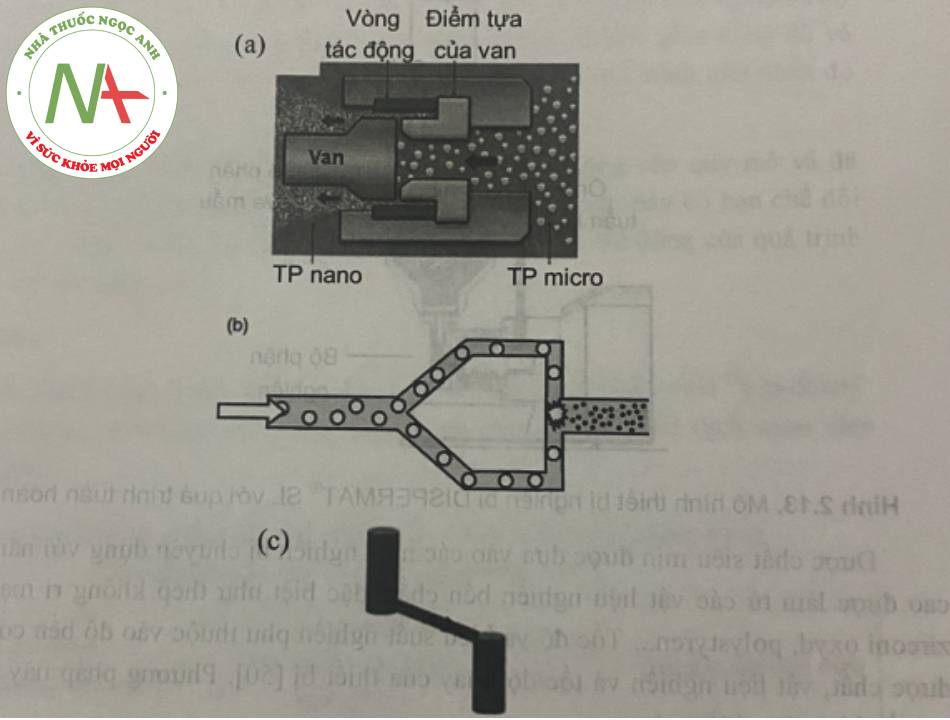
Trong mô hình “piston-gap”, hỗn dịch ban đầu đuợc cho đi qua một khe hẹp cơ 10 μm. Lực vỡ “bong bóng” xảy ra khi áp suất động của dòng chất lỏng tăng và áp suất tĩnh giảm dưới áp suất hơi của nước ờ nhiệt độ phòng, làm nước sôi ở nhiệt độ nàỵ từ đo hình thành các bong bóng khí. Khi đi qua khe hẹp, bong bóng bị vỡ và trờ lại áp suất không khí hình thường, dẫn đến sự phá vỡ các tiểu phân.
Trong buồng tương tác của các dòng chất lỏng dạng chữ Y (hay mô hình “jet- stream’’), hai dòng hỗn dịch sẽ va chạm vào nhau ở vận tốc rất lớn giúp làm giảm kích thước tiểu phân nhờ lực va đập.
Trong đó, mô hình “jet-stream” được xem có hiệu quả hơn trong việc tạo các giọt dầu có kích thước nhỏ so với mô hình “piston-gap” và với sô vòng đông nhât hóa cũng ít hơn.
Áp suất yêu cầu để thu được hỗn dịch nano là 1000-1500 bar và sô vòng đông nhất hóa dao động từ 10-20 lần tùy thuộc vào từng loại thuốc. Đặc tính vật lý và độ ổn định của sản phẩm cuối cùng phụ thuộc vào nhiều thông số bao gồm nồng độ và thành phần hóa học của nguyên vật liệu cũng như điều kiện của quá trình như nhiệt độ hoặc áp suất.
Phương pháp đồng nhất hóa ở áp suất cao phù hợp để nâng cấp quy mô và đã được dùng trong công nghiệp thực phẩm. Tuy nhiên, phương pháp này có hạn chế đối với các được chất cứng và dẻo dai khó để gây vỡ, nứt gãy dưới tác động của quá trình va chạm giữa các tiểu phân.
* Minh họa
Đã có rất nhiều công trinh nghiên cứu sử dụng kỹ thuật phân chia “top-down” cùng với các chất ổn định khác nhau ứng dụng trong bào chế các hỗn dịch nano như bảng 5 dưới đây:
Bảng 5. Kỹ thuật phân chia “top-down” và chất ổn định ứng dụng trong các nghiên cứu bào chế hỗn dịch nano
| Chất ổn định 1 (% kl/kl so với hoạt chất) | Hoạt chắt (% kl/tt hoặc kl/kl trong CT) | Phương pháp | Tác giả nghiên cứu |
| Lecithin (6,7%) | RMKP 22 (9%) | HPH | Muller và Peters (1998) |
| Cremophor RH 40 (12,5%) | Albendazol (4%) | HPH | Kumar và cs. (2008) |
| Poloxame 188 (4%) | Hydrocortisone (2.5%) | HPH | Kassem và cs. (2007 |
| Poloxame 407 (50%) | Itraconazol (1 %) | HPH | Crisp và cs. (2007) |
| Poloxame 407 (50%) | Paclitaxel (2%) | MM | Merisko-Liversidge và cs. (1996) |
| Natri lauryl sulfat (5%) | Spironolacton (10%) | HPH | Langguth và cs. (2005 |
| 1.2. Polyme | |||
| HPMC (Methocel E15; 10-200%) | Nifedipin (5%) | HPH | Hecq và cs. (2006b) |
| Polyvinyl alcol (30-70 kDa; 50%) | Beclomethason dipropionat (5%) | MM | Wiedmann và cs. (1997) |
| 2. Hệ thống nhiều chất ổn định
2.1. Các chất diện hoạt |
|||
| Poloxame 188 (20%)-Lecithin (10%) | Azithromycin (1%) | HPH | Zhang và cs. (2007) |
| Tween 80 (20%)-Lecithin (10%) | Azithromycin (1%) | HPH | Zhang và cs. (2007) |
| Tween 80 (12,5%>-Natri lauryl 1 sulfat (12,5%) | Albendazol (4%) | HPH | Kumar và cs. (2008) |
| 2.2. Polyme và chất diện hoạt | |||
| Carbopol 974 p (2,5%)-Tween 80 (12,5%) | Albendazole (4%) | HPH | Kumar và cs. (2008) |
| HPC-Natri lauryl sulfat | Cilostazol | MM | Jinno và cs. (2006) |
| HPMC (K4MCR; 12,5%)-Tween 80 (12,5% | Albendazole (4%) | HPH | Kumar và cs. (2008) |
| PVA (50%)-Poloxame 188 (50%) | Buparvaquon (1%) | HPH | Hemández-Trejo vàcs. (2005) |
Công nghệ NanoCrystal (sử dụng phương pháp nghiền) giúp cải thiện độ tan và độ hòa tan của dược chất ít tan, giúp tạo nano tinh thể hoặc hỗn dịch nano (nanosuspension) ứng dụng cho các dạng thuốc uống, hít, tiêm tĩnh mạch, tiêm dưới da, tiêm bắp, dùng trong nhãn khoa. Đây là công nghệ đã được đăng ký độc quyền của công ty Dược phẩm Elan Pharma International Ltd. giúp tăng cường sinh khả dụng của thuốc bằng cách bào chế thuốc dưới dạng nano, giúp thuốc có thể phân tán trong chất lỏng, rồi tạo thành bột, nén thành viên hoặc được bao gói.
b. Kỹ thuật kết tụ tiểu phân (bottom-up)
* Nguyên tắc
Kỹ thuật này liên quan đến việc tạo cấu trúc nano từ những nguyên tử hoặc phân tử. Tuy nhiên, kỹ thuật này đòi hỏi việc dùng thêm dung môi do đó làm tăng chi phí sản xuất.
– Phương pháp kết tủa
Để quá trình kết tủa xảy ra thì dược chất cần tan được trong một dung môi và dung môi này phải trộn lẫn được với “đối dung môi” (non-solvent). Do vậy, nhiêu hợp chất mới phát triển kém tan trong nước cũng như trong môi trường không thân nước sẽ không thể áp dụng được kỹ thuật này.
– Phương pháp dung môi siêu tới hạn

Việc áp dụng dung môi siêu tới hạn trong bào chế nano mang lại rất nhiều ưu điểm. Khí carbonic (CO2) thường được sử dụng trong sản xuất dược phẩm do không dễ cháy, không độc, giá thành rẻ và có các thông số tới hạn không quá cao (nhiệt độ tới hạn là 31,3°C, áp suất tới hạn là 73,7 bar). Nguyên tắc của phương pháp có thể được mô tả như sau: hòa tan dược chất trong CO2 siêu tới hạn ở áp suất cao trong bình khí nén, sau đó xả CO2, để giảm áp suất đột ngột, dược chất sẽ bị kết tủa lại dưới dạng siêu mịn hoặc | hòa tan dược chất vào dung môi rồi bơm vào thùng chứa cùng với CO2 siêu tới hạn,
dung môi chuyển sang CO2, làm kết tủa dược chất, sau đó giảm áp suất để thu sản phẩm.
– Phun sấy
Phương pháp tuy đơn giản nhưng tỉ lệ nano thu được sau khi phun sấy không cao. Kích thước tiểu phân phụ thuộc vào điều kiện phun sấy (đường kính vòi phun, nhiệt độ bốc hơi, khả năng bay hơi của dung môi,…)
Ngoài ra, hỗn dịch thu được sau khi áp dụng các kỹ thuật phân chia hay kết tụ nêu trên như nghiền, kết tủa và đồng nhất hóa cũng có thể đem phun sấy. Khi cần, có thể cho tá dược tạo khung vào hỗn dịch phun sấy để tạo siêu vi cầu mang dược chất. Phương pháp phun sấy còn được dùng để bao nano dược chất làm chất mang định hướng tới đích hoặc biển tính bề mặt để tránh nhận biết của hệ thực bào. Trong trường hợp này, phối hợp polyme hoặc chất bao vào hỗn dịch tiểu phân rồi phun sấy.
* Minh họa
– Phương pháp kết tủa
Homayouni (2014) đã bào chế nano celecoxib bằng phương pháp kết tủa. Đầu tiên, dược chất được hòa tan trong methanol với các nồng độ khác nhau. Sau đó, phối hợp 10 ml dung dịch methanol chứa celecoxib vào 200 ml nước chứa PVP K30 (0,0250,25% kl/t) với tốc độ 10 ml/phút. Tiến hành động khô hỗn dịch thu được trong 48 giờ. Kết quả thu được tiểu phân có KTTP từ 291 + 15 nm đến 442 +58 nm tùy thuộc vào tỉ lệ giữa celecoxib và PVP K30.
– Phương pháp dung môi siêu tới hạn
Sharma (2016) đã bào chế nano ibuprofen bằng phương pháp dung môi siêu tới hạn. Khí carbonic được duy trì ở áp suất và nhiệt độ lần lượt là 325 bar và 40°C. Các tiểu phân nano tạo thành từ đầu phun, được thu vào khay chứa nitrogen lỏng dưới dạng “đá khô”. Tiến hành thăng hóa các đá khô trong dung dịch nước chứa chất diện hoạt hoặc chất ổn định như Poly ethylen amin (PEI, KLPT 750 kDa và 1300 Da), PVP (KLPT 40 kDa) và Tween 40 (KLPT 1,3 kDa). Kết quả thu được các tiểu phân với KTTP trung bình lần lượt là 7 nm, 30 nm, 150 nm, 250 nm khi sử dụng các chât là PEI (KLPT 750 kDa), PVP, PEI (KEPT 1,3 kDa), Tween 40 ở nồng độ 1%.
– Phương pháp phun sấy
Trần Tuấn Hiệp (2013) đã bào chế hệ phân tán rắn chứa nano raloxifen bằng phương pháp phun sấy. Dung dịch chứa raloxifen, PVP K-30, Tween 20 trong nước được phun sấy với các thông số gồm nhiệt độ đầu vào: 120°C; nhiệt độ đầu ra: 65-70°C, áp suất phun: 4 kg/cm2, tốc độ thổi khí: quạt hút chỉnh ở vị trí 10 (tương ứng áp suất ở buồng lọc: —25 mbar), đầu phun (ộ=0,7 mm) với tốc độ phun dịch 3 ml/phút. Kết quả thu được các tiểu phân nano raloxifen phân tán lại trong môi trường pH 1,2 có đường kính trung bình khoảng 180 nm. Thông qua phổ XRD và DSC chứng tỏ raloxifen tồn tại ở trạng thái vô định hình trong bột phun sấy. Công thức tối ưu cho thấy tốc độ hòa tan
của raloxifen được tăng cường trong môi trường pH 1,2, 4,0, 6,8 và nước cất so với bột raloxifen, góp phần tăng cường sinh khả dụng đường uống của công thức nano trên chuột thí nghiệm.
Ngoài ra, để khắc phục hạn chế của từng kỹ thuật riêng lẻ như thời gian nghiền hoặc đồng nhất hóa dài, khả năng phân hủy hóa học, tạp kim loại trong kỹ thuật top- down hoặc tính chất khó tan trong cả môi trường nước và hữu cơ của một số thuốc mới, chi phí cao (như phương pháp dung môi siêu tới hạn), quy mô nhỏ,… của kỹ thuật bottom-up, việc kết họp các phương pháp của cả hai kỹ thuật trên đã được phát triển. Vi dụ, Baxter đã phát triển kỹ thuật Nanoedge™ kết hợp phương pháp kết tủa (bottom-up) và phương pháp đồng nhất hóa ở áp suất cao (top-down), hoặc kỹ thuật SmartCrystal™ đã được phát triển dựa trên sự kết hợp phương pháp phun sấy với phương pháp đồng nhat hoa ơ ap suat cao hoạc sự ket họp cua hai phương pháp top-down như phương pháp nghiên bi, sau đó tiếp tục bởi phương pháp đồng nhất hóa ở áp suất cao.
2.2. Bào chế nano polynie
2.2.1. Tá dược sử dụng
Các polyme sử dụng trong bào chế nano polyme có thể phân chia thành các polyme thân dầu như PLGA, PLA, PCL,… hoặc các polyme thân nước như chitosan, gelatin, alginat… như đã trình bày ở mục 2.1 của chương này, các dẫn chất Eudragit, dẫn chất cellulose…. Nhằm ứng dụng trong lĩnh vực dược, khả năng phân hủy và khả năng tương thích sinh học của các polyme là các đặc tính hết sức quan trọng. Khả năng phân hủy sinh học xảy ra khi nước xâm nhập vào trong cột polyme, thủy phân va cắt ngắn các chuỗi polyme, làm giảm khối lượng phân tử của chúng, từ đó gây ra sự chuyển hóa của các phân mảnh và ăn mòn tiểu phân. Trong khi đó, khả năng tương thích sinh học của một polyme khi polyme đó không độc cũng như không gây tác động xấu đên hệ thống các cơ quan sinh học trong cơ thể. Tuy nhiên, cũng cần lưu ý rằng khả năng tương thích sinh học không đòi hỏi phải có khả năng phân hủy sinh học. Ví dụ, poly(N-isopropyl acrylamid) là polyme không độc, tương thích sinh học nhưng không có khả năng phân hủy sinh học. Trong những trường hợp như thế này, cần xem xét khả năng chất mang polyme có thể đào thải khỏi cơ thể như thế nào để tránh sự tích tụ quá nhiều các polyme không có khả năng phân hủy ở các mô trong cơ thể.
Ngoài các polyme, còn sử dụng các tá dược khác trong bào chế như chất ổn định, dung môi thân dâu và thân nước, các chất cải biến bề mặt
2.2.2. Thiết bị sử dụng
Tùy thuộc vào nguyên tắc của mỗi phương pháp bào chế, có thể sử dụng các thiết bị khác nhau để bào chế các nano polyme, phổ biến vẫn là thiết bị siêu âm, thiết bị đồng nhất hóa.
2.2.5. Phân loại các phương pháp bào chế
Có nhiều cách phân loại phưcmg pháp bào chế tiểu phân nano polyme, ví dụ phân loại theo mức độ năng lượng sử dụng; theo cách hình thành tiểu phân nano (phương pháp kết tụ tiều phân hay giảm kích thước tiLphân),..
a. Phân loại theo mức độ năng lượng sử dụng
– Phương pháp sử dụng năng lượng thấp:
- Kết tủa do thay đổi dung môi: dựa vào sự kết tủa của polyme khi thay đổi dung môi.
- Muối hóa (salting-out): dựa trên sự tách pha của pha dầu (có khả năng trộn lẫn được với nước) khỏi pha nước thông qua tác dụng muối hóa. Các tác nhân muối hóa bao gồm các chất điện ly như magnesi clorid, calci clorid, và magnesi acetat hoặc các chất không điện ly như saccarose.
Thẩm tích: polyme được hòa tan trong pha dầu và được đặt trong túi thầm tích có kích thước lỗ màng phù hợp. Sự thay thế dung môi bên trong màng sẽ dẫn đến sự kết tủa của polyme.
– Phương pháp sử dụng năng lượng cao
Các phương pháp này sử dụng nguồn năng lượng cao từ các thiết bị như thiết bị siêu âm, thiết bị đồng nhất hóa,…. Bao gồm:
+ Nhũ hóa – bốc hơi dung môi.
+ Nhũ hóa – khuếch tán dung môi: dựa vào khả năng khuếch tán của pha dầu trong nhũ tương dầu/nước (D/N) vào một thê tích lớn của pha nước.
+ Phun điện trường.
b. Phân loại theo cách hình thành tiểu phân nano
– Kỹ thuật phân chia:
+ Nghiền.
+ Đồng nhất hóa.
– Kỹ thuật kết tụ tiểu phân:
+ Kết tủa do thay đổi dung môi.
+ Phun sấy.
+ Sử dụng dung môi siêu tới hạn.
+ Phun điện trường.
2.2.4. Một số phương pháp bào chế
Nano polyme có thể được tạo thành dựa trên nguyên lý của nhóm các phương pháp sử dụng năng lượng thấp, sử dụng năng lượng cao, hoặc kỹ thuật phân chia và kỹ thuật kết tụ tiểu phân. Dưới đây chỉ trình bày một số phương pháp thường được sử dụng.
a. Nhũ hóa – bốc hơi dung môi
* Nguyên tắc
Nhũ tương được sử dụng để tạo nano bằng cách hòa tan dược chất và polyme vào pha dầu, sau đó nhỏ giọt hỗn họp pha dầu vào pha nước có chứa chất diện hoạt. Quá trình đồng nhất hóa hay siêu âm đã được trình bày ở phần bào chế nano tinh thể có thể áp dụng để giảm kích thước của tiểu phân đến cỡ nano. Tiếp theo, bốc hơi dung môi hữu cơ và thu được hỗn dịch nano. Nhũ tương kép N/D/N thường được sử dụng để bao gói các dược chât tan trong nước như peptid, protein hay vaccin, trong khi đó, nhũ tương đơn D/N phù họp đối với dược chất khồng tan trong nước như steroid.
Quá trình này được minh họa dựa vào hình 17
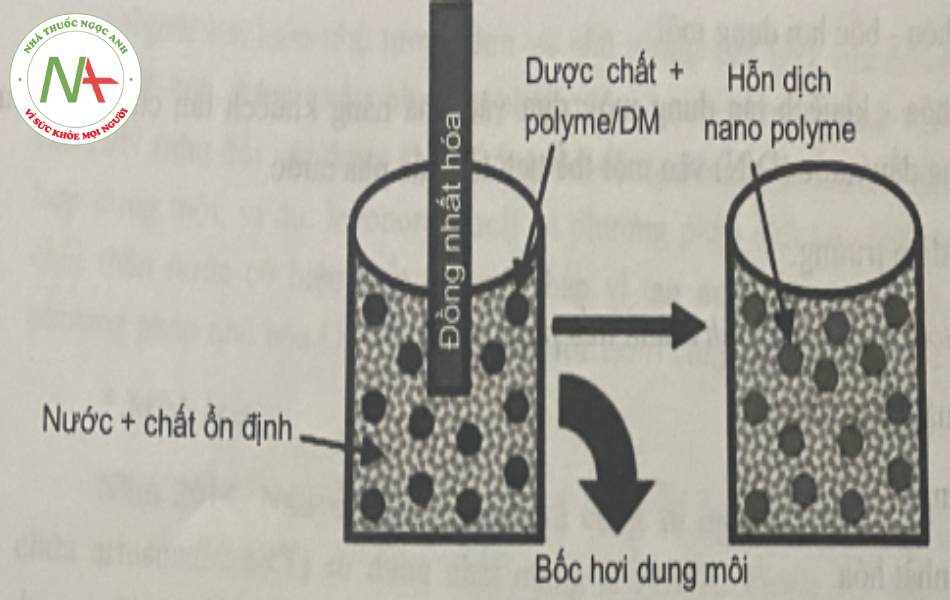
Quá trình đồng nhất hóa có thể được thực hiện bằng thiết bị đồng nhất hóa đã được giưới thiệu ở phần bào chế nano tinh thể hoặc thiết bị siêu âm đầu dò.

Đối với phương pháp nhũ tương D/N, đầu tiên, PLGA được hòa tan trong dung môi dễ bay hơi, không trộn lẫn với nước (như diclorometan (DCM)), sau đó thêm dược chất thân dầu vào dung dịch polyme. Hỗn hợp của polyme và dược chất được thêm từ từ vào một thể tích pha nước có chứa chất diện hoạt như polyvinyl alcol (PVA), Tween 80 để tạo nhũ tương D/N, dưới tác động của quá trình đồng nhất hóa hay siêu âm. Tiếp theo bốc hơi dung môi hữu cơ và rửa, thu nano bằng cách lọc, hoặc ly tâm. Các tiểu phân nano có thể được làm khô bằng kỹ thuật thích hợp hoặc kỹ thuật đông khô.
Ngoài hai kiểu nhũ tương đơn và nhũ tương kép như vừa đề cập, tùy thuộc vào bản chất của dược chất, phương pháp tạo hỗn dịch trong nhũ tương cấu trúc chất rắn/D/N (như đối với dược chất không tan trong dung môi hòa tan chất mang hoặc hỗn hợp dung môi, ví dụ: levonorgestrel) và phương pháp nhũ hóa D/D (như đối với dược chất thân nước có hiệu suất bao gói thấp vì tan một phần trong pha nước nếu dùng phương pháp nhũ hóa D/N, ví dụ: hydrocortison) cũng có thể được xếp vào nhóm này.
* Minh họa
Năm 2014, Nguyễn Hạnh Thủy và cộng sự nghiên cứu bào chế tiểu phân nano chứa artesunat (ART) sử dụng chất mang là PLGA. Trong đó, phương pháp bốc hơi dung môi từ nhũ tương dầu/nước đã được sử dụng. Đầu tiên, ART, PLGA được hòa tan vào dung môi diclorometan, và nhỏ từng giọt vào pha nước chứa các chất diện hoạt khảo sát là Tween 80, PVA, SLS (natri lauryl sulfat) dưới tác dụng của siêu âm đầu dò (Vibracell VCX130, Sonics & Materials, Newtown, CT, USA) ở công suất 100 W trong 5 phút (5-10°C). Công thức tốt nhất thu được với PLGA (1%, kl/tt), Tween 80% (kl/tt), ART (0,4%, kl/tt), tỉ lệ pha dầu và pha nước là 1:10. Kết quả KTTP nano khoảng 170 nm, hiệu suất nano hóa 83,4%, kéo dài thời gian giải phóng đến 48 giờ.
b. Nhũ hóa – Khuếch tản dung môi
* Nguyên tắc
Đối với phương pháp này, quá trình tạo thành nano đòi hỏi việc sử dụng ba pha là pha dầu pha nước, pha pha loãng. Đối với dược chất thân dầu, pha dầu sẽ bao gồm polyme, dược chất và dung môi hữu cơ được nhũ hoá vào dung dịch pha nước chứa chất ổn định đã được bão hoà trước đó bằng dung môi hữu cơ. Nhũ tương được phối hợp với một thể tích nước lớn hơn và được khuấy trộn nhẹ nhàng, dung môi khuếch tán từ giọt pha dầu vào môi trường, hình thành các nano polyme. Các dung môi pha dầu được lựa chọn phải tan một phần trong nước như alcol benzylic, ethyl aaceta…
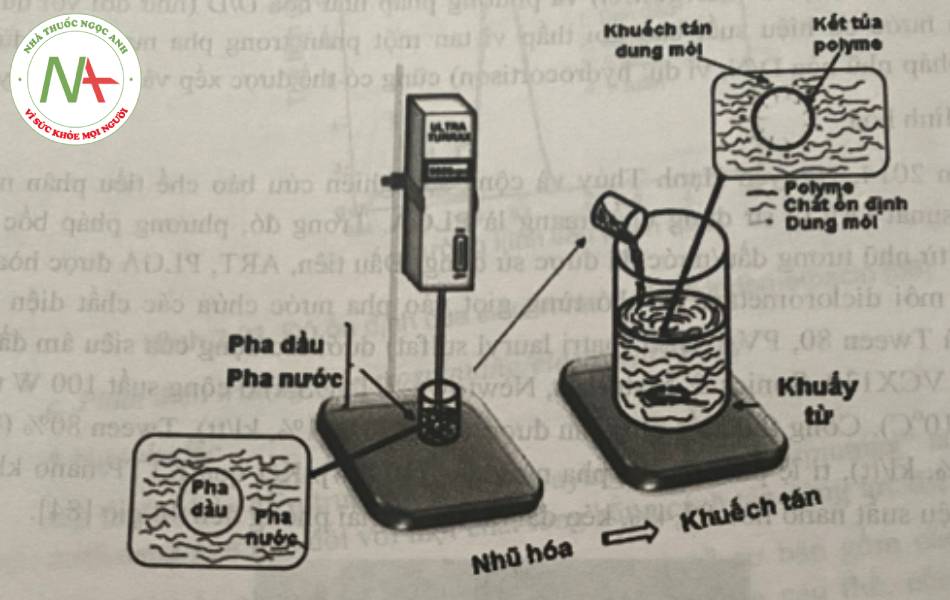
Trong phương pháp này, kích thước của tiểu phân có thể phụ thuộc vào một số yếu tố như lực cắt sử dụng trong quá trình nhũ hóa, thành phần hóa học của pha dầu, nồng độ polyme, tỉ lệ pha dầu, kích thước của giọt dầu trong nhũ tương chính.
* Minh họa
Trong nghiên cứu của Limayem (năm 2004), các tác giả đã tiến hành bào chế nano chứa indomethacin bằng phương pháp nhũ hóa – khuếch tán dung môi. Đầu tiên, PCL (polycaprolacton), miglyol 812 được hòa tan trong 0,65 1 ethyl acetat đã được bão hòa với nước. Pha hữu cơ này được nhũ hóa với 1,3 1 pha nước đã bão hòa ethyl acetat chứa PVA, sử dụng thiết bị đồng nhất hóa ở 8000 rpm trong 10 phút. 3,5 1 nước được tiếp tục thêm vào nhũ tương trên để khuếch tán ethyl acetat vào pha nước dẫn đến hình thành nano. Tiểu phân thu được có hai vùng phân bố kích thước: một vài tiểu phân có kích thước khoảng 80nm, phần lớn có kích thước khoảng 400 nm.
c. Phun điện trường (electrospinning/electrospraying)
* Nguyên tắc
Kỹ thuật phun điện trường “electrospraying” và “electrospinning” là phương pháp phun dưới dạng giọt mịn đối với một chất lỏng bằng cách tác động lực điện trường.
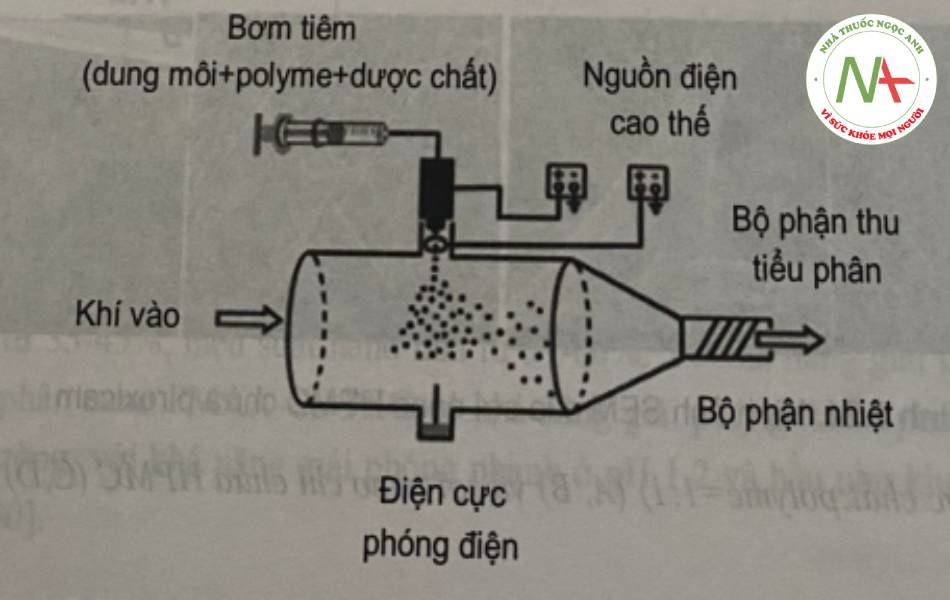
Một thiết bị phun điện trường “electrospraying” cơ bản gồm các bộ phận như đầu súng phun dạng mao quản được nối với nguồn điện cao thế, còn điện cực tròn “ring extractor electrode” được nối đất (Hình 2.22). Một lực điện trường mạnh sẽ được tạo thành ngoài đầu súng phun. Pha lỏng được phun ra khỏi đầu súng phun dạng
mao quản dưới dạng mặt khum “meniscus” sẽ bị kéo dài ra trong môi trường điện trường và phân tán thành những giọt nhỏ do lực điện trường gây ra. Trong quá trình giọt nhỏ được phun từ súng phun đến bộ phận thu mẫu, dung môi sẽ bay hơi tạo thành các nano polyme rắn.
* Minh họa
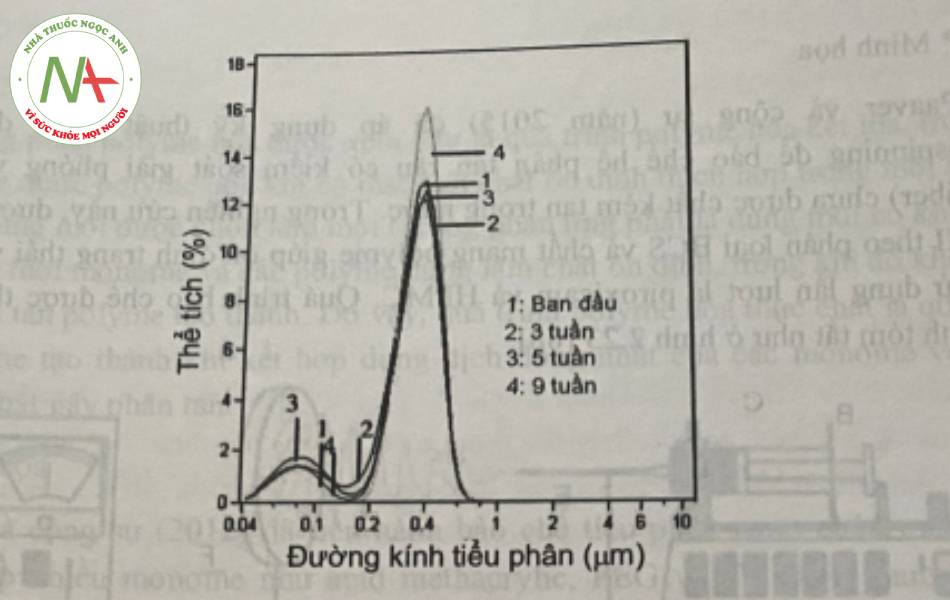
Paaver và cộng sự (năm 2015) đã áp dụng kỹ thuật phun điện trường electrospinning để bào chế hệ phân tán rắn có kiểm soát giải phóng và sợi nano (nanofiber) chứa dược chất kém tan trong nước. Trong nghiên cứu nay, dược chất thuộc nhóm II theo phân loại BCS và chất mang polyme giúp ổn định trạng thái vô định hình được sử dụng lần lượt là piroxicam và HPMC. Quá trinh bào chê được thực hiện với quy trình tóm tắt như ở hình 22.
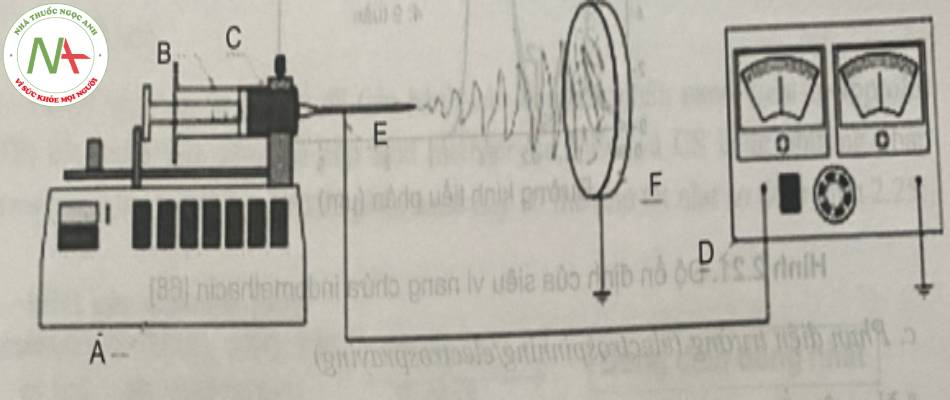
(A: bơm xy-lanh; B: xy-lanh; C: dung dịch polyme; D: nguồn điện cao thê; E: dây điện cực; F: bộ phận thu mẫu được nối đất)
Cụ thể, các thông số của quy trình bao gồm: bơm xy-lanh tự động được sử dụng với tốc độ 1 ml/giờ; nguồn điện cao thế được sử dụng từ 7-22kV, khoảng cách từ đầu kim đến bộ phận thu mẫu được khảo sát nằm trong khoảng 8-25cm. Tỉ lệ dược chất so với polyme được sử dụng lần lượt là 1:1, 2:1, 4:1 (kl/kl) pha trong dung môi HFIP (1,1,1,3,3,3-hexa-fluoro-2-propanol). Kết quả thu được sợi nano với kích thước từ 400- 600nm thông qua hình ảnh SEM.
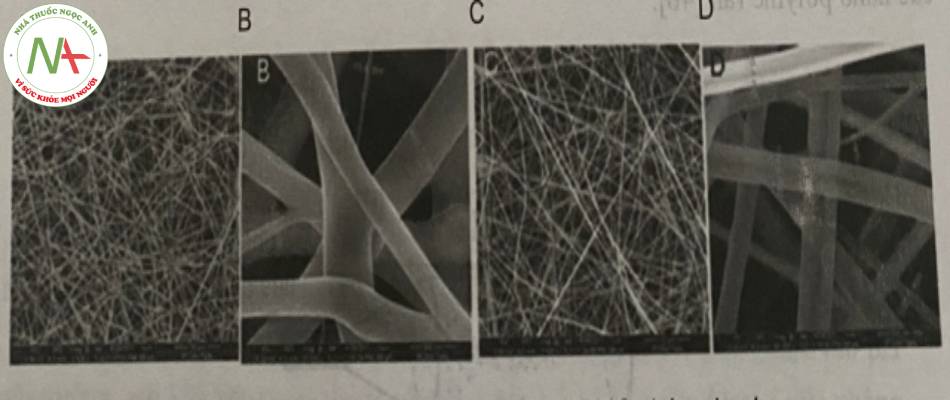
(Tỉ lệ dược chất:poỉyme=1:1) (A, B) và sợi nano chỉ chứa HPMC (C,D)
d. Poliyme hóa
* Nguyên tắc
Phương pháp polyme hóa được xem như là quá trinh polyme hóa kết tủa, trong đó một monome được polyme hóa khi có mặt một chất ổn định thích hợp trong moi trường phản ứng. Dung môi được chọn làm môi trường phản ứng phải là dung moi có khả năng hòa tan đồng thời monome và các polyme dùng làm chất ổn định, trong khi đó không có khả năng hòa tan polyme tạo thành. Do vậy, quá trình polyme hóa thực chất là quá trình kết tủa polyme tạo thành khi kết hợp dung dịch đồng nhất của các monome với chất khởi đầu và chất gây phân tán.
* Minh họa
Pawar và cộng sự (2012) đã tiến hành bào chê tiêu phân nano chứa metoprolol (MTP) kết hợp nhiều monome như acid methacrylic, PEG và CS bằng phương pháp polyme hóa. Quy trình bào chế tiểu phân nano này có thể tóm tăt như sơ đô ở hình 24.
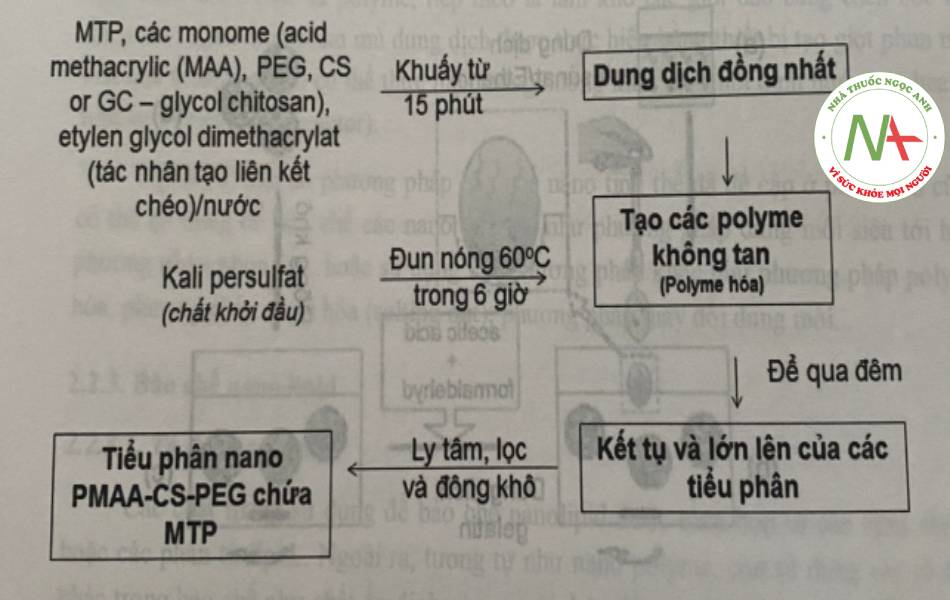
Kết quả thu được là các tiểu phân có hình cầu với KTP từ 190-450 nm, tỳ lệ dược chất nano từ 35-45%, hiệu suất nano hóa từ 37-60%. về khả năng giải phóng thuốc in vitro, tiểu phân nano PMAA-CS-PEG có khả năng giải phóng thuốc phụ thuộc vào pH của môi trường, với khả năng giải phóng nhanh ở pH 1,2 và hầu như không giải phóng ở pH 6,8.
e. Kết tủa do thay đổi dung môi
* Nguyên tắc
Phương pháp kết tụ được thực hiện bằng cách sử dụng cac hệ gồm ba thành phần cơ bản là polyme, dung môi để hòa tan polyme, dung môi không hòa tan được polyme. Dung môi hòa tan polyme thường là dung môi hữu cơ, trộn lẫn được với nước, và dễ dàng loại bỏ bằng cách bốc hơi. Ví dụ như aceton hay hôn hợp của aceton va ethanol,…
* Minh họa
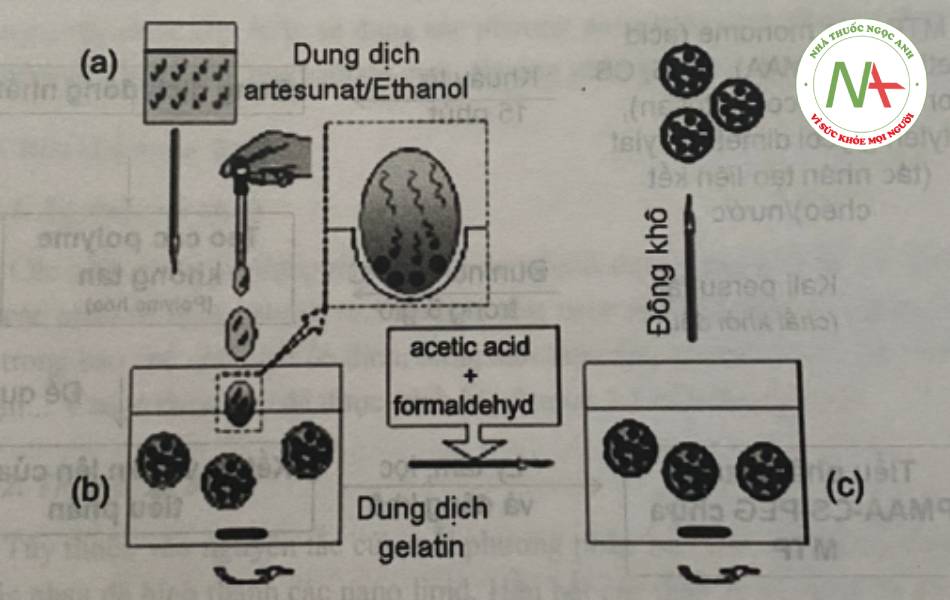
Năm 2010, Xiao X. và Hong z. cũng tiến hành bào chế siêu vi nang của artesunat bằng phương pháp kết tủa do thay đổi dung môi. Dược chất được hòa tan hoàn toan trong ethanol, sau đó được nhỏ vào dung dịch gelatin ở khoảng 40oC, khuấy trộn ở 150 vòng/phút. Vỏ nang được làm cứng nhờ điều chỉnh pH và sử dụng dung dịch formaldehyd. Hệ nano được thẩm tích, lọc chân không và thu sản phẩm nhờ phun sấy. Kích thước tiểu phân nano thu được bào chế bằng phương pháp này khoảng 76 nm.
f. Một số phương pháp khác
– Tạo gel ion (ionic gelation): phương pháp này liên quan đến việc chuyển tiếp từ pha lỏng sang dạng gel do tương tác ion xảy ra ở nhiệt độ phòng. Trong phương pháp này, các polyme có khả năng phân hủy sinh học thường được sử dụng như gelatin, alginat và agarose. Ví dụ, phối hợp dung dịch natri alginat vào dung dịch calci clorid tạo thành nano calci alginat.
– Phương pháp tạo hên kết chéo
Phương pháp này liên quan đến việc tạo hên kêt chéo giữa các đại phân tử có điện tích trái dấu, từ đó gây nên hiện tượng kết tụ của phức họp tạo thanh. Vi dụ, khi phối hợp dung dịch natri tripolyphosphat (TPP) hoặc phối hợp dung dich chondroitin su (ChS) vào dung dịch cs trong dung dịch acid acetic sẽ tạo thành nano TPP-CS hoặc ChS-CS.
– Tự hình thành (self-assembly)
Phương pháp này liên quan đến khả năng tự hình thành các tiêu phân nano có cấu trúc nhân-vỏ (core-shell) của các hợp chất lưỡng tính (vừa thân dầu, vừa thân nước) khi phân tán vào pha nước. Ví dụ như các dẫn chât của N-octyTO,N-carboxymethyl CS hay của oleoyl-carboxymethyl CS.
– Phun mù (aerosol flow reactor)
Phương pháp này gồm quy trình với hai bước, đầu tiên là quá trình phun mù dung dịch chứa dược chất và polyme, tiếp theo là làm khô các giọt dâu băng cách bốc hơi dung môi. Quá trình phun mù dung dịch được thực hiện bằng thiết bị tạo giọt phun mù, còn quá trình làm khô có thể thực hiện trong buồng khí nóng thổi định hướng (a heated tubular laminar flow reactor).
Ngoài ra, một số phương pháp bào chế nano tinh thể đã đề cập ở phần trên cũng có thể áp dụng để bào chế các nano polyme như phương pháp dung môi siêu tới hạn, phương pháp phun sấy, hoặc sử dụng các phương pháp khác như phương pháp polyme hóa, phương pháp muối hóa (salting out), phương pháp thay đổi dung môi…
2.3. Bào chế nano lipid
2.3.1. Tá dược sử dụng
Các chất mang sử dụng để bào chế nano lipid được tổng hợp từ các lipid sinh lý hoặc các phân tử lipid.. Ngoài ra, tương tự như nano polyme, còn sử dụng các tá dược khác trong bào chế như chất ổn định, dung môi thân dầu và thân nước, các chất cải biến bề mặt…. Các tá dược này đã được trình bày ở mục 2.1 của chương này.
2.3.2. Thiết bị sử dụng
Tùy thuộc vào nguyên tắc của mỗi phương pháp bào chế, có thể sử dụng các thiết bị khác nhau để hinh thành các nano lipid. Hầu hết các thiết bị sử dụng để bào chế nano lipid đêu đã được giới thiệu trong các phần bào chế nano tinh thể và nano polyme.
2.3.3. Phân loại các phương pháp bào chế
a. Phân loại theo mức độ năng lượng sử dụng
– Phương pháp sử dụng năng lượng thấp:
+ Kết tủa do thay đổi dung môi
+ Đông tụ
+ Kỹ thuật phân tán qua màng (membrane contactor)
– Phương pháp sử dụng năng lượng cao:
+ Đồng nhất hóa ở áp suất cao
+ Đồng nhất hóa kết hợp siêu âm
+ Nhũ hóa – khuếch tán dung môi
+ Nhũ hóa – bốc hơi dung môi
b. Phân loại theo cách hình thành tiểu phân nano
– Kỹ thuật phân chia:
+ Đồng nhất hóa ở áp suất cao
+ Đồng nhất hóa kết họp siêu âm
+ Nhũ hóa – khuếch tán dung môi
+ Nhũ hóa – bốc hơi dung môi
– Kỹ thuật kết tụ tiểu phân:
+ Kết tủa do thay đổi dung môi
+ Đông tụ
2.3.4. Một số phương pháp bào chế
a. Kết tủa do thay đổi dung môi
* Nguyên tắc
Hòa tan dược chất và lipid trong một dung môi hữu cơ đồng tan với nước, rồi phân tán vào pha nước chứa chất nhũ hóa. Hiện tượng khuếch tán dung môi từ pha dầu ra pha nước dẫn đến hình thành nano lipid do lipid và hoạt chất kết tủa lại bên trong các thê micell. Bôc hơi dung môi ở áp suất thấp sẽ thu được nano lipid rắn.
* Minh họa
Schubert và cộng sự đã bào chế nano lipid rắn bằng kỹ thuật thay đổi dung môi (hay tiêm dung môi). Các lipid được hòa tan trong các dung môi hay hỗn hợp dung môi có khả năng trộn lẫn với nước như aceton, ethanol, methanol rồi được tiêm nhanh bằng bơm tiêm vào pha nước được khuấy trộn hên tục có hoặc không có chat diẹn hoạt. ^ ìeu p được có KTTP nằm trong khoảng 80 đến 300 nm tùy thuộc điều kiện bao chế.
b. Đông tụ
* Nguyên tắc
Nguyên tắc bào chế dựa trên sự tương tác chậm giữa dung dịch micell của muối natri của acid béo và một dung dịch acid (dung dịch đông tụ), với sự có mặt của tác nhân ổn đinh polyme có một đầu thân nước, một đầu kỵ nước. Khi pH giảm, nano sẽ kết tủa. Ưu điểm của phương pháp này là không cần sử dụng thiêt bị phức tạp hay dung môi nguy hiểm, do đó chi phí không quá cao cho quy mô phòng thí nghiệm cũng như quy mô công nghiệp.
* Minh họa
Bằng phương pháp đông tụ, Battaglia và cộng sự đã bào chế nano lipid răn chứa methotrexat. Đầu tiên, muối natri behenat được phân tán trong nước với PVA (KLPT 9000), sau đó hỗn họp được khuấy trộn và đun nóng ở 80°C. Hòa tan didoceylmethotrexat (tiền thuốc của methotrexat) vào ethanol ở 65°C, sau đó thêm vào hỗn hợp trên. Dung dịch acid hóa (dung dịch đông tụ gồm natri dihydrogen phosphat và acid hyđrocloric) được thêm từng giọt vào hỗn hợp vừa tạo thành cho đến khi acid behenic được kết tủa hoàn toàn. Hỗn hợp sau đó được làm lạnh xuống 15°c kết hợp khuây trộn. Tiểu phân thu được có KTTP nằm trong khoảng 300-400 nm.
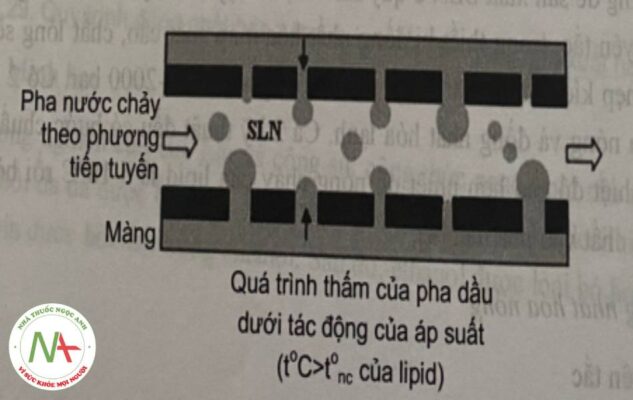
c. Kỹ thuật phân tản qua màng
* Nguyên tắc
Hỗn hợp lipid được đun nóng đến nhiệt độ trên nhiệt độ nóng chảy của nó. Sau đó, hỗn hợp lipid được nén qua các lỗ nhỏ của màng nhờ áp lực được tạo ra bởi khí nitrogen, giúp hình thành các giọt nhỏ. Khi đó, pha nước được khuấy trộn và lưu thông ở buồng phía trong màng sẽ kéo theo các giọt này. Sau đó, nano lipid được tạo thành khi được làm mát xuống nhiệt độ phòng.
* Minh họa
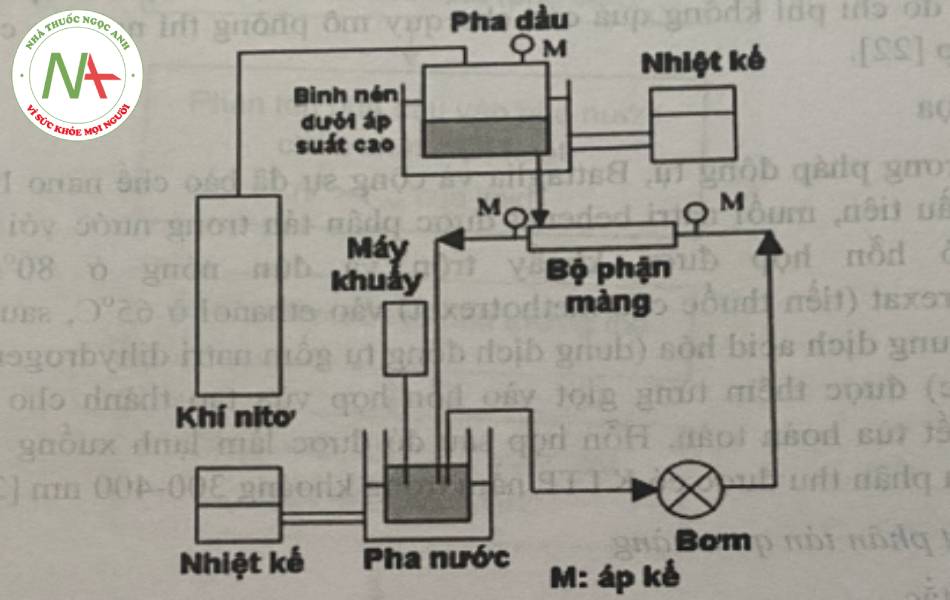
Charcosset và cộng sự đã bào chế nano lipid răn chưa vitamin E bằng phương pháp phân tán qua màng với các điều kiện thí nghiệm như sau: màng kích thước 0,2 μm với áp suất pha dầu là 6 bar và vận tốc cháy tiếp tuyến của pha nước là 1,7m/s, pha dầu chứa 300g Gelucire 44/14 và vitamin E ở nhiệt độ 65oC, trong khi đó, pha dầu chứa 1,2l nước và 2,04 g Tween 20 ở nhiệt độ 60°C. Quá trinh bào chế được thực hiện như sơ đồ như hình 23 và thu được nano lipid rắn khi hạ nhiệt độ xuống nhiệt độ phòng. Tiểu phân thu được có KTTP nằm trong khoảng 70 đến 215 nm với tốc độ của pha dâu trong khoảng 0,15 đến 0.35 m3/h.m2.
d. Đồng nhất hóa ở áp suất cao
Đồng nhất hóa ở áp suất cao là kỹ thuật hiệu quả trong bào chế SLN. Kỹ thuật này dễ dàng áp dụng để sản xuất SLN ở quy mô lớn, do vậy nó được nhiều công ty dược lựa chọn, về nguyên tắc, trong thiết bị đồng nhất hóa ở áp suất cao, chất lỏng sẽ được đẩy qua một khe hẹp kích thước vài micromet dưới áp suất 100-2000 bar. Có 2 kỹ thuật là đồng nhất hóa nóng và đồng nhất hóa lạnh. Cả 2 kỹ thuật đều có bước chuẩn bị là đun chảy lipid ở nhiệt độ cao hơn nhiệt độ nóng chảy của lipid là 5-10°C rồi hòa tan hoặc phân tán dược chất vào pha dầu.
(i). Đồng nhất hóa nóng
– Nguyên tắc
Trong bào chế nano lipid rắn, đồng nhất hóa nóng được thực hiện ở nhiệt độ cao hơn nhiệt độ nóng chảy của lipid và do vậy được xem như là quá trình đồng nhất hóa nhũ tương. Nói chung, nhiệt độ càng cao thì kích thước của hạt nhũ tương càng nhỏ do
nhớt của pha nội giảm. Tuy nhiên, nhiệt độ càng cao có thể làm tăng tốc độ phản huy của dược chất và chất mang. Thông thường, các bước nhũ hóa có thể lặp lại một vài lát. Đồng thời, phải cần lưu ý rằng quá trình đồng nhất hóa ở áp suất cao sẽ làm tăng nhiệt độ của mẫu (khoảng 10°C ở 500 bar). Đối với phần lớn trường hợp, 3-5 vòng đồng nhất hóa với áp suất từ 500-1500 bar thường là đủ. Sản phẩm chính của quá trình đồng nhất hóa là nhũ tương nano do trạng thái lỏng của lipid. Các nano lipid rắn thu được khi hạ nhiệt độ của mẫu xuống nhiệt độ phòng hoặc nhiệt độ thấp hơn. Quy trình có thể tóm tắt theo sơ đồ ở hình 28.
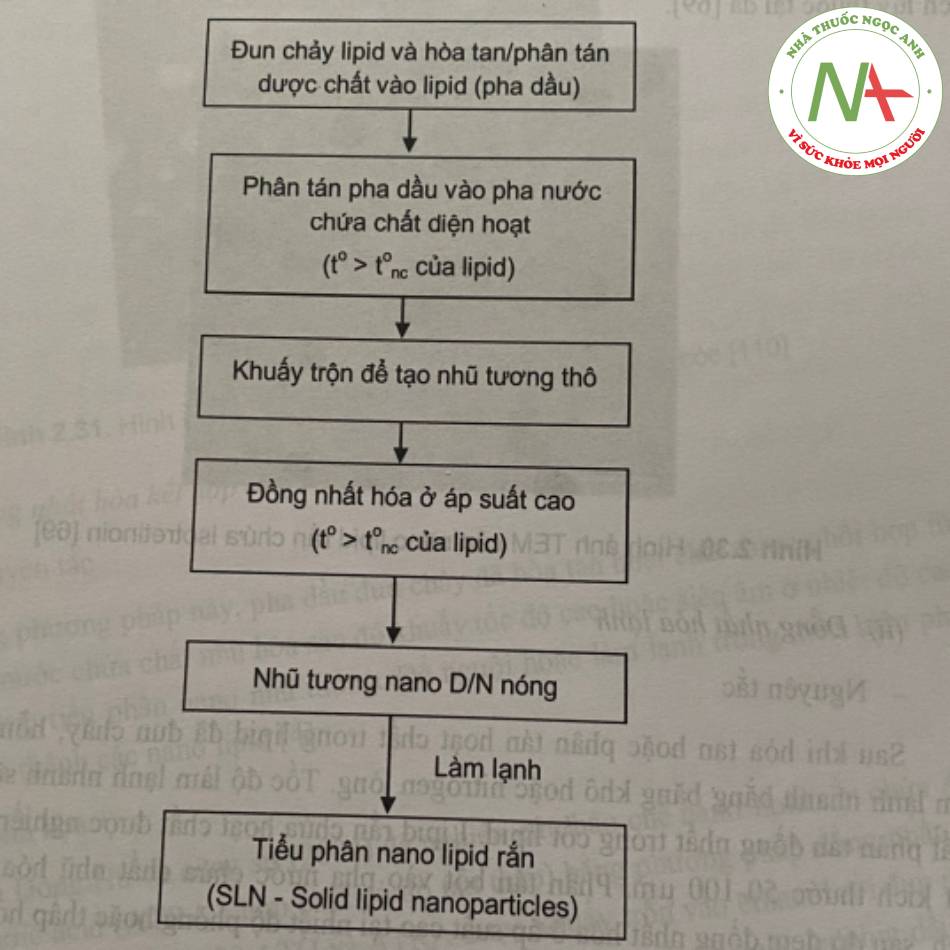
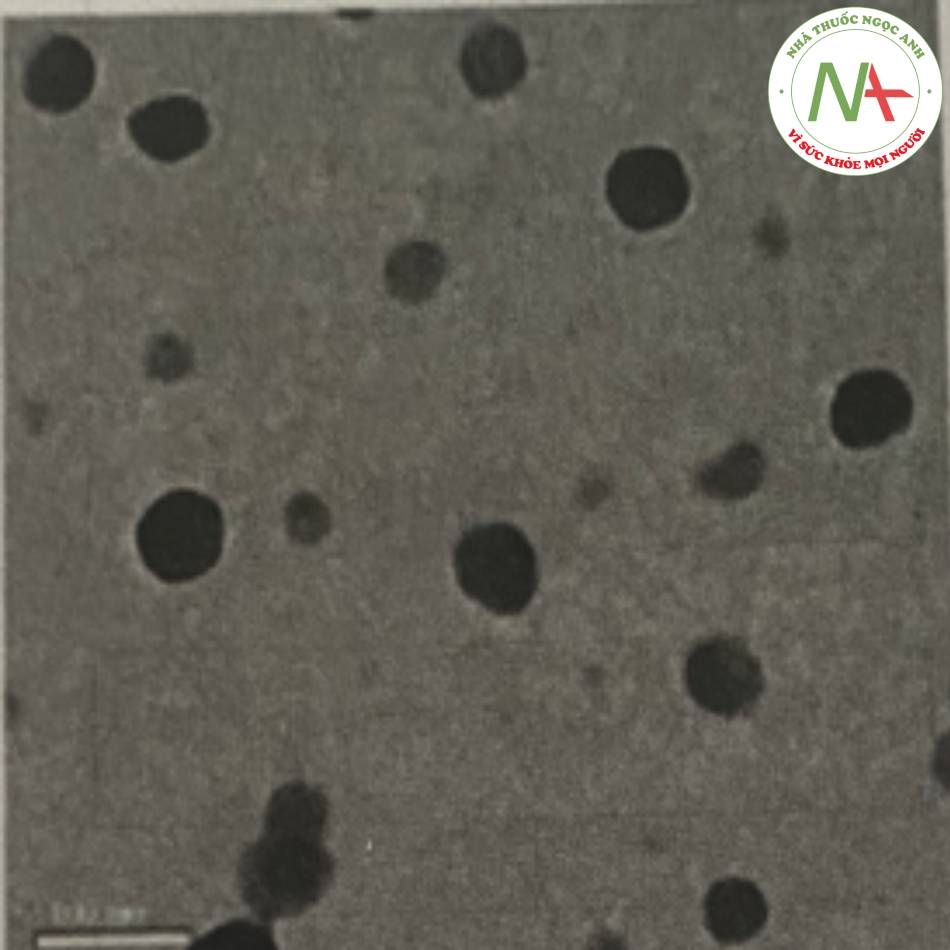
Trong nghiên cứu của Liu và cộng sự, công thức nano lipid răn chứa isotretinoin dùng để bôi da đã được bào chế. Đầu tiên, lipid Precirol ATO 5, lecithin dầu đậu nành, isotretinoin được hòa tan trong ethanol. Sau đó, ethanol được loại bỏ hoàn toàn bằng cô quay ở nhiệt độ 80°C. Pha dầu đang nóng chảy được thêm vào nước nóng chứa Tween 80. Tiếp theo, nhũ tương được tạo thành bằng cách sử dụng máy khuấy tốc độ cao với tốc độ 6000 vòng/phút trong 20 phút. Hỗn hợp tiếp tục được xử lý bằng máy đông nhất hóa áp suất cao ở áp suất 800 bar, nhiệt độ 80°C trong 5 vòng. Sau đó, mầu đã đông nhất hóa được làm lạnh xuống 5°C thu được nano lipid rắn chứa isotretinoin,
Kết quả thu được các tiểu phân có KTTP từ 30 nm đến 50 nm, có dạng hình cầu, hiệu suất nano hóa cao từ 80-100%. Tiểu phân nano này đã được chứng minh làm giảm khả năng hấp thu toàn thân của dược chất trong khi làm tăng khả năng tích lũy thuốc tại da quay ở nhiệt độ 80°c. Pha dầu đang nóng chảy được thêm vào nước nóng chưa Tween 80. Tiếp theo, nhũ tương được tạo thành bằng cách sử dụng máy khuấy tốc độ cao tốc độ 6000 vòng/phút trong 20 phút. Hỗn hợp tiếp tục được xử lý bằng máy đồng nhất hóa áp suất cao ơ áp suất 800 bar, nhiệt độ 80°c trong 5 vòng. Sau đó, mẫu đã đông nhất hóa được làm lạnh xuống 5°c thu được nano lipid răn chứa isotretmom.
Kết quả thu được các tiểu phân có KTTP từ 30 nm đên 50 nm, có dạng hình cầu, hiệu suất nano hóa cao từ 80-100%. Tiểu phân nano này đã được chứng minh làm giảm khả năng hấp thu toàn thân của dược chất trong khi làm tăng khả năng tích lũy thuốc tại da.
(ii). Đồng nhất hóa lạnh
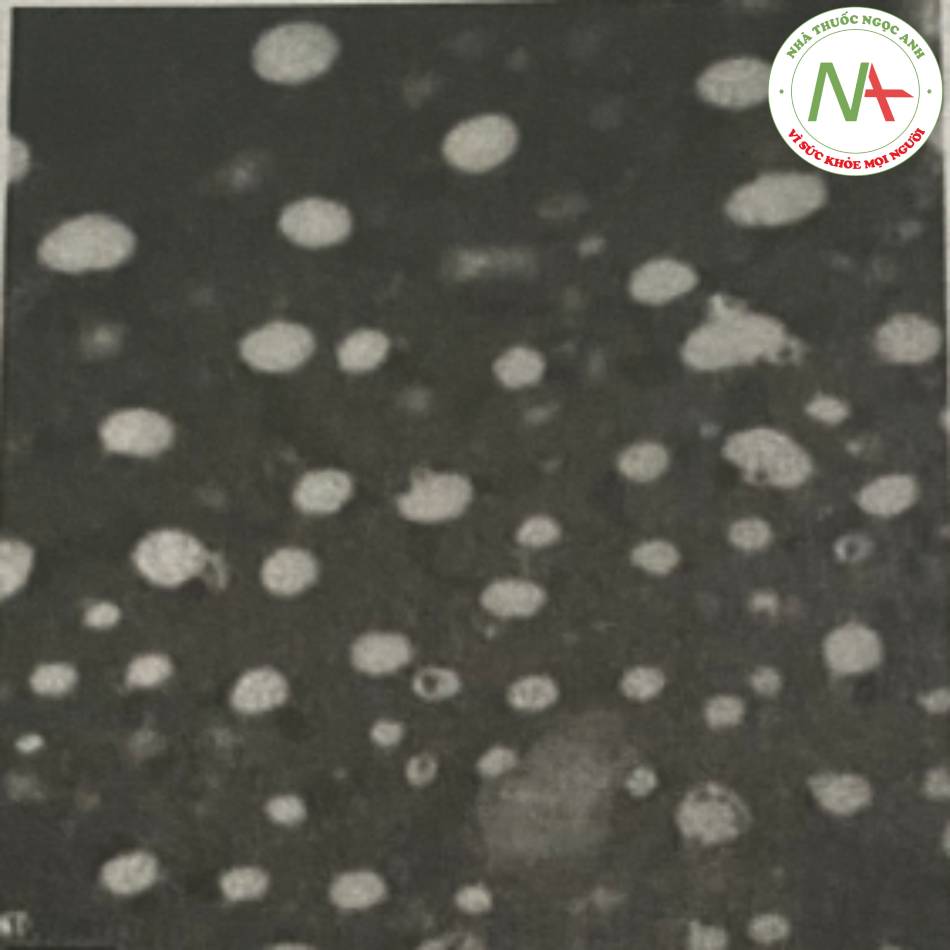
– Nguyên tắc
Sau khi hòa tan hoặc phân tán hoạt chất trong lipid đã đun chảy, hỗn hợp được làm lạnh nhanh bằng băng khô hoặc nitrogen lỏng. Tốc độ làm lạnh nhanh sẽ giúp hoạt chất phân tán đồng nhất trong cốt lipid. Lipid rắn chứa hoạt chất được nghiền mịn thành bột kích thước 50-100 μm. Phân tán bột vào pha nước chứa chất nhũ hóa ở nhiệt độ lạnh, sau đó đem đồng nhất hóa ở áp suất cao tại nhiệt độ phòng hoặc thấp hơn.
– Minh họa
Zhang và cộng sự đã bào chế nano lipid rắn chứa dịch chiết nọc độc của cóc bằng phưong pháp đồng nhất lạnh. Trong đó, dịch chiết nọc độc cóc, Compritol 888 ATO, Lipoid S 100 được hòa tan hoàn toàn trong ethanol ở 80°c. Sau khi bốc hơi hết dung môi, phần rắn được làm lạnh nhanh xuống -20°c trong 2 giờ, sau đó tiếp tục phối hợp với dung dịch Pluronic F68 đã được hòa tan trong 100ml nước ở 4°c. Sau khi nghiền hỗn lhợp trên thu được hệ phân tán thô. Hệ phân tán tiêp tục được đong thiết bị đồng nhất hóa ở áp suất 600 bar, rồi đưa vê nhiẹt đọ phong c tiểu phân hình cầu có kích thước khoảng 120-150 nm.
e. Đồng nhất hóa kết hợp siêu âm
* Nguyên tắc
Trong phương pháp này, pha dầu đun chảy đã hòa tan hoạt chất được phối hợp từ từ vào pha nước chứa chất nhũ hóa sau đó khuấy tốc độ cao hoặc siêu âm ở nhiệt độ cao để hình thành tiểu phân nano nhũ tương. Để nguội hoặc làm lạnh trong điều kiện phù họp sẽ hình thành các nano lipid.
* Minh họa
Lian Dong Hu và cộng sự (2004) đã nghiên cứu bào chế nano lipid rắn chứa Ali- trans retinoic acid (ATRA – họp chất có độ tan thấp) bằng phương pháp đồng nhất hóa nóng. Cụ thể, Compritol 888 ATO và ATRA được khuấy trộn vào ethanol rồi đun nóng đến 80°C. Các chât nhũ hóa (lecithin dầu đậu nành/pluronic F 68 hoặc lecithin dầu đậu nành /Tween 80) được phân tán vào nước cất bằng khuấy từ và đun nóng đến cùng nhiệt độ. Sau khi bốc hơi hết ethanol, pha nước được thêm nhỏ giọt vào pha dầu ở 80°c, khuấy trộn bằng khuấy từ. Nhũ tương thô được siêu âm bằng siêu âm đầu dò trong 10 phút ở 80 c, sau đó được đồng nhất hóa ở 800 bar trong 3 vòng. Tiến hành lọc ngay qua màng lọc 0,45 μm, rồi pha loãng bằng nước cất và bảo quản ở 4°C. Kết quả của nghiên cứu đã bào chế ra các SLN chứa ATRA có kích thước các tiểu phân dưới 300 nm. Các SLN cho tốc độ giải phóng ATRA nhanh hom dạng dung dịch qua thử nghiệm hoà tan vi tro bằng phương pháp thẩm tích qua màng, và có sinh khả dụng cao hơn. Đồng thời, các SLN ổn định hơn so với dạng nhũ tương [59].
Năm 2018, El-Housiny và cộng sự đã tiến hành bào chế gel bôi da chưa nano lipid rắn của fluconazol bằng phương pháp đồng nhất hóa kêt hợp siêu âm. Các lipid (Compritol 888 ATO hoạc Precirol ATO 5) được đun nóng đến khoảng 50°c. Sau đó, 1% fluconazol được thêm vào để thu được hỗn hợp lipid-dược chất. Pha nước chứa chất diện hoạt (Poloxame 407 hoặc Cremophor RH 40) được đun nóng đến nhiệt độ nóng chảy của pha dầu. Sau đó, phối hợp pha dầu vào pha nước, rồi tiến hành đồng nhất hóa ở 21000 vòng trong 10 phút bằng máy đồng nhất hóa. Nhũ tương tiếp tục được siêu âm bằng máy siêu âm kỹ thuật số trong 30 phút. Nano lipid rắn chứa fluconazol thu được bằng cách hạ xuống nhiệt độ phòng, sau đó phối họp với Carbopol 934 để tạo hệ gel. Kết quả thu được tiểu phân có hình cầu với KTTP từ 292-500 nm. Hiệu suât nano hoa từ 55,49-83,04%, thế zeta nằm trong khoảng -21 đến -33 mV. Tiểu phân nano có khả năng giải phóng dược chất in vitro kéo dài. Đồng thời, kết quả thử nghiệm lâm sàng trên 30 bệnh nhân cho thấy gel bào chế được có các chỉ số tốt hơn trong điều trị bệnh nấm lang ben (.Pityriasis versicolor) so với kem Candistan trên thị trường.
f. Nhũ hóa- khuếch tán dung môi
*Nguyên tắc
Phương pháp này sử dụng các dung môi có thể tan một phân với nước. Khi nhũ tương D/N được trộn lẫn với một lượng thừa nước thì pha dầu sẽ hóa rắn do sự khuếch tán của dung môi hữu cơ vào pha phân tán. Bằng cách thay đổi tỉ lệ và nồng độ lipid/chất diện hoạt, loại dung môi, có thể thu được tiểu phân với nhiều kích thước khác nhau.
*Minh họa
Trotta và cộng sự đã thực hiện nghiên cứu bào chế nano lipid rắn glyceryl monostearat. Đầu tiên, dung môi alcol benzyl hoặc butyl lactat được bão hòa với nước ở 47 ± 2°c trong 10 phút. Tiếp theo, 250 mg glyceryl monostearat được hòa tan trong 1 ml dung môi đã được bão hòa với nước, sau đó pha dầu này sẽ được nhũ hóa ở 47 ± 2°c với 9,0 ml dung dịch chứa 100 mg hỗn họp chất nhũ hóa (Tween 80, lecithin, muối natri của acid taurodeoxycholic hoặc của acid cholic, Caprylyl-capryl glucosid) trong nước đã bão hòa dung môi trên bằng thiết bị nhũ hóa ở tốc độ 12000 vòng trong 1 phút. Nano lipid sẽ được kết tủa nhanh bằng cách phối họp nhanh 50 ml nước vào 10 ml nhũ tương ban đầu. Sau khi khuấy liên tục trong 60 phút, hỗn dịch được tinh chế bằng cách phương pháp siêu lọc. Tiểu phân thu được có dạng hình cầu và KTTP dao động trong khoảng 205-695 nm.
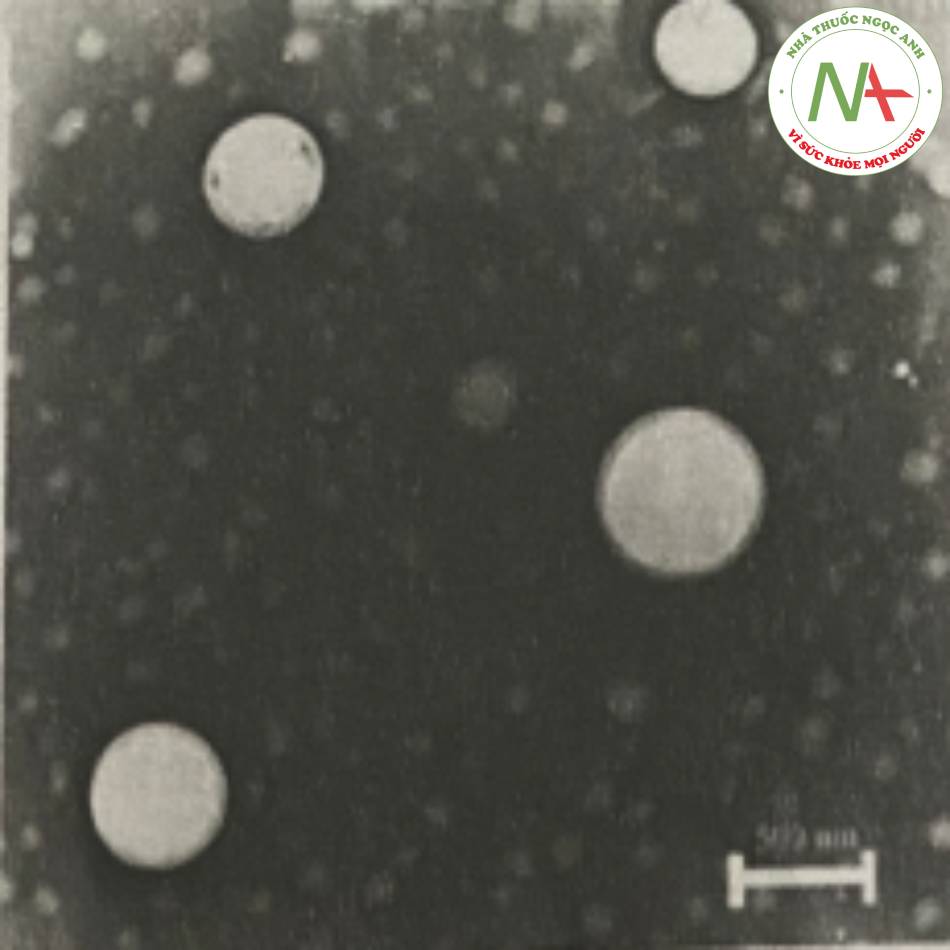
g. Nhũ hóa – bốc hơi dung môi
* Nguyên tắc
Trong kỹ thuật này, lipid và hoạt chất được hòa tan trong dung môi hữu cơ không đồng tan với nựớc, sau đó được phân tán vào pha nước chứa chât nhũ hóa đê tạo nhũ tương D/N. Bốc hơi dung môi dưới áp suất giảm, lipid và hoạt chât kêt tủa tạo thành nano lipid rắn [4].
* Minh họa
Sjostrom và cộng sự đã bào chế nano cholesteryl acetat bằng phương pháp nhũ hóa – bốc hơi dung môi. Đầu tiên, cholesteryl acetat được hòa tan trong dung dịch gồm lecithin trong cyclohexan. Dung dịch pha dầu được nhũ hóa với dung dịch pha nước chứa chất đồng diện hoạt để tạo nhũ tương D/N. Các chất đồng diện hoạt được sử dụng bao gồm muối mật, este polyethylen oxyd sorbitan, este của acid béo và saccarose và một polyme. Quá trình nhũ hóa được thực hiện bằng cách dùng máy nghiền keo trong 2 phút ở nhiệt độ phòng, tiếp theo bằng cách đồng nhất hóa ở 1000 bar trong 5 phút. Hỗn dịch nano thu được sau khi bốc hơi dung môi bằng cô quay. Tiểu phân thu được có KTTP trong khoảng 20-200 nm.
Ngoài các phương pháp kể trên kỹ thuật bào chế nano lipid còn có các phương pháp: Phương pháp sử dụng dung môi siêu tới hạn; phương pháp nhiệt pha đảo (Phase inversion temperature); phương pháp phun sấy; phương pháp phun điện trường; phương pháp tạo nhũ tương kép.
2.4. Bào chế nano polyme-lipid
2.4.1. Tá dược
Nano polyme-lipid hay còn gọi là hybrid nanoparticles chứa đồng thời 2 thành phần polyme và lipid chứa dược chất ở kích thước nano. Trong đó lipid và polyme có thể tồn tại theo các cấu trúc:
(i) Lõi poly me ở trong, lớp vỏ lipid ở ngoài (nano lipid-polyme, Lipid-polymer hybrid nanoparticles)
(ii) Lõi lipid ở trong, lóp vỏ polyme ở ngoài (nano polyme-lipid, Polymer-lipid hybrid nanoparticles)
(iii) Phân tán đồng thời
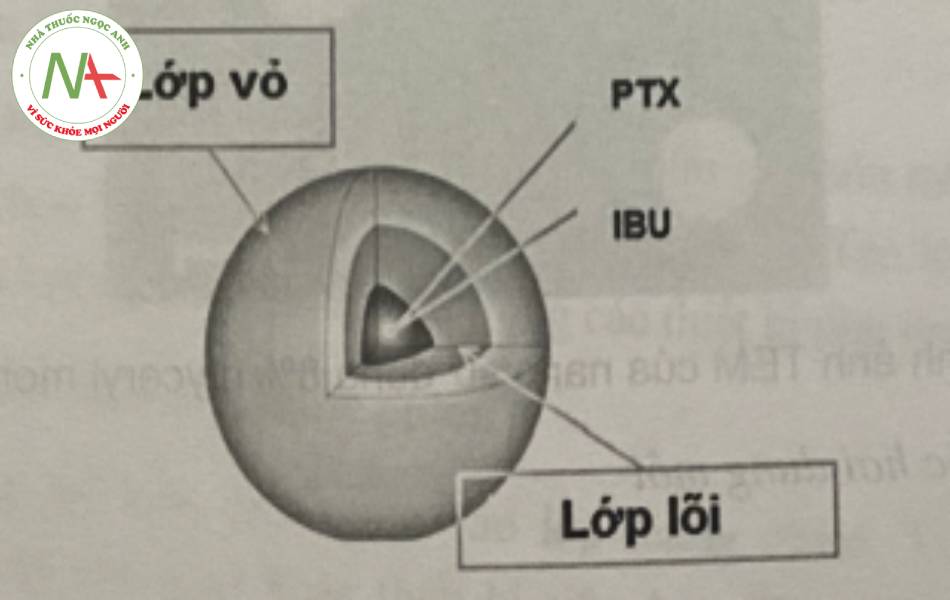
2.4.2. Thiết bị sử dụng
Đây là nano kết hợp của hai loại nano polyme và nano lipid do đó hầu hết các thiết bị sử dụng để bào chế dạng nano này đều đã được giới thiệu trong các phân bào chế nano tinh thể, nano polyme và nano lipid.
2.4.3. Phân loại
a. Phương pháp bào chế hai bước (two-step method)
Phương pháp bào chế hai bước bao gồm:
- Bước 1: bào chế nano polyme hoặc nano lipid.
- Bước 2: phối họp nano polyme với lipid hoặc ngược lại.
Đây là phương pháp phổ biến nhất trong quá trình nghiên cứu phát triển nano polyme-lipid (LPN) hoặc nano lipid-polyme (PLN). Nói chung, các nano polyme sẽ phụ lên trên bề mặt nano (thông qua tương tác tĩnh điện hoặc hấp phụ bề mặt).
b. Phương pháp bào chế một bước </>
Phương pháp bào chế một bước bao gồm:</>
– Đồng nhất hóa khi phối họp đồng thời hai pha dầu và pha nước chứa polyme và lipid.
2.4.4. Các phương pháp bào chế
a. Lõi polyme ở trong, lớp vỏ lipid ở ngoài
* Nguyên tắc: Dùng phương pháp bào chế hai bước
Trong cấu trúc này, nano-polyme có thê được bào chế bằng các phương pháp trình bày ở mục 2.2. Các nano-polyme có thể được phối họp với lipid thông qua các bước sau.
(i) Tạo lớp màng phim lipid:
Lipid được hòa tan trong hệ dung môi hữu cơ chứa một hoặc phối hợp các dung môi như hydrocarbon halogen hóa, ethanol, hoặc n-hexan. Tạo lớp màng phim mỏng bằng cách cất quay chân không dung dịch lipid trong các thiêt bị phù họp (vi dụ máy cất quay).
(ii) Hydrat hóa lóp màng phim:
Phối hợp hệ hỗn dịch nano vào lớp màng phim. Tiên hành đồng nhất hóa bằng thiết bị lắc xoáy (vortex) hoặc thiết bị siêu âm. Chú ý nano được phối hợp với lipid ở nhiệt độ cao hơn nhiệt độ chuyển hóa gel (gel-liquid transition temperature) của lipid.
Sau đó, nano polyme bao lipid có thể được tinh chế nhờ ống ly tâm màng lọc (ultrafiltration) hoặc màng lọc tiếp tuyến (tangenial filtration).
Để thu được hệ LPN đồng nhất về kích thước, hỗn dịch LPN thường được đồng nhất hóa lại, hoặc sử dụng thiết bị đùn qua màng. Trong đó, hệ hỗn dịch LPN được đưa qua hệ thống màng lọc có kích thước lỗ lọc phù hợp, qua đó tạo ra các tiểu phân có KTTP phù hợp. Bên cạnh việc sử dụng thiết bị đùn qua màng, có thê đông nhât hóa lại ở áp suất cao.
* Minh họa
Wang, Zhao (2011) bào chế nano PLGA tạo lớp lõi (điện tích âm). Trong đó, lớp vỏ lipid mang điện tích dương có thể gồm có acid folic (FA) liên hợp với phức hợp của chitosan và lysin được amonium hóa bởi octadecyl (octadecyl-quatemized lysine modified chitosan), phức hợp của chitosan và lysin được amonium hóa bởi PEG- octadecyl (PEG-octadecyl-quatemized lysine modified chitosan), và cholesterol. Hệ LPN được tạo ra bằng cách khuấy trộn hỗn dịch nano PLGA với hệ lipid một cách liên tục hoặc có thể dùng bể siêu âm. Hệ LPN thu được có thê zeta ~ 20-30 mV, KTTP trung bình 200 nm (khi sử dụng FA) và 400 nm khi sử dụng PEG.
Trong nghiên cứu của Fenart & Migue, quá trình bào chế nano lipid-polyme đã sử dụng lớp lõi maltodextrin polysaccharid, lớp vỏ thành phần là 1,2-dipalmitoyl-sn- glycero-3-phosphocholin/cholesterol. Nano maltodextrin được hình thành bằng cách tạo liên kết chéo với epiclorohydrin (2,3 epoxy cloropropan) và cải biến bề mặt bằng muối amoni glycidyl trimethyl. Hỗn hợp được đồng nhất hóa ở áp suất cao và tinh chế bằng ống ly gắn màng lọc để thu được các tiểu phân nano tích điện dương. Hệ hỗn dịch nano được tiếp tục phối hợp với dung dịch DDPC (Dipalmitoyl phosphatidyl cholin)/cholesterol trong ethanol. Hệ hỗn dịch thu được tiến hành đồng nhất hóa ở áp suất cao (Miniỉab homogenizer) ở nhiệt độ 80°c, tạo ra nano có kích thước ~ 60 nm
đồng nhất.
b. Lõi lipid ở trong, lớp vở polyme ở ngoài (nano polyme-lipid)
* Nguyên tắc: dùng phương pháp bào chế hai bước
Nano lipid tạo ra bằng một trong các phương pháp bào chế đã trình bày ở mục 2.3 thường được bao lớp polyme bên ngoài, sử dụng tương tác tĩnh điện, tạo ra nano polyme- lipid. Trên thực tế, do lipid có bản chất sơ nước hay các chất mang có bản chất lipid thường không có thể zeta cao nên cần phối hợp thêm các chất diện hoạt ion hóa để thuận lợi cho quá trình hình thành các tương tác tĩnh điện, tạo cấu trúc nano polyme-lipid.
* Minh họa
Trần Ngọc Bảo (2017) đã bào chế nano lipid rắn (SLN) theo phương pháp đồng nhất hóa nóng, sử dụng chất diện hoạt ion dương didodecyldimethylammonium bromid (DDAB), sau đó acid hyaluronic (HA) được bao lên bề mặt SLN dựa vào tương tác tĩnh điện (SLN-HA). Nano thu được có KTTP trung bình 169,3 ± 0,55 nm; PDI 0,285 ± 004; thể Zeta -10,5 ± 0,15 mV, chỉ số EE cao (>90%). Sự có mặt của HA trên bề mặt nano (SLN-HA) làm tăng khả năng hấp thu nano vào trong tế bào MDA-MB-231 (chứa nhiều thụ thể CD44), qua đó tăng tác dụng điều trị.
Jong-Suep Baek, Cheong-Weon Cho bào chế nano SLN chứa curcumin sử dụng glycerol monostearat, lecithin. Tác giả đã tiến hành bao N-carboxymethyl chitosan lên bề mặt nano, mục đích giúp kìm hãm giải phóng curcumin trong giai đoạn đầu, tăng sinh khả dụng của thuốc. Để tạo ra điện tích cho lõi lipid, stearyl amin được phối hợp vào trong pha dầu trong quá trình bào chế SLN, tạo ra lõi lipid mang thế zeta dương. Lõi lipid được phối hợp với dung dịch chứa N-carboxymethyl chitosan (mang nhiều điện tích âm), tạo ra hệ polyme bao lõi lipid dựa trên tương tác tĩnh điện.
c. Cốt lipid và polyme
* Nguyên tắc: dùng phương pháp bào chế một bước
Phương pháp bào chế một bước hay còn được gọi là phương pháp kết tủa nano. Trong đó, polyme và dược chất được hòa tan trong dung môi đồng tan với nước (ví dụ aceton), còn pha nước chứa lipid được phân tán ở nhiệt độ cao 65-70°C, tạo hệ phân tán đồng nhất. Dung dịch polyme được thêm từ từ vào pha nước, kết hợp với đồng nhất hóa. Do quá trình khuếch tán dung môi, polyme sẽ bị kêt tủa lại, lipid sẽ tự kết tập xung quanh các nano polyme (dựa trên các tương tác giữa các nhóm chức sơ nước) . Đầu sơ nước của các lipid sẽ kết tập với tiểu phân polyme, ngược lại, đầu thân nước hướng ra phía pha nước, tạo ra nano chứa lipid & polyme. Nano có thể tinh chế bằng ly </>tâm hoặc màng siêu lọc.
Thông thường lipid sử dụng là lipid-PEG, khi đó phân lipid sẽ hướng vào trong cấu trúc nano, phần đầu PEG sẽ hướng ra phía pha nước phân tán. Chi tiêu quan trọng nhất trong công thức sẽ là tỷ lệ khối lượng polyme và lipid (Lipid/Polyme).
* Minh họa
Zhang (2008) nghiên cứu tiểu phân nano kết hợp PLGA với lecithin và dẫn chất PEG hóa của DSPE (l,2-distearoyl-sn-glycero-3-phosphoethanolamin-polyethylen glycol). Trong đó, khi Lipid/Polyme (w/w) là 15%, lớp lipid có thể hoàn toàn bao bọc lớp lõi bên trong PLGA với KTTP ~ 60-80 nm. Tăng tỷ lệ Lipid/Polyme vượt quá nồng độ micel, có thể hình thành hệ liposome bên cạnh hệ LPN. Ngược lại, khi Lipid/Polyme giảm, có thể nguy cơ kết tập LPN do không đủ lóp áo điện tích cho nano.
Trên đây là các phương pháp bào chế nano tinh thể, nano polyme, nano lipid, nano polyme-lipid còn các phương pháp bào chế liposome, dendrime…. không nằm trong phạm vi sách này, người đọc có thể tham khảo tài liệu khác.
Câu hỏi lượng giá
- Trinh bày đặc điểm của một số chất mang thường được sử dụng cho nano polyme, nano lipid.</>
- Trình bày đặc điểm về nguồn gốc, cấu trúc, tính chất lý hóa, dược động học của PLGA, CS
- Trình bày đặc điểm, vai trò các thành phần khác, thường được sử dụng trong bào chế tiểu phân nano.
- Phân tích vai trò của các chất biến đổi bề mặt. Cho ví du minh họa
- Trình bày các phương pháp bào chế nano tinh thể, nano polyme, nano lipid nano polyme-lipid.