Bệnh da liễu
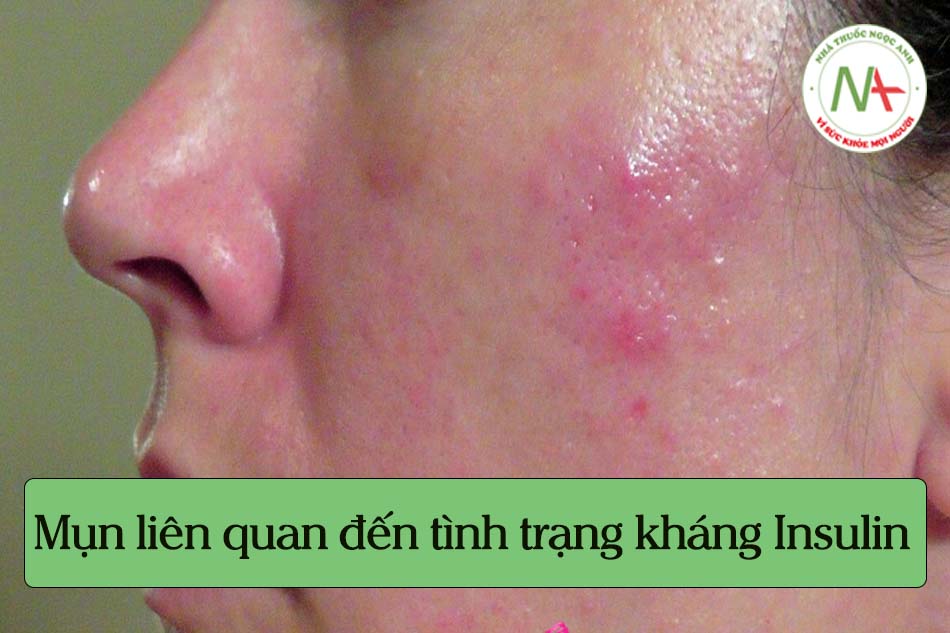
Tìm hiểu về: Mụn liên quan đến tình trang kháng Insulin
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Chủ đề: Mụn liên quan đến tình trang kháng Insulin tải bản PDF tại đây
Tác giả: Raj Kubba
Dịch: Bs. Trương Tấn Minh Vũ
Vai trò quan trọng của insulin, yếu tố tăng trưởng giống insulin-1 (IGF-1), và tình trạng kháng insulin (insulin resistance, IR) trong cơ chế bệnh sinh của mụn trứng cá nổi lên sau một bài báo của Cordain và các đồng nghiệp vào năm 2002, có tiêu đề “Mụn trứng cá: bệnh của nền văn minh phương tây” [1], và đã phát triển đều đặn trong những năm tiếp theo để đưa đến với một bài báo khác của Bodo Melnik có tiêu đề “Mụn trứng cá: hội chứng chuyển hóa của nang lông tuyến bã” [2]. Có lẽ đã đến lúc để nhìn vào tổng thể nghiên cứu được tích lũy về chủ đề này thông qua lăng kính của thực hành lâm sàng, và kết nối các “điểm khoa học” có liên quan. Có lẽ đã đến lúc để kết hợp những hiểu biết sâu sắc thu thập được trong việc đánh giá và kiểm soát mụn liên quan đến tình trạng kháng insulin (IR).
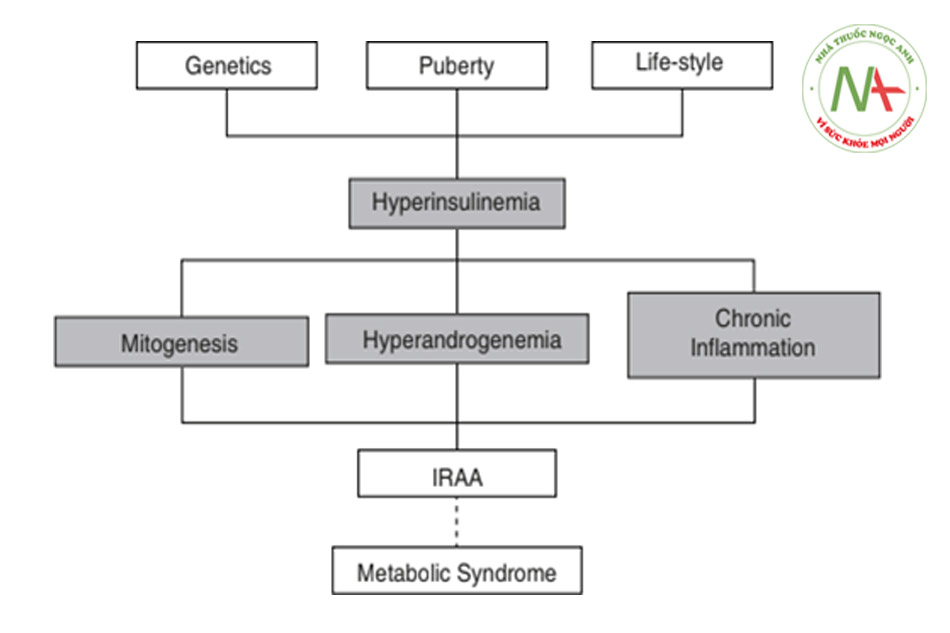
Mụn được biết đến trong các tài liệu liên quan đến IR [3], đặc biệt là trong tình trạng hội chứng buồng trứng đa nang (Polycystic ovary syndrome, PCOS) [4]; tuy nhiên, những mụn này được cho là do tăng tiết androgen hơn là do insulin hoặc IR [3,4]. Khái niệm về mụn liên quan đến tình trạng kháng insulin (insulin resistance associated acne, IRAA) đã được đưa ra và các đặc điểm nổi bật của nó đã được mô tả [5–7]. Trình bày bên dưới về IRAA, một loại mụn là một thực thể chuyển hóa riêng biệt và là một dấu hiệu của hội chứng chuyển hóa (MetS).
Các khía cạnh phân tử của IRAA
Để hiểu IRAA, cần hiểu về insulin và kháng insulin (IR). Insulin là một loại hormone peptide được sản xuất bởi các tế bào beta của đảo tụy để phản ứng trực tiếp với mức glucose lưu thông của trong máu. Insulin điều chỉnh quá trình chuyển hóa carbohydrate và góp phần vào quá trình chuyển hóa lipid và protein [8]. Insulin cũng là một mitogen, có nghĩa là nó thúc đẩy sự phát triển của tế bào, phân chia tế bào và di cư, đồng thời ức chế quá trình apoptosis [8]. Một phần tác dụng phân bào của insulin là trực tiếp, và một phần lớn hơn là nhờ sự phối hợp của nó với IGF-1 [8]. Insulin là một mitogen mạnh khi nó liên kết với thụ thể insulin A (IR-A) hoặc thụ thể IGF-1 (IGF-1R); đối với các hoạt động trao đổi chất và chuyển hóa glucose, nó liên kết với thụ thể insulin B (IR-B) [9]. Insulin cũng thúc đẩy các yếu tố tăng trưởng khác, cụ thể là PDGF (yếu tố tăng trưởng có nguồn gốc từ tiểu cầu), VEGF (yếu tố tăng trưởng nội mô mạch máu) và EGF (yếu tố tăng trưởng biểu bì) [8]. Insulin kích hoạt đường truyền tín hiệu Ras-Raf-Map kinase để tạo ra hiệu ứng phân bào [8]. Điều này thúc đẩy quá trình phosphoryl hóa và hoạt hóa farnesyltransferase, một loại enzyme farnesyl hóa Ras protein [8]. Sự gia tăng sẵn có của Ras được farnesyl hóa tại màng sinh chất giúp tăng cường khả năng đáp ứng phân bào của các tế bào liên quan với các yếu tố tăng trưởng khác nhau [8].
IR mô tả sự kích thích bởi insulin bị khiếm khuyết đối với sự hấp thu glucose của cơ xương, mô mỡ, gan và tế bào nội mô dẫn đến tăng bù insulin máu, là tác động chuyển hóa cơ bản của IR [1]. Tăng insulin máu là nguyên nhân chính của MetS [10], tiến triển không đồng bộ theo nhiều trục, trong suốt cuộc đời, làm phát hiện theo thứ tự ngẫu nhiên tăng huyết áp, đái tháo đường týp 2, rối loạn lipid máu, bệnh mạch vành, tăng acid uric máu, gan nhiễm mỡ, béo phì, bất thường của quá trình phân hủy fibrin (vấn đề chính) cùng với acanthosis nigricans (AN), acrochordons, mụn trứng cá, PCOS, rụng tóc ở nam giới, kinh nguyệt sớm, vóc dáng cao, cận thị và tăng nguy cơ ung thư biểu mô (vấn đề phụ) (Bảng 9.1) [10]. Tăng insulin máu là cấp tính và không liên tục trong những năm đầu ở những người bị IR và tương ứng với các kích thích sản xuất insulin như dùng quá nhiều thức ăn phương tây và sữa [11].
Theo thời gian, tình trạng tăng insulin máu trở nên dai dẳng và mãn tính [10].
Xem thêm: Hiệu ứng quang động và quang sinh học của diode phát sáng (LED) trong bệnh da liễu
Bảng 9.1 Các vấn đề chính và phụ của hội chứng chuyển hóa
| Vấn đề chính | Vấn đề phụ |
| Tiểu đường tuýp 2 | Acanthosis nigricans |
| Tăng huyết áp | U mềm treo |
| Rối loạn lipid máu (↑ TG, ↓ HDL) | Mụn |
| Bệnh động mạch vành | Rụng tóc |
| Béo phì | Có kinh sớm |
| Tăng acid uric máu | Sự phát triển sinh lí ↑ |
| Sự bất thường quá trình phân hủy fibrin | PCOS |
| Cận thị | |
| Ung thư biểu mô (vú, tuyến tiền liệt, ruột kết) |
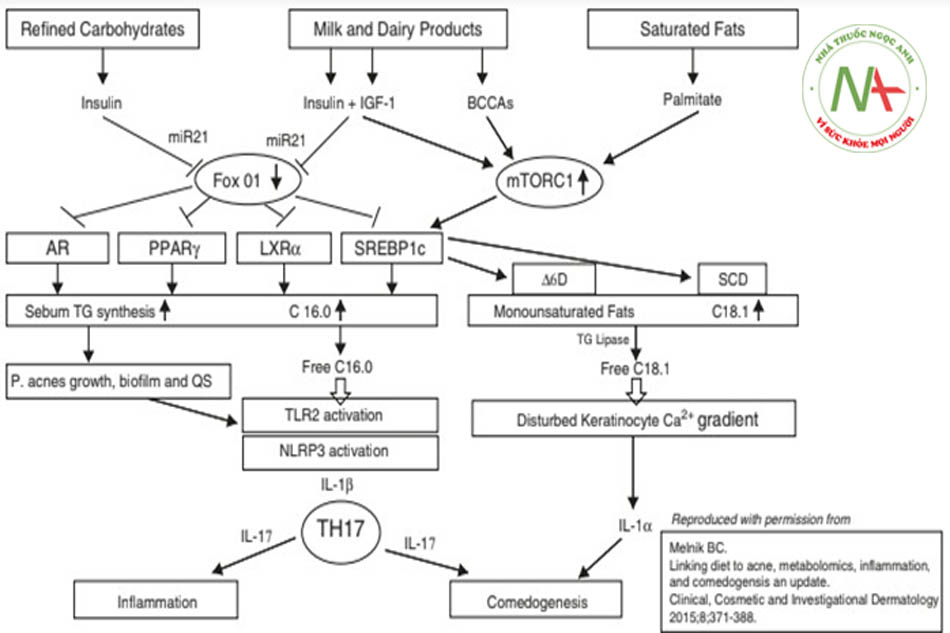
Tăng insulin máu dẫn đến tăng tín hiệu insulin/IGF-1 với nhiều hậu quả chuyển hóa, trong đó mụn trứng cá là một [2]. Có nhiều con đường mà tín hiệu tăng cường như vậy hoạt động, trong đó sự hoạt hóa của mTORC1 (mục tiêu cơ học của phức hợp rapamycin 1; một kinase nhạy cảm với chất dinh dưỡng) là đáng chú ý nhất. MTORC1 được kích hoạt thúc đẩy sự hình thành chất nhờn của tuyến bã thông qua sự hoạt hóa của SREBP1 (protein liên kết yếu tố phản ứng sterol1) [12], và nó là chất điều hòa chính hoạt động của tuyến bã nhờn và sự hình thành chất nhờn tuyến bã, một yếu tố gây bệnh chính trong mụn trứng cá (Hình 9.1).
Sự gia tăng biểu hiện gen mTOR đã được quan sát thấy ở da tổn thương cũng như không tổn thương của bệnh nhân mụn trứng cá so với đối chứng khỏe mạnh bình thường [13]. Các nghiên cứu hóa mô miễn dịch cho thấy sự biểu hiện tế bào chất và biểu hiện nhân của mTORC1 mạnh hơn ở các tuyến bã nhờn bị viêm ở lưng của bệnh nhân mụn trứng cá so với nhóm chứng [14]. Một con đường khác là S6K1 (protein ribosome S6 kinase beta-1) thông qua IRS-1 (chất nền của thụ thể insulin – 1) phosphoryl hóa gây ra IR [2]. Tăng tín hiệu insulin / IGF-1 ức chế trực tiếp hoạt động của FoxO1 hạt nhân trong tế bào tuyến bã của người [15]. Tăng insulin máu điều hòa tăng sản xuất androgen tuyến sinh dục [16] với các tác động theo đó như mụn trứng cá, rậm lông và PCOS. Tăng androgen thúc đẩy mụn trứng cá thông qua một số cơ chế, một trong số đó là tăng cường biểu hiện mTORC1 thông qua AR (thụ thể androgen) ức chế DEPTOR (DEP domain-containing mTOR-interacting protein) [17].
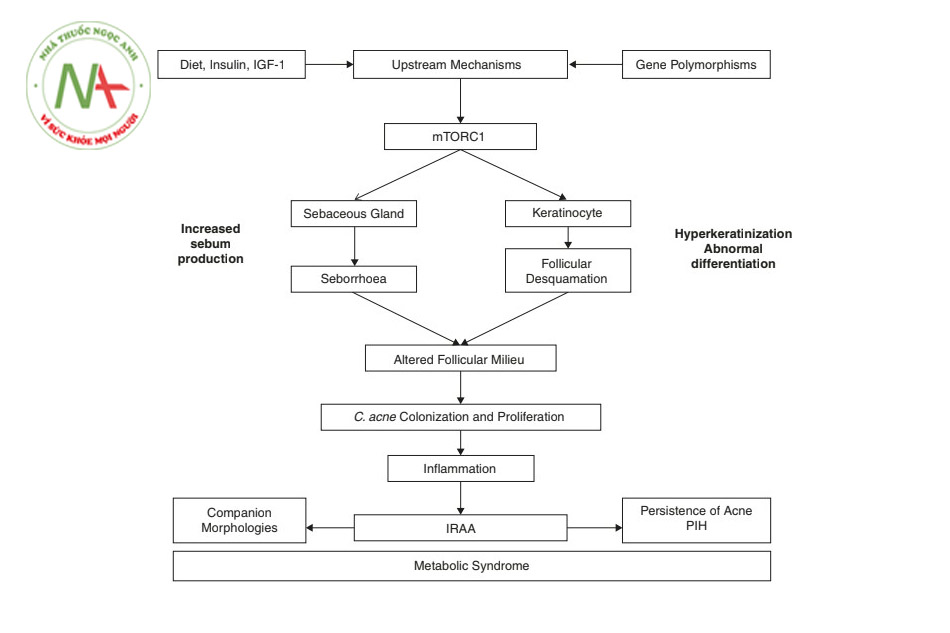
Tăng tín hiệu insulin/IGF-1 chịu trách nhiệm cho IR sinh lý đi kèm với tuổi dậy thì. Tuy nhiên, chế độ ăn phương tây nhiều calo thường được tiêu thụ ở độ tuổi này kết hợp IR sinh lý và tăng insulin máu. Tín hiệu insulin / IGF-1 chiếm một vị trí quan trọng trong cơ chế ngược dòng của bệnh sinh mụn trứng cá và theo cách này, nó tác động lên tất cả bốn yếu tố sinh bệnh chính của mụn trứng cá, đó là sự sừng hóa bất thường, sự hình thành chất bã nhờn, rối loạn vi sinh vật nang lông, đặc biệt là Cutibacterium acnes, và viêm nang lông và quanh nang lông [1] (Hình 9.1).
Các khía cạnh về chủng tộc, dân tộc, khu vực, địa lý của IRAA
IRAA có sự khác biệt về chủng tộc / dân tộc và khu vực / địa lý được báo cáo trong quần thể mụn trứng cá trên toàn cầu. Hầu hết các tài liệu liên quan đến insulin trong cơ chế bệnh sinh của mụn trứng cá đều xuất phát từ Nam và Đông Á, Mỹ Latinh, Thổ Nhĩ Kỳ và Ý [18–22]. Có những dự đoán theo chủng tộc đối với IR [23]. Người Ấn Độ, Tây Ban Nha và Châu Phi được cho là có xu hướng bị IR nhiều hơn [23]. Vai trò của việc thay đổi thói quen ăn uống cùng với việc chuyển đổi sang chế độ ăn phương Tây trong các xã hội đang phát triển là lời giải thích thuyết phục cho việc gia tăng tỷ lệ bị IR và mụn trứng cá trong các xã hội này [10]. Nó chắc chắn áp dụng tốt cho Ấn Độ, nơi các quan sát trong 30 năm qua chứng thực giả thuyết này. IR tác động đến hệ vi sinh vật, tính dễ bị tổn thương trước các tác nhân môi trường gây stress (ô nhiễm không khí, tác nhân lây nhiễm, tiếp xúc với hóa chất và UV), sức khỏe miễn dịch và nội tiết, tất cả đều phụ thuộc vào các yếu tố địa lý và khu vực. Tác động trầm trọng hơn của ô nhiễm không khí đối với mụn trứng cá là một ví dụ điển hình [24]. Ô nhiễm không khí với các chất dạng hạt 2,5 (PM 2,5) đã được ghi nhận là làm trầm trọng thêm IR có từ trước [25]. Tóm lại, khuynh hướng di truyền, thay đổi chế độ ăn uống và ô nhiễm không khí đang làm nổi bật sự khác biệt giữa các vùng trong biểu hiện mụn trứng cá mà IRAA là một ví dụ điển hình
Thông tin lâm sàng của IRAA
IRAA và tuổi
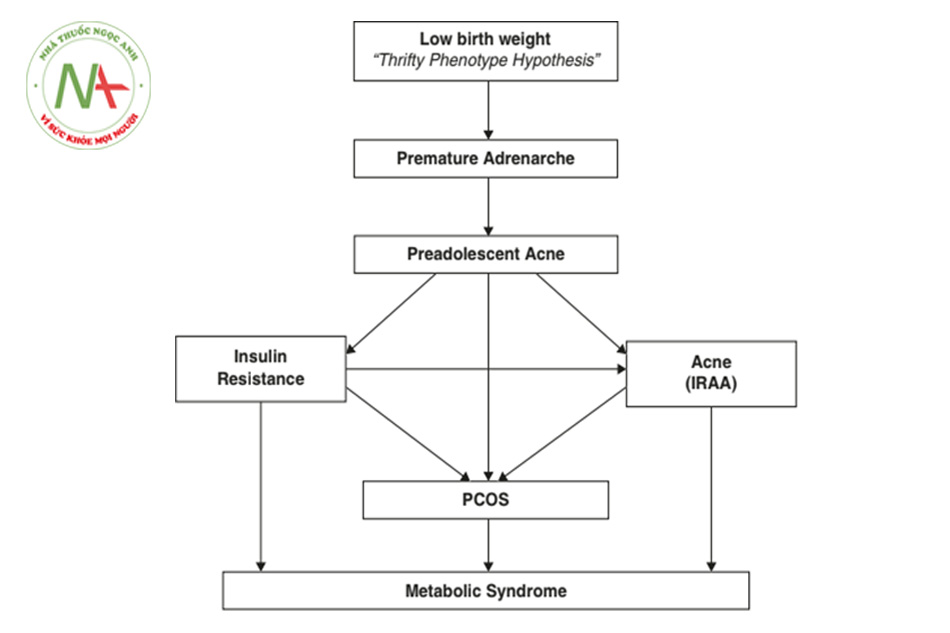
IRAA diễn ra trong một giai đoạn dài (Hình 9.2). Khi nó xuất hiện sớm trong cuộc đời, nó có thể được dự đoán là sẽ tồn tại và tiến triển thành mụn trứng cá ở tuổi trưởng thành [6]. Theo thời gian, IR xấu đi và tình trạng tăng insulin máu trở nên thường xuyên (tăng insulin máu mãn tính). Điều này biểu hiện về mặt lâm sàng với sự xuất hiện và sự tiến triển sau đó của các hình thái đi cùng, với các bệnh đi kèm ngày càng tăng và với các dấu hiệu toàn thân của MetS. Mức độ nghiêm trọng lâm sàng của mụn trứng cá trên khuôn mặt giảm dần đặc biệt là sau 22 tuổi và các di chứng của mụn trứng cá bắt đầu được chú ý nhiều hơn [6]. IRAA ở tuổi thanh thiếu niên được xem như một yếu tố dự báo của MetS trong khi IRAA ở người trưởng thành là một dấu hiệu của MetS đang phát triển hoặc đã phát triển [6].
IRAA ở tuổi trước thanh thiếu niên (Preadolescent IRAA)
Khởi phát mụn trứng cá ở tuổi trước dậy thì có thể được giải thích trên cơ sở dậy thì sớm (PA), được xác nhận bằng tăng mức DHEA và DHEAS trước 8 tuổi ở trẻ em gái và 9 tuổi ở trẻ em trai, và sự hiện diện đồng thời dấu hiệu thừa androgen bao gồm mùi cơ thể kiểu người trưởng thành, da và tóc dầu, và mọc lông mu [26]. Mụn trứng cá có thể được kích hoạt bởi IR, và khi đó nó có khả năng liên quan đến sự xuất hiện của acanthosis nigricans (AN) [27] và trong một số trường hợp với buồng trứng đa nang, sự phát triển nhanh của bộ xương và sự trưởng thành về thể chất [27] (Hình. 9.3). Mụn trứng cá ở tuổi trước dậy thì cũng có thể xảy ra ở trẻ em mắc chứng tăng sản tuyến thượng thận bẩm sinh không điển hình (Nonclassic Congenital Adrenal Hyperplasia, NCAH), và NCAH và IR có thể đồng thời xảy ra [6]. IRAA trước dậy thì dự báo mụn trứng cá nghiêm trọng hơn để theo dõi và đóng vai trò là manh mối lâm sàng sớm nhất cho bệnh MetS trong tương lai xa [6].
IRAA ở tuổi thanh thiếu niên (Adolescent IRAA)
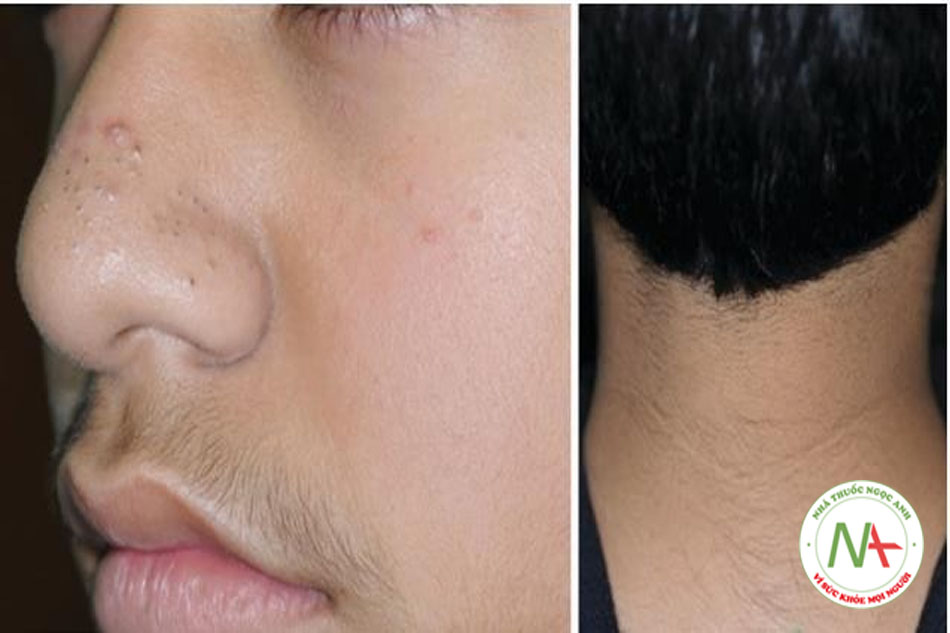
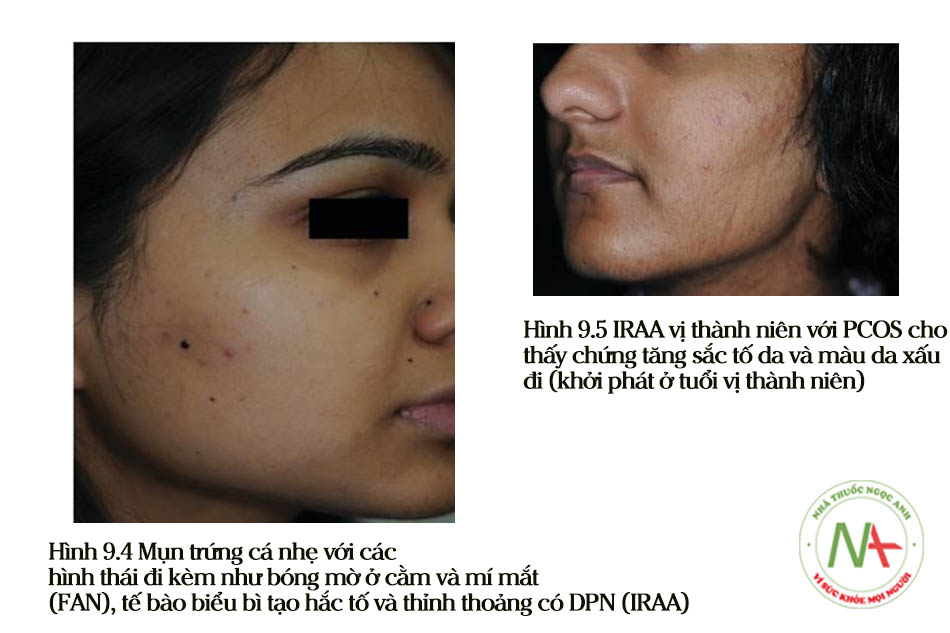
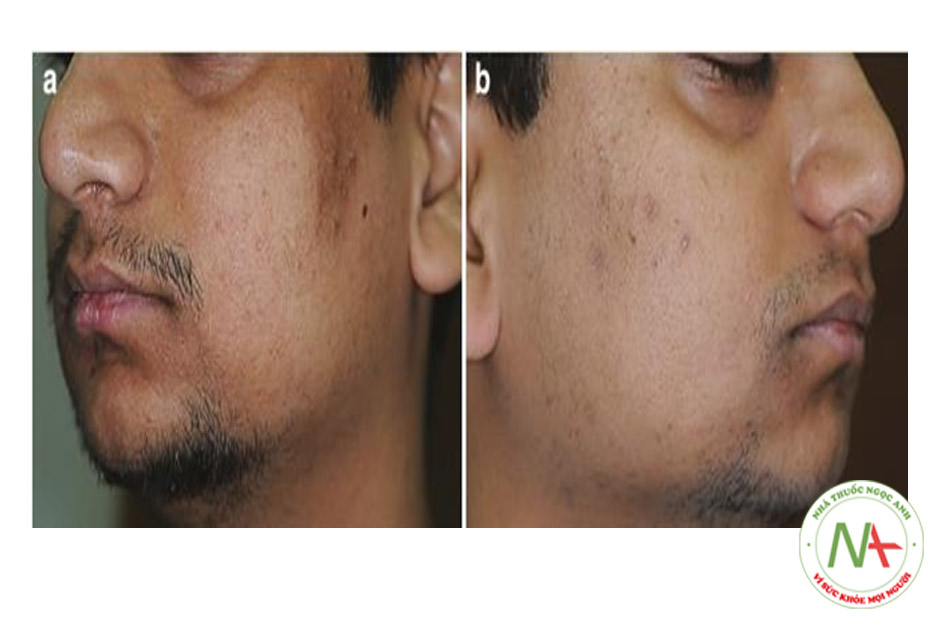
Sự hiện diện của acanthosis nigricans trên mặt (FAN) trong mụn trứng cá ở tuổi thanh thiếu niên là dấu hiệu phổ biến nhất đối với IR/MetS [28] và biểu hiện lâm sàng như quầng thâm (mắt), trán bóng mờ và cằm bóng mờ (Hình 9.4). Các manh mối lâm sàng khác trong IRAA ở tuổi thanh thiếu niên là: chứng rậm lông lan tỏa (bao gồm chứng rậm lông trên trán và các vùng gò má) (Hình 9.5), tăng tiết bã nhờn, các dấu hiệu xâm chiếm quá mức của Malassezia (gàu, viêm da tiết bã nhờn) và đôi khi tăng sản lành tính như viêm da papulosa nigra (DPN) và u mềm treo [6]. Thông thường, IRAA ở tuổi thanh thiếu niên là nhẹ (mức 1) và cho thấy sự chuyển đổi từ phân bố vùng chữ T sang phân bố toàn mặt [6]. Tuy nhiên, mụn trứng cá nghiêm trọng trong bối cảnh IR đã được báo cáo [29].
IRAA ở sau tuổi thanh thiếu niên (Postadolescent IRAA)
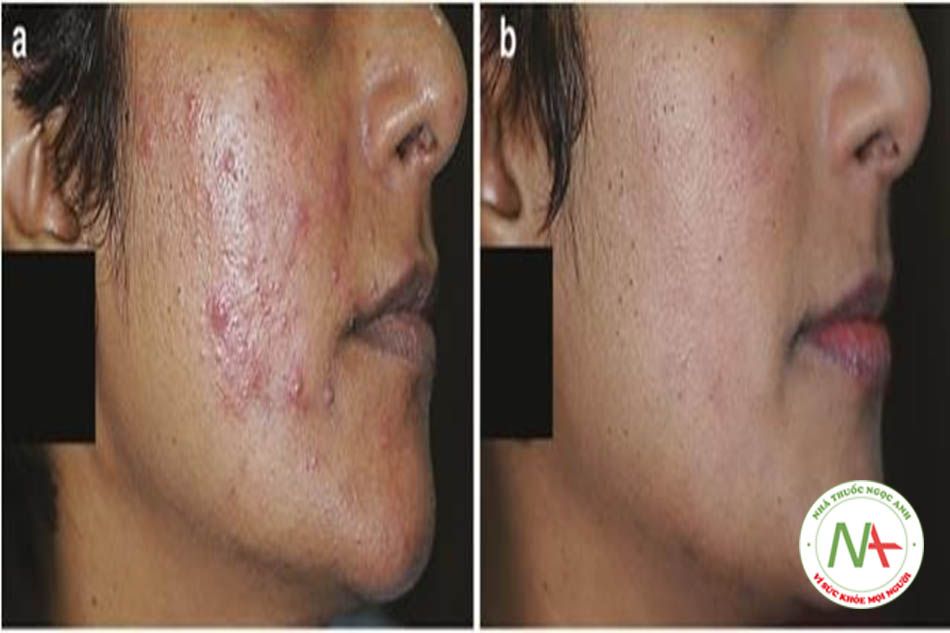
Điều này thể hiện sự dai dẳng và tiếp tục của mụn trứng cá ở tuổi thanh thiếu niên. FAN và tăng sản lành tính được gặp nhiều hơn. Mức độ nghiêm trọng của mụn trứng cá dường như giảm dần và phân bố theo “vùng chữ V”. Một bệnh nhân trong nhóm này có thể biểu hiện mụn trứng cá cấp II hoặc thậm chí cấp III (dạng nốt) (Hình 9.6 a, b). Di chứng mụn trứng cá trở nên rõ ràng, đặc biệt là chứng tăng sắc tố sau viêm (PIH). Một số bệnh nhân cảm thấy màu da xấu đi (WOSC) mà họ mô tả là “rám nắng dai dẳng” [6]. Tình trạng dư thừa androgen phổ biến hơn và PCOS chiếm ưu thế.
IRAA ở người trưởng thành
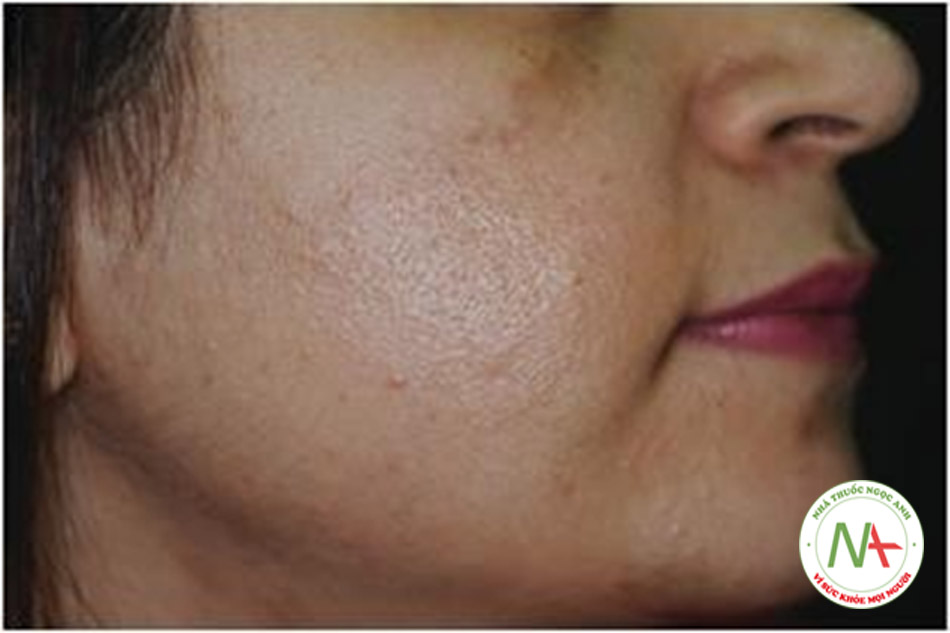
Mụn trứng cá tiếp tục xảy ra sau 25 tuổi biểu hiện tính dai dẳng, tái phát muộn ít phổ biến là và bắt đầu xuất hiện muộn hơn [6]. Ở giai đoạn này, các hình thái đi chung như rối loạn sắc tố / tăng sắc tố giống nám da (Hình 9.7), rậm lông và rụng tóc (đặc biệt do nội tiết tố) chiếm ưu thế và thường là biểu hiện chính của bệnh nhân [6]. Các bệnh tăng sản lành tính như DPNs, syringomas, acrochordons, ephelides / lentigines, và melanocytic nevi thì phức tạp hơn [6]. Ở người trưởng thành (ngoài 35 tuổi), tăng sản bã nhờn, dày sừng tiết bã, u mạch và xanthelasma là gặp phải [6]. Bệnh nhân IRAA có nguy cơ phát triển các khối u lành tính khác như u mỡ và u xơ cao hơn. Lão hoá do ánh sáng xuất hiện ở giai đoạn này và tiến triển từ từ [6]. Quan trọng hơn, bệnh nhân IRAA trưởng thành bắt đầu có dấu hiệu về bệnh MetS đang tiến triển [7]. IRAA có xu hướng kéo dài như mụn trứng cá lẻ tẻ ở nam giới trung niên và mụn trứng cá ở cằm ở phụ nữ tiền mãn kinh [6].
Các phân loại IRAA
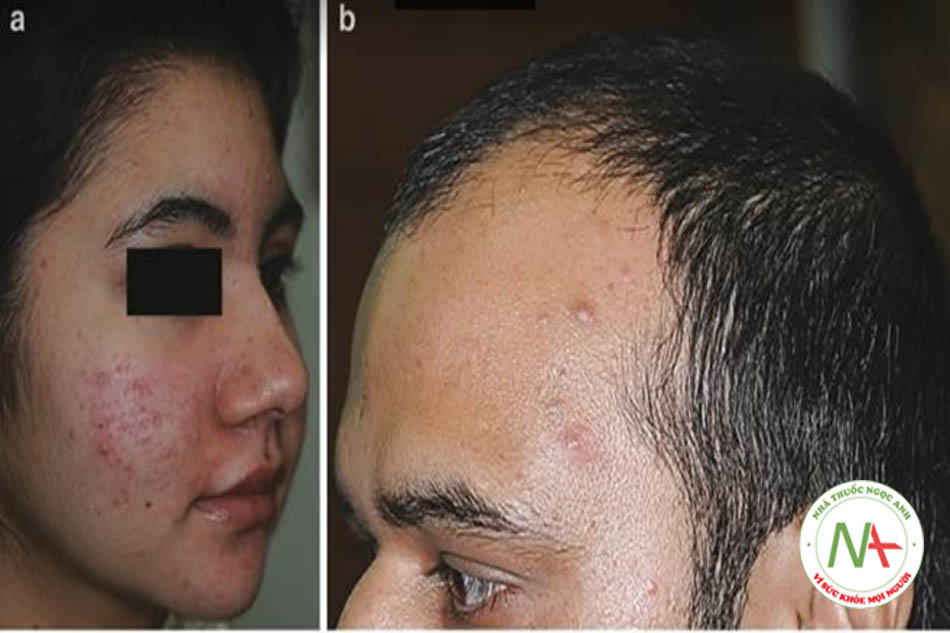
Tăng insulin máu theo thời gian dẫn đến mất cân bằng nội tiết tố, rối loạn chức năng miễn dịch và viêm mãn tính, tất cả đều góp phần và điều chỉnh sự biểu hiện của mụn trứng cá đang có. Chúng tôi đã quan sát thấy các loại IRAA sau: Malassezia IRAA, Dystrophic IRAA, Autoimmune IRAA và Hormonal IRAA dựa trên các đặc điểm lâm sàng nổi bật và các bất thường trong xét nghiệm (chưa được công bố). Trong Malassezia IRAA, malassezia phát triển quá mức như gàu nhiều và khó trị, và viêm da tiết bã nhờn vùng má biểu hiện rõ ràng cùng với mụn trứng cá biểu hiện dưới dạng sẩn / mụn mủ, comedon kiểu giấy nhám và sẹo nhỏ, có khuynh hướng ở da dọc theo trán và chân tóc thái dương (Hình 9.8) và / hoặc theo vùng chữ O, tức là, phân bố cạnh mũi và quanh miệng. Dystrophic IRAA có thêm biểu hiện loạn dưỡng da, thường được quan sát thấy trên các vùng thái dương và gò má, và biểu hiện bất đối xứng hai bên (Hình 9.9). Autoimmune IRAA được quan sát thấy hầu hết ở những phụ nữ có biểu hiện lâm sàng với mụn trứng cá kháng trị; nó có biểu hiện rối loạn chức năng miễn dịch như tổng IgE tăng và các tự kháng thể cơ quan cụ thể tăng cao, như kháng thể thyroglobulin và kháng thể peroxidase tuyến giáp và nghịch lý là ở một số bệnh nhân như vậy mức độ hormone sinh dục giảm tương đối (AMH, DHEAS, 5αDHT, LH, FSH, prolactin). Trong Hormonal IRAA, dư thừa androgen / hội chứng SAHA chiếm ưu thế về mụn trứng cá và bằng chứng về PCOS, prolactinemia hoặc NCAH là rõ ràng. Có sự chồng chéo đáng kể giữa các phân loại IRAA nói trên (chưa được công bố).
Các hội chứng IRAA
Hội chứng APAAN là từ viết tắt của Acne, Patterned Alopecia, Acanthosis Nigricans, và được xem như một bản sao của SAHA ở nam giới (Hình 9,10) [5]. Tương đương PCOS ở nam giới là một tình trạng được mô tả gần đây [30] biểu hiện như rụng tóc kiểu nam giới (Kiểu Ludwig), Malassezia phát triển quá mức, với tăng insulin, prolactin và LH huyết thanh; những bệnh nhân này cũng bị mụn trứng cá và tương đương PCOS ở nam giới biểu hiện trùng lặp với IRAA (chưa được công bố). Hội chứng HAIR-AN là từ viết tắt của HyperAndrogenism, Insulin Resistance và Acanthosis Nigricans; một khiếm khuyết di truyền bao gồm các đột biến trong vùng tyrosine kinase của gen thụ thể insulin [31, 32] và biểu hiện lâm sàng như rậm lông, mụn trứng cá, AN, béo phì và PCOS (Hình 9.11) [33].
Các hình thái đi chung trong IRAA
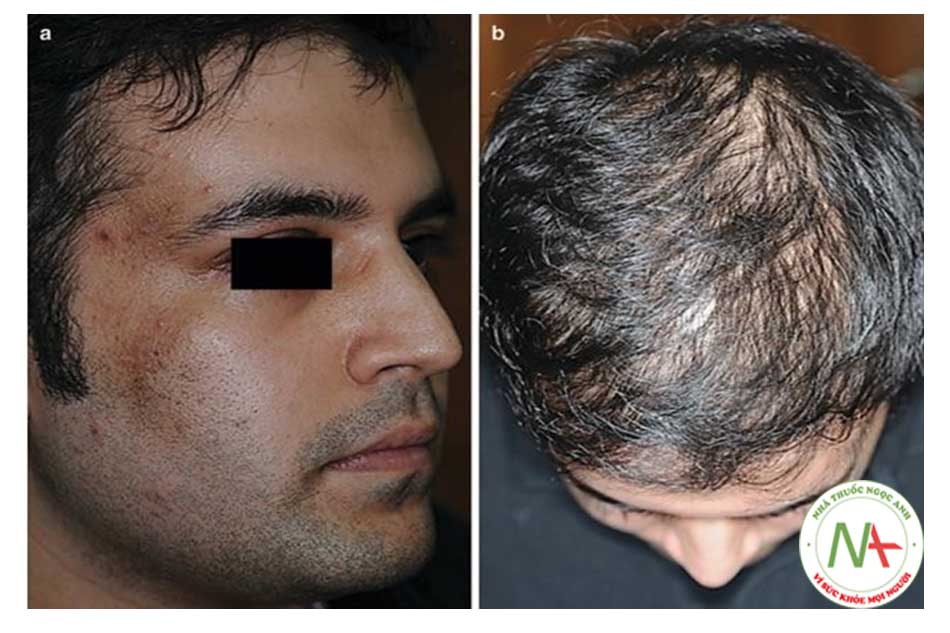
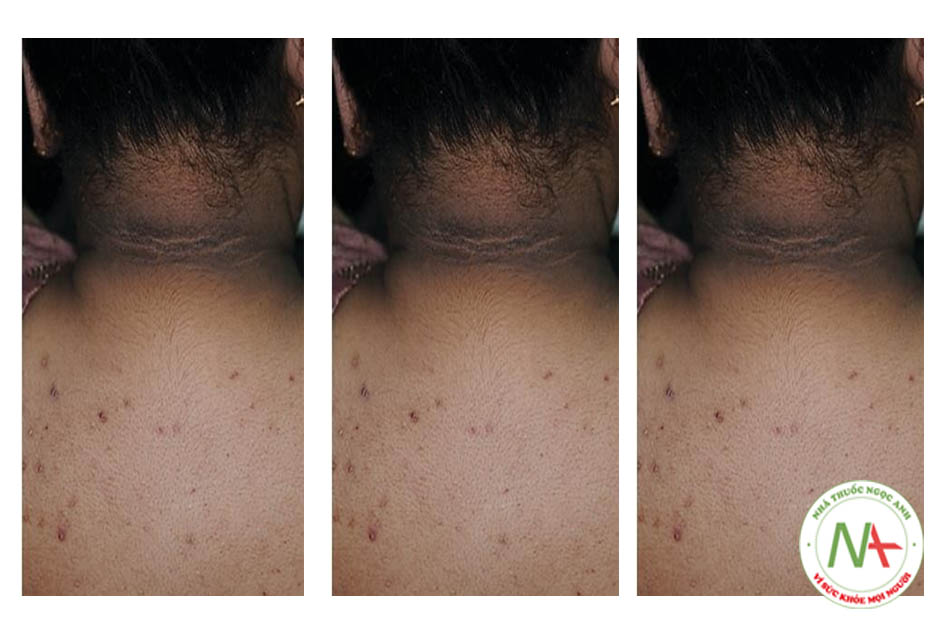
IRAA không xảy ra đơn lẻ! Tăng sản lành tính như liệt kê ở trên đóng vai trò là đầu mối lâm sàng (Bảng 9.2). AN và FAN là các dấu hiệu được công nhận của IR [28, 34]. AN là một chỉ dấu quan trọng về độ nhạy insulin độc lập với chỉ số khối cơ thể BMI [34]. Tuy nhiên, người ta đã lưu ý rằng phân loại màu da (SPT) IV biểu hiện AN nhiều hơn loại da II- III và hơn nữa, người ta cho rằng AN trong loại da II-III đặc biệt hơn và dự báo IR nhiều hơn trong loại IV [35]; một ý kiến cần được xem xét kỹ lưỡng hơn? Rậm lông vùng cùng biểu hiện, đặc biệt khi quan sát thấy trên trán, vùng gò má và vùng gáy ủng hộ IRAA [6]. Điều này được thể hiện rõ ràng hơn ở IRAA ở tuổi thanh thiếu niên. Rụng và mỏng tóc lan tỏa (DHLT), đôi khi kèm theo da đầu lỏng lẻo, được ghi nhận trong một số trường hợp, cả nam và nữ, [6] và là dấu hiệu nổi bật khi gặp ở nam thanh niên IRAA. Theo thời gian, tình trạng mất lượng tóc tăng lên thành loại rụng tóc Ludwig (Hình 9.10). Viêm nang tóc da đầu đồng thời, tái phát và thuyên giảm, là một hình thái đi kèm gây khó chịu, thường được gọi nhầm là “mụn trứng cá da đầu”, theo chúng tôi, là một phần của IRAA [6]. Sẹo lồi mụn trứng cá đã được báo cáo là một triệu chứng ngoài da của MetS [36]. Bệnh nhân IRAA cũng gặp các dạng viêm nang lông khác (Bảng 9.2).
Bảng 9.2 Các hình thái đi kèm trong IRAA
| Acanthosis nigricans |
| U mềm treo |
| Tăng sản da lành tính |
| DPN, syringomata, u mạch anh đào, xanthelasma, dày sừng tiết bã |
| Thương tổn sắc tố |
| Ephelides, lentigines, melanocytic nevi |
| Facial acanthosis nigricans (FAN) |
| Màu da xấu đi / rám nắng kéo dài |
| Nám da |
| Rối loạn sự phát triển của lông, tóc |
| Rậm lông |
| Rụng và mỏng tóc lan tỏa (DHLT) |
| Rụng tóc theo vùng |
| Các vấn đề nang lông |
| Dày sừng nang lông |
| Viêm nang tóc gáy |
| Viêm nang tóc da đầu tái phát |
| Viêm nang lông Malassezia |
| Viêm nang lông sâu – vùng mu, mông, đùi |
| Viêm nang lông sau wax lông |
| Vấn đề khác |
| Viêm da tiết bã nhờn |
| Gàu khó trị |
Các bệnh đi kèm IRAA
IRAA có nhiều bệnh hệ thống đi kèm [37] chỉ có thể được làm sáng tỏ bằng cách đánh giá tổng thể và cẩn thận đối với từng bệnh nhân mụn trứng cá thông qua đánh giá xét nghiệm thích hợp cho từng bệnh đi kèm đã biết bao gồm thiếu hụt vitamin D3, thiếu hụt vitamin B12, cơ địa dị ứng, rối loạn chức năng miễn dịch, PCOS , prolactinemia, tăng sản thượng thận, NCAH (tăng sản thượng thận bẩm sinh không điển hình), rối loạn chức năng tuyến giáp, rối loạn chức năng tiêu hóa, rối loạn lipid máu và viêm mãn tính [38–44]. Các bệnh hệ thống đi kèm dựa trên bản chất hệ thống /chuyển hóa tự nhiên của IRAA và cần được giải quyết bằng các biện pháp điều trị phù hợp.
Cơ chế bệnh sinh của IRAA
IRAA là một thành phần của MetS, tự nó đại diện cho nhiều bất thường trong hệ thống cơ thể cực kỳ phức tạp với nhiều hệ thống con lồng vào nhau và tác động lẫn nhau. IRAA là kết quả từ các sai lệch định tính, sai lệch định lượng và sai lệch trong mối quan hệ qua lại của cả bốn yếu tố sinh bệnh chính.
Các cơ chế phân tử của IRAA rất phức tạp và liên quan đến nhiều con đường và nhiều phân tử hoạt tính sinh học, trong đó insulin/IGF-1 gây ra tín hiệu PI3K/Akt/FoxO1/ mTORC1 được đề xuất là quan trọng nhất [45]. Tín hiệu IGF-1 thông qua MAPK cũng kích hoạt mTORC1 [45]. Một kinase nhạy cảm với chất dinh dưỡng, mTORC1 điều chỉnh tăng trưởng và đồng hóa nói chung và cũng là nguyên nhân gây ra bệnh béo phì, đái tháo đường típ 2 và MetS [2]. BCAAs (axit amin chuỗi nhánh) và axit palmitic (từ chất béo chế độ ăn uống và sữa) cũng kích hoạt mTORC1 [2]. Tăng tín hiệu mTORC1/SREBP1 giúp tăng cường biểu hiện của các enzym quan trọng của quá trình tổng hợp axit béo như acetyl-CoA carboxylase (ACC) và các desaturase như ∆6-desaturase và stearyl CoA desaturase (SCD1) [trích dẫn từ2]. Các tác dụng sinh học khác của mTORC1 được kích hoạt bao gồm stress oxy hóa, viêm và sự di chuyển các tế bào đơn nhân trong máu ngoại vi [2].
Tăng tín hiệu insulin / IGF-1 ức chế hoạt động của FoxO1 trong tế bào tuyến bã và tuyến bã của bệnh nhân mụn trứng cá [46]. FoxO1 (Forkhead Box O1) là yếu tố phiên mã trao đổi chất mà từ vị trí hạt nhân của nó ức chế tín hiệu SREBP1 và AR và theo cách này, và theo một số cách khác, đóng vai trò bảo vệ chống lại mụn trứng cá (Hình 9.12) [46]. IGF-1 gây ra sự tăng sinh trong tế bào tuyến bã, và cả insulin và IGF-1 đều gây ra sự biệt hóa của tế bào tuyến bã [46]. Sự biểu hiện của IGF-1 mạnh nhất ở tuyến bã nhờn và kiểu biểu hiện cho thấy vai trò của IGF-1 như một mitogen và morphogen của tuyến bã nhờn [47]. Chiết xuất từ C.acnes (phần màng) làm tăng sự biểu hiện IGF-1 / IGF-1R trong biểu bì của mẫu cấy [48]. IR được báo cáo là làm tăng các phản ứng viêm bên trong và tiếp giáp với mụn trứng cá [49].
Truyền tín hiệu insulin / IGF-1 góp phần hình thành mụn và viêm thông qua việc kích hoạt mTORC1 / SREBP1, làm tăng sản xuất axit palmitic, axit sapienic và axit oleic bởi tuyến bã nhờn, do đó thúc đẩy sự phát triển của C. acnes và hình thành màng sinh học, đồng thời tăng cường biểu hiện lipase triacylglycerol [50].
Truyền tín hiệu insulin / IGF-1 cũng có thể bị ảnh hưởng bởi sự đa hình gen và đột biến gen. Mức độ IGF-1 cao hơn đã được báo cáo ở những bệnh nhân mụn trứng cá đồng hợp tử đối với 192/192 cặp cơ sở alen của gen IGF-1 [51]. Người ta cho rằng những cá nhân đồng hợp tử về gen IGF-1 không chỉ có khả năng bị mụn trứng cá nhiều hơn mà còn có khả năng bị mụn trứng cá nặng hơn [51]. Các dạng IRAA bất thường hoặc nghiêm trọng cũng có thể phát sinh từ các đột biến trên gen INSR mã hóa cho thụ thể insulin [52].
Tăng tín hiệu insulin / IGF-1 làm màu da xấu đi do tác động kết hợp của AN và thay đổi mạch máu da (rối loạn chức năng nội mô, tăng tốc độ xơ vữa động mạch và lắng đọng các sản phẩm cuối cùng của glycation) [53]. Ngoài ra, nó làm tăng sự hình thành hắc tố [53] và tăng sự biểu hiện của α-MSH [54] và POMC [55]. Insulin cũng có tính phân bào đối với tế bào hắc tố in vitro [56].
Xét nghiệm chẩn đoán IRAA
Đầu tiên và quan trọng nhất lúc bắt đầu là xác nhận IR trong một đối tượng mụn nhất định. Tiêu chuẩn vàng của xác nhận IR là kỹ thuật kẹp tăng insulin-euglycemic [57] yêu cầu truyền IV và do đó, không thực tế. Lựa chọn tốt nhất tiếp theo là HOMA-IR (Đánh giá mô hình cân bằng nội môi về kháng insulin) [58], một công thức từ máy tính, trong đó giá trị của đường huyết lúc đói được nhân với giá trị của insulin lúc đói và sản phẩm được chia cho 405 (trong đơn vị đo quy đồng mẫu số là 22,5); giá trị bắt nguồn trên 4,50 được chấp nhận là giả định của IR trên tất cả các quy luật của chăm sóc sức khỏe. Trong nhóm mụn trứng cá, con số này đã được điều chỉnh giảm xuống 2,50 [17] và 2,70 [29]. HOMA2-IR là một mô hình được cập nhật bằng máy tính, được coi là chính xác và đáng tin cậy hơn và có giới hạn cho IR là 1,80 [59, 60].
Thử nghiệm insulin phụ thuộc vào các biến số kỹ thuật như nhãn hiệu của bộ công cụ thử nghiệm và kỹ thuật được sử dụng [61], sự cẩn thận trong việc xử lý mẫu vật và độ chính xác mà thử nghiệm được thực hiện. Một biến số khác là dòng chảy máu được báo cáo là ảnh hưởng đến nồng độ insulin huyết thanh lúc đói và IR [62]. Sự khác biệt trong kết quả xét nghiệm thường gặp trong thực tế của chúng tôi. Hơn nữa, có sự nhầm lẫn là nồng độ bình thường trong huyết thanh lúc đói và insulin PP là bao nhiêu? Phạm vi tham chiếu tiêu chuẩn được sách giáo khoa trích dẫn là <25 μIU/ml đối với insulin lúc đói và 16–166 μIU/ml đối với sau khi nạp insulin 2 giờ [61]. Các phạm vi tham chiếu này dường như bị lệch đối với bệnh tiểu đường và gây hiểu lầm cho các bác sĩ da liễu. Từ một nghiên cứu dịch tễ học ở Hoa Kỳ [63], Johnson và cộng sự kết luận rằng insulin lúc đói lớn hơn 9 μIU / ml được xác định là tiền tiểu đường ở 80% nhóm thuần tập. Một nghiên cứu của Nhật Bản đã công bố mức insulin bình thường là từ 8 đến 11 μIU / ml [64]. Trong một nghiên cứu về IR ở mụn trứng cá nặng ở Thổ Nhĩ Kỳ, insulin lúc đói trung bình ở 156 đối chứng (tuổi trung bình 19,94 ± 4,77 tuổi) được báo cáo là 9,12 ± 3,55 μIU/ml so với 14,01 ± 11,99 μIU/ml đối với các đối tượng mụn trứng cá [29]. Trong một nghiên cứu về IR ở trẻ em và thanh niên mắc AN ở Ấn Độ, insulin lúc đói ở 30 đối chứng bình thường phù hợp với độ tuổi (tuổi 16,06 ± 4,89) được báo cáo là 10,17 ± 3,54 μIU /ml [65]. Insulin sau ăn (và đường) thường không được kiểm tra ở những đối tượng trẻ hơn vì những lý do y đức nhưng được cho là có liên quan đặc biệt trong giai đoạn dậy thì và thanh thiếu niên khi IR toàn bộ cơ thể tăng lên một cách tự nhiên [66]. Trong một nhóm thuần tập gồm 132 bệnh nhân IRAA (93 nữ, 39 nam; 69 dưới 25 tuổi), insulin lúc đói trung bình được tìm thấy là 10,91 ± 6,44 μIU/ml và insulin PP trung bình là 55,41 ± 38,99 (Kubba R, chưa được công bố). Sau nhiều năm tiến hành thử nghiệm insulin ở bệnh nhân mụn trứng cá, chúng tôi nhận thấy insulin huyết thanh lúc đói trên 10 μIU / ml và PP-insulin tăng gấp bốn lần hoặc cao hơn là gợi ý IR và, trong tình trạng mụn trứng cá, các dấu hiệu IR trên da xác định IRAA (tương quan lâm sàng-phòng thí nghiệm; CLC).
Điều trị IRAA
Điều chỉnh chế độ ăn uống và lối sống
Các biện pháp điều trị bổ sung được đảm bảo để giải quyết IR và các rối loạn chuyển hóa toàn thân liên quan ở bệnh nhân IRAA. Mục tiêu điều trị chính là tình trạng tăng insulin máu (Hình 9.13). Bước đầu tiên theo hướng này là tối ưu hóa lối sống, trong đó quản lý cân nặng và kiểm soát chế độ ăn uống là điều tối quan trọng. Giảm trọng lượng có lợi cho mụn trứng cá bằng nhiều cơ chế bao gồm tăng mức adiponectin [67], từ đó ngăn chặn tín hiệu mTORC1 / S6K1 và giảm IR [68]. Thực phẩm chứa đường bao gồm sữa và các sản phẩm từ sữa và chất béo bão hòa giúp tăng cường tín hiệu insulin/ GF-1 [69], hạn chế chúng làm suy yếu tín hiệu mTORC1 [70]. Trong một nghiên cứu có kiểm soát kéo dài 10 tuần, chế độ ăn uống có đường huyết thấp đã được chứng minh là cải thiện mụn trứng cá với việc giảm kích thước tuyến bã nhờn, giảm viêm, giảm SREBP-1 và giảm IL-8 [71]. Nên tăng cường hoạt động thể chất và tập thể dục thường xuyên. Có một số tác nhân điều trị được thiết lập trong việc quản lý bệnh tiểu đường, IR, PCOS và béo phì, phù hợp để tái sử dụng trong điều trị IRAA. Cơ sở lý luận điều trị là tất cả chúng đều ngăn chặn sự kích hoạt của mTORC1 (Bảng 9.3).
Bảng 9.3 Các chất có khả năng ức chế tín hiệu mTORC1 và các chất hỗ trợ trong điều trị IRAA
| EPA (eicosapentaenoic acid) and DHA (docosahexaenoic acid) |
| EGCG (Epigallocatechin-3-gallate) |
| Resveratrol |
| Curcumin |
| N-acetylcysteine |
| Alpha-lipoic acid |
| Myo-inositol |
| Vitamin D3 |
Metformin
Một biguanide, một loại thuốc trị đái tháo đường, là cơ sở chính của việc điều trị IRAA bằng thuốc. Metformin là một loại thuốc nhạy cảm với insulin và cũng là một chất ức chế mTORC1 tuyệt vời [72]. Metformin làm giảm hấp thu glucose qua đường tiêu hóa [73]. Metformin kháng androgen thông qua các cơ chế khác với kháng androgen cổ điển [74]. Metformin có khả năng chống viêm nhờ tác động lên tín hiệu NF-ҡB [75]. Tác dụng có lợi của metformin trong mụn trứng cá, chỉ định off-label, đã được ghi nhận trong một số nghiên cứu lâm sàng quốc tế [76–78]. Metformin được dùng bằng đường uống với liều lượng hàng ngày thay đổi từ 500 mg đến 2500 mg, có thể dùng cho những bệnh nhân trên 10 tuổi và cũng có thể được tiếp tục ở những bệnh nhân nữ bị mụn trứng cá đang có kế hoạch thụ thai hoặc đã thụ thai, được phân nhóm B trên thai kỳ. Liều metformin được chuẩn độ tùy theo đáp ứng điều trị và khả năng dung nạp. Khoảng 20% đối tượng được dùng metformin có G-I. không dung nạp và trong một số lần tăng liều dần dần có thể giúp vượt qua nó [79]. Metformin có độ an toàn tuyệt vời với ít tương tác thuốc. Metformin có thể được kê đơn một cách an toàn với các loại thuốc trị mụn toàn thân gồm kháng sinh, retinoids và kháng androgen. Metformin không gây hạ đường huyết phản ứng ở bệnh nhân không tiểu đường [80]. Prudence cho rằng nên tìm hiểu kỹ dược lý của metformin trước khi bắt đầu kê đơn cho bệnh nhân mụn trứng cá.
Các loại thuốc khác ức chế mTORC1 và có lợi trong IRAA
EPA (axit eicosapentaenoic) và DHA (axit docosahexaenoic) được sử dụng bằng đường uống với liều 1–2 g hàng ngày đã được chứng minh là làm giảm các tổn thương mụn do viêm và không viêm [81], được báo cáo thông qua việc ức chế kích hoạt và giảm tín hiệu mTORC1/SREBP1 [82], 83]. EPA cũng được báo cáo là làm giảm hoạt động của mTORC1 [84]. EGCG (epigallocatechin-3-gallate), có nguồn gốc từ trà xanh, là một chất ức chế mTORC1 khác [85]. EGCG bôi tại chỗ đã được báo cáo là có tác dụng cải thiện mụn trứng cá bằng cách nhắm mục tiêu tăng sản bã nhờn, bội nhiễm C. acnes và viêm nhiễm [86]. Mặc dù con đường MAPK là quan trọng nhất, nhưng EGCG bôi tại chỗ điều chỉnh nhiều mục tiêu phân tử khác bao gồm ức chế con đường IGF-1/PI3K/Akt [86]. Resveratrol, được tìm thấy trong nho và quả berry, ức chế mTORC1 [87]. Resveratrol tại chỗ cũng có tác dụng kháng khuẩn đối với C. acnes [88]. Curcumin, một dẫn xuất của nghệ, nhắm mục tiêu đến cả mTORC1 và mTORC2 theo cách phụ thuộc vào liều lượng [89]. Nghệ cũng có thể cải thiện mụn trứng cá thông qua tác dụng kháng khuẩn, chống viêm và chống đái tháo đường [90]. N- acetylcysteine, một chất chống oxy hóa, đã được thử dùng trong mụn trứng cá cả bôi tại chỗ (đối với comedone) và uống (đối với mụn trứng cá sẩn- mụn mủ) [91] cũng là một chất ức chế mTORC1 [92]. Axit alpha-lipoic, một chất chống oxy hóa khác, là một chất chống tăng đường huyết được công nhận thông qua tác dụng của nó đối với tín hiệu insulin, thông qua việc tăng quá trình phosphoryl hóa tyrosine của IRS-1 và thông qua kích thích chuyển vị GLUT4 (thông qua PI3K / Akt) và kích hoạt GLUT4 (thông qua p38 MAPK) [93]. Axit alpha-lipoic đã được chứng minh là có khả năng ức chế mTORC1 trong các thí nghiệm trên động vật [94]. Myo-inositol (một trong chín đồng phân của inositol) là một thành phần của phức hợp vitamin B, và là một chất nhạy cảm insulin được công nhận; nó cải thiện tín hiệu insulin và làm giảm insulin huyết thanh [95]. Myo-inositol được khuyên dùng trong PCOS (đặc biệt là ở thanh thiếu niên), nơi nó có tác dụng kháng nội tiết tố tương đương với OCP và cải thiện các thông số trao đổi chất [96]. Ở cấp độ phân tử, inositol polyphosphat điều chỉnh sự hoạt hóa của mTOR để đáp ứng với các axit amin thiết yếu, và cũng liên quan đến các con đường tín hiệu AMPK [97].
Vitamin D3 và IRAA
Thiếu vitamin D3 phổ biến ở các khu vực địa lý bị ô nhiễm không khí và tạo thành một yếu tố gây nhiễu quan trọng trong cơ chế bệnh sinh của IRAA. Thiếu vitamin D có liên quan đến rối loạn chức năng IR và tế bào ẞ [98]. Nâng mức vitamin D từ 10 ng/dl lên 30 ng/dl được cho là cải thiện độ nhạy insulin lên 60% [99]. Điều chỉnh tình trạng thiếu hụt vitamin D trong mụn trứng cá có thể làm giảm tín hiệu mTORC1, tăng biểu hiện của peptide kháng khuẩn cathelicidin, và do đó ức chế C. acnes [99, 100]. Các tác nhân nói trên trong phần này (Bảng 9.3) là các chất bổ sung dinh dưỡng có bán tại hiệu thuốc. Chúng là chất bổ trợ và cung cấp phạm vi cho các kế hoạch điều trị IRAA rộng hơn, sáng tạo và phù hợp.
Tóm tắt
IRAA là một tập hợp con của mụn do insulin có đặc điểm lâm sàng đặc biệt, các hình thái đi chung, nhiều bệnh đi kèm, diễn tiến dai dẳng và tăng insulin máu. IRAA dường như đứng giữa di truyền, proteomics, transcriptomics và chuyển hóa. Dấu hiệu chuyển hóa của nó được biểu hiện bằng mTORC1 [2]. IRAA có liên quan về dinh dưỡng, trao đổi chất, nội tiết tố và miễn dịch mà cho đến nay vẫn chưa được thể hiện trong tài liệu về mụn trứng cá. Là một tình trạng chuyển hóa toàn thân, nó đòi hỏi sự tham gia, phác hoạ và quản lý toàn diện. Nó cũng mang đến một cơ hội duy nhất cho các bác sĩ da liễu để “ngăn chặn cuộc hành quân của MetS” [2].
Tài liệu tham khảo
- Cordain L, Lindeberg S, Hurtado M, et Acne vulgaris: a disease of western civilization. Arch Dermatol. 2002;138:1584–90.
- Melnik BC. Acne vulgaris: the metabolic syndrome of pilosebaceous follicle. Clin Dermatol. 2018;36:29–
- Gonzalez-Salvidar G, Rodriguez-Gutierrez R, Ocampo-Candiani J, et al. Skin manifestations of insulin resistance: from a biochemical stance to a clinical diagnosis and Dermatol Ther. 2017;7:37–51.
- Housman E, Reynolds RV. Polycystic ovary syndrome: a review for dermatologists. Part I. Diagnosis and J Am Acad Dermatol. 2014;71:847–56.
- Kubba R. Acne in dark skin people. In: Schwartz RA, Micali G, editors. Acne. Gurgaon: Macmillan; p. 39–50.
- Kubba R, Chatrath V. Acne expression and management in Indians. World Clin Dermatol. 2013;1:105–
- Zouboulis CC, Okoro E, Kubba R. Acne in dark skin. In: Orfanos CE, Zouboulis CC, Assaf C, editors. Pigmented ethnic skin and imported Germany: Springer; 2018. p. 203–17.
- Draznin B. Mechanism of the mitogenic infuence of hyperinsulinemia. Diabetol Metab Syndr. 2011;3:10–
- Denley A, Cosgrove L, Booker GW, et al. Molecular interactions of the IGF system. Cytokine Growth Factor 2005;16:421–39.
- Cordain L, Eades MR, Eades Hyperinsulinemic diseases of civilization: more than just syndrome
- Comp Biochem Physiol. 2003;136:95–112.
- Thibutot DM, Strauss Diet and acne revisited (editorial). Arch Dermatol. 2002;138:1591–2.
- Caron A, Richard D, Laplante M. The role of mTOR complexes in lipid metabolism. Ann Rev Nutr. 2015;35:321–48.
- Monfrecola G, Lembo S, Caiazzo G, et al. Mechanistic target of rapamycin (mTOR) expression is increased in acne patients’ Exp Dermatol. 2016;25:153–5.
- Agamia NF, Abdallah DM, Sorour O, et al. Skin expression of mammalian target of rapamycin and forkhead box transcription factor O1 in patients with acne vulgaris and their relationship with diet. Br J 2016;174:1299–307.
- Mirdamadi Y, Thielitz A, Wiede A, et al. Insulin and insulin-like growth factor-1 can modulate the phosphoinositide-3-kinase/Akt/FoxO1 pathway in SZ95 sebocytes in Mol Cell Endocrinol. 2015;415:32–44.
- Homburg Polycystic ovary syndrome. Clin Obstet Gynecol. 2008;22:261–74.
- Dibble CC, Cantley Regulation of mTORC1 by PI3K signalling. Trends Cell Biol. 2015;25:545–55.
- Kaymak Y, Adisen E, Ilter N, et al. Dietary glyce- mic index and glucose, insulin, insulin-like growth factor-1, insulin-like growth factor binding protein 3, and leptin levels in patients with acne. J Am Acad 2007;57:819–23.
- Nagpal M, De D, Handa S, Sachdeva N. Insulin resistance and metabolic syndrome in young men with JAMA Dermatol. 2016;152:399–404.
- Kumari R, Thappa DM. Role of insulin resistance and diet in acne. Indian J Dermatol Venereol Leprol. 2013;79:291–9.
- Del Prete M, Mauriello MC, Faggiano A, et al. Insulin resistance and acne: a new risk factor for men? 2012;42:555–60.
- Vora S, Ovhal A, Jerajani H, et al. Correlation of facial sebum to serum insulin-like growth factor-1 in patients with acne. Br J 2008;159:990–1.
- Svetlana T, Maclaren Insulin resistance syn- drome in children. J Clin Endocrinol Metab. 2004;89:2526–34.
- Krutmann J, Moyal D, Liu W, Kandhari S, et al. Pollution and Acne: is there a link? Clin Cosmet Investig 2017;10:199–204.
- Haberzettl P, McCracken JP, Bhatnagar A, Conklin Insulin sensitizers prevent fne particulate matter- induced vascular insulin resistance and changes in endothelial progenitor cell homeostasis. Am J Physiol Heart Circ Physiol. 2016;310:1423–38.
- Idkowiak J, Lavery GG, Dhir V, et al. Premature adrenarche: novel lessons from early onset androgen Eur J Endocrinol. 2011;165:189–207.
- Oppenheimer E, Linder B, DiMartino-Nardi J. Decreased insulin sensitivity in prepubertal girls with premature adrenarche and acanthosis J Clin Endocrinol Metab. 1995;80:614–8.
- Panda S, Das A, Lahiri K, et al. Facial acanthosis nigricans: morphological marker of metabolic syn- Indian J Dermatol. 2017;62:591–7.
- Emiroglu N, Cengiz FP, Kemeriz F. Insulin resis- tance in severe acne vulgaris. Postep Derm Alergol. 2015;32:281–5.
- Sanke S, Chander R, Jain A, et A comparison of the hormonal profle of early androgenetic alopecia in men with the phenotypic equivalent of polycystic ovarian syndrome in women. JAMA Dermatol. 2016;152:986–91.
- Dunaif A. Insulin resistance and the polycystic ovary syndrome: mechanisms and implications for patho- Endocr Rev. 1997;18:774–800.
- Globerman H. Analysis of the insulin receptor gene tyrosine kinase domain in obese patients with hyperandrogenism, insulin resistance, and acan- thosis nigricans. Int J Obes Relat Metab Discord. 1998;22:349–53.
- Barbieri RL, Ryan KJ. Hyperandrogenism, insu- lin resistance and acanthosis nigricans syndrome. A common endocrinopathy with distinct patho- physiologic features. Am J Obstet Gynecol. 1983;137:90–
- Sinha S, Schwartz Juvenile acanthosis nigricans (review). J Am Acad Dermatol. 2007;57:502–8.
- Lopez-Alvarenga JC, Gardia-Hidalco L, Landa- Anell MV, et Infuence of skin color on the diagnostic utility of clinical acanthosis nigricans to predict insulin resistance in obese patients. Arch Med Res. 2006;37:744–8.
- Verma SB, Wollina U. Acne keloidalis nuchae: another cutaneous symptom of metabolic syndrome, truncal obesity, and impending/overt diabetes mel- litus? Am J Clin 2010;11:433–6.
- Kubba Acne comorbidities. World Clin Dermatol. 2013;1:155–68.
- Chiu KC, Chu A, Go VL, Saad MF. Hypovitaminosis D is associated with insulin resistance and beta cell Am J Clin Nutr. 2004;79:820–5.
- Reichrath Vitamin D and the skin: an ancient friend revisited. Exp Dermatol. 2007;16:618–25.
- Schmuth M, Watson RE, Deplewski D, et al. Nuclear hormone receptors in human skin. Horm Metab 2007;39:96–105.
- Reichrath J, Lehmann B, Carlberg C, et Vitamins as hormones. Horm Metab Res. 2007;39:71–84.
- Jasim ZF, McKenna Vitamin B12 and folate defciency anaemia associated with isotretinoin treatment for acne. Clin Exp Dermatol. 2006;31:599.
- Karadag AS, Tutal E, Ertugrul DT, Akin Effect of isotretinoin treatment on plasma holotranscobalamin, vitamin B12, folic acid, and homocysteine levels: non-controlled study. Int J Dermatol. 2011;50:1564–9.
- Calvo Romero JM, Ramiro Lozano Vitamin B (12) in type 2 diabetic patients treated with metformin. Endocrinol Nutr. 2012;59:487–90.
- Cong TX, Hao D, Wen X, et al. From pathogenesis of acne vulgaris to anti-acne agents. Arch Dermatol 2019;311:337–49.
- Melnik BC. FoxO1 – the key for the pathogen- esis and therapy of acne. J Dtsch Dermatol Ges. 2010;8:105–14.
- Rudman SM, Philpott MP, Thomas GA, Kealey The role of IGF-I in human skin and its append- ages: morphogen as well as mitogen? J Invest Dermatol. 1997;109:771–7.
- Isard O, Knol AC, Aries MF, et al. Propionibacterium acnes activates the IGF-1/IGF-1R system in the epidermis and induces keratinocyte J Invest Dermatol. 2011;131:59–66.
- Shoelson SE, Lee J, Goldfne Infammation and insulin resistance. J Clin Invest. 2006;116:1793–801.
- Stewart ME, Grahek MO, Cambier LS, et al. Dilutional effect of increased sebaceous gland activity on the proportion of linoleic acid in sebaceous wax esters and in epidermal J Invest Dermatol. 1986;87:733–6.
- Rahman MA, De D, Handa S, et al. Association of insulin-like growth factor (IGF)-1 gene polymor- phisms with plasma levels of IGF-1 and acne sever- J Am Acad Dermatol. 2016;75:768–73.
- Krishnamurthy M, Pingul MM. A novel insulin receptor mutation in an adolescent with acantho- sis nigricans and hyperandrogenism. J Pediatr Endocrinol 2016;29:1201–5.
- Hung-Yuan C, Tze-Wah K, Yen-Lin C, et al. Skin color is associated with insulin resistance in non- diabetic peritoneal dialysis Perit Dial Int. 2009;29:458–64.
- Costa JL, Hochgeschwender U, Brennan M. The role of melanocyte-stimulating hormone in insulin resis- tance and type 2 diabetes Treat Endocrinol. 2006;5:7–13.
- Mountjoy KG, Wong Obesity, diabetes and func- tions for pro-opiomelanocortin-derived peptides. Mol Cell Endocrinol. 1997;128:171–7.
- Abdel-Naser MB. Mitogen requirements of nor- mal epidermal human melanocytes in a serum and tumour promoter free Eur J Dermatol. 2003;13:29–33.
- DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: a method for quantifying insulin secre- tion and resistance. Am J 1979;237:214–23.
- Matthews DR, Hosker JP, Rudenski AS, et al. Homeostasis model assessment: insulin resis- tance and beta cell function from fasting glucose and insulin concentrations in Diabetologia. 1985;28:412–9.
- Levy JC, Matthews DR, Hermans MP. Correct homeostasis model assessment (HOMA) evalua- tion uses the computer program. Diabetes 1998;21:2191–2.
- Safar FH, Mojiminiyi OA, Al-Rumaih HM, Diejomaoh MF. Computational methods are signifcant determinants of the associations and defnitions of insulin resistance using the homeostasis model assessment in women of reproductive Clin Chem. 2011;57:279–85.
- Melmed S, Polonsky KS, Larsen PR, Kronenberg HM. Williams textbook of endocrinology. 13th ed. Philadelphia: Elsevier-Saunders;
- Yoshida K, Kimura T, Aoki T, et al. Fasting serum insulin levels and insulin resistance are associated with blood rheology in Japanese young adults with- out J Int Med Res. 2016;44:496–507.
- Johnson JL, Duick DS, Chui MA, Aldasouqi SA. Identifying prediabetes using fasting insulin levels. Endocr 2010;16:47–52.
- Iwase H, Kobayashi M, Nakajima M, Takatori T. The ratio of insulin to C-peptide can be used to make a forensic diagnosis of exogenous insulin Forensic Sci Int. 2001;115:123–7.
- Nithun TM, Ranugha PSS, Betkerur JB, Shastry Association of acanthosis nigricans and insulin resistance in Indian children and youth – a HOMA2-IR based cross-sectional study. Indian Dermatol Online J. 2019;10:272–8.
- Moran A, Jacobs DR, Steinberger J, et al. Insulin resistance during puberty: results from clamp studies in 357 Diabetes. 1999;48: 2039–44.
- Yang W-S, Lee W-J, Funahashi T, et al. Weight reduction increases plasma levels of an adipose- derived anti-infammatory protein, J Clin Endocrinol Metab. 2001;86:3815–9.
- Ruan H, Dong LQ. Adiponectin signalling and function in insulin target tissues. J Mol Cell Biol. 2016;8:101–9.
- Melnik BC. Linking diet to acne metabolomics, infammation, and comedogenesis: an update. Clin Cosmet Investig Dermatol. 2015;8:371–88.
- Melnik BC. Dietary intervention in acne. Attenuation of increased mTORC1 signaling promoted by west- ern diet. Dermat 2012;4:20–32.
- Kwon HH, Yoon JY, Hong JS, et al. Clinical and histological effect of a low glycaemic load diet in treatment of acne vulgaris in Korean patients: a randomized controlled trial. Acta Derm Venereol. 2012;92:241–6.
- Melnik BC, Schmitz G. Metformin: an inhibitor of mTORC1 signaling. J Endocrinol Diabetes Obes 2014;2:1029.
- Foretz M, Guigas B, Bertrand L, et al. Metformin: from mechanisms of action to therapies. Cell Metab. 2014;20:953–66.
- Malaguarnera R, Sacco A, Morcavallo A, et al. Metformin inhibits androgen-induced IGF-IR up- regulation in prostate cancer cells by disrupt- ing membrane-initiated androgen Endocrinology. 2014;155:1207–21.
- Cameron AR, Morrison VL, Levin D, et al. Antiinfammatory effects of metformin irrespective of diabetes status. Circ 2016;119:652–65.
- Tan S, Hahn S, Benson S, et al. Metformin improves polycystic ovary syndrome symptoms irrespective of pre-treatment insulin resistance. Eur J Endocrinol. 2007;157:669–76.
- Fabbrocini G, Izzo R, Faggiano A, Del Prete M, et al. Low glycemic diet and metformin therapy: a new approach in male subjects with acne resis- tant to common treatments. Clin Exp Dermatol. 2016;41:38–
- Robinson S, Kwan Z, Tang MM. Metformin as an adjunct therapy for the treatment of moderate to severe acne vulgaris: a randomized open-label Dermatol Ther. 2019; May 1(epub).
- Lashen H. Role of metformin in the management of polycystic ovary syndrome. Ther Adv Endocrinol 2010;1:117–28.
- Bailey CJ. Metformin: historical overview. Diabetologia. 2017;60:1566–76. 81. McCusker MM, Grant- Kels JM. Healing fats of the skin: the structural and immunologic roles of the omega-6 and omega-3 fatty Clin Dermatol. 2010;28:440–51.
- Jung JY, Kwon HH, Hong JS, et al. Effect of dietary supplementation with omega-3 fatty acid and gamma-linolenic acid on acne vulgaris: a ran- domized, double-blind, controlled Acta Derm Venereol. 2014;94:521–5.
- Yan Y, Jiang W, Spinetti T, et al. Omega-3 fatty acids prevent infammation and metabolic disorder through inhibition of NLRP3 infammasome Immunity. 2013;38:1154–63.
- Yasuda M, Tanaka Y, Kume s, et al. Fatty acids are novel nutrient factors to regulate mTORC1 lysosomal localization and apoptosis in Biochim Biophys Acta. 2014;1842:1097–108.
- Van Aller GS, Carson JD, Tang W, et al. Epigallocatechin gallate (EGCG), a major component of green tea, is a dual phosphoinositide- 3-kinase/mTOR Biochem Biophys Res Commun. 2011;406:194–9.
- Yoon JY, Kwon HH, Min SY, et al. Epigallocatechin- 3-gallate improves acne in humans by modulating intracellular molecular targets and inhibiting acnes. J Invest Dermatol. 2013;133:429–40.
- Park D, Jeong H, Lee MN, et al. Resveratrol induces autophagy by directly inhibiting mTOR through ATP competition. Sci 2016;6:21772.
- Taylor EJM, Yu Y, Champer J, Kim Resveratrol demonstrates antimicrobial effects against Propionibacterium acnes in vitro. Dermatol Ther. 2014;4:249–57.
- Beevers CS, Zhou H, Huang S. Hitting the golden TORget: curcumin’s effects on mTOR signalling. Anti Cancer Agents Med Chem. 2013;13:988–94.
- Clark AK, Haas KN, Sivamani RK. Edible plants and their infuence on the gut microbiota and acne. Int J Mol 2017;18:1071–85.
- Adil M, Amin SS, Mohtashim M. N-acetylcysteine in dermatology. Ind J Dermatol Venereol Leprol. 2018;84:652–9.
- Lai Z-W, Hanczko R, Bonilla E, et al. N-acetylcysteine reduces disease activity by blocking mTOR in T cells of lupus Arthritis Rheum. 2012;64:2937–46.
- Konrad D, Somwar R, Sweeney G, et al. The anti- hyperglycemic drug alpha-lipoic acid stimulates glucose uptake via both GLUT4 translocation and GLUT4 activation. Potential role of p38 Mitogen- Activated Protein Kinase in GLUT4 Diabetes. 2001;50:1464–71.
- Li Z, Dungan CM, Carrier B, et al. Alpha-lipoic acid supplementation reduces mTORC1 signaling in skeletal muscle from high fat fed obese Zucker Lipids. 2014;49:1193–201.
- Lauretta R, Lanzolla G, Vici P, et al. Insulin- sensitizers, polycystic ovary syndrome and gynaecological cancer Int J Endocrinol. 2016;2016:867162.
- Pkhaladze L, Barbakadze L, Kvashilava N. Myo- inositol in the treatment of teenagers affected by Int J Endocrinol. 2016; Article ID 1473612, 6 pages.
- Lee J-Y, Kim Y-R, Park J, Kim S. Inositol polyphosphate multikinase signalling in the regulation of Ann N Y Acad Sci. 2012;1271:68–74.
- Chiu KC, Chu A, Go VLW, et al. Hypovitaminosis D is associated with insulin resistance and beta cell Am J Clin Nutr. 2004;79:820–5.
- Lee WJ, Cha HW, Sohn MY, et al. Vitamin D increases expression of cathelicidin in cultured sebocytes. Arch Dermatol 2012;304:627–32.
- Lee DY, Yamasaki K, Rudsil J, et al. Sebocytes express functional cathelicidin antimicrobial peptides and can act to kill propionibacterium J Invest Dermatol. 2008;128:1863–6.