Sản xuất Dược phẩm
Các chất độc vô cơ: nguyên nhân gây độc, triệu chứng và cách xử trí
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: Giáo sư. Tiến sĩ Dược sĩ Thái Nguyễn Hùng Thu.
Bài viết các chất độc vô cơ trích trong chương 2 sách Độc chất học – giáo trình đào tạo dược sĩ đại học bộ môn Độc chất trường Đại học Dược Hà Nội.
Mục tiêu học tập
- Trình bày được nguyên nhân gây ngộ độc và độc tính của một số kim loại và nguyên tố độc (thủy ngân, chì, arsen, bari), khí độc, acid vô cơ và kiềm mạnh.
- Giới thiệu được triệu chứng ngộ độc, cách xử trí ngộ độc và các biện pháp đề phòng nhiễm độc các hợp chất vô cơ kể trên.
- Trình bày được nguyên tắc của những phương pháp có thể phân tích các chất độc đã nêu trên.
1. Các kim loại và nguyên tố độc
Một số nguyên tố được Tổ chức Y tế Thế giới (WHO) xếp vào nhóm độc loại A gồm: Hg, Pb, Se, Cd, As. Ngoài ra còn một số nguyên tố khác thường có mặt trong môi trường và được dùng trong y học nhưng cũng có thể gây độc cho con người. Dưới đây là nguyên nhân ngộ độc, cơ chế gây độc, triệu chứng, cách xử trí và phương pháp phân tích một số nguyên tố này.
1.1. Thủy ngân
1.1.1. Các dẫn chất và nguyên nhân ngộ độc
Thủy ngân nguyên tố là kim loại lỏng, dễ bốc hơi ở nhiệt độ thường. Nồng độ hơi thủy ngân bão hoà ở nhiệt độ 20°C là 20mg/m3 nên có thể gây ngộ độc qua đường hô hấp. Ở nhiệt độ thường, thủy ngân lỏng hầu như không tan trong nước (5 μg/L ở 25°C). Thủy ngân cũng không tan trong dung dịch acid hydrocloric loãng, acid sulfuric nguội và dung dịch kiềm, tan một phần trong lipid, pentan, acid nitric đặc và acid sulfuric đặc nóng.
Thuỷ ngân là nguyên tố chỉ chiếm 8.10-6% (80 μg/kg) trọng lượng Trái đất. Trong tự nhiên thủy ngân có thể tồn tại ở các dạng như:
– Dạng kim loại lỏng hay hơi trong không khí.
– Dạng hợp chất vô cơ trong các quặng như cinnabar (dạng sunfid), trong các khoáng vật như: thần sa (HgS), timanic (HgSe), colodoit (HgTe), livingstonite (HgSb4O7), calomel (Hg2Cl2)…
– Thủy ngân có thể kết hợp với carbon tạo thành họp chất thủy ngân hữu cơ như: dimethyl thủy ngân, phenyl thủy ngân, ethyl thủy ngân và phổ biến nhất là methyl thủy ngân. Thủy ngân hữu cơ là nguyên nhân chính gây ô nhiễm thủy sinh vật.
Một số vi sinh vật có thể biến đổi thủy ngân vô cơ thành methyl thủy ngân tích lũy sinh học trong các loại cá lớn ăn thịt. Trong vụ ngộ độc do ăn cá nhiễm thủy ngân ở vịnh Minamata những năm 60 của thế kỷ XX, người ta đã phát hiện các ở vịnh này có hàm lượng thủy ngân 27-103ppm dưới dạng methyl thủy ngân. Nước ở vịnh bị nhiễm thủy ngân là do nước thải của một nhà máy sản xuất vinyl clorid của công ty hóa chất Minamata.
Thủy ngân được ứng dụng rộng rãi trong đời sống và sản xuất công nghiệp. Một lượng lem thủy ngân được sử dụng làm điện cực, trong công nghiệp sản xuất CỈ2 và NaOH băng phương pháp điện phân. Thủy ngân cũng được sử dụng trong nhiều nhà máy sản xuât thiết bị điện: đèn thuỷ ngân cao áp, bóng đèn X-quang, pin, dụng cụ ngắt điện… Ngoài ra thủy ngân còn được sử dụng trong xử lý quặng vàng, bạc, dùng để chế các hôn hông, các máy đo (nhiệt kế, áp kế, điện cực calomel…).
Từ xa xưa thủy ngân đã được sử dụng làm thuốc: chu sa, thần a (HgS) là vị thuốc có công dụng trấn tâm, an thần. Thủy ngân clorid (HgCl2), thủy ngân oxid (HgO), thủy ngân iodid (Hgl2), thủy ngân (I) acetat, thủy ngân (I) clorid (Hg2Cl2) được dùng làm thuốc sát trùng, diệt nấm và vi khuẩn, thuốc lợi tiểu, thuốc nhuận tràng. Thủy ngân nitrat (Hg(NO3)2 thường dùng dạng dung dịch trong acid nitric để đốt cháy chỗ viêm. Trước đây, người ta cũng dùng Hg(CN)2để điều trị giang mai, mercurochrom, thimarosal dùng làm thuốc sát trùng… Một số thủy ngân vô cơ được dùng trong sản xuất xà phòng và kem làm trắng da hay hỗn hống thủy ngân dùng trong nha khoa.
Diethyl thủy ngân, ethyl thủy ngân clorid (Cl-Hg-C2H5), ethyl thủy ngân phosphat, methyl thủy ngân nitrit… làm thuốc trừ sâu, trừ nấm.
Do có khả năng bay hơi ở điều kiện thường, thuỷ ngân bốc hơi từ đất, đá, nước vào không khí rồi được gió, dòng chảy sông suối vận chuyển đi khắp nơi. Các hoạt động như khai thác mỏ, nấu kim loại, sản xuất xi măng, ngành công nghiệp sử dụng than làm nguồn nhiên liệu, hoả táng, xử lý hoá chất và chất thải y tế, tinh chế vàng…. góp phần gây ô nhiễm thủy ngân một cách đáng kể. Các sinh vật dưới nước (cá, tôm, cua, sò, hến…) tích luỹ thuỷ ngân trong cơ thể chúng, thường là dạng methyl thủy ngân rất độc. Thuỷ ngân cũng được tích luỹ trong giun đất và có chứa trong một số loài nấm. Ngộ độc thủy ngân có thể do các nguyên nhân sau:
- Do cố ý: các trường họp đầu độc rất hiếm vì nó có mùi vị khó chịu, tuy nhiên vẫn có trường hợp tự tử bằng thủy ngân.
- Do tai biến: nhàm lẫn hay vô ý, ăn phải cá có nhiễm thủy ngân, ngũ cốc được xử lý nấm bằng chất trừ nấm có thủy ngân hoặc dùng quá liều các dược phẩm (chu sa để an thần, thuốc mỡ có thủy ngân hay thuốc đỏ ở vết thương diện rộng…).
- Do nghề nghiệp: công nhân làm việc nơi phải thường xuyên tiếp xúc với thủy ngân có khả năng bị ngộ độc trường diễn.
- Do ô nhiễm môi trường: Trong tự nhiên, thủy ngân là nguyên tố vết. Trong than đá có khoảng 100 ppb, trong các quặng 80 ppb, trong đất canh tác khoảng 0,1 ppm. Tuy nhiên hoạt động của con người đã đưa nhiều thủy ngân vào môi trường như: sản xuất NaOH bằng điện phân với điện cực thủy ngân, sản xuất giấy dùng phenyl thuỷ ngân diệt nấm mốc, dùng nhiều thuốc trừ sâu, diệt nấm có thủy ngân phun lên cây trồng, từ các vật liệu phế thải có thủy ngân như nhiệt kế, bóng đèn huynh quang…
Thủy ngân không có chức năng gì trong chuyển hoá ở cơ thể người và động vật. Nếu thức ăn, nước uống bị ô nhiễm bởi thủy ngân, khi sử dụng sẽ bị ngộ độc. Các muối Hg đa dạng: vô cơ, hữu cơ, khi vào nước nhiều vi khuẩn yếm khí sẽ chuyển methan thành methyl thủy ngân. Quá trình chuyển hoá ngày càng trở nên dê dàng khi có mặt coenzym chứa vitamin B12. Gốc này dễ tan trong nước, tập trung ở thực vật nổi, rồi vào cá và được cô đặc đến 1000 lần, cuối cùng theo chuỗi thực phẩm đi vào cơ thể người.
Thủy ngân có thể được hấp thu qua da, đường hô hấp và tiêu hóa.
1.1.2. Độc tính, cơ chế gây độc, triệu chứng và cách xử trí
Độc tính, cơ chế gây độc:
Độc tính tùy thuộc vào dạng hợp chất có thủy ngân và đường tiếp xúc.
Thủy ngân kim loại chỉ độc ở thể hơi vì thể lỏng hấp thu rất ít qua đường tiêu hóa. Hơi thủy ngân hấp thu nhanh qua đường hô hấp. Gần 80% hơi thủy ngân hít vào được giữ ngay lại cơ thể, hấp thu vào phổi và từ đó xâm nhập vào não gây rối loạn thân kinh trung ương.
Thủy ngân vô cơ khó xâm nhập vào cơ thể (dưới 0,001 %) và ít ảnh hưởng tới hệ thần kinh trung ương, bào thai. Tuy nhiên nếu ăn phải một lượng lớn thủy ngân vô cơ cũng gây tổn thương thận.
Thủy ngân dưới dạng ion Hg2+ rất độc. Nó tác dụng lên nhóm – SH của các hệ thống enzym cơ bản. Liều độc của HgCl2 với người lớn là 0,2-0,3g. Với liều 0,4 – 1,0 mg hàng ngày và liên tục trong thời gian dài có thể gây ngộ độc trường diễn.
Các hợp chất thủy ngân hữu cơ ít độc hơn, chúng gây rối loạn tiêu hoá, chức năng thận và thần kinh. Thủy ngân hữu cơ thường được tích lũy trong các chuỗi thực phẩm đặc biệt tích lũy trong cá với nồng độ cao gấp hàng nghìn lần so với lúc đầu. Khi liên kết với cystein (một loại acid amin có chứa nhóm SH) thủy ngân methyl dễ dàng hấp thu qua đường tiêu hóa. Do dễ hòa tan trong mỡ nên hợp chất này có thể xâm nhập vào hệ thần kinh trung ương gây rối loạn hoạt động các cơ quan. Mặt khác cần hết sức chú ý với phụ nữ mang thai vì sự hấp thụ methyl thủy ngân của bào thai nhạy cảm hơn người lớn rất nhiều: gây ra sự phá hoại không hồi phục hệ thần kinh trung ương bao gồm sự phân liệt thần kinh, kém phát triển trí tuệ, co giật. Nhiễm methyl thủy ngân cũng dẫn đến nhiễm sắc thể bị phân lập, phá vỡ nhiễm sắc thể và ngăn cản sự phân chia tế bào.
Cơ chế gây độc của thủy ngân là làm thoái hóa tổ chức vì tạo nên các phức hợp protein rất tan, ức chế enzym do tác dụng lên nhóm SH gây rối loạn chuyển hóa màng tế bào. Kết quả nghiên cứu cho thấy dù xâm nhập vào cơ thể qua đường nào thì thủy ngân cũng qua máu và tích lũy nhiều nhất ở thận. Hầu hết các dạng thủy ngân sau khi xam nhập vào các tổ chức đều tích lũy dưới dạng ion Hg2+. Thủy ngân (II) không qua được màng sinh học nhưng do có áị lực mạnh với nguyên tử s nên nó dễ dàng kết họp với cằc acid amin chứa s của protein (hemoglobin, albumin). Đặc biệt nó lam bất hoạt các enzym có chứa nhóm thiol cần thiết cho cơ thể theo phan ứng sau: 2+
HS SH + HgCl2 ⇒ S-Hg-S + 2HCl
Dựa vào đặc tính trên của Hg2+ người ta đưa ra biện pháp điều trị nhiễm độc thủy ngân đặc hiệu bằng các chất chứa nhóm thiol có ái lực mạnh với thủy ngân như BAL(British anti-Lewisite, dimercaprol, HS-CH2-CH(SH)-CH2OH), DMSA (2,3 dimercapto succinic acid, HOOC-CH(SH) CH(SH)-COOH).
Triệu chứng:
Khi bị ngộ độc cấp:
– Do hít phải hơi thủy ngân: gây kích ứng phổi, viêm nướu cấp tính, nồng độ cao có thể viêm phổi nặng và phù phổi.
– Do muối thủy ngân qua đường tiêu hóa (đặc biệt là HgCl2 ):
+ Rối loạn tiêu hóa: có cảm giác cháy rát ở miệng, thực quản dạ dày và có vị kim loại khó chịu; xuất huyết tiêu hóa, nôn ra chất nhầy và máu, đau bụng tiêu chảy, phân có máu, hoại tử ruột, sốc, chết sau vài giờ do trụy tim mạch.
+ Viêm nướu do Hg được đào thải qua nước bọt, tiết nước bọt nhiều, hoi thở hôi, răng bị lung lay. Triệu chứng này thường xuất hiện vào ngày thứ ba, sau khi các triệu chứng trên đã giảm và có giá trị chẩn đoán lớn.
+ Tổn thương thận: suy thận cấp do hoại tử ống thận có thể xảy ra trong vài ngày với các triệu chứng viêm thận, tiểu ít hay bí tiểu. Sau đó ure huyết tăng, thân nhiệt giảm, hôn mê và chết.
Nếu qua khỏi nạn nhân cũng khó hồi phục vì phủ tạng bị hủy hoại nặng do thủy ngân đào thải chậm.
Khi ngộ độc trường diễn:
– Do hít phải hơi thủy ngân: run tay, đau đầu chi, rối loạn tâm thần (nhức đầu, mệt mỏi, mất ngủ, biêng ăn, bồn chồn, mất trí nhớ, dễ bị kích thích), viêm nướu và miệng, tiết nước bọt nhiều.
– Do muối thủy ngân qua đường tiêu hóa: có vài triệu chứng như ngộ độc cấp tính nhưng nhẹ hơn; xuất hiện viền đen ở nướu kéo dài và vài triệu chứng ve thần kinh như hàm run, tay chân run, rối loạn tâm thần.
– Do ngộ độc các họp chất thủy ngân hữu cơ: methyl thủy ngân tác động chủ yếu trên hệ thần kinh trung ương gây hội chứng rối loạn vận động, rối loạn phát âm, giảm thính lực. Methyl thủy ngân là chất gây quái thai mạnh, gây hội chứng phát triển tâm thần. Ethyl thủy ngân có thể gây viêm dạ dày ruột.
Xử trí:
Ngộ độc muối thủy ngân qua đường tiêu hóa:
– Loại chất độc ra khỏi cơ thể: Rửa dạ dày bằng nước pha lòng trắng trứng hoặc rongalit (sodium oxymethylen sulfoxylat H0-CH2S02–Na+) để chuyển muối thủy ngân thành thủy ngân ít hấp thu; uống than hoạt.
– Trung hòa chất độc:
+ Thủy ngân kim loại: uống lòng trắng trứng, sữa kết hợp rửa dạ dày để tránh họp chât đó tan lại. Sử dụng antidote uống DMSA để tăng đào thải qua nước tiểu. Chú ý không dùng BAL cho ngộ độc hơi thủy ngân và Hg hữu cơ vì có thể tái phân bố từ các mô khác đến não.
+ Muối Hg vô cơ: Tiêm bắp BAL trong vòng vài giờ có thể làm giảm tổn thương trên thận, uống DMSA nên kết họp với sử dụng BAL. Truyền hay tiêm tĩnh mạch chậm rongalit.
+ Thủy ngân hữu cơ: uống DMSA để làm giảm nồng độ thủy ngân trong mô nhất là mồ não.
– Chữa triệu chứng: chống viêm thận (uống nhiều nước, truyền glucose), chạy thận nhân tạo (nêu vô niệu); cần thiết có thể thẩm phân máu trong 1 -2 tuần; dùng thuốc trợ tim.
1.1.3. Phương pháp phân tích
Định tính:
– Tạo hỗn hống với đồng kim loại: có thể thực hiện trực tiếp trên mẫu thử chưa vô cơ hoá. Acid hoá mẫu bằng acid hydrocloric, cho vào bình một mảnh đồng kim loại (đã cạo sạch và rửa bằng acid nitric loãng rồi nước cất), đun nóng khoảng 1 giờ. Nếu có Hg2+ thì trên bề mặt mảnh đồng sẽ có lớp thuỷ ngân kim loại sáng bóng. Để khẳng định có thể làm thêm phản ứng tạo thủy ngân iodid (màu hồng) từ hỗn hong thủy ngân đong trên mảnh đồng với iod tinh thể hoặc Cu2l2.
– Phản ứng với dithizon: các muối Hg2+ tạo với dithizon một hợp chất phức màu vàng cam bền vững. Phản ứng tạo phức của dithizon với kim loại X như sau:
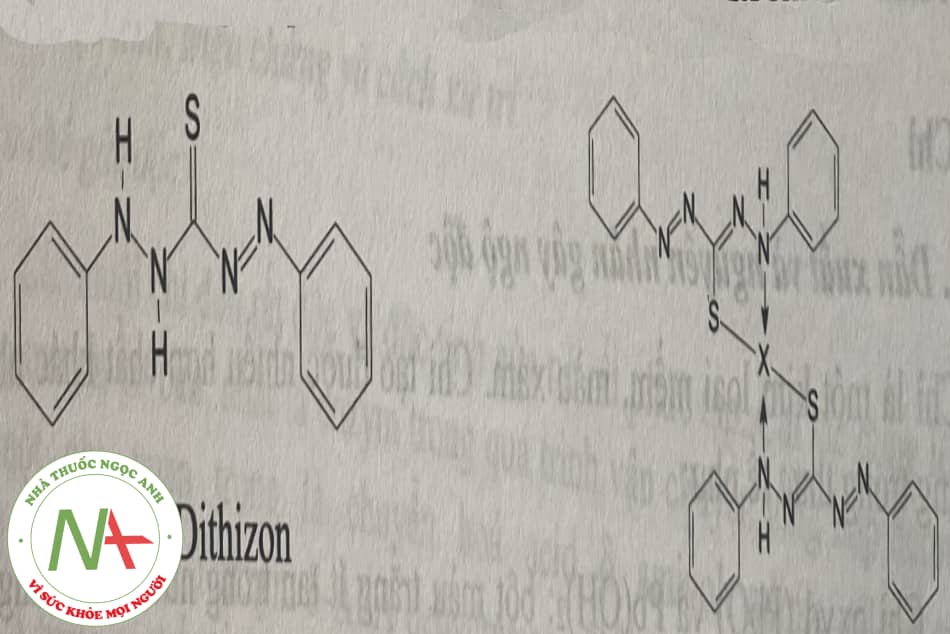
– Phản ứng với dung dịch KI: các muối Hg2+ cho kết tủa màu đỏ Hgl2 với dung dịch KI ở môi trường trung tính hay acid nhẹ và tan trong thuốc thử thừa.
– Phản ứng với SnCl2: cho kết tủa trắng (ở pH 2,5) rồi chuyển sang xám.
Một số phương pháp định lượng thuỷ ngân:
– Phương pháp quang phổ hấp thụ nguyên tử:
Phương pháp hay được sử dụng nhất đê định lượng, phát hiện thủy ngân la phương pháp AAS sử dụng kỹ thuật hoa hơi lạnh (cold evaporation). Lượng thủy ngân có mặt trong mẫu được chuyển về dạng Hg2+ hòa tan nhờ quá trình vô cơ hóa mâu băng các tác nhân oxy hóa (HNƠ3 đặc, H2O2 30%, dung dịch KMnƠ4 5%…). Trong môị trường acid mạnh, Hg2+ sẽ tác dụng với tác nhân khử (SnCI2 hay NaBH4 trong môi trường acid mạnh) tạo thành hơi thủy ngân tự do ngaỵ ở điều kiện nhiệt độ thường, có thể phát hiện trực tiếp bằng phương pháp quang phổ hấp thụ nguyên tử.
– Phương pháp chuẩn độ dithizon:
Nguyên tắc: Thuỷ ngân ở dưới dạng Hg+2 kết hợp với anion Cl– tạo thành hợp chất ít phân ly: Hg+2 + 2Cl– = HgCl2 và khi đạt đến điểm tương đương, phát hiện việc thừa Hg+2 bằng chỉ thị diphenylcarbazol (diphenylcarbazol kết hợp với Hg+2 thành tủa màu xanh).
– Phương pháp quang phổ hấp thụ UV – VIS:
Nguyên tắc: Hòa tan chất phân tích vào một dung môi thích hợp sau đó cho tác dụng với thuốc thử ở một điều kiện nhất định để tạo ra một phức chất cho phổ hấp thụ tử ngoại hoặc khả kiến. Sau đó tiến hành đo mật độ quang của dung dịch đó.
Với thủy ngân người ta dùng phương pháp này dựa trên cơ sở phản ứng của Hg2+ với dung dịch KI tạo Hgl2. Sau đó Hgl2 kết hợp với CU2l2 tạo phức màu hồng Cu2[HgI4].
Thủy ngân cũng có thể tạo phức với dithizon ở pH từ 0,5 – 1 trong dung môi CCl4 và đo mật độ quang ở bước sóng 485nm.
Tuy nhiên, phương pháp đo quang ít được sử dụng để phân tích thủy ngân vì khả năng phát hiện kém khi hàm lượng thủy ngân trong mẫu thấp.
Chú ý: Khi vô cơ hoá mẫu thử, dưới tác dụng của nhiệt, thủy ngân bị bay mất một phần nên cần phải chọn phương pháp thích hợp để không mất quá nhiều thủy ngân. Nếu dùng phương pháp sulfonitric thì dừng lại ở giai đoạn chất hữu cơ tan rã thành chất lỏng màu sẫm. Nếu chỉ muốn tìm thủy ngân thì nên dùng phương pháp vo cơ hoa băng khí clo mới sinh hoặc các tác nhân nhẹ nhàng hơn như trên.
1.2. Chì
1.2.1. Dẫn xuất và nguyên nhân gây ngộ độc
Chì là một kim loại mêm, màu xám. Chì tạo được nhiều họp chất khác nhau có ứng dụng trong thực tế như:
– Chì oxyd (PbO) và Pb(OH)2: bột màu trắng ít tan trong nước, tan trong kiềm NaOH hay KOH thừa.
– Minium (Pb3O4) bột màu đỏ không tan trong nước, minium có thể coi như sự kết hợp của chì oxyd và chì dioxyd (2PbO.PbO2). Minium được dùng để pha sơn, dùng trong kỹ nghệ thủy tinh, làm chất màu cho đồ gốm…
– Chì carbonat PbCO3: dùng pha màu sơn.
– Chì cromat PbCrO4: màu vàng đẹp, dùng pha sơn màu.
– Chì sulfid PbS : dùng tạo lớp màu trên mặt đồ gốm.
– Chì acetat [Pb(CH3COO)2.3H2O] được dùng nhiều trong phòng thí nghiệm, trong y học.
Chì và các hợp chất của nó ít gây ngộ độc cấp tính vì chúng có mùi vị rất khó chịu nên khó uống. Nhưng vẫn có thể xảy ra khi: trẻ em ngậm đồ chơi có pha chì, đựng natri clorid đẳng trương vào chai thủy tinh có pha chì…
Trong thực thế thường hay xảy ra ngộ độc trường diễn do tích lũy chì trong thời gian dài. Các nguyên nhân gây ngộ độc trường diễn có thể là:
- Ăn các thực phẩm có nhiễm chì hay đóng hộp hàn bằng thiếc lẫn chì, trẻ em mít đồ chơi có chì, uống nước dẫn qua đường ống pha chì.
- Hít phải bụi chì và các hợp chất của nó trong các nhà máy sản xuất sơn, làm acqui, mạ kim loại, khai thác chì, bụi chì thôi ra từ một số loại sơn tường…
- Trước đây, còn có thể do tiếp xúc với xăng dầu chứa Pb(C2H5)4 hay công nhân trong các nhà máy in.
Nguy hiểm nhất là ngộ độc chì trường diễn. Người ta tính cân bằng lượng chì cho một người dân ở đô thị:
- Ô nhiễm không khí: dùng xăng có chì, lắng đọng hạt có chì… đưa vào người khoảng 10 μm/ngày.
- Nước uống: 15μg/ngày.
- Thực phẩm: 200-300 μg chì /ngày.
Trong khi đó lượng chì trong cơ thể trao đổi 15 μg/ngày. Như vậy lượng dư trên 200 μg/ngày gây nguy hiểm cho hoạt động sống cảu con người. Nếu lượng dư khoảng 1mg/ngày có thể gây ngộ độc trường diễn.
1.2.2. Độc tính, triệu chứng và cách xử trí.
Cơ chế gây độc
Các muối chì đều rất độc và độc tính của nó rất phức tạp. Chì tác dụng lên các hệ thống enzym cơ bản, nhất là enzym trong quá trình vận chuyển tổng hợp heme. Ở đây có một pha quan trọng là chuyển hóa acid δ aminolevulinic (δ-ALA) thành porphobilinogen nhờ enzym δ-ALA dehydratase. Pb2+ ức chế enzym này làm tích lũy δ-ALA trong cơ thể, đồng thời thiếu heme để tổng hợp hemoglobin. Nếu Pb2+ trong máu trên 0,03ppm sẽ ngăn cản quá trình oxy hóa glucose tạo ra năng lượng duy trì sự sống. Nếu hàm lượng chì trong máu trên 0,8 ppm gây thiếu máu do thiếu hụt hemoglobin.
Triệu chứng ngộ độc:
Khi ngộ độc cấp hay bán cấp sẽ xuất hiện các triệu chứng:
- Mệt mỏi, kích ứng, biếng ăn, mất ngủ, sút cân.
- Rối loạn tiêu hóa, đau thượng vị từng cơn (cơn đau bụng chì), buồn nôn và nôn ra chất trắng (PbCl2), tiêu chảy ra phân đen sau đó táo bón.
- Nhức đầu, kích ứng mạnh hệ thần kinh trung ương. Trẻ em bị ảnh hưởng nhiều hơn vì hệ thần kinh đang phát triển. Ngay cả khi tiếp xúc ở nồng độ thấp cũng thể hiện các triệu chứng hiếu động, kém tập trung, giảm thị lực… Chì hủy hoại mao mạch và vận mạch dẫn đến phù não và thoái hóa thần kinh với các triệu chứng như ngớ ngẩn, mê sảng, co giật, hôn mê.
- Rối loạn phối hợp vận động cơ, gây yếu cơ duỗi, đau cơ, viêm khớp.
- Rối loạn chức năng ống thận, viêm thận, có thể gây vô niệu do thận bị tổn thương, tăng ure huyết,…
- Gây thiếu máu.
- Ảnh hưởng đến hệ thống sinh sản của cả nam và nữ: gây thoái hóa tinh hoàn, giảm sự sản sinh tinh trùng, sẩy thai hay sinh non, trẻ sinh ra nhẹ cân.
Trong trường hợp ngộ độc trường diễn: đầu tiên xuất hiện viền xanh ở lợi, hơi thở thối, đau bụng, thiếu máu, mệt mỏi, suy nhược, nước da xanh tái. Nếu không điều trị sẽ gây viêm thận mạn, rối loạn thần kinh, co giật, tê liệt các chi. Hồng cầu giảm, xuất hiện hồng cầu hạt kiềm trong máu và porphyrin trong nước tiểu.
Trong ngộ độc cấp tính thường tìm thấy lượng chì lớn ở đường tiêu hóa. Đánh giá kết quả định lượng chì trong máu và nước tiểu để chẩn đoán ngộ độc trường diễn, cần chú ý lượng chì có tự nhiên trong cơ thể: mức trung bình của chì trong máu là 0,06mg/100mL, trong nước tiểu 24 giờ là 0,08mg. Để chẩn đoán ngộ độc trường diễn người ta còn ứng dụng thử nghiệm δ-ALA.
Xử trí:
Trong ngộ độc cấp tính: Loại chất độc khỏi cơ thể: gây nôn, rửa dạ dày bằng dung dịch natri hoặc magnesi sulfat, uống than hoạt, thụt tháo… Dùng các chất tạo phức để giảm nồng độ chì trong máu và tăng bài tiết qua nước tiểu như tiêm tĩnh mạch chậm hay tiêm truyền calci EDTA, khởi đâu có thể tiêm dimercaprol (BAL) với người có tổn thương não hoặc uống DMSA kết hợp calci EDTA với người chưa có tổn thương não. Điều trị triệu chứng: động kinh, hôn mê (nếu có), nếu áp suất nội sọ tăng có thể tiêm dexamethason hay manitol.
Để tránh nhiễm độc chì cần phải chú ý cải thiện điều kiện làm việc, giảm thiểu lương bụi chì và các hợp chất của nó xâm nhập vào cơ thể. Kiểm tra sức khoẻ định kỳ cho công nhân tiếp xúc với chì 6 tháng một lân. Định lượng chì trong máu và nước tiểu. Xét nghiệm urê huyết, tìm hồng cầu có chấm trong máu.
1.2.3. Phương pháp phân tích
Xử lý mẫu thử:
– Kiểm nghiệm chì trong không khí: hút không khí có bụi chì vào acid nitric rồi dùng phản ứng của chì đê định tính và định lượng.
– Xác định chì trong phủ tạng, máu và nước tiểu: tủa PbSO4 tạo thành sau khi vô cơ hóa bằng hỗn hợp sulfonitric được hòa tan trong amoni acetat nóng rồi tiến hành định tính và định lượng.
Định tính Pb2+
Phản ứng với dithizon tạo chì dithizonat:
Pb(COOCH3)2 + 2H2D2 ⇒ Pb(Dz)2 + 2 CH3COOH
Chiết bằng carbon tetraclorid ở pH=7-10, nếu có Pb2+ thì lớp dung môi hữu cơ có màu đỏ tia. Phản ứng có độ nhậy cao (0,05 μg/mL) và có tính đặc hiệu tuyệt đối. Vì chì dithizonat thu được từ Pb2+ trong PbSO4 tức là tách riêng được Pb2+ ra khỏi đa số các nguyên tô khác. Trong kết tủa PbSƠ4 có thể kéo theo Fe3+ và Cr3+ vào dung dịch cùng với Pb sau khi hoà tan PbSO4 trong amoni acetat. Nhưng vì Fe3+ có ái lực rất yếu đối với dithizon, còn Cr3+ tạo với dithizon hợp chất không màu cho nên chúng không gây cản trở.
Phản ứng với dung dịch kali iodid:
Pb2+ + 2KI ⇒ PbI2 (màu vàng) + 2K+
Thêm nước, đun nóng hòa tan PbI2 tạo thành dung dịch màu vàng, để nguội kết tinh trở lại cho những tinh thể màu vàng óng ánh (“phản ứng mưa vàng”).
Phản ứng tạ kali chì đồng hexanitrit (K2 CuPb(NO2)6: Cho vài giọt dung dịch Pb2+ lên phiến kính bốc hơi tới khô, thêm vào cắn 1-2 giọt dung dịch đồng acetat bão hòa rồi lại bốc hơi tới khô. Hòa tan cắn trong 2-3 giọt dung dịch acid acetic 30% và thêm vài tinh thể kali nitrit. Nếu có Pb2+ sẽ thấy các tinh thể K2 CuPb(NO2)6 hình lập phương màu đen.
Phản ứng tạo chì sulfid PbS:
Pb(N03)2 + H2S ⇒ PbS ↓ + 2HN03
Kết tủa không tan trong acid hydrocloric và sulfuric loãng nhưng tan trong acid nitric loãng, giải phóng nitrogen oxyd và lưu huỳnh nguyên tố.
3PbS + 8HN03 -> 3Pb(N03)2 + 2NO + 3S + 4 H2O
Tạo kết tủa PbCrO4 màu vàng không tan trong acid acetic, tan trong acid vô cơ và trong kiềm.
2Pb(CH3COO)2 + K2Cr2O7 + H20 -> 2CH3COOK + 2 PbCrO4 + 2 CH3COOH
Định lượng:
Sau khi vô cơ hoá mẫu thử, chì tồn tại dạng PbSO4 được hoà tan trong amoni acetat chuyển thành Pb2+. Có thể định lượng Pb2+ bằng nhiều phương pháp:
Phương pháp AAS: Hiện nay phương pháp quang phổ hấp thụ nguyên tử AAS hay phát xạ ICP được ứng dụng phổ biến để phân tích chì trong dịch sính học, dược liệu các chế phẩm từ dược liệu, mỹ phẩm. Bước sóng đo là 283,3 nm, giới hạn phát hiện và giới hạn định lượng là 0,8 ng/mL và 2,6 ng/mL.
Phương pháp cực phổ: khử ion chì trên catod giọt thuỷ ngân với nên amoni acetat. Thế bán sóng của chì 0,55 V. Độ nhạy của phương pháp là 5 μg/mL.
Phương pháp dicromat – iod: chuẩn độ thừa trừ với kali dicromat, định lượng kali dicromat dư bàng phương pháp đo iod.
2Pb(CH3COOH)2 + K2Cr207 + H20 -> 2PbCrO4 +2CH3COOK+2CH3COOH
K2Cr207 +6KI+7H2SO4 -> 3I2 + Cr2(S04)3 +4K2S04 +7H20
I2+ 2Na2S2O3 -> 2NaI + Na2S4O6
Phương pháp này cho kết quả tốt khi hàm lượng chì tương đối lớn (2-100mg chì trong 100 g mẫu thử).
Phương pháp chiết đo quang với dithizon: tạo chì dithizonat ở pH=7-10. Chiết dithizonat thu được bằng cloroform ở pH >7,0. Rửa dịch chiết bằng dung dịch KCN có thêm NH4OH. Đo mật độ quang của dịch chiết cloroform ở bước sóng 520 nm. Tính hàm lượng chì theo đồ thị chuẩn. Độ nhậy của phương pháp là l0 μg/g.
Phương pháp complexon: đinh lượng Pb2+ bằng cách cho dư complexon (III) 0,01N trong dung dịch đệm amoniac. Chuẩn độ complexon thừa bằng dung dịch kẽm clorid với chỉ thị đen eriocrom T.
1.3. Arsen
1.3.1. Dẫn chất và nguyên nhân ngộ độc
Từ lâu arsen được xem là một chất độc nguy hiểm và gây ô nhiễm môi trường. Nhiều hợp chất arsen vô cơ và hữu cơ được sử dụng trong y học như trong một số thuốc cổ truyền, thuốc bổ (dung dịch Fowler), thuôc thú y .. .cũng như trong các lĩnh vực khác như: bảo quản gỗ, thuốc trừ sâu, diệt côn trùng, diệt cỏ, sản xuất thủy tinh, chất bán dẫn…
- Arsen nguyên tố là chất có màu xám, ngoài không khí bị oxy hoá thành As2Ơ3, đốt cháy cho mùi tỏi.
- Arsen trioxỵd As203 là hợp chất quan trọng nhất của arsen, thường gọi là thạch tín hay arsen trắng, rất độc.
- Arsenid: muối kali, natri của acid arsenơ. Ngoài ra còn có muối đồng arsenid, đồng aceto arsenid. Hai loại muối này đều có màu xanh lục, dùng trong cong nghẹ nhuộm giây….
- Arsenat là các muối của acid arsenic: natri arsenat dùng làm thuốc súng đồng arsenat có màu xanh lục dừng làm phẩm màu, chì và calci arsenat dùng làm thuốc trừ sâu.
- Arsen sulfid: dùng trong công nghệ sơn, in, thuốc nhuộm.
- Arsin (AsH3) là chất khí rất độc, mùi tỏi, sinh ra trong sản xuất công nghiệp.
- Arsen còn có trong nước ngầm nên sự có mặt arsen trong nước sinh hoạt là một vấn đề được nhiều người quan tâm.
- Các hợp chất arsen hữu cơ được sử dụng làm chất độc hóa học (trong chiến tranh giới thứ I), làm thuốc trừ sâu (monosodium methỵlarsenat-MSMA và disodium methylarsenat-DSMA), trước kia còn được dùng làm thuốc trị giang mai (như stovarsol, sulfarseno, acetylacsan..) nhưng độc nên hiện nay ít dùng.
Ngộ độc arsen có thể do một trong các nguyên nhân sau:
- Bị đầu độc: vì arsen rất độc, không mùi vị nên dễ dùng để đầu độc và có thể gây độc trường diễn do đào thải chậm dẫn đến triệu chứng nặng và chết sau khi uống liên tục liều nhỏ. Tuy nhiên người ta vẫn có thể phát hiện các trường hợp này qua khai quật tử thi và xét nghiệm.
- Do tự tử bằng thuốc sâu, thuốc diệt cỏ.
- Do ăn uống các rau hoa quả còn chứa các thuốc trừ sâu, diệt cỏ chứa arsen.
- Dùng kéo dài hay quá liều các thuốc có chứa arsen.
- Công nhân làm việc trong các mỏ khai thác hay nhà máy có liên quan đến arsen.
- Do nước sinh hoạt bị nhiễm arsen…
Các muối arsenic tan nhanh trong nước, hấp thu nhanh qua niêm mạc đường tiêu hoá và tích luỹ ở các tổ chức: gan, lách, thận, phổi, niêm mạc ruột, lông, tóc, móng. Thải trừ chậm qua ruột và thận.
1.3.2. Cơ chế gây độc, triệu chứng và cách xử trí
Độc tỉnh và cơ chế gây độc
Arsen và các họp chất của arsen dễ thăng hoa biến đổi trực tiếp thành dạng khí. Độc tính của các hợp chất arsen thay đổi đáng kể phụ thuộc vào hóa trị, trạng thái vật lý, độ tan và chủng loại động vật bị nhiêm. Hợp chât arsen vô cơ hóa trị III độc hơn các hợp chất hóa trị V, hợp chất hữu cơ ít độc hơn hợp chất vô cơ.
Arsen và các hợp chất chứa arsen ức chế enzym qua tương tác với nhóm -SH của enzym (các hợp chất As3+) hay thay thế phosphat (các hợp chất As5+).
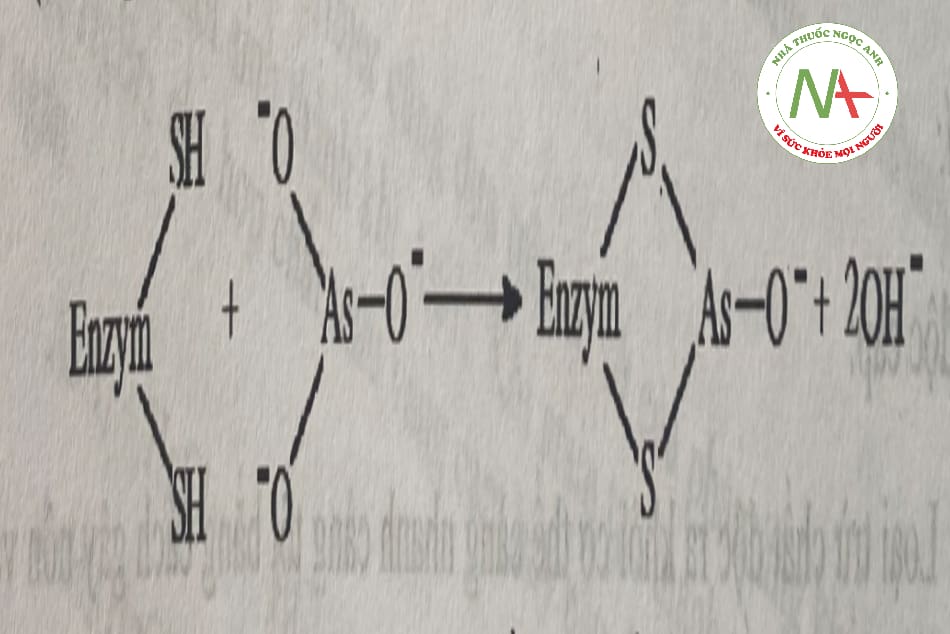
Liều độc của arsen khó xác định vì phần lớn chất độc bị nôn ra ngoài. Liều gây chết của As2O3 được ước lượng khoảng 2mg/kg. Tiếp xúc lặp lại hằng ngày liều 20-60μg/kg có thể gây ngộ độc mạn tính. Liều độc các hợp chất hữu cơ thường cao hơn như có thể uống tới 0,60g natri cacodylat một ngày tức là một lượng arsen cao hơn 40 lần ở thể As2O3 mà vẫn chưa gây ngộ độc. Liều độc cũng thay đổi theo khả năng dung nạp cảu từng cá thể.
Do vậy, khi đánh giá kết quả phân tích arsen cần chú ý tới các thành phần tự nhiên của arsen trong mẫu thử. Để xem xét có phải ngộ độc arsen không cần phân tích nồng độ arsen trong trong máu, nước tiểu, móng và tóc. Nồng độ bình thường cuạ arsen trong máu là dưới 30 μg/L và trong móng, tóc là dưới 1 ppm. Nếu tìm thấy vài centigram arsen trong phủ tạng có thể kết luận bị ngộ độc nhưng nếu chỉ tìm thấy vài miligram thì phải tìm hiểu xem người bệnh có dùng thuốc gì chứa arsen không.
Để đề phòng nhiễm độc arsen, WHO cũng như Uỷ ban hỗn hợp FAO-OMS đã chấp nhận: Lượng arsen đưa vào cơ thể hằng ngày không được quá 0,002 mg/kg và giới hạn arsen trong nước uống là 0,01 mg/L.
Triệu chứng:
Khi bị ngộ độc cấp:
- Các triệu chứng nghiêm trọng xảy ra trên đường tiêu hóa (sau 30 phút đến 2 giờ) như: bỏng rát thực quản, buồn nôn, nôn, đau bụng dữ dội, tiêu ra máu, xuất huyết tiêu hóa, phân lổn nhổn hạt trắng… Trường họp quá nặng gây viêm dạ dày, hạ huyết áp, sốc và chết.
- Trên tim phổi: cơ tim sung huyết, nhịp tim nhanh, phù phổi, chết do trụy tim mạch sau 24 giờ.
- Trên hệ thần kinh: mê sảng, co giật, hôn mê, suy nhược và tê liệt, phù não.
- Trên hệ tiết niệu: suy thận, bí tiểu…
Khi bị ngộ độc mạn tính:
- Loại trừ chất độc ra khỏi cơ thể càng nhanh càng tốt bằng cách gây nôn và rửa dạ dày với nước lòng trắng trứng.
- Trung hòa chất độc bằng các chất chống độc như các dung dịch có sulfid, muối Fe3+ , magnesi oxid… Tiêm thuốc đặc trị BAL với liều 5mg/kg, tiêm cách nhau 4-6 giờ. Sau khi nạn nhân đã ổn định hoặc nhiễm độc mạn tính có thể uống Succimer (dimercapto succinic acid, DMSA).
- Truyền huyết thanh mặn, ngọt; dùng thuốc trợ tim, lợi tiểu…
- Tăng cường thải trừ bằng thẩm tích máu nếu cần thiết.
Ngộ độc mạn tính:
Chủ yếu chữa triệu chứng như uống thuốc trợ tim, lợi tiểu kết hợp với phương pháp vật lý trị liệu.
1.3.3. Phương pháp phân tích
Vô cơ hoá mẫu thử bằng hỗn họp sulfonitric, dùng dịch vô cơ hoá để tiến hành xác định arsen. Có thể sử dụng một số phương pháp sau để định tính và định lượng:
Phương pháp DDTC-Ag:
Dùng Zn trong môi trường acid để khử arsenic thành AsH3. Khí này được dẫn qua bình có thuốc thử DDTC-Ag (bạc diethyl dithiocarbamat) hoà tan trong pyridin. Đo mật độ quang của phức màu tạo thành tại cực đại hấp thụ 535 nm. Phương pháp này rất nhạy, có thể phát hiện được arsen ở mức 0,002 ppm.
Phương pháp AAS:
Lần lượt đo độ hấp thụ arsen của các dung dịch chuẩn, dung dịch thử trên thiết bị quang phổ hấp thụ nguyên tử. Sử dụng kỹ thuật hoá hơi hydrid với dung dịch natri borohydrid 0,5% (trong dung dịch NaOH 0,4%) và đèn cathod rỗng arsen, bước sóng. làm việc là 193,7 nm. Tính toán nồng độ arsen trong dung dịch thử dựa vào đường chuẩn. Giới hạn phát hiện đạt được là 0,3 ng/mL và giới hạn định lượng là 0,99 ng/mL.
Phương pháp Marsh:
Nguyên tắc: khử các hợp chất arsenic hoá trị cao bằng hydro mới sinh (H2SO4 loãng và kẽm kim loại) thành AsH3:
H3 AsO4 + 8H ⇒ AsH3 + 4H2O
Phát hiện khí AsH3 bằng cách cho khí arsin đi qua một bình thủy tinh và đốt lên tới nhiệt độ 600°C, khí AsH3 sẽ phân hủy thành arsen nguyên to và H2. Arsen sẽ đọng lại trên thành ống thủy tinh một vòng đen ánh kim loại. Lấy ống có vòng xam đen ra, đốt nhẹ, sẽ thấy các hạt trắng bám trên thành, soi dưới kính hiển vi sẽ thấy hình đặc biệt của As2O3.
AsH(HgCl)2 + HgCl2 ⇒ HCl + As(HgCl)3
AsH3 + As(HgCl)3 -> 3HCl + As2Hg3
Để định lượng tiến hành làm dẫy chuẩn trong cùng điêu kiện với mẫu thử, nhung các dải giấy tẩm HgCl đã tạo mầu với khí arsin vào dung dịch KI 10% để cố định màu. Sau đó so sánh độ dài của giấy có màu ở mẫu thử và chuẩn.
Phương pháp này cũng có độ nhậy cao (1μg arsen trong dung dịch) và tốn ít thơi gian. Tuy nhiên phản ứng này không đặc hiệu vì H2S và H3P cũng cho màu vàng với giấy tẩm dung dịch HgCl2. Cho nên phương pháp này thường chỉ dùng để thử sơ bộ trước khi thực hiện phương pháp Marsh. Nếu phản ứng này âm tính thì không cần làm phản ứng Marsh nữa.
1.4. Bari
1.4.1. Các dẫn chất và nguyên nhân ngộ độc
Bari là một kim loại độc thuộc nhóm kiềm thổ, đa số các muôi của nó đều độc, đặc biệt là bari phóng xạ (Ba140). Các muối của bari thường gặp:
- Bari clorid (BaCl2.2H20) là chất kết tinh trắng, vị rất khó chịu, tan tốt trong nước và không tan trong còn.
- Bari carbonat (BaC03) không tan trong nước nhưng tan trong acid, kể cả trong nước có C02. Bari carbonat được dùng để giết chuột, dùng trong pha chế sơn.
- Bari sulfat (BaSƠ4) thực tế không tan trong nước và các acid nên không độc, được dùng làm chất cản quang trong y học.
- Bari fluoro silicat (BaSiF4) ít tan trong nước, thường dùng để diệt sâu bọ.
Ngộ độc do muối bari thường xảy ra do uống nhầm natri sulfat, kali bromid với bari clorid, nhầm bari sulfat với bari carbonat… Ngộ độc cũng có thể xảy ra khi uống thuốc cản quang bari sulfat có lẫn nhiều tạp chất bari dễ tan.
1.4.2. Độc tính, triệu chứng và cách xử trí
Trừ bari sulfat, các muối khác của bari đều độc.
Khi ngộ độc muối bari hoà tan các triệu chứng đến sớm nhất thường là gây nôn, ỉa chảy, đôi khi ứa nước bọt. Những dấu hiệu độc tế bào đến sau như liệt, mất phản xạ, có khi run, co giật. Những rối loạn tim mạch cũng cần chú ý như tim chậm lại rồi không đều, ngoại tâm thu, tăng huyết áp, chết do ngừng tim.
Cần rửa dạ dày bằng tanin hay magnesi sulfat. Kháng độc bằng natri sulfat tạo bari sulfat. Có thể tiêm tĩnh mạch 10mL dung dịch natri sulfat 10%, cứ 15 phút tiêm một lần cho đến khi hết triệu chứng hoặc cho uống 30g. Có thể tiêm kali clorid để chống hạ kali huyết. Chữa triệu chứng: chống co giật, giảm đau, thở oxy, chữa loạn nhịp.
1.4.3. Phương pháp phân tích
Bari sau khi phân lập từ mâu thử, chuyển thành dạng muối hoà tan để tiến hành định tính và định lượng.
Định tính:
- Phản ứng kết tinh lai BaSO4 với acid sulfuric đậm đặc: lấy một ít kết tủa trọn với 1 -2 giọt acid sulfuric đặc trên phiến kính và đun nóng. Sau khi để nguội sẽ thay những tinh thể bari sulfat hình chữ thập và hình vuông. Độ nhạy của phản ứng 0,05 μg trong mẫu thử.
- Phản ứng với dung dịch kali cromat: tạo tủa bari cromat màu vàng, không tan trong acid acetic và kiềm. Có thể dùng phản ứng này để phân biệt bari với chì.
- Phản ứng với dung dịch natri rodizonat ở môi trường trung tính: cho kết tủa màu nâu đỏ, không mất đi khi thêm HCl 10%.
- Đốt trên ngọn lửa: các muối bari cho màu xanh lục.
Định lượng: Có nhiều cách định lượng bari:
- Đo quang: Cho Ba2+ phản ứng với kali cromat ở pH = 5,5. Xử lý vói hỗn hợp cồn và aceton (3:2) và dung dịch formol loãng để thu được bari cromat. Hoà tan ban cromat trong dung dịch acid hydrocloric loãng rồi so màu trực tiếp hay làm phản ứng tạo phức màu cromat với thuốc thử diphenylcarbazid ở môi trường acid (có màu hồng tím).
- Chuẩn độ thừa trừ: cho complexon dư vào dung dịch có bari. Xác định phân dư bằng dung dịch chuẩn kẽm clorid với chỉ thị đen eriocrom T.
1.5. Một số kim loại khác
1.5.1. Cadmi
Cadmi và các hợp chất của cadmi:
Cadmi là nguyên tố hoá học nhóm HB, chu kì 5 bảng tuần hoàn các nguyên tố hoá học. Cadmi là kim loại nặng, mềm, màu trắng xanh, dễ nóng chảy, dễ tan trong HNO3. Bị mờ xỉn trong không khí ẩm, nhờ có màng oxid bao phủ nên không bị gỉ.
Cadmi là một nguyên tố hiếm, chiếm 8.10-6% khối lượng vỏ Trái đất. Trong thiên nhiên, cadmi thường tồn tại cùng với kẽm, đồng. Cadmi được điều chế bằng cách dùng kẽm khử hoặc điện phân muối cadmi. Cadmi được dùng để mạ, sản xuất ắc quy có công suất lớn, làm thanh điêu chỉnh trong lò phản ứng hạt nhân. Cadmi có trong nhiều hợp kim dễ nóng chảy. Các hợp chất CdS, CdSe, CdTe là vật liệu bán dẫn. Nhiều hợp chất của Cd là chất độc.
Độc tính:
Cadmi là một trong rất ít nguyên tố không có ích lợi gì cho cơ thể con người. Nguyên tố này và dung dịch các hợp chất của nó là những chất cực độc thậm chí chỉ với nồng độ thấp. Chúng tích lũy sinh học trong cơ thể cũng như trong các hệ sinh thái.
Một trong những lý do chính gây nên độc tính của cadmi là sự can thiệp của nó vào phản ứng của các enzym chứa kẽm. Kẽm là một nguyên tố quan trọng trong các hệ sinh học. Cadmi mặc dù rất giống với kẽm về phương diện hóa học nhưng dường như không thể thay thể cho kẽm trong các vai trò sinh học đó. Cadmi cũng có thể can thiệp vào các quá trình sinh học có chứa magnesi và calci theo cách thức tương tự. Hít thở phải bụi có chứa cadmi nhanh chóng dẫn đến các vấn đề đối với hệ hô hấp và thận, có thể dẫn đến tử vong (thông thương là do hỏng thận). Nuốt phải một lượng nhỏ cadmi có thể phát sinh ngộ độc cấp và gây tổn thương gan, thận. Các hợp chất chứa cadmi cũng là các chất gây ung thư. Ngoài tổn thương thận, người bệnh còn chịu các chứng laongx xương…
1.5.2. Crom
Crom và dẫn chất:
Crom kim loại trắng, bóng, không bị oxy hóa ở nhiệt độ thường. Lớp mạ crom bảo vệ kim loại rất tốt.
Anhydrit cromic CrO3: tinh thể màu đỏ gây bỏng da, là chất oxy hóa mạnh dùng trong kỹ nghệ chất màu.
Kali cromat K2CrO4 dùng trong công nghệ sản xuất phẩm nhuộm và thuộc da, phối hợp với acid sulfuric được dùng làm chất oxy hóa.
Các muối cromat của chì, kẽm và bari được dùng trong công nghệ sơn.
Amoni dicromat dùng trong kỹ nghệ in ảnh và chất nổ.
Độc tính:
Các muối cromat và dicromat rất độc. Ngộ độc trường diễn thường xảy ra đối với những công nhân tiếp xúc với chúng.
Liều độc 0,25-0,30g kali dicromat. Ngộ độc các muối crom thể hiện triệu chứng rõ rệt nhất là gây loét da và niêm mạc.
Crom được dùng rộng rãi trong nhiều quy trình công nghệ nên cần giám sát hàm lượng nước trong sinh hoạt.
Khi uống phải các muối crom thì cần rửa dạ dày, cho uống sữa đặc, magnesi oxyd rồi gây nôn. Cho uống các thuốc giải độc kim loại như BAL, trilon B. Khi các chất độc này bám vào da thì phải rửa bằng xà phòng cho sạch.
Phương pháp phân tích:
Định lượng dựa trên phản ứng với thuốc thử diphenylcarbazid, đo mật độ quang ở 546nm.
1.5.3. Đồng
Đồng và dẫn chất:
Đồng là kim loại dẻo có độ dẫn điện và dẫn nhiệt cao. Đồng nguyên chất mềm và dễ uốn, bề mặt đồng tươi có màu đỏ cam. Nó được sử dụng là chất dẫn nhiệt và điện, vật liệu xây dựng và thành phần của các hợp kim của nhiều kim loại khác nhau.
Ngoài một số ít tồn tại dưới dạng muối Cu+ (như Cu2Cl2), các hợp chất cảu nó thường tồn tại ở dạng muối Cu2+, chúng thường đem lại màu xanh lam hoặc xanh lục cho các loại khoáng và trong lịch sử đã được sử dụng rộng rãi làm thuốc nhuộm. Các ion Cu2+ tan trong nước với nồng độ thấp có thể dùng làm chất diệt khuẩn, diệt nấm và làm chất bảo quản gỗ.
Đồng và các muối của nó được sử dụng rộng rãi trong công nghiệp sơn, nhuộm, trong nông nghiệp để trừ nấm bệnh.
Độc tính:
Với số lượng đủ lớn, các ion Cu2+ là chất độc đối với các sinh vật bậc cao. Với nồng độ thấp hơn, nó là một vi chất dinh dưỡng đối với hầu hết các thực vật và động vật bậc cao. Nơi tập trung đồng chủ yếu trong cơ thể động vật là gan, cơ và xương.
Các muối đồng gây tổn thương đường tiêu hoá, gan, thận. Nếu uống phải muối đồng sẽ bị bỏng đường tiêu hoá, nôn, ỉa ra máu, vô niệu…
Xử trí ngộ độc cấp đồng bằng cách rửa dạ dày băng dung dịch tanin hoặc nước lòng trắng trứng. Cho uống khoảng 200mL dung dịch kali ferocyanid 1% đê loại đông dưới dạng hợp chất không tan.
Phương pháp phân tích :
Tiến hành vô cơ hoá mẫu thử bằng hỗn họp sulfonitric rồi phân tích ion Cu2+ trong dịch vô cơ hoá này. Có thể định lượng đồng bằng các phương pháp:
- Chiết đo quang sau khi tạo phức màu: với DDTC (đo ở bước sóng 435nm) hay với neocuproin (chiết bằng hỗn hợp cloroform – methanol và đo quang ở 457nm).
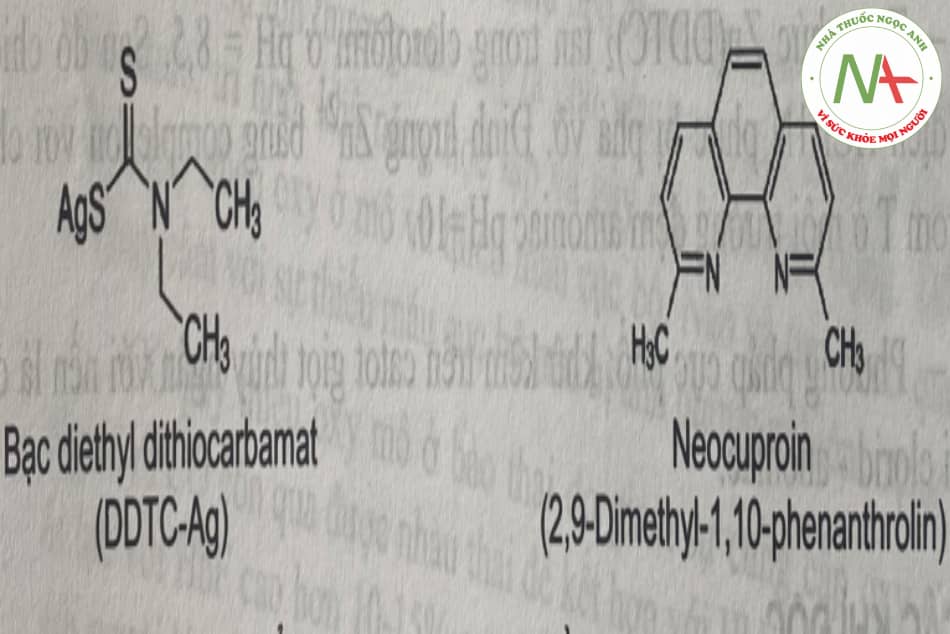
- Phương pháp cực phổ: dựa hên cơ sở khử đồng ở catod giọt thủy ngân, với nền hỗn hợp amoni clorid-amoniac.
1.5.4.Kẽm
Kẽm và dẫn chất:
Kẽm kim loại có màu trắng xanh, ngoài không khí ẩm nó được bao bọc bằng một lớp hydrocarbonat che chở cho kim loại. Kẽm hòa tan dễ dàng trong các acid vô cơ cũng như hữu cơ (citric, tartric, malic…) có trong thức ăn. Kẽm hoà tan trong các kiềm mạnh cho các muối zincat. Người ta dùng kẽm để mạ bảo vệ các kim loại khác khỏi bị phá hủy trong không khí ẩm.
- Kẽm oxyd ZnO: bột trắng, ít độc, dùng trong kỹ nghệ sơn.
- Kẽm clorid ZnCk: dùng làm thuốc sát khuẩn
- Kẽm sulfat ZnSO4.7H20: dùng làm thuốc nhỏ mắt Kẽm phosphid Zn3P2: rất độc, thường dùng để diệt chuột.
Độc tính:
Các muối kẽm hoà tan rất độc. Ngộ độc thường xảy ra do uống nhầm thuốc (như nhầm ZnS04 với MgSO4 hoặc Na2SO4. Ngộ độc cũng xảy ra khi dùng các dụng cụ băng tôn (sắt tráng kẽm) đun nấu và đựng thức ăn, các acid hữu cơ ơ thực p am se oa tan kẽm và gây ngộ độc.
Khi bị ngộ độc muối kẽm sẽ cảm thấy miệng có vị kim loại, đau bụng, mạch chậm, co giật…
Xử trí bằng cách rửa dạ dày bằng dung dịch NaHCO3 2% hay dung dich tanm 0,2%; cho uống sữa, uống MgO và dùng các thuốc trợ tim.
Cơ thể bình thường có chứa khoảng 10-15 mg kẽm trong 1kg phủ tạng. Kẽm được đưa vào cơ thể nhiều nhất từ thực phẩm. Một sô thực phẩm giàu kẽm như: bột mì, thịt bò, gan, trứng… Do đó muốn kết luận là ngộ độc kẽm thì lượng kẽm tìm được trong mẫu thử phải cao.
Trong ngộ độc kẽm phosphid ngoài việc xác định kẽm trong phủ tạng còn phải xác định sự có mặt của ion phosphid.
Phương pháp phân tích:
Vô cơ hoá mẫu thử bằng hỗn hợp sulfonitric. Pha loãng dịch vô cơ hoá bằng nước cho nồng độ acid sulfuric khoảng 10% rồi tiến hành xác định. Có thể định lượng Zn2+ theo các phương pháp sau:
- Tạo phức Zn(DDTC)2 tan trong cloroform ở pH = 8,5. Sau đó chiết lại với dung dịch HCl 1N phức bị phá vỡ. Định lượng Zn2+ bằng complexon với chỉ thị đen eriocrom T ở môi trường đệm amoniac pH=10.
- Phương pháp cực phổ: khử kẽm trên catot giọt thủy ngân với nền là dung dịch amoni clorid – anoniac.
2. Các khí độc
2.1. Carbon monoxyd
Nguồn gốc:
Carbon monoxyd (CO) là chất khí cực độc là một trong những tác nhân chủ yếu gây tổn thương và tử vong do ngộ độc các chất khí.
CO được tạo thành do sự dốt chất không hoàn toàn của carbon hay các nhiên liệu chứa carbon như gỗ, than, xăng dầu, khí đốt,… thường xảy ra ở nhiệt độ cao:
O 2 + 2C ⇒ 2CO
CO có thể tồn tại trong các nhà máy, lò luyện gang thép, hóa dầu, giấy, khói thải từ các phương tiện giao thông và động cơ đốt trong, lò than, khói thuốc lá, giếng sâu,…
CO cũng được hình thành từ phản ứng quang hóa của tầng đối lưu, sự hoạt động của núi lửa, cháy rừng, cháy nhà, cháy nổ hầm mỏ,…
CO còn được hình thành trong cơ thể từ sự chuyển hóa của dicloromethan tại gan hay sự chuyển hóa hem thành biliyerdin dưới tác động của enzym hemoxygenase…
Tính chất:
CO là một khí không màu, không mùi, không vị, không gay kích ứng nên rất nguy hiểm vì khó nhận biết, hơi nhẹ hơn không khí ở điêu kiện bình thường, rất Ít tan trong nước, tan trong ethanol, benzen, có thể cháy với ngọn lửa xanh lam tạo CO2.
CO không hấp thụ bởi than hoạt và có thể chui qua các mặt nạ phòng độc thông thường. Tuy nhiên co có thể bị oxy hóa bởi các oxyd kim loại như AgO, CuO, HgO, Mn02… nên có thể vận dụng phản ứng này đê khử độc cho mặt nạ phòng độc CO.
Nguyên nhân nhiễm độc:
- Do cố ý trong các trường hợp tự tử.
- Do sự cố, tai nạn: Các thiết bị dùng trong gia đình (bếp gas, than củi, lò sưởi, máy phát điện…) bảo trì không đúng cách, sử dụng vận hành nơi kín, thông khí kém. Các tai nạn cháy nổ hầm lò, xuống giếng hay hầm sâu, hỏa hoạn…
- Do ô nhiễm môi trường từ khói xe, khói nhà máy.
- Do nghề nghiệp: thợ rèn đúc kim loại, thợ thông ống khói, thợ mỏ, công nhân xăng dầu, tài xế, cảnh sát giao thông…
2.1.2. Độc tính, cơ chế gây độc, triệu chứng và cách xử trí
Độc tính và cơ chế gây độc:
CO có thể kết hợp dễ dàng với hemoglobin tạo thành carboxy hemoglobin rất bền vững làm mất khả năng vận chuyển oxy trong máu, giảm sự phân bố oxy đến mô. CO kết hợp với enzym cytocromoxydase gây ức chế hô hấp tế bào. CO kết hợp với myoglobin làm giảm sử dụng oxy, dẫn đến suy giảm sự co cơ tim, hạ huyết áp và thiếu máu cục bộ ở não. Ái lực với hemoglobin và myoglobin của co mạnh gấp 250 lần và 60 lần so với oxy.
CO gây sự peroxyd hóa cá acid béo chưa bão hòa dẫn đến phù, hoại tử, thoái hóa tế bào não. Sự tổn thương não xảy ra chủ yếu trong giai đoạn hồi phục, ảnh hưởng đến nhận thức, trí nhớ, khả năng học tập và gây rối loạn hoạt động. Độc tính chủ yếu cảu CO là gây thiếu oxy ở mô và thiếu máu cục bộ. Não và tim là cơ quan tiêu thụ oxy cao và nhạy cảm với sự thiếu máu cục bộ nên bị ảnh hưởng nghiêm trọng nhất,
CO gây thiếu oxy ở bào thai do giảm sự cung cấp oxy từ mẹ đến bào thai. Ngoài ra CO còn qua được nhau thai để kết hợp với HbF gây thiếu oxy trực tiếp. CO có ái lực với HbF cao hơn 10-15% so với HbA với sự đào thải CO ở bào thai chậm hơn so với người lớn nên CO có độc tính rất cao đối với thai nhi.
Triệu chứng:
Ngộ độc cấp:
– Trường hợp nhẹ: nhức đầu, thở nhanh, buồn nôn, nôn, chóng mặt, hoa mắt, đau bụng, mệt mỏi…
– Trường hợp nặng:
+ Gây rối loạn tim mạch như tim đập nhanh, hạ huyết áp, loạn nhịp tim.
+ Những triệu chứng ở hệ thần kinh trung ương như mê sảng, ảo giác, chóng mặt, mất phương hướng, kích động, lú lẫn, ngất, hồn mê, suy nhược thần kinh sau đó ngừng hô hấp và chết rất nhanh.
+ Một số triệu chứng ít gặp hơn như: thiếu máu cơ tim, viêm phổi, phù phổi, nhiễm acid lactic, suy thận cấp, rối loạn thị giác.
+ Dù điều trị kịp thời vẫn có thể để lại các di chứng về thần kinh như hội chứng Parkinson, giảm trí nhớ, rối loạn tâm thần, tê liệt thần kinh, đau tứ chi, yếu cơ…
– Nếu chết, tử thi có sắc thái đặc biệt như môi đỏ, có những vết đỏ thắm ở đùi và bụng vì máu nhiễm co có màu đỏ tươi.
Ngộ độc mạn tính:
- Nhức đầu liên tục, buồn nôn.
- Suy nhược, trầm cảm, lú lẫn, mất trí nhớ.
Xử trí:
– Nhanh chóng đưa người bệnh ra khỏi nơi nhiễm độc.
- Tăng cường hô hấp: hô hấp nhân tạo, thở oxy 100% hay carbogen (oxy có 5% CO2); trường hợp nặng, phụ nữ có thai, trẻ sơ sinh dùng oxy cao áp để tăng tốc độ thải trừ CO.
- Thay máu hoặc truyền máu, dùng thuốc trợ tim, theo dõi điện tâm đồ liên tục trong vài giờ sau khi ngộ độc.
- Điều trị hôn mê hay co giật nếu có.
- Đắp ấm và để người bệnh yên tĩnh.
Đề phòng ngộ độc CO:
- Không để xe nổ máy trong garage đóng kín.
- Đảm bảo ông khói, ông thoát khí của lò sưởi và các động cơ đốt trong hoạt động tốt.
- Không nên sử dụng các thiết bị, đồ gia dụng sử dụng xăng dầu hay đun nấu bằng lò than, củi trong nhà kín, trong lều trại.
- Lắp đặt thiết bị phát hiện co.
2.1.3. Phương pháp phân tích
Định lượng nhanh CO trong không khí:
Dựa trên phản ứng I2O5+5CO —> 5CO2+I2, bột silicagel được tẩm I2O5 trong H2SO4 đặc rồi cho vào ống thủy tinh. Hút không khí có CO vào iod sẽ giải phóng làm ống silicagel có màu, so màu với chuẩn.
Định lượng CO trong máu: CO được giải phóng từ hemoglobin sau đó được định lượng bằng sắc ký khí với detetor dẫn nhiệt hay định lượng gián tiếp qua carboxyhemoglobin bằng phương pháp đo quang.
Phương pháp đo quang dựa trên nguyên tắc trong môi trường kiềm cả oxyhemoglobin và carboxyhemoglobin đều có cực đại hấp thụ quanh 541nm (540-542nm và 538-540nm), tuy nhiên oxyhemoglobin bị Na2S2O4 biến đổi thành deoxyhemoglobin (có cực đại hấp thụ ở 555nm) còn carboxyhemoglobin không bị biến đổi bởi tác nhân này, Đo mật độ quang tại 541nm và 555nm. Xây dựng đường chuẩn dựa trên tỷ số A451/A555 với nồng độ carboxyhemoglobin để tính kết quả. Phương pháp này nhanh, thuận lợi đảm bảo yêu cầu về độ đúng khi nồng độ carboxyhemoglobin trên 3%.
2.2.2. Độc tính, cơ chế gây độc, triệu chứng và cách xử trí
Độc tính và cơ chết gây độc:
Nitrogen dioxyd hủy hoại phổi theo ba cơ chế:
- Biến đổi thành các acid tương ứng ở đường khí ngoại biên, phá hủy một số loại tế bào chức năng và cấu trúc phổi.
- Khởi dầu quá trình tạo ra các gốc tự do gây oxy hóa protein, peroxyd hóa lipid làm hủy hoại màng tế bào.
- Gây giảm đề kháng đối với sự nhiễm trùng do làm thay đổi chức năng miễn dịch của đại thực bào.
Ngộ độc Nitrogen dioxyd có thể gây phù phổi, viêm phổi, viêm phế quản, ho, thở nhanh, khó thở, nhịp tim nhanh, thiếu oxy mô. Những người hen suyễn, bệnh phổi mạn tính, bệnh tim đặc biệt nhạy cảm với các nitrogen oxyd.
Nitrogen dioxyd là chất gây hoại tử mạnh còn nitrogen monoxyd là chất gây methemoglobin mạnh và nhanh.
Ở nông độ cao các nitrogen oxyd là các chất kích ứng da, mắt, màng nhầy và đường hô hấp. Khi tiếp xúc với hơi ẩm có thể gây hủy hoại thành mao mạch sau 2- 24giờ.
Triệu chứng và cách xử trí:
Ngộ độc cấp tính:
Có những triệu chứng tức thời như: ho, khó thở, mệt mỏi, buồn nôn, khản tiếng, nhức đầu, đau bụng… trước khi chuyển sang phù phổi. Bất kể giai đoạn nào cũng có thể gây tử vong, nếu qua được vẫn có thể bị tắc cuống phổi sau đó vài tuân. Tác động lên các cơ quan như sau:
- Hô hấp: Nồng độ thấp gây kích ứng nhẹ, có thể gây thở hơi nhanh, ho. Sau vài giờ đến vài ngày có thể tiến triển sang viêm phổi với các triệu chứng ho dữ dội, thở nhanh, giảm oxy huyết, co thắt phế quản và phù phổi, ở nồng độ cao gây kích ứng mạnh đường hô hấp, trước hết là hô hấp dưới gây bỏng, co thắt, phù mô ở cuồng họng. Nạn nhân thấy khó chịu, yếu, sốt, ớn lạnh, thở gấp, ho kèm theo đau ngực, chảy máu phổi hay phế quản, da xanh, trụy hô hấp và có thể bị tắc nghẽn đường hô hấp.
- Tim mạch: mạch yếu, nhanh, ngực sung huyết, có thể bị trụy tim mạch.
- Tiêu hóa: khi uống phải nitrogen oxyd dạng lỏng sẽ gây kích ứng hay đốt cháy đường tiêu hóa.
- Máu: NO gây methemoglobin làm giảm khả năng vận chuyển oxy.
- Da: ở nồng độ cao gây kích ứng và hoại tử, da ẩm ướt khi tiếp xúc với NO2 lỏng hay hơi có nồng độ cao có thể bị bỏng da, vàng da do HNO3 hình thành.
- Thị giác: dạng khí nồng độ cao có thể gây kích ứng mắt và viêm, tiếp xúc lâu có thể gây mờ hay mù mắt; dạng lỏng có gây bỏng mắt.
Ngộ độc mạn tính:
Ngộ độc mạn tính có nguy cơ gây nhiễm trùng hô hấp ở trẻ em, bệnh phổi tắc nghẽn mạn tính có thể xảy ra do phế quản bị hủy hoại.
Cách xử trí:
- Không có thuốc giải độc cho ngộ độc nitrogen oxyd, điều trị chủ yếu là hỗ trợ hô hấp và tim mạch. Cung cấp oxy và dùng thuốc để giúp hô hấp được dễ dàng hơn.
- Xanh methylen có thể sử dụng để điều trị khi nạn nhân có dấu hiệu thiếu oxy mô hay có nồng độ methemoglobin trên 30%.
- Rửa ngay mắt hoặc vùng da bị nhiễm với nước hay nước muối liên tục trong ít nhất 20 phút.
- Nếu nạn nhân uống phải, không gây nôn, không uống than hoạt (để có thể nội soi kiểm tra đường tiêu hóa). cho uống nhiều nước hay sữa.
- Theo dõi chặt chẽ các dấu hiệu của sự tắc nghẽn đường hô hấp trên, đặt nội khí quản và thông khí nếu cần, cung cấp oxy bổ sung và theo dõi ít nhất trong 24 giờ.
- Điều trị viêm phổi và phù phổi nếu có.
2.2.3. Theo dõi mức độ ngộ độc
NO và NO2 được chuyển hóa thành nitrit (NO2 ) và nitrat (NO3– ) và bài xuất ra nước tiểu, đo nồng độ các chất chuyển hóa này trong nước tiểu để xác định mức độ ngộ độc.
Ngoài ra có thể đo nồng độ methemoglobin, chụp X quang và kiêm tra chức năng của phổi.
3. Các acid vô cơ và kiềm mạnh
3.1. Các acid vô cơ
3.1.1. Nguyên nhân gây độc của một số acid vô cơ
Các acid vô cơ được sử dụng rất rộng rãi trong các ngành công nghiệp khác nhau và trong đời sống. Các acid mạnh như H2SO4, HNO3, HC1 đóng vai trò quan trọng trong sản xuất phân bón, pin, acqui, chất tẩy rửa, thuốc nổ, chạm khắc… HF trong sản xuất màn hình, bóng đèn huỳnh quang, chạm khắc thủy tinh… Chúng có tác dụng ăn mòn ở nồng độ đậm đặc, có thể gây bỏng, hủy hoại mô, trường hợp nặng có thể gây chết. Ở nồng độ loãng, tính chất ăn mòn có thể giảm dần nhưng vẫn có thể còn nguy cơ gây hại như HF 1 % vẫn còn nguy hiểm.
Vì vậy các acid vô cơ có thể gây ra các trường họp ngộ độc, do ngẫu nhiên hoặc cố ý. Việc sử dụng các acid trong công nghiệp nếu không tôn trọng các qui tắc bảo hiểm cũng như nhầm lẫn, bất cẩn, tai nạn… sẽ không tránh khỏi ngộ độc.
Các acid vô cơ có thể gây độc do cố ý như tạt acid để giải quyết thù oán mâu thuẫn cá nhân. Những trường hợp này thường là nặng.
3.1.2. Cơ chế gây độc, triệu chứng ngộ độc một số acid vô cơ và cách xử trí
Cơ chế gây độc:
Độc tính chủ yếu của các acid vô cơ là tác động gây ăn mòn, có thể gây bỏng, hủy hoại mô khi tiếp xúc với da hay màng nhầy, thậm chí có thể gây chết do tổn thương ở diện rộng theo các cơ chế gây hoại tử mô theo kiểu “đông kết” tức thời, tạo thành một khối đông kết ngăn chặn sự thâm nhập sâu hơn của acid nhưng gây tắc nghẽn những vi mạch tại nơi bị tổn thương, gây mất nước, collagen và mucopolysaccharid ở tế bào.
Acid vô cơ có thể được hấp thu qua da vào máu gây tác động toàn thân như nhiễm acid chuyển hóa, suy thận. Nhiễm độc HF có thể gây hạ calci huyết.
Triệu chứng:
Triệu chứng ngộ độc cấp các acid đều khá giống nhau trên các cơ quan.
- Tiêu hoá: gây tổn thương tại chỗ, đau đớn dữ dội từ môi, lưỡi, cô họng, thực quan, thanh quản, dạ dày, khó nuốt, đau ngực, đau bụng. Nạn nhân có thể bị thủng thực quan, dạ dày, nôn ra máu, sốc. Đôi khi nạn nhân bị ngạt thở do phù thanh quản.
- Hô hấp: hít phải hơi acid có thể gây kích ứng mũi, họng, ho, tổn thương đường hô hấp trên, viêm họng, phế quản, phổi, thở có tiếng rít, khản tiêng và có thể ho ra máu.
- Da và toàn thân: gây bỏng, viêm loét da, hoại tử. Nếu bị diện rộng có thê gây tai biến sốc, hạ huyết áp, mạch nhanh. Nhiễm độc toàn thân có thê xây ra sau khi hít, uống hay tiếp xúc qua da các acid vô cơ.
- Mắt: đỏ mắt, chảy nước mắt, rát mắt do viêm kết mạc, bỏng mi mắt, giác mạc, ảnh hưởng đến chức năng thị giác và có thể bị mù.
Tiếp xúc thời gian dài với không khí có nhiều hơi acid có thể bị viêm giác mạc, mũi miệng, thanh quản, nướu và răng, màng phổi bị tổn thương gây viêm phê quản mạn tính.
Xử trí:
Ngộ độc qua đường tiêu hóa:
- Trung hoà ngay acid bằng cách cho uống các dung dịch kiềm nhẹ như MgO (15- 20g trong 1,5 lít nước); nước xà phòng (15g trong 2 lít nước). Chú ý trường hợp này không được dùng NaHCO3 vì tạo ra CO2 có thể gây thủng màng tiêu hoá đã bị viêm.
- Có thể rửa dạ dày bằng ống mũi – dạ dày để giảm sự tiếp xúc với đường tiêu hóa.
- Cho uống sữa để gây tác dụng đệm nhờ albumin nhưng phải uống từ từ để tránh đông vón casein có thể gây ngạt.
- Chữa các triệu chứng: uống thuốc giảm đau, chống các biến chứng ở thực quản bằng cách cho uống kaolin tán nhỏ, nhịn ăn sau đó ăn loãng dần, truyền dịch để chống sốc do mất nước, huyết tương và dùng thêm các thuốc trợ tim.
Ngộ độc qua đường hô hấp:
Phải nhanh chóng đưa nạn nhân khỏi vùng nhiễm độc, hỗ trợ hô hấp với những trường hợp nghiêm trọng.
Ngộ độc qua da và mắt:
- Nếu các acid bắn vào da thì rửa bằng nước cho sạch rồi rửa bằng xà phòng hoặc NaHCO3
- Nếu acid bắn vào mắt thì cần rửa kỹ bằng nước rồi bằng dung dịch NaHCO3.
- Đắp dung dịch kiềm và nhỏ kháng sinh để tránh bội nhiễm.
3.1.3.Phương pháp phân tích
Các phản ứng hay dùng để xác định sự có mặt của acid vô cơ trong mẫu thử là phản ứng với các chỉ thị màu. Nếu kết quả dương tính thì tiếp tục làm các phản ứng phân biệt các acid.
Dùng các phương pháp chuẩn độ để đánh giá mức độ nhiễm độc sau khi phân lập bằng phương pháp lọc qua màng bán thâm hay thâm tích.
3.2. Các kiềm mạnh
3.2.1. Các kiềm mạnh và nguyên nhân gây độc
Các kiềm mạnh như NaOH, KOH, NH4OH… rất dế tan trong nước, có tính ăn mòn, đốt cháy da và niêm mạc.
Các chất này có mặt trong các dung môi, chất tẩy rửa, tẩy trắng đồ gia dụng, thuốc uốn tóc…
Nguyên nhân gây độc chủ yếu do bất cẩn (đựng các đồ uống trong cá vỏ đựng kiềm mạnh chưa súc rửa kỹ) hay nhẫm lẫn, ít có trường hợp cố ý (tự tử).
3.2.2. Cơ chế gây độc, triệu chứng và cách xử trí
Cơ chế gây độc:
Ngộ độc kiềm mạnh còn nguy hiểm hơn các acid vô cơ. Kiềm mạnh gây hoại tử theo kiểu “hóa lỏng”. Chúng xà phòng hoá mỡ ở da và niêm mạc, làm tan albumin, collagen, làm mô bị mất nước, tạo huyết khối mạch máu. Chúng có khả năng đi vào sâu gây hủy hoại lan rộng, làm thủng thực quản, dạ dày, gây nhiễm trùng và có thê dân đến tử vong.
Tác dụng độc của kiềm mạnh tuỳ thuộc vào nồng độ của nó trên các tổ chức cơ thể. LD đường uống với KOH hoặc NaOH khoảng 7-8g, nước javel khoảng 120-220g, với amoniac 2-4g.
Triệu chứng:
Khi uống phải kiềm mạnh, nạn nhân cảm thấy bỏng và đau rát ở môi, miệng thực quản, dạ dày, hắt hơi, khó thở, thở rít, viêm mũi, miệng, khó nuốt, nước bọt tiết nhiều khó phát âm, khàn giọng hay tắt tiếng. Nạn nhân đau ngực, đau bụng dữ dội nôn va tiểu ra máu, sốt có thể dẫn tới thủng dạ dày, phù phổi, thở khò khè, trụy tim mạch hạ huyết áp, sốc và chết rất nhanh.
Với da gây bỏng dạ, rộp nước, hoại tử. Với mắt có thể gây các vết bỏng hủy hoại giác mạc và có thể dẫn đến mù.
Xử trí:
- Trung hòa ngay kiêm băng các acid nhẹ như: nước chanh loãng, dung dich acid citric 3%.
- Nong thực quản khi có biến chứng hẹp thực quản.
- Phẫu thuật can thiệp khi có dấu hiệu xuất huyết dạ dày, ruột hay thủng đường tiêu hóa đe dọa đến tính mạng.
- Rửa da và mắt bằng nước sạch trong ít nhất 15 phút, nhỏ kháng sinh để tránh nhiễm trùng mắt.
3.2.3. Theo dõi mức độ nhiễm độc
- Xét nghiệm công thức máu, phân tích khí máu.
- Chụp phim ngực, bụng để chẩn đoán biến chứng thủng dạ dày – ruột khi có hiện diện của khí tự do trong trung thất hay phúc mạc.
- Nội soi đường tiêu hóa với ống nội soi mềm.
Câu hỏi lượng giá
- Trình bày nguyên nhân gầy ngộ độc, cơ chế gây độc, các triệu chứng và cách xử trí ngộ độc thủy ngân. Nguyên tắc của các phương pháp phân tích thủy ngân?
- Trình bày nguyên nhân gầy ngộ độc, nhiễm độc, cơ chế gầy độc, các triệu chứng và cách xử trí ngộ độc chì. Nguyên tắc của các phương pháp phân tích chì?
- Trình bày nguyên nhân gây ngộ độc, nhiễm độc, cơ chế gây độc, các triệu chưng va each xử trí ngộ độc arsen. Nguyên tắc của các phương pháp phân tích arsen?
- Trình bày nguyên nhân gây ngộ độc, độc tính, các triệu chứng và các xử trí ngộ bari, crom, đồng, kẽm.
- Trình bày nguyên nhân gây ngộ độc, cơ chế gây độc, các triệu chứng và cách xử trí ngộ độc carbon monoxyd.
- Trình bày nguyên nhân gây ngộ độc, cơ chế gây độc, các triệu chứng và cách xử trí ngộ độc nitrogen monoxyd.
- Cơ chế gây độc, triệu chứng và cách xử trí khi bị ngộ độc các acid vô cơ?
- Cơ chế gây độc, triệu chứng và cách xử trí khi bị ngộ độc các acid kiềm mạnh?
