Bệnh hô hấp
VIÊM PHỔI VI KHUẨN KHÁNG THUỐC VÀ PHƯƠNG PHÁP ĐIỀU TRỊ
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết VIÊM PHỔI VI KHUẨN KHÁNG THUỐC VÀ PHƯƠNG PHÁP ĐIỀU TRỊ – tải về file pdf ở đây.
Người soạn: Nguyễn Văn Thành
1. ĐẶT VẤN ĐỀ
Viêm phổi là tình trạng viêm nhu mô phổi, đến tầm phế nang. Viêm phổi thông thường do nhiễm trùng (virus hay vi khuẩn), ít khi do các tác nhân khác (thuốc, tự miễn dịch, ký sinh trùng). Điều kiện thuận lợi để xuất hiện viêm phổi là tình trạng suy giảm sức đề kháng tại chỗ hay toàn thân. Đây là bệnh lý mang tính thực hành rất cao, không chỉ trong bệnh viện mà còn ở cộng đồng. Tuổi thọ trung bình tăng, gia tăng các bệnh đồng mắc và mạn tính, chỉ định thuốc kháng viêm và ức chế miễn dịch rộng rãi, gia tăng các chăm sóc y tế can thiệp, dễ dàng phơi nhiễm kháng sinh và lây nhiễm kháng thuốc là những vấn đề đang làm trầm trọng thêm dịch tễ viêm phổi.
Dưới thuật ngữ viêm phổi, bộ ba mang nhiều đặc điểm khác biệt trong chẩn đoán, tiếp cận điều trị và tiên lượng là Viêm phổi cộng đồng (community-acquired pneumonia – CAP), Viêm phổi bệnh viện (hospitalacquired pneumonia – HAP) và Viêm phổi trên người suy giảm miễn dịch (immunosuppressed host associated pneumonia). Bên cạnh tình hình mắc và nhập viện điều trị có chiều hướng gia tăng, vấn đề tử vong do viêm phổi không giảm trong nhiều thập niên qua, vấn đề kháng thuốc của vi khuẩn gây bệnh đang là những thách thức có tính bức thiết, đòi hỏi cần thực hành chuẩn cao trong bệnh lý này.
Bên cạnh vấn đề chỉ định quá mức kháng sinh tĩnh mạch, vấn đề chỉ định kháng sinh phổ rộng cũng được đề cập đến trong nhiều nghiên cứu. Số bệnh nhân được chỉ định kháng sinh phổ rộng kinh nghiệm cao hơn rất nhiều so với số bệnh nhân xác định được vi khuẩn gây bệnh kháng thuốc. Chỉ định kháng sinh phổ rộng không làm giảm tỷ lệ tử vong trên viêm phổi cộng đồng (VPCĐ) nói chung cũng như trên những trường hợp xác định là viêm phổi có kết hợp với chăm sóc y tế (healthcare-associated pneumonia, HCAP). Chỉ định kháng sinh phổ rộng kết hợp với tăng tử vong và các kết cục xấu trên bệnh nhân VPVĐ nhập viện. Mặc dù các bằng chứng đều không chứng minh được chỉ định kháng sinh phổ rộng là có lợi thì trong thực hành lâm sàng các thầy thuốc thường vẫn có lý lẽ biện minh cho chỉ định kháng sinh phổ rộng là vì “sự an toàn” và “có thể có nhiễm khuẩn kháng thuốc”. Trong khi số bệnh nhân khỏi được điều trị bằng kháng sinh phổ rộng bao phủ được hết vi khuẩn gây bệnh không nhiều hơn được điều trị kháng sinh theo phác đồ hướng dẫn thì tác dụng không mong muốn của trị liệu này đã được ghi nhận rõ ràng. Tỷ lệ tử vong có liên quan tới một tác dụng phụ do thuốc kháng sinh phổ rộng cao hơn mà trong đó thông thường do piperacillin/tazobactam hoặc vancomycin hoặc cả hai. Như vậy, “quan điểm an toàn” khi chỉ định kháng sinh phổ rộng thực ra là “quan điểm không an toàn” và chỉ định kháng sinh phổ rộng cần là một chiến lược tiếp cận trong một phác đồ chuẩn hơn là chỉ hướng tới từng ca bệnh.
2. VI SINH GÂY BỆNH VÀ KHÁNG THUỐC
2.1. Phổ vi sinh gây bệnh
Trong khoảng trên một thập niên trở lại đây, việc áp dụng kỹ thuật sinh học phân tử trong xét nghiệm vi sinh đã tạo ra một sự thay đổi lớn về hiểu biết vi sinh gây bệnh trong VPCĐ, nhất là với các tác nhân gây bệnh virus và vi khuẩn không điển hình (atypical pathogens). Đây là các tác nhân vi sinh không xác định được bằng các xét nghiệm thường quy. Trên VPCĐ nhập viện, xét nghiệm vi sinh gây bệnh bằng cả 2 phương pháp nuôi cấy truyền thống và PCR, cho thấy vi sinh gây bệnh đơn độc phát hiện được bằng PCR trên 87% các trường hợp trong khi nuôi cấy là 39%. H.influenzae và S.pneumoniae là các tác nhân gây bệnh chính xác định được cùng với nhiều tác nhân khác, gồm cả vi khuẩn không điển hình. Virus hiện diện trên 30% các trường hợp mà trong đó 82% phát hiện cùng với vi khuẩn. Các nghiên cứu vi sinh gây bệnh áp dụng kỹ thuật sinh học phân tử trong VPCĐ đều có chung nhận định: 1) Số trường hợp xác định được tác nhân vi sinh gây bệnh cao hơn; 2) Virus và vi khuẩn không điển hình hiện diện nhiều hơn; 3) Hiện tượng đồng nhiễm (co-infecton) có tỷ lệ cao hơn. Phối hợp virus ở trẻ em đa số là virus hợp bào hô hấp (respiratory syncytial virus, SRV) trong khi ở người lớn là virus cúm (influenza). Vi khuẩn kết hợp với virus trong đa số các trường hợp là S.pneumoniae.
Trong VPCĐ, thuật ngữ vi khuẩn gây bệnh không điển hình thường được được hiểu là M.pneumoniae, C.pneumoniae và L.pneumophila mặc dù khái niệm này cũng chưa được chấp nhận có tính toàn cầu. Guideline của Hội Nhiễm trùng và Lồng ngực Mỹ (Infectious Diseases Society of America and American Thoracic Society, IDSA/ATS) năm 2007 sử dụng thuật ngữ “không điển hình” cho tất cả các vi sinh gây bệnh không phát hiện được bằng nhuộm Gram hoặc bằng các phương pháp xét nghiệm vi sinh chuẩn. Trong khi guideline của Hội Hô hấp châu Âu (European Respiratory Society, ERS) năm 2011 cho rằng tác nhân gây viêm phổi không điển hình là M. pneumoniae, C. pneumoniae và L. pneumophila. Trong thực hành lâm sàng, do không xét nghiệm được thường quy, vi khuẩn không điển hình thường được hiểu khá mơ hồ và thiếu xử trí. Với tỷ lệ mắc và sự kết hợp tỷ lệ cao trên các trường hợp nặng, một phác đồ hướng tới bao vây vi khuẩn không điển hình trên bệnh nhân nhập viện là cần thiết. Ở Việt Nam, một bài báo công bố số liệu nghiên cứu từ 2010-2012 tại bệnh viện Nhi trung ương trên trẻ 1-15 tuổi VPCĐ nhập viện cho thấy 29,8% xác định được vi khuẩn không điển hình mà trong đó chủ yếu là M.pneumoniae. Trong số các trường hợp xác định được vi khuẩn không điển hình có 45,12% là các trường hợp nặng và hiện tượng đồng nhiễm (với vi khuẩn điển hình, với virus) là nguy cơ xuất hiện viêm phổi nặng. Trong một phân tích quan trọng năm 2007 trên một số lượng lớn bệnh nhân trên phạm vi toàn cầu gồm Bắc Mỹ (vùng I), châu Âu (vùng II), Mỹ La-tinh (vùng III), châu Á/châu Phi (vùng IV) dựa trên dữ liệu tổng hợp quốc tế cho thấy tỷ lệ VPCĐ do vi khuẩn không điển hình khoảng 20-28%. Ghi nhận về chỉ định kháng sinh bao vây vi khuẩn không điển hình là 91%, 74%, 53% và 10% theo thứ tự ở từng vùng. Kết quả của nghiên cứu trên cho thấy sự hiện diện có ý nghĩa mang tính toàn cầu của vi khuẩn không điển hình trong VPCĐ nhưng thái độ điều trị hướng tới các tác nhân gây bệnh này lại khác nhau (p<0,02).
Mặc dù lịch sử loài người trong trên một thế kỷ vừa qua đã có 4 đại dịch cúm, nhưng có rất ít thông tin về căn nguyên gây tử vong từ các đại dịch này. Phân tích đại thể các trường hợp tử vong trong đại dịch cúm 1918-1919 cho thấy đa số các trường hợp tử vong đều bị viêm phổi do nhiễm khuẩn thứ phát mà vi khuẩn chủ yếu là nhóm bình thường có phổ biến ở đường hô hấp trên.
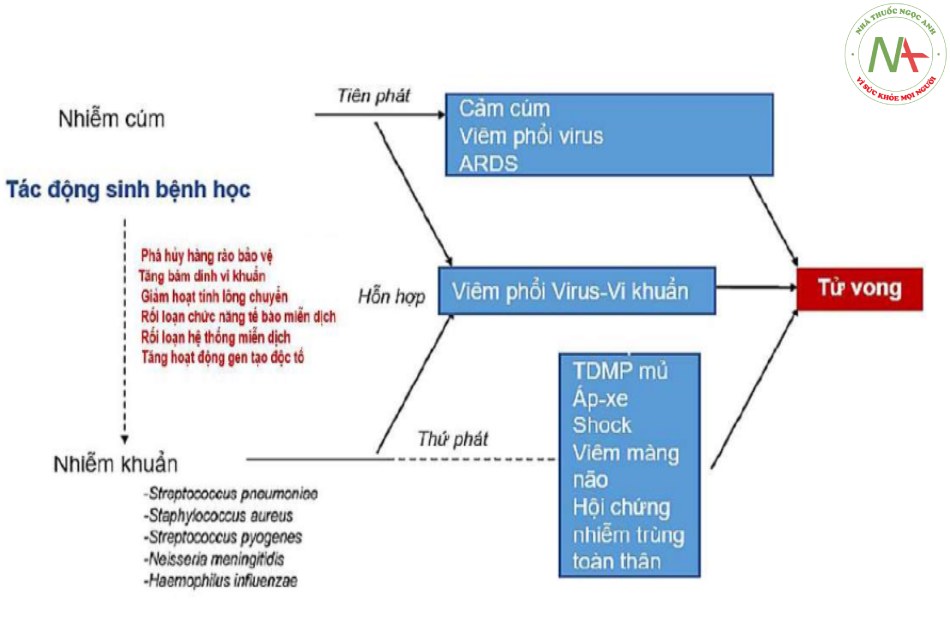
Mặc dù cả vi khuẩn và virus đều có khả năng độc lập gây viêm phổi nhưng đồng nhiễm virus-vi khuẩn trong viêm phổi đã đặc biệt được chú ý nhiều, nhất là sau dịch cúm năm 2009. Trong khi không có biểu hiện lâm sàng đặc trưng của viêm phổi sau nhiễm virus thì đã có bằng chứng cho thấy kết hợp virus-vi khuẩn làm cho diễn biến viêm phổi xấu đi, cả về mức độ nặng và tử vong. Hiện tượng đồng nhiễm trong viêm phổi cho chúng ta một cách nhìn hoàn toàn khác với cách thống kê tác nhân đơn mà y văn thường ghi nhận theo tỷ lệ tác nhân vi sinh gây bệnh phân lập được. Đó là cách nhìn có tính tương tác của các tác nhân gây bệnh có tác động trên bệnh học viêm phổi.
Tác nhân vi sinh gây bệnh trong VPCĐ là giống nhau trên phạm vi toàn cầu. Trong một vài thập niên gần đây, ý niệm về vi khuẩn kháng thuốc và đa kháng thuốc, nhiễm khuẩn không phổ biến đã tạo nên những khuynh hướng điều trị kháng sinh kinh nghiệm quá mức, nhất là đối với các trường hợp cần nhập viện. Thói quen sử dụng thuật ngữ “vi khuẩn kháng thuốc” trong nhiễm trùng hô hấp dưới cộng đồng có vẻ không thực sự hợp lý vì 2 lý do: 1) Không giống như trong nhiễm khuẩn bệnh viện, vi
khuẩn gây bệnh trong nhiễm khuẩn cộng đồng chủ yếu là nhạy cảm kháng sinh. Kể cả vi khuẩn thường có nguồn gốc nhiễm khuẩn bệnh viện như P.aeruginosa,
S.aureus cũng không kháng thuốc giống như nhiễm khuẩn bệnh viện và 2) Vi khuẩn gây bệnh không đáp ứng với trị liệu kháng sinh thông thường chỉ chiếm một tỷ lệ rất thấp trong nhiễm khuẩn cộng đồng. Do vậy, thuật ngữ vi khuẩn “không phổ biến” để chỉ những trường hợp này là hợp lý hơn và thuật ngữ này nên hiểu theo nghĩa không đáp ứng với trị liệu kháng sinh thông thường.
2.2. Vi khuẩn gây bệnh cộng đồng kháng thuốc
2.2.1. S.pneumoniae kháng thuốc:
Tình hình S.pneumoniae kháng penicillin (PRSP) và đa kháng khác nhau giữa các thông báo từ các khu vực và giữa các quốc gia. Cơ chế kháng với penicillin và các betalactam khác là do thay đổi penicillin-binding proteins (PBPs). PBPs tương tác với betalactam kiểu enzym bằng cách hình thành một phức hợp đồng hóa trị ở các vị trí serin hoạt hóa. Sự thay đổi PBPs có tác động tới tất cả các thuốc nhóm betalactam mặc dù có khác nhau ở từng loại thuốc do ái lực của các PBPs đối với từng kháng sinh trong nhóm khác nhau và do vậy khi kháng với với penicillin không có nghĩa là kháng hết với các thuốc nhóm beta-lactam. Điểm cắt (break-points) nhạy cảm của S.pneumoniae đối với penicillin do Viện chuẩn Lâm sàng và Xét nghiệm, Mỹ (Clinical and Laboratory Standards Institute, CLSI) đề xuất năm 2008 là kết quả của việc xem xét lại dựa trên các kết quả nghiên cứu lâm sàng cho thấy nhiễm khuẩn S.pneumoniae vẫn còn đáp ứng điều trị với penicillin trong khi theo định nghĩa đã giảm nhạy cảm trên in vitro. Điểm cắt mới được đề xuất dựa trên đặc tính dược động và dược lực kháng sinh, các dữ liệu có liên quan tới MIC và kết cục điều trị.
Trên cơ sở các tiêu chuẩn này, ngưỡng nhậy, giảm nhậy và kháng là ≤0,06; 0,12-1; ≥2 mg/L được thay đổi (khi không sử dụng penicillin uống, không viêm màng não) thành 2, 4, 8 mg/L. Với việc đề xuất điểm cắt mới này, việc chỉ định kháng sinh nhóm penicillin sẽ tăng lên thay vì sử dụng các kháng sinh phổ rộng. Việc sử dụng kháng sinh như vậy sẽ giúp làm giảm nguy cơ xuất hiện kháng thuốc trong S.pneumoniae, S.aureus và Clostridium difficile nếu sử dụng quá mức các kháng sinh phổ rộng hơn. Với điểm cắt mới như trên, chỉ định kháng sinh penicillin điều trị viêm phổi do S.pneumoniae là: Penicillin G 2g (3,2 triệu đơn vị) IV/4 giờ khi MIC<8 mg/L; Ceftriaxone 1g IV hoặc IM/12 giờ hoặc cefotaxime 2g IV/6 giờ (59). Với amoxicillin-clavulanic acid liều 2g/125/mỗi 12 giờ đủ làm sạch khuẩn với các chủng kháng amoxicillin (MIC 4-8 mg/L). Với điều trị như trên, tình hình S.pneumoniae kháng penicillin như hiện nay tỏ ra là không có tác động tới hiệu quả điều trị.
Đối với macrolide, S.pneumoniae kháng theo 2 cơ chế: Thay đổi vị trí đích (trên ribosome do gen ermB quyết định) và tăng hoạt tính bơm đẩy (do gen mefA quyết định). Vi khuẩn có gen ermB thường thể hiện kháng cao tới rất cao với erythromycin.
Nhất là khi kết hợp cả hai cơ chế trên. Hiện tượng thất bại lâm sàng do S.pneumoniae kháng macrolide xảy ra không phụ thuộc vào kiểu kháng và mức độ tăng MIC đối với erythromycin. Cơ chế giải thích lợi ích kết hợp macrolide với beta-lactam còn chưa rõ ràng, có thể là bao vây vi khuẩn không điển hình, có thể tăng hoạt tính hiệp đồng (synergy) khi kết hợp 2 thuốc, có thể bao vây nếu có đa nhiễm khuẩn và các đặc tính điều hòa miễn dịch. Macrolide có khả năng, mà không thấy ở bất kỳ nhóm kháng sinh nào khác, làm bất hoạt quá trình tạo pneumolysin (yếu tố quyết định độc lực của S.pneumoniae) ngay cả với liều dưới MIC và khi S.pneumoniae đã kháng macrolide.
S.pneumoniae kháng với fluoroquinolone (FQ) xảy ra theo cách tăng dần. Các đột biến lần đầu được nhận thấy hoặc ở gen parC hoặc gen gyrA làm giảm nhạy cảm thuốc. Thông thường các chủng trở nên kháng hoàn toàn khi có kết hợp thêm đột biến ở các gen đích khác trên nền đột biến một trong hai gen kể trên. Sự xuất hiện kháng thuốc ngay trong quá trình điều trị kháng sinh có vẻ là do phát triển từ những chủng đã mang sẵn vùng quyết định kháng FQ (quinolone resistance determining region, QRDR) và chỉ cần xuất hiện thêm một đột biến ở vị trí khác là trở thành kháng.
Ý niệm về nồng độ phòng đột biến kháng thuốc (mutant prevention concentration, MPC) là nồng độ phòng xuất hiện đột biến lần đầu. MPC của các kháng sinh FQ có khả năng hạn chế xuất hiện kháng thuốc ở những mức độ khác nhau, theo chiều giảm dần moxifloxacin, trovafloxacin, gatifloxacin, grepafloxacin và levofloxacin. Kháng FQ còn khá hiếm. Tuy nhiên tỷ lệ kháng do đột biến lần đầu là bao nhiêu chúng ta còn chưa được biết và các nghiên cứu ở Việt Nam cho thấy đang có sự gia tăng kháng với thuốc này trong khoảng thời gian 10 trở lại đây.
Với kháng sinh khác, ở nhiều nước, chloramphenicol, co-trimoxazole và tetracyclines tỷ lệ kháng đã ở mức không nên khuyến cáo điều trị kinh nghiệm cho S.pneumoniae bằng các thuốc này nữa.
2.2.2. H.influenzae kháng thuốc:
Đặc điểm kháng thuốc của H.influenzae, một trong các tác nhân vi sinh gây bệnh phổ biến, rất được chú ý nghiên cứu. Cơ chế tạo beta-lactamase (BLMe) của H.influenzae là cơ chế đầu tiên được biết và là yếu tố nguy cơ thất bại điều trị trong nhiễm khuẩn hô hấp cộng đồng. Hiện tượng kháng này có thể khắc phục bằng cách sử dụng các cephalosporin bền vững với BLMe hoặc kết hợp với chất ức chế BLMe. Có một nhóm H.influenzae có thay thế ở amino acid trên gen ftsl (PBP3) cũng có thể kháng ampicillin nhưng BLMe (-) (BLNAR). Kiểu hình này của vi khuẩn cũng giảm nhạy cảm với một số cephalosporin. Mặc dù hiếm nhưng vẫn tồn tại vi khuẩn BLMe(-) kháng ampicillin và BLMe (+) kháng amoxicillin/a.clavulanic và là một mối lo ngại. Azithromycin là kháng sinh có hoạt tính nhất đối với H.influenzae, với MIC 4-8 lần thấp hơn erythromycin. Sự tồn tại của cơ chế bơm đẩy giúp cho vi khuẩn giảm nhạy cảm macrolide. Trên 98% các chủng sở hữu cơ chế này. Cũng giống như với S.pneumoniae, có sự khác biệt giữa việc nhận định tính nhạy cảm của H.influenzae với macrolide khi sử dụng điểm cắt CLSI và hiệu quả in vivo vì H.influenzae là vi khuẩn ngoại bào trong khi macrolide tập trung vào trong tế bào. H.influenzae kháng fluoroquinolone (FQ) còn hiếm. Tỷ lệ kháng với tetracycline trên một số theo dõi cho thấy có khuynh hướng giảm.
2.2.3. M.catarrhalis kháng thuốc:
Tính nhạy cảm của M.catarrhalis ít thay đổi từ 1999. Vi khuẩn này tiết ra BLMe có tính toàn cầu và các thầy thuốc nên xem rằng tất cả các phân lập đều kháng với amoxicillin, ampicillin, piperacillin và penicillin. Tuy nhiên, cả hai enzym tạo BLMe (BRO-1 và BRO-2) đều bị các chất ức chế với betalactamase bất hoạt. Như vậy các kết hợp beta-lactam/kháng BLMe đều có chỉ định tốt đối với vi khuẩn này. Macrolide, tetracyclines còn hoạt tính rất tốt.
2.2.4. M.pneumoniae kháng thuốc:
M.pneumoniae bị tetracyclines, macrolides, ketolides và fluoroquinolones ức chế và các phân lập cho thấy có ít biến đổi MIC. Do không có cấu trúc thành tế bào, vi khuẩn này kháng với tất cả các beta-lactam và glycopeptides. Bởi vì tetracyclines và fluoroquinolones không được khuyến cáo sử dụng ở trẻ em nên macrolide là kháng sinh thường được chọn điều trị cả ở trẻ em và người lớn. Từ sau năm 2000, có một số thông báo xuất hiện kháng macrolide, chủ yếu ở châu Á (Trung quốc, Nhật bản) trong khi ở châu Âu tỷ lệ này từ một số dữ liệu cho thấy còn thấp. Tuy nhiên điều này cho thấy cần theo dõi tình hình kháng macrolide của M.pneumoniae.
2.2.5. S.aureus kháng thuốc:
Nhiễm S.aureus tiên phát vẫn còn là không phổ biến mặc dù đây là vi khuẩn gây bệnh viêm phổi quan trọng và gây tử vong trong các dịch cúm. Vai trò của S.aureus kháng methicillin từ cộng đồng (CommunityAssociated Methicillin-Resistant Staphylococcus, CA-MRSA) thực sự còn chưa xác định rõ ràng. Xem là nhiễm khuẩn do CA-MRSA khi triệu chứng nhiễm khuẩn xảy ra trước nhập viện hoặc trong 48 giờ sau nhập viện và bệnh nhân không tiếp cận với chăm sóc y tế trước đó. Viêm phổi cộng đồng do CA-MRSA thường ở người trẻ, khỏe mạnh, tiến triển bệnh nhanh, bệnh cảnh hô hấp nặng. CA-MRSA thông thường kháng với beta-lactam nhưng nhạy với hầu hết các kháng sinh khác. Điều này là rất khác với MRSA từ nhiễm khuẩn bệnh viện và chẩn đoán vi sinh cần làm rõ mặc dù với test nhạy cảm kháng sinh thường qui là khó chẩn đoán phân biệt. Do vi khuẩn không phổ biến trong VPCĐ nên không cần thiết bao vây vi khuẩn này một cách thường quy. Tuy nhiên, tình trạng nặng và tiên lượng xấu của nhiễm khuẩn CA-MRSA nhấn mạnh việc lưu ý chẩn đoán và điều trị sớm. Clindamycin và linezolid ức chế tốt sự hình thành các độc tố vi khuẩn (kể cả PVL) nên làm giảm hội chứng sốc nhiễm độc trong khi với điều trị vancomycin, ngưỡng độc tố không khác nhóm chứng (không được điều trị kháng sinh). Ức chế tạo độc tố có thể liên quan tới cải thiện kết cục bệnh nên vancomycin đơn độc không phải là trị liệu lý tưởng cho viêm phổi do CA-MRSA. Việc kết hợp thuốc diệt khuẩn và ức chế tạo độc tố như clindamycin hoặc linezolid được xem là giải pháp cải thiện tiên lượng.
2.2.6. Tình hình vi khuẩn gây bệnh kháng thuốc ở Việt Nam:
Có nhiều nghiên cứu trong nước về tình hình vi sinh gây bệnh và kháng thuốc trong nhiễm khuẩn hô hấp dưới và viêm phổi cộng đồng. Tuy nhiên, hầu hết đây là những nghiên cứu thực hiện trong bệnh viện, phân tích đơn thuần từ phòng xét nghiệm, đơn trung tâm và không áp dụng chuẩn các phương pháp chẩn đoán vi sinh. Trong khoảng một thập niên vào những năm 20002010 ở Việt Nam, theo chương trình giám sát ANSORP (Asian Network for Surveillance of Resistant Pathogens), phân lập trên những trường hợp nhiễm khuẩn hô hấp cấp đã cho những ghi nhận khá cụ thể về tình hình nhiễm và đề kháng của các tác nhân gây bệnh phổ biến với nhận định chung là tình hình kháng thuốc của S.pneumoniae là khá cao so với các nước cùng tham gia lấy số liệu ở khu vực châu ÁTBD. Với chuẩn mới (năm 2008) của CLSI như đã nói ở trên, một nghiên cứu đa trung tâm thực hiện vào thời điểm 2010-2011 (nghiên cứu SOAR) ghi nhận tỷ lệ kháng penicillin của S.pneumoniae giảm xuống còn rất thấp (1%). Tuy nhiên các tác giả của nghiên cứu này cũng cho thấy MIC của vi khuẩn đối với penicillin đã tăng từ 2mg/L lên 3mg/L kể từ 2007. Cũng với kết quả nghiên cứu SOAR ghi nhận, S.pneumoniae có tỷ lệ đề kháng cao đối với các kháng sinh macrolides (96-97%), clindamycin (85%), cefuroxime (71%), cefaclor (88%), cotrimoxazol (91%), tetracycline (79%) và chloramphenicol (68%). Trong khi S.pneumoniae kháng amoxicillin/a.clavulanic là rất thấp (chỉ 0,3%). Tuy nhiên MIC90 của amoxicillin/a.clavulanic là 3mg/L cao hơn so với kết quả nghiên cứu năm 2007 là 2 mg/L.
Nghiên cứu cũng ghi nhận đã có 5% vi khuẩn kháng được ofloxacin, so với nghiên cứu năm 2007 chưa có vi khuẩn kháng fluoroquinolones được ghi nhận. Năm 2018, một nghiên cứu thực hiện đa trung tâm trên bệnh nhân nhiễm khuẩn hô hấp dưới cộng đồng (nghiên cứu EACRI) thêm một lần nữa ghi nhận khuynh hướng gia tăng đề kháng kháng sinh đối với S.pneumoniae. Nếu như trong nghiên cứu SOAR, tỷ lệ đề kháng fluoroquinolone (ofloxacin) còn thấp, là 4,8% thì trong nghiên cứu EACRI có đến 29,2% kháng được levofloxacin. Ngay cả với fluoroquinolone được được xem là nhậy cảm tốt với S.pneumoniae là moxifloxacin, tỷ lệ đề kháng cũng được ghi nhận là 4,6%. Đáng chú ý so với nghiên cứu SOAR, trong nghiên cứu EACRI tỷ lệ S.pneumoniae kháng penicillin (ngưỡng MIC ≥8 mg/L) đã tăng tới 4,2% so với 1% cũng như MIC90 đã tăng tới 4 mg/L so với 3 mg/L. Tóm lại, các nghiên cứu trong nước về tình hình kháng thuốc của S.pneumoniae và H.influenzae có những ghi nhận cơ bản: 1) S.pneumoniae có khuynh hướng tăng đề kháng với penicillin trong khoảng một thập niên trở lại đây; 2) H.influenzae đề kháng kháng sinh nhóm beta-lactam chủ yếu bằng cơ chế tiết ra beta-lactamase cổ điển và nhậy cảm tốt với betalactam/kháng betalactamase và 3)
S.pneumoniae đang gia tăng đề kháng với fluoroquinolone hô hấp. Với những nhận định như trên, chiến lược kháng sinh cần có những lưu ý: 1) Sử dụng beta-lactam trong điều trị S.pneumoniae cần với liều thích hợp để đảm bảo điểm gãy PK/PD trên MIC90 đã ghi nhận ở mức 4 mg/L; 2) H.influenzae còn nhậy cảm tốt với kháng sinh kết hợp betalactam/kháng betalactamase; 3) S.pneumoniae giảm nhậy cảm khá cao với fluoroquinolone (bảng 1).
Bảng 1. MIC90, MIC70 và MIC50 của các kháng sinh trên các vi khuẩn S.pneumoniae và H.influenzae phân lập được
| MIC | S.pneumoniae (N=65) | H.influenzae (N=148) | ||||||||
| Clari | Levo | Moxi | Ax/As | Pn | Clari | Levo | Moxi | Ax/As | Pn | |
| MIC90 | 128 | 16 | 2 | 4 | 4 | 32 | 4 | 4 | 4 | 64 |
| MIC70 | 128 | 2 | 0,125 | 2 | 2 | 8 | 2 | 2 | 2 | 8 |
| MIC50 | 64 | 1 | 0,125 | 1 | 1 | 4 | 1 | 1 | 1 | 1 |
Viết tắt: Clari: clarithromycin, Levo: levofloxacin, Moxi: Moxifloxacin, Ax: Amoxicillin, Pn: Penicillin, As: Amoxicillin/sulbactam
2.3. Vi khuẩn gây bệnh không phổ biến và kháng thuốc
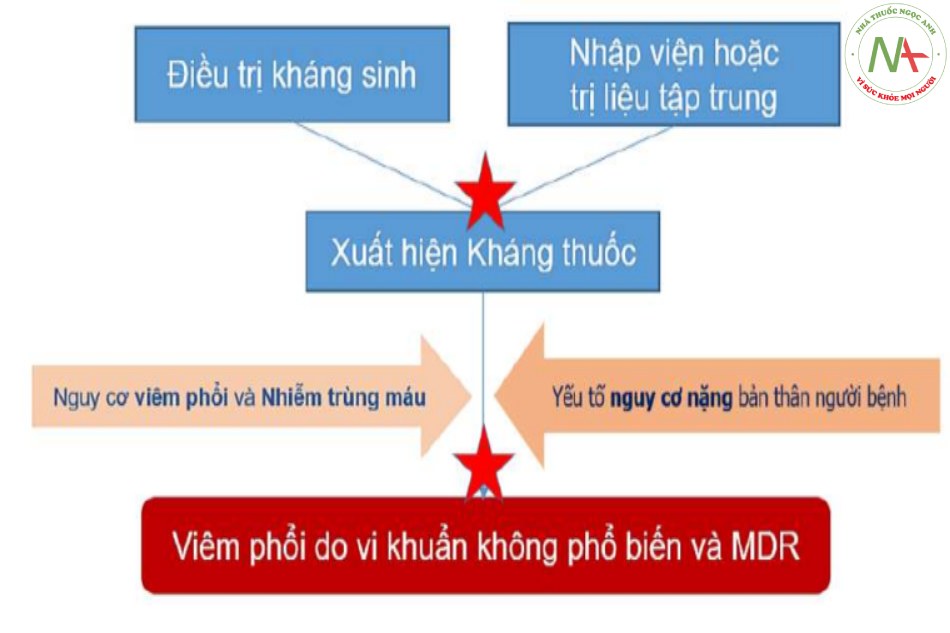
Viêm phổi là nhóm bệnh được tập trung nghiên cứu nhiều nhất về vi khuẩn gây bệnh kháng thuốc (drug-resistant pathogens, DRPs). Trong những năm gần đây, vi khuẩn gây bệnh kháng thuốc xuất hiện ở cộng đồng do việc mở rộng hệ thống chăm sóc sức khỏe và điều trị can thiệp ra ngoài bệnh viện. Vào năm 2005, trong tài liệu hướng dẫn của ATS/IDSA, một phân loại viêm phổi mới đã được đề xuất, viêm phổi liên quan tới chăm sóc y tế (Health care-associated pneumonia, HCAP). Hướng dẫn này cho rằng tất cả bệnh nhân HCAP nên được điều trị kháng sinh kinh nghiệm hướng tới DRPs. Tuy nhiên, có một số hạn chế đã phát sinh khi xem xét định nghĩa HCAP. Các vấn đề bao gồm: Các yếu tố xác định nguy cơ HCAP khác nhau giữa các quốc gia; Các yếu tố dự đoán nguy cơ nhiễm khác nhau giữa các loại vi khuẩn. Thời gian gần đây nhiều nghiên cứu đã được thực hiện theo hướng xác định các yếu tố nguy cơ đối với nhiễm khuẩn kháng thuốc. Tuy nhiên, mỗi nghiên cứu lại xác định yếu tố nguy cơ theo cách khác nhau. Năm 2015, Prima và cs đã đề xuất khái niệm viết tắt PES (P.aeruginosa, Enterobacteriaceae extended-spectrum beta-lactamase-positive và methicillin resistant S.aureus), cho các vi khuẩn gây bệnh trên bệnh nhân VPCĐ người lớn tình trạng miễn dịch bình thường nhập viện, bao gồm cả những trường hợp viêm phổi ở nhà dưỡng lão, có yêu cầu điều trị kháng sinh khác với viêm phổi cộng đồng thông thường. Gần đây, ở châu Âu có nhiều ý kiến không chấp nhận ý niệm viêm phổi kết hợp với chăm sóc y tế (HCAP). Người ta cho rằng định nghĩa HCAP có thể làm cho việc điều trị kháng sinh quá mức cần thiết, ý niệm về HCAP không xác định được chính xác vi khuẩn gây bệnh kháng thuốc và định nghĩa bao gồm cả những người suy giảm miễn dịch. Mặt khác, cũng đã có thông báo rằng kết cục không tốt trong HCAP không bị ảnh hưởng bởi vi khuẩn kháng thuốc hoặc bởi cách chọn kháng sinh mà đúng hơn, nó có liên quan tới tình trạng chung của bệnh nhân trong đó bao gồm bệnh đồng mắc và có tác giả cho rằng PES chỉ nên xác định trên những người có tình trạng miễn dịch bình thường. Đối với những người có suy giảm miễn dịch, nên được xem là nhóm có nguy cơ nhiễm khuẩn nguồn gốc bệnh viện. Bằng phân tích hồi quy đa biến, tiền sử nhập viện, ăn qua xông và tình trạng tiếp xúc kém là các yếu tố nguy cơ độc lập đối với nhiễm PES. Những lúng túng trong việc định nghĩa nguy cơ để từ đó chỉ định kháng sinh kinh nghiệm hợp lý nhằm giải quyết tình trạng kháng thuốc từ VPCĐ cho đến thời điển hiện tại chưa thể được giải quyết dựa trên các bằng chứng từ nghiên cứu. Do vậy khi đặt những bệnh nhân này trong môi trường có sử dụng kháng sinh là nhà dưỡng lão hay không phải nhà dưỡng lão cũng rất khó xem đây là nguy cơ được. Thêm nữa, ở Việt Nam, mô hình “nhà dưỡng lão” còn rất ít trong hệ thống y tế nên thuật ngữ này sử dụng vào thực tế trong nước sẽ khá gượng ép. Nhìn một cách khái quát, những yếu tố riêng lẻ như người già, sống ở nhà dưỡng lão, suy thận, bệnh đồng mắc… đều có thể mang đặc tính có chứa nguy cơ mà nhiều phân tích đã xác định, đó là có tiền sử nhập viện, tiền sử sử dụng kháng sinh. Trên nền tảng này, nguy cơ viêm phổi hít như nằm tại chỗ, nuôi ăn qua xông, sử dụng kéo dài thuốc ức chế bơm proton (PPIs), suy nhược cơ thể nặng, nguy cơ nhiễm bệnh từ da và niêm mạc như truyền dịch hay đặt catheter mạch máu kéo dài sẽ dễ dàng đưa tới nhiễm trực khuẩn Gram âm (gồm cả P.aeruginosa) và MRSA. Do vậy, yếu tố nhập viện, yếu tố sử dụng kháng sinh trước đó là quan trọng và có xuyên suốt trong các nghiên cứu phân tích nguy cơ. Đây chính là các yếu tố tạo ra vi khuẩn kháng thuốc. Vi khuẩn kháng thuốc có mặt trên cơ thể thông thường dưới hình thức tạo màng sinh học (biofilm) để từ đó tồn tại và phát triển. Kết hợp với đó là các yếu tố thuận lợi cho viêm phổi sẽ tạo ra viêm phổi do các chủng vi khuẩn mang đặc điểm của nhiễm khuẩn bệnh viện. Có thể diễn đạt sinh bệnh học nhiễm khuẩn không phổ biến và kháng thuốc bằng sơ đồ bên dưới (hình 2). Cho đến nay, tất cả các nghiên cứu đều thống nhất nhận định tỷ lệ nhiễm khuẩn không phổ biến và kháng thuốc từ cộng đồng thấp, khoảng <10%.
Đặc điểm kháng thuốc của vi khuẩn gây bệnh rõ ràng không giống nhau giữa các khu vực trên thế giới. Điều này là lý giải có sự khác nhau tương đối trong khuyến cáo sử dụng kháng sinh giữa các tài liệu hướng dẫn. Vấn đề sử dụng fluoroquinolone là một trong những nội dung trên và đã được đề xuất không nên chỉ định thường quy trong VPCĐ mức độ nhẹ. Điều trị theo phác đồ bằng fluoroquinolone hô hấp kinh nghiệm trong 5-10 ngày là phù hợp ngay cả ở những khu vực có dịch tễ lao cao. Tuy nhiên, rất cần tránh chỉ định fluoroquinolone khi chưa loại trừ được lao phổi và việc hạn chế sử dụng fluoroquinolone, nhất là sử dụng đơn độc, là cần thiết do nguy cơ gia tăng đề kháng, có thể làm chậm chẩn đoán lao phổi. Như vậy trị liệu kháng sinh kinh nghiệm nên hướng tới các tác nhân vi khuẩn phổ biến dựa trên betalactam, macrolide và fluoroquinolone, đơn độc hay kết hợp. Phác đồ kết hợp tỏ ra có hiệu quả tốt hơn so với đơn trị liệu và kết hợp thuốc cần chỉ định trên phân nhóm bệnh nhân có bệnh đồng mắc, có nguy cơ nhiễm khuẩn kháng thuốc và bệnh nhân nặng nhập viện.
Phác đồ điều trị kết hợp với macrolide có hiệu quả trên những trường hợp có tham gia gây bệnh của vi khuẩn không điển hình, đồng nhiễm và S.pneumoniae kháng thuốc. Trên trẻ em 1-18 tuổi viêm phổi không nhập viện, hiệu quả điều trị của betalactam đơn trị và macrolide đơn trị là tương đương.
Trong viêm phổi bệnh viện và thở máy, các báo cáo sử dụng dữ liệu từ các nghiên cứu giám sát tại bệnh viện cũng như từ Hiệp hội Bệnh truyền nhiễm Mỹ (IDSA) đã gọi nhóm các vi khuẩn gây nhiễm trùng bệnh viện là “ESKAPE”, bao gồm: Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa và Enterobacter species. Trong số này, K. pneumoniae là vi khuẩn, theo Báo cáo toàn cầu năm 2014 của Tổ chức Y tế Thế giới (WHO) về Giám sát tình trạng kháng thuốc, được coi là một trong ba loài gây nhiễm trùng hàng đầu ở người, bao gồm nhiễm trùng đường tiết niệu, viêm phổi, viêm màng não, nhiễm trùng đường ruột và nhiễm trùng huyết. Trong viêm phổi bệnh viện do K. pneumoniae, tỷ lệ tử vong có thể vượt quá 50% ở những bệnh nhân dễ bị tổn thương, ngay cả khi được điều trị bằng kháng sinh đầy đủ. Ở châu Âu, giám sát kháng thuốc kháng sinh đối với fluoroquinolone, aminoglycoside, cephalosporin thế hệ thứ ba và kháng carbapenem cho thấy hơn một phần ba số chủng K. pneumoniae (37,2%) đã kháng với ít nhất một trong các loại kháng sinh, với khả năng kháng tỷ lệ dao động từ 31,7% đối với cephalosporin thế hệ thứ ba đến 7,5% đối với carbapenems. Vi khuẩn này có các enzym kháng với nhiều loại kháng sinh nhóm betalactams. Việc sử dụng carbapenems quá mức, đặc biệt là để chống lại các bệnh nhiễm trùng do Enterobacteriaceae, đã tạo ra áp lực chọn lọc thúc đẩy sự xuất hiện và gia tăng sự phổ biến của các enzym khác nhau có hoạt tính carbapenemase. Để đối phó với tỷ lệ ngày càng tăng của các bệnh nhiễm khuẩn Enterobacteriaceae sinh carbapenemase, có hai khuynh hướng sử dụng kháng sinh: i) Khuynh hướng kết hợp betalactam phổ rộng với các kháng betalactamase (như Ceftazidime-avibatactam, Meropenemvaborbactam) và ii) Sử dụng các kháng sinh cũ như Tigecycline, Fosfomycin, polymyxin. Các lựa chọn điều trị cuối cùng thường áp dụng cho các loại thuốc độc hơn và không được phổ biến rộng rãi như Colistin (polymyxin E), polymyxin B, Fosfomycin, Tigecycline và aminoglycoside (ví dụ: Gentamycin). Trong số này, Colistin ngày càng được sử dụng phổ biến như một loại thuốc cuối cùng để điều trị các bệnh nhiễm trùng phức tạp do Enterobacteriaceae MDR tạo carbapenemase.
3. LIÊN HỆ LÂM SÀNG VÀ ĐIỀU TRỊ KHÁNG SINH
3.1. Vi khuẩn kháng thuốc và đặc điểm lâm sàng
Chậm điều trị kháng sinh hợp lý làm tăng nguy cơ diễn biến xấu và tử vong trong VPCĐ. Chỉ định kháng sinh kinh nghiệm cần dựa trên các phân tích để không bỏ sót khả năng nhiễm khuẩn không phổ biến. Về việc này, ba nguyên tắc cơ bản cần được xem xét đó là: 1) Có nguy cơ nhiễm khuẩn kháng thuốc hay không mà việc dự đoán chủ yếu dựa vào tiền sử điều trị kháng sinh của bệnh nhân trong 90 ngày trước đó, trong đó gồm cả tiền sử nhập viện điều trị trên 2 ngày; 2) Có nguy cơ nhiễm khuẩn ít gặp trong đó gồm cả trực khuẩn Gram(-) và P.aeruginosa mà việc dự đoán chủ yếu dựa trên đánh giá cơ địa người bệnh (người già, người có bệnh mạn tính phổi, người suy giảm sức đề kháng, người có nguy cơ viêm phổi hít); 3) Có nguy cơ nhiễm S.aureus hay không, nhất là MRSA, chủ yếu dựa trên đánh giá nguy cơ nhiễm khuẩn qua da, niêm mạc, viêm phổi sau cúm, đặc điểm diễn biến lâm sàng và hình ảnh Xquang ngực. Tuy nhiên với bất luận căn nguyên vi sinh là gì, việc chỉ định kháng sinh phổ rộng và kết hợp trên những trường hợp được đánh giá nặng là nguyên tắc do trị liệu kháng sinh giúp làm giảm nhanh tình trạng nhiễm trùng toàn thân, tránh được nguy cơ kháng thuốc và bao phủ được phổ rộng các tác nhân vi sinh gây bệnh kết hợp. Do vậy, việc đánh giá mức độ nặng của bệnh lại càng rất quan trọng và cần được thực hiện đầy đủ trước khi quyết định điều trị kháng sinh.
Trong VPCĐ, trên hầu hết các trường hợp, nhất là khi khởi đầu điều trị, chỉ định điều trị kháng sinh là kinh nghiệm, tức là không dựa trên kết quả cụ thể của xét nghiệm vi sinh và đặc tính nhậy cảm kháng sinh của vi khuẩn.
Tính định hướng tác nhân vi sinh từ triệu chứng lâm sàng nhìn chung là không rõ ràng. Các tình huống thực hành đối với thầy thuốc nhìn từ góc độ tác nhân vi sinh gây bệnh và chỉ định kháng sinh kinh nghiệm bao gồm:
i) Mức độ nặng của bệnh
ii) Nguy cơ nhiễm khuẩn không phổ biến và kháng thuốc
iii) Đồng nhiễm tác nhân vi sinh gây bệnh.
Phân tích liên quan giữa vi khuẩn gây bệnh và mức độ nặng trên bệnh nhân VPCĐ cả ở cộng đồng và nhập viện cho thấy S.pneumoniae và tình trạng đồng nhiễm tăng trên bệnh nhân nhập viện và vào ICU trong khi vi khuẩn không điển hình giảm. Những trường hợp nhiễm trực khuẩn Gram(-), P.aeruginosa, S.aureus và đồng nhiễm có tỷ lệ tử vong cao nhất. Phân tích đồng nhiễm trên bệnh nhân VPCĐ nhập viện cho thấy có 13% các trường hợp đồng nhiễm, trong đó nhiều nhất là S.pneumoniae với H.influenzae và S.pneumoniae với virus cúm A. Các trường hợp đồng nhiễm vi khuẩn sinh mủ (pyogenic bacteria) kết hợp sốc nhiễm khuẩn nhiều hơn. Trên VPCĐ ở tất cả các mức độ nặng, điều trị ở cộng đồng hay nhập viện, S.pneumoniae, virus và vi khuẩn không điển hình đều chiếm tỷ lệ cao nhất. Phân tích những trường hợp đồng nhiễm trên bệnh nhân VPCĐ nhập ICU cho thấy S.pneumoniae, virus và P.aeruginosa là hay gặp nhất. Tình trạng đồng nhiễm thường gặp trên những người có bệnh hô hấp mạn tính và ARDS. Nhóm bệnh nhân đồng nhiễm được điều trị kháng sinh không phù hợp nhiều hơn và điều trị kháng sinh không phù hợp làm tăng nguy cơ tử vong bệnh viện.
3.2. Đánh giá mức độ nặng
Đánh giá mức độ nặng và quyết định nơi điều trị cho bệnh nhân VPCĐ là mấu chốt đảm bảo an toàn và phân bổ nguồn lực đầy đủ cho việc chăm sóc bệnh nhân và nhất là chỉ định kháng sinh hợp lý.
Cần nhập viện hay điều trị ngoài bệnh viện là quyết định quan trọng khi xử trí VPCĐ. Trong điều kiện khám bệnh ngoài bệnh viện, thang điểm CURB-65 với phiên bản đơn giản hơn là CRB-65 do Hội Lồng Mỹ ngực xây dựng là thuận tiện nhưng chỉ nên sử dụng với mục đích xác định có cần nhập viện hay không vì các yếu tố nặng, có nguy cơ tử vong sớm thể hiện trên xét nghiệm khí máu, công thức máu ngoại vi và sinh hóa máu không được đánh giá trong khi các xét nghiệm này là khả thi trong điều kiện nhập viện mặc dù CURB-65 cũng tỏ ra dự đoán tốt nguy cơ tử vong. Cũng hướng tới xác định nhóm VPVĐ nguy cơ thấp để quyết định điều trị ngoài bệnh viện thang điểm PSI (pneumonia severe index) (hình 3) có 4 tiêu chí xác định với 20 thông số, cho điểm từng thông số để vào xếp thành 5 nhóm nguy cơ theo mức độ nặng (từ I-V). Thang điểm này khá chi tiết, gồm cả giới, số tuổi, sống ở nhà dưỡng lão, và cụ thể các bệnh đồng mắc (ung thư, bệnh gan, suy tim xung huyết, bệnh mạch não, bệnh thận) đã làm cho thực hành khó thực hiện, nhất là ở điều kiện ngoài bệnh viện. Hơn nữa cách xếp nhóm nguy cơ nặng của PSI theo cách tính điểm cho từng thông số khá khó nhớ nên tính thực hành không cao, chủ yếu được sử dụng trong các nghiên cứu. Thêm nữa, với tiêu chí xác định nhóm nguy cơ thấp để quyết định điều trị ngoài bệnh viện thang điểm PSI cũng có tính đặc hiệu không cao. PSI sẽ khó quyết định nhập viện trên nhóm nguy cơ thấp nếu như bệnh nhân có ít nhất một trong các yếu tố: Giảm Oxy máu <60 mmHg, sốc, mất bù bệnh đồng mắc, tràn dịch màng phổi, không thể uống thuốc, có vấn đề về cuộc sống xã hội, thiếu đáp ứng ban đầu với kháng sinh kinh nghiệm.
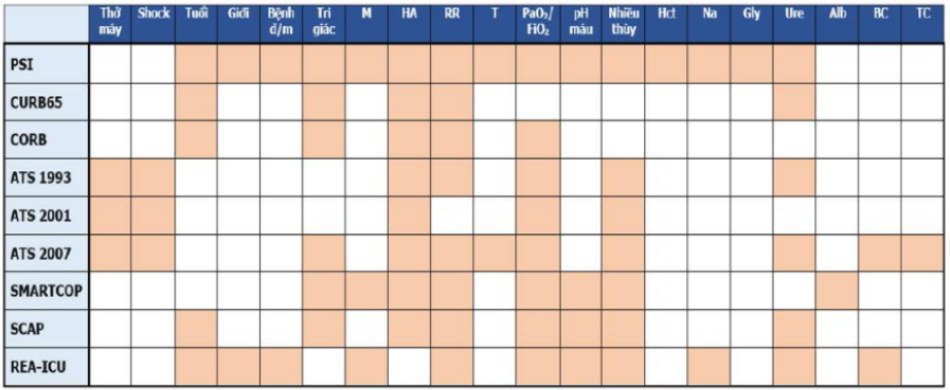
(Ô mầu vàng là các yếu tố được xác định là nguy cơ trong từng thang điểm. đ/m: đồng mắc, M: mạch, HA: hyết áp, RR” nhịp thở,
T: nhiệt độ, Nhiều thùy: tổn thương đánh giá trên Xquang ngực, Hct: hematocrit, Na: natri máu, Gly: đường máu, Ure: ure máu, Alb: albumin máu, BC: bạch cầu máu, TC: tiểu cầu máu).
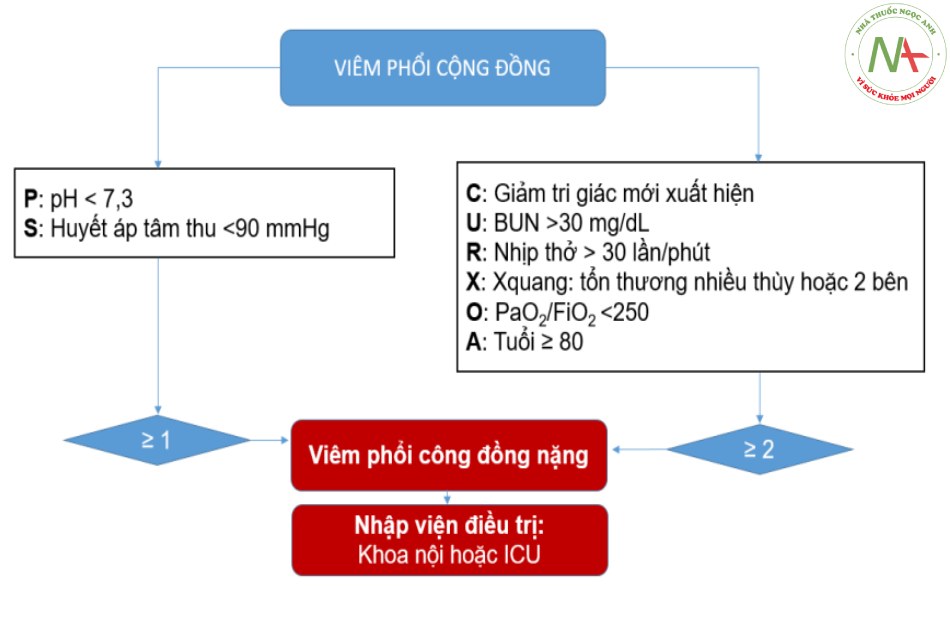
Cũng với quan điểm quyết định nơi điều trị, có cần vào khoa chăm sóc tích cực (ICU) hay không cũng là rất quan trọng. Năm 2007, ATS/IDSA đề xuất có chỉnh sửa so với ATS 2001, tăng từ 3 tiêu chuẩn phụ lên thành 9 tiêu chuẩn phụ nhưng độ nhậy và độ đặc hiệu không cải thiện so với khuyến cáo 2001. Nhược điểm của các thang điểm ATS đề xuất đối với nhu cầu nhập ICU là ở hai thông số chính: Cần thở máy và cần sử dụng thuốc vận mạch. Hai thông số với thuật ngữ thiếu tính xác định làm cho thực hành áp dụng không thuận tiện. Gần đây, hai thang điểm hướng tới quyết định nhập ICU được đề xuất: Thang điểm SMARTCOP năm 2008 (viết tắt từ: Systolic blood pressure, Multilobar infiltrates, Albumin, Respiratory rate, Tachycardia, Confusion, Oxygen và pH) và thang điểm SCAP năm 2006 (gồm 2 thông số chính: pH, systolic blood pressure và 6 thông số phụ: confusion, urea, respiratory rate, multilobar infiltrates, oxygen, age ≥80). Hai thang điểm này thiết kế để đánh giá mức độ nặng và quyết định vào ICU với nhiều nội dung, đánh giá cụ thể, cho điểm theo cách bán định lượng (mỗi yếu tố 1 điểm) nên đã khắc phục được nhược điểm của của thang điểm CURB-65 cũng như thang điểm của ATS. Hai thang điểm SMARTCOP và SCAP có năng lực phân biệt (discriminatory power) mạnh hơn và nhất là SCAP với AUC >0,8 và giá trị dự đoán âm (negative predictive value) là cao nhất (nhu cầu thở máy: 1,0 và nhu cầu sử dụng vận mạch: 0,99). Cụ thể kết quả phân tích thang điểm SCAP và hướng dẫn như bảng 2, hình 4.
Bảng 2. Các yếu tố nguy cơ nhập ICU theo thang điểm SCAP
| Thông số phân tích | OR | Xác định chính – phụ |
| pH <7,3 | 10.8 (3,5–34,0) | Yếu tố chính |
| Huyết áp tâm thu <90 mmHg | Yếu tố chính | |
| Nhịp thở >30 lần/phút | Yếu tố phụ | |
| BUN >30 mg/dL | Yếu tố phụ | |
| Giảm tri giác mới xuất hiện | Yếu tố phụ | |
| PaO2/FiO2 <250 | Yếu tố phụ | |
| Tuổi ≥80 | Yếu tố phụ | |
| Xquang: Tổn thương nhiều thùy hoặc 2 bên | Yếu tố phụ |
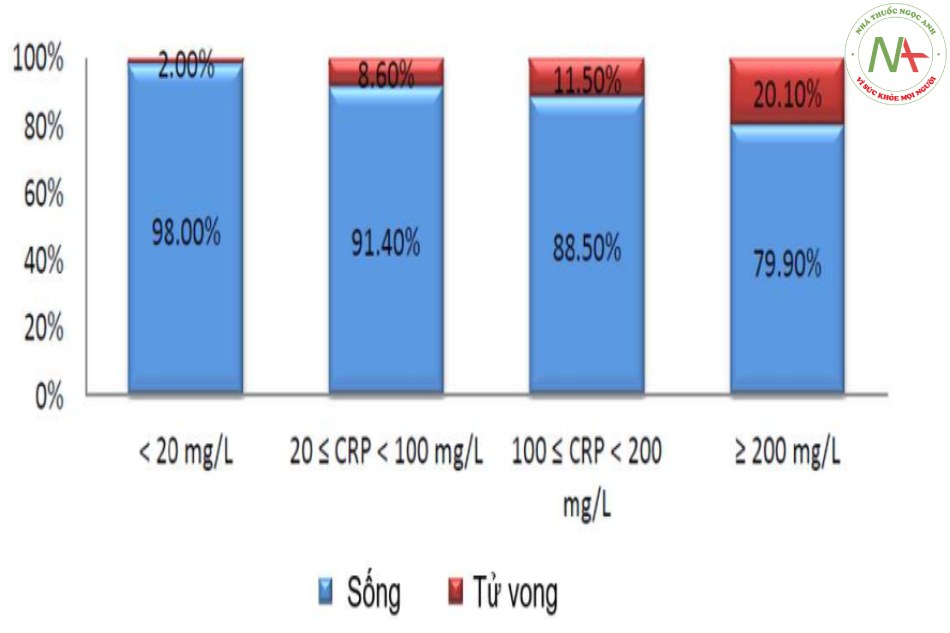
Bên cạnh thang điểm đánh giá mức độ nặng VPCĐ, trong những năm gần đây, việc sử dụng các dấu ấn sinh học (biomarker) trong thực hành lâm sàng, nhất là trong bệnh viện, được chú ý nhiều. Hầu hết các biomarker đều có giá trị tiên lượng độc lập với tử vong sớm, tử vong muộn, nhập ICU và thất bại điều trị. Tuy nhiên các nghiên cứu không chứng minh được vai trò hơn hẳn của biomarker so với các thang điểm dự đoán nhưng khi kết hợp các biomarker, trong đó có protein C phản ứng (C reactive protein, CRP), sẽ giúp làm tăng khả năng dự đoán. CRP là một xét nghiệm rẻ tiền và dễ thực hiện, được nghiên cứu rất nhiều về tính ứng dụng trong đánh giá và theo dõi VPCĐ. CRP tăng có mối tương quan có ý nghĩa với thang điểm CURB-65, thời gian nằm viện, thời gian sử dụng kháng sinh và kết cục lâm sàng. Tăng CRP khi nhập viện có khuynh hướng làm chậm thời gian bình phục và CRP tăng ở ngày thứ 4 của điều trị kết hợp có ý nghĩa với các biến chứng. Bên cạnh giá trị tiên lượng, CRP còn được các nghiên cứu xác định là yếu tố giúp theo dõi hiệu quả điều trị. CRP không giảm 50% hoặc hơn ở ngày thứ 4-5 của điều trị kết hợp có ý nghĩa với tăng tử vong, tăng thời gian điều trị và tăng biến chứng (bảng 3 và hình 5). CRP tăng cao nhất đối với S.pneumoniae, tăng thấp hơn nếu nhiễm vi khuẩn không điển hình và tăng thấp nhất khi nhiễm virus..
Bảng 3. Các chỉ điểm (indicators) và thay đổi giá trị trung bình CRP
| Đặc điểm chỉ điểm | CRP (mg/L) khi chỉ điểm (+) | CRP (mg/L) khi chỉ điểm (-) |
Giá trị p |
| Bệnh đồng mắc | 138,29 ± 98,44 | 109,21 ± 97,70 | <0,001 |
| Biến chứng ở phổi | |||
| TDMP | 142,80 ± 100,28 | 124,38 ± 98,39 | <0,01 |
| Hóa hang phổi | 154,86 ± 97,63 | 127,64 ± 99,07 | <0,05 |
| Suy hô hấp cấp | 168,28 ± 93,18 | 107,46 ± 95,73 | <0,001 |
| Thâm nhiễm nhiều thùy | 170,73 ± 100,62 | 115,25 ± 94,73 | <0,001 |
| Điều trị ICU | 176,11 ± 93,85 | 116,71 ± 96,77 | <0,001 |
| Tử vong | 171,85 ± 83,17 | 123,42 ± 99,68 | <0,001 |
Nhìn một cách khái quát, tác động trên tình trạng nặng của VPCĐ gồm 4 yếu tố: 1) Yếu tố cơ địa thuận lợi (predisposition), 2) Tình trạng nhiễm trùng (infection) 3) Phản ứng của cơ thể và 4) Rối loạn chức năng tạng.
Tiên lượng VPCĐ cần được đặt trong sự phân tích tổng hòa của 4 yếu tố trên thay vì chỉ lưu ý đến vi sinh gây bệnh và sử dụng kháng sinh.
3.3. Điều trị kháng sinh kinh nghiệm
Tổng quan các nghiên cứu trong khoảng 1 thập niên trở lại đây cho thấy đặc tính vi sinh gây bệnh trên VPCĐ không thay đổi và không khác nhau giữa các khu vực trên thế giới. Tỷ lệ vi khuẩn gây bệnh không phổ biến thấp, chỉ khoảng 10%. Có sự hiện diện với tỷ lệ cao của các vi khuẩn không điển hình. Hiện tượng đồng nhiễm có tỷ lệ cao và đã có bằng chứng cho thấy đồng nhiễm làm cho lâm sàng và các kết cục của VPCĐ xấu đi. Phân tích đặc điểm vi sinh phân lập được bằng áp dụng đồng thời các phương pháp xét nghiệm cấy, chẩn đoán huyết thanh và PCR cho thấy tuổi tăng và mức độ nặng tăng làm tăng khả năng phân lập được vi sinh gây bệnh, gồm cả virus, vi khuẩn và kết hợp virus-vi khuẩn. Vai trò vi khuẩn gây bệnh không điển hình quan trọng hơn điều chúng đã nghĩ và trị liệu kinh nghiệm hướng tới nhóm vi khuẩn này là cần thiết. Tiếp cận điều trị kháng sinh kinh nghiệm cần dựa trên đánh giá mức độ nặng. Đây là quan điểm rất hợp lý cả về mặt vi sinh gây bệnh.
Trên cơ sở những phân tích như trên, ở Việt Nam khuyến cáo phác đồ điều trị kháng sinh kinh nghiệm trong VPCĐ đã được chấp thuận trong một hội thảo khoa học đồng thuận các chuyên gia năm 2019 như sau (bảng 4).
Bảng 4. Các phác đồ kháng sinh kinh nghiệm
|
PĐ1 |
Nên áp dụng cho người lớn: Amoxicillin uống
Nên áp dụng cho trẻ em: Amoxicillin uống – hoặc Clarythromycin uống – hoặc Azithromycin uống |
|
PĐ1+ |
Amoxicillin / kháng betalactamase uống (liều tính theo amocixillin)
– hoặc Moxifloxacin uống – hoặc Levofloxacin uống |
|
PĐ2 |
Amoxicillin uống hoặc tĩnh mạch Kết hợp với:
– hoặc Clarythromycin uống – hoặc Azithromycin uống |
|
PĐ2+ |
Amoxicillin / kháng betalactamase uống hoặc tĩnh mạch
– hoặc Ceftriaxone tĩnh mạch – hoặc Cefotaxime tĩnh mạch Kết hợp với: – hoặc Moxifloxacin uống hoặc tĩnh mạch – hoặc Levofloxacin uống hoặc tĩnh mạch. – Macrolide (Clarythromycin, Azithromycin) đối với trẻ em. |
|
PĐ3 |
Ceftriaxone
– hoặc Cefotaxime Kết hợp với: – hoặc Moxifloxacin – hoặc Levofloxacin |
|
PĐ3+ |
Carbapenem (Imipenem, Meropenem)
– hoặc Piperacilline/tazobactam – hoặc Cefepime Kết hợp với: – hoặc Ciprofloxacin – hoặc Levofloxacin (liều 750 mg/ngày) Kết hợp hay không với: – hoặc Amikacin – hoặc Tobramycin |
Lưu ý:
- PĐ (phác đồ), PĐ+ (phác đồ dành cho những trường hợp có nguy cơ nhiễm vi khuẩn gây bệnh không phổ biến, kháng thuốc hoặc là phác đồ thay thế khi không đáp ứng sau 72 giờ). Thời gian điều trị Phác đồ 1, 2 từ 5-7 ngày; Phác đồ 3 từ 7-10 ngày.
- Liều Amoxicilline cần đạt được Time/MIC90 >35 với MIC: 4 mg/L
- Các thuốc đều cần điều chỉnh theo chức năng thanh thải của gan và thận.
- Amoxicillin/kháng betalactamase (a.clavulanic, sulbactam): thí dụ: Augmentin, Claminat, Bactamox.
- Tất cả các phác đồ đều có thể chuyển từ thuốc tiêm sang thuốc uống khi tình trạng bệnh thuyên giảm và bệnh nhân có thể sử dụng thuốc uống được. Liều thuốc uống tương đương với liều tiêm. Khi khởi đầu bằng Cephalosporin thì chuyển uống bằng Amoxicillin/kháng betalactamase.
- Các fluoroquinolone đều không khuyến cáo dùng cho trẻ em và phụ nữ mang thai hay cho con bú trừ khi bắt buộc.
- Nếu nghi ngờ MRSA: Linezolid hoặc Vancomycin
Tài liệu tham khảo
- Woodhead et al. Guidelines for the management of adult lower respiratory tract infections – Full version. Clin Microbiol Infect 2011; 17(Suppl. 6): E1–E59.
- Mandell LA, Wunderink RG, Anzueto A, et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults. Clin Infect Dis 2007; 44: Suppl. 2, S27–S72.
- Woodhead M, Blasi F, Ewig S, et al. Guidelines for the management of adult lower respiratory tract infections – summary. Clin Microbiol Infect 2011; 17: Suppl. 6, 1–24.
- Huong et al. First report on prevalence and risk factors of severe atypical pneumonia in Vietnamese children aged 1–15 years. BMC Public Health 2014, 14:1304
- Forest W. Arnold, James T. Summersgill, Andrew S. LaJoie et al A Worldwide Perspective of Atypical Pathogens in Community-acquired Pneumonia. Am J Respir Crit Care Med Vol 175. pp 1086–1093, 2007
- Prina E, Ranzani OT, Polverino E, Cilloniz C, Ferrer M, Fernandez L, et al. Risk factors associated with potentially antibiotic-resistant pathogens in community-acquired pneumonia. Annals ATS 2015;12:153-60.
- Van P.H. et al. The multicenter study in Vietnam on the antibiotic resistance S. pneumoniae – The results from 204 clinical isolates. Hochiminh City Medicine 2007. 11: Supplement 3, 67-77.
- PH Vân; PT Bình; ĐM Phương và cs. Tình hình đề kháng kháng sinh của S.pneumoiae và H.influenzae phân lập từ NKHH cấp – Kết quả nghiên cứu đa trung tâm thực hiện tại Việt Nam (SOAR) 2010-2011. YHTH 85512, 2012. 6-11
- H.Vân, N.V.Thành, T.V.Ngọc, N.Đ.Duy, L.T.T.Hương, C.T.M.Thúy, L.T.K.Thảo, N.T.H.Thảo, P.T.Hương, P.Q.Camelia, P.T.Sơn. Tác nhân vi sinh gây nhiễm trùng hô hấp dưới cộng đồng cấp tính không nhập viện: Kết quả bước đầu từ nghiên cứu EACRI. Thời sự Y học TP Hồ Chí Minh, 9/2018: 52-62.
- Miteva D, Radkov Y, Kostadinova V. Role of c-reactive protein in severity assessment and monitoring of hospitalized patients with community-acquired pneumonia. World science. № 6(34), Vol.5, June 2018
- NV Thành (thay mặt Ban chuyên gia, Tổng hội y học Việt Nam chủ trì). Biên bản đồng thuận chuyên gia: Cập nhật chẩn đoán và điều trị viêm phổ cộng đồng. NXB Y học 2019.
- ĐN Sỹ, NV Thành, PH Vân và cs. Xác định tác nhân vi sinh gây bệnh và nhận xét hiệu quả điều trị ngoại trú của amoxicillin/sulbactam (Bactamox 1g) trên bệnh nhân nhiễm khuẩn hô hấp dưới cấp tính cộng đồng. Y Học Việt Nam, tháng 1, số 2, 2019. Tập 474, tr.176-183
- P Crowther-Gibson, N Govender, D A Lewis et al. Part IV. Human infections and antibiotic resistance. August 2011, Vol. 101, No. 8. SAMJ
- European Centre for Disease Prevention and Control. Surveillance of Antimicrobial Resistance in Europe 2018; ECDC: Stockholm, Sweden, 2019.
- World Health Organization. Antimicrobial Resistance: Global Report on Surveillance; World Health Organization: Geneva, Switzerland, 2014.
- Navon-Venezia, S.; Kondratyeva, K.; Carattoli, A. Klebsiella pneumoniae: A major worldwide source and shuttle for antibiotic resistance. FEMS Microbiol. Rev. 2017, 41, 252–275
- Mathers, A. Mobilization of Carbapenemase-Mediated Resistance in Enterobacteriaceae. Microbiol. Spectr. 2016, 4, 1–10
- Biswas, S.; Brunel, J.M.; Dubus, J.C.; Reynaud-Gaubert, M.; Rolain, J.M. Colistin: An update on the antibiotic of the 21st century. Expert Rev. Anti-Infect. Ther. 2012, 10, 917–934
- Petrosillo, N.; Taglietti, F.; Granata, G. Treatment Options for Colistin Resistant Klebsiella pneumoniae: Present and Future. J. Clin. Med. 2019, 8, 934
- European Centre for Disease Prevention and Control. Antimicrobial Consumption in the EU/EEA, Annual Epidemiological Report for 2018; ECDC: Stockholm, Sweden, November 2019