Bệnh da liễu, Bệnh tiêu hóa
Trục Ruột- Da: Vai trò trong sức khỏe và bệnh tật
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Để tải về bài viết Trục Ruột- Da: Vai trò trong sức khỏe và bệnh tật pdf mời các bạn click vào link ở đây.
Tác giả: Alok Malaviya, K. Vamsi Krishna, Shruti Malviya và T. Nimisha Das Dịch: Bs. Trương Tấn Minh Vũ
Tóm tắt
Hệ vi sinh ở người bao gồm các vi sinh vật và các vật chất di truyền tích lũy của chúng trong cơ thể người. Da là cơ quan bên ngoài của cơ thể và tiếp xúc với môi trường bên ngoài, là một hệ sinh thái với diện tích 1,8 m2. Da có độ dày biểu bì, nếp gấp và phần phụ thay đổi ở các vị trí khác nhau cùng với độ ẩm và nhiệt độ khác nhau trên bề mặt. Sự xâm chiếm của vi sinh vật trên bề mặt da bắt đầu từ khi trẻ mới sinh ra, phương pháp sinh ảnh hưởng đến quá trình xâm chiếm ở một mức độ đáng kể. Nhóm vi khuẩn cư trú trên bề mặt da được xác định bởi các đặc điểm vật lý và hóa học của nó, cũng được áp dụng cho các vi khuẩn sống trong ruột và các hốc sinh thái khác trong cơ thể. Có một số đặc điểm quan trọng chung phổ biến ở ruột và da, nơi cả hai đều có (1) mạch máu nhiều, (2) tưới máu dồi dào, (3) bố trí thần kinh dày, (4) tích hợp với hệ thống miễn dịch, (5) liên quan nhiều đến hệ thống nội tiết, (6) bị xâm chiếm bởi hệ vi sinh vật được nhận biết, và (7) cả hai đều giúp cơ thể giao tiếp với môi trường bên ngoài. Nhiều báo cáo khác nhau về mối liên hệ chặt chẽ và hai chiều giữa ruột và da trong việc duy trì cân bằng nội môi và cân bằng của da cũng như sức khỏe đường tiêu hóa (GI). Do đó, nhiều bệnh lý đường ruột có liên quan đến các bệnh đi kèm về da. Người ta nhận thấy rằng da bị tác động trực tiếp bởi các trường hợp khác nhau mà chủ yếu ảnh hưởng đến ruột. Tương tự, các rối loạn tiêu hóa khác nhau có thể liên quan đến các bệnh da riêng biệt. Trong bối cảnh tương tự, ngày càng có nhiều bằng chứng cho thấy mối liên hệ của chứng loạn khuẩn ruột với nhiều bệnh lý viêm da thông thường bao gồm viêm da cơ địa dị ứng (atopic dermatitis, AD), vẩy nến (psoriasis), trứng cá đỏ (rosacea) và mụn trứng cá (acne vulgaris). Và việc nhận ra mối liên hệ liên kết giữa da và ruột này đã dẫn đến một khái niệm mới về “Trục Ruột- Da”. Sự gắn bó mật thiết hai chiều giữa ruột và da đã được thiết lập bởi các bằng chứng nghiên cứu ngày càng tăng trong lĩnh vực này. Các báo cáo gần đây đã chỉ ra rằng việc sử dụng các chủng Lactobacilli cụ thể cho chuột có thể làm thay đổi đáng kể kiểu hình da tổng thể. Mặc dù nỗ lực nghiên cứu đang tăng trong lĩnh vực này, một đánh giá hệ thống về “Trục ruột- da” vẫn chưa được khám phá bởi cả các chuyên gia tiêu hóa cũng như da liễu. Và trong bài này chúng ta thảo luận về các khía cạnh khác nhau của trục ruột- da và vai trò của nó đối với sức khỏe tổng thể của các cá nhân.
Giới thiệu
Tổng số vi sinh vật hiện diện trong một môi trường được gọi là “hệ vi sinh vật” (“microbiome” hoặc “microbiota”) (Adamczyk và cộng sự 2018; Kim và Kim 2019). Các vi sinh vật cùng với thông tin di truyền chung của chúng có trong cơ thể con người tạo thành hệ vi sinh vật của con người. Và do đó, thông tin di truyền được lưu trữ trong hệ vi sinh vật được coi là phó bản của bộ gen người và đại diện cho việc tổng hợp toàn bộ thông tin di truyền trong một cá nhân (Mańkowska-Wierzbicka và cộng sự 2015). Cơ thể con người đóng vai trò như một hệ sinh thái vi sinh vật, là nơi sinh sống của các loài vi sinh vật khác nhau. Một số vị trí trong cơ thể con người từ da đến khoang miệng, đường tiêu hóa, đường hô hấp và hệ thống sinh dục là những vị trí được vi sinh vật cư trú (Kong và Segre 2012; Schommer và Gallo 2013; Adamczyk và cộng sự 2018; Ellis và cộng sự năm 2019; Lee và cộng sự 2019).
Da
Da là cơ quan bên ngoài và tiếp xúc nhiều nhất của cơ thể con người, có diện tích khoảng 1,8 m2, đại diện cho một hệ sinh thái vi sinh vật sinh sống. Sự thay đổi về độ dày biểu bì, các nếp gấp, các phần phụ và các mức độ ẩm và nhiệt độ bề mặt da khác nhau có ảnh hưởng đáng kể đến thành phần và sự phân bố số lượng của các loài vi sinh vật hiện diện trên bề mặt da (Grice và Segre 2013; Adamczyk et al. 2018). Một số sinh vật sống trên da bao gồm vi khuẩn, nấm, vi rút và mạt. Trong hầu hết các trường hợp, các thành phần của hệ vi sinh vật trên da là vô hại và duy trì mối liên kết cộng sinh với các tế bào da gồm cộng sinh, ký sinh và hội sinh (Adamczyk et al. 2018). Vai trò chính của da gồm (1) bảo vệ cơ thể khỏi sự tấn công có thể xảy ra bởi các sinh vật bên ngoài hoặc các vật chất độc hại khác, (2) phản công lại các thách thức và (3) phản ứng một cách thích hợp với mọi xâm nhập nguy hiểm.
Mặc dù da tiếp xúc hoàn toàn với môi trường bên ngoài, chỉ một số vi sinh vật được chọn lọc hiện diện ưu thế trên bề mặt da do chúng thích ứng với các thành phần vật lý và hóa học của da. Các yếu tố góp phần vào môi trường sống đặc trưng của da gồm (1) độ dày, (2) số nếp gấp, (3) mật độ nang lông và (4) các tuyến khác nhau hiện diện trên da. Nói chung, môi trường da mát, có tính axit và khô. Lớp biểu bì đại diện cho một hàng rào vật lý trên bề mặt da, chống lại sự xâm nhập của vi khuẩn và độc tố tiềm ẩn bên trong cơ thể, đồng thời giữ độ ẩm và chất dinh dưỡng bên trong cơ thể. Các tế bào sừng biệt hóa ở giai đoạn cuối, không nhân tạo nên lớp trên cùng của biểu bì, còn được gọi là lớp sừng. Chúng còn được gọi là “vảy”, cấu tạo gồm các sợi keratin với liên kết chéo, các vảy sừng hoá được nhúng các lớp lipid kép, do đó tạo thành “gạch và vữa” của biểu bì. Những “vảy” này liên tục bong ra khỏi bề mặt da khiến da trở thành một cơ quan tự đổi mới liên tục.
Các cấu trúc khác nhau trên da như các khoang của da và các phần phụ liên quan như tuyến mồ hôi eccrine và apocrine, tuyến bã nhờn và nang lông được biết là có hệ vi sinh vật đặc trưng của chúng. Trong số này, các tuyến eccrine hầu như được thấy trên tất cả các bề mặt da, giúp (1) tưới nước liên tục bề mặt da với chất bài tiết tạo thành từ nước và muối, do đó giúp điều hòa nhiệt độ của cơ thể con người; (2) bài tiết nước và điện giải; và (3) tính axit của da, ngăn chặn sự phát triển và xâm chiếm của vi sinh vật. Các tuyến apocrine có vị trí cụ thể và hiện diện ở nách, núm vú và các vùng sinh dục và chúng tạo ra một “chất tiết” màu trắng sữa, nhớt và không mùi để đáp ứng với hormone adrenaline, có chứa pheromone kích hoạt các hành vi cụ thể chẳng hạn như tình dục hoặc báo động ở người nhận. Quá trình tác động của vi khuẩn lên các chất tiết của tuyến apocrine này sẽ tạo ra mùi đặc trưng cùng với mồ hôi. Bã nhờn, một lớp bao phủ giàu lipid kỵ nước giúp bảo vệ và bôi trơn da và lông, do đó đem lại lá chắn kháng khuẩn, được sản xuất bởi tuyến bã trong đơn vị nang lông tuyến bã (Schommer và Gallo 2013; Grice và Segre 2013; Dréno et al. 2016; Balato et al. 2019; Ellis et al. 2019).
Sự phát triển của hệ vi sinh vật trên da
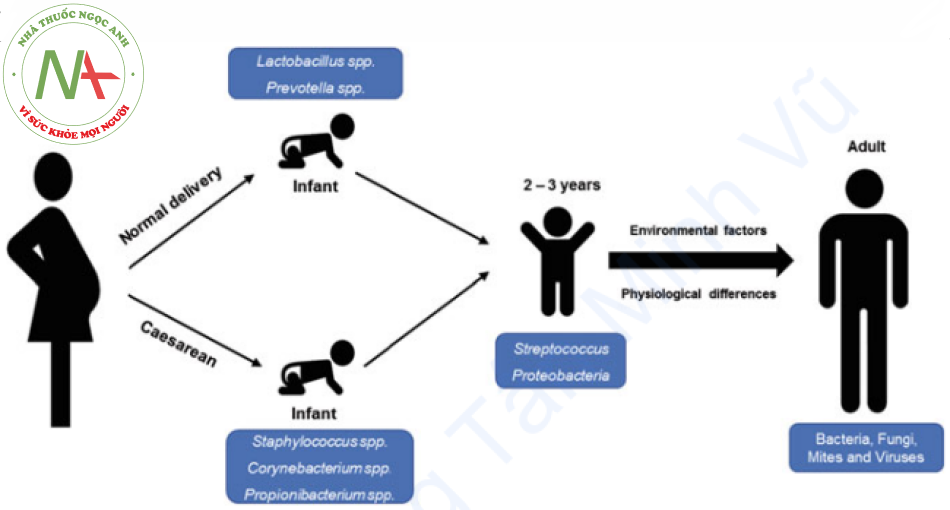
Sự xâm chiếm da của vi sinh vật bắt đầu từ khi trẻ mới sinh ra. Phương pháp sinh nở ảnh hưởng đến quá trình xâm chiếm ở mức độ đáng kể (Hình 1.1). Trong trường hợp trẻ sơ sinh được sinh qua đường âm đạo, hệ vi sinh vật của mẹ như Lactobacillus spp., Prevotella spp. … sẽ xâm chiếm trên da trẻ sơ sinh. Ngược lại, bề mặt da của trẻ sơ sinh được sinh bằng phương pháp mổ lấy thai chủ yếu tiếp xúc với vi khuẩn sống trên da của mẹ và nhân viên y tế cũng như hệ vi sinh vật trong môi trường bệnh viện ngay từ đầu. Do đó hệ vi sinh trên da của những trẻ sơ sinh sinh mổ sẽ hoàn toàn khác so với trẻ sơ sinh sinh qua đường âm đạo, chủ yếu khu trú các loài vi khuẩn như Staphylococcus spp., Corynebacterium spp., Propionibacterium spp … Tiến triển xâm chiếm của nấm trên da tương đối biến động. Ở 89-100% trẻ sơ sinh, chi nấm Malassezia đáng chú ý trên bề mặt da ngay từ ngày đầu tiên. Trong khoảng thời gian tới 3 tuổi, có thể thấy những thay đổi trong hệ vi sinh vật trên da do những thay đổi về sinh lý da, chế độ ăn uống, vận động… Da của trẻ bị xâm chiếm bởi Streptococcus và các loại Proteobacteria khác nhau như Betaproteobacteria và Gammaproteobacteria (Hình 1.1). Cả hai yếu tố giải phẫu và sinh lý đều góp phần vào thành phần vi sinh vật ở người lớn và dẫn đến sự khác biệt về hệ vi sinh vật trên da giữa nữ giới và nam giới. Sự phát triển của hệ vi sinh da bị ảnh hưởng nhiều bởi các yếu tố như số lượng và thành phần của bã nhờn, mồ hôi và bài tiết nội tiết tố (Kong và Segre 2012; Adamczyk et al. 2018).
Các yếu tố ảnh hưởng đến hệ vi sinh vật trên da
Về bản chất, thành phần và sự phân bố của hệ vi sinh là kết quả của mọi thứ mà cá nhân tiếp xúc, tắm rửa, hít thở, ăn và uống. Các yếu tố cụ thể của vật chủ như tuổi tác, nơi ở và giới tính ảnh hưởng đến hệ vi sinh vật trên da của họ. Như đề cập trước đó, da của thai nhi không có mầm bệnh và quá trình xâm chiếm bắt đầu ngay sau khi sinh và thành phần khác nhau tùy theo hình thức sinh, hoặc sinh đường âm đạo hoặc sinh mổ. Ngoài ra, các môi trường da khác nhau như mồ hôi, bã nhờn và sản xuất hormone cũng gây ra sự khác biệt về thành phần vi sinh vật giữa nam và nữ.
Tương tự, nhiều yếu tố khác đặc trưng cho cá nhân cũng có thể làm thay đổi sự xâm chiếm của hệ vi sinh vật trên da. Một số yếu tố này gồm (1) nghề nghiệp, (2) lựa chọn quần áo, (3) sử dụng kháng sinh, (4) sử dụng mỹ phẩm, (5) sử dụng xà phòng, (6) sử dụng các sản phẩm vệ sinh và kem dưỡng ẩm, v.v. Tuy nhiên, những các sản phẩm làm thay đổi tình trạng hàng rào bảo vệ da và tác động của chúng lên hệ vi sinh vật trên da vẫn chưa chắc chắn. Tiếp xúc những người trong gia đình và và vật nuôi trong nhà mang vi sinh vật cũng có ảnh hưởng quan trọng đến quần thể vi sinh vật. Một số yếu tố khác bao gồm (1) ánh sáng mặt trời (tia cực tím), (2) nhiệt độ xung quanh, (3) tiếp xúc với môi trường, (4) chất lượng không khí, (5) độ ẩm, (6) thông gió và (7) cùng cư trú. (Kong và Segre 2012; Grice và Segre 2013; Prescott và cộng sự 2017; Ellis và cộng sự 2019).
Hệ vi sinh vật ở da: Thành phần và phân bố
Thành phần hệ vi sinh vật trên da và sự đa dạng của chúng vẫn chưa được làm sáng tỏ hoàn toàn vì phần lớn vi khuẩn không thể được nuôi cấy bằng các phương pháp nuôi cấy tiêu chuẩn và chỉ đại diện một tỷ lệ nhỏ vi khuẩn có thể nuôi cấy có thể được tìm thấy trên bề mặt (Grice và Segre 2013; Adamczyk và cộng sự. 2018). Các công cụ sinh học phân tử dựa trên DNA để phân tích và nhận dạng các gen RNA ribosome 16 đã cố gắng nhận ra các loại vi sinh vật trong cơ thể chúng ta. Ngay cả như vậy, các đoạn mồi PCR không thể khuếch đại tất cả các gen RNA ribosome 16S với hiệu quả tương tự. Giải trình tự gen từng phần (whole-genome shotgun, WGS) của vi khuẩn có thể xác định sự đa dạng di truyền hoàn chỉnh và giúp dự đoán vai trò gen liên quan đến hệ vi sinh da. Tuy nhiên, nghiên cứu gen hệ vi sinh vật trên da bằng WGS chưa được công bố.
Vi khuẩn
Với nghiên cứu gen 16S rRNA, không ít hơn 19 ngành có thể được tìm thấy trong hệ vi sinh vật trên da, và trong số đó chủ yếu là Actinobacteria (51,8% Corynebacterium spp., Propionibacterium spp., Microbacterium spp., Micrococcus spp.), Firmicutes (24,4% Staphylococcus spp., Clostridium spp., Streptococcus spp., Enterococcus spp.), Proteobacteria (16,5% Janthinobacterium spp., Serratia spp., Halomonas spp., Delftia spp., Và Comamonas spp.) Và Bacteroidete (6,3% Sphingobacterium spp., Chryseobacterium spp.) (Bảng 1.1).
Phần lớn hệ vi sinh vật trên bề mặt da thuộc về ngành Corynebacterium, Propionibacterium, Actinobacteria, Firmicutes, Bacteroidetes và Proteobacteria. Cả hệ vi sinh vật da và đường ruột đều cho thấy sự đa dạng đáng kể ở cấp độ ngành, trong khi mức độ đa dạng cao ở cấp độ loài. Ngoài ra còn cho thấy sự thay đổi dựa trên vị trí da. Phần trên của nang lông là nơi cư trú của gần 50% tổng số vi khuẩn là Staphylococcus epidermidis. Các loài vi khuẩn còn lại thuộc cùng một chi (Staphylococcus saprophyticus, S. hominis, S. warneri, S. haemolyticus, và S. capitis) và các chi Microccus (M. luteus, M. varians, M. lylae, M. sedentarius, M. roseus, M. kristinae, và M. nishinomiyaensis). Nói chung, các vị trí tiết bã nhờn với mức phong phú các loại ngành vi khuẩn thấp thường có tính đa dạng vi khuẩn thấp nhất và gồm trán, khu vực sau tai (nếp gấp sau tai) và bên cạnh lỗ mũi. Các vi sinh vật phổ biến nhất ở các vị trí trên và các vị trí nhiều bã nhờn khác là vi khuẩn Propionibacterium spp. Tương tự, các khu vực ẩm ướt của cơ thể gồm rốn, vòm nách, nếp gấp bẹn, vùng trên cùng của nếp gấp giữa mông, lòng bàn chân, phía sau đầu gối và trong khuỷu tay chủ yếu bị xâm chiếm bởi Staphylococcus và Corynebacterium spp. Các vùng da khô như cẳng tay, mông và các bộ phận khác của bàn tay là những vị trí da có đa dạng vi khuẩn nhất với sự biểu hiện kết hợp từ bốn loại ngành chính. Streptococcus aureus, S. pyogenes (Streptococci nhóm A), Corynebacterium spp., Và P. aeruginosa (trực khuẩn Gram âm) là một số vi khuẩn gây bệnh có thể được tìm thấy trên da. Các bệnh nhiễm trùng da khác nhau có thể do các vi khuẩn gây bệnh này gây ra (Bảng 1.1).
Bảng 1.1 Sự phân bố của vi sinh vật trên các vùng da khác nhau
| Vi sinh vật | Ngành | Vùng phân bố |
| Vi khuẩn | Actinobacteria (Micrococcus
spp. và Corynebacterium spp.) |
Khu vực ẩm ướt — Nách, khuỷu tay trong hoặc nếp gấp bẹn |
| Firmicutes (Staphylococcus spp.) | ||
| Propionibacterium spp. | Khu vực nhiều bã nhờn — Trán, nếp gấp mũi,
nếp gấp sau tai và lưng |
|
| Actinobacteria | Khu vực khô — Cẳng tay, mông và các bộ phận khác nhau của bàn tay | |
| Proteobacteria | ||
| Bacteroidetes | ||
| Firmicutes | ||
| Nấm | Malassezia spp. | Khu vực nhiều bã nhờn — Trán, nếp gấp mũi,
nếp gấp sau tai và lưng |
| Aspergillus | Da chân | |
| Candida albicans | ||
| Cryptococcus | ||
| Mạt | Demodex folliculorum | Nang lông và tuyến bã nhờn |
| Demodex brevis | Các tuyến bã nhờn và tuyến Meibomian của
mí mắt |
Nấm
Phần lớn các nghiên cứu hệ vi sinh vật trên da nhằm mục đích tìm hiểu thành phần vi khuẩn; tuy nhiên, nấm, virus và mạt cũng là thành viên chính của hệ vi sinh vật trên da ngoài các thành viên vi khuẩn. Các nghiên cứu giải trình tự gen đã phát hiện ra rằng nấm hiện diện ở hầu hết các vị trí trên cơ thể và nó chiếm ít hơn 1% tổng số vi sinh vật, tuy nhiên chúng có rất nhiều ở khu vực xung quanh tai và trán. Malassezia spp. (M. limiteda, M. globosa, và M. evalodialis) là loại nấm chính (gần 53–80%) được tìm thấy ở tất cả các vùng da. Các loài Malassezia là vi sinh vật ưa lipid và thường kết nối với các khu vực giàu bã nhờn trên da. Các chi khác của nấm như Penicillium (P. chrysogenum, P. lanosum), Aspergillus (A. candidus, A. terreus, A. versicolor), Alternaria, Candida (C. Tropicalis, C. parapsilosis, C. orthopsilosis), Chaetomium, Chrysosporium, Cladosporium, Mucor, Debaryomyces, Cryptococcus (C. flavus, C. dimmennae, C. diffluent), Trichophyton và Rhodotorula có thể được tìm thấy trong hệ vi sinh vật ở da.
C. albicans và Cryptococcus có thể xâm chiếm trên da, gây ra cả bệnh nấm Candida và Cryptococcosis trong điều kiện thuận lợi gồm bề mặt biểu bì bị thương, tăng độ ẩm và nhiệt độ. Do kiến thức còn hạn chế về các sinh vật nấm trên bề mặt da, các nghiên cứu sâu hơn về nấm trên da người với các phương pháp cải tiến để nhận biết và phân tích trình tự gen nấm là rất cần thiết.
Mạt
Demodex folliculorum và Demodex brevis là những loài mạt demodex, là động vật chân đốt nhỏ thường có liên quan đến bệnh trứng cá đỏ và cũng là tác nhân gây ra một số chứng rối loạn da khác thường được tìm thấy ở các đơn vị nang lông tuyến bã trên mặt và được tính là một phần của hệ vi sinh vật trên da.
Virus
Đa số các virus trên da biểu hiện gồm các bacteriophage (thực khuẩn) nhắm mục tiêu vi khuẩn (Propionibacterium và Staphylococcus). Cấu tạo di truyền (DNA và RNA) của virus phát triển nhanh chóng khiến việc tạo ra các thư viện gen trở nên khó khăn hơn, do đó việc xác định và phân loại virus nằm trên bề mặt da là một thách thức khó khăn. Virus không chỉ được coi là tác nhân lây nhiễm và còn là yếu tố dẫn đến việc duy trì cân bằng nội môi của da. Polyomaviridae và Papillomaviridae là virus DNA sợi đôi (dsDNA) có thể được coi là một phần của hệ vi sinh vật trên da (Kong và Segre 2012; Schommer và Gallo 2013; Grice và Segre 2013; Dréno và cộng sự 2016; Prescott và cộng sự 2017; Adamczyk và cộng sự 2018; Balato và cộng sự 2019; Ellis và cộng sự 2019) (Bảng 1.1).
Trục Ruột- Da
Hệ vi sinh vật đường ruột của con người là một tập hợp các vi khuẩn, virus, nấm và động vật nguyên sinh vượt quá gấp mười lần số tế bào vật chủ cũng nhiều bằng hệ vi sinh vật ở da. Những tiến bộ trong phân tích gen và sự phát triển của công nghệ giải trình tự DNA đã củng cố sự hiểu biết của chúng ta về hệ vi sinh vật đường ruột và tác động đa dạng của nó đối với sức khỏe và bệnh lý của con người. Hệ vi sinh vật của ruột chịu trách nhiệm cho các lợi ích quan trọng về trao đổi chất và miễn dịch của vật chủ. Cả đường tiêu hóa và da đều được kết nối chuyên biệt với nhau về mục đích và chức năng, đồng thời kết nối hệ thống mạch máu chặt chẽ với các cơ quan nội tạng có vai trò miễn dịch và thần kinh nội tiết quan trọng. Cả hai cơ quan này đều quan trọng
trong việc duy trì cân bằng nội môi sinh lý. Một số bằng chứng tích lũy đã thiết lập mối quan hệ chặt chẽ và hai chiều giữa ruột và da liên quan đến sức khỏe đường tiêu hóa (GI), cân bằng nội môi và cân bằng da. Các bất thường đường tiêu hóa khác nhau đôi khi có liên quan đến các biểu hiện trên da, và hệ vi sinh đường ruột dường như có liên quan đến sinh lý bệnh của các bệnh viêm nhiễm khác nhau. Trong quá trình phân hủy các polysaccharid phức tạp khó tiêu hóa, hệ vi sinh vật đường ruột hỗ trợ quá trình này và cần thiết cho việc tạo ra các nguyên tố dinh dưỡng, ví dụ như vitamin K. Tác động của hệ vi sinh đường ruột lên hệ thống miễn dịch của vật chủ là rất lớn và sự liên kết được quản lý phức tạp để cho phép dung nạp miễn dịch kháng nguyên trong chế độ ăn uống và môi trường tương ứng và cung cấp khả năng bảo vệ chống lại các mầm bệnh tiềm ẩn. Do đó, sự thay đổi hệ vi sinh đường ruột gây ra sự khởi đầu của các bệnh tự miễn dịch và bệnh viêm nhiễm ở da nhưng xa ruột. Rõ ràng, viêm da cơ địa dị ứng, vẩy nến, trứng cá đỏ và mụn trứng cá là những bệnh lý viêm da phổ biến, tình trạng mất cân bằng vi sinh vật được gọi là rối loạn sinh học đường ruột có thể luôn được quan sát thấy. Sự phát hiện này đã làm nảy sinh khái niệm “Trục Ruột- Da” mới, nhưng nó không phải là một vấn đề mới.
Các bác sĩ da liễu John H. Stokes và Donald M. Pillsbury, trong những năm 1930, đã thiết lập một lý thuyết liên kết mối quan hệ giữa hệ vi sinh vật đường ruột với các tình trạng viêm da và toàn thân (Stokes và Pillsbury 1930), sau này được gọi là “Trục Ruột-Não” (Arck et al. 2010) và “Trục Ruột-Não-Da” (Bowe và Logan 2011). Mối liên hệ phức tạp giữa loạn khuẩn ruột và các tình trạng da đang được đề xuất bởi các bằng chứng lâm sàng khác nhau. Tuy nhiên, các cơ chế đằng sau những diễn giải như vậy vẫn chưa được thiết lập. Mối quan hệ tương tác đa yếu tố giữa hệ thống thần kinh, miễn dịch và nội tiết và các khía cạnh khác như thói quen ăn uống và thuốc men có thể liên quan đến mối liên hệ giữa ruột và da. Căng thẳng tâm lý xã hội đã được biết là có liên quan đến cả việc xấu đi và khởi phát nhiều loại bệnh về da trong khái niệm “Trục ruột- não-da”. Điều hợp lý là các chất dẫn truyền thần kinh có thể được tạo ra để phản ứng với stress và các kích thích khác bởi hệ vi sinh có thể điều chỉnh các chức năng của da thông qua các con đường thần kinh (Vaughn và cộng sự 2017; Salem và cộng sự 2018; Szántó và cộng sự 2019).
Hệ vi sinh vật với “Trục Ruột- Da”
Da thực hiện các chức năng khác nhau một cách hiệu quả như che chắn, điều chỉnh nhiệt độ, giữ nước và giữ cân bằng nội môi. Hệ vi sinh vật đường ruột ảnh hưởng đến các con đường truyền tín hiệu điều phối cân bằng nội môi của da và tác động đến sức khỏe của da (Hình 1.2). Tuy nhiên, các cơ chế vẫn chưa được khám phá hoàn toàn. Vi khuẩn đường ruột Bacteroides vulgilis và Faecalibacterium prausnitzii tạo ra nhiều loại chất chuyển hóa như axit retinoic, polysaccharide A, v.v. Tương tự như vậy, cụm vi khuẩn Clostridium IV và XI kích thích sự tích tụ của các tế bào T điều hòa và tế bào lympho cũng hỗ trợ các phản ứng chống viêm trong cơ thể.
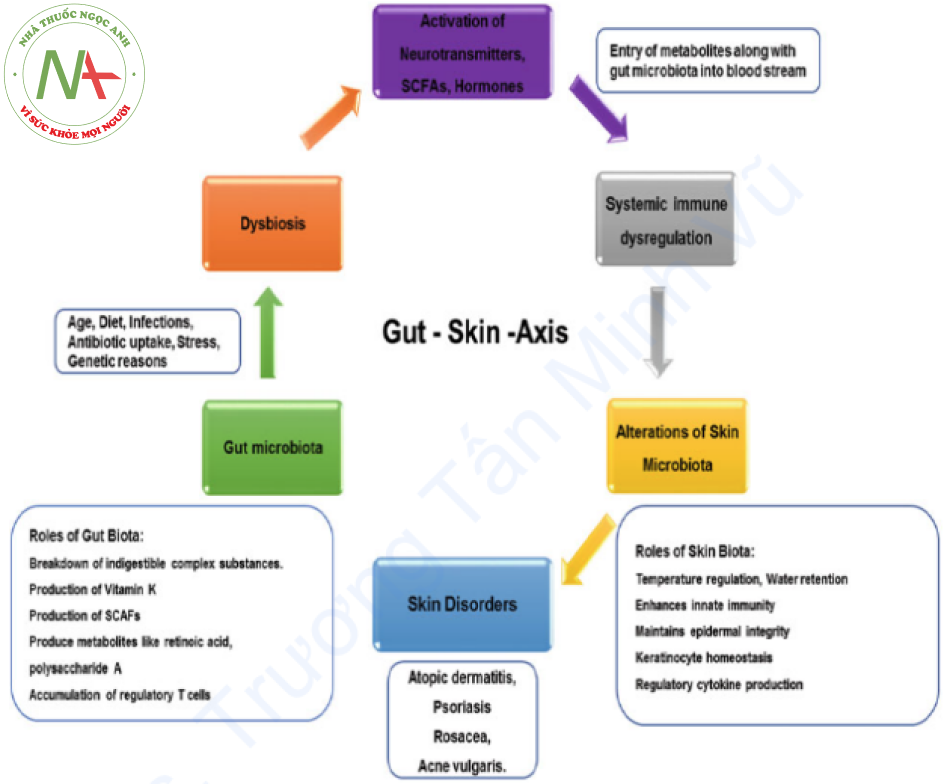
Sự tập hợp của các tế bào tiền viêm Th27 và Th2 được kích thích bởi một số vi khuẩn dạng sợi. Một số loài hội sinh ở ruột tiết ra chất dẫn truyền thần kinh như norepinephrine, serotonin và acetylcholine hoặc cũng có thể gây ra sự giải phóng neuropeptide từ các tế bào nội tiết đường ruột lân cận nơi chúng đi vào tuần hoàn biểu mô ruột và có thể dẫn đến các tác dụng toàn thân. Axit propionic, axit butyric, axit axetic và axit lactic, các axit béo chuỗi ngắn (SCFAs), dường như được tạo ra thông qua quá trình lên men của vi sinh vật đường ruột (Michael de Vrese 2008), đi vào tuần hoàn và ảnh hưởng đến da (O’Neill et al. 2016). Butyrate ngăn cản các phản ứng miễn dịch bằng cách ngăn cản sự lan truyền, di dời, kết dính và phát triển cytokine của các tế bào viêm. Ngoài ra, nó ngăn ngừa histone deacetylase và bất hoạt các con đường dẫn đến NF-κB, do đó tạo điều kiện thuận lợi cho sự lan truyền của các tế bào điều hòa tham gia vào các vai trò sinh lý khác nhau trên da bao gồm kiểm soát nang lông, biệt hóa tế bào gốc và chữa lành thương (Meijer et al. 2010; Loser và Beissert 2012).
SCFAs kiểm soát hoạt động của tế bào miễn dịch cũng như quá trình apoptosis. Sự phổ biến của một số vi sinh vật trên da tác động đến hệ thống phản ứng miễn dịch qua da được coi là một vai trò quan trọng của SCFAs. Ví dụ, vi khuẩn Propionibacterium có thể phát triển một axit propionic cho thấy tác dụng kháng khuẩn hiệu quả đối với Staphylococcus aureus, một loại vi khuẩn kháng methicillin mắc phải trong cộng đồng (Shu et al. 2013). Các loài vi khuẩn như S. epidermidis và P. acnes có thể chịu được các sự thay đổi SCFAs lớn hơn các vi khuẩn khác. Tất cả những phát hiện này hoàn toàn ủng hộ một cơ chế liên kết giữa ruột và da (Shu và cộng sự 2013; Schwarz và cộng sự 2017) (Hình 1.2).
Nhiều nghiên cứu trên động vật gặm nhấm và con người đã ghi nhận những tác động có lợi khác nhau đối với sức khỏe làn da. Trong nghiên cứu của Levkovich và cộng sự (2013), những con chuột dùng bổ sung Lactobacillus reuteri có độ dày lớp da tốt hơn, tăng sự hình thành nang lông và cải thiện sự phát triển của tế bào tuyến bã và có bộ lông mượt và bóng hơn (Levkovich et al. 2013). Horii và cộng sự (2014) đã thực hiện một thử nghiệm chứng minh sự giải phóng serotonin được cải thiện bởi các tế bào enterochromaffin ruột ở chuột bằng cách sử dụng Lactobacillus brevis SBC8803, và kết quả là sự kích hoạt các con đường phó giao cảm dẫn đến giảm tín hiệu giao cảm thần kinh động mạch da (CASNA), cũng tăng cường tuần hoàn máu cho da. Mất nước qua biểu bì (TEWL) cũng giảm đáng kể và cũng tăng cường hydrat hóa giác mạc trong các nghiên cứu lâm sàng ở người, sau 12 tuần sử dụng cùng loại vi sinh vật (Horii và cộng sự. 2014).
Trong một thử nghiệm, việc sử dụng probiotic Lactobacillus paracasei NCC2461 ở những tình nguyện viên khác nhau được kiểm soát bằng giả dược trong 2 tháng dẫn đến giảm độ nhạy cảm của da và TEWL, do sự gia tăng có thể đo lường được của yếu tố tăng trưởng TGF-β (Gueniche và cộng sự 2014). Trong một phân tích khác của Baba et al. (2006), biểu hiện mRNA của keratin 10 và involucrine, tương ứng các chỉ dấu biệt hoá sớm và muộn, được tăng cường khi cho sữa lên men với Lactobacillus helveticus vào nuôi cấy tế bào sừng biểu bì của người, do đó gợi ý rằng sự tham gia của vi khuẩn trong việc thúc đẩy sự biệt hóa biểu bì. Trong so sánh, sự gia tăng của profilaggrine, một loại protein thực hiện sự biệt hóa cuối cùng của tế bào sừng, cho thấy vi khuẩn này có khả năng giữ ẩm tốt hơn. Điều này cuối cùng tạo ra filaggrin, một loại protein giúp biểu bì luôn mềm dẻo và ẩm (Baba et al. 2006).
“Trục ruột- da” và các bệnh liên quan
Hệ vi sinh da rất quan trọng trong việc duy trì làn da khỏe mạnh. Hệ vi sinh trên da tương tác với vật chủ với sự trợ giúp của các chất chuyển hóa của chúng, điều này rất quan trọng trong việc thiết lập và duy trì cân bằng nội môi của vật chủ. Nhưng các yếu tố khác nhau như thói quen ăn uống, sử dụng kháng sinh, vệ sinh, các bệnh do mầm bệnh gây ra, v.v. có thể làm thay đổi thành phần của chúng, tạo ra sự mất cân bằng. Trạng thái mất cân bằng này được gọi là rối loạn sinh học (dysbiosis) có thể góp phần vào sự phát triển hoặc xuất hiện các mầm bệnh và giảm vi khuẩn có lợi. Điều này dẫn đến hậu quả là việc kích hoạt bất thường các tế bào miễn dịch, ảnh hưởng đến cấu trúc hàng rào biểu mô, dẫn đến điều chỉnh phản ứng của hệ thống miễn dịch và sau đó dẫn đến sự phát triển viêm và cuối cùng dẫn đến khởi phát và / hoặc đợt cấp của bệnh. Có cơ sở rõ ràng rằng có sự trao đổi liên tục giữa ruột, da và não thông qua “Trục Ruột- Não-Da”. Qua các nghiên cứu khác nhau, người ta hiểu rằng những thay đổi trong thành phần hệ vi sinh vật đường ruột có thể ảnh hưởng đến các phản ứng miễn dịch tại chỗ, làm thay đổi không chỉ khả năng miễn dịch của vật chủ mà còn gây viêm ở các bộ phận cơ thể xa ruột. Có bằng chứng thuyết phục chứng minh mối liên hệ giữa chứng loạn khuẩn ruột và nhiều bệnh viêm nhiễm và tự miễn dịch, bao gồm các bệnh da liễu/ rối loạn viêm da như viêm da cơ địa dị ứng (AD), vẩy nến, mụn trứng cá, v.v. (Hình 1.2) (Grice và Segre 2013; Grice 2014; Mańkowska-Wierzbicka và cộng sự 2015; Vaughn và cộng sự 2017; Salem và cộng sự 2018). Bảng 1.2 cho thấy một số bệnh da và vi sinh vật liên quan đến chúng. Trong phần sau, chúng ta sẽ cùng tìm hiểu về một số bệnh liên quan đến da này.
Bảng 1.2 Các vi sinh vật có liên quan đến sự khởi phát của một số bệnh ngoài da
| Bệnh | Vi sinh vật liên quan | Tài liệu |
| Viêm da cơ địa dị ứng | Tăng Staphylococcus spp. (S. aureus, S. epidermidis, S.
hominis và S. haemolyticus) |
Ellis et al. (2019), Kim and Kim (2019) |
| Tăng Clostridium difficile, Escherichia coli và
Faecalibacterium prausnitzii |
||
| Giảm Cutibacterium, Streptococcus, Acinetobacter,
Corynebacterium và Prevotella |
||
| Bệnh vẩy nến | Tăng Corynebacterium, Propionibacterium, Staphylococcus,
Streptococcus và Malassezia ovalis (nấm) |
Benhadou et al. (2018), Ellis et al.
(2019) |
| Giảm Actinobacteria | ||
| Mụn trứng cá | Cutibacterium acnes (trước đây là Propionibacterium acnes) | Ellis et al. (2019),
Lee et al. (2019) |
| Bệnh trứng cá
đỏ |
Helicobacter pylori | Buechner (2005), Mańkowska- Wierzbicka et al.
(2015) |
| Tăng Demodex folliculorum (mạt), Bacillus oleronius, Staphylococcus epidermidis và Chlamydophila pneumonia |
Viêm da cơ địa dị ứng (Atopic Dermatitis)
Viêm da cơ địa dị ứng (AD) hay còn gọi là chàm, một bệnh viêm da mãn tính thường xảy ra trong 5 năm đầu đời. Gần 15–20% trẻ em và 2–10% người lớn bị bệnh này ở các quốc gia khác nhau trên thế giới. Những bệnh nhân mắc bệnh này có biểu hiện rối loạn chức năng hàng rào đáng chú ý là hậu quả của đột biến gen mã hóa một loại protein cấu trúc gọi là filaggrin duy trì cân bằng nội môi của biểu bì bằng cách hỗ trợ trong giữ nước hoặc các yếu tố môi trường như sử dụng các sản phẩm vệ sinh. Độ pH của bề mặt da tăng lên do sử dụng các sản phẩm vệ sinh như xà phòng và chất tẩy rửa, và nó có hại cho chức năng của hàng rào biểu bì, và do đó, người ta quan sát thấy độ pH bề mặt da của những bệnh nhân bị AD cao hơn những người có làn da bình thường. Tuy nhiên, vẫn chưa làm rõ rằng việc tăng độ pH của da gây ra chứng loạn khuẩn da ở bệnh nhân AD (Rather et al. 2016), nhưng việc bôi Lactobacillus johnsonii NCC 533 (HT La1) tại chỗ, trong 3 tuần đã làm giảm sự xâm nhập của vi khuẩn gây bệnh Staphylococcus aureus và giảm độ pH của da bởi các chất chuyển hóa được tạo ra bởi vi khuẩn trên (Blanchet-Réthoré et al. 2017).
Sự tiếp xúc với vi sinh vật bắt đầu từ lúc mới sinh và hệ vi sinh vật trong ruột và da của trẻ sơ sinh phụ thuộc rất nhiều vào hình thức sinh nở. Các vi khuẩn thuộc giống Lactobacillus và Prevotella là những vi khuẩn ưu thế ở trẻ sinh qua đường âm đạo và giống với hệ vi sinh vật âm đạo của mẹ, trong khi Staphylococcus, Corynebacterium và Propionibacterium spp. chiếm ưu thế ở trẻ sinh mổ và giống bề mặt da của mẹ chúng (Li et al. 2014).
Các rối loạn miễn dịch như là hen suyễn, dị ứng và các bệnh viêm ruột được cho là có liên quan đến hình thức sinh mổ. Mặc dù không có mối liên hệ nào với việc sinh mổ trong trường hợp AD, nhưng vi khuẩn Lactobacilli có nguồn gốc từ âm đạo có trách nhiệm bảo vệ để chuẩn bị hệ thống miễn dịch ban đầu của trẻ chống lại Staphylococcus aureus, một mầm bệnh có thể có vai trò trong các vấn đề da khác nhau. Một số nghiên cứu nhấn mạnh tầm quan trọng của sự phát triển thích hợp của quần thể vi sinh vật đường ruột đa dạng trong giai đoạn đầu đời để giúp ngăn ngừa AD. Thành phần vi sinh vật đường ruột có khả năng là một yếu tố quan trọng trong sự phát triển của tình trạng này. Các chất chuyển hóa khác nhau được tạo ra bởi hệ vi sinh đường ruột đi khắp cơ thể và ảnh hưởng đến các vị trí ở xa sinh vật. Trong tình trạng được gọi là “hội chứng ruột bị rò rỉ”, nơi tính toàn vẹn của hàng rào biểu mô bị hư hỏng, gây ra sự chênh lệch trong khả năng xâm nhập của ruột, các phân tử sinh miễn dịch, kháng nguyên thực phẩm, độc tố vi sinh vật và vi khuẩn có hại xâm nhập mức độ cao hơn vào cơ thể và tích tụ trên da. Điều này có thể làm kích động thành biểu mô và dẫn đến viêm và các đáp ứng miễn dịch không gián đoạn. Các chất chuyển hóa của vi khuẩn như phenol và p-cresol tự do được tạo ra để đáp ứng với sự lây nhiễm của mầm bệnh Clostridium difficile sau khi điều trị bằng kháng sinh (O’Neill et al. 2016). Chúng xâm nhập vào hệ tuần hoàn máu, tập trung ở da và làm suy yếu tính nhất quán của màng biểu bì bằng cách giảm biểu hiện keratin 10 của tế bào sừng. Thường xuyên bổ sung probiotic Bifidobacterium breve cùng với một prebiotic galactooligosaccharides làm tăng quá trình hydrat hóa da ở phụ nữ trưởng thành khỏe mạnh bằng cách giảm mức phenol trung bình trong huyết thanh. Một số chất chuyển hóa của vi khuẩn ruột kết, như axit mật thứ cấp gồm axit lithocholic và axit deoxycholic, cũng ảnh hưởng đến sinh lý của da. Axit lithocholic ảnh hưởng đến phản ứng miễn dịch thích ứng bằng cách ảnh hưởng đến sự khởi động của các tế bào Th2 (Miyazaki và cộng sự 2014).
Các SCFA như butyrate, propionat, acetate và lactate được xác nhận là hỗ trợ tính toàn vẹn của hàng rào biểu mô ruột và có tác dụng chống viêm. Trong một số nghiên cứu, phân tích mẫu phân cho thấy giảm rõ rệt SCFAs ở bệnh nhân AD. Do đó, giả thuyết rằng bất kỳ sản phẩm nào có khả năng ảnh hưởng đến hệ vi sinh đường ruột và sản xuất SCFA đều có thể ảnh hưởng đến phản ứng viêm và do đó ảnh hưởng đến tình trạng của da. Sử dụng probiotics phục hồi đường ruột với SCFA tiết ra từ vi khuẩn ở bệnh nhân AD và do đó giúp thúc đẩy tính toàn vẹn của hàng rào biểu mô. Nhạy cảm với gluten được biết là gây hại cho hàng rào bảo vệ ruột (de Sousa Moraes và cộng sự 2014) khiến ruột bị rò rỉ và do đó có liên quan đến các biểu hiện da nghiêm trọng giống như AD (Szántó và cộng sự 2019). Việc sử dụng các probiotics trong AD liên quan đến nhạy cảm với gluten làm liệu pháp bổ trợ dường như là một chiến lược hấp dẫn vì một số polypeptit gluten nhất định có thể bị thủy phân bởi các probiotics đó. Nồng độ vitamin D cũng tương quan với mức độ nghiêm trọng của AD. Trong một nghiên cứu, sự thiếu hụt vitamin D có liên quan đến sự thay đổi thành phần của vi khuẩn trong một nghiên cứu về bệnh nhân cystic fibrosis, có thể kích thích tình trạng viêm (Baek và cộng sự 2014; Kanhere và cộng sự 2018). Probiotics giúp tăng nồng độ vitamin D trong huyết thanh cùng với sự biểu hiện của thụ thể vitamin D, giúp bảo vệ viêm đường tiêu hóa (Shang và Sun 2017). Tất cả những điều này gợi ý sự tương tác nhiều mặt giữa hệ vi sinh vật đường ruột và bệnh AD, và do đó, việc điều chỉnh hệ vi sinh vật đường ruột bằng probiotics có thể là một lựa chọn tốt cho liệu pháp bổ trợ trong việc kiểm soát bệnh AD. Vì nguyên nhân này, cần phải xác định đặc điểm của hệ vi sinh vật đường ruột và các chất chuyển hóa của nó, cùng với các chủng probiotics liên quan đến chế phẩm prebiotic, thời gian và mức độ điều trị bằng probiotics và các thử nghiệm lâm sàng được lên kế hoạch cẩn thận.
Vẩy nến
Vẩy nến, bị kích hoạt bởi nhiều nguyên nhân bên ngoài như nhiễm trùng do vi khuẩn, điều trị bằng thuốc kháng sinh hoặc thay đổi chế độ ăn uống nhiều và các khía cạnh di truyền bên trong, là bệnh viêm da do can thiệp miễn dịch gây ra. Nó được đặc trưng bởi sự tăng sinh tế bào sừng được gọi là “acanthosis”, với kết quả là tăng sản tế bào sừng và sự biệt hóa của các tế bào sừng bị rối loạn điều hòa được gọi là “parakeratosis”: Bệnh này ảnh hưởng đến khoảng 2-4% dân số trên thế giới (Bata-Csorgo et al. 1995; Salem và cộng sự 2018; Balato và cộng sự 2019; Szántó và cộng sự 2019). Một bệnh tiêu hóa khác như bệnh viêm ruột (IBD), có liên quan chặt chẽ với rối loạn sinh học đường ruột, cũng kéo theo sự khởi phát của bệnh vẩy nến. Dấu hiệu rối loạn sinh học được tìm thấy trong các trường hợp bệnh nhân IBD có xu hướng gần giống với các loại vi khuẩn được tìm thấy ở bệnh nhân vảy nến (Vaughn và cộng sự 2017; Salem và cộng sự 2018; Ellis và cộng sự 2019; Szántó và cộng sự 2019). Trong cả hai trường hợp, người ta đã quan sát thấy sự suy giảm của vi khuẩn cộng sinh như Bifidobacteria, Lactobacilli và Faecalibacterium prausnitzii, và sự gia tăng của các vi khuẩn gây bệnh như Salmonella, Escherichia coli, Helicobacter, Campylobacter, Mycobacterium và Alcaligenes (Scher et al. 2015). Việc giảm vi khuẩn có lợi này có thể dẫn đến giảm khả năng kiểm soát các phản ứng miễn dịch của ruột và ảnh hưởng đến các hệ thống cơ quan ở xa. Có rất nhiều dữ liệu cho thấy rằng có một vai trò quan trọng trong mạng lưới cytokine của tế bào Th27, một phân nhóm mới của tế bào T, là thành viên chính trong cơ chế bệnh sinh của bệnh. Các cytokine Th27 cải thiện biểu hiện của gia đình cytokine IL-10, đặc biệt là các cytokine IL-20 và IL-22 tạo điều kiện cho tăng sinh tế bào sừng (Ma et al. 2008; Nograles et al. 2008). Việc sản xuất và hoạt động của các tế bào Th27 cũng có khả năng được kiểm soát bằng SCFAs. Bệnh vẩy nến có liên quan đến việc mất đi vi khuẩn Faecalibacterium prausnitzii, một nguồn SCFA phòng thủ quan trọng trong ruột, cho thấy mối tương quan giữa chứng loạn khuẩn ruột, SCFA và tình trạng viêm qua trung gian Th27 trong cơ chế bệnh sinh của bệnh (Eppinga et al. 2016). Tất cả dữ liệu này cho thấy rằng ý nghĩa của “Trục Ruột- Da” trong sinh lý bệnh của bệnh vẩy nến và nâng cao tầm quan trọng của việc áp dụng probiotic đường uống trong quản lý bệnh. Cho đến ngày nay, chỉ có ba nghiên cứu probiotic đường uống đã được nghiên cứu với ba loài probiotic khác nhau ảnh hưởng đến các con đường khác nhau của cơ chế bệnh sinh của bệnh vẩy nến (Szántó et al. 2019). Sự cải thiện được nhìn thấy trong quá trình bệnh, nhưng thông tin có thể tiếp cận được rất ít và không đồng nhất, do đó, việc đề xuất một quy trình bổ sung thích hợp với probiotic ở những bệnh nhân bị bệnh vẩy nến trở nên khó khăn (Vaughn và cộng sự 2017; Salem và cộng sự 2018; Balato và cộng sự 2019; Szántó và cộng sự 2019).
Mụn trứng cá
Mụn trứng cá là một bệnh tái phát ở tuyến bã nhờn (cấu trúc 3D phức tạp tồn tại trên bề mặt da của động vật có vú bao gồm nang lông, trục lông và tuyến bã nhờn), được biểu hiện lâm sàng dưới dạng comedone không viêm hoặc sẩn viêm, mụn mủ và cục (Salem et năm 2018; Szántó và cộng sự 2019). Cơ chế sinh bệnh của mụn trứng cá được xác định bởi 3 yếu tố: tiết quá nhiều bã nhờn, tăng sừng hóa nang và tăng cường bài tiết các cytokine gây viêm do vi khuẩn Propionibacterium acnes. Tình trạng mụn trứng cá này ảnh hưởng đến khoảng 70–80% thanh thiếu niên và thanh niên trong độ tuổi từ 12 đến 25 và là vấn đề y tế phổ biến thứ tám trên toàn cầu (Bowe và cộng sự 2014; Balato và cộng sự 2019; Salem và cộng sự 2018). Mụn trứng cá nổi bật ở các nước phương Tây, nơi chế độ ăn uống thường có nhiều carbohydrate. Sự tham gia của một loại vi khuẩn da hội sinh, Propionibacterium acnesium, hay còn được gọi là Cutibacterium acnes (C. acnes) trong cơ chế bệnh sinh của mụn trứng cá, là một trong những đối tượng được quan tâm nhiều nhất trong nghiên cứu về mụn trứng cá, và tuy nhiên, nó vẫn chưa được giải thích hoàn toàn. C. acnes là một loài chính của hệ vi sinh vật ở da và sản xuất SCFA trên da và duy trì cân bằng nội môi của da. Người ta tin rằng C. acnes tăng sinh do lượng bã nhờn tăng cao và sản xuất axit béo trong các nang lông và các tuyến bã nhờn kèm theo, do đó tạo ra các chất trung gian gây viêm (Salem và cộng sự 2018; Balato và cộng sự 2019; Szántó và cộng sự. 2019). Trong một nghiên cứu gần đây, không có sự khác biệt về số lượng của vi khuẩn này được tìm thấy giữa những bệnh nhân bị mụn trứng cá và những người khỏe mạnh, cho thấy rằng sự hiện diện của vi khuẩn này quyết định sự khởi phát của bệnh hơn là sự gia tăng của vi khuẩn này (Barnard et al. 2016; Dréno et al. 2018).
Tỷ lệ mụn trứng cá cao đáng kể ở các nước đang phát triển do thói quen chế độ ăn đường huyết cao hoặc kiểu phương Tây (Melnik 2013). Thực phẩm có lượng đường huyết cao tạo điều kiện thuận lợi cho việc sản xuất insulin và IGF-1 (yếu tố tăng trưởng giống insulin), do đó gây ra biểu hiện tế bào chất tăng cường của FoxO1 chuyển hóa (yếu tố phiên mã fork-head box), một cảm biến trạng thái dinh dưỡng tế bào. Cuối cùng, FoxO1 kích hoạt mTORC1, một chất quản lý sự trao đổi chất và tăng sinh tế bào, để làm trung gian cho việc tăng sinh tuyến bã nhờn, tạo lipid và tăng sản tế bào sừng acroinfundibular, do đó dẫn đến tạo mụn trứng cá (Melnik 2015; Agamia et al. 2016).
Rất ít nghiên cứu tập trung về vai trò của hệ vi sinh đường ruột đối với bệnh mụn trứng cá. Stokes và Pillsbury (1930) phát hiện ra rằng một tỷ lệ cao bệnh nhân bị mụn trứng cá bị hypochlorhydria (tình trạng có nồng độ axit dạ dày thấp) (Stokes và Pillsbury 1930) khiến vi khuẩn ruột già trôi dạt đến các đoạn xa của ruột non, gây ra tình trạng bệnh loạn khuẩn ruột và SIBO (vi khuẩn ruột non phát triển quá mức) (Salem và cộng sự 2018; Balato và cộng sự 2019). Đối với các chất dinh dưỡng, các loài vi khuẩn lớn hơn cạnh tranh và làm suy yếu sự hấp thụ chất béo, protein, carbohydrate và vitamin. Axit folic, kẽm, crom, selen và axit béo ω-3 đã cho thấy tác động đến sức khỏe tâm lý của một người và có liên quan đến sinh lý bệnh của mụn trứng cá. Những vi khuẩn này cũng cho phép tạo ra các chất chuyển hóa độc hại có thể làm tổn thương các tế bào ruột, làm tăng khả năng thâm nhập của ruột, và cuối cùng gây ra tình trạng viêm toàn thân. Strickler và cộng sự đã thiết lập khả năng phản ứng với Coliforms được phân tách trong phân ở 66% bệnh nhân mụn trứng cá có liên quan đến nhóm chứng (Salem et al. 2018). Tương tự, các nhà nghiên cứu khác, Juhlin và Michaëlsson (1983), đã quan sát tỷ lệ nội độc tố lipopolysaccharide của E. coli ở bệnh nhân mụn trứng cá, điều này cho thấy rằng hệ vi sinh đường ruột có thể cải thiện sự xuất hiện của nội độc tố lưu hành trong máu của bệnh nhân mụn trứng cá trái ngược với nhóm chứng khỏe mạnh. Chắc chắn, mụn trứng cá biểu hiện mối liên hệ giữa ruột và da có thể do sự thay đổi hệ vi sinh đường ruột gây ra (Juhlin và Michaëlsson 1983). Loveman và cộng sự (1955) quan sát thấy rằng Bacteroides spp. thường đi kèm với bệnh nhân mụn trứng cá (Loveman và cộng sự. 1955). Tương ứng, nhà nghiên cứu Nga Volkova đã phát hiện ra rằng 54% bệnh nhân bị mụn trứng cá có sự khác biệt trong hệ vi sinh đường ruột của họ so với nhóm chứng khỏe mạnh vào năm 2001 (Volkova và cộng sự 2001). Trong một nghiên cứu gần đây, tỷ lệ của hai ngành vi khuẩn chính — Bacteroidetes to Firmicutes — tăng trong vi khuẩn đường ruột của bệnh nhân mụn trứng cá, điều này đáng tin cậy với thói quen ăn uống phương Tây (Deng et al. 2018).
C. acnes được cho là kích hoạt cơ chế thụ thể IGF-1 / IGF-1 của da, cho thấy sự kích thích đồng thời của đường ruột và con đường thụ thể IGF-1 / IGF-1 của vi khuẩn trên da, dẫn đến sinh lý bệnh mụn trứng cá (Isard et al. 2011). Tuy nhiên, cần phải nghiên cứu thêm để hiểu liệu các cơ chế này có liên quan với nhau hay không. Hệ thống thụ thể IGF-1 có thể được gây ra bởi rối loạn vi khuẩn đường ruột có thể gây ra sự thay đổi về số lượng và /hoặc hàm lượng của bã nhờn giàu lipid, cho phép các phylotype C. acnes xâm chiếm ở đơn vị nang lông do đó phá vỡ sự cân bằng các thành viên của hệ vi sinh vật da (Smith và cộng sự 2006). Cơ chế này được cho là có thể được đối với sự tương tác có thể xảy ra giữa hệ vi sinh vật ở ruột và da. Lipopolysaccharides (LPS) là nguyên nhân thêm vào cho rối loạn chức năng vi sinh vật đường ruột và mụn viêm. Ở những bệnh nhân bị mụn trứng cá, các con đường tổng hợp sinh học LPS đã được chứng minh là được điều chỉnh, đó có thể là kết quả của việc cải thiện sự phong phú của các loài Bacteroidetes trong ruột tạo ra LPS (Deng và cộng sự 2018). Trong một nghiên cứu của Fabbrocini (2016), việc uống liên tục lợi khuẩn Lactobacillus rhamnosus SP1 trong 12 tuần làm giảm biểu hiện IGF-1 trên da và tăng cường các triệu chứng mụn trứng cá, cho thấy một quan niệm mới rằng các con đường IGF-1 và LPS có thể không khác biệt với nhau và rằng rối loạn sinh học đường ruột dẫn đến bệnh sinh mụn trứng cá (Fabbrocini et al. 2016). Sinh lý bệnh của mụn trứng cá bị ảnh hưởng quá nhiều bởi hệ vi sinh đường ruột do tương tác chéo giữa vi khuẩn đường ruột và con đường mTOR. Các chất chuyển hóa khác nhau được tạo ra bởi hệ vi sinh đường ruột đã được quan sát để kiểm soát các chức năng sinh lý khác nhau như tăng sinh tế bào, chuyển hóa lipid và các chức năng chuyển hóa khác qua trung gian mTOR ảnh hưởng đến thành phần của hệ vi sinh vật đường ruột bằng cách kiểm soát hàng rào ruột. Mối quan hệ này hoạt động như một con đường mà qua đó hệ vi sinh vật đường ruột có thể tác động đến sinh lý bệnh của mụn trứng cá (Noureldein và Eid 2018). Stokes và Pillsbury (1930) đã công nhận một ý tưởng nêu rõ mối liên hệ phức tạp giữa mụn trứng cá và rối loạn chức năng GI do não tạo điều kiện. Lo lắng và trầm cảm, các bệnh đi kèm tâm lý – cùng với lo lắng bởi GI có liên quan đến mụn trứng cá. Những căng thẳng khác nhau này làm cho hệ vi sinh vật đường ruột cũng sản sinh ra một số chất dẫn truyền thần kinh khác nhau, cụ thể là serotonin, norepinephrine và acetylcholine hoặc tạo ra các neuropeptide bằng cách kích hoạt các tế bào nội tiết gần đó làm tăng khả năng thâm nhập của ruột gây ra viêm ruột và hệ thống, dẫn đến các tác động toàn than thông qua tuần hoàn từ hàng rào ruột bị tổn thương (Zhang et al. 2008; Do et al. 2009; Ramrakha et al. 2012; Duman et al. 2016; Prakash et al. 2016).
Các bệnh da khác
Trứng cá đỏ (rosacea), một bệnh viêm da mãn tính có đặc điểm chủ yếu là ban đỏ và giãn mạch (tình trạng các mạch máu nhỏ tạo ra các đường giống sợi chỉ hoặc vết màu đỏ trên da) chủ yếu ở mặt (Buechner 2005). Vai trò của nhiễm vi khuẩn đường tiêu hóa Helicobacter pylori có liên quan đến sự khởi phát của bệnh này (Rebora et al. 1995). Tuy nhiên, nó vẫn còn là một vấn đề gây tranh cãi về khía cạnh lây nhiễm của loạn khuẩn ruột ở bệnh rosacea. Rosacea, giống như bệnh vẩy nến, có mối tương quan với IBD (Egeberg et al. 2017). Trong một nghiên cứu gần đây được thực hiện ở Hàn Quốc liên quan đến 12 phụ nữ Hàn Quốc mắc bệnh rosacea, một sự thay đổi trong hệ vi sinh vật đường ruột được phát hiện có liên quan đến bệnh này. Trong một nghiên cứu khác, người ta đã báo cáo rằng sự phối hợp giữa doxycycline và probiotics dùng đường uống được sử dụng như một cách sử dụng hiệu quả cho bệnh nhân rosacea. Điều này minh họa cho triển vọng của probiotics trong việc điều trị kiểm soát bệnh rosacea (Nam và cộng sự 2018).
Các bệnh lý da khác ít phổ biến hơn nhưng nghiêm trọng như viêm tuyến mồ hôi mủ (Hidradenitis Suppurativa), hồng ban nút (Erythema nodosum,) và viêm da mủ hoại tử (Pyoderma Gangrenosum), thường liên quan đến viêm ruột (Fleisher và cộng sự 2018; Szántó và cộng sự 2019). Tuy nhiên căn nguyên của chúng rất phức tạp và mối liên hệ giữa các bệnh này với bệnh loạn khuẩn đường ruột vẫn chưa được xác định, ngoại trừ những bệnh này có liên quan đến IBD. Rất nhiều nghiên cứu cần được thực hiện để biết được vai trò của hệ vi sinh đường ruột trong cơ chế bệnh sinh của các bệnh này.
“Trục Ruột- Da” và ý nghĩa điều trị
Sự tiến bộ của kiến thức khoa học trong vài năm qua đã khiến chúng ta nhận ra rằng vi sinh vật hội sinh có vai trò quan trọng trong sinh lý, phản ứng miễn dịch thích ứng và trao đổi chất bên cạnh sức khỏe và bệnh tật của vật chủ. Do đó, các nghiên cứu khác nhau đang được tiến hành để điều khiển hệ vi sinh vật của con người và cải thiện sức khỏe con người. Sự tiến bộ trong các công nghệ mới nhất như giải trình tự gen, metagenomic, v.v., đã biến đổi các kỹ thuật để mô tả hệ vi sinh vật. Hệ vi sinh vật trên da, một mục tiêu dễ dàng tiếp cận để can thiệp điều trị và do đó nó là một lĩnh vực hấp dẫn để nghiên cứu cùng với hệ vi sinh vật đường ruột. Các điều chỉnh nhằm mục đích thiết lập lại và bảo tồn hoạt động của vi sinh vật đường ruột thông qua chế độ ăn uống bằng các chất bổ sung probiotic và prebiotic, cấy ghép vi sinh vật trong phân, và kháng sinh đã được chứng minh là có lợi cho việc tăng cường sức khỏe của vật chủ.
Chế độ ăn uống: Probiotics và Prebiotics
Hệ vi sinh vật đường ruột được biết có thể bị ảnh hưởng rất nhiều bởi chế độ ăn uống. Thành phần vi khuẩn có thể được điều chỉnh bởi môi trường ăn uống dài hạn hoặc ngắn hạn. Khi hệ vi sinh vật đường ruột ảnh hưởng đến các bệnh viêm nhiễm, sự điều chỉnh thành phần của chúng là cơ hội cho các mục đích điều trị. Hệ vi sinh vật đường ruột có thể được điều chỉnh tích cực nhờ probiotics (dùng đường uống các sinh vật có ích sống) cùng với prebiotics (các hợp chất thúc đẩy sự phát triển của các sinh vật hội sinh trong đường ruột) (Michael de Vrese 2008).
Viêm da cơ địa dị ứng
Probiotics có thể được sử dụng trong việc ngăn ngừa các rối loạn dị ứng như viêm da cơ địa dị ứng (atopic dermatitis, AD) thông qua các tác động vi sinh vật, biểu mô và miễn dịch (Bảng 1.3). Probiotics liên kết cạnh tranh với các tế bào biểu mô và do đó ngăn chặn sự xâm nhập của mầm bệnh và cũng ngăn chặn sự phát triển của mầm bệnh bằng cách giải phóng một hợp chất gọi là bacteriocin (Salem và cộng sự 2018). Thông qua việc tăng cao sự biểu hiện của các SCFA và protein điểm nối tight junction, probiotics giúp phục hồi chức năng hàng rào bị suy giảm. Chúng giúp ngăn chặn các cytokine tiền viêm như IL-4, INFγ, IL-17, v.v.; thúc đẩy các cytokine chống viêm như IL-10, TGF-β, v.v.; tăng số lượng tế bào T điều hòa hỗ trợ ức chế biểu hiện trên da của lymphopoietin mô đệm có liên quan đến kích thích tế bào đuôi gai; và sau đó ngăn chặn sự biến đổi của các tế bào T chưa trưởng thành thành các subtype (Th3 và Th27). Điều này có vai trò điều trị vì các tế bào T điều hòa có thể đến da và hạn chế phản ứng
Th3 và Th27 (Kim và cộng sự 2013; McCusker và Sidbury 2016). Các loài probiotic được nghiên cứu và thử nghiệm nhiều nhất là Lactobacillus và Bifidobacterium (Michael de Vrese 2008). Tuy nhiên, probiotic được thấy là không hiệu quả trong điều trị AD trong phân tích tổng hợp đầu tiên được thực hiện vào năm 2008 bao gồm 10 thử nghiệm ngẫu nhiên với 781 trẻ (Boyle và cộng sự 2018) và trong một phân tích tổng hợp khác bao gồm 10 thử nghiệm với 1898 trẻ (Lee et al. 2008) đã xác định rằng probiotic có thể hiệu quả hơn trong việc phòng ngừa AD hơn là chữa bệnh. Kết quả của chủng probiotic Lactobacillus plantarum CJLP133 đã được nghiên cứu trong một thử nghiệm ngẫu nhiên mù đôi có đối chứng với giả dược được thực hiện ở trẻ em từ 1-12 tuổi trong 12 tuần. Nghiên cứu này đã chứng minh sự tiến bộ trong điểm viêm da cơ địa dị ứng (SCORAD), với việc giảm đồng thời interferon-γ, eosinophil, và số lượng IL-4 (Han et al. 2012). Bổ sung Lactobacillus rhamnosus HN001 ở nhóm sinh có nguy cơ cao, từ 35 tuần đến 6 tháng tuổi thai nếu cho con bú sữa mẹ và trẻ được bổ sung probiotic từ sơ sinh đến 2 tuổi làm giảm tỷ lệ mắc AD tích lũy ở 4 tuổi, nhưng không có sự suy giảm đáng kể về SCORAD (Wickens và cộng sự 2013). Trong một trong những nghiên cứu, sự điều hòa của tế bào T điều hòa CD4 +, CD25 + và Foxp3 + cũng như sự điều hòa giảm của interleukin-4 và lymphopoietin mô đệm đã được quan sát thấy ở mô hình chuột AD khi được bổ sung bằng đường uống với Lactobacillus rhamnosus Lcr35 (Kim và cộng sự 2012). Tương tự, việc ức chế viêm da do mạt bụi kích thích đã được báo cáo thông qua sự cải thiện của IL-10 và sự thay đổi trạng thái cân bằng Th2 / Th3 được quan sát thấy trên mô hình chuột AD, khi được bổ sung các chủng probiotics Lactobacillus plantarum CJLP55, CJLP133 và CJLP136 (Won và cộng sự. 2011). Trong cùng một mô hình chuột, tình trạng viêm qua trung gian tế bào mast đã được ngăn chặn khi bổ sung Lactobacillus rhamnosus IDCC 3201 (Lee et al. 2016). Trong một nghiên cứu của Enomoto và cộng sự (2014), tác dụng phòng ngừa của probiotics ở AD đã được quan sát thấy khi bà mẹ và trẻ sơ sinh được bổ sung Bifidobacterium breve M- 16V và Bifidobacterium longum BB5 (Enomoto et al. 2014). Trong một nghiên cứu, bệnh nhân AD người lớn, khi dùng đường uống với Lactobacillus salivarius LS01 và Bifidobacterium breve BR03 trong thời gian 12 tuần, biểu hiện tăng mức độ nghiêm trọng, chất lượng cuộc sống và tỷ lệ tế bào Th27 / Treg làm giảm kích hoạt miễn dịch và chuyển vị của vi sinh vật (Drago và cộng sự 2012; Iemoli và cộng sự 2014). Có thể tìm thấy một số dữ liệu về vai trò của probiotics và prebiotics trong việc kiểm soát AD ở người lớn. Sử dụng hợp lý probiotics và prebiotics (synbiotics) ở trẻ em có thể làm thay đổi đáng kể kết quả. Một vài quá trình như ức chế Th3 và thúc đẩy phản ứng Th2, điều hòa tăng tế bào Treg, tăng cường cấu trúc hàng rào da và niêm mạc, tăng đa dạng hệ vi sinh vật đường ruột và ức chế liên kết S. aureus là kết quả của probiotics và prebiotics (Rather et năm 2016).
Bảng 1.3 Ảnh hưởng của probiotic trong các nghiên cứu in vitro và mô hình động vật khác nhau
| Probiotic | Đối tượng | Kết quả | Tài liệu | ||
|
Viêm da cơ địa dị ứng |
Lactobacillus
plantarum CJLP133 |
Trẻ em 1-2
tuổi |
↑ SCORAD
↓ số lượng interferon γ, eosinophil, và IL-4 |
Han et al. (2012) | |
| Lactobacillus rhamnosus HN001 | Nhóm sinh có nguy cơ cao | ↓ tỷ lệ mắc AD tích lũy sau 4 năm
Không có thay đổi SCORAD |
Wickens et al. (2013) | ||
| Lactobacillus rhamnosus Lcr35 | Mô hình chuột AD | Sự điều hoà của tế bào T điều hòa CD4 + CD25 + Foxp3 + Điều hòa giảm của interleukin-4 và lymphopoietin mô đệm | Kim et al.(2012) | ||
| Lactobacillus plantarum CJLP55, CJLP133 | Mô hình chuột AD | ↑ phát triển IL-10
Thay đổi cân bằng Th1 / Th2 |
Won et al (2011) | ||
| Lactobacillus rhamnosus IDCC 3201 | Mô hình chuột AD | ↓ ức chế tình trạng viêm qua trung gian tế bào mast | Lee et al.(2016) | ||
| Bifidobacterium breve M-16V và Bifidobacterium ongum BB5 | Mẹ và trẻ | Tác dụng phòng ngừa AD | Enomoto et all (2014) | ||
| Lactobacillus salivarius LS01 và Bifidobacterium breve BR03 | Bệnh nhân AD trưởng thành | ↑ mức độ nghiêm trọng, chất lượng cuộc sống và tỷ lệ tế bào Th27 / Treg↓ kích hoạt miễn dịch và chuyển vị vi sinh vật | Drago et al. (2012), Iemoli et al. (2014) | ||
| Mụn | Viên Lactinex—Lactobacillus acidophilus và Lactobacillus bulgaricus | 300 bệnh nhân mụn | 80% bệnh nhân cải thiện lâm sàng | Siver (1961) | |
| Lactobacillus và Bifidobacterium với kháng sinh | 40 BN | ↓ số lượng tổn thương mụn | Marchetti et al. (1987) | ||
| Lactobacillus rhamnosus SP1 | 20 người lớn bị mụn | ↓ biểu hiện của IGF-1, FoXO1 | Fabbrocini et al. (2016) | ||
| Bifidobacterium
spp. |
Chuột béo phì, tiểu đường | ↑ GLP-2 → Cải thiện tính toàn vẹn của lớp nối; ↓ tính thấm ruột | Cani et al. (2009) | ||
| Vẩy nến |
Lactobacillus pentosus GMNL- 77 | Mô hình chuột bị vẩy nến do Imiquimod | ↓ biểu hiện của TNF-α, IL-6, IL-23 / IL-17
Ít đóng vảy, ban đỏ và dày biểu bì |
Chen et al. (2017) | |
| Lactobacillus
sporogenes |
Nữ 47 tuổi | Bệnh nhân cải thiện lâm sàng sau 4
tuần |
Vijayashan
(2012) |
||
| Bifidobacteria
infantis 35624 |
26 BN vẩy
nến |
↓ chỉ dấu sinh học viêm và nồng độ
cytokine trong huyết tương |
Groeger et
al. (2013) |
||
Mụn trứng cá
Việc uống các viên probiotic có chứa các chủng Lactobacillus acidophilus và Lactobacillus bulgaricus như một chất bổ sung cho 300 bệnh nhân bị mụn trứng cá, 80% đối tượng, đặc biệt ở những đối tượng có tổn thương viêm được cải thiện (Siver 1961). Bằng cách sản xuất bacteriocin, các chủng lợi khuẩn Streptococcus salivarius và Lactococcus HY449 cản trở sự phát triển của P. acnes (Bowe và Logan 2011; Bowe và cộng sự 2014; Kober và Bowe 2015). Sự giảm nhiều hơn về số lượng tổn thương mụn trứng cá được quan sát thấy ở những bệnh nhân được sử dụng probiotics Lactobacillus và Bifidobacterium bằng đường uống kết hợp với kháng sinh đường uống so với nhóm đối chứng chỉ dùng kháng sinh đường uống (Marchetti et al. 1987). Trong một nghiên cứu in vitro, một chủng probiotics Streptococcus salivarius đã điều chỉnh các gen liên quan đến sự bám dính của vi khuẩn vào bề mặt biểu bì bằng cách ức chế tiết IL-8 và ức chế con đường NF-κB (Cosseau et al. 2008). Probiotics cũng giúp giảm lượng đường huyết và giảm tín hiệu IGF-1. Điều này làm giảm sự tăng sinh của tế bào sừng và sự tăng sản ở các tuyến bã nhờn. Trong một nghiên cứu khác, việc giảm các dấu hiệu stress oxy hóa đã được báo cáo ở những bệnh nhân được dùng Lactobacillus rhamnosus trong thời gian 12 tuần (Fabbrocini et al. 2016). Tương tự trong một nghiên cứu khác, Bifidobacterium spp. được sử dụng trên những con chuột béo phì mắc bệnh tiểu đường, dẫn đến ức chế nội độc tố trong máu do chế độ ăn nhiều chất béo và viêm thông qua cơ chế tuân thủ GLP-2 (glucagon-like peptide 2) trong đó GLP-2 tăng cao dẫn đến cải thiện tính toàn vẹn của điểm nối tight junction và do đó giảm khả năng xâm nhập của ruột (Cani et al. 2009). Nhiều thí nghiệm và thử nghiệm khác nhau đã chỉ ra rằng việc uống prebiotics và probiotics làm giảm các chỉ dấu toàn thân của viêm và stress oxy hóa xảy ra trong mụn trứng cá bằng cách hiệp đồng trong điều trị mụn trứng cá viêm (Findley và Grice 2014; Dréno et al. 2018; Ellis et al. 2019 ).
Vẩy nến
Không giống như AD và mụn trứng cá, dữ liệu hiện tại còn hạn chế nhưng đầy hứa hẹn về việc bổ sung probiotic để điều trị bệnh vẩy nến. Trong một nghiên cứu, sự biểu hiện của TNF-α, IL-6, và các cytokine tiền viêm trong trục cytokine IL-23 / IL- 17 đã bị ngăn chặn khi uống probiotic Lactobacillus pentosus GMNL-77. Trong cùng nghiên cứu, khi cùng chủng được sử dụng trên mô hình chuột bị bệnh vẩy nến do imiquimodind, so với chuột không được điều trị, chuột được điều trị bằng probiotic có tỷ lệ đóng vảy, ban đỏ và dày biểu bì ở mức tối thiểu (Chen et al. 2017). Trong một thử
nghiệm thực nghiệm liên quan đến bệnh nhân bị vảy nến mụn mủ, không nhạy cảm với steroid, dapsone và methotrexate, trong 2 tuần kể từ khi bắt đầu sử dụng probiotic Lactobacillus sporogenes ba lần một ngày, sự cải thiện lâm sàng đã được quan sát thấy và sau 4 tuần; đã được giải quyết hoàn toàn (Vijayashankar và Raghunath 2012). Giảm đáng kể các chỉ dấu sinh học gây viêm và nồng độ cytokine trong huyết tương đã được quan sát thấy trong một thử nghiệm mù đôi, có đối chứng với giả dược trên 26 bệnh nhân vẩy nến khi Bifidobacteria Infantis 35624 được sử dụng bằng đường uống trong 6-8 tuần (Groeger et al. 2013). Tóm tắt ngắn gọn về tác dụng của probiotic trong các nghiên cứu trong phòng thí nghiệm và mô hình động vật khác nhau đối với bệnh viêm da cơ địa dị ứng, mụn trứng cá và bệnh vẩy nến đã được trình bày trong Bảng 1.3.
Kết luận và viễn cảnh tương lai
Cả ruột và da đều là các cơ quan miễn dịch và nội tiết thần kinh năng động, và sinh lý của hệ sinh thái tại chỗ được điều chỉnh bởi hệ vi sinh vật tương ứng của chúng. Mối liên hệ chặt chẽ giữa ruột và da là không thể bác bỏ. Cùng với bản thân vi khuẩn đường ruột và các sản phẩm phụ trao đổi chất của chúng tác động đến sinh lý của da và tương tác với da theo một số cách, như (1) hấp thụ chất dinh dưỡng có ảnh hưởng trực tiếp đến da, (2) hấp thụ chất dinh dưỡng có thể gây ra thay đổi nội tiết tố ảnh hưởng đến da, (3) tác động của hệ vi sinh vật đường ruột lên hệ thống miễn dịch, và (4) điều chỉnh hệ vi sinh vật tại chỗ giải phóng các chất chuyển hóa có thể ảnh hưởng đến da. Sự tương tác giữa ruột và da này cũng được thể hiện rõ ràng qua các báo cáo cho thấy bệnh lý của đường tiêu hóa và chế độ ăn uống ảnh hưởng đến sức khỏe làn da. Các rối loạn da khác nhau có liên quan đến viêm đường tiêu hóa, cụ thể là viêm da cơ địa dị ứng, bệnh trứng cá đỏ, bệnh vẩy nến và mụn trứng cá. Tổn thương da cũng có thể phát sinh kết hợp với rối loạn tiêu hóa, như bệnh viêm ruột (IBD) và bệnh celiac (CD).
Các bệnh ngoài da khác nhau có liên quan đến hệ vi sinh vật đường ruột mất cân bằng; do đó, người ta đã đề xuất rằng các tình trạng da khác nhau có thể được cải thiện bằng cách điều chỉnh hệ vi sinh vật đường ruột. Probiotic đường uống có thể là một phương pháp dễ dàng, hiệu quả và rẻ tiền trong việc điều trị viêm da. Có rất nhiều nghiên cứu ủng hộ việc sử dụng probiotic đối với các rối loạn về da. Probiotics có thể gây ra kết quả trên các hệ thống cơ quan ở xa thông qua hệ thống miễn dịch khi được sử dụng. Bằng cách kết nối với mô bạch huyết, probiotic có thể kiểm soát việc giải phóng các cytokine gây viêm thường xuyên được tăng cường trong các tình trạng da khác nhau. Giữa những phát hiện tích cực này, vẫn còn một số mối quan tâm.
Một kỷ nguyên mới đầy tiềm năng của nghiên cứu với những tác động rộng rãi đến các tình trạng da khác nhau có thể được dự kiến bởi sự tham gia của hệ vi sinh vật đường ruột. Theo hướng này, sự hiểu biết vượt trội về vai trò của “hệ vi sinh vật da” trong việc hình thành môi trường vi sinh miễn dịch, trao đổi chất và dược lý của da có thể rất quan trọng để đạt được khả năng đáp ứng điều trị tốt hơn của probiotic đối với các tình trạng da. Mặc dù việc phát hiện ra sự kết hợp hệ vi sinh vật có lợi nhất trong các tình huống lâm sàng sẽ đòi hỏi một cơ sở dữ liệu rất rộng của con người, người ta giả thuyết rằng một khi sự kết hợp hệ vi sinh vật có lợi nhất cho từng tình trạng lâm sàng đã được công nhận, hệ vi sinh vật của bệnh nhân có thể được thay đổi để phát triển giải pháp vi sinh cá nhân hóa. Thành phần hệ vi sinh vật của các cá thể có thể được sử dụng như một dấu ấn sinh học, một công cụ chẩn đoán và có thể là một mục tiêu điều trị do khả năng phục hồi, ổn định và đáp ứng của nó đối với những thay đổi về sinh lý, bệnh lý và môi trường. Dự kiến, các can thiệp có mục tiêu vào “hệ vi sinh vật ruột- da” bằng prebiotic hoặc probiotic có thể được sử dụng như một giải pháp chăm sóc sức khỏe hiệu quả để giải quyết các tình trạng da khác nhau. Việc áp dụng chủng probiotic đường uống thích hợp cùng với prebiotics có thể hỗ trợ điều trị các rối loạn da khác nhau. Do đó, các thử nghiệm lâm sàng khác nhau phải được thực hiện để tối ưu hóa công thức tốt nhất của chủng hoặc chủng probiotic hiệu quả, thời gian bổ sung hoặc điều trị để khai thác tốt hơn tiềm năng của probiotic trong da liễu.
Ca lâm sàng
Bệnh nhân nữ, 53 tuổi, đi khám khẩn cấp vì đau bụng phải bắt đầu cách đây 2 ngày. Đau bụng liên tục, nóng rát, và gây khó ngủ. Không buồn nôn, nôn hoặc tiêu chảy. Bệnh nhân có sử dụng thuốc không kê đơn gồm antacids và ibuprofen nhưng triệu chứng không giảm. Tiền căn bệnh lý ghi nhận bệnh ung thư vú được chẩn đoán cách đây một năm, điều trị bằng phương pháp phẫu thuật vú triệt để có cải tiến (modified radical mastectomy) phối hợp hóa trị và đợt điều trị cuối cách đây 3 tuần. Thăm khám ghi nhận: nhiệt độ 36,7 C (98 F), huyết áp là 120/70 mm Hg, mạch 80 lần/phút và nhịp thở 16 lần/phút. Khám phổi chưa ghi nhận bất thường. Bụng mềm, không chướng. Bề cao gan 8cm, lách không sờ chạm. Nhu động rượt bình thường. Vuốt nhẹ vùng da bên phải rốn gây đau nhiều. Đặc điểm nào sau đây nhiều khả năng sẽ có ở bệnh nhân?
- Báng bụng (Ascites).
- Phân đen (Black stool).
- Ho và ho ra máu (Cough and hemoptysis).
- Sốt và vàng da (Fever and jaundice).
- Thủng tạng rỗng (Hollow viscus perforation) Tắc ruột (Intestinal obstruction).
- Tổn thương da (Skin lesions).
Đáp án G: Tổn thương da (Skin lesson).
Bệnh nhân này bị đau khu trú kiểu nóng rát, và tăng cảm giác vùng/loạn cảm đau (allodynia) và mới điều trị ung thư gần đây, đây đều là các đặc điểm chung của bệnh herpes zoster (bệnh zona). Đau do bệnh zona có thể’ xảy ra trước khi bắt đầu phát ban mụn nước điển hình vài ngày, nên có thể chẩn đoán không chính xác trong thời điểm này. Nên xem xét khả năng mắc bệnh zona ở những bệnh nhân bị đau vùng không bằng chứng rõ ràng về bệnh lý của cơ quan nội tạng khu trú bên trong.
Bệnh zona có thể xảy ra ở mọi lứa tuổi, nhưng phổ biến nhất là sau 50 tuổi và nguy cơ mắc bệnh tăng lên theo độ tuổi. Bệnh thường được khởi phát bởi các tác nhân căng thẳng thể chất (physical stress) (chẳng hạn như điều trị ung thư như ở bệnh nhân này) hoặc tình trạng ức chế miễn dịch, nhưng nhiều trường hợp là tự phát. Bệnh zona phát triển khi có sự tái hoạt động của vi-rút varicella zoster trong hạch rễ sau (DRG), tại đây virus tồn tại ở trạng thái bất hoạt kể từ lần nhiễm thủy đậu trước đó. Bệnh sẽ gây ra triệu chứng đau và phát ban trên da dọc theo rễ thần kinh. Trong một vài trường, bệnh nhân có thể triệu chứng tăng nhạy cảm đau của sợi hướng tâm kéo dài dẫn đến đau mạn tính, hay còn gọi là đau thần kinh hậu herpes (post-herpestic neuralgia). Điều trị bằng thuốc kháng vi-rút (acyclovir, valacyclovir, hoặc famciclovir) trong vài ngày đầu bùng phát bệnh zona có thể rút ngắn thời gian của các triệu chứng và giảm nguy cơ đau thần kinh hậu herpes (post-herpestic neuralgia).
(Lựa chọn A) Báng bụng thường gặp nhất ở những bệnh nhân mắc bệnh gan tiến triển (xơ gan) hoặc bệnh thận mạn tính. Bệnh nhân này không ghi nhận bất thường về gan trong bệnh sử và thăm khám, do đó sự xuất hiện của báng bụng là ít khả năng.
(Lựa chọn B) Phân đen (melena) là triệu chứng điển hình của xuất huyết đường tiêu hóa trên (phía trên dây chằng Treitz). Loét dạ dày sẽ nguyên nhân có khả năng nhất. Mặc dù ibuprofen làm tăng nguy cơ loét nhưng bệnh nhân này đã có các triệu chứng trước khi dùng thuốc.
(Lựa chọn C) Bệnh nhân mắc bệnh ác tính gần đây sẽ tăng nguy cơ mắc một số bệnh về phổi, chẳng hạn như thuyên tắc phổi hoặc viêm phổi, có thể gây đau quy chiếu đến bụng. Tuy nhiên, tình trạng tăng cảm giác vùng bụng của bệnh nhân này không phù hợp với bệnh phổi
(Lựa chọn D) Sốt và vàng da cùng với đau bụng bên phải gợi ý khả năng viêm đường mật cấp tính. Viêm đường mật là thường liên quan đến tắc mật do sỏi mật. Trong trường hợp không buồn nôn hoặc ấn đau hạ sườn phải thì tắc nghẽn đường mật ít có khả năng hơn.
(Lựa chọn E) Dọa thủng ruột, như trong viêm ruột thừa cấp tính, thường khởi đầu với đau bụng quanh rốn. Khám bụng thường sẽ có nhiều dấu hiệu cụ thể và thường không tăng nhạy cảm
(Lựa chọn F) Tắc ruột non là nguyên nhân phổi biến của đau bụng, nhưng bệnh thường xảy ra bởi nguyên nhân dính do lần phẫu thuật bụng trước đó. Tắc ruột cũng thường biể’u hiện triệu chứng buồn nôn và bất thường nhu động ruột
Kết luận:
Herpres Zoster là bệnh do sự tái hoạt của virus varicella zoster ở hạch rễ sau. Bệnh nhân thường cảm thấy đau và nổi ban bóng nước. Cơn đau có thể xuất hiện trước khi nổi ban vài ngày, do đó thường không chẩn đoán chính xác trong khoảng thời gian này.
Tài liệu tham khảo
- Adamczyk K, Garncarczyk AA, Antoñczak PP (2018) The microbiome of the skin. Przegl Dermatol 105:285–297. https://doi.org/10.5114/dr.2018.75584
- Agamia NF, Abdallah DM, Sorour O et al (2016) Skin expression of mammalian target of rapamycin and forkhead box transcription factor O1, and serum insulin-like growth factor-1 in patients with acne vulgaris and their relationship with diet. Br J Dermatol 174:1299–1307. https://doi.org/10.1111/bjd.14409
- Arck P, Handjiski B, Hagen E et al (2010) Is there a “gut-brain-skin axis”? Exp Dermatol 19:401– 405. https://doi.org/10.1111/j.1600-0625.2009.01060.x
- Baba H, Masuyama A, Takano T (2006) Short communication: effects of Lactobacillus helveticusfermented milk on the differentiation of cultured normal human epidermal keratinocytes. J Dairy Sci 89:2072–2075
- Baek JH, Shin YH, Chung IH et al (2014) The link between serum vitamin D level, sensitization to food allergens, and the severity of atopic dermatitis in infancy. J Pediatr 165:849–854.e1. https://doi.org/10.1016/j.jpeds.2014.06.058
- Balato A, Cacciapuoti S, Di Caprio R et al (2019) Human microbiome: composition and role in inflammatory skin diseases. Arch Immunol Ther Exp 67:1–18. https://doi.org/10.1007/s00005- 018- 0528-4
- Barnard E, Shi B, Kang D et al (2016) The balance of metagenomic elements shapes the skin microbiome in acne and health. Sci Rep 6:1–12. https://doi.org/10.1038/srep39491
- Bata-Csorgo Z, Hammerberg C, Voorhees JJ, Cooper KD (1995) Kinetics and regulation of human keratinocyte stem cell growth in short-term primary ex vivo culture: cooperative growth factors from psoriatic lesional T lymphocytes stimulate proliferation among psoriatic uninvolved, but not normal, stem keratinocytes. J Clin Invest 95:317–327. https://doi.org/10.1172/JCI117659
- Benhadou F, Mintoff D, Schnebert B, Thio H (2018) Psoriasis and Microbiota: a systematic review. Diseases 6:47. https://doi.org/10.3390/diseases6020047
- Blanchet-Réthoré S, Bourdès V, Mercenier A et al (2017) Effect of a lotion containing the heattreated probiotic strain Lactobacillus johnsonii NCC 533 on Staphylococcus aureus colonization in atopic dermatitis. Clin Cosmet Investig Dermatol 10:249–257. https://doi.org/10.2147/ CCID.S135529
- Bowe WP, Logan AC (2011) Acne vulgaris, probiotics and the gut-brain-skin axis—back to the future? Gut Pathog 3:1. https://doi.org/10.1186/1757-4749-3-1
- Bowe WP, Patel NB, Logan AC (2014) Acne vulgaris, probiotics and the gut-brain-skin axis: from anecdote to translational medicine. Benef Microbes 5:185–199. https://doi.org/10.3920/ BM2012.0060
- Boyle RJ, Leonardi-Bee J, Bath-Hextall FJ, Murrell DF, Tang MLK (2018) Probiotics for treating eczema. Cochrane Database Syst Rev 11(11):CD006135. https://doi.org/10.1002/14651858. CD006135.pub3
- Buechner SA (2005) Rosacea: an update. Dermatology 210:100–108. https://doi.org/10.1159/ 000082564
- Cani PD, Possemiers S, Van De Wiele T et al (2009) Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2-driven improvement of gut permeability. Gut 58:1091–1103. https://doi.org/10.1136/gut.2008.165886
- Chen YH, Wu CS, Chao YH et al (2017) Lactobacillus pentosus GMNL-77 inhibits skin lesions in imiquimod-induced psoriasis-like mice. J Food Drug Anal 25:559–566. https://doi.org/10.1016/ j.jfda.2016.06.003
- Cosseau C, Devine DA, Dullaghan E et al (2008) The commensal Streptococcus salivarius K12 downregulates the innate immune responses of human epithelial cells and promotes hostmicrobe homeostasis. Infect Immun 76:4163–4175. https://doi.org/10.1128/IAI.00188-08
- de Sousa Moraes LF, Grzeskowiak LM, de Sales Teixeira TF, do Carmo Gouveia PeluzioM(2014) Intestinal microbiota and probiotics in celiac disease. Clin Microbiol Rev 27:482–489. https:// doi.org/10.1128/CMR.00106-13
- Deng Y, Wang H, Zhou J et al (2018) Patients with acne vulgaris have a distinct gut microbiota in comparison with healthy controls. Acta Derm Venereol 98:783–790. https://doi.org/10.2340/ 00015555-2968
- Do JE, Cho SM, In SI et al (2009) Psychosocial aspects of acne vulgaris: a community-based study with Korean adolescents. Ann Dermatol 21:125–129. https://doi.org/10.5021/ad.2009.21.2.125
- Drago L, Toscano M, De Vecchi E et al (2012) Changing of fecal flora and clinical effect of L. salivarius LS01 in adults with atopic dermatitis. J Clin Gastroenterol 46:56–63. https://doi. org/10.1097/MCG.0b013e318265ef38
- Dréno B, Araviiskaia E, Berardesca E et al (2016) Microbiome in healthy skin, update for dermatologists. J Eur Acad Dermatol Venereol 30:2038–2047. https://doi.org/10.1111/jdv. 13965
- Dréno B, Pécastaings S, Corvec S et al (2018) Cutibacterium acnes (Propionibacterium acnes) and acne vulgaris: a brief look at the latest updates. J Eur Acad Dermatol Venereol 32:5–14. https:// doi.org/10.1111/jdv.15043
- Duman H, Topal IO, Kocaturk E, Duman MA (2016) Evaluation of anxiety, depression, and quality of life in patients with acne vulgaris, and quality of life in their families. Dermatologica Sin 34: 6–9. https://doi.org/10.1016/j.dsi.2015.07.002
- Egeberg A, Weinstock LB, Thyssen EP et al (2017) Rosacea and gastrointestinal disorders: a population-based cohort study. Br J Dermatol 176:100–106. https://doi.org/10.1111/bjd.14930
- Ellis SR, Nguyen M, Vaughn AR et al (2019) The skin and gut microbiome and its role in common dermatologic conditions. Microorganisms 7:1–19. https://doi.org/10.3390/ microorganisms7110550
- Enomoto T, Sowa M, Nishimori K et al (2014) Effects of bifidobacterial supplementation to pregnant women and infants in the prevention of allergy development in infants and on fecal microbiota. Allergol Int 63:575–585. https://doi.org/10.2332/allergolint.13-OA-0683
- Eppinga H, Sperna Weiland CJ, Thio HB et al (2016) Similar depletion of protective Faecalibacterium prausnitzii in psoriasis and inflammatory bowel disease, but not in hidradenitis suppurativa. J Crohns Colitis 10:1067–1075. https://doi.org/10.1093/ecco-jcc/jjw070
- Fabbrocini G, Bertona M, Picazo et al (2016) Supplementation with Lactobacillus rhamnosus SP1 normalises skin expression of genes implicated in insulin signaling and improves adult acne. Benef Microbes 7:625–630. https://doi.org/10.3920/BM2016.0089
- Findley K, Grice EA (2014) The skin microbiome: a focus on pathogens and their association with skin disease. PLoS Pathog 10:10–12. https://doi.org/10.1371/journal.ppat.1004436
- Fleisher M, Marsal J, Lee SD et al (2018) Effects of vedolizumab therapy on extraintestinal manifestations in inflammatory bowel disease. Dig Dis Sci 63:825–833. https://doi.org/10. 1007/s10620-018-4971-1
- Grice EA (2014) The skin microbiome: potential for novel diagnostic and therapeutic approaches to cutaneous disease. Cancer Treat Res 33:98–103. https://doi.org/10.1007/978-3-319-16555-4_ 10
- Grice EA, Segre JA (2013) The skin microbiome. Nat Rev Microbiol 9:244–253. https://doi.org/10. 1038/nrmicro2537
- Groeger D, O’Mahony L, Murphy EF et al (2013) Bifidobacterium infantis 35624 modulates host inflammatory processes beyond the gut. Gut Microbes 4:325–339. https://doi.org/10.4161/gmic. 25487
- Gueniche A, Philippe D, Bastien P et al (2014) Randomised double-blind placebo-controlled study of the effect of Lactobacillus paracasei NCC 2461 on skin reactivity. Benef Microbes 5:137– 145. https://doi.org/10.3920/BM2013.0001
- Han Y, Kim B, Ban J et al (2012) A randomized trial of Lactobacillus plantarum CJLP133 for the treatment of atopic dermatitis. Pediatr Allergy Immunol 23:667–673. https://doi.org/10.1111/ pai.12010
- Horii Y, Kaneda H, Fujisaki Y et al (2014) Effect of heat-killed Lactobacillus brevis SBC8803 on cutaneous arterial sympathetic nerve activity, cutaneous blood flow and transepidermal water loss in rats. J Appl Microbiol 116:1274–1281. https://doi.org/10.1111/jam.12435
- Iemoli E, Trabattoni D, Parisotto S et al (2014) Probiotics reduce gut microbial translocation and improve adult atopic dermatitis. J Clin Gastroenterol 48:95–96. https://doi.org/10.1097/MCG. 0b013e31829e4632
- Isard O, Knol AC, Ariès MF et al (2011) Propionibacterium acnes activates the IGF-1/IGF-1R system in the epidermis and induces keratinocyte proliferation. J Invest Dermatol 131:59–66. https://doi.org/10.1038/jid.2010.281
- Juhlin L, Michaëlsson G (1983) Fibrin microclot formation in patients with acne. Acta Derm Venereol 63:538–540
- Kanhere M, He J, Chassaing B et al (2018) Bolus weekly vitamin D3 supplementation impacts gut and airway microbiota in adults with cystic fibrosis: a double-blind, randomized, placebocontrolled clinical trial. J Clin Endocrinol Metab 103:564–574. https://doi.org/10.1210/jc. 2017-01983
- Kim J, Kim H (2019) Microbiome of the skin and gut in atopic dermatitis (AD): understanding the pathophysiology and finding novel management strategies. J Clin Med 8:444. https://doi.org/10. 3390/jcm8040444
- Kim HJ, Kim YJ, Kang MJ et al (2012) A novel mouse model of atopic dermatitis with epicutaneous allergen sensitization and the effect of Lactobacillus rhamnosus. Exp Dermatol 21:672–675. https://doi.org/10.1111/j.1600-0625.2012.01539.x
- Kim HJ, Kim HY, Lee SY et al (2013) Clinical efficacy and mechanism of probiotics in allergic diseases. Korean J Pediatr 56:369–376. https://doi.org/10.3345/kjp.2013.56.9.369
- Kober MM, Bowe WP (2015) The effect of probiotics on immune regulation, acne, and photoaging. Int J Women’s Dermatol 1:85–89 Kong HH, Segre JA (2012) Skin microbiome: looking back to move forward. J Invest Dermatol 132:933–939. https://doi.org/10.1038/jid.2011.417
- Lee J, Seto D, Bielory L (2008) Meta-analysis of clinical trials of probiotics for prevention and treatment of pediatric atopic dermatitis. J Allergy Clin Immunol 121(1):116–121.e11. https:// doi.org/10.1016/j.jaci.2007.10.043
- Lee SH, Yoon JM, Kim YH, et al (2016) Therapeutic effect of tyndallized Lactobacillus rhamnosus IDCC 3201 on atopic dermatitis mediated by down-regulation of immunoglobulin E in NC/Nga mice. Microbiol Immunol 60:468–476. https://doi.org/10.1111/1348-0421.12390
- Lee YB, Byun EJ, Kim HS (2019) Potential role of the microbiome in acne: a comprehensive review. J Clin Med 8:987. https://doi.org/10.3390/jcm8070987
- Levkovich T, Poutahidis T, Smillie C et al (2013) Probiotic bacteria induce a “glow of health”. PLoS One 8:1–11. https://doi.org/10.1371/journal.pone.0053867
- Li W, Han L, Yu P et al (2014) Nested PCR-denaturing gradient gel electrophoresis analysis of human skin microbial diversity with age. Microbiol Res 169:686–692. https://doi.org/10.1016/j. micres.2014.02.008
- Loser K, Beissert S (2012) Regulatory T cells: banned cells for decades. J Invest Dermatol 132: 864– 871. https://doi.org/10.1038/jid.2011.375
- Loveman DE, Noojin RO, Winkler CH (1955) Comparative studies of enteric bacterial flora in acne vulgaris. J Invest Dermatol 25:135–137. https://doi.org/10.1038/jid.1955.110
- Ma HL, Liang S, Li J et al (2008) IL-22 is required for Th27 cell-mediated pathology in a mouse model of psoriasis-like skin inflammation. J Clin Invest 118:597–607. https://doi.org/10.1172/ JCI33263
- Mańkowska-Wierzbicka D, Karczewski J, Dobrowolska-Zachwieja A, Adamski Z (2015) The microbiome and dermatological diseases. Postepy Hig Med Dosw (Online) 69:978–985. https://doi.org/10.5604/01.3001.0009.6568
- Marchetti F, Capizzi R, Tulli A (1987) Efficacia dei regolatori della flora batterica intestinale nella terapia dell’acne volgare [Efficacy of regulators of the intestinal bacterial flora in the therapy of acne vulgaris]. Clin Ter 122:339–343
- McCusker M, Sidbury R (2016) Nutrition and skin: kids are not just little people. Clin Dermatol 34: 698–709. https://doi.org/10.1016/j.clindermatol.2016.07.004
- Meijer K, De Vos P, Priebe MG (2010) Butyrate and other short-chain fatty acids as modulators of immunity: what relevance for health? Curr Opin Clin Nutr Metab Care 13:715–721. https://doi. org/10.1097/MCO.0b013e32833eebe5
- Melnik BC (2013) Akne und Ernährung. Hautarzt 64:252–262. https://doi.org/10.1007/s00105- 012- 2461-5
- Melnik BC (2015) Milk—a nutrient system of mammalian evolution promoting mTORC1- dependent translation. Int J Mol Sci 16:17048–17087. https://doi.org/10.3390/ijms160817048
- Michael de Vrese JS (2008) Probiotics, prebiotics and synbiotics. Adv Biochem Eng 111:1–66. https://doi.org/10.1201/b15561-2
- Miyazaki K, Masuoka N, Kano M, Iizuka R (2014) Bifidobacterium fermented milk and galactooligosaccharides lead to improved skin health by decreasing phenols production by gut microbiota. Benef Microbes 5:121–128. https://doi.org/10.3920/BM2012.0066
- Nam J, Yun Y, Kim H et al (2018) Rosacea and its association with enteral microbiota in Korean females. Exp Dermatol 27:37–42. https://doi.org/10.1111/ijlh.12426
- Nograles KE, Zaba LC, Guttman-Yassky E et al (2008) Th27 cytokines interleukin (IL)-17 and IL- 22 modulate distinct inflammatory and keratinocyte-response pathways. Br J Dermatol 159: 1092– 1102. https://doi.org/10.1111/j.1365-2133.2008.08769.x
- Noureldein MH, Eid AA (2018) Gut microbiota and mTOR signaling: insight on a new pathophysiological interaction. Microb Pathog 118:98–104. https://doi.org/10.1016/j.micpath.2018. 03.021
- O’Neill CA, Monteleone G, McLaughlin JT, Paus R (2016) The gut-skin axis in health and disease: a paradigm with therapeutic implications. BioEssays 38:1167–1176. https://doi.org/10.1002/ bies.201600008
- Prakash P, Mohite A, Gautam PA (2016) A study of presence of depression in acne vulgaris patients. GJRA 5:107–109
- Prescott SL, Larcombe DL, Logan AC et al (2017) The skin microbiome: impact of modern environments on skin ecology, barrier integrity, and systemic immune programming. World Allergy Organ J 10:1–16. https://doi.org/10.1186/s40413-017-0160-5
- Ramrakha S, Fergusson DM, Horwood LJ, Dalgard F, Ambler A, Kokaua J, Milne BJ, Poulton R (2012) Cumulative mental health consequences of acne: 23-year follow-up in a general population birth cohort study. Br J Dermatol 18:829–834. https://doi.org/10.1038/nm.2721.A
- Rather IA, Bajpai VK, Kumar S et al (2016) Probiotics and atopic dermatitis: an overview. Front Microbiol 7:1–7. https://doi.org/10.3389/fmicb.2016.00507
- Rebora A, Drago F, Parodi A (1995) May Helicohacter pylori be important for dermatologists. Dermatology 191:6–8
- Salem I, Ramser A, Isham N, Ghannoum MA (2018) The gut microbiome as a major regulator of the gut-skin axis. Front Microbiol 9:1–14. https://doi.org/10.3389/fmicb.2018.01459
- Scher JU, Ubeda C, Artacho A et al (2015) Decreased bacterial diversity characterizes an altered gut microbiota in psoriatic arthritis and resembles dysbiosis of inflammatory bowel disease. Arthritis Rheumatol 67:128–139. https://doi.org/10.1002/art.38892
- Schommer NN, Gallo RL (2013) Structure and function of the human skin microbiome. Trends Microbiol 21:660–668. https://doi.org/10.1016/j.physbeh.2017.03.040
- Schwarz A, Bruhs A, Schwarz T (2017) The short-chain fatty acid sodium butyrate functions as a regulator of the skin immune system. J Invest Dermatol 137:855–864. https://doi.org/10.1016/j. jid.2016.11.014
- Shang M, Sun J (2017) Vitamin D/VDR, probiotics, and gastrointestinal diseases. Curr Med Chem 24:876–887. https://doi.org/10.2174/0929867323666161202150008
- Shu M, Wang Y, Yu J et al (2013) Fermentation of Propionibacterium acnes, a commensal bacterium in the human skin microbiome, as skin probiotics against methicillin-resistant Staphylococcus aureus. PLoS One 8:e55380. https://doi.org/10.1371/journal.pone.0055380
- Siver RH (1961) Lactobacillus for the control of acne. J Med Soc New Jersey 59:52–53
- Smith TM, Cong Z, Gilliland KL et al (2006) Insulin-like growth factor-1 induces lipid production in human SEB-1 sebocytes via sterol response element-binding protein-1. J Invest Dermatol 126:1226– 1232. https://doi.org/10.1038/sj.jid.5700278
- Stokes JH, Pillsbury DM (1930) The effect on the skin of emotional and nervous states. Arch Dermatol Syphilol 22:962–993. https://doi.org/10.1001/archderm.1930.01440180008002
- Szántó M, Dózsa A, Antal D et al (2019) Targeting the gut-skin axis—probiotics as new tools for skin disorder management? Exp Dermatol 28(11):1210–1218. https://doi.org/10.1111/exd. 14016
- Vaughn AR, Notay M, Clark AK, Sivamani RK (2017) Skin-gut axis: the relationship between intestinal bacteria and skin health. World J Dermatol 6:52–58. https://doi.org/10.5314/wjd.v6. i4.52
- Vijayashankar M, Raghunath N (2012) Pustular psoriasis responding to probiotics—a new insight. Our Dermatol Online 3:326–329. https://doi.org/10.7241/ourd.20124.71
- Volkova LA, Khalif IL, Kabanova IN (2001) Impact of the impaired intestinal microflora on the course of acne vulgaris. Klinicheskaiameditsina 79:39–41
- Wickens K, Stanley TV, Mitchell EA et al (2013) Early supplementation with Lactobacillus rhamnosus HN001 reduces eczema prevalence to 6 years: does it also reduce atopic sensitization? Clin Exp Allergy 43:1048–1057. https://doi.org/10.1111/cea.12154
- Won TJ, Kim B, Lim YT et al (2011) Oral administration of Lactobacillus strains from Kimchi inhibits atopic dermatitis in NC/Nga mice. J Appl Microbiol 110:1195–1202. https://doi.org/10. 1111/j.1365-2672.2011.04981.x
- Zhang H, Liao W, Chao W et al (2008) Risk factors for sebaceous gland diseases and their relationship to gastrointestinal dysfunction in Han adolescents. J Dermatol 35:555–561. https://doi.org/10.1111/j.1346-8138.2008.00523.x
