Để tải bài viết Tổng hợp một số trường hợp xoắn đỉnh PDF mời các bạn click vào link ở đây.
Department of Internal Medicine, Chonnam National University Medical School, Gwangju, Korea
Các tác giả: Ji Ae Yang, Hong Sang Choi, Eun Hui Bae, Seong Kwon Ma, Soo Wan Kim, Chang Seong Kim
1Department of Internal Medicine, Texas Tech University Health Sciences Center, Permian Basin, USA
2Department of Critical Care, Texas Tech University Health Sciences Center, Midland Memorial Hospital, Midland, TX, USA
3Department of Clinical Pharmacology, Medical Center Hospital, Odessa, TX, USA
Các tác giả: O. Mukarram,1 Y. Hindi,1 G. Catalasan,2 and J. Ward3
Trích dẫn bài báo: Siraj T Z, Ganim I, Barker W, et al. (July 29, 2021) Torsades de Pointes With a Normal Magnesium Level in the Setting of Short Bowel Syndrome. Cureus 13(7): e16743.
Các tác giả: Talhah Z. Siraj, Ismail Ganim, William Barker, Joseph Abraham, Eric Landa
Dịch: Ths.Bs Phạm Hoàng Thiên
Xoắn đỉnh khi bắt đầu chạy thận nhân tạo: báo cáo ca lâm sàng
Giới thiệu
Hội chứng QT dài mắc phải có thể do một số loại thuốc, chẳng hạn như thuốc chống loạn nhịp nhóm III và Ia, thuốc chống loạn thần, thuốc chống trầm cảm ba vòng, kháng sinh macrolide và methadone ( 1 – 3 ). Bản thân việc kéo dài khoảng QT trong dân số mắc hội chứng QT dài là quan trọng về mặt lâm sàng vì khoảng QT kéo dài là tiền đề cho xoắn đỉnh, một loại nhịp nhanh thất không phổ biến và có khả năng gây tử vong ( 4 ). Các loại thuốc được liệt kê trước đây làm chậm tốc độ tái cực có thể dẫn đến xoắn đỉnh. Xoắn đỉnh dễ xảy ra với một số tình trạng thúc đẩy, bao gồm bệnh tim, nhịp tim chậm và rối loạn điện giải như hạ kali máu và hạ magie máu ( 1 , 5).
Ở bệnh nhân chạy thận nhân tạo, sự bài tiết kali đạt được bằng cách khuếch tán (diffusion) và đối lưu (convection) kali từ nơi có nồng độ cao hơn trong huyết thanh đến nồng độ thấp hơn trong dịch thẩm tách, và do đó, tỷ lệ thuận với gradien nồng độ giữa huyết thanh và dịch lọc. Một số nghiên cứu đã cho thấy mối liên quan giữa dịch lọc có kali thấp với nguy cơ đột tử do tim cao hơn ( 6 – 9 ). Karnik và cộng sự cho thấy rằng những bệnh nhân bị ngừng tim nhiều khả năng đã được điều trị bằng dịch lọc có hàm lượng kali thấp vào ngày ngừng tim ( 6 ). Hơn nữa, Pun và cộng sự báo cáo rằng một dịch lọc có kali ≤ 2 mEq / L làm tăng gấp đôi nguy cơ ngừng tim đột ngột từ 10% lên 20% so với một dịch lọc có kali cao hơn ≥ 2 mEq / L, bất kể nồng độ kali huyết thanh trước khi chạy thận nhân tạo ( 8 ). Một nghiên cứu mù đơn chéo cũng cho thấy ở một nhóm bệnh nhân nhạy cảm với chạy thận nhân tạo được điều trị bằng cách sử dụng dịch lọc có kali hằng định với nồng độ kali tương đối thấp (2,5 mEq / L) dẫn đến tỷ lệ rối loạn nhịp tim cao hơn 3,9 lần so với điều trị bằng cách sử dụng giảm kali trong chạy thận nhân tạo với nồng độ kali huyết thanh cao hơn ( 10 ). Ngoài ra, hạ kali máu là một biến chứng thường gặp khi chạy thận nhân tạo ( 11 ). Về mặt này, bản thân chạy thận nhân tạo có thể là một yếu tố nguy cơ kéo dài khoảng QT và xoắn đỉnh.
Theo hiểu biết của chúng tôi, đã có những báo cáo về xoắn đỉnh do thuốc ở những bệnh nhân chạy thận nhân tạo ( 12 – 15 ). Tuy nhiên, các trường hợp xoắn đỉnh do nồng độ kali giảm đột ngột ở những bệnh nhân bắt đầu chạy thận nhân tạo vẫn chưa được mô tả rõ ràng. Chúng tôi báo cáo trường hợp xoắn đỉnh này xảy ra khi bắt đầu chạy thận nhân tạo trên một bệnh nhân bị rung nhĩ kèm theo kéo dài QT sau khi điều trị bằng thuốc chống loạn nhịp.
Trình bày tình huống
Một BN nữ 70 tuổi không bị rối loạn nhịp tim hay bệnh tim nào ngoài bệnh thận mạn, đái tháo đường và tăng huyết áp được đưa vào cấp cứu do áp xe mông tái phát sau điều trị kháng sinh. 28 ngày sau khi nhập viện, rung nhĩ đáp ứng thất nhanh mới được phát hiện, nhưng tần số tim của bà ấy đã được kiểm soát (< 110 nhịp / phút) sau hai ngày dùng amiodarone tĩnh mạch ( Hình 1). Mặc dù urê máu và creatinin huyết thanh tăng rõ rệt (lần lượt là 74,9 và 5,42 mg / dL), kali huyết thanh vẫn nằm trong giới hạn bình thường (3,8 mg / dL). Tuy nhiên, phù phổi vẫn khởi phát mặc dù đã sử dụng furosemide; do đó, BN được chạy thận nhân tạo. Sau ba đợt chạy thận nhân tạo, BN kêu chóng mặt và suy giảm ý thức. Điện tâm đồ cho thấy nhịp nhanh thất đa hình với khoảng QT hiệu chỉnh kéo dài (QTc) là 560 ms, sau đó là xoắn đỉnh (Hình 2). Kali huyết thanh đã giảm xuống 3,1 mg / dL (khoảng tham chiếu 3,5–5,1 mEq / L), canxi total xuống 8,7 mg/dL (khoảng tham chiếu 8,4-10,2 mg/dL) và magiê còn 1,7 mg/dL (khoảng tham chiếu 1,9 – 2,5 mg/dL). Chúng tôi đã thực hiện khử rung tim bằng dòng điện trực tiếp ba lần để điều chỉnh xoắn đỉnh. Chúng tôi ngừng amiodarone và sử dụng magnesium sulfate. Sau đó, bệnh nhân được chuyển đến ICU và trải qua liệu pháp thay thế thận liên tục bằng dịch lọc chứa kali và phosphat để ngăn ngừa hạ kali máu. Do đó, kali và magiê huyết thanh tăng lên lần lượt là 4,8 và 2,5 mg / dL, và điện tâm đồ cho thấy khoảng QTc giảm xuống còn 412 ms. Tình trạng ý thức của bà ấy đã hồi phục và không còn bị xoắn đỉnh nữa. Bà được xuất viện với thuốc chẹn beta đường uống (bisoprolol, 2,5 mg hai lần một ngày) để kiểm soát rung nhĩ. Một điện tâm đồ được thực hiện tại phòng khám ngoại trú một tháng sau đó, cho thấy rung nhĩ với tần số 78 nhịp / phút và khoảng QTc là 454 ms. Quá trình lâm sàng của bệnh nhân của chúng tôi được mô tả trong Hình 3 .
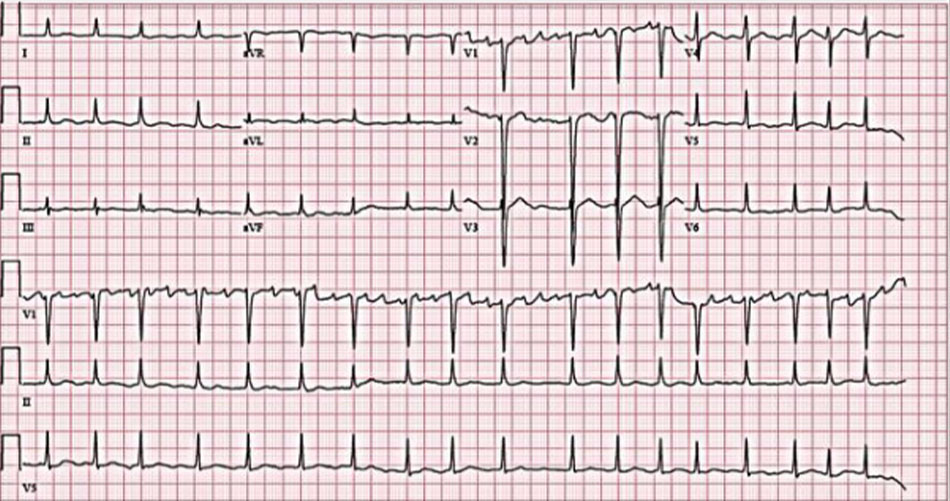
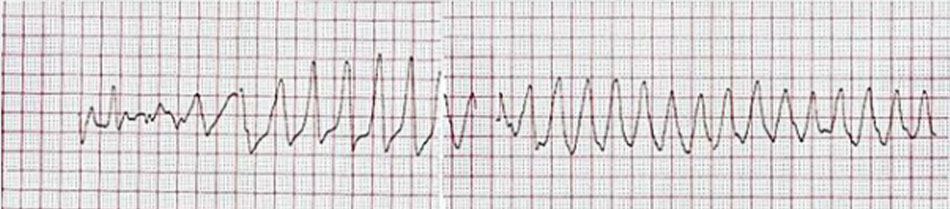
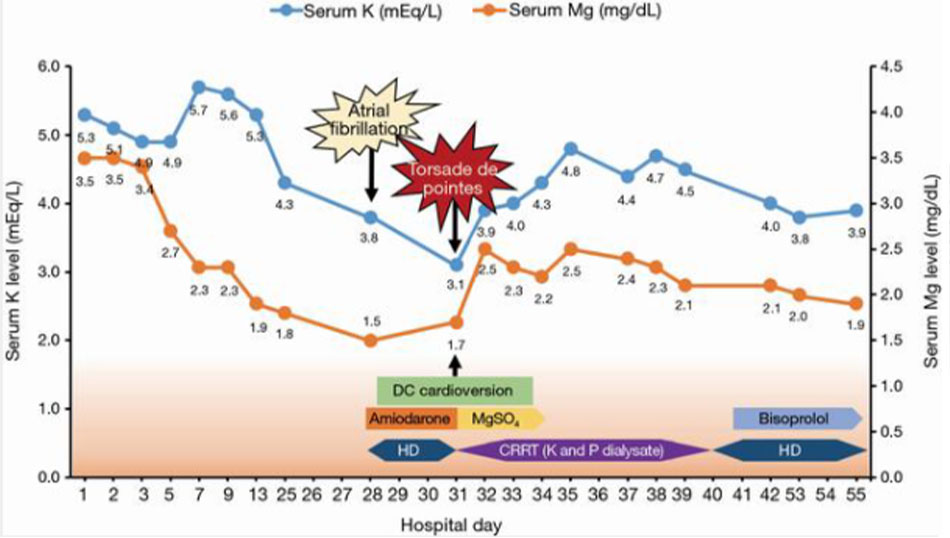
Thảo luận
Xoắn đỉnh là một rối nhịp tim bất thường có thể dẫn đến đột tử do tim và do đó, cần được điều trị khẩn cấp. Điện tâm đồ cho thấy nhịp nhanh thất đa hình và sự xuất hiện rõ rệt của khoảng QT kéo dài. Hậu khử cực sớm là do sự khử cực bất thường của kênh kali hoặc kênh natri và là biến cố kích phát xoắn đỉnh ( 16). Mặc dù sinh lý bệnh cơ bản trực tiếp của xoắn đỉnh là khoảng QT thực tế tăng lên, các yếu tố thúc đẩy như giới tính nữ; rối loạn điện giải, bao gồm hạ kali máu, hạ magie huyết và hạ calci máu; thuốc kéo dài khoảng QT; suy tim sung huyết; nhồi máu cơ tim; suy giáp; nhồi máu não hoặc xuất huyết nội sọ; hội chứng QT dài bẩm sinh; và sự biến thiên của sóng T có liên quan đến xoắn đỉnh ( 1 – 3 , 17 ).
Trong trường hợp của chúng tôi, sự kéo dài khoảng QT hiệu chỉnh có thể được gây ra bởi amiodaron để điều trị rung nhĩ ở bệnh nhân giới tính nữ là một yếu tố nguy cơ. Mặc dù amiodarone là một nguyên nhân nổi tiếng của kéo dài QT và xoắn đỉnh, hạ kali máu và hạ magie máu do chạy thận nhân tạo cũng có thể kích phát xoắn đỉnh. Do đó, bác sĩ nên kiểm tra hạ kali máu khi bắt đầu chạy thận nhân tạo và duy trì tần số tim ≥ 70 nhịp / phút và khoảng QTc không quá 440 ms ( 18 ). Trên thực tế, trong một nghiên cứu thuần tập tiến cứu được thực hiện ở những bệnh nhân bị bệnh thận mạn, những bệnh nhân có nồng độ kali ≤ 4 mEq / L có nguy cơ tử vong cao hơn và bệnh thận giai đoạn cuối cao hơn so với những người có nồng độ kali bình thường (4.1–5.5 mEq / L) hoặc nồng độ kali cao (5,5–5,9 mEq / L) (19 ).
Duy trì các chất điện giải trong huyết thanh ở mức thích hợp trong quá trình chạy thận nhân tạo là chìa khóa để tránh xoắn đỉnh. Điều quan trọng là ngăn ngừa sự sụt giảm mạnh nồng độ kali huyết thanh trong quá trình chạy thận nhân tạo vì nguy cơ rối loạn nhịp tim. Nồng độ magiê cũng cho thấy mối liên hệ giữa đường cong hình chữ J với tỷ lệ tử vong do mọi nguyên nhân, đặc biệt là hạ magie máu liên quan đến sự phân tán QT (QT dispersion) ( 20 ). Thật vậy, đối với những bệnh nhân chạy thận nhân tạo có xoắn đỉnh đi kèm, các nghiên cứu trước đây đã chỉ ra rằng truyền magiê sulfat và kali vào tĩnh mạch ngay lập tức là lựa chọn điều trị đầu tiên ( 2 , 18 ).
Rất tiếc, chúng tôi không thể thực hiện xét nghiệm trong ba lần chạy thận liên tiếp, ngoại trừ lần chạy thận đầu tiên. Tuy nhiên, một phát hiện đáng chú ý trong trường hợp của chúng tôi là dịch lọc có chứa hàm lượng kali sinh lý đã được sử dụng để điều trị chứng xoắn đỉnh. Chạy thận nhân tạo thông thường, đặc biệt là liệu pháp thay thế thận liên tục, sử dụng dịch lọc có ít hoặc không có kali. Cách tiếp cận thông thường này có thể gây hạ kali máu nghiêm trọng ( 21 ). Do đó, dịch lọc có chứa kali và phosphat có thể được yêu cầu ở những bệnh nhân dễ bị kéo dài khoảng QT để ngăn ngừa hạ kali máu nghiêm trọng.
Kết luận, chạy thận nhân tạo có thể là một yếu tố nguy cơ gây xoắn đỉnh ở những bệnh nhân có khoảng QT kéo dài. Do đó, nhận biết sớm và phòng ngừa xoắn đỉnh là rất quan trọng đối với những bệnh nhân có các yếu tố nguy cơ kéo dài khoảng QT và có thể giúp giảm tỷ lệ mắc bệnh và tử vong. Do đó, nên theo dõi nồng độ kali huyết thanh và điện tâm đồ ở những bệnh nhân có khoảng QT kéo dài khi bắt đầu chạy thận nhân tạo.
Tài liệu tham khảo
1. Bahrle S, Schols W. Torsade de pointes in haemodialysis patients. Nephrol Dial Transplant 1996;11:944-6. [Crossref] [PubMed]
2. Uvelin A, Pejakovic J, Mijatovic V. Acquired prolongation of QT interval as a risk factor for torsade de pointes ventricular tachycardia: a narrative review for the anesthesiologist and intensivist. J Anesth 2017;31:413-23. [Crossref] [PubMed]
3. Schwartz PJ, Woosley RL. Predicting the Unpredictable: Drug-Induced QT Prolongation and Torsades de Pointes. J Am Coll Cardiol 2016;67:1639-50. [Crossref] [PubMed]
4. Gupta A, Lawrence AT, Krishnan K, et al. Current concepts in the mechanisms and management of drug-induced QT prolongation and torsade de pointes. Am Heart J 2007;153:891-9. [Crossref] [PubMed]
5. el-Sherif N, Zeiler RH, Craelius W, et al. QTU prolongation and polymorphic ventricular tachyarrhythmias due to bradycardia-dependent early afterdepolarizations. Afterdepolarizations and ventricular arrhythmias. Circ Res 1988;63:286-305. [Crossref] [PubMed]
6. Karnik JA, Young BS, Lew NL, et al. Cardiac arrest and sudden death in dialysis units. Kidney Int 2001;60:350-7. [Crossref] [PubMed]
7. Pun PH, Goldstein BA, Gallis JA, et al. Serum Potassium Levels and Risk of Sudden Cardiac Death Among Patients With Chronic Kidney Disease and Significant Coronary Artery Disease. Kidney Int Rep 2017;2:1122-31. [Crossref] [PubMed]
8. Pun PH, Lehrich RW, Honeycutt EF, et al. Modifiable risk factors associated with sudden cardiac arrest within hemodialysis clinics. Kidney Int 2011;79:218-27. [Crossref] [PubMed]
9. Redaelli B, Locatelli F, Limido D, et al. Effect of a new model of hemodialysis potassium removal on the control of ventricular arrhythmias. Kidney Int 1996;50:609-17. [Crossref] [PubMed]
10. Santoro A, Mancini E, London G, et al. Patients with complex arrhythmias during and after haemodialysis suffer from different regimens of potassium removal. Nephrol Dial Transplant 2008;23:1415-21. [Crossref] [PubMed]
11. Hung AM, Hakim RM. Dialysate and serum potassium in hemodialysis. Am J Kidney Dis 2015;66:125-32. [Crossref] [PubMed]
12. Daya SK, Gowda RM, Khan IA. Ciprofloxacin- and hypocalcemia-induced torsade de pointes triggered by hemodialysis. Am J Ther 2004;11:77-9. [Crossref] [PubMed]
13. Rizza C, Valderrabano M, Singh BN. Recurrent Torsades de Pointes After Sotalol Therapy for Symptomatic Paroxysmal Atrial Fibrillation in a Patient with End-Stage Renal Disease. J Cardiovasc Pharmacol Ther 1999;4:129-34. [Crossref] [PubMed]
14. Tang S, Lo CY, Lo WK, et al. Sotalol-induced Torsade de pointes in a CAPD patient–successful treatment with intermittent peritoneal dialysis. Perit Dial Int 1997;17:207-8. [Crossref] [PubMed]
15. Huynh-Do U, Wahl C, Sulzer M, et al. Torsades de pointes during low-dosage sotalol therapy in haemodialysis patients. Nephrol Dial Transplant 1996;11:1153-4. [Crossref] [PubMed]
16. Weiss JN, Qu Z, Shivkumar K. Electrophysiology of Hypokalemia and Hyperkalemia. Circ Arrhythm Electrophysiol 2017. [Crossref] [PubMed] s
17. Viskin S. Long QT syndromes and torsade de pointes. Lancet 1999;354:1625-33. [Crossref] [PubMed]
18. Gregoratos G, Cheitlin MD, Conill A, et al. ACC/AHA guidelines for implantation of cardiac pacemakers and antiarrhythmia devices: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Pacemaker Implantation). J Am Coll Cardiol 1998;31:1175-209. [PubMed]
19. Korgaonkar S, Tilea A, Gillespie BW, et al. Serum potassium and outcomes in CKD: insights from the RRI-CKD cohort study. Clin J Am Soc Nephrol 2010;5:762-9. [Crossref] [PubMed]
20. Sakaguchi Y, Fujii N, Shoji T, et al. Hypomagnesemia is a significant predictor of cardiovascular and non-cardiovascular mortality in patients undergoing hemodialysis. Kidney Int 2014;85:174-81. [Crossref] [PubMed]
21. Besnard N, Serveaux M, Machado S, et al. Electrolytes-Enriched Hemodiafiltration Solutions for Continuous Renal Replacement Therapy in Acute Kidney Injury: A Crossover Study. Blood Purif 2016;42:18-26. [Crossref] [PubMed]
Xoắn đỉnh do Loperamide: Ca lâm sàng
Tóm tắt
Việc lạm dụng thuốc không kê đơn thường bị các bác sĩ bỏ qua. Loperamide là một trong những loại thuốc không kê đơn thường bị lạm dụng bởi những người nghiện ma túy. Chúng tôi trình bày ở đây một trường hợp một nam thanh niên đạt được sự hưng phấn khi dùng liều lượng lớn loperamide. Anh ta đã bị xoắn đỉnh và ngừng tim sau đó. Chúng tôi nhận thấy sự tương đồng về sự tiến triển của các bất thường dẫn truyền điện cơ tim giữa loperamide và các thuốc gây rối loạn nhịp tim khác đã biết trước đây. Chúng tôi dự định nâng cao mối quan tâm về sự dễ dàng có sẵn của các loại thuốc không kê đơn và tăng chỉ số nghi ngờ về việc lạm dụng thuốc không kê đơn từ kinh nghiệm của chúng tôi.
1. Giới thiệu
Loperamide là một chất chủ vận opioid giảm nhu động được coi là an toàn do tính đặc hiệu trên thụ thể μ của nó và khả năng lạm dụng thấp. Nó ức chế nhu động ruột và làm giảm sự mất nước và điện giải, tạo nên một chất chống tiêu chảy mạnh thường có sẵn không cần kê đơn. Các tác dụng ngoại ý như táo bón, buồn nôn và chuột rút được báo cáo ở ít hơn 5% bệnh nhân dùng loperamide liều được kê đơn [ 1 ]. Các tác dụng phụ trên tim mạch của loperamide trước đây chỉ được ghi nhận là các trường hợp quá liều ở trẻ em [ 2 ]. Tuy nhiên, các tài liệu gần đây đã báo cáo các trường hợp tác dụng phụ gây độc cho tim ở người lớn khi sử dụng liều cao loperamide để đạt được trạng thái hưng phấn (euphoric state).
2. Trình bày ca lâm sàng
Một nam thanh niên 26 tuổi, có tiền sử lạm dụng heroin, đã được đưa đến phòng cấp cứu sau một cơn mất ý thức thoáng qua. Các dấu hiệu sinh tồn của anh khi đến nơi là nhịp tim 50 lần / phút, huyết áp 125/60 mmHg, nhịp thở 14 nhịp / phút và nhiệt độ 98,9°F. Anh ta lơ mơ và đồng tử co đối xứng hai bên, không có nhu động ruột, và thăm khám thần kinh cơ, tim và hô hấp bình thường. Các xét nghiệm ban đầu cho thấy natri là 142 mmol / L, kali là 4,2 mmol / L, canxi là 9,1 mg / dL và magiê là 1,8 mg / dL; kiểm tra nước tiểu chỉ dương tính với opiates. Nồng độ cồn trong máu trong giới hạn bình thường. Không có bất thường nào được ghi nhận trên CT scan đầu. Điện tâm đồ cho thấy nhịp chậm xoang với khoảng PR, QRS và QT/QTc bình thường (Hình 1). Ngay sau khi vào cấp cứu, anh ta xuất hiện khó thở, vã mồ hôi và nhịp nhanh thất kéo dài với tần số thất là 220 nhịp / phút. Anh ta đã được khử rung tim 2 lần với 200 J trước khi trở lại nhịp chậm xoang. Sau khi khử rung, nhịp tim chậm của anh ấy trở nên tồi tệ hơn với tần số tim là 40 lần / phút; tuy nhiên, bệnh nhân vẫn không có triệu chứng. Trong một giờ, anh ta có 2 cơn xoắn đỉnh (TdP) tự giới hạn, mỗi cơn kéo dài dưới 10 giây và đợt thứ 3 kết thúc bằng nhịp nhanh thất không vô mạch (Hình 2 hiển thị một cơn TdP như vậy bắt được trên monitoring). Anh ta đã được khử rung tim một lần nữa và thực hiện CPR ngay lập tức. Mạch có lại ngay lập tức và tiếp tục bị nhịp chậm xoang với tần số 40 lần / phút. Anh ta đã được chỉ định 2 g magiê IV và bắt đầu được tăng tần số tim với isoproterenol. Tần số tim mục tiêu là 90 lần / phút được duy trì trong 48 giờ. Không có rối loạn nhịp thất nào được ghi nhận; khi ngừng sử dụng isoproterenol, nhịp tim của anh ta vẫn trong khoảng 50 đến 60 nhịp / phút. Siêu âm tim qua lồng ngực cho thấy phân suất tống máu thất trái bình thường và không có bất thường về cấu trúc hoặc van tim. Chụp mạch cũng không phát hiện bệnh lý mạch vành nào. Vào ngày thứ 3 nhập viện, bệnh nhân thừa nhận đã dùng loperamide trong hai tháng qua để giảm tiêu chảy liên quan đến việc cai heroin. Gần đây, anh ấy đã đọc trên một blog internet rằng liều lượng cao của loperamide có thể gây “bay bổng” tương tự như heroin. Một ngày trước khi nhập viện, anh ta bắt đầu tăng liều lượng thuốc hàng ngày của mình để đạt được trạng thái hưng phấn. Vào ngày nhập viện, liều tối đa đã dùng của anh ta lên đến 192 mg loperamide. Tại thời điểm này, nồng độ loperamide huyết thanh đã được gửi trở lại, 2 ng / mL (mức đỉnh dự kiến sau khi uống 8 mg là 2 ng / mL hoặc thấp hơn). Bệnh nhân vẫn ổn định về huyết động và được xuất viện về cơ sở cai nghiện ma túy vào ngày nhập viện thứ 8.
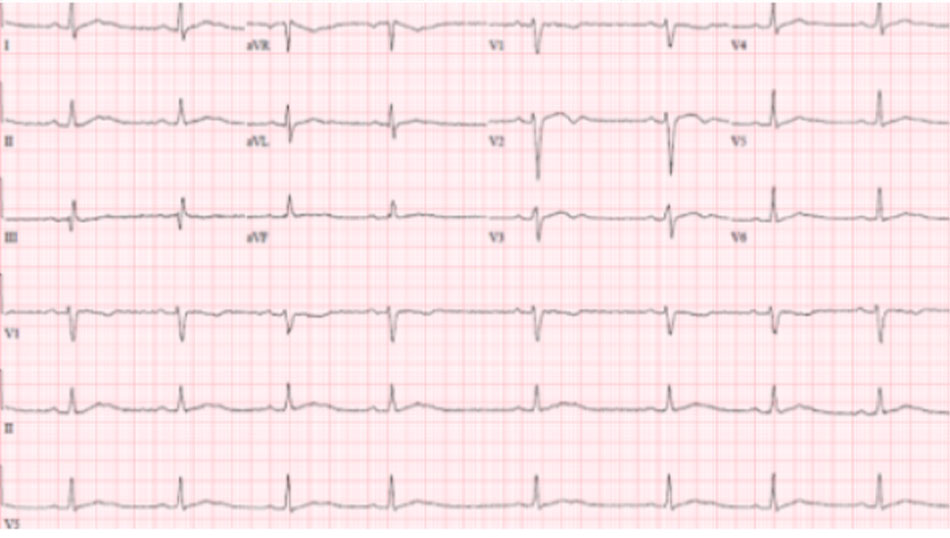
Điện tâm đồ khi vào viện cho thấy nhịp chậm xoang 50 bpm, khoảng PR 198 ms, thời gian QRS 122 ms, khoảng QTc 371 ms và khoảng QT 408 ms.
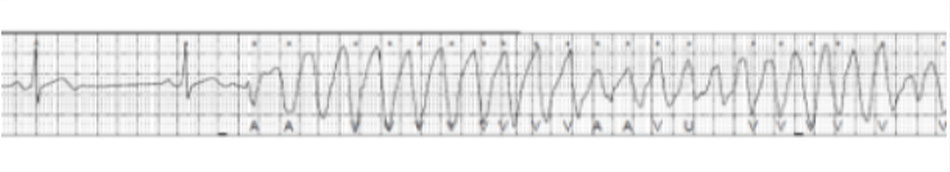
Hình ảnh monitor khi anh ta xuất hiện TdP.
3. Thảo luận
Trước đây đã có báo cáo về kéo dài QTc, loạn nhịp chậm và sóng U ở những người lạm dụng thuốc opioid [ 3 ]. Rối loạn nhịp tim thúc đẩy bệnh nhân của chúng tôi phát triển kéo dài khoảng QT và TdP có khả năng là nhịp chậm xoang dai dẳng. VT đa hình cho thấy xảy ra liên quan đến nhịp tim chậm hoặc thường xuyên ngừng hoạt động điện [ 4 ]. TdP do thuốc thường là kết quả của sự phát triển hậu khử cực sớm và các hoạt động được kích phát từ quá trình tái cực kéo dài. Điều này thường xảy ra khi một nhát ngoại tâm thu thất rơi vào chu kỳ tái cực kéo dài. Đặc điểm điển hình của những TdP này là khoảng QT kéo dài trước đó, đặc biệt ở nhịp xoang cuối cùng trước khi bắt đầu loạn nhịp [ 5 , 6]. Khoảng QTc ngay trước ở bệnh nhân của chúng tôi là hơn 500 ms trước khi phát triển TdP. Việc chẹn các kênh K + chỉnh lưu bị trì hoãn trên mạng lưới His-Purkinje và các tế bào M trong tim dễ tạo ra sự không đồng nhất trong sự phục hồi từ tính dễ kích thích. Điều này tạo ra một vùng trơ chức năng (functional refracrotiness) ở lớp giữa cơ tim, tạo tiền đề cho vòng vào lại (reentry) cần thiết để duy trì TdP [ 7 ].
Trong tế bào cơ tim của chuột, kích thích thụ thể opioid đã cho thấy ức chế hoạt động của thụ thể adrenergic β 1 và β 2. Hiệu ứng này là kết quả của sự trao đổi chéo giữa các đường truyền tín hiệu liên quan. Các thụ thể opioid là thụ thể cặp Gi / Go, trong khi thụ thể β adrenergic là thụ thể cặp Gs. Do đó tác dụng của kích thích thụ thể opioid là hạn chế tác dụng co bóp và chronotropic của kích thích adrenergic trên tim [ 8 ]. Các nhà nghiên cứu đã tìm thấy các thụ thể opioid mu, kappa và delta trên tim người [ 9 ]. Sự ức chế adrenergic tương tự có thể có vai trò trong nào đó trong bối cảnh quá liều opioid trong tế bào cơ tim của con người.
Quan sát của Marraffa và cộng sự cho thấy rằng nồng độ thuốc không thể dự đoán được với liều lượng đã uống vào và cũng không thể tạo ra mối tương quan giữa nồng độ huyết thanh với khả năng gây độc [10]. Loperamid có sinh khả dụng rất kém và thay đổi (khoảng 10 đến 20%). Ngoài ra, loperamide làm giảm nhu động ruột, có thể làm tăng sự hấp thu toàn thân bằng cách giữ thuốc trong đường tiêu hóa trong một thời gian dài hơn [1]. Khó gây tác dụng độc khi dùng loperamid đường uống với liều điều trị. Tuy nhiên, khi bệnh nhân của chúng tôi uống 96 viên (192 mg), lượng hấp thụ toàn thân sẽ vô cùng lớn so với bình thường. Thời gian bán thải của loperamide là 9–14 giờ; do đó, sẽ mất 70 giờ để loại thuốc này được đào thải khỏi cơ thể. Sử dụng thuốc trong thời gian dài có thể dẫn đến phát triển các kho chất béo (fat depots) của loperamide không được tính đến trong nồng độ huyết thanh [10 ]. Vào ngày thứ 3 nhập viện, bệnh nhân của chúng tôi vẫn có nồng độ điều trị của loperamide, cho thấy nồng độ độ này khi vào viện có thể đã cao hơn đáng kể.
Quá liều Loperamide đã được báo cáo nhiều lần và các tài liệu gần đây chỉ ra một kiểu hình tác dụng độc lên tim tương tự. Trường hợp của chúng tôi cho thấy diễn tiến điện học của rối loạn nhịp tim này trong bối cảnh quá liều và làm sáng tỏ những điểm tương đồng giữa TdP gây ra bởi loperamide và các thuốc gây độc tim đã được nghiên cứu trước đây.
Tài liệu tham khảo
1. Lexicomp Online, Lexi-Drugs, Lexi-Comp, Hudson, Ohio, USA, 2014.
2. T. Litovitz, C. Clancy, B. Korberly, A. R. Temple, and K. V. Mann, “Surveillance of loperamide ingestions: an analysis of 216 poison center reports,” Journal of Toxicology: Clinical Toxicology, vol. 35, no. 1, pp. 11–19, 1997.View at: Publisher Site | Google Scholar
3. J. Lipski, B. Stimmel, and E. Donoso, “The effect of heroin and multiple drug abuse on the electrocardiogram,” American Heart Journal, vol. 86, no. 5, pp. 663–668, 1973.View at: Publisher Site | Google Scholar
4. W. M. Jackman, K. J. Friday, J. L. Anderson, E. M. Aliot, M. Clark, and R. Lazzara, “The long QT syndromes: a critical review, new clinical observations and a unifying hypothesis,” Progress in Cardiovascular Diseases, vol. 31, no. 2, pp. 115–172, 1988.View at: Publisher Site | Google Scholar
5. R. Passman and A. Kadish, “Polymorphic ventricular tachycardia, long Q-T syndrome, and torsades de pointes,” Medical Clinics of North America, vol. 85, no. 2, pp. 321–341, 2001.View at: Publisher Site | Google Scholar
6. I. A. Khan, “Long QT syndrome: diagnosis and management,” American Heart Journal, vol. 143, no. 1, pp. 7–14, 2002.View at: Publisher Site | Google Scholar
7. Y. G. Yap and A. J. Camm, “Drug induced QT prolongation and torsades de pointes,” Heart, vol. 89, no. 11, pp. 1363–1372, 2003.View at: Publisher Site | Google Scholar
8. S. Pepe, O. W. V. Van Den Brink, E. G. Lakatta, and R.-P. Xiao, “Cross-talk of opioid peptide receptor and β-adrenergic receptor signalling in the heart,” Cardiovascular Research, vol. 63, no. 3, pp. 414–422, 2004.View at: Publisher Site | Google Scholar
9. P. Sobanski, M. Krajnik, M. Shaqura, E. Bloch-Boguslawska, M. Schäfer, and S. A. Mousa, “The presence of mu-, delta-, and kappa-opioid receptors in human heart tissue,” Heart and Vessels, vol. 29, no. 6, pp. 855–863, 2014.View at: Publisher Site | Google Scholar
10. J. M. Marraffa, M. G. Holland, R. W. Sullivan et al., “Cardiac conduction disturbance after loperamide abuse,” Clinical Toxicology, vol. 52, no. 9, pp. 952–957, 2014.View at: Publisher Site | Google Scholar
Xoắn đỉnh với nồng độ magiê bình thường trong hội chứng ruột ngắn
Tóm tắt
Xoắn đỉnh (TdP) là một rối loạn nhịp tim có khả năng gây tử vong, thường biểu hiện do căn nguyên bẩm sinh hoặc mắc phải. Nồng độ magiê huyết thanh thấp là một nguyên nhân được biết đến dẫn đến chứng rối loạn nhịp tim này. Tuy nhiên, người ta nhận thấy rằng ngay cả trong trường hợp nồng độ magiê huyết thanh bình thường và không có nguyên nhân nào khác, TdP vẫn có thể xảy ra, đặc biệt ở những người bị thiếu hụt điện giải mạn tính. TdP có thể được điều trị theo một số cách, bao gồm magiê sulfat IV hoặc khử rung tim nếu bệnh nhân không đáp ứng và huyết động không ổn định. Trong một số trường hợp, tăng tần số nhĩ được chỉ định bằng việc sử dụng isoproterenol. Tuy nhiên, quyết định cuối cùng là liệu bệnh nhân có thể được xuất viện về nhà với thuốc ngăn ngừa loạn nhịp tái phát hay cần phải đặt máy tạo nhịp tim vĩnh viễn. Ở đây, chúng tôi mô tả một trường hợp xoắn đỉnh tái diễn dù nồng độ magie máu bình thường trong bối cảnh hội chứng ruột ngắn.
Trình bày ca lâm sàng
Một BN nam 89 tuổi vào viện vì các cơn giống như co giật, được chứng kiến bởi con gái ông. Ông có tiền sử ung thư đại tràng được phẫu thuật cắt mở thông hồi tràng và cắt bỏ một đoạn ruột non đáng kể vì tắc ruột do dính. Hơn nữa, ông bị suy dinh dưỡng và bất thường điện giải mạn tính do hội chứng ruột ngắn thứ phát sau nhiều lần phẫu thuật.
Cô con gái nhận thấy cha mình không phản ứng nên bắt đầu hồi sinh tim phổi (CPR) tại giường trong hai phút cho đến khi xe cấp cứu đến. Khi vào khoa cấp cứu (ED), bệnh nhân được ghi nhận có nồng độ magiê huyết thanh là 0,6 mg / dl, và điện tâm đồ cho thấy QTc kéo dài là 590 ms, như được ghi trong Hình 1 .
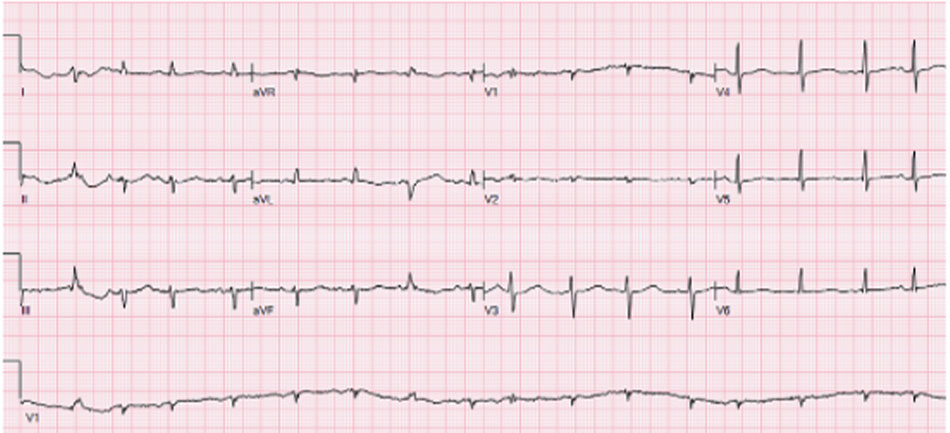
Điện tâm đồ 12 chuyển đạo này cho thấy QT kéo dài 590 ms, là sự thay đổi cấp tính so với điện tâm đồ gần đây nhất của bệnh nhân trước khi nhập viện.
Hai gam magiê sulfat IV đã được bolus, và bệnh nhân sau đó được chuyển đến ICU. Cuối buổi chiều hôm đó, QTc của bệnh nhân bắt đầu bình thường, và nồng độ magiê của ông ấy sau đó là 2,5 mg / dl. Vì cho rằng ông ấy có vẻ ổn định và không có vấn đề gì, nên ông ấy đã được đưa trở lại cấp cứu để theo dõi.
Sáng hôm sau, bệnh nhân bắt đầu có các đợt TdP ngắt quãng như ghi nhận trên monitoring. QTc của ông lại kéo dài đến 573 ms (Hình 2 ); tuy nhiên, nồng độ magiê huyết thanh của ông ấy vẫn bình thường.
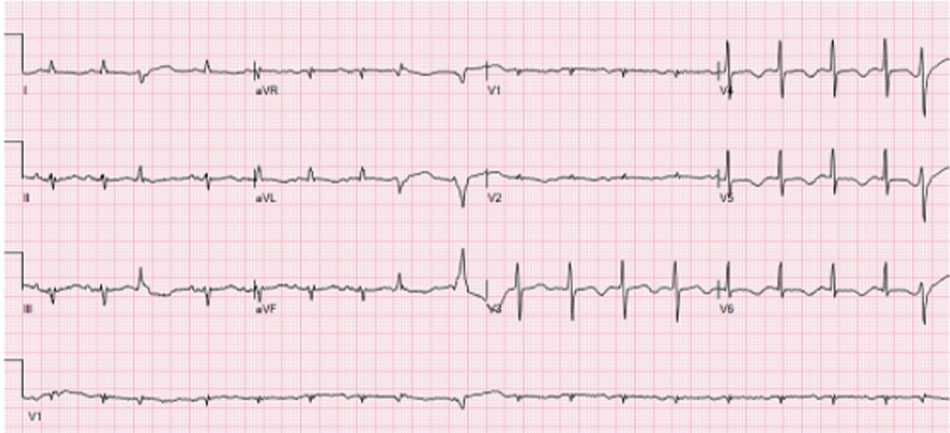
Điện tâm đồ 12 đạo trình cho thấy tái phát QT kéo dài đến 573 ms sau khi cải thiện ban đầu. Bệnh nhân sẽ tiếp tục phát triển các đợt TdP tái phát.
Ông đã được cho thêm magiê cùng với metoprolol IV và hai liều bolus amiodarone. Ông đã được khử rung tim cho những cơn TdP này, tại thời điểm đó bác sĩ tim mạch đã được hội chẩn. Các đợt TdP được chấm dứt thành công và nồng độ magiê không bao giờ giảm xuống dưới mức bình thường. Bác sĩ tim mạch khuyến cáo sử dụng isoproterenol nếu các đợt TdP tái phát. Ông vẫn ổn định trong suốt cả ngày cho đến cuối buổi tối hôm đó, bệnh nhân trở nên không phản ứng và mất mạch khi xuất hiện thêm một đợt TdP khác được bác sĩ cấp cứu chứng kiến (Hình 3 ).
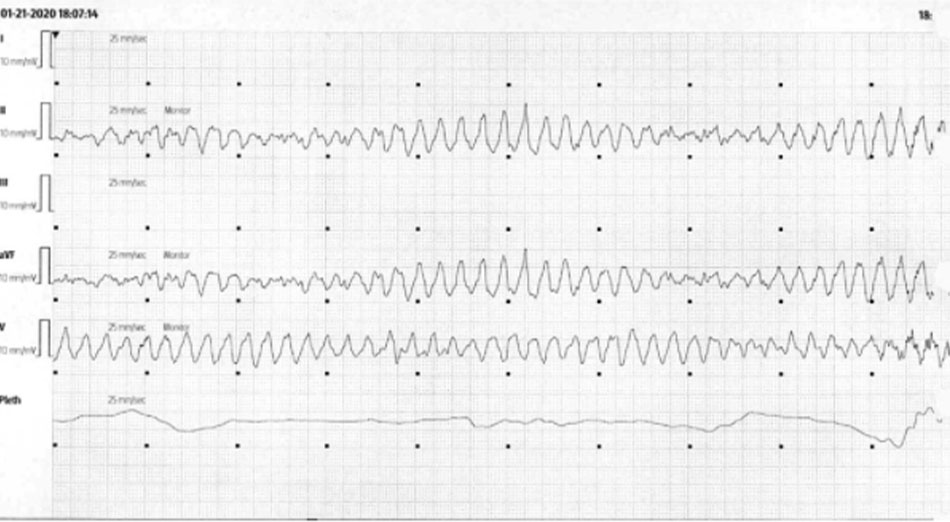
Hình ảnh thời điểm bệnh nhân xuất hiện TdP cuối cùng cần khử rung tim. Bệnh nhân phát triển một vài đợt TdP ngắn không kéo dài trong 20 phút trước đợt TdP này.
Việc khử rung tim ngay lập tức đã thành công trong việc đạt được nhịp xoang bình thường, và isoproterenol được bắt đầu trong 24 giờ sau đó. Theo chuyên khoa tim mạch, chúng tôi duy trì kali của bệnh nhân trên 4 mg / dl và magie trên 2 mg / dl, điều này đòi hỏi cần phải bù từng đợt trong suốt quá trình nhập viện. Bệnh nhân không phát triển bất kỳ rối loạn nhịp tim nào khi dùng isoproterenol và có vẻ ổn định sau khi ngừng (đủ 24 giờ). Khoảng nửa đêm, bệnh nhân xuất hiện một đợt TdP ngắn khác; tuy nhiên, nó tự động chuyển trở lại nhịp xoang và không cần khử rung tim. Isoproterenol được bổ sung trở lại với nửa liều, và sáng hôm sau, chuyên khoa tim mạch khuyến nghị đặt máy tạo nhịp tim vĩnh viễn (PPM) để điều trị TdP dai dẳng. Bệnh nhân đồng ý và được đặt máy tạo nhịp tim thành công vào sáng hôm sau với tần số tim cài đặt cao hơn do xu hướng phát triển loạn nhịp tim. Sau khi đặt máy tạo nhịp tim, bệnh nhân không còn xuất hiện các đợt TdP. Ngoại trừ XN lần đầu tiên lúc vào cấp cứu, nồng độ magiê của ông ấy không bao giờ giảm xuống dưới 1,8 mg / dl và hầu hết duy trì trên 2 mg / dl. QTc của ông ấy đã bình thường hóa thành 406 ms sau khi đặt PPM (Hình4 ).
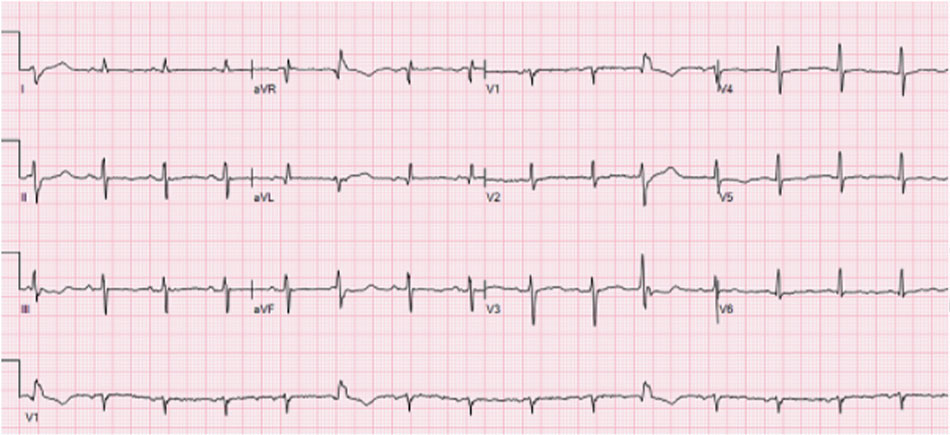
EKG 12 chuyển đạo cuối cùng này cho thấy sự khỏi hoàn toàn của khoảng QT còn 406 ms sau khi đặt PPM với thiết lập tần số tim cao hơn.
Bệnh nhân đã ổn định để chuyển ra khỏi ICU, và không xuất hiện bất kỳ rối loạn nhịp tim nào trong thời gian còn lại, được xuất viện sau sáu ngày ổn định.
Thảo luận
TdP có thể là một rối loạn nhịp tim có hại, nếu không được điều trị ngay lập tức, có thể dẫn đến tử vong. Bước đầu tiên là xác định căn nguyên. TdP hầu như luôn luôn được báo trước bởi QT kéo dài, thường trên 500 ms. QT kéo dài có thể do bẩm sinh hoặc mắc phải. Khi xem xét nguyên nhân mắc phải của TdP, phổ biến nhất là do thuốc hoặc hạ kali máu. Khi một bệnh nhân vào cấp cứu vì TdP, XN nồng độ magiê huyết thanh thường được chỉ định và thường có kết quả là thấp. Nồng độ magiê huyết thanh có thể là một thước đo không chính xác cho dự trữ magiê trong cơ thể, đặc biệt đối với những người bị thiếu hụt mạn tính [6] . Một nghiên cứu đã chỉ ra rằng thiếu magiê có liên quan đến việc gia tăng tỷ lệ mắc bệnh và nguy cơ mắc 11 bệnh quan trọng [7]. Nó cũng lưu ý rằng sự thiếu hụt magiê có thể dự đoán các biến cố bất lợi và giảm nguy cơ mắc bệnh lý nếu bổ sung được thực hiện mặc dù mức magiê huyết thanh bình thường.
Bệnh nhân được trình bày trong trường hợp này bị thiếu hụt chất điện giải mạn tính thứ phát sau nhiều lần cắt bỏ ruột non và đại tràng. Điều này bao gồm hồi tràng đoạn cuối, nơi chịu trách nhiệm hấp thụ magiê. Sau những lần cắt bỏ này, bệnh nhân bị hội chứng ruột ngắn, ông ta chỉ còn lại ít hơn 180 cm ruột để có khả năng hấp thụ nước và chất hòa tan thích hợp [8]. Bệnh nhân bị thiếu hụt vitamin và chất điện giải mạn tính và đang sử dụng một số chất bổ sung đường uống, bao gồm cả magie oxit. Mặc dù vậy, ông vẫn có nồng độ magiê là 0,6 mg / dl. Biết dự trữ magiê có thể thấp mặc dù nồng độ magiê huyết thanh bình thường, thực tế là nồng độ của bệnh nhân này cũng thấp là điều đáng lo ngại. Tình trạng hạ magie máu đáng kể thứ phát do hội chứng ruột ngắn làm tăng các đợt TdP tái phát khi vào cấp cứu. Ban đầu, ông ta có nồng độ magiê thấp. Tuy nhiên, mặc dù được bổ sung magiê thích hợp và đạt được mức magiê huyết thanh bình thường, ông ấy vẫn tiếp tục xuất hiện TdP. Điều này cho thấy lượng magiê dự trữ trong cơ thể của ông ấy tiếp tục duy trì ở mức thấp và việc bổ sung không được hấp thụ một cách thích hợp do hội chứng ruột ngắn.
Việc bệnh nhân tiếp tục bị rối loạn nhịp tim đã gây ra một vấn đề cần phải khắc phục vĩnh viễn. Isoproterenol đã được chứng minh là có thể điều trị TdP bằng cách tăng nhịp tim đến mức mà tại đó nguy cơ tái phát loạn nhịp tim thấp. Tuy nhiên, đây chỉ là biện pháp tạm thời. Thêm vào đó, việc ngừng isoproterenol có thể khiến rối loạn nhịp tim tái phát, thể hiện rõ ở bệnh nhân này. Do đó, cách điều chỉnh thích hợp nhất cho rối loạn nhịp tim là đặt máy tạo nhịp tim. Máy tạo nhịp tim cần được điều chỉnh vĩnh viễn ở tần số thất cao hơn, thường từ 90 đến 110 nhịp mỗi phút, để khắc phục chứng loạn nhịp tim [1]. Các căn nguyên khác của TdP không tái phát có thể được điều trị bằng cách bổ sung magiê IV thích hợp cùng với bổ sung kali và canxi. Việc ngừng sử dụng bất kỳ loại thuốc nào có thể gây ra khoảng QT kéo dài cũng là điều khôn ngoan đối với những bệnh nhân này [1] .
Kết luận
Chúng tôi đã trình bày một trường hợp một người đàn ông lớn tuổi bị hội chứng ruột ngắn nghiêm trọng và thiếu hụt chất điện giải mạn tính trong nhiều năm. Mặc dù đang sử dụng các chất bổ sung đường uống lượng nhiều, bao gồm cả oxit magiê, bệnh nhân vẫn có nồng độ magiê rất thấp dẫn đến các đợt TdP ngay cả khi nồng độ magiê huyết thanh đo được là bình thường. Isoproterenol tạm thời được sử dụng để chấm dứt rối loạn nhịp tim cho đến khi đặt PPM. Quan sát này giúp chúng tôi hiểu rằng dù không có bất kỳ nguyên nhân nào khác được biết đến, thì việc dự trữ magiê trong cơ thể bị cạn kiệt mạn tính ở một bệnh nhân mắc hội chứng ruột ngắn có thể dẫn đến sự phát triển của chứng loạn nhịp tim gây tử vong như TdP.
Tài liệu tham khảo
1. Cohagan B, Brandis D: Torsades de pointes. StatPearls [Internet]. StatPearls Publishing, Treasure Island (FL); 2020.
2. Nachimuthu S, Assar MD, Schussler JM: Drug-induced QT interval prolongation: mechanisms and clinical management. Ther Adv Drug Saf. 2012, 3:241-53. 10.1177/2042098612454283
3. Hypomagnesemia. (2020). Accessed: January 15, 2021: https://www.merckmanuals.com/professional/endocrine-and-metabolic-disorders/electrolyte-disorders/hypomagnesemia.
4. Suarez K, Mack R, Hardegree EL, Chiles C, Banchs JE, Gonzalez MD: Isoproterenol suppresses recurrent torsades de pointes in a patient with long QT syndrome type 2. HeartRhythm Case Rep. 2018, 4:576-9. 10.1016/j.hrcr.2018.08.013
5. Omar HR, Sprenker C, Karlnoski R, Mangar D, Camporesi EM: The use of isoproterenol and phenytoin to reverse torsade de pointes. Am J Emerg Med. 2014, 32:683.e5-7. 10.1016/j.ajem.2013.11.037
6. Ismail A, Ismail AA, Ismail Y: Reply: Chronic magnesium deficiency and human disease; time for reappraisal?. QJM. 2019, 112:475. 10.1093/qjmed/hcy298
7. Ismail Y, Ismail AA, Ismail AA: The underestimated problem of using serum magnesium measurements to exclude magnesium deficiency in adults; a health warning is needed for “normal” results. Clin Chem Lab Med. 2010, 48:323-7. 10.1515/CCLM.2010.077
8. Guillen B, Atherton NS: Short bowel syndrome. StatPearls [Internet]. StatPearls Publishing, Treasure Island (FL); 2020.
Xem thêm:
Các nguyên nhân liên quan đến máy thở của chấn thương phổi sức mạnh
Thông khí không xâm lấn trong bệnh phổi tắc nghẽn mãn tính
Tiêu cơ vân và Tổn thương thận cấp
Những tranh cãi về liệu pháp điều trị ngoài cơ thể không do thận trên bệnh nhân COVID-19 nguy kịch.

