COVID-19, Bệnh tim mạch
Thuyên tắc huyết khối tĩnh mạch ở bệnh nhân COVID-19
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: Hoàng Bùi Hải, Bùi Thị Hoa, Đỗ Giang Phúc, Nguyễn Phương Mai, Nguyễn Văn Hiếu
Bài viết THUYÊN TẮC HUYẾT KHỐI TĨNH MẠCH Ở BỆNH NHÂN COVID-19 trong quá trình thở máy được trích từ chương 16 trong phần 4 “CÁC ĐIỀU TRỊ KÈM THEO” sách Chẩn đoán và điều trị COVID-19.
1. TÌNH TRẠNG TĂNG ĐÔNG TRÊN BỆNH NHÂN COVID-19
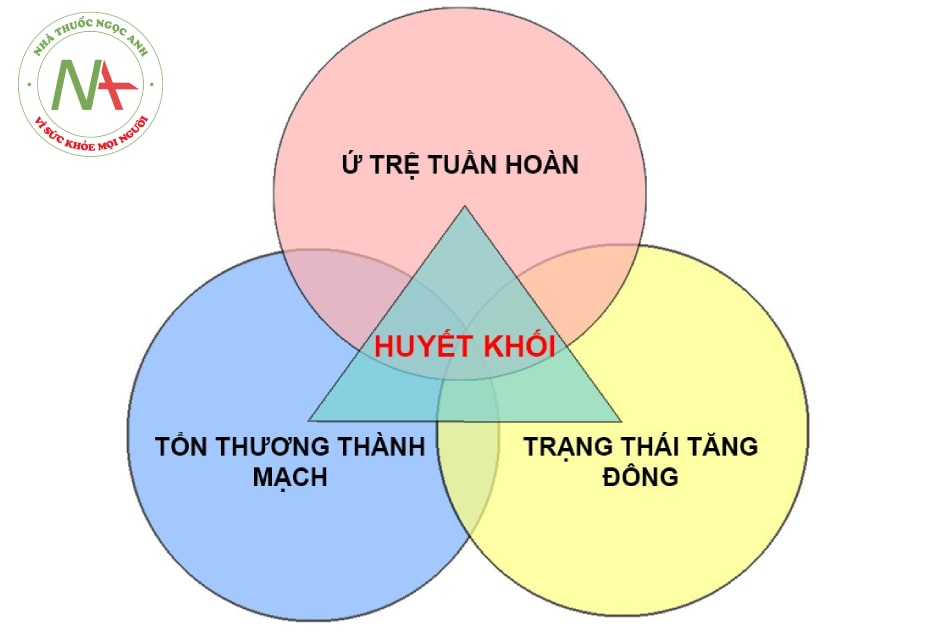
Các bệnh nhân mắc hội chứng viêm đường hô hấp cấp do chủng mới của vi rút Coronavirus 2 (SARS-CoV-2) có đặc điểm nổi bật là bất thường phức tạp về tình trạng đông máu, cụ thể là tình trạng tăng đông với “vi huyết khối”. Cơ chế của tình trạng tăng đông này chưa được làm rõ nhưng có thể nhận thấy cả ba tình trạng cấu thành huyết khối ở tam giác Virchow đều hiện hiện đầy đủ.
Tổn thương nội mạch
Có bằng chứng về sự xâm nhập trực tiếp vào các tế bào nội mô bởi SARS-CoV-2 gây hội chứng hô hấp cấp tính nghiêm trọng, có khả năng dẫn đến tổn thương tế bào. Một số chuyên gia đã công nhận rằng tổn thương nội mô, viêm vi mạch, xuất huyết nội mô và/hoặc viêm nội mô đóng vai trò trung tâm trong cơ chế bệnh sinh của hội chứng suy hô hấp cấp và suy cơ quan ở những bệnh nhân nhiễm SARS-CoV-2 nặng.
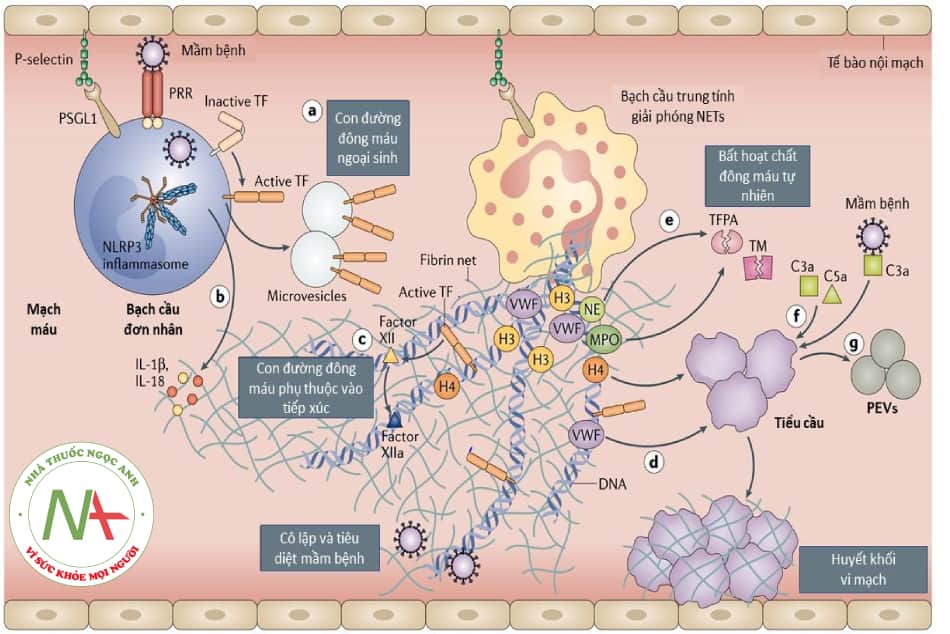
Quá trình xâm nhập của virus SARS-CoV-2 vào tế bào vật chủ bắt đầu từ việc gắn kết của virus với thụ thể ACE-2 – thụ thể có mặt không chỉ ở tế bào phế nang type II ở phổi mà còn có nhiều ở bề mặt nội mô tế bào tim, thận, ruột… Sau khi nhận biết mầm bệnh thông qua các thụ thể nhận dạng tác nhân gây bệnh (pathogen receptor – PRR), bạch cầu đơn nhân và các vi tế bào có nguồn gốc từ bạch cầu đơn nhân hiện diện yếu tố mô đã hoạt hóa (active tissue factor – active TF) trên bề mặt của chúng và giải phóng nó tại các vị trí khu trú mầm bệnh, từ đó kích hoạt con đường đông máu ngoại sinh (con đường a, Hình 16.2). Tác nhân gây bệnh cũng kích thích NLRP3 gây viêm trong bạch cầu đơn nhân và/hoặc đại thực bào, dẫn đến giải phóng các cytokine gây viêm như interleukin-1β (IL-1β) và IL-18 (con đường b, Hình 16.2). Bạch cầu trung tính được hoạt hóa và tham gia vào quá trình này thông qua việc giải phóng các lưới ngoại bào của bạch cầu trung tính (neutrophil extracellular traps – NET), trực tiếp kích hoạt yếu tố XII từ đó kích hoạt con đường đông máu phụ thuộc vào tiếp xúc (con đường c, Hình 16.2). NET cũng liên kết yếu tố von Willebrand (vWF) và giúp hoạt hóa tiểu cầu (con đường dẫn d, Hình 16.2). Ngoài ra, elastase bạch cầu trung tính (neutrophil elastase – NE) và myeloperoxidase (MPO) trong NETs phân cắt và bất hoạt chất chống đông máu tự nhiên (chất ức chế con đường yếu tố mô (tissue factor pathway inhibitor – TFPA) và thrombomodulin (TM)) (con đường e, Hình 16.2). Cuối cùng, NET có thể ngoại vi và liên kết với tiểu cầu tạo huyết khối vi mạch. Do đó, NET là một trong những dấu hiệu đánh giá mức độ nghiêm trọng của bệnh ở bệnh nhân nhiễm SARS-CoV-2. Các histon, đặc biệt là H3 và H4, kích hoạt sự hoạt hóa của các tiểu cầu. Ngoài ra, tiểu cầu có thể được kích hoạt bởi C3a và C5a (con đường f, Hình 16.2). Các tiểu cầu sau khi được hoạt hóa giải phóng một lượng lớn các cytokine gây viêm (con đường g, Hình 16.2). Tiểu cầu tham gia vào quá trình tạo huyết khối bằng cách kích hoạt con đường đông máu phụ thuộc vào tiếp xúc thông qua việc giải phóng polyphosphat và cùng với các tế bào nội mô, có thể thúc đẩy quá trình tạo fibrin. Cơ chế hình thành huyết khối này được gọi là huyết khối miễn dịch (immunothrombosis). Các vi huyết khối được tạo ra này có thể gây tắc các vi mạch hoặc tạo thành huyết khối lớn khi gặp các điều kiện thích hợp.
Nghiên cứu in vitro cho thấy SARS-CoV-2 có thể kích hoạt con đường bổ thể trong cơ chế gây bệnh. Các nghiên cứu cũng đã chỉ ra sự gia tăng các dấu hiệu kích hoạt bổ thể như C5b-9 trong tuần hoàn của những người nhập viện với SARS-CoV-2 so với nhóm chứng (người khỏe mạnh, bệnh nhân hồi sức tích cực bị suy hô hấp không do SARS-CoV-2 hoặc bệnh nhân bị cúm). Mức độ ảnh hưởng cao hơn ở những bệnh nhân nặng so với mức độ trung bình và ở những bệnh nhân cần thở máy so với bệnh nhân không phải thở máy. Dấu hiệu kích hoạt bổ thể trong sinh thiết mô cũng đã được báo cáo.
Các nguyên nhân tổn thương nội mô khác bao gồm: catheter tĩnh mạch, tăng quá mức của các cytokine tiền viêm (như IL-6, IL-8 và IL-1β) và chemokine (như CCL2, CCL3, CCL4 và CCL7).
Bất động kéo dài
Tình trạng bất động gây ra sự ứ trệ tuần hoàn; các dòng chảy chậm là điều kiện thuận lợi cho việc hình thành huyết khối. Tình trạng này gặp ở hầu hết các bệnh nhân nhập viện (do mệt mỏi, sốt, đau mỏi người, khó thở – hậu quả của việc nhiễm virus). Đặc biệt các bệnh nhân nhập khoa hồi sức tích cực hay tầng 3 của tháp điều trị thì nguy cơ càng cao.
Tình trạng tăng đông
Các thay đổi của các yếu tố đông máu đã được ghi nhận ở bệnh nhân nhiễm COVID-19 nặng bao gồm: (1) Tăng yếu tố VIII; (2) Tăng fibrinogen;
(3) Tăng nồng độ plasminogen activator inhibitor-1 (PAI1); (4) Tăng nồng độ vWF, giảm hoạt tính ADAMTS13 (a disintegrin and metalloprotease with a thrombospondin type 1 motif, member 13); (5) Sự xuất hiện của kháng đông lupus và/hoặc kháng thể kháng phospholipid; (6) Tăng độ nhớt của máu: Độ nhớt của máu có thể thúc đẩy trạng thái tăng đông. Nó thường liên quan đến các bệnh gamma đơn dòng, tuy nhiên có thể tăng trong tăng các protein lớn như fibrinogen.
Yếu tố nguy cơ của thuyên tắc huyết khối
Bảng 16.1 Các yếu tố nguy cơ của thuyên tắc huyết khối
| Yếu tố liên quan đến bệnh nhân | Yếu tố liên quan đến tình trạng viêm phổi | Yếu tố liên quan đến SARS-CoV-2 |
| – Tuổi
– Giới nữ (liên quan đến yếu tố hormon) – Béo phì (BMI ≥ 30) – Bất động – Bệnh lý mạch máu (xơ vữa mạch, nhồi máu cơ tim, nhồi máu não…) – Ung thư – Tiền sử bệnh lý tăng đông (thiếu hụt protein C, protein S, antithrombin III, hội chứng tăng sinh tủy mạn tính ác tính: tăng tiểu cầu tiên phát, đa hồng cầu…) |
– Nằm hồi sức tích cực
– Catheter tĩnh mạch trung tâm – HFI-1 (hypoxia- inducible factor) ↑ – Tổn thương nội mạch và gia tăng yếu tố VIII; tăng nồng độ kháng nguyên vàhoạt tính yếu tố von Willebrand – Giảm hoạt tính ADAMTS13 |
– Angiotensin ↑
– Cytokines, chemo-kine ↑ – Fibrinogen ↑ – Tissue Factor ↑ – Neutrophil extracel- lular traps (NETs) ↑ – PAI-1 ↑ (plasmino- gen activator inhibi- tor-1) – Độ nhớt của máu ↑ – Sự xuất hiện của kháng đông lupus và/hoặc kháng thể kháng phospholipid |
2. CÁC XÉT NGHIỆM ĐÁNH GIÁ TÌNH TRẠNG TĂNG ĐÔNG TRÊN BỆNH NHÂN COVID-19
Các bất thường về xét nghiệm đông máu ở bệnh nhân COVID-19 chủ yếu thể hiện tình trạng tăng đông, phù hợp với lâm sàng thường gặp bệnh nhân bị huyết khối tắc mạch. Trạng thái này được một số chuyên gia gọi là viêm huyết khối (thromboinflammation) hoặc rối loạn đông máu liên quan đến COVID-19 (CAC: COVID-19-associated coagulopathy). Một số tác giả khác coi trạng thái tăng đông liên quan đến COVID-19 giống như đông máu nội mạch rải rác (DIC), đặc biệt trên nhóm bệnh nhân nặng, và đáp ứng các tiêu chí của thang điểm DIC do Hiệp hội Huyết khối và Cầm máu quốc tế (ISTH) công bố năm 2009. Tuy nhiên, phát hiện lâm sàng chính ở COVID-19 là huyết khối, trong khi phát hiện chính ở DIC mất bù cấp tính là chảy máu. Tương tự như vậy, COVID-19 có một số phát hiện trong phòng thí nghiệm giống DIC, bao gồm sự gia tăng rõ rệt D-dimer và giảm tiểu cầu nhẹ trong một số trường hợp. Tuy nhiên, các thông số đông máu khác trong COVID-19 khác với DIC. Trong COVID-19, các phát hiện điển hình bao gồm nồng độ fibrinogen cao và hoạt tính của yếu tố VIII tăng cao, cho thấy rằng việc tiêu thụ chính các yếu tố đông máu không xảy ra.
Bất kể sự khác biệt với DIC hay những điểm tương đồng được nêu ra, nhiều nguyên tắc cơ bản của quản lý DIC vẫn được áp dụng, bao gồm tầm quan trọng của việc điều trị tình trạng cơ bản, tầm quan trọng của các biện pháp can thiệp dựa trên bệnh cảnh lâm sàng thay vì chỉ tìm hiểu trong phòng xét nghiệm, và cần cá thể hóa bệnh nhân trong việc sử dụng thuốc chống đông cho huyết khối và các liệu pháp cầm máu thích hợp khi có tình trạng chảy máu.
Các xét nghiệm thường quy được sử dụng đánh giá tình trạng tăng đông trên bệnh nhân COVID-19 bao gồm: (1) aPTT (activated partial thromboplastin); (2) PT (prothrombin); (3) Định lượng fibrinogen; (4) Số lượng tiểu cầu; (5) Định lượng D-Dimer; (6) Định lượng các sản phẩm thoái giáng của fibrinogen (FDP: fibrinogen and fibrin degradation products).
Các xét nghiệm chuyên sâu được sử dụng đánh giá tình trạng tăng đông trên bệnh nhân COVID-19 bao gồm: (1) ROTEM; (2) Đo độ nhớt của máu; (3) Định lượng yếu tố VIII; (4) Định lượng vWF; (5) Đo hoạt tính ADAMTS 13; (6) Kháng đông Lupus (LA), kháng phospholipid; (7) Định lượng PAI-1.
Xem thêm: Thuyên tắc ối: Bệnh sinh – chẩn đoán và hồi sức cấp cứu.
2.1. Xét nghiệm số lượng tiểu cầu
Một số đặc điểm về số lượng tiểu cầu ở bệnh nhân COVID-19:
- Giảm tiểu cầu rất thường gặp ở bệnh nhân nặng và thường tiến triển dẫn đến
- Giảm số lượng tiểu cầu là chỉ số sinh học rất nhạy trong chẩn đoán DIC, gặp khoảng 97% bệnh nhân bị
- Giảm tiểu cầu cũng là 1 trong những tiêu chí chẩn đoán DIC (theo ISTH).
- Ở bệnh nhân nhiễm COVID-19, số lượng tiểu cầu thường giảm nhẹ hoặc bình thường, giảm số lượng tiểu cầu gặp khoảng 12-36%, trong đó 5% bệnh nhân giảm số lượng tiểu cầu dưới 100 G/L.
- Số lượng tiểu cầu giảm nặng có tương quan với bệnh tiến triển nặng, khoảng 7% số bệnh nhân nặng có tiểu cầu dưới 50 G/L, trên 55% bệnh nhân COVID-19 tử vong có số lượng tiểu cầu dưới 100 G/L.
- Tăng tiểu cầu trên bệnh nhân COVID-19 có ghi nhận trong một số báo cáo, tuy nhiên tình trạng tăng tiểu cầu không quá cao và không làm ảnh hưởng đến tiên lượng bệnh.
Kết quả nghiên cứu trên mẫu xét nghiệm của 4098 bệnh nhân mắc COVID-19 tại bệnh viện dã chiến hồi sức cấp cứu tỉnh Bình Dương từ ngày 13 tháng 8 đến ngày 20 tháng 9 năm 2021 như sau:
- Số lượng tiểu cầu trung bình 250,2 G/L, khoảng: 6-1723 G/L.
- Số lượng tiểu cầu trong nhóm bệnh nhân hồi sức tích cực trung bình 276 G/L, khoảng: 16-726 G/L.
- Số lượng tiểu cầu trong nhóm bệnh nhân không phải hồi sức tích cực trung bình 284 G/L, khoảng: 8-775 G/L.
- Tỷ lệ bệnh nhân có tiểu cầu dưới 100 G/L là 9,4%.
- Tỷ lệ bệnh nhân có tiểu cầu trên 450 G/L là 6,5%.
2.2. Xét nghiệm định lượng D-dimer
Một số đặc điểm về định lượng D-dimer ở bệnh nhân COVID-19:
- D-dimer tăng là phản ánh hoạt hoá cả hệ thống đông máu và hệ thống tiêu sợi huyết ở trong cơ thể.
- D-dimer di chuyển từ nhu mô phổi vào tuần hoàn; vì vậy ở COVID-19, tăng D-dimer phản ánh tăng sản phẩm thoái giáng fibrin ở trong phế nang và nhu mô phổi và liên quan đến hậu quả của tổn thương phổi.
- D-dimer là xét nghiệm có giá trị chẩn đoán huyết khối tĩnh mạch.
- D-dimer là xét nghiệm nhạy cho chẩn đoán DIC (theo ISTH).
- Ở bệnh nhân COVID-19, tăng D-dimer gặp 36%, D-dimer thường tăng cao ở nhóm bệnh nhân nặng và tử vong. Đây là xét nghiệm có giá trị tiên lượng ở bệnh nhân COVID-19.
- Theo nghiên cứu của Zhou và cộng sự: 24% bệnh nhân có D-dimer > 1 mg/L ở nhóm COVID -19 sống và 81% ở nhóm tử
- Theo Tang và cộng sự: 85% bệnh nhân COVID-19 tử vong có D-dimer > 3 mg/L.
Kết quả nghiên cứu trên mẫu xét nghiệm của 1651 bệnh nhân mắc COVID-19 tại bệnh viện dã chiến hồi sức cấp cứu tỉnh Bình Dương từ ngày 13 tháng 8 đến ngày 20 tháng 9 năm 2021 như sau:
- D-dimer trung bình 2713 μg/L.
- D-dimer trong nhóm bệnh nhân hồi sức tích cực trung bình 6717 μg/L, khoảng: 293-113477 μg/L.
- D-dimer trong nhóm bệnh nhân không hồi sức tích cực trung bình 1685 μg/L, khoảng: 50-131400 μg/L.
2.3. Xét nghiệm định lượng fibrinogen
Một số đặc điểm về fibrinogen ở bệnh nhân COVID-19:
- Fibrinogen là xét nghiệm đặc hiệu nhất cho chẩn đoán DIC (100%), nhưng độ nhạy thấp (22%).
- Fibrinogen thường tăng ở bệnh nhân nhiễm khuẩn huyết nhưng có giảm ở bệnh nhân bị DIC nặng.
- Fibrinogen là tiêu chí chẩn đoán
- Fibrinogen tăng cao ở bệnh nhân COVID-19, fibrinogen trung bình khoảng 4,55 g/L.
- Fibrinogen tăng không tương quan với tỷ lệ tử vong, nhưng tương quan chặt chẽ với IL-6.
- Giảm fibrinogen động học có tương quan chặt chẽ với tỷ lệ tử vong, khoảng 29% bệnh nhân tử vong có fibrinogen giảm dưới 1 g/L.
Kết quả nghiên cứu trên mẫu xét nghiệm của 1764 bệnh nhân mắc COVID-19 tại bệnh viện dã chiến hồi sức cấp cứu tỉnh Bình Dương từ ngày 13 tháng 8 đến ngày 20 tháng 9 năm 2021 như sau:
- Fibrinogen trung bình 4,97 g/L, khoảng: 0,4-12 g/L.
- Fibrinogen trên nhóm bệnh nhân không hồi sức tích cực trung bình 4,6 g/L, khoảng: 1,51-11,25 g/L.
- Fibrinogen trên nhóm bệnh nhân hồi sức tích cực trung bình 5,2 g/L, khoảng: 2,1-7,9 g/L.
2.4. Xét nghiệm aPTT
Một số đặc điểm về aPTT ở bệnh nhân COVID-19:
- aPTT thường kéo dài ở bệnh nhân
- aPTT kéo dài đơn độc không có giá trị trong dự đoán DIC (theo ISTH).
- Có khoảng 6% bệnh nhân COVID-19 có xét nghiệm aPTT kéo dài.
- aPTT kéo dài không có sự khác biệt giữa nhóm COVID-19 nặng và không nặng.
Kết quả nghiên cứu trên mẫu xét nghiệm của 1775 bệnh nhân mắc COVID-19 tại bệnh viện dã chiến hồi sức cấp cứu tỉnh Bình Dương từ ngày 13 tháng 8 đến ngày 20 tháng 9 năm 2021 như sau:
- aPTT trên 1775 mẫu: trung bình 29,3 giây, có 5,2% aPTT kéo dài trên 40 giây.
- aPTT trên nhóm bệnh nhân hồi sức tích cực: trung bình 28,4 giây, khoảng: 20-49,5 giây.
- aPTT trên nhóm bệnh nhân không nằm hồi sức tích cực: trung bình 28,2 giây, khoảng 20-46,9 giây.
2.5. Xét nghiệm PT
Một số đặc điểm về PT ở bệnh nhân COVID-19:
- PT thường kéo dài ở bệnh nhân DIC (theo ISTH).
- PT là tiêu chí trong chẩn đoán
- Có khoảng 5% bệnh nhân COVID-19 có xét nghiệm PT kéo dài.
- PT kéo dài có khác biệt giữa nhóm nặng và không nặng, PT kéo dài hơn trung bình ở nhóm nặng là khoảng 1,6 giây.
- 48% trường hợp tử vong có PT kéo dài trên 6 giây.
- PT kéo dài động học được xem là dấu hiệu tiên lượng xấu.
Kết quả nghiên cứu trên mẫu xét nghiệm của 1775 bệnh nhân mắc COVID-19 tại bệnh viện dã chiến hồi sức cấp cứu tỉnh Bình Dương từ ngày 13 tháng 8 đến ngày 20 tháng 9 năm 2021 như sau:
- PT trên nhóm bệnh nhân hồi sức tích cực: trung bình 88,4%, khoảng: 43-128%.
- PT trên nhóm bệnh không hồi sức tích cực: trung bình 106,3%, khoảng: 40-144%.
2.6. Xét nghiệm định lượng các sản phẩm thoái giáng của fibrinogen (FDP)
Một số đặc điểm về định lượng FDP ở bệnh nhân COVID-19:
- FDP là xét nghiệm có độ nhạy là 100% và độ đặc hiệu là 67% trong chẩn đoán
- FDP là một tiêu chí chẩn đoán DIC (theo ISTH).
- Giá trị FDP tăng trước khi tăng D-dimer, được xem là xét nghiệm phát hiện rối loạn đông máu sớm khi bệnh tiến triển.
- FDP bình thường ở đại đa số bệnh nhân COVID-19 thể nhẹ hoặc giai đoạn đầu.
- FDP tăng cao ở nhóm bệnh nhân COVID-19 tử vong do đó FDP được xem là yếu tố tiên lượng.
Hình 16.3. Các bất thường đông cầm máu theo giai đoạn bệnh COVID-19
2.7. Xét nghiệm ROTEM
ROTEM được cải tiến liên tục từ TEG trong những năm 1995-1997 ở Munich. Một số xét nghiệm ROTEM có thể làm ở bệnh nhân COVID-19.
- INTEM: Hoạt hóa đông máu theo con đường nội sinh (Ellagic acid) → Đánh giá đông máu đường nội sinh.
- HEPTEM: Hoạt hóa đông máu nội sinh + heparinase → Loại trừ ảnh hưởng của heparin (nhiễm heparin, điều trị heparin…).
- EXTEM: Hoạt hóa đông máu ngoại sinh, cung cấp lượng nhỏ TF (thromboplastin) → Đánh giá đông máu ngoại
- FIBTEM: Như EXTEM + cytochalasin D (chất ức chế tiểu cầu) → Đánh giá tạo fibrin và polymer hóa fibrin mà không bị ảnh hưởng bởi tiểu cầu.
- APTEM: Như EXTEM + aprotinin (ức chế tiêu sợi huyết) → So sánh EXTEM với APTEM đánh giá tiêu sợi huyết.
- NATEM: Tương tự như INTEM và EXTEM nhưng không có chất hoạt hóa.
- ROTEM là xét nghiệm có giá trị lớn chẩn đoán tăng đông trong giai đoạn đầu và chảy máu đặc biệt là chảy máu cấp trong giai đoạn sau của COVID-19. Tuy nhiên xét nghiệm có giá thành cao nên trong điều trị đại dịch COVID-19 xét nghiệm này bị hạn chế chế sử dụng.
Bảng 16.2. Một số thông số tham chiếu của ROTEM
| Chỉ số | CT (giây) | A5 (mm) | A10 (mm) | MCF (mm) | LI30% | ML% |
| INTEM | 100-240 | 38-57 | 44-66 | 50-72 | 94-100 | 0-15 |
| HEPTEM | So sánh với INTEM để phát hiện sự ảnh hưởng của heparin | |||||
| EXTEM | 38-79 | 34-55 | 43-65 | 50-72 | 94-100 | 0-15 |
| APTEM | So sánh với EXTEM để phát hiện sớm tiêu sợi huyết quá mức | |||||
| FIBTEM | 38-62 | 4-17 | 7-23 | 9-25 | ||
Biểu hiện tăng đông trên ROTEM của bệnh nhân COVID-19:
- CT là thời gian từ khi bắt đầu xét nghiệm bằng việc cho các chất kích hoạt cục máu đông cho đến khi biên độ đạt 2 mm: Thường rút ngắn phù hợp với tình trạng tăng đông mạnh trong giai đoạn đầu của bệnh.
- CFT là là thời gian giữa biên độ 2 mm và biên độ 20 mm của quá trình đông máu: Thường rút ngắn phù hợp với tình trạng tăng tạo fibrin.
- Chỉ số MCF đo độ chắc của cục máu đông và phản ánh chất lượng của cục máu đông: Thường tăng phù hợp với tình trạng tăng fibrinogen
- Giá trị LI30 thể hiện hủy fibrin tại 30 phút sau CT: Thường giảm phù hợp với tình trạng giảm tiêu sợi huyết. Một nghiên cứu thực hiện TEG (tiền thân của ROTEM) trên 44 bệnh nhân hồi sức tích cực cho thấy 57% thiếu hoàn toàn quá trình ly giải cục máu đông (LI30 là 0%), được gọi là “ngừng tiêu sợi huyết” và có liên quan đến tỷ lệ suy thận và biến cố huyết khối tắc mạch
Biểu hiện giảm đông trên ROTEM và xử trí:
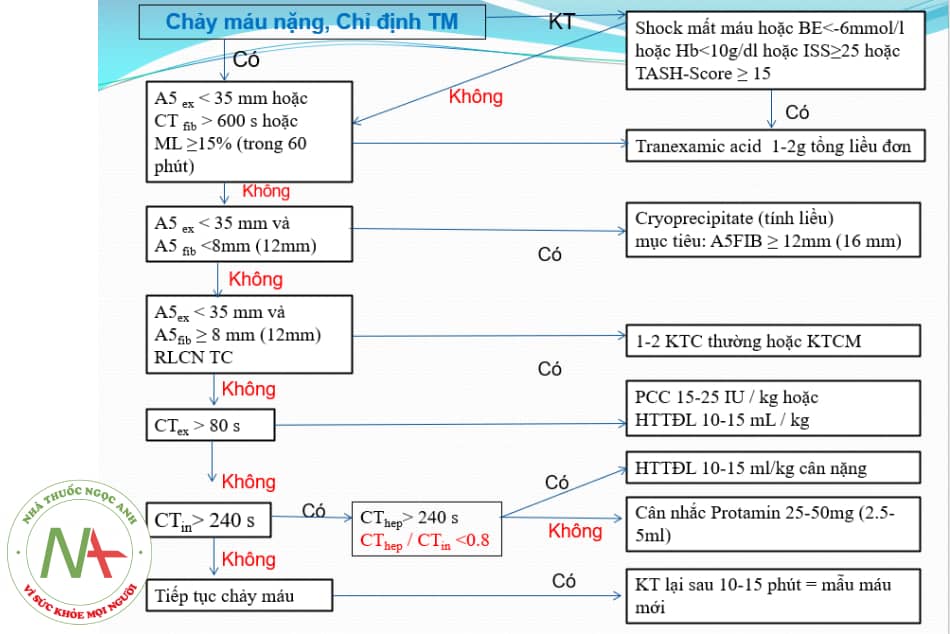
Chú thích: TM: truyền máu; KT: kiểm tra; RLCN TC: rối loạn chức năng tiểu cầu; KTC: khối tiểu cầu; KTCM: khối tiểu cầu máy; PCC: tổ hợp prothrombin cô đặc; HTTĐL: huyết tương tươi đông lạnh.
2.8. Đo quánh nhớt của máu
Độ nhớt của máu được quyết định bởi hồng cầu và thành phần protein trong huyết tương. Giá trị bình thường của độ nhớt máu là 2,3-4,1 centipoise ở 37 độ C. Độ nhớt của máu được cho là có thể thúc đẩy trạng thái tăng đông. Theo nghiên cứu của Cheryl L Maier và cộng sự, tăng độ nhớt đã được chứng minh trên một loạt 15 bệnh nhân bị bệnh nặng trong khoa hồi sức tích cực.
2.9. Định lượng yếu tố VIII
Yếu tố VIII tham gia vào quá trình đông máu, nó là đồng yếu tố cho yếu tố Xa, khi có mặt Ca2+ và phospholipid, tạo thành một phức hợp chuyển yếu tố X thành dạng hoạt hóa Xa. Nồng độ yếu tố VIII giảm, tăng nguy cơ huyết khối tĩnh mạch và huyết khối động mạch phổi. Theo các nghiên cứu hoạt tính của yếu tố VIII tăng lên (trung bình 297 đơn vị/dL) ở các bệnh nhân COVID -19, tăng cao ở các bệnh nhân nặng.
2.10. Đo nồng độ kháng nguyên và hoạt tính vWF (von Willebrand Factor) và ADAMTS13
vWF là một phân tử glycoprotein đa phân tử có liên quan đến quá trình viêm, cầm máu nguyên phát và thứ phát. Các nghiên cứu đã chỉ ra rằng những bệnh nhân COVID-19 có mức độ hoạt động và kháng nguyên vWF tăng cao đáng kể (trung bình 529; khoảng 210 đến 863), phù hợp với tổn thương hoặc rối loạn nội mô, có thể góp phần làm tăng nguy cơ huyết khối ở bệnh nhân COVID- 19.
Nồng độ kháng nguyên và hoạt tính của vWF có liên quan đến tiên lượng bệnh ở bệnh nhân COVID-19. Nồng độ và hoạt tính của vWF càng cao, tiên lượng càng xấu.
Sự gia tăng nồng độ kháng nguyên và hoạt tính của vWF có liên quan đến giảm hoạt động của ADAMTS13. Mặt khác, giảm hoạt động ADAMTS13 còn liên quan đến tình trạng viêm do tăng IL-6, điều này đã được phát hiện ở bệnh nhân COVID-19. Hoạt tính ADAMTS 13 giảm làm tăng kết dính giữ tiểu cầu vào thành mạch gây huyết khối vi mạch.
2.11. Kháng đông Lupus (LA) và kháng phospholipid
Trên những bệnh nhân có aPTT kéo dài phát hiện sự có mặt của kháng đông Lupus (LA) và kháng phospholipid.
Hai nghiên cứu đã phát hiện ra một tỷ lệ LA cao ở những bệnh nhân có aPTT kéo dài (50 trong số 57 bệnh nhân chiếm 88% và 31 trong số 34 bệnh nhân chiếm 91%). Sự hiện diện của LA có thể dẫn đến aPTT kéo dài nhưng không phản ánh nguy cơ chảy máu tăng lên và có thể dùng chống đông nếu có chỉ định trên nhóm bệnh nhân này. Một nghiên cứu khác đã kiểm tra lại 10 bệnh nhân COVID–19 dương tính với LA sau 1 tháng cho thấy rằng 9 trong 10 người đó đã có kết quả âm tính với LA. Hiện tượng mẫn cảm với kháng thể kháng phospholipid thoáng qua thường gặp ở những bệnh nhân nhiễm virus cấp tính và không tạo thành hội chứng kháng phospholipid.
2.12. Định lượng PAI-1
Chức năng chính của PAI-1 là ức chế chất hoạt hóa plasminogen urokinase, một loại enzyme chịu trách nhiệm phân cắt plasminogen để tạo thành plasmin. Các nghiên cứu đã chứng minh tìm thấy nồng độ cao của PAI-1 ở bệnh nhân COVID-19, điều này dẫn đến tình trạng giảm tiêu sợi huyết toàn thân và trong vi mạch phổi từ đó tạo thành vi huyết khối.
3. CHẨN ĐOÁN VÀ PHÂN TẦNG NGUY CƠ THUYÊN TẮC HUYẾT KHỐI TĨNH MẠCH Ở BỆNH NHÂN COVID-19
3.1. Tổng quan về thuyên tắc huyết khối tĩnh mạch
Tình trạng tăng đông phức tạp trong COVID-19 dẫn đến nhiều loại biến chứng liên quan đến huyết khối, đòi hỏi các đánh giá thích hợp và can thiệp kịp thời để ngăn ngừa và điều trị huyết khối.
Huyết khối tĩnh mạch: tỷ lệ thuyên tắc huyết khối tĩnh mạch ở bệnh nhân COVID-19 nặng và nguy kịch là rất cao, có nghiên cứu báo cáo lên đến 1/3 tổng số bệnh nhân trong ICU. Tỷ lệ này ở bệnh nhân COVID-19 nặng nhưng không cần đến ICU dao động từ 3-10%.
Cục máu đông có thể hình thành tại bất kỳ mạch máu nào trong cơ thể nhưng hay gặp nhất là hình thành ở các tĩnh mạch sâu chi dưới như tĩnh mạch đùi, tĩnh mạch khoeo, tĩnh mạch chậu gây ra bệnh lý huyết khối tĩnh mạch sâu chi dưới (HKTMS) (deep venous thrombosis). Huyết khối tĩnh mạch sâu có thể bứt ra khỏi thành mạch, trôi tự do trong máu và dừng lại khi trôi tới chỗ hẹp của hệ tuần hoàn.
Cục máu đông bắt nguồn trong hệ tĩnh mạch hoặc tim phải sẽ được đẩy vào động mạch phổi gây tắc động mạch phổi (TĐMP) (pulmonary embolism). Đây là một biến chứng nguy hiểm và có thể dẫn đến tử vong nếu không được cấp cứu kịp thời.
Tuy nhiên trong bệnh lý COVID-19, huyết khối có thể hình thành tại chỗ do tương tác giữa tình trạng tăng đông, tổn thương trực tiếp nội mô, hoạt hóa bổ thể và các quá trình viêm khác như trình bày trong phần 1 – Tình trạng tăng đông ở bệnh nhân COVID-19. Các nghiên cứu khám nghiệm tử thi ở các bệnh nhân tử vong do COVID-19 đã chứng minh có huyết khối vi mạch phổi. Từ đó sẽ gây ra các rối loạn bất tương xứng thông khí – tưới máu và làm nặng thêm tình trạng tụt oxy của bệnh nhân COVID-19.
Mặt khác, huyết khối có thể gây tổn thương các van tĩnh mạch gây ra tình trạng suy van tĩnh mạch sâu chi dưới về mặt lâu dài, gọi là bệnh lý tĩnh mạch hậu huyết khối. Trên lâm sàng sẽ biểu hiện bằng các triệu chứng như nặng chân, phù, giãn tĩnh mạch, loét chi dưới.
Huyết khối động mạch: đã có những báo cáo về việc tăng tỷ lệ huyết khối động mạch, bao gồm đột quỵ, thiếu máu chi cấp tính (limb ischaemia) và nhồi máu cơ tim, ở bệnh nhân COVID-19 so với các bệnh nhân không nhiễm COVID-19. Ở một số ít các trường hợp khi có lỗ bầu dục thông giữa tim trái và phải, huyết khối tĩnh mạch có thể từ tim phải qua tim trái và gây tắc các tiểu động mạch, như tắc mạch não (gây đột quỵ não), được gọi là thuyên tắc mạch nghịch thường.
3.2. Đặc điểm lâm sàng của thuyên tắc huyết khối tĩnh mạch ở bệnh nhân COVID-19
a. Triệu chứng lâm sàng
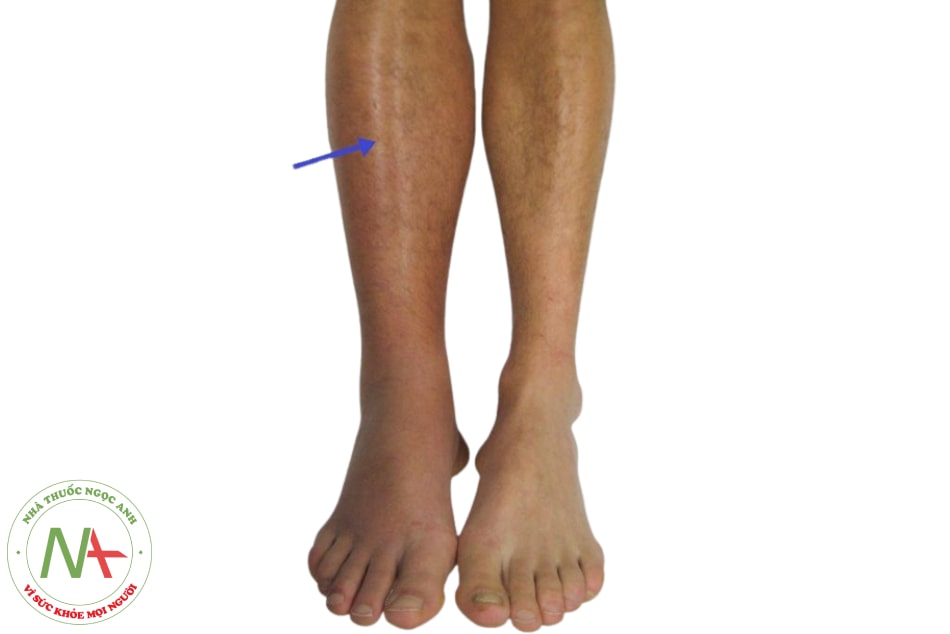
Huyết khối tĩnh mạch sâu (HKTMS) chi dưới:
- Sưng chân 1 bên: kích thước chân bên có huyết khối to hơn chân phía bên đối diện.
- Đau.
- Phù chân.
- Nóng.
- Thay đổi màu ở chân (đỏ hoặc tím)
Thuyên tắc động mạch phổi cấp:
- Đau ngực kiểu màng phổi.
- Ho/ho ra máu.
- Khó thở.
- Có thể kèm theo biểu hiện của HKTMS chi dưới.
- Choáng váng, ngất.
- Các dấu hiệu như: nhịp tim nhanh, suy hô hấp (tụt SpO2), có thể có rối loạn huyết động (tụt huyết áp) nếu huyết khối lớn.
b. Thang điểm WELLS cải tiến
Bảng 16.3. Thang điểm WELLS cải tiến: Đánh giá khả năng lâm sàng bị huyết khối tĩnh mạch sâu chi dưới
| Yếu tố nguy cơ | Điểm |
| 1. Ung thư hoạt động (đang điều trị hoặc mới phát hiện trong vòng 6 tháng) | +1 |
| 2. Liệt, yếu cơ hoặc mới phải bất động chi dưới (bó bột…) | +1 |
| 3. Nằm liệt giường ≥ 3 ngày hoặc mới phẫu thuật lớn trong vòng 4 tuần trước | +1 |
| Dấu hiệu lâm sàng (nếu bị cả hai chân, đánh giá ở chân nặng hơn) | |
| 4. Đau dọc đường đi của hệ tĩnh mạch sâu | +1 |
| 5. Sưng toàn bộ chi dưới | +1 |
| 6. Bắp chân sưng >3 cm so với bên đối diện (đo dưới lồi củ chày 10cm) | +1 |
| 7. Phù ấn lõm | +1 |
| 8. Giãn tĩnh mạch nông bàng hệ (không phải búi giãn tĩnh mạch mạn tính) | +1 |
| 9. Chẩn đoán bệnh khác, nhiều khả năng hơn là chẩn đoán huyết khối tĩnh mạch sâu chi dưới | 2 |
Áp dụng thang điểm Wells cải tiến:
| Xác suất huyết khối tĩnh mạch sâu chi dưới | Tổng điểm | |
| 3 mức độ | Thấp | < 1 |
| Trung bình | 1 – 2 | |
| Cao | ≥ 3 | |
3.3. Chẩn đoán và phân tầng nguy cơ thuyên tắc huyết khối tĩnh mạch
a. Cận lâm sàng
Các xét nghiệm thường quy
- Công thức máu: tiểu cầu có thể giảm.
- Xét nghiệm đông máu: PT, aPTT (thường hơi kéo dài).
- Fibrinogen: thường tăng lên.
- D-dimer: nếu bình thường, loại trừ huyết khối. D-dimer có độ đặc hiệu thấp vì vậy không thể dùng để chẩn đoán huyết khối. Nếu D-dimer tăng, đặc biệt > 2500 ng/mL, cần làm thêm các chẩn đoán hình ảnh để đánh giá.
Các xét nghiệm này cần được làm khi bệnh nhân COVID-19 nặng nhập viện và có thể được theo dõi hàng ngày hoặc ít thường xuyên hơn, phụ thuộc vào các chỉ số ban đầu, xu hướng tiến triển của các chỉ số xét nghiệm và tình trạng lâm sàng của bệnh nhân. Mục đích của các xét nghiệm này (đặc biệt D-dimer) còn để tiên lượng bệnh nhân và đánh giá mức độ cần theo dõi. Tuy nhiên, không nên dùng các chỉ số này một cách riêng rẽ để đưa ra các quyết định về điều trị, ví dụ về liều chống đông.
Về chi tiết các xét nghiệm đông máu và các biện pháp đánh giá khác, xem thêm Phần 2. Các xét nghiệm đánh giá tình trạng tăng đông trên bệnh nhân COVID-19.
Cận lâm sàng khác trong đánh giá thuyên tắc động mạch phổi
- Điện tâm đồ: nhịp tim nhanh, rung nhĩ, block nhánh phải. Trường hợp nặng thì có thể có S sâu ở DI, Q sâu ở DIII, T âm DIII hoặc T âm ở các chuyển đạo trước tim phải V1-V3.
- Khí máu động mạch: kiềm hô hấp và shunt pH tăng, PCO2 giảm, PO2 giảm, HCO3- bình thường, A-aO2 > 50 (ở bệnh nhân bệnh phổi tắc nghẽn mạn tính (COPD) PCO2 có thể bình thường và HCO3- tăng).
- Xquang phổi: Có một số dấu hiệu của huyết khối động mạch phổi trên Xquang phổi như phổi quá sáng (Westermark), dấu hiệu đám mờ ngoại vi phổi (Hampton’s Hump); tuy nhiên các dấu hiệu này đều có độ nhạy thấp. Xquang phổi vẫn cần được chụp để tìm các nguyên nhân khác của tình trạng suy hô hấp ở bệnh nhân COVID-19, ví dụ tràn khí màng phổi hoặc trung thất, tràn dịch màng phổi, viêm phổi..
- Chụp xạ hình thông khí tưới máu phổi (ventilation-perfusion scintigraphy): Khi có chống chỉ định thuốc cản quang, dị ứng thuốc cản quang, nguy cơ khi nhiễm tia X như trường hợp có
Chẩn đoán hình ảnh
- Siêu âm Doppler mạch chi dưới: phát hiện hình ảnh huyết khối ở hệ tĩnh mạch chi dưới. Ưu điểm của siêu âm Doppler là có thể được thực hiện tại giường vì vậy không cần di chuyển các bệnh nhân lâm sàng nặng và nguy kịch. Các dấu hiệu trực tiếp bao gồm: không có tín hiệu Doppler, tĩnh mạch ấn không xẹp hoặc xẹp hoàn toàn, nhìn thấy huyết khối với mật độ âm thay đổi. Hoặc có thể thấy các dấu hiệu gián tiếp: giảm tốc độ tuần hoàn phía trên chỗ bị tắc, không thấy sự biến đổi theo hô hấp của dòng chảy tĩnh mạch, tĩnh mạch giãn, khó ấn xẹp hơn bên đối diện, tăng tốc độ dòng chảy ở các tĩnh mạch bàng hệ.
- Chụp cắt lớp vi tính (CLVT) động mạch phổi: có độ nhạy và đặc hiệu cao vì vậy là loại chẩn đoán hình ảnh được ưu tiên lựa chọn để chẩn đoán xác định hoặc loại trừ thuyên tắc động mạch phổi. Tuy nhiên, có một số lỗi kỹ thuật có thể ảnh hưởng đến chất lượng của CLVT động mạch phổi, ví dụ, thuốc cản quang có thời gian bị lệch pha chụp, không vào đúng thì động mạch phổi.
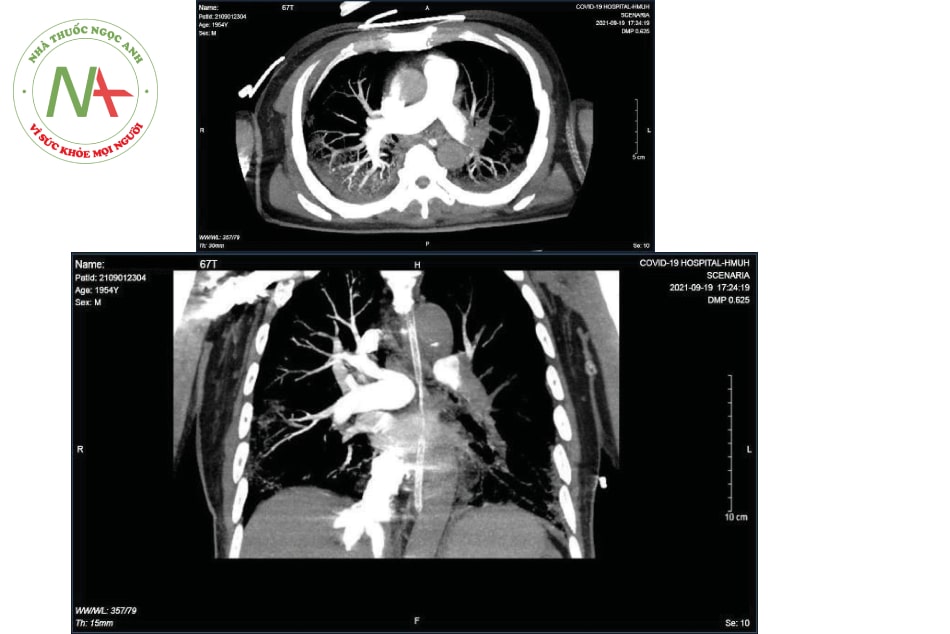
- Siêu âm tim: Siêu âm tim rất có ý nghĩa khi bệnh nhân bị rối loạn huyết động do đó không thể hoặc khó khăn khi vận chuyển đi chụp Siêu âm tim có độ nhạy thấp (khoảng 60%) nhưng đặc hiệu nếu nhìn thấy huyết khối buồng tim phải, trong động mạch phổi. Các dấu hiệu suy thất phải như: giãn thất phải, dấu hiệu McConnell: vận động nghịch thường vách liên thất, mỏm tim bình thường, đè đẩy thất trái có thể do huyết khối động mạch phổi. Tuy nhiên, ở các bệnh nhân COVID-19 nguy kịch, dấu hiệu giãn và suy thất phải có thể do tổn thương phổi đáng kể và tăng áp phổi mà không có huyết khối động mạch phổi.
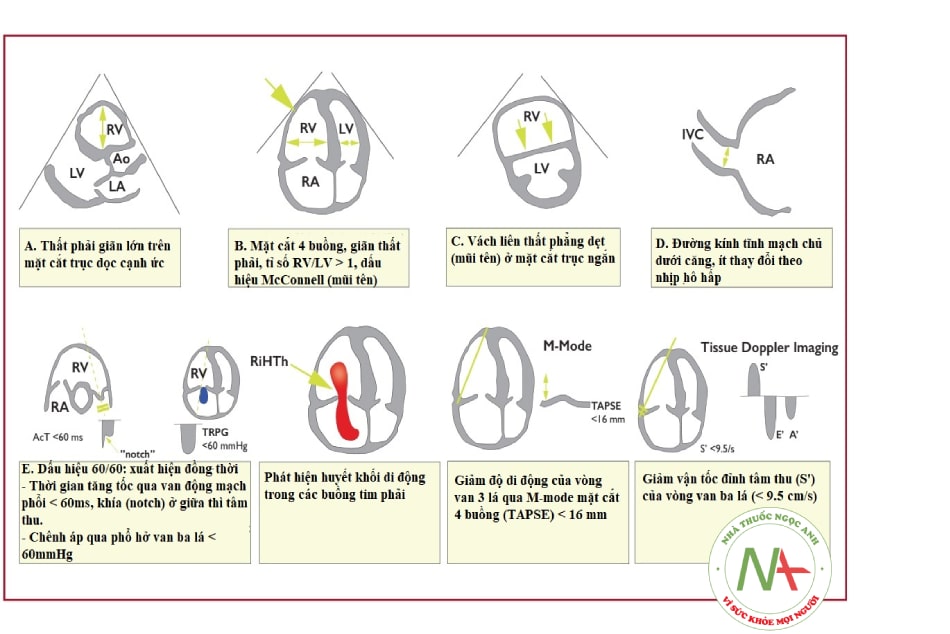
Chú thích: RV (Right Ventricle/ventricular): thất phải; LV (Left Ventricle): thất trái; Ao (Aorta): động mạch chủ lên); LA (Left Atrium): nhĩ trái; RA (Right Atrium): nhĩ phải; IVC (Inferior vena cava): tĩnh mạch chủ dưới; ACT (right ventricular outflow Doppler acceleration time): thời gian tăng tốc đường ra thất phải; RiHTh (Right Heart Thrombus): huyết khối buồng tim phải; TAPSE (tricuspid annular plane systolic excursion): độ di động vòng van ba lá; Tissue Doppler Imaging: hình ảnh Doppler mô cơ tim.
b. Chẩn đoán
- Chẩn đoán xác định khi: Hình ảnh huyết khối tĩnh mạch sâu trên siêu âm Doppler chi dưới hay huyết khối động mạch phổi trên CLVT động mạch phổi.
- Lâm sàng nghi ngờ: Chưa thể chẩn đoán xác định bằng siêu âm Doppler hoặc CLVT, tuy nhiên nghi ngờ cao về huyết khối dựa trên triệu chứng lâm sàng, yếu tố nguy cơ và thang điểm lâm sàng.
Chẩn đoán phân biệt:
- Hội chứng vành cấp: Cơn đau ngực gợi ý mạch vành, có yếu tố nguy cơ bệnh mạch vành (tăng huyết áp, đái tháo đường, rối loạn lipid, hút thuốc lá, tiền sử gia đình), điện tâm đồ gợi ý, tăng troponin, siêu âm tim có giảm vận động vùng.
- Viêm phổi, viêm màng phổi: Ho, sốt cao, bạch cầu tăng, Xquang phổi có hình ảnh viêm phổi.
- Phình tách động mạch chủ: tăng huyết áp, mạch tứ chi không cân đối, dấu hiệu thiếu máu ngoại vi, Xquang ngực trung thất rộng, chụp CT động mạch chủ có thuốc cản
- Tràn khí màng phổi: Đau ngực đột ngột ở người trẻ, nghe phổi rì rào phế nang kém một bên, Xquang phổi có tràn khí màng phổi.
c. Phân tầng nguy cơ
Sử dụng thang điểm PESI hoặc PESI rút gọn để tiên lượng bệnh nhân:
Bảng 16.4. Thang điểm PESI và PESI rút gọn
| Dấu hiệu | PESI kinh điển (PESI) | PESI rút gọn (sPESI) |
| Tuổi > 80 | Tuổi (năm) | 1 |
| Nam giới | +10 | – |
| Tiền sử ung thư | +30 | 1 |
| Tiền sử suy tim | +10 | 1 |
| Tiền sử bệnh phổi mạn tính | +10 | |
| Mạch ≥ 110 lần/phút | +20 | 1 |
| Huyết áp tối đa < 100mmHg | +30 | 1 |
| Nhịp thở ≥ 30 lần/phút | +20 | – |
| Nhiệt độ < 36oC | +20 | – |
| Rối loạn ý thức | +60 | – |
| Bão hoà oxy < 90% | +20 | 1 |
| Phân loại nguy cơ tử vong | Theo 5 mức
– PESI độ I: ≤ 65 điểm – PESI độ II: 66-85 điểm – PESI độ III: 86-105 điểm – PESI độ IV: 106-125 điểm – PESI độ V: > 125 điểm |
– Nguy cơ tử vong thấp: 0 điểm
– Nguy cơ tử vong cao: ≥ 1 điểm |
| Theo 2 mức
– Nguy cơ tử vong thấp: ≤ 85 điểm – Nguy cơ tử vong cao: ≥ 86 điểm |
Phân tầng nguy cơ thuyên tắc động mạch phổi cấp:
Bảng 16.5. Phân tầng nguy cơ thuyên tắc động mạch phổi cấp
| Tình trạng huyết động | Nguy cơ tử vong sớm | Sốc hoặc tụt huyết áp | PESI III-IV hoặc sPESI ≥ 1 | Dấu hiệu rối loạn thất phải trên hình ảnh học | Tăng troponin T | |
| Rối loạn | Cao | + | + | + | + | |
| Ổn định | Trung bình | Cao | – | + | Cả hai yếu tố đều dương tính | |
| Thấp | – | + | Một trong 2 dương tính | |||
| Thấp | – | – | Âm tính | |||
4. QUẢN LÝ VÀ ĐIỀU TRỊ THUYÊN TẮC HUYẾT KHỐI TĨNH MẠCH Ở BỆNH NHÂN COVID-19
4.1. Chiến lược điều trị
Dự phòng và điều trị huyết khối ở COVID-19 là một thử thách do tình trạng tăng đông phức tạp và thiếu những nghiên cứu lớn để đưa ra một quyết định rõ ràng về phác đồ chống đông.
D-dimer sớm được nhận biết là chỉ số đánh giá tình trạng tăng đông, nguy cơ huyết khối và tiên lượng ở bệnh COVID-19. Vào những tháng đầu tiên của đại dịch (nửa đầu 2020), nhiều nơi trên thế giới sử dụng các ngưỡng D-dimer để giúp quyết định liều chống đông dự phòng hay điều trị. Các nghiên cứu sau này cho thấy D-dimer tăng cao cũng liên quan đến việc tăng nguy cơ chảy máu. Hiện tại chưa đủ bằng chứng để khuyến cáo dùng D-dimer hoặc các kết quả xét nghiệm khác để đánh giá, chẩn đoán huyết khối hoặc để đưa ra những quyết định về điều trị chống đông.
Tình trạng tăng đông trong COVID-19 được thấy tăng lên cùng với mức độ nặng trên lâm sàng của bệnh nhân. Vì vậy, ở nửa cuối năm 2020 và nửa đầu năm 2021, xu hướng trong phác đồ chống đông chuyển sang dùng phân loại về mức độ lâm sàng. Trong đó, liều dự phòng được dùng ở các bệnh nhân nhẹ và liều điều trị được dùng ở các bệnh nhân bệnh nặng hoặc nguy kịch. Ở một số nơi, liều trung gian được sử dụng ở các bệnh nhân nặng nhưng chưa cần đến ICU.
Kết quả từ những thử nghiệm lâm sàng lớn về liệu pháp chống đông đang bắt đầu được công bố (2021). Trong đó, quan trọng nhất là thử nghiệm ATTACC + ACTIVE-4 + REMAP-CAP so sánh hiệu quả chống đông liều điều trị và liều dự phòng ở bệnh nhân COVID-19 nặng và nguy kịch. Nghiên cứu này được công bố vào tháng 5/2021 và chỉ ra rằng việc dùng rộng rãi chống đông liều điều trị (không phụ thuộc bằng chứng huyết khối) ở nhóm bệnh nhân này không có hiệu quả cải thiện nhu cầu hỗ trợ suy đa tạng, và thậm chí, có những điểm đáng lo ngại về nguy cơ chảy máu. Nghiên cứu này đã giúp định hướng các khuyến cáo mới nhất về chống đông từ các tổ chức y tế lớn trên thế giới. Các hướng dẫn này đều thống nhất về việc dùng chống đông liều dự phòng cho bệnh nhân COVID-19 nhập viện, và chỉ dùng chống đông liều điều trị khi có bằng chứng huyết khối (trên siêu âm Doppler hoặc CLVT động mạch phổi) hoặc khi có nghi ngờ cao trên lâm sàng.
Các phác đồ điều trị này vẫn đang được nghiên cứu và có thể thay đổi nhiều trong tương lai. Một số tác giả khuyến cáo liều chống đông tăng cường (hay còn gọi là liều trung gian) cho một số đối tượng có nguy cơ thuyên tắc huyết khối tĩnh mạch cao như béo phì, mắc bệnh ác tính, suy hô hấp mức độ vừa (nhu cầu oxy > 6 l/phút). Theo quan điểm của chúng tôi cũng như các nghiên cứu lâm sàng trước đây, liều chống đông dự phòng là an toàn và nên được sử dụng sớm ngay khi có chỉ định; việc đánh giá nguy cơ cũng như phát hiện sớm huyết khối cần được thăm khám, kiểm tra hằng ngày.
Tham khảo thêm về bằng chứng nghiên cứu và các khuyến cáo hiện nay (11/2021) trên thế giới, Xem Chương 7 – Phần 5. LIỆU PHÁP CHỐNG HUYẾT KHỐI Ở BỆNH NHÂN COVID-19.
Chiến lược điều trị thuyên tắc huyết khối tĩnh mạch ở bệnh nhân COVID-19 được tóm tắt trong sơ đồ sau:
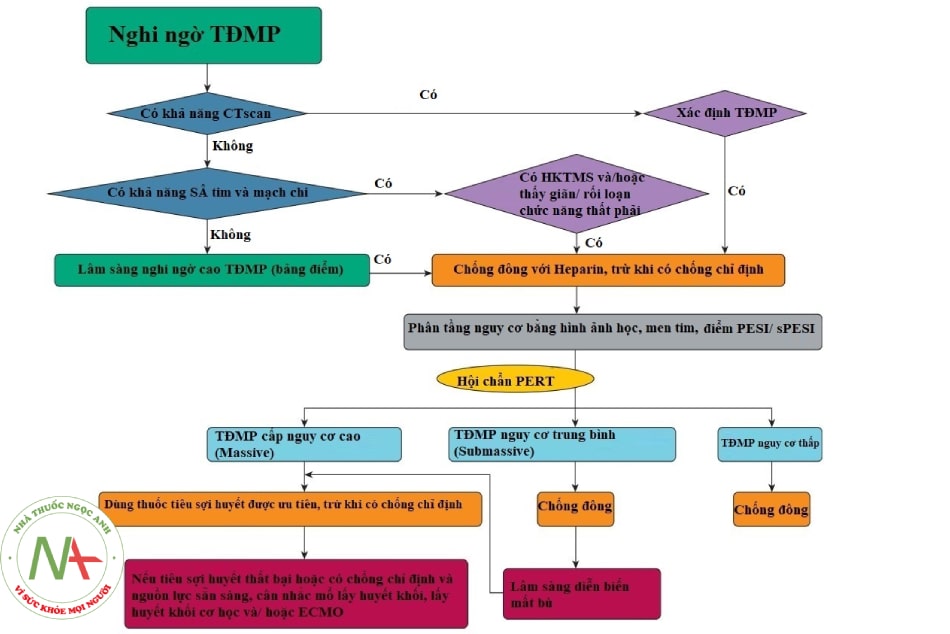
Chú thích: TĐMP: tắc động mạch phổi; HKTMS: huyết khối tĩnh mạch sâu; S : siêu âm; PERT (Pulmonary embolism response team): Đội ứng phó tắc động mạch phổi cấp bao gồm: bác sĩ các chuyên khoa Hồi sức cấp cứu, Tim mạch, Can thiệp điện quang, Phẫu thuật và Dược lâm sàng.
4.2. Thuốc chống đông
a. Chống đông dự phòng
Chỉ định:
- Chống đông liều dự phòng được dùng cho tất cả các bệnh nhân COVID-19 nhập viện điều trị (với liệu pháp oxy hoặc hỗ trợ hô hấp) bao gồm cả các bệnh nhân ICU và phụ nữ có thai – trừ khi có chống chỉ định.
- Các bệnh nhân mức độ nhẹ và không cần hỗ trợ về oxy hay hô hấp: chưa cần dùng chống đông. Tuy nhiên, có thể cân nhắc dùng liều dự phòng nếu có nguy cơ cao như: bệnh lý nền, tăng huyết áp, tiểu đường, ung thư, bệnh phổi mạn tính, bệnh lý mạch vành, tiền sử huyết khối, béo phì. Đánh giá nguy cơ huyết khối dựa trên thang điểm IMPROVE-VTE sửa đổi: tăng nguy cơ khi 2 hoặc 3 điểm.
Bảng 16.6. Thang điểm IMPROVE-VTE sửa đổi đánh giá nguy cơ huyết khối
| Yếu tố nguy cơ VTE | Điểm nguy cơ VTE |
| Tiền sử VTE | 3 |
| Bệnh lý tăng đông đã được chẩn đoán (V Leiden, Thiếu protein C, protein S bẩm sinh, kháng đông Lupus) | 2 |
| Liệt chi dưới | 2 |
| Bệnh lý ung thư (ngoại trừ ung thư da không melanin) trong vòng 5 năm | 2 |
| Đang nằm tại ICU/CCU | 1 |
| Bất động hoàn toàn ≥ 1 ngày | 1 |
| Tuổi ≥ 60 | 1 |
Chú thích: VTE: thuyên tắc huyết khối tĩnh mạch.
Loại thuốc chống đông – liều dự phòng
- Ở các bệnh nhân nội trú, heparin (tiêm dưới da) được ưu tiên dùng thay vì thuốc chống đông trực tiếp đường uống (DOAC).
- Heparin trọng lượng phân tử thấp (TLPTT), như enoxaparin được ưu tiên dùng ở các bệnh nhân không có suy thận. Nếu không có heparin TLPTT, có thể dùng heparin không phân đoạn.
- Ở bệnh nhân suy thận CrCl < 20 mL/phút, dùng heparin không phân đoạn.
- Nếu không có heparin, thuốc chống đông đường uống (DOAC) có thể được dùng để thay thế. Lưu ý: không dùng nhóm DOAC ở các bệnh nhân có CrCl < 15 mL/phút.
- Phụ nữ có thai: ưu tiên dùng heparin Chuyển sang dùng heparin không phân đoạn ở những thai phụ tuần 36 trở đi hoặc nếu có khả năng chuẩn bị chuyển dạ hoặc cần can thiệp thai.
Thời gian dùng:
- Sử dụng trong thời gian nằm viện.
- Không khuyến cáo tiếp tục dùng dự phòng chống đông khi xuất viện.
Lưu ý:
Nghiên cứu ATTACC, ACTIV-4, REMAP-CAP ở 2219 bệnh nhân nội trú mắc COVID-19 thể nặng vừa (chỉ thở liệu pháp oxy nhưng không cần đến oxy dòng cao, thở máy hoặc ICU) cho thấy bệnh nhân dùng sớm dự phòng VTE bằng liều điều trị có nhu cầu hồi sức tích cực ít hơn so với nhóm bệnh nhân dùng liều dự phòng. Sau khi nghiên cứu này được công bố vào giữa năm 2021, một số tổ chức (Ví dụ: British Thoracic Society 8/2021) khuyến cáo cân nhắc dự phòng VTE bằng liều điều trị ở bệnh nhân nội trú mắc COVID-19 thể nặng vừa (chỉ thở liệu pháp oxy).
Với phác đồ này: bệnh nhân COVID-19 nặng vừa (chỉ cần đến liệu pháp oxy) sẽ được dự phòng VTE sớm bằng liều điều trị – sau đó nếu bệnh nhân tiến triển nặng hơn (cần thở HFNC/thở máy), liều chống đông sẽ được giảm xuống liều dự phòng (trừ khi có bằng chứng huyết khối) do nguy cơ chảy máu cao hơn ở giai đoạn này.
Tuy nhiên, một số tổ chức khác (NIH, Uptodate) vẫn khuyến cáo dùng liều dự phòng ở nhóm bệnh nhân nặng vừa. Các hướng dẫn này khả năng cao sẽ còn thay đổi và tiến tới thống nhất khi có đủ bằng chứng nghiên cứu hơn về chống đông.
b. Chống đông điều trị
Chỉ định
- Dùng chống đông liều điều trị ở các bệnh nhân có bằng chứng huyết khối (dựa trên chẩn đoán hình ảnh như siêu âm Doppler, CLVT động mạch phổi…).
- Có thể cân nhắc dùng ở các bệnh nhân nghi ngờ cao có huyết khối dựa trên lâm sàng (triệu chứng của huyết khối, suy hô hấp đột ngột), nhưng chưa thể làm chẩn đoán hình ảnh.
- Các bệnh nhân có tình trạng tắc catheter tĩnh mạch trung tâm, hoặc tắc quả lọc/ ECMO: có thể dùng chống đông liều điều trị hoặc liều trung
- Các bệnh nhân đã dùng chống đông từ trước cho một chỉ định khác, ví dụ ngăn ngừa nguy cơ đột quỵ trong rung nhĩ, thay van tim cơ học,…: tiếp tục dùng.
Loại thuốc chống đông – liều điều trị:
- Ở các bệnh nhân nội trú, heparin trọng lượng phân tử thấp (TLPTT) tiêm dưới da (ví dụ noxaparin…) được ưu tiên dùng ở các bệnh nhân không có suy thận do không cần theo dõi anti-Xa hoặc aPTT và chỉnh liều như heparin không phân đoạn (truyền tĩnh mạch).
- Ở các bệnh nhân suy thận CrCl < 20 mL/phút, dùng heparin không phân đoạn.
- Các bệnh nhân đã dùng chống đông đường uống từ trước cho một chỉ định khác: tiếp tục dùng – có thể chuyển sang heparin TLPTT hoặc heparin không phân trong thời gian nội trú.
- Nếu bệnh nhân dùng warfarin từ trước: ngừng warfarin và theo dõi INR; bắt đầu dùng heparin khi INR <
- Phụ nữ có thai: ưu tiên dùng heparin Chuyển sang dùng heparin không phân đoạn ở những thai phụ tuần 36 trở đi hoặc nếu có khả năng chuẩn bị chuyển dạ hoặc cần can thiệp thai.
Thời gian dùng:
- Các bệnh nhân sử dụng chống đông liều điều trị dù chưa rõ bằng chứng huyết khối: làm chẩn đoán hình ảnh sớm nhất khi có thể. Nếu không có bằng chứng huyết khối, sử dụng chống đông đường uống (DOAC) liều dự phòng ít nhất 10 ngày.
- Các bệnh nhân có bằng chứng huyết khối cần điều trị chống đông ít nhất 3 tháng. Chuyển từ heparin sang dùng chống đông đường uống (DOAC hoặc Warfarin) trước khi bệnh nhân xuất viện. DOACs: Lưu ý không dùng nhóm DOAC ở bệnh nhân có CrCl < 15 mL/phút.
- Rivaroxaban: 15 mg x 2 viên/ngày trong 21 ngày, sau đó duy trì 20 mg x 1 viên/ngày.
- Apixaban: 10 mg x 2 lần/ngày trong 7 ngày, sau đó duy trì 5 mg x 2 lần/ngày.
- Dabigatran (CrCl > 30 mL/phút): Dùng heparin trong 5 ngày đầu, sau đó duy trì 150 mg x 2 viên/ngày, chia 2 lần.
- Thuốc kháng vitamin K (warfarin): duy trì liều đạt INR mục tiêu 2-3. Lưu ý khi bắt đầu warfarin: gối với heparin, theo dõi INR và chỉ ngừng heparin khi INR đã đạt mục tiêu 2-3.
c. Chống chỉ định của thuốc chống đông máu
- Không sử dụng thuốc chống đông máu nếu bệnh nhân có một trong những yếu tố sau:
- Đang có chảy máu
- Xuất huyết não gần đây
- Fibrinogen < 0,5 g/l
- Viêm nội tâm mạc nhiễm khuẩn cấp
- Thận trọng dùng thuốc chống đông nếu bệnh nhân có một trong những yếu tố sau:
- Điểm HAS-BLED ≥ 3
- Tiểu cầu < 25 G/L
- Với bệnh nhân có tiểu cầu < 50 G/L: không dùng heparin không phân đoạn.
Bảng 16.7. Thang điểm HAS-BLED đánh giá nguy cơ chảy máu
| Tiêu chuẩn HAS-BLED | Điểm |
| Cao huyết áp | 1 |
| Bất thường chức năng thận/gan (1 điểm cho mỗi cơ quan) | 1 hoặc 2 |
| Đột quỵ não | 1 |
| Chảy máu | 1 |
| Chỉ số INR không ổn định | 1 |
| Tuổi ≥ 65 | 1 |
| Thuốc (aspirin, NSAID…), uống rượu (1 điểm cho mỗi phần) | 1 hoặc 2 |
d. Tóm tắt liều thuốc chống đông và các trường hợp đặc biệt
Liều của các loại thuốc chống đông thường gặp được tóm tắt ở Bảng 16.8 (Theo “Hướng dẫn chẩn đoán và điều trị COVID-19” – Số 4689 ban hành ngày 06/10/2021 và có sửa đổi)
Lưu ý:
- Bảng này có bao gồm liều dự phòng tăng cường của heparin TLPTT với mục đích cho các bác sĩ tham khảo và cân nhắc. Hiện nay chưa có đủ nghiên cứu về hiệu quả của liều dự phòng tăng cường ở bệnh nhân COVID-19 để đưa ra khuyến cáo về cách dùng và đối tượng bệnh nhân phù hợp.
- Nếu bệnh nhân đang dùng thuốc kháng tiểu cầu từ trước (aspirin, clopidogrel…): Tiếp tục dùng thuốc kháng tiểu cầu và thuốc chống đông liều dự phòng như trên. Cân nhắc tạm dừng nếu bệnh nhân cần dùng chống đông liều điều trị.
- Dabigatran hoặc edoxaban chỉ dùng trong điều trị huyết khối sau khi đã dùng chống đông điều trị bằng heparin (TLPTT hoặc không phân đoạn) ít nhất 5 ngày.
Bảng 16.8. Thuốc chống đông và liều dùng
|
BMI và chức năng thận |
Enoxaparin (Heparin TLPTT) | Heparin không phân đoạn (heparin chuẩn) | Các thuốc chống đông khác | |
| Liều dự phòng | BMI ≤ 30 kg/ m2 và CrCl ≥ 30 ml/phút | – Liều chuẩn: 40 mg, 1 lần/ngày, TDD.
– Liều tăng cường: 0,5 mg/kg, 2 lần/ ngày ± 20%, TDD. |
– 5000 đơn vị, 2 lần/ngày, TDD. |
– Có thể lựa chọn 1 trong các loại chống đông khác sau đây để thay thế heparin:
● Rivaroxaban 10, uống 1 lần/ngày. ● Apixaban 2,5 mg, uống 2 lần/ngày. ● Dabigatran 220 mg, uống 1 lần/ngày. |
| BMI ≥ 30 kg/ m2 và CrCl ≥ 30 ml/phút | – Liều chuẩn: 40 mg, có thể tăng lên 2 lần/ngày, TDD.
– Liều tăng cường: 0,5 mg/kg, 2 lần/ ngày ± 20%, TDD. Có thể tăng lên 60 mg, 2 lần/ngày. |
– 7500 đơn vị, 2 lần/ngày, TDD. | ||
| CrCl < 30 ml/ phút | – Liều chuẩn: 30 mg x 1 lần/ngày, TDD.
– Liều tăng cường: 0,5 mg/kg x 1 lần/ ngày, TDD. Không dùng Enoxaparin khi CrCl < 15mL/phút. |
– 5000-7500 đơn vị, 2 lần/ ngày, TDD. |
● Rivaroxaban 10mg, uống 1 lần/ngày ● Apixaban 2,5mg, uống 2 lần/ngày. Không dùng DOACs khi CrCl < 15 mL/phút. |
| Liều điều trị | BMI ≤ 30 kg/ m2 và CrCl ≥ 30 ml/phút | – 1 mg/kg, 2 lần/ngày, TDD. Hoặc:
– 1,5 mg/kg ± 10%, 1 lần/ngày, TDD. |
Có thể xem xét tiêm bolus 5000 UI, sau đó TTM 18 đơn vị/kg/h Hoặc 250 đơn vị/kg, mỗi 12 giờ, TDD. Chỉnh liều sao cho đạt anti Xa 0,3-0,7 IU/ml. |
● Rivaroxaban 15 mg, uống 2 lần/ngày trong 3 tuần → 20mg, 1 lần/ngày. ● Apixaban 10mg, 2 lần/ngày trong 1 tuần → 5mg, 2 lần/ngày. ● Dabigatran 150 mg, uống 2 lần/ngày; Ở bệnh nhân cao tuổi, có ít nhất 1 yếu tố nguy cơ chảy máu, dùng liều 110 mg, uống, 2 lần/ngày. ● Edoxaban 60 mg, uống ngày 1 lần; ● Warfarin: Đạt INR 2-3. |
| BMI ≥ 30 kg/ m2 và CrCl ≥ 30 ml/phút | – 0,8 mg/kg, 2 lần/ngày, TDD.
Liều 1 lần/ngày không áp dụng với bệnh nhân BMI ≥ 30 kg/m2. |
|||
| CrCl < 30 ml/ phút | – 1 mg/kg, 1 lần/ngày, TDD. và theo dõi anti-Xa
Không dùng Enoxaparin khi CrCl < 15mL/phút. |
Liều điều trị, như trên sau đó chỉnh liều duy trì theo anti-Xa. | ● Rivaroxaban 15 mg, uống 2 lần/ngày trong 3 tuần → 20mg, 1 lần/ngày.
● Apixaban 10mg, 2 lần/ngày trong 1 tuần → 5mg, 2 lần/ngày. ● Edoxaban 30 mg, uống 1 lần/ngày. Không dùng DOACs khi CrCl < 15 ml/phút ● Warfarin: Đạt INR 2-3; |
Chú thích: CrCl: độ thanh thải creatinin, DOACs: thuốc chống đông đường uống tác động trực tiếp, IU: đơn vị quốc tế, TDD: tiêm dưới da, TTM: truyền tĩnh mạch.
Các trường hợp đặc biệt:
Suy thận:
- Cần chỉnh liều thuốc chống đông theo chức năng thận và ở bệnh nhân béo phì (cân nặng > 120 kg hoặc BMI > 40 kg/m2).
- Khuyến cáo sử dụng heparin không phân đoạn (thay cho heparin TLPTT) cho các trường hợp suy thận nặng (CrCl < 15 mL/phút) do ít phụ thuộc vào sự đào thải qua thận, có thuốc đối kháng đặc hiệu là protamin sulfat trong trường hợp quá liều/chảy máu.
- Ở các bệnh nhân lọc máu, dùng heparin theo quy trình của máy lọc máu.
- Chi tiết về các loại heparin, DOAC và chỉnh liều theo mức lọc cầu thận và cân nặng: Xem Chương 7 – Phần LIỆU PHÁP CHỐNG HUYẾT KHỐI Ở BỆNH NHÂN COVID-19.
Phụ nữ có thai:
- Do những thay đổi sinh lý khi mang thai, nguy cơ thuyên tắc huyết khối tăng lên trong thời kỳ mang thai và ngay sau khi sinh. Hiện tại không có đủ nghiên cứu về thang điểm tiên lượng về huyết khối nào ở phụ nữ có thai. Hơn nữa, do những thay đổi về sinh lý ở phụ nữ có thai, xét nghiệm D-dimer không phải là một chỉ số đáng tin cậy để đánh giá nguy cơ huyết khối.
- Chỉ định liều chống đông ở phụ nữ có thai giống như ở các bệnh nhân COVID-19 khác: chống đông liều dự phòng cho tất cả các phụ nữ có thai bị COVID-19 cần nhập viện điều trị (trừ khi có chống chỉ định) và liều điều trị cho những người có bằng chứng huyết khối hoặc nghi ngờ cao trên lâm sàng.
- Heparin (TLPTT hoặc không phân đoạn) được ưu tiên sử dụng ở các phụ nữ có thai do heparin không đi qua nhau thai. Ở các bệnh nhân có CrCl > 30 mL/phút, ưu tiên sử dụng heparin TLPTT (enoxaparin) do liều enoxaparin dễ sử dụng. Tuy nhiên, ở các bệnh nhân có suy giảm chức năng thận CrCl < 30 mL/phút, khuyến cáo dùng heparin không phân đoạn.
- Nhóm thuốc DOAC không được sử dụng ở phụ nữ có thai do thiếu các dữ liệu về an toàn sử dụng ở nhóm bệnh nhân này. Tránh sử dụng warfarin ở phụ nữ có thai (đặc biệt ở thai kỳ đầu tiên) do nguy cơ gây dị tật bẩm
- Heparin TLPTT có thể được chuyển đổi thành heparin không phân đoạn (UFH) ở những bệnh nhân có nguy cơ cao cần can thiệp sản khoa. Nếu can thiệp sản khoa cần dừng chống đông trước tối thiểu 12 giờ hoặc dùng chất trung hòa.
- Ở phụ nữ mang thai, liều trung gian có thể cần cân nhắc khi bệnh nhân tăng cân theo sự tiến triển của
Bảng 16.9. Liều dùng heparin cho phụ nữ mang thai
| Mức liều | Enoxaparin (heparin TLPTT) | Heparin không phân đoạn |
| Dự phòng | – 40mg, 1 lần/ngày, TDD
Khi thai tiến triển: liều trung gian 40mg, 2 lần/ngày, TDD hoặc 1mg/kg, 1 lần/ngày TDD |
– Ba tháng đầu: 5000– 7000 đơn vị, 2 lần/ngày, TDD.
– Ba tháng giữa: 7500– 10000 đơn vị, 2 lần/ngày, TDD. – Ba tháng cuối: 10000 đơn vị, 2 lần/ngày, TDD. |
| Điều trị | – 1mg/kg, 2 lần/ngày, TDD Nếu CrCl < 30 mL/phút, theo dõi anti-Xa, mục tiêu 0,6 – 1,0 IU/mL
Không dùng khi CrCl <15 mL/phút |
– Bolus 80 đơn vị/kg sau đó truyền tĩnh mạch 18 đơn vị/kg/h
Điều chỉnh theo anti-Xa (mục tiêu 0,3 – 0,7 IU/mL) |
Chú thích: IU: đơn vị quốc tế, TDD: Tiêm dưới da, TTM: truyền tĩnh mạch.
e. Theo dõi và chỉnh liều thuốc chống đông
Chống đông liều dự phòng (TDD):
- Ở bệnh nhân có CrCl > 30 mL/phút: không khuyến cáo theo dõi anti-Xa với liều dự phòng của heparin không phân đoạn hay heparin trọng lượng phân tử thấp.
- Ở người bệnh có CrCl < 30 mL/phút: cần kiểm tra sau 10 liều.
- Cân nặng < 50 kg: theo dõi sau tiêm 10 liều; cân nặng > 120 kg: theo dõi sau tiêm 3 liều.
- Lấy mẫu xét nghiệm sau tiêm dưới da (TDD) 4 giờ. Mục tiêu anti Xa cần đạt: 0,1-0,4 IU/ml.
Chống đông liều điều trị:
- Heparin TLPTT (TDD): theo dõi anti-Xa ở các bệnh nhân có CrCl < 30 mL/phút. Lấy mẫu xét nghiệm sau TDD 4 giờ. Enoxaparin liều điều trị: mục tiêu anti-Xa cần đạt: 0,5 – 1 IU/mL (tối đa 1,5 IU/mL).
- Heparin không phân đoạn (TTM): theo dõi anti-Xa ở tất cả các bệnh nhân (mục tiêu 0,3 – 0,7 IU/mL).
- Nếu không thể làm anti-Xa, có thể dùng aPTT bệnh/chứng; tuy nhiên cách này có thể không chính xác ở bệnh nhân COVID-19 do yếu tố VIII ở bệnh nhân COVID-19 tăng rất cao, > 70% bệnh nhân có kháng đông nội sinh lưu hành và sai lệch khi người bệnh suy thận. Mục tiêu aPTT bệnh/ chứng là 1,5 – 2 (tối đa đến 2,5).
- Cách điều chỉnh tốc độ truyền heparin không phân đoạn dựa trên anti-Xa hoặc aPTT bệnh/chứng, cũng như tần suất lấy mẫu xét nghiệm: Xem bảng 16.10 và 11.
Các xét nghiệm theo dõi khác (tần suất xét nghiệm tùy tình trạng người bệnh và điều kiện cơ sở điều trị):
- Tổng phân tích tế bào máu ngoại vi, đông máu (PT, aPTT, fibrinogen), D-dimer
- Nếu có tình trạng giảm tiểu cầu do heparin (HIT) cần dừng heparin và dùng chống đông khác thay thế như agatroban, fondaparinux hoặc DOACs…
Chỉnh liều heparin truyền tĩnh mạch theo aPTT
Bảng 16.10. Phác đồ dùng heparin
| Tên bệnh nhân: ………………………….. ; Cao:….. cm; Nặng:.…..kg; BMI:….. | |||
| Pha thuốc: 25000 đơn vị/50ml (500 đơn vị/ml) | |||
| Bolus ban đầu: 80 đơn vị/kg =……….. Đơn vị = ……ml
Duy trì ban đầu: 18 đơn vị/kg/giờ = …… Đơn vị/giờ = …… ml/giờ |
|||
| aPTT (lần chứng) | Thay đổi (Đơn vị/kg/giờ) | Thao tác | Kiểm tra aPTT |
| < 35 (1,2 ) | Tăng lên 4 | Bolus lại 80 đơn vị/kg | Sau 4-6 giờ |
| 35-45 (1,2-1,5) | Tăng lên 2 | Bolus lại 40 đơn vị/kg | Sau 4-6 giờ |
| 46-70 (1,5-2,3) | Không thay đổi | Sau 4-6 giờ | |
| 71-90 (2,3-3,0) | Giảm xuống 2 | Sau 4-6 giờ | |
| > 90 (> 3) | Giảm 3 hoặc | Dừng truyền 1 giờ | Sau 4-6 giờ |
Chỉnh liều heparin truyền tĩnh mạch theo anti-Xa
Bảng 16.11. Phác đồ chỉnh liều heparin theo mức anti-Xa
| Mức anti-Xa (IU/ml) |
Liều điều chỉnh |
Khuyến cáo khác |
| < 0,1 | Tăng 400 IU/h | Có thể xem xét bolus 2000 UI |
| 0,1-0,19 | Tăng 200 IU/h | |
| 0,2-0,29 | Tăng 100 IU/h | |
| 0,3-0,7 | Không thay đổi | |
| 0,71-0,8 | Giảm 100 IU/h | Tạm ngừng truyền trong 30 phút |
| 0,81-1,7 | Giảm 200 IU/h | Tạm ngừng truyền trong 1 giờ |
| > 1,7 | Giảm 300 IU/h | Tạm ngừng truyền trong 1 giờ |
4.3. Thuốc tiêu sợi huyết
Tiếp cận bệnh nhân COVID-19 nghi ngờ thuyên tắc động mạch phổi cấp có rối loạn huyết động
Việc chẩn đoán và điều trị các tình huống sốc/tụt áp thực sự là một thách thức, đặc biệt là ở các bệnh nhân COVID-19 nặng và nguy kịch lại trong hoàn cảnh số lượng bệnh nhân lớn và nguồn lực y tế hạn chế. Việc xác định rõ ràng chẩn đoán rồi mới điều trị không phải lúc nào cũng làm được và việc trì hoãn có thể làm bỏ lỡ cơ hội điều trị cho bệnh nhân. Vì vậy, việc cân nhắc lợi ích – nguy cơ trong từng trường hợp cụ thể là hết sức cần thiết.
Thuyên tắc động mạch phổi (TĐMP) cấp là một nguyên nhân gây sốc/tụt áp có khả năng đảo ngược được với thuốc chống đông và/hoặc thuốc tiêu sợi huyết. Việc chụp CLVT động mạch phổi không phải lúc nào cũng sẵn sàng và việc đưa bệnh nhân đi chụp cũng tiềm ẩn nhiều nguy cơ rủi ro cho bệnh nhân, cùng với việc huy động nhiều nhân lực cho một bệnh nhân không phải là giải pháp tốt, trong khi việc trì hoãn điều trị có thể làm nặng thêm tình trạng suy thất phải và sốc tim, dẫn đến tử vong nhanh chóng.
Vì vậy chúng tôi đề xuất việc tiến hành những công cụ chẩn đoán, đánh giá có thể làm tại giường ít xâm lấn để định hướng chẩn đoán và điều trị cho bệnh nhân. Đó là việc sử dụng siêu âm tim, siêu âm mạch chi dưới tại giường kết hợp với xét nghiệm men tim để quyết định tiến hành tái tưới máu mạch phổi cho bệnh nhân. Việc tiếp cận chẩn đoán và điều trị này được minh họa bằng lưu đồ sau (Hình 16.9).
Cần lưu ý những bệnh nhân COVID-19 này thường ở giai đoạn có rối loạn đông và chảy máu phức tạp và việc cân nhắc lợi ích – nguy cơ trên từng trường hợp cụ thể là hết sức cần thiết. Hiện tại chưa có nghiên cứu lớn nào về tiêu sợi huyết ở bệnh nhân COVID-19. Các báo cáo ca bệnh nhỏ lẻ ở bệnh nhân COVID-19 dùng tiêu sợi huyết thường mô tả việc cải thiện hô hấp trong thời gian ngắn; tuy nhiên tỷ lệ tử vong, kể cả sau khi dùng tiêu sợi huyết, là rất cao. Báo cáo quan sát đầu tiên (So et al., 2021) ở 57 bệnh nhân COVID-19 được sử dụng tiêu sợi huyết dựa trên các dấu hiệu từ siêu âm tim (không có chẩn đoán đặc hiệu bằng CLVT động mạch phổi) cho thấy tỷ lệ tử vong là 89,5%. Trong 6 bệnh nhân (10,5%) được ra viện, 2 bệnh nhân cần đến ECMO. Chúng tôi hy vọng sẽ có thêm các nghiên cứu về tiêu sợi huyết trong COVID-19 để đánh giá và nhận định các bệnh nhân phù hợp để sử dụng liệu pháp này.
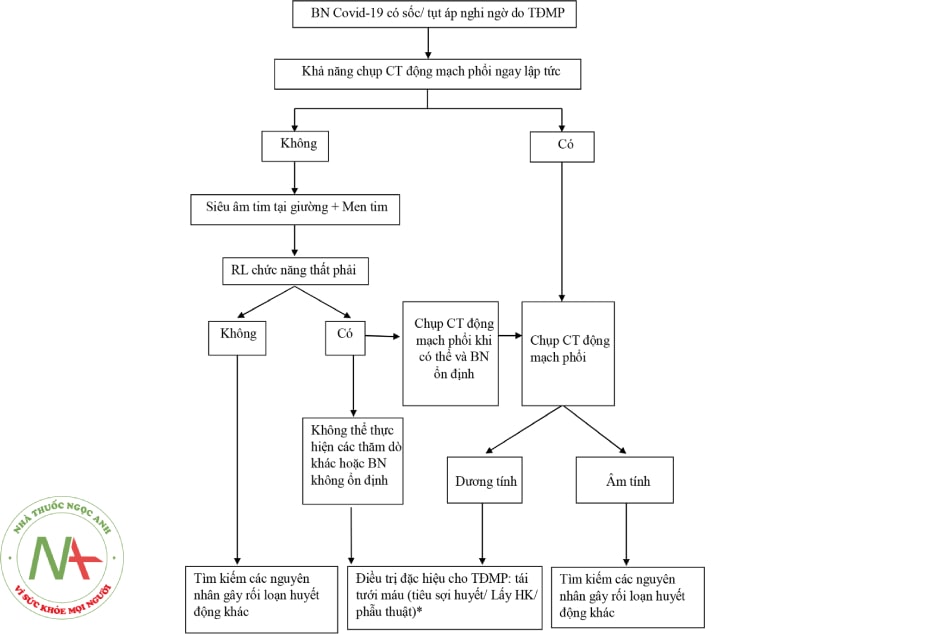
(*) Quyết định tiêu sợi huyết trong trường hợp rối loạn chức năng thất phải mới xuất hiện (mà chưa được chụp cắt lớp vi tính xác định thuyên tắc động mạch phổi): Cần hết sức cân nhắc, do giãn thất phải có thể do nguyên nhân tổn thương phổi gây tăng áp động mạch phổi, đồng thời tỷ lệ bệnh nhân tử vong cao ở bệnh nhân sau tiêu sợi huyết.
Rối loạn chức năng thất phải: thất phải giãn, tỷ lệ đường kính thất phải/thất trái (RV/LV) > 1, áp lực động mạch phổi tăng.
Chú thích: BN: Bệnh nhân; HK: Huyết khối; TĐMP: Tắc động mạch phổi; CT: Cắt lớp vi tính.
Chỉ định tiêu sợi huyết
- Tắc động mạch phổi cấp nguy cơ cao (có sốc/tụt huyết áp).
- Tắc động mạch phổi cấp nguy cơ trung bình cao (không có sốc/tụt huyết áp nhưng có rối loạn chức năng thất phải).
- Ngoài ra, các chỉ định khác của tiêu sợi huyết cũng tương tự ở các bệnh nhân không COVID-19, bao gồm: huyết khối tĩnh mạch sâu đe dọa chi cấp tính (limb-threatening DVT), nhồi máu não cấp tính và nhồi máu cơ tim cấp tính.
Chống chỉ định của tiêu sợi huyết
- Chống chỉ định tuyệt đối:
- Đang chảy máu trong / chảy máu tạng rõ ràng
- Tiền sử xuất huyết nội sọ
- Ung thư não rõ ràng, dị dạng động tĩnh mạch, hoặc phình mạch não
- Đột quỵ không xuất huyết trong vòng 3 tháng
- Chấn thương sọ não quan trọng trong vòng 3 tháng
- Mổ nội sọ hoặc nội tủy trong vòng 3 tháng
- Tăng huyết áp nặng không kiểm soát được (thường không gặp trong TĐMP)
- Nghi ngờ bóc tách động mạch chủ
- Chống chỉ định tương đối:
- Mới chảy máu trong
- Mới phẫu thuật lớn hoặc sinh thiết tạng
- Mới bị chấn thương, kể cả ngừng tuần hoàn (đặc biệt nếu kéo dài)
- Mới chọc động mạch tại các vị trí khó ép
- Tiểu cầu < 100 G/l
- Bệnh võng mạc đái tháo đường hoặc xuất huyết các vị trí khác của mắt
- Có thai
- Viêm màng ngoài tim cấp
- Viêm nội tâm mạc
- Rối loạn đông máu quan trọng
- Đang dùng thuốc chống đông kéo dài liều điều trị hoặc hiệu quả
- Tuổi cao (ví dụ: trên 75 tuổi)
- Tiền sử đã dùng streptokinase trước đây (trên 5 năm) hoặc tiền sử dị ứng thuốc này
- Tất cả các tình trạng mà chảy máu có thể khó kiểm soát
Quy trình dùng thuốc tiêu sợi huyết
- Kiểm tra kỹ các chống chỉ định. Hội chẩn với chuyên gia nếu có thể.
- Kiểm tra các vị trí có thể chảy máu, đặc biệt các đường truyền phải đảm bảo chắc chắn và phải ở các vị trí có thể ép được.
- Dừng heparin ngay trước khi truyền thuốc tiêu sợi huyết.
- Liều thuốc tiêu sợi huyết: thống nhất phác đồ dùng liều thấp alteplase 0,6 mg/kg cân nặng (tối đa 50 mg) truyền tĩnh mạch trong vòng 15 phút.
- Theo dõi sát tình trạng chảy máu, dùng lại heparin sau khi truyền thuốc tiêu sợi huyết 30 phút, duy trì aPTT bệnh/chứng 1,5 đến 2,3.
4.4. Các biện pháp tái tưới máu động mạch phổi khác
Các biện pháp tái tưới máu động mạch phổi khác bao gồm:
- Can thiệp nội mạch huyết khối cơ học
- Phẫu thuật lấy huyết khối
Chỉ định:
- Bệnh nhân tắc động mạch phổi cấp nguy cơ cao, có chỉ định tái tưới máu động mạch phổi nhưng có chống chỉ định với sử dụng tiêu sợi huyết.
Trong điều kiện nguồn lực hạn chế khi điều trị bệnh nhân COVID-19, các biện pháp này không thực hiện ở tất cả các cơ sở điều trị mà chỉ có thể thực hiện ở các trung tâm lớn có phòng can thiệp/phòng mổ và bác sĩ chuyên khoa sẵn sàng. Việc di chuyển bệnh nhân đến các cơ sở khác nhau cũng tiềm ẩn nhiều rủi ro và bất lợi cho bệnh nhân, vì vậy cần phải hội chẩn với các chuyên gia trước khi đưa ra quyết định, tối ưu là hội chẩn với đội ứng phó với tắc động mạch phổi đã đề cập ở trên (PERT), có thể sử dụng TELE-ICU để cho quyết định nhanh nhất. Trong phạm vi khuôn khổ của cuốn sách, chúng tôi không đề cập cụ thể đến quy trình và phương thức kĩ thuật của các biện pháp này.
4.5. Trao đổi oxy qua màng ngoài cơ thể (ECMO)
TĐMP cấp huyết động không ổn định cũng là một chỉ định được xem xét của ECMO khi bệnh nhân rối loạn huyết động hoặc suy hô hấp nặng, không đáp ứng với tiêu sợi huyết và chống đông trong khi chưa thể/không thể can thiệp lấy huyết khối cơ học hoặc phẫu thuật. Trong TĐMP cấp thì phương thức ECMO được lựa chọn là VA-ECMO, phương thức này hỗ trợ tốt cho việc đảm bảo huyết động đồng thời làm giảm áp lực lên thất phải giúp cải thiện tình trạng suy thất phải của bệnh nhân. Tuy nhiên đây là biện pháp kỹ thuật cao, xâm lấn lớn, chi phí cao cho nên cần phải hội chẩn với các chuyên gia để đưa ra quyết định phù hợp.
4.6. Đặt lưới lọc (filter) tĩnh mạch chủ dưới
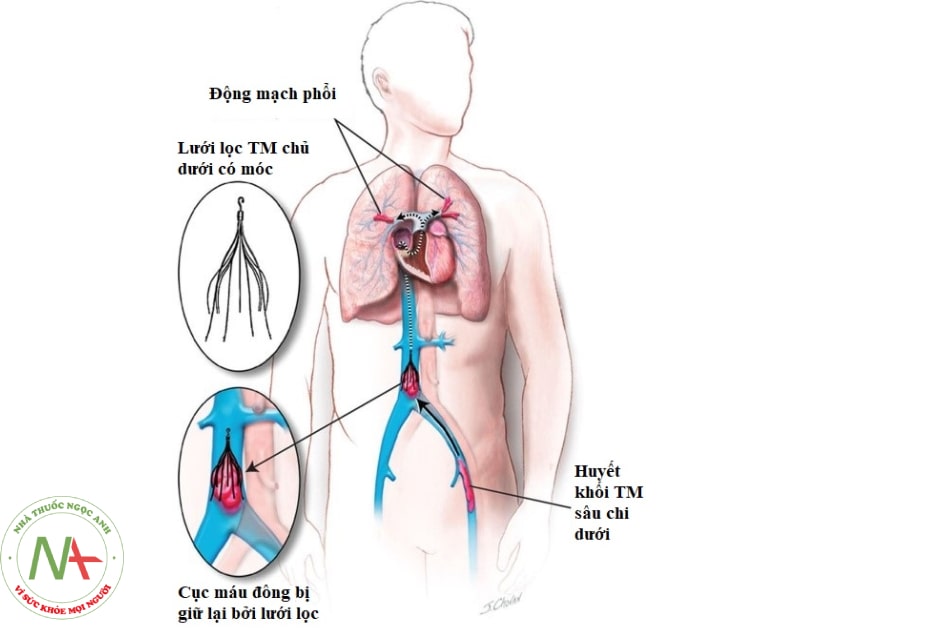
Chỉ định:
- TĐMP cấp có chống chỉ định với thuốc chống đông (rối loạn đông máu nặng, chảy máu tiến triển)
- TĐMP tái phát dù đang dùng thuốc chống đông liều tối ưu.
Đặt lưới lọc tĩnh mạch chủ dưới là một thủ thuật xâm lấn với mục đích ngăn chặn cục máu đông di chuyển từ huyết khối tĩnh mạch sâu chi dưới gây thuyên tắc động mạch phổi. Thủ thuật này không làm tiêu biến cục máu đông vì vậy không được đặt một cách thường quy cho bệnh nhân tắc động mạch phổi cấp. Ở bệnh nhân COVID-19 chưa có TĐMP nhưng có nhiều huyết khối tĩnh mạch sâu chi dưới, thủ thuật này có thể được cân nhắc để ngăn ngừa nguy cơ thuyên tắc động mạch phổi. Lưới lọc tĩnh mạch chủ dưới không thể thay thế được cho việc sử dụng chống đông, nên ngay khi điều kiện cho phép, tiến hành cho bệnh nhân sử dụng thuốc chống đông máu.
Lưới lọc tĩnh mạch chủ dưới có thể được đặt vĩnh viễn hoặc tạm thời (có thể rút ra được khi cần). Loại lưới lọc có thể rút ra được khuyến cáo dùng cho bệnh nhân có thuyên tắc huyết khối tĩnh mạch do căn nguyên có thể đảo chiều được (có thể chữa khỏi hoàn toàn) ví dụ như trong trường hợp của COVID-19. Tuy nhiên, chi phí của loại này cũng sẽ cao hơn. Tùy từng điều kiện thực tế mà có thể lựa chọn loại lưới lọc phù hợp.
5. NHẬN BIẾT VÀ XỬ TRÍ BIẾN CHỨNG LIÊN QUAN ĐẾN CHỐNG ĐÔNG Ở BỆNH NHÂN COVID-19
5.1. Biến chứng chảy máu lớn
Biến chứng chảy máu lớn bao gồm chảy máu não, chảy máu sau phúc mạc, và bất kỳ tình trạng chảy máu nào có thể dẫn tới tử vong, nhập viện, hoặc phải truyền máu.
a. Các bước xử trí biến chứng chảy máu do quá liều chống đông
- Ngừng ngay thuốc chống đông đang dùng, xác định thời gian và liều dùng cuối cùng.
- Sử dụng chất trung hòa hoặc đối kháng nếu có.
- Điều trị hỗ trợ: bù khối lượng tuần hoàn, truyền chế phẩm máu nếu có chỉ định.
- Tìm vị trí chảy máu, xét cầm máu tại chỗ nếu thuận lợi.
Chiến lược cụ thể với từng loại chống đông:
- Chảy máu do heparin không phân đoạn: Trung hòa bằng protamine sulfate (1 mg protamine trung hòa được 100 UI heparin). Thời gian bán hủy của heparin từ 30-60 phút. Nếu không định lượng được heparin trong máu, chỉ cần tiêm tĩnh mạch chậm 25-50 mg protamine, sau đó kiểm tra lại
- Chảy máu do heparin TLPTT: Tỷ lệ chảy máu do heparin TLPTT rất thấp. Trong trường hợp chảy máu nặng, có thể trung hòa bằng protamine sulfate. Nếu heparin TLPTT (enoxaparin) được dùng trong vòng 8 giờ, liều protamine là 1 mg cho 1 mg enoxaparin; nếu quá 8 giờ, liều protamine là 0,5 mg cho 1 mg enoxaparin.
- Chảy máu do fondaparinux: Không trung hòa được bằng protamine sulfate do fondaparinux không gắn kết với chất này.
- Chảy máu do kháng vitamin K: Xử trí dựa vào kết quả theo dõi
- INR < 5, không chảy máu: giảm liều kháng vitamin K, hoặc ngừng 1 liều.
- INR 5-9, không chảy máu: ngừng 1-2 liều kế tiếp, sau đó giảm liều theo INR; hoặc ngừng 1 liều + uống 1-2,5 mg vitamin
- INR ≥ 9, không chảy máu: ngừng kháng vitamin K + uống 2,5-5 mg Vitamin
- INR bất kỳ và chảy máu nặng: tiêm 10 mg vitamin K đường tĩnh mạch, truyền huyết tương tươi đông lạnh hoặc phức hợp yếu tố đông máu.
- Chảy máu do thuốc chống đông thế hệ mới: Hiện tại ở Việt Nam chỉ có dabigatran là có thuốc đối kháng đặc hiệu, đó là idarucizumab (PraxbindTM), tuy nhiên giá thành còn cao và chỉ có ở một số bệnh viện lớn. Các biện pháp khác gồm: than hoạt (nếu mới dùng thuốc < 4 giờ), lọc máu (với dabigatran), truyền yếu tố VIIa tái tổ hợp, phức hợp prothrombin đông đặc (PCC), FEIBA (Factor Eight Inhibitor Bypassing Agent).
b. Thời điểm bắt đầu lại điều trị chống đông sau biến chứng chảy máu
Tất cả bệnh nhân sau xử trí biến chứng chảy máu do thuốc chống đông đều phải được đánh giá nguy cơ chảy máu tái phát/lan rộng và nguy cơ thuyên tắc huyết khối tĩnh mạch tiến triển/tái phát, từ đó lựa chọn phương pháp dự phòng trong thời gian ngừng chống đông (bơm hơi áp lực ngắt quãng, lưới lọc tĩnh mạch chủ dưới), cũng như thời điểm bắt đầu lại thuốc chống đông.
- Chảy máu nội sọ: Cân nhắc thời gian dùng lại chống đông với từng bệnh nhân cụ thể, đánh giá nguy cơ chảy máu lại, hoặc lan rộng (lâm sàng, vị trí và kích thước ổ chảy máu). Thời gian dùng lại chống đông trung bình từ 7-14 ngày.
- Chảy máu tiêu hóa: Cân nhắc thời gian dùng lại chống đông dựa vào vị trí, mức độ nặng của chảy máu tiêu hóa (theo phân loại Forrest), và loại chống đông được sử dụng trước đó.
5.2. Biến chứng giảm tiểu cầu do heparin (HIT)
Là tình trạng rối loạn tiểu cầu sau khi điều trị bằng heparin, với số lượng tiểu cầu giảm (< 150.000/µl, hoặc giảm ≥ 50% so với trị số trước điều trị), có thể kèm theo biến chứng huyết khối động mạch và/hoặc tĩnh mạch.
Thời điểm xét nghiệm tiểu cầu: mỗi 2-3 ngày, kể từ ngày thứ 4 đến ngày thứ 14 tới khi dừng heparin.
Chẩn đoán: Đánh giá nguy cơ bị HIT bằng thang điểm 4T.
Bảng 16.12. Thang điểm 4T đánh giá nguy cơ HIT
| Thông số | 2 | 1 | 0 |
| Tiểu cầu | Giảm > 50% và mức tiểu cầu thấp nhất> 20G/L và không phẫu thuật trong vòng 3 ngày gần đây | Giảm 30–50% hoặc mức tiểu cầu thấp nhất từ 10–19 G/L hoặc giảm > 50% (nhưng
có phẫu thuật trong 3 ngày gần đây) |
Giảm < 30%
hoặc mức tiểu cầu thấp nhất < 10 G/L |
| Thời điểm
giảm tiểu cầu từ khi dùng heparin |
Từ ngày 5 – 10 hoặc ≤ 1 ngày (nếu sử dụng heparin trong vòng 30 ngày) | Từ ngày 5–10 nhưng không rõ số lượng tiểu cầu ban đầu hoặc giảm
tiểu cầu sau ngày thứ 10; hoặc giảm ≤ 1 ngày (nếu dùng heparin trong vòng 31–100 ngày) |
Thời điểm
giảm ≤ 4 ngày (không dùng heparin trong vòng 100 ngày) |
| Huyết khối | Huyết khối mới, hoại tử da, phản ứng toàn thân sau bolus heparin | Huyết khối tái phát hoặc tiến triển; tổn thương da không hoại tử, nghi ngờ huyết khối (chưa rõ ràng) | Không |
| Nguyên nhân khác của giảm tiểu cầu | Không có nguyên nhân khác rõ ràng của giảm tiểu cầu | Nguyên nhân khác có thể rõ ràng | Nguyên nhân khác đã rõ |
| Tổng điểm:
– Từ 0-3 điểm: Nguy cơ thấp – Từ 4-5 điểm: Nguy cơ trung bình – Từ 6-8 điểm: Nguy cơ cao |
|||
Xét nghiệm: Kháng thể kháng PFF4-heparin ở những bệnh nhân có xác suất lâm sàng cao hoặc trung bình bị HIT.
Điều trị:
- Ngừng mọi điều trị heparin với bệnh nhân có nguy cơ cao hoặc trung bình.
- Hội chẩn chuyên khoa huyết học và sử dụng thuốc chống đông thay thế: Nhóm ức chế trực tiếp thrombin (argatroban, bivalirudin) hoặc heparinoid (daparanoid, fondaparinux). Liều fondaparinux giống như liều điều trị thuyên tắc huyết khối tĩnh mạch.
- Trì hoãn dùng kháng vitamin K tới khi số lượng tiểu cầu đã hồi phục.
- Tránh truyền tiểu cầu.
TÀI LIỆU THAM KHẢO
- Pascarella, et al. COVID-19 diagnosis and management: a comprehensive review. J. Intern. Med. 288, 192–206 (2020).
- Aldo Bonaventura, A. et al. Endothelial dysfunction and immunothrombosis as key pathogenic mechanisms in COVID -19. Nature (2021)
- Ranucci, et al. The procoagulant pattern of patients with COVID-19 acute respiratory distress syndrome. J. Thromb. Haemost. 18, 1747–1751 (2020).
- Berlin, A., Gulick, R. M. & Martinez, F. J. Severe COVID-19. N. Engl. J. Med. 383, 2451–2460 (2020).
- Mehta, et al. COVID-19: consider cytokine storm syndromes and immunosuppres- sion. Lancet 395, 1033–1034 (2020).
- Xu, Z. et al. Pathological findings of COVID-19 associated with acute respiratory dis- tress syndrome. Lancet Respir. Med. 8, 420–422 (2020).
- Martinelli, et al. A relative ADAMTS13 deficiency supports the presence of a second- ary microangiopathy in COVID 19. Thromb. Res. 193, 170–172 (2020).
- Paar, et al. Anti-coagulation for COVID-19 treatment: both anti-thrombotic and an- ti-inflammatory? J. Thromb. Thrombolysis 51, 226–231 (2021).
- Zhang, et al. Coagulopathy and antiphospholipid antibodies in patients with COVID-19. N. Engl. J. Med. 382, e38 (2020).
- Luis, et al. Coronavirus Disease 2019-Associated Thrombosis and Coagulopathy: Review of the Pathophysiological Characteristics and Implications for Antithrombotic Management. Am Heart Assoc. 3, 2- 10 (2021).
- Mukul, A. et al. Hemostatic Abnormalities in COVID-19: An Update. Hematol Blood Transfus.36 (4):616-626 (2020)
- Kadir et al, COVID-19 coagulopathy in pregnancy: Critical review, preliminary recom- mendations, and ISTH registry – Communication from the ISTH SSC for Women’s J Thromb Haemost.18:3086-3098(2020)
- Tang, N. et al. Anticoagulant treatment is associated with decreased mortality in se- vere coronavirus disease 2019 patients with J Thromb Haemost. 18:1094- 1099 (2020)
- Chandra, A et al. Anticoagulation in COVID -19: current concepts and controversies. Postgrad Med J.0:1-8 (2021).
- Al Samkari, H et Thrombosis, Bleeding, and the observational effect of early thera- peutic anticoagulation on survival in critically III patients with COVID-19. Ann intern Med. 174:622 (2021).
- Moores L., Trischler , Brosnahan S., et al. Prevention, Diagnosis, and Treatment of VTE in Patients with Coronavirus Disease 2019. CHEST Guideline and Expert Panel Re- port (2020) CHEST; 158 (3): 1143 – 1163
- Hướng dẫn chẩn đoán và điều trị COVID-19. Bộ Y Tế.
- Rosovky P., Grodzin C., Channick R., et al. Diagnosis and Treatment of Pulmonary Embolism During the Coronavirus Disease 2019 Pandemic. A Position Paper From the National PERT consortium (2020) CHEST; 158 (6): 2590 – 2601.
- Cuker , Tseng E.K., Nieuwlaat R., et al. American Society of Hematology 2021 guide- lines on the use of anticoagulation for thromboprophylaxis in patients with COVID-19 (2021) Blood Advances; 5(3): 872 – 888.
- Miro , Jimenez S., Mebazaa A., et al. Pulmonary embolism in patients with COVID-19: incidence, risk factors, clinical characteristics, and outcome (2021) European Heart Jour- nal; 42: 3127 – 3142.
- Konstatinides V., Meyer G., Becattini C., et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the Eu- ropean Respiratory Society (2020) European Heart Journal; 41: 543 – 603.
- Hoàng Bùi Hải, Đỗ Doãn Lợi, Nguyễn Đạt Anh (2013). Nghiên cứu chẩn đoán và điều trị tắc động mạch phổi cấp, Luận án tiến sĩ y học
- Hoang B.H., Do P., Le D.L., et al. Safety, Efficacy of an Accelerated Regimen of Low- Dose Recombinant Tissue-Type Plasminogen Activator for Reperfusion Therapy of Acute Pulmonary Embolism (2021) Clinical and Applied Thrombosis/Hemostasis (2021).Vol- ume 27: 1-5. DOI: 10.1177/10760296211037920.
- Khuyến cáo về chẩn đoán, điều trị và dự phòng thuyên tắc huyết khối tĩnh mạch (2016) Hội tim mạch học Việt
- Bikedli B., Madhavan V., Jimenez D., et al. COVID-19 and Thrombotic or Throm- boembolic Disease: Implications for prevention, Antithrombotic Therapy, and Follow-up. JACC state-of-the-Art review. (2020) JACC; 75: 2950 – 73.
- The REMAP-CAP, ACTIV-4a, and ATTACC Therapeutic Anticoagulation with Heparin in Critically Ill Patients with Covid-19 (2021) New England Journal of Medi- cine; 385:777-789 DOI: 10.1056/NEJMoa2103417.
