Bệnh truyền nhiễm
Viêm phúc mạc nhiễm khuẩn tiên phát: Nguyên nhân, triệu chứng, chẩn đoán và hướng dẫn điều trị theo BMJ
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhathuocngocanh.com – Bài viết Viêm phúc mạc nhiễm khuẩn tiên phát. Để tải file PDF, mời các bạn click vào link ở đây
Tóm tắt
◊ Một trong những tình trạng nhiễm trùng thường gặp nhất ở bệnh nhân bị xơ gan và phổ biến nhất ở bệnh nhân mắc bệnh gan giai đoạn cuối.
◊ Các triệu chứng chính bao gồm đau bụng, sốt, nôn, rối loạn ý thức và xuất huyết tiêu hóa. Tuy nhiên, bệnh nhân thường ít biểu hiện triệu chứng và thậm chí là không biểu hiện triệu chứng.
◊ Cần xét nghiệm đếm số lượng tế bào và nuôi cấy dịch cổ trướng. Xét nghiệm dịch cổ trướng bằng que thử esterase bạch cầu (dùng que thử nước tiểu) tại giường bệnh giúp chẩn đoán nhanh viêm phúc mạc nhiễm khuẩn tiên phát (VPMNKTP); que thử có độ nhạy cảm cao có thể dùng để loại trừ VPMNKTP.
◊ Được xác định bằng số lượng bạch cầu trung tính tuyệt đối trong dịch cổ trướng >250 tế bào/mm³, bất kể nuôi cấy có mọc hay không.
◊ Phác đồ kháng sinh theo kinh nghiệm bao gồm cefotaxime, ceftriaxone, fluoroquinolone, và ampicillin/sulbactam.
Tuy nhiên, phải cân nhắc khi lựa chọn kháng sinh do đã có những báo cáo cho thấy có sự gia tăng đề kháng kháng sinh, bao gồm cả kháng cephalosporin thế hệ thứ ba và fluoroquinolone.
◊ Bệnh nhân bị sepsis, tiền sử điều trị dự phòng bằng fluoroquinolone, VPMNKTP mắc phải tại bệnh viện, hoặc tiền sử bị nhiễm các vi khuẩn kháng thuốc có thể cần phải sử dụng các kháng kinh nghiệm có phổ bao phủ được các vi khuẩn kháng thuốc.
◊ Albumin được chỉ định trong điều trị bệnh nhân bị rối loạn chức năng thận.
◊ Dùng kháng sinh dự phòng kéo dài được chỉ định ở bệnh nhân có nồng độ protein trong dịch cổ trướng <15 g/L (<1,5 g/dL) hoặc trước đây từng bị VPMNKTP. Ciprofloxacin, trimethoprim/sulfamethoxazole, hoặc rifaximin có thể hiệu quả cho việc phòng ngừa ban đầu hoặc phòng ngừa thứ phát sau VPMNKTP.
Thông tin cơ bản
Định nghĩa
Viêm phúc mạc nhiễm khuẩn tiên phát (VPMNKTP) là tình trạng nhiễm trùng dịch cổ trướng, không phải do tình trạng viêm nhiễm hoặc bệnh ngoại khoa khác đang diễn ra trong ổ bụng. Đây là một trong những tình trạng nhiễm khuẩn thường gặp nhất ở bệnh nhân bị xơ gan.
Dịch tễ học
Các nghiên cứu đã chứng minh tỷ lệ hiện mắc VPMNKTP là 12% ở bệnh nhân bị cổ trướng được nhập viện vì xơ gan mất bù, 18% ở những người được nhập viện vì bệnh não gan, và 10% đến 14% ở những người được nhập viện vì xuất huyết tiêu hóa cấp tính.[4] [5] [6] [7] Trong số các bệnh nhân ngoại trú không có triệu chứng được chọc dịch ổ bụng, tỷ lệ hiện mắc là 2,5%.[8] [9] Không có dữ liệu chỉ ra sự khác biệt về tỷ lệ hiện mắc VPMNKTP theo giới tính hoặc chủng tộc so với tỷ lệ hiện mắc trên bệnh nhân cổ trướng.
Mặc dù VPMNKTP có thể xảy ra trên bệnh nhân cổ trướng do khối u ác tính, nhưng ít gặp hơn nhiều so với trên bệnh nhân cổ trướng do bệnh gan giai đoạn cuối.
Gần đây, đã có những thay đổi trong dịch tễ học của căn nguyên gây VPMNKTP; đặc biệt, đã có gia tăng tỷ lệ nhiễm trùng do cầu khuẩn gram dương. Các nghiên cứu cho thấy những thay đổi này liên quan đến thời gian nằm viện kéo dài của bệnh nhân mắc bệnh gan giai đoạn cuối và sử dụng thuốc kháng sinh dự phòng sau đợt VPMNKTP đầu tiên, có thể là do các thuốc dự phòng thường dùng có hoạt tính vượt trội đối với vi khuẩn gram âm so với vi khuẩn gram dương.[10]
Tuy nhiên, vi khuẩn gram âm vẫn là tác nhân gây bệnh thường gặp nhất trong VPMNKTP.
Bệnh căn học
Sinh bệnh học của VPMNKTP là do nhiễm trùng dịch cổ trướng. Hơn 92% số ca bệnh VPMNKTP là đơn vi khuẩn.[12] Trường hợp do đa vi khuẩn gặp nhiều hơn trong viêm phúc mạc thứ phát.
Tuy nhiên, vi khuẩn gram âm vẫn là tác nhân gây bệnh thường gặp nhất trong VPMNKTP. Tuy nhiên, đã có những thay đổi gần đây trong dịch tễ học của căn nguyên gây VPMNKTP. Đặc biệt, đã có sự gia tăng tỷ lệ nhiễm trùng do cầu khuẩn gram dương. Các nghiên cứu cho thấy những thay đổi này liên quan đến thời gian nằm viện kéo dài của bệnh nhân mắc bệnh gan giai đoạn cuối và sử dụng thuốc kháng sinh dự phòng sau đợt VPMNKTP đầu tiên. Thuốc kháng sinh dự phòng thường có phổ trên các vi khuẩn gram âm tốt hơn các vi khuẩn gram dương.[10] [11] [13] Có một báo cáo ca bệnh nhiễm Klebsiella pneumoniae kháng carbapenem, đã gây ra mối quan ngại đặc biệt về nguy cơ lan rộng kháng thuốc do các yếu tố di truyền có khả năng di động của nó.[14]
Các tác nhân gây bệnh thường gặp nhất là:[15] [16] [17]
- Escherichia coli (được báo cáo ở 39%-61% ca bệnh)
- Staphylococcus aureus (3%-12%)
- Streptococcus pneumoniae (2%-11%)
- Enterococcus faecalis (4%-17%)
- Klebsiella pneumoniae (4%-20%)
- Pseudomonas aeruginosa (3%-9%). Các tác nhân ít gặp hơn là:
- Proteus species
- Acinetobacter species
- Citrobacter freundii
- Bacteroides fragilis
- Aeromonas hydrophila
- Listeria monocytogenes[18]
- Vibrio vulnificus.
Vi khuẩn hiếm gặp được ghi nhận trong các báo cáo ca bệnh bao gồm:
- Haemophilus influenzae, không thể phân týp[19] [20]
- Haemophilus parainfluenzae[21]
- Neisseria meningitidis[22]
- Salmonella typhimurium[23]
- Salmonella paratyphi A[24]
- Leclercia adecarboxylata[25]
- Leminorella grimontii[26]
- Aerococcus urinae[27]
- Gemella morbillorum[28]
- Actinomyces species[29]
- Streptococcus salivarius[30]
- Ochrobactrum anthropi[31]
- Arcanobacterium haemolyticum[32]
- Cryptococcus neoformans (thậm chí ở bệnh nhân âm tính với HIV)[33] [34]
- Coccidioides immitis[35]
- Candida species[36]
- Brucella species[37]
- Enterococcus hirae[38]
- Enterococcus gallinarum[39]
- Enterococcus casseliflavus[39]
- Bordetella bronchiseptica[40]
- Plesiomonas shigelloides.[41]
Streptococcus viridans thường gây tạp nhiễm trong nuôi cấy dịch ổ bụng.[42] Tuy nhiên, nó cũng đã được xác định là căn nguyên gây bệnh trong các nghiên cứu khác.[43] [44]
Sinh lý bệnh học
VPMNKTP được cho là do vi khuẩn lan truyền theo đường máu rồi sau đó xâm nhập vào dịch cổ trướng. Nguồn gốc vi khuẩn có thể được phân loại thành đường ruột (thường gặp hơn) và không phải đường ruột (ít gặp hơn).
Với các nguồn gốc đường ruột, có hiện tượng vi khuẩn chuyển dịch từ hệ vi khuẩn chí đường ruột sang các hạch bạch huyết ở mạc treo ruột và từ đó đến dòng máu. Sinh lý bệnh học của xơ gan mở đường cho sự xâm nhập này và làm suy yếu khả năng chống nhiễm trùng sau đó. Sự dịch chuyển của vi khuẩn được cho là liên quan đến nhiều cơ chế được tìm thấy ở những bệnh nhân bị xơ gan tiến triển:[45]
- Suy giảm chức năng hệ võng-nội mô của gan
- Sự phát triển quá mức của vi khuẩn đường ruột, có thể là do giảm nhu động ruột gây ra
- Ứ máu tĩnh mạch do tăng áp lực tĩnh mạch cửa, gây tăng tính thấm ruột đối với các vi khuẩn đường ruột.
VPMNKTP đôi khi do các vi khuẩn không thuộc hệ vi khuẩn chí đường ruột. Trong những trường hợp như vậy, nguồn gốc vi khuẩn được cho là do nhiễm trùng hoặc thủ thuật ngoài ruột, chẳng hạn như:
- Nhiễm trùng đường hô hấp
- Nhiễm trùng đường tiết niệu
- Thủ thuật xâm lấn (ví dụ: nội soi tiêm xơ trong giãn tĩnh mạch thực quản, kết hợp với tỷ lệ vãng khuẩn huyết từ 5-30%;[46] [47] đặt ống thông tĩnh mạch trung tâm; đặt ống thông tiết niệu; chọc dịch ổ bụng; bắc cầu cửa-chủ trong gan qua tĩnh mạch cảnh).
Sau khi vi khuẩn lây lan theo đường máu đến dịch cổ trướng, các bổ thể trong dịch ổ bụng có thể bảo vệ khỏi nhiễm trùng. Tuy nhiên, nhiều bệnh nhân xơ gan có nồng độ protein trong cổ trướng thấp, tương quan với giảm hoạt tính opsin và gây ra nhiễm trùng.[48]
Phân loại
International Ascites Club[1]
- Viêm phúc mạc nhiễm khuẩn tiên phát (VPMNKTP)
- Xác định bởi số lượng bạch cầu trung tính tuyệt đối (ANC) >250 tế bào/mm³.
- Do khó khăn trong nuôi cấy mầm bệnh, các tiêu chí không đòi hỏi kết quả nuôi cấy dương tính, mặc dù một số tác giả khởi thảo đã sử dụng tiêu chí này như một phần của chẩn đoán VPMNKTP.
- Cổ trướng bạch cầu trung tính nuôi cấy âm tính (CNNA)
- Xác định bởi ANC >250 tế bào/mm³, nuôi cấy âm tính, được coi là một thể của VPMNKTP.
- Các nghiên cứu đã thống kê tỷ lệ tử vong ngắn hạn và dài hạn là tương tự nhau ở bệnh nhân bị cổ trướng bạch cầu trung tính nuôi cấy âm tính và VPMNKTP.[2] [3]
- Nhiễm trùng dịch cổ trướng
- Bệnh nhân phải đáp ứng tất cả các tiêu chí sau đây: nuôi cấy dịch cổ trướng dương tính; ANC <250 tế bào/ mm³; và không có bằng chứng về nhiễm trùng toàn thân hoặc khu trú.
Phòng ngừa
Ngăn ngừa sơ cấp
Nồng độ protein trong dịch cổ trướng thấp (<15 g/L [<1,5 g/dL]) đã được xác định là yếu tố nguy cơ cho sự phát triển VPMNKTP. Các nghiên cứu đã cho thấy rằng dùng thuốc kháng sinh dự phòng đường uống trong phân nhóm bệnh nhân này làm giảm tỷ lệ mắc VPMNKTP giai đoạn đầu và nhiễm trùng do vi khuẩn khác, và dẫn đến giảm tỷ lệ tử vong.2[A]Evidence Các bài tổng quan hệ thống của các nghiên cứu này cho thấy có nhiều phương pháp khác nhau. Một nghiên cứu đã xem xét lợi ích của biện pháp dự phòng tiên phát bằng thuốc kháng sinh ở những bệnh nhân có nồng độ protein dịch cổ trướng thấp (<15 g/L [<1,5 g/dL]), cùng với yếu tố nguy cơ khác của VPMNKTP (suy gan tiến triển, suy giảm chức năng thận hoặc natri máu ≤130 mmol/L). Bệnh nhân được chọn ngẫu nhiên để dùng norfloxacin hàng ngày có mức tái phát VPMNKTP thấp hơn (7% so với 61%), tiến triển lên hội chứng gan thận thấp hơn (28% so với 41%), và tỷ lệ tử vong 3 và 12 tháng thấp hơn (6% so với 38%, và 40% so với 52%) so với giả dược.[53] While most studies have been done with norfloxacin, which has been discontinued in some countries (including the US), prophylaxis with ciprofloxacin and trimethoprim/sulfamethoxazole has also shown benefit.
Lợi ích tiềm năng của kháng sinh dự phòng phải cân đối với tăng nguy cơ kháng thuốc kháng sinh khi sử dụng lâu dài. Một vài trong số các nguy cơ chưa được tìm hiểu đầy đủ trong các nghiên cứu này bao gồm gia tăng vi khuẩn kháng fluoroquinolone trong nước tiểu hoặc dịch màng bụng ở cả trên bệnh nhân và trong cộng đồng, tác dụng phụ trên cơ xương của fluoroquinolone và xuất hiện nhiễm trùng Clostridium difficile.[57] [58]
Rifaximin, một thuốc kháng sinh đường uống kém hấp thu có hoạt phổ rộng đối với cả vi khuẩn đường ruột gram dương và gram âm, đã được nghiên cứu làm làm thuốc dự phòng tiên phát VPMNKTP. Một nghiên cứu quan sát trên nhóm nhỏ đã chứng minh rằng điều trị bằng rifaximin có liên quan đến việc giảm số lượng bạch cầu trung tính trong dịch ổ bụng và nồng độ nội độc tố trong huyết tương.[59]
Cả hướng dẫn của Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hiệp hội Nghiên cứu Gan Châu Âu (EASL) đều khuyến cáo sử dụng thuốc chẹn beta không chọn lọc để dự phòng VPMNKTP.[60] [61] Phân tích gộp của 3 thử nghiệm ngẫu nhiên, có đối chứng (1 phòng ngừa tiên phát, 2 phòng ngừa thứ phát) cho thấy propranolol và nadolol có thể ngăn ngừa các đợt VPMNKTP mới ở bệnh nhân bị xơ gan và cổ trướng.[62] Ở những bệnh nhân tiến triển VPMNKTP, việc sử dụng liên tục thuốc chẹn beta không chọn lọc có liên quan đến giảm tỷ lệ sống sót (không cấy ghép), tăng thời gian nằm viện, và tỷ lệ hội chứng gan thận và tổn thương thận cấp tính cao hơn.[63] Cần cân nhắc việc dừng thuốc chẹn beta không chọn lọc nếu tiến triển VPMNKTP.
Thuốc ức chế bơm proton (PPI) tạo điều kiện cho sự xâm nhập của vi khuẩn vào ruột, phát triển quá mức và chuyển dịch vào màng bụng, có thể dẫn đến tăng nguy cơ mắc VPMNKTP. Phân tích gộp của 4 nghiên cứu lâm sàng liên quan đã chứng minh mối liên hệ đáng kể giữa việc sử dụng PPI và sự tiến triển của VPMNKTP.[64] Tuy nhiên, các nghiên cứu khác đã thất bại trong việc tìm ra mối liên hệ tích cực giữa việc sử dụng PPI và VPMNKTP.[65] [66] Do dữ liệu mâu thuẫn này, nên cân nhắc cẩn thận khi đưa ra quyết định dùng PPI cho bệnh nhân xơ gan.
Ngăn ngừa thứ cấp
Bệnh nhân đã trải qua một đợt VPMNKTP có nguy cơ tái phát cao; nên bắt đầu thuốc kháng sinh dự phòng lâu dài ở những bệnh nhân này. [60] Điều trị nên tiếp tục cho đến khi hết cổ trướng, bệnh nhân tiến triển nặng hoặc ghép gan diễn ra.[45]
Thuốc kháng sinh dự phòng đã được chứng minh làm giảm tỷ lệ nhiễm trùng (bao gồm cả VMPMNKTP) và tỷ lệ tử vong ở những bệnh nhân xơ gan được nhập viện do xuất huyết tiêu hóa.[60] [132] Fluoroquinolone đã được sử dụng rộng rãi cho mục đích này từ năm 1992, mặc dù cephalosporin cũng đã được sử dụng. Thời gian điều trị thông thường trong các nghiên cứu là 7 ngày.
So với norfloxacin, rifaximin dùng hàng ngày trong 6 tháng làm giảm tái phát VPMNKTP và giảm tỷ lệ tử vong trong một thử nghiệm ngẫu nhiên, có đối chứng trên 262 bệnh nhân bị cổ trướng và bị VPMNKTP trước đó.[133] Phân tích gộp của các nghiên cứu về rifaximin trong dự phòng VPMNKTP tiên phát và thứ phát cho thấy hiệu quả bảo vệ, nhưng chất lượng bằng chứng rất thấp.[134]
Các kiểu đề kháng của vi khuẩn theo khu vực cần được xem xét khi lựa chọn loại kháng sinh thích hợp nhất.
Phân tích gộp của 3 thử nghiệm ngẫu nhiên, có đối chứng (1 phòng ngừa tiên phát, 2 phòng ngừa thứ phát) cho thấy propranolol và nadolol có thể ngăn ngừa các đợt VPMNKTP mới ở bệnh nhân bị xơ gan và cổ trướng.[62] Ở những bệnh nhân tiến triển VPMNKTP, việc sử dụng liên tục thuốc chẹn beta không chọn lọc có liên quan đến giảm tỷ lệ sống sót (không cấy ghép), tăng thời gian nằm viện, và tỷ lệ hội chứng gan thận và tổn thương thận cấp tính cao hơn.[63] Cần cân nhắc việc dừng thuốc chẹn beta không chọn lọc nếu tiến triển VPMNKTP.
Chẩn đoán
Tiền sử ca bệnh
Tiền sử ca bệnh #1
Một bệnh nhân nam 53 tuổi có tiền sử viêm gan C phàn nàn về tình trạng chướng bụng, sốt, nôn và đại tiện phân máu. Ông bị chướng bụng nhiều lần trước đây và đã được chọc dò dịch ổ bụng giúp cải thiện các triệu chứng.
Tiền sử ca bệnh #2
Một phụ nữ 46 tuổi có tiền sử nghiện rượu nhiều năm và có nhiều đợt mắc bệnh não gan trước đây với biểu hiện rối loạn ý thức và bụng chướng nặng.
Cách tiếp cận chẩn đoán từng bước
Các bước chẩn đoán, đầu tiên xác định có hay không cổ trướng, sau đó tìm kiếm các dấu hiệu và triệu chứng phù hợp với kích ứng phúc mạc, và cuối cùng khẳng định thông qua xét nghiệm dịch ổ bụng.
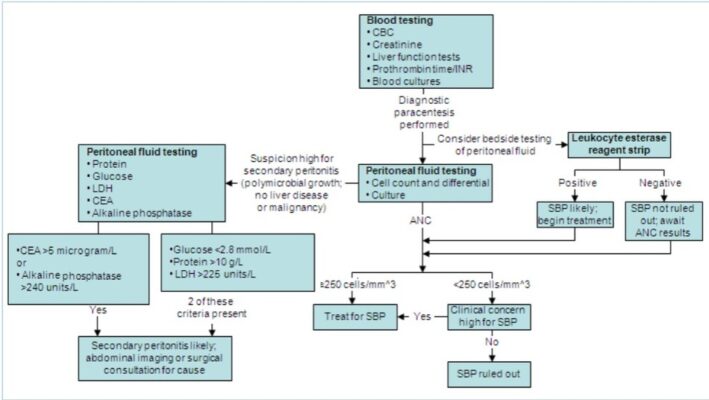
Tiền sử và khám lâm sàng
Bệnh nhân mắc bệnh gan giai đoạn cuối biểu hiện bệnh não gan, xơ gan mất bù, tăng thể tích và/hoặc tần suất cổ trướng, hoặc xuất huyết tiêu hóa có nguy đặc biệt cơ mắc VPMNKTP. Bệnh nhân được nội soi trị liệu gần đây cũng có nguy cơ. Cổ trướng ác tính cũng là yếu tố nguy cơ, mặc dù được mô tả ít hơn so với nguy cơ ở những bệnh nhân mắc bệnh gan giai đoạn cuối.[67]
Sốt và đau bụng là 2 triệu chứng thường gặp nhất. Các triệu chứng khác bao gồm buồn nôn, nôn, nôn ra máu, đại tiện phân máu hoặc phân đen.
Khám lâm sàng gồm sốt hoặc hạ thân nhiệt, hạ huyết áp, nhịp tim nhanh, rối loạn ý thức, và bụng chướng căng và/ hoặc đau khi sờ nắn.
Xét nghiệm dịch ổ bụng là cách duy nhất để xác nhận hoặc loại trừ VPMNKTP; dấu hiệu, triệu chứng và phán đoán lâm sàng ít tin cậy. Trong hai nghiên cứu trên các bệnh nhân bị cổ trướng tại khoa tai nạn và cấp cứu, các bác sĩ đã được yêu cầu đưa ra chẩn đoán nghi ngờ VPMNKTP chỉ dựa trên tiền sử và khám lâm sàng,[68] hoặc liên quan đến đánh giá tính chất dịch chọc dò,[69] trước khi có kết quả về xét nghiệm dịch về. Ở những bệnh nhân có kết quả số lượng bạch cầu trung tính tuyệt đối trong dịch cổ trướng >250 tế bào/mm³, bác sĩ đánh giá trước đó khả năng bị VPMNKTP là ‘không có’ hoặc ‘thấp’ ở 6 trong số 17 bệnh nhân VPMNKTP (3 trong số đó đã tử vong trong lần nhập viện tiếp theo) và 25 trong số 43 bệnh nhân được đánh giá VPMNKTP dựa trên quan sát ban đầu dịch cổ trướng.[68] [69]
Phát hiện cổ trướng
Có một số thao tác khám để phát hiện cổ trướng, bao gồm gõ đục vùng hông, gõ đục vùng thấp, dấu hiệu sóng vỗ và thính chẩn gõ.
Gõ đục vùng hông được thực hiện bằng cách gõ thành bụng, bắt đầu từ khu vực quanh rốn và di chuyển về phía hông. Nếu có cổ trướng, sẽ có sự thay đổi âm từ vang sang đục.
Để phát hiện dấu hiệu gõ đục vùng thấp, cần gõ vùng bụng từ rốn theo chiều ngang và mức ghi nhận mà tại đó tiếng âm vang chuyển sang đục. Bệnh nhân cần nằm ở tư thế nằm ngửa nghiêng sang phải. Gõ vùng bụng một lần nữa, bắt đầu ở phía bên trái và di chuyển về phía bên phải. Nếu có cổ trướng, vị trí mà tại đó âm vang chuyển sang đục sẽ thay đổi so với lần trước.
Cần một người hỗ trợ khi tìm dấu hiệu sóng vỗ. Bệnh nhân ở tư thế nằm ngửa, và mặt xương trụ của bàn tay và cẳng tay của người trợ giúp được đặt dọc theo đường giữa thành bụng trước. Hai tay của người khám sau đó được đặt ở hai bên bụng. Khi một tay đập vào bụng, tay kia sẽ cảm nhận được sóng dịch nếu bệnh nhân bị cổ trướng.
Thính chẩn gõ được thực hiện khi bệnh nhân đứng. Nghe được bắt đầu ngay phía trên khớp mu trong khi gõ từ bờ sườn xuống xương chậu. Thông thường âm thanh sẽ có sự thay đổi từ yên tĩnh sang âm lớn ở bờ xương chậu. Ở bệnh nhân bị cổ trướng, sự thay đổi này xảy ra ở vị trí cao hơn.
Độ nhạy và độ đặc hiệu của các dấu hiệu này đối với cổ trướng rất khác nhau. Gõ thành bụng là có độ nhạy cao nhất trong số các thao tác khám cổ trướng với độ nhạy là 84%.[70]
Siêu âm là xét nghiệm khẳng định cổ trướng. Có tới 25% bệnh nhân được cho là bị cổ trướng theo các kỹ thuật khám lâm sàng, những người tiếp tục siêu âm bụng được phát hiện là không có hoặc có ít cổ trướng.[71] Siêu âm có thể xác định mức độ dịch để quyết định chọc dò và có thể giúp xác định vị trí chọc dò.
Các xét nghiệm ban đầu
Các xét nghiệm chỉ định ban đầu bao gồm:
- Công thức máu, có thể cho biết số lượng bạch cầu tăng; phát hiện thiếu máu có thể gợi ý cho xuất huyết tiêu hóa
- Creatinine, vì hội chứng gan thận có thể xảy ra đồng thời
- Xét nghiệm chức năng gan và lipase, cần được chỉ định nếu nghi ngờ bệnh lý vùng bụng khác
- PT/INR, cần được thực hiện nếu có xuất huyết tiêu hóa hoặc xuất huyết khác
- Cấy máu, có thể hỗ trợ trong việc xác định các vi khuẩn gây bệnh, tuy nhiên cơ hội mọc vi khuẩn từ nuôi cấy dịch màng bụng là rất kém.
Chọc dò dịch để chẩn đoán
Owing to the high prevalence of SBP in hospitalised patients with cirrhosis and ascites, diagnostic paracentesis should be performed on all patients with these 2 conditions. Patients with known ascites who present with GI bleed should also generally be evaluated for SBP. Diagnostic paracentesis has been shown to be safe even in patients with significant coagulopathy or thrombocytopenia, and fresh frozen plasma or platelet transfusion is not indicated before diagnostic paracentesis in patients with coagulopathy.
[VIDEO: Ascitic drainage animated demonstration ]
Xét nghiệm dịch cổ trướng
Các xét nghiệm được chỉ định nhiều nhất đối với dịch ổ bụng để phân tích VPMNKTP là số lượng tế bào và thành phần, nhuộm Gram và nuôi cấy. Nhân viên phòng xét nghiệm cũng có thể đánh giá sơ bộ tính chất dịch.
Số lượng tế bào
- Số lượng bạch cầu trung tính tuyệt đối (ANC) trong dịch màng bụng >250 tế bào/mm³ là tiêu chí được chấp nhận để chẩn đoán VPMNKTP.
- Mặc dù ANC >500 tế bào/mm³ đặc hiệu hơn để chẩn đoán, nhưng nguy cơ bỏ qua VPMNKTP ở bệnh nhân có số lượng ANC từ 250 tế bào/mm³ đến 500 tế bào/mm³ là rất cao.[1] Ngoài ra, mặc dù ANC >250 tế bào/mm³ được chấp nhận là tiêu chí để chẩn đoán, tuy nhiên con số này không dựa trên nghiên cứu lâm sàng đánh giá sự an toàn của việc không điều trị kháng sinh đối với tất cả bệnh nhân có ANC <250 tế bào/mm³. Do đó, nên xem xét điều trị cho bệnh nhân nếu nghi ngờ có nguy cơ cao bị VPMNKTP.
- Đếm tế bào trong dịch cổ trướng bằng phương pháp tự động được xác định là tương đương với phương pháp thủ công.[77] [78] [79]
Nhuộm gram
- Đôi khi giúp xác định sớm vi khuẩn gây bệnh.
- Tuy nhiên, nó chỉ có lợi ích trong 9% đến 11% bệnh nhân bị VPMNKTP, do nồng độ thấp của vi khuẩn gây bệnh trong dịch nhiễm trùng (1 vi khuẩn/mL).[80] Ngoài ra, 50% trường hợp tìm thấy vi khuẩn tạp nhiễm từ da thay vì vi khuẩn gây bệnh.[42]
Nuôi cấy
- Nuôi cấy dịch cổ trướng, ngay cả ở những bệnh nhân có VPMNKTP rõ ràng, cho hiệu quả thấp, do nồng độ vi khuẩn thấp so với nhiễm trùng ở các chất dịch cơ quan khác (ví dụ, nước tiểu).
- Bơm dịch cổ trướng trực tiếp vào chai nuôi cấy máu ở giường bệnh cho thấy hiệu quả tăng đáng kể và nên được khuyến cáo là phương pháp thu thập chuẩn. Tuy nhiên, nuôi cấy vẫn âm tính ở khoảng 50% bệnh nhân có ANC cổ trướng >250 tế bào/mm³.[1] [15]
- Trường hợp mọc nhiều vi khuẩn có thể gợi ý viêm phúc mạc thứ phát. Tính chất dịch
- Các mô tả chủ quan về dịch cổ trướng của kỹ thuật viên phòng xét nghiệm là ‘mờ’, ‘đục’ hoặc ‘có máu’ có độ nhạy cảm từ 72% đến 98% đối với việc phát hiện VPMNKTP.[69] [81]
- Không nên sử dụng “ấn tượng” lâm sàng, bao gồm cả việc đánh giá cảm quan tính chất dịch cổ trướng, để loại trừ chẩn đoán.[69]
Có thể thực hiện các xét nghiệm với dịch cổ trướng bao gồm định lượng protein, glucose, lactate dehydrogenase, kháng nguyên carcinoembryonic và phosphatase kiềm. Mặc dù các xét nghiệm này không sử dụng thường quy trong đánh giá VPMNKTP, nhưng chúng có thể có vai trò trong việc phân biệt VPMNKTP với viêm phúc mạc thứ phát.
Có thể đo pH dịch cổ trướng. pH dịch cổ trướng <7,35 và chênh lệch pH động mạch và pH dịch cổ trướng >0,10 đều kết hợp với nguy cơ cao bị VPMNKTP(Tỷ số dự báo khả năng gần bằng 10).[82] Tuy nhiên, vì ANC được chấp nhận là xét nghiệm tiêu chuẩn để chẩn đoán VPMNKTP, cho nên xét nghiệm này thường không được sử dụng.
Xét nghiệm bằng que thử esterase bạch cầu có độ nhạy cao cho dịch cổ trướng (Periscreen) có thể được sử dụng để loại trừ VPMNKTP. Trong một nghiên cứu đa trung tâm đánh giá 84 mẫu dịch cổ trướng từ 9 bệnh nhân ngoại trú (17 mẫu dịch cổ trướng) và 31 bệnh nhân nội trú (67 mẫu dịch cổ trướng) được chẩn đoán VPMNKTP, xét nghiệm que thử esterase bạch cầu có độ nhạy cảm 92% và độ đặc hiệu 57%.[83]
Xét nghiệm que thử esterase bạch cầu tại giường (giốn như que thử nước tiểu) đã được nghiên cứu trong đánh giá VPMNKTP. Que thử được nhúng vào dịch cổ trướng, và sau 60 đến 120 giây kết quả được phân tích theo thang so màu dành cho loại que thử đó. Hầu hết các nghiên cứu sử dụng màu que cho kết quả dương tính tương ứng với từ 15 (1+) đến 125 bạch cầu/mL (3+). Một phân tích gộp cho thấy độ nhạy cảm nằm trong khoảng từ 45% đến 100% và độ đặc hiệu nằm trong khoảng từ 81% đến 100%.[84]
Độ nhạy cảm thấp cho thấy xét nghiệm que thử esterase bạch cầu tại giường bệnh không phù hợp để loại trừ nhanh VPMNKTP. Tuy nhiên, độ đặc hiệu cao cho thấy nó có vai trò trong chẩn đoán nhanh VPMNKTP, tạo điều kiện cho việc tiến hành nhanh chóng điều trị kháng sinh.
Có thể đo lactoferrin dịch cổ trướng. Nếu tăng cao, nó có độ nhạy cảm 96% và độ đặc hiệu 97% để phát hiện VPMNKTP.[85] Xét nghiệm này không được thực hiện thường quy, nhưng nếu có thể phát triển xét nghiệm tại giường định tính, nó có thể làm giảm đáng kể thời gian chẩn đoán.
Chụp CT bụng
Có thể được xem xét ở bệnh nhân nghi ngờ viêm phúc mạc thứ phát. Có thể phát hiện được khí tự do. Một báo cáo ca bệnh mô tả một bệnh nhân xơ gan, được xác định có nhiễm khuẩn dịch cổ trướng (nuôi cấy dịch cổ trướng dương tính; số lượng bạch cầu trung tính tuyệt đối <250 tế bào/mm³; và không có bằng chứng về nhiễm trùng toàn thân hoặc khu trú), trên phim thấy nhiều quai ruột trướng hơi và khí trong tĩnh mạch màng treo ruột. Bệnh nhân được điều trị với kháng sinh phổ rộng và không bằng phẫu thuật sau đó khỏi bệnh.[86]
Xét nghiệm mới
Elastase bạch cầu hạt (GE) là enzym được giải phóng từ bạch cầu đa nhân (PMN) thoái triển. Một nghiên cứu đã chứng minh rằng, với giá trị ngưỡng 49,5 nanogram/mL, xét nghiệm GE miễn dịch latex có độ nhạy cảm 86% và độ đặc hiệu 98% đối với việc phát hiện VPMNKTP trong dịch cổ trướng. Que thử GE có độ nhạy cảm 93% và độ đặc hiệu 91%.[87]
Các kết quả mâu thuẫn nhau liên quan đến xét nghiệm PCR đối với ADN vi khuẩn trong dịch cổ trướng. Một số nghiên cứu đã chứng minh rằng việc phát hiện ADN vi khuẩn trong dịch cổ trướng phù hợp với các vi khuẩn được phát hiện qua nuôi cấy, và kết hợp với thời gian sống ngắn hơn.[88] [89] Tuy nhiên, một nghiên cứu khác đã chứng minh rằng ADN vi khuẩn được xác định là khác biệt so với kết quả nuôi cấy, và không có mối liên hệ với giảm thời gian sống.[90]
Test kích thích corticotrophin ngắn có thể giúp tiên lượng. Xét nghiệm này đánh giá tình trạng suy thượng thận, đã được xác định là có liên quan đến xơ gan và nhiễm trùng huyết nặng. Trong một nghiên cứu ở các bệnh nhân xơ gan và sepsis, tỷ lệ tử vong ở bệnh nhân suy thượng thận là 81%, so với 37% ở những bệnh nhân không bị suy thượng thận.[91]
Procalcitonin, một marker viêm được tạo ra trong tế bào C của tuyến giáp, đã được chứng minh có liên quan với chẩn đoán VPMNKTP. Một nghiên cứu, sử dụng ngưỡng 0,48 nanogram/mL, cho thấy độ nhạy cảm 95% và độ đặc hiệu 79% đối với chẩn đoán VPMNKTP, mặc dù chẩn đoán VPMNKTP không rõ ràng và dựa trên số lượng bạch cầu đa nhân tuyệt đối trong dịch cổ trướng >250 tế bào/mm³.[92] Một nghiên cứu khác cho thấy độ nhạy cảm 78% và độ đặc hiệu 75% đối với chẩn đoán VPMNKTP sử dụng ngưỡng procalcitonin huyết thanh là 0,42 nanogram/mL.[93] Giá trị ngưỡng 0,61 nanogram/mL có độ nhạy 100% và độ đặc hiệu 92% trong chẩn đoán VPMNKTP có nuôi cấy dương tính.[93] Phân tích gộp của 3 nghiên cứu trước đây cho thấy độ nhạy cảm là 86% và độ đặc hiệu là 80%.[94]
[VIDEO: Venepuncture and phlebotomy animated demonstration ]
Các yếu tố nguy cơ
Mạnh
Trạng thái gan mất bù (thường là xơ gan)
- Ở những bệnh nhân xơ gan tiến triển (tăng tần suất bị cổ trướng căng, xuất huyết tiêu hóa, bệnh não gan), tình trạng phát triển vi khuẩn quá mức trong đường ruột làm tăng nguy cơ lây lan theo đường máu, kết hợp với giảm nồng độ protein trong dịch cổ trướng và giảm hoạt tính opsin để chống lại nhiễm trùng.
Protein dịch cổ trướng/bổ thể thấp
- Thử nghiệm ngẫu nhiên, có đối chứng giả dược phát hiện thấy những bệnh nhân có nồng độ protein cổ trướng <15 g/L (<1,5 g/dL) tăng nguy cơ phát triển VPMNKTP so với những bệnh nhân có nồng độ protein cao hơn.[49] Tuy nhiên, phân tích thuần tập sau đó trên các bệnh nhân nhập viện không thấy lặp lại tình trạng này.[50]
Xuất huyết tiêu hóa
- Ở những bệnh nhân bị cổ trướng nằm viện vì xuất huyết tiêu hóa cấp tính, tỷ lệ hiện mắc VPMNKTP là từ 10% đến 14%.[6] [7] Điều này được cho là do tăng khả năng tiếp cận của vi khuẩn đường ruột với dòng máu trong đợt xuất huyết.
Tiêm xơ trong giãn tĩnh mạch thực quản
- Gây ra vãng khuẩn huyết ở 5% đến 30% bệnh nhân, làm tăng nguy cơ vi khuẩn lây lan theo đường máu đến dịch cổ trướng.[45] Việc thắt búi tĩnh mạch qua nội soi chưa được chứng minh là làm tăng nguy cơ.
Yếu
Cổ trướng ác tính
- Không có nghiên cứu nào mô tả việc bệnh nhân bị cổ trướng do bệnh gan giai đoạn cuối có nguy cơ cao hơn bị VPMNKTP so với những bệnh nhân bị cổ trướng do bệnh ác tính. Tuy nhiên, có một số gợi ý cho thấy các cơ chế trong xơ gan làm tăng độ nhạy cảm với nhiễm trùng có thể không gặp ở những bệnh nhân không bị xơ gan.[51]
Nhiễm trùng ngoài ruột
- Nhiễm trùng đường hô hấp và đường tiết niệu có thể gây nhiễm trùng dịch cổ trướng; trong những trường hợp này, các vi khuẩn gây ra VPMNKTP có thể không thuộc hệ vi khuẩn chí bình thường.
Thủ thuật xâm lấn
- Nội soi tiêm xơ búi giãn tĩnh mạch thực quản đã được báo cáo là có tỷ lệ vãng khuẩn huyết 5% đến 30%, và vi khuẩn có thể lan tới dịch cổ trướng.[46] [47] Các thủ thuật xâm lấn khác, như đặt ống thông tĩnh mạch trung tâm, đặt ống thông tiết niệu, chọc dò dịch, và bắc cầu tĩnh mạch cửa-chủ trong gan qua tĩnh mạch cảnh có liên quan đến VPMNKTP.
Các yếu tố về tiền sử và thăm khám
Các yếu tố chẩn đoán chủ yếu
Có các yếu tố nguy cơ (thường gặp)
- Bệnh nhân mắc bệnh gan giai đoạn cuối biểu hiện bệnh não gan, xơ gan mất bù, tăng thể tích và/hoặc tần suất cổ trướng, hoặc nguy cơ cao xuất huyết tiêu hóa.
- Bệnh nhân được nội soi trị liệu gần đây cũng có nguy cơ.
- Cổ trướng do bệnh ác tính cũng có nguy cơ, mặc dù thấp hơn so với nguy cơ ở những bệnh nhân mắc bệnh gan giai đoạn cuối.[67]
Đau bụng hoặc ấn đau ở vùng bụng (thường gặp)
- Thường gặp, xảy ra ở 50% đến 94% bệnh nhân.[12] [68]
Dấu hiệu của cổ trướng (thường gặp)
- Khám lâm sàng để phát hiện cổ trướng, bao gồm khám dấu hiệu gõ đục vùng hông,
Dấu hiệu gõ đục vùng thấp, dấu hiệu sóng vỗ, và thính chẩn gõ.
- Độ nhạy cảm và đặc hiệu của các dấu hiệu này đối với cổ trướng rất khác nhau. Gõ thành bụng có độ nhạy cao nhất trong số các thao tác khám cổ trướng với độ nhạy cảm 84%.[70]
Sốt (thường gặp)
- Sốt biểu hiện ở 35% đến 68% bệnh nhân.[68] [95]
Buồn nôn/ nôn (thường gặp)
- Gây ra do giảm khả năng vận động của các quai ruột và sự phát triển quá mức của vi khuẩn liên quan đến xơ gan và VPMNKTP.
Tiêu chảy (thường gặp)
- Gây ra do giảm khả năng vận động của các quai ruột và sự phát triển quá mức của vi khuẩn liên quan đến xơ gan và VPMNKTP.
Thay đổi ý thức (thường gặp)
- Ở những bệnh nhân được nhập viện do bệnh não gan, tỷ lệ hiện mắc VPMNKTP là 18% trong 1 đợt nhập viện.[5]
Xuất huyết tiêu hóa (thường gặp)
- Ở những bệnh nhân bị cổ trướng nằm viện vì xuất huyết tiêu hóa cấp tính, tỷ lệ hiện mắc VPMNKTP là từ 10% đến 14%.[6] [7]
Các yếu tố chẩn đoán khác
Hạ thân nhiệt (thường gặp)
- Có thể có các dấu hiệu sepsis.
Hạ huyết áp (thường gặp)
- Có thể có các dấu hiệu sepsis.
Nhịp tim nhanh (thường gặp)
- Có thể có các dấu hiệu sepsis.
Xét nghiệm chẩn đoán
Xét nghiệm thứ nhất cần yêu cầu
| Xét nghiệm | Kết quả |
Công thức máu
|
tăng bạch cầu, thiếu máu |
Creatinine huyết thanh
|
có thể tăng |
| đánh giá sơ bộ dịch cổ trướng | ‘mờ’, ‘đục’, ‘có máu’ |
số lượng bạch cầu trung tính tuyệt đối (ANC) trong dịch cổ trướng
|
>250 tế bào/mm³ |
| nhuộm Gram dịch cổ trướng | Vi khuẩn nhuộm Gram |
| nuôi cấy dịch cổ trướng | mọc vi khuẩn gây bệnh |
xét nghiệm que thử esterase bạch cầu có nhạy cảm cao cho dịch cổ trướng (Periscreen)
|
chỉ số ‘âm tính’ trên que so màu sau 3 phút được xem là loại trừ VPMNKTP |
xét nghiệm que thử esterase bạch cầu tại giường bệnh (nước tiểu chuẩn) đối với dịch cổ trướng
|
bạch cầu tăng được đo bằng cách so màu |
Cấy máu
|
mọc vi khuẩn gây bệnh |
Xét nghiệm chức năng gan
|
tăng men gan và bilirubin; giảm albumin |
PT/INR
|
Tăng |
pH dịch cổ trướng và pH máu động mạch
|
pH dịch cổ trướng <7,35; độ chênh lệch pH dịch cổ trướng với pH động mạch >0,10 |
Các xét nghiệm khác cần cân nhắc:
| Xét nghiệm | Kết quả |
protein dịch cổ trướng, glucose, lactate dehydrogenase (LDH)
|
protein >10 g/L (>1 g/dL); glucose <2,8 mmol/L (<50 mg/ dL); LDH >225 đơn vị/L tăng khả năng viêm phúc mạc thứ phát |
kháng nguyên carcinoembryonic (CEA) dịch cổ trướng
|
<5 microgram/L (<5 nanogram/mL) |
phosphatase kiềm dịch cổ trướng
|
<240 đơn vị/L |
Chụp CT bụng
|
thấy được cổ trướng lan tỏa; loại trừ tràn khí phúc mạc ở bệnh nhân bị viêm phúc mạc thứ phát |
Các xét nghiệm giai đoạn đầu:
| Xét nghiệm | Kết quả |
lactoferrin dịch cổ trướng
|
>242 nanogram/mL |
elastase bạch cầu hạt dịch cổ trướng (xét nghiệm miễn dịch latex)
|
>49,5 nanogram/mL chỉ ra VPMNKTP |
PCR dịch cổ trướng tìm ADN vi khuẩn
|
có thể phát hiện ADN vi khuẩn |
xét nghiệm kích thích corticotrophin ngắn
|
suy thượng thận, được xác định là cortisol nền 414 nanomol/L hoặc thấp hơn (15 microgam/dL hoặc thấp hơn) hoặc đáp ứng cortisol <248 nanomol/L (<9 microgram/dL) với giá trị ban đầu là 414-938 nanomol/L (15 -34 microgam/ dL). |
procalcitonin huyết thanh
|
mức procalcitonin trên ngưỡng giá trị tham chiếu |
Chẩn đoán khác biệt
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| Viêm phúc mạc thứ phát |
|
|
| Lao màng bụng |
|
|
| Chảy máu trong màng bụng vào dịch cổ chướng |
|
|
| Cổ chướng do viêm tụy |
|
|
Điều trị
Cách tiếp cận điều trị từng bước
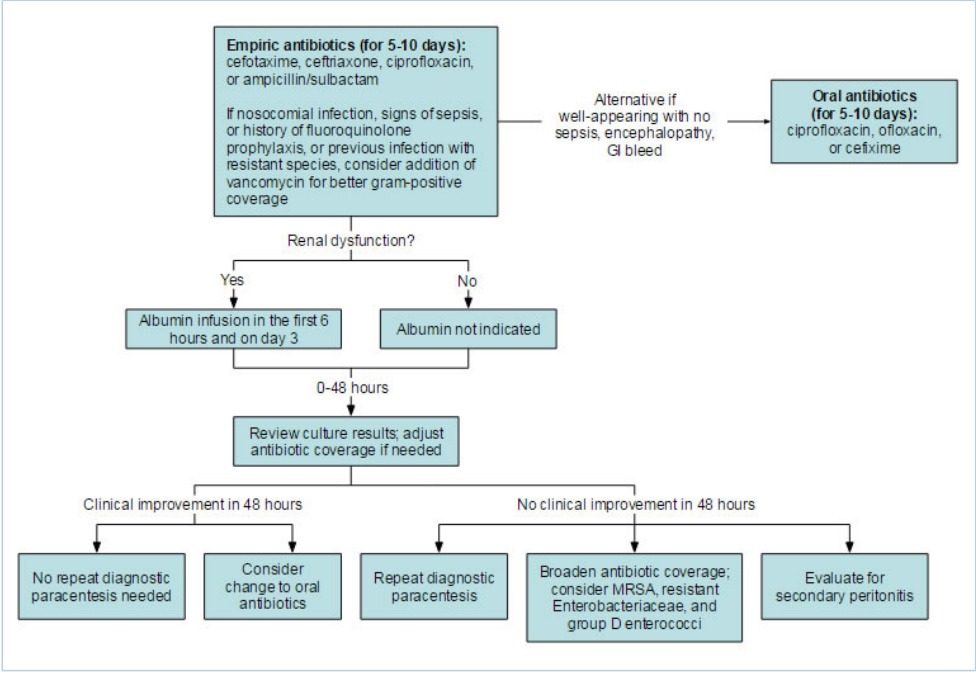
Điều trị VPMNKTP chủ yếu hướng vào việc sử dụng kháng sinh sớm theo kinh nghiệm thích hợp.
From the personal collection of Brian Chinnock, MD; used with permission
Hồi sức tích cực là cần thiết nếu có tình trạng sepsis, bồi phụ dịch và dùng thuốc co mạch để duy trì huyết áp động mạch trung bình >65 mmHg.[104] Điều trị kháng sinh phổ rộng theo kinh nghiệm càng sớm càng tốt sau khi nhận định sepsis và trong vòng 1 giờ.
Tóm tắt về điều trị kháng sinh
Bệnh nhân toàn trạng tốt không có biểu hiện của sepsis, bệnh não, hay xuất huyết tiêu hóa có thể điều trị ban đầu bằng thuốc kháng sinh đường uống (quinolone hoặc cephalosporin như cefixime).3[A]Evidence Điều trị cần tiếp tục duy trì trong 5 đến 10 ngày.
Bệnh nhân có dấu hiệu sepsis, bệnh não, hoặc xuất huyết tiêu hóa nên được bắt đầu bằng kháng sinh phổ rộng theo kinh nghiệm, hoạt phổ chống lại cả vi khuẩn gram âm và gram dương. Lựa chọn kháng sinh hàng đầu sẽ là cephalosporin thế hệ thứ ba, ciprofloxacin, hoặc penicillin phổ rộng kết hợp với thuốc ức chế beta-lactamase, chẳng hạn như ampicillin/sulbactam. Nếu bệnh nhân có tiền sử dùng fluoroquinolone dự phòng, nhiễm trùng mắc phải tại bệnh viện, hoặc tiền sử nhiễm vi khuẩn kháng thuốc, có thể xem xét bổ sung vancomycin để bao phủ cầu khuẩn gram dương tốt hơn, đặc biệt là ở bệnh nhân sepsis.
Nhiều loại thuốc kháng sinh đã chứng minh hiệu quả.4[A]Evidence Khoảng thời gian điều trị dựa trên sự cải thiện các dấu hiệu và triệu chứng lâm sàng, thường không được xác định trước (đa phần các trường hợp, là 7-10 ngày). Ngoài ra, liều lượng thuốc kháng sinh được điều chỉnh đối với bệnh nhân suy thận.
Nhìn chung không có khác biệt về hiệu quả xét về tỷ lệ tử vong và/hoặc khỏi bệnh VPMNKTP giữa các phác đồ thuốc kháng sinh khác nhau. Thông thường, hầu hết các nghiên cứu không cho thấy ưu thế rõ ràng của cephalosporin thế hệ ba so với các phác đồ kháng sinh khác; tuy nhiên, do hiệu quả của nó, thuốc này hiện được coi như phương pháp điều trị chuẩn cho VPMNKTP.[108] [109] Bằng chứng yếu cho thấy rằng liều thấp hơn hoặc điều trị ngắn hạn bằng cephalosporin thế hệ ba có hiệu quả tương đương với liều cao hơn hoặc điều trị kéo dài hơn.[108] Một thử nghiệm ngẫu nhiên, có đối chứng cho thấy cefotaxime liều thấp có hiệu quả như cefotaxime liều cao cho VPMNKTP trên bệnh nhân xơ gan.[110]
Việc tăng tỷ lệ hiện mắc đối với cầu khuẩn gram dương và trực khuẩn gram âm sinh beta-lactamase phổ rộng (ESBL), cùng với sự xuất hiện của Klebsiella pneumoniae kháng carbapenem đưa đến câu hỏi liệu cephalosporin thế hệ ba có còn là liệu pháp theo kinh nghiệm bậc 1 thích hợp hay không. Các nghiên cứu được công bố từ năm 2001 và 2011 đã cho thấy tỷ lệ kháng cephalosporin từ 20% đến 43%.[115] [116] [117] Loạt ca bệnh gồm 38 đợt VPMNKTP được điều trị bằng cefotaxime báo cáo tỷ lệ thất bại 41% sau 48 giờ, đòi hỏi phải thay đổi sang thuốc kháng sinh thay thế.[118] Một nghiên cứu khác với 314 mẫu nuôi cấy dịch màng bụng dương tính từ năm 2005 đến 2011 cho thấy không có thay đổi về căn nguyên gây bệnh của VPMNKTP, nhưng tăng đáng kể tình trạng kháng thuốc kháng sinh được khuyến cáo bậc 1. Tỷ lệ phần trăm chủng kháng thuốc của vi khuẩn gram âm và gram dương với các thuốc kháng sinh sau đây đã được báo cáo: cefotaxime (63%, 86%), ceftazidime (73%, 82%), ciprofloxacin (30%, 60%) và oxacillin (35%, 52%). Escherichia coli trong các nghiên cứu này nhạy cảm nhất với imipenem/cilastatin, piperacillin/ tazobactam, ceftizoxime, amikacin, và gentamicin.[119] Ngay cả ở những bệnh nhân mắc VPMNKTP lần đầu, một nghiên cứu thực hiện từ năm 2007 đến năm 2013 đã chứng minh tỷ lệ kháng thuốc 30% đối với cephalosporin thế hệ thứ ba ở VPMNKTP cộng đồng và 44% ở VPMNKTP bệnh viện.[120] Không ngạc nhiên rằng sự gia tăng phổ kháng thuốc của các vi khuẩn được chứng minh là yếu tố dự báo độc lập về tỷ lệ tử vong ở những bệnh nhân bị VPMNKTP. Rõ ràng là các kiểu kháng thuốc mới xuất hiện cần phải được kiểm tra chặt chẽ tại mỗi cơ sở để xác định xem liệu một điều trị kinh nghiệm phổ rộng hơn có được cho phép hay không.
Bệnh nhân đang đáp ứng và cải thiện lâm sàng có thể được xem xét chuyển sang thuốc kháng sinh đường uống, quinolone hoặc cephalosporin, sau khoảng 48 giờ.6[A]Evidence Cần tiếp tục dùng thuốc kháng sinh với tổng thời gian điều trị từ 5 đến 10 ngày. Fluoroquinolone đường uống được lựa chọn điều trị ở bệnh nhân bị VPMNKTP không biến chứng.[108]
Nhiễm trùng bệnh viện
Trong một thử nghiệm ngẫu nhiên, có đối chứng nhỏ ở bệnh nhân bị VPMNKTP bệnh viện (được xác định là VPMNKTP bắt đầu từ ≥72 giờ sau khi nhập viện), điều trị theo kinh nghiệm bằng meropenem cùng với daptomycin kết hợp với khỏi bệnh lớn hơn đáng kể sau 48 giờ so với điều trị bằng ceftazidime.[122] Nghiên cứu này quá nhỏ để đánh giá sự khác biệt về tỷ lệ tử vong.
Trong một thử nghiệm ngẫu nhiên, có đối chứng lớn hơn trên các bệnh nhân bị VPMNKTP bệnh viện, imipenem/ cilastatin được xác định là tương đương với cefepime.[123]
Điều trị ngoại trú so với nội trú
Mặc dù nhiều bệnh nhân bị VPMNKTP không biến chứng (không có sepsis, bệnh não gan, hoặc xuất huyết tiêu hóa, và chức năng thận bình thường) có thể lựa chọn cho điều trị ngoại trú, không có thử nghiệm nào đánh giá độ an toàn của thực hành này.
Thời gian điều trị kháng sinh
Trong một nghiên cứu so sánh 5 ngày so với 10 ngày dùng cefotaxime đường tĩnh mạch, không có khác biệt về tỷ lệ tử vong hoặc khỏi bệnh VPMNKTP giữa 2 nhóm.[124] Có thể khuyến cáo đợt điều trị ngắn hơn ở bệnh nhân hết triệu chứng lâm sàng.
Albumin chỉ định cho bệnh nhân bị rối loạn chức năng thận
Khuyến cáo điều trị bằng albumin đường tĩnh mạch cho bệnh nhân bị rối loạn chức năng thận. Albumin góp phần làm giảm suy thận,7[B]Evidence có lẽ bằng cách tăng thể tích tuần hoàn và gắn với các phân tử gây viêm.[95] Albumin cũng được chứng minh là làm giảm tỷ lệ tử vong tại bệnh viện.8[B]Evidence
Chọc tháo dịch thể tích lớn (LVP)
Trong quá khứ người ta cho rằng chống chỉ định chọc tháo dịch thể tích lớn (>4 L) để giảm đau do cổ chướng căng ở bệnh nhân bị VPMNKTP, do ảnh hưởng bất lợi trên huyết động. Các nghiên cứu trên bệnh nhân bị VPMNKTP không biến chứng (không có nhiễm khuẩn huyết, bệnh não gan, xuất huyết tiêu hóa, hoặc rối loạn chức năng thận đáng kể) đã chứng minh rằng chọc tháo dịch ổ bụng với thể tích lớn kết hợp với truyền albumin thay thế là an toàn.[126] [127] There are no studies that have examined whether LVP is safe in patients with complicated SBP.
[VIDEO: Ascitic drainage animated demonstration ]
Chọc dịch nhiều lần và mở rộng phổ thuốc kháng sinh ở những bệnh nhân kháng trị
Nên lặp lại dò dịch chẩn đoán sau 48 giờ điều trị ở những bệnh nhân không có cải thiện đáng kể. Điều này có thể được trì hoãn một cách an toàn ở những bệnh nhân cải thiện về mặt lâm sàng đáng kể.[128] Thất bại điều trị được cho là nếu số lượng bạch cầu trung tính tuyệt đối giảm đi <25% khi lặp lại chọc dò dịch trong 48 giờ.
Việc tăng kháng thuốc với các điều trị bậc 1 thường gặp như cephalosporin thế hệ thứ ba, quinolone và ampicillin/ clavulanate đã được chứng minh.[129] [130] Những bệnh nhân mà kết quả nuôi cấy ra vi khuẩn kháng thuốc kháng sinh theo kinh nghiệm bậc 1 có tỷ lệ tử vong cao hơn.[129] Có thể thay đổi liệu pháp kháng sinh theo kết quả nuôi cấy máu hoặc dịch cổ chướng. Nếu không mọc vi khuẩn, nên xem xét thêm thuốc, hoặc đổi sang vancomycin, để bao phủ MRSA và enterococci nhóm D. Ngoài ra, nên xem xét các thuốc kháng sinh bao phủ trực khuẩn Gram âm đường ruột kháng thuốc (như E coli). Trong một nghiên cứu nhỏ, 19 bệnh không đáp ứng với điều trị cefotaxime sau 2 ngày được chọn ngẫu nhiên sử dụng meropenem hoặc levofloxacin. Kết quả sau đó, 11 trong số 11 bệnh nhân được điều trị bằng meropenem và 6 trong số 8 bệnh nhân được điều trị bằng levofloxacin đã khỏi nhiễm trùng.[131] Một nghiên cứu ngẫu nhiên khác trên các bệnh nhân thất bại với ceftriaxone sau 48 giờ được chuyển sang hoặc imipenem/cilastatin hoặc cefepime, cho thấy hiệu quả tương đương giữa 2 kháng sinh.[123]
Ngoài ra, việc không có cải thiện rõ cũng làm tăng mối lo ngại về viêm phúc mạc thứ phát, do đó chỉ định chụp chiếu hoặc hội chẩn phẫu thuật có thể cần thiết.
Tổng quan về các chi tiết điều trị
Tham khảo cơ sở dữ liệu dược địa phương của quý vị để biết thông tin toàn diện về thuốc, bao gồm các chống chỉ định, tương tác giữa các loại thuốc, và liều dùng thay thế. ( xem Tuyên bố miễn trách nhiệm )
| Cấp tính | ||
| Nhóm bệnh nhân | Tx line | Điều trị |
| nhiễm khuẩn huyết, bệnh não hoặc xuất huyết tiêu hóa
|
1 |
kháng sinh tĩnh mạch theo kinh nghiệm |
|
bổ sung | có thể chuyển sang dùng kháng sinh đường uống |
|
bổ sung | mở rộng phổ thuốc kháng sinh + đánh giá thêm |
|
thêm | albumin tĩnh mạch |
| không bị sepsis, bệnh não hoặc xuất huyết tiêu hóa | 1 | kháng sinh đường uống theo kinh nghiệm |
| bổ sung | chọc dò dịch thể tích lớn (LVP) | |
| Tiếp diễn | ||
| Nhóm bệnh nhân | Tx line | Điều trị |
| dự phòng tiên phát hoặc thứ phát | 1 | thuốc kháng sinh dự phòng + thuốc chẹn beta |
| Cấp tính |
||
| Nhóm bệnh nhân | Tx line | Điều trị |
| Nhiễm khuẩn huyết, bệnh não hoặc xuất huyết tiêu hóa | 1 | kháng sinh tĩnh mạch theo kinh nghiệm » Điều trị cần tiếp tục duy trì trong 5 đến 10 ngày. » Nếu bệnh nhân có tiền sử dự phòng bằng fluoroquinolone, nhiễm trùng mắc phải tại bệnh viện, hoặc tiền sử nhiễm các vi khuẩn đa kháng trước đó, có thể xem xét bổ sung vancomycin để bao phủ cầu khuẩn gram dương tốt hơn, đặc biệt là ở bệnh nhân nhiễm khuẩn huyết. » Việc tăng tỷ lệ hiện mắc đối với cầu khuẩn gram dương và trực khuẩn gram âm sinh beta-lactamase phổ rộng, cùng với sự xuất hiện của Klebsiella pneumoniae kháng carbapenem dẫn đến câu hỏi liệu cephalosporin thế hệ thứ ba có còn là liệu pháp theo kinh nghiệm bậc 1 thích hợp hay không.[115] [116] [117] [118] [119] » Một thử nghiệm ngẫu nhiên, có đối chứng nhỏ ở bệnh nhân bị VPMNKTP bệnh viện (được xác định là VPMNKTP bắt đầu từ ≥72 giờ sau khi nhập viện) đã cho thấy điều trị theo kinh nghiệm bằng meropenem cùng với daptomycin có liên quan đến tỷ lệ khỏi bệnh cao hơn đáng kể sau 48 giờ so với điều trị bằng ceftazidime.[122] Nghiên cứu này quá nhỏ để đánh giá sự khác biệt về tỷ lệ tử vong. Một thử nghiệm ngẫu nhiên, có đối chứng lớn hơn trên bệnh nhân bị VPMNKTP bệnh viện cho thấy imipenem có hiệu quả và tỷ lệ sống sót tương đương với cefepime.[123] » Các kiểu kháng thuốc mới xuất hiện phải được kiểm tra chặt chẽ tại mỗi cơ sở để xác định xem điều trị kinh nghiệm phổ rộng hơn có được phép chỉ định hay không. Các lựa chọn sơ cấp» cefotaxime: 2 g tiêm tĩnh mạch mỗi 8-12 giờ HOẶC Các lựa chọn sơ cấp» ceftriaxone: 2 g tiêm tĩnh mạch mỗi 12-24 giờ HOẶC Các lựa chọn sơ cấp » ampicillin/sulbactam: 2 g đường tĩnh mạch mỗi 6 giờ Liều dùng tính theo thành phần ampicillin. HOẶC » imipenem/cilastatin: 1 g tiêm tĩnh mạch mỗi 8 giờ Liều dùng liên quan đến thành phần imipenem. HOẶC » cefepime: 2 g tiêm tĩnh mạch mỗi 8-12 giờ HOẶC » meropenem: 1 g tiêm tĩnh mạch mỗi 8 giờ -và- » daptomycin: 6 mg/kg tiêm tĩnh mạch mỗi 24 giờ HOẶC » cefotaxime: 2 g tiêm tĩnh mạch mỗi 8-12 giờ -hoặc- » ceftriaxone: 2 g tiêm tĩnh mạch mỗi 12-24 giờ -hoặc- » Ciprofloxacin: 200-400 mg tiêm tĩnh mạch mỗi 12 giờ -hoặc- » ampicillin/sulbactam: 2 g đường tĩnh mạch mỗi 6 giờ Liều dùng tính theo thành phần ampicillin. -hoặc- » imipenem/cilastatin: 1 g tiêm tĩnh mạch mỗi 8 giờ Liều dùng liên quan đến thành phần imipenem. -hoặc- » cefepime: 2 g tiêm tĩnh mạch mỗi 8-12 giờ -và- » vancomycin: 500-1000 mg tiêm tĩnh mạch 12 giờ HOẶC » meropenem: 1 g tiêm tĩnh mạch mỗi 8 giờ -và- » daptomycin: 6 mg/kg tiêm tĩnh mạch mỗi 24 giờ -và-
|
| đáp ứng sau 48 giờ | bổ sung | có thể chuyển sang dùng kháng sinh đường uống
Các lựa chọn sơ cấp » Ciprofloxacin: 500 mg uống mỗi 12 giờ » ofloxacin: 400 mg uống mỗi 12 giờ » cefixime: 400 mg uống mỗi 12 giờ |
| không đáp ứng sau 48 giờ hoặc tình trạng xấu đi bất cứ lúc nào
|
bổ sung | mở rộng phổ thuốc kháng sinh + đánh giá thêm » Có thể thay đổi liệu pháp kháng sinh theo kết quả nuôi cấy máu hoặc dịch cổ trướng. Nếu không có vi khuẩn mọc, xem xét bổ sung hoặc đổi sang vancomycin, để bao phủ MRSA và enterococci nhóm D, và xem xét thuốc kháng sinh bao phủ trực khuẩn Gram âm đường ruột kháng thuốc. » A repeat diagnostic paracentesis should be performed after 48 hours of treatment in patients who have not demonstrated significant improvement.[VIDEO: Ascitic drainage animated demonstration ] » Việc không có cải thiện rõ làm tăng mối lo ngại về viêm phúc mạc thứ phát, do đó có thể cần thiết phải chụp chiếu thêm hoặc hội chẩn phẫu thuật. Các lựa chọn sơ cấp» meropenem: 1 g tiêm tĩnh mạch mỗi 8 giờ HOẶC Các lựa chọn sơ cấp » imipenem/cilastatin: 1 g tiêm tĩnh mạch mỗi 8 giờ HOẶC » cefepime: 2 g tiêm tĩnh mạch mỗi 8-12 giờ » meropenem: 1 g tiêm tĩnh mạch mỗi 8 giờ |
| bị rối loạn chức năng thận | thêm | albumin tĩnh mạch » Khuyến cáo điều trị bằng albumin đường tĩnh mạch cho bệnh nhân bị rối loạn chức năng thận. Albumin góp phần làm giảm suy thận,7[B]Evidence có lẽ bằng cách tăng thể tích tuần hoàn và gắn với các phân tử gây viêm.[95] Albumin cũng được chứng minh là làm giảm tỷ lệ tử vong tại bệnh viện.8[B]Evidence Các lựa chọn sơ cấp » albumin người: xem phác đồ tại địa phương để biết hướng dẫn về liều dùng |
| không bị sepsis, bệnh não hoặc xuất huyết tiêu hóa | 1 | kháng sinh đường uống theo kinh nghiệm » Điều trị cần tiếp tục trong 5 đến 10 ngày. » Không có thử nghiệm ngẫu nhiên, có đối chứng nào chứng minh bệnh nhân bị VPMNKTP có thể được điều trị kháng sinh đường uống một cách an toàn trong môi trường ngoại trú. » Việc tăng tỷ lệ hiện mắc đối với cầu khuẩn gram dương và trực khuẩn gram âm sinh beta-lactamase phổ rộng, cùng với sự xuất hiện của Klebsiella pneumoniae kháng carbapenem dẫn đến câu hỏi liệu cephalosporin thế hệ thứ ba có còn là liệu pháp theo kinh nghiệm bậc 1 thích hợp hay không.[115] [116] [117] [118] [119] » Các kiểu kháng thuốc mới xuất hiện phải được kiểm tra chặt chẽ tại mỗi cơ sở để xác định xem điều trị kinh nghiệm phổ rộng hơn có được phép chỉ định hay không. Các lựa chọn sơ cấp» Ciprofloxacin: 500 mg uống mỗi 12 giờ |
| bổ sung | chọc dò dịch thể tích lớn (LVP)
» LVP (>4 L) có thể làm giảm đau do cổ trướng căng. Người ta từng cho rằng điều này bị chống chỉ định ở bệnh nhân bị VPMNKTP, do ảnh hưởng bất lợi đối với huyết động. Tuy nhiên, các nghiên cứu ở bệnh nhân bị VPMNKTP không biến chứng (không bị sepsis, bệnh não gan, xuất huyết tiêu hóa, hoặc rối loạn chức năng thận đáng kể) đã chứng minh rằng LVP kết hợp với albumin là an toàn.[126] [127] » There are no studies that have examined whether LVP is safe in patients with complicated SBP. |
|
| dự phòng tiên phát hoặc tự phát | 1 |
thuốc kháng sinh dự phòng + thuốc chẹn beta» Nồng độ protein trong dịch cổ trướng thấp (<15 g/L [<1,5 g/dL]) đã được xác định là yếu tố nguy cơ cho sự phát triển VPMNKTP. Các nghiên cứu cho thấy rằng thuốc kháng sinh dự phòng đường uống trong phân nhóm bệnh nhân này làm giảm tỷ lệ mắc VPMNKTP lần đầu1[A]Evidence và nhiễm trùng do vi khuẩn khác, và dẫn đến giảm tỷ lệ tử vong.2[A]Evidence » Rifaximin, một thuốc kháng sinh đường uống kém hấp thu có hoạt phổ rộng đối với cả vi khuẩn đường ruột gram dương và gram âm, đã được nghiên cứu làm làm thuốc dự phòng tiên phát VPMNKTP. Một nghiên cứu quan sát trên nhóm nhỏ đã chứng minh rằng điều trị bằng rifaximin có liên quan đến việc giảm số lượng bạch cầu trung tính trong dịch ổ bụng và nồng độ nội độc tố trong huyết tương.[59] » Bệnh nhân đã trải qua một đợt VPMNKTP có nguy cơ tái phát cao; nên bắt đầu thuốc kháng sinh dự phòng lâu dài ở những bệnh nhân này. [60] [52] Điều trị nên tiếp tục cho đến khi hết cổ trướng, bệnh nhân tiến triển nặng hoặc ghép gan diễn ra.[45] Thuốc kháng sinh dự phòng cũng đã được chứng minh làm giảm tỷ lệ nhiễm trùng (bao gồm cả VPMNKTP) và tỷ lệ tử vong ở những bệnh nhân xơ gan được nhập viện do xuất huyết tiêu hóa.[60] [132] » Lợi ích tiềm năng của kháng sinh dự phòng phải cân đối với tăng nguy cơ kháng thuốc kháng sinh khi sử dụng lâu dài. Một vài trong số các nguy cơ chưa được tìm hiểu đầy đủ trong các nghiên cứu này bao gồm gia tăng vi khuẩn kháng fluoroquinolone trong nước tiểu hoặc dịch màng bụng ở cả trên bệnh nhân và trong cộng đồng, tác dụng phụ trên cơ xương của fluoroquinolone và xuất hiện nhiễm trùng Clostridium difficile.[57] [58] » So với norfloxacin, rifaximin dùng hàng ngày trong 6 tháng làm giảm tái phát VPMNKTP và giảm tỷ lệ tử vong trong một thử nghiệm ngẫu nhiên, có đối chứng trên 262 bệnh nhân bị cổ trướng và bị VPMNKTP trước đó.[133] Phân tích gộp của các nghiên cứu về rifaximin trong dự phòng VPMNKTP tiên phát và thứ phát cho thấy hiệu quả bảo vệ, nhưng chất lượng bằng chứng rất thấp.[134] » Cả hướng dẫn của Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hiệp hội Nghiên cứu Gan Châu Âu (EASL) đều khuyến cáo sử dụng thuốc chẹn beta không chọn lọc để dự phòng VPMNKTP.[60] [61] Phân tích tổng hợp của 3 thử nghiệm ngẫu nhiên, có đối chứng (1 dự phòng tiên phát, 2 dự phòng thứ phát) cho thấy propranolol và nadolol có thể ngăn ngừa các đợt VPMNKTP mới ở bệnh nhân bị xơ gan và cổ trướng.[62] Ở những bệnh nhân tiến triển VPMNKTP, việc sử dụng liên tục thuốc chẹn beta không chọn lọc có liên quan đến giảm tỷ lệ sống sót (không cấy ghép), tăng thời gian nằm viện, và tỷ lệ hội chứng gan thận và tổn thương thận cấp tính cao hơn.[63] Cần cân nhắc việc dừng thuốc chẹn beta không chọn lọc nếu VPMNKTP tiến triển. » Thuốc ức chế bơm proton (PPI) tạo điều kiện cho sự xâm nhập của vi khuẩn vào ruột, phát triển quá mức và chuyển dịch vào màng bụng, có thể dẫn đến tăng nguy cơ mắc VPMNKTP. Phân tích gộp của 4 nghiên cứu lâm sàng liên quan đã chứng minh mối liên hệ đáng kể giữa việc sử dụng PPI và sự tiến triển của VPMNKTP.[64] Tuy nhiên, các nghiên cứu khác đã thất bại trong việc tìm ra mối liên hệ tích cực giữa việc sử dụng PPI và VPMNKTP.[65] [66] Do dữ liệu mâu thuẫn này, nên cân nhắc cẩn thận khi đưa ra quyết định dùng PPI cho bệnh nhân xơ gan. |
Liên lạc theo dõi
Khuyến nghị
Giám sát
Việc chọc dò dịch lặp lại có thể cần thiết để xác định khỏi bệnh VPMNKTP ở bệnh nhân còn triệu chứng.
Hướng dẫn dành cho bệnh nhân
Bệnh nhân cần được khuyên không nên tham gia vào bất kỳ hoạt động nặng nào trong vòng 24 giờ sau khi chọc dò dịch. Họ cũng được khuyên nên gọi bác sĩ hoặc quay trở lại phòng cấp cứu nếu có bất kỳ điều nào sau đây sau khi chọc dịch:
• Các dấu hiệu nhiễm trùng, chẳng hạn như sưng, tấy đỏ hoặc chảy mủ từ vị trí chọc
• Đau bụng nặng lên
• Sốt
• Nôn nhiều
• Chảy máu từ vị trí chọc không cầm sau 1 giờ ép trực tiếp vào chỗ chảy máu
• Dẫn lưu liên tục nhiều hơn một lượng nhỏ dịch từ vị trí chọc trong >24 giờ.
Sau khi xuất viện sau đợt VPMNKTP , bệnh nhân nên được khuyên dùng thuốc (quan trọng nhất là thuốc kháng sinh) theo chỉ dẫn. Họ cũng được dặn nên gọi bác sĩ hoặc quay trở lại phòng cấp cứu ngay lập tức nếu có bất kỳ điều nào sau đây:
• Đau bụng nặng lên
• Sốt
• Nôn nhiều
• Máu mới trong phân hoặc nôn ra máu.
Các biến chứng
| Các biến chứng | Khung thời gian | Khả năng |
| Sepsis/sốc nhiễm khuẩn | ngắn hạn | cao |
| Mặc dù không có dữ liệu về tần suất sepsis hoặc sốc nhiễm khuẩn ở bệnh nhân VPMNKTP, sepsis trên bệnh nhân xơ gan được ước tính xảy ra trong ít nhất 30% đến 50% số ca nhập viện, và bệnh nhân xơ gan có nguy cơ cao hơn so với các bệnh nhân khác về tiến triển nhiễm trùng bệnh viện.[138] | ||
| cổ trướng căng | ngắn hạn | trung bình |
| Cổ trướng nặng lên đi kèm với bụng chướng căng và đau bụng sau đó có thể xuất hiện triệu chứng của VPMNKTP. Chọc dò dịch thể tích lớn kết hợp với thay thế albumin ở bệnh nhân không có rối loạn huyết động là an toàn và hiệu quả trong tình huống này.[126] [127]
[VIDEO: Ascitic drainage animated demonstration ] |
||
| chảy máu sau chọc dò dịch | ngắn hạn | thấp |
| Chảy máu sau khi chọc dò dịch có thể xảy ra như là xuất huyết trong màng bụng, tụ máu thành bụng, hoặc hiếm hơn là xuất huyết bên ngoài.
Lý do xuất huyết là do tổn thương động mạch thượng vị dưới gây ra do lựa chọn không tốt vị trí chọc; chọc vào tĩnh mạch rốn được tái thông hoặc búi giãn tĩnh mạch trong bụng, có thể phổ biến hơn khi vị trí chọc ở đường giữa;[139] [140] và vỡ búi giãn mạch mạc treo ruột, được cho là do giảm áp lực trong màng bụng đột ngột có thể xảy ra trong quá trình chọc tháo dịch thể tích lớn (giảm áp lực đột ngột này làm tăng độ chênh lệch áp lực giữa giữa 2 bên thành tĩnh mạch mạc treo ruột), có thể gây ra tràn máu phúc mạc đe dọa tính mạng).[141] Tuy nhiên, các nghiên cứu đã cho thấy tỷ lệ xuất huyết thấp liên quan đến thủ thuật. |
||
| thủng ruột sau khi chọc dịch | ngắn hạn | thấp |
| Chọc vào thành ruột khi đặt catheter chọc dịch, gây ra viêm phúc mạc hoặc áp-xe thành bụng sau đó là các biến chứng đã được báo cáo. Hướng dẫn siêu âm để giúp tìm các túi dịch không có các quai ruột có thể làm giảm nguy cơ biến chứng này. Một nghiên cứu về 242 trường hợp chọc dò dịch chẩn đoán có 1 trường hợp thủng thành ruột.[145] | ||
| rò dịch từ vị trí chọc dịch | ngắn hạn | thấp |
| Khoảng 1% đến 5% có thể bị rò rỉ dịch dai dẳng tại vị trí chọc dịch.[70] [144] Điều này có thể được phòng ngừa theo 3 cách: sử dụng kim chọc dò dịch nhỏ hơn, không thực hiện rạch trước kim quá rộng hoặc quá sâu, hoặc bằng cách sử dụng kỹ thuật đâm kin zic-zắc ‘Z-tract’. Với kỹ thuật này, đâm kim và di chuyển về phía trước một khoảng ngắn.
Hướng đâm kim sau đó được thay đổi khoảng 90° đến 120° và di chuyển về phía trước một khoảng ngắn khác. Sau cùng, thay đổi hướng kim về hướng ban đầu. Người ta hy vọng rằng đường chữ Z được hình thành bởi kim sẽ làm cho dịch cổ trướng khó tạo thành đường liên tục hơn. Rò rỉ kéo dài có thể được điều trị bằng cách áp dụng vết khâu túm trong khi bệnh nhân đang nằm ngửa hơi nghiêng sang bên kia.[146] Sử dụng 2-octyl cyanoacrylate cũng đã được mô tả.[147] |
||
| Suy thận | biến thiên | cao |
| Trong một nghiên cứu với 252 đợt VPMNKTP, có 83 (33%) đợt suy thận, 62 (25%) trong số đó tiến triển hoặc duy trì tình trạng suy thận.[137] Nghiên cứu này và các nghiên cứu khác đã chứng minh rối loạn chức năng thận là yếu tố dự báo độc lập mạnh nhất về tỷ lệ tử vong ở bệnh nhân VPMNKTP.[136] | ||
Tiên lượng
Tỷ lệ tái phát cao VPMNKTP trong vòng một năm ở mức 69% đã được báo cáo.[135]Các thử nghiệm ngẫu nhiên, có đối chứng so sánh các phác đồ kháng sinh đã mô tả tỷ lệ tử vong tại bệnh viện từ 10% đến 28%.[44] [109] [111] [113] Mức này giảm so với tỷ lệ tử vong khoảng 50% vào những năm 1980 và 40% vào những năm 1990.[45] Việc giảm tỷ lệ tử vong này có liên quan đến việc sử dụng kháng sinh theo tiêu chuẩn số lượng bạch cầu trung tính tuyệt đối (ANC) trong dịch cổ trướng <250 tế bào/mm³ , cho phép điều trị sớm hơn và rộng hơn, và sử dụng các phác đồ kháng sinh hiệu quả. Tỷ lệ tử vong liên quan đến nhiễm trùng ở mức thấp 0% đã được mô tả ở bệnh nhân bị VPMNKTP không biến chứng tại thời điểm điều trị.[106] [124] Tỷ lệ sống sót sau một đợt VPMNKTP là 30% đến 50% sau 1 năm và 25% đến 30% sau 2 năm. Vì tỷ lệ sống sót sau khi ghép gan cao hơn mức này, nên cần xem xét đánh giá ghép.[1] Trong một bài tổng quan hệ thống các nghiên cứu đánh giá các yếu tố tiên lượng ở bệnh nhân bị VPMNKTP, rối loạn chức năng thận đã được xác định là yếu tố dự báo độc lập quan trọng nhất cho tỷ lệ tử vong. Tỷ lệ tử vong tại bệnh viện ở bệnh nhân bị VPMNKTP và rối loạn chức năng thận đã được xác định là 67%, so với 11% ở bệnh nhân bị VPMNKTP và chức năng thận bình thường.[136]
Hướng dẫn
Hướng dẫn chẩn đoán
| Châu Âu |
| EASL clinical practice guidelines: management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document |
| Nhà xuất bản: International Club of Ascites Xuất bản lần cuối: 2000 |
| Bắc Mỹ |
| Management of adult patients with ascites due to cirrhosis: update 2012 |
| Nhà xuất bản: American Association for the Study of Liver Diseases Xuất bản lần cuối: 2012 |
Hướng dẫn điều trị
| Châu Âu |
| Cirrhosis in over 16s: assessment and management Nhà xuất bản: National Institute for Health and Care Excellence Xuất bản lần cuối: 2016 |
| EASL clinical practice guidelines: management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis Nhà xuất bản: European Association for the Study of the Liver Xuất bản lần cuối: 2010 |
| Guidelines on the management of ascites in cirrhosis Nhà xuất bản: British Society of Gastroenterology Xuất bản lần cuối: 2006 |
| Quốc tế |
| Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document Nhà xuất bản: International Club of Ascites Xuất bản lần cuối: 2000 |
| Bắc Mỹ |
| Management of adult patients with ascites due to cirrhosis: update 2012 Nhà xuất bản: American Association for the Study of Liver Diseases Xuất bản lần cuối: 2012 |
Điểm số bằng chứng
1. Reduction rate of first-episode spontaneous bacterial peritonitis (SBP) in patients with low ascitic protein: there is good-quality evidence that prophylactic oral antibiotics reduce the rate of initial SBP in patients with low levels of protein (<15 g/L [<1.5 g/dL]) in their ascitic fluid.[6] [52] [53] [54] [55] [56] One meta-analysis found an absolute risk reduction of 8% for the development of SBP, meaning that 13 patients need to be treated to prevent 1 episode. Bằng chứng cấp độ A: Đánh giá hệ thống (SR) hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) với >200 người tham gia.
2. Reduction in mortality in patients with low ascitic protein: there is good-quality evidence that prophylactic oral antibiotics improve 1-year survival rates (60% versus 48% in untreated patients).[52] [53] One meta-analysis found a significant short-term benefit (from high-quality studies of both primary and secondary prophylaxis patient groups together), with a mortality of 6% in treated patients versus 22% in untreated patients at 3 months.[56] Bằng chứng cấp độ A: Đánh giá hệ thống (SR) hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) với >200 người tham gia.
3. Difference in mortality or resolution of SBP when using oral versus intravenous antibiotics: there is good- quality evidence that there is no difference in mortality or resolution of SBP when oral versus intravenous
antibiotics are compared. Studies have looked at oral cefixime versus intravenous ceftriaxone,[105] oral ofloxacin versus intravenous cefotaxime,[106] and oral ciprofloxacin versus intravenous cefotaxime versus intravenous ceftriaxone.[107] Patients with complicated SBP (sepsis, encephalopathy, or significant renal insufficiency) were generally excluded from these studies.
Bằng chứng cấp độ A: Đánh giá hệ thống (SR) hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) với >200 người tham gia.
4. Resolution or improvement in clinical features of SBP: there is good-quality evidence for the efficacy of many antimicrobials and administration regimens for the treatment of SBP,[108] including cefotaxime,[44] [109] [110] [106] [111] [107] ceftriaxone,[107] [112] [105] ciprofloxacin,[113] ceftazidime,[113] cefonicid,[112] amoxicillin- clavulanate,[44] and amikacin (although this may not be an acceptable empirical agent with the increase in gram- positive organisms).[111] In all studies examining these treatment regimens, duration of treatment was based on clinical resolution of signs and symptoms, not on a predetermined duration (in most, the duration was 7-10 days). Bằng chứng cấp độ A: Đánh giá hệ thống (SR) hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) với >200 người tham gia.
5. Mortality and resolution of SBP with different antibiotic regimens: there is good-quality evidence that different antibiotic regimens in clinical use do not differ significantly in terms of mortality and/or resolution of SBP. Studies of cefotaxime versus ceftriaxone,[107] cefotaxime versus amikacin,[111] cefotaxime versus amoxicillin/ clavulanate,[44] ceftriaxone versus cefonicid,[112] moxifloxacin versus amoxicillin/clavulanate,[114] and ciprofloxacin versus ceftazidime[113] revealed no difference between the antibiotics in terms of mortality and/or resolution of SBP.
Bằng chứng cấp độ A: Đánh giá hệ thống (SR) hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) với >200 người tham gia.
6. Mortality or resolution of SBP with early switch to oral antibiotics: there is good-quality evidence that an early transition to oral antibiotics when clinical symptoms and signs have improved demonstrates no difference in mortality or resolution of SBP compared with longer intravenous treatment.[44] [113] [121] Bằng chứng cấp độ A: Đánh giá hệ thống (SR) hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) với >200 người tham gia.
7. Reduction in non-reversible renal impairment: there is medium-quality evidence from a trial involving 126 patients with uncomplicated SBP that albumin infusion on day 1 and day 3 of treatment reduces non-reversible renal impairment compared with no albumin infusion (21% versus 6%).[125] Bằng chứng cấp độ B: Các thử nghiệm ngẫu nhiên đối chứng (RCT) với <200 người tham gia, các RCT có lỗi về phương pháp với >200 người tham gia, các đánh giá hệ thống (SR) có lỗi về phương pháp hoặc các nghiên cứu quan sát (thuần tập) có chất lượng cao.
8. Reduction in mortality: there is medium-quality evidence from a trial involving 126 patients with uncomplicated SBP that albumin infusion on day 1 and day 3 of treatment reduces in-hospital mortality compared with no albumin infusion (29% versus 10%). There was no significant mortality difference in patients with normal renal function and a bilirubin <68 micromol/L (<4 mg/dL).[125] Bằng chứng cấp độ B: Các thử nghiệm ngẫu nhiên đối chứng (RCT) với <200 người tham gia, các RCT có lỗi về phương pháp với >200 người tham gia, các đánh giá hệ thống (SR) có lỗi về phương pháp hoặc các nghiên cứu quan sát (thuần tập) có chất lượng cao.
9. Bleeding after paracentesis: there is medium-quality evidence that the rate of bleeding after paracentesis in patients with cirrhosis is low. Two retrospective studies with over 5300 patients demonstrated a significant bleed rate of 0.2%.[142] [143] In a prospective study with 410 paracenteses, only 2 patients had significant bleeding, despite 55 patients having a platelet count <50,000 cells/mm^3 and 84 patients having an INR >2.5.[96] Another prospective study showed 5 significant bleeds in 515 paracenteses, and these bleeds were associated only with therapeutic, not diagnostic, procedures.[144] Significant bleeding has not been associated with either coagulopathy or thrombocytopenia, but may have some association with renal insufficiency.[142] Bằng chứng cấp độ B: Các thử nghiệm ngẫu nhiên đối chứng (RCT) với <200 người tham gia, các RCT có lỗi về phương pháp với >200 người tham gia, các đánh giá hệ thống (SR) có lỗi về phương pháp hoặc các nghiên cứu quan sát (thuần tập) có chất lượng cao.
Tài liệu tham khảo
Các bài báo chủ yếu
• Loomba R, Wesley R, Bain A, et al. Role of fluoroquinolones in the primary prophylaxis of spontaneous bacterial peritonitis: meta-analysis. Clin Gastroenterol Hepatol. 2009 Apr;7(4):487-93. Tóm lược
• McGibbon A, Chen GI, Peltekian KM, et al. An evidence-based manual for abdominal paracentesis. Dig Dis Sci. 2007 Dec;52(12):3307-15. Tóm lược
• Wong CL, Holroyd-Leduc J, Thorpe KE, et al. Does this patient have bacterial peritonitis or portal hypertension? How do I perform a paracentesis and analyze the results? 2008 Mar 12;299(10):1166-78. Tóm lược
• Koulaouzidis A, Leontiadis GI, Abdullah M, et al. Leukocyte esterase reagent strips for the diagnosis of spontaneous bacterial peritonitis: a systematic review. Eur J Gastroenterol Hepatol. 2008 Nov;20(11):1055-60. Tóm lược
• Chavez-Tapia NC, Soares-Weiser K, Brezis M, et al. Antibiotics for spontaneous bacterial peritonitis in cirrhotic patients. Cochrane Database Syst Rev. 2009;(1):CD002232. Toàn văn Tóm lược
Tài liệu tham khảo
1. Rimola A, Garcia-Tsao G, Navasa M, et al; International Ascites Club. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. J Hepatol. 2000 Jan;32(1):142-53. Toàn văn Tóm lược
2. Runyon BA, Hoefs JC. Culture-negative neutrocytic ascites: a variant of spontaneous bacterial peritonitis. Hepatology. 1984 Nov-Dec;4(6):1209-11. Tóm lược
3. Terg R, Levi D, Lopez P, et al. Analysis of clinical course and prognosis of culture-positive spontaneous bacterial peritonitis and neutrocytic ascites area: evidence of the same disease. Dig Dis Sci. 1992 Oct;37(10):1499-504. Tóm lược
4. Borzio M, Salerno F, Piantoni L, et al. Bacterial infection in patients with advanced cirrhosis: a multicentre prospective study. Dig Liver Dis. 2001 Jan-Feb;33(1):41-8. Tóm lược
5. Dhiman RK, Makharia JK, Jain S, et al. Ascites and spontaneous bacterial peritonitis in fulminant hepatic failure. Am J Gastroenterol. 2000 Jan;95(1):233-8. Tóm lược
6. Blaise M, Pateron D, Trinchet JC, et al. Systemic antibiotic therapy prevents bacterial infections in cirrhotic patients presenting with gastrointestinal hemorrhage. Hepatology. 1994 Jul;20(1 Pt 1):34-8. Tóm lược
7. Bleichner G, Boulanger R, Squara P, et al. Frequency of infections in cirrhotic patients presenting with acute gastrointestinal haemorrhage. Br J Surg. 1986 Sep;73(9):724-6. Tóm lược
8. Evans LT, Kim WR, Poterucha JJ, et al. Spontaneous bacterial peritonitis in asymptomatic outpatients with cirrhotic ascites. Hepatology. 2003 Apr;37(4):897-901. Toàn văn Tóm lược
9. Jeffries MA, Stern MA, Gunaratnam NT, et al. Unsuspected infection is infrequent in asymptomatic outpatients with refractory ascites undergoing therapeutic paracentesis. Am J Gastroenterol. 1999 Oct;94(10):2972-6. Tóm lược
10. Cholongitas E, Papatheodoridis GV, Lahanas A, et al. Increasing frequency of Gram-positive bacteria in spontaneous bacterial peritonitis. Liver Int. 2005 Feb;25(1):57-61. Tóm lược
11. Campillo B, Richardet P, Kheo T, et al. Nosocomial spontaneous bacterial peritonitis and bacteremia in cirrhotic patients: impact of isolate type on prognosis and characteristics of infection. Clin Infect Dis. 2002 Jul 1;35(1):1-10. Toàn văn Tóm lược
12. Parsi MA, Atreja A, Zein NN. Spontaneous bacterial peritonitis: recent data on incidence and treatment. Cleve Clin J Med. 2004 Jul;71(7):569-76. Tóm lược
13. Alexopoulou A, Papadopoulos N, Eliopoulos DG, et al. Increasing frequency of gram-positive cocci and gram- negative multidrug-resistant bacteria in spontaneous bacterial peritonitis. Liver Int. 2013 Aug;33(7):975-81. Tóm lược
14. Piano S, Romano A, Rosi S, et al. Spontaneous bacterial peritonitis due to carbapenemase-producing Klebsiella pneumoniae: the last therapeutic challenge. Eur J Gastroenterol Hepatol. 2012 Oct;24(10):1234-7. Tóm lược
15. Boixeda D, De Luis DA, Aller R, et al. Spontaneous bacterial peritonitis: clinical and microbiological study of 233 episodes. J Clin Gastroenterol. 1996 Dec;23(4):275-9. Tóm lược
16. Singh N, Wagener MM, Gayowski T. Changing epidemiology and predictors of mortality in patients with spontaneous bacterial peritonitis at a liver transplant unit. Clin Microbiol Infect. 2003 Jun;9(6):531-7. Toàn văn Tóm lược
17. Kamani L, Mumtaz K, Ahmed US, et al. Outcomes in culture positive and culture negative ascitic fluid infections in patients with viral cirrhosis: cohort study. BMC Gastroenterol. 2008 Dec 18;8:59. Tóm lược
18. Espinoza-Gómez F, Newton-Sánchez O, Melnikov V, et al. Spontaneous bacterial peritonitis caused by Listeria in a patient with cirrhosis: case report [in Spanish]. Rev Med Chil. 2006 Sep;134(9):1171-4. Toàn văn Tóm lược
19. Musher DM, Nichol AC, Rueda AM. Nontypeable Haemophilus influenzae as a cause of spontaneous bacterial peritonitis. J Clin Microbiol. 2006 Jun;44(6):2304-6. Toàn văn Tóm lược
20. Dimopoulou A, Dimopoulou D, Christianakis E, et al. Spontaneous bacterial peritonitis caused by nontypeable Haemophilus influenzae in a previously healthy child. Pediatr Infect Dis J. 2013 Jun;32(6):704. Tóm lược
21. Brautbar A, Esayag Y, Breuer GS, et al. Spontaneous bacterial peritonitis caused by Haemophilus parainfluenzae. Isr Med Assoc J. 2007 Mar;9(3):175-6. Tóm lược
22. Nathanson L. Spontaneous bacterial peritonitis due to Neisseria meningitides serogroup Z. Clin Pediatr (Phila). 1993 Aug;32(8):510. Tóm lược
23. Lecliere S, Di Fiore F, Hervé S, et al. Spontaneous infection of ascitic fluid due to Salmonella typhimurium in a cirrhotic patient undergoing selective intestinal decontamination with norfloxacin [in French]. Presse Med. 2003 Mar 29;32(12):550-2. Tóm lược
24. Adhikary R, Joshi S, Venugopa RV, et al. Spontaneous bacterial peritonitis caused by S. paratyphi A. J Assoc Physicians India. 2013 Dec;61(12):930-31. Tóm lược
25. Kim HM, Chon CY, Ahn SH, et al. Fatal spontaneous bacterial peritonitis by Leclercia adecarboxylata in a patient with hepatocellular carcinoma. Int J Clin Pract. 2008 Aug;62(8):1296-8. Tóm lược
26. Dalamaga M, Karmaniolas K, Pantelaki M, et al. Spontaneous peritonitis caused by Leminorella grimontii. Diagn Microbiol Infect Dis. 2006 Sep;56(1):83-5. Tóm lược
27. Colakoglu S, Turunc T, Taskoparan M, et al. Three cases of serious infection caused by Aerococcus urinae: a patient with spontaneous bacterial peritonitis and two patients with bacteremia. Infection. 2008 Jun;36(3):288-90. Tóm lược
28. Velayos Jiménez B, Fernández Salazar L, Aller Fuente R, et al. Spontaneous bacterial peritonitis due to Gemella morbillorum in a patient under chronic treatment with norfloxacin [in Spanish]. Gastroenterol Hepatol. 2008 Mar;31(3):129. Tóm lược
29. Flores-Franco RA, Lachica-Rodriguez GN, Banuelos-Moreno L, et al. Spontaneous peritonitis attributed to actinomyces species. Ann Hepatol. 2007 Oct-Dec;6(4):276-8. Tóm lược
30. Gautam M, Chopra KB, Douglas DD, et al. Streptococcus salivarius bacteremia and spontaneous bacterial peritonitis in liver transplantation candidates. Liver Transpl. 2007 Nov;13(11):1582-8. Toàn văn Tóm lược
31. Wi YM, Sohn KM, Rhee JY, et al. Spontaneous bacterial peritonitis due to Ochrobactrum anthropi: a case report. J Korean Med Sci. 2007 Apr;22(2):377-9. Toàn văn Tóm lược
32. Farmer AD, Bruckner Holt CE, Le Roux G, et al. Spontaneous bacterial peritonitis due to Arcanobacterium haemolyticum. J Infect. 2007 May;54(5):516. Tóm lược
33. Singh DK, Tyagi I, Saran RK, et al. Fatal spontaneous Cryptococcal peritonitis in a woman with decompensated liver cirrhosis. Acta Cytol. 2010 Sep-Oct;54(5 Suppl):1087-9. Tóm lược
34. Bal CK, Bhatia V, Khillan V, et al. Spontaneous cryptococcal peritonitis with fungemia in patients with decompensated cirrhosis: Report of two cases. Indian J Crit Care Med. 2014 Aug;18(8):536-9. Toàn văn Tóm lược
35. Alavi K, Atla PR, Haq T, et al. Coccidioidomycosis masquerading as eosinophilic ascites. Case Rep Gastrointest Med. 2015;2015:891910. Toàn văn Tóm lược
36. Hwang SY, Yu SJ, Lee JH, et al. Spontaneous fungal peritonitis: a severe complication in patients with advanced liver cirrhosis. Eur J Clin Microbiol Infect Dis. 2014 Feb;33(2):259-64. Tóm lược
37. Ferreira AO, Martins LN, Marinho RT, et al. Spontaneous bacterial peritonitis by Brucella in a cirrhotic patient. BMJ Case Rep. 2013;2013:bcr2013008629. Toàn văn Tóm lược
38. Sim JS, Kim HS, Oh KJ, et al. Spontaneous bacterial peritonitis with sepsis caused by Enterococcus hirae. J Korean Med Sci. 2012 Dec;27(12):1598-600. Toàn văn Tóm lược
39. Narciso-Schiavon JL, Borgonovo A, Marques PC, et al. Enterococcus casseliflavus and Enterococcus gallinarum as causative agents of spontaneous bacterial peritonitis. Ann Hepatol. 2015 Mar-Apr;14(2):270-2. Toàn văn Tóm lược
40. Dlamini NR, Bhamjee A, Levick P, et al. Spontaneous bacterial peritonitis and pneumonia caused by Bordetella bronchiseptica. J Infect Dev Ctries. 2012 Jul 23;6(7):588-91. Toàn văn Tóm lược
41. Patel S, Gandhi D, Mehta V, et al. Plesiomonas shigelloides : an extremely rare cause of spontaneous bacterial peritonitis. Acta Gastroenterol Belg. 2016 Mar;79(1):52-3. Tóm lược
42. Chinnock B, Fox C, Hendey GW. Gram’s stain of peritoneal fluid is rarely helpful in the evaluation of the ascites patient. Ann Emerg Med. 2009 Jul;54(1):78-82. Tóm lược
43. Bert F, Valla D, Moreau R, et al. Viridans group streptococci causing spontaneous bacterial peritonitis and bacteremia in patients with end-stage liver disease. Liver Transpl. 2008 May;14(5):710-1. Toàn văn Tóm lược
44. Ricart E, Soriano G, Novella MT, et al. Amoxicillin-clavulanic acid versus cefotaxime in the therapy of bacterial infections in cirrhotic patients. J Hepatol. 2000 Apr;32(4):596-602. Tóm lược
45. Strauss E, Caly WR. Spontaneous bacterial peritonitis: a therapeutic update. Expert Rev Anti Infect Ther. 2006 Apr;4(2):249-60. Tóm lược
46. Fernandez J, Navasa M, Gomez J, et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis. Hepatology. 2002 Jan;35(1):140-8. Tóm lược
47. Navasa M, Rimola A, Rodés J. Bacterial infections in liver disease. Semin Liver Dis. 1997;17(4):323-33. Tóm lược
48. Simberkoff MS, Moldover NH, Weiss G. Bactericidal and opsonic activity of cirrhotic ascites and nonascitic peritoneal fluid. J Lab Clin Med. 1978 May;91(5):831-9. Tóm lược
49. Terg R, Fassio E, Guevara M, et al. Ciprofloxacin in primary prophylaxis of spontaneous bacterial peritonitis: a randomized, placebo-controlled study. J Hepatol. 2008 May;48(5):774-9. Tóm lược
50. Bruns T, Lutz P, Stallmach A, et al. Low ascitic fluid protein does not indicate an increased risk for spontaneous bacterial peritonitis in current cohorts. J Hepatol. 2015 Aug;63(2):527-8. Toàn văn Tóm lược
51. Yildirim B, Sezgin N, Sari R, et al. Complement and immunoglobulin levels in serum and ascitic fluid of patients with spontaneous bacterial peritonitis, malignant ascites, and tuberculous peritonitis. South Med J. 2002 Oct;95(10):1158-62. Tóm lược
52. Loomba R, Wesley R, Bain A, et al. Role of fluoroquinolones in the primary prophylaxis of spontaneous bacterial peritonitis: meta-analysis. Clin Gastroenterol Hepatol. 2009 Apr;7(4):487-93. Tóm lược
53. Fernández J, Navasa M, Planas R, et al. Primary prophylaxis of spontaneous bacterial peritonitis delays hepatorenal syndrome and improves survival in cirrhosis. Gastroenterology. 2007 Sep;133(3):818-24. Tóm lược
54. Pauwels A, Mostefa-Kara N, Debenes B, et al. Systemic antibiotic prophylaxis after gastrointestinal hemorrhage in cirrhotic patients with a high risk of infection. Hepatology. 1996 Oct;24(4):802-6. Tóm lược
55. Hsieh WJ, Lin HC, Hwang SJ, et al. The effect of ciprofloxacin in the prevention of bacterial infection in patients with cirrhosis after upper gastrointestinal bleeding. Am J Gastroenterol. 1998 Jun;93(6):962-6. Tóm lược
56. Saab S, Hernandez JC, Chi AC, et al. Oral antibiotic prophylaxis reduces spontaneous bacterial peritonitis occurrence and improves short-term survival in cirrhosis: a meta-analysis. Am J Gastroenterol. 2009 Apr;104(4):993-1001. Tóm lược
57. Cohen MJ, Sahar T, Benenson S, et al. Antibiotic prophylaxis for spontaneous bacterial peritonitis in cirrhotic patients with ascites, without gastro-intestinal bleeding. Cochrane Database Syst Rev. 2009;(2):CD004791. Toàn văn Tóm lược
58. Segarra-Newnham M, Henneman A. Antibiotic prophylaxis for prevention of spontaneous bacterial peritonitis in patients without gastrointestinal bleeding. Ann Pharmacother. 2010 Dec;44(12):1946-54. Tóm lược
59. Kalambokis GN, Mouzaki A, Rodi M, et al. Rifaximin for the prevention of spontaneous bacterial peritonitis. World J Gastroenterol. 2012 Apr 14;18(14):1700-2. Toàn văn Tóm lược
60. Runyon BA; AASLD. Introduction to the revised American Association for the Study of Liver Diseases Practice Guideline management of adult patients with ascites due to cirrhosis 2012. Hepatology. 2013 Apr;57(4):1651-3. Toàn văn Tóm lược
61. European Association for the Study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol. 2010 Sep;53(3):397-417. Toàn văn Tóm lược
62. Senzolo M, Cholongitas E, Burra P, et al. Beta-blockers protect against spontaneous bacterial peritonitis in cirrhotic patients: a meta-analysis. Liver Int. 2009 Sep;29(8):1189-93. Tóm lược
63. Mandorfer M, Bota S, Schwabl P, et al. Nonselective beta blockers increase risk for hepatorenal syndrome and death in patients with cirrhosis and spontaneous bacterial peritonitis. Gastroenterology. 2014 Jun;146(7):1680-90.e1. Toàn văn Tóm lược
64. Trikudanathan G, Israel J, Cappa J, et al. Association between proton-pump inhibitors and spontaneous bacterial peritonitis in cirrhotic patients – a systematic review and meta-analysis. Int J Clin Pract. 2011 Jun;65(6):674-8. Tóm lược
65. Campbell MS, Obstein K, Reddy KR, et al. Association between proton pump inhibitor use and spontaneous bacterial peritonitis. Dig Dis Sci. 2008 Feb;53(2):394-8. Tóm lược
66. Terg R, Casciato P, Garbe C, et al; Study Group of Cirrhosis Complications of the Argentine Association for the Study of Liver Disease. Proton pump inhibitor therapy does not increase the incidence of spontaneous bacterial peritonitis in cirrhosis: a multicenter prospective study. J Hepatol. 2015 May;62(5):1056-60. Tóm lược
67. Makharia GK, Sharma BC, Bhasin DK, et al. Spontaneous bacterial peritonitis in a patient with gastric carcinoma. J Clin Gastroenterol. 1998 Oct;27(3):269-70. Tóm lược
68. Chinnock B, Afarian H, Minnigan H, et al. Physician clinical impression does not rule out spontaneous bacterial peritonitis in patients undergoing emergency department paracentesis. Ann Emerg Med. 2008 Sep;52(3):268-73. Tóm lược
69. Chinnock B, Hendey GW, Minnigan H, et al. Clinical impression and ascites appearance do not rule out bacterial peritonitis. J Emerg Med. 2013 May;44(5):903-9. Tóm lược
70. McGibbon A, Chen GI, Peltekian KM, et al. An evidence-based manual for abdominal paracentesis. Dig Dis Sci. 2007 Dec;52(12):3307-15. Tóm lược
71. Nazeer SF, Dewbre H, Miller AH. Ultrasound-assisted paracentesis performed by emergency physicians versus the traditional technique: a prospective, randomized study. Am J Emerg Med. 2005 May;23(3):363-7. Tóm lược
72. Moore KP, Aithal GP. Guidelines on the management of ascites in cirrhosis. Gut. 2006;55(suppl 6):vi1-vi12.
73. European Association for the Study of the Liver. Clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol. 2010;53(3):397-417.
74. Kuiper JJ, van Buuren HR, de Man RA. Ascites in cirrhosis: a review of management and complications. Neth J Med. 2007;65(8):283-288.
75. Rimola A, Garcia-Tsao G, Navasa M, et al. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. International Ascites Club. J Hepatol. 2000;32(1):142-153.
76. Bernardi M, Carceni P, Navickis RJ, et al. Albumin infusion in patients undergoing large-volume paracentesis: a meta-analysis of randomized trials. Hepatology. 2012;55(4):1172-1181. Tóm lược
77. Angeloni S, Nicolini G, Merli M, et al. Validation of automated blood cell counter for the determination of polymorphonuclear cell count in the ascitic fluid of cirrhotic patients with or without spontaneous bacterial peritonitis. Am J Gastroenterol. 2003 Aug;98(8):1844-8. Tóm lược
78. Riggio O, Angeloni S, Parente A, et al. Accuracy of the automated cell counters for management of spontaneous bacterial peritonitis. World J Gastroenterol. 2008 Oct 7;14(37):5689-94. Toàn văn Tóm lược
79. Cereto F, Genesca J, Segura R. Validation of automated blood cell counters for the diagnosis of spontaneous bacterial peritonitis. Am J Gastroenterol. 2004 Jul;99(7):1400. Tóm lược
80. Runyon BA, Canawati HN, Akriviadis EA. Optimization of ascitic fluid culture technique. Gastroenterology. 1988 Nov;95(5):1351-5. Tóm lược
81. Chinnock B, Hendey GW. Can clear ascitic fluid appearance rule out spontaneous bacterial peritonitis? Am J Emerg Med. 2007 Oct;25(8):934-7. Tóm lược
82. Wong CL, Holroyd-Leduc J, Thorpe KE, et al. Does this patient have bacterial peritonitis or portal hypertension? How do I perform a paracentesis and analyze the results? 2008 Mar 12;299(10):1166-78. Tóm lược
83. Thévenot T, Briot C, Macé V, et al; CFEHTP, ANGH and the PerDRISLA Study Group. The Periscreen strip is highly efficient for the exclusion of spontaneous bacterial peritonitis in cirrhotic outpatients. Am J Gastroenterol. 2016 Oct;111(10):1402-9. Tóm lược
84. Koulaouzidis A, Leontiadis GI, Abdullah M, et al. Leukocyte esterase reagent strips for the diagnosis of spontaneous bacterial peritonitis: a systematic review. Eur J Gastroenterol Hepatol. 2008 Nov;20(11):1055-60. Tóm lược
85. Parsi MA, Saadeh SN, Zein NN, et al. Ascitic fluid lactoferrin for diagnosis of spontaneous bacterial peritonitis. Gastroenterology. 2008 Sep;135(3):803-7. Tóm lược
86. Yellapu RK, Rajekar H, Martin JD, et al. Pneumatosis intestinalis and mesenteric venous gas – a manifestation of bacterascites in a patient with cirrhosis. J Postgrad Med. 2011 Jan-Mar:57(1);42-3. Toàn văn Tóm lược
87. Yamazaki M, Sano R, Kuramoto C, et al. Rapid detection of spontaneous bacterial peritonitis by granulocyte elastase latex immunoassay and reagent strip. Rinsho Byori. 2011 Jun;59(6):549-58. Tóm lược
88. Zapater P, Frances R, Gonzalez-Navaja JM, et al. Serum and ascitic fluid bacterial DNA: a new independent prognostic factor in non-infected patients with cirrhosis. Hepatology. 2008 Dec:48(6);1924-31. Toàn văn Tóm lược
89. Rogers GB, Russell LE, Preston PG, et al. Characterisation of bacteria in ascites -reporting the potential of culture- independent, molecular analysis. Eur J Clin Microbiol Infect Dis. 2010 May;29(5):533-41. Tóm lược
90. Appenrodt B, Lehmann LE, Thyssen L, et al. Is detection of bacterial DNA in ascitic fluid of clinical relevance? Eur J Gastroenterol Hepatol. 2010 Dec;22(12):1487-94. Tóm lược
91. Tsai MH, Peng YS, Chen YC, et al. Adrenal insufficiency in patients with cirrhosis, severe sepsis and septic shock. Hepatology. 2006 Apr;43(4):673-81. Toàn văn Tóm lược
92. Yuan LY, Ke ZQ, Wang M, et al. Procalcitonin and C-reactive protein in the diagnosis and prediction of spontaneous bacterial peritonitis associated with chronic severe hepatitis B. Ann Lab Med. 2013 Nov;33(6):449-54. Toàn văn Tóm lược
93. Cekin Y, Cekin AH, Duman A, et al. The role of serum procalcitonin levels in predicting ascitic fluid infection in hospitalized cirrhotic and non-cirrhotic patients. Int J Med Sci. 2013 Aug 20;10(10):1367-74. Toàn văn Tóm lược
94. Su DH, Zhuo C, Liao K, et al. Value of serum procalcitonin levels in predicting spontaneous bacterial peritonitis. Hepatogastroenterology. 2013 Jun;60(124):641-6. Tóm lược
95. Koulaouzidis A, Bhat S, Saeed AA. Spontaneous bacterial peritonitis. World J Gastroenterol. 2009 Mar 7;15(9):1042-9. Toàn văn Tóm lược
96. Lin CH, Shih FY, Ma MH, et al. Should bleeding tendency deter abdominal paracentesis? Dig Liver Dis. 2005 Dec;37(12):946-51. Tóm lược
97. Runyon BA, Hoefs JC. Ascitic fluid analysis in the differentiation of spontaneous bacterial peritonitis from gastrointestinal tract perforation into ascitic fluid. Hepatology. 1984 May-Jun;4(3):447-50. Tóm lược
98. Wu SS, Lin OS, Chin YY, et al. Ascitic fluid carcinoembryonic antigen and alkaline phosphatase levels for the differentiation of primary from secondary bacterial peritonitis with intestinal perforation. J Hepatol. 2001 Feb;34(2):215-21. Tóm lược
99. Runyon BA, Hoefs JC. Spontaneous versus secondary bacterial peritonitis: differentiation by response of ascitic fluid neutrophil count to antimicrobial therapy. Arch Intern Med. 1986 Aug;146(8):1563-5. Tóm lược
100. Uygur-Bayramicli O, Dabak G, Dabak R. A clinical dilemma: abdominal tuberculosis. World J Gastroenterol. 2003 May;9(5):1098-101. Toàn văn Tóm lược
101. Riquelme A, Calvo M, Salech F, et al. Value of adenosine deaminase (ADA) in ascitic fluid for the diagnosis of tuberculosis peritonitis: a meta-analysis. J Clin Gastroenterol. 2006 Sep;40(8):705-10. Tóm lược
102. Runyon BA. Amylase levels in ascitic fluid. J Clin Gastroenterol. 1987 Apr;9(2):172-4. Tóm lược
103. Bracher GA, Manocha AP, DeBanto JR, et al. Endoscopic pancreatic duct stenting to treat pancreatic ascites. Gastrointest Endosc. 1999 Jun;49(6):710-15. Tóm lược
104. Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017 Mar;43(3):304-77. Toàn văn Tóm lược
105. Figueiredo FAF, Coelho HSM, Alvariz RG, et al. Randomized trial comparing intravenous ceftriaxone with oral cefixime for treatment of spontaneous bacterial peritonitis (SBP) in cirrhotic patients: pilot study. Presented at: 5th United European Gastroenterology Week, Paris, 1996.
106. Navasa M, Follo A, Llovet JM, et al. Randomized, comparative study of oral ofloxacin versus intravenous cefotaxime in spontaneous bacterial peritonitis. Gastroenterology. 1996 Oct;111(4):1011-7. Tóm lược
107. Tuncer I, Topcu N, Durmus A, et al. Oral ciprofloxacin versus intravenous cefotaxime and ceftriaxone in the treatment of spontaneous bacterial peritonitis. Hepatogastroenterology. 2003;50:1426-1430. Tóm lược
108. Chavez-Tapia NC, Soares-Weiser K, Brezis M, et al. Antibiotics for spontaneous bacterial peritonitis in cirrhotic patients. Cochrane Database Syst Rev. 2009;(1):CD002232. Toàn văn Tóm lược
109. Felisart J, Rimola A, Arroyo V, et al. Cefotaxime is more effective than is ampicillin-tobramycin in cirrhotics with severe infections. Hepatology. 1985 May-Jun;5(3):457-62. Tóm lược
110. Rimola A, Salmeron JM, Clemente G. Two different dosages of cefotaxime in the treatment of spontaneous bacterial peritonitis in cirrhosis: results of a prospective, randomized, multicenter study. Hepatology. 1995 Mar;21(3):674-9. Tóm lược
111. Chen TA, Lo GH, Lai KH, et al. Single daily amikacin versus cefotaxime in the short-course treatment of spontaneous bacterial peritonitis in cirrhotics. World J Gastroenterol. 2005 Nov 21;11(43):6823-7. Toàn văn Tóm lược
112. Gomez-Jimenez J, Ribera E, Gasser I, et al. Randomized trial comparing ceftriaxone with cefonicid for treatment of spontaneous bacterial peritonitis in cirrhotic patients. Antimicrob Agents Chemother. 1993;37:1587-1592. Toàn văn Tóm lược
113. Angeli P, Guarda S, Fasolato S, et al. Switch therapy with ciprofloxacin vs. intravenous ceftazidime in the treatment of spontaneous bacterial peritonitis in patients with cirrhosis: similar efficacy at lower cost. Aliment Pharmacol Ther. 2006 Jan 1;23(1):75-84. Toàn văn Tóm lược
114. Grange J. Randomized comparative study of moxifloxacin versus amoxicillin-clavulanate in
115. Ariza X, Castellote J, Lora-Tamayo J, et al. Risk factors for resistance to ceftriaxone and its impact on mortality in community, healthcare and nosocomial spontaneous bacterial peritonitis. J Hepatol. 2012 Apr;56(4):825-32. Tóm lược
116. Novovic S, Semb S, Olsen H, et al. First-line treatment with cephalosporins in spontaneous bacterial peritonitis provides poor antibiotic coverage. Scand J Gastroenterol. 2012 Feb;47(2):212-6. Tóm lược
117. Reuken PA, Pletz MW, Baier M, et al. Emergence of spontaneous bacterial peritonitis due to enterococci – risk factors and outcome in a 12-year retrospective study. Aliment Pharmacol Ther. 2012 May;35(10):1199-208. Tóm lược
118. Angeloni S, Leboffe C, Parente A, et al. Efficacy of current guidelines for the treatment of spontaneous bacterial peritonitis in the clinical practice. World J Gastroenterol. 2008 May 7;14(17):2757-62. Toàn văn Tóm lược
119. Sheikhbahaei S, Abdollahi A, Hafezi-Nejad N, et al. Patterns of antimicrobial resistance in the causative organisms of spontaneous bacterial peritonitis: a single centre, six-year experience of 1981 samples. Int J Hepatol. 2014;2014:917856. Toàn văn Tóm lược
120. Friedrich K, Nüssle S, Rehlen T, et al. Microbiology and resistance in first episodes of spontaneous bacterial peritonitis: implications for management and prognosis. J Gastroenterol Hepatol. 2016 Jun;31(6):1191-5. Tóm lược
121. Terg R, Cobas S, Fassio E, et al. Oral ciprofloxacin after a short course of intravenous ciprofloxacin in the treatment of spontaneous bacterial peritonitis: results of a multicenter, randomized study. J Hepatol. 2000;33:564-569. Tóm lược
122. Piano S, Fasolato S, Salinas F, et al. The empirical antibiotic treatment of nosocomial spontaneous bacterial peritonitis: Results of a randomized, controlled clinical trial. Hepatology. 2016 Apr;63(4):1299-309. Tóm lược
123. Jindal A, Kumar M, Bhadoria AS, et al. A randomized open label study of ‘imipenem vs. cefepime’ in spontaneous bacterial peritonitis. Liver Int. 2016 May;36(5):677-87. Tóm lược
124. Runyon BA, McHutchinson JG, Antillon MR, et al. Short-course versus long-course antibiotic treatment of spontaneous bacterial peritonitis: a randomized controlled study of 100 patients. Gastroenterology. 1991 Jun;100(6):1737-42. Tóm lược
125. Sort P, Navasa M, Arroyo V, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med. 1999;341:403-409. Toàn văn Tóm lược
126. Choi CH, Han KH, Kim do Y, et al. Efficacy and safety of large volume paracentesis in cirrhotic patients with spontaneous bacterial peritonitis: a randomized, prospective study [in Korean]. Taehan Kan Hakhoe Chi. 2002 Mar;8(1):52-60. Tóm lược
127. Choi CH, Ahn SH, Kim DY, et al. Long-term clinical outcome of large volume paracentesis with intravenous albumin in patients with spontaneous bacterial peritonitis: a randomized prospective study. J Gastroenterol Hepatol. 2005 Aug;20(8):1215-22. Tóm lược
128. Garcia-Tsao G. Bacterial infections in cirrhosis: treatment and prophylaxis. J Hepatol. 2005;42(suppl 1):S85-92. Tóm lược
129. Umgelter A, Reindl W, Miedaner M, et al. Failure of current antibiotic first-line regimens and mortality in hospitalized patients with spontaneous bacterial peritonitis. Infection. 2009 Feb;37(1):2-8. Tóm lược
130. Bhat G, Vandana KE, Bhatia S, et al. Spontaneous ascitic fluid infection in liver cirrhosis: bacteriological profile and response to antibiotic therapy. Indian J Gastroenterol. 2013 Sep;32(5):297-301. Tóm lược
131. Badawy AA, Zaher TI, Sharaf SM, et al. Effect of alternative antibiotics in treatment of cefotaxime resistant spontaneous bacterial peritonitis. World J Gastroenterol. 2013 Feb 28;19(8):1271-7. Toàn văn Tóm lược
132. Chavez-Tapia NC, Barrientos-Gutierrez T, Tellez-Avila FI, et al. Antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding. Cochrane Database Syst Rev. 2010;(9):CD002907. Toàn văn Tóm lược
133. Elfert A, Abo Ali L, Soliman S, et al. Randomized-controlled trial of rifaximin versus norfloxacin for secondary prophylaxis of spontaneous bacterial peritonitis. Eur J Gastroenterol Hepatol. 2016 Dec;28(12):1450-4. Tóm lược
134. Kamal F, Khan MA, Khan Z, et al. Rifaximin for the prevention of spontaneous bacterial peritonitis and hepatorenal syndrome in cirrhosis: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol. 2017 Oct;29(10):1109-17. Tóm lược
135. Tito L, Rimola A, Gines P, et al. Recurrence of spontaneous bacterial peritonitis in cirrhosis: frequency and predictive factors. Hepatology. 1988 Jan-Feb;8(1):27-31. Tóm lược
136. Tandon P, Garcia-Tsao G. Renal dysfunction is the most important independent predictor of mortality in cirrhotic patients with spontaneous bacterial peritonitis. Clin Gastroenterol Hepatol. 2011 Mar;9(3):260-5. Tóm lược
137. Follo A, Llovet JM, Navasa M, et al. Renal impairment after spontaneous bacterial peritonitis in cirrhosis: incidence, clinical course, predictive factors and prognosis. Hepatology. 1994 Dec;20(6):1495-1501. Tóm lược
138. Wong F, Bernardi M, Balk R, et al. Sepsis in cirrhosis: report on the 7th meeting of the International Ascites Club. Gut. 2005 May;54(5):718-25. Toàn văn Tóm lược
139. Qureshi WA, Harshfield D, Shah H, et al. An unusual complication of paracentesis. Am J Gastroenterol. 1992 Sep;87(9):1209-11. Tóm lược
140. Aagaard J, Jensen LI, Sorensen TI, et al. Recanalized umbilical vein in portal hypertension. AJR Am J Roentgenol. 1982 Dec;139(6):1107-10. Tóm lược
141. Arnold C, Haag K, Blum HE, et al. Acute hemoperitoneum after large-volume paracentesis. Gastroenterology. 1997 Sep;113(3):978-82. Tóm lược
142. Pache I, Bilodeau M. Severe hemorrhage following abdominal paracentesis for ascites in patients with liver disease. Aliment Pharmacol Ther. 2005;21:525-529. Toàn văn Tóm lược
143. McVay PA, Toy PT. Lack of increased bleeding after paracentesis and thoracentesis in patients with mild coagulation abnormalities. Transfusion. 1991;31:164-171. Tóm lược
144. De Gottardi A, Thévenot T, Spahr, et al. Risk of complications after abdominal paracentesis in cirrhotic patients: a prospective study. Clin Gastroenterol Hepatol. 2009 Aug;7(8):906-9. Tóm lược
145. Mallory A, Schaefer JW. Complications of diagnostic paracentesis in patients with liver disease. JAMA. 1978 Feb 13;239(7):628-30. Tóm lược
146. Moore KP, Wong F, Gines P, et al. The management of ascites in cirrhosis: report on the consensus conference of the International Ascites Club. Hepatology. 2003 Jul;38(1):258-66. Tóm lược
147. Hale BR Jr, Girzadas DV Jr. Application of 2-octyl-cyanoacrylate controls persistent ascites fluid leak. J Emerg Med. 2001 Jan;20(1):85-6. Tóm lược
Tuyên bố miễn trách nhiệm
Bên ngoài Hoa Kỳ và Canada. BMJ Publishing Group Ltd (”BMJ Group”) nỗ lực để đảm bảo rằng các thông tin được cung cấp là chính xác và cập nhật, nhưng chúng tôi và cả những người cấp giấy phép của chúng tôi, là những người cung cấp các nội dung nhất định có liên kết với nội dung của chúng tôi hoặc có thể truy cập được từ nội dung của chúng tôi, đều không đảm bảo điều đó. BMJ Group không ủng hộ hay xác nhận việc sử dụng bất kỳ loại thuốc hay trị liệu nào trong đó và BMJ Group cũng không thực hiện chẩn đoán cho các bệnh nhân. Các chuyên gia y tế cần sử dụng những cân nhắc chuyên môn của mình trong việc sử dụng thông tin này và chăm sóc cho bệnh nhân của họ và thông tin trong này không được coi là sự thay thế cho việc đó.
các phương pháp chẩn đoán, điều trị, liên lạc theo dõi, thuốc và bất kỳ chống chỉ định hay phản ứng phụ nào. Ngoài ra, các tiêu chuẩn và thực hành y khoa đó thay đổi khi có thêm số liệu, và quý vị nên tham khảo nhiều nguồn khác nhau. Chúng tôi đặc biệt khuyến nghị người dùng nên xác minh độc lập các chẩn đoán, điều trị và theo dõi liên lạc được đưa ra, đồng thời đảm bảo rằng thông tin đó là phù hợp cho bệnh nhân trong khu vực của quý vị. Ngoài ra, liên quan đến thuốc kê toa, chúng tôi khuyên quý vị nên kiểm tra trang thông tin sản phẩm kèm theo mỗi loại thuốc để xác minh các điều kiện sử dụng và xác định bất kỳ thay đổi nào về liều dùng hay chống chỉ định, đặc biệt là nếu dược chất được cho sử dụng là loại mới, ít được sử dụng, hay có khoảng trị liệu hẹp. Quý vị phải luôn luôn kiểm tra rằng các loại thuốc được dẫn chiếu có giấy phép để sử dụng cho mục đích được nêu và trên cơ sở được cung cấp trong tình trạng “hiện có” như được nêu, và trong phạm vi đầy đủ được pháp luật cho phép BMJ Group và những người cấp giấy phép của mình không chịu bất kỳ trách nhiệm nào cho bất kỳ khía cạnh chăm sóc sức khỏe nào được cung cấp với sự hỗ trợ của thông tin này hay việc sử dụng nào khác của thông tin này.