nhathuocngocanh.com – Để tải file PDF của bài viết Viêm phổi do nhiễm Pneumocystis Jirovecii, xin vui lòng click vào link ở đây.
Tóm tắt
- Loài vi sinh vật này trước đây được gọi là Pneumocystis carinii
- Vẫn là bệnh nhiễm trùng cơ hội phổ biến nhất liên quan đến AIDS
- Nghi ngờ mắc viêm phổi do nhiễm nấm Pneumocystis (PCP) dựa trên các dấu hiệu hoặc triệu chứng lâm sàng của viêm phổi ở người bị ức chế miễn dịch, đặc biệt là do nhiễm HIV.
- Chẩn đoán dựa vào xét nghiệm phát hiện vi sinh vật trong mẫu đờm pha loãng hoặc dịch rửa phế quản – phế nang (BAL).
- Lựa chọn điều trị bằng trimethoprim/sulfamethoxazole (TMP/SMX).
- Tỉ lệ mắc mới PCP hiện đang giảm dần nhờ sử dụng liệu pháp kháng retrovirus (ARV) kết hợp với điều trị dự phòng PCP.
Định nghĩa
Viêm phổi do nhiễm nấm Pneumocystis (PCP) là tình trạng nhiễm trùng phổi gây ra bởi nấm Pneumocystis jirovecii (trước đây gọi là Pneumocystis carinii). Loại nấm này thường gây ra bệnh cảnh lâm sàng ở những bệnh nhân bị suy giảm miễn dịch nghiêm trọng, ví dụ như bệnh nhân dương tính với HIV có số lượng tế bào CD4 <200 tế bào/microlit, bệnh nhân ghép tủy xương, bệnh nhân ghép tạng đặc, hoặc bệnh nhân đang điều trị thuốc ức chế miễn dịch kéo dài.
Dịch tễ học
Viêm phổi PCP là một trong những bệnh phổ biến nhất ở trẻ em, trẻ vị thành niên và người lớn nhiễm AIDS.[1] Đây vẫn là nguyên nhân thường gặp nhất gây tử vong có liên quan đến AIDS ở bệnh nhân nhập viện do nhiễm HIV. Ở một bệnh viện cấp cứu hạng ba tại thành phố New York (có chương trình chăm sóc điều trị HIV ngoại trú toàn diện), 4.8% trường hợp tử vong có liên quan đến AIDS trong thời gian từ năm 2004 đến năm 2008 (10/208) là do PCP.[2] Việc sử dụng liệu pháp kháng retrovirus (ARV) kết hợp và điều trị dự phòng PCP đều đặn giúp giảm tổng số ca bệnh.[3] Nghiên
cứu EuroSIDA dựa trên một nghiên cứu đoàn hệ thực hiện trên hơn 8500 bệnh nhân dương tính với HIV tại châu Âu cho thấy tỉ lệ mắc mới PCP đã giảm từ mức 4.9 ca/100 người – số liệu tính đến trước tháng Ba năm 1995, xuống 0.3 ca/100 người – số liệu tính từ sau tháng Ba năm 1998.[4] Tương tự, nghiên cứu NA-ACCORD dựa trên 16 nghiên cứu đoàn hệ thực hiện trên hơn 80.000 bệnh nhân dương tính với HIV đến từ Hoa Kỳ và Canada, đã cho thấy tỉ lệ mắc mới PCP đã giảm từ 0.92 ca/100 người – số liệu từ năm 2000 đến 2003, xuống 0.39 ca – số liệu từ năm 2008 đến 2010.[5] Ở người lớn dương tính với HIV, yếu tố nguy cơ lớn nhất nhiễm PCP là số lượng tế bào CD4 <200 tế bào/microlit, và nguy cơ sẽ càng tăng nếu số lượng tế bào CD4 giảm xuống dưới mức này.[6] [7] Nguy cơ mắc PCP giảm nếu bệnh nhân duy trì mức tăng số lượng tế bào CD4 cao hơn 200 tế bào/microlit bằng các thuốc ARV.
Hiện nay, phần lớn các ca bệnh PCP xảy ra ở những bệnh nhân không biết mình bị nhiễm HIV, không điều trị HIV, hoặc không sử dụng ARV hoặc điều trị dự phòng PCP do không tuân thủ điều trị hoặc không dung nạp thuốc.[8] [9] [10] [11]Trong khoảng thời gian từ năm 2000 đến năm 2013, một nghiên cứu ở châu Âu báo cáo có sự gia tăng trong độ tuổi và tỉ lệ bệnh nhân bị viêm phổi do nấm Pneumocystis jirovecii (PJP) trước khi chẩn đoán HIV (từ 34 đến 44 tuổi, tương ứng từ 48% đến 67%).[12]
Tại Hoa Kỳ, tỷ lệ hiện mắc HIV có lẽ không được ước tính chính xác, và do đó, tỷ lệ mắc PCP lần đầu tiên cũng có thể không được ước tính chính xác, đặc biệt là ở những nhóm không được tiếp cận đầy đủ với hệ thống chăm sóc sức khỏe.[13] Một nhóm bệnh nhân khác có nguy cơ nhiễm PCP là những người dân tị nạn dương tính với HIV đến từ các nước đang phát triển, ở nhóm bệnh nhân này có thể khó phân biệt được nhiễm PCP với nhiễm lao phổi hoặc đồng nhiễm.[14] Tuy nhiên, tỷ lệ hiện mắc PCP thay đổi theo khu vực địa lý, và ở một số khu vực trên thế giới, tỷ lệ này là khá thấp.[15] Ở trẻ em, tỷ lệ mắc mới PCP nhìn chung đã giảm kể từ đầu kỷ nguyên HIV, một phần nhờ vào những tiến bộ về hệ thống xét nghiệm HIV tiền sản và việc sử dụng các phương pháp điều trị HIV để phòng ngừa lây từ mẹ sang con, nhưng cũng nhờ vào việc sử dụng liệu pháp ARV.[8] Theo Nghiên cứu Hợp tác về Lây truyền AIDS trong giai đoạn chu sinh, tỷ lệ mắc mới PCP ở trẻ dương tính với HIV giảm từ 5.2 ca/100 người thời chưa có thuốc ARV xuống 0.3 ca/100 người thời sau khi có thuốc ARV.[16] Ở trẻ dương tính với HIV, tỉ lệ mắc PCP cao nhất xảy ra ở trẻ sơ sinh từ 3 đến 6 tháng tuổi. Nguy cơ mắc PCP không liên quan đến số lượng tế bào CD4 ở trẻ dưới 6 tuổi mà liên quan nhiều đến tỉ lệ %CD4. Ở trẻ trên 6 tuổi, số lượng tế bào CD4 liên quan đến nguy cơ mắc PCP, tương tự như ở người lớn.[17] [18] [19]
Ở bệnh nhân âm tính với HIV, tỷ lệ mắc mới PCP nhìn chung là thấp và chủ yếu xảy ra ở bệnh nhân có các nguyên nhân suy giảm miễn dịch khác.[20] [21] [22] [23] [24] [25] [26] Trong khi tỷ lệ mắc mới PCP ở bệnh nhân dương tính với HIV giảm ở Anh trong khoảng thời gian từ năm 2000 đến 2010 và ở Pháp từ năm 2005 đến 2013, tỉ lệ mắc PCP ở bệnh nhân âm tính với HIV lại tăng trong cùng khoảng thời gian này.[27] Trong nhóm bệnh nhân này, PCP xảy ra chủ yếu ở người nhận ghép tạng (7% đến 43%), người mắc bệnh máu ác tính (23% đến 39%), người mắc khối u ác tính (18% đến 27%) và người mắc các tình trạng viêm nhiễm (11% đến 27%).[21] [22] [24] [25] PCP cũng xảy ra ở bệnh nhân sử dụng chất đối kháng yếu tố hoại tử u (TNF-alpha) hoặc kháng thể đơn dòng kháng CD20, rituximab.[28] [29] [30] [31] [32] [33] PCP nghiêm trọng hơn ở nhóm người âm tính với HIV và gây ra tỉ lệ mắc bệnh và tỉ lệ tử vong cao hơn so với bệnh nhân dương tính với HIV.[25] [34] [35]
Bệnh căn học
Viêm phổi do nhiễm nấm Pneumocystis (PCP) gây ra bởi nấm Pneumocystis jirovecii (trước đây gọi là Pneumocystis carinii). Chưa có nghiên cứu đầy đủ về chu kỳ sống và sự lây nhiễm của nấm Pneumocystis.
Ca viêm phổi ở người gây ra bởi nấm Pneumocystis đầu tiên được phát hiện vào những năm 1940 và 1950. Ban đầu người ta nghĩ rằng loài nấm này là một động vật nguyên sinh cho đến năm 1988 khi các nghiên cứu RNA đã chỉ ra tính tương đồng với nấm nhiều hơn.[36] Năm 2001, Pneumocystis được phân loại lại là nấm và được đổi tên thành Pneumocystis jirovecii.[37] [38]Viêm phổi do nấm Pneumocystis vẫn thường được gọi là PCP.
Sinh lý bệnh học
Nhiễm trùng phổi bắt đầu với sự nhân lên của các tế bào nấm trong phế nang. Khi nhiễm trùng tiến triển, các túi phế nang sẽ chứa đầy dịch tiết, xuất hiện tình trạng tăng sinh tế bào phế nang týp 2 và các tế bào đơn nhân xâm nhập vào phổi.
Sự bóc vẩy da của các tế bào lót phế nang làm gia tăng độ thẩm thấu của màng mao mạch phế nang và gây phù phổi cấp không do nguyên nhân tim mạch (phù phổi cấp tổn thương).
Ở những bệnh nhân mắc AIDS, số lượng nấm Pneumocystis trong phổi nhiều hơn và số lượng tế bào viêm ít hơn so với bệnh nhân âm tính với HIV bị PCP.[39] Số lượng tế bào viêm ở những bệnh nhân AIDS mắc PCP dường như liên quan đến sự ô-xy hóa và tỷ lệ sống sót tốt hơn so với ở những bệnh nhân không mắc AIDS.[39]
Nếu phổi bị tổn thương hơn nữa có thể dẫn đến hình thành túi phế nang thành mỏng (còn được gọi là nang, mụn nước, hoặc khoang) và tràn khí màng phổi. Tổn thương này có thể xảy ra do tình trạng nhiễm khuẩn nhẹ và kéo dài, sự bào mòn nhu mô phổi do viêm làm giải phóng enzym proteases và enzym elastases, hoặc làm biến đổi mô liên kết ở phổi gây ra bởi tình trạng nhiễm HIV.[40]
Phân loại
Phân loại sinh học
- Giới: Nấm (Fungi)
- Phân giới: Nấm bậc cao (Dikarya)
- Ngành: Nấm túi/nang (Ascomycota)
- Phân ngành: Taphrinomycotina
- Lớp: Pneumocystidomycetes
- Bộ: Pneumocystidales
- Họ: Pneumocystidaceae
- Chi: Pneumocystis
Ngăn ngừa sơ cấp
Viêm phổi PCP có thể được phòng ngừa ở bệnh nhân dương tính với HIV bằng cách thực hiện liệu pháp kháng retrovirus (ARV) kết hợp, mục tiêu là khôi phục và duy trì chức năng miễn dịch.[42] [43] [44]
Bên cạnh ARV (đối với những người đang điều trị ARV), cần có phương pháp điều trị dự phòng ban đầu cụ thể ở tất cả bệnh nhân có nguy cơ cao nhiễm PCP (xem dưới đây).
Người lớn hoặc trẻ vị thành niên, dương tính với HIV
- Bệnh nhân dương tính với HIV không có các triệu chứng hoặc dấu hiệu lâm sàng PCP cần điều trị dự phòng cơ bản trong các hoàn cảnh sau:[44]
- Số lượng tế bào CD4 <200 tế bào/microlit
- Tỉ lệ tế bào CD4 <14%
- Tiền sử mắc các bệnh liên quan đến AIDS
- Số lượng tế bào CD4 >200 tế bào/microlit nhưng <250 tế bào/microlit nếu dừng ART và không thể kiểm tra số lượng tế bào CD4 mỗi 1 đến 3 tháng.
- Lựa chọn thuốc dự phòng là trimethprim/sulfamethoxazole (TMP/SMX), khi không có chống chỉ định. Đối với bệnh nhân không dung nạp TMP/SMX, các lựa chọn khác bao gồm trimethoprim, dapsone, dapsone kết hợp với pyrimethamine, atovaquone, atovaquone kết hợp với pyrimethamine, hoặc pentamidine dạng hít.
- Dừng điều trị dự phòng PCP khi bệnh nhân đã khôi phục miễn dịch với số lượng tế bào CD4 vượt mức 200 tế bào/microlit trong 3 tháng liên tục.[44] Xem xét dừng điều trị dự phòng PCP ở những bệnh nhân điều trị thuốc kháng vi-rút với tải lượng vi-rút bị ức chế và số lượng tế bào CD4 từ 100 đến 200 tế bào/microlit đối với các nhóm bệnh nhân nhất định, nhưng không khuyến nghị chung.[45] Duy trì điều trị dự phòng suốt đời đối với những bệnh nhân mắc PCP mặc dù đã có sự hồi phục miễn dịch.
Trẻ em mắc hoặc có nguy cơ mắc HIV
- Điều trị dự phòng PCP được khuyến cáo áp dụng đối với các nhóm trẻ em sau đây:
- Trẻ em từ 1 đến 12 tháng tuổi dương tính với HIV
- Trẻ em từ 1 đến 5 tuổi dương tính với HIV và có số lượng tế bào CD4 <500 tế bào/microlit hoặc tỷ lệ CD4 <15%
- Trẻ em từ 6 đến 12 tuổi dương tính với HIV và có số lượng tế bào CD4 <200 tế bào/microlit hoặc tỷ lệ CD4 <15%
- Trẻ nhỏ chưa xác định HIV có mẹ dương tính với HIV
- Trẻ nhỏ từ 1 đến 12 tháng tuổi âm tính với HIV nhưng có suy giảm miễn dịch là nhóm hiếm gặp nhưng có thể cân nhắc điều trị dự phòng ban đầu.
- Lựa chọn thuốc điều trị là TMP/SMX, khi không có chống chỉ định. Ở những bệnh nhân không dung nạp TMP/ SMX, những lựa chọn khác bao gồm dapson, atovaquone, hoặc pentamidine dạng hít.
- Trẻ em có mẹ dương tính với HIV cần được điều trị dự phòng TMP/SMX bắt đầu lúc 4 đến 6 tuần tuổi cho đến
khi chắc chắn trẻ không bị nhiễm HIV. Trẻ em dương tính với HIV lúc mới sinh cần được điều trị trong suốt năm đầu tiên của cuộc đời cho đến khi số lượng CD4 nằm trong phạm vi bình thường trong lứa tuổi của trẻ. - Cân nhắc dừng điều trị dự phòng PCP sau khi dùng ARV trên 6 tháng, và tỷ lệ CD4 là 15% hoặc cao hơn, hoặc số
lượng tế bào CD4 là 200 tế bào/microlit hoặc cao hơn.[43]
Người lớn hoặc trẻ vị thành niên âm tính với HIV nhưng có suy giảm miễn dịch
- Chỉ định điều trị dự phòng ban đầu ở những bệnh nhân âm tính với HIV mà không có triệu chứng hay dấu hiệu lâm sàng của PCP, bao gồm:
- Bệnh máu ác tính
- Cấy ghép tủy xương
- Ghép tạng đặc
- Rối loạn quá trình viêm, và những người sử dụng corticosteroid với liều lượng ít nhất 16 mg đến 20 mg prednisone (prednisolone) hàng ngày trong vòng hơn 1 tháng.[23] [46]
- Không có hướng dẫn điều trị dự phòng cho những bệnh nhân trong nhóm này. TMP/SMX là kháng sinh bậc 1 ưu tiên sử dụng, cùng với pentamidine dạng hít hoặc dapsone dạng uống nếu bệnh nhân không dung nạp TMP/SMX.
Mặc dù có bằng chứng cho thấy có sự lây nhiễm vi khuẩn từ người sang người, nhưng hiện tại không khuyến cáo cách ly hô hấp bệnh nhân mắc PCP.[44] [47] [48] [49] [50]
Vắc-xin hiện đang trong giai đoạn phát triển.[51] [52] [53]
Ngăn ngừa thứ cấp
Các bệnh nhân nhiễm PCP, đã được điều trị và không có các triệu chứng, có thể được điều trị dự phòng thứ phát với lộ trình tương tự như điều trị dự phòng ban đầu cho mỗi nhóm bệnh nhân.
Khuyến cáo điều trị dự phòng thứ phát cho bệnh nhân dương tính với HIV mắc PCP và nên bắt đầu ngay khi kết thúc điều trị PCP và tiếp tục điều trị trọn đời, trừ khi xuất hiện sự hồi phục miễn dịch khi điều trị kháng retrovirus.[43] [44] [104]
Dừng điều trị dự phòng thứ phát khi bệnh nhân đã khôi phục miễn dịch và số lượng tế bào CD4 vượt 200 tế bào/microlit trong 3 tháng liên tục. Cần duy trì điều trị dự phòng suốt đời đối với những bệnh nhân mắc PCP dù đã khôi phục miễn dịch.
Tiền sử ca bệnh
Tiền sử ca bệnh #1
Bệnh nhân nam 34 tuổi có tiền sử quan hệ tình dục đồng giới bị khó thở tăng dần trong 3 tuần kèm sốt và ho khan. Bệnh nhân có biểu hiện nhịp tim nhanh và thở nhanh, sốt 38.1°C (100.5°F). SpO2 (độ bão hòa oxy máu) đo ở khí phòng là 86%. Bệnh nhân trông gầy gò và bị suy hô hấp mức độ vừa. Khám phổi không phát hiện gì đặc biệt.
Tiền sử ca bệnh #2
Bệnh nhân nữ 45 tuổi có tiền sử u hạt Wegener, đã điều trị 6 tháng bằng cyclophosphamid và prednisolon vào viện vì ho, khó thở và sốt một tuần nay. Bệnh nhân thở nhanh và có SpO2 (khí phòng) là 80%. Bệnh nhân bị suy hô hấp ở mức độ vừa và có ran rải rác trong phổi.
Các bài trình bày khác
Các bệnh nhân nhiễm HIV tiến triển nặng, đặc biệt đang sử dụng pentamidin dạng hít, có thể thỉnh thoảng bị nhiễm nấm pneumocystosis ngoài phổi, chủ yếu ở các hạch bạch huyết, lách, gan, và tủy xương.
Cách tiếp cận chẩn đoán từng bước
Biểu hiện lâm sàng thay đổi tùy theo mức độ ức chế miễn dịch. Chẩn đoán ở những bệnh nhân dương tính với HIV thường sớm hơn, trong khi đó, ở những bệnh nhân âm tính với HIV, biểu hiện bệnh nghiêm trọng hơn và có thể có một sự trì hoãn trong việc đưa ra chẩn đoán PCP. Chẩn đoán xác định nếu có sự tồn tại của vi khuẩn trong dịch rửa phế quản- phế nang hoặc đờm pha loãng hoặc, ít gặp hơn, ở trong nhu mô phổi.
Tiền sử
Các bác sĩ cần nghi ngờ có tình trạng nhiễm PCP khi chăm sóc bệnh nhân người lớn hoặc trẻ vị thành niên dương tính với HIV, đặc biệt khi bệnh nhân không tuân thủ điều trị thuốc kháng retrovirus (ARV) kết hợp hoặc biện pháp dự phòng PCP, đã từng bị PCP, và/hoặc có số lượng tế bào CD4 <200 tế bào/microlit.[54]
Trẻ sơ sinh chưa xác định nhiễm HIV có mẹ nhiễm HIV kèm theo triệu chứng hô hấp cũng cần được kiểm tra để xác định tình trạng nhiễm PCP.
Những nhóm bệnh nhân khác cần nghi ngờ mắc PCP là những người bị suy giảm miễn dịch và có tiền sử:
- Cấy ghép tủy xương
- Ghép tạng đặc
- Bệnh máu ác tính
- Sử dụng corticosteroid ± các thuốc ức chế miễn dịch khác kéo dài.[25] [34]
Ở những bệnh nhân có các triệu chứng viêm phổi không điển hình, việc đánh giá các yếu tố nguy cơ nhiễm HIV và thực hiện xét nghiệm HIV cũng có thể giúp xác định những bệnh nhân có nguy cơ mắc PCP.
Ở bệnh nhân PCP dương tính với HIV, triệu chứng thường tiến triển âm thầm với những biểu hiện mệt mỏi, sốt, ớn lạnh, toát mồ hôi, ho khan, và khó thở trong nhiều tuần. Những dấu hiệu khác liên quan đến PCP là tiền sử mắc viêm phổi do vi khuẩn tái phát, giảm cân, và nhiễm nấm candida miệng.
Ở những bệnh nhân âm tính với HIV, biểu hiện thường nhanh và nặng hơn.[34] Các triệu chứng khởi phát khi giảm hoặc ngưng liều thông thường của các thuốc ức chế miễn dịch.[22]
Hiếm khi nhiễm trùng gây biểu hiện ngoài phổi ở những bệnh nhân mắc HIV giai đoạn tiến triển; tuy nhiên, ở những bệnh nhân bị AIDS giai đoạn tiến triển hoặc những bệnh nhân dương tính với HIV mà đang không sử dụng thuốc điều trị dự phòng, có thể bị nhiễm trùng toàn thân với các triệu chứng rõ ràng, suy giảm nhận thức do ảnh hưởng đến hệ thần kinh trung ương, và các triệu chứng tiêu hóa như tiêu chảy.
Khám lâm sàng
Những phát hiện khi khám lâm sàng là không đặc hiệu, bao gồm sốt, thở nhanh, và nhịp tim nhanh. Khám phổi thường cho kết quả bình thường nhưng đôi khi có thể nghe thấy tiếng lép bép nhẹ. Trẻ em có thể bị chứng xanh tím. Nhiễm trùng hiếm khi gây ra các biểu hiện ngoài phổi, nhưng ở những bệnh nhân mắc AIDS giai đoạn tiến triển có thể có tình trạng nhiễm trùng toàn thân.
Nhịp thở giảm không đều có thể là dấu hiệu của tràn khí màng phổi. Đau do viêm màng phổi có thể là dấu hiệu của tràn khí màng phổi nhưng không thường gặp ở bệnh nhân mắc PCP không bị tràn khí màng phổi.
Các thăm dò
Nếu nghi ngờ PCP dựa trên các triệu chứng lâm sàng, và X-quang ngực phù hợp với PCP, bước đầu tiên trong chẩn đoán sẽ là xét nghiệm đờm pha loãng để tìm nấm Pneumocystis jirovecii.[3] [55] Độ nhạy của xét nghiệm đờm pha loãng là 50% đến 90% tùy theo chất lượng mẫu, phương pháp nhuộm màu được sử dụng, và kinh nghiệm của khoa xét nghiệm.[44] [56] [57] [58] [59]
Nếu xét nghiệm đờm pha loãng cho kết quả âm tính, cần thực hiện nội soi phế quản và xét nghiệm dịch rửa phế quản- phế nang (BAL). Độ nhạy của BAL là 90% đến 99% ở những bệnh nhân dương tính với HIV, vì vậy việc này thường được thực hiện mà không cần sinh thiết xuyên thành phế quản.[44] Nhìn chung, nếu xét nghiệm BAL âm tính ở một bệnh nhân dương tính với HIV, thì cần tìm các nguyên nhân khác và có thể ngưng điều trị.
Sinh thiết xuyên thành phế quản có thể được thực hiện nếu xét nghiệm BAL ban đầu âm tính nhưng mức độ nghi ngờ PCP trên lâm sàng là cao hoặc có những chẩn đoán khác được cân nhắc. Độ nhạy của sinh thiết xuyên thành phế quản là 95% đến 100%.[44] Ở những bệnh nhân âm tính với HIV, sinh thiết xuyên thành phế quản thường cần thiết hơn để xác định chẩn đoán vì BAL kém nhạy hơn. Sinh thiết xuyên thành phế quản có nguy cơ bị biến chứng cao hơn, chẳng hạn như chảy máu và tràn khí màng phổi. Tràn khí màng phổi xảy ra với 9% bệnh nhân dương tính với HIV đã từng nhiều lần sinh thiết xuyên thành phế quản và 5% cần phải đặt dẫn lưu ngực.[60]
Nếu mức độ nghi ngờ PCP trên lâm sàng cao hoặc xét nghiệm trước đó không phát hiện nguyên nhân gây bệnh, có thể cân nhắc sinh thiết phổi hở để xác nhận hay loại trừ mắc PCP cũng như để xác định xem có bệnh nào khác hay không.
Nồng độ LDH trong máu cao (>220 IU/L) có tầm quan trọng cả về chẩn đoán và tiên lượng, trong đó mức độ tăng cao LDH tỷ lệ thuận với tỷ lệ tử vong.[61] Cần xét nghiệm khí máu động mạch để xác định xem có sự chênh lệch oxy phế nang-động mạch (A-a) tăng cao hay không.
Những bệnh nhân có biểu hiện lâm sàng giống với PCP, nhưng có X-quang ngực bình thường hoặc không thay đổi, cần thực hiện chụp cắt lớp vi tính lồng ngực độ phân giải cao (HRCT), hoặc xét nghiệm chức năng phổi bằng phương pháp đo khả năng khuếch tán khí carbon monoxide (DLCO). Nếu kết quả chụp HRCT cho hình ảnh kính mờ, hoặc DLCO giảm, thì bệnh nhân cần xét nghiệm đờm pha loãng sau đó xét nghiệm BAL (nếu xét nghiệm đờm âm tính) vì sự xuất hiện hình kính mờ hoặc DLCO giảm là nhạy với PCP, nhưng không phải là xét nghiệm đặc hiệu cho PCP.[62] [63] [64] Nếu cả hai xét nghiệm đều âm tính, cần xem xét các nguyên nhân khác và thực hiện các bước chẩn đoán phù hợp. Nếu tất cả các mẫu bệnh phẩm để chẩn đoán tìm nấm Pneumocystis jirovecii đều âm tính, thì gần như là bệnh nhân không mắc PCP và cần được theo dõi và tìm các nguyên nhân gây bệnh khác. Có thể cần xét nghiệm thêm tùy theo bệnh cảnh lâm sàng.
Việc chẩn đoán PCP không loại trừ khả năng có một bệnh đồng nhiễm thứ hai. Mặc dù việc xác nhận chẩn đoán PCP bằng kính hiển vi được ưu tiên hơn vì nhiều bệnh có thể có triệu chứng tương tự, nhưng việc điều trị theo kinh nghiệm cho bệnh nhân có biểu hiện lâm sàng giống PCP có thể được thực hiện, đặc biệt tại những nơi mà nguồn lực để thực hiện xét nghiệm đờm pha loãng hay BAL bị hạn chế.
Việc xác định nấm Pneumocystis jirovecii trong đờm hay dịch BAL thường được thực hiện bằng thuốc nhuộm, như thuốc nhuộm tế bào, Geimsa, Diff-Quik, và bạc methenamine. Cũng có thể sử dụng phản ứng miễn dịch huỳnh quang (xét nghiệm kháng nguyên huỳnh quang trực tiếp), phương pháp này có độ nhạy cao hơn.[65] Sinh thiết xuyên thành phế quản làm xét nghiệm BAL có thể làm tăng khả năng chẩn đoán.[66]
Những xét nghiệm khác, ví dụ như PCR, PCR thời gian thực, và PCR phiên mã ngược, có thể phát hiện Pneumocystis jirovecii ở nồng độ ADN thấp. Những xét nghiệm này, cùng với nồng độ S-adenosylmethionine trong huyết tương có thể làm tăng độ nhạy chẩn đoán PCP nhưng thông thường không có sẵn trên lâm sàng. Các kỹ thuật PCR có tỷ lệ dương tính giả cao hơn phương pháp nhuộm hóa mô.[67] [68] [69] [70] [71] [72] [73]
Ngoài ra, đã có những chú ý nhất định đối với việc định lượng hoạt chất (1,3)-beta-D-glucan trong máu, một yếu tố cấu thành nên vách tế bào nấm, giúp chẩn đoán PCP.[74] [75] [76] [77] [78] Những nghiên cứu này cho thấy hoạt chất (1,3)-beta-D-glucan tăng mạnh ở những bệnh nhân bị mắc PCP, mặc dù thấp hơn ở những bệnh nhân âm tính với HIV mắc PCP, và nồng độ của nó không tương đồng với độ nghiêm trọng hay đáp ứng điều trị.[79] Các nghiên cứu phân tích tổng hơp về hoạt chất (1,3)-beta-D-glucan trong chẩn đoán PCP ở những nhóm đối tượng khác nhau (nhiễm HIV và không nhiễm HIV) cho thấy độ nhạy và độ đặc hiệu chung tương ứng là 96% và 84%.[80] Một phân tích tổng hợp gần đây hơn cũng cho thấy độ nhạy (92%) và độ đặc hiệu (78%) tương tự ở những bệnh nhân nhiễm HIV; tuy nhiên, ở các bệnh nhân không nhiễm HIV, độ nhạy và độ đặc hiệu thấp hơn, tương ứng là 85% và 73%.[81] Trong một trong những nghiên cứu lớn nhất về những bệnh nhân nhiễm HIV (n=282) trong đó 69% mắc PCP, độ nhạy và độ đặc hiệu tương ứng là 92% và 65%.[82] Ngoài ra, trong một nghiên cứu thực hiện trên 159 bệnh nhân AIDS có ít nhất một triệu chứng về hô hấp, trong đó có 139 người mắc PCP, độ nhạy và độ đặc hiệu của beta-glucan (≥80 ng/ml) tương ứng là 92.8% và 75.0%.[83] Mặc dù độ nhạy của beta-glucan có thể hữu ích trong việc loại trừ mắc PCP tại các cơ sở không thể tiến hành các xét nghiệm cho độ nhạy tốt hơn, nhưng việc độ nhạy giảm là do phát hiện ra (1,3)-beta- D-glucan trong các trường hợp nhiễm nấm khác, bởi vì (1,3)-beta-D-glucan không phải là một protein đặc hiệu với nấm Pneumocystis và có thể không đáng tin cậy đối với những người không nhiễm HIV.
Các yếu tố nguy cơ
Các yếu tố nguy cơ mạnh
Số lượng tế bào CD4 dưới 200 tế bào/microlit
- Số lượng tế bào CD4 thông thường ở một người không nhiễm HIV là khoảng 400 đến 1200 tế bào/microlit. Các bệnh nhân dương tính với HIV có số lượng tế bào CD4 <200 tế bào/microlit có nguy cơ mắc viêm phổi PCP cao gấp khoảng 5 lần bệnh nhân có số lượng tế bào CD4 >200 tế bào/microlit; nguy cơ tăng lên khi số lượng tế bào CD4 thấp hơn mức này.[6] [7]
Tình trạng suy giảm miễn dịch
- Các bệnh nhân âm tính với HIV có các thiếu hụt miễn dịch liên quan đến tế bào lympho T rất dễ mắc bệnh.
- Nhóm nguy cơ cao bao gồm các bệnh nhân ghép tạng và các bệnh nhân bị bệnh máu ác tính.
- Nhóm nguy cơ thấp hoặc không xác định bao gồm các bệnh nhân đang điều trị ức chế miễn dịch kéo dài, ví dụ như chất đối kháng yếu tố hoại tử u (TNF-alpha).[21] [28] [29] [30] [31] [32]
Sử dụng corticorsteroid kéo dài
- Việc sử dụng corticosteroid kéo dài cho các bệnh như viêm khớp dạng thấp, hoặc các tình trạng viêm hoặc tự miễn khác, là một yếu tố nguy cơ quan trọng dẫn đến các bệnh nhiễm trùng cơ hội, đặc biệt là PCP.
- Theo một nghiên cứu về bệnh nhân âm tính HIV mắc PCP, 90.5% trong số này đã sử dụng corticosteroid với liều lượng ít nhất 16-20 mg prednison (predisolon) mỗi ngày trong vòng hơn 1 tháng.[23]
- Trong một loạt bệnh nhân mắc u hạt Wegener đang được điều trị bằng glucorticoid và các thuốc ức chế miễn dịch hàng ngày, khoảng 6% mắc PCP.[41]
Viêm phổi do PCP trước đó
- Có tiền sử bị PCP trước đó là một yếu tố nguy cơ cao mắc các đợt tái phát.
Các yếu tố về tiền sử và thăm khám
Các yếu tố chẩn đoán chủ yếu
HIV dương tính (thường gặp)
- Đã mắc HIV hoặc có yếu tố nguy cơ nhiễm HIV.
Các yếu tố chẩn đoán khác
Nấm candida hầu họng (thường gặp)
- Bệnh nấm Candida là một yếu tố báo trước độc lập cho PCP.[6]
Viêm phổi do vi khuẩn tái phát (thường gặp)
- Tiền sử viêm phổi do vi khuẩn tái phát là một yếu tố có liên quan đến nguy cơ mắc PCP.
Sút cân (thường gặp)
- Tiền sử giảm cân là một yếu tố có liên quan đến nguy cơ mắc PCP.
Các triệu chứng tồn tại lâu hơn (bệnh nhân dương tính với HIV) (thường gặp)
- Các triệu chứng thường tồn tại lâu hơn ở các bệnh nhân dương tính với HIV.
Khởi phát triệu chứng nhanh (bệnh nhân âm tính với HIV) (thường gặp)
- Các bệnh nhân HIV âm tính thường có diễn biến lâm sàng nhanh và nghiêm trọng hơn.
Sốt (thường gặp)
- Ở những bệnh nhân dương tính với HIV, thường khởi phát triệu chứng âm ỉ kèm theo sốt kéo dài trên 2 tuần.
Ho khan (thường gặp)
- Thường không có đờm. Đờm có mủ gợi ý bệnh nguyên do viêm phổi.
Khó thở (thường gặp)
- Ở những bệnh nhân dương tính với HIV, thường khởi phát triệu chứng âm ỉ.
Mệt mỏi (thường gặp)
- Ở những bệnh nhân dương tính với HIV, thường khởi phát triệu chứng âm ỉ.
Khám ngực thấy bình thường (thường gặp)
- Bệnh nhân thường có kết quả khám ngực không có gì đáng chú ý; đôi khi có thể nghe thấy tiếng ran.
Nhịp tim nhanh (thường gặp)
- Không có dấu hiệu đặc hiệu.
Thở nhanh hoặc suy hô hấp (thường gặp)
- Không có dấu hiệu đặc hiệu.
Chứng xanh tím (không thường gặp)
- Ở trẻ em có thể gặp triệu chứng này.
Biểu hiện ngoài phổi (không thường gặp)
- Hiếm khi nhiễm trùng gây biểu hiện ngoài phổi ở những bệnh nhân mắc HIV giai đoạn tiến triển; tuy nhiên, ở những bệnh nhân bị AIDS giai đoạn tiến triển hoặc những bệnh nhân dương tính với HIV mà đang không sử dụng thuốc điều trị dự phòng, có thể bị nhiễm trùng toàn thân với các triệu chứng rõ ràng, suy giảm nhận thức do ảnh hưởng đến hệ thần kinh trung ương, và các triệu chứng tiêu hóa như tiêu chảy.
Đau ngực do viêm màng phổi (không thường gặp)
- Có thể gặp tràn khí màng phổi, nhưng không phổ biến ở PCP không có tràn khí màng phổi.
Nhịp thở giảm không đều (không thường gặp)
- Nhịp thở giảm không đều có thể là dấu hiệu của tràn khí màng phổi.
Xét nghiệm chẩn đoán
Xét nghiệm thứ nhất cần yêu cầu
| Xét nghiệm | Kết quả |
X quang ngực
|
Thâm nhiễm mô kẽ đối xứng hai bên |
| Khí máu động mạch
pO2 khí phòng <70 mmHg hoặc chênh lệch nồng độ oxy phế nang-động mạch >35mmHg là mức độ trung bình đến nặng. |
pO2 giảm và chênh lệch nồng độ oxy phế nang-động mạch (A-a) tăng |
| Nồng độ LDH huyết thanh
Nồng độ LDH tăng cao ở 90% bệnh nhân nhiễm HIV mắc PCP. Nồng độ LDH sẽ giảm khi điều trị thành công.[61] |
Tăng cao (>220 IU/L) |
Xét nghiệm đờm pha loãng
|
Dương tính với Pneumocystis |
Các xét nghiệm khác cần cân nhắc
Chụp cắt lớp vi tính lồng ngực độ phân giải cao (HRCT)
|
Hình ảnh kính mờ rải rác hai bên |
Kiểm tra chức năng phổi
|
Khả năng khuếch tán khí carbon monoxide (DLCO) giảm |
Nội soi phế quản và xét nghiệm dịch rửa phế quản – phế nang (BAL)
|
Dương tính với Pneumocystis |
Sinh thiết
|
Dương tính với Pneumocystis |
Các xét nghiệm giai đoạn đầu
| Xét nghiệm | Kết quả |
| PCR
PCR, PCR thời gian thực, và PCR phiên mã ngược, có thể phát hiện nấm Pneumocystis jirovecii với nồng độ thấp của ADN. Những xét nghiệm này có thể làm tăng độ nhạy của chẩn đoán PCP nhưng thường không có sẵn trên lâm sàng. Chúng có tỷ lệ chẩn đoán dương tính giả cao hơn so với phương pháp nhuộm hóa mô. |
Dương tính với Pneumocystis |
| Nồng độ S-adenosylmethionine trong huyết tương
Có thể giúp tăng độ nhạy trong chẩn đoán PCP nhưng hiện tại không có sẵn trên lâm sàng. |
Giảm |
Nồng độ (1,3)-beta-D-glucan trong huyết thanh
|
Tăng |
Chẩn đoán khác biệt
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| Viêm phổi do vi khuẩn |
|
|
| Nhiễm nấm coccidioidomycosis |
|
|
| Nhiễm Cytomegalovirus (CMV) |
|
|
| Bệnh nấm histoplasmosis |
|
|
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| Ung thư Kaposi ảnh hưởng đến phổi |
|
|
| Viêm phổi kẽ thâm nhiễm lympho bào |
|
|
| Nhiễm Mycobacterium avium complex (MAC) | Nhiễm MAC không thường gặp ở các đối tượng có HIV dương tính và thường gây ra các biểu hiện ngoài phổi. |
|
| Bệnh phổi kẽ không do nhiễm khuẩn | Triệu chứng điển hình là khó thở và mệt mỏi.
Sốt là triệu chứng không điển hình. Khởi phát không đau trong vòng vài tháng đến vài năm. |
|
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| Bệnh nấm Penicilliosis |
|
|
| Bệnh lao phổi |
|
|
| Nhiễm vi khuẩn Legionella |
|
Vi khuẩn Legionella pneumophila là loại vi khuẩn thường gặp nhất trên lâm sàng. Có thể chẩn đoán qua xét nghiệm huyết thanh với các chuẩn độ IgG, IgM hoặc IgA cấp tính. AST và ALT có thể tăng. |
| Cryptococcus |
|
|
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| Bệnh nấm blastomycosis |
|
|
| Bệnh sarcoid | Có thể có các triệu chứng tương tự như PCP nhưng cũng có các biểu hiện toàn thân khác, bao gồm các nốt sẩn trên da. |
|
| Mycoplasma pneumoniae |
|
|
| Thuyên tắc động mạch phổi |
|
Phương thức chẩn đoán xác định để khẳng định/loại trừ bao gồm xét nghiệm D-dimer, chụp cắt lớp vi tính đa dãy (MDCT) lồng ngực, chụp xạ hình phổi và chụp mạch máu phổi. |
| Viêm phổi do virút | Các triệu chứng và dấu hiệu có thể tương tự với PCP. Kháng sinh không hiệu quả. |
|
| Bệnh cúm |
|
Huyết thanh học hoặc nuôi cấy vi-rút có thể dương tính với cúm. |
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| Hội chứng suy hô hấp cấp (ARDS) |
|
|
Các tiêu chí chẩn đoán
Phân loại mức độ nghiêm trọng
Ở người lớn và trẻ em, mức độ nghiêm trọng của bệnh viêm phổi do nhiễm nấm Pneumocystis (PCP) có thể được phân loại như sau:
- PCP mức độ nhẹ đến trung bình: pO2 khí máu động mạch trong điều kiện không khí phòng > 70 mmHg hoặc chênh lệch nồng độ oxy phế nang – động mạch (A-a) < 35 mmHg.
- PCP mức độ trung bình đến nặng: pO2 khí máu động mạch trong điều kiện không khí phòng <70 mmHg hoặc chênh lệch A-a >35 mmHg.
Cách tiếp cận điều trị từng bước
Tất cả bệnh nhân mắc viêm phổi do nhiễm nấm Pneumocystis (PCP) đều được điều trị bằng kháng sinh, nhưng phương pháp điều trị này có thể thay đổi tùy theo mức độ nghiêm trọng của bệnh.[91] Ở người lớn và trẻ em, mức độ nghiêm trọng của PCP có thể được phân loại như sau:
- PCP mức độ nhẹ đến trung bình: pO2 khí máu động mạch trong điều kiện không khí phòng >70 mmHg hoặc chênh lệchA-a < 35 mmHg.
- PCP mức độ trung bình đến nặng: pO2 khí máu động mạch trong điều kiện không khí phòng <70 mmHg hoặc chênh lệch A-a >35 mmHg.
Bệnh nhân được điều trị PCP chủ yếu là:
- Người lớn hoặc trẻ vị thành niên dương tính với HIV
- Người lớn hoặc trẻ vị thành niên âm tính với HIV nhưng bị suy giảm miễn dịch
- Trẻ em dương tính với HIV hoặc có nguy cơ nhiễm HIV.
Thời gian điều trị PCP là 21 ngày ở bệnh nhân dương tính với HIV và 14–21 ngày ở tất cả các bệnh nhân khác.
Người lớn hoặc trẻ vị thành niên: HIV dương tính
Khi nghi ngờ mắc PCP cần tiến hành điều trị ngay lập tức, thậm chí trước cả khi có chẩn đoán cụ thể. Tuy nhiên, cần đưa ra chẩn đoán xác định khi có thể bởi nguy cơ mắc các bệnh nhiễm trùng cơ hội khác có các biểu hiện tương tự ở nhóm bệnh nhân này.[44] Nấm Pneumocystis vẫn có thể có trong đờm, dịch và mô sau khi bắt đầu điều trị.
PCP mức độ nhẹ đến trung bình
- Được xác định khi có đồng thời mức pO2 khí phòng >70 mmHg và chênh lệch A-a <35 mmHg.
- Lựa chọn điều trị là trimethoprim/sulfamethoxazole (TMP/SMX), đường tĩnh mạch hoặc đường uống.[44] [92][93] 1[A]Evidence Tác dụng phụ thường gặp ở những bệnh nhân dương tính với HIV.
- Chỉ nên áp dụng các biện pháp điều trị thay thế nếu bệnh nhân không dung nạp TMP/SMX và điều trị không giúp ích cho bệnh nhân, hoặc có bằng chứng cho thấy điều trị thất bại. Bởi các triệu chứng và dấu hiệu của bệnh nhân thường xấu đi trong vòng 3 đến 5 ngày đầu điều trị, cho nên hãy xem xét khả năng điều trị thất bại nếu bệnh nhân có tình trạng lâm sàng xấu đi sau ít nhất 4 đến 8 ngày điều trị.
- Thuốc điều trị thay thế bao gồm dapsone kết hợp trimethoprim,2[B]Evidence clindamycin kết hợp primaquine,3[A]Evidence hoặc atovaquone.4[A]Evidence Nếu có thể, tất cả bệnh nhân cần được xác định tình trạng thiếu hụt glucose-6-phosphate dehydrogenase (G6PD) trước khi bắt đầu sử dụng primaquine hoặc dapsone. Không dùng atovaquone chung với rifampicin hoặc rifabutin.[94]
- Thời gian khuyến nghị điều trị PCP là 21 ngày.[44] PCP
Mức độ trung bình đến nặng
- Được xác định khi có mức pO2 khí phòng >70 mmHg hoặc chênh lệch pO2 phế nang-động mạch >35 mmHg.
- Bệnh nhân khi khám lâm sàng phát hiện ra các dấu hiệu tổn thương đường hô hấp, ví dụ như thở nhanh, nhịp tim nhanh, chứng xanh tím, hoặc sử dụng cơ hô hấp phụ, hoặc tổn thương huyết động cần nhập viện ngay lập tức và xem xét khả năng nhập khoa chăm sóc tích cực nếu có biểu hiện cho thấy cần thông khí nhân tạo xâm lấn hoặc không xâm lấn.
- Lựa chọn điều trị là TMP/SMX đường tĩnh mạch kết hợp với corticosteroid.[95] [96] [97] [98] [99] [100] [101] Ở những bệnh nhân này, có các bằng chứng lâm sàng thuyết phục rằng corticosteroid bổ trợ giúp cải thiện tỉ lệ tử vong trong vòng 1 và 3 tháng và ngăn ngừa khả năng phải thông khí nhân tạo.[101] Một liệu trình điều trị ngắn thường không gây ra tình trạng ức chế miễn dịch đáng kể.
- Chỉ nên áp dụng biện pháp điều trị thay thế nếu bệnh nhân không dung nạp TMP/SMX và điều trị không giúp ích cho bệnh nhân, hoặc nếu có bằng chứng cho thấy điều trị thất bại. Bởi tình trạng bệnh nhân thường xấu đi trong vòng 3 đến 5 ngày đầu điều trị, cho nên hãy xem xét khả năng điều trị thất bại nếu bệnh nhân có tình trạng lâm sàng xấu đi sau ít nhất 4 đến 8 ngày điều trị.
- Phác đồ điều trị thay thế bao gồm clindamycin kết hợp primaquine,3[A]Evidence hoặc pentamidine đường tĩnh mạch,5[B]Evidence cả hai đều kết hợp với corticosteroid bổ trợ. Pentamidine được cho là có hiệu quả hơn clindamycin kết hợp primaquine, nhưng clindamycin kết hợp primaquine thông thường được bệnh nhân dung nạp tốt hơn. Một số bằng chứng cho thấy rằng clindamycin kết hợp primaquine có thể là liệu pháp cứu nguy hiệu quả nhất, nhưng phương pháp này chưa được củng cố bằng các thử nghiệm lâm sàng tiến cứu trên những bệnh nhân đã điệu trị TMP/SMX thất bại.[44] Nếu có thể, tất cả bệnh nhân cần được xác định tình trạng thiếu hụt glucose-6-phosphate dehydrogenase (G6PD) trước khi bắt đầu sử dụng primaquine. Trước đây trimetrexate được sử dụng làm liệu pháp cứu nguy, nhưng bây giờ thì không.
- Thời gian khuyến nghị điều trị PCP là 21 ngày.[44]
Trẻ em: HIV dương tính hoặc có nguy cơ nhiễm HIV
Tất cả trẻ em nghi mắc PCP cần được điều trị ngay lập tức trong khi đang được kiểm tra. PCP
Mức độ nhẹ đến trung bình
- Được xác định khi có đồng thời mức pO2 khí phòng >70 mmHg và chênh lệch A-a <35 mmHg.
- Lựa chọn kháng sinh đầu tay vẫn là TMP/SMX, bằng đường tĩnh mạch hoặc đường uống.
- Cần áp dụng phác đồ điều trị bậc hai bao gồm pentamidine đường tĩnh mạch, atovaqone, dapsone kết hợp trimethoprim, hoặc primaquine kết hợp clindamycin nếu trẻ không dung nạp TMP/SMX hoặc nếu điều trị thất bại trên lâm sàng sau 5 đến 7 ngày.[43] Nếu có thể, tất cả bệnh nhân cần được xác định tình trạng thiếu hụt glucose-6-phosphate dehydrogenase (G6PD) trước khi bắt đầu sử dụng primaquine hoặc dapsone.
- Thời gian khuyến nghị điều trị PCP là 21 ngày. PCP
Mức độ trung bình đến nặng
- Được xác định khi có mức pO2 khí phòng >70 mmHg hoặc chênh lệch phân áp oxy phế nang-động mạch >35 mmHg.
- Trẻ em cần được nhập viện và có thể phải đưa vào khoa chăm sóc tích cực và cho thở máy nếu có thể.
- Thuốc điều trị bậc 1 cho mức độ bệnh trung bình đến nặng là TMP/SMX và corticosteroid.
- Chỉ nên áp dụng các biện pháp điều trị thay thế nếu bệnh nhân không dung nạp TMP/SMX và điều trị không giúp ích cho bệnh nhân, hoặc nếu có bằng chứng cho thấy điều trị thất bại.
- Thời gian khuyến nghị điều trị PCP là 21 ngày.
Cần lưu ý rằng PCP hiếm khi xảy ra ở trẻ em âm tính với HIV hoặc trẻ suy giảm miễn dịch và không có hướng dẫn điều trị cho những bệnh nhân này.
Người lớn hoặc trẻ vị thành niên: HIV âm tính nhưng có suy giảm miễn dịch
Thuốc điều trị được ưu tiên dành cho bệnh nhân âm tính với HIV mắc PCP cũng là TMP/SMX hoặc pentamidine đường tĩnh mạch. Các thuốc điều trị thay thế cũng tương tự như với bệnh nhân dương tính với HIV.[91]
Tỷ lệ tác dụng phụ do TMP/SMX ở bệnh nhân âm tính với HIV có thể ít hơn ở bệnh nhân dương tính với HIV.[102] Việc sử dụng corticosteroid bổ trợ cho điều trị PCP nặng ở những bệnh nhân HIV âm tính còn đang tranh cãi, mặc dù một số báo cáo hồi cứu ở người trưởng thành bị ức chế miễn dịch và một nghiên cứu phân tích tổng hợp cho rằng bệnh nhân được bổ sung corticosteroid tăng cường có thể hồi phục nhanh hơn.[22] [103] Những kết luận mạnh mẽ hơn về việc steroid bổ trợ cho bệnh nhân âm tính với HIV bị loại trừ bởi các nghiên cứu cho đến thời điểm này đều thiếu các thử nghiệm lâm sàng ngẫu nhiên, yếu tố nhiễu khi lựa chọn bệnh nhân và cỡ mẫu nhỏ.
Thời gian điều trị ở những bệnh nhân âm tính với HIV nên từ 14 đến 21 ngày.[21] [102]
Điều trị dự phòng ban đầu
Những bệnh nhân không có triệu chứng hoặc dấu hiệu lâm sàng của PCP nhưng dương tính với HIV, có nguy cơ nhiễm HIV, hoặc có suy giảm miễn dịch có thể cần được điều trị dự phòng PCP phụ thuộc vào các đặc điểm trên lâm sàng.
Người lớn hoặc trẻ vị thành niên: HIV dương tính
- Bệnh nhân dương tính với HIV không có các triệu chứng hoặc dấu hiệu lâm sàng PCP cần điều trị dự phòng cơ bản trong các hoàn cảnh sau:[44]
- Số lượng tế bào CD4 <200 tế bào/microlit
- Tỉ lệ tế bào CD4 <14%
- Tiền sử mắc các bệnh liên quan đến AIDS
- Số lượng tế bào CD4 >200 tế bào/microlit nhưng <250 tế bào/microlit nếu dừng ART và không thể kiểm tra số lượng tế bào CD4 mỗi 1 đến 3 tháng.
- Lựa chọn thuốc điều trị là TMP/SMX khi không có chống chỉ định.6[C]Evidence Đối với bệnh nhân không dung nạp TMP/SMX, các lựa chọn khác bao gồm trimethoprim, dapsone, dapsone kết hợp với pyrimethamine, atovaquone, atovaquone kết hợp với pyrimethamine, hoặc pentamidine dạng hít.
- Dừng điều trị dự phòng PCP khi bệnh nhân đã khôi phục miễn dịch với số lượng tế bào CD4 vượt mức 200 tế bào/microlit trong >3 tháng.[44] Xem xét dừng điều trị dự phòng PCP ở những bệnh nhân điều trị thuốc kháng vi-rút với tải lượng vi-rút bị ức chế và số lượng tế bào CD4 từ 100 đến 200 tế bào/microlit đối với các nhóm bệnh nhân nhất định, nhưng không khuyến nghị chung.[45] Duy trì điều trị dự phòng suốt đời đối với những bệnh nhân mắc PCP mặc dù đã có sự hồi phục miễn dịch.
Trẻ em: HIV dương tính hoặc có nguy cơ nhiễm HIV
- Chỉ định điều trị dự phòng ban đầu cho nhóm trẻ em không có triệu chứng hoặc dấu hiệu lâm sàng của PCP:
- Trẻ nhỏ từ 1 đến 12 tháng tuổi dương tính với HIV hoặc không xác định nhiễm HIV hay không
- Trẻ em dương tính với HIV độ tuổi từ 1 đến 5 tuổi với số lượng tế bào CD4 <500 tế bào/microlit hoặc tỉ lệ CD4 <15%
- Trẻ em dương tính với HIV độ tuổi từ 6 đến 12 tuổi với số lượng tế bào CD4 <200 tế bào/microlit hoặc tỉ lệ CD4 <15%[43]
- Trẻ nhỏ từ 1 đến 12 tháng tuổi âm tính với HIV nhưng có suy giảm miễn dịch là nhóm hiếm gặp nhưng có thể cân nhắc điều trị dự phòng ban đầu.
- Lựa chọn thuốc điều trị là TMP/SMX, khi không có chống chỉ định. Ở những bệnh nhân không dung nạp TMP/SMX, những lựa chọn khác bao gồm dapson, atovaquone, hoặc pentamidine dạng hít.
- Trẻ em có mẹ dương tính với HIV cần được điều trị dự phòng TMP/SMX bắt đầu lúc 4 đến 6 tuần tuổi cho đến khi chắc chắn trẻ không bị nhiễm HIV. Trẻ em dương tính với HIV lúc mới sinh cần được điều trị trong suốt năm đầu tiên của cuộc đời cho đến khi số lượng CD4 nằm trong phạm vi bình thường trong lứa tuổi của trẻ.
Người lớn hoặc trẻ vị thành niên: HIV âm tính nhưng có suy giảm miễn dịch
- Chỉ định điều trị dự phòng ban đầu ở những bệnh nhân âm tính với HIV mà không có triệu chứng hay dấu hiệu lâm sàng của PCP, bao gồm:
- Bệnh máu ác tính
- Cấy ghép tủy xương
- Ghép tạng đặc
- Rối loạn quá trình viêm, và những người sử dụng corticosteroid với liều lượng ít nhất 16 mg đến 20 mg prednisone (prednisolone) hàng ngày trong vòng >1 tháng.[23] [46]
- Không có hướng dẫn điều trị dự phòng cho những bệnh nhân trong nhóm này. TMP/SMX là kháng sinh bậc 1 ưu tiên sử dụng, cùng với pentamidine dạng hít hoặc dapsone dạng uống nếu bệnh nhân không dung nạp TMP/ SMX.
Điều trị dự phòng thứ phát
Các bệnh nhân nhiễm PCP, đã được điều trị và không có triệu chứng, có thể được điều trị dự phòng thứ phát với lộ trình tương tự như điều trị dự phòng ban đầu cho mỗi nhóm bệnh nhân.
Khuyến cáo điều trị dự phòng thứ phát cho bệnh nhân dương tính với HIV mắc PCP và nên bắt đầu ngay khi kết thúc điều trị PCP và tiếp tục điều trị trọn đời trừ khi xuất hiện tình trạng khôi phục miễn dịch khi điều trị bằng thuốc kháng retrovirus.[43] [44] [104]
Dừng điều trị dự phòng thứ phát khi bệnh nhân có sự hồi phục miễn dịch và số lượng tế bào CD4 vượt 200 tế bào/ microlit trong >3 tháng. Cần duy trì điều trị dự phòng suốt đời đối với những bệnh nhân mắc PCP dù đã khôi phục miễn dịch.
Tổng quan về các chi tiết điều trị
Tham khảo cơ sở dữ liệu dược địa phương của quý vị để biết thông tin toàn diện về thuốc, bao gồm các chống chỉ định, tương tác giữa các loại thuốc, và liều dùng thay thế. ( xem Tuyên bố miễn trách nhiệm )
| Cấp tính | ( tóm tắt ) | |||||
| Người lớn hoặc trẻ vị thành niên: HIV dương tính | ||||||
|
PCP mức độ nhẹ đến trung bình |
1 |
Thuốc điều trị |
||||
| PCP thể trung bình đến nặng | 1
thêm |
Điều trị thuốc ± thông khí nhân tạo
corticosteroid |
||||
| Trẻ em: HIV dương tính hoặc có nguy cơ nhiễm HIV | ||||||
|
PCP mức độ nhẹ đến trung bình |
1 |
Thuốc điều trị |
||||
| PCP thể trung bình đến nặng | 1
thêm |
Điều trị thuốc ± thông khí nhân tạo
corticosteroid |
||||
| Cấp tính | ( tóm tắt ) | ||
| Người lớn hoặc trẻ vị thành niên: HIV âm tính nhưng có suy giảm miễn dịch | |||
| 1
bổ sung |
Điều trị thuốc ± thông khí nhân tạo
corticosteroid |
||
| Bắt đầu | ( Tóm tắt ) | |||
| Nguy cơ cao nhiễm PCP | ||||
| Người lớn hoặc trẻ vị thành niên: HIV dương tính |
1 |
Điều trị dự phòng ban đầu | ||
| Tem: HIV dương tính hoặc có nguy cơ nhiễm HIV | 1 | điều trị dự phòng ban đầu | ||
| người lớn hoặc trẻ vị thành niên: HIV âm tính nhưng có suy giảm miễn dịch | 1 | điều trị dự phòng ban đầu | ||
| Tiếp diễn | ( tóm tắt ) | ||
| kết thúc điều trị thành công PCP | |||
| 1 | điều trị dự phòng thứ phát | ||
Các lựa chọn điều trị
| Cấp tính | ||
| Người lớn hoặc trẻ vị thành niên: HIV dương tính | ||
| PCP mức độ nhẹ đến trung bình | 1 | Thuốc điều trị
Các lựa chọn sơ cấp
Các lựa chọn thứ cấp
-và-
HOẶC
-và-
Các lựa chọn cấp ba
|
| PCP thể trung bình đến nặng | 1 | Điều trị thuốc ± thông khí nhân tạo
Các lựa chọn sơ cấp
Các lựa chọn thứ cấp
-và-
HOẶC
|
| Thêm | Corticosteroid
Các lựa chọn sơ cấp
HOẶC
|
|
| Trẻ em: HIV dương tính hoặc có nguy cơ nhiễm HIV | ||
| PCP mức độ nhẹ đến trung bình | 1 | Thuốc điều trị
Các lựa chọn sơ cấp
Các lựa chọn thứ cấp
HOẶC
-và-
Các lựa chọn cấp ba
HOẶC
-và-
HOẶC
-và-
|
| PCP thể trung bình đến nặng | 1 | Điều trị thuốc ± thông khí nhân tạo
Các lựa chọn sơ cấp
Các lựa chọn thứ cấp
HOẶC
-và-
Các lựa chọn cấp ba
HOẶC
-và-
|
| Thêm | Corticosteroid
Các lựa chọn sơ cấp
Các lựa chọn thứ cấp
|
|
| Người lớn hoặc trẻ vị thành niên: HIV âm tính nhưng có suy giảm miễn dịch | ||
| 1 | Điều trị thuốc ± thông khí nhân tạo
Các lựa chọn sơ cấp
HOẶC
Các lựa chọn thứ cấp
-và-
HOẶC
HOẶC
-và-
|
|
| Bổ sung | Corticosteroid
Các lựa chọn sơ cấp
HOẶC
|
|
| Bắt đầu | ||
| Nguy cơ cao nhiễm PCP | ||
| Người lớn hoặc trẻ vị thành niên: HIV dương tính | 1 | Điều trị dự phòng ban đầu
Các lựa chọn sơ cấp
Các lựa chọn thứ cấp
HOẶC
HOẶC
-và-
-và-
HOẶC
-và-
-và-
HOẶC
HOẶC
Các lựa chọn cấp ba
-và-
-và-
|
| Trẻ em: HIV dương tính hoặc có nguy cơ nhiễm HIV | 1 | Điều trị dự phòng ban đầu
Các lựa chọn sơ cấpư
Các lựa chọn thứ cấp
HOẶC
HOẶC
|
| Người lớn hoặc trẻ vị thành niên: HIV âm tính nhưng có suy giảm miễn dịch | 1 | Điều trị dự phòng ban đầu
Các lựa chọn sơ cấp
Các lựa chọn thứ cấp
HOẶC
|
| Tiếp diễn | ||
| Kết thúc điều trị thành công PCP | ||
| 1 | Điều trị dự phòng thứ phát
|
|
Giai đoạn đầu
Echinocandins
Echinocandins là một nhóm thuốc chống nấm giúp ngăn chặn quá trình tổng hợp phân tử glucan của vách tế bào nấm. Nghiên cứu trên động vật và báo cáo ca bệnh đã được công bố.[106] [107] [108] [109] [110] Cho đến nay chưa có thử nghiệm lâm sàng nào. Trong tương lai có thể tăng cường sử dụng Echinocandins để điều trị viêm phổi do nấm Pneumocystis.
Khuyến nghị
Giám sát
Giám sát trong quá trình điều trị cần tập trung đánh giá đáp ứng với điều trị, độc tính của thuốc, và hội chứng viêm phục hồi miễn dịch (IRIS).[127] Nếu bệnh viêm phổi do nấm Pneumocystis (PCP) có biểu hiện lâm sàng xấu đi sau khi bắt đầu điều trị kháng retrovirus (ARV) kết hợp, cần phải loại trừ khả năng điều trị PCP thất bại, phản ứng thuốc, nhiễm khuẩn mới, mức độ ác tính, hoặc các diễn biến bệnh khác, ví dụ như suy tim sung huyết, trước khi chẩn đoán IRIS. Việc điều trị ARV sớm (trong vòng 2 tuần) so với việc bắt đầu điều trị ARV sau khi kết thúc điều trị PCP có liên quan đến nguy cơ tử vong giảm, do đó khuyến nghị bắt đầu điều trị ARV sớm.[19] [128]
Hướng dẫn dành cho bệnh nhân
Các biến chứng
| Các biến chứng | Khung thời gian | Khả năng |
| suy hô hấp | ngắn hạn | trung bình |
| Suy hô hấp thường gặp hơn ở bệnh nhân âm tính với HIV.
Tiên lượng ở những bệnh nhân cần thở máy để điều trị bệnh viêm phổi do nấm Pneumocystis xấu hơn.
Có thể gặp tình trạng tương tự ARDS ở một số bệnh nhân mắc PCP nặng và những bệnh nhân này có tiên lượng xấu. |
||
| các tác dụng phụ do thuốc | ngắn hạn | trung bình |
| Các biến chứng | Khung thời gian | Khả năng |
| Tác dụng phụ của điều trị khá phổ biển ở bệnh nhân dương tính với HIV và có thể làm hạn chế việc điều trị.[3]
Trimethoprim/sulfamethoxazole: tác dụng phụ khá phổ biến ở bệnh nhân dương tính với HIV (20%-85%) và bao gồm tăng kali máu, suy thận, ức chế tủy xương, phát ban, hội chứng Stevens-Johnson, nhiễm độc gan, buồn nôn, nôn mửa và trụ niệu. Pentamidine: khi sử dụng đường tĩnh mạch, có thể gây nhiễm độc thận, hạ huyết áp liên quan đến truyền thuốc, chứng loạn nhịp, viêm tụy, giảm đường máu, đái tháo đường, viêm gan, và các rối loạn điện giải. Khuyến cáo rằng bệnh nhân nên được theo dõi tình trạng tim mạch liên tục và điện tâm đồ để phát hiện khoảng QT kéo dài. Clindamycin: tác dụng phụ bao gồm tiêu chảy, viêm đại tràng giả mạc, và phát ban. Primaquine: có thể gây co thắt vùng bụng, buồn nôn, và nôn mửa, nhưng, nghiêm trọng nhất, có thể gây chứng met- haemoglobin máu và chứng thiếu máu huyết tán, đặc biệt ở bệnh nhân thiếu hụt glucose-6-phosphate dehydrogenase (G6PD). Dapsone: cũng có thể gây chứng met-haemoglobin máu và chứng thiếu máu huyết tán (đặc biệt ở bệnh nhân thiếu hụt G6PD) cũng như giảm bạch cầu trung tính, phát ban, sốt, viêm gan, tăng kali máu, bệnh lý thần kinh ngoại biên, và nhiễm độc gan. Atovaquone: có thể gây tiêu chảy, phát ban, buồn nôn, nôn mửa, đau đầu, hạ natri máu, tăng glucose huyết, và sốt. Không nên dùng chung với rifampicin hoặc rifabutin. |
||
| Tràn khí màng phổi | ngắn hạn | thấp |
| Nguy cơ tương đối bị tràn khí màng phổi ở bệnh nhân có tiền sử PCP là 14.5 so với bệnh nhân dương tính với HIV mà không có tiền sử PCP và, ở bệnh nhân sử dụng pentamidine dạng hít là 17.6.[124] Trong một loạt các bệnh nhân dương tính với HIV mắc PCP, 6 trong tổng số 104 bệnh nhân bị tràn khí màng phổi nguyên phát.[125]
Các yếu tố nguy cơ gây tràn khí màng phổi ở bệnh nhân dương tính với HIV mắc PCP bao gồm tiền sử hút thuốc lá, điều trị pentamine dạng hít, và có hình ảnh túi phế nang thành mỏng khi chụp X-quang ngực.[126] |
||
| Hội chứng viêm phục hồi miễn dịch (IRIS) | dài hạn | thấp |
| IRIS là một phản ứng viêm với các kháng nguyên đặc hiệu do sự phục hồi miễn dịch gây ra bởi liệu pháp kháng retrovirus (ART) kết hợp và có thể xảy ra với bất kỳ kháng nguyên nào (tác nhân truyền bệnh, vật chủ, hoặc khối u), nhưng thường xảy ra với PCP hoặc nhiễm trùng cơ hội khác.[127]
IRIS thứ phát sau PCP có thể biểu hiện với tình trạng hạ oxy máu xấu đi, bất thường trên các phim chụp X-quang liên tiếp và sốt. |
||
Tiên lượng
Ở tất cả bệnh nhân mắc viêm phổi do nấm Pneumocystis (PCP), tỉ lệ sống sót tổng thể đã được cải thiện. Theo một cơ sở dữ liệu chứng tử lớn ở Hoa Kỳ, tỉ lệ tử vong đã giảm từ 0.470 ca/100.000 người vào năm 1999 xuống còn 0.154 ca/100.000 người vào năm 2014.[111] Cụ thể hơn, theo dự án Bệnh HIV nhóm Người Lớn và Trẻ Vị Thành Niên, tỉ lệ sống sau 12 tháng đã tăng từ 40% vào năm 1992/1993 lên 63% vào năm 1996/1998.[112]Các yếu tố liên quan đến tỉ lệ sống sót thấp là tiền sử mắc PCP trước đó, số lượng tế bào CD4 thấp (<50 tế bào/microlit), tỉ lệ CD4 <15%, và độ tuổi dưới 60. Ở bệnh nhân dương tính với HIV nhập viện do mắc PCP tại 3 trung tâm nghiên cứu chính vào thời gian từ năm 1995 đến 1997, tỉ lệ tử vong tổng thể ở bệnh nhân nội trú là 11.3%.[113] Các yếu tố liên quan đến tỉ lệ tử vong tăng là:
- Chênh lệch nồng độ oxy phế nang-động mạch tăng
- Giảm albumin máu
- Sử dụng tiền chất gây nghiện
- Nhịp thở tăng
- Sử dụng thuốc điều trị dự phòng nhiễm khuẩn Mycobacterium avium intracellulare trước đó
- Chẩn đoán AIDS trước đó
- Số lượng bạch cầu tăng
- Creatinine trong huyết thanh tăng
- Các triệu chứng thần kinh.
Một nghiên cứu gần đây hơn cho thấy tỷ lệ tử vong do PCP từ năm 1996 đến 2006 là 9.7% và các yếu tố dự đoán sớm về tỉ lệ tử vong bao gồm:[114]
- Tuổi bệnh nhân tăng
- Các đợt bệnh sau của PCP
- Mức haemoglobin thấp khi nhập viện
- Áp suất riêng phần oxy trong điều kiện không khí phòng thấp khi nhập viện
- Có bệnh kèm theo
- Ung thư Kaposi ảnh hưởng đến phổi
Một nghiên cứu về 136 đợt PCP diễn ra từ năm 2000 đến năm 2013 đã phát hiện ra rằng tỷ lệ tử vong là 11% và tỷ lệ sống sót chung sau 5 năm là 73% (88% đối với những người tuân thủ biện pháp điều trị kháng vi-rút [ARV] kết hợp, và 34% ở những người không tuân thủ ARV).[12]
Tại Bệnh viện Đa khoa San Francisco, có một loạt nghiên cứu về kết quả điều trị và dịch tễ học PCP tại ICU mở rộng bao trùm toàn bộ tình hình nhiễm HIV/AIDS tại bệnh viện này.[115] [116] [117] [118] [119] [120] Các nghiên cứu sâu hơn trong loạt nghiên cứu này cho thấy tỷ lệ sống sót ở những bệnh nhân dương tính với HIV giai đoạn nặng tiếp tục được cải thiện ở kỷ nguyên ARV và tỉ lệ mắc mới PCP cần nhập viện ICU tiếp tục giảm.[115] [117] [121] Ở bệnh nhân dương tính với HIV giai đoạn nặng nhập viện vào khoa ICU, PCP là nguyên nhân phổ biến nhất gây suy hô hấp và là nguyên nhân làm giảm tỷ lệ sống sót, mặc dù tỉ lệ mắc mới PCP ở bệnh nhân điều trị ARV đã thấp hơn nhiều so với những người không điều trị ARV (3% so với 19%, P <0.001).[117] Ở bệnh nhân nhập viện vào khoa ICU do mắc PCP, việc áp dụng liệu pháp ART là một yếu tố dự đoán độc lập cho việc cải thiện tỷ lệ sống sót và nhu cầu phải thở máy và/hoặc mắc tràn khí màng phổi. Chậm trễ trong việc nhập khoa ICU là nguyên nhân làm tăng tỷ lệ tử vong.[121]
Ở những bệnh nhân âm tính với HIV bị mắc PCP, tỷ lệ mắc bệnh và tỷ lệ tử vong cao hơn ở những bệnh nhân HIV dương tính.[22] [23] [25] [26] [34] [35] [122] Trong một loạt ca bệnh âm tính với HIV mắc PCP, 96% cần nhập viện, 69% được nhập khoa ICU, 65% cần thông khí nhân tạo, và tỷ lệ tử vong là 39%.[21] Trong một loạt nghiên cứu khác, tỷ lệ tử vong là 69% và có nhiều yếu tố liên quan đến tỷ lệ tử vong (ví dụ như thang điểm APCHE II, hội chứng tổn thương phổi cấp tính/suy hô hấp cấp, chẩn đoán muộn, nhiễm khuẩn bệnh viện).[123]
Hướng dẫn điều trị
| Bắc Mỹ |
| Guidelines for the prevention and treatment of opportunistic infections in HIV-infected adults and adolescents
Nhà xuất bản: Centers for Disease Control and Prevention; National Institutes of Health; HIV Medicine Association of the Infectious Diseases Society of America Xuất bản lần cuối: 2017 |
| Guidelines for prevention and treatment of opportunistic infections in HIV-exposed and HIV- infected children
Nhà xuất bản: Centers for Disease Control and Prevention; National Institutes of Health; HIV Medicine Association of the Infectious Diseases Society of America, Pediatric Infectious Diseases Society; American Academy of Pediatrics Xuất bản lần cuối: 2016 |
| Treatment of fungal infections in adult pulmonary and critical care patients
Nhà xuất bản: American Thoracic Society Xuất bản lần cuối: 2011 |
Điểm số bằng chứng
- Tỷ lệ tử vong hoặc điều trị thất bại: có bằng chứng thuyết phục rằng trimethoprim/sulfamethoxazole (TMP/SMX) hiệu quả hơn atovaquone trong việc giảm tỉ lệ tử vong. TMP/SMX hiệu quả tương đương với clindamycin kết hợp với primaquine, pentamidine đường tĩnh mạch, và trimethoprim kết hợp với dapsone trong việc giảm tỉ lệ tử vong. Có bằng chứng thuyết phục rằng TMP/SMX hiệu quả hơn atovaquone trong việc phòng ngừa điều trị thất bại. TMP/SMX hiệu quả tương đương với clindamycin kết hợp với primaquine, pentamidine đường tĩnh mạch, và trimethoprim kết hợp với dapsone trong việc phòng ngừa điều trị thất bại.Bằng chứng cấp độ A: Đánh giá hệ thống (SR) hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) với >200 người tham gia.
- Tỷ lệ tử vong và điều trị thất bại: có bằng chứng tương đối thuyết phục rằng trimethoprim kết hợp dapsone cũng có hiệu quả tương đương với sclindamycin kết hợp primaquine trong việc giảm tỷ lệ tử vong ở bệnh nhân mắc PCP, và cũng có hiệu quả tương đương với clindamycin kết hợp primaquine trong việc phòng ngừa điều trị thất bại.
Bằng chứng cấp độ B: Các thử nghiệm ngẫu nhiên đối chứng (RCT) với <200 người tham gia, các RCT có lỗi về phương pháp với >200 người tham gia, các đánh giá hệ thống (SR) có lỗi về phương pháp hoặc các nghiên cứu quan sát (thuần tập) có chất lượng cao. - Tỷ lệ tử vong và điều trị thất bại: có bằng chứng thuyết phục rằng clindamycin kết hợp primaquine cũng có hiệu quả tương đương với trimethoprim/sulfamethoxazole (TMP/SMX) trong việc giảm tỷ lệ tử vong ở bệnh nhân mắc PCP, và cũng có hiệu quả tương đương với TMP/SMX trong việc phòng ngừa điều trị thất bại.
Bằng chứng cấp độ A: Đánh giá hệ thống (SR) hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) với >200 người tham gia. - Tỷ lệ tử vong và điều trị thất bại: nếu có bằng chứng thuyết phục rằng atovaquone kém hiệu quả hơn so với trimethoprim/sulfamethoxazole (TMP/SMX) trong việc giảm tỷ lệ tử vong ở bệnh nhân mắc PCP, và cũng kém hiệu quả hơn so với TMP/SMX trong việc phòng ngừa điều trị thất bại. Tuy nhiên, có sự đồng thuận rằng atovaquone được coi là có ích cho bệnh nhân có chống chỉ định với TMP/SMX.
Bằng chứng cấp độ A: Đánh giá hệ thống (SR) hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) với >200 người tham gia. - Tỷ lệ tử vong và điều trị thất bại: có bằng chứng tương đối thuyết phục rằng pentamidine đường tĩnh mạch có hiệu quả tương đương với trimethoprim/sulfamethoxazole (TMP/SMX) trong việc giảm tỷ lệ tử vong ở những bệnh nhân mắc PCP, và cũng có hiệu quả tương đương với TMP/SMX trong việc dự phòng điều trị thất bại.
Bằng chứng cấp độ B: Các thử nghiệm ngẫu nhiên đối chứng (RCT) với <200 người tham gia, các RCT có lỗi về phương pháp với >200 người tham gia, các đánh giá hệ thống (SR) có lỗi về phương pháp hoặc các nghiên cứu quan sát (thuần tập) có chất lượng cao. - Phòng ngừa: có bằng chứng ít thuyết phục rằng trimethoprim/sulfamethoxazole (TMP/SMX) có thể hiệu quả hơn pentamindine dạng hít và dapsone (có hoặc không có pyrimethamine) trong việc giảm tỉ lệ mắc mới PCP.Bằng chứng cấp độ C: Các nghiên cứu quan sát (thuần tập) có chất lượng thấp hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) có lỗi về phương pháp với <200 người tham gia.
- Hiệu quả điều trị: có các bằng chứng thuyết phục cho thấy ở trường hợp viêm phổi do nấm Pneumocystis (PCP) trung bình đến nặng, corticosteroid giúp cải thiện tỉ lệ tử vong trong vòng 1 và 3 tháng và hạn chế việc phải thở máy.
Các bài báo chủ yếu
- Palella FJ, Delaney KM, Moorman FC, et al. Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection. N Engl J Med. 1998 Mar 26;338(13):853-60. Toàn văn Tóm lược
- Kaplan JE, Hanson D, Dworkin MS, et al. Epidemiology of human immunodeficiency virus-associated opportunistic infections in the U.S. in the era of highly active antiretroviral therapy. Clin Infect Dis. 2000 Apr;30 Suppl 1:S5-14. Tóm lược
- Pulvirenti J, Herrera P, Venkataraman P, et al. Pneumocystis carinii pneumonia in HIV-infected patients in the HAART era. AIDS Patient Care STDS. 2003 Jun;17(6):261-5. Tóm lược
- Morris A, Lundgren JD, Masur H, et al. Current epidemiology of Pneumocystis pneumonia. Emerg Infect Dis. 2004 Oct;10(10):1713-20. Tóm lược
- Centers for Disease Control and Prevention; National Institutes of Health; HIV Medicine Association of the Infectious Diseases Society of America. Guidelines for prevention and treatment of opportunistic infections in HIV- infected adults and adolescents. March 2017 [internet publication]. Toàn văn
- Shelhamer JH, Gill VJ, Quinn TC, et al. The laboratory evaluation of opportunistic pulmonary infections. Ann Intern Med. 1996 Mar 15;124(6):585-99. Tóm lược
- Broaddus C, Dake MD, Stulbarg MS, et al. Bronchoalveolar lavage and transbronchial biopsy for the diagnosis of pulmonary infections in the acquired immunodeficiency syndrome. Ann Intern Med. 1985 Jun;102(6):747-52. Tóm lược
- Limper AH, Knox KS, Sarosi GA, et al. An official american thoracic society statement: treatment of fungal infections in adult pulmonary and critical care patients. Am J Respir Crit Care Med. 2011 Jan 1;183(1):96-128. Toàn văn Tóm lược
- Ewald H, Raatz H, Boscacci R, et al. Adjunctive corticosteroids for Pneumocystis jiroveci pneumonia in patients with HIV infection. Cochrane Database Syst Rev. 2015;(4):CD006150. Toàn văn Tóm lược
Ca lâm sàng
Ca 1
Nam 53 tuổi vô gia cư tới khoa cấp cứu sau vài ngày khó thở và ho có đờm. 1 tháng trước, bệnh nhân được theo dõi khó nuối: và được chẩn đoán viêm thực quản do Candida. Anh ta dùng nystatin nhưng từ chối làm thêm bất kỳ các xét nghiệm và các lời khuyên y tế. Bệnh nhân đang dùng cocaine và heroin đường tiêm chích. Thân nhiệt 38.8 độ C, huyết áp 121/72 mmHg, mạch 124 lần/phút, nhịp thở 22 lần/phút. SpO2 89% với oxy 2L/min bằng ống thở mũi. Anh ta tỉnh, nhận thức được và có rối loạn hô hấp nhẹ. Thấy nhiều mảng bám màu trắng ở niêm mạc miệng. Thổi tâm thu 2/6 nghe rõ ở bờ trái trên xương ức. Nghe phổi thấy ran ẩm nhẹ, hai bên. Tĩnh mạch cổ không nổi hay phù chi dưới. Cơ chế nào chịu trách nhiệm chính cho việc giảm oxy máu ở bệnh nhân này?
- Giảm thông khí phế nang lan tỏa.
- Tăng áp lực mao mạch phổi bít.
- Shunt trái-phải tại tim.
- Tăng áp phổi.
- Bất tương hợp thông khí – tưới máu.
Đáp án đúng là E: Bệnh nhân này có viêm niêm mạc do nấm mức độ nặng (mảng bám trắng) gợi ý tình trạng suy giảm miễn dịch (AIDS) với ho, khó thở, sốt và giảm oxy máu, tất cả dấy lên nghi ngờ với tình trạng viêm phổi. Bệnh nhân suy giảm miễn dịch có nghi ngờ viêm phổi do các vi khuẩn thường thấy (S. pneumonia) cũng như các tác nhân gây bệnh cơ hội (Pneumocystis jiroveci).
Trong viêm phổi, phế nang bị lấp đầy bởi dịch tiết do viêm, dẫn tới giảm oxy máu do gây bất thường trong thông khí tại phế nang tại vùng bị ảnh hưởng tại phổi. Kết quả là tạo shunt phải-trái tại phổi do bất tương hợp thông khí – tưới máu tại nơi mà có tưới máu mô phổi nhưng không có thông khí phế nang. Phụ thuộc vào việc phổi bị ảnh hưởng nhiều như thế nào bởi shunt tại phổi, thì sự giảm oxy máu có hoặc không có tương ứng với sự tăng FiO2, viêm phổi do P. jiroveci nặng thường có thể gây shunt lan rộng tại phổi với giảm oxy máu tạo nên sự khó khăn trong hỗ trợ thở oxy.
Đáp án A: Giảm thông khí phế nang lan toả gây giảm đồng bộ sự thông khí tại tất cả các vùng phổi gây giảm thể tích thông khí và tần số thở. Nó có thể do dùng opioid quá liều và do yếu thần kinh cơ. Bệnh nhân này có sốt, thở nhanh, ran ẩm hai bên nên chẩn đoán viêm phổi là hợp lý hơn.
Đáp án B: Viêm nội tâm mạc có thể dẫn tới suy giảm chức năng van – có thể gây suy tim trái kèm tăng áp lực tâm nhĩ trái (PCWP) và ran ẩm hai bên. Tuy nhiên, bệnh nhân này không có dấu hiệu suy tim (tĩnh mạch cổ nổi, phù chi dưới). Sốt kèm tình trạng tăng trương lực có thể gây ra tiếng thổi ở bệnh nhân này.
Đáp án C và D: Không giống như shunt phải-trái tại tim, shunt trái-phải (thông liên nhĩ) thường không có triệu chứng và không gây giảm oxy máu. Tuy nhiên, shunt trái-phải tại tim có thể dẫn tới quá tải tim phải và tăng áp phổi. Bệnh nhân bị tăng áp phổi thường có khó thở và giảm oxy máu tuy nhiên triệu chứng thường tiến triển chậm và không có sốt.
Tổng kết: Viêm phổi gây giảm oxy máu do shunt trái-phải tại phổi, một dạng nặng của bất tương đồng thông khí/ tưới máu. Phụ thuộc vào mức độ tổn thương của phổi bởi shunt phổi, gây giảm oxy máu và có thể gây khó khăn trong việc điều chỉnh bằng cách tăng FiO2.
Ca 2
Bệnh sử
Bệnh nhân nữ 54 tuổi mắc đái tháo đường típ 2 trong 40 năm, đang kiểm soát đường huyết bằng insuline. Bệnh nhân tăng huyết áp điều trị bằng amlodipine. Chức năng thận giảm dần và cách đây 18 tháng bệnh nhân được ghép thận từ người hiến tạng đã qua đời. Bệnh nhân có 3 đợt thải ghép (đào thải) làm tăng suy giảm miễn dịch. Bệnh nhân đã điều trị bằng co-trimoxazole nhưng đã ngưng 12 tháng sau ghép thận.
Bệnh nhân đến khám vì sốt và khó chịu kéo dài 5-6 ngày. Cùng lúc đó bệnh nhân cũng ho khan nhiều.
Khám lâm sàng
Khám lâm sàng ghi nhận nhiệt độ 38 độ C, huyết áp 132/82 mmHg, nhịp thở 20 lần/phút, độ bão hòa oxy 96%. Khám hệ tim mạch và hệ hô hấp chưa ghi nhận bất thường. Không sờ đau vùng thận cấy ghép và không có bệnh bạch huyết.
Cận lâm sàng
| Bình thường | ||
| Haemoglobin | 12.8 g/dL | 13.3-17.7 g/dL |
| Thể tích trung bình hồng cầu (MCV) | 89 fL | 80-99fL |
| Số lượng tế bào hồng cầu | 8.2 X 109/L | 3.9-10.6 X 109/L |
| Neutrophils | 7.6 X 109/L | 1.8-7.7 X 109/L |
| Lymphocytes | 0.2 X 109/L | 0.6-4.8 X 109/L |
| Monocytes | 0.2 X 109/L | 0.6-1.0 X 109/L |
| Số lượng tế bào tiểu cầu | 221 X 109/L | 150-440 X 109/L |
| Natri | 134 mmol/L | 135-145 mmol/L |
| Kali | 4.3 mmol/L | 3.5-5.0 mmol/L |
| Urea | 7.2 mmol/L | 2.5-6.7 mmol/L |
| Creatinine | 141 pmol/L | 70-120 pmol/L |
| Bilirubin | 16 mmol/L | 3-17 mmol/L |
| Alanine transaminase | 29IU/L | 5-35 IU/L |
| Gamma-glutamyl transaminase | 53IU/L | 11-51 IU/L |
| Alkaline phosphatase | 251IU/L | 30-300 IU/L |
Tổng phân tích nước tiểu: không protein, không máu.
Xquang ngực bình thường.
Bệnh nhân được cho uống paracetamol rồi cho về và yêu cầu trở lại bệnh viện nếu xuất hiện tình trạng xấu. 3 ngày sau bệnh nhân quay lại, sốt cao hơn, ho và bắt đầu khó thở. Khám ghi nhận nhiệt độ 38.8 độ C, huyết áp 122/78 mmHg, mạch 90 lần/ phút, nhịp thở 26 lần/phút và độ bão hòa Oxy 92%.
Câu hỏi
- Chẩn đoán phù hợp là gì?
- Điều trị bệnh nhân này thế nào?
Trả lời
Sốt ở bệnh nhân được ghép tạng thường liên quan liên quan nhất với mầm bệnh thông thường, nhưng tăng suy giảm miễn dịch có thể do nhiễm trùng cơ hội. Khả năng xảy ra cao trên bệnh nhân này vì suy giảm miễn dịch liên quan các đợt thải ghép.
Các triệu chứng ho khan và khó thở chỉ ra nhiễm trùng tập trung ở hô hấp. Mặc dù không có bất thường khi khám hệ hô hấp ngoài việc tăng nhịp thở và Xquang phổi ban đầu vẫn binh thường, giảm độ bão hòa oxy chứng minh có vấn đề đáng kể trao đổi khí trong phổi.
Sự kết hợp của sốt và ho khan mà không có dấu hiệu hô hấp và giảm oxy máu gợi ý chẩn đoán viêm phổi do pneumocystic jiroveci (nấm). Xquang ngực bình thường trong giai đoạn đầu trước khi tăng bóng mờ lan tỏa, với hình ảnh lấp đầy phế nang rõ nhất ở vùng giữa và dưới phổi, thường ít ở góc sườn hoành (hình dưới).
Bệnh nhân này điều trị bằng co-trimoxazole là thuốc dự phòng nhiễm trùng bào tử pneumocystic nhưng đã ngưng vì phát ban làm tăng nguy cơ nhiễm trùng.
Cận lâm sàng đầu tiên nên chụp Xquang phổi. Thậm chí nếu ho có đàm, Pneumocystic jiroveci thường không thể thấy trong đàm và cần một kỹ thuật như chọc hút đàm bằng nước muối ưu trương hoặc dịch rửa phế nang bằng nội soi phế quản để lấy mẫu bệnh phẩm phế nang.
Pneumocystic jiroveci là một loại nấm, trước đây gọi là Pneumocystic carinii. Thường xuất hiện trong môi trường nhưng không gây lây nhiễm khi không bị ức chế miễn dịch. Các mẫu bệnh phẩm từ đàm hay dịch rửa phế nang được nhuộm bằng thuộc nhuộm bạc, acid periodic Schiff hoặc phương pháp miễn dịch huỳnh quang.
Điều trị thường dùng liều cao co-trimoxazole nhưng bệnh nhân này trước đó có phát ban nên điều trị thay thế bằng dapsone và trimethoprim hoặc clindamycine và primaquine chứ không phải dùng pentamidine đường tĩnh mạch thế gây độc hơn khi được yêu cầu. Prednisolone thường dùng trong điều trị ban đầu trong các trường hợp giảm oxy máu nặng.
Hình 20.1 Xquang ngực thẳng
Ý chính
- Pneumocystic jiroveci là vi sinh vật phổ biến nhưng chỉ gây bệnh trên bệnh nhân suy giảm miễn dịch.
- Ho khan, sốt và khó thở là các triệu chứng thường gặp đi cùng với giảm oxy máu nặng và thở nhanh.
- Chẩn đoán thường yêu cầu lấy mẫu bệnh phẩm trong phế nang bằng cách rửa phế nang hoặc chọc hút đàm
Tài liệu tham khảo
- Palella FJ, Delaney KM, Moorman FC, et al. Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection. N Engl J Med. 1998 Mar 26;338(13):853-60. Toàn văn Tóm lược
- Kim JH, Psevdos G Jr, Gonzalez E, et al. All-cause mortality in hospitalized HIV-infected patients at an acute tertiary care hospital with a comprehensive outpatient HIV care program in New York City in the era of highly active antiretroviral therapy (HAART). Infection. 2013 Apr;41(2):545-51. Tóm lược
- Murray JF, Nadel JA, Mason RJ. Murray and Nadels Textbook of respiratory medicine. 4th ed. 2005, Philadelphia, PA: Elsevier Saunders. Viêm phổi do nhiễm Pneumocystis jirovecii Tài liệu tham khảo
- Weverling GJ, Mocroft A, Ledergerber B, et al. Discontinuation of Pneumocystis carinii pneumonia prophylaxis after start of highly active antiretroviral therapy in HIV-1 infection. EuroSIDA Study Group. Lancet. 1999 Apr 17;353(9161):1293-8. Tóm lược
- Buchacz K, Lau B, Jing Y, et al. Incidence of AIDS-defining opportunistic infections in a multicohort analysis of HIV-infected persons in the United States and Canada, 2000-2010. J Infect Dis. 2016 Sep 15;214(6):862-72. Toàn văn Tóm lược
- Phair J, Munoz A, Detels R, et al. The risk of Pneumocystis carinii pneumonia among men infected with human immunodeficiency virus type 1. Multicenter AIDS Cohort Study Group. N Engl J Med. 1990 Jan 18;322(3):161-5. Tóm lược
- Stansell JD, Osmond DH, Charlebois E, et al. Predictors of Pneumocystis carinii pneumonia in HIV-infected persons. Pulmonary Complications of HIV Infection Study Group. Am J Respir Crit Care Med. 1997 Jan;155(1):60-6. Tóm lược
- Kaplan JE, Hanson D, Dworkin MS, et al. Epidemiology of human immunodeficiency virus-associated opportunistic infections in the U.S. in the era of highly active antiretroviral therapy. Clin Infect Dis. 2000 Apr;30 Suppl 1:S5-14. Tóm lược
- Pulvirenti J, Herrera P, Venkataraman P, et al. Pneumocystis carinii pneumonia in HIV-infected patients in the HAART era. AIDS Patient Care STDS. 2003 Jun;17(6):261-5. Tóm lược
- Lundberg BE, Davidson AJ, Burman WJ. Epidemiology of Pneumocystis carinii pneumonia in an era of effective prophylaxis: the relative contribution of non-adherence and drug failure. AIDS. 2000 Nov 10;14(16):2559-66. Tóm lược
- Huang L, Hecht FM. Why does Pneumocystis carinii pneumonia still occur? AIDS. 2000 Nov 10;14(16):2611-2. Tóm lược
- López-Sánchez C, Falcó V, Burgos J, et al. Epidemiology and long-term survival in HIV-infected patients with Pneumocystis jirovecii pneumonia in the HAART era:experience in a university hospital and review of the literature. Medicine (Baltimore). 2015 Mar;94(12):e681. Toàn văn Tóm lược
- Centers for Disease Control and Prevention (CDC). HIV prevalence estimates: United States, 2006. MMWR Morb Mortal Wkly Rep. 2008 Oct 3;57(39):1073-6. Toàn văn Tóm lược
- Fisk DT, Meshnick, S, Kazanjian PH. Pneumocystis carinii pneumonia in patients in the developing world who have acquired immunodeficiency syndrome. Clin Infect Dis. 2003 Jan 1;36(1):70-8. Tóm lược
- Taylor SM, Meshnick SR, Worodria W, et al. Low prevalence of Pneumocystis jirovecii lung colonization in Ugandan HIV-infected patients hospitalized with non-Pneumocystis pneumonia. Diagn Microbiol Infect Dis. 2012 Feb;72(2):139-43. Tóm lược
- Nesheim SR Kopogiannis BG, Soe SM, et al. Trends in opportunistic infections in the pre- and post-highly active antiretroviral therapy eras among HIV-infected children in the Perinatal AIDS Collaborative Transmission Study, 1986-2004. Pediatrics. 2007 Jul;120(1):100-9. Tóm lược Viêm phổi do nhiễm Pneumocystis jirovecii Tài liệu tham khảo
- Kovacs A, Frederick T, Church J, et al. CD4 T-lymphocyte counts and Pneumocystis carinii pneumonia in pediatric HIV infection. JAMA. 1991 Apr 3;265(13):1698-703. Tóm lược
- Morris A, Lundgren JD, Masur H, et al. Current epidemiology of Pneumocystis pneumonia. Emerg Infect Dis. 2004 Oct;10(10):1713-20. Tóm lược
- Kaplan JE, Masur H, Holmes KK. Guidelines for preventing opportunistic infections among HIV-infected persons–2002. Recommendations of the U.S. Public Health Service and the Infectious Diseases Society of America. MMWR Recomm Rep. 2002;51(RR-8):1-52.
- Falagas ME, Manta KG, Betsi GI, et al. Infection-related morbidity and mortality in patients with connective tissue diseases: a systematic review. Clin Rheumatol. 2007 May;26(5):663-70. Tóm lược
- Gilmartin GS, Koziel H. Pneumocystis carinii pneumonia in adult non-HIV disorders. J Intensive Care Med. 2002;17:283-301.
- Pareja JGR, Garland R, Koziel H. Use of adjunctive corticosteroids in severe adult non-HIV Pneumocystis carinii pneumonia. Chest. 1998 May;113(5):1215-24. Tóm lược
- Yale SH, Limper AH. Pneumocystis carinii pneumonia in patients without acquired immunodeficiency syndrome: associated illness and prior corticosteroid therapy. Mayo Clin Proc. 1996;71:5-13.
- Fillatre P, Decaux O, Jouneau S, et al. Incidence of Pneumocystis jiroveci pneumonia among groups at risk in HIV- negative patients. Am J Med. 2014 Dec;127(12):1242.e11-7. Tóm lược
- Bienvenu AL, Traore K, Plekhanova I, et al. Pneumocystis pneumonia suspected cases in 604 non-HIV and HIV patients. Int J Infect Dis. 2016 May;46:11-7. Tóm lược
- Ling C, Qian S, Wang Q, et al. Pneumocystis pneumonia in non-HIV children: a 10-year retrospective study. Clin Respir J. 2016 Feb 15 [Epub ahead of print]. Tóm lược
- Maini R, Henderson KL, Sheridan EA, et al. Increasing Pneumocystis Pneumonia, England, UK, 2000-2010. Emerg Infect Dis. 2013 Mar;19(3):386-92. Toàn văn Tóm lược
- Harigai M, Koike R, Miyasaka M, et al. Pneumocystis pneumonia associated with infliximab in Japan. N Engl J Med. 2007 Nov 1;357(18):1874-6. Tóm lược
- Imaizumi K, Sugishita M, Usui M, et al. Pulmonary infectious complications associated with anti-TNFalpha therapy (infliximab) for rheumatoid arthritis. Intern Med. 2006;45(10):685-8. Tóm lược
- Kalyoncu U, Karadag O, Akdogan A, et al. Pneumocystis carinii pneumonia in a rheumatoid arthritis patient treated with adalimumab. Scand J Infect Dis. 2007;39(5):475-8. Tóm lược
- Lahiff C, Khiaron OB, Nolan N, et al. Pneumocystis carinii pneumonia in a patient on etanercept for psoriatic arthritis. Ir J Med Sci. 2007 Dec;176(4):309-11 Tóm lược
- Mori S, Imamura S, Fiyofiji C, et al. Pneumocystis jiroveci pneumonia in a patient with rheumatoid arthritis as a complication of treatment with infliximab, anti-tumor necrosis factor alpha neutralizing antibody. Mod Rheumatol. 2006;16(1):58-62. Tóm lược Viêm phổi do nhiễm Pneumocystis jirovecii Tài liệu tham khảo
- Martin-Garrido I, Carmona EM, Specks U, et al. Pneumocystis pneumonia in patients treated with rituximab. 2013 Jul;144(1):258-265. Tóm lược
- Kovacs JA, Hiemenz JW, Macher AM, et al. Pneumocystis carinii pneumonia: a comparison between patients with the acquired immunodeficiency syndrome and patients with other immunodeficiencies. Ann Intern Med. 1984 May;100(5):663-71. Tóm lược
- Mansharamani NG, Garland R, Delaney G, et al. Management and outcome patterns for adult Pneumocystis carinii pneumonia, 1985 to 1995: comparison of HIV-associated cases to other immunocompromised states. Chest. 2000 Sep;118(3):704-11. Tóm lược
- Edman JC, Kovacs JA, Masur H, et al. Ribosomal RNA sequence shows Pneumocystis carinii to be a member of the fungi. Nature. 1988;334:519-522. Tóm lược
- Stringer JR, Cushion MT, Wakefield AE. New nomenclature for the genus Pneumocystis. J Eukaryot Microbiol. 2001;Suppl:184S-189S. Tóm lược
- Stringer JR, Beard CB, Miller RF, et al. A new name (Pneumocystis jiroveci) for Pneumocystis from humans. Emerg Infect Dis. 2002 Sep;8(9):891-6. Toàn văn Tóm lược
- Limper AH, Offord KP, Smith TF, et al. Pneumocystis carinii pneumonia. Differences in lung parasite number and inflammation in patients with and without AIDS. Am Rev Respir Dis. 1989 Nov;140(5):1204-9. Tóm lược
- Leoung GS. Pneumocystosis and HIV. HIV InSite Knowledge Base. January 2006 [internet publication]. Toàn văn
- Ognibene FP, Shelhamer JH, Hoffman GS, et al. Pneumocystis carinii pneumonia: a major complication of immunosuppressive therapy in patients with Wegeners granulomatosis. Am J Respir Crit Care Med. 1995;151(3 Pt 1):795-799. Tóm lược
- Green H, Paul M, Vidal J, et al. Prophylaxis of Pneumocystis pneumonia in immunocompromised non-HIV- infected patients: systematic review and meta-analysis of randomized controlled trials. Mayo Clinic Proc. 2007 Sep;82(9):1052-9. Tóm lược
- National Institutes of Health; Centers for Disease Control and Prevention; HIV Medicine Association of the Infectious Diseases Society of America; Pediatric Infectious Diseases Society; American Academy of Pediatrics. Guidelines for the prevention and treatment of opportunistic infections in HIV-exposed and HIV-infected children. December 2016 [internet publication]. Toàn văn
- Centers for Disease Control and Prevention; National Institutes of Health; HIV Medicine Association of the Infectious Diseases Society of America. Guidelines for prevention and treatment of opportunistic infections in HIV- infected adults and adolescents. March 2017 [internet publication]. Toàn văn
- Opportunistic Infections Project Team of the Collaboration of Observational HIV Epidemiological Research in Europe (COHERE), Mocroft A, Reiss P, et al. Is it safe to discontinue primary Pneumocystis jiroveci pneumonia prophylaxis in patients with virologically suppressed HIV infection and a CD4 cell count <200 cells/microL? Clin Infect Dis. 2010 Sep 1;51(5):611-9. Tóm lược
- Stern A, Green H, Paul M, et al. Prophylaxis for Pneumocystis pneumonia (PCP) in non-HIV immunocompromised patients. Cochrane Database Syst Rev. 2014;(10):CD005590. Toàn văn Tóm lượcm Viêm phổi do nhiễm Pneumocystis jirovecii Tài liệu tham khảo
- Helweg-Larsen J, Tsolaki AJ, Miller RF, et al. Clusters of Pneumocystis carinii pneumonia: analysis of person-to- person transmission by genotyping. QJM. 1998 Dec;91(12):813-20. Tóm lược
- Olsson M, Lidman C, Latouche S, et al. Identification of Pneumocystis carinii f. sp. hominis gene sequences in filtered air in hospital environments. J Clin Microbiol. 1998 Jun;36(6):1737-40. Tóm lược
- Schmoldt S, Schuhegger R, Wendler T, et al. Molecular evidence of nosocomial Pneumocystis jiroveci transmission among 16 patients after kidney transplantation. J Clin Microbiol. 2008 Mar;46(3):966-71. Tóm lược
- Morris A, Beard CB, Huang L. Update on the epidemiology and transmission of Pneumocystis carinii. Microbes Infect. 2002 Jan;4(1):95-103. Tóm lược
- Zheng M, Shellito JE, Marrero L, et al. CD4+ T cell-independent vaccination against Pneumocystis carinii in mice. J Clin Invest. 2001 Nov;108(10):1469-74. Tóm lược
- Wells J, Haidaris CG, Wright TW, et al. Active immunization against Pneumocystis carinii with a recombinant P. carinii antigen. Infect Immunol. 2006 Apr;74(4):2446-8. Tóm lược
- Theus SA, Smulian AG, Steele P, et al. Immunization with the major surface glycoprotein of Pneumocystis carinii elicits a protective response. Vaccine. 1998 Jul;16(11-12):1149-57. Tóm lược
- Katz MH, Baron RB, Grady D. Risk stratification of ambulatory patients suspected of Pneumocystis pneumonia. Arch Intern Med. 1991 Jan;151(1):105-10. Tóm lược
- Singh N, Shafer RW, Swindells S (eds). HIV clinical manual. Pittsburgh, PA: ESun Technologies; 2003.
- Fortun J, Navas E, Marti-Belda P, et al. Pneumocystis carinii pneumonia in HIV-infected patients: diagnostic yield of induced sputum and immunofluorescent stain with monoclonal antibodies. Eur Respir J. 1992 Jun;5(6):665-9. Tóm lược
- Kovacs JA, Ng VL, Masur H, et al. Diagnosis of Pneumocystis carinii pneumonia: improved detection in sputum with use of monoclonal antibodies. N Engl J Med. 1988 Mar 10;318(10):589-93. Tóm lược
- Midgley J, Parsons P, Leigh TR, et al. Increased sensitivity of immunofluorescence for detection of Pneumocystis carinii. Lancet. 1989 Dec 23-30;2(8678-8679):1523. Tóm lược
- Ng VL, Virani NA, Chaisson RE, et al. Rapid detection of Pneumocystis carinii using a direct fluorescent monoclonal antibody stain. J Clin Microbiol. 1990 Oct;28(10):2228-33. Tóm lược
- Harcup C, Baier HJ, Pitchenik AE. Evaluation of patients with the acquired immunodeficiency syndrome (AIDS) by fiberoptic bronchoscopy. Endoscopy. 1985 Nov;17(6):217-20. Tóm lược
- Zaman MK, White DA. Serum lactate dehydrogenase levels and Pneumocystis carinii pneumonia. Diagnostic and prognostic significance. Lancet. 1988 Nov 5;2(8619):1049-51. Tóm lược
- Gruden JF, Huang L, Turner J, et al. High-resolution CT in the evaluation of clinically suspected Pneumocystis carinii pneumonia in AIDS patients with normal, equivocal, or nonspecific radiographic findings. AJR Am J Roentgenol. 1997 Oct;169(4):967-75. Tóm lược Viêm phổi do nhiễm Pneumocystis jirovecii Tài liệu tham khảo
- Huang L, Stansell J, Osmond D, et al. Performance of an algorithm to detect Pneumocystis carinii pneumonia in symptomatic HIV-infected persons. Chest. 1999 Apr;115(4):1025-32. Toàn văn Tóm lược
- Sankary RM, Turner J, Lipavsky A, et al. Alveolar-capillary block in patients with AIDS and Pneumocystis carinii pneumonia. Am Rev Respir Dis. 11988 Feb;137(2):443-9. Tóm lược
- Shelhamer JH, Gill VJ, Quinn TC, et al. The laboratory evaluation of opportunistic pulmonary infections. Ann Intern Med. 1996 Mar 15;124(6):585-99. Tóm lược
- Broaddus C, Dake MD, Stulbarg MS, et al. Bronchoalveolar lavage and transbronchial biopsy for the diagnosis of pulmonary infections in the acquired immunodeficiency syndrome. Ann Intern Med. 1985 Jun;102(6):747-52. Tóm lược
- Fillaux J, Malvy S, Alvarez M, et al. Accuracy of a routine real-time PCR assay for the diagnosis of Pneumocystis jiroveci pneumonia. J Microbiol Methods. 2008 Oct;75(2):258-61. Tóm lược
- Tuncer S, Erguven S, Kocagoz S, et al. Comparison of cytochemical staining, immunofluorescence and PCR for diagnosis of Pneumocystis carinii on sputum samples. Scand J Infect Dis. 1998;30(2):125-8. Tóm lược
- Larsen HH, Masur H, Kovacs JA, et al. Development and evaluation of a quantitative, touch-down, real-time PCR assay for diagnosing Pneumocystis carinii pneumonia. J Clin Microbiol. 2002 Feb;40(2):490-4. Tóm lược
- Helweg-Larsen J, Jensen JS, Lundgren B. Diagnostic use of PCR for detection of Pneumocystis carinii in oral wash samples. J Clin Microbiol. 1998 Jul;36(7):2068-72. Tóm lược
- Larsen HH, Huang L, Kovacs JA, et al. A prospective, blinded study of quantitative touch-down polymerase chain reaction using oral-wash samples for diagnosis of Pneumocystis pneumonia in HIV-infected patients. J Infect Dis. 2004 May 1;189(9):1679-83. Tóm lược
- Skelly MJ, Holzman RS, Merali S. S-adenosylmethionine levels in the diagnosis of Pneumocystis carinii pneumonia in patients with HIV infection. Clin Infect Dis. 2008 Feb 1;46(3):467-71. Toàn văn Tóm lược
- Summah H, Zhu YG, Falagas ME, et al. Use of real-time polymerase chain reaction for the diagnosis of Pneumocystis pneumonia in immunocompromised patients: a meta-analysis. Chin Med J (Engl). 2013;126(10):1965-73. Tóm lược
- Watanabe T, Yasuoka A, Tanuma J, et al. Serum (1-->3) beta-D-glucan as a noninvasive adjunct marker for the diagnosis of Pneumocystis pneumonia in patients with AIDS. Clin Infect Dis. 2009 Oct 1;49(7):1128-31. Toàn văn Tóm lược
- Shimizu Y, Sunaga N, Dobashi K, et al. Serum markers in interstitial pneumonia with and without Pneumocystis jirovecii colonization: a prospective study. BMC Infect Dis. 2009 Apr 22;9:47. Toàn văn Tóm lược
- Desmet S, Van Wijngaerden E, Maertens J, et al. Serum (1-3)-beta-D-glucan as a tool for diagnosis of Pneumocystis jirovecii pneumonia in patients with human immunodeficiency virus infection or hematological malignancy. J Clin Microbiol. 2009 Dec;47(12):3871-4. Toàn văn Tóm lược.Viêm phổi do nhiễm Pneumocystis jirovecii Tài liệu tham khảo
- Del Bono V, Mularoni A, Furfaro E, et al. Clinical evaluation of a (1,3)-beta-D-glucan assay for presumptive diagnosis of Pneumocystis jiroveci pneumonia in immunocompromised patients. Clin Vaccine Immunol. 2009 Oct;16(10):1524-6. Toàn văn Tóm lược
- Nakamura H, Tateyama M, Tasato D, et al. Clinical utility of serum beta-D-glucan and KL-6 levels in Pneumocystis jirovecii pneumonia. Intern Med. 2009;48(4):195-202. Toàn văn Tóm lược
- Huang L. Clinical and translational research in pneumocystis and pneumocystis pneumonia. Parasite. 2011 Feb;18(1):3-11. Tóm lược
- Onishi A, Sugiyama D, Kogata Y, et al. Diagnostic accuracy of serum 1,3-β-D-glucan for pneumocystis jiroveci pneumonia, invasive candidiasis, and invasive aspergillosis: systematic review and meta-analysis. J Clin Microbiol. 2012 Jan;50(1):7-15. Toàn văn Tóm lược
- Li WJ, Guo YL, Liu TJ, et al. Diagnosis of pneumocystis pneumonia using serum (1-3)-β-D-Glucan: a bivariate meta-analysis and systematic review. J Thorac Dis. 2015 Dec;7(12):2214-25. Toàn văn Tóm lược
- Sax PE, Komarow L, Finkelman MA, et al. Blood (1->3)-beta-D-glucan as a diagnostic test for HIV-related Pneumocystis jirovecii pneumonia. Clin Infect Dis. 2011 Jul 15;53(2):197-202. Toàn văn Tóm lược
- Wood BR, Komarow L, Zolopa AR, et al. Test performance of blood beta-glucan for Pneumocystis jirovecii pneumonia in patients with AIDS and respiratory symptoms. AIDS.2013 Mar 27;27(6):967-72. Tóm lược
- Kennedy CA, Goetz MB. Atypical roentgenographic manifestations of Pneumocystis carinii pneumonia. Arch Intern Med. 1992 Jul;152(7):1390-8. Tóm lược
- Sandhu JS, Goodman PC. Pulmonary cysts associated with Pneumocystis carinii pneumonia in patients with AIDS. Radiology. 1989 Oct;173(1):33-5. Tóm lược
- Abd AG, Nierman DM, Ilowite JS, et al. Bilateral upper lobe Pneumocystis carinii pneumonia in a patient receiving inhaled pentamidine prophylaxis. Chest. 1988 Aug;94(2):329-31. Toàn văn Tóm lược
- Aberg JA. Coccidioidomycosis and HIV. HIV InSite Knowledge Base. March 2006. http://hivinsite.ucsf.edu/ (last accessed 5 June 2016). Toàn văn
- Drew WL, Lalezari JP. Cytomegalovirus and HIV. HIV InSite Knowledge Base. May 2006. http:// hivinsite.ucsf.edu/ (last accessed 5 June 2016). Toàn văn
- Young EM, Goldman H. Histoplasmosis and HIV infection. HIV InSite Knowledge Base. March 2006. http:// hivinsite.ucsf.edu/ (last accessed 5 June 2016). Toàn văn
- Krown SE. Clinical characteristics of Kaposi sarcoma. HIV InSite Knowledge Base. February 2006. http:// hivinsite.ucsf.edu/ (last accessed 5 June 2016). Toàn văn
- Limper AH, Knox KS, Sarosi GA, et al. An official american thoracic society statement: treatment of fungal infections in adult pulmonary and critical care patients. Am J Respir Crit Care Med. 2011 Jan 1;183(1):96-128. Toàn văn Tóm lược Viêm phổi do nhiễm Pneumocystis jirovecii Tài liệu tham khảo
- Hughes W, Leoung G, Kramer F, et al. Comparison of atovaquone (566C80) with trimethoprim-sulfamethoxazole to treat Pneumocystis carinii pneumonia in patients with AIDS. N Engl J Med. 1993 May 27;328(21):1521-7. Tóm lược
- Safrin S, Finkelstein DM, Feinberg J, et al. Comparison of three regimens for treatment of mild to moderate Pneumocystis carinii pneumonia in patients with AIDS. A double-blind, randomized, trial of oral trimethoprim- sulfamethoxazole, dapsone-trimethoprim, and clindamycin-primaquine. ACTG 108 Study Group. Ann Intern Med. 1996 May 1;124(9):792-802. Tóm lược
- Benfield T, Atzori C, Miller RF, et al. Second-line salvage treatment of AIDS-associated Pneumocystis jiroveci pneumonia: a case series and systematic review. J Acquir Immune Defic Syndr. 2008 May 1;48(1):63-7. Tóm lược
- Bozzette SA, Sattler FR, Chiu J, et al. A controlled trial of early adjunctive treatment with corticosteroids for Pneumocystis carinii pneumonia in the acquired immunodeficiency syndrome. California Collaborative Treatment Group. N Engl J Med. 1990 Nov 22;323(21):1451-7. Tóm lược
- Bozzette SA. The use of corticosteroids in Pneumocystis carinii pneumonia. J Infect Dis. 1990 Dec;162(6):1365-9. Tóm lược
- Gagnon S, Boota AM, Fischl MA, et al. Corticosteroids as adjunctive therapy for severe Pneumocystis carinii pneumonia in the acquired immunodeficiency syndrome. A double-blind, placebo-controlled trial. N Engl J Med. 1990 Nov 22;323(21):1444-50. Tóm lược
- Montaner JS, Lawson LM, Levitt L, et al. Corticosteroids prevent early deterioration in patients with moderately severe Pneumocystis carinii pneumonia and the acquired immunodeficiency syndrome (AIDS). Ann Intern Med. 1990 Jul 1;113(1):14-20. Tóm lược
- Nielsen TL, Eeftinck Schattenkerk JK, Jensen BN, et al. Adjunctive corticosteroid therapy for Pneumocystis carinii pneumonia in AIDS: a randomized European multicenter open label study. J Acquir Immune Defic Syndr. 1992;5(7):726-31. Tóm lược
- Walmsley S, Levinton C, Brunton J, et al. A multicenter randomized double-blind placebo-controlled trial of adjunctive corticosteroids in the treatment of Pneumocystis carinii pneumonia complicating the acquired immune deficiency syndrome. J Acquir Immune Defic Syndr Hum Retrovirol. 1995 Apr 1;8(4):348-57. Tóm lược
- Ewald H, Raatz H, Boscacci R, et al. Adjunctive corticosteroids for Pneumocystis jiroveci pneumonia in patients with HIV infection. Cochrane Database Syst Rev. 2015;(4):CD006150. Toàn văn Tóm lược
- Wazir JF, Ansari NA. Pneumocystis carinii infection. Update and review. Arch Pathol Lab Med. 2004 Sep;128(9):1023-7. Tóm lược
- Injean P, Eells SJ, Wu H, et al. A systematic review and meta-analysis of the data behind current recommendations for corticosteroids in non-HIV-related PCP: knowing when you are on shaky foundations. Transplant Direct. 2017 Feb 15;3(3):e137. Toàn văn Tóm lược
- Benson CA, Kaplan JE, Masur H, et al. Treating opportunistic infections among HIV-infected adults and adolescents: recommendations from CDC, the National Institutes of Health, and the HIV Medicine. Clin Infect Dis. 2005;40:S131. Toàn văn Viêm phổi do nhiễm Pneumocystis jirovecii Tài liệu tham khảo
- Di Cocco P, Orlando G, Bonanni L, et al. A systematic review of two different trimetoprim-sulfamethoxazole regimens used to prevent Pneumocystis jirovecii and no prophylaxis at all in transplant recipients: appraising the evidence. Transplant Proc. 2009 May;41(4):1201-3. Tóm lược
- Annaloro C, Della Volpe A, Usardi P, et al. Caspofungin treatment of Pneumocystis pneumonia during conditioning for bone marrow transplantation. Eur J Clin Microbiol Infect Dis. 2006;25:52-54. Tóm lược
- Hof H, Schnulle P. Pneumocystis jiroveci pneumonia in a patient with Wegeners granulomatosis treated efficiently with caspofungin. Mycoses. 2008;51(suppl 1):65-67. Tóm lược
- Powles MA, Liberator P, Anderson J, et al. Efficacy of MK-991 (L-743,872), a semisynthetic pneumocandin, in murine models of Pneumocystis carinii. Antimicrob Agents Chemother. 1998;42:1985-1989. Tóm lược
- Utili R, Durante-Mangoni E, Basilico C, et al. Efficacy of caspofungin addition to trimethoprim-sulfamethoxazole treatment for severe Pneumocystis pneumonia in solid organ transplant recipients. Transplantation.
2007;84:685-688. Tóm lược - Waters L, Nelson A. The use of caspofungin in HIV-infected individuals. Expert Opin Investig Drugs. 2007;16:899-908.
- Wickramasekaran RN, Jewell MP, Sorvillo F, et al. The changing trends and profile of pneumocystosis mortality in the United States, 1999-2014. Mycoses. 2017 Sep;60(9):607-15. Tóm lược
- Dworkin MS, Hanson DL, Navin TR. Survival of patients with AIDS, after diagnosis of Pneumocystis carinii pneumonia, in the United States. J Infect Dis. 2001 May 1;183(9):1409-12. Toàn văn Tóm lược
- Arozullah AM, Yarnols PR, Weinstein RA, et al. A new preadmission staging system for predicting inpatient mortality from HIV-associated Pneumocystis carinii pneumonia in the early highly active antiretroviral therapy (HAART) era. Am J Respir Crit Care Med. 2000 Apr;161(4 Pt 1):1081-6. Tóm lược
- Walzer PD, Evans HE, Copas AJ, et al. Early predictors of mortality from Pneumocystis jiroveci pneumonia in HIV-infected patients: 1985 to 2006. Clin Infect Dis. 2008 Feb 15;46(4):625-33. Tóm lược
- Morris A, Creasman J, Turner J, et al. Intensive care of human immunodeficiency virus-infected patients during the era of highly active antiretroviral therapy. Am J Respir Crit Care Med. 2002 Aug 1;166(3):262-7. Tóm lược
- Nickas G, Wachter RM. Outcomes of intensive care for patients with human immunodeficiency virus infection. Arch Intern Med. 2000 Feb 28;160(4):541-7. Tóm lược
- Powell K, Davis JL, Morris AM, et al. Survival for patients with human immunodeficiency virus admitted to the intensive care unit continues to improve in the current era of highly active antiretroviral therapy. Chest. 2009 Jan;135(1):11-17. Tóm lược
- Wachter RM, Luce JM, Safrin S, et al. Cost and outcome of intensive care for patients with AIDS, Pneumocystis carinii pneumonia, and severe respiratory failure. JAMA. 1995 Jan 18;273(3):230-5. Tóm lược
- Wachter RM, Luce JM, Turner J, et al. Intensive care of patients with the acquired immunodeficiency syndrome. Outcome and changing patterns of utilization. Am Rev Respir Dis. 1986 Nov;134(5):891-6. Tóm lược
- Wachter RM, Russi MB, Bloch DA, et al. Pneumocystis carinii pneumonia and respiratory failure in AIDS. Improved outcomes and increased use of intensive care units. Am Rev Respir Dis. 1991 Feb;143(2):251-6. Tóm lược
- Morris A, Wachter RM, Luce J, et al. Improved survival with highly active antiretroviral therapy in HIV-infected patients with severe Pneumocystis carinii pneumonia. AIDS. 2003 Jan 3;17(1):73-80. Tóm lược
- Arend SM, Kroon FP, van’t Wout JW. Pneumocystis carinii pneumonia in patients without AIDS, 1980 through 1993. An analysis of 78 cases. Arch Intern Med. 1995 Dec 11-25;155(22):2436-41. Tóm lược
- Cao B, Wang H, Wang P, et al. Clinical parameters and outcomes of Pneumocystis jiroveci pneumonia in non-HIV/ AIDS patients. Chin Med J (Engl). 2006 Feb 5;119(3):234-7. Tóm lược
- Sepkowitz KA, Telzak EE, Gold JW, et al. Pneumothorax in AIDS. Ann Intern Med. 1991 Mar 15;114(6):455-9. Tóm lược
- DeLorenzo LJ, Huang CT, Maguire GP, et al. Roentgenographic patterns of Pneumocystis carinii pneumonia in 104 patients with AIDS. Chest. 1987 Mar;91(3):323-7. Toàn văn Tóm lược
- Metersky ML, Colt HG, Olson LK, et al. AIDS-related spontaneous pneumothorax. Risk factors and treatment. Chest. 1995 Oct;108(4):946-51. Tóm lược
- Dhasmana DJ, Dheda K, Ravn P, et al. Immune reconstitution inflammatory syndrome in HIV-infected patients receiving antiretroviral therapy: pathogenesis, clinical manifestations and management. Drugs. 2008;68(2):191-208. Tóm lược
- Lawn SD, Török ME, Wood R. Optimum time to start antiretroviral therapy during HIV-associated opportunistic infections. Curr Opin Infect Dis. 2011 Feb;24(1):34-42. Tóm lược
Hình ảnh
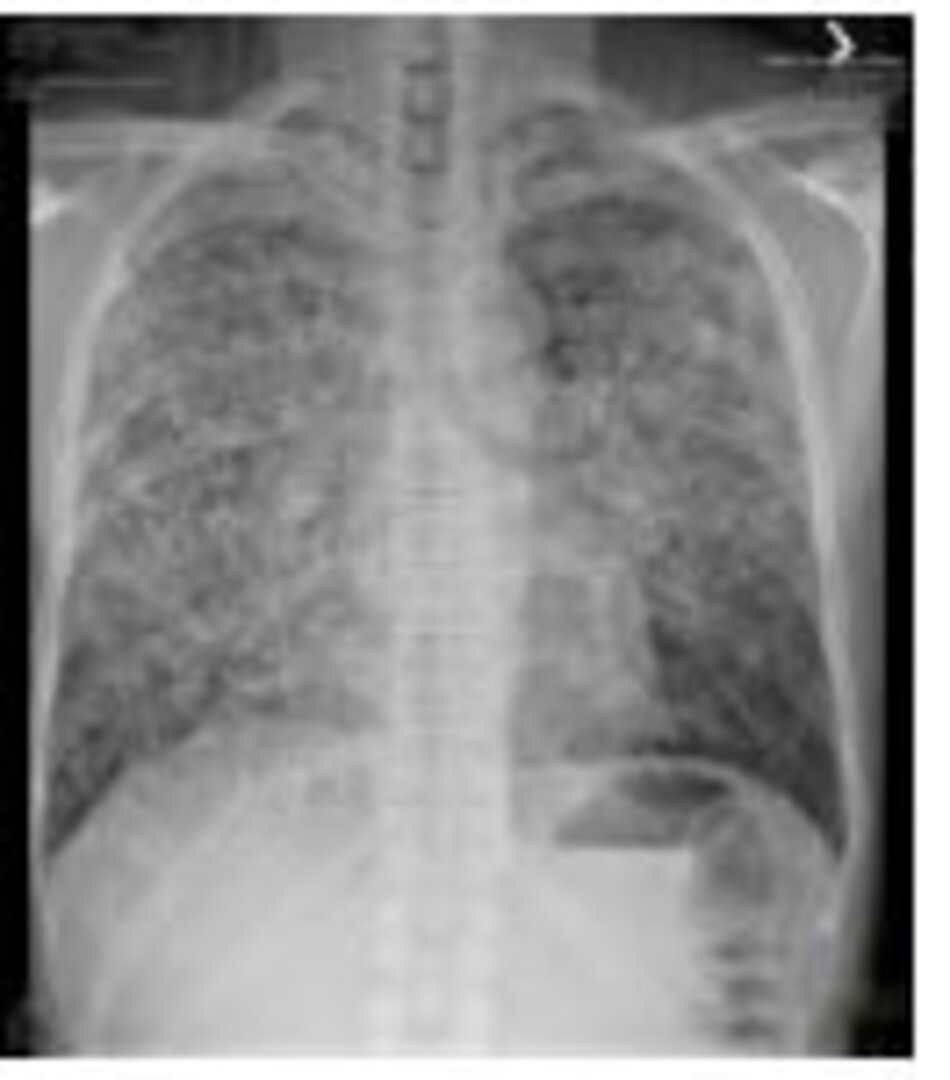
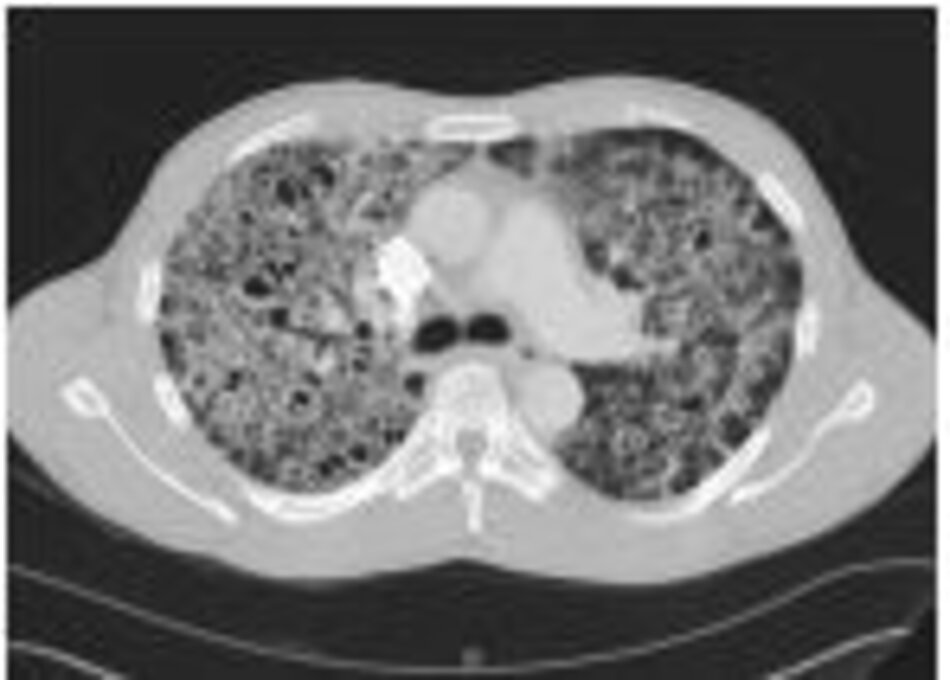

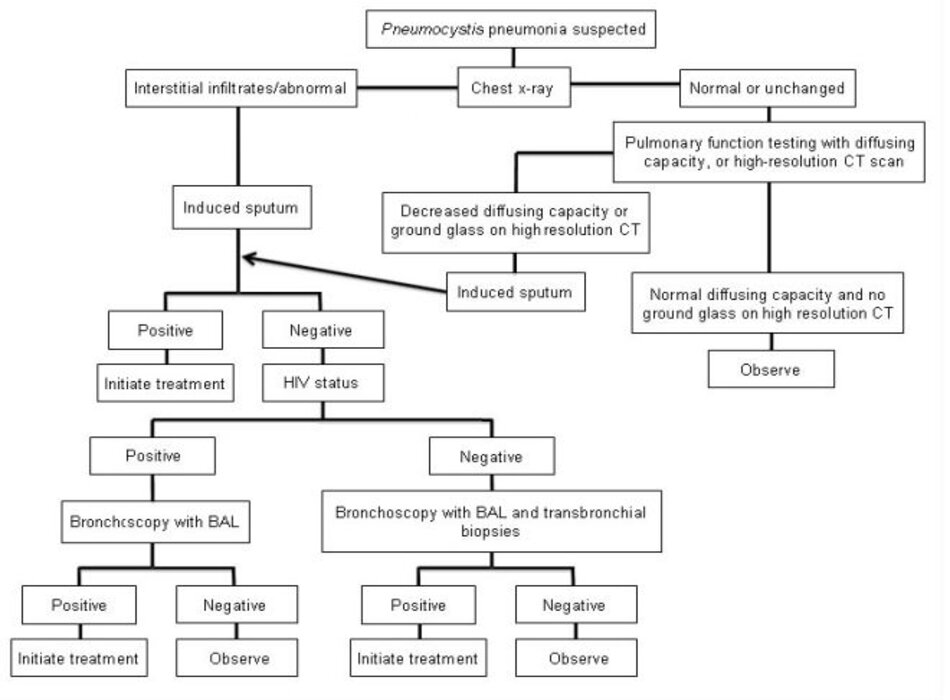
Tuyên bố miễn trách nhiệm
Bên ngoài Hoa Kỳ và Canada. BMJ Publishing Group Ltd (”BMJ Group”) nỗ lực để đảm bảo rằng các thông tin được cung cấp là chính xác và cập nhật, nhưng chúng tôi và cả những người cấp giấy phép của chúng tôi, là những người cung cấp các nội dung nhất định có liên kết với nội dung của chúng tôi hoặc có thể truy cập được từ nội dung của chúng tôi, đều không đảm bảo điều đó. BMJ Group không ủng hộ hay xác nhận việc sử dụng bất kỳ loại thuốc hay trị liệu nào trong đó và BMJ Group cũng không thực hiện chẩn đoán cho các bệnh nhân. Các chuyên gia y tế cần sử dụng những cân nhắc chuyên môn của mình trong việc sử dụng thông tin này và chăm sóc cho bệnh nhân của họ và thông tin trong này không được coi là sự thay thế cho việc đó.
Các phương pháp chẩn đoán, điều trị, liên lạc theo dõi, thuốc và bất kỳ chống chỉ định hay phản ứng phụ nào. Ngoài ra, các tiêu chuẩn và thực hành y khoa đó thay đổi khi có thêm số liệu, và quý vị nên tham khảo nhiều nguồn khác nhau. Chúng tôi đặc biệt khuyến nghị người dùng nên xác minh độc lập các chẩn đoán, điều trị và theo dõi liên lạc được đưa ra, đồng thời đảm bảo rằng thông tin đó là phù hợp cho bệnh nhân trong khu vực của quý vị. Ngoài ra, liên quan đến thuốc kê toa, chúng tôi khuyên quý vị nên kiểm tra trang thông tin sản phẩm kèm theo mỗi loại thuốc để xác minh các điều kiện sử dụng và xác định bất kỳ thay đổi nào về liều dùng hay chống chỉ định, đặc biệt là nếu dược chất được cho sử dụng là loại mới, ít được sử dụng, hay có khoảng trị liệu hẹp. Quý vị phải luôn luôn kiểm tra rằng các loại thuốc được dẫn chiếu có giấy phép để sử dụng cho mục đích được nêu và trên cơ sở được cung cấp trong tình trạng “hiện có” như được nêu, và trong phạm vi đầy đủ được pháp luật cho phép BMJ Group và những người cấp giấy phép của mình không chịu bất kỳ trách nhiệm nào cho bất kỳ khía cạnh chăm sóc sức khỏe nào được cung cấp với sự hỗ trợ của thông tin này hay việc sử dụng nào khác của thông tin này.