Bệnh truyền nhiễm
Sốt xuất huyết Crimea-Congo: Cơ chế bệnh sinh, chẩn đoán, điều trị
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhathuocngocanh.com – Bài viết Sốt xuất huyết Crimea-Congo. Để tải file PDF, mời các bạn click vào link ở đây
Tóm tắt
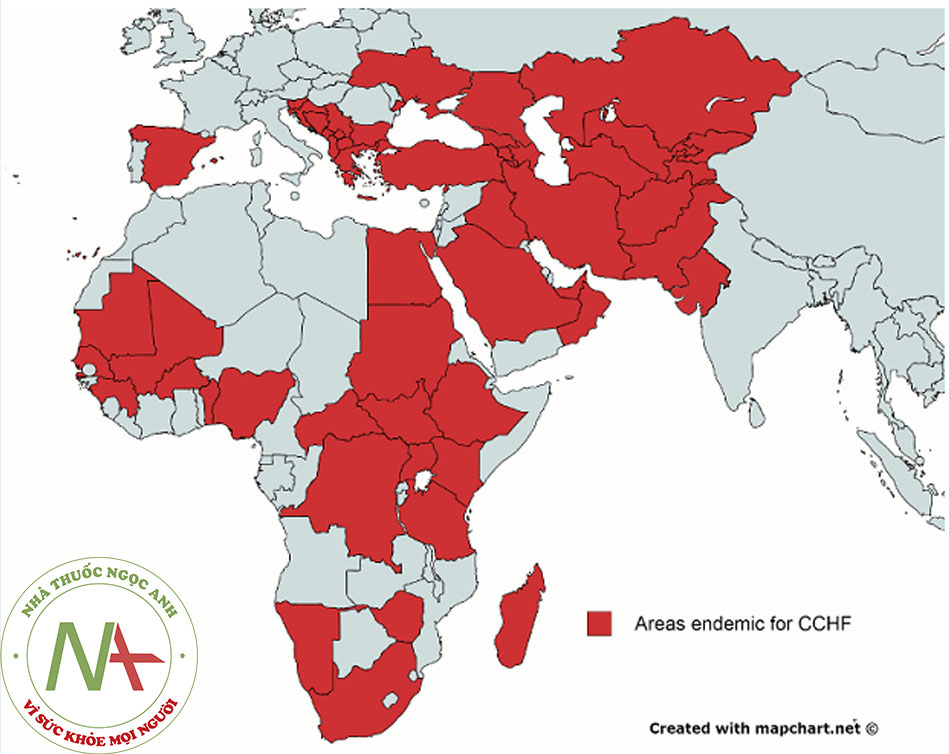
◊ Dịch bệnh bùng phát ở Châu Á, Châu Phi và Đông Nam châu Âu với đợt bùng phát ở Tây Ban Nha vào năm 2016.
◊ Nên sử dụng thiết bị bảo hộ cá nhân thích hợp và bệnh nhân phải được cách ly.
◊ Biểu hiện dưới dạng bệnh nặng, khởi phát đột ngột với các triệu chứng ban đầu giống cúm, mắt đỏ và chấm xuất huyết, sau đó là các dấu hiệu xuất huyết vào khoảng ngày thứ 4.
◊ Điều trị hỗ trợ là chăm sóc tiêu chuẩn, mặc dù một số bệnh nhân có thể hưởng lợi từ phương pháp điều trị bằng ribavirin
Thông tin cơ bản
Định nghĩa
Sốt xuất huyết Crimean-Congo (CCHF) là một tình trạng nhiễm vi-rút gây tử vong do vi-rút CCHF gây ra đã được báo cáo ở nhiều vùng của Châu Phi, Châu Á, Đông Âu và Trung Đông.[1] [2] Vi-rút này thuộc chi Nairovirus trong họ Bunyaviridae và gây ra bệnh nặng ở người, với tỷ lệ tử vong được báo cáo từ 3% đến 30%.[1] [3] Phạm vi địa lý của virút CCHF lớn nhất trong số các vi-rút truyền bệnh do ve có thể ảnh hưởng đến con người. Đây là loại arbovirus lan rộng nhất trong số các loại arbovirus quan trọng về mặt y tế, chỉ sau mỗi vi-rút dengue.[3] Con người bị nhiễm bệnh qua vết ve cắn, thông qua tiếp xúc với người bệnh ở giai đoạn nhiễm CCHF cấp tính hoặc từ gia súc nhiễm vi-rút huyết (thông qua tiếp xúc với máu hoặc mô).[1] [2] [3]
Dịch tễ học
‘Sốt xuất huyết Crimea’ đã được mô tả lần đầu tiên từ năm 1944 đến năm 1945 khi có khoảng 200 quân nhân Liên Xô bị nhiễm bệnh trong khi giúp nông dân ở Crimea trong Thế Chiến II.[2] [4] Vào đầu những năm 1950, các nhà khoa học ở Congo gọi là ‘sốt xuất huyết Congo’ và hơn một thập kỷ sau đó bệnh này đã được đặt tên là bệnh sốt xuất huyết CrimeaCongo (CCHF).[5]
Trong nửa sau thế kỷ 20, các đợt bùng phát CCHF xảy ra ở Châu Á, Châu Phi và Đông Nam Âu.[3] Kể từ năm 2000, các đợt bùng phát mới đã được ghi nhận ở Pakistan,[6] Iran,[7] Senegal,[8] Albania,[9] Kosovo,[10] Bulgaria,[11] Thổ Nhĩ Kỳ,[12] Hy Lạp,[13] Kenya,[14] Mauritania,[15] Kazakhstan,[16] Tajikistan,[17] Ấn Độ,[18] [19] và vào năm 2016 ở Tây Ban Nha.[20] [21]
Hầu hết các ca bệnh xảy ra ở người lớn tiếp xúc với ve trong quá trình làm việc (nông nghiệp và/hoặc chăn nuôi). Do đó, phân bố giới khác nhau giữa các quốc gia phụ thuộc vào sự tham gia của phụ nữ vào công việc nông nghiệp. Ví dụ: nông dân chiếm gần 90% số ca bệnh trong đợt bùng phát ở Thổ Nhĩ Kỳ kết thúc vào năm 2007,[22] [23] với tỉ lệ nam-nữ là 1:1.[22] Nhân viên y tế là nhóm bị ảnh hưởng nhiều thứ hai.[1]
Mặc dù bằng chứng về huyết thanh của vi-rút CCHF đã được báo cáo ở Ai Cập, Pháp, Hungary, Bồ Đào Nha và Benin nhưng chưa có ca bệnh nào ở người được ghi nhận ở các quốc gia này.[23]
Tỷ lệ mắc Sốt xuất huyết Crimean Congo khá tương đương với tỷ lệ phân bố trên toàn thế giới của loài bọ ve Hyalomma, với các phân tích hệ thống phát sinh loài cho thấy mối quan hệ giữa các chủng từ các đợt bùng phát xa.
Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC)
Bệnh căn học
Vi-rút CCHF là một vi-rút RNA mạch đơn của họ Bunyaviridae (chi Nairovirus), và có liên quan với vi-rút hanta và virút gây sốt Rift Valley. Vi-rút CCHF lan truyền trong chu kỳ ve-động vật có xương sống-ve gây bệnh động vật và có bằng chứng cho thấy vi-rút gây bệnh ở động vật. Con người bị nhiễm bệnh qua vết cắn của ve, do tiếp xúc với bệnh nhân bị CCHF trong giai đoạn cấp tính hoặc do tiếp xúc với máu hoặc các mô từ vật nuôi bị nhiễm vi rút huyết.[3] [24]
Ở những vùng lưu hành dịch, khảo sát kháng thể ở gia súc đã xác nhận tỷ lệ hiện mắc cao ở gia súc và cừu. Những loài động vật hoang dã nhỏ hơn như nhím Âu và thỏ rừng, đóng vai trò là vật chủ cho các giai đoạn chưa trưởng thành của vật chủ trung gian ve, thường biểu hiện nhiễm vi-rút CCHF nhiều hơn.[2] Chim có thể đóng vai trò trong việc vận chuyển ve nhiễm vi-rút CCHF giữa các quốc gia [25] Sự xâm nhập của bọ ve Hyalomma vào Anh Quốc đã được đánh giá sau vụ dịch bùng phát tại Tây Ban Nha năm 2016.[26]
Sự lây truyền từ người sang người xảy ra khi tiếp xúc với chất dịch cơ thể từ những bệnh nhân bị nhiễm bệnh. Nhân viên y tế và những người tiếp xúc trong gia đình có nguy cơ nhiễm bệnh nếu họ tiếp xúc với chất dịch cơ thể của bệnh nhân nhiễm bệnh mà không có dụng cụ bảo vệ thích hợp
Nhiều chủng vi-rút CCHF đã được báo cáo.[27] [28] Tất cả các chủng, trừ một chủng là AP92, gây ra bệnh có triệu chứng.

Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC)
Sinh lý bệnh học
Thời gian ủ bệnh của vi-rút CCHF kéo dài từ 1 đến 9 ngày, tuy nhiên ở Thổ Nhĩ Kỳ thời gian ủ bệnh được báo cáo là 30 ngày.[29] Sau khi nhiễm truyền, vi-rút CCHF ban đầu nhân lên trong các mô tại chỗ, bao gồm các tế bào hình tua, trước khi di chuyển đến các hạch bạch huyết khu vực và lan tràn nhờ bạch cầu đơn nhân đến các mô và cơ quan bao gồm gan, lách và hạch bạch huyết. Sự di chuyển của các đại thực bào mô dẫn đến nhiễm trùng thứ phát ở các tế bào nhu mô tiếp nhận. Tế bào lympho vẫn không bị nhiễm vi rút, nhưng trong suốt quá trình nhiễm bệnh, có thể bị phá hủy số lượng lớn qua quá trình tế bào chết theo chương trình giống như xảy ra với các dạng khác của sốc nhiễm khuẩn.[30] [31]
Vi mạch không bền vững và suy giảm khả năng cầm máu là dấu hiệu nhiễm vi-rút CCHF. Suy giảm khả năng cầm máu có thể là kết quả của rối loạn chức năng tiểu cầu, tế bào nội mô và/hoặc yếu tố đông máu. Giảm các yếu tố đông máu có thể do rối loạn chức năng gan và/hoặc rối loạn đông máu nội mạch rải rác, thường ghi nhận thấy ở trường hợp nhiễm virút CCHF. Ngoài ra, thể tạng xuất huyết có thể xảy ra qua tổn thương trực tiếp của tế bào nội mô và tiểu cầu, và/hoặc gián tiếp qua quá trình miễn dịch và viêm.[32] [33] [34] Những thay đổi này dường như do sự giải phóng các chất trung gian tiền viêm như chemokine và cytokine khỏi đại thực bào và bạch cầu đơn nhân nhiễm vi-rút.[35] [36] Tổn thương mô có thể là kết quả của hoại tử trực tiếp ở tế bào nhiễm bệnh hoặc gián tiếp thông qua quá trình tế bào chết theo chương trình của các tế bào miễn dịch. Các tế bào gan đặc biệt bị ảnh hưởng khi nhiễm vi-rút CCHF.[30] [37]
Tải lượng vi-rút CCHF đã được chứng minh nhất quán là có tương quan với đầu ra của bệnh nhân. Tải lượng vi-rút >10^8 bản sao/mL đã được chứng minh có liên quan chặt chẽ với bệnh nặng và tử vong.[38] [39] [40]
Phòng ngừa
Ngăn ngừa sơ cấp
Hiện tại không có loại vắc-xin nào được cấp phép sử dụng trên người.
Khuyến cáo sử dụng các biện pháp phòng ngừa sau đây cho người trong vùng lưu hành dịch CCHF:
• Trung tâm Kiểm soát và Phòng chống Dịch bệnh (CDC) và Tổ chức Y tế Thế giới (WHO) khuyến cáo các biện pháp phòng ngừa ve cắn sau đây:[41] [46]
- Mặc quần áo che được càng nhiều cơ thể càng tốt (ví dụ: áo dài tay và quần dài); có thể xử lý quần áo bằng permethrin hoặc thuốc diệt ve đã được phê duyệt khác (hóa chất dùng để diệt ve)
- Kiểm tra toàn bộ cơ thể hàng ngày và loại bỏ ve ngay khi dính vào; quần áo màu sáng cho phép dễ dàng phát hiện ve
- Sử dụng thuốc trừ sâu bọ được phê duyệt lên da (nếu >2 tháng tuổi); có thể sử dụng DEET (N,N-diethyl-3methylbenzamide), picaridin và IR3535 cho phụ nữ mang thai và cho con bú khi có chỉ dẫn
- Kiểm soát tình trạng nhiễm ve bất kỳ khi nào có thể; tránh những khu vực có nhiều ve và mùa chúng hoạt động nhiều nhất.
• Quy trình chăn nuôi và hoạt động giết mổ động vật được xem là có nguy cơ cao và có thể làm tăng khả năng phơi nhiễm vi-rút CCHF. Khi làm việc với động vật, đặc biệt ở các vùng đã từng xảy ra bùng phát vi-rút CCHF, khuyến cáo nên:[41] [43] [47]
- Cá nhân mặc thiết bị bảo hộ (bao gồm găng tay và mặt nạ có bảo vệ mắt) để tránh bị phơi nhiễm với máu hoặc mô có khả năng bị nhiễm bệnh
- Thuốc diệt ve được sử dụng trong các cơ sở sản xuất gia súc để giảm nguy cơ lây truyền sang người lao động
- Tránh giết mổ động vật bị bệnh để tiêu thụ, đặc biệt là trong đợt bùng phát dịch bệnh
Nhân viên y tế có thể phải tiếp xúc với bệnh nhân bị nhiễm bệnh nên:
- Mặc quần áo bảo hộ
- Thực hiện các biện pháp kiểm soát nhiễm khuẩn và khử trùng thích hợp
- Cách ly các bệnh nhân bị nghi ngờ với những người khác nếu có thể, và cách ly bệnh nhân chắc chắn mắc bệnh với các bệnh nhân bị nghi ngờ mắc bệnh
- Thông báo cho cán bộ y tế nếu bạn đã tiếp xúc trực tiếp với dịch cơ thể của bệnh nhân nhiễm bệnh.
Hầu hết con đường lây truyền vi-rút CCHF từ người sang người đều thông qua tiếp xúc trực tiếp với máu và dịch cơ thể nhiễm bệnh. Do đó, khuyến cáo rằng trong khi chăm sóc bất kỳ bệnh nhân nào nghi ngờ hoặc được ghi nhận nhiễm vi-rút CCHF, nên thực hiện ngay các phòng ngừa vật lý cụ thể (bao gồm sử dụng găng tay, áo choàng, tấm che mặt và mặt nạ). Đối với các thủ thuật có thể tạo khí dung, nhân viên y tế nên cân nhắc dùng khẩu trang N95 hoặc FFP2 (Tiêu chuẩn châu Âu [EN] 61010-1).[30] [48]Để giảm thiểu nguy cơ xảy ra vết thương do kim châm, cần luôn sẵn có các thùng đựng đồ sắc nhọn và cũng nên cân nhắc sử dụng thiết bị được thiết kế an toàn.[30] [48]
WHO có hướng dẫn chi tiết về PPE (trang bị bảo hộ cá nhân):
[WHO: steps to put on personal protective equipment] [WHO: steps to remove personal protective equipment]Phòng ngừa
Ngăn ngừa thứ cấp
CCHF là bệnh cần khai báo. Cần cách ly bệnh nhân bị nghi ngờ nhiễm bệnh và tất cả các nhân viên y tế tiếp xúc với bệnh nhân phải mang thiết bị bảo hộ cá nhân (PPE).
Ribavirin đường uống đã được sử dụng để dự phòng sau phơi nhiễm CCHF.[75] [81] Nhìn chung, thuốc này dung nạp tốt và nên cân nhắc dùng cho các nhân viên y tế có nguy cơ phơi nhiễm cao như vết thương do kim đâm.[48] [82] [83]WHO ủng hộ khuyến cáo này.[80]
Chẩn đoán
Tiền sử ca bệnh
Tiền sử ca bệnh #1
Một người phụ nữ 17 tuổi đến bệnh viện Thổ Nhĩ Kỳ với bệnh sử sốt, khó chịu, đau đầu, đau cơ, buồn nôn, nôn mửa và chảy máu cam trong 5 ngày. Cô đến từ một ngôi làng nông thôn ở đông bắc Anatolia và làm việc với gia súc. Cô không tiếp xúc với bệnh, không đi du lịch gần đây và không có bệnh lý nền. Khi nhập viện, nhiệt độ của cô là 38,3ºC, có triệu chứng chảy máu cam, sung huyết kết mạc và ấn đau khi khám bụng Số lượng bạch cầu (WBC) là 1,1 x 10^9/ L, haemoglobin là 93 g/L (9,3 g/dL), số lượng tiểu cầu là 106 x 10^9/L. Vào ngày nằm viện thứ 2, WBC của cô giảm xuống 0,5 x 10^9/L , nồng độ hemoglobin giảm xuống 53 g/L (5,3 g/dL) và số lượng tiểu cầu giảm xuống 89 x 10^9/ L. Các vết thâm tím và tụ máu lớn ở nếp gấp khuỷu xuất hiện tại các vị trí lấy máu trước đó. Men gan có biểu hiện tăng AST (3195 IU/L), ALT (1443 IU/L), lactate dehydrogenase (8190 IU/L) và creatinine phosphokinase (1427 IU/ L). Thời gian prothrombin cũng tăng ở mức 22,9 giây, thời gian prothrombin từng phần hoạt hóa (aPTT) 65 giây và chỉ số bình thường hóa quốc tế (INR) là 1,23. Bệnh nhân được truyền một đơn vị khối hồng cầu và có chút cải thiện chủ quan. Vào ngày nằm viện thứ 3, bệnh nhân được ghi nhận có nổi hạch nách hai bên và gan to nhẹ, sờ mềm CCHF được coi là chẩn đoán có thể có và bệnh nhân được cho uống ribavirin. Vào ngày thứ tư dùng ribavirin, bệnh nhân có cải thiện lâm sàng, WBC ở mức 4,5 x 10^9/L và số lượng tiểu cầu là 100 x 10^9/L. Cô tiếp tục cải thiện chậm, mặc dù mệt mỏi và khó chịu kéo dài. Triệu chứng sốt thuyên giảm vào ngày nằm viện thứ 6 và bệnh nhân được cho ra viện vào ngày thứ 8 khi các thông số huyết học cải thiện và cải thiện lâm sàng. Bệnh nhân hoàn tất 10 ngày điều trị bằng ribavirin. Ba tuần sau khi nhập viện, một mẫu máu được gửi đi tiến hành xét nghiệm phản ứng chuỗi sao chép ngược (RT-PCR) của vi-rút CCHF trả về kết quả dương tính.
Tiền sử ca bệnh #2
Một y tá 27 tuổi có vết thương do kim đâm trong khi lấy máu cho một bệnh nhân nhiễm CCHF nặng. Cô ấy không được cho dùng ribavirin để dự phòng sau phơi nhiễm. Ba ngày sau khi xảy ra sự cố, cô ấy bị sốt và ngày hôm sau đến phòng cấp cứu với tình trạng đau đầu dữ dội và đau cơ. Cô ấy có số lượng tiểu cầu là 80 x 10^9/L, WBC là 2,5 x 10^9/L, PT 13 giây, aPTT 35 giây, creatine kinase 123 IU/L, ALT là 67 IU/L và AST là 129 IU/L. Chức năng thận và các dấu hiệu sinh tồn khác quan sát được đều bình thường, ngoại trừ cơn sốt (38.2 độ C) Cô ấy được nhập viện và cách ly với chẩn đoán nghi ngờ nhiễm CCHF và bắt đầu điều trị bằng ribavirin. Ngày hôm sau cô bị tiêu chảy và nôn mửa, bắt đầu truyền dịch qua đường tĩnh mạch và số lượng tiểu cầu của cô giảm xuống 40 x 10^9/L. Ngày hôm sau, cô than phiền về tình trạng chảy máu ở nướu (chân răng) và được ghi nhận là có vết bầm máu ở mạn sườn và tại chỗ tiêm. Xét nghiệm RT-PCR vi-rút CCHF của cô ấy được phòng thí nghiệm tham khảo báo cáo dương tính. ALT và AST của cô đã tăng lên tương ứng là 489 IU/L và 790 IU/L, tiểu cầu giảm xuống còn 13 x 10^9/L, PT tăng (22 giây) và aPTT tăng (46 giây). Cô được truyền 2 đơn vị tiểu cầu và 1 đơn vị huyết tương tươi đông lạnh Tình trạng của cô ấy xấu đi trong 24 giờ tiếp theo với tình trạng lú lẫn ngày càng tăng và bằng chứng về xuất huyết tiêu hóa thấp và vết bầm máu ngày càng gia tăng. Số lượng tiểu cầu duy trì ở khoảng 10- 20 x 10^9/L khi tiếp tục truyền tiểu cầu (2 đơn vị), PT và aPTT tiếp tục tăng (26 giây, 100 giây) mặc dù đã truyền 3 đơn vị huyết tương tươi đông lạnh. ALT đã tăng lên 1809 IU/L và AST >2000 IU/L. Creatinin tăng lên 214.8 micromol/L (2.43 mg/dL) và cô ấy được chuyển sang chăm sóc tích cực với mức độ chăm sóc cao hơn và lọc máu ở ngày thứ 5. Chức năng hô hấp suy giảm với bằng chứng của ARDS và chảy máu phổi xảy ra ở ngày thứ 6, cần phải thông khí nhân tạo, sau đó xuất hiện sốc nhiễm khuẩn cần dùng thuốc vận mạch. Cô ấy bị suy đa phủ tạng tiến triển và tử vong vào ngày thứ 7 của bệnh.
Cách tiếp cận chẩn đoán từng bước
CCHF là bệnh cần khai báo. Phải báo cáo ngay mọi ca bệnh nghi ngờ cho sở y tế địa phương hoặc tiểu bang. Bất kỳ phòng thí nghiệm lâm sàng nào xử lý mẫu cũng cần được thông báo. Định nghĩa ca bệnh nhiễm CCHF có thể khác nhau tùy theo từng quốc gia tùy thuộc vào trang thiết bị chẩn đoán sẵn có và danh sách dài các chẩn đoán phân biệt.
Cách ly và sử dụng thiết bị bảo hộ cá nhân (PPE)
Bunyavirus có tính lây nhiễm cao và được truyền từ người sang người sau khi tiếp xúc trực tiếp với máu và dịch cơ thể nhiễm bệnh. Do đó, khuyến cáo rằng khi chăm sóc bất kỳ bệnh nhân nào nghi ngờ hoặc được ghi nhận nhiễm virút CCHF, nên thực hiện ngay các dự phòng vật lý cụ thể. Một nghiên cứu sau đợt bùng phát dịch CCHF ở Thổ Nhĩ Kỳ báo cáo không có tình trạng lây truyền CCHF qua không khí sang nhân viên y tế.[49] Các biện pháp phòng ngừa tiêu chuẩn bao gồm vệ sinh bàn tay và sử dụng găng tay, áo choàng, tấm che mặt và mặt nạ. Mặc dù những biện pháp này thường đủ để bảo vệ, nhưng nếu thủ thuật có thể tạo khí dung, nhân viên y tế nên cân nhắc đeo khẩu trang N95 hoặc FFP2 (Tiêu chuẩn châu Âu [EN] 61010-1).[30] [48]
Để giảm thiểu nguy cơ xảy ra vết thương do kim châm, cần luôn sẵn có các thùng đựng đồ sắc nhọn và cũng nên cân nhắc sử dụng thiết bị được thiết kế an toàn.[30] [48]
Tổ chức Y tế Thế giới (WHO) có hướng dẫn chi tiết về PPE:
[WHO: steps to put on personal protective equipment] [WHO: steps to remove personal protective equipment]Tiền sử
Tiền sử chi tiết giúp làm rõ mức độ nguy cơ đối với CCHF, cũng như đánh giá khả năng của các nguyên nhân khác gây ra hội chứng sốt cấp tính.
Những người sống hoặc làm việc ở các vùng lưu hành dịch có nguy cơ cao bị nhiễm bệnh. Tuy nhiên, gần đây đi du lịch đến các vùng lưu hành dịch cũng là một yếu tố nguy cơ quan trọng. Tiền sử phơi nhiễm với ve, và việc có sử dụng các phương pháp phòng ngừa ve cắn hay không, cũng có thể giúp đánh giá nguy cơ. Những người tiếp xúc với bệnh nhân nhiễm bệnh (bao gồm cả nhân viên y tế và thành viên trong gia đình) có nguy cơ bị nhiễm bệnh, đặc biệt nếu họ không sử trang bị bảo hộ thích hợp.
Thời gian ủ bệnh của vi-rút CCHF kéo dài từ 1 đến 9 ngày, tuy nhiên ở Thổ Nhĩ Kỳ thời gian ủ bệnh được báo cáo là 30 ngày.[29] Bệnh nhân ban đầu có biểu hiện tiền triệu không đặc hiệu, thường kéo dài dưới 1 tuần. Các triệu chứng thường bao gồm sốt cao, đau đầu, tình trạng khó chịu, đau khớp, đau cơ, buồn nôn, đau bụng, và tiêu chảy hiếm gặp.[36] Trước khi tử vong thường xuất hiện thể tạng xuất huyết, sốc và suy đa phủ tạng toàn thân từ 1 đến 2 tuần sau khi khởi phát các triệu chứng. Bệnh này đã được báo cáo diễn ra nhẹ hơn ở trẻ em.[30] [50]
Khám lâm sàng
Các dấu hiệu ban đầu thường bao gồm sốt, hạ huyết áp, viêm kết mạc và phát ban trên da (nổi ban hoặc đốm xuất huyết). Sau đó, bệnh nhân có thể xuất hiện các dấu hiệu xuất huyết tiến triển bao gồm xuất huyết kết mạc, đái máu, nôn ra máu và đi ngoài phân đen. Những bệnh nhân này có thể tiến triển thành đông máu nội mạch rải rác (DIC) và sốc tuần hoàn.[30] [50]
Xác định ca bệnh
Mặc dù cách xác định ca bệnh nhiễm CCHF có thể khác nhau giữa các nơi, nhưng có thể sử dụng hướng dẫn sau đây làm hướng dẫn chung.[51]
• Ca bệnh nghi ngờ:
- Tiền sử:
• Sốt, đau cơ, tình trạng khó chịu, tiêu chảy
• Tiền sử phơi nhiễm với ve hoặc tiếp xúc với người hoặc động vật nhiễm CCHF
• Cư trú hoặc đi lại đến vùng lưu hành dịch CCHF - Khám lâm sàng: • Ban chấm hoặc nốt xuất huyết hoặc xuất huyết.
• Ca bệnh có thể:
- Phát hiện ca bệnh nghi ngờ, cùng với
- Giảm tiểu cầu, giảm bạch cầu, tăng men gan và nồng độ lactate dehydrogenase.
• Ca bệnh được khẳng định:
- Tăng nồng độ kháng thể IgM CCHF hoặc PCR dương tính trong máu hoặc dịch cơ thể của bệnh nhân.
Trung tâm Kiểm soát và Phòng chống Dịch bệnh cũng đưa ra định nghĩa ca bệnh chung dành cho bệnh sốt xuất huyết do vi-rút.[52]
Các xét nghiệm ban đầu
Xét nghiệm phân tử:
- Nên được chỉ định ở tất cả các bệnh nhân nghi ngờ nhiễm CCHF trong khi bệnh nhân được cách ly. Phản ứng khuếch đại gen chuỗi sao chép ngược (RT-PCR) là một xét nghiệm nhanh rất nhạy, mặc dù phải chú ý cẩn thận đến khả năng cho ra kết quả dương tính giả. Việc phát triển các xét nghiệm RT-PCR một bước trong thời gian thực gặp khó khăn do sự đa dạng cao của trình tự bộ gen vi – rút.[30] [53] [54] [55
Xét nghiệm bệnh sốt rét:
- Được chỉ định trong các vùng lưu hành dịch sốt rét hoặc khi có tiền sử du lịch tới vùng lưu hành dịch Tiêu bản máu đặc và máu đàn nhuộm Giemsa và các xét nghiệm chẩn đoán nhanh là các xét nghiệm được lựa chọn để sàng lọc bệnh sốt rét.
Các xét nghiệm khác
Xét nghiệm huyết thanh:
- Chuyển đảo huyết thanh với phát hiện kháng thể IgM của vi-rút CCHF hoặc tăng chuẩn độ kháng thể ≥4 lần giữa hai mẫu máu liên tiếp là bằng chứng cho tình trạng nhiễm gần đây.[15] [16] Chẩn đoán huyết thanh có hiệu lực vài ngày sau khi khởi phát bệnh; tuy nhiên, đáp ứng kháng thể hiếm khi quan sát thấy ở các ca tử vong.[56]
- ELISA thường được sử dụng và có độ nhạy cao hơn 90%. Phương pháp này đã được báo cáo nhạy hơn so với xét nghiệm miễn dịch huỳnh quang (IFA).[57] Tất cả các kháng nguyên tự nhiên phải được xử lý ở phòng xét nghiệm an toàn sinh học cấp (BSL)-4 và chiếu xạ trước khi sử dụng.
- Kháng thể IgM và IgG thường được phát hiện ở ngày thứ 4 đến ngày thứ 5 sau khi khởi phát các triệu chứng. Chuẩn độ IgM đạt tối đa ở tuần thứ 2 đến tuần thứ 3 sau khi khởi phát bệnh và thường trở về bình thường trong 4 tháng. Vẫn có thể phát hiện kháng thể IgG trong nhiều năm.[58]
Công thức máu:
- Bệnh nhân có thể giảm số lượng tiểu cầu và giảm lympo bào rõ rệt ở giai đoạn đầu nhiễm bệnh; tuy nhiên, đây không phải là biểu hiện mang tính chẩn đoán. Sau đó thường là tăng bạch cầu đa nhân trung tính, cùng với số lượng tiểu cầu trở về bình thường. Thiếu máu không thường thấy ở giai đoạn sớm của bệnh nhưng có thể xuất hiện ở giai đoạn muộn của bệnh. Tăng bạch cầu có thể kéo dài và xuất hiện các hình thái chưa trưởng thành.
Bệnh nhân bị bệnh nặng có thể biểu hiện giảm tiểu cầu tiến triển, một biểu hiện của DIC.
Các xét nghiệm đông máu:
• Những biểu hiện bất thường có thể bao gồm thời gian máu chảy kéo dài, thời gian prothrombin kéo dài và thời gian thromboplastin từng phần hoạt hóa kéo dài; tăng sản phẩm thoái hóa fibrin; và giảm fibrinogen.
Xét nghiệm chức năng gan:
- Cả ALT và AST thường tăng lên; tuy nhiên, hầu hết các nghiên cứu cho thấy rằng AST tăng không tương xứng với ALT và điều này gợi ý đến tổn thương mô toàn thân hơn là tổn thương tế bào gan.
Chức năng thận:
- Có thể tăng và có thể cho thấy tổn thương thận cấp. Đặc biệt hữu ích ở những bệnh nhân bị tiêu chảy và nôn mửa. Phân tích nước tiểu có thể thấy hồng cầu niệu hoặc protein niệu.
Điện giải đồ máu:
- Có thể bất thường và có thể chỉ ra tổn thương thận cấp. Đặc biệt hữu ích ở những bệnh nhân bị tiêu chảy và nôn mửa. Có ích trong việc hướng dẫn điều chỉnh điện giải và truyền dịch thay thế.
Lactate dehydrogenase:
- Nồng độ cao hơn 4 mmol/L (36 mg/dL) có thể là chỉ điểm cho tình trạng giảm tưới máu dai dẳng và nhiễm khuẩn huyết.[30]
Creatinine phosphokinase:
- Nồng độ cao hơn hai lần so với giới hạn trên của khoảng bình thường có thể cho thấy tình trạng căng cơ toàn thân.
Phân lập vi-rút:
- Nuôi cấy vi-rút là xét nghiệm xác định; tuy nhiên, vi-rút cần từ 2 đến 10 ngày để phát triển có nghĩa là xét nghiệm mất quá nhiều thời gian để áp dụng được trên lâm sàng.[58]
Các yếu tố nguy cơ
Mạnh
Sinh sống hoặc gần đây du lịch đến vùng lưu hành dịch CCHF
• Trong trường hợp bệnh nhân có biểu hiện sốt cao và có các triệu chứng giống cúm, đặc biệt nếu có bất kỳ yếu tố nguy cơ nào khác, cần nhanh chóng cân nhắc đến tình trạng nhiễm vi-rút CCHF nếu gần đây di du lịch đến một quốc gia bị ảnh hưởng bởi vi-rút CCHF.
• Kiến thức cập nhật về các vùng địa lý hiện đang lưu hành dịch giúp làm rõ nguy cơ dịch tễ học của bệnh nhân.
Tiền sử phơi nhiễm với ve
• Việc lây truyền sang người chủ yếu là do vết cắn của ve bị nhiễm bệnh. Tỷ lệ nhiễm CCHF khá tương đương với tỷ lệ phân bố trên toàn thế giới của loài ve Hyalomma.
Tiếp xúc với dịch cơ thể nhiễm bệnh
• Những người tiếp xúc với bệnh nhân nhiễm bệnh (bao gồm cả nhân viên y tế và thành viên trong gia đình) có nguy cơ bị nhiễm bệnh nếu người đó tiếp xúc với chất dịch cơ thể của bệnh nhân bị bệnh mà không có thiết bị bảo vệ thích hợp. Tiếp xúc với các thành viên của gia đình bệnh nhân có nguy cơ lây nhiễm cao hơn nếu đang bị bệnh tiêu chảy, nôn, hoặc xuất huyết.
Phơi nhiễm nghề nghiệp
• Nhân viên y tế tiếp xúc với các bệnh nhân bị nhiễm bệnh có nguy cơ cao.
• Nhân viên y tế trong và ngay bên ngoài khu vực bùng phát dịch bệnh nên thực hiện biện pháp phòng ngừa kiểm soát nhiễm khuẩn tiêu chuẩn.[41]
Tiếp xúc với động vật nhiễm bệnh
• Đường lây truyền này có thể là nguyên nhân lây truyền từ động vật sang người trong các đợt dịch bệnh lẻ tẻ.
• Lây truyền có thể xảy ra do tiếp xúc với máu của động vật hoặc trong khi lột da động vật; do đó, người chăn nuôi động vật ở các vùng lưu hành dịch cần thực hiện theo các biện pháp phòng ngừa. Động vật có nguy cơ cao bao gồm: thỏ rừng, gia súc, cừu, dê, các loài động vật nhai lại hoang dã và nuôi khác, và đà điểu. Các loài chim khác được coi là có nguy cơ thấp.[41] [42]
• Một báo cáo đồng thuận về các biện pháp phòng ngừa đã được công bố để phòng ngừa lây truyền liên quan đến hiến tế động vật trong lễ tế sinh Eid al-Adha.[43]
Yếu
Quan hệ tình dục không an toàn với người bị nhiễm bệnh
• Vi-rút CCHF đã được báo cáo lây truyền qua đường tình dục trong thời kì lui bệnh.[44] [45] Vi-rút có thể hiện diện trong máu hoặc dịch cơ thể lên đến 90 ngày. Tuy nhiên, điều này chỉ dựa trên bằng chứng nghiên cứu ca bệnh.
Các yếu tố về tiền sử và thăm khám
Các yếu tố chẩn đoán chủ yếu
Có các yếu tố nguy cơ (thường gặp)
• Các yếu tố nguy cơ chính bao gồm tiền sử phơi nhiễm với ve; tiếp xúc với người hoặc động vật nhiễm CCHF; và cư trú tại hoặc đi lại đến một vùng lưu hành dịch CCHF.
Sốt (thường gặp)
• Đa số bệnh nhân được ghi nhận có biểu hiện sốt hoặc có tiền sử sốt khi đến khám, nhưng cũng không loại trừ nhiễm CCHF giai đoạn sớm hoặc nhiễm thể nhẹ khi không có sốt. Sốt không theo một quy luật thời gian đều đặn như sốt rét.
Đau cơ (thường gặp)
• Có thể có cường độ lớn, tương tự như cúm nặng.
Khó chịu (thường gặp)
• Nặng hơn các bệnh thường gặp như cúm.
Chảy máu (thường gặp)
• Thường gặp nhất là triệu chứng chảy máu mũi hoặc chảy máu chân răng, mặc dù có thể chảy máu từ bất cứ đâu. Kinh nguyệt kéo dài có thể là triệu chứng duy nhất.
Ban dát hoặc ban xuất huyết (thường gặp)
• Ban đầu là một ban dát, sau đó tiến triển thành phát ban dạng đốm.
Các yếu tố chẩn đoán khác
Đau đầu (thường gặp)
• Dấu hiệu không đặc hiệu của giai đoạn đầu giống cúm.
Buồn nôn (thường gặp)
• Có thể gặp cùng với các triệu chứng giống cúm khác.
Đau bụng (thường gặp)
• Có thể xảy ra sớm và sau đó khu trú ở góc phần tư trên bên phải (liên quan đến gan to).[41] Có thể thường gặp hơn ở trẻ em.
Gan to (thường gặp)
• Có thể phát hiện ở những bệnh nhân mắc bệnh vừa đến nặng.
Lách to (thường gặp)
• Có thể phát hiện ở những bệnh nhân nặng.
Ngủ gà (thường gặp)
• Xảy ra sau 2 đến 4 ngày; có thể là dấu hiệu của bệnh nặng.[41]
Tiêu chảy (không thường gặp)
• Không thường xảy ra ở người lớn, nhưng có thể là triệu chứng phổ biến hơn ở trẻ em.
Hạ huyết áp (không thường gặp)
• Có thể gặp khi bệnh tiến triển.
Viêm kết mạc (không thường gặp)
• Viêm kết mạc xuất huyết cấp tính. Cũng cần tìm các dấu hiệu xuất huyết khác.
Đau khớp (không thường gặp)
• Không có đặc điểm đau khớp đặc trưng
Xét nghiệm chẩn đoán
Xét nghiệm thứ nhất cần yêu cầu
| Xét nghiệm | Kết quả |
| Phản ứng khuếch đại chuỗi gen sao chép ngược (RT-PCR)
• Nên được chỉ định ở tất cả các bệnh nhân nghi ngờ nhiễm CCHF trong khi bệnh nhân đang được cách ly • Trả kết quả 24 đến 48 giờ trước khi có kết quả xét nghiệm huyết thanh • Ở các nước phát triển, xét nghiệm chỉ có thể thực hiện ở các phòng thí nghiệm khu vực hoặc quốc gia có các trang thiết bị loại 4 • Nếu kết quả âm tính, cần phải làm lại xét nghiệm trong vòng 48 giờ do tải lượng vi-rút thấp và có thể không phát hiện được ở giai đoạn sớm của bệnh. Các xét nghiệm có kết quả âm tính nên được làm lại để loại trừ chẩn đoán nếu mức độ nghi ngờ cao (hoặc để khẳng định khỏi bệnh). |
Dương tính với RNA vi-rútCCHF |
| Xét nghiệm sốt rét
• Được chỉ định trong các vùng lưu hành sốt rét hoặc khi có tiền sử du lịch tới vùng lưu hành sốt rét • Tiêu bản máu đặc và máu đàn nhuộm Giemsa và các xét nghiệm chẩn đoán nhanh là các xét nghiệm được lựa chọn để sàng lọc bệnh sốt rét • Có thể dương tính nếu đồng nhiễm. |
Âm tính |
Các xét nghiệm khác cần cân nhắc
| Xét nghiệm | Kết quả |
| Huyết thanh học
• Chuyển đảo huyết thanh với phát hiện kháng thể IgM của vi-rút CCHF hoặc tăng chuẩn độ kháng thể ≥4 lần giữa hai mẫu máu liên tiếp là bằng chứng cho tình trạng nhiễm gần đây.[15] [16 • ELISA thường được sử dụng và có độ nhạy cao hơn 90%. Phương pháp này đã được báo cáo nhạy hơn so với xét nghiệm miễn dịch huỳnh quang (IFA).[57] Tất cả các kháng nguyên tự nhiên phải được xử lý ở phòng xét nghiệm an toàn sinh học cấp (BSL)-4 và chiếu xạ trước khi sử dụng • Kháng thể IgM và IgG thường được phát hiện ở ngày thứ 4 đến ngày thứ 5 sau khi khởi phát các triệu chứng. Chuẩn độ IgM đạt tối đa ở tuần thứ 2 đến tuần thứ 3 sau khi khởi phát bệnh và thường trở về bình thường trong 4 tháng. Vẫn có thể phát hiện kháng thể IgG trong nhiều năm.[58] |
Dương tính với vi-rút CCHF |
| Công thức máu
• Bệnh nhân có thể giảm số lượng tiểu cầu và giảm lympo bào rõ rệt ở giai đoạn đầu khi nhiễm bệnh; tuy nhiên, đây không phải là biểu hiện mang tính chẩn đoán. Thông thường sau đó là tăng bạch cầu trung tính, cùng với tăng số lượng tiểu cầu trở lại. Tăng bạch cầu có thể kéo dài và biểu hiện các hình thái chưa trưởng thành • Bệnh nhân bị bệnh nặng có thể có giảm số lượng tiểu cầu tiến triển, như là một biểu hiện của đông máu nội mạch lan tỏa (DIC). |
Giảm tiểu cầu; giảm lympo bào rõ rệt; tăng bạch cầu; giảm haemoglobin (nếu có biểu hiện xuất huyết ở giai đoạn sau của bệnh) |
| Các xét nghiệm đông máu
• Thời gian prothrombin kéo dài (PT) hoặc thời gian thromboplastin từng phần hoạt hóa (aPTT) kéo dài có liên quan đến tình trạng bệnh nặng hơn và các biểu hiện chảy máu chẳng hạn như DIC. |
Thời gian máu chảy kéo dài; tăng sản phẩm thoái hóa fibrin; giảm fibrinogen |
| Xét nghiệm chức năng gan
• Cả ALT và AST thường tăng lên; tuy nhiên, hầu hết các nghiên cứu cho thấy rằng AST tăng không tương xứng với ALT, và điều này gợi ý tới tổn thương mô toàn thân hơn là tổn thương tế bào gan. |
Tăng |
| Creatinine và urê huyết thanh
• Có thể chỉ điểm cho tổn thương thận cấp • Đặc biệt hữu ích ở những bệnh nhân bị tiêu chảy và nôn mửa. |
Có thể tăng |
| Tổng phân tích nước tiểu
• Hồng cầu niệu hoặc protein niệu có thể gặp ở trường hợp nặng • Thiểu niệu không đáp ứng với bù dịch là dấu hiệu tiên lượng xấu. |
Có thể quan sát thấy hồng cầu niệu hoặc protein niệu |
| Điện giải đồ
• Có thể bất thường và có thể chỉ điểm cho tổn thương thận cấp.• Đặc biệt hữu ích ở những bệnh nhân bị tiêu chảy và nôn mửa. • Có ích trong hướng dẫn điều chỉnh điện giải và bù dịch. |
Có thể bị biến loạn |
| Lactate dehydrogenas
• Nồng độ cao hơn 4 mmol/L (36 mg/dL) có thể là chỉ điểm cho tình trạng giảm tưới máu dai dẳng và nhiễm khuẩn huyết.[30] |
Có thể tăng |
| Creatinine phosphokinas
• Nồng độ cao hơn hai lần so với giới hạn trên của khoảng bình thường có thể cho thấy tình trạng căng cơ toàn thân. |
Có thể tăng |
Chẩn đoán khác biệt
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| Sốt rét | • Cư trú/hoặc du lịch từ vùng lưu hành sốt rét
• Điều trị dự phòng không đầy đủ hoặc không điều trị dự phòng sốt rét • Khó phân biệt được với nhiễm CCHF khi không tiến hành xét nghiệm chẩn đoán. |
• Phiến máu nhuộm Giemsa:dương tính với các chủng Plasmodium.
• Test chẩn đoán nhanh: dương tính đối với các chủng Plasmodium. |
| Nhiễm vi-rút Ebola | • Không phân biệt triệu chứng thực thể hoặc cơ năng
• Các đặc điểm dịch tễ học có thể giúp phân biệt giữa các bệnh sốt xuất huyết do vi rút. |
• Phản ứng khuếch đại chuỗi gen phiên mã ngược (RT-PCR):dương tính đối với virút Ebola
• Khuyến cáo nên thực hiện xét nghiệm khẳng định phù hợp đối với nhiễm virút Ebola trước hoặc đồng thời với các xét nghiệm phân biệt nếu nghi ngờ bị nhiễm virút Ebola. |
| Sốt Lassa | • Không phân biệt triệu chứng thực thể hoặc cơ năng
• Các đặc điểm dịch tễ học có thể giúp phân biệt giữa các bệnh sốt xuất huyết do vi rút. • Tiếp xúc với chuột ở vùng lưu hành dịch. |
• RT-PCR: dương tính với virútLassa. |
| Sốt thương hàn | • Tiếp xúc với nước/thực phẩm nhiễm bệnh, tiếp xúc đường phân-miệng trực tiếp, suy dinh dưỡng, vệ sinh kém và điều kiện chật chội, bệnh mạn tính và đi lại đến các vùng lưu hành dịch. | • Cấy máu hoặc phân: dương tính với Salmonella enterica. |
| Bệnh leptospira | • Không có các dấu hiệu hoặc triệu chứng phân biệt; tuy nhiên, tiền sử tiếp xúc có thể giúp ích cho chẩn đoán.
• Tiếp xúc với nước hoặc đất bị nhiễm bẩn bởi động vật gặm nhấm bị nhiễm bệnh.[59] • Thường gặp hơn ở khu vực có khí hậu nhiệt đới. |
• PCR: dương tính.
• Huyết thanh: dương tính. • Các xét nghiệm khẳng định thích hợp đối với vi-rút CCHF được khuyến cáo thực hiện trước hoặc cùng với các xét nghiệm phân biệt nếu nghi ngờ bị nhiễm vi-rút CCHF. |
| Nhiễm cúm | • Các dấu hiệu hoặc triệu chứng hô hấp (như ho, nghẹt mũi) thường gặp hơn. | • Nuôi cấy vi-rút hoặc PCR: phát hiện vi-rút cúm mùa hoặc RNA vi-rút.
• Công thức máu: bình thường. |
| Nhiễm khuẩn huyết | • Nhiễm khuẩn huyết do vi khuẩn không rõ nguồn gốc thường gặp ở các nước đang phát triển. Thường là nhiễm trùng sâu ổ bụng, nhiễm trùng tiết niệu cao, viêm nội tâm mạc, hoặc viêm xương tủy.
• Thường không bị tiêu chảy. |
• Cấy máu: dương tính. |
| Bệnh Rickettsia | • Bao gồm bệnh sốt phát ban do chuột, sốt ve đốt Châu Phi, và sốt ban dịch tễ.[60]
• Eschar là đặc trưng. • Có thể xuất hiện sưng hạch bạch huyết. • Phát ban rải rác. |
• Huyết thanh học: dương tính đốivới các loài Rickettsia.
• PCR Eschar: dương tính với cácloài Rickettsia. |
| Nhiễm vi-rút vùng Tây sông Nile | • Cư ngụ/du lịch từ vùng dịch tễ vi-rút Tây Sông Nile.
• Rối loạn thị giác thường gặp. • Hiếm khi gây bệnh lý thần kinh xâm lấn (ví dụ: viêm não, viêm màng não, hội chứng liệt mềm). • Khó phân biệt với nhiễm vi-rút CCHF nếu không tiến hành xét nghiệm chẩn đoán. |
• IgM đặc hiệu vi-rút Tây Sông Nile trong huyết thanh hoặc dịch não tủy: dương tính. |
| Sốt Rift Valley | • Cư trú/đi lại từ vùng lưu hành vi-rút sốt Thung lũng Rift.
• Tiếp xúc với muỗi hoặc động vật nhiễm bệnh. |
• RT-PCR: dương tính với vi-rút sốt Thung lũng Rift. |
| Nhiễm vi-rút Marburg | • Không phân biệt triệu chứng thực thể hoặc cơ năng.
• Các đặc điểm dịch tễ học có thể giúp phân biệt giữa các bệnh sốt xuất huyết do vi rút. • Tiếp xúc với dơi, các hang động hoặc mỏ khai thác. |
• RT-PCR: dương tính với vi-rút Marburg. |
| Sốt xuất huyết Omsk/Bệnh Rừng Kyasanur | • Không có các dấu hiệu hoặc triệu chứng phân biệt trong giai đoạn đầu.
• Ảnh hưởng đến hệ thần kinh trung ương có thể xảy ra ở giai đoạn thứ hai.[61] • Các đặc điểm dịch tễ học có thể giúp phân biệt giữa các bệnh sốt xuất huyết do vi rút. |
• Xét nghiệm huyết thanh trong máu hoặc dịch não tủy: dương tính đối với tỉ lệ kháng thể IgM/ IgG. |
| Sốt vàng | • Cư trú/đi lại từ vùng lưu hành bệnh sốt vàng.
• Tiếp xúc với muỗi hoặc khỉ nhiễm bệnh. • Chứng vàng da thường gặp hơn ở bệnh giai đoạn đầu. • Nhịp tim chậm tương đối. |
• Xét nghiệm huyết thanh (IgM ELISA hoặc ức chế ngưng kết hồng cầu): dương tính đối với RNA vi-rút sốt vàng, tăng nồng độ IgG. |
| Hantavirus | • Cư trú/đi lại từ vùng lưu hành hantavirus.
• Cư trú/đi tới khu vực rừng rậm nơi có quần thể động vật gặm nhấm lớn. • Tiếp xúc với phân, nước tiểu hoặc xác chết của động vật gặm nhấm hoặc bị động vật gặm nhấm cắn. • Tổn thương phổi hoặc thận. |
• Phát hiện được RNA củahantavirus bằng RT-PCR.
• Khởi phát suy hô hấp nặng. |
| Não mô cầu | • Phát ban có đặc trưng là chấm xuất huyết và xuất hiện sớm hơn so với nhiễm rickettsia, bắt đầu ở trung tâm sau đó lan rộng ra ngoại biên.
• Có khả năng xảy ra sốc nhiễm khuẩn, DIC và hoại tử ngón tay chân. |
• Nuôi cấy máu (và đôi khi nuôi cấy dịch não tủy): dương tính với Neisseria meningitidis. |
| Bệnh Lyme | • Tiền sử ve cắn.
• Quá trình mạn tính hơn và khởi phát từ từ. • Ban đỏ mạn tính di chuyển. • Viêm khớp do bệnh Lyme. • Dị cảm lan tỏa mạn tính. |
• Chuẩn độ kháng thể huyết thanh dương tính với Borrelia burgdorferi: hiệu giá Lyme toàn phần hoặc IgG và IgM dương tính.
• Western blot (IgM/IgG): đểkhẳng định định lượng dương tính.[62] |
| Bệnh Brucella | • Tiếp xúc với các sản phẩm từ sữa chưa tiệt trùng. | • Cấy máu: mọc ra loài Brucella.
• các xét nghiệm huyết thanh(ví dụ: ngưng kết Wright hoặc ELISA) • Công thức máu: giảm ba dòng. |
| Sốt Q (Coxiella burnetii) | • Tiếp xúc với động vật nhiễm bệnh, phơi nhiễm nghề nghiệp, đi lại đến hoặc cư trú trong vùng lưu hành dịch.
• Sốt cao (39°C đến 40°C [102,2ºF đến 104ºF]). • Có thể có dấu hiệu của viêm phổi không điển hình. |
• Phản ứng miễn dịch huỳnh quang (IFA) của mô nhiễm bệnh: dương tính. |
| Nhiễm khuẩn huyết do tụ cầu khuẩn hoặc gram âm | • Nhiễm khuẩn huyết do vi khuẩn không rõ nguồn gốc thường gặp ở các nước đang phát triển. Thường là nhiễm trùng sâu ổ bụng, nhiễm trùng tiết niệu cao, viêm nội tâm mạc, hoặc viêm xương tủy.
• Thường không bị tiêu chảy. |
• Cấy máu: dương tính. |
| Hội chứng sốc nhiễm độc (TSS) | • Bệnh lý sốt cấp tính có liên quan đến nôn, tiêu chảy, đau cơ, lưỡi đỏ như dâu tây, và phát ban đỏ sau đó là bong vỡ.
• Nhiều bệnh nhân bị suy hô hấp cấp, hạ huyết áp, và sốc. • Bệnh này là do nhiễm khuẩn tụ cầu (staphylococcus) hoặc nhiễm liên cầu nhóm A. |
• Phân lập tụ cầu khuẩn hoặcđịnh nhóm huyết thanh liên cầu nhóm A sản sinh ra độc tố TSS-1. |
| Sốt vẹt | • Tiếp xúc với chim và động vật có vú nhiễm bệnh.
• Biểu hiện hoặc triệu chứng đường hô hấp trên và dưới thường gặp hơn. |
• Kháng thể miễn dịch vi huỳnhquang (MIF): cặp huyết thanh dương tính với kháng thể sốt vẹt.
• Nuôi cấy đờm, dịch màng phổi, dịch kết mạc hoặc máu đông: dương tính với Chlamydia psittaci. |
| Nhiễm khuẩn huyết do dịch hạch | • Tiếp xúc với bọ chét, cư trú hoặc đi lại đến một vùng lưu hành bệnh dịch hạch và tiếp xúc với động vật nhiễm bệnh. | • Cấy dương tính với Yersinia pestis. |
| Rubella | • Thông thường xuất hiện sốt nhẹ và phát ban dát sần lan rộng tiến triển trong khoảng 3 ngày. Cũng có thể nổi hạch bạch huyết chắc ở sau tai, sau cổ và các nhóm hạch bạch huyết vùng chẩm; viêm kết mạc; và đau khớp hoặc viêm khớp. | • Kháng thể IgM đặc hiệu với virút Rubella hoặc các xét nghiệm đặc hiệu khác đối với vi-rút Rubella. |
| Nhiễm sởi | • Phát ban dạng sởi màu đỏ hoặc nâu lan ra từ đầu và cổ xuống dưới, và kéo dài từ 3 đến 7 ngày.
• Biểu hiện thường thấy là viêm mũi, ho, và viêm kết mạc. • Hạt Koplik xuất hiện ở giai đoạn sớm của bệnh. |
• Huyết thanh dương tính với kháng thể IgM kháng vi-rút sởi là xét nghiệm ưa dùng.
• Tăng hiệu giá kháng thể IgGkháng vi – rút sởi ở hai mẫu bệnh phẩm máu lấy trong giai đoạn cấp và giai đoạn lui bệnh. • Phân lập được vi-rút sởi từ dịch họng, dịch mũi họng, máu, hoặc nước tiểu (thường chỉ thực hiện bởi các phòng xét nghiệm tham chiếu và y tế công cộng). |
| Ban xuất huyết giảm tiểu cầu huyết khối | • Giảm tiểu cầu và phát ban đỏ. | • Phết lam máu ngoại vi phát hiện thấy mảnh vỡ hồng cầu. |
| Hội chứng HELLP (phụ nữ mang thai) | • Có thể bị nhầm lẫn với CCHF ở bệnh nhân mang thai.
• Thường thấy tăng phản xạ gân xương, đau bụng ở góc phần tư trên bên phải. • Sốt không thường gặp. |
• Mảnh vỡ hồng cầu, hồng cầu hình răng cưa và hồng cầu đa sắc trên phết lam máu ngoại vi là dấu hiệu mang tính chẩn đoán.
• Nồng độ axit uric: thường tăng. |
| Hội chứng huyết tán tăng urê máu | • Thường gặp hơn ở trẻ em, đặc biệt ở trẻ <5 tuổi.
• Bệnh nhân có biểu hiện tiêu chảy ra nhiều máu hơn và suy thận. • Có thể không sốt. |
•Liên quan đến nhiễm khuẩn Escherichia coli O157:H7, được phát hiện trong phân. |
Các tiêu chí chẩn đoán
Chỉ số đánh giá mức độ nặng trên lâm sàng (SSI) của CCHF[63]
• Số lượng tiểu cầu (×10^3 tiểu cầu/mm^3)
- >150 = 0
- 150-50 = 1
- 49-20 = 2
- <20 = 3
• aPTT (giây)
- ≤34 = 0
- 35-45 = 1
- 46-59 = 2
- >60 = 3
• Nồng độ Fibrinogen (mg/dL)
- ≥180 = 0
- 179-160 = 1
- 159-120 = 2
- <120 = 3
• Chảy máu
- Không = 0
- Chấm xuất huyết = 1
- Vết bầm máu = 2
- Chảy máu = 3
• Ngủ gà
- Không = 0
- Có = 1
0-2 điểm = nhẹ
3-9 điểm = trung bình
10-13 điểm = nặng.
Điểm > 10 liên quan đến tỷ lệ tử vong trên quần thể bệnh nhân >50%.
Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh: định nghĩa ca bệnh sốt xuất huyết do vi-rút (VHF)[52]
Tiêu chuẩn lâm sàng
• Bệnh khởi phát cấp tính với:
- Sốt > 40°C (104°F) và
• Một hoặc nhiều biểu hiện lâm sàng sau:
- Đau đầu dữ dội
- Đau cơ
- Ban đỏ dát sẩn ở thân có bong vảy mịn sau khởi phát 3 – 4 ngày
- Nôn
- Tiêu chảy
- Đau bụng
- Xuất huyết không liên quan đến thương tích
- Giảm tiểu cầu.
Tiêu chuẩn xét nghiệm
• Một hoặc nhiều đặc điểm xét nghiệm sau:
- Phát hiện kháng nguyên vi-rút VHF trong máu bằng phương pháp phát hiện kháng nguyên ELISA
- Phân lập vi-rút VHF bằng nuôi cấy tế bào máu hoặc mô
- Phát hiện trình tự gen đặc hiệu VHF bằng phản ứng khuếch đại gen chuỗi sao chép ngược (RT-PCR) từ máu hoặc mô
- Phát hiện kháng nguyên vi-rút VHF trong mô bằng kỹ thuật hóa mô miễn dịch.
Mối liên hệ dịch tễ học
• Một hoặc nhiều trường hợp phơi nhiễm sau đây trong vòng 3 tuần trước khi khởi phát triệu chứng:
- Tiếp xúc với máu hoặc dịch cơ thể khác của bệnh nhân nhiễm VHF
- Làm việc trong phòng thí nghiệm xử lý các mẫu VHF
- Làm việc trong phòng thí nghiệm có xử lý dơi, động vật gặm nhấm hoặc linh trưởng từ các vùng lưu hành dịch
- Cư trú/đi lại đến vùng lưu hành dịch VHF.
- Tiếp xúc với tinh dịch từ ca bệnh đã được khẳng định nhiễm VHF ở giai đoạn cấp hoặc giai đoạn hồi phục trong vòng 10 tuần kể từ khi người đó khởi phát triệu chứng.
Phân loại trường hợp
• Ca bệnh nghi ngờ: đáp ứng tiêu chuẩn lâm sàng và có mối liên hệ về dịch tễ
• Ca bệnh được khẳng định: đáp ứng tiêu chuẩn lâm sàng và xét nghiệm
Điều trị
Cách tiếp cận điều trị từng bước
Điều trị chính là phát hiện bệnh sớm cùng với cách ly hiệu quả và chăm sóc hỗ trợ sẵn có tại bệnh viện. Ribavirin có thể được cân nhắc dùng ở một số bệnh nhân.
Cách ly và kiểm soát nhiễm khuẩn
Hầu hết con đường lây truyền vi-rút CCHF từ người sang người đều thông qua tiếp xúc trực tiếp với máu và dịch cơ thể nhiễm bệnh. Do đó, khuyến cáo rằng trong khi chăm sóc bất kỳ bệnh nhân nào nghi ngờ hoặc được ghi nhận nhiễm vi-rút CCHF, nên thực hiện ngay các phòng ngừa vật lý cụ thể (bao gồm sử dụng găng tay, áo choàng, tấm che mặt và mặt nạ). Đối với các thủ thuật có thể tạo khí dung, nhân viên y tế nên cân nhắc dùng khẩu trang N95 hoặc FFP2 (Tiêu chuẩn châu Âu [EN] 61010-1).[30] [48]
Để giảm thiểu nguy cơ xảy ra vết thương do kim châm, cần luôn sẵn có các thùng đựng đồ sắc nhọn và cũng nên cân nhắc sử dụng thiết bị được thiết kế an toàn.[30] [48]
Điều trị hỗ trợ
Điều trị hỗ trợ có thể đóng vai trò cứu mạng bệnh nhân, đặc biệt đối với những bệnh nhân nặng và những bệnh nhân được nhập viện vào giai đoạn muộn của bệnh.
Điều trị hỗ trợ bao gồm truyền dịch và sử dụng thuốc giảm đau và/hoặc thuốc hạ sốt (ví dụ: paracetamol). Nên tránh dùng aspirin và thuốc kháng viêm không steroid (NSAID) khác vì nguy cơ xuất huyết.
Bệnh nhân nhiễm CCHF nặng sẽ cần nâng mức chăm sóc thành chăm sóc tích cực và thực hiện liệu pháp thay thế thận và hỗ trợ thông khí khi cần và áp dụng các biện pháp phòng ngừa kiểm soát nhiễm khuẩn cần thiết.[64]
Xuất huyết nặng không thường gặp, nhưng là một biểu hiện của bệnh tiến triển thường dẫn đến tử vong. Nếu có sẵn, nên tiến hành truyền tiểu cầu và huyết tương theo các quy trình tại cơ sở.
Liệu pháp kháng vi-rút
Ribavirin là loại thuốc kháng vi-rút duy nhất đã được sử dụng để điều trị các hội chứng sốt xuất huyết do vi-rút, bao gồm sốt CCHF và Lassa.[65] [66] [67] Vi-rút trong họ Bunyaviridae thường nhạy với ribavirin.[68] Ribavirin đã được chứng minh có hiệu quả chống vi-rút CCHF in vitro.[69] [70] [71] Trong thực hành lâm sàng, các nghiên cứu quan sát đã phát hiện thấy ribavirin có hiệu quả, đặc biệt nếu được cho dùng trong giai đoạn đầu nhiễm bệnh.[30] [72] [73] [74] [75] [63] [76] Tuy nhiên, có những nghiên cứu trái ngược, bao gồm phân tích tổng hợp, đã cho thấy không có khác biệt có ý nghĩa về mặt lâm sàng về tỷ lệ sống sót khi dùng ribavirin, dẫn đến có một số tranh luận về việc sử dụng thuốc này trong nhiễm CCHF.[77] [78] [79]
Ribavirin nằm trong danh sách thuốc thiết yếu của Tổ chức Y tế Thế giới (WHO) để điều trị bệnh sốt xuất huyết do vi-rút. WHO khuyến cáo có thể sử dụng ribavirin để điều trị bệnh nhân nhiễm CCHF. Thuốc này cũng có thể được cân nhắc dùng đối với những người tiếp xúc với bệnh nhân có nguy cơ cao. Hiệu quả của nó vẫn chưa được chứng minh bằng các thử nghiệm ngẫu nhiên có đối chứng, và có nhiều quan điểm khác nhau về hiệu quả lâm sàng của thuốc trong các tài liệu đã công bố. Tuy nhiên, với nhiều thử nghiệm hơn với sốt Lassa, dữ liệu quan sát từ sốt Lassa cho thấy rằng ribavirin có hiệu quả nhất nếu được cho dùng trong 6 ngày đầu tiên bị bệnh.[80]
Biện pháp dự phòng sau phơi nhiễm
Ribavirin đường uống đã được sử dụng để dự phòng sau phơi nhiễm CCHF.[75] [81] Nhìn chung, thuốc này dung nạp tốt và nên cân nhắc dùng cho các nhân viên y tế có nguy cơ phơi nhiễm cao như vết thương do kim đâm.[48] [82] [83]WHO ủng hộ khuyến cáo này.[80]
Tổng quan về các chi tiết điều trị
Tham khảo cơ sở dữ liệu dược địa phương của quý vị để biết thông tin toàn diện về thuốc, bao gồm các chống chỉ định, tương tác giữa các loại thuốc, và liều dùng thay thế. ( xem Tuyên bố miễn trách nhiệm )
| Bắt đầu | (Tóm tắt) | |
| Phơi nhiễm tiềm tàng | ||
| 1 | Ribavirin | |
| Cấp tính | (Tóm tắt) | |
| Nhiễm khuẩn nghi nhờ hoặc khẳng định | ||
| 1 | Cách ly và kiểm soát nhiễm khuẩn | |
| thêm | Kiểm soát dịch và điện giải | |
| thêm | Thuốc giảm đau/thuốc hạ sốt | |
| bổ sung | Ribavirin | |
| Có xuất huyết/đông máu nội mạch rải rác | thêm | Truyền tiểu cầu và huyết tương tưới đông lạnh |
Các lựa chọn điều trị
| Bắt đầu | ||
| Phơi nhiễm tiềm tàng | 1 | Ribavirin
Các lựa chọn sơ cấp » ribavirin: trẻ em: hội chẩn với chuyên gia để được hướng dẫn về liều dùng; người lớn: 35 mg/ kg uống như liều nạp (tối đa 2,5 g/liều), sau đó là 15 mg/kg (tối đa 1 g/liều) 8 giờ một lần trong vòng 10 ngày » Ribavirin đường uống đã được sử dụng để dự phòng sau phơi nhiễm CCHF.[75] [81]Nhìn chung, thuốc này dung nạp tốt và nên cân nhắc dùng cho các nhân viên y tế có nguy cơ phơi nhiễm cao như vết thương do kim đâm.[48] [82] [83]Tổ chức Y tế Thế giới (WHO) ủng hộ khuyến cáo này.[80] |
| Cấp tính | ||
| Nhiễm khuẩn nghi nhờ hoặc khẳng định | ||
| 1 | Cách ly và kiểm soát nhiễm khuẩn
» Hầu hết con đường lây truyền vi-rút CCHF từ người sang người đều thông qua tiếp xúc trực tiếp với máu và dịch cơ thể nhiễm bệnh. Do đó, khuyến cáo rằng trong khi chăm sóc bất kỳ bệnh nhân nào nghi ngờ hoặc được ghi nhận nhiễm vi-rút CCHF, nên thực hiện ngay các phòng ngừa vật lý cụ thể (bao gồm sử dụng găng tay, áo choàng, tấm che mặt và mặt nạ). Đối với các thủ thuật có thể tạo khí dung, nhân viên y tế nên cân nhắc dùng khẩu trang N95 hoặc FFP2 (Tiêu chuẩn châu Âu [EN] 61010-1).[30] [48] » Để giảm thiểu nguy cơ xảy ra vết thương do kim châm, cần luôn sẵn có các thùng đựng đồ sắc nhọn và cũng nên cân nhắc sử dụng thiết bị được thiết kế an toàn.[30] [48] |
|
| thêm | Kiểm soát dịch và điện giải
» Điều trị ban đầu nên dựa vào dấu hiệu sinh tồn ban đầu Bệnh nhân người lớn thường cần ≥3-6 L dịch truyền tĩnh mạch hoặc đường uống mỗi ngày để duy trì thể tích máu tuần hoàn trong tình trạng liên tục mất nước qua đường tiêu hóa.[80 » Theo dõi và điều chỉnh tích cực nồng độ kali, rối loạn axit-bazơ, và các rối loạn điện giải khác có thể giúp ngăn ngừa các biến chứng loạn nhịp và chuyển hóa đe dọa tính mạng.[80] » Các nguyên tắc chung về xử trí trẻ em bị nhiễm virút CCHF giống như đối với người lớn, với trọng tâm là chăm sóc hỗ trợ và bù dịch. Có thể cần bù dịch bằng đường truyền trong xương và dưới da ở những trẻ không thể dung nạp được việc bù nước đường uống hoặc tiêm tĩnh mạch.[80] |
|
| thêm | Thuốc giảm đau/thuốc hạ sốt
Các lựa chọn sơ cấp » Paracetamol: trẻ em: 10-15 mg/kg qua đường uống/trực tràng mỗi 4-6 giờ khi cần, tối đa 75 mg/kg/ngày; người lớn: 500-1000 mg qua đường uống/trực tràng mỗi 4-6 giờ khi cần, tối đa 4000 mg/ngày Các lựa chọn thứ cấp » morphine sulfate: trẻ em: 0,2 đến 0,4 mg/kg uống mỗi 4-6 giờ khi cần, hoặc 0,05 đến 0,1 mg/kg tiêm tĩnh mạch mỗi 4-6 giờ khi cần; người lớn: 2,5 đến 10 mg uống/tiêm tĩnh mạch mỗi 4 giờ khi cần » Nên được điều trị bước đầu bằng paracetamol (giảm đau và sốt).[80] » Thuốc giảm đau có chứa opioid (ví dụ như morphine) sẽ tốt hơn nếu bị đau nặng hơn.[80] » Nên tránh các thuốc kháng viêm không chứa steroid (gồm aspirin) vì có liên quan đến tăng nguy cơ xuất huyết và có khả năng gây độc thận. |
|
| bổ sung | Ribavirin
Các lựa chọn sơ cấp » ribavirin: trẻ em: hội chẩn với chuyên gia để được hướng dẫn về liều dùng; người lớn: 30 mg/ kg (tối đa 2000 mg/liều) truyền tĩnh mạch như liều nạp, tiếp theo là 15 mg/kg (tối đa 1000 mg/liều) mỗi 6 giờ trong 4 ngày, sau đó là 7,5 mg/kg (tối đa 500 mg/liều) mỗi 8 giờ trong 6 ngày » Ribavirin là loại thuốc kháng vi-rút duy nhất đã được sử dụng để điều trị các hội chứng sốt xuất huyết do virút, bao gồm sốt CCHF và Lassa.[65] [66] [67] Vi-rút trong họ Bunyaviridae thường nhạy với ribavirin.[68] Ribavirin đã được chứng minh có hiệu quả chống vi-rút CCHF in vitro.[69] [70] [71] Trong thực hành lâm sàng, các nghiên cứu quan sát đã phát hiện thấy ribavirin có hiệu quả, đặc biệt nếu được cho dùng trong giai đoạn đầu nhiễm bệnh.[30] [72] [73] [74] [75] [63] [76] » Ribavirin nằm trong danh sách thuốc thiết yếu của WHO có tác dụng điều trị bệnh sốt xuất huyết do vi-rút và được WHO khuyến cáo sử dụng khi bị CCHF.[80] |
|
| Có xuất huyết/đông máu nội mạch rải rác | thêm | Truyền tiểu cầu và huyết tương tưới đông lạnh
» Xuất huyết nặng không thường gặp, nhưng là một biểu hiện của bệnh tiến triển thường dẫn đến tử vong. Nếu có sẵn, nên tiến hành truyền tiểu cầu và huyết tương theo các quy trình tại cơ sở. |
Giai đoạn đầu
Liệu pháp miễn dịch
Một thử nghiệm đã phát hiện ra rằng liệu pháp miễn dịch, thông qua việc đưa đồng thời thụ động hai chế phẩm globulin miễn dịch đặc hiệu khác nhau (CCHF-bulin tiêm bắp và CCHF-venin tiêm tĩnh mạch) được tạo ra từ huyết tương của những người hiến máu sống sót sau khi nhiễm CCHF, và tăng cường bằng một liều vắc-xin ngừa CCHF, đã phục hồi cho tất cả 7 bệnh nhân nhiễm CCHF nặng.[84] Các nghiên cứu viên sau đó đã đề xuất sử dụng chế phẩm tiêm tĩnh mạch để điều trị CCHF.[85] Một nghiên cứu khác đã cho thấy cho dùng ngay siêu globulin miễn dịch kháng vi-rút CCHF có thể là phương pháp điều trị thay thế, đặc biệt đối với những người có nguy cơ cao.[30] [86] Cần tiến hành những nghiên cứu khác để xác định liệu những phương pháp điều trị này có vai trò trong xử trí CCHF hay không.
Favipiravir
Các nghiên cứu trên động vật cho thấy favipiravir có hiệu quả trong việc điều trị CCHF, đơn độc hoặc kết hợp với ribavirin.[87]
Liên lạc theo dõi
Khuyến nghị
Giám sát
Cải thiện về lâm sàng và xét nghiệm của bệnh nhân được chấp nhận là tiêu chuẩn thích hợp để bệnh nhân xuất viện và không cần kết quả PCR âm tính. Tiêu chuẩn chung cho bệnh nhân xuất viện là không có máu chảy, số lượng tiểu cầu và bạch cầu bình thường, men gan có xu hướng giảm và xét nghiệm hóa sinh khác có xu hướng giảm và không có các biến chứng khác như nhiễm trùng bệnh viện.
Hướng dẫn dành cho bệnh nhân
Bệnh nhân cần được thông báo rằng họ vẫn có thể có khả năng lây nhiễm khi xuất viện. Người chăm sóc và bạn tình nên được hướng dẫn cách tránh tiếp xúc với máu và dịch cơ thể của bệnh nhân trong vài tháng. Vi-rút CCHF lây truyền qua đường tình dục đã được báo cáo,[44] [45] và vi-rút có thể hiện diện trong máu hoặc dịch cơ thể lên đến 90 ngày.
Trang thông tin giáo dục do Trung tâm Kiểm soát và Phòng chống Dịch bệnh (CDC) và Tổ chức Y tế Thế giới (WHO) cung cấp:
[CDC: Crimean-Congo hemorrhagic fever fact sheet] [WHO: Crimean-Congo haemorrhagic fever fact sheet]Các biến chứng
| Các biến chứng | Khung thời gian | Khả năng |
| Đông máu nội mạch rải rác | Ngắn hạn | Cao |
| Khiến bệnh nhân gặp các biến chứng chảy máu. Xuất huyết nặng không thường gặp, nhưng là một biểu hiện của bệnh tiến triển thường dẫn đến tử vong. Nếu có thể, nên tiến hành truyền tiểu cầu và huyết tương theo các quy trình tại cơ sở.[88] | ||
| Tổn thương thận cấp | Ngắn hạn | Trung bình |
| Thường xảy ra khi bệnh nặng. Có thể là do mất nước ban đầu, nhưng có thể là hậu quả của đông máu nội mạch rải rác hoặc vi-rút CCHF trực tiếp gây tổn thương thận ở các giai đoạn sau. Phát hiện sớm bằng cách theo dõi lượng nước tiểu và hóa sinh máu cho phép xử trí kịp thời. | ||
Tiên lượng
Tỷ lệ tử vong trên quần thể bệnh nhân được báo cáo dao động lớn trong khoảng từ 3% đến 30%.[1] [3] Những người sống sót hồi phục chậm; cần phải tiến hành nghiên cứu khác để tìm hiểu về những biến chứng lâu dài.[47]Ngoài hội chứng stress sau chấn thương, không có biến chứng muộn của tình trạng nhiễm vi-rút CCHF được xác định. Xác định thấy rằng những người sống sót phục hồi chậm và có nguy cơ lây truyền bệnh trong thời gian lên đến 90 ngày. Tái phát vẫn chưa được báo cáo.
Hướng dẫn
Hướng dẫn chẩn đoán
| Châu Âu |
| Viral haemorrhagic fever: sample testing advice
Nhà xuất bản: Public Health England Xuất bản lần cuối: 2016 |
| Bắc Mỹ |
| CDC health information for international travel (Yellow Book): viral hemorrhagic fevers
Nhà xuất bản: Centers for Disease Control and Prevention Xuất bản lần cuối: 2017 |
Hướng dẫn điều trị
| Châu Âu |
| Crimean-Congo haemorrhagic fever: origins, reservoirs, transmission and guidelines
Nhà xuất bản: Public Health England Xuất bản lần cuối: 2016 |
| Management of Hazard Group 4 viral haemorrhagic fevers and similar human infectious diseases of high consequence
Nhà xuất bản: Department of Health (UK) Xuất bản lần cuối: 2015 |
| Bắc Mỹ |
| CDC health information for international travel (Yellow Book): viral hemorrhagic fevers
Nhà xuất bản: Centers for Disease Control and Prevention Xuất bản lần cuối: 2017 |
| Hemorrhagic fever viruses as biological weapons: medical and public health management
Nhà xuất bản: Working Group on Civilian Biodefense Xuất bản lần cuối: 2002 |
Nguồn trợ giúp trực tuyến
1. WHO: steps to put on personal protective equipment (external link)
2. WHO: steps to remove personal protective equipment (external link)
3. CDC: Crimean-Congo hemorrhagic fever fact sheet (external link)
4. WHO: Crimean-Congo haemorrhagic fever fact sheet (external link)
Các bài báo chủ yếu
Tài liệu tham khảo
1. Watts DM, Ksiasek TG, Linthicum KJ, et al. Crimean-Congo hemorrhagic fever. In: Monath TP, ed. The arboviruses: epidemiology and ecology. Boca Raton: CRC; 1988.
2. Hoogstraal H. The epidemiology of tick-borne Crimean-Congo hemorrhagic fever in Asia, Europe, and Africa. J Med Entomol. 1979;15:307-417. Tóm lược
3. Ergonul O. Crimean-Congo haemorrhagic fever. Lancet Infect Dis. 2006;6:203-214. Tóm lược
4. Butenko AM, Karganova G. Crimean Congo hemorrhagic fever in Russia and other countries of the former Soviet Union. In: Ergonul O, Whitehouse CA, eds. Crimean Congo hemorrhagic fever: a global perspective. Dordrecht: Springer; 2007:99-115.
5. Woodall JP. Personal reflections. In: Ergonul O, Whitehouse CA, eds. Crimean Congo hemorrhagic fever: a global perspective. Dordrecht: Springer; 2007:23-32.
6. Athar MN, Baqai HZ, Ahmad M, et al. Short report: Crimean-Congo hemorrhagic fever outbreak in Rawalpindi, Pakistan, February 2002. Am J Trop Med Hyg. 2003;69:284-287. Toàn văn Tóm lược
7. Mardani M, Jahromi MK, Naieni KH, et al. The efficacy of oral ribavirin in the treatment of Crimean-Congo hemorrhagic fever in Iran. Clin Infect Dis. 2003;36:1613-1618. Toàn văn Tóm lược
8. Nabeth P, Thior M, Faye O, et al. Human Crimean-Congo hemorrhagic fever, Senegal. Emerg Infect Dis. 2004;10:1881-1882. Toàn văn Tóm lược
9. Papa A, Bino S, Llagami A, et al. Crimean-Congo hemorrhagic fever in Albania, 2001. Eur J Clin Microbiol Infect Dis. 2002;21:603-606. Tóm lược
10. Drosten C, Minnak D, Emmerich P, et al. Crimean-Congo hemorrhagic fever in Kosovo. J Clin Microbiol. 2002;40:1122-1123. Toàn văn Tóm lược
11. Papa A, Christova I, Papadimitriou E, et al. Crimean-Congo hemorrhagic fever in Bulgaria. Emerg Infect Dis. 2004;10:1465-1467. Toàn văn Tóm lược
12. Ergonul O, Celikbaş A, Dokuzoguz B, et al. Characteristics of patients with Crimean-Congo hemorrhagic fever in a recent outbreak in Turkey and impact of oral ribavirin therapy. Clin Infect Dis. 2004;39:284-287. Toàn văn Tóm lược
13. Maltezou HC, Papa A, Tsiodras S, et al. Crimean-Congo hemorrhagic fever in Greece: a public health perspective. Int J Infect Dis. 2009;13:713-716. Toàn văn Tóm lược
14. Dunster L, Dunster M, Ofula V, et al. First documentation of human Crimean-Congo hemorrhagic fever, Kenya.
Emerg Infect Dis. 2002;8:1005-1006. Toàn văn Tóm lược
15. Nabeth P, Cheikh DO, Lo B, et al. Crimean-Congo hemorrhagic fever, Mauritania. Emerg Infect Dis. 2004;10:2143-2149. Toàn văn Tóm lược
16. Knust B, Medetov ZB, Kyraubayev KB, et al. Crimean-Congo hemorrhagic fever, Kazakhstan, 2009-2010. Emerg Infect Dis. 2012;18:643-645. Toàn văn Tóm lược
17. Tishkova FH, Belobrova EA, Valikhodzhaeva M, et al. Crimean-Congo hemorrhagic fever in Tajikistan. Vector Borne Zoonotic Dis. 2012;12:722-726. Toàn văn Tóm lược
18. Patel AK, Patel KK, Mehta M, et al. First Crimean-Congo hemorrhagic fever outbreak in India. J Assoc Physicians India. 2011;59:585-589. Tóm lược
19. Mishra AC, Mehta M, Mourya DT, et al. Crimean-Congo haemorrhagic fever in India. Lancet. 2011;378:372. Tóm lược
20. Negredo A, de la Calle-Prieto F, Palencia-Herrejón E, et al. Autochthonous Crimean-Congo hemorrhagic fever in Spain. N Engl J Med. 2017 Jul 13;377(2):154-161. Tóm lược
21. García Rada A. First outbreak of Crimean-Congo haemorrhagic fever in western Europe kills one man in Spain. BMJ. 2016;354:i4891. Tóm lược
22. Yilmaz GR, Buzgan T, Irmak H, et al. The epidemiology of Crimean-Congo hemorrhagic fever in Turkey,
2002-2007. Int J Infect Dis. 2009;13:380-386. Toàn văn Tóm lược
23. Ergonul O, Whitehouse CA. Introduction. In: Ergonul O, Whitehouse CA, eds. Crimean Congo hemorrhagic fever: a global perspective. Dordrecht: Springer; 2007:3-11.
24. Shepherd AJ, Swanepoel R, Leman PA, et al. Field and laboratory investigation of Crimean-Congo haemorrhagic fever virus (Nairovirus, family Bunyaviridae) infection in birds. Trans R Soc Trop Med Hyg. 1987;81:1004-1007. Tóm lược
25. Leblebicioglu H, Eroglu C, Erciyas-Yavuz K, et al. Role of migratory birds in spreading Crimean-Congo
hemorrhagic fever, Turkey. Emerg Infect Dis. 2014;20:1331-1334. Toàn văn Tóm lược
26. England ME, Phipps P, Medlock JM, et al. Hyalomma ticks on northward migrating birds in southern Spain:
implications for the risk of entry of Crimean-Congo haemorrhagic fever virus to Great Britain. J Vector Ecol.
2016;41:128-134. Toàn văn Tóm lược
27. Gargili A, Midilli K, Ergonul O, et al. Crimean-Congo hemorrhagic fever in European part of Turkey: genetic
analysis of the virus strains from ticks and a seroepidemiological study in humans. Vector Borne Zoonotic Dis.
2011;11:747-752. Tóm lược
28. Aradaib IE, Erickson BR, Karsany MS, et al. Multiple Crimean-Congo hemorrhagic fever virus strains are
associated with disease outbreaks in Sudan, 2008-2009. PLoS Negl Trop Dis. 2011;5:e1159. Toàn văn Tóm lược
29. Meric Koc M, Willke A. A case of Crimean-Congo hemorrhagic fever with long incubation period in Kocaeli,
Turkey. Mikrobiyol Bul. 2012;46:129-133. Tóm lược
30. Ergonul O. Crimean-Congo hemorrhagic fever. In: Ergonul O, Can F, Akova M, Madoff L, eds. Emerging infectious diseases: clinical case studies. London: Academic Press; 2014:136-149.
31. Akıncı E, Bodur H, Leblebicioglu H. Pathogenesis of Crimean-Congo hemorrhagic fever. Vector Borne Zoonotic Dis. 2013;13:429-437. Tóm lược
32. Peters CJ, Zaki SR. Role of the endothelium in viral hemorrhagic fevers. Crit Care Med. 2002;30(suppl 5):S268- S273. Tóm lược
33. Geisbert TW, Jahrling PB. Exotic emerging viral diseases: progress and challenges. Nat Med. 2004;10(suppl
12):S110-S121. Tóm lược
34. Chen JP, Cosgriff TM. Hemorrhagic fever virus-induced changes in hemostasis and vascular biology. Blood Coagul Fibrinolysis. 2000;11:461-483. Tóm lược
35. Ergonul O, Tuncbilek S, Baykam N, et al. Evaluation of serum levels of interleukin (IL)-6, IL-10, and tumor
necrosis factor-alpha in patients with Crimean-Congo hemorrhagic fever. J Infect Dis. 2006;193:941-944. Toàn văn
Tóm lược
36. Bray M. Comparative pathogenesis of Crimean Congo hemorrhagic fever and Ebola hemorrhagic fever. In:
Ergonul O, Whitehouse CA, eds. Crimean Congo hemorrhagic fever: a global perspective. Dordrecht: Springer;
2007:221-231.
37. Rodrigues R, Paranhos-Baccalà G, Vernet G, et al. Crimean-Congo hemorrhagic fever virus-infected hepatocytes induce ER-stress and apoptosis crosstalk. PLoS One. 2012;7:e29712. Toàn văn Tóm lược
38. Saksida A, Duh D, Wraber B, et al. Interacting roles of immune mechanisms and viral load in the pathogenesis of Crimean-Congo hemorrhagic fever. Clin Vaccine Immunol. 2010;17:1086-1093. Toàn văn Tóm lược
39. Duh D, Saksida A, Petrovec M, et al. Viral load as predictor of Crimean-Congo hemorrhagic fever outcome. Emerg Infect Dis. 2007;13:1769-1772. Toàn văn Tóm lược
40. Cevik MA, Erbay A, Bodur H, et al. Viral load as a predictor of outcome in Crimean-Congo hemorrhagic fever.
Clin Infect Dis. 2007;45:e96-e100. Toàn văn Tóm lược
41. World Health Organization. Crimean-Congo haemorrhagic fever. January 2013. http://www.who.int/ (last accessed 17 November 2016). Toàn văn
42. Centers for Disease Control and Prevention. Factsheet: Crimean-Congo hemorrhagic fever (CCHF). https://
www.cdc.gov/ (last accessed 17 November 2016). Toàn văn
43. Leblebicioglu H, Sunbul M, Memish ZA, et al. Consensus report: preventive measures for Crimean-Congo
hemorrhagic fever during Eid-al-Adha festival. Int J Infect Dis. 2015;38:9-15. Toàn văn Tóm lược
44. Pshenichnaya NY, Sydenko IS, Klinovaya EP, et al. Possible sexual transmission of Crimean-Congo hemorrhagic fever. Int J Infect Dis. 2016;45:109-111. Toàn văn Tóm lược
45. Ergonul O, Battal I. Potential sexual transmission of Crimean-Congo hemorrhagic fever infection. Jpn J Infect Dis. 2014;67:137-138. Toàn văn Tóm lược
46. Centers for Disease Control and Prevention. Yellow Book: health information for international travel. Chapter 2 protection against mosquitoes, ticks, & other arthropods. May 2017. http://www.cdc.gov/ (last accessed 5 December 2017). Toàn văn
47. Centers for Disease Control and Prevention. Crimean-Congo haemorrhagic fever (CCHF). May 2014. http:// www.cdc.gov/ (last accessed 17 November 2016). Toàn văn
48. Tarantola A, Ergonul O, Tattevin P. Estimates and prevention of Crimean Congo hemorrhagic fever risks for health care workers. In: Ergonul O, Whitehouse CA, eds. Crimean Congo hemorrhagic fever: a global perspective. Dordrecht: Springer; 2007:281-294.
49. Ergonul O, Zeller H, Celikbas A, et al. The lack of Crimean-Congo hemorrhagic fever virus antibodies in healthcare workers in an endemic region. Int J Infect Dis. 2007;11:48-51. Toàn văn Tóm lược
50. Tezer H, Sucakli IA, Sayli TR, et al. Crimean-Congo hemorrhagic fever in children. J Clin Virol. 2010;48:184-186. Tóm lược
51. European Centre for Disease Prevention and Control. Meeting report: consultation on Crimean-Congo haemorragic fever prevention and control. September 2008. http://ecdc.europa.eu (last accessed 17 November 2016). Toàn văn
52. Centers for Disease Control and Prevention. Viral hemorrhagic fever (VHF) 2011 case definition. https:// wwwn.cdc.gov/nndss/conditions/viral-hemorrhagic-fever/case-definition/2011/ (last accessed 5 December 2017). Toàn văn
53. Drosten C, Kümmerer BM, Schmitz H, et al. Molecular diagnostics of viral hemorrhagic fevers. Antiviral Res. 2003;57:61-87. Tóm lược
54. Drosten C, Göttig S, Schilling S, et al. Rapid detection and quantification of RNA of Ebola and Marburg viruses, Lassa virus, Crimean-Congo hemorrhagic fever virus, Rift Valley fever virus, dengue virus, and yellow fever virus by real-time reverse transcription-PCR. J Clin Microbiol. 2002;40:2323-2330. Toàn văn Tóm lược
55. Atkinson B, Chamberlain J, Logue CH, et al. Development of a real-time RT-PCR assay for the detection of Crimean-Congo hemorrhagic fever virus. Vector Borne Zoonotic Dis. 2012;12:786-793. Toàn văn Tóm lược
56. Ergonul O, Celikbas A, Baykam N, et al. Analysis of risk-factors among patients with Crimean-Congo haemorrhagic fever virus infection: severity criteria revisited. Clin Microbiol Infect. 2006;12:551-554. Toàn văn Tóm lược
57. Burt FJ, Swanepoel R, Braack LE. Enzyme-linked immunosorbent assays for the detection of antibody to CrimeanCongo haemorrhagic fever virus in the sera of livestock and wild vertebrates. Epidemiol Infect. 1993;111:547-557. Toàn văn Tóm lược
58. Zeller H. Laboratory diagnosis of Crimean Congo hemorrhagic fever. In: Ergonul O, Whitehouse CA, eds. Crimean Congo hemorrhagic fever: a global perspective. Dordrecht: Springer; 2007:233-243.
59. Hartskeerl RA, Collares-Pereira M, Ellis WA. Emergence, control and re-emerging leptospirosis: dynamics of infection in the changing world. Clin Microbiol Infect. 2011;17:494-501. Toàn văn Tóm lược
60. Hensley LE, Wahl-Jensen V, McCormick JB, et al. Viral hemorrhagic fevers. In: Cohen J, Powderly W, Opal S, eds. Infectious diseases. 3rd ed. Maryland Heights, MO: Mosby; 2010:1231-1237.
61. Lindquist L, Vapalahti O. Tick-borne encephalitis. Lancet. 2008;371:1861-1871. Tóm lược
62. Wilske B, Fingerle V, Schulte-Spechtel U. Microbiological and serological diagnosis of Lyme borreliosis. FEMS Immunol Med Microbiol. 2007;49:13-21. Toàn văn Tóm lược
63. Dokuzoguz B, Celikbas AK, Gök ŞE, et al. Severity scoring index for Crimean-Congo hemorrhagic fever and the impact of ribavirin and corticosteroids on fatality. Clin Infect Dis. 2013;57:1270-1274. Toàn văn Tóm lược
64. Leblebicioglu H, Bodur H, Dokuzoguz B, et al. Case management and supportive treatment for patients with Crimean-Congo hemorrhagic fever. Vector Borne Zoonotic Dis. 2012;12:805-811. Tóm lược
65. McCormick JB, King IJ, Webb PA, et al. Lassa fever: effective therapy with ribavirin. N Engl J Med. 1986;314:20-26. Tóm lược
66. Ergonul O. Treatment of Crimean Congo hemorrhagic fever. In: Ergonul O, Whitehouse CA, eds. Crimean Congo hemorrhagic fever: a global perspective. Dordrecht: Springer; 2007:245-260.
67. Bausch DG, Hadi CM, Khan SH, et al. Review of the literature and proposed guidelines for the use of oral ribavirin as postexposure prophylaxis for Lassa fever. Clin Infect Dis. 2010;51:1435-1441. Toàn văn Tóm lược
68. Sidwell RW, Smee DF. Viruses of the Bunya- and Togaviridae families: potential as bioterrorism agents and means of control. Antiviral Res. 2003;57:101-111. Tóm lược
69. Watts DM, Ussery MA, Nash D, et al. Inhibition of Crimean-Congo hemorrhagic fever viral infectivity yields in vitro by ribavirin. Am J Trop Med Hyg. 1989;41:581-585. Tóm lược
70. Tignor GH, Hanham CA. Ribavirin efficacy in an in vivo model of Crimean-Congo hemorrhagic fever virus (CCHF) infection. Antiviral Res. 1993;22:309-325. Tóm lược
71. Paragas J, Whitehouse CA, Endy TP, et al. A simple assay for determining antiviral activity against Crimean-Congo hemorrhagic fever virus. Antiviral Res. 2004;62:21-25. Tóm lược
72. Tasdelen Fisgin N, Ergonul O, Doganci L, et al. The role of ribavirin in the therapy of Crimean-Congo hemorrhagic fever: early use is promising. Eur J Clin Microbiol Infect Dis. 2009;28:929-933. Tóm lược
73. Ozbey SB. Impact of early ribavirin use on fatality of CCHF. Klimik J. 2010;23:6-10.
74. Izadi S, Salehi M. Evaluation of the efficacy of ribavirin therapy on survival of Crimean-Congo hemorrhagic fever patients: a case-control study. Jpn J Infect Dis. 2009;62:11-15. Toàn văn Tóm lược
75. Ergonul O. Treatment of Crimean-Congo hemorrhagic fever. Antiviral Res. 2008;78:125-131. Tóm lược
76. Ozbey SB, Kader Ç, Erbay A, et al. Early use of ribavirin is beneficial in Crimean-Congo hemorrhagic fever. Vector Borne Zoonotic Dis. 2014;14:300-302. Tóm lược
77. Koksal I, Yilmaz G, Aksoy F, et al. The efficacy of ribavirin in the treatment of Crimean-Congo hemorrhagic fever in Eastern Black Sea region in Turkey. J Clin Virol. 2010;47:65-68. Tóm lược
78. Elaldi N, Bodur H, Ascioglu S, et al. Efficacy of oral ribavirin treatment in Crimean-Congo haemorrhagic fever: a quasi-experimental study from Turkey. J Infect. 2009;58:238-244. Tóm lược
79. Ascioglu S, Leblebicioglu H, Vahaboglu H, et al. Ribavirin for patients with Crimean-Congo haemorrhagic fever: a systematic review and meta-analysis. J Antimicrob Chemother. 2011;66:1215-1222. Toàn văn Tóm lược
80. World Health Organization. Clinical management of patients with viral haemorrhagic fever: a pocket guide for the front-line health worker. February 2016. http://apps.who.int/ (last accessed 17 November 2016). Toàn văn
81. Leblebicioglu H, Sunbul M, Guner R, et al. Healthcare-associated Crimean-Congo haemorrhagic fever in Turkey, 2002-2014: a multicentre retrospective cross-sectional study. Clin Microbiol Infect. 2016;22:387. Toàn văn Tóm lược
82. Celikbas AK, Dokuzoğuz B, Baykam N, et al. Crimean-Congo hemorrhagic fever among health care workers, Turkey. Emerg Infect Dis. 2014;20:477-479. Toàn văn Tóm lược
83. Guner R, Hasanoglu I, Tasyaran MA, et al. Is ribavirin prophylaxis effective for nosocomial transmission of Crimean-Congo hemorrhagic fever? Vector Borne Zoonotic Dis. 2014;14:601-605. Tóm lược
84. Vassilenko SM, Vassilev TL, Bozadjiev LG, et al. Specific intravenous immunoglobulin for Crimean-Congo haemorrhagic fever. Lancet. 1990;335:791-792. Tóm lược
85. Dimitrov DS. Antibodies to CCHFV for prophylaxis and treatment. In: Ergonul O, Whitehouse CA, eds. Crimean Congo hemorrhagic fever: a global perspective. Dordrecht: Springer; 2007:261-269.
86. Kubar A, Haciomeroglu M, Ozkul A, et al. Prompt administration of Crimean-Congo hemorrhagic fever (CCHF) virus hyperimmunoglobulin in patients diagnosed with CCHF and viral load monitorization by reverse transcriptasePCR. Jpn J Infect Dis. 2011;64:439-443. Toàn văn Tóm lược
87. Oestereich L, Rieger T, Neumann M, et al. Evaluation of antiviral efficacy of ribavirin, arbidol, and T-705 (favipiravir) in a mouse model for Crimean-Congo hemorrhagic fever. PLoS Negl Trop Dis. 2014;8:e2804. Toàn văn Tóm lược
88. Wada H, Thachil J, Di Nisio M, et al. Guidance for diagnosis and treatment of DIC from harmonization of the recommendations from three guidelines. J Thromb Haemost. 2013;4:761-767. Toàn văn Tóm lược
Hình ảnh

Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC)

Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC)
Xem thêm:
Gút: Những thông tin cơ bản, cách phòng ngừa, chẩn đoán và điều trị theo BMJ.
Đợt cấp của suy tim sung huyết: Cách phòng ngừa, chẩn đoán và điều trị theo BMJ.
Đột quỵ xuất huyết: cách phòng ngừa, chẩn đoán và điều trị theo BMJ.
Đột quỵ do thiếu máu cục bộ: Phòng ngừa, chẩn đoán và điều trị theo BMJ.

