Bệnh hô hấp
BỆNH PHỔI TẮC NGHẼN MẠN TÍNH – LỊCH SỬ CỦA KHAI NIỆM VÀ ĐỊNH NGHĨA
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết BỆNH PHỔI TẮC NGHẼN MẠN TÍNH – LỊCH SỬ CỦA KHAI NIỆM VÀ ĐỊNH NGHĨA
Tham khảo từ 2 bản dịch của Bác Sĩ Trần Minh Thành- Khoa HSTC-CĐ
Xem đủ file PDF tại: link 1, link 2
LỊCH SỬ CỦA KHÁI NIỆM
Thuật ngữ “Bệnh phổi tắc nghẽn mạn tính” (Choronic Obstructive Pulmonary Disease, COPD) được sử dụng từ những năm 1960 và dần dần trở thành thuật ngữ phổ biến trong y văn, thay thế thuật ngữ Viêm phế quản mạn tính, Khí phế thũng (Chronic bronchitis, Emphysema). Từ thời điểm này, thuật ngữ COPD được chấp nhận và được sử dụng phổ biến không chỉ trong học thuật mà còn trong thực hành. Cho tới những năm 1980, thuật ngữ COPD được đưa vào bảng phân loại Phân loại bệnh tật quốc tế (The International Classification of Disease, ICD) [1].
Một số tài liệu cho rằng mô tả sớm nhất về khí phế thũng là Bonet vào năm 1679 với mô tả “phổi quá lớn” (voluminous lungs) [2], Morgagni năm 1769 mô tả 19 trường hợp “phổi căng phồng” (turgit) nhất là do khí [3].
Trước năm 1930, những người đầu tiên trong y học lâm sàng đã mô tả Viêm phế quản mạn tính và Khí phế thũng vào đầu thế kỷ XIX ở Tây Âu. Trong những mô tả đầu tiên về viêm phế quản cấp tính, mạn tính, đặc điểm phân biệt các tình huống bệnh lý này với các bệnh lý phổi khác đã được Charles Badham công bố vào năm 1808 [4]. Cũng vào thời điểm đó, René Laennec (1781-1862) phát minh ra ống nghe (một tai) vào năm 1815. Với phương tiện này, ông đã ghi nhận được các thay đổi bệnh lý trong phù phổi và góp phần vào các nghiên cứu toàn diện khí phế thũng trên các phần phổi bị căng phồng (inflated) [5]. Trong số các đặc điểm của khí phế thũng mà ông mô tả có sự hiện diện của tắc nghẽn đường thở ngoại vi, thông khí bàng hệ, mất độ đàn hồi của phổi, phì đại tâm thất phải ở những trường hợp bệnh tiến triển và viêm phế quản mạn tính (“quá tiết và ứ đọng dịch tiết” phế quản, bronchial catarrh). Kiến thức của Laennec về bệnh lý chức năng đã đi trước rất nhiều so với việc áp dụng trong thực hành lâm sàng vào thời kỳ đó, và nhiều khía cạnh đã không được nghiên cứu lại cho đến tận thế kỷ XX.
Năm 1837 William Stokes, một bác sĩ người Ireland, đã xuất bản cuốn sách kinh điển “Chẩn đoán và Điều trị các bệnh lồng ngực” [6]. Stokes cũng sử dụng ống nghe và mô tả khí phế thũng giống như Laennec. Tuy nhiên Stokes nhấn mạnh: “Tình trạng này là kết quả của viêm phế quản mạn tính và việc phòng bệnh, điều trị khỏi hay điều trị giảm nhẹ cần dựa trên nguyên tắc của nhận định này”. Trong tài liệu này, phần “Viêm phế quản” Stokes mô tả đầy đủ cách tiến tiến triển triệu chứng trên người bệnh từ khởi bệnh âm thầm, khuynh hướng có nhiều đợt cấp, khó thở vào mùa lạnh, tới khó thở tư thế khom lưng, phì đại tim, gan và phù ngoại vi. Những ghi nhận này được xem là kinh điển trong những y văn từ đó về sau.
James Jackson Jnr (1810-1834) có lẽ là người có đóng góp quan trọng nhất tiếp theo Laennec trong chẩn đoán bằng ống nghe. Ông mô tả đặc tính di truyền của khí phế thũng trên 26 người trẻ khi nhận thấy 18 trên 26 người bệnh có một hoặc cả hai bố mẹ có tình trạng bệnh tương tự [7].
Edward Greenhow (1814-1888), một người hoạt động tiên phong trong lĩnh vực y tế cộng đồng, trên cơ sở đồng ý với những nhận định của Jackson đã cung cấp những thông tin về đặc tính di truyền trong khí phế thũng trong sách của mình và cho rằng khí phế thũng thường xuất hiện sau nhiều năm bị viêm phế quản. Trên các trường khám nghiệm tử thi vào năm 1899 ở khoa nội bệnh viện St. Bartholomew’s (London, Anh), ghi nhận tử vong khí phế thũng là 11% và hầu hết các trường hợp có kết hợp với quá tiết ứ đọng dịch tiết ở phế quản [8].
Mặc dù một số nhà khoa học trước đó đã thực hiện việc đo tổng lượng khí thở ra có thể sau khi hít vào hết sức nhưng cho đến năm 1840 Hutchinson mới đưa ra thuật ngữ “dung tích sống” (vital capacity, VC) và đã thực hiện khảo sát giá trị thông số này một cách hệ thống trên 2.000 nam giới [9]. Hutchinson cũng đã trình bày cách đo chức năng phổi (VC) bằng dụng cụ đo phế dung kế (spirometer) (hình 1.1) khi đó để chẩn đoán bệnh và tiên lượng tuổi thọ. Tuy nhiên, thật không may, phép đo này không được áp dụng để đánh giá viêm phế quản mạn tính và khí phế thũng. Sau thời kỳ này, ngoài những nghiên cứu lẻ tẻ, chức năng hô hấp cũng không được chú ý trong đánh giá bệnh phổi cho tới thế kỷ XX [1 ].
Những ghi nhận đầu tiên vào giữa thế kỷ XIX về tình hình tử vong ở Anh cho thấy tình trạng nhiễm trùng phế quản tái diễn dẫn tới suy tim phù phổi là nguyên nhân tử vong ở 5% trên những người tuổi trung niên và người già [10]. Những trường hợp này thường được chẩn đoán “viêm phế quản” và cũng có nhiều trường hợp có ghi nhận khí phế thũng kết hợp. Tỷ lệ tử vong này cũng được ghi nhận có liên quan tới sự phát triển không đầy đủ của phổi, điều kiện sống và lao động trong xã hội nước Anh vào thời kỳ đó [11]. Đây cũng là điều mà Hutchinson đã đề xuất trước đó gần một thế kỷ thông qua việc đánh giá chức năng phổi [9].
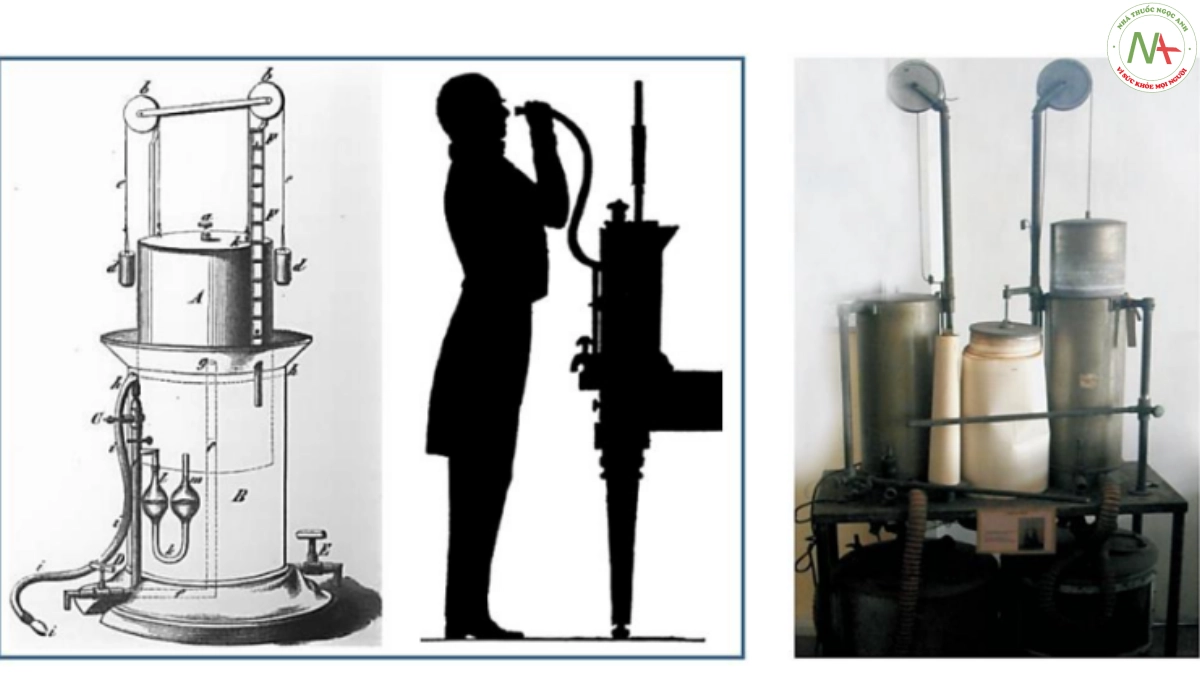
Sinh lý hô hấp và đo chức năng phổi đã được chú ý vào đầu thế kỷ XX, nhất là ở Đức và Đan Mạch. Volhard, một bác sỹ người Đức, đã làm ra được hệ thống ký ghi nhịp thở người bệnh khi đo chức năng phổi, cho phép quan sát nhịp thở người đo [12]. Volhard nhận thấy thời gian thở ra kéo dài trên những người bị khí phế thũng tương phản với thời gian hít vào còn ít thay đổi. Sau đó Raither, trong một nghiên cứu bằng spirometer, xác nhận nhận định quan trọng này [13]. Tuy nhiên điều này đã không được các bác sỹ thực hành lâm sàng chú ý. Năm 1917, Peabody, một bác sĩ tim mạch ở Boston, đã công bố một loạt bài báo về thông khí và tốc độ chuyển hóa cơ bản trong suy tim và phổ biến việc sử dụng những thay đổi trong VC để đánh giá chứng khó thở do tim [14]. Vào thời điểm này phế dung kế đã được phát triển thương mại ở Hoa Kỳ nhưng cơ bản cũng giống như phế dung kế do Hutchinson phát triển ở chỗ được thiết kế chỉ để đo VC chứ không phải để đo các thể tích động (ký) nên không đánh giá được thể tích thở ra gắng sức trong một giây (FEV1) cho tới những năm cuối thập niên 1940. X- quang ngực đã phát triển từ cuối thế kỷ XIX nhưng chỉ góp được một phần nhỏ trong nhận định về viêm phế quản mạn tính-khí phế thũng khi bệnh đã tiến triển nặng, khi đã có các bóng khí lớn và biến dạng lồng ngực.
Vào giữa những năm 1890-1920, đã có những phát triển đáng chú ý trong khảo sát sinh lý hô hấp như đo oxy, carbon dioxide trong máu động mạch, không khí phế nang, xác định hình dạng đường cong phân ly oxyhemoglobin và hiểu biết vai trò của carbon dioxide trong điều hòa hoạt động thông khí. Năm 1923, Collis (đại học Cardiff xứ Wales) cho rằng hai biện pháp quan trọng để phòng viêm phế quản là cải thiện điều kiện sống và giảm ô nhiễm khói bụi trong công nghiệp và ở các thành phố lớn.
Cho tới sau Thế chiến lần thứ II, thuốc lá không được xem là căn nguyên gây bệnh đối với viêm phế quản mạn-khí phế thũng. Khoảng thời gian giữa hai cuộc Thế chiến thứ nhất (1914-1918) và thứ hai (19391945), tiêu thụ thuốc lá tăng đều đặn [15]. Ở Anh, tiêu thụ thuốc lá trong giới nam bắt đầu giảm vào khoảng sau năm 1945 trong khi hút thuốc lá chủ động ở giới nữ tiếp tục tăng dần cho tới những năm 1975 mới giảm dần [1]. Bên cạnh các tiến bộ trong khoảng thời gian này về đánh giá chức năng hô hấp, sự ra đời của kháng sinh, kiến thức về bệnh học, y tế cộng đồng và dịch tễ có liên quan tới viêm phế quản mạn-khí phế thũng không có gì cho tới những năm 1950.
Trong khoảng thời gian 1930-1960, các bác sỹ phẫu thuật lồng ngực đã áp dụng kỹ thuật đánh giá năng lực thông khí phổi bằng thử nghiệm (test) kích thích trực tiếp để tiên lượng phẫu thuật cắt phổi trong ung thư, lao đang có chỉ định ngày càng tăng. Thử nghiệm đầu tiên đánh giá khả năng thông khí là phép đo thông khí tối đa tự nguyện (maximum voluntary ventilation (MVV) trong 15-30 giây được phát triển ở Đức bằng phế dung kế Knipping [16,17] (hình 1.1). Phép đo này kết hợp với phép đo thông khí khu vực (bronchospirometry) cho phép ước tính thông khí của khu vực sẽ bị cắt bỏ [18]. Việc ghi nhận hơi thở trong test MVV đã cho thấy mô hình thở tắc nghẽn ở thì thở ra bình thường (tidal expiration) và dẫn tới những cố gắng đầu tiên trong việc mô tả các loại suy hô hấp do tắc nghẽn [19]. Các kỹ thuật sinh lý khác đã được sử dụng để chẩn đoán viêm phế quản mạn tính-khí phế thũng vào những năm 1930. Phép đo tổng dung tích phổi (total lung capacity, TLC) và các thể tích đã được thực hiện trước Thế chiến lần thứ nhất bằng phương pháp định luật Boyle trước đó và sử dụng việc đánh giá thăng bằng khí thở với hydrogen trong nhiều lần thở. Vào những năm đầu thập niên 1930, Christie đã chuẩn hóa kỹ thuật làm sạch nitrogen (nitrogen washout method) [20] và tạo ra các dụng cụ đo độ đàn hồi phổi bằng đặt catheter vào khoang màng phổi [21]. Barach đã thực nghiệm việc đánh giá thông khí bằng khí trộn helium-oxygen để làm giảm trở kháng khi thở và đánh giá hiệu quả của hít thuốc dãn phế quản bằng đo dung tích sống theo thời gian [22]. Dây thắt bụng cũng đã được sử dụng để mô phỏng tác động của tràn khí phúc mạc trong việc cải thiện chức cơ hoành bằng cách làm tăng thời gian nghỉ cơ hoành [23,24].
Vào những năm đầu 1940, Eleanor Baldwin, Cournand và Richards đã áp dụng một bộ đo chức năng hô hấp toàn diện rất đáng chú ý cho bệnh nhân có bệnh phổi mạn tính [2527], đo tổng dung tích phổi (TLC) và các thể tích bằng phương pháp làm sạch nitrogen của Christie, MMV trước và sau dùng thuốc dãn phế quản, chỉ số hòa trộn trong phổi (index of intrapulmonary mixing), thông khí, phân tích khí thở ra và các mẫu máu động mạch (hàm lượng oxy, carbon dioxide, pH) khi nghỉ và sau khi test đi bộ 1 phút. Đóng góp nổi tiếng nhất của Cournand, Richards và các đồng nghiệp trong giai đoạn này là sự ra đời của phương pháp đặt catheter tim phải trên lâm sàng, nhờ đó họ đã giành được giải Nobel Y học và Sinh lý học năm 1956 [28]. Việc đưa được catheter vào tim phải và sau đó vào động mạch phổi đã cho phép đo nồng độ oxy cũng như carbon dioxide. Việc đo khí máu thông qua catheter tim phải và động mạch phổi này dẫn tới hình thành hiểu biết về mô hình trao đổi khí ở 3 khoang là phế nang, khoảng chết và máu tĩnh mạch pha trộn và cũng là lần đầu tiên chúng ta nhận biết rằng mối tương quan thông khí-tưới máu bất thường là nguyên nhân chính dẫn tới giảm oxy máu động mạch trong viêm phế quản mạn tính-khí phế thũng [29]. Các nghiên cứu về tim phải cũng góp phần quan trọng trong sự hiểu biết về bệnh tim do phổi (tâm phế, cor pulmonale), một biến chứng tim phổ biến trong viêm phế quản mạn tính-khí phế thũng.
Khoảng 20 năm sau thế chiến lần thứ II, có một bước tiến dài về hiểu biết sinh lý hô hấp trong thực hành ở Hoa Kỳ. Các xét nghiệm chức năng hô hấp đã được áp dụng tại trường đại học Pennsylvania như phế thân ký (plethysmography) để đo đạc trở kháng đường thở (airway resistance), các thể tích phổi, test Nitơ trong một lần thở, khả năng khuyếch tán CO [30]. Các xét nghiệm mới khác như đánh giá sức cản và đàn hồi phổi bằng đặt catheter có bóng thực quản mô phỏng áp suất màng phổi đã được áp dụng tại Trường Y tế Công cộng Harvard [30]. Phép phân tích đường cong cung lượng – thể tích thở ra tối đa đã được thực hiện ở Viện Y tế Quốc gia [31-33]. Nhờ sự phát triển của các điện cực, phép đo oxy và carbon dioxide máu động mạch đã được đơn giản hóa rất nhiều.
Mặc dù dạng tắc nghẽn thở ra là đặc trưng trên test MVV đã được mô tả rõ ràng vào những năm 1930 nhưng thực hiện test này trong thực tế lại rất khó khăn do làm cho bệnh nhân mệt và khó chuẩn hóa. Phân tích phế dung đồ thở ra gắng sức trong một lần thở được Tiffeneau giới thiệu vào 1947 ở Pháp [34] và sau đó được Gaensler phổ biến ở Hoa Kỳ năm 1951 [35] có lẽ có hiệu quả thực tế nhiều hơn tất cả các cách thử nghiệm khác vì có thể dễ dàng áp dụng ở các cơ sở y tế ít chuyên khoa. Trong vòng một vài năm sau đó, MVV đã không còn được sử dụng, thay vào đó tỷ lệ FEV1/VC (hoặc FVC) (còn gọi là chỉ số Tiffeneau hoặc Gaensler) được xác nhận như là tiêu chuẩn, đơn giản trong chẩn đoán và theo dõi tiến triển các bệnh phổi tắc nghẽn.
Vào những năm 50 thế kỷ XX, trong một giai đoạn tập trung vào các bệnh truyền nhiễm và bệnh nghề nghiệp, cùng với những tiến bộ về thăm dò chức năng hô hấp, các nhà khoa học-y học đã ngày càng chú ý nhiều tới tình trạng suy giảm chức năng hô hấp tắc nghẽn. Lúc này ở Anh, tình trạng tắc nghẽn thông khí (obstructive ventilatory impairment) chủ yếu được chẩn đoán là “viêm phế quản mạn tính” trong khi ở Mỹ, thường được chẩn đoán là “khí phế thũng”. Tính tương đồng và khác biệt giữa “viêm phế quản mạn tính” và “khí phế thũng” đã được tranh luận rộng rãi.
Hai cuộc họp có tính bước ngoặt là Hội nghị chuyên đề khách mời CIBA vào tháng 9 năm 1958 [36,37] và Ủy ban tiêu chuẩn chẩn đoán của Hiệp hội Lồng ngực Hoa Kỳ (ATS) năm 1962 đã xác định các thành phần của COPD, là nền tảng cho các định nghĩa của chúng ta ngày nay [38]. ATS đã định nghĩa viêm phế quản mạn tính bằng một thuật ngữ lâm sàng bao gồm ho mạn tính kéo dài ít nhất ba tháng trong ít nhất hai năm. Ngược lại, ATS xác định khí phế thũng bằng một thuật ngữ có tính mô-giải phẫu học là mở rộng khoảng phế nang và mất cấu trúc vách phế nang. Cả hai định nghĩa đều không sử dụng bất kỳ tiêu chí sinh lý nào. Trong khi hen được mô tả là tình trạng tăng đáp ứng của đường thở với nhiều kích thích khác nhau và viêm phế quản dạng hen (asthmatic bronchitis) được xem như là một tình trạng chồng lấp (overlapping condition) [38]. Sau này, nhiều nỗ lực khác nhằm định nghĩa COPD đã không cải thiện được các định nghĩa cơ bản này, ngoại trừ việc COPD hiện nay được định nghĩa theo thuật ngữ chức năng. Trước khi COPD được xem là chữ viết tắt cho thuật ngữ được chấp thuận là Bệnh phổi tắc nghẽn mạn tính (chronic obstructive pulmonary disease) cũng đã có nhiều thuật ngữ được đề xuất như bệnh phổi-phế quản tắc nghẽn mạn tính (chronic obstructive bronchopulmonary disease), tắc nghẽn luồng khí thở mạn tính (chronic airflow obstruction), hạn chế luồng khí thở mạn tính (chronic airflow limitation), bệnh phổi tắc nghẽn mạn tính (chronic obstructive lung disease), bệnh phổi mạn tính không đặc hiệu (nonspecific chronic pulmonary disease), hội chứng phổi tắc nghẽn lan tỏa (diffuse obstructive pulmonary syndrome). William Briscoe được cho là người đầu tiên sử dụng thuật ngữ COPD trong cuộc thảo luận tại Hội nghị Khí phế thũng Aspen lần thứ 9 (năm 1965). Thuật ngữ này đã được xác lập và ngày nay chúng ta gọi COPD như là tên gọi của một vấn đề sức khỏe đang ngày càng gia tăng gánh nặng [39].
ĐỊNH NGHĨA COPD
Hội nghị Ciba được tổ chức năm 1958 với mục tiêu thống nhất thuật ngữ định nghĩa, phân loại để làm cơ sở cho các nghiên cứu tiếp theo [37] nhưng phải tới năm 1986, Hội lồng ngực Hoa Kỳ (ATS) [40] với thuật ngữ COPD (Chronic obstructive pulmonary disease) mới đưa ra định nghĩa khái niệm này. Theo đó, COPD được định nghĩa lại là một bệnh đặc trưng bằng rối loạn chức năng đường thở xa và gây ra tắc nghẽn luồng khí không hồi phục. Ba loại bệnh hợp thành trong COPD là khí phế thũng, viêm phế quản mạn tính và bệnh đường thở ngoại vi (peripheral airways disease). Ở thời điểm này, theo ATS, COPD không gồm các bệnh dãn phế quản, xơ hóa nang (cystic fibrosis) và có ý phân biệt COPD với hen [40]. Tuy nhiên khái niệm COPD cũng không thể loại trừ hen được. Với hen, thông thường đó là các trường hợp khởi phát muộn, không xác định được dị nguyên cụ thể và cơ địa dị ứng, còn gọi là hen nội sinh vì có nhiều trường hợp COPD có đặc điểm triệu chứng giống hen (asthma-like) và ngay cả bệnh nhân COPD cũng có những trường hợp biểu hiện tăng phản ứng phế quản, tăng bạch cầu ái toan trong đờm và tăng IgE [41]. Do vậy, thêm một khái niệm mới cũng đã được đề xuất “Hen và COPD chồng lấp” (“asthma-COPD overlap”, ACO) vào năm 2009 [42] và đến 2015 GOLD và GINA (Global Initiative for Asthma) phối hợp soạn tài liệu hướng dẫn cho ACO [43]. Tuy nhiên, thuật ngữ ACO cũng có nhiều ý kiến không chấp nhận [44-46]. Đến năm 1995 ATS [47] và ERS [48] mới có những tài liệu chính thức viết về COPD. Đây có lẽ là nền tảng khoa học làm tiền đề cho các ấn bản có tầm quốc tế về sau. Cả hai tài liệu nói trên đều cho rằng chăm sóc COPD với đa hình thức và rất thay đổi nên cần có một dạng tài liệu hướng dẫn “sống” (a “live” modular document), được cập nhật liên tục trên nền tảng web [49].
Cũng phải 40 năm sau hội nghị Ciba, đến năm 1998 cộng đồng khoa học quốc tế trong chuyên ngành hô hấp mới bắt đầu tập trung dưới sự khuyến khích của Viện Tim Phổi và Máu quốc gia Hoa Kỳ (NHLBI) và Tổ chức y tế thế giới (WHO) khởi động thành lập một nhóm chuyên gia (think tank) xây dựng và phát triển tài liệu Khởi động toàn cầu đối với bệnh phổi tắc nghẽn mạn tính (Global Initiative for Chronic Obstructive Lung Disease) mà sau này tài liệu từ hoạt động này được biết dưới tên gọi phổ biến là GOLD [50]. Sau 3 năm hoạt động dưới hình thức hội thảo chuyên đề (workshop 19982000) tài liệu GOLD phiên bản đầu tiên công bố dưới dạng một biên bản đồng thuận dưới tên gọi là “Chiến lược Toàn cầu về Chẩn đoán, Quản lý và Phòng ngừa COPD” vào năm 2001. GOLD xác định mục tiêu là thu hút sự chú ý nhiều hơn đến việc quản lý và phòng ngừa COPD mà trong đó mục tiêu quan trọng là nâng cao nhận thức về COPD [51]. Tài liệu hay còn gọi là chiến lược GOLD, được cập nhật hàng năm và sửa đổi mỗi 5 năm bởi một ủy ban khoa học và điều hành. Tài liệu GOLD cũng rất phổ biến ở Việt Nam và là tài liệu tham khảo chính trong thực hành và biên soạn tài liệu về COPD. Các định nghĩa COPD trong tài liệu này cũng được thay đổi trong các phiên bản cập nhật và sửa đổi. Nếu theo dõi các phiên bản GOLD, chúng ta dễ dàng nhận thấy y học đang cố gắng và ngày càng tiệm cận bản chất bệnh học của COPD và các định nghĩa được đề xuất không chỉ hướng tới nhận diện vấn đề COPD dưới góc độ sinh bệnh học mà còn nhằm cải thiện chất lượng thực hành chăm sóc bệnh nhân và phòng bệnh (bảng 1.1).
Bảng 1.1. Định nghĩa COPD từ tài liệu GOLD, qua các lần sửa đổi (revised) và phiên bản cập nhật 2023
| Phiên bản GOLD | Định nghĩa | Lý giải định nghĩa từ góc độ sinh bệnh học |
| 2001 [52] | COPD là một tình trạng bệnh được đặc trưng bởi sự hạn chế luồng không khí không thể đảo ngược hoàn toàn. Giới hạn luồng khí thường tiến triển và liên quan đến phản ứng viêm bất thường của phổi đối với các hạt hoặc khí độc hại | Hạn chế luồng khí thở không đảo ngược hoàn toàn.
Hạn chế luồng khí thở tiến triển. Hạn chế luồng khí thở liên quan tới phản ứng viêm của phổi. Căn nguyên là khí, bụi độc hại với phổi. |
| 2006 [53] | COPD là một bệnh có thể phòng ngừa và điều trị được với một số tác động ngoài phổi đáng kể có thể góp phần làm trầm trọng thêm ở từng bệnh nhân. Thành phần phổi của bệnh được đặc trưng bởi giới hạn luồng khí | Hạn chế luồng khí không đảo ngược hoàn toàn.
Hạn chế luồng khí tiến triển. Hạn chế luồng khí liên quan tới phản ứng viêm của phổi. |
| không thể đảo ngược hoàn toàn. Sự hạn chế luồng khí thường tiến triển và liên quan đến phản ứng viêm bất thường của phổi đối với các hạt hoặc khí độc hại. | Căn nguyên là khí, bụi độc hại với phổi.
Có tác động ngoài phổi. |
|
| 2011 [54] | COPD là một bệnh thông
thường có thể phòng ngừa và điều trị được, đặc trưng bởi sự hạn chế luồng khí dai dẳng, thường tiến triển và liên quan đến gia tăng phản ứng viêm mạn tính đường thở và phổi đối với các hạt hoặc khí độc hại. Các đợt cấp và bệnh đi kèm góp phần vào mức độ nghiêm trọng chung ở từng bệnh nhân |
Hạn chế luồng khí tiến triển.
Hạn chế luồng khí liên quan tới phản ứng viêm mạn tính của đường thở và phổi. Căn nguyên là khí, bụi độc hại với phổi. Có tác động xấu đi từ các đợt cấp. |
| 2017 [55] | COPD là một bệnh phổ biến, có thể phòng và điều trị được. Bệnh đặc trưng bằng các triệu chứng hô hấp và hạn chế luồng khí dai dẳng gây ra do các bất thường đường thở và/hoặc phế nang thông thường do phơi nhiễm với các hạt và khí thở độc hại | Hạn chế luồng khí dai dẳng.
Hạn chế luồng khí liên quan tới các bất thường của đường thở và/hoặc phổi. Căn nguyên là khí, bụi độc hại với phổi. |
| 2023 [56] | COPD là một tình trạng bệnh phổi (lung condition) không đồng nhất (heterogenous) đặc trưng bởi các triệu chứng hô hấp mạn tính (khó thở, ho, đàm và/hoặc các đợt cấp) gây ra do các bất thường đường thở (viêm phế quản, viêm tiểu phế quản) và/hoặc phế nang (khí phế thũng) tạo ra tình trạng nghẽn đường thở, tồn tại dai dẳng và thường tiến triển | Tình trạng bệnh lý không đồng nhất.
Tắc nghẽn đường thở dai dẳng và thường tiến triển. Tắc nghẽn đường thở liên quan tới các bất thường của đường thở và/hoặc phổi. |
Từ bảng 1.1 cho thấy phiên bản 2001 nhấn mạnh phản ứng viêm dưới tác động của ô nhiễm khí thở gây tắc nghẽn luồng khí không đảo ngược (khác với hen). Tới 2006, GOLD nhấn mạnh hơn vào bản chất viêm và lưu ý tới tình trạng viêm toàn thân (ngoài phổi) và giữa phổi với tình trạng viêm toàn thân có sự tác động qua lại làm nặng thêm tình trạng bệnh. Năm 2011, GOLD ghi nhận có hai hình thái tổn thương là ở đường thở và/hoặc ở phế nang và lưu ý vai trò của đợt cấp trong tiến trình của COPD. Từ 2017, định nghĩa bệnh COPD của GOLD không còn quá chú ý tới các đặc tính bệnh học mà chỉ ghi nhận bất thường (abnornalities) trong khi muốn nhấn mạnh tới triệu chứng và chức năng hô hấp. Định nghĩa năm 2023 của GOLD lại quay lại nhấn mạnh bản chất bệnh học trong COPD là không đồng nhất bên cạnh đó rất chi tiết các triệu chứng lâm sàng hô hấp trong đó có các đợt cấp.
Có thể nhận định để có một ý niệm cơ bản về bệnh lý trong COPD là không đơn giản do khó tách bạch giữa các triệu chứng lâm sàng, chức năng vốn không đặc hiệu cho một bệnh lý mạn tính nào. Hơn nữa, mối liên quan nhân quả giữa bệnh với phơi nhiễm thuốc lá hay khói bụi độc hại không hoàn toàn đồng nhất nên có thể nói khuynh hướng định nghĩa trong các phiên bản GOLD đi từ mô tả mang tính học thuật tới nhận xét có tính khái quát trên cơ sở tập trung dần sự lưu ý vào thực hành giải quyết triệu chứng và phòng bệnh. Rất cần chú ý ngay từ phiên bản đầu tiên, GOLD xác định COPD là bệnh (disease) thì tới năm 2023 COPD được xem là một tình trạng phổi (lung condition) không đồng nhất. Bên cạnh đó, thuật ngữ “viêm” cũng không được viết trong phiên bản 2017 và về sau.
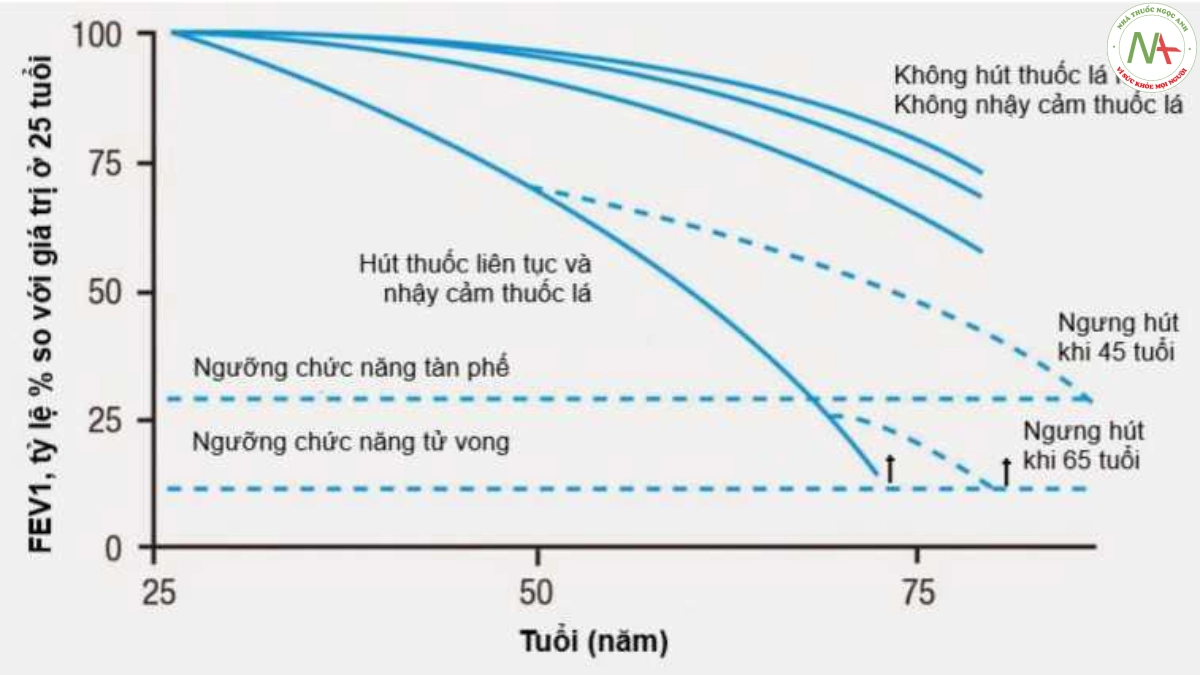
Công trình nghiên cứu của Fletcher và Peto vào cuối những năm 1970 đã củng cố vai trò của phép đo phế dung trong chẩn đoán và quản lý COPD, tạo cơ sở cho sự hiểu biết hiện tại của chúng ta về COPD như một bệnh suy giảm chức năng phổi tiến triển liên quan đến hút thuốc lá [57,58]. Họ cũng giới thiệu “sơ đồ Fletcher – Peto” nổi tiếng về sự suy giảm FEV1 theo thời gian [59,60] (hình 1.3). Dựa trên những phát hiện của Fletcher và Peto, Burrows và các đồng nghiệp đã chỉ ra rằng sự suy giảm FEV1 cũng là một yếu tố dự báo mạnh mẽ về tỷ lệ tử vong trong 10 năm ở bệnh nhân COPD [61,62]. Giá trị của phép đo phế dung trong chẩn đoán COPD được hỗ trợ thêm bởi nghiên cứu NHANES III (National health and nutrition examination survey, Hoa Kỳ 1988-1994) [63]. Dựa trên dữ liệu từ nghiên cứu này, tình trạng tắc nghẽn thể hiện trên phép đo phế dung được xác định bằng giảm tỷ lệ FEV1/FVC <70% (hoặc <85% ở người 5-18 tuổi) [64].
Các hướng dẫn COPD quốc tế hiện nay yêu cầu đo phế dung để chẩn đoán COPD ở những bệnh nhân có các triệu chứng và/hoặc yếu tố nguy cơ phù hợp và tán thành việc sử dụng đo phế dung trong tiên lượng COPD thông qua chỉ số BODE (Chỉ số khối cơ thể, Tắc nghẽn luồng khí, Khó thở và Khả năng gắng sức, BMI, airflow Obstruction, Dyspnea and Exercise) [65]. Tuy nhiên, giá trị của phép đo phế dung để theo dõi tình trạng bệnh còn gây tranh cãi [66]. Một khía cạnh mà kết quả giá trị của phế dung không được đánh giá cao trong nghiên cứu ban đầu của Fletcher và Peto là họ đã chứng minh sự không đồng nhất đáng kể trong việc giảm FEV1 theo thời gian ở những người hút thuốc lá, cho thấy rằng không phải tất cả bệnh nhân mắc COPD đều tuân theo đường cong Fletcher-Peto [58]. Đồng thời, mở rộng dựa trên những phát hiện này, nghiên cứu cũng cho thấy rằng chỉ có khoảng một nửa số người trưởng thành mắc COPD có FEV1 giảm dần theo thời gian, rằng các triệu chứng lâm sàng thường không tương quan với phép đo phế dung và vẫn không có bằng chứng mạnh mẽ nào ủng hộ việc sử dụng đo phế dung định kỳ để quản lý COPD ổn định [60,68-70].
Bảng 1.2. Định nghĩa chức năng hô hấp COPD theo biên bản đồng thuận ERS, NICE và tài liệu GOLD (Nguồn trích dẫn: Lennart Nathell et al. COPD diagnosis related to different guidelines and spirometry techniques. Respiratory Research 2007, 8:89)
| FEV1/(VC hoặc FVC) | FEV1 | Lưu ý | |
| ERS [48] | <88% dự đoán vớinam
<89% dự đoán với nữ |
Chỉ sử dụng để phân loại giai đoạn | |
| GOLD [52] | <70% giá trị tuyệt đối | Chỉ sử dụng để phân loại giai đoạn | Giá trị sau thuốc dãn phế quản |
| NICE [71] | <70% giá trị tuyệt đối | <80% giá trị dự đoán |
Viết tắt: ERS: European Respiratory Society; NICE: National Institute for Health and Care Excellence, GOLD: Global Initiative for Chronic Obstructive Lung Disease
Các định nghĩa và khuyến cáo sử dụng giá trị chức năng từ đo phế dung để xác định COPD có từ tuyên bố đồng thuận của ERS năm 1995 [48], hướng dẫn GOLD năm 2001 [52] và hướng dẫn của NICE năm 2004 [71] (bảng 1.2). Trong hướng dẫn của NICE, FEV1 <80% giá trị dự đoán là cần thiết để chẩn đoán COPD. Để đáp ứng định nghĩa về COPD theo hướng dẫn của ERS, FEV1/VC phải <88% (nam) hoặc <89% (nữ) giá trị dự đoán trong khi tỷ lệ FEV1/VC <0,7 là bắt buộc trong các khuyến cáo của NICE và GOLD. Hướng dẫn NICE và GOLD chỉ sử dụng FVC trong khi FVC và SVC (dung tích sống thở chậm, slow vital capacity) tốt nhất được sử dụng trong khuyến cáo của ERS. Các tiêu chuẩn ATS/ERS được xuất bản năm 2004 [52] cũng giống với các hướng dẫn của GOLD.
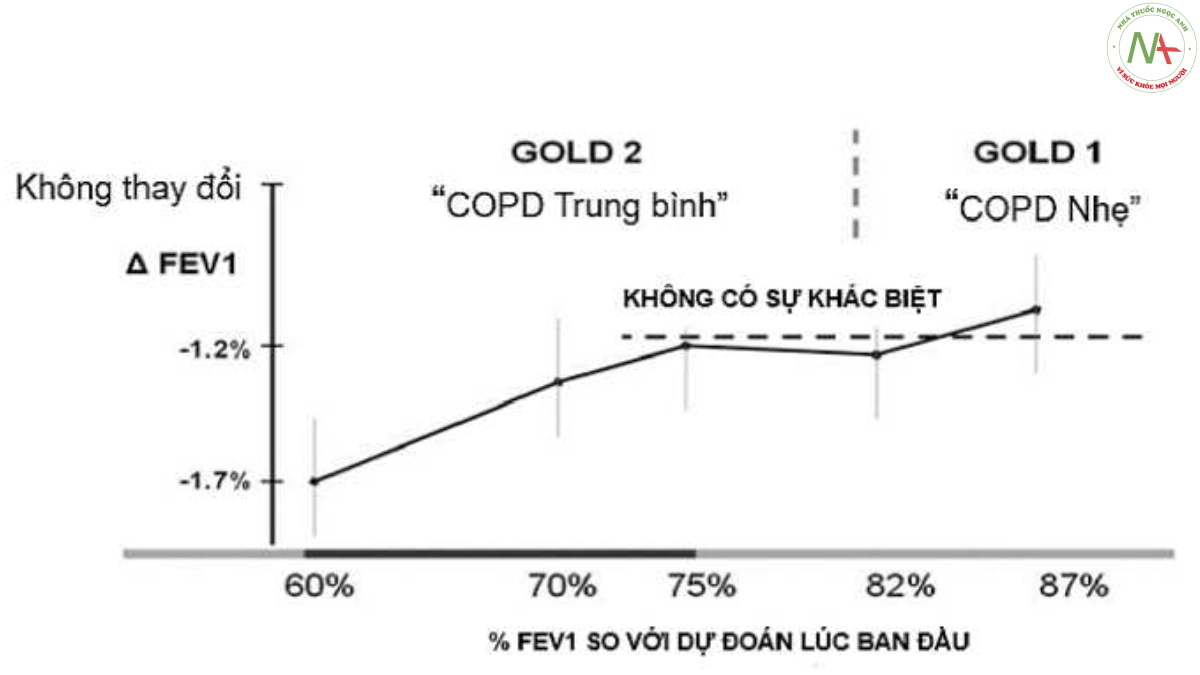
Các điểm cắt tỷ lệ FEV1/FVC (thí dụ <70% theo NICE và GOLD) để chẩn đoán COPD mặc dù được áp dụng khá rộng rãi nhưng không phải không còn nhiều ý kiến tranh luận và cho rằng không nên sử dụng điểm cắt của tỷ lệ này để chẩn đoán COPD. Trong một bài viết đăng trên tạp chí American College of Chest Physicians năm 2010 Enright P và cs phản biện rằng nên bỏ việc sử dụng tỷ lệ FEV1/FVC <70% trong thực hành chẩn đoán COPD [72]. Mặc dù cả ERS, NICE và GOLD đều khuyến cáo sử dụng tỷ lệ FEV1/FVC cho chẩn đoán, tuy nhiên điểm cắt chẩn đoán vẫn không thống nhất được (bảng 1.2). Enright P và cs trong bài viết trên cho rằng không nên chỉ vì nó “đơn giản” để chấp nhận hậu quả là quá nhiều người bị chẩn đoán sai và điều trị không cần thiết. Và rằng không nên so sánh với việc xét nghiệm định lượng đường huyết và đo huyết áp để chẩn đoán vì các ngưỡng này được duy trì dao động trong khoảng hẹp và được một hệ thống sinh lý kiểm soát, trong khi giá trị FEV1/FVC thì không như vậy, không có ngưỡng lý tưởng bình thường cho tỷ lệ FEV1/FVC [72]. Rất nhiều nghiên cứu đo chức năng hô hấp cộng đồng bằng phế dung kế ghi nhận trên 50% người khỏe mạnh, không hút thuốc lá cũng có giảm EFV1/FVC theo tuổi ở cả giới nam và giới nữ [73-75]. Trong một nghiên cứu sức khỏe phổi cộng đồng tiến cứu, ngẫu nhiên ở Bắc Mỹ [76] cho thấy phần lớn những người hút thuốc có FEV1/FVC <70% và FEV1 trong khoảng từ 70% đến 90% sau đó không bị suy giảm chức năng phổi nhanh chóng sau 5 năm theo dõi, mặc dù vẫn tiếp tục hút thuốc (hình 1.4).
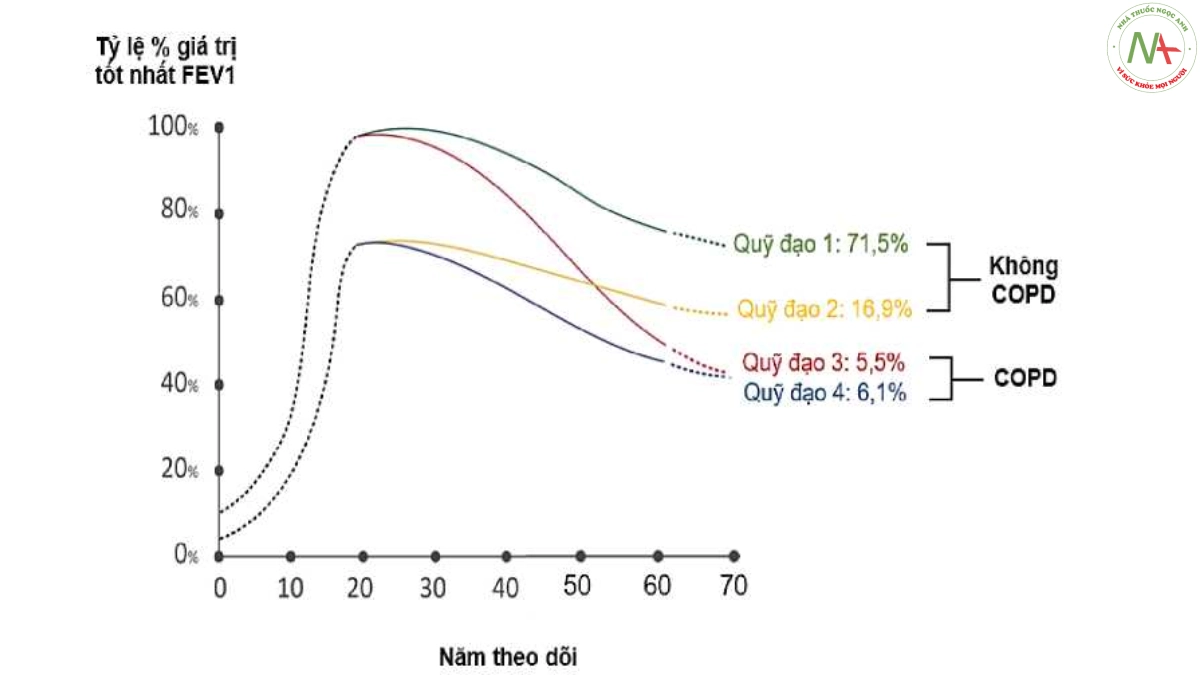
Sinh bệnh học của COPD rất phức tạp, nguyên nhân chính dẫn đến căn bệnh này là khói thuốc lá có vai trò quan trọng ở các quốc gia công nghiệp hóa và ô nhiễm không khí có vai trò quan trọng ở các nước đang phát triển [77]. Ý nghĩa của các sự cố sức khỏe ở giai đoạn đầu đời trong cơ chế bệnh sinh của COPD đang bắt đầu được công nhận. Hai quá trình chính dẫn đến COPD là: (i) Suy giảm nhanh chức năng phổi ở tuổi trưởng thành và (ii) Phổi kém phát triển trong thời thơ ấu [78]. Trong khi hầu hết bệnh nhân COPD có bệnh nhẹ (thể tích thở ra gắng sức trong 1 giây (FEV1) >80% dự đoán với tỷ lệ FEV1/dung tích sống gắng sức (FVC) <70%) nhưng nhiều bệnh nhân trong số này đã có triệu chứng [79] và có tốc độ giảm FEV1 nhanh nhất [79].
Vậy, nên xem COPD là bệnh (disease) hay là một hội chứng (syndrome) của nhiều bệnh?. Theo Scadding [80], bệnh có thể được xác định bởi bốn thành tố như sau: 1) Có mô tả lâm sàng (triệu chứng), 2) Có mô tả rối loạn cấu trúc (giải phẫu bệnh), 3) Có mô tả rối loạn chức năng (sinh lý bệnh) và 4) Xác định được bệnh nguyên (aetiology). Thoạt nhìn, thuật ngữ COPD đáp ứng tất cả. Đầu tiên, nó là một hội chứng, được xác định bởi sự hiện diện của một số triệu chứng chính (khó thở, ho và khạc đờm) [55]. Thứ hai, đây là một bệnh lý đặc trưng, bao gồm cả việc tái tạo (remodeling) bất thường cấu trúc đường dẫn khí (thu hẹp lòng, tăng kích thước các tuyến niêm mạc, thâm nhiễm tế bào vào đường thở nhỏ và đường thở lớn, và sự lắng đọng thực sự của mô sợi quanh phế quản), phá hủy nhu mô (khí phế thũng) và tổn thương các mạch chịu trách nhiệm tưới máu [81]. Thứ ba, sự có mặt của giới hạn luồng khí kém hồi phục, được đo bằng tỷ lệ FEV1/FVC, là một đặc điểm sinh lý bệnh cốt lõi của định nghĩa COPD hiện tại [55]. Cuối cùng, các nghiên cứu dịch tễ học và lâm sàng đã chỉ ra rằng COPD có các tác nhân gây bệnh khác nhau, bao gồm bất thường di truyền (ví dụ: thiếu hụt al- antitrypsin), khói thuốc lá, tiếp xúc với nhiên liệu sinh khối, tiền sử nhiễm trùng phổi, tiền sử hen và phổi phát triển bất thường [55].
Các nghiên cứu dân số đã cho thấy có một tỷ lệ các trường hợp được chẩn đoán COPD bằng phép đo phế dung nhưng không xác định được tác nhân gây bệnh [82,83]. Từ các kết quả nghiên cứu cho thấy việc cần phải đặt lại câu hỏi về khái niệm COPD truyền thống này. Ví dụ, một số người có đủ các triệu chứng tương tự, nếu không muốn nói là giống hệt với triệu chứng của bệnh nhân COPD (bao gồm cả các đợt “đợt cấp”) nhưng không có phế dung ký bất thường [84,85]. Tương tự như vậy, trước khi chụp cắt lớp vi tính (CT) ra đời, chỉ có kiểm tra cơ thể bệnh cẩn thận mới có thể phát hiện được sự hiện diện của khí phế thũng, nhưng hiện nay CT có thể xác định và định lượng, in vivo và không xâm lấn, những thay đổi cấu trúc của khí phế thũng và/hoặc sự hiện diện bất thường đường thở trên những người không có giới hạn luồng khí [86,87]. Do đó, dường như “đặc điểm định nghĩa” của COPD (hạn chế luồng khí) không phải lúc nào cũng đi kèm với sự hiện diện “đặc trưng” của các triệu chứng và/hoặc mô bệnh học của bệnh. Định nghĩa về bệnh đã được sử dụng trong một khái niệm thu hẹp đồng nghĩa với hút thuốc lá đã tạo ra một mức độ nhầm lẫn không nên có vì nhiều người mắc hội chứng hô hấp này chưa bao giờ hút thuốc [70,82,83,88]. Khi không xác định được thật chính xác căn nguyên gây bệnh cũng khó có thể nói đây là bệnh có thể phòng và điều trị được. Trong một bài báo gần đây William Z. Zhang và cs đăng trên American Journal of Respiratory and Critical Care Medicine năm 2020 với tựa đề “The Origins of Chronic Obstructive Pulmonary Disease: Sometimes the Journey Matters More than the Destination” tạm dịch trong ngữ cảnh này là “Định nghĩa COPD: hiệu quả hơn là tên gọi” [89]. Bài báo kết thúc bằng cách nhấn mạnh tầm quan trọng của việc hiểu được căn nguyên ban đầu của COPD đối với các chiến lược phòng ngừa, chẩn đoán và điều trị hơn là muốn có ngay một tên gọi thỏa đáng. Chúng ta cần hiểu “COPD” là một thuật ngữ gộp (“umbrella”) để từ đó xác định định nghĩa với mục tiêu có thể định hướng cho việc điều trị. Với phân tích như vậy, chúng ta không nên hiểu COPD là một bệnh (disease) mà là một nhóm bệnh (diseases, COPDs) như một số tác giả đề nghị [90-92]. Với ý niệm COPD là một thuật ngữ chung cho các thực thể lâm sàng khác nhau do nhiều nguyên nhân dẫn đến hạn chế luồng khí không thể đảo ngược hoàn toàn [55,88,93,94] thì tốt hơn hết, COPD nên được coi là một hội chứng lâm sàng đặc trưng bởi các triệu chứng hô hấp mạn tính, bất thường về cấu trúc phổi (bệnh đường thở, khí phế thũng, hoặc cả hai), suy giảm chức năng phổi (chủ yếu là hạn chế luồng khí khó hồi phục), hoặc bất kỳ sự kết hợp nào của những điều này [91]. Bệnh nhân COPD có nguy cơ cao hơn bệnh nhân không có COPD phát triển các bệnh đồng mắc và có kết cục xấu hơn, bao gồm cả tử vong [95,96].
KIỂU HÌNH (PHENOTYPE) VÀ XEM LẠI ĐỊNH NGHĨA TRONG COPD
Như đã phân tích ở trên, với định nghĩa COPD như là một tình trạng bệnh phổi (theo GOLD) hay là hội chứng, chúng ta đều hiểu rằng COPD là một bệnh đa hình thái cơ chế và biểu hiện lâm sàng có tác động tới nhiều cơ quan (multisystemic disease). Y văn về COPD trong khoảng 2 thập niên trở lại đây có sử dụng thuật ngữ kiểu hình (hay phenotype) thể hiện tính đa dạng triệu chứng hay nói một cách khác, COPD có thể chia thành các phân nhóm có tính riêng biệt tương đối về triệu chứng, diễn biến, tiên lượng và điều trị [97]. Trong một bài viết (trên American journal of respiratory and critical care medicine năm 2010), các tác giả cho rằng phenotype trong COPD là cách nhìn tương lai trong bệnh lý này [98] do nó mở ra một cách tiếp cận chẩn đoán và điều trị bệnh nhân linh hoạt theo đặc thù bệnh học và tình trạng của người bệnh.
Định nghĩa “kiểu hình” (một thuật ngữ di truyền học có nghĩa là tập hợp các tính chất, đặc điểm quan sát được của một sinh vật) được xem như là biểu hiện lâm sàng hoặc đặc tính sinh hóa, là kết quả của sự tương tác giữa kiểu gen và môi trường [99]. Thêm vào đó, định nghĩa kiểu hình nêu rõ rằng một kiểu hình phải là một phân nhóm có tác động lớn đến tiên lượng (các triệu chứng, đợt cấp, đáp ứng với điều trị, tốc độ tiến triển của bệnh hoặc tử vong) [97]. Người đầu tiên có ý tưởng khái niệm hóa các loại kiểu hình khác nhau trong COPD là Snider, vào năm 1989. Với sơ đồ Venn không theo tỷ lệ [100] phân nhóm cổ điển của COPD đã được giới thiệu: Viêm phế quản mạn tính, khí phế thũng và hen trong ba vòng tròn chồng lên nhau. Những nhóm bệnh nhân đó được biết là bị tắc nghẽn đường thở liên tục. Khái niệm đó đã được đưa vào hướng dẫn COPD năm 1995 của Hiệp hội Lồng ngực Hoa Kỳ (ATS) [101]. Trong những năm sau khi khái niệm đó được đề xuất, một số nghiên cứu đã chỉ ra rằng sự chồng chéo chắc chắn là có ý nghĩa và hiểu biết về cơ chế bệnh sinh cũng như các đặc điểm lâm sàng đã dần được mở rộng theo thời gian. Thí dụ trong hen, nhiều giả thuyết nhận định rằng có thể chia hen thành nhiều phân nhóm khác nhau về cơ chế sinh bệnh (hay gọi là “kiểu cơ chế bệnh học”, pathogenic mechanisms, endotype) [102]. Tương tự, các kiểu hình khí phế thũng, viêm phế quản mạn tính cũng được phân tích thành các phân nhóm kiểu cơ chế bệnh học. Sau một nghiên cứu xác định kết cục đại diện bằng theo dõi dọc trong 3 năm (Longitudinally to Identify Predictive Surrogate Endpoints, ECLIPSE), các tác giả nhận thấy mặc dù đợt cấp tăng dần theo mức độ nặng của bệnh nhưng dường như mức độ xuất hiện đợt cấp phản ánh một kiểu hình độc lập, kiểu hình nhậy cảm với đợt cấp hay kiểu hình nhiều đợt cấp [103]. Gần đây, Alexandru Corlateanu và cs (năm 2020) trong một bài tổng quan đã tập hợp các dạng kiểu hình (được nhiều chấp nhận và mới được đề xuất) trong COPD với các định nghĩa cụ thể [99] (bảng 1.3).
Bảng 1.3. Kiểu hình COPD và định nghĩa (Nguồn trích dẫn: Alexandru Corlateanu et al. Chronic obstructive pulmonary disease and phenotypes: a state-of-the-art. Pulmonol. 2020;26(2):95-100).
| Kiểu hình COPD | Định nghĩa |
| Kiểu hình được nhiều chấp nhận | |
| Viêm phế quản mạn tính | Ho đờm hơn 3 tháng mỗi năm trong hai năm hoặc nhiều hơn liên tiếp |
| Khí phế thũng | Hiện diện của khí phế thũng xác nhận trên hình ảnh học |
| Hen và COPD chồng lấp (ACO) | Hạn chế luồng khí dai dẳng kết hợp một số triệu chứng thường có trong hen với một số triệu chứng thường có trong COPD (thường là hen ở người hút thuốc) |
| COPD nhiều đợt cấp | Có nhiều đợt cấp (1 hoặc nhiều hơn mỗi năm) |
| COPD không nhiều đợt cấp | Có ít đợt cấp (không hoặc chỉ 1 mỗi năm) |
| Kiểu hình mới được đề xuất | |
| Kiểu hình suy mòn do bệnh phổi (Pulmonary cachexia phenotype) | Body Mass Index <21 kg/m2 |
| Kiểu hình COPD chồng lấp với dãn phế quản | Có chẩn đoán xác định COPD và dãn phế quản xác nhận trên hình ảnh CT phân giải cao (Hrct) |
| Kiểu hình COPD khí phế thũng ưu thế ở thùy trên | Kết quả CT xác nhận khí phế thũng ưu thế ở thùy trên |
| Kiểu hình giảm nhanh chức năng phổi | Giảm nhanh chức năng phổi |
| Kiểu hình nhiều bệnh đồng mắc hay kiểu hình toàn thân | Nhiều bệnh đồng mắc, nhất là bệnh tim mạch và chuyển hóa |
| Kiểu hình thiếu hụt al-antitrypsin | Tình trạng di truyền gây ra do thiếu hụt a1- antitrypsin |
| Kiểu hình COPD không hút thuốc lá | COPD do khói từ đốt sinh khối (biomass) |
Đề cập tới kiểu hình và tiếp cận điều trị theo kiểu hình là sự thống nhất trong trong các tài liệu hướng dẫn hiện nay. Tài liệu của Tây Ban Nha (GesEPOC năm 2012) được xem là tài liệu đầu tiên đề xuất khuynh hướng này [104]. Tuy nhiên, năm 2016, Marc Miravitlles và cs trong một tổng quan về các tài liệu hướng dẫn quốc gia châu Âu và Nga [105] cho thấy giữa các tài liệu có sự khác nhau về cách đánh giá kiểu hình. Với thời gian là 7 năm mà bài tổng quan xem xét, sự khác biệt này giữa các tài liệu có thể đã cho thấy quá trình nhận thức của chúng ta về kiểu hình thay đổi theo thời gian. Trong khi các kiểu hình COPD cổ điển viêm phế quản mạn tính và khí phế thũng đã được công nhận trong các hướng dẫn của Cộng hòa Séc, Anh và xứ Wales, Ba Lan, Nga, Tây Ban Nha và Thụy Điển (chỉ viêm phế quản) thì trong GOLD 2019, COPD được phân nhóm thành A, B, C, D theo mức độ triệu chứng (nhất là khó thở) và đợt cấp. Trong tài liệu này của GOLD, bạch cầu ái toan máu cũng được xem là chỉ số đánh giá để quyết định điều trị corticosteroid dạng hít hay không [106]. Điều này cũng cho thấy COPD là một bệnh rất phức tạp. Nỗ lực xác định các phân nhóm hoặc kiểu hình là một thách thức. Siafakas và cs đề xuất một số phương thức điều trị bằng cách xác định kiểu hình của bệnh nhân trước khi bắt đầu điều trị, nhưng cũng nhận thấy còn thiếu các nghiên cứu cụm (cluster study) đủ mạnh để chứng minh [107]. Có lẽ trong tương lai, hướng tìm các dấu ấn sinh học (biomarker) sẽ giúp cho công việc của các thầy thuốc lâm sàng dễ dàng hơn trong việc xác định phenotype [99].
Rõ ràng là trong y học nói chung và trong COPD, định nghĩa và phân loại bệnh chuẩn xác, cho phép chúng ta suy nghĩ, nói và viết về các hiện tượng quan sát được một cách dễ hiểu và thống nhất [108], từ đó tiếp cận thực hành sẽ thuận lợi và chính xác. Trong COPD, nhìn lại, chúng ta thấy định nghĩa còn đang được làm sáng tỏ theo thời gian. Với COPD, mặc dù đã qua nhiều thập kỷ nghiên cứu về sinh bệnh học và điều trị, cộng đồng y tế đã thất bại trong việc giảm tỷ lệ mắc bệnh và tử vong tương tự như ở mức độ đã đạt được trong các bệnh không lây nhiễm chính khác (chẳng hạn như bệnh động mạch vành, đột quỵ và một số bệnh ác tính [109,110]. Nhiều yếu tố có thể giải thích cho điều này trong đó bao gồm cả bản chất phức tạp của bệnh lý COPD với các tác động không đồng nhất lên đường thở, mạch máu phổi và nhu mô phổi, cũng như tác động của các đợt cấp. Tuy nhiên, hạn chế quan trọng có thể xuất phát từ định nghĩa và phân loại COPD hiện tại là không xác định được rối loạn ở giai đoạn đầu, trước khi giới hạn luồng khí trở nên rõ ràng. Nếu cho rằng COPD là một thực thể bệnh riêng biệt, do thuốc lá gây ra thì sẽ không đánh giá được hết vai trò của các nguyên nhân khác gây ra COPD và dẫn đến cùng một bất thường về chức năng hoặc sinh lý. Trong khi đó, mỗi người khi được sinh ra là sản phẩm của bộ gen thừa hưởng từ cha mẹ của họ và sự tương tác của nó với môi trường theo thời gian sẽ tạo ra các phản ứng không giống nhau, điều này hoàn toàn có thể suy diễn trong COPD khi có thể gặp ngay cả trên người trẻ.
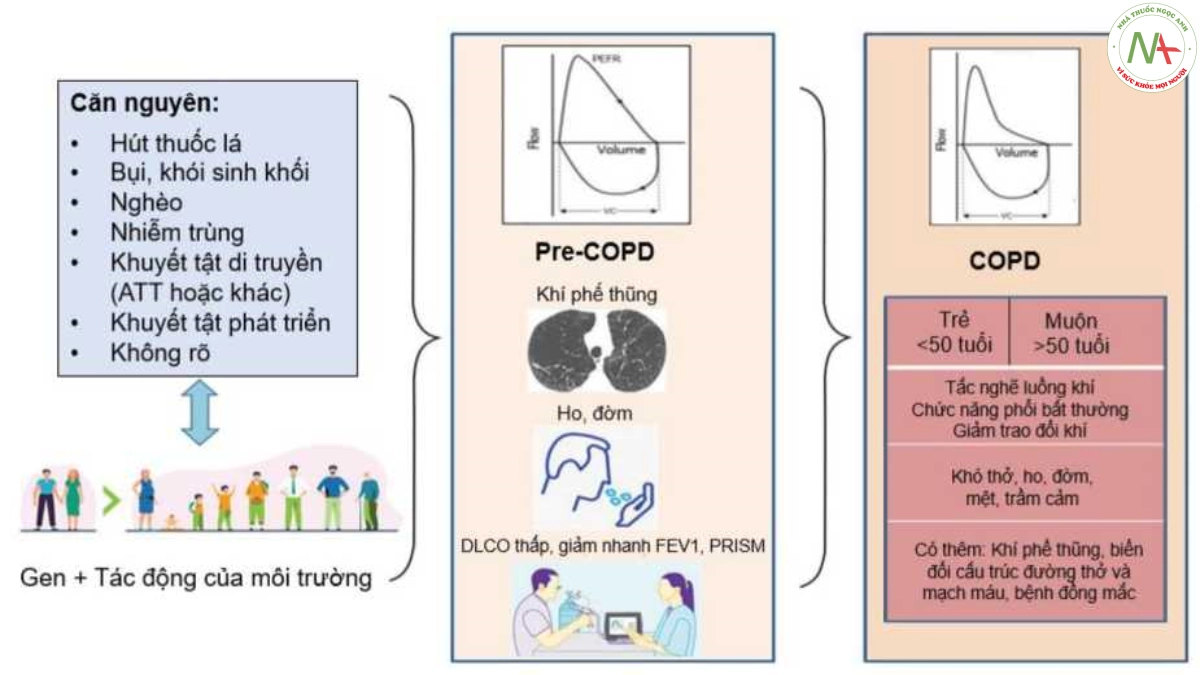
Để định nghĩa COPD, ý niệm đầu tiên cần thống nhất là COPD không chỉ do hút thuốc lá mà còn do các nguyên nhân khác, chẳng hạn như phơi nhiễm khói sinh khối [111114], nghèo đói [115], nhiễm trùng (như bệnh lao) [94,116-118] hoặc thậm chí hen [119-125]. COPD do các nguyên nhân khác nhau tiến triển theo các kiểu khác nhau so với COPD cổ điển liên quan đến hút thuốc lá [108]. Sự ra đời của các phương tiện khám xét mới, chẳng hạn như CT ngực, đã cung cấp bằng chứng cho thấy các bất thường về cấu trúc phổi có thể được phát hiện khi không có giới hạn luồng khí [126] và thuật ngữ tiền COPD (pre-COPD) đã được đề xuất để mô tả những những trường hợp này [91,127]. Tương tự, một người khi khảo sát CT cho thấy có khí phế thũng nhưng đo phế dung có kết quả bình thường, một người có triệu chứng hô hấp cùng với đo phế dung có kết quả giảm FEV1 nhưng tỷ lệ FEV1/FVC >70% (preserved ratio impaired spirometry, PRISM) nên được chẩn đoán và điều trị như thế nào ?, nhất là đã có chứng minh các biểu hiện này làm tăng nguy cơ dẫn tới các kết cục (outcome) xấu [128-130]. Thêm nữa, những sự cố sức khỏe xảy ra trong thời kỳ mang thai, trong thời thơ ấu và lúc còn trẻ có tác động tới sự phát triển của phổi dẫn tới hạn chế luồng khí có được xem là COPD hay không ? [131-133]. Tất cả những điều này đang đòi hỏi có một định nghĩa và phân loại COPD đầy đủ từ đó sẽ giúp phát triển các phương pháp điều trị làm cải thiện quỹ đạo suy giảm chứng năng trong phần đời còn lại [134].
Trong một bài viết với nhan đề: “Đã tới lúc sửa đổi định nghĩa và danh pháp COPD” (Definition and Nomenclature of Chronic Obstructive pulmonary Disease: Time for Its Revision) [108] Bartolome Celli và cs năm đã đề nghị đưa các khái niệm gen (COPD-G), sự phát triển không bình thường của phổi (COPD-D), tác động của môi trường (thí dụ khói thuốc lá COPD-C, bụi và khói sinh khối COPD-P), hen (COPD-A) và các nguyên nhân hỗn hợp hay còn chưa biết (COPD-M, COPD-U) vào định nghĩa COPD. Những đề nghị này cũng đã được GOLD [56] đề cập trong nội dung các căn nguyên COPD và điều này có thể hiểu đây là nhận thức mà từ đó GOLD 2023 đã thay đổi định nghĩa khi nhấn mạnh bản chất đa dạng của một tình trạng bệnh lý phổi (heterogeneous lung condition) mà không còn đề cập tới các thuật ngữ “bệnh”, “phòng và điều trị được” hay “viêm” như trong các định nghĩa trước nữa (bảng 1.1).
Có nên thay đổi chữ viết tắt COPD hay không là câu hỏi mà Bartolome Celli và cs đặt ra trong tài liệu đã nói ở trên [108]. Thuật ngữ COPD hiện đã được các tổ chức y tế lớn trên thế giới công nhận [135] và được chấp nhận trong các tài liệu y khoa, bao gồm cả Mã hóa bệnh tật quốc tế (ICD) [136]. Để có và thống nhất một từ viết tắt mới là bắt đầu lại con đường mà chúng ta đã mất nhiều thời gian và công sức để theo đuổi. Giữ nguyên thuật ngữ COPD nhưng điều chỉnh ý nghĩa của nó để bao gồm kiến thức mở rộng về căn bệnh này sẽ giúp đạt được các mục tiêu cụ thể và quản lý bệnh nhân tốt hơn [108]. Một định nghĩa cập nhật có thể hữu ích (và cần thiết) vì nó mở rộng phạm vi bao gồm những người có bất thường về cấu trúc hoặc chức năng phổi bất thường, những người tại thời điểm tiếp xúc có thể chưa đạt đến ngưỡng chẩn đoán hô hấp ký đối với COPD nhưng có khả năng tăng nguy cơ phát triển giới hạn luồng khí mạn tính [91,92,127], do đó cho phép thực hiện các can thiệp phòng ngừa và điều trị sớm hơn trên những đối tượng này.
Hiện tại, chẩn đoán COPD yêu cầu phải có sự hiện diện của giới hạn luồng khí không thể đảo ngược hoàn toàn với FEV1/FVC <0,7, vì các giá trị dưới ngưỡng này có liên quan đến kết quả xấu [137,138]. Tuy nhiên, do một số triệu chứng có thể ghi nhận được, những thay đổi về cấu trúc và những bất thường về chức năng phổi có thể xảy ra trước khi đạt tới bất kỳ ngưỡng hạn chế luồng khí nào (arbitrary threshold) [130,139,140], nên có thể lưu ý thêm các tiêu chuẩn chẩn đoán cho các giai đoạn tiền COPD nhằm nâng cao nhận thức và tác động tới các trường hợp này trong một bức tranh tổng thể xử trí COPD. Các thuật ngữ liên quan tới tiền COPD đã được đề cập tới trong GOLD 2022 [141] gồm: COPD sớm (Early COPD), COPD nhẹ (Mild COPD), COPD ở người trẻ (COPD in young people), tiền COPD (Pre-COPD).
COPD hình thành là kết quả của sự giảm nhanh chóng chức năng phổi theo thời gian. Tuy nhiên, một người có chức năng phổi bình thường thấp, chỉ với tốc độ giảm chức năng hô hấp bình thường cũng có thể dẫn tới COPD theo định nghĩa chức năng. Năm 2015, để hiểu được quỹ đạo (trajectory) FEV1 hình thành COPD Lange và cs [70] nhận xét trên 657 người có giá trị FEV1 ban đầu <80% giá trị dự đoán ở tuổi <40 thì có 26% trở thành COPD sau 22 năm theo dõi, trong khi trên 2.207 người có giá trị FEV1 ban đầu >80% giá trị dự đoán ở tuổi <40 có 7% trở thành COPD (p<0,001). Mặc dù hút thuốc lá như nhau, những người bị COPD từ giá trị FEV1 ban đầu bình thường lúc <40 tuổi có tốc độ giảm FEV1 là 53±21 ml/năm trong khi những người bị COPD từ giá trị FEV1 ban đầu thấp lúc <40 tuổi có tốc độ giảm FEV1 là 27±18 ml/năm (p<0,001). Điều này cho thấy giảm nhanh FEV1 không phải là yếu tố bắt buộc hình thành COPD và chức năng hô hấp thấp ở tuổi trường thành là yếu tố nguy cơ hình thành COPD. Có đa dạng tốc độ giảm FEV1 do sự tương tác phức tạp của gen với sự phơi nhiễm môi trường và các yếu tố rủi ro trong suốt cuộc đời một cá thể (hình 1.5)
Để hiểu về việc giảm FEV1 sớm hay muộn có dẫn tới COPD và tác động tới đợt cấp và tử vong hay không, năm 2020 Jacob Louis Marott và cs [142], trên cơ sở dữ liệu có được từ 1.170 thanh niên đăng ký tham gia nghiên cứu tim mạch ở thành phố Copenhagen trong những năm 1970 và 1980, đã thực hiện phân tích cách dẫn tới COPD từ quỹ đạo FEV1 tối đa bình thường và từ quỹ đạo FEV1 tối đa thấp. Các tác giả nhận thấy những người bị COPD phát triển thông qua quỹ đạo FEV1 tối đa bình thường có liên quan đến việc tăng nguy cơ mắc bệnh hô hấp và tử vong do mọi nguyên nhân so với những người COPD phát triển thông qua quỹ đạo FEV1 tối đa thấp. Điều này cho thấy định nghĩa COPD, nếu muốn gắn với hình ảnh bệnh học, không thể chỉ hiểu đơn giản thông qua hiện tượng hạn chế luồng khí đo bằng giá trị FEV1.
Viết tắt: AAT: alpha-1-antitrypsin deficiency; PRISM: preserved ratio impaired spirometry). (Nguồn trích dẫn: Bartolomé Celli et al. Definition and Nomenclature of Chronic Obstructive Pulmonary Disease: Time for Its Revision. Am J Respir Crit Care Med Vol 206, Iss 11, pp. 1317-1325, Dec 1, 2022).
NGUYÊN TẮC ĐIỀU TRỊ
CHẨN ĐOÁN VÀ TÁC ĐỘNG CỦA ĐỢT CẤP COPD
Lịch sử tự nhiên của COPD được nhấn mạnh bởi các giai đoạn giật cấp, trong đó bệnh nhân có các triệu chứng gia tăng và sử dụng nhiều nguồn lực chăm sóc sức khỏe hơn. Các triệu chứng phổ biến của AECOPD bao gồm tăng sản xuất đờm. ho và khó thở do tăng viêm đường thở, nút nhầy và bẫy khí [1, 2]. Các đợt cấp của COPD có liên quan đến tỷ lệ tử vong là 10% trong bệnh viện, 43% sau 1 năm và 50% trong 5 năm tiếp theo [3 5], Bản thân các đợt cấp có liên quan đến sự suy giảm từng bước chức năng phối và chất lượng cuộc sống giảm sút [6]. Các tác nhân thường được xác định nhất đối với AECOPD là vi rút đường hô hấp. đặc biệt là vi rút Rhinovirus, cũng như vi khuẩn gây bệnh và tiếp xúc với môi trường.
NIPPV
NIPPV được chỉ định trong trường hợp suy hô hấp cấp thứ phát sau đợt cấp COPD [7. 8]. Mục tiêu của NIPPV trong bối cảnh này là giảm công thở. cải thiện thông khí, điều chỉnh tình trạng tăng CO2 máu và ngăn ngừa việc đặt nội khí quản. NIPPV tránh được nhiều nguy cơ của thông khí xâm nhập (qua ống nội khí quản), bao gồm nguy cơ hít sặc, tụt huyết áp hoặc chấn thương khi soi thanh quan và đặt ống nội khí quản. Ngoái ra. NIPPV bảo vệ đường thở, có thế làm giảm nguy cơ viêm phổi liên quan đến máy thở và thường không cần dùng thuốc an thần. Độ bão hòa oxy mục tiêu trong đợt cấp COPD là 88 92%, có liên quan đến tỉ lệ tử vong thấp hơn so với hỗ trợ oxy không chuẩn độ [9].
NIPPV làm giảm tỷ lệ tử vong khi nhập viện trong đợt cấp COPD, thêm vào đó nó cũng giảm nhu cầu đặt nội khí quản và thời gian nằm viện [8, 10]. NIPPV cũng đã được chứng minh là làm giảm tần số hô hấp và cải thiện tình trạng nhiễm toan hô hấp [11] .
Các cài đặt điển hình cho NIPPV trong đợt cấp COPD là bilevel positive pressure support, với áp lực hít vào được đặt ở 8 -12 cmH2O và áp lực thở ra được đặt ở 3-5 cm H2O. Giao diện mặt nạ Oronasal (che miệng và mũi) thường được sử dụng do những lợi ích đã biết về thông số sinh lý và tính khả dụng rộng rãi. Nếu không được dung nạp, mặt nạ mũi hoặc đệm mũi có thể thoải mái hơn. với lưu ý rằng chúng thường có rò rỉ khí lớn hơn [12, 13]. Các giao diện mới hơn bao gồm các thiết bị Helmet có thể có thêm lợi ích, bao gồm sự thoải mái của bệnh nhân và khả năng uống trong khi được thông khí áp lực dương, nhưng không được sử dụng rộng rãi vào thời điểm này [14].
Các chi định và chống chỉ định tuyệt đối với NIPPV được liệt kê dưới đây. Bệnh não do suy hô hấp tăng CO2 không phải là chống chỉ định, nhưng cần theo dõi bệnh nhân thường xuyên đi đảm bảo cải thiện tình trạng tri giác và tình trạng toan hô hấp trong những giờ đầu [15].
“Thất bại NIPPV” được mô tả tốt hơn với sự tiến triển hoặc thiếu cải thiện của suy hô hấp mặc dù đang NIPPV, thường dẫn đến thở máy xâm nhập (IMV) [16]. Khoảng 30% bệnh nhân AECOPD được điều trị bàng NIPPV thuộc loại này [17]. NIPPV thất bại có liên quan đến tỷ lệ tử vong cao. Tỷ lệ tử vong được báo cáo dao động từ 13,5% trong ICU đến 60,2% và cao hơn tỷ lệ tử vong của những người ban đầu được đưa vào IMV [17, 18].
THUỐC GIÃN PHẾ QUẢN
Thuốc giãn phế quản dạng hít là phương pháp điều trị chính trong đợt cấp COPD. Thuốc chủ vận beta tác dụng ngắn (ví dụ, albuterol) đã được chứng minh là thuốc giãn phế quản tác dụng nhanh và đáng tin cậy. Không có sự khác biệt nào về hiệu quả giữa thuốc chủ vận beta tác dụng ngắn và thuốc kháng cholinergic dược cung cấp qua máy khi dừng hoặc bình xịt định liều (MDI) [19], mặc dù máy phun khí dung có thể được ưu tiên sử dụng nếu bệnh nhân suy hô hấp vả không thể tạo ra áp lực hít vào năm cần thiết để phân phối thuốc MDl tối ưu. Nair và cộng sự. không tìm thấy sự khác biệt về đáp ứng giãn phế quản tối đa giữa liều 2,5mg / 3mL và 5 mg / 3 mL albuterol khí dung trong đợt cấp COPD [20].
Thuốc kháng cholinergic dạng hít tác dụng ngẩn (ví dụ: ipratropium bromide) thường được sử dụng cùng với liệu pháp chủ vận beta dạng hít [7], Dữ liệu được trộn lẫn xem liệu sự kết hợp của thuốc kháng cholinergic và chất chủ vận beta có tạo ra giãn phế quán vượt quá mức đơn độc hay không [21,22].
Không khuyến cáo sử dụng tiêm tĩnh mạch methylxanthine hoặc thuốc chủ vận beta để điều trị đợt cấp COPD.
GLUCOCORTICOID
Tất cả bệnh nhân nhập viện điều trị AECOPD nên dùng glucocorticoid toàn thân. Liệu pháp này cải thiện chức năng phổi, giảm tỷ lệ thất bại trong điều trị, cải thiện các triệu chứng và giảm thời gian lưu trú [23, 24]. Một đánh giá có hệ thống đã thiết lập rằng mười bệnh nhân sẽ cần dược điều trị bằng corticosteroid toàn thân để ngăn ngừa một lần điều trị thất bại [25]. Corticosteroid tiêm tĩnh mạch không có lợi thế hơn liệu pháp uống, trừ khi bệnh nhân không thể dung nạp thuốc uống [26, 27]. Nên ngừng uống steroid sau 5 ngày nếu bệnh nhân đã cải thiện vẽ mặt lâm sàng.
Trong một thử nghiệm ngẫu nhiên có đối chứng duy nhất, liệu trình prednisone đường uống kéo dài 5 ngày trong AECOPD cho thấy hiệu quả không thua kém so với liệu trình 14 ngày [28].
Liều lượng lý lường của corticosteroid trong đợt cấp COPD vẫn chưa được biết rõ. Các hướng dẫn GOLD khuyến cáo liều tương đương 40 mg prednisone một lần mỗi ngày [7]. Các chiến lược liều dùng đã được công bố từ 40 mg prednisone một lần mỗi ngày đến 125mg methylprednisolone đến bốn lần một ngày [7, 27,29]. Steroid toàn thân, đặc biệt ở liều cao hơn, có liên quan đến tăng đường huyết [30].
KHÁNG SINH
Mặc dù không phải tất cả các đợt cấp COPD đều do vi khuẩn gây bệnh, nhưng kháng sinh được khuyến cáo cho tất cả các bệnh nhân có đợt cấp từ trung bình đến nặng, bao gồm tất cả các bệnh nhân cần nhập viện [7]. Thuốc kháng sinh đã được chứng minh là làm giảm thất bại điều trị trong các đợt cấp nặng [31].
Một số nỗ lực đã được thực hiện để xác định các nhóm phụ có thể được hưởng lợi từ kháng sinh: ví dụ, những bệnh nhân có đờm mủ, tăng protein phản ứng c (CRP) hoặc procalcitonin. Đờm mủ có thể liên quan đến nhiễm vi khuẩn, nhưng lợi ích lâm sàng của kháng sinh chưa được xác định một cách khá quan ở nhóm này [32, 33]. Clark và cộng sự. cho thấy CRP tăng cao không phân biệt một cách đáng tin cậy giữa các bệnh nhiễm trùng do vi rút và vi khuẩn nên không có ích trong việc hướng dẫn quyết định sử dụng kháng sinh [34]. Procalcitonin là một dấu ấn sinh học đầy hứa hẹn, có thể giúp phân biệt nhiễm trùng do vi khuẩn và vi rút [35]. Sử dụng kháng sinh có hướng dẫn của procalcitonin có kết quả tương tự nhưng ít sử dụng kháng sinh hơn trong AECOPD [35] Tuy nhiên, dữ liệu gần đây bao gồm bệnh nhân bị viêm phổi hoặc AECOPD là không thể lặp lại phát hiện này [36].
Sự lựa chọn kháng sinh cho đợt cấp COPD phái phản ánh kháng sinh đồ tụi chờ và mô hình kháng thuốc. Thời gian điển hình là 5 ngày [7], có hiệu quả điều trị tương tự với liệu trình 7 và 10 ngày [37].
CAI THUỐC LÁ
Mặc dù không phải là phương pháp điều trị đợt cấp. việc cai thuốc lá cần được chú ý ở những bệnh nhân hút thuốc lá và đến cơ sở chăm sóc sức khỏe có các triệu chứng cấp tính. Cai thuốc lá có thể làm giảm 1/3 lần xuất đợt cấp COPD [5].
Một số liệu pháp hiệu quả có sẵn có thể thúc đẩy việc kiêng hút thuốc kéo dài, mặc dù vậy sự kết hợp giữa dược trị liệu với điều chỉnh hành vi là có bằng chứng mạnh mẽ nhất [38].
ĐƯỜNG VIỀN BẰNG CHỨNG
LOẠI BỎ CARBON DIOXIDE NGOÀI CƠ THỂ
Loại bỏ carbon dioxide ngoài cơ thể (ECCO2R) đề cập đến việc loại bỏ carbon dioxide (CO2) khỏi máu thông qua thiết bị trao đổi khí ngoài cơ thể. Quá trình này, được khám phá ban đầu cho hội chứng suy hô hấp cấp (ARDS), có thể là một phần của quá trình oxy hóa màng ngoài cơ thể qua tĩnh mạch (VV) thông thường (ECMO) hoặc ECMO qua động mạch (AV) [39], Tuy nhiên, gần đây, các vòng mạch lưu lượng thấp hơn chỉ 0,3-1 L/phút là được đề xuất cho mục đích loại bỏ CO2, đặc biệt trong AECOPD để bổ sung NIPPV và ngăn ngừa nhu cầu đặt nội khí quản [39, 40]. Một phân tích hồi cứu so sánh 21 bệnh nhân COPD không cái thiện với N1PPV và sau đó được đặt nội khí quản với 21 bệnh nhân được điều trị bằng thiết bị hỗ trợ phối ngoài cơ thể [PECLA]. Không có sự khác biệt nào được ghi nhận trong ICU hoặc thời gian nằm viện, mặc dù những người được điều trị bằng PECLA đã giảm PCO2, cải thiện pH và không cần dùng thuốc an thần, cho phép họ ăn, tập thể dục và giao tiếp [41].
Những tác giả khác đã đánh giá ECCO2R như một công cụ để tạo điều kiện rút nội khí quản ở bệnh nhân AECOPD với một số thành công, mặc dù với số lượng rất nhỏ; n = 5 và n = 20, tương ứng [42, 43]. Các nghiên cứu nhóm khác đã được công bố với những lợi ích tương tự, nhưng đã báo cáo các biến chứng chảy máu đáng kể [44, 45]. Một nghiên cứu tổng hợp gần đây kết luận rằng ECCO2R đối với AECOPD vẫn còn đang thử nghiệm, ghi nhận cả lợi ích tiềm năng nhưng cũng có nguy cơ biến chứng nghiêm trọng [46]. Không có thử nghiệm ngẫu nhiên tiềm năng nào về chủ đề này đã được công bố, mặc dù một số thứ nghiệm đang được tiến hành [40].
AECOPD VÀ HUYẾT KHỐI TẮC MẠCH
Tỷ lệ thuyên tắc phổi (PE) cao trong bối cảnh AECOPD không rõ, dao động từ 16-25% [47-49]. Một đánh giá hệ thống gần đây bao gồm 880 bệnh nhân cho thấy tỷ lệ hiện mắc là 16,1 %, với phần lớn các cục máu đông nằm ở các động mạch gần chứ không phải ớ các động mạch nhánh hạ phân thùy [49]. Trong phân tích này, bệnh nhân PE và AECOPD có thời gian nằm viện lâu hơn và tỷ lệ tử vong cao hơn.
Mối liên hệ cơ học giữa AECOPD và bệnh huyết khối tắc mạch vẫn chưa rõ ràng tại thời điểm này, và không có mối liên hệ nhân quả nào được thiết lập giữa PE và AECOPD. Các bác sĩ lâm sàng nên duy trì mức độ cảnh giác cao đối với bệnh huyết khối tắc mạch khi chăm sóc bệnh nhân AECOPD vì mối liên quan dã biệt và ý nghĩa đối với việc xử trí, đặc biệt là nhu cầu kháng đông.
| Indications for NIPPV | |
| Respiratory acidosis | pH < 7.35 with elevated PCO2 |
| Respiratory distress | Noted accessory muscle use or signs of muscle fatigue |
| Severe dyspnea | Subjective report or validated scale (NRS, YAS) |
| Absolute contraindications for NIPPV |
| Patient is unable to tolerate |
| Respiratory or cardiac arrest |
| Diminished level of consciousness not explained by hypercapnia |
| Inability to handle respiratory secretions |
| High risk for aspiration (e.g…SBO) |
| Facial deformity preventing adequate seal |
CA LÂM SÀNG
Một bệnh nhân nam 73 tuổi, hút thuốc 50 gói/ năm, tiền sử bệnh phổi tắc nghẽn mãn tính (COPD) được thở oxy tại nhà và bệnh cơ tim thiếu máu cục bộ, bệnh nhân trực đưa đến khoa cấp cứu (ED) trong tình trạng khó thở. BS ghi nhận 1 tuần khó thở tiến triển khi gắng sức và ho ngày càng nhiều kèm theo đờm mủ. Anh ta phủ nhận tình trạng sốt, ớn lạnh, ho ra máu. khó thở kịch phát về đêm và phù 2 chi dưới. Anh ấy đã sử dụng thuốc giãn phế quản dạng hít vài lần mỗi ngày và đã tăng tốc độ dòng oxy bổ sung lên 4 lít/phút mà không có cải thiện đáng kể. Vào buổi sáng nhập viện, anh ấy khó thở, khó thở khi nghỉ ngơi. Thăm khám ghi nhận: không sốt, nhịp tim nhanh 110 nhịp/phút và tăng huyết áp lên đến 178/90 mmHg; Anh ta có tần số thở là 36 lần / phút và độ bão hòa oxy 85% với oxy cannula 4 lít phút. Một KHĐM được thực hiện trong khi thở oxy cho thấy: pH 7,24, pCO2 60 mmHg, PO2 55 mmHg. Trong thăm khám ghi nhận: anh ấy tỉnh táo, trong tình trạng đau nhẹ. sử dụng các cơ hô hấp phụ để hít vào và thở ra. Ngoài ra ghi nhận khắc đáng chú ý là nhịp tim nhanh, thở khò khè lan toả cuối kỳ thở ra hai bên và không có ran. X quang ngực cho thấy căng phồng phổi mà không có hình mờ khu trú.
CÂU HỎI
Phương pháp tiếp cận ngay lập tức với bệnh nhân suy hô hấp cấp tăng CO2 máu là gì?
TRẢ LỜI
Thông khí áp lực dương không xâm lấn.
Thông khí áp lực dương không xâm nhập (NIPPV) là phương pháp hỗ trợ thông khí được ưa chuộng ở bệnh nhân suy hô hấp cấp thứ phát sau đợt cấp COPD (AECOPD). Bệnh nhân này được điều trị với bilevel NIPPV với áp lực hít vào là 12 cmH2O và áp lực thở ra là 5 cmH20 với nồng độ oxy là 50% qua mặt nạ mũi miệng. Độ bão hòa oxy của anh ấy được duy trì từ 88 đến 92%. Anh ta được cho 500 mg azithromycin tiêm tĩnh mạch và 60 mg methylprednisolon tiêm tĩnh mạch. Trong vòng vài giờ, nhịp hô hấp của anh ấy đã giảm xuống còn 22 lần/phút và anh ấy có vẻ thoải mái với việc cải thiện trong khí máu động mạch của mình.
Phân tích một số case lâm sàng khác:
Ca 1
Nam 66 tuổi có tiền sử bệnh phổi tắc nghẽn mạn tính tới khoa cấp cứu do khó thở tăng dần và thở rít trong vài ngày gần đây. Bệnh nhân cũng có ho có đờm, đờm nhầy nhưng không sốt và đau ngực. Tiền sử y tế bao gồm tăng huyết áp và tăng mỡ máu. Bệnh nhân hút thuố’c lá 35 năm và bỏ được 5 năm nay. Thân nhiệt 37.1 độ C, huyết áp 130/80 mmHg, mạch 114 lần/phút và không đều. SPO2 86% ở khí phòng. Thăm khám thấy rố’i loạn hô hấp nhẹ, ran rít hai bên và tiếng tim mờ. Điện tâm đồ thấy mạch nhanh phức bộ hẹp không đều với 3 hình dạng sóng P khác nhau và khoảng PR thay đổi. Điện giải bình thường. Bước điều trị tiếp theo phù hợp nhất ở bệnh nhân này là?
- Dùng thuốc chống rối loạn nhịp để chuyển thành nhịp xoang thường.
- Thuốc chống đông và thuốc chẹn kênh Canxi.
- Theo dõi để điều trị cơn COPD.
- Kiểm soát tần số và dùng chẹn Beta không chọn lọc.
- Siêu âm tim qua thực quản và chuyển nhịp.
Đáp án đúng là C: Điện tâm đồ của bệnh nhân phù hợp với nhịp nhanh nhĩ đa ổ (Multifocal atrial tachycardia – MAT), MAT là rối loạn nhịp nhanh trên thất xảy ra do dẫn truyền bất thường tại tâm nhĩ gây ra bởi các yếu tố như phì đại tâm nhĩ phải, tiết catecholamine (Nhiễm khuẩn) hoặc rối loạn điện giải. Nó thường gặp ở người già trong đợt cấp của bệnh phổi tắc nghẽn mãn tính (COPD), bệnh nhân thường có triệu chứng (ho, thở khò khè, khó thở) và mạch nhanh thì tự nó thường không gây ra triệu chứng (có thể có đánh trống ngực).
Thăm khám tim ở bn MAT thấy mạch không đều và mạch nhanh. Chẩn đoán dựa trên ECG thấy có >= 3 hình dạng sóng P, khoảng RR không đều và tần số nhĩ > 100 l/ph. Điều trị tốt nhất là quản lý phù hợp các triệu chứng đi kèm và thuố’c dùng giãn phế quản, corticosteroid đường toàn thân, hỗ trợ oxy/thông khí ở bệnh nhân có đợt cấp COPD có thể giúp giải quyết được MAT.
| Nhịp nhanh nhĩ đa ổ | |
| Nguyên nhân | -Đợt cấp của bệnh phổi (COPD) -Rối loạn điện giải (giảm kali máu) -Tăng catecholamine (Sepsis) |
| Các biểu hiện lâm sàng | -Thường không có triệu chứng
-Nhịp nhanh, không đều -Điện tâm đồ: >= 3 hình dạng của sóng P, tần số nhĩ > 100 l/ph |
| Điều trị | -Điều chỉnh rố’i loạn
-Chẹn nút AV (Verapamil) nếu nó dai dẳng |
Ý A và E: Mat thường bị nhầm với rung nhĩ, ECG ở cả MAT và rung nhĩ đều thấy RR ko đều, tuy nhiên MAT thấy sóng P nhiều hình dạng còn trong rung nhĩ không thấy sóng P. Các thuốc chống loạn nhịp (Amiodarone) hoặc chuyển nhịp trực tiếp thường được sử dụng ở bệnh nhân có rung nhĩ nhưng không có hiệu quả để chuyển từ MAT sang mạch xoang thường.
Đáp án B: Không như rung nhĩ, MAT không có nguy cơ tạo huyết khối và thuyên tắc do huyết khối nên vì vậy chố’ng đông là không cần thiết.
Đáp án D: Các thuốc kiểm soát nhịp và Chẹn kênh Canxi (Verapamil) hoặc chẹn Beta không chọn lọc (Metoprolol) được chỉ định ở MAT khi mạch nhanh thất dẫn tới thiếu máu cơ tim hoặc suy tim sung huyết hoặc khi rối loạn nhịp kéo dài dù cho đã điều trị các bệnh nền. Chẹn Beta có thể làm hẹp phế quản tăng lên ở bệnh nhân COPD và nên được sử dụng một cách cẩn thận.
Tổng kết: MAT là rối loạn nhịp nhanh trên thất đặc trưng bởi sóng P có >= 3 hình dạng, tần số nhĩ > 100 l/ph và mạch không đều. Nó thường xuất hiện sau rối loạn hô hâp cấp ở bệnh nhân có bệnh phổi mãn. Điều trị nên trực tiếp chỉnh sửa lại các rối loạn có sẵn.
Ca 2
Nam 68 tuổi tới phòng cấp cứu do khó thở tăng dần trong 2 ngày nay. Ông ta có sốt nhẹ, chảy nước mũi, ho có đờm 01 tuần nay. Các vấn đề sức khỏe khác của anh ta bao gồm bệnh mạch vành, tăng mỡ máu. Ông ta nhập viện năm ngoái do nhồi máu cơ tim và được đặt stent ở động mạch liên thất trước. Bệnh nhân hút thuốc lá 40 năm và bỏ sau khi bị nhồi máu cơ tim. Thân nhiệt 37.2 độ C, huyết áp 140/90 mmHg, nhịp thở 22 lần/phút. Bệnh nhân có rối loạn hô hấp nhẹ, ông ta có sử dụng cơ hô hấp phụ nhưng vẫn có thể nói đủ câu. Tĩnh mạch cổ nổi nhẹ, đặc biết khi thở ra. Phổi thấy giảm tiếng thở và ran rít hai bên. Tiếng tim mờ. BNP huyết tương 88 pg/ml (bình thường: 0-100). Xquang ngực thấy:
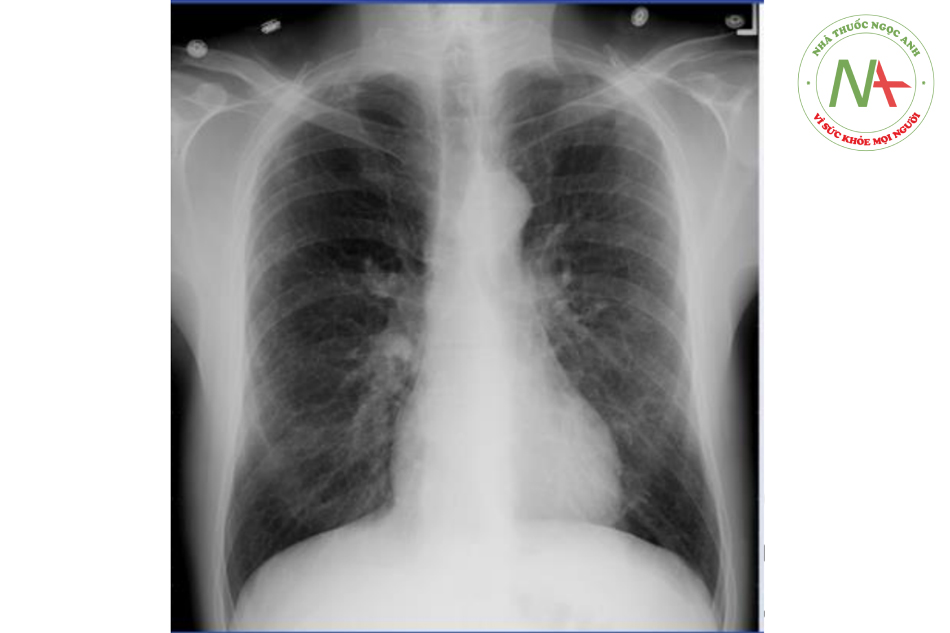
Chẩn đoán có khả năng nhất là gì?
- Đợt cấp của hen phế quản.
- Đợt cấp suy tim mất bù.
- Thuyên tắc phổi cấp.
- Đợt cấp COPD.
- Viêm phổi cộng đồng.
- Chèn ép tim bán cấp.
Đáp án đúng là D: Bệnh nhân này lớn tuổi có tiến sử hút thuốc kéo dài nhiều khả năng mắc COPD chưa được chẩn đoán, biểu hiện của ông ta phù hợp với đợt cấp của COPD, đặc trưng bởi có >=1 các thay đổi sau đây:
- Cường độ hoặc tần suất ho.
- Thể tích hoặc đặc điểm của đờm
- Mức độ khó thở.
Thăm khám thường thấy thở rít, thở nhanh, thở ra kéo dài, sử dụng cơ hô hấp phụ. Có thể thấy tĩnh mạch cổ nổi, đặc biệt trong kì thở ra, do tăng áp lực trong lồng ngực. Có thể thấy hình ảnh ứ khí trên Xquang ngực và giải thích được tiếng tim mờ khi nghe. Nhiễm khuẩn đường hô hấp trên (Upper respiratory infection, URI) là yếu tố khởi phát thường gặp nhất của đợt cấp COPD. Ở bệnh nhân này, URI được gợi ý thông qua tiền sử 1 tuần sốt nhẹ, chảy nước mũi kèm ho có đờm.
Đáp án A: Đợt cấp của cơn hen có thể biểu hiện giống đợt cấp COPD. Tuy nhiên, ở người già kèm tiền sử hút thuốc và không có tiền sử mắc hen thì COPD là nhiều khả năng hơn.
Đáp án B: Suy tim mất bù cấp thường biểu hiện với khó thở, khó thở khi nằm, ho, phù ngoại biên và khó thở kịch phát về đêm. Thăm khám có thể thấy tiếng T3, ran ẩm hai bên với gõ đục và tĩnh mạch cổ nổi. Xquang ngực thấy hình tim to, tràn dịch màng phổi, sung huyết phổi lan tỏa. Tăng BNP có độ nhậy cao với suy tim mất bù và BNP < 100pg/mL (ở bệnh nhân này) có tác dụng loại trừ chẩn đoán.
Đáp án C: Thuyên tắc phổi có thể gây khó thở và thở nhanh. Tuy nhiên, ở bệnh nhân này không có đau ngực kiểu màng phổi hoặc mạch nhanh và thấy ho có đờm, thở khò khè, ứ khí trên Xquang trên nền vừa mắc URI gợi ý nhiều hơn tới đợt cấp COPD.
Đáp án E: Viêm phổi cộng đồng biểu hiện với khó thở, đau ngực kiểu màng phổi, sốt, ho có đờm. Tuy nhiên, thường thấy tiếng thở tăng ở ổ và ran ẩm, Xquang ngực thường thấy đông đặc phế nang.
Đáp án F: Chèn ép tim bán cấp biểu hiện với tụt huyết áp, tiếng tim mờ, và tĩnh mạch cổ nổi. Huyết áp ở bệnh nhân này bình thường ngoài ra hình tim trên xquang ngực không to.
Diễn giải: Đợt cấp của COPD đặc trưng bởi các triệu chứng nặng lên ở bệnh nhân COPD, thường khởi phát bởi nhiễm khuẩn đường hô hấp trên. Thăm khám thấy thở rít, thở nhanh, thở ra kéo dài, và sử dụng cơ hô hấp phụ.
Ca 3
Nam 65 tuổi tới cấp cứu ho và khó thở tăng dần 3 ngày nay. Tiền sử bao gồm COPD, tăng huyết áp, đau cột sốíng thắt lưng. Đánh giá ở phòng cấp cứu thấy rối loạn hô hấp vừa với thở nhanh và sử dụng cơ hô hấp phụ. Nghe phổi thấy ran rít lan tỏa. Bắt đầu dùng thông khí không xâm nhập, kèm thở khi dung giãn phế quản, Glucocorticoid đường toàn thân, kháng sinh theo kinh nghiệm. Tình trạng hô hấp có dấu hiệu cải thiện sau vài giờ, dừng thông khí không xâm nhập. Sáng hôm sau, bệnh nhân trở nên mơ màng. Thân nhiệt 37 độ C, huyết áp 132/86 mmHg, mạch 92 lần/phút, nhịp thở 16 lần/phút, SpO2 96% khi thở oxy mũi 2L/phút. Bệnh nhân có thể vận động chi nhưng không theo chỉ dẫn. Nghe phổi thấy ran rít nhỏ hai bên. Bước theo dõi tiếp theo phù hợp nhất ở bệnh nhân này là gì?
- Khai thác thêm tiền sử sử dụng rượu.
- Khí máu động mạch.
- Chụp CT mạch máu lồng ngực.
- Chụp CT sọ não không cản quang.
- Xét nghiệm ma túy trong nước tiểu.
Đáp án đúng là B: Thay đổi nhận thức là một tình trạng xảy ra trong đợt cấp của COPD được nghi ngờ khi có tăng PaCo2 có triệu chứng và nên được kiểm tra sớm bằng khí máu động mạch. Dù cho thở nhanh, vài bệnh nhân COPD vẫn tăng tích trữ CO2 trong suốt cơn do thở sâu và tăng bất tương hợp V/Q, bệnh nhân này được thở không xâm nhập rất có thể được ngừng quá sớm nên dẫn tới nhiễm toan hô hấp.
Nghi ngờ nhiều tới tăng PaCo2 và nó có thể xảy ra mà không có dấu hiệu giảm Oxi máu. Thực tế, thở oxy có thể kích thích tăng PaCo2 ở vài bệnh nhân COPD do làm tăng bất tương hợp V/Q và giảm sự điều phối hô hấp. Biểu hiện lâm sàng của tăng PaCo2 chủ yếu là thần kinh. Bệnh nhân có tăng PaCO2 từ nhẹ tới vừa, có thể có đau đầu hoặc tăng buồn ngủ, với mức độ CO2 cao hơn (75-80 mmHg) có thể gây lú lẫn, mơ ngủ và thậm chí động kinh hoặc hôn mê.
Đáp án A: Khai thác thêm tiền sử uc>ng rượu là quan trọng với bệnh nhân nghi ngờ có hội chứng cai rượu, tuy nhiên bệnh nhân này không có các dấu hiệu tăng kích thích của hệ thần kinh (mạch nhanh, thở nhanh, kích thích).
Đáp án C: Chụp CT mạch máu ngực có hiệu quả trong chẩn đoán thuyên tắc phổi cấp. Bệnh nhân có thể có sốc tắc nghẽn với lú lẫn do giảm tưới máu não, tuy nhiêu không thấy hạ huyết áp nặng.
Đáp án D: Chụp CT sọ não không chất cản quang được chỉ định để theo dõi đột quỵ, cái có khả năng gây ra mơ ngủ, ngủ gà, lú lẫn. Tuy nhiên, đột quỵ không phù hợp ở bệnh nhân này do có khả năng vận động chi và ở bệnh nhân trong cơn COPD cấp nên được đánh giá PaCo2 trước.
Đáp án E: Nhiễm độc cấp do opioid hoặc benzodiazepine có thể dẫn tới thay đổi trạng thái tinh thần và test ma túy nước tiểu có thể có hiệu quả tronng việc chẩn đoán. Tuy nhiên, nhiễm độc opioid hoặc benzodiazepine ít nghĩ tới do anh ta tỉnh táo và có tiến triển tới mơ ngủ.
Tổng kết: Bệnh nhân đợt cấp của COPD có nguy cơ cao tăng PaCo2. Biểu hiện lâm sàng chủ yếu là thần kinh và bao gồm đau đầu và mơ màng do PaCO2 tăng nhẹ tới vừa, tăng cao hơn (>75-80 mmHg) có thể dẫn tới lú lẫn, mơ màng, ngủ gà và thậm chí hôn mê hay co giật.
Ca 4
Nam 65 tuổi mắc COPD tới cấp cứu do tăng khó thở và ho tăng dần trong 2 ngày qua. Anh ta không thể nghỉ ngơi do gia tăng các triệu chứng. Bệnh tăng lượng đờm so với bình thường. Anh ta cố điều trị bằng albuterol và ipratropium tại nhà nhưng không đỡ. Chức năng hô hấp tháng trước thấy FEV1 60%. Thân nhiệt 37.2 độ C, huyết áp 150/90 mmHg, mạch 110 lần/phút, nhịp thở 23 lần/phút. SpO2 87%. Anh ta xuất hiện rối loạn hô hấp nhẹ. Nghe phổi thấy ran rít hai bên và thở ra kéo dài. ECG thấy mạch nhanh nhĩ. Xquang ngực thấy vòm hoành bằng và không có thâm nhiễm. Cận lâm sàng ban đầu thấy BC 11000. Anh ta bắt đầu thở oxy, giãn phế quản, glucoccorticoid. Điều trị nào sẽ có hiệu quả nhất ở bệnh nhân trong tình trạng cấp tính này?
- Kháng sinh.
- Tập luyện cơ thành ngực.
- Fluticasone khí
- MgSo4.
- Không điều trị gì thêm.
- Roflumilast.
Đáp án đúng là A: Bệnh nhân trên có đợt cấp của COPD với khó thở tăng, ho và có đờm nhiều. Tất cả bệnh nhân đợt cấp COPD nên được dùng giãn phế quản và glucocorticoid toàn thân. Ngoài ra, kháng sinh được chỉ định ở bệnh nhân có:
- Cơn COPD vừa tới nặng (chỉ ra bằng >= 2 tiêu chí ở trên), thường là tăng đờm.
- Thở máy (đặt nội khí quản hoặc thở máy không xâm nhập áp lực dương)
Ở đa số bệnh nhân, điều trị kháng sinh cho thấy tăng tỷ lệ cải thiện các triệu chứng, giảm nguy cơ tăng nặng và giảm nguy cơ phải dùng máy thở.
Trên 50% bệnh nhân đợt cấp COPD do nhiễm khuẩn đường hô hấp, nhưng việc tìm ra nguyên nhân có thể là một thử thách trên lâm sàng. Không khuyến cáo cấy đờm tìm vi khuẩn (trừ khi ở bệnh nhân có nguy cơ nhiễm khuẩn P. aeruginosa) do khó khăn trong phân lập một tác nhân riêng. Vì vậy, điều trị kháng sinh theo kinh nghiệm thường ảnh hưởng trực tiếp tới đường hô hấp trên (H. influenza, M. catarhhalis, S. pneumonia) và bao gồm marcolide (azithromycin), fluroquinon hô hấp (levofloxacin, moxifloxacin) hoặc penicillin/ức chế beta-lactam (amoxicillin-clavulantae). Thường điều trị trong 3-7 ngày.
| Đợt cấp bệnh phổi tắc nghẽn mạn tính | |
| Các triệu chứng chỉ dấu | -Tăng khó thở
-Tăng ho (cả về tần số và mức độ) -Tăng đờm (thay đổi màu sắc hoặc số lượng) |
| Chẩn đoán xác định | -Xquang ngực: Tăng thông khí.
-Khí máu: Giảm oxy máu, tăng trữ Co2 (mạn hoặc cấp) |
| Quản lý | -Hỗ trợ hô hấp (mục tiêu SpO2 88%-92%)
-Giãn phế quản khí dung -Glucocorticoid đường toàn thân -Kháng sinh nếu >=2 triệu chứng chỉ điểm -Oseltamivir nếu có bằng chứng nhiễm cúm -Thở máy không xâm nhập nếu thông khí thất bại -Đặt nội khí quản nếu không thở máy không xâm nhập được hoặc chốíng chỉ định |
Đáp án B: Tập luyện thành ngực các bài tập khác nhằm loại bỏ lượng đờm còn sót lại nhưng nó không cho thấy hiệu quả trong cải thiện khả năng ra viện ở bệnh nhân trong đợt cấp COPD. Tập vận động ngực thường làm ở bệnh nhân giãn phế quản.
Đáp án C: Điều trị bằng ICS được sử dụng trong thời gian dài ở bệnh nhân hen. Bệnh nhân mắc COPD liên quan tới các bệnh khác, các chất giảm cơn và cải thiện triệu chứng không
tác động lên chức năng phổi hoặc tỷ lệ tử vong. Không như glucocorticoid đường toàn thân, ICS không có vai trò trong điều trị cơn COPd tăng nặng.
Đáp án D: Truyền MgSO4 có thể làm giãn phế quản và được sử dụng trong bệnh nhân có cơn hen nặng nguy hiểm tới tính mạng. Tuy nhiên, các nghiên cứu không cho thấy bất kỳ hiệu quả nào của nó trong điều trị cơn COPD cấp.
Đáp án F: Roflumilast là chất ức chế phosphodiesterasa với các chất kháng viêm khác giúp giảm tạo đờm và cải thiện chức năng phổi. Nó có hiệu quả trong điều trị duy trì để giảm các cơn trong tương lai ở bệnh nhân COPD nặng và có tiền sử nhiều cơn, không đc dùng trong đợt cấp.
Tổng kết: Kháng sinh được chỉ định trong điều trị COPD ở bệnh nhân có đợt cấp từ vừa tới nặng và cần thở máy. Kháng sinh không đc chỉ định trong đợt cấp COPD mức độ nhẹ.
KẾT LUẬN
Hiểu biết của chúng ta liên quan đến COPD đã thay đổi đáng kể từ một căn bệnh gần như bị bỏ qua, không thể phòng ngừa và không thể điều trị khi lần đầu tiên được Rene Laennec mô tả là khí phế thũng vào năm 1821 [143] tới nay được xem là một
căn bệnh mà nghiên cứu đã mở ra cơ hội hiểu biết cơ chế bệnh sinh, tác nhân gây bệnh, biểu hiện lâm sàng và liệu pháp điều trị. Chúng ta có đồng ý giữ nguyên thuật ngữ tên gọi và chữ viết tắt COPD hay không, cũng như có đồng ý với những định nghĩa COPD đang được khuyến cáo từ những tài liệu hướng dẫn hiện nay hay không?, tùy thuộc vào hiểu biết của chúng ta về sinh bệnh học COPD và mục tiêu hướng tới hiệu quả của các tác động dự phòng và điều trị. Bất luận danh pháp và định nghĩa như thế nào, bệnh, hội chứng hay là một tình trạng bệnh thì đó cũng phải là tình huống có triệu chứng lâm sàng, được xác định bằng các khám xét khách quan cho thấy có bất thường về chức năng và/hoặc cấu trúc. Chúng ta vẫn chưa dừng lại trong việc nghiên cứu để tăng thêm hiểu biết trước một thách thức y tế không có chiều hướng giảm và đang là gánh nặng quan trọng trong mô hình bệnh tật.
NGUỒN THAM KHẢO
- Wedzicha JA. Svemungal TAR. COPD exacerbations: de lining Lheir cause and prevail ion. Lancet. 2(Ml7,37O<Q5gQ>:7^6 96.
- Amhomsen NR. Miinfreda J, Warren CP. Hersh field ES. I larding CiK, Nelson NA. Antibiotic therapy in exacerbations ur chronic obsiniciivc pulmonary disease. Ann Jniern Med. 1987;I()6<2);196 204,
- Iloogendcom M, Koogcnveen RT. Ru I ten* van Mol ken Mi*. Vcstho J. Fcenstra TL. Clise fatality o f COPD exacerbations: a mcta-analysis and statistical modelling approach. Eur Rcspir J. 2011:37(31:508 15.
- Miillerovti It. Maselli DJ. Locantorc N. Vcstho i. Hurst JR. Wcdzicha JA, cl al. Hospitalized exacerbations o f COl’D: risk factors and outcomes in the ECLIPSE cohort. Chest. 201$; 147(41:999 1007.
- Stoller IK. Clinical practice. Acute exacerbations o f chronic obstructive pulmonary disease. N Engl J Med. 2002;346(I3):988 94.
- Sccmtingal TA. Donaldson GC. Paul EA, Bestall JC, Jeffries DJ. Wcdzicha JA. Effect o f exacerbation on quality of life in patients with chronic obstructive pulmonary disease. Ain J Respir Crit Care Med. I998;IS7($ Pl l):1418-22.
- Global Initiative for Chronic Obstructive Lung Disease Global Strategy for the Diagnosis Management and Prevention o f Chronic Obstructive Pulmonary Disease. 2018:201« Report.
- Wcdzicba JA. Calvcrlcy PMA, Albert RK. cl al. Prevention of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur Rcspir J. 2017:50:1 — 12.1602265 https: //doi. urgf 10.1183/13993003.02265-2016.
- Austin MA. Wills KE. Blizzard L. Walters Ell. Wood-Baker R. Effect o f high flow oxygen on mortality in chronic obstructive pulmonary disease patients in prehospital setting: randomised controlled trial. BMJ. 2010:341×5462.
- Brochard L. Mancebo J, Wysocki M. Lofaso F, Conti G. Rauss A. Ct al. Non invasive ventilation for acute exacerbations of chronic obstructive pulmonary disease. N Engl J Med. 1995:333113 ):817-22.
- Lightowlcr JV, Wedzicha JA. Elliott MW, Ram FSF. Non-invasivc positive pressure ventilation Io treat respiratory failure resulting from exacerbations o f chronic obstructive pulmonary disease: Cochrane systematic review and meta-analysis. BMJ. 2003:326(73X21:185.
- Navalesi p. Panfulla F, Frigcrio p. Grcgorclti C< Nava s. Physiologic evaluation o f nonin vast VC mechanical ventilation delivered with three types of masks in patients with chronic hypercapnic respiratory failure. Crit Care Med. 20(10:28(61:1785 90.
- Girault c . Uriel A. Benichou J, H cl lot MF, Dachnioui F, ‘famton F. Ct al. Interface strategy during nonin vast vc positive pressure ventilation for hypercapnic acute respiratory failure. Crit Care Med. 2009:3711):124 31
- Nava 8, Navalcsi p, Grcgorctti c . Interfaces and humidification for nonin vast VC mechanical ventilation. Resptr Cure. 2009;54(l ):7I 84.
- Anion A. Gut’ll R. Gomez J, Serrano J, Castellano A, Carrasco JL, Ct al. Predicting the result o f noninvasive ventilation in severe acute exacerbations o f palicuts with chronic airflow limitation. Chest. 2000:117(3 ):R28 33.
- Conti G. Antonelli M, Navalcsi p. Rocco M. Butt M. Spadelta G, cl al. Noninvasivc vs. conventional mechanical ventilation 111 patients with chronic obstructive pulmonary disease after failure o f medical treatment in the ward: <1 randomized trial. Intensive Care Med. 2002:28(121:1701-7.
- Confalonicri M. Garun G. Caltaruzzu MS. Osborn JF, Antonelli M. Conti G. et al. A chart o f failure risk for non invasive ventilation in patients with COP I) exacerbation Fur Rcspir J. 2005:25(2):348 55.
- Stefan MS. Nathanson Bl I. Higgins TL. Steingrub JS. Lagu T. Rolhbcrg MB, Ct al. Comparative effectiveness of non invasive and invasive ventilation in critically ill patients with acute exacerbation o f chronic obstructive pulmonary disease. Crit Care Med. 2015:43(7): 1386 94.
- van Golfen WH. Douma WR. Slcbos DJ, Kerstjens HA. Bronchodilators delivered by nebuliser versus pMDI with spacer or DPI for exacerbations of COPD. Cochrane Database Syst Rev. 2OI6;(8):CD0l 1826.
- Nair s. Thomas E. Pearson SB. Henry MT. A randomized controlled triul to assess the optima I dose and effect P age 9 o f nebulized albuterol in acute exacerbations of COPD. Chest. 2005:128(1 ):48 54.
- Cydulka RK, Emcrmtin CL. Effects o f combined treatment with glycopyrrolate and albuterol in acute exacerbation o f chronic obstructive pulmonary disease Ann Emerg Med. I995;25(4):47O 3.
- O’Driscoll BR. Taylor RJ, Horsley MG. Chambers DK. Bernstein A. Nebulised salbutamol with and without ipratropium bromide in acute airflow obstruction. Lancet (London. England). 1989:1(8652): 1418-20.
- Niewoehner DE. Erbland ML. Deupree RII. Collins D. Gross NJ, Light RW. Ct al. Effect of systemic glucocorticoids on exacerbations of chronic obstructive pulmonary disease. Department o f Veterans Affairs Cooperative Study Group. N Engl J Med. 1999:340(25):! 94] 7.
- Aaron SI). Vundemheen KL, Hebert p. Dales R. Sticll IG. Ahuja J. cl al. Outpatient oral prednisone after emergency treatment o f chronic obstructive pulmonary disease. N Engl J Med. 2OO3:348(26):2618-25.
- Walters JAE, Gibson K i. Wood- Baker R. Hannay M, Walters Ell. Systemic corticosteroids Cor acme exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2009; ]
- de Jong YP, Uil SM. Grotjuhnn IIP. Poslmu DS. Kcrsljcns HA, van den Berg JW. Oral or IV prednisolone in the treatment oi’ COPD exacerbations: a randomized, controlled, double-blind study. Chest. 2007; 132(61:1741 7.
- Lindciiaucr PK. Pekow PS. Lahti MC, Lee Y. Benjamin EM, Rolliberg MB Association o f corticosteroid dose and route o f administration with risk o f treatment failure in acute exacerbation o f chronic obstructive pulmonary disease. JAMA. 2OIO:3O3(23):2359 67.
- Lcuppi JD, Schuetz p. Bingisser R. Bodmer M, Bricl M. Drescher T. et al. Short-term vs conventional glucocorticoid therapy in acute exacerbations o f chronic obstructive pulmonary disease: the REDUCE randomized clinical trial. JAMA. 2013:309(2 0:2223-3].
- Bonilla Arcos D. Krishnan JA. Vatidivier RW. Scvransky JE. Chccklcy w , Kiser TH. Ct al. High-dose versos low-dose systemic steroids in the treatment o f acute exacerbations o f chronic obstructive pulmonary disease: systematic review. Chronic Obsir Pulm Dis. 20l6;3(2):580 8.
- Woods JA. Wheeler JS. Finch CK, Pinner NA. Curticostcroids in the treatment o f acute exacerbations of chronic obstructive pulmonary disease. I nt J Citron Obstruct Pulman Dis. 2014:9:421-30.
- Vollenwcidcr DJ. Janet! ll.Slcurer- Slcy CA. Garcia-Aynicrich J, Puhan MA. Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2012:12:CD010257.
- Mirnvilllcs M. Krucsmann F, lluverstock D. Perroncel R. Choudhri SH. Arvis p Sputum colour and bacteria in chronic bronchitis exacerbations: a pooled analysis. Eur Respir J. 2012:39(61:1354 60.
- Slock Icy R A. O’ Brien c . Pye A. 111II SL. Relationship o f sputum color to nature and outpatient management of acute exacerbations o f COPD. Chest. 2000; 117(61:1638-45.
- Clark TW. Medina MJ. Batham s. Curran MD. Purmar s, Nicholson KG. C-reaclivc protein level and microbial aetiology in patients hospitalised with acute exacerbation o f COPD. Eur Rcspir J. 2015;45( 11:76-86.
- Stolz D. Christ-Crain M, Bingisser R, Lcuppi J, Miedinger D, Muller c , et al. Antibiotic treatment of exacerbations of COPD: a randomized, controlled trial comparing procalc itun in-guidance with standard therapy. Chest. 20 0 7 J 3 I(I):9 19.
- Huang D f. Yealy DM . Filbin MR, Brown AM. Chang CH. Doi Y. Ct al. Procalciton ill-guided use of antibiotics for lower respiratory tract infection. N Engl Ì Med. 20IR;379(3):236-49.
- l-‘alagas ME. Avgeri so , Multhaiou DK. Diniopoutos G, Stempos It Short- versus long-dural ion antimicrobial treatment lor exacerbations of chronic bronchitis a mcta-analysis. J Antimicroh Chcmothcr. 2008;62(3):442 50.
- an Eerd EA, van dvr Meer RM. van Schayck ()C, Kolz D. Smoking cessation for people with chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2()I6;(8):CDOI0744.
- Morelli A. Del Surbu L. Pesenti A. Ranieri VM . Fan E. Extracorporeal carbon dioxide removal (ECCO2R) tn patients with acute respiratory failure. Intensive Care Med 2(J17;43(4):519 30.
- Peltenuzzo T, Fan E, Del Sortto L. Extracorporeal carbon dioxide removal in acule exacerbations of chronic obstructive pulmonary disease. Ann Transl Med. 2018;6(2):31.