Bệnh thận - tiết niệu, Bệnh sản phụ khoa
ĐỒNG THUẬN LÂM SÀNG “NHIỄM TRÙNG ĐƯỜNG TIẾT NIỆU TRONG THAI KỲ” ACOG – 08/2023
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết ĐỒNG THUẬN LÂM SÀNG “NHIỄM TRÙNG ĐƯỜNG TIẾT NIỆU TRONG THAI KỲ” ACOG – 08/2023 – Tải file PDF Tại đây.
Biên dịch: Bác sĩ Vũ Tài
TÓM TẮT
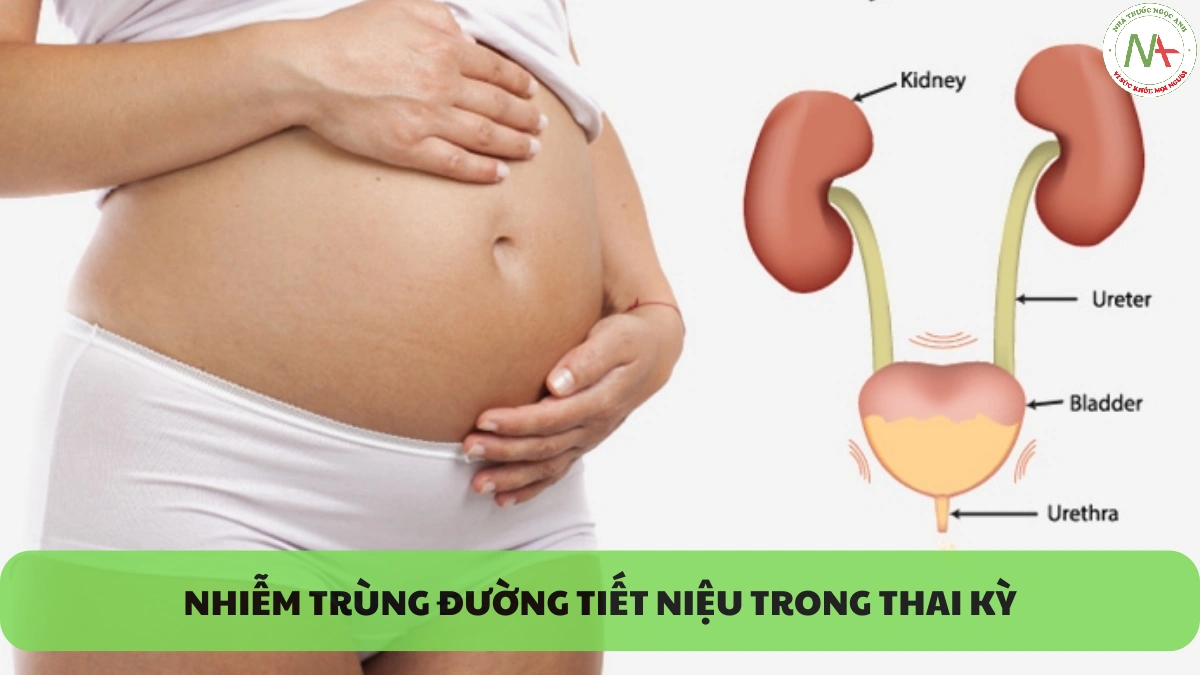
Một trong những biến chứng chu sinh khá phổ biến đó là nhiễm trùng đường tiết niệu (UTI), ảnh hưởng khoảng 8% thai kỳ (1, 2). Các nhiễm trùng này là một phổ bệnh, từ nhiễm vi khuẩn niệu không triệu chứng, đến viêm bàng quang cấp tính có triệu chứng, và cho đến viêm thận bể thận là nghiêm trọng nhất. Sự hiện diện của UITs có liên quan với những kết cục thai kỳ bất lợi, bao gồm tăng tỷ lệ sinh non và trẻ nhẹ cân. Sàng lọc và điều trị vi khuẩn niệu không triệu chứng đã được chứng minh trong nhiều nghiên cứu là làm giảm tỷ lệ viêm thận bể thận trong thai kỳ (3-5). Với tần suất UITs xảy ra trong thai kỳ, nâng cao khả năng nhận biết, chẩn đoán và điều trị chúng là vô cùng cần thiết đối với mỗi bác sĩ sản phụ khoa. Tài liệu Đồng thuận lâm sàng này được phát triển bằng cách sử dụng một quy trình đã được thiết lập cùng với các tác giả được liệt kê.
Đại cương
Mục đích
Một trong những biến chứng chu sinh khá phổ biến đó là nhiễm trùng đường tiết niệu (UTI), ảnh hưởng khoảng 8% thai kỳ (1, 2). Các nhiễm trùng này là một phổ bệnh, từ vi khuẩn niệu không triệu chứng (ASB), đến viêm bàng quang cấp tính có triệu chứng, và cho đến viêm thận bể thận là nghiêm trọng nhất. Nhìn chung, Escherichia coli là mầm bệnh vi khuẩn phổ biến nhất được phân lập trong các mẫu nước tiểu của thai phụ (6-9). Sự hiện diện của UITs có liên quan với các kết cục thai kỳ bất lợi, bao gồm tăng tỷ lệ sinh non và trẻ nhẹ cân. Hơn nữa, các biến chứng nghiêm trọng của mẹ do viêm thận bể thận bao gồm nhiễm trùng huyết (sepsis), đông máu rải rác trong lòng mạch (disseminated intravascular coagulation) và hội chứng suy hô hấp cấp tính (ARDS). Với tần suất UITs xảy ra trong thai kỳ, nâng cao khả năng nhận biết, chẩn đoán và điều trị chúng là vô cùng cần thiết đối với mỗi bác sĩ sản phụ khoa.
Dịch tễ học
Nhiễm trùng đường tiết niệu được phân loại dựa trên vị trí nhiễm trùng: đường tiết niệu dưới (ASB hoặc viêm bàng quang) hoặc đường tiết niệu trên (viêm thận bể thận). Vi khuẩn niệu không triệu chứng, là tình trạng có một lượng vi khuẩn đáng kể trong nước tiểu mà không gây triệu chứng, được xác định ở 2-10% bệnh nhân mang thai (3). Sàng lọc và điều trị ASB đã được chứng minh trong nhiều nghiên cứu là làm giảm tỷ lệ mắc mới viêm thận bể thận trong thai kỳ (3-5). Viêm thận bể thận để lại những di chứng nặng nề trong thai kỳ như sinh non, thiếu máu, nhiễm trùng huyết, DIC và ARDS. Hai trong số các nghiên cứu ủng hộ sàng lọc và điều trị ASB để ngăn ngừa viêm thận bể thận cũng cho thấy tỷ lệ sinh non giảm khi thực hiện sàng lọc (3).
Ước tính có 1-2% bệnh nhân mang thai bị viêm bàng quang cấp tính (10), và tương tự cũng có 1-2% thai phụ bị viêm thận bể thận cấp tính (11). Viêm thận bể thận thường xảy ra nhất trong ba tháng giữa thai kỳ và là một trong những nguyên nhân nội khoa phổ biến nhất phải nhập viện trong thai kỳ.
Một số thay đổi về giải phẫu và sinh lý xảy ra ở đường tiết niệu khi mang thai có thể khiến thai phụ dễ bị UITs. Dãn niệu quản do progesterone, kết hợp với tử cung mang thai chèn ép cơ học lên niệu quản, từ đó làm tăng thể tích tồn dư trong bàng quang và ứ đọng nước tiểu, dẫn đến trào ngược bàng quang niệu quản. Kết quả là, những thay đổi này làm tăng nguy cơ vi khuẩn xâm nhập và nhiễm trùng ngược dòng.
VI KHUẨN NIỆU KHÔNG CÓ TRIỆU CHỨNG (ASB)
Chẩn đoán
Các bác sĩ lâm sàng nên sàng lọc ASB bằng cấy nước tiểu một lần ở lần khám tiền sản đầu tiên. Không có đủ bằng chứng để khuyến cáo hoặc phản đối lặp lại sàng lọc trong thai kỳ sau kết quả nuôi cấy ban đầu âm tính.
Sàng lọc ASB đã trở thành thực hành lâm sàng được chấp nhận để ngăn ngừa viêm thận bể thận trong thai kỳ. Tuy nhiên, các nghiên cứu ủng hộ sàng lọc ASB hầu hết được thực hiện vào những năm 1960 và 1970, chất lượng nghiên cứu rất kém và phác đồ điều trị kháng sinh không phản ánh thực hành hiện nay. Kể từ khi sàng lọc và điều trị ASB trở thành thực hành thường quy, tỷ lệ mắc mới viêm thận bể thận trong thai kỳ đã giảm từ 20-35% xuống còn 1^1% (3). Mặc dù mức giảm này ủng hộ khẳng định rằng sàng lọc và điều trị ASB có hiệu quả, nhưng 2 thử nghiệm ngẫu nhiên gần đây nhất về điều trị ASB cho thấy tỷ lệ viêm thận bể thận chỉ là 2,2-2,4% ở nhóm bệnh nhân không điều trị ASB (13, 14). Điều này gợi ý rằng, ở ít nhất một số quần thể, tỷ lệ viêm thận bể thận nền (baseline) hiện nay thấp hơn ngay cả khi không sàng lọc và điều trị. Do những hạn chế trong dữ liệu này, Preventive Services Task Force Hoa Kỳ vào năm 2019 đã hạ mức độ khuyến cáo của họ về sàng lọc ASB trong thai kỳ từ “A” (bằng chứng về lợi ích đáng kể) xuống “B” (bằng chứng về lợi ích trung bình). Tuy nhiên, vì các thử nghiệm đã công bố chúng minh mối liên quan nhất quán với giảm viêm thận bể thận nên vẫn khuyến cáo sàng lọc và điều trị ASB trong thai kỳ (4, 5).
Sàng lọc ASB nên được thực hiện ở lần khám tiền sản đầu tiên (15). Viêm thận bể thận thường gặp nhất trong tam cá nguyệt thứ hai, mặc dù có một tỷ lệ đáng kể các trường hợp được báo cáo trong tam cá nguyệt thứ nhất, đặc biệt ở những bệnh nhân chưa được sàng lọc ASB (16, 17). Nên thận trọng khi thu thập mẫu nước tiểu sàng lọc ở lần khám tiền sản đầu tiên, mặc dù không có đủ bằng chứng để khuyến cáo tuổi thai cụ thể nên thực hiện sàng lọc.
Sàng lọc nhiễm trùng bằng que thử nước tiểu thường quy ở mỗi lần khám tiền sản không có lợi và không đủ nhạy để phát hiện ASB (18, 19). Khuyến cáo cấy nước tiểu giữa dòng để sàng lọc ASB. Hướng dẫn làm sạch tầng sinh môn (“nước tiểu sạch”) trong quá trình lấy mẫu nước tiểu giữa dòng không chứng minh được là làm giảm tỷ lệ nhiễm vi khuẩn âm hộ âm đạo vào nước tiểu (20). Cả 2 mẫu nước tiểu giữa dòng và giữa dòng “sạch” thường có mức độ ô nhiễm ít nhất là trung bình ở bệnh nhân mang thai, bằng chứng là các tế bào biểu mô khi nhuộm Gram và hệ vi khuẩn hỗn hợp trên môi trường nuôi cấy. Ở 1/3 số bệnh nhân mang thai, cấy nước tiểu bằng một trong hai phương pháp thu thập cho thấy sự phát triển của hệ vi khuẩn trên da với số lượng khuẩn lạc lên tới 10.000 (104) CFU/mL. Không có bằng chứng cụ thể nào đề cập đến việc có nên lặp lại mẫu để chứng minh nhiễm khuẩn âm hộ âm đạo hay không. Với tỷ lệ mẫu nước tiểu bị ô nhiễm cao, cũng như tỷ lệ ô nhiễm môi trường nuôi cấy ngày càng tăng khi tuổi thai tăng lên (15), và các nỗ lực lấy lại mẫu với hy vọng tránh ô nhiễm bởi hệ vi khuẩn trên da, cuối cùng có thể là vô ích.
Sau kết quả cấy nước tiểu sàng lọc ban đầu âm tính, sàng lọc bổ sung có thể không được chỉ định vì nguy cơ viêm thận bể thận còn lại rất thấp (21). Có ý kiến cho rằng, ở nhóm dân số có nguy cơ cao hơn có thể được sàng lọc nhiều lần. Năm 2007, Tita và cộng sự (22) đã báo cáo tỷ lệ cấy nước tiểu nền dương tính tăng 40% ở những bệnh nhân mang thai có đặc điểm hồng cầu hình liềm (sickle cell trait) so với những người có kiểu gen hemoglobin A bình thường (aOR 1,4, 95% CI 1,2-1,5), nhưng không tăng ở bệnh nhân có hemoglobin c trait. Những phát hiện này được mở rộng dựa trên những phát hiện trong một nghiên cứu cũ của Baill và Witter vào năm 1990 (23), báo cáo tỷ lệ ASB cao hơn ở những bệnh nhân mang thai có đặc điểm hồng cầu hình liềm so với những bệnh nhân trong nhóm chứng (13,0% so với 9%, p = 011). Trong một nghiên cứu bệnh-chứng ở Châu u chủ yếu là các alpha và beta thalassemia trait (72%), những người có đặc điểm bệnh lý huyết sắc tố (hemoglobinopathy trait) phát hiện có tỷ lệ ASB hoặc UTI trong thai kỳ cao hơn (RR 12,18, 95% 4,76-33,51) so với những người trong nhóm chứng phù họp (24). Ngược lại, sự hiện diện của hemoglobin c trait dường như không làm tăng đáng kể tỷ lệ ASB (aRR 1,0 95% CI 0,8-1,3) (23). Dữ liệu không nhất quán về việc liệu tỷ lệ viêm thận bể thận có cao hơn tương ứng ở bệnh nhân mắc Hemoglobin AS hay không. Mặc dù, có lẽ là hợp lý khi sàng lọc thường xuyên hơn cho những người có đặc điểm hồng cầu hình liềm nhưng không có đủ bằng chứng để xác định tần suất cụ thể. Ngược lại, bệnh nhân mang thai bị đái tháo đường hoặc tổn thương tủy sống không nên thực hiện sàng lọc ASB bổ sung ngoài một lần sàng lọc ban đầu, bởi vì có bằng chứng cho thấy tác hại của việc sàng lọc lớn hơn lợi ích tiềm năng (4, 25).Ở những người bị tổn thương tủy sống, ASB dường như có tác dụng bảo vệ chống lại UTI có triệu chứng (4) và việc điều trị có thể khởi phát UTI có triệu chứng và góp phần kháng kháng sinh.
Điều trị
Các bác sĩ lâm sàng nên kê đơn một liệu trình kháng sinh hướng vào mục tiêu kéo dài 5-7 ngày để điều trị ASB với số lượng khuẩn lạc > 100.000 CFU/mL. Không có đủ bằng chứng để khuyến cáo hoặc phản đối việc sàng lọc lặp lại sau khi điều trị thích hợp đợt ASB ban đầu.
Vi khuẩn niệu không triệu chứng có ý nghĩa lâm sàng khi số lượng khuẩn lạc > 100.000 CFU/mL (105 CFU/mL). số lượng khuẩn lạc thấp hơn có thể do ô nhiễm từ âm hộ hoặc âm đạo và không cần điều trị. Điều trị bằng một đợt kháng sinh kéo dài 5- 7 ngày đã được chúng minh là có hiệu quả chống lại các vi khuẩn phổ biến nhất trong ASB và UTI, đặc biệt là các loài E coli, Proteus và Klebsiella (Bảng 1). Liên cầu nhóm B nên được điều trị nếu số lượng > 100.000 CFU/mL. Không cần điều trị nếu số lượng khuẩn lạc thấp hơn nhưng cần lưu ý đó là một chỉ định dự phòng liên cầu nhóm B tại thời điểm sinh (xem Committee Opinion 797, Prevention of Group B Streptococcal Early-Onset Disease in Newboms, để biết thêm thông tin). Không nên điều trị hệ vi khuẩn âm hộ âm đạo bình thường, bao gồm các loài Lactobacilli và Corynebacteria và Tụ cầu âm tính với coagulase (20).
Thời gian điều trị thường là 5-7 ngày, phản ánh thời gian tiêu chuẩn được chọn trong hầu hết các nghiên cứu về điều trị ASB (Bảng 1). Một số nghiên cứu ngẫu nhiên cho thấy thời gian điều trị 5-7 ngày tốt hơn điều trị đơn liều, với tỷ lệ khỏi cao hơn và giảm tỷ lệ trẻ nhẹ cân sau đó. Tuy nhiên, tỷ lệ tái phát ASB, viêm thận bể thận hoặc sinh non đều không có sự khác biệt (26). Fosfomycin là một ngoại lệ đối với nguyên tắc này; nó cho thấy hiệu quả tốt khi điều trị đơn liều cho cả ASB và viêm bàng quang cấp tính có triệu chứng (27), khiến nó trở thành lựa chọn hợp lý để điều trị ASB trong 1 ngày. Mặc dù thời gian điều trị 3 ngày được khuyến cáo và thường áp dụng cho bệnh viêm bàng quang cấp tính ở phụ nữ không mang thai, nhưng không có nghiên cứu nào đánh giá thời gian điều trị 3 ngày đối với ASB (28).
Nên bắt đầu điều trị ngay khi vi khuẩn niệu được xác nhận và sau đó thay đổi nếu vi khuẩn phân lập được không nhạy cảm với lựa chọn kháng sinh ban đầu. Vì bệnh nhiễm trùng này theo định nghĩa không có triệu chứng nên thường thực hiện cấy nước tiểu sau khi hoàn thành điều trị để đánh giá đáp ứng. Tuy nhiên, hiện không có nghiên cứu nào đánh giá hoặc đề xuất một xét nghiệm đánh giá khởi bệnh hay sàng lọc lại có nên được chỉ định sau điều trị hay không.
Viêm bàng quang cấp tính
Chẩn đoán
Các bác sĩ lâm sàng nên đánh giá bệnh nhân có triệu chứng viêm bàng quang cấp tính bằng cấy nước tiểu. Nên nghi ngờ nhiễm trùng đường tiết niệu dựa vào các triệu chứng, có thể được hỗ trợ bởi kết quả phân tích nước tiểu dương tính và được xác nhận bằng cấy nước tiểu cho thấy > 100.000 CFU/mL.
Phân biệt viêm bàng quang cấp tính với ASB bởi có các triệu chứng, bao gồm tiểu buốt, tiểu máu, tiểu nhiều lần và tiểu đêm. Tuy nhiên, các triệu chứng này có sự trùng lặp với các triệu chứng thông thường khi mang thai, đặc biệt là tiểu nhiều lần, tiểu gấp và tiểu đêm (29, 30). Để ngăn ngừa việc điều trị quá mức, các xét nghiệm chẩn đoán có vai trò cực kỳ quan trọng để phân biệt các triệu chứng điển hình khi mang thai và UTI có ý nghĩa lâm sàng. Phân tích nước tiểu là một công cụ hữu ích để phân loại các triệu chứng UTI (Bảng 2). Mủ niệu, được định nghĩa là có > 5 tế bào bạch Cầu/HPF (high-power field) hoặc sự hiện diện esterase bạch cầu, có độ nhạy lên tới 97% đối với UTI nhưng kém đặc hiệu hơn, vì bạch cầu có thể bị ô nhiễm từ âm hộ hoặc âm đạo. Nitrit là đặc hiệu nhất (94-98%) nhưng không hiện diện trong mọi trường hợp UITs, vì không phải tất cả vi khuẩn đều tạo ra nitrit. Nếu không có nitrit hoặc esterase bạch cầu, UTI khó có khả năng xảy ra (giá trị tiên đoán âm tính 78-98%); UTI được loại trừ nếu que thử nước tiểu hoàn toàn bình thường (31). Khi kết quả phân tích nước tiểu dương tính, có thể bắt đầu điều trị bằng kháng sinh để làm giảm triệu chứng. Trong những tình huống mà không thể lấy được mẫu nước tiểu, có thể cân nhắc điều trị theo kinh nghiệm khi có hiện tượng tiểu buốt và tiểu nhiều lần mới khởi phát, đây là triệu chứng đặc hiệu nhất ở phụ nữ không mang thai (32).
Tốt nhất là nên cấy nước tiểu để xác nhận chẩn đoán và giúp điều chỉnh liệu pháp kháng sinh theo độ nhạy cảm (sensitivity). số lượng khuẩn lạc ngưỡng (threshold) để xác nhận UTI là 100.000 (105) CFU/mL. Tuy nhiên, trái ngược hoàn toàn với điều trị ASB, khi có các triệu chứng, một số tác giả đề nghị điều trị với số lượng khuẩn lạc thấp tới 100 (102) của một vi sinh vật có thể là phù hợp (32, 33).
Điều trị
Các bác sĩ lâm sàng nên điều trị viêm bàng quang cấp tính ở thai phụ với một liệu trình kháng sinh hướng vào mục tiêu kéo dài 5-7 ngày. Nếu điều trị theo kinh nghiệm được bắt đầu trước khi có kết quả nuôi cấy và độ nhạy cảm thì nên tránh dùng phác đồ amoxicillin hoặc ampicillin do tỷ lệ E coli kháng các loại thuốc này cao ô’ hầu hết các khu vực.
Sau khi chẩn đoán viêm bàng quang cấp tính, điều trị cho thai phụ nên được bắt đầu với một đợt kháng sinh kéo dài 5-7 ngày. Có thể bắt đầu điều trị theo kinh nghiệm khi có các triệu chứng bao gồm tiểu buốt, tiểu máu, tiểu nhiều lần và tiểu đêm, cùng với kết quả phân tích nước tiểu phù hợp với UTI, để làm giảm triệu chứng. Sau đó, liệu pháp kháng sinh có thể được thay đổi nếu cần, dựa trên kết quả cấy nước tiểu để điều trị mục tiêu. Lựa chọn kháng sinh điều trị không chỉ phụ thuộc vào kết quả nuôi cấy mà còn cả kháng sinh đồ và tính an toàn và bao gồm nitrofurantoin, p-lactam, sulfonamid và fosfomycin (Bảng 1). Khi tình trạng kháng kháng sinh tiếp tục gia tăng, lựa chọn kháng sinh thích hợp, phổ kháng khuẩn thực tế hẹp nhất và khoảng thời gian điều trị thích hợp là những thành phần thiết yếu của cả quản lý kháng sinh và chăm sóc lâm sàng tối ưu.
Điều trị UITs trong thai kỳ có hiệu quả; tuy nhiên, dữ liệu về phác đồ điều trị tối ưu hoặc ưu tiên trong thai kỳ còn hạn chế (34). Một phân tích tổng hợp đánh giá nhiều lựa chọn điều trị cho thấy không có sự khác biệt về tỷ lệ khỏi, tỷ lệ tái nhiễm, sinh non hoặc nhu cầu điều trị thay thế (34). Nếu bắt đầu điều trị trước khi có kết quả nuôi cấy, nên tránh dùng phác đồ amoxicillin hoặc ampicillin do tỷ lệ kháng kháng sinh của E coli ngày càng tăng. Các nghiên cứu ở những người không mang thai cho thấy sự biến thiên về kết quả kháng sinh đồ (antibiotic susceptibility), với khả năng kháng ampicillin đối với E coli dao động từ 39,3% đến 48,2% (7, 35). Tương tự, tỷ lệ kháng thuốc ngày càng tăng đã được báo cáo ở những thai phụ và thay đổi tùy theo khu vực (36).
Nitrofurantoin có tỷ lệ kháng thuốc thấp và có hiệu quả chống lại nhiều mầm bệnh thường gặp trong thai kỳ. Hơn nữa, nitrofurantoin cô đặc và đạt được nồng độ điều trị trong bàng quang (36), khiến nó trở thành lựa chọn đầu tay phù hợp cho các bệnh nhiễm trùng đường tiết niệu dưới. Có một số dữ liệu về việc có thể xảy ra dị tật bẩm sinh liên quan đến nitrofurantoin và sulfamethoxazole-trimethoprim nếu được dùng trong ba tháng đầu thai kỳ; tuy nhiên, những dữ liệu này không rõ ràng và có những hạn chế về phương pháp luận (37-39). Nitrofurantoin và sulfonamid là lựa chọn hợp lý trong tam cá nguyệt thứ nhất nếu không có lựa chọn thay thế thích hợp. Ngoài ra, dùng nitrofurantoin ở những bệnh nhân thiếu glucose-6 phosphate dehydrogenase có liên quan với những biến chứng hiếm gặp, bao gồm nhiễm độc phổi và thiếu máu tán huyết, và nên tránh ở những bệnh nhân này (39). Có thể tiếp tục dùng nitrofurantoin và sulfonamide trong tam cá nguyệt thứ hai và thứ ba như là liệu pháp đầu tay cho UTI.
Không có đủ bằng chứng để khuyến cáo thời gian điều trị 3 ngày đối với viêm bàng quang cấp tính trong thai kỳ. Tuy nhiên, một số nghiên cứu đã đánh giá fosfomycin liều duy nhất so với các liệu trình kháng sinh dài hơn để điều trị UTI (40). Kết quả phân tích tổng hợp cho thấy fosfomycin liều duy nhất có kết cục lâm sàng tương tự so với các phác đồ kháng sinh khác và có thể là điều trị hiệu quả với sự tuân thủ cao hơn (27, 40). Liên quan đến khả năng gây quái thai tiềm tàng của fosfomycin, các nghiên cứu ban đầu chưa xác định được sự gia tăng nguy cơ ảnh hưởng bất lợi đến thai kỳ (41, 42). Nên tránh dùng nitrofurantoin và fosfomycin trong trường hợp không chắc chắn về chẩn đoán viêm bàng quang so với viêm thận bể thận, do các thuốc này không thể đạt được nồng độ thuốc thích hợp trong mô thận.
Không có đủ bằng chứng để hướng dẫn quản lý sau điều trị viêm bàng quang cấp tính trong thai kỳ. Các bác sĩ lâm sàng có thể cân nhắc cấy lại nước tiểu 1-2 tuần sau khi hoàn thành điều trị viêm bàng quang cấp tính hoặc chỉ đánh giá nếu các triệu chứng tái phát.
Mỗi đợt viêm bàng quang cấp tính đều có nguy cơ tiến triển thành viêm thận bể thận, kèm theo các kết cục cho mẹ và sản khoa bất lợi. Vì vậy, các khuyến cáo về cách quản lý để ngăn ngừa UTI tái phát sẽ là rất hữu ích. Có thể cấy lại nước tiểu 1-2 tuần sau khi hoàn thành điều trị, hoặc bệnh nhân có thể được theo dõi các triệu chứng và chỉ cấy nước tiểu nếu triệu chứng tái phát (39). Hiện đang thiếu dữ liệu chắc chắn về nguy cơ hoặc lợi ích của từng chiến lược, về liệu pháp ức chế bằng kháng sinh sau một đợt viêm bàng quang duy nhất, một tổng quan của Cochrane năm 2015 chỉ xác định được một nghiên cứu trên 200 bệnh nhân. Không có sự khác biệt về tỷ lệ tái phát viêm bàng quang giữa những người được điều trị ức chế hàng ngày bằng nitrofurantoin và theo dõi sát bệnh nhân ngoại trú so với chỉ theo dõi sát bệnh nhân ngoại trú. Do có rất ít dữ liệu, các tác giả không thể đưa ra kết luận về cách quản lý tối ưu (43).
Không có đủ bằng chứng giúp hướng dẫn quản lý sau UITs tái phát trong thai kỳ. Sau khi điều trị nhiễm trùng cấp tính tái phát, các bác sĩ lâm sàng có thể cân nhắc bắt đầu liệu pháp ức chế bằng kháng sinh qua nước tiểu trong thời gian còn lại của thai kỳ, ưu tiên dùng liều duy nhất hàng ngày thấp hơn của một loại thuốc kháng khuẩn mà vi khuẩn phân lập được nhạy cảm
UTI tải phát được định nghĩa là > 2 lần UTI được chẩn đoán trong thai kỳ (44) và xảy ra ở 4-5% thai kỳ (1). Với những nguy cơ liên quan đến UTI trong thai kỳ, các bác sĩ lâm sàng có thể quyết định khuyến cáo bắt đầu dự phòng kháng sinh sau 1 lần tái phát.
Như đã thảo luận ở trên, dữ liệu về cách quản lý trong trường hợp này còn hạn chế. Các nghiên cứu ở phụ nữ không mang thai phát hiện ra rằng dự phòng kháng sinh làm giảm tỷ lệ tái phát so với giả dược ở những bệnh nhân mắc > 2 lần UITs mỗi năm (45).
Nếu bắt đầu điều trị dự phòng, có 2 chiến lược thường dùng: điều trị dự phòng sau quan hệ tình dục hoặc liên tục trong thời gian còn lại của thai kỳ. Đối với bệnh nhân lựa chọn dự phòng sau quan hệ tình dục, thuốc kháng sinh sẽ được dùng trước hoặc sau khi giao hợp qua đường âm đạo. Chiến lược này giúp làm giảm các tác dụng phụ liên quan đến kháng sinh (46, 47). Với điều trị dự phòng liên tục, thuốc kháng sinh được dùng 1 lần/ngày. Mặc dù vẫn chưa rõ liều kháng sinh dự phòng tối ưu, nên xem xét dùng liều kháng sinh duy nhất hàng ngày thấp hơn mà vi khuẩn phân lập được nhạy cảm với các nỗ lực giảm tình trạng kháng kháng sinh. Phác đồ ức chế thường dùng bao gồm nitrofurantoin 100 mg uống hàng ngày hoặc cephalexin 250-500 mg uống hàng ngày.
VIÊM THẬN BỂ THẬN
Chẩn đoán
Nên nghi ngờ viêm thận bể thận khi sốt > 38,0°C và xét nghiệm nước tiểu gọi ý UITs, kèm theo các triệu chứng nhiễm trùng đường tiết niệu-sinh dục trên khác, chẳng hạn như đau mạng sườn hoặc ấn đau góc sườn cột sống, giúp hỗ trợ cho chẩn đoán.
Viêm thận bể thận là một bệnh nhiễm trùng thận được cho là do vi khuẩn ngược dòng từ bàng quang lên đường tiết niệu trên. Cả viêm bàng quang cấp tính và viêm thận bể thận đều có các dấu hiệu nhiễm trùng trên xét nghiệm nước tiểu, như đã mô tả trước đó. Phân biệt UTI có triệu chứng và viêm thận bể thận dựa vào bệnh sử và khám thực thể. Viêm thận bể thận có các dấu hiệu nhiễm trùng, chẳng hạn như sốt, buồn nôn và nôn. Các triệu chứng toàn thân đi kèm với các dấu hiệu khám thực thể khu trú ở đường tiết niệu trên, chẳng hạn như đau mạng sườn, ấn đau góc sườn cột sống (CVA), hoặc siêu âm thận bất thường (11). Công thức máu toàn phần có thể cho thấy tăng bạch cầu, công thức bạch cầu chuyển trái, giảm tiểu cầu hoặc thiếu máu. Những bất thường ở nhiều dòng tế bào có tương quan cao với các kết cục bất lợi, chẳng hạn như nhu cầu vào đơn vị chăm sóc tích cực (ICU) (48). Biểu hiện phổ biến mà nên bắt đầu điều trị kháng sinh kịp thời đó là phân tích nước tiểu bất thường, sốt, đau mạng sườn và ấn đau CVA. Khi chỉ có một số triệu chứng này (ví dụ: sốt và UITs nhưng ấn không đau CVA hoặc UITs và ấn đau CVA nhưng không sốt), trên lâm sàng nên nghi ngờ nhiều về viêm thận bể thận sớm hoặc đang tiến triển. Các bác sĩ lâm sàng phải cảnh giác với các triệu chứng lâm sàng xấu đi cho đến khi có thể loại trừ chẩn đoán viêm thận bể thận (48). Viêm thận bể thận cũng có thể gây ra các hậu quả nghiêm trọng hơn, chẳng hạn như các cơn co hoặc chuyển dạ sinh non, cũng như nhiễm trùng huyết, suy thận cấp và ARDS (16, 48, 49). Chẩn đoán phân biệt các triệu chứng này trong thai kỳ cũng có thể bao gồm sỏi thận, áp xe thận, nhiễm trùng huyết từ nhiễm trùng đường tiết niệu không viêm thận bể thận và nhiễm trùng ối.
Bệnh nhân mang thai nghi ngờ bị viêm thận bể thận nên lấy mẫu nước tiểu giữa dòng hoặc qua ống thông để phân tích nước tiểu, soi nước tiểu dưới kính hiển vi và nuôi cấy. Mẫu bệnh phẩm này phải được lấy trước khi dùng kháng sinh, nhưng không nên trì hoãn điều trị trong khi chờ kết quả nuôi cấy. cấy máu, mặc dù thường được thực hiện ở những bệnh nhân này, nhưng có thể không hữu ích về mặt lâm sàng. Một nghiên cứu cho thấy kết quả cấy máu dương tính ở 21 % bệnh nhân nhưng hiếm khi thay đổi quản lý lâm sàng (50). Khi vi khuẩn học giữa cấy nước tiểu và cấy máu phù hợp, khi đó thời gian điều trị sẽ không bị ảnh hưởng bởi vãng khuẩn huyết (bacteremia) (50).
Điều trị
Ban đầu, các bác sĩ lâm sàng nên quản lý viêm thận bể thận trong thai kỳ ỏ’ CO’ sở điều trị nội trú. Liệu pháp kháng sinh theo kinh nghiệm phải có khả năng thâm nhập mô thận thỏa đáng và hướng đến mục tiêu là các mầm bệnh có khả năng nhất. Liệu pháp kháng sinh nên được điều chỉnh khi cần dựa trên kết quả cấy nước tiểu và độ nhạy cảm. Nên tiếp tục dùng kháng sinh đường tiêm cho đến khi lâm sàng bệnh nhân cải thiện. Bệnh nhân phải hoàn thành tổng cộng 14 ngày điều trị kháng sinh.
Trong thai kỳ, viêm thận bể thận là một trong những lý do nhập viện thường gặp nhất và nếu không được điều trị có thể dẫn đến các biến chứng nghiêm trọng cho mẹ và sản khoa, bao gồm chuyển dạ và sinh non, nhiễm trùng huyết, sốc nhiễm trùng và ARDS. Nhận biết và chẩn đoán kịp thời là điều vô cùng cần thiết để bắt đầu điều trị. Với những nguy cơ liên quan, khuyến cáo quản lý nội trú đối với bệnh nhân viêm thận bể thận cấp tính (8, 10, 51). Quản lý ban đầu bao gồm bù dịch và dùng kháng sinh tĩnh mạch. Liệu pháp kháng sinh nên được bắt đầu ngay trong khi chờ đợi kết quả cấy nước tiểu và sẽ điều chỉnh khi có kết quả vi sinh. Việc lựa chọn thuốc kháng sinh cần phải được cá thể hóa dựa trên dữ liệu về độ nhạy cảm tại chỗ và bất kỳ lần sử dụng kháng sinh nào gần đây của bệnh nhân. Các nghiên cứu đã đánh giá lợi ích của các phác đồ kháng sinh khác nhau trong điều trị viêm thận bể thận và không có phác đồ điều trị nào được cho là tốt hơn (34, 39, 52, 53). Liệu pháp kháng sinh đầu tay bao gồm p-lactam phổ rộng với cân nhắc bổ sung aminoglycoside, bao gồm ampicillin và gentamicin, hoặc cephalosporin liều duy nhất, như ceftriaxone hoặc cefepime (Bảng 3). Với bệnh nhân dị ứng với p-lactam, có thể cần đánh giá thêm mức độ nặng của phản ứng dị ứng. Ở bệnh nhân có nguy cơ phản vệ thấp với penicillin, điều trị bằng cephalosporin sẽ là thích hợp; tuy nhiên, những người có nguy cơ phản vệ cao sẽ cần điều trị bằng phác đồ thay thế như aztreonam. Trong những tình huống như vậy, khuyến cáo nên tham vấn ý kiến của bác sĩ chuyên khoa bệnh truyền nhiễm.
Phần lớn bệnh nhân (75-95%) sẽ cải thiện lâm sàng (được xác định là hết sốt > 24 giờ và cải thiện các triệu chứng) trong vòng 48-72 giờ sau khi dùng kháng sinh tĩnh mạch (8, 10, 39). Những bệnh nhân không có biểu hiện cải thiện lâm sàng trong vòng 72 giờ, nên được đánh giá thêm để đảm bảo không có tình trạng kháng kháng sinh và chỉ định các phương tiện chẩn đoán hình ảnh để loại trừ các bệnh lý đường tiết niệu khác (8, 10). Kháng kháng sinh là lý do phổ biến nhất dẫn đến thất bại điều trị (1, 8, 9, 11, 54). Sau khi lâm sàng cải thiện, bệnh nhân nên được chuyển sang dùng kháng sinh đường uống thích hợp dựa trên độ nhạy khi nuôi cấy để hoàn thành liệu trình kháng sinh 14 ngày (8, 39). Nitrofurantoin và fosfomycin không phải là thuốc uống thích hợp để hoàn thành liệu trình điều trị viêm thận bể thận, vì chúng chỉ có tác dụng ở đường tiết niệu dưới và không có khả năng thâm nhập để đạt được nồng độ điều trị trong nhu mô thận, nơi có ổ nhiễm trùng. Sau khi hoàn thành liệu trình kháng sinh, nên cấy lại nước tiểu để đảm bảo không còn nhiễm trùng.
Các vi khuẩn kháng kháng sinh, đặc biệt là E coli tiết p-lactamase phổ rộng (ESBL) và Tụ cầu vàng kháng methicillin đang ngày càng phổ biến và làm hạn chế các lựa chọn điều trị kháng sinh. Gần đây, một phân tích tổng hợp cho thấy tỷ lệ ESBL ở thai phụ là 34% (95% CI 24-43%) (55). Các nghiên cứu khác cho thấy ESBL có ở khoảng 50% chủng E coli và 37% chủng Klebsiella được phân lập, và Tụ cầu vàng kháng methicillin được xác định ở gần 30% chủng Tụ cầu vàng được phân lập (56). Mặc dù tình trạng kháng kháng sinh ngày càng gia tăng nhưng vẫn chưa rõ dữ liệu về ảnh hưởng đến kết cục của mẹ và sản khoa. Một nghiên cứu cho thấy tỷ lệ tử vong mẹ tăng ở những bệnh nhân nhiễm trùng ESBL (57), trong khi những nghiên cứu khác không thấy sự khác biệt nào về kết cục của mẹ hoặc sản khoa ở những bệnh nhân nhiễm trùng ESBL so với các vi khuẩn không kháng thuốc (58). Khi xác định được vi sinh vật kháng kháng sinh, có thể chỉ định tham vấn với các chuyên gia bệnh truyền nhiễm để được hỗ trợ trong việc lựa chọn kháng sinh và thời gian điều trị thích họp.
Không có đủ bằng chứng giúp hướng dẫn quản lý sau điều trị viêm thận bể thận trong thai kỳ. Các bác sĩ lâm sàng có thể cân nhắc liệu pháp ức chế trong thời gian còn lại của thai kỳ, như đối với UTI tái phát.
Có tới 25% thai phụ bị viêm thận bể thận tái phát trong thai kỳ (10, 51); tuy nhiên, dữ liệu về cách quản lý hiệu quả nhất sau điều trị viêm thận bể thận trong thai kỳ còn hạn chế. Một số ít nghiên cứu ủng hộ dùng liệu pháp ức chế hàng ngày sau điều trị viêm thận bể thận để giảm tỷ lệ tái phát, tuy nhiên tính phổ quát (generalizability) của chúng bị hạn chế do cỡ mẫu nhỏ và dữ liệu hơi cũ (11, 59, 60). Nếu áp dụng liệu pháp ức chế, khuyến cáo dùng nitrofurantoin 100mg hoặc cephalexin 250-500mg uống hàng ngày trong thời gian còn lại của thai kỳ và tiếp tục cho đến 4-6 tuần sau sinh (11). Tuy nhiên, theo nguyên tắc, thuốc ức chế được lựa chọn phải phù hợp với dữ liệu nhạy cảm của mầm bệnh được phân lập với chẩn đoán viêm thận bể thận. Ngoài ra, nên xem xét cấy nước tiểu định kỳ hàng tháng để sàng lọc tái phát trong thai kỳ (11).
==>> Xem thêm: HƯỚNG DẪN QUỐC TẾ ĐÁNH GIÁ VÀ QUẢN LÝ HỘI CHỨNG BUỒNG TRỨNG ĐA NANG DỰA TRÊN BẰNG CHỨNG 2023
TÓM TẮT CÁC KHUYẾN CÁO ĐÔNG THUẬN
Vi khuẩn niệu không triệu chứng
Chẩn đoán
Các bác sĩ lâm sàng nên sàng lọc ASB bằng cấy nước tiểu một lần ở lần khám tiền sản đầu tiên. Không có đủ bằng chứng để khuyến cáo hoặc phản đối lặp lại sàng lọc trong thai kỳ sau kết quả nuôi cấy ban đầu âm tính.
Điều trị
Các bác sĩ lâm sàng nên kê đơn một liệu trình kháng sinh hướng vào mục tiêu kéo dài 5-7 ngày để điều trị ASB với số lượng khuẩn lạc > 100.000 CFU/mL. Không có đủ bằng chứng để khuyến cáo hoặc phản đối việc sàng lọc lặp lại sau khi điều trị thích hợp đợt ASB ban đầu.
Viêm bàng quang cấp tính
Chẩn đoán
Các bác sĩ lâm sàng nên đánh giá bệnh nhân có triệu chứng viêm bàng quang cấp tính bằng cấy nước tiểu. Nên nghi ngờ nhiễm trùng đường tiết niệu dựa vào các triệu chứng, có thể được hỗ trợ bởi kết quả phân tích nước tiểu dương tính và được xác nhận bằng cấy nước tiểu cho thấy > 100.000 CFU/mL.
Điều trị
Các bác sĩ lâm sàng nên điều trị viêm bàng quang cấp tính ở thai phụ với một liệu trình kháng sinh hướng vào mục tiêu kéo dài 5-7 ngày. Nếu điều trị theo kinh nghiệm được bắt đầu trước khi có kết quả nuôi cấy và độ nhạy cảm thì nên tránh dùng phác đồ amoxicillin hoặc ampicillin do tỷ lệ E coli kháng các loại thuốc này cao ở hầu hết các khu vực.
Không có đủ bằng chứng để hướng dẫn quản lý sau điều trị viêm bàng quang cấp tính trong thai kỳ. Các bác sĩ lâm sàng có thể cân nhắc cấy lại nước tiểu 1-2 tuần sau khi hoàn thành điều trị viêm bàng quang cấp tính hoặc chỉ đánh giá nếu các triệu chứng tái phát.
Không có đủ bằng chứng giúp hướng dẫn quản lý sau UITs tái phát trong thai kỳ. Sau khi điều trị nhiễm trùng cấp tính tái phát, các bác sĩ lâm sàng có thể cân nhắc bắt đầu liệu pháp ức chế bằng kháng sinh qua nước tiểu trong thời gian còn lại của thai kỳ, ưu tiên dùng liều duy nhất hàng ngày thấp hơn của một loại thuốc kháng khuẩn mà vi khuẩn phân lập được nhạy cảm
Viêm thận bể thận
Chẩn đoán
Nên nghi ngờ viêm thận bể thận khi sốt > 38,0°C và xét nghiệm nước tiểu gợi ý UITs, kèm theo các triệu chứng nhiễm trùng đường tiết niệu-sinh dục trên khác, chẳng hạn như đau mạng sườn hoặc ấn đau góc sườn cột sống, giúp hỗ trợ cho chẩn đoán.
Điều trị
Ban đầu, các bác sĩ lâm sàng nên quản lý viêm thận bể thận trong thai kỳ ở cơ sở điều trị nội trú. Liệu pháp kháng sinh theo kinh nghiệm phải có khả năng thâm nhập mô thận thỏa đáng và hướng đến mục tiêu là các mầm bệnh có khả năng nhất. Liệu pháp kháng sinh nên được điều chỉnh khi cần dựa trên kết quả cấy nước tiểu và độ nhạy cảm. Nên tiếp tục dùng kháng sinh đường tiêm cho đến khi lâm sàng bệnh nhân cải thiện. Bệnh nhân phải hoàn thành tổng cộng 14 ngày điều trị kháng sinh.
Không có đủ bằng chứng giúp hướng dẫn quản lý sau điều trị viêm thận bể thận trong thai kỳ. Các bác sĩ lâm sàng có thể cân nhắc liệu pháp ức chế trong thời gian còn lại của thai kỳ, như đối với UTI tái phát.
Viết tắt: ASB: vi khuẩn niệu không có triệu chứng; UTI: nhiễm trùng đường tiết niệu.
CẦN NGHIÊN CỨU THÊM
Cần nghiên cứu thêm để đưa ra các khuyến cáo cụ thể hơn về thời điểm sàng lọc ASB lần đầu, trong đó quần thể nào lặp lại sàng lọc ASB có thể là phù hợp và tần suất của các sàng lọc đó, sự thích đáng của xét nghiệm đánh giá khỏi bệnh hoặc sàng lọc lặp lại sau khi hoàn thành điều trị ASB, và liệu thời gian điều trị 3 ngày có thể có hiệu quả đối với ASB hay không. Ngoài ra, cần nghiên cứu thêm để xác định khi nào nên chỉ định cấy lại nước tiểu sau UITs đầu tiên hoặc tái phát trong thai kỳ; cách tốt nhất để xác định UTI tái phát trong thai kỳ; và về hiệu quả, ứng dụng và liều lượng của liệu pháp kháng sinh dự phòng sau viêm thận bể thận hoặc UITs tái phát. Cuối cùng, cần có thêm nhiều nghiên cứu hơn để xác định liệu có những cân nhắc đặc biệt nào khi điều trị và quản lý những người sau sinh hoặc những người có ống thông tiểu hay không.
| Bảng 1. Phác đồ kháng sinh điều trị vi khuẩn niệu không triệu chứng và viêm bàng quang cấp tính | ||
| Kháng sinh | Phác đồ | Lưu ý |
| Nitroíùrantoin | 100 mg uống mỗi 12 giờ trong 5-7 ngày | Nó sẽ là lựa chọn hợp lý trong tam cá nguyệt thứ nhất nếu không có lựa chọn thay thế phù hợp
Tránh dùng để điều trị viêm thận bể thận do không thể đạt được nồng độ điều trị trong thận |
| Cephalexin* | 250-500 mg uống mỗi 6 giờ trong 5-7 ngày | |
| Sulfamethoxazole- trimethoprim | 800/160 mg mỗi 12
giờ trong 5-7 ngày |
Nó sẽ là lựa chọn hợp lý trong tam cá nguyệt thứ nhất nếu không có lựa chọn thay thế phù hợp Ở những khu vực có tỷ lệ kháng trimethoprim-sulfamethoxazole > 20%, tránh dùng để điều trị trước khi có kết quả nuôi cấy |
| Fosfomycin | 3g uống một lần | Tránh dùng để điều trị viêm thận bể thận do không thể đạt được nồng độ điều trị trong thận |
| Amoxicillin’ | 500 mg uống mỗi 8 giờ trong 5-7 ngày
875 mg uống mỗi 12 giờ trong 5-7 ngày |
Tỷ lệ kháng thuốc cao; tránh dùng để điều trị trước khi có kết quả nuôi cấy |
| Amoxicillin-clavulanate* | 500 mg uống mỗi 8 giờ trong 5-7 ngày | Tỷ lệ kháng thuốc cao; tránh dùng để điều trị trước khi có kết quả nuôi cấy |
| 875 mg uống mỗi 12 giờ trong 5-7 ngày | ||
| *Đối với những bệnh nhân dị ứng với p-lactam mà các nhóm kháng sinh khác không thích hợp, cần phải đánh giá thêm về mức độ dị ứng của bệnh nhân. Đối với những bệnh nhân có nguy cơ phản vệ thấp, điều trị bằng cephalosporin sẽ là thích hợp; tuy nhiên, những người có nguy cơ phản vệ cao sẽ cần điều trị bằng phác đồ thay thế. Được sửa đổi từ:
1. Matuszkiewicz-Rowinska J, Ma lyszko J, Wieliczko M. Ưrinary tract iníections in pregnancy: old and new unresolved diagnostic and therapeutic problems. Arch Med Sci 2015;11:67-77. doi: 10.5114/aoms.2013.39202 2. Wang T, Wu G, Wang J, Cui Y, Ma J, Zhu z, Qiu J, Wu J. Comparison of single- dose íosíồmycin tromethamine and other antibiotics for lower uncomplicated urinary tract iníection in women and asymptomatic bacteriuria in pregnant women: a systematic review and meta-analysis. Int J Antimicrob Agents 2020;56:106018. doi: 10.1016/j .ijantimicag.2020.106018 |
||
| Bảng 2. Độ chính xác của kết quả phân tích nước tiểu trong việc dự đoán nhiễm | |||||
| trùng đường tiết niệu dương tính vói nuô | icây | ||||
| Xét nghiệm | Kết quả | Độ nhạy | Độ đặc hiệu | PPV | NPV |
| Que thử nước tiểu | |||||
| Esterase bạch cầu (+) | 72-97 | 41-86 | 43-56 | 82-91 | |
| Nitrites (+) | 19-48 | 92-100 | 50-83 | 70-88 | |
| Esterase bạch cầu hoặc nitrites (+) | 46-100 | 42-98 | 52-68 | 78-98 | |
| Protein > 3+ | 96 | 87 | NA | NA | |
| Protein> 1+ | 91-100 | 65-99 | NA | NA | |
| Soi dưới kính hiển vi | |||||
| >5 WBCs/HPF | 90-96 | 47-50 | 56-59 | 83-95 | |
| >5 RBCs/HPF | 18-44 | 88-89 | 27 | 82 | |
| Vi khuẩn (số lượng bất kỳ) | 46-58 | 89-94 | 54-88 | 77-86 | |
| Viết tắt: PPV, giá trị tiên đoán dương; NPV, giá trị tiên đoán âm; NA, không áp dụng; WBC, bạch cầu; HPF, high-power field; RBC, hồng cầu.
*PPV và NPV của UTI được biểu thị dưới dạng khoảng, vì chúng sẽ thay đổi tùy theo tỷ lệ hiện mắc UTI trong quần thể nghiên cứu. Ở nhũng quần thể có tỷ lệ hiện mắc UTI thấp, PPV giảm trong khi NPV tăng. |
|||||
| Bảng 3. Phác đồ kháng sinh điều trị viêm thận bể thận | |
| Kháng sinh | Phác đồ |
| Ampicillin
+ gentamicin |
2 g IV mỗi 6 giờ
1,5 mg/kg IV mỗi 8 giờ 5 mg/kg IV mỗi 24 giờ |
| Ceíìriaxone | 1 g IV mỗi 24 giờ |
| Ceíepime | 1 g IV mỗi 12 giờ |
| Aztreonam (thích họp với bệnh nhân dị ứng p-lactam) | 1 g IV mỗi 8-12 giờ |
| Viết tắt: IV, tiêm tĩnh mạch.
Dữ liệu từ: 1. Wing DA, Hendershott CM, Debuque L, Millar LK. A randomized trial of three antibiotic regimens for the treatment of pyelonephritis in pregnancy. Obstet Gynecol 1998;92:249-53. doi: 10.1016/s0029-7844(98)00156-2 2. Sanchez-Ramos L, McAlpine KJ, Adair CD, Kaunitz AM, Delke I, Briones DK. Pyelonephritis in pregnancy: once-a-day ceữriaxone versus multiple doses of cefazolin. A randomized, double-blind trial. Am J Obstet Gynecol 1995;172:129-33. doi: 10.1016/0002-9378(95)90100-0 3. Vazquez JC, Abalos E. Treatments for symptomatic urinary tract inĩections during pregnancy. The Cochrane Database of Systematic Reviews 2011, Issue 1. Art. No.: CD002256. doi: 10.1002/14651858.CD002256.pub2 4. Glaser AP, Schaeffer AJ. ưrinary tract infection and bacteriuria in pregnancy. Urol ClinNorth Am 2015;42:547-60. doi: 10.1016/j.ucl.2015.05.004 |
|
==>> Xem thêm: Sẩy thai tái phát – Y học chứng thực trong thúc đẩy triển vọng kết quả trẻ sinh sống
TÀI LIỆU THAM KHẢO
- McCormick T, Ashe RG, Keamey PM. ưrinary tract infection in pregnancy. Obstet Gynaecol 2008;10:156-62. doi: 10. 1576/toag. 10.3.156.27418
- Patterson TF, Andriole VT. Bacteriuria in pregnancy. Infect Dis Clin North Am 1987;1:807-22.
- Nicolle LE, Gupta K, Bradley SF, Colgan R, DeMuri GP, Drekonja D, et al. Clinical practice guideline for the management of asymptomatic bacteriuria: 2019 update by the Infectious Diseases Society of America. Clin Infect Dis 2019;68:e83- 110. doi: 10.1093/cid/ciyl 121
- Smaill FM, Vazquez JC. Antibiotics for asymptomatic bacteriuria in pregnancy. Cochrane Database Syst Rev 2019, Issue 11. Art. No.: CD000490. doi: 10.1002/14651858.CD000490.pub4
- Owens DK, Davidson KW, Krist AH, Barry MJ, Cabana M, Caughey AB, et al. Screening for asymptomatic bacteriuria in adults: ưs Preventive Services Task Force recommendation statement. JAMA 2019;322:1188-94. doi: 10.1001/jama.2019.13069
- ưnlu BS, Yildiz Y, Keles I, Kaba M, Kara H, Tasin c, et al. Urinary tract infection in pregnant population, which empirical antimicrobial agent should be speciíied in each of the three trimesters? Ginekol Pol 2014;85:371-6. doi: 10.17772/gp/l744
- Zhanel GG, Hisanaga TL, Laing NM, DeCorby MR, Nichol KA, Weshnoweski B, et al. Antibiotic resistance in Escherichia coli outpatient urinary isolates: fmal results from the North American ưrinary Tract Infection Collaborative Alliance (NAƯTICA). NAƯTICA Group. Int J Antimicrob Agents 2006;27:468-75. doi: 10. 1016/j. ij antimi cag.2006.02.009
- Wing DA. Pyelonephritis in pregnancy: treatment options for optimal outcomes. Drugs 2001;61:2087-96. doi: 10. 2165/00003495-200161140-00006
- Denoble A, Reid HW, Krischak M, Rosett H, Sachdeva s, Weaver K, et al. Bad bugs: antibiotic-resistant bacteriuria in pregnancy and risk of pyelonephritis. Am J Obstet Gynecol MFM 2022;4:100540. doi: 10.1016/j.ajogmf.2021.100540
- Gilstrap LC III, Ramin SM. Urinary tract infections during pregnancy. Obstet Gynecol ClinNorth Am 2001;28:581-91. doi: 10. 1016/s0889-8545(05)70219-9
- Jolley JA, Wing DA. Pyelonephritis in pregnancy: an update on treatment options for optimal outcomes. Drugs 2010;70:1643-55. doi: 10.2165/11538050-000000000- 00000
- ACOG methodology: clinical consensus methodology. American College of Obstetricians and Gynecologists. Obstet Gynecol 2021; 138: 523-26. doi: 10.1097/AOG.0000000000004520
- Kazemier BM, Koningstein FN, Schneeberger c, Ott A, Bossuyt PM, de Miranda E, et al. Matemal and neonatal consequences of treated and untreated asymptomatic bacteriuria in pregnancy: a prospective cohort study with an embedded randomised controlled trial. Lancet Infect Dis 2015;15:1324-33. doi: 10.1016/S1473- 3099(15)00070-5
- Foley ME, Farquharson R, Stronge JM. Is screening for bacteriuria in pregnancy worthwhile? Br Med J (Clin Res Ed) 1987; 295:270. doi: 10.1136/bmj.295.6592.270
- Langermans LM, Cools w, Van Limbergen I, Gucciardo L, Faron G. optimal timing to screen for asymptomatic bacteriuria during pregnancy: first vs second trimester. J Perinat Med 2021;49: 539^15. doi: 10.1515/jpm-2020-0322
- Hill JB, Sheffield JS, Mclntire DD, Wendel GD Jr. Acute pyelonephritis in pregnancy. Obstet Gynecol 2005;105:18-23. doi: 10.1097/01. AOG.OOOO 149154.96285 ,a0
- McDonnold MA, Friedman AM, Raker CA, Anderson BL. Firsttrimester pyelonephritis is associated with later initiation of prenatal care: a retrospective cohort analysis. Am J Perinatol 2012; 29:141-6. doi: 10.1055/S-0031-1295655
- American Academy of Pediatrics; American College of Obstetricians and Gynecologists. Guidelines íồrperinatal care. 8th ed. AAP; ACOG; 2017.
- O’Leary BD, Armstrong FM, Byme s, Talento AF, O’Coigligh s. The prevalence of positive urine dipstick testing and urine culture in the asymptomatic pregnant woman: a cross-sectional study. Eur J Obstet Gynecol Reprod Biol 2020;253:103-7. doi: 10.1016/j.ejogrb.2020.08.004
- Schneeberger c, van den Heuvel ER, Erwich JJ, Stolk RP, Visser CE, Geerlings SE. Contamination rates of three urinesampling methods to assess bacteriuria in pregnant women. Obstet Gynecol 2013;121:299-305. doi: 10.1097/AOG. 0b013e31827e8cfe
- Macejko AM, Schaeffer AJ. Asymptomatic bacteriuria and symptomatic urinary tract iníections during pregnancy. Urol Clin North Am 2007;34:35^12. doi: 10.1016/j.ucl.2006.10.010
- Tita AT, Biggio JR, Chapman V, Neely c, Rouse DJ. Perinatal and matemal outcomes in women with sickle or hemoglobin c trait. Obstet Gynecol 2007;110:1113-9. doi: 10.1097/01.AGG.0000285995.41769.83
- Baill IC, Witter FR. Sickle trait and its association with birthweight and urinary tract iníections in pregnancy. Int J Gynaecol Obstet 1990;33:19-21. doi: 10.1016/0020-7292(90)90649-6
- Kasparek J, Burkhardt T, Hoesli I, Amstad Bencaiova G. Pregnancy outcomes in women with a hemoglobinopathy trait: a multicenter, retrospective study. Arch Gynecol Obstet 2021;304: 1197-203. doi: 10.1007/s00404-021-06058-y
- Schneeberger c, Erwich JJ, van den Heuvel ER, Mol BW, Ott A, Geerlings SE. Asymptomatic bacteriuria and urinary tract iníection in pregnant women with and without diabetes: cohort study. Eur J Obstet Gynecol Reprod Biol 2018;222:176-81. doi: 10.1016/j.ejogrb.2017.12.013
- Widmer M, Lopez I, Gũlmezoglu AM, Mignini L, Roganti A. Duration of treatment for asymptomatic bacteriuria during pregnancy. Cochrane Database Syst Rev2015, Issue 11. Art. No.: CD000491. doi: 10.1002/14651858.CD000491.pub3
- Wang T, Wu G, Wang J, Cui Y, Ma J, Zhu z, et al. Comparison of single-dose fosfomycin tromethamine and other antibiotics for lower uncomplicated urinary tract iníection in women and asymptomatic bacteriuria in pregnant women: a systematic review and meta-analysis. Int J Antimicrob Agents 2020;56: 106018. doi: 10.1016/j .ijantimicag.2020.106018
- Gupta K, Hooton TM, Naber KG, Wullt B, Colgan R, Miller LG, et al. International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: a 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Iníectious Diseases. Infectious Diseases Society of America, European Society for Microbiology and Infectious Diseases. Clin Infect Dis 2011 ;52:103. doi: 10.1093/cid/ciq257
- FitzGerald MP, Graziano s. Anatomic and hinctional changes of the lower urinary tract during pregnancy. ưrol Clin North Am 2007;34:7-12. doi: 10.1016/j.ucl.2006.10.007
- Aslan D, Aslan G, Yamazhan M, Ispahi c, Tinar s. Voiding symptoms in pregnancy: an assessment with intemational prostate symptom score. Gynecol Obstet Invest 2003;55:46- 9. doi: 10.1159/000068957
- Simerville JA, Maxted wc, Pahira JJ. ưrinalysis: a comprehensive review. Am Fam Physician 2005;71:l 153-62.
- Chu CM, Lowder JL. Diagnosis and treatment of urinary tract iníections across age groups. Am J Obstet Gynecol 2018;219: 40-51. doi: 10.1016/j.ajog.2017.12.231
- Graham JC, Galloway A. ACP Best Practice No 167: the laboratory diagnosis of urinary tract infection. J Clin Pathol 2001;54: 911-9. doi: 10.1136/jcp.54.12.911
- Vazquez JC, Abalos E. Treatments for symptomatic urinary tract infections during pregnancy. Cochrane Database Syst Rev 2011, Issue 1. Art. No.: CD002256. doi: 10. 1002/14651858.CD002256.pub2
- Naber KG, Schito G, Botto H, Palou J, Mazzei T. Surveillance study in Europe and Brazil on clinical aspects and Antimicrobial Resistance Epidemiology in Females with Cystitis (ARESC): implications for empiric therapy. Eur ưrol 2008;54: 1164-75. doi: 10.1016/j.eururo.2008.05.010
- Emami A, Javanmardi F, Pirbonyeh N. Antibiotic resistant proíìle of asymptomatic bacteriuria in pregnant women: a systematic review and meta-analysis. Expert Rev Anti Iníect Ther 2020;18: 807-15. doi: 10.1080/14787210.2020.1759420
- Goldberg o, Koren G, Landau D, Luneníeld E, Matok I, Levy A. Exposure to nitroĩurantoin during the íĩrst trimester of pregnancy and the risk for major malíồrmations. J Clin Pharmacol 2013;53:991-5. doi: 10.1002/jcph. 139
- Crider KS, Cleves MA, Reeíhuis J, Berry RJ, Hobbs CA, Hu DJ. Antibacterial medication use during pregnancy and risk of birth deíects: National Birth Defects Prevention Study. Arch Pediatr Adolesc Med 2009;163:978-85. doi: 10.1001 /archpediatrics.2009.188
- Glaser AP, Schaeffer AJ. ưrinary tract iníection and bacteriuria in pregnancy. ưrol ClinNorth Am 2015;42:547-60. doi: 10. 1016/j.ucl.2015.05.004
- Schulz GS, Schutz F, Spielmann FV, da Ros Lư, de Almeida JS, Ramos JG. Single-dose antibiotic therapy for urinary infections during pregnancy: a systematic review and meta-analysis of randomized clinical trials. Int J Gynaecol Obstet 2022;159:56-64. doi: 10.1002/ijgo. 14087
- Philipps w, Fietz AK, Meixner K, Bluhmki T, Meister R, Schaeíer c, et al. Pregnancy outcome after íĩrst-trimester exposure to fosfomycin for the treatment of urinary tract infection: an observational cohort study. Infection 2020;48:57-64. doi: 10.1007/S15010-019-01342-1
- Mannucci c, Dante G, Miroddi M, Facchinetti F, D’Anna R, Santamaria A, et al. Vigilance on use of drugs, herbal Products, and food supplements during pregnancy: íocus on íosíồmycin. J Matem Fetal Neonatal Med 2019;32:125-8. doi: 10. 1080/14767058.2017.1373761
- Schneeberger c, Geerlings SE, Middleton p, Crowther CA. Interventions for preventing recurrent urinary tract infection during pregnancy. Cochrane Database Syst Rev 2015, Issue 7. Art. No.: CD009279. doi: 10.1002/14651858.CD009279.pub3
- Epp A, Larochelle A. No. 250-recurrent urinary tract infection. J Obstet Gynaecol Can 2017;39:e422-31. doi: 10.1016/j.jogc. 2017.08.017
- Albert X, Huertas I, Pereiró II, Saníélix J, Gosalbes V, Perrota c. Antibiotics for preventing recurrent urinary tract infection in nonpregnant women. Cochrane Database Syst Rev 2004, Issue 3. Art. No.: CD001209. doi: 10.1002/14651858.CD001209.pub2
- de Rossi p, Cimerman s, Truzzi JC, Cunha CA, Mattar R, Martino MD, et al. Joint report of SBI (Brazilian Society of Infectious Diseases), FEBRASGO (Brazilian Federation of Gynecology and Obstetrics Associations), SBU (Brazilian Society of ưrology) and SBPC/ML (Brazilian Society of Clinical Pathology/Laboratory Medicine): recommendations for the clinical management of lower urinary tract infections in pregnant and non-pregnant women. Braz J Iníect Dis 2020;24:110-9. doi: 10.1016/j.bjid.2020.04.002
- Anger J, Lee u, Ackerman AL, Chou R, Chughtai B, Clemens JQ, et al. Recurrent uncomplicated urinary tract iníections in women: AƯA/CUA/SUFU guideline. J Urol 2019;202:282-9. doi: 10.1097/JƯ.0000000000000296
- Stephens AJ, Baker A, Barton JR, Chauhan SP, Sibai BM. Clinical ííndings predictive of matemal adverse outcomes with pyelonephritis. Am J Obstet Gynecol MFM2022;4:100558. doi: 10.1016/j.ajogmf.2021.100558
- Wing DA, Fassett MJ, Getahun D. Acute pyelonephritis in pregnancy: an 18-year retrospective analysis. Am J Obstet Gynecol 2014;210:219.el-6. doi: 10.1016/j.ajog.2013.10.006
- Chen Y, Nitzan o, Saliba w, Chazan B, Colodner R, Raz R. Are blood cultures necessary in the management of women with complicated pyelonephritis? J Infect 2006;53:235-40. doi: 10. 1016/j.jinf.2005.12.005
- Mittal p, Wing DA. Urinary tract infections in pregnancy. Clin Perinatol 2005;32:749-64. doi: 10.1016/j.clp.2005.05.006
- Wing DA, Hendershott CM, Debuque L, Millar LK. A randomized trial of three antibiotic regimens for the treatment of pyelonephritis in pregnancy. Obstet Gynecol 1998;92:249-53. doi: 10. 1016/s0029-7844(98)00156-2
- Sanchez-Ramos L, McAlpine KJ, Adair CD, Kaunitz AM, Delke I, Briones DK. Pyelonephritis in pregnancy: once-a-day ceíìriaxone versus multiple doses of cefazolin. A randomized, doubleblind trial. Am J Obstet Gynecol 1995;172:129-33. doi: 10. 1016/0002-9378(95)90100-0
- Artero A, Alberola J, Eiros JM, Nogueira JM, Cano A. Pyelonephritis in pregnancy. How adequate is empirical treatment? Rev Esp Quimioter 2013;26:30-3.
- Moradi Y, Eshrati B, Motevalian SA, Majidpour A, Baradaran HR. A systematic review and meta-analysis on the prevalence of Escherichia coli and extended-spectrum b-lactamase-producing Escherichia coli in pregnant women. Arch Gynecol Obstet 2021;303:363-79. doi: 10.1007/s00404-020-05903-w
- Rizvi M, Khan F, Shukla I, Malik A, Shaheen. Rising prevalence of antimicrobial resistance in urinary tract infections during pregnancy: necessity for exploring newer treatment options. J Lab Physicians 2011;3:98-103. doi: 10.4103/0974-2727.86842
- Melzer M, Petersen I. Mortality following bacteraemic infection caused by extended spectrum beta-lactamase (ESBL) producing E. coli compared to non-ESBL producing E. coli. J Iníect 2007;55:254-9. doi: 10.1016/j.jinf.2007.04.007
- Greer LG, Roberts sw, Sheffield JS, Rogers VL, Hill JB, Mcintire DD, et al. Ampicillin resistance and outcome differences in acute antepartum pyelonephritis. Infect Dis Obstet Gynecol 2008;2008:891426. doi: 10.1155/2008/891426
- Sandberg T, Brorson JE. Effícacy of long-term antimicrobial prophylaxis after acute pyelonephritis in pregnancy. Scand J Inĩect Dis 1991;23:221-3. doi: 10.3109/00365549109023404
- Van Dorsten JP, Lenke RR, Schiírin BS. Pyelonephritis in pregnancy. The role of in-hospital management and nitroíùrantoin suppression. J Reprod Med 1987;32:895- 900.