Toan hóa ở một bệnh nhân nữ trẻ tuổi. File PDF ở đây.
Dịch bài: Nguyễn Đức Thanh Liêm, Sài Gòn -Việt nam, 29/01/2023.
“Toan hóa ở một bệnh nhân nữ trẻ tuổi” được viết bởi các tác giả mà mình chưa từng gặp như rất nhiều tác giả lớn khác. Mình đã tìm kiếm thuật ngữ “toan hóa” và “nữ trẻ” bởi một người bạn của mình đã gặp một tình huống tương tự, rồi mình tìm được bài như ý muốn từ PubMed.
Bài đầu này có nội dung khó nhằn, cũng như các khía canh khác của mảng ngành hồi sức tích cực, vì vậy, sau bài đầu này làm mình phải tiếp tục xem thêm và ghi chép lại một bài liên quan ở kênh YouTube (mà mình có để nguồn) để bù tiếp phần nội dung mình đang thấy cần có.
Bài thứ ba mình cho rằng hay. Bởi cách mà các tác giả của cuốn IBCC đã dùng cho website của họ làm mình cảm thấy mọi thứ trở nên dễ tiếp nhận hơn từng ít một, và cũng dễ để ứng dụng trong những tình huống thực tế.
Bài cuối cùng chứa một lượng lớn kiến thức, trích dẫn, lẫn các chi tiết khác. Các mà anh Alex Yartsev viết bài có cái gì đấy làm mình thấy bản thân website của ảnh là một sinh vật đẹp lộng lẫy trong “khoảng rừng y khoa rậm rạp.” Nếu đọc hết toàn bộ phần bài này và bạn cảm thấy khó nhớ, thậm chí khó hiểu, đừng lo lắng. Dù mình đã bỏ thời gian để hoàn thành bốn bản dịch này, nhưng mình vẫn cần phải đọc lại liên tục để hình dung tốt hơn cho nội dung của bài dịch lẫn lượng kiến thức liên quan.
Bác sĩ (BS) Feinstein
Chào đón các bạn đến với Khoa Thận-niệu. Lần này chúng ta sẽ thảo luận về một trường hợp bệnh nhân nữ trẻ tuổi nhiễm toan chuyển hóa. Chẩn đoán tình trạng toan hóa này sẽ giúp chúng ta đi đến được rối loạn gốc rễ mà bệnh nhân mắc phải.
Một phụ-nữ-34-tuổi người Phi-luật-tân nhập vào Trung tâm Y tế Nam California của Học viện Los Angeles County do buồn nôn và mửa trong vòng 3 tuần trước nhập viện. Bốn năm trước bệnh nhân cũng nhập viện với bối cảnh tương tự là một đợt mửa liên tục mà không có được kết luận cuối cùng. Ba năm trước, khi ở Phi-luật-tân, ở bệnh nhân xuất hiện tình trạng liệt, và được phát hiện bởi tình trạng hạ kali máu, được bù Kali. Bệnh nhân ngưng dùng Kali ba tuần trước khi nhập viện lần này. Trong ba năm qua, bệnh nhân uống tám ly rượu mỗi ngày.
Sáu tuần trước nhập viện, bệnh nhân ho có đờm vàng và vì lý do này cô ấy dùng Tetracyclin kèm các thuốc chống sung huyết. Lúc khởi phát tình trạng buồn nôn và ói mửa như hiện tại, bệnh nhân cảm thấy chán ăn và rồi đau bụng vùng phần tư trên bên phải. Cảm giác đau đớn này tăng lên khi ăn. Sau cùng ở bệnh nhân xuất hiện tình trạng nôn mửa sau mỗi lần ăn. Kết cục là bệnh nhân đã mất 20-pound cân nặng (khoảng 9kg). Bệnh nhân cũng cảm giác đau nhức xương ở hai chân trong khoảng một tháng nay. Cô ấy đi khám bác sĩ và được ghi thuốc cimetidine, nhưng sự đau đớn vẫn tiếp tục. Bệnh nhân không đi tiêu phân đen, không tiêu chảy, không nôn ra máu, cũng không thay đổi màu sắc của phân hoặc nước tiểu.
Bệnh nhân đã không còn răng sau khi sinh con đầu. Không có tiền căn nổi mẩn trên da, sưng khớp, chứng Raynaund, khó nuốt hoặc khô mắt.
Khám lâm sàng thấy bệnh nhân có tổng trạng chung là một cô gái phát triển đầy đủ, hoàn thiện, nhưng kém dinh dưỡng, ốm và hơi bứt rứt. Huyết áp 100/70mmHg ở tư thế nằm ngửa, mạch 80/phút, tần số thở 24/phút, thân nhiệt (hậu môn) 37 độ C (100.6 độ F). Da lạnh khô không ban. Không có loét giác mạc hoặc vàng kết mạc mắt. Ổ miệng không còn răng. Tuyến giáp không lớn.
Nghe phổi và tim bình thường. Ấn chẩn vùng phần trên bên phải của bụng đau nhẹ nhưng không gây đau khi làm phản ứng dội. Không sờ thấy tạng nào lớn trong ổ bụng. Có giảm sức cơ toàn thân. Không phản xạ bệnh lý.
Kết quả xét nghiệm gồm: Nước tiểu pH 6.5, Protein 2+, không trụ. Hemoglobin (Hgb) 12 g/dL; bạch cầu 16,300/mm3, với tế bào chưa trưởng thành (bands) 8, tế bào đa nhân 82, và 7 lymphs. Natri máu 144 mEq/L, kali 2.3 mEg/L, chloride 128 mEq/L, bicarbonate 9 mEq/L, calcium 8.9mg/dL, phosphate 3.5mg/dL, glucose 127 mg/dL, urea nitrogen 59 mg/dL, uric acid 5.6 mg/dL, creatinine 4.0 mg/dL, protein toàn phần 9.3 g/dL, albumin 3.8 g/dL, alkaline phosphatase 384 IU, creatinine phosphokinase 76 IU, bilirubin 0.7 mg/dL, SGPT 33 IU, SGOT 28 IU, amylase 556 IU. Khí máu động mạch pH 7.15, pO2 123 mmHg, pCO2 15 mmHg, HCO3 5 mEq/L.
Xquang ngực thẳng thấy thâm nhiễm vùng phân thùy lưỡi phổi. Phim bụng đứng thấy calcium hóa thận hai bên. Hình ảnh học đường tiêu hóa trên thấy giãn nở các quai và phù nề các nếp gấp tá tràng. Bệnh nhân được nhập vào khoa hồi sức ngoại. Truyền natri bicarbonate. Các ngày tiếp theo bệnh nhân xuất hiện tình trạng co rút chân tay. Natri máu 164 mEq/L, bicarbonate 20 mEq/L, Kali máu 3.7 mEq/L, calcium 7.2 mg/dL, phosphate 0.5 mg/dL, urea nitrogen 35 mg/dL và creatinine 3.0 mg/dL. Bệnh nhân được bổ sung Calcium gluconate.
Ba ngày sau nhập viện, bệnh nhân cải thiện. Natri máu 145 mEq/L, kali 3.7 mEq/L, bicarbonate 17 mEq/L, calcium 7.4 mg/dL và phosphate 3.4 mg/dL. Bệnh nhân được truyền dung dịch Shohl (Sodium Citrate and Citric Acid).
Các xét nghiệm chẩn đoán khác gồm: mức thanh thải protein 24-giờ 1.6 g, kháng thể kháng nhân (Anti-nuclear antibody, ANA) 1:160. Bổ thể máu (serum complement level) của C3 là 72 mg/dL và C4 là 30mg/dL. Xét nghiệm cố định latex hiệu chỉnh là 1:2,560. IgG máu 2,260 mg/dL, IgA 817 mg/dL, IgM 124 mg/dL. HLA phenotype A11, B7, BW60 CW32. Kết quả đo độ tiết lệ của mắt (Schirmer test) là 4-5mm ở mắt phải và trái.
Tannen bây giờ sẽ thảo luận các chẩn đoán phân biệt (the differential diagnosis, DDx) của sự rối loạn kiềm toan ở bệnh nhân này cũng như nguyên nhân gốc rễ.
Tannen
Chẩn đoán phân biệt ở bệnh nhân này có thể tìm được khi bước đầu tập trung vào hai rối loạn chủ đạo: hạ kali máu và toan chuyển hóa. Sẽ là hợp lý khi cho rằng tình trạng hạ kali máu phản ánh sự cạn kiệt nguồn Kali thực tế trong cơ thể, khi nhìn vào sự thiếu hụt lâu dài cũng như thiếu vắng của bất cứ bằng chứng nào khác gây hạ kali thứ phát gây ra sự di chuyển (tái phân bố) kali ra vào tế bào. Các yếu tố gây hạ kali máu gây ra do sự chuyển dịch Kali vào trong khoang nội bào được liệt kê ở Bảng I. Bệnh nhân này không có tình trạng kiềm hóa, không uống các thuốc hoặc chất độc, cũng không có tiền căn gia đình hoặc các được liệt tái diễn mà gợi ý cho chẩn đoán liệt cách hồi do hạ kali máu (hypokalemic periodic paralysis).
Các bệnh nguyên hay gặp nhất gây cạn kiệt kali trong khi tình trạng toan kiềm bình thường hoặc kiềm chuyển hóa có thể hoặc là rất nhẹ, hoặc là quá nặng. Do đó, các DDx của thiếu hụt kali máu liên quan đến toan chuyển hóa với một vài chẩn đoán được liệt kê ở Bảng II.
Bảng I. Hạ kali máu thứ phát do sự dịch chuyển giữa tế bào và máu
- Kiềm hóa máu
- Dùng isulin
- Chất đồng vận beta-adrenergic
- Uống nuốt Toluene
- Liệt giãn cách di truyền
Bảng II. Cạn kiệt kali trong bối cảnh toan chuyển hóa
Tiêu chảy
2) Adenoma vi mao
3) Nhiễm toan keton
- Tiểu đường
- Nhịn đói
4) Phẫu thuật tạo hình bàng quang từ trực tràng sigmoid.
- Ống lượn gần (type 2)
- Ống lượn xa (type 1)
- Do thuốc ức chế carbonic anhydrase.
Có thể phân định các rối loạn liệt kê ở Bảng II thông qua việc đánh giá lượng kali tiết ra trong nước tiểu. Khi thiếu hụt kali trong cơ thể bởi nguyên nhân không phải từ thận, thận giảm thải kali. Một vài cơ chế có thể thông qua các đáp ứng giúp bảo tồn lượng kali trong cơ thể như giảm tiết aldosteron, ngưng giải phóng muối nước đến ống lượn xa, tăng tạo và thải ammoniac ở thận, và giảm lượng kali trong huyết thanh. Các nghiên cứu hiện tại từ phòng xét nghiệm chỉ ra rằng cơ chế thích nghi của thận độc lập với các cơ chế khác, đóng một vai trò quan trọng trong quá trình tìm đến điểm cân bằng này. Thận bình thường thải ít hơn 20 mEq kali mỗi ngày. Định lượng kali trong nước tiểu có thể có sai sót, bởi vì đa niệu là biến chứng của tình trạng cạn kiệt kali. Do vậy, nồng độ kali tương đối thấp có thể vẫn phản ảnh được tỉ lệ bài tiết kali. Tỉ lệ tiết này (<6%) hoặc nồng độ kali: tỉ lệ thải creatinine (<20 mEq/g) là một thông số hữu ích để cho biết rằng chức năng thận với việc giữ lại kali vẫn ổn, khi dùng một mẫu xét nghiệm nước tiểu bất kỳ.
Trong tình huống bệnh nhân của chúng ta, không có xét nghiệm định lượng kali niệu; tuy nhiên, không có bệnh sử nào cho thấy bệnh nhân có ỉa lỏng. U nhú trực tràng (villous adenoma) có thể gây ra hoặc là kiềm hoặc là toan chuyển hóa, nhưng có thể ít nghĩ đến bởi bệnh sử không gợi ý. Thêm nữa, dựa vào các thông tin bổ sung, chỉ ra rằng có thể một chẩn đoán khác sẽ phù hợp hơn để lý giải cho tình huống của bệnh nhân này. Có thể loại trừ tình trạng nhiễm toan do keton hoặc của đái tháo đường, hoặc do nhịn đói ở bệnh nhân bởi một vài lập luận trong đó có một sự thật rằng ở bệnh nhân có toan chuyển hóa tăng chlore máu với một khoảng trống Anion bình thường. Ở các chẩn đoán cuối cùng nơi Bảng II, toan hóa ống thận (renal tubular acidosis, RTA) hoặc do ống lượn gần (type 2) hoặc từ ống lượn xa (type 1). Cũng trong nhóm này có nguyên nhân dùng Carbonic anyhydrase inhibitors, gây ra tình trạng RTA do thuốc trong đó kết hợp hai đặc điểm bệnh của RTA type 1 và 2. Cả hai loại RTA này đều gây toan chuyển hóa tăng chlore máu và thiếu hụt kali máu, gây ra bởi việc mất kali qua nước tiểu. Tuy nhiên, cơ chế bên dưới làm mất kali qua thận là rất khác biệt trong hai nhóm tình huống này.
Với Toan hóa ống thận do ống lượn gần (type 2), có đặc điểm do bất thường tái hấp thu bicarbonate ở ống lượn gần, trong khi việc vận chuyển H+ ở ống lượn xa vẫn bình thường. Kali máu có thể bình thường hoặc hơi giảm ở các bệnh nhân không được điều trị. Tuy nhiên, tình trạng mất mát kali qua thận thường xảy ra trong quá trình điều trị truyền NaHCO3. Kiềm hóa máu gây tăng lượng bicarbonate và do đó làm tăng lượng bicarbonate được lọc nơi cầu thận. Ống lượn gần của cầu thận bị quá tải và không hấp thụ được hết lượng bicarbonate trong dịch lọc, lượng này được gửi tới ống lượn xa với một nồng độ cao hơn bình thường làm kéo theo cả natri lẫn lượng nước bên trong ống thận. Các sự kiện này làm tăng sự đào thải kali, đặc biệt khi có thêm nồng độ cao của aldosterone mà thường thấy ở bệnh nhân có bệnh lý RTA type 2. Nồng độ aldosterone máu cao xuất hiện hoặc do tình trạng giảm thể tích máu thứ phát sau (1) sự tái hấp thu NaHCO3 bất thường ở ống lượn gần và/hoặc (2) do sự kích động của tình trạng toan hóa lên quá trình tiết aldosterone. Sự giảm tái hấp thu kali từ ống lượn gần có đóng vai trò quan trọng trong sự mất mát kali trong bối cảnh RTA type 2 hay không thì hiện tại chưa được xác định rõ ràng.
Toan hóa ống lượn xa (RTA type 1) xảy ra do tình trạng bất thường vận chuyển H+ ở ống lượn xa. Đến từ (1) hoặc do sự bất toàn của khả năng vận chuyển của bơm H+ từ bế bào biểu mô vào lòng ống lượn; hoặc do (2) sự suy giảm tính thấm đối với H+ từ tế bào biểu mô vào máu làm ứ H+ trong tế bào biểu mô ống lượn xa. Không giống như RTA type 2 (tổn thương ở ống lượn gần), tình trạng cạn kiệt kali sẽ hay gặp hơn ở các bệnh nhân không được điều trị. Có vài yếu tố gây ra tình trạng mất mát Kali ở thận. Toan hóa ức chế sự tái hấp thu natri ở ống lượn gần. Việc này làm tăng thải natri và nước đến ống lượn xa và cùng với việc kém hấp thu natri ở ống lượn xa, natri trở nên cạn kiệt ở bệnh nhân RTA type 1. Cũng giống như trong RTA type 2, tình trạng giảm thể tích và dường như thêm tình trạng toan hóa đã đưa đến sự kích tiết aldosterone. Do vậy, nếu tình trạng RTA type 2 không được điều trị, tỉ lệ natri và nước được gửi đến ống lượn xa sẽ tăng lên cùng với mức aldosterone cao trong máu. Các kích thích làm tiết kali này có thể trở nên nặng nề hơn bởi sự bất hoạt tiết H+ như bình thường ở ống lượn xa. Ngược lại với RTA type 2, điều trị tình trạng toan với NaHCO3 giúp giảm bớt tình trạng mất K+ ở đa số bệnh nhân RTA type 1. Tuy nhiên, ở một vài bệnh nhân, vì một lý do nào đó không rõ ràng, K+ vẫn mất liên tục ngay cả khi tình trạng toan hóa đã được điều chỉnh. Dù chúng ta không đo được K+ niệu (ở bệnh nhân này), sự xuất hiện của tình trạng toan hóa tăng chlore và hạ kali máu mà không kèm một bệnh sử tiêu chảy giúp hướng đến chẩn đoán toan hóa ống thận. Các đặc điểm giúp phân biệt giữa toan hóa ống thận type 2 so với type 1 được liệt kê ở Bảng III. Các dữ kiện có được chỉ ra tình trạng thương tổn nơi ống lượn xa trong trường hợp bệnh nhân này. Như đã thảo luận trước đó, độ nặng của tình trạng thiếu hụt kali với tổn thương ở ống lượn xa tương ứng với mức độ sụt giảm của nồng độ bicarbonate máu. Bởi tình trạng calcium hóa thận là điểm nhấn của RTA type 1 hơn là của type 2, nên rõ ràng thương tổn ở ống lượn xa là vấn đề có ở bệnh nhân này. Mẫu xét nghiệm nước tiểu bất kỳ của bệnh nhân có pH 6.5 đi kèm với nồng độ HCO3- máu thấp (5-9 mEq/L) cũng tiếp tục gợi ý cho thương tổn ở ống lượn xa. Để đáp ứng với tình trạng toan hóa nặng, pH nước tiểu sẽ giảm thấp trong RTA type 2, nhưng vẫn cao một cách bất thường trong RTA type 1 dù toan đến thế nào.
Trên lý thuyết, nếu bệnh nhân có RTA type 2 kèm một ngưỡng HCO3 thận ở mức 5 mEq/L, pH nước tiểu có thể cao, nhưng dường như điều này khó có thể xảy ra. Trong tình huống mức toan tự phát trở nên cực kỳ nặng, như trường hợp bệnh nhân này, pH nước tiểu lấy ở thời điểm bất kỳ sẽ giúp chúng ta đánh giá được khả năng điều chỉnh của ống lượn xa đối với mức chênh áp H+ bình thường giữa tế bào và dịch lọc. Tuy nhiên, nếu tình trạng toan hóa ít nghiêm trọng hơn, ví dụ, khi nồng độ HCO3 lớn hơn 10 mEq/L, đáp ứng pH với các yếu tố kích thích có tính toan hóa (NH4Cl hoặc CaCl2) là cần thiết để khẳng định rằng có tổn thương ở ống lượn xa.
Một xét nghiệm khác để phân biệt giữa toan hóa ống lượn gần (RTA type 2) với toan hóa ống lượn xa (RTA typ1) là đánh giá độ chênh biệt pCO2 giữa nước tiểu và máu (U-B pCO2) ở các tình huống mà trong đó lượng HCO3 được thải nhiều trong nước tiểu. Do tình trạng tách nước khỏi acid carbonic bị trì hoãn ở ống lượn xa, nên mức độ pCO2 trong nước tiểu tăng lên giúp gián tiếp đánh giá được sự giải phóng H+ ở vị trí này của cầu thận. Trong RTA type 1, U-B pCO2 < 10 mmHg; trong khi RTA type 2 con số này > 30 mmHg.
Một bằng chứng thêm nữa để phân biệt giữ hai dạng RTA là mức độ đào thải citrate trong nước tiểu, mà sẽ thấp ở RTA type 1, nhưng bình thường hoặc cao ở RTA type 2. Cuối cùng, sự tồn tại của tổn thương ống lượn gần có thể xác định bằng nghiên cứu điều chỉnh HCO3- cổ điển và do lườn tỉ lệ tái hấp thu HCO3-. Thông số này có thể thấp với RTA type 2 và bình thường với RTA type 1.
Nếu cùng xảy ra cả hai loại tổn thương, đây có thể là phương pháp duy nhất để chỉ ra được một cách chính xác tình trạng tổn thương của ống lượn gần.
Cũng có thể nghi ngờ tình trạng tổn thương ống lượn gần thông qua nhu cầu NaHCO3 để duy trì sự cân bằng toan kiềm sau khi lượng bicarbonate thiếu đã được điều chỉnh. Ở người lớn trưởng thành chỉ bị RTA do tổn thương ống lượn xa đơn thuần, lượng nhập HCO3 ít hơn 2-3 mEq/kg/ngày luôn đủ để giữ được tình trạng thăng bằng kiềm toan, trong khi với tổn thương ở ống gần luôn cần một lượng bù bicarbonate theo đường uống 3-4 mEq/kg/ngày.
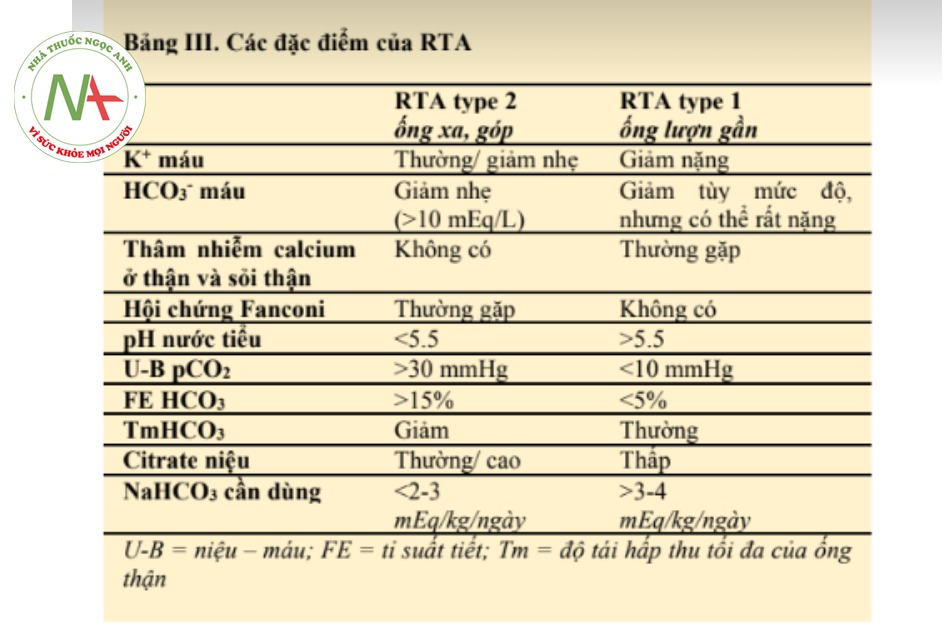
Cuối cùng, RTA type 2 thường liên quan đến thương tổn khác của chức năng ống lượn gần trong hội chứng Fanconi. Tôi giả định rằng ở bệnh nhân này không có đường trong nước tiểu; và mức acid uric là 5.6 gợi ý một mức thanh thải acid uric bình thường, dù rằng một người có thể nhận định sai khi đối diện với một tình huống chức năng thận bất thường xảy ra đồng thời. Không có xét nghiệm nào đo lường mức độ bài tiết amino acid. Lượng phosphate thấp tương đồng với chức năng thận; tuy nhiên, nếu không đo được lượng phosphate niệu thì không thể biết được liệu có mất qua thận hay không cũng như do nguyên nhân gì. Cũng cần phải nhắc rằng bản thân sự cạn kiệt nghiêm trọng phosphate có thể gây ra các bất thường liên quan đến sự toan hóa của cả ống lượn gần lẫn ống lượn xa. Thêm vào đó, tetracycline hết hạn sử dụng có thể gây ra tổn thương ống lượn gần. Ở trường hợp hạ kali máu xuất hiện trước khi dùng thuốc thì không có lý do gì phải nghi ngờ rằng nguyên nhân toan hóa là do thuốc. Tóm lại, đến hiện tại, dường như bệnh nhân toan hóa là do tổn thương ở ống lượn xa, dù không thể loại trừ việc có hay không tình trạng tổn thương đồng thời chức năng của ống lượn gần. Tiếp theo, chúng ta cần xác định được các nguyên nhân khả dĩ gây xuất hiện hội chứng này (RTA type 1).
Bảng IV liệt kê các nguyên nhân gây ra hạ kali máu do RTA do tổn thương ống lượn xa cũng như các nguyên nhân kích hoạt,đôi khi cũng chính là nguyên nhân trực tiếp gây bệnh. Tuy nhiên, ở trường hợp bệnh nhân này, mức độ gammaglobulin máu cao (5.5 g/dL) giúp ta tập trung vào các nguyên nhân tương ứng trong danh sách các chẩn đoán khả dĩ.
Bảng IV. Bệnh nguyên của tình trạng Toan hóa ống lượn xa
- Tiên phát
- Sơ sinh
- Người lớn
Bất thường gene liên quan đến men carbonic anhydras
Thâm nhiễm calcium ở thận do các nguyên nhân khác nhau
Thận xốp (tủy) thận
Các tình trạng làm tang gammaglobulin máu
Cạn kiệt phosphate
Do thuốc
- Amphotericine beta
- Vitamin D
- Toluene
- Lithium
- Thuốc gây mê
- Ức chế carbonic anhydrase
Nhóm các nguyên nhân làm tăng gammaglobulin máu gây ra RTA được liệt kê ở Bảng V. Hội chứng Sjogren chiếm một nửa các trường hợp gây RTA type 1 và tăng gammaglobulin máu đã được công bố. Hơn nữa, các hội chứng còn lại thường có liên quan đến hội chứng Sjogren. Bệnh nhân có xét nghiệm miễn dịch ANA dương tính, yếu tố thấp dương tính và test Schirmer dương tính giúp đưa đến chẩn đoán xác định là hội chứng Sjogren.
Không có dấu chứng nào gợi ý rằng hội chứng Sjogren ở bệnh nhân liên quan đến các rối loạn mang tính hệ thống, nhưng tôi xin nhấn mạnh rằng không thể loại trừ hoàn toàn khả năng bệnh nhân mắc Lupus bạn đổ hệ thống (Systemic Lupus Erythematosus, SLE) một cách chắc chắn.
Bảng V. RTA kèm tăng gammaglobulin máu
Hội chứng Sjogren hoặc bệnh lý liên quan
• Hội chứng Sjogren
• SLE
• Xơ gan mật tiên phát
• Viêm gan mạn hoạt động
• Viêm phế nang xơ hóa
• Bệnh tự miễn tuyến giáp
• Xuất huyết tăng globulin máu
• Tăng gamma globulin máu vô căn
• Bệnh lý macroglobulin máu
• Cryptoglobulin máu
Bệnh khác
• Lao
• Sarcoidosis
• Coccidioidomycosis
• Bệnh lý Hodgkin
• Đa u tủy
Điểm đáng quan tâm là cách mà tình trạng tăng globulin máu và hội chứng Sjogren lại gây ra tình trạng RTA. Phân nửa bệnh nhân có hội chứng Sjogren đặc trưng bởi tình trạng khô mắt, khô miệng và viêm khớp. Các triệu chứng ở mắt và miệng gây ra do sự thâm nhiễm tế bào lympho ở tuyến nước bọt và tuyến lệ, từ đó làm tổn thương chức năng bài tiết. Tình trạng thâm nhiễm lympho đó cũng tương tự ở thận trong đại đa số các trường hợp có hội chứng Sjogren gây RTA khi thận được xem xét qua góc nhìn giải phẫu bệnh. Phần lớn
các bằng chứng cho thấy mối tương quan giữa chức năng- và sinh lý bệnh rõ rệt được công bố bởi Shioji và cộng sự. Ba trong bốn trường hợp hội chứng Sjogren gây RTA có thâm nhiễm kẽ thận và bệnh nhân thứ tư có tình trạng xơ hóa kẽ, trong khi cả bốn trường hợp không có RTA lại có cấu trúc thận bình thường. Hình ảnh sinh lý bệnh học cũng tương tự ở các bối cảnh tăng globulin máu và RTA khác. Sự thâm nhiễm mô kẽ thận được mô tả ở các trường hợp RTA kèm tăng gammaglobulin máu vô căn, ban xuất huyết tăng gammaglobulin máu, viêm gan mạn hoạt đọng, xơ gan mật tiên phát, và SLE.
Trong khi các tổn thương thấy ở thận ở các bệnh này chỉ giới hạn ở các bệnh nhân có bất thường độ acid hóa nước tiểu lại không được công bố (Whether the renal findings in these diseases are limited solely to patients with abnormalities in urine acidification has not been delineated). Không có các bằng chứng thông qua thăm khám, xét nghiệm liên quan sinh lý bệnh của thận ở các trường hợp có RTA liên quan đến các nguyên nhân gây khác gây tăng globulin máu đã được liệt kê ở Bảng V, nhưng đa số các bệnh lý này có thể gây tổn thương ống thận và/hoặc viêm thận kẽ. Thêm nữa, tình trạng thâm nhiễm kẽ thận do các chất trung gian miễn dịch xảy ra do quá trình thải ghép có thể đi cùng với RTA.
Dù các dữ liệu gợi ý rằng có tình trạng thâm nhiễm tế bào lympho ở thận và sự xuất hiện của RTA là có liên quan với nhau ở bệnh nhân có hội chứng Sjogren và có lẽ ở cả các bệnh nhân có hội chứng RTA tăng globulin máu, nhưng mối liên quan tự nhiên này cũng không rõ ràng. Sự thâm nhiễm có thể là nguyên nhân chính gây hư hại tế bào thượng bì ống thận hoặc nói cách khác có thể phản ảnh quá trình các chất trung gian miễn dịch thay đổi chức năng của ống thận. Các mà quá trình này làm hư hại sự vận chuyển của ion H+ ở ống lượn xa hiện chưa được mô tả rõ ràng.
Cần nhấn mạnh rằng ở hội chứng Sjogren, ống thận cũng như rối loạn chức năng của ống thận có thể không giới hạn ở sự vận chuyển H+ nơi ống lượn xa không thôi. Các bất thường ở cơ chế cô đặc nước tiểu cũng được mô tả trong hội chứng này. Tuy nhiên, bởi cả RTA type 1 và tình trạng hạ kali máu có thể gây ảnh hưởng đến cơ chế cô đặc; nên không rõ liệu có hay không điều này gây phản ảnh tác dụng trực tiếp của tình trạng tổn thương mô kẽ thận hay nó là tình trạng thứ phát gây ra RTA và/hoặc hạ kali máu. Thêm nữa, dù ít được báo cáo hơn so với RTA type 1, toan hóa ống lượn gần cũng như các nguyên nhân khác gây rối loạn chức năng ống lượn gần, như hội chứng Fanconi, cũng được mô tả cùng với hội chứng Sjogren. Do đó, dù quá trình bệnh học thận trông có vẻ rất liên quan đến tổn thương ống lượn xa, nhưng nó cũng có thể kèm cả tổn thương ống lượn gần.
Tôi xin kết luận bằng cách nhấn mạnh giá trị của việc truyền bù bicarbonate tích cực ở các bệnh nhân toan hóa ống lượn xa. Các tác giả McSherry và Morris mới đây đã cho thấy sự cải thiện rõ rệt trong sự phát triển của trẻ em mắc RTA được điều trị với một lượng kiềm đủ và có thể sẽ có ích trong việc điều trị bệnh lý xương ở người trưởng thành.
Ngoài ra, các dữ liệu cũng gợi ý rằng liệu pháp kiềm hóa có thể giúp hạn chế sự hình thành sỏi thận và có lợi đối với tình trạng thâm nhiễm calci ở thận. Hai tác dụng này có thể mang lại do việc tăng thải citrate và giảm thải calci khi áp dụng trị liệu kiềm hóa máu.
Dù không có các báo cáo cụ thể về lợi ích của kiềm hóa máu ở bệnh nhân có hội chứng Sjogren mà gây ra RTA ống lượn xa, nhưng phương pháp này dường như có tiềm năng trong việc điều trị các rối loạn tương tự trong tương lai.
- Feinstein
Bây giờ BS. Richard Blau của phân khoa Thấp- học sẽ cho chúng ta một cái nhìn chung về các biểu hiện ngoài thận của hội chứng Sjogren.
- Blau
Bối cảnh bệnh nhân này cho thấy các điểm đặc trưng của hội chứng Sjogren. Với mục tiêu phân loại, hội chứng này thường được chia ra thành hai dạng, tiên phát và thứ phát. Cả hai dạng, đều có tình trạng khô mắt- miệng, nhưng dạng thứ phát thì liên quan đến bệnh lý thấp có tính hệ thống, ví dụ viêm khớp dạng thấp, xơ cứng hệ thống tiến triển hoặc Lupus ban đỏ hệ thống. Ngoài tuyến nước bọt và tuyến lệ bị ảnh hưởng, các tuyến ngoại tiết khác có thể cũng không bình thường như tuyến tiết chất nhờn của đường hô hấp trên và dưới, tụy và cơ quan sinh dục ở nữ.
Các triệu chứng tiết của mắt và nước bọt gây ra bởi sự giảm sút tiết nước mắt và nước bọt. Sự phá hủy của thượng bì giác mạc có thể đưa đến đau, đỏ mắt và nhạy cảm với ánh sáng. Ở bệnh nhân này, tình trạng khô giác mạc được xác định qua Schirmer test. Hậu quả của khô miệng là nuốt khó, loét ở môi và niêm mạc trong của má, teo lưỡi. Sâu răng nặng có thể đưa đến tình trạng mất răng, như ở bệnh nhân này.
Các dấu hiệu bệnh lý ở tuyến là diễn tiến viêm kèm với tình trạng thâm nhiễm bạch cầu, tế bào máu quanh ống tuyến và thâm nhiễm vào các tế bào chức năng ngoại tiết đưa đến tình trạng teo các tế bào này. Phì đại tế bào thượng bì ống tuyến và lớp tế bào biểu mô tuyến gây ra sự hình thành các đảo tế bào biểu mô tuyến. Nhuộm miễn dịch huỳnh quang thấy có sự thâm nhiễm IgG, IgA và IgM cũng như yếu tố thấp bên trong và chung quanh vị trí thâm nhiễm của các tế bào máu.
Cùng với các bất thường nói trên, bệnh nhân còn có các rối loạn về huyết thanh. Kháng thể kháng nhân tăng, thấy trong 37-35% bệnh nhân có hội chứng Sjogren. Yếu tố thấp cũng thường gặp (52- 98% bệnh nhân). Các bất thường miễn dịch liên quan khác gồm test Coomb dương tính, phức hợp miễn dịch IgG-IgM máu, tăng gammaglobulin máu đa dòng. Các kháng thể kháng cơ trơn, tế bào thành dạ dày, microsome tuyến giáp, thyroglobulin cũng đã được nhắc đến. Giảm nồng độ C3 cũng gặp ở bệnh nhân này, gợi ý tình trạng viêm mạch. HLA của bệnh nhân có Sjogren thứ phát được xác định qua tình trạng tăng HLA-B8 và HLA-Dw3. Tuy nhiên, bệnh nhân chúng ta không có kháng nguyên HLA. Các đặc điểm khác của bệnh nhân mà có thể liên quan đến Sjogren là
buồn nôn, mửa làm bệnh nhân phải nhập viện. Sự kiện tăng amylase máu gợi ý bệnh nhân có thể viêm tụy như là một phần của hội chứng Sjogren. Thâm nhiễm phổi có thể như là một biểu hiện của bệnh liên quan đến đường hô hấp dưới.
Tóm lại, bệnh nhân mắc hội chứng Sjogren tiên phát với tổn thương ở thận đưa đến toan hóa ống thận. Các dấu hiệu miễn dịch đi kèm là biểu hiện xuất hiện trong bối cảnh của hội chứng này, nhưng như BS. Tannen đã nói, không thể loại từ được bệnh lupus ban đỏ ở bệnh nhân này.
- Feinstein
- Koss sẽ trình bày các biểu hiện tìm thấy ở kết quả sinh thiết thận.
- Koss
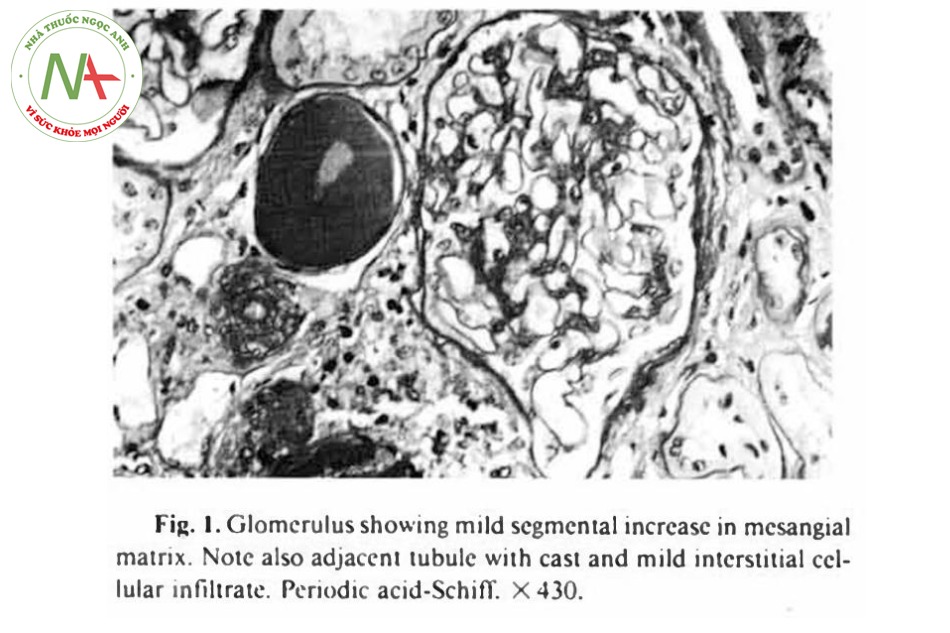
Kết quả sinh thiết thận đủ, với tám cấu trúc cầu thận với cấu trúc tủy vỏ rõ ràng. Bốn cấu trúc cầu thận bị xơ hóa và phần còn lại cho thấy sự tăng sinh tại chỗ từng đoạn của tế bào gian mao mạch cầu thận (mesangial hypercellularity) lẫn mô kẽ của cấu trúc này (Hình 1). Dấu hiệu thấy rõ nhất là hình ảnh viêm thận mô kẽ ống thận, gồm sự tụ tập của bạch cầu và tế bào máu nàm sát các ống
lượn gần bị giãn nở (Hình 2). Rất nhiều trụ hiện diện ở ống lượn xa và có sự xơ hóa quanh ống thận vùng tủy của cầu thận. Động mạch gian thùy thể hiện tình trạng xơ hóa ở lớp giữa. Hình ảnh dưới kính hiển vi qua nhuộm miễn dịch huỳnh quang (immuno-fluorescence, IF) cho thấy 1-2+ IgG, IgA, và IgM ở mô kẽ thận, thể hiện rõ tình trạng viêm tế bào. Không có sự lắng đọng phức hợp nào ở cầu thận và ống thận, nhưng chỉ có 2 cầu thận ở hình ảnh này.
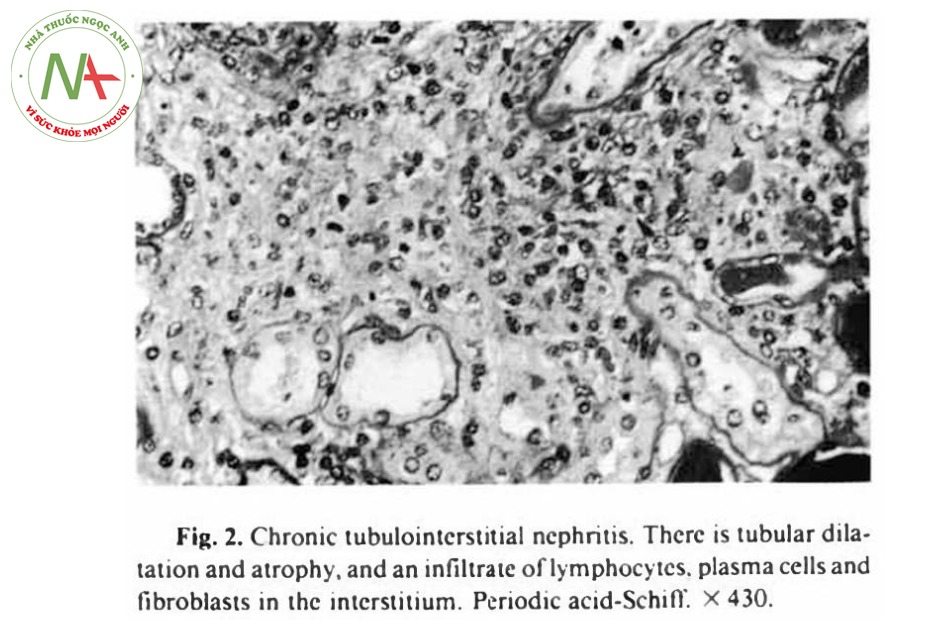
Ở kính hiển vi điện tử, chúng ta nhận thấy có sự thâm nhiễm mô kẽ thận bởi bạch cầu, nguyên bào lympho, tế bào máu và một lượng lớn collagen.
Không thấy có sự lắng đọng với mật độ điện tử cao ở cả mô kẽ lẫn màng đáy của ống thận, nhưng ở cầu thận có một vài sự lắng đọng ở tế bào gian mạch cạnh cầu thận (Hình 3). Màng đáy cầu thận, ngược lại, không thấy có sự lắng đọng và các cấu trúc chân của lớp thượng bì bọc bên ngoài các mao mạch cầu thận (visceral epithelial foot processes) nhìn chung không bị ảnh hưởng gì.
Cũng không thấy các cấu trúc giống myxovirus, hoặc các hình ảnh ‘dấu vân tay’. Tóm lại, trên sinh thiết thận thể hiện hình ảnh viêm mô kẽ ống thận mạn tính kèm tăng viêm cầu thận tăng sinh từng vùng của tế bào cạnh mao mạch cầu thận cùng với sự lắng đọng điện tích trên các tế bào này. Sự thiếu vắng các chất nhuộm miễn dịch ở cầu thận thật khó để lý giải: có thể có sự phân phối khu trú và từng phần của các chất lắng đọng thấy trên kính hiển vi điện tử và sự gián đoạn của cầu thận hiện diện trên hình ảnh hiển vi huỳnh quang miễn dịch đưa ra một nỗ lực để giải thích cho điều này. Ở bất cứ tình huống nào, thì các dấu hiệu giải phẫu bệnh thấy được đều tương đồng các trường hợp bệnh nhân có hội chứng Sjogren.
Toan hóa ống thận – Nhắc lại
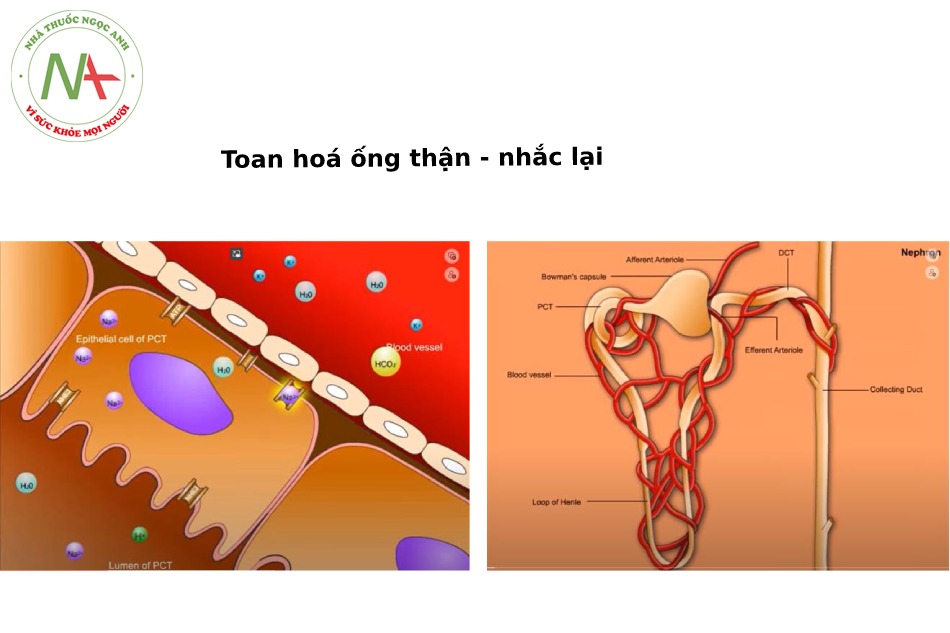
Bình thường – Ống lượn gần
Tại tế bào thượng bì của ống lượn gần (epithelial cell of proximal convoluted tubule), có kênh Sodium- hydrogen Exchanger 3 (Sodium-hydrogen Antiporter, NHE3) nằm trên bờ bàn chải (vi mao) hướng vào lòng ống, và kênh sodium-potassium ATP pump (hoặc Na+/K+-ATPase hoặc Na+/K+ Pump) nối kết giữa tế bào sát với mạch máu.
Các chất điện giải được vận chuyển từ lòng ống (trong dịch lọc) vào tế bào thượng bì này trong đó có Natri, Chlore, Kali và HCO3.
- Kênh NHE3 đưa 1 Na+ vào tế bào và đẩy 1 H+ vào trong dịch lọc ở lòng ống lượn gần.
- HCO3 không thể di chuyển trực tiếp xuyên màng để vào trong tế bào được.
o Mà nó phải kết hợp với H+ để tạo thành H2CO3, chất này dưới tác dụng của men Carbonic Anhydrase IV (CA IV) tại bờ bàn chải tạo thành CO2 và H2O và khuếch tán dễ dàng vào trong tế bào. Bên trong tế bào, CA II giúp kết hợp CO2 và H2O để tạo thành H2CO3 rồi từ đó phân tách thành H+ và HCO3-.
o H+ trở lại vòng lặp của nó, đi ra khỏi tế bào qua kênh NHE3 để đổi 1 Na+ từ dịch lọc vào tế bào. Còn HCO3- cùng Na+ đi qua kênh Sodium-bicarbonate Co-transporter 1 (NBC1, nằm ở đáy tế bào tiếp giáp với mạch máu) để được tái hấp thu vào máu.
- Vậy với 1 H+ được thải vào dịch lọc nơi lòng ống lượn gần sẽ có 1 HCO3- được hấp thu vào máu.
- Na+ được trao đổi với K+ thông qua bơm Na+/K+ ATPase ở đáy tế bào. Bản thân K+ di chuyển từ tế bào vào máu một cách tự do tùy theo chênh áp nồng độ thông qua 1 kênh dành riêng cho Kali.
Toan hóa ống thận do ống lượn gần (RTA type 2)
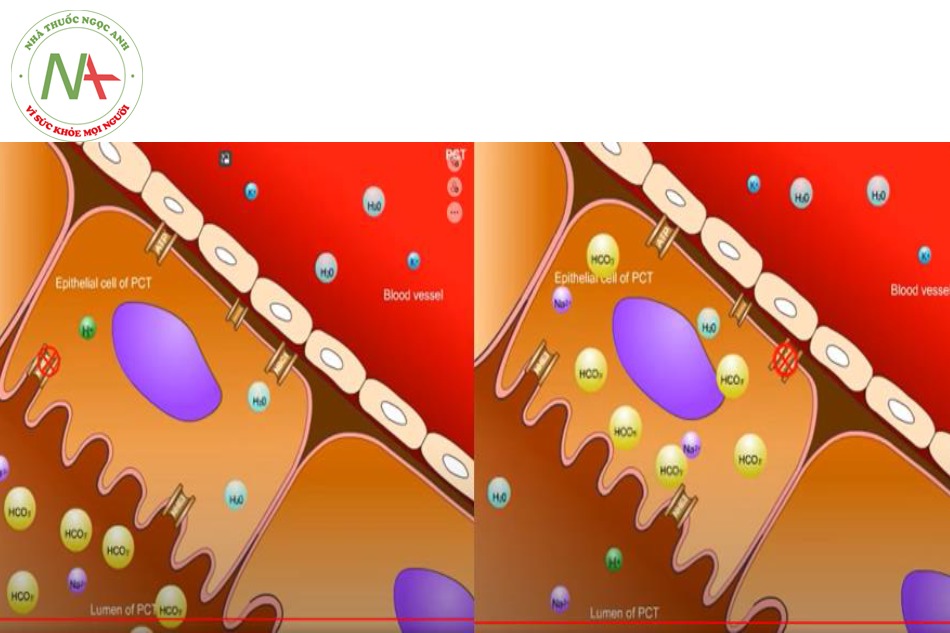
Xảy ra do sự bất thường hấp thu HCO3- trở lại từ dịch lọc vào tế bào thượng bì lót lòng ống lượn gần, đưa đến sự đào thải quá mức HCO3- ra nước tiểu.
- Nếu xảy ra sự bất hoạt động của NHE3, Na sẽ không được tái hấp thu, và H+ sẽ không có cơ hội được thải từ tế bào thượng bì lót ống vào dịch lọc bên trong lòng ống. Sự sụt giảm H+ đi vào lòng ống kéo theo tình trạng giảm sinh tạo H2CO3 nên HCO3- không được hấp thu vào tế bào mà bị thải theo dịch lọc.
- Trong trường hợp NBC1 bất hoạt, từ CO2 và H2O dưới tác dụng của CA II sẽ tạo được H2CO3, và rồi tạo thành HCO3- + H+, do kênh NBC1 bất hoạt, nên HCO3- không được chuyển vào máu, từ đó làm ứ đọng HCO3 ở trong tế bào trong khi thiếu HCO3- trong máu, và gây ra toan chuyển hóa. H+ được tạo ra được giải phóng vào lòng ống khi được trao đổi với Na+ đi vào tế bào qua kênh NHE3.
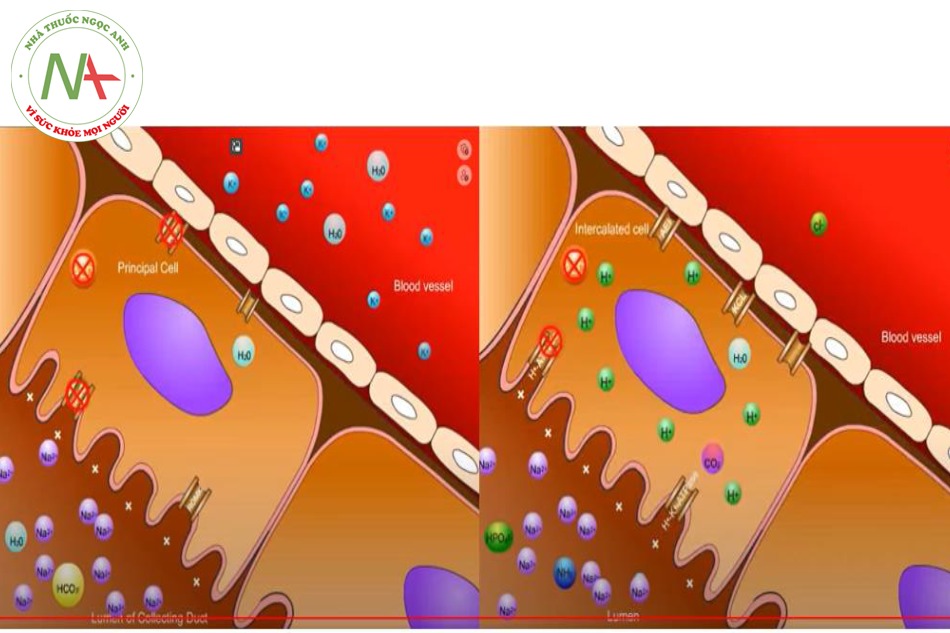
Bình thường – Ống lượn xa, ống góp
Lòng ống góp được lót bởi tế bào chính (principal cell, PC) và tế bào chen-giữa (intercalated cell, IC).
Ở tế bào chính (PC)
- Thông thường Aldosteron (ALD) trong tế bào chính sẽ kích động ENaC (Epithelial sodium channel, kênh natri ở thượng bì/bờ bàn chải) để vận chuyển chủ động Na+ vào trong tế bào, gây ra tình trạng tích điện âm ở lòng ống góp.
- ALD cũng kích động kênh Na+/K+ ATPase để đẩy Na+ từ tế bào vào máu và đổi lấy K+ vào trong tế bào chính này.
- Lượng Kali này bị thu hút bởi tình trạng tích điện âm ở lòng ống góp nên thoát ra khỏi tế bào – đi vào lòng ống thông qua kênh ROMK (the renal outer medullary potassium channel, là một kênh vận chuyển Kali cần sử dụng năng lượng ATP).
Ở tế bào chen-giữa (IC)
ALD kích động kênh H+ATPase và cùng với tình trạng tích điện âm ở ống góp, đẩy H+ ra khỏi tế bào qua kênh H+ATPase.
Cũng bên trong tế bào, CO2 và H2O kết hợp nhau dưới tác dụng của enzyme CA II tạo thành H2CO3, rồi chất này tách thành HCO3- và H+.
- H+ được trao đổi vào lòng ống góp thông qua kênh H+/K+ ATPase để đổi lấy K+ từ lòng ống góp vào tế bào.
- HCO3- được tái hấp thu vào máu thông qua kênh AE1 (anion exchanger 1, hoặc tên khác Bicarbonate-Chloride Exchanger) đổi lấy Chlore vào tế bào.
- Bản thân các ion Cl- này có thể tái hấp thu theo lối khuếch tán thụ động theo nồng độ để đi ngược lại vào máu, hoặc được vận chuyển chủ động cùng với Kali để vào máu thông qua bơm KCl (kali-chlore pump).
- Trong lòng ống góp, H+ kết hợp với HPO43- và NH3- để tạo thành H2PO4- và NH4+ rồi thải ra ngoài theo nước tiểu.
Toan hóa ống thận do ống lượn xa và ống góp (RTA type 1)
- Thường gặp nhất gây ra bởi sự bất hoạt của kênh H+ATPase6 ở tế bào chen-giữa, ngoài ra, còn có thể do sự bất hoạt của H+/K+ ATPase. Sự bất hoạt của hai kênh này làm ứ đọng H+ bên trong tế bào IC này và không thải vào dịch lọc gây ra toan chuyển hóa.
- Với trường hợp bất hoạt kênh H+/K+ ATPase, kali không được tái hấp thu và do đó gây hạ kali máu. Với trường hợp kênh AE1 không hoạt động, HCO3- ở tế bào chen-giữa không được tái hấp thu vào máu gây giảm HCO3-, từ đó gây toan hóa máu.
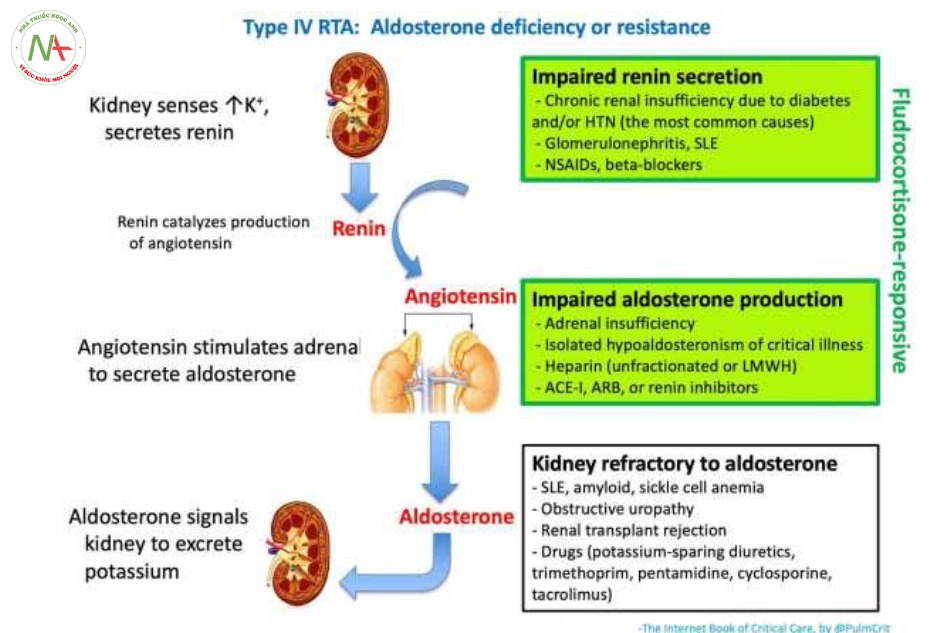
Toan hóa ống thận liên quan đến suy giảm chức năng Aldosteron (RTA type 4)
Liên quan đến tình trạng thiếu hụt Aldosteron hoặc cơ thể không nhạy cảm với tác dụng của ALD.
- Trong tế bào chính
o Sự thiếu hụt ALD hoặc xảy ra sự đề kháng của ALD trên ENaC ở tế bào chính lót trong lòng ống góp làm Na2+ không vào được tế bào, do đó gây tăng điện tích dương ở dịch lọc lòng ống góp.
o Thiếu vắng tác dụng của ALD cũng làm kênh Na+/K+ ATPase kém hoạt động, do đó làm K+ không được thải từ máu vào tế bào chính, từ đó gây hiện tượng tăng kali máu.
- Trong tế bào chen-giữa
o Sự thiếu hụt ALD máu làm gia tăng điện tích dương ở dịch lòng ống góp (và cũng làm ức chế kênh H+ATPase) từ đó làm giảm thải H+ từ tế bào chen giữa (IC) vào dịch lọc trong lòng ống, và đưa đến tình trạng toan chuyển hóa.
Toan chuyển hóa không tăng Anion Gap
Chẩn đoán
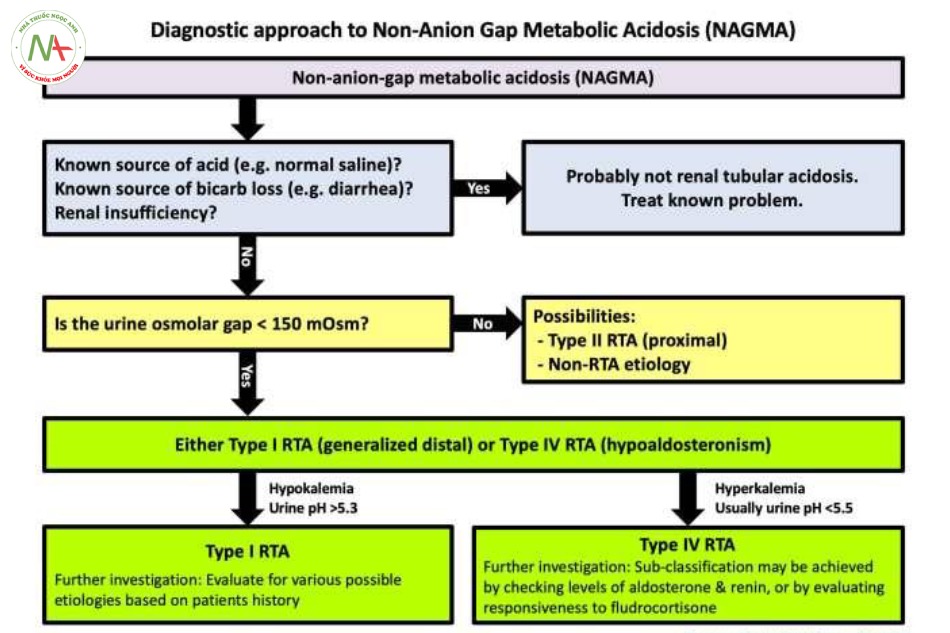
Có thể chẩn đoán tình trạng Toan chuyển hóa không tăng Anion Gap (Non-anion-gap metabolic acidosis, NAGMA) bằng một trong hai cách sau (mũi tên đỏ trên hình)
Bệnh nhân có toan chuyển hóa với khoảng trống Anion bình thường (bicarbonate < 22mM). Bệnh nhân có toan chuyển hóa tăng khoảng trống anion, nhưng tình trạng sụt giảm bicarbonate lớp hơn nhiều so với khoảng trống anion này (ám chỉ tình huống có kết hợp giữa toan chuyển hóa tăng anion-gap KÈM THÊM toan chuyển hóa không tăng anion-gap).
Nguyên nhân
Các nguyên nhân hay gặp nhất gây NAGMA
- Truyền nhiều nước muối sinh lý (normal saline, NS)
- Toan keton đái đường đang cải thiện
- Mất bicarbonate qua đường dạ dày ruột
o Tiêu chảy (đặc biệt ở dạng mất dịch tiết)
o Dò đường thông nối ống tiêu hóa với lượng dịch mất lớn, dẫn lưu mật/tụy
- Phẫu thuật tạo hình bàng quang từ dạ dày hoặc đại tràng sigma
- Suy chức năng thận (đặc biệt khi GFR 20-50 ml/phút)
- Có sự hiện diện của các acid ngoại sinh (ví dụ, truyền dinh dưỡng tĩnh mạch, calcium chloride)
- Thông khí quá mức lâu dài (trường hợp này cực kỳ hiếm gặp)
- Toan hóa ống thận (Renal Tubular acidosis, RTA) – rất nhiều bệnh nguyên gây ra tình trạng này sẽ được nhắc ở bảng bên dưới.
Tìm kiếm nguyên nhân
(1) Có nguyên nhân nào rõ ràng tìm được từ bệnh sử hay không?
Nguyên nhân của NAGMA thường tương đối rõ ràng, dựa vào bệnh sử và các thuốc đã sử dụng trước đó.
- Kali có thể dùng như là một bằng chứng để định nguyên nhân của NAGMA (xem bảng dưới, “Using potassium as a clue to etiology in NAGMA”)
o Lẽ đương nhiên, bảng gợi ý này không đúng 100%, nhưng nó giúp nhà lâm sàng đi đúng hướng.
o Nếu nồng độ kali bất thường, bảng phân loại có thể trở nên hữu ích hơn. tương tự, với bệnh nhân ít bệnh nền thì việc định hướng nguyên nhân sẽ trở nên dễ dàng hơn (bệnh nhân nhiều khả năng chỉ có một nguyên nhân đang bị ẩn giấu gây NAGMA)
- Nếu định được nguyên nhân khả dĩ, có thể điều trị bệnh nhân ngay. Dùng thêm các test chẩn đoán đôi khi sẽ không cần thiết (trừ khi bệnh nhân không đáp ứng với lượt điều trị đầu tiên).
(2) Xét nghiệm trong NAGMA
- Điện giải đồ (gồm cả Ca/Mg/Phos)
- Phân tích nước tiểu
- Xét nghiệm phân tích nước tiểu
o Natri, kali, glucose, urea, độ thẩm thấu nước tiểu
o pH nước tiểu (đo chính xác với máy đo pH)
(3) Tính khoảng trống độ thẩm thấu nước tiểu để chẩn đoán phân biệt giữa RTA type 1 hay 4
Khoảng trống độ thẩm thấu (OsmGap) được tính dựa vào thông số các chất trong nước tiểu:
o Osmolar Gap = Urine osmolarity –2(sodium + potassium) – Glucose (in mg/dL)/18 – Urea (in mg/dL)/28.
o Có thể dùng công cụ trực tuyến của QXmD11
- OsmGap này gián tiếp đo được ammonium (ví dụ, acid) tiết vào dịch lọc (nước tiểu) ở ống lượn xa. Với bệnh nhân có toan hóa thì:
o OsmGap > 150 mOsm chỉ ra sự bài tiết ammonium là bình thường (loại trừ được RTA type 1 và 4)
o OsmGap < 150 mOsm chỉ ra sự bài tiết ammonium là bất thường (gợi ý bệnh
nhân có RTA type 1 hoặc 4)
- Trong RTA type 2 (rối loạn chức năng ống lượn gần), sự bài tiết ammonium bình thường (và do đó OsmGap nước tiểu tăng bình thường).
- Trước đây, khoảng trống anion nước tiểu (Urine-AG) đã từng dùng cho mục tiêu phân biệt này, nhưng bản thân nó có các giới hạn.
Đặc biệt, Urine-AG có thể không chính xác khi bệnh nhân có đa niệu, pH niệu > 6.5, hoặc có sự xuất hiện của các anion không hay gặp như ketonacid hoặc penicillins.
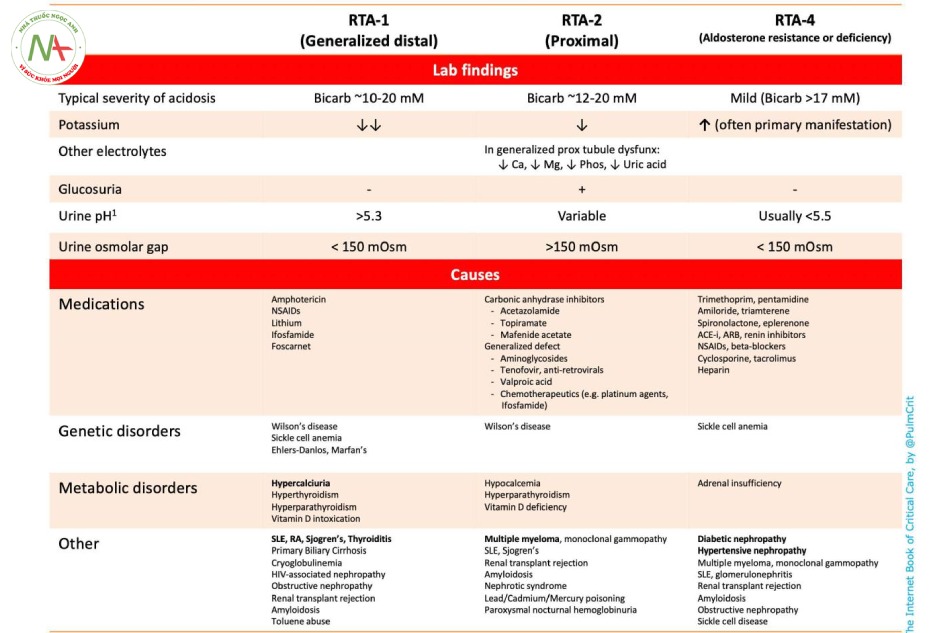
(4) RTA type nào?
Bảng dưới đây tóm tắt các xét nghiệm lẫn nguyên nhân của RTA.
- Nhưng không may là ở các bệnh nhân ICU, sự rối loạn điện giải vô cùng phức tạp và do đó có thể khó để đơn giản hóa bước tìm nguyên nhân này.
- pH nước tiểu không phải là giá trị đáng tin ở bệnh nhân hồi sức, do đó nên thận trọng.
(5) Nguyên nhân của RTA type 4
- Các nguyên nhân gây RTA type 4 được liệt kê ở trên
- Đo nồng độ Renin, aldosterone, và cortisol có thể sẽ hữu ích cho chẩn đoán (tuy nhiên, có thể sẽ mất thời gian để chờ kết quả).
- Có thể cân nhắc sử dụng test Fludro-cortisone theo kinh nghiệm (ví dụ, 0.2mg) trong khi chờ kết quả xét nghiệm. Có thể nghĩ đến các nguyên nhân trong bảng xanh thể hiện sự thiếu hụt các chất mineralocorticoid (được tiết từ vỏ thượng thận như aldosterone, cortisol) nếu xảy ra sự kiện gia tăng chênh lệch nồng độ kali xuyên lòng ống thận (trans-tubular potassium gradient, TTKG) dưới tác động của fludro- cortisone 5 giờ sau tiêm kèm với sự sụt giảm kali máu.
Điều trị
Giải quyết nguyên nhân gốc rễ
Nếu có thể, cần xác định và giải quyết các nguyên nhân gốc rễ, ví dụ:
o Ngưng các thuốc gây NAGMA,
o Fludro-cortisone có thể hiệu quả ở một vài bệnh nhân RTA type 4 gây ra bởi tình trạng thiếu hụt aldosterone (vừa đề cập ở trên).
- Nhưng không may là việc điều trị nguyên nhân thường không đủ để tạo ra một đáp ứng nhanh chóng (ví dụ, bệnh nhân có tổn thương thận mức độ trung bình). Ở đa số các trường hợp, cần điều trị thêm như mô tả dưới đây.
Cần điều trị NAGMA hay không?
Vẫn còn nhiều tranh cãi về câu hỏi này. Dù NAGMA thường tương quan với dự hậu không mấy tốt đẹp, nhưng vẫn không rõ là liệu tình trạng này có thể gây hại hay không.
- Ý nghĩa quan trọng của điều trị gồm các điểm sau:
1) Toan chuyển hóa tăng chlore có thể làm tăng nguy cơ tổn thương thận.
2) Toan chuyển hóa tăng chlore hiện diện như một tình trạng gây viêm hệ thống.
3) Toan chuyển hóa làm tăng công hô hấp (bằng việc khởi phát đáp ứng tạo ra kiềm hô hấp bù trừ). Điều này đặc biệt bất lợi ở bệnh nhân đang không thật ổn về hô hấp (ví dụ, bệnh nhân đang có nguy cơ phải đặt nội khí quản, hoặc bệnh nhân đang cần cai máy).
4) Toan hóa làm tăng sự đề kháng insulin, tình trạng này làm tăng nguy cơ tái xuất hiện Toan chuyển hóa tăng keton máu ở bệnh nhân đái đường (Diabetic Ketoacidosis, DKA) (trong nhóm các bệnh nhân đang cải thiện DKA mà ngưng truyền insulin đột ngột).
Chỉ định hợp lý cho việc điều trị NAGMA bằng kiềm có thể gồm các điểm sau:
o Bicarbonate dưới mức ~ 16-18 mEq/L
o Ngưỡng điều trị có thể thấp hơn (tức là trên mức 18 mEq/L) ở các bệnh nhân có gia tăng nguy cơ khi nhiễm toan chuyển hóa (ví dụ, ở bệnh nhân có tổn thương thận cấp hoặc đang cải thiện tình trạng toan keton máu do đái đường).
Tổng quan về điều trị NAGMA
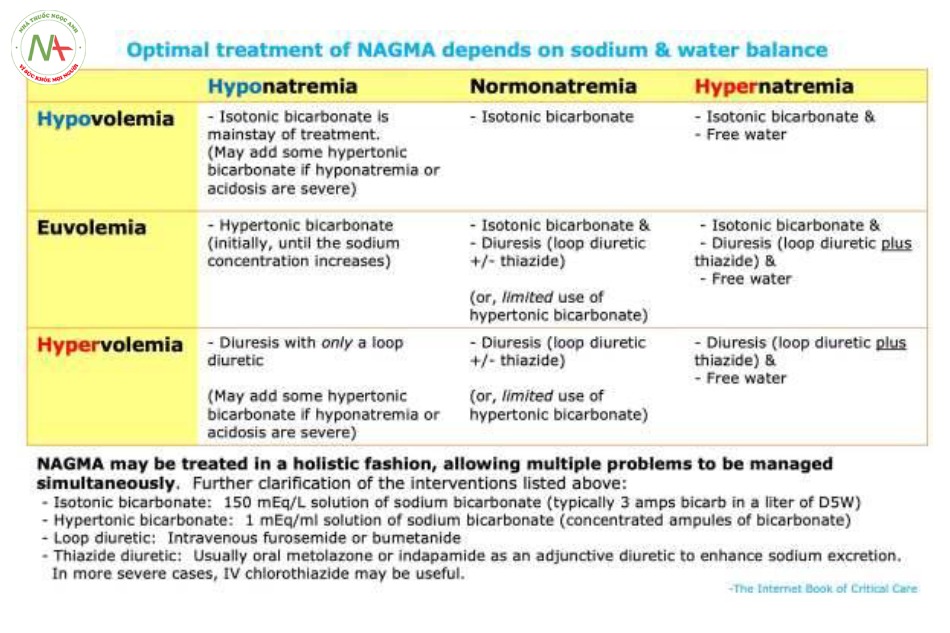
NAGMA có nền tảng là tình trạng mất cân bằng giữa natri chloride với natri bicarbonate.
Nên việc điều trị có thể liên quan đến việc bù natri bicarbonate và/hoặc loại bỏ natri chloride. Phương thức tiếp cận tối ưu tùy vào tình trạng cân bằng dịch (volume status) của người bệnh, ví dụ:
o Giảm thể tích (thiếu dịch) > truyền bù natri bicarbonate.
o Đẳng tích > truyền bù natri bicarbonate và đồng thời loại bỏ natri chloride. Mục tiêu lúc này là thay thế chloride bằng bicarbonate trong khi vẫn không thay đổi tình trạng dịch của cơ thể.
o Thể tích dư thừa (dư dịch) > loại bỏ sodium chloride bằng lợi tiểu.
Việc này sẽ hơi phức tạp đôi chút, bởi các phương thức điều trị khác nhau sẽ ảnh hưởng đến nồng độ của natri máu (mà về bản chất là phản ánh tình trạng cân bằng của lượng nước tự do trong cơ thể). Ví dụ:
o Dịch ưu trương bicarbonate sẽ làm tăng nồng độ natri.
o Thuốc lợi tiểu quai đơn độc (ví dụ, furosemide) sẽ làm tăng nồng độ Natri.
o Lợi tiểu sử dụng cả lợi tiểu quai lẫn thiazide có thể giúp loại bỏ natri chloride mà không gây tăng natri máu. Trị liệu tối ưu sẽ là vừa giải quyết được NAGMA, vừa kiểm soát được tình trạng dịch, và vừa điều chỉnh được nồng độ natri. Ví dụ, bệnh nhân có hạ natri máu kèm NAGMA, việc sử dụng bicarbonat ưu trương có thể cùng lúc giải quyết được hai vấn đề có ở người bệnh.
Trị liệu bicarbonate
- Khi bù bicarbonate, sẽ có lợi hơn nếu tính toán được mức thiếu hụt bicarbonate của bệnh nhân, ví dụ, có thể tính dựa vào ứng dụng MDCalc. Đương nhiên điều này không chính xác 100%, nhưng con số này giúp nhà lâm sàng có một khái niệm chung về lượng bicarbonate cần sử dụng.
- Truyền tĩnh mạch bicarbonate được mô tả kỹ ở phần này. Một vài ghi chú ngắn gọn tùy vào dạng bicarbonate như sau:
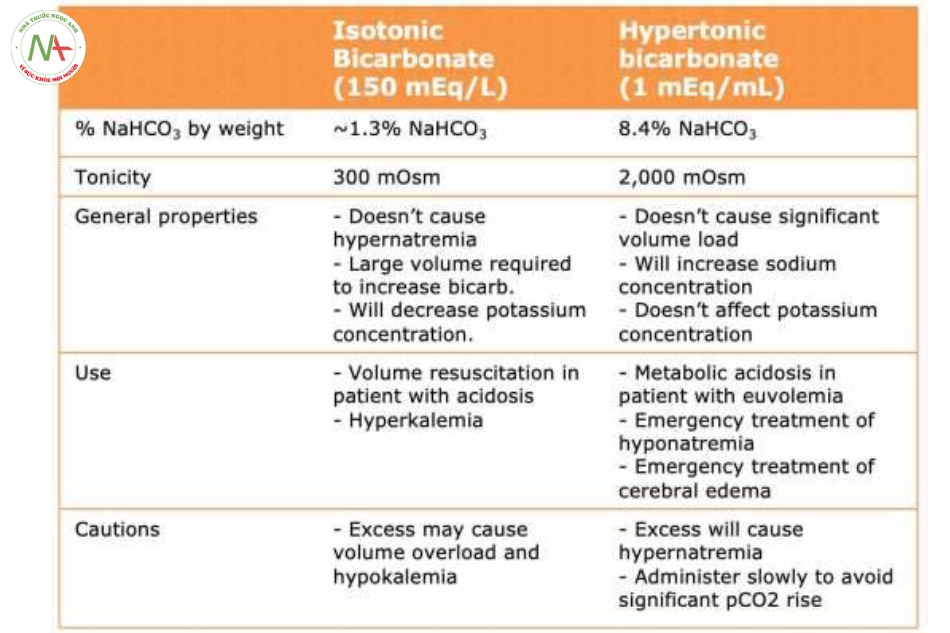
1) Bicarbonate ưu trương
o Có thể thích hợp ở bệnh nhân hạ natri máu (sẽ giúp điều trị được NAGMA lẫn tình trạng hạ natri máu) o Có thể dùng với lượng giới hạn ở bệnh nhân có mức natri máu bình thường (tránh lượng cao gây tăng natri máu).
o Chống chỉ định ở bệnh nhân có tăng natri máu (vì sẽ làm nặng thêm tình trạng tăng natri máu có sẵn này).
2) Bicarbonate đẳng trương
o Có thể phù hợp ở bệnh nhân có thể tích máu sụt giảm (bởi loại này được chuẩn bị với một lượng thể tích lớn, từ đó giúp điều chỉnh cả NAGMA và tình trạng giảm thể tích máu).
3) Kiềm uống
o Sẽ mất nhiều thời gian để đạt được hiệu quả, và nhìn chung thì không mạnh, và có xu hướng làm tăng natri máu.
o Có thể hữu dụng ở các trường hợp NAGMA hoặc bệnh nhân đang mất bicarbonate (như một phương thức điều trị duy trì việc bổ sung phần bicarbonate mất mát).
o Sodium bicarbonate có thể dùng theo dạng viên uống (1300mg = 15 mEq bicarbonate).
o Sodium citrate loại dung dịch là dạng thay thế cho natri bicarbonate (citrate mau chóng chuyển hóa thành bicarbonate).
▪ Các dạng thường dùng nhất (ví dụ, BICITRA) chứa lượng 1 mEq/L sodium bicarbonate.
▪ Có thể tính toán dễ dàng hơn khi dùng viên uống sodium bicarbonate (ví dụ, 30mL mỗi 6 giờ cung cấp 120 mEq kiềm mỗi ngày). Liều này tương đương với 16 viên sodium bicarbonate 650mg. Dung dịch potassium citrate (ví dụ, POLYCITRA-K) có thể có ích trong NAGMA có hạ kali máu. POLYCITRA-K có đồng độ cao gấp đôi dung dịch sodium citrate (2mEq/mL kali và có 2mEq kiềm mỗi mL).
Lưu ý
Thất bại điều trị: Nhìn chung có thể điều trị thành công tình trạng NAGMA bằng phương thức trị liệu hỗ trợ (ví dụ, với truyền tĩnh mạch bicarbonate), ngay cả khi không biết nguyên nhân đích xác. Nên điều trị bệnh nhân có toan chuyển hóa thực sự đồng thời tìm nguyên nhân của tình trạng này.
- Sử dụng khoảng trống anion niệu có thể gây lầm đường lạc lối. Do đó nên tránh sử dụng thông số này, và nên dùng khoảng trống thẩm thấu niệu thay thế (cả hai thông số này đề được thiết kế để đánh giá lượng ammonium).
Ống lượn xa và Ống góp
Chương này sẽ có ích để giải quyết được Section H1(ii) ở 2017 CICM Primary Syllabus, đòi hỏi người học “mô tả về việc quá trình lọc của cầu thận và chức năng của ống thận”. Những câu hỏi chuyên biệt cho từng vùng của cầu thận (ví dụ, “điều gì xảy ra ở ống thận riêng biệt này”) rõ ràng không được đề cập đến trong phần đầu của bài kiểm tra CICM, và do đó các bạn học có thể bỏ qua toàn bộ chương này. Các nội dung được nhắc đến dưới đây chỉ bởi người viết (Alex Yartsev) tiện làm cho đầy đủ.
Tóm tắt
- Nhánh lên dày của quai Henle
o Chứa cấu trúc Macula densa, mà:
▪ Giải quyết các phản hồi của cầu-và-ống thận (tăng lượng muối được vận chuyển đưa đến phản xạ giảm lưu lượng máu nơi cầu thận).
▪ Điều chỉnh tình trạng tiết renin từ các tế bào cạnh cầu thận, khi lượng muối vận chuyển đến giảm xuống.
- Ống lượn xa
o Được xác định khi có sự hiện diện của protein đồng vận chuyển có tên NCC, đồng vận chuyển natri và chloride (nhạy cảm với thiazide) (the thiazide-sensitive sodium and chloride co-transporter)
o Việc tái hấp thu muối được thực hiện bởi kênh Na+/K+ATPase ở màng đáy tế bào lót lòng ống thận (tiếp xúc với mạch máu)
o Tiết kali để tạo ra cân bằng điện tích khi có sự tái hấp thu natri (đây là nguồn căn của tình trạng hạ kali máu gây ra bởi furosemide)
- Ống nối
o Đặc trưng bởi sự hiện diện của các kênh vận chuyển calcium ở đỉnh tế bào (hướng vào lòng ống góp)
o Phần còn lại giống như cấu trúc của ống góp
- Ống góp
o Đặc trưng bởi sự nhạy cảm với aldosterone và vasopressin
o Aldosterone làm tăng sự hoạt động của kênh ENaC
▪ Điều này giúp tăng hấp thu natri
▪ Hấp thu natri đưa đến tăng tiết kali
▪ Vị trí này là đích tác dụng của spironolactone và amiloride
o Vassopressin tăng sự hiện diện và hoạt động của aquaporins và kênh UT1-3
▪ Aquaporins giúp tái hấp thu nước trong dịch lọc dễ dàng hơn
▪ UT transporter giúp tái hấp thu ure trong vòng tuần hoàn urea ở thận, và quá trình này cần thiết để duy trì được cơ chế cô đặc nước tiểu
- Tế bào chen-giữa
o Liên quan đến quá trình cân bằng toan kiềm
o Tiết ra ammoniac và H+, giúp tạo thành ammonium trong ống thận
o Bài tiết chloride giúp cân bằng điện tích với cationic ammnonium
o Sự hủy hoại chức năng tế bào này gây ra tình trạng Toan hóa ống thận type 1.
Bài viết hay nhất cho chủ đề liên quan đến Ống lượn xa (DCT) và ống góp – và trong trường hợp mệt mỏi hơn – là cho cả cấu trúc và chức năng thận – thì bài viết “Structural organisation of the mammalian kidney” của tác giả Kriz & Kaissling. Nếu phải tập trung vào DCT, không bài nào có thể xuất sắc hơn Subramanya & Ellison (2014), và để hiểu hơn về hoạt động của tế bào chen-giữa (intercalated cells), có thể đọc Roy et al (2015). Vì CICM không bao giờ hỏi sâu hơn, nên đương nhiên nội dung tóm tắt dưới đây có lẽ đã đủ dùng.
Cấu trúc Macula densa và thể cạnh cầu thận
Ở phần cuối ống lượn xa của quai Henle (khi phần ống quay trở lại vào vỏ thận nơi chứa phần cuộn của ống thận, sau khi đã lặn ngụp ở phần tủy thận) có lớp tế bào lót trong lòng ống đã dày sẵn ở nhánh lên (quai Henle) đoạn gần sát với điểm bắt đầu từ cầu thận. Hình ảnh nổi tiếng nhất của vùng này xuất hiện từ bài báo của Kriz & Kaissling năm 1992; với mặt cắt, đặc biệt may mắn có được, ngang qua đúng đoạn gốc mạch máu của cầu thận, và một phần hình ảnh đó đã được cắt ghép lại như hình bên dưới đây (xin xem hình ở trang tiếp theo).
Chúng là các thụ cảm có chức năng phát hiện sự gia tăng lượng muối được chuyển đến lòng ống lượn xa và dùng tín hiệu này để phối hợp một loạt các đáp ứng tại chỗ lẫn toàn thân với mục tiêu làm giảm lượng muối được chuyển đến này. Bản thân cơ chế này cực kỳ phức tạp, và bạn đọc nào thích thì có thể tìm hiểu chi tiết ở bài viết của tác giả Bell cùng cộng sự (2003)21. Nhưng nói ngắn gọn là:
- Natri và chloride được chuyển đến phần dày nhánh lên quai Henle (và nồng độ của một trong hai không nên quá lớn, bởi độ thẩm thấu ở phần ống này cần tầm khoảng 100 mOsm/kg, ví dụ, bạn sẽ may mắn khi có được 40-50 mmol/L natri ở đoạn này).
- Natri, kali và chloride sau đó vào trong tế bào macula-densa thông qua protein đồng vận Na/K/2Cl co-transporter.
- Chloride rời khỏi tế bào qua một kênh khác ở vùng đáy tế bào.
- Tổng điện tích dương có được qua quá trình trên giúp khử cực được tế bào macula-densa.
- Lúc này, thông qua cơ chế vận hành bởi calcium làm tín hiệu, đưa đến sự giải phóng ATP vào trong vùng dịch gian mạch máu ở khu vực mạch máu vào(/đến) và ra(/đi) của ống thận.
- ATP sau đó kích hoạt hoặc là các thụ thể đặc hiệu cho purine ở tiểu động mạch đến, hoặc được chuyển thành adenosine (mà sau này sẽ kích hoạt A1-adenosine receptors).
- Hiệu quả cuối cùng là sự tăng lượng muối vận chuyển đến cầu thận sẽ gây ra sự sụt giảm lưu lượng máu vào cầu thận, từ đó giảm lượng muối được vận chuyển đến thận (và ống thận) (ví dụ, đây là cơ chế hồi đáp/feedbake ngược).
Những điểm trên là những điểm cơ bản của sự hồi đáp của cầu thận- ống thận, và sẽ được mô tả kỹ hơn bởi bài viết xuất sắc của Volker Vallon (2003)22 và trong chương viết về dòng máu tới thận.
Cấu trúc Macula densa cũng chịu tác động của sự điều hòa huyết áp bởi hormone, thông qua sự điều hòa tiết renin thông qua một vài cơ chế không được biết rõ qua đó sự sụt giảm lượng muối hấp thụ sẽ giúp giải phóng renin, và ngược lại. Với chương bài được trình bày theo hướng cấu trúc-kèm-chức năng như ở đây có lẽ sẽ đủ để nói rằng cấu trúc quan trọng nhất quyết định chức năng toàn bộ phần nhánh lên quai Henle này nằm ở phần gần cuối của nhánh lên-dày, ngay trước khi quai Henle bẻ gập và đột ngột chuyển thành ống lượn xa.
Ống lượn xa (DCT)
Mặc dù ống này cuộn xoắn, nhưng nó tương đối ngắn. (Và) ngay cả khi kéo dãn ra, thì theo Crayen& Thonenes (1978), ống lượn xa cũng chỉ dài khoảng 1mm. Thành ống này thậm chí còn dày hơn cả nhánh lên của quai Henle, được lót bởi các tế bào hình lục giác chứa đầy những ti thể – nhà máy sản xuất năng lượng của tế bào. Cũng giống phần dày nhánh lên quai Henle và ống thận gần, lớp đáy của các tế bào này chứa các cấu trúc kết nối (ví dụ, các kênh vận chuyển giữa tế bào và mô kẽ, mạch máu) cực kỳ phức tạp.
Có ít nhất khoảng 4 loại tế bào khác nhau và chúng rải rác ở vùng này, làm cho khó để phân biệt ranh giới giữa chúng trên mô tế bào. Các nhà nghiên cứu gần đây mô tả sự trải dài của ống lượn xa theo kiểu “không khẳng định”; ví dụ, ống lượn xa là bất kỳ phần ống nào nằm giữa cấu trúc Macula Densa và phần ống tiếp theo. Đặc trưng chính của phần này là cách mà nó kiểm soát thành phần dịch lọc, và đã được mô tả kỹ ở bài viết của tác giả Subramanya & Ellison (2014).
- Nước: Thượng bì của ống lượn xa không tái hấp thu nước. Ở phần tận của ống lượn xa, đoạn này đôi khi được gọi là “ống nối” (với ống góp), có chứa một vài kênh Aquaporins, giống như ở ống góp, nhưng phần đầu của DCT được xem như hoàn toàn không thấm nước. Điều này có nghĩa rằng phần dịch đã được hòa loãng ở đoạn dày nhánh lên quai Henle sẽ vẫn giữ được tình trạng hòa loãng ở phần lớn suốt chiều dài của ống lượn xa. Điểm này được củng cố bởi các dữ liệu thử nghiệm của hai tác giả Clapp & Robinson (1966) thông qua việc thu lượm được lượng dịch ở phần này trên chó và xác định được độ thẩm thấu của dịch lọc ở DCT là nhược trương khi so sánh với huyết tương, đâu đó ở mức 60-120 mOsm/kg.
- Natri và Chloride: Kênh vận chuyển muối ở đoạn này rất khác biệt; chúng tái hấp thu 5-10% lượng muối được đưa vào dịch lọc, nhưng NKCC2 (kênh này là đích của các thuốc lợi tiểu quai) được thay thế bởi NCC, một loại kênh đồng vận natri-chloride nhạy cảm với Thiazide. Thực tế thì ở các định nghĩa sau này về ống lượn xa, nơi bắt đầu và kết thúc của phần ống có sự hiện diện của NCC được tính là ranh giới tạo nên phần ống lượn xa. Ngoài ra, phần xa của ống lượn xa cũng có kênh ENaC, giống như ở ống góp.
- Kali: đã bị hấp thu gần như hoàn toàn khi chúng đến được đây (phần ống lượn gần, phần dày nhánh lên quai Henle cũng dự phần tái hấp thu gần hết Kali trong dịch lọc), nên chỉ còn khoảng 10% kali được lọc ở cầu thận là đến được ống lượn xa. Rồi thì nồng độ của Kali ở lòng ống tăng lên khi nó đi qua DCT bởi một lượng Kali bị rò rỉ qua kênh ROMK (Renal Outer Medulla Potassium), sự rò rỉ này là cơ chế phụ thuộc điện tích. Càng nhiều natri được hấp thu vào tế bào lót lòng ống (và rồi vào máu), thì càng nhiều Kali được rò rỉ vào dịch lọc để bảo tồn sự quân bình điện tích.
- Cần thiết cho sự vận chuyển Magnesium (Mg2+): Ống lượn xa là nơi hiện diện cơ chế tái hấp thu chủ động Mg2+ qua màng tế bào, và nói chung lượng này là nhiều nhất giúp xác định được nồng độ Mg2+ trong nước tiểu.
- Cần thiết cho sự vận chuyển Calcium (Ca2+): cùng với kênh Calcium ở ống góp, phần ống lượn xa góp phần tạo lên tổng lượng calium mà thận phải xử lý.
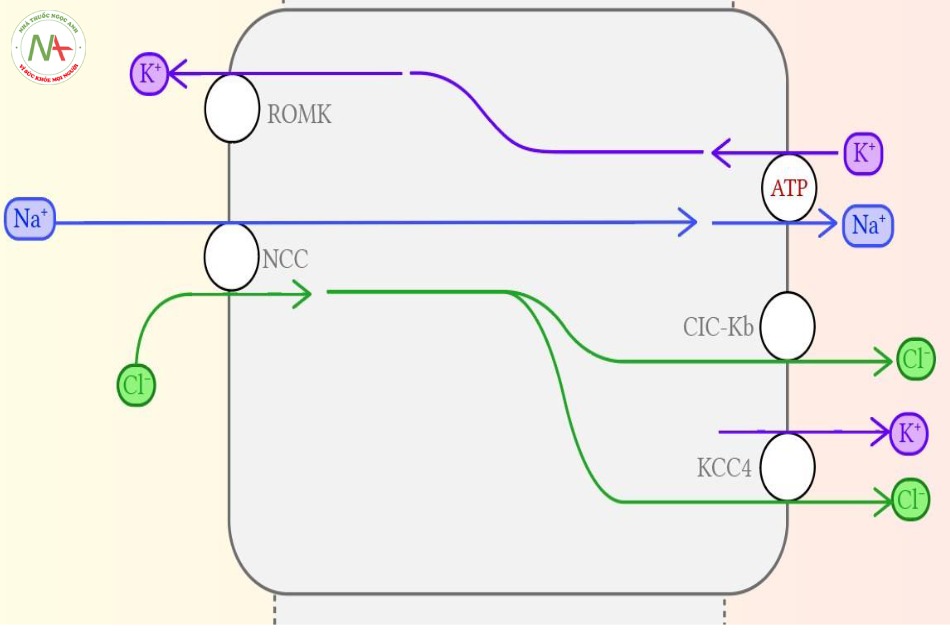
Vùng này (ống lượn xa) là nơi mà nhiều thuốc nổi tiếng nhắm vào, và điều đó đóng vai trò quan trọng về những điểm lâm sàng liên quan ICU mà giúp chương này trở nên khó quên.
- Là đích nhắm đến của thuốc lợi tiểu nhóm Thiazide: các ảnh hưởng lên muối và nước của thiazide xảy ra thông qua sự ức chế kênh NCC. Sự ngăn trở tái hấp thu natri ở đây dần dần sẽ tạo ra tình trạng Hạ natri máu.
- Tác dụng hạ-kali-máu do Frusemide: gây ra bởi sự vận chuyển natri và kali của ống lượn xa. Khi natri càng tăng cao trong dịch lọc của lòng ống, thì kênh NCC càng làm việc cật lực qua đó càng hấp thu nhiều natri từ dịch lọc trong lòng ống. Sự hiện diện của kênh EnaC ở phần xa của lòng ống cũng giúp tăng tái hấp thu natri. Điểm này làm tăng lượng tổng điện tích dương trong lòng tế bào (khi Na+ đi vào tế bào), qua đó đẩy nhiều Kali hơn ra khỏi tế bào qua kênh ROMK vào trong dịch lọc. Và bởi lý do đó, bất cứ nguyên nhân nào gây tăng sự tống xuất Natri vào dịch lọc và đến ống lượn xa sẽ làm tăng sự đào thải kali do sự điều hòa điện tích kiểu này. Có vài nguyên nhân gây tăng thải Natri vào dịch lọc ở phần này của ống thận, nhưng quan trọng nhất (để cho việc học thi) là bởi việc sử dụng thuốc lợi tiểu. Khi kênh đồng vận NKCC2 bị chặn bởi Frusemide, kênh này không thể hấp thu được natri, và ống lượn xa theo đó tiếp nhận một dịch lọc đặc quánh Natri, từ đó làm thất thoát một lượng lớn kali gây hạ kali máu. Trong khi đó, sự tái hấp thu natri vẫn không thay đổi. Đây là một trong các lý do tại sao bệnh nhân dùng frusemide lại xuất hiện tăng natri máu và hạ kali máu.
Ống nối
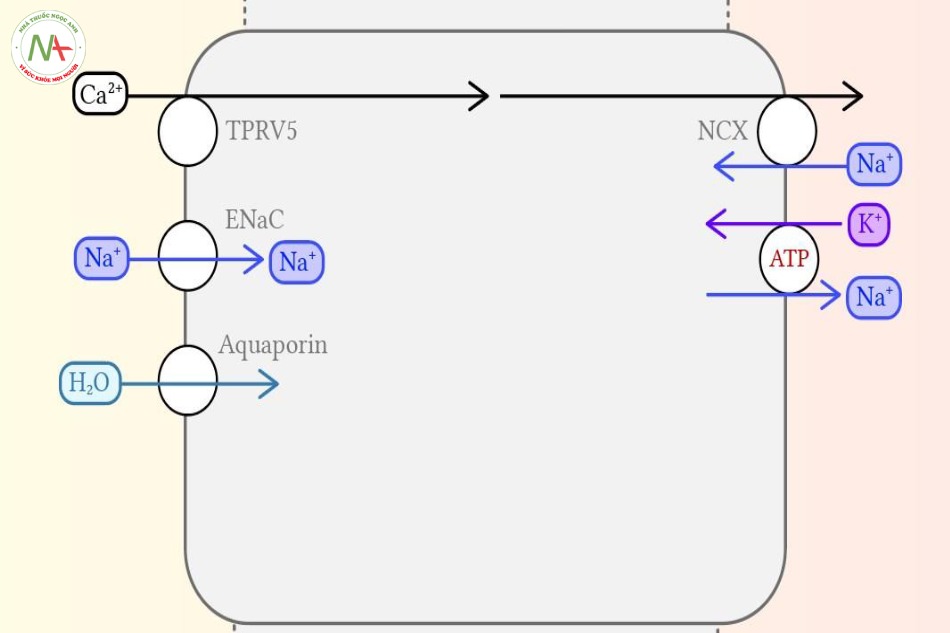
Phần này bị lãng quên và hiểu lầm trong cấu trúc của cầu thận là nơi cuối cùng xảy ra sự hấp thu calcium.
Hiện nay, phần ống này được định nghĩa qua các protein nằm trộn lẫn trên thành tế bào lót lòng ống. Nếu có kênh TPRV5 Calcium và kênh EnaC ở-tế-bào-thượng-bì-chịu-ảnh-hưởng aldosterone, mà đã có ở phần tận của ống lượn xa, nhưng hiện tại cũng có thêm aquaporins phụ thuộc vasopressin- loại kênh chủ yếu ở ống góp nằm trong phần vỏ thận.
Tái hấp thu calcium xảy ra ở ống góp nhờ vào kênh TPRV5, và điều này chịu ảnh hưởng của hormone cận giáp cũng như 1,25-dihydroxy-vitamin D3. Điều này không xảy ra ở ống góp, và chính nó làm cho ống nối trở nên phần nào đấy đặc biệt.
Natri, kali và nước được xử lý ở phần này cũng tương tự như ở ống góp, và sẽ được mô tả chung trong nội dung “aldosterone và phần xa của cầu thận chịu sự điều hòa của vasopressin”.
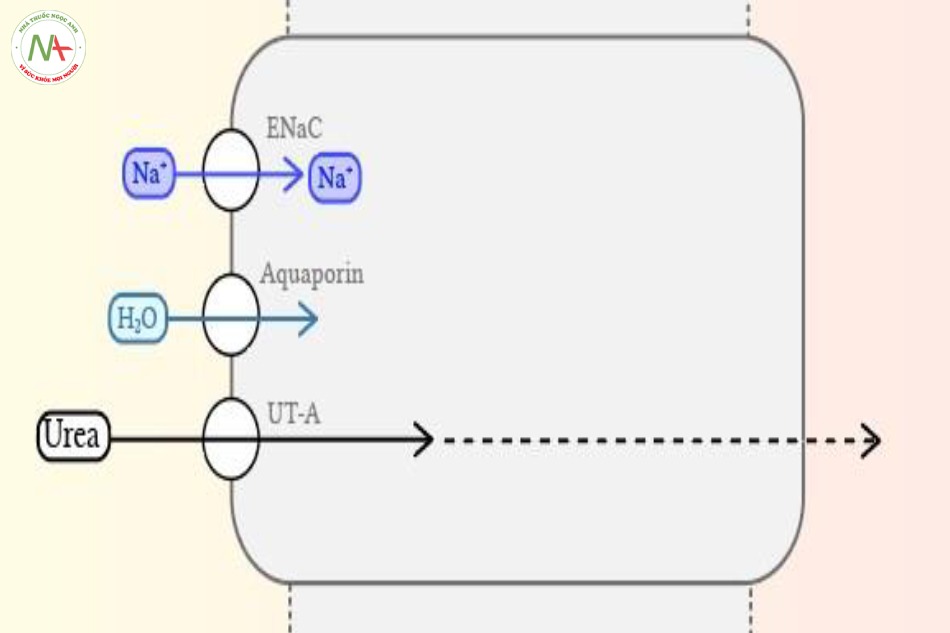
Ống góp
Ở đây không có bộ máy vận chuyển calcium (chủ yếu là các kênh TPRV5 trên đỉnh tế bào và các kênh vận chuyển trao đổi NCX ở phần đáy tế bào) truyền tín hiệu vận chuyển của ống nối vào trong ống góp. Phần ống góp này được chia thành hai phần nhỏ hơn có vị trí giải phẫu cũng như chức năng hoàn toàn khác nhau:
- Phần ống góp trong vỏ thận, nằm ở vỏ thận và không thấm với urea.
- Phần ống góp nằm ở trong và ngoài tủy thận, rất thấm urea và đây là nơi sự tái hấp thu urea tạo thành cơ chế luân chuyển xoay vòng urea trong thận qua đó giữ được nồng độ urea cao ở khu vực bên trong tủy thận.
Phần này được đặc trưng về chức năng bởi tính nhạy cảm của nó với aldosterone và vasopressin, giúp điều hòa sự tái hấp thu muối, nước và urea:
Tái hấp thu muối ở đoạn này được thực hiện triệt để dù còn bao nhiêu sau khi đã được rút cạn ở ống lượn gần, đoạn lên dày của quai Henle và ống lượn xa. Giai đoạn này sự tái hấp thu muối nước được điều hòa bởi kênh EnaC dưới tác dụng của Aldosterone. Đây là nơi mà các thuốc spironolactone (chặn sự tác động của aldosterone lên kênh ENaC) và amiloride (bất hoạt trực tiếp kênh ENaC).
- Tiết Kali ở ống góp cũng được điều phối bởi kênh ROMK, và cũng giống ở những đoạn khác trong ống xa của cầu thận, kali ở đây được tống vào dịch lọc theo chênh áp điện tích. Nếu có một sự tái hấp thu natri lớn dưới tác động của aldosterone, sự bài tiết kali sẽ tăng lên để bảo tồn được thế cân bằng điện tích trong tế bào (lẫn trong dịch lọc), và cuối cùng là kali được thải cùng nước tiểu. Kết cục của sự kiện này đưa đến tình trạng tăng natri máu và hạ kali máu, thấy trong bối cảnh cường aldosterone27, cũng như gây ra tình huống hạ natri máu, tăng kali máu khi sử dụng spironolactone.
- Tái hấp thu nước và urea ở ống góp được điều hòa bởi vasopressin. Chất này kích hoạt sự gắn kết của aquaporin và kênh UT1-3 vào lớp màng hướng vào lòng ống. Kênh Aquaporin hiện diện rất nhiều ở ống nằm trong phần vỏ, cho phép urea tập trung với nồng độ cao, và kênh UT1-3 rất nhiều ở phần ống nằm ở sâu trong tủy thận, giúp urea tái hấp thu vào trong tủy thận theo chênh áp nồng độ. Cơ chế tuần hoàn của urea này cần cho việc giữ được nồng độ thẩm thấu trong tủy thận, qua đó giúp tái hấp thu nước từ dịch lọc trong ống thận. Nhiều điều hơn sẽ được trình bày trong các nội dung ở các bài khác.
Tế bào Chen-giữa
Thuật ngữ “intercalated”, có nghĩa là “lèn điều gì đấy một cách rõ ràng vào giữa những điều khác”, đã mô tả rất rõ về các tế bào này. Các tế bào chen-giữa này nằm giữa các tế bào thượng bì trông có vẻ bình thường tạo nên phần ống gọi là “nhạy cảm với aldosterone” (phần xa của D2 ống lượn, ống nối và ống góp). Chúng có cấu trúc khác biệt rõ rệt với các tế bào còn lại, và thực hiện chức năng chủ yếu liên quan đến ammonia, kali và cân bằng toan-kiềm. Chi tiết sâu hơn được viết bởi tác giả Roy và cộng sự (2015)29, nhưng với bạn đọc muốn ngắn gọn, hình dưới đây có lẽ đủ dùng:
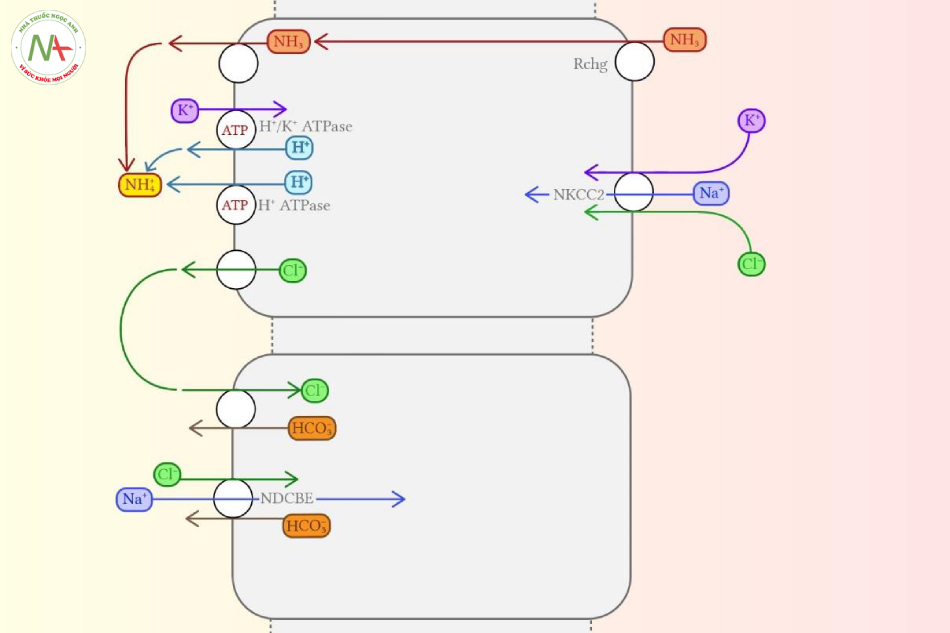
Hoặc, nói cách khác, các tế bào này:
- Tiết ammonium (là chất gắn kết trường tồn [bẫy] của hydrogen ion [H+] trong ống). NH4+ là sự kết hợp của NH3 và H+, nằm ở dịch lọc trong lòng ống (bị giam cầm bởi sự tích điện dương của chính nó).
- Tiết Chloride. Theo cơ chế thụ động chủ yếu được vận hành bởi cơ chế điện tích; sự tích điện dương của ammonium có trong lòng dịch tạo ra một chênh áp điện tích theo đó kéo chloride vào (dịch lọc trong lòng ống). Bản thân Chloride có thể bị kéo ngược vào lại tế bào qua kênh trao đổi Chloride-bicarbonate, nhưng protein này (kênh trao đổi Chloride-bicarbonate) chỉ hoạt động khi pH trong tế bào ổn định ở một mức cao.
Chức năng thăng bằng toan kiềm này đóng vai trò quan trọng sinh bệnh học của Toan hóa ống thận type 1 (do tổn thương ống lượn xa), khi mà sự bài tiết H+ nhờ vào năng lượng (ATP-powered H+ secretion) bị hư hoại, mà thông thường nhờ quá trình này giúp điều chỉnh tính acid. Khi pH giảm, theo lý thuyết hoạt động của protein giúp tiết H+ này phải gia tăng, và do đó làm tăng khả năng bắt giữ ammonium ở ống thận cũng như tăng thải chloride. Ở bối cảnh RTA (đặc biệt ở thể gene lặn), các protein tiết H+ này có thể trở nên kém hoặc bất hoạt ngay cả khi pH máu thấp.
Tài liệu tham khảo
- Madsen et al – Anatomy of the Kidney; in: Brenner and Rector’s The Kidney, 8th ed. (Chapter 2)
- Bell, P. Darwin, Jean Yves Lapointe, and János Peti-Peterdi. “Macula densa cell signaling.” Annual review of physiology 65.1 (2003): 481-500.
- Kriz, Wilhelm, and Brigitte Kaissling. “Structural organization of the mammalian kidney.” The kidney: physiology and pathophysiology 3 (1992): 587-654.
- Vallon, Volker. “Tubuloglomerular feedback and the control of glomerular filtration rate.” Physiology 18.4 (2003): 169-174.
- Crayen, M. L., and W. Thoenes. “Architecture and cell structures in the distal nephron of the rat kidney.” Cytobiologie 17.1 (1978): 197-211.
- Reilly, Robert F., and David H. Ellison. “Mammalian distal tubule: physiology, pathophysiology, and molecula anatomy.” Physiological reviews 80.1 (2000): 277-313.
- Subramanya, Arohan R., and David H. Ellison. “Distal convoluted tubule.” Clinical Journal of the American Society of Nephrology 9.12 (2014): 2147-2163.
- Roy, Ankita, Mohammad M. Al-bataineh, and Núria M. Pastor-Soler. “Collecting duct intercalated cell function and regulation.” Clinical Journal of the American Society of Nephrology 10.2 (2015): 305-324.
- Clapp, J. Ro, and R. R. Robinson. “Osmolality of distal tubular fluid in the dog.” The Journal of clinical investigation 45.12 (1966): 1847-1853.