Bệnh cơ xương khớp, Bệnh thận - tiết niệu
Tiêu cơ vân và Tổn thương thận cấp
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Để tải bài viết Tiêu cơ vân và Tổn thương thận cấp PDF mời các bạn click vào link ở đây.
Rhabdonmyolysis and Acute Kidney Injury.
Tác giả: Xavier Bosch, M.D., Ph.D., Esteban Poch, M.D., Ph.D., and Josep M. Grau, M.D., Ph.D.
Dịch: BS Võ Thị Diễm Hà
HABDOMYOLYSIS (TIÊU CƠ VÂN)
Theo định nghĩa, là quá trình phân hủy cơ vân — đặc trưng là sự thất thoát các thành phần có trong tế bào cơ vào hệ tuần hoàn, gồm có điện giải, myoglobin và các protein cơ tương khác (vd, creatine kinase, aldolase, lactate dehydrogenase, alanine aminotransferase, và aspartate amino- transferase). Hoại tử cơ ồ ạt biểu hiện là yếu chi, đau cơ, phù, và thường gặp là tiểu sắc tố đại thể không gồm tiểu máu, là đặc điểm thường gặp của tiêu cơ vân do chấn thương và không do chấn thương.1,2 Tổn thương thận cấp (AKI) là một biến chứng tiềm tàng của tiêu cơ vân nặng dù là do chấn thương hoặc do nguyên nhân khác, và tiên lượng xấu nếu suy thận tiến triển. Ngược lại, tiêu cơ vân dạng nhẹ hoặc trong những trường hợp hủy cơ mạn tính hoặc từng đợt — một tình trạng gọi là tăng creatine kinase máu — bệnh nhân biểu hiện ít triệu chứng hơn và không có suy thận. Chúng tôi xin lược lại các đặc điểm về sinh bệnh học và điều trị AKI do tiêu cơ vân.
Có 8 nhóm nguyên nhân phổ biến gây tiêu cơ vân đã được báo cáo (Bảng 1). Các chất ngoại sinh có thể gây độc cho cơ, đặc biệt là rượu, ma túy, các thuốc hạ lipid máu, là những nguyên nhân không do chấn thương thường gặp. Tiêu cơ vân tái phát nhiều lần thường là một dấu hiệu tiềm ẩn của khiếm khuyết chuyển hóa cơ.1,3,4
Tiêu cơ vân cấp tính thường tiến triển ở những bệnh nhân có bệnh cơ cấu trúc khi tập luyện cường độ cao, đang được gây mê, dùng thuốc độc cơ hoặc nhiễm siêu vi.1 Khi nghi ngờ có tiêu cơ vân cấp tính, sinh thiết cơ làm các xét nghiệm hóa mô, hóa mô miễn dịch, hô hấp mức độ tế bào-ti thể có thể giúp chẩn đoán xác định. Điều quan trọng là phải chờ vài tuần đến vài tháng sau khi có biểu hiện lâm sàng mới sinh thiết, vì trong giai đoạn sớm của tiêu cơ vân cấp tính kết quả sinh thiết sẽ không cung cấp thông tin gì; kết quả có thể bình thường hoặc không có dấu hiệu đặc hiệu gì ngoài hình ảnh hoại tử (Hình 1).2,5
Cơ chế bệnh sinh của tiêu cơ vân là tổn thương trực tiếp màng tế bào cơ (vd, chấn thương) hoặc cạn kiệt ATP trong tế bào cơ, dẫn đến tăng calcium nội bào không kiểm soát.6,7 Calcium trong cơ tương được điều hòa chặt chẽ bởi một chuỗi các bơm, kênh và chất trao đổi để duy trì nồng độ thấp khi cơ ở trạng thái nghỉ và tăng khi cần có sự gắn kết actin-myosin và co cơ. Thiếu hụt ATP làm suy giảm chức năng của các bơm này, gây tăng calcium trong cơ tương kéo dài, dẫn đến co cơ liên tục và cạn kiệt năng lượng, hoạt hóa các protease trung tính phụ thuộc calcium và phospholipase; hậu quả là phá hủy các tơ cơ, khung xương tế bào và protein màng, sau đó là các sợi cơ bị lysosome tiêu hủy. Cuối cùng, mạng lưới tơ cơ đứt gãy, dẫn đến tế bào cơ bị phân rã.2 Trong trường hợp bệnh nhân bị tiêu cơ vân do chấn thương, các tổn thương khác tổn thương tái tưới máu sau thiếu máu nuôi và viêm do bạch cầu trung tính gây thâm nhiễm các tế bào cơ đã bị phá hủy.8
| Bảng 1. Phân loại và các nguyên nhân thường gặp của tiêu cơ vân | |
| Phân loại | Nguyên nhân thường gặp đã được báo cáo |
| Chấn thương | Hội chứng vùi lấp |
| Gắng sức | Tập luyện cường độ cao, động kinh, hội chứng cai rượu |
| Thiếu oxy trong cơ | Chi bị chèn ép bởi đầu hoặc thân mình khi nằm bất động kéo dài hoặc mất ý thức,* tắc động mạch lớn |
| Khiếm khuyết di truyền | Rối loạn quá trình đường phân hoặc thoái giáng glycogen, bao gồm myophosphorylase (glycogenosis type V), phosphofructokinase (glycogenosis type VII), phosphorylase kinase (glycogenosis type VIII), phosphoglycerate kinase (glycogenosis type IX), phosphoglycerate mutase (glycogenosis type X), lactate dehydrogenase (glycogenosis type XI)
Rối loạn chuyển hóa lipid, bao gồm carnitine palmitoyl transferase II, acylCoA dehydrogenase chuỗi dài, L3hydroxyacylCoA dehydrogenase chuỗi ngắn, acylCoA dehydrogenase chuỗi vừa, acylCoA dehydrogenase chuỗi rất dài, 3ketoacylCoA chuỗi trung bình, thiolase† Rối loạn liên quan ti thể, bao gồm succinate dehydrogenase, cytochrome c oxidase, coenzyme Q10 Con đường Pentose phosphate: glucose6phosphate dehydrogenase Chu trình Purine nucleotide: myoadenylate deaminase |
| Nhiễm trùng‡ | Influenza A và B, coxsackievirus, Epstein–Barr virus, HIV nguyên phát, legionella
Streptococcus pyogenes, Staphylococcus aureus (viêm cơ mủ), clostridium |
| Thay đổi nhiệt độ cơ thể | Sốc nhiệt, tăng thân nhiệt ác tính, hội chứng an thần kinh ác tính, hạ thân nhiệt |
| Rối loạn chuyển hóa và điện giải | Hạ kali máu, hạ phosphate máu, hạ calci máu, tăng áp lực thẩm thấu không do cetone, toan cetone do ĐTĐ |
| Thuốc và độc chất | Các thuốc hạ lipid máu (fibrates, statins), rượu, heroin, cocaine |
| Vô căn (thỉnh thoảng tái phát) | |
| * Cơ chế của tiêu cơ vân do nguyên nhân này giống với hội chứng vùi lấp. † CoA nghĩa là coenzyme A. |
|
DỊCH TỄ CỦA AKI DO MYOGLOBIN NIỆU
AKI do myoglobin niệu là biến chứng nghiêm trọng nhất có thể đe dọa tính mạng của tiêu cơ vân kể cả do chấn thương và không do chấn thương. Biến chứng AKI của tiêu cơ vân khá phổ biến, chiếm 7-10% các trường hợp AKI ở Hoa Kì. 4,9 Rất khó để tính được tỉ suất mới mắc của AKI do tiêu cơ vân vì có nhiều định nghĩa và bối cảnh lâm sàng khác nhau. Tỉ suất mới mắc được báo cáo dao động từ 13% đến xấp xỉ 50%.9-11 Trong một nghiên cứu của Melli và cs. trên 475 bệnh nhân tiêu cơ vân nhập viện, tỉ suất mới mắc của AKI là 46%.10 Mặc dù tiêu cơ vân do nguyên nhân nào đi nữa cũng đều có thể gây AKI, nhưng trong nghiên cứu này, tỉ suất mới mắc của AKI ở nhóm người có dùng ma túy, nghiện rượu, chấn thương cao hơn ở nhóm người có bệnh lý ở cơ, và đặc biệt cao ở nhóm bệnh nhân có một hoặc nhiều yếu tố nguyên nhân được phát hiện10.
Dự hậu của tiêu cơ vân thường tốt nếu không có suy thận. Tuy nhiên, dữ liệu về tử suất dao động lớn tùy theo dân số nghiên cứu, số lượng và độ nặng của các bệnh đồng mắc. Trong một nghiên cứu mà tỉ suất mới mắc của bệnh lý mạch máu gây tiêu cơ vân do thiếu máu chi cao, tử suất chung là 32%.12 Ngược lại, nghiên cứu của Melli và cs trên những bệnh nhân nhập viện, những người nào lạm dụng ma túy hoặc rượu – nguyên nhân thường gặp nhất của tiêu cơ vân, có tử suất là 3.4% giữa những bệnh nhân AKI. 10 Tử suất ở những bệnh nhân trong ICU được báo cáo là 59% khi có AKI và 22% khi không có AKI. 13,14 Thời gian sống còn kéo dài ở những bệnh nhân tiêu cơ vân và AKI được báo cáo là gần 80%, và đa số bệnh nhân AKI do tiêu cơ vân có chức năng thận được phục hồi. 14
![Tiêu cơ vân và Tổn thương thận cấp 6 Hình 1. Hình ảnh mô bệnh học trên mẫu mô cơ đông lạnh của bệnh nhân tiêu cơ vân. Hình A cho thấy hoại tử cơ ồ ạt (mũi tên) ở bệnh nhân tiêu cơ vân liên quan đến Statin (nhuộm hematoxylin và eosin). Đặc điểm mô học này tương tự ở tất cả các trường hợp tiêu cơ vân bất kể nguyên nhân. Hình B là mẫu mô có những sợi cơ màu đỏ rách nham nhở (mũi tên) đặc trưng ở những bệnh nhân có bệnh lý cơ liên quan đến ti thể, được lấy sau đợt tiêu cơ vân nặng cấp tính được 3 tháng. Chẩn đoán rối loạn chức năng ti thể nhờ xét nghiệm phân tích chuỗi hô hấp ti thể (nhuộm Gomori’s trichrome). Hình C là hình ảnh đặc hiệu của nhuộm periodic acid–Schiff (PAS) (mũi tên) ở một số sợi cơ trong bệnh McArdle. Mẫu mô này được lấy sau khi bệnh nhân tiêu cơ vân tái phát đã hồi phục được nhiều tháng (nhuộm PAS). Hình D là mẫu sinh thiết cơ của bệnh nhân mắc bệnh lõi trung tâm [central core disease - một bệnh cơ bẩm sinh (ND)]. Mẫu mô này được lấy từ bệnh nhân tăng thân nhiệt ác tính đã hồi phục. Mũi tên là hình ảnh của các lõi trung tâm (nhuộm NADH–tetrazolium reductase)](https://nhathuocngocanh.com/wp-content/uploads/2022/01/tieu_co_van_va_ton_thuong_than_cap_1.jpg)
CƠ CHẾ BỆNH SINH CỦA AKI DO MYOGLOBIN NIỆU
Myoglobin niệu chỉ xảy ra trong bệnh cảnh tiêu cơ vân. Myoglobin là một protein màu đỏ sậm có trọng lượng phân tử 17.8-kDa, được lọc tự do bởi cầu thận đi vào biểu mô ống thận qua cơ chế nhập bào và được chuyển hóa. Nó chỉ xuất hiện trong nước tiểu khi vượt quá ngưỡng của thận là 0.5-1.5 mg/dL và có màu đỏ nâu khi quan sát đại thể (màu nước trà) khi nồng độ myoglobin huyết thanh là 100mg/dL15; vì vậy, không phải tất cả các trường hợp tiêu cơ vân có liên quan đến myoglobin niệu.
Cơ chế chính xác tại sao tiêu cơ vân gây giảm độ lọc cầu thận chưa được biết rõ, tuy nhiên các bằng chứng thực nghiệm cho rằng tình trạng co mạch máu thận, tổn thương ống thận trực tiếp do thiếu máu và tắc ống thận có vai trò trong đó (Hình 2).16 Myoglobin trở nên cô đặc dọc theo ống thận và tăng dần khi có giảm thể tích và co mạch máu thận, nó sẽ kết tủa khi phản ứng với protein Tamm–Horsfall, quá trình này thuận lợi hơn nhờ môi trường nước tiểu toan hóa.17 Tắc nghẽn ống thận xảy ra chủ yếu ở ống lượn xa và tác dụng gây độc ống thận trực tiếp là ở ống lượn gần.
Myoglobin dường như không gây độc cho ống thận nếu nước tiểu không toan. Myoglobin là một protein heme; chứa sắt dạng sắt II oxide (Fe2+), cần thiết cho quá trình gắn kết các phân tử oxy. Tuy nhiên, phân tử oxy có thể làm tăng quá trình oxy hóa Fe2+ thành sắt III oxide (Fe3+), làm kích hoạt các gốc hydroxyl. Quá trình oxy hóa này đối kháng với các phân tử chống oxy hóa nội bào. Tuy nhiên, sự phóng thích myoglobin từ tế bào dẫn đến thất thoát các chất hoạt hóa oxy và gốc tự do không kiểm soát gây tổn thương tế bào. Người ta cho rằng heme và các gốc hydroxyl gắn sắt là các chất trung gian quyết định trong việc phá hủy ống thận do hiệu quả bảo vệ của deferoxamine (một chất chelate hóa sắt) và glutathion. 18 Gần đây, người ta thấy rằng tự myoglobin có thể hoạt động như là một enzyme giống peroxidase dẫn đến sự oxy hóa quá mức các phân tử sinh học, peroxide hóa lipid và hình thành các isoprostane. 19
Co mạch thận là một đặc trưng của AKI do tiêu cơ vân và là kết quả của nhiều cơ chế hợp lại. Đầu tiên, giảm thể tích nội mạch do mất dịch vào khoang thứ ba cùng với tình trạng hủy cơ dẫn đến kích hoạt hệ thống renin-angiotensin, vasopressin và hệ thần kinh giao cảm. Thứ hai, các nghiên cứu thực nghiệm cho thấy các chất trung gian mạch máu tăng khi có giảm lưu lượng máu tới thận, gồm có endothelin-1, thromboxane A2, yếu tố hoại tử mô α; và F2-iso-prostanes9,20; thiếu nitric oxide – một chất giãn mạch, có thể do hiệu ứng làm sạch myoglobin trong vi tuần hoàn thận, cũng được cho là một chất trung gian khi có giảm lưu lượng máu đến thận. 16 Nói chung, các chất trung gian mạch máu này được kích thích tại chỗ bởi các tổn thương oxy hóa và viêm qua trung gian bạch cầu vốn là hậu quả của rối loạn nội mô, thường gặp trong những dạng AKI khác. 21
BIỂU HIỆN Ở THẬN CỦA TIÊU CƠ VÂN
Bệnh nhân tiêu cơ vân cấp có biểu hiện là có trụ hạt sắc tố, nước tiểu màu đỏ nâu và tăng creatine kinase huyết thanh ồ ạt. Không có ngưỡng creatine kinase huyết thanh xác định mà trên ngưỡng đó làm tăng nguy cơ AKI đáng kể. Đã có báo cáo về mối tương quan rất kém giữa giá trị creatine kinase đỉnh với tỉ suất AKI mới mắc hoặc đỉnh creatinine huyết thanh. 10,11,22 Nguy cơ AKI trong tiêu cơ vân thường thấp khi nồng độ creatine kinase lúc nhập viện < 15,000-20,000 U/L. 12,13,23 Mặc dù AKI có thể liên quan đến giá trị creatine kinase thấp 5000 U/L, điều này thường xảy ra khi có kèm theo nhiễm trùng huyết, mất nước và toan máu11. Ví dụ, bệnh nhân có bệnh cơ mạn tính như loạn dưỡng cơ hoặc bệnh viêm cơ, AKI hiếm khi tiến triển trừ khi có một biến cố thêm vào. Mặt khác, những bệnh nhân này có thể có myoglobin huyết tương tăng mức độ trung bình nhưng không gây myoglobin niệu. 24 Nếu que nhúng nước tiểu dương tính với máu khi không có hồng cầu trong cặn lắng nước tiểu, điều này gợi ý có myoglobin niệu. Kết quả dương tính giả này xảy ra vì que nhúng nước tiểu không phân được myoglobin và hemoglobin. Que nhúng có độ nhạy 80% để phát hiện tiêu cơ vân.10 Nên nghĩ đến các nguyên nhân khác làm đổi màu nước tiểu (Bảng 2).25 Myoglobin là yếu tố bệnh sinh thực sự trong AKI do tiêu cơ vân nhưng hiếm khi được đo trực tiếp trong nước tiểu hoặc huyết tương. Nồng độ myoglobin huyết thanh đạt đỉnh sớm hơn so với nồng độ creatine kinase huyết thanh; nồng độ myoglobin huyết thanh chuyển hóa nhanh và khó dự đoán,một phần qua thận nhưng chủ yếu là ngoài thận (có thể qua gan hoặc lách).26 Vì vậy, định lượng nồng độ myoglobin huyết thanh có độ nhạy thấp trong vệc chẩn đoán tiêu cơ vân. 27
AKI do tiêu cơ vân thường có creatinine huyết tương tăng nhanh hơn so với các dạng AKI khác. Tuy nhiên, điều này có thể biểu hiện quá mức nếu là bệnh nhân nam trẻ tuổi nhiều cơ bắp trong những bệnh nhân bị tiêu cơ vân hơn là do tăng creatinine hoặc giải phóng creatine từ cơ bị phá hủy. 14,28,29 Tương tự, tỉ số BUN/creatinine thấp thường gặp ở bệnh nhân tiêu cơ vân. AKI do tiêu cơ vân thường gây thiểu niệu và đôi khi gây vô niệu.
Điểm đặc trưng của AKI do tiêu cơ vân khác với AKI do hoại tử ống thận cấp khác là tỉ suất bài xuất natri thấp (<1%), thường gặp nhưng không phải là tất cả; điều này cho thấy bệnh sinh chủ yếu là do co mạch trước cầu thận và tắc nghẽn ống thận hơn là hoại tử ống thận. 30 Tỉ suất bài xuất natri là tỉ lệ phần trăm natri được lọc và thải qua nước tiểu, tỉ suất này thấp trên bệnh nhân AKI là một dấu hiệu cho thấy chức năng ống thận tương đối còn nguyên vẹn. Tuy nhiên, khi có hoại tử ống thận cấp do thiếu máu hoặc độc chất, cả natri nước tiểu và tỉ suất bài xuất natri nước tiểu đều tăng.
Rối loạn điện giải – hậu quả của việc phóng thích các thành phần trong tế bào – thường đi kèm và giúp xác định độ nặng của AKI do tiêu cơ vân. Vì rối loạn điện giải có thể có trước AKI, cần làm điện giải đồ ngay khi chẩn đoán tiêu cơ vân. Các bất thường điện giải có thể gặp trong tiêu cơ vân là tăng kali máu (có thể tăng rất nhanh), tăng phosphate máu, tăng acid uric máu, toan chuyển tóa tăng anion gap và tăng magie máu chủ yếu khi đã có suy thận.4,15,22,31 Nồng độ phosphate cao có thể gắn kết với calcium và sự lắng đọng phức hợp calcium-phosphate trong mô mềm có thể xảy ra. Hơn nữa, phosphate máu tăng ức chế 1α-hydroxylase, vì vậy làm hạn chế hình thành calcitriol (1,25-dihy-droxyvitamin D3), dạng vitamin D có hoạt tính. Tăng kali máu là một biểu hiện sớm của tiêu cơ vân, và nồng độ kali huyết thanh tăng có thể đến ngưỡng đe dọa tính mạng trên cả bệnh nhân tiêu cơ vân do hoặc không do chấn thương.15, 31 Tăng acid uric máu xảy ra do sự giải phóng các nucleoside từ cơ bị tổn thương và có thể làm tắc ống thận vì acid uric vốn không tan và có thể kết tủa trong môi trường toan hóa của nước tiểu.
| Bảng 2. Nguyên nhân và đặc điểm vi thể của nước tiểu có màu đỏ và nâu. | |||
| Nguyên nhân | Kết quả hồng cầu trong nước tiểu tươi* |
Cặn lắng†‡ | Lớp nước bề mặt‡ |
| Tiểu máu | + đến ++++ | Đỏ | Vàng |
| Myoglobin niệu | + đến ++++ | Bình thường | Đỏ đến nâu |
| Hemoglobin niệu | + đến ++++ | Bình thường | Đỏ đến nâu |
| Porphyria | Âm tính | Bình thường | Đỏ |
| Tiểu sắc tố mật | Âm tính | Bình thường | Nâu |
| Thức ăn và thuốc§ | Âm tính | Bình thường | Đỏ đến nâu |
| * Xét nghiệm nước tiểu bằng que nhúng. Đây là một xét nghiệm số lượng hồng cầu bán định lượng trên mỗi microliter. Kết quả dao động từ + (5-10 hồng cầu mỗi microliter) đến ++++ (xấp xỉ 250 hồng cầu mỗi microliter).
† Nước tiểu bình thường có máu trắng hoặc vàng, không có gì đặc biệt nếu không có các tế bào, tinh thể hoặc trụ. ‡ Cặn lắng và lớp nước tiểu bề mặt được kiểm tra sau khi ly tâm 10-15 ml nước tiểu tốc độ 1500-3000 vòng/phút trong 5 phút. § Thức ăn và thuốc làm nước tiểu có màu đỏ gồm củ dền, mâm xôi đen, đại hoàng, màu thực phẩm, đậu răng ngựa, phenolphthalein, rifampin, doxorubicin, deferoxamine, chloroquine, ibuprofen và methyldopa. Thuốc làm nước tiểu có màu nâu là levodopa, metronidazole, nitrofurantoin, iron sorbitol, chloroquine và methyldopa |
|||
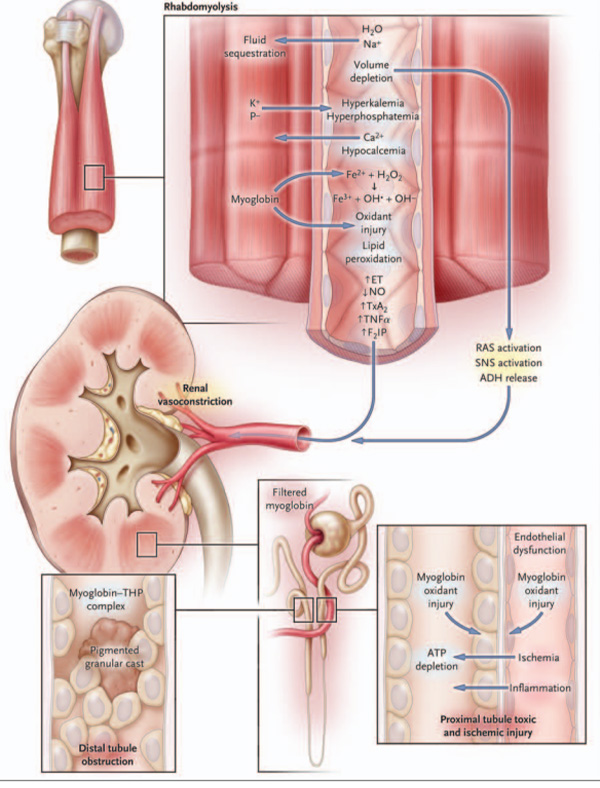
| Hình 2. Cơ chế bệnh sinh của AKI do tiêu cơ vân.
Sự dịch chuyển dịch vào mô cơ bị tổn thương gây giảm thể tích, và hậu quả là kích hoạt hệ thần kinh giao cảm (SNS), hormone chống bài niệu(ADH), và hệ reninangiotensin (RAS), các cơ chế đều gây co mạch và giữ muối nước. Hơn nữa, tổn thương oxy hóa do myoglobin làm tăng các chất co mạch và làm giảm chất giãn mạch. Tổn thương thận là do sự kết hợp giữa thiếu máu nuôi do co mạch thận, tổn thương gây độc ống thận trực tiếp qua trung gian các chất oxy hóa liên quan đến myoglobin (hình dưới phải), tổn thương ống thận do thiếu máu, và tắc ống thận do lắng đọng phức hợp protein Tamm– Horsfall protein–myoglobin (hình dưới trái) bên cạnh việc bong tróc các tế bào ống thận tạo thành các trụ tế bào. Giống như AKI do những nguyên nhân khác, rối loạn chức năng nội mô và viêm tại chỗ góp phần phá hủy mô và rối loạn chức năng cơ quan. ET nghĩa là endothelin, F2 IP F2 isoprostanes, NO nitric oxide, THP Tamm–Horsfall protein, TNF¬α yếu tố hoại tử mô α, TxA2 thromboxane A2, và VC vasoconstriction (co mạch). |
Hạ calcium máu là biến chứng thường gặp của tiêu cơ vân, thường do calcium đi vào các tế bào cơ bị tổn thương do thiếu máu nuôi và do kết tủa tạo thành calcium phosphate kèm với vôi hóa cơ bị hoại tử. Tăng calcium máu có liên quan đến chức năng thận hồi phục là điểm đặc biệt nhất của AKI do tiêu cơ vân, do sự di chuyển của calcium trước đây lắng đọng trong cơ, phosphate máu trở về bình thường và calcitriol tăng.32
ĐIỀU TRỊ VÀ PHÒNG NGỪA
Bệnh nhân tiêu cơ vân có AKI thường biểu hiện lâm sàng là thiếu dịch do nước thất thoát vào các cơ bị hoại tử. Vì vậy, biện pháp chủ yếu để xử trí vấn đề này (Bảng 3) vẫn là bù dịch sớm và tích cực; bệnh nhân cần khoảng 10 lít dịch/ngày,31 lượng dịch đưa vào phụ thuộc vào mức độ nặng của tình trạng ly giải cơ. 33 Chưa có thử nghiệm ngẫu nhiên đánh giá bù dịch ở bệnh nhân bị hội chứng vùi lấp do chấn thương trong thảm họa như động đất. Tuy nhiên, đa số, không phải tất cả các báo cáo đều cho rằng bệnh nhân có tổn thương thận cấp tiến triển có thời gian điều trị nâng đỡ chậm hơn so với bệnh nhân chưa tiến triển đến tổn thương thận cấp (Bảng 4).8,23,31,33,39 Vì vậy, bù dịch sớm tích cực là điều khẩn thiết ở bệnh nhân bị hội chứng vùi lấp. Mặc dù nhu cầu của việc bù dịch đã được đặt ra, điều còn gây tranh cãi là nên dùng loại dịch nào. Một số nhà nghiên cứu khuyến cáo truyền natri bicarbonate để làm kiềm hóa nước tiểu, được đề nghị đầu tiên bởi Bywaters và Beall, 8,39,40 trong khi đó những người khác tranh luận rằng nên dùng normal saline hoặc dung dịch saline 0.45%. Ba ưu điểm của của việc kiềm hóa theo kinh nghiệm này dựa theo nghiên cứu trên mô hình tiêu cơ vân ở động vật. Đầu tiên, điều đã biết là sự kết tủa của phức hợp protein TammHorsfall và myoglobin tăng trong môi trường toan của nước tiểu.17 Thứ hai, kiềm hóa nước tiểu ức chế sự tái chuyển oxy hóa-khử của myoglobin và peroxidase hóa lipid trong tiêu cơ vân, điều gây tổn thương ống thận.41 Thứ ba, metmyoglobin chỉ gây co mạch trong môi trường acid ở thận độc nhất được tưới máu.42 Bất lợi chủ yếu và duy nhất của kiềm hóa nước tiểu là giảm calcium ion hóa, điều này làm cho các triệu chứng của giai đoạn hạ calcium máu của tiêu cơ vân trở nên tệ hơn.
| Bảng 3. Các bước phòng ngừa và điều trị AKI do tiêu cơ vân |
| Đánh giá tình trạng dịch ngoại bào, áp lực tĩnh mạch trung tâm và thể tích nước tiểu.*
Định lượng nồng độ creatine kinase huyết thanh và các enzyme cơ khác (myoglobin, aldolase, lactate dehydrogenase, alanine aminotransferase, và aspartate aminotransferase) hỗ trợ thông tin cho chẩn đoán hoặc điều trị. Đo nồng độ creatinine trong huyết tương và nước tiểu, kali và natri, BUN, calcium toàn phần và ion hóa, magnesium, phosphate, acid uric, albumin; đánh giá tình trạng toan kiềm, công thức máu và đông máu. Tổng phân tích nước tiểu bằng que nhúng và soi cặn lắng nước tiểu. Khởi đầu bù dịch bằng normal saline đúng lúc tốc độ xấp xỉ 400 ml/giờ (200 đến 1000 ml mỗi giờ tùy thuộc vào độ nặng), kèm với theo dõi lâm sàng và áp lực tĩnh mạch trung tâm. Thể tích nước tiểu đạt mục tiêu 3 ml/kg cơ thể/giờ (200 ml/giờ). Kiểm tra nồng độ kali thường xuyên. Chỉ điều trị hạ calcium máu khi có triệu chứng (vd, tetany hoặc co giật) hoặc có tăng kali máu nặng. Tìm nguyên nhân gây tiêu cơ vân. Kiểm tra pH nước tiểu. Nếu < 6.5, thay thế mỗi lít normal saline bằng 1 lít dextrose 5% + 100 mmol bicarbonate. Tránh dùng dung dịch chứa kali và lactate. Cân nhắc dùng mannitol (tối đa 200g/ngày và liều tích lũy tối đa 800 g). Kiểm tra áp lực thẩm thấu huyết tương và osmolol gap huyết tương. Ngưng dùng nếu không có tác dụng lợi tiểu (>20 ml/giờ). Duy trì bù dịch cho đến khi myoglobin được thải sạch (kiểm tra bằng cách quan sát nước tiểu trong trở lại hoặc dùng que nhúng thử nước tiểu âm tính với máu). Cân nhắc điều trị thay thế thận nếu tăng kali máu kháng trị > 6.5 mmol/L có triệu chứng (đánh giá qua ECG), kali máu tăng nhanh, thiểu niệu (nước tiểu <0.5 ml/kg/giờ trong 12 giờ), vô niệu, quá tải dịch hoặc toan chuyển hóa kháng trị (pH <7.1). * Trong trường hợp có hội chứng vùi lấp (vd, động đất, sập nhà), bù dịch tích cực ngay trước khi sơ tán bệnh nhân. |
Lợi ích lâm sàng của kiềm hóa nước tiểu so với bù dịch thông thường chưa được xác định rõ. Các nghiên cứu so sánh thường có cỡ mẫu nhỏ và có kết hợp nhiều phương pháp (vd, kiềm hóa nước tiểu kết hợp mannitol) nên không thể phân tích được hiệu quả của từng phương pháp34-38 (Bảng 4). Trong một nghiên cứu, dự hậu lên thận không khác biệt đáng kể giữa những bệnh nhân được điều trị kết hợp bicarbonate và mannitol và chỉ dùng normal saline, mặc dù nồng độ creatine kinase đỉnh trong huyết thanh dưới 5000 U/L, điều này cho thấy mức độ tổn thương khá nhẹ nên khó đánh giá hiệu quả điều trị. 36 Trong một nghiên cứu lớn ở những bệnh nhân chấn thương (2083 người), tiêu cơ vân xảy ra 85%, và truyền bicarbonate kết hợp mannitol không giúp phòng ngừa suy thận, nguy cơ lọc máu hoặc tử vong, mặc dù kết quả gợi ý rằng điều này có thể có lợi cho bệnh nhân có nồng độ creatine kinase đỉnh trên 30,000 U/L.37 Trong một thử nghiệm ngẫu nhiên tiến cứu về bù dịch bằng Ringer lactate so với normal saline ở bệnh nhân tiêu cơ vân do ngộ độc doxylamine, 28 bệnh nhân được xếp ngẫu nhiên để dùng một loại dịch truyền.38 Natri carbonate được thêm vào ở cả 2 nhóm nếu pH nước tiểu < 6.5 sau 12 giờ bù dịch tích cực. Nồng độ creatine kinase huyết thanh đỉnh thấp hơn 10,000 U/L, dường như những bệnh nhân này không có AKI tiến triển, mặc dù những dữ liệu này không được báo cáo. Dù thực tế việc kiềm hóa nước tiểu ở bệnh nhân tiêu cơ vân là có lợi, có bằng chứng cho thấy truyền normal saline lượng lớn có thể gây toan chuyển hoá, chủ yếu do sự pha loãng bicarbonate trong huyết thanh bằng một dung dịch chứa lượng lớn ion clo, gây toan chuyển hóa tăng clo máu với pH máu giảm khoảng 0.3.43 Vì vậy, truyền cả normal saline và natri bicarbonate có vẻ là cách tiếp cận hợp lý khi bù dịch cho bệnh nhân tiêu cơ vân, đặc biệt là bệnh nhân có toan chuyển hóa (Table 3). Nếu dùng natri bicarbonate, cần theo dõi pH nước tiểu, nồng độ bicarbonate, calcium và kali huyết thanh, nếu pH nước tiểu không tăng sau 4-6 giờ điều trị hoặc có triệu chứng hạ calcium máu, cần ngưng việc kiềm hóa và tiếp tục bù dịch bằng normal saline.
| Bảng 4. Các nghiên cứu so sánh về các phác đồ phòng ngừa và điều trị tiêu cơ vân. | |||||
| Nghiên cứu | Thiết kế NC | Đặc điểm bệnh nhân | Số lượng mẫu |
Chiến lược điều trị | Dự hậu trên bệnh nhân AKI |
| Shimazu et al.34 | Hồi cứu | Bệnh nhân bị hội chứng vùi lấp | 14 | Điều trị sớm vs. muộn; bù dịch nhiều (>10L/48 giờ) vs. ít | Tốt hơn nếu được điều trị sớm; bù dịch nhiều tốt hơn bù dịch ít |
| Gunal et al.35 | Hồi cứu | Bệnh nhân bị hội chứng vùi lấp | 16 | Điều trị sớm vs. điều trị muộn bằng normal saline + bicarbonate | Tốt hơn nếu được điều trị sớm |
| Homsi et al.36 | Hồi cứu | Bệnh nhân trong ICU | 24 | Normal saline vs. normal saline +bicarbonate+mannitol | Không khác biệt |
| Brown et al.37 | Hồi cứu | Bệnh nhân chấn thương | 2083 | Normal saline vs. bicarbonate + mannitol | Không khác biệt |
| Cho et al.38 | Tiến cứu, ngẫu nhiên | Bệnh nhân bị ngộ độc doxylamine | 28 | Ringer’s lactate vs. normal saline; bicarbonate nếu pH nước tiểu <6.5 |
Không có hiệu quả đến nồng độ đỉnh của creatine kinase giữa 2 nhóm; nhóm dùng normal saline cần nhiều bicarbonate hơn nhóm dùng Ringer lactate |
Việc dùng lợi tiểu vẫn còn tranh cãi, nhưng rõ ràng là nên hạn chế dùng nếu bệnh nhân đã bù đủ dịch. Mannitol có thể có nhiều lợi ích: chất lợi tiểu thẩm thấu, nó làm tăng lưu lượng nước tiểu và đẩy các chất độc thận qua ống thận; là một chất thẩm thấu, nó tạo ra một gradient kéo dịch trong các cơ bị tổn thương ra ngoài và cải thiện tình trạng giảm thể tích; cuối cùng, nó là một chất rửa trôi gốc tự do.4,8,20 Đa số dữ liệu về hoạt tính của mannitol đến từ thực nghiệm trên động vật, kết quả cho thấy hiệu quả bảo vệ của mannitol có thể do tính lợi niệu thẩm thấu hơn là do cơ chế khác. 44 Chưa có thử nghiệm ngẫu nhiên đối chứng ủng hộ việc dùng mannitol, mặc dù một số nghiên cứu lâm sàng gợi ý rằng không có lợi ích.36,37 Hơn nữa, lượng mannitol tích lũy cao trong cơ thể (>200g/ngày hoặc tổng liều tích lũy >800g) có liên quan đến AKI do co mạch máu thận và độc ống thận, một tình trạng được gọi là bệnh thận do thẩm thấu. 45,46 Tuy nhiên, nhiều chuyên gia vẫn tiếp tục khuyến cáo dùng mannitol để phòng ngừa và điều trị AKI do tiêu cơ vân và làm giảm áp lực khoang. 20,45-47 Trong thời gian truyền mannitol, nên theo dõi áp lực thẩm thấu huyết tương và khoảng trống nồng độ thẩm thấu (osmolal gap, nghĩa là sự khác biệt giữa độ thẩm thấu đo được và tính toán) thường xuyên và ngưng truyền nếu không đạt hiệu quả lợi tiểu hoặc khi osmolal gap tăng trên 55mOsm/kg.46 Lợi tiểu quai cũng làm tăng lượng nước tiểu và có thể làm giảm nguy cơ lắng đọng myoglobin, nhưng chưa có nghiên cứu nào cho thấy lợi ích rõ ràng trên bệnh nhân tiêu cơ vân. Vì vậy, nên dùng lợi tiểu quai trong AKI do tiêu cơ vân tương tự như dùng trong AKI do nguyên nhân khác theo khuyến cáo.47,48
| Bảng 5. Tiếp cận điều trị tăng kali máu (K+≥5.5 mmol/L) do tiêu cơ vân |
| Đo nồng độ kali máu mỗi 4 giờ khi bị tiêu cơ vân nặng (creatine kinase >60,000 – 80,000 U/L) hoặc khi nghi ngờ nhiễm độc toàn thân. Điều trị tăng kali máu tích cực.
Đo ECG và kiểm tra các dấu hiệu nặng (QRS giãn rộng, sóng P dẹt, rối loạn nhịp nặng nghĩ do tăng kali máu). Theo dõi chức năng tim và nhập ICU nếu nồng độ kali máu > 6 mmol/L, có bất thường trên ECG, tiêu cơ vân nặng gây tăng kali máu nhanh. Đo nồng độ calcium huyết tương. Hạ calcium làm nặng các biểu hiện trên ECG của tăng kali máu hơn. Nếu ECG có hình ảnh bất thường nghiêm trọng, truyền tĩnh mạch calcium chloride hoặc calcium gluconate. Xem xét truyền chậm liên tục nếu có hạ calcium máu kèm theo. Dự đoán khả năng tăng calcium máu trong giai đoạn muộn của tiêu cơ vân. Không truyền bicarbonate kết hợp. Nếu nồng độ K+ > 6 mmol/L, cần đưa kali vào tế bào. Nồng độ kali sẽ giảm trong 10-30 phút sau điều trị, hiệu quả kéo dài từ 2-6 giờ. Truyền chậm insulin và glucose đường tĩnh mạch; theo dõi glucose máu bằng test đường huyết mao mạch đầu ngón tay. Phun khí dung chất đồng vận β2 như albuterol 10-20 mg pha trong 4 ml normal saline trong 10 phút. Không nên dùng như một biện pháp duy nhất; cần phối hợp với insulin và glucose cho tác dụng hiệp đồng. Truyền natri bicarbonate nếu có toan máu. Phương pháp này có thể làm nặng thêm triệu chứng hạ calcium máu và hiệu quả không chắc chắn bằng insulin và glucose hoặc albuterol. Không nên dùng như là một biện pháp duy nhất. Loại bỏ kali khỏi cơ thể bằng resin hoặc lọc máu nếu có chỉ định; dùng lợi tiểu là tùy chọn. Dùng resin trao đổi cation (sodium polystyrene sulfonate) đường miệng hoặc thụt tháo giữ lại (tránh dùng sorbitol trong những trường hợp này và sau phẫu thuật). Chạy thận nhân tạo cấp cứu nếu các biện pháp trên thất bại hoặc nếu suy thận nặng hơn hoặc tăng kali máu tiến triển. Xem xét chạy thận nhân tạo khi tiêu cơ vân có tình trạng phá hủy mô đáng kể và tăng kali máu nhanh. Kiểm tra lại kali máu sau chạy thận 4 giờ vì có thể có hiện tượng rebound. Các phương pháp đưa kali vào tế bào đã dùng trước đó có thể làm giảm hiệu quả loại bỏ kali của chạy thận nhân tạo. Dùng lợi tiểu quai ví dụ furosemide, nhưng chỉ dùng khi bệnh nhân đã được bù đủ dịch. |
Rối loại điện giải trong AKI do tiêu cơ vân phải được điều trị kịp thời; điều trị tăng kali máu, thường xảy ra rất sớm, là đặc biệt quan trọng (Bảng 5).49 Các chất đưa kali từ ngoại bào vào nội bào (vd, glucose ưu trương và bicarbonate) chỉ có hiệu quả tạm thời, và phương pháp duy nhất loại bỏ kali là lợi tiểu (lợi tiểu mất kali hiệu quả), dùng các chất gắn kết kali trong đường ruột hoặc lọc máu. 4,8,9,15 Ngược lại, không nên điều trị hạ calcium máu sớm trừ khi có triệu chứng hoặc có kèm theo tăng kali máu nặng. Nên thận trọng khi dùng các chất chelate chứa calcium để điều trị tăng phosphate máu, vì lượng lớn calcium có thể làm tăng kết tủa calcium phosphate vào trong mô cơ bị tổn thương. 4,8,9,15
Khi AKI nặng gây tăng kali máu kháng trị, toan máu hoặc quá tải dịch, cần chỉ định điều trị thay thế thận, chủ yếu là lọc máu ngắt quãng là có thể điều chỉnh các rối loạn điện giải nhanh chóng và hiệu quả. 8,9,47 Chạy thận nhân tạo thông thường không giúp loại bỏ myoglobin một cách hiệu quả do kích thước lớn. Tuy nhiên, do vai trò bệnh sinh của myoglobin trong AKI do tiêu cơ vân, các biện pháp dự phòng bằng cách loại bỏ myoglobin ngoài cơ thể đã được nghiên cứu. Mặc dù thay huyết tương được cho rằng không có hiệu quả về dự hậu hoặc giảm tải myoglobin trên thận,50 CVVHF hoặc HDF cho thấy có một số hiệu quả loại bỏ myoglobin, chủ yếu do việc dùng màng lọc super high-flux và thể tích siêu lọc lớn (cơ chế đối lưu).51 Tuy nhiên, bằng chứng chỉ dựa vào các báo cáo ca lâm sàng riêng lẻ và hiệu quả chưa được biết rõ. Hơn nữ, một số nghiên cứu cho thấy thời gian bán thải của myoglobin huyết thanh không khác nhau đáng kể giữa những bệnh nhân được điều trị bảo tồn và được CVVHDF. 27 UCho đến khi có các nghiên cứu ngẫu nhiên được thực hiện, hiện không khuyến cáo điều trị phòng ngừa bằng HF.
Dùng các chất chống oxy hóa và chất rửa trôi gốc tự do (vd, pentoxifylline, vitamine E và vitamin C) “có thể” hỗ trợ phòng ngừa AKI do myoglobin niệu,8,52 như gợi ý trong một số báo cáo hàng loạt ca, báo cáo ca lâm sàng hoặc nhiều nghiên cứu thực nghiệm về myoglobin niệu, nhưng chưa có các nghiên cứu có đối chứng đánh giá hiệu quả của các thuốc trên.
Supported by grants from Fondo Investigaciones Sanatarias (FIS 05/0015, to Dr. Poch; and FIS 04/0464, to Dr. Grau), Instituto de Salud Carlos III, Red Renal de Investigación Cooperativa (ISCIII-Retic-RD06, to Dr. Poch), Suport Grup de Recerca (05/300, to Dr. Grau), and the Center for Biomedical Research on Rare Diseases, Instituto de Salud Carlos III, Barcelona (to Dr. Grau). No potential conflict of interest relevant to this article was reported. We thank Assumpta Violan, M.D., for her invaluable technical assistance in preparing the original draft of Figure 2.
References
1. Tein I, DiMauro S, Rowland LP. Myoglobinuria. In: Rowland LP, DiMauro S, eds. Myopathies. Handbook of clinical neurology. Vol. 62. Amsterdam: Elsevier Science Publishers, 1992:553-93.
2. Warren JD, Blumbergs PC, Thompson PD. Rhabdomyolysis: a review. Muscle Nerve 2002;25:332-47.
3. Allison RC, Bedsole DL. The other medical causes of rhabdomyolysis. Am J Med Sci 2003;326:79-88.
4. Bagley WH, Yang H, Shah KH. Rhabdomyolysis. Intern Emerg Med 2007;2: 210-8.
5. Fernandez-Sola J, Grau JM, PedroBotet JC, et al. Nontraumatic rhabdomyolysis: a clinical and morphological analysis of 53 cases. Med Clin (Barc) 1988;90: 199-202. (In Spanish.)
6. Giannoglou GD, Chatzizisis YS, Misirli G. The syndrome of rhabdomyolysis: pathophysiology and diagnosis. Eur J Intern Med 2007;18:90-100.
7. Wrogemann K, Pena SD. Mitochondrial calcium overload: a general mechanism for cell-necrosis in muscle diseases. Lancet 1976;1:672-4.
8. Vanholder R, Sever MS, Erek E, Lameire N. Rhabdomyolysis. J Am Soc Nephrol 2000;11:1553-61.
9. Holt SG, Moore KP. Pathogenesis and treatment of renal dysfunction in rhabdomyolysis. Intensive Care Med 2001;27: 803-11.
10. Melli G, Chaudhry V, Cornblath DR. Rhabdomyolysis: an evaluation of 475 hospitalized patients. Medicine (Baltimore) 2005;84:377-85.
11. Ward MM. Factors predictive of acute renal failure in rhabdomyolysis. Arch Intern Med 1988;148:1553-7.
12. Veenstra J, Smit WM, Krediet RT, Arisz L. Relationship between elevated creatine phosphokinase and the clinical spectrum of rhabdomyolysis. Nephrol Dial Transplant 1994;9:637-41.
13. de Meijer AR, Fikkers BG, de Keijzer MH, van Engelen BG, Drenth JP. Serum creatine kinase as predictor of clinical course in rhabdomyolysis: a 5-year intensive care survey. Intensive Care Med 2003; 29:1121-5.
14. Woodrow G, Brownjohn AM, Turney JH. The clinical and biochemical features of acute renal failure due to rhabdomyolysis. Ren Fail 1995;17:467-74.
15. Knochel JP. Rhabdomyolysis and myoglobinuria. Annu Rev Med 1982;33:435-43.
16. Zager RA, Gamelin LM. Pathogenetic mechanisms in experimental hemoglobinuric acute renal failure. Am J Physiol 1989;256:F446-F455.
17. Zager RA. Studies of mechanisms and protective maneuvers in myoglobinuric acute renal injury. Lab Invest 1989;60:619- 29.
18. Zager RA, Foerder CA. Effects of inorganic iron and myoglobin on in vitro proximal tubular lipid peroxidation and cytotoxicity. J Clin Invest 1992;89:989- 95.
19. Reeder BJ, Wilson MT. Hemoglobin and myoglobin associated oxidative stress: from molecular mechanisms to disease states. Curr Med Chem 2005;12:2741-51.
20. Holt S, Reeder B, Wilson M, et al. Increased lipid peroxidation in patients with rhabdomyolysis. Lancet 1999;353:1241.
21. Bonventre JV, Weinberg JM. Recent advances in the pathophysiology of ischemic acute renal failure. J Am Soc Nephrol 2003;14:2199-210.
22. Gabow PA, Kaehny WD, Kelleher SP. The spectrum of rhabdomyolysis. Medicine (Baltimore) 1982;61:141-52.
23. Hatamizadeh P, Najafi I, Vanholder R, et al. Epidemiologic aspects of the Bam earthquake in Iran: the nephrologic perspective. Am J Kidney Dis 2006;47:428- 38.
24. Sieb JP, Penn AS. Myoglobinuria. In: Engel AG, Franzini-Armstrong C, eds. Myology. New York: McGraw-Hill, 2004: 1677-92.
25. Simerville JA, Maxted WC, Pahira JJ. Urinalysis: a comprehensive review. Am Fam Physician 2005;71:1153-62. [Erratum, Am Fam Physician 2006;74:1096.]
26. Wakabayashi Y, Kikuno T, Ohwada T, Kikawada R. Rapid fall in blood myoglobin in massive rhabdomyolysis and acute renal failure. Intensive Care Med 1994;20: 109-12.
27. Mikkelsen TS, Toft P. Prognostic value, kinetics and effect of CVVHDF on serum of the myoglobin and creatine kinase in critically ill patients with rhabdomyolysis. Acta Anaesthesiol Scand 2005;49:859-64.
28. Grossman RA, Hamilton RW, Morse BM, Penn AS, Goldberg M. Nontraumatic rhabdomyolysis and acute renal failure. N Engl J Med 1974;291:807-11.
29. Oh MS. Does serum creatinine rise faster in rhabdomyolysis? Nephron 1993; 63:255-7.
30. Corwin HL, Schreiber MJ, Fang LS. Low fractional excretion of sodium: occurrence with hemoglobinuric- and myoglobinuricinduced acute renal failure. Arch Intern Med 1984;144:981-2.
31. Better OS, Stein JH. Early management of shock and prophylaxis of acute renal failure in traumatic rhabdomyolysis. N Engl J Med 1990;322:825-9.
32. Akmal M, Bishop JE, Telfer N, Norman AW, Massry SG. Hypocalcemia and hypercalcemia in patients with rhabdomyolysis with and without acute renal failure. J Clin Endocrinol Metab 1986;63:137-42.
33. Sever MS, Vanholder R, Lameire N. Management of crush-related injuries after disasters. N Engl J Med 2006;354:1052- 63.
34. Shimazu T, Yoshioka T, Nakata Y, et al. Fluid resuscitation and systemic complications in crush syndrome: 14 HanshinAwaji earthquake patients. J Trauma 1997; 42:641-6.
35. Gunal AI, Celiker H, Dogukan A, et al. Early and vigorous fluid resuscitation prevents acute renal failure in the crush victims of catastrophic earthquakes. J Am Soc Nephrol 2004;15:1862-7.
36. Homsi E, Barreiro MF, Orlando JM, Higa EM. Prophylaxis of acute renal failure in patients with rhabdomyolysis. Ren Fail 1997;19:283-8.
37. Brown CV, Rhee P, Chan L, Evans K, Demetriades D, Velmahos GC. Preventing renal failure in patients with rhabdomyolysis: do bicarbonate and mannitol make a difference? J Trauma 2004;56:1191-6.
38. Cho YS, Lim H, Kim SH. Comparison of lactated Ringer’s solution and 0.9% saline in the treatment of rhabdomyolysis induced by doxylamine intoxication. Emerg Med J 2007;24:276-80.
39. Ron D, Taitelman U, Michaelson M, Bar-Joseph G, Bursztein S, Better OS. Prevention of acute renal failure in traumatic rhabdomyolysis. Arch Intern Med 1984; 144:277-80.
40. Richards JR. Rhabdomyolysis and drugs of abuse. J Emerg Med 2000;19: 51-6.
41. Moore KP, Holt SG, Patel RP, et al. A causative role for redox cycling of myoglobin and its inhibition by alkalinization in the pathogenesis and treatment of rhabdomyolysis-induced renal failure. J Biol Chem 1998;273:31731-7.
42. Heyman SN, Greenbaum R, Shina A, Rosen S, Brezis M. Myoglobinuric acute renal failure in the rat: a role for acidosis? Exp Nephrol 1997;5:210-6.
43. Ho AM, Karmakar MK, Contardi LH, Ng SS, Hewson JR. Excessive use of normal saline in managing traumatized patients in shock: a preventable contributor to acidosis. J Trauma 2001;51:173-7.
44. Zager RA, Foerder C, Bredl C. The influence of mannitol on myoglobinuric acute renal failure: functional, biochemi cal, and morphological assessments. J Am Soc Nephrol 1991;2:848-55.
45. Better OS, Rubinstein I, Winaver JM, Knochel JP. Mannitol therapy revisited (1940-1997). Kidney Int 1997;52:886-94.
46. Visweswaran P, Massin EK, Dubose TD Jr. Mannitol-induced acute renal failure. J Am Soc Nephrol 1997;8:1028-33.
47. Lameire N, Van Biesen W, Vanholder R. Acute renal failure. Lancet 2005;365:417- 30.
48. Kellum JA. The use of diuretics and dopamine in acute renal failure: a systematic review of the evidence. Crit Care 1997; 1:53-9.
49. Evans KJ, Greenberg A. Hyperkalemia: a review. J Intensive Care Med 2005;20: 272-90.
50. Szpirt WM. Plasmapheresis is not justified in treatment of rhabdomyolysis and acute renal failure. J Cardiovasc Surg (Torino) 1997;38:557.
51. Ronco C. Extracorporeal therapies in acute rhabdomyolysis and myoglobin clearance. Crit Care 2005;9:141-2.
52. Huerta-Alardin AL, Varon J, Marik PE. Bench-to-bedside review: rhabdomyolysis — an overview for clinicians. Crit Care 2005;9:158-69. Copyright © 2009 Massachusetts Medical Society
Xem thêm:
Những tranh cãi về liệu pháp điều trị ngoài cơ thể không do thận trên bệnh nhân COVID-19 nguy kịch.
Corticosteroid và Covid 19: Những vấn đề cốt lõi