Bệnh hô hấp
Nhồi máu phổi: Các vấn đề trên lâm sàng, chẩn đoán và điều trị
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Để tải về bài viết NHỒI MÁU PHỔI, mời bạn click vào link ở đây
Bản Dịch Của Bác Sĩ Diệp Thanh Bình
Một người đàn ông 41 tuổi đến khoa cấp cứu với bệnh sử khó thở kéo dài 3 tuần. Gần đây bệnh nhân đã hoàn thành một đợt điều trị bằng thuốc kháng sinh cho bệnh viêm phổi được chẩn đoán. Vào ngày nhập viện, anh ta thức dậy với cơn đau âm ỉ ở phía bên lưng phải. Tiền sử bệnh tật của anh ta không có gì nổi bật. Nhịp tim của anh ấy là 88 nhịp / phút, huyết áp 149/86 mmHg, nhịp thở 18 lần / phút, nhiệt độ 37 ° C và độ bão hòa oxy 95% khi anh ấy đang hít thở khí trời. Nghe ngực thấy tiến tim và tiếng thở bình thường. Khám chân bình thường. Mức độ creatinin và troponin của anh ấy ở trong giới hạn bình thường, và phim chụp X quang phổi là bình thường. Nhận định ngầm của bác sĩ là khả năng thuyên tắc phổi lớn hơn 15%. Điểm Wells của bệnh nhân là 0 (trên thang điểm từ 0 đến 12,5, với điểm số cao hơn cho thấy xác suất thuyên tắc phổi cao hơn) và mức D-dimer là 2560 ng trên mililit. Bạn đánh giá bệnh nhân này như thế nào về thuyên tắc phổi, và bạn sẽ xử trí trường hợp này như thế nào?
VẤN ĐỀ TRÊN LÂM SÀNG
Thuyên tắc phổi xảy ra khi huyết khối tĩnh mạch thuyên tắc bị mắc lại trong phân nhánh mạch máu phổi. Những huyết khối này thường phát triển trong tĩnh mạch chân hoặc vùng chậu, và khoảng một nửa số huyết khối tĩnh mạch sâu sẽ thuyên tắc đến phổi. Tỷ lệ thuyên tắc phổi hàng năm trên toàn thế giới là khoảng 1 trên 1000 người. Mặc dù vậy, gần 20% bệnh nhân được điều trị thuyên tắc phổi đã tử vong trong vòng 90 ngày, nhưng thuyên tắc phổi thường không phải là nguyên nhân gây tử vong vì nó thường xảy ra cùng với các tình trạng nặng khác, chẳng hạn như ung thư, nhiễm trùng huyết hoặc bệnh dẫn đến nhập viện, hoặc với các bệnh cảnh khác, chẳng hạn như phẫu thuật. Tỷ lệ tử vong thực sự liên quan đến thuyên tắc mạch không được chẩn đoán được ước tính là dưới 5%, nhưng sự hồi phục sau thuyên tắc phổi có liên quan đến các biến chứng như chảy máu do điều trị chống đông máu, huyết khối tĩnh mạch tái phát, tăng huyết áp động mạch phổi mãn tính do huyết khối và suy nhược tâm lý kéo dài. Khoảng một nửa số bệnh nhân được chẩn đoán thuyên tắc phổi có những hạn chế về chức năng và vận động 1 năm sau đó (được gọi là hội chứng sau thuyên tắc phổi), và chất lượng cuộc sống liên quan đến sức khỏe của những bệnh nhân có tiền sử thuyên tắc phổi bị giảm so với so sánh với nhóm đối chứng. Do đó, chẩn đoán kịp thời và xử trí chuyên nghiệp về thuyên tắc phổi là quan trọng.
| ĐIỂM CHÍNH LÂM SÀNG |
| NHỒI MÁU PHỔI
• Thuyên tắc phổi là một chẩn đoán phổ biến và có thể liên quan đến huyết khối tĩnh mạch tái phát, chảy máu do điều trị chống đông máu, tăng áp động mạch phổi do huyết khối tắc mạch phổi mãn tính và suy nhược thần kinh lâu dài. • Một số ít bệnh nhân được đánh giá có khả năng bị thuyên tắc phổi có thể được hỗ trợ từ chẩn đoán hình ảnh ngực (ví dụ, chụp cắt lớp vi tính). • Điều trị ban đầu được hướng dẫn bằng cách phân loại thuyên tắc phổi là nguy cơ cao, nguy cơ trung bình hoặc nguy cơ thấp. Hầu hết bệnh nhân bị thuyên tắc phổi nguy cơ thấp và việc chăm sóc của họ có thể được quản lý tại nhà bằng thuốc chống đông máu đường uống trực tiếp. • Bệnh nhân thuyên tắc phổi cấp nên được điều trị chống đông máu trong ít nhất 3 tháng. Quyết định tiếp tục điều trị vô thời hạn phụ thuộc vào việc giảm nguy cơ thuyên tắc huyết khối tĩnh mạch tái phát liên quan có lớn hơn nguy cơ chảy máu tăng lên hay không và cần tính đến sự tham vấn với bệnh nhân. • Bệnh nhân nên được theo dõi liên tục sau đợt thuyên tắc phổi cấp tính để đánh giá tình trạng khó thở hoặc hạn chế chức năng, có thể cho thấy sự phát triển của hội chứng sau thuyên tắc phổi hoặc tăng huyết áp động mạch phổi do huyết khối tắc mạch mãn tính. |
CHIẾN LƯỢC VÀ BẰNG CHỨNG
Cận lâm sàng chẩn đoán nhồi máu phổi
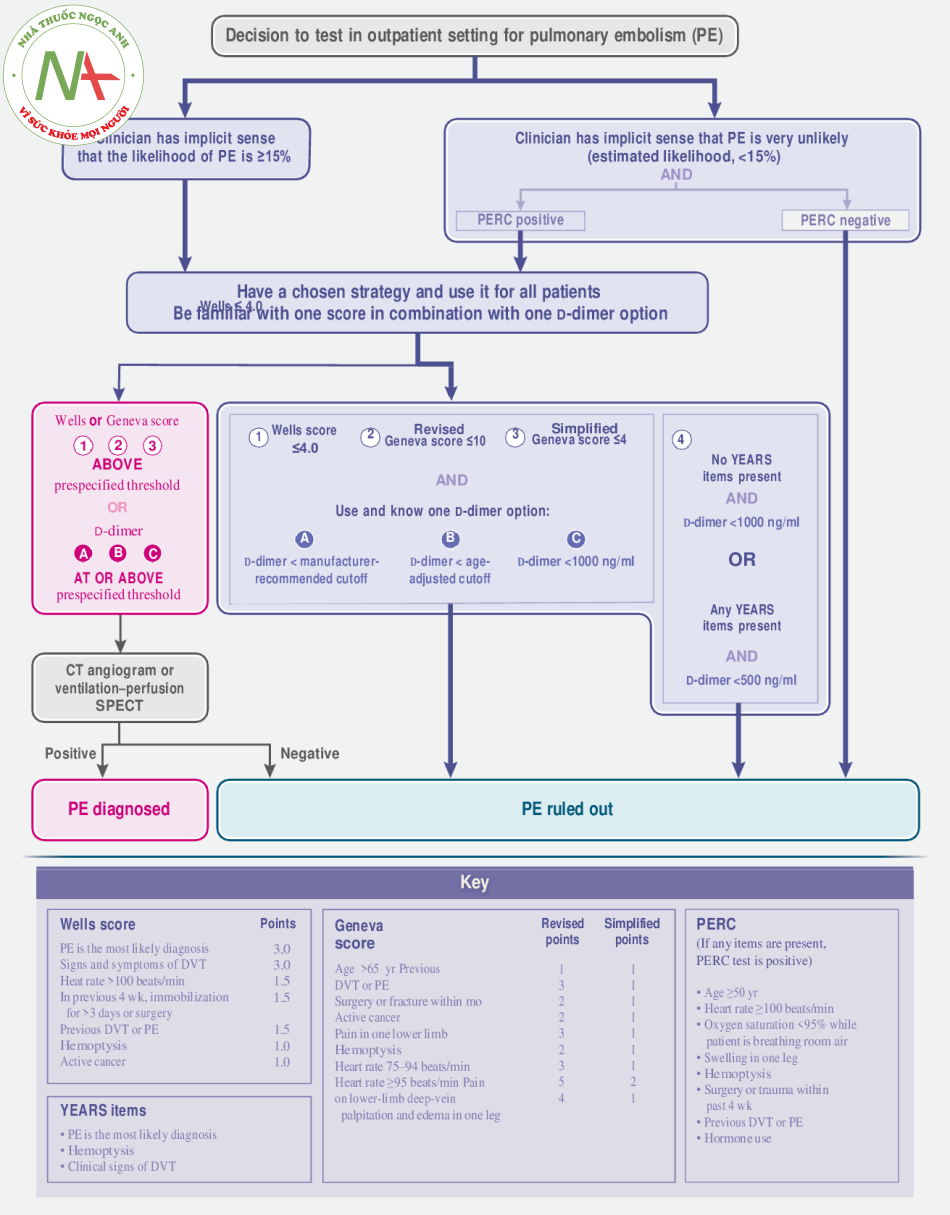
Có lẽ khía cạnh thách thức nhất của CLS thuyên tắc phổi là biết khi nào cần làm. Các triệu chứng phổ biến của thuyên tắc phổi là mệt mỏi, khó thở, đau ngực, chóng mặt, ho, vã mồ hôi, sốt và ho ra máu. Một phân tích tổng hợp các nghiên cứu thuần tập cho thấy tiền sử khó thở, bất động, phẫu thuật gần đây, ung thư đang hoạt động, ho ra máu, huyết khối tĩnh mạch trước đó hoặc ngất có liên quan đến tăng khả năng thuyên tắc phổi. Xét nghiệm thuyên tắc phổi cũng nên được xem xét nếu bệnh nhân dường như không đáp ứng với điều trị đối với một tình trạng hô hấp được chẩn đoán khác, bởi vì chẩn đoán sai ban đầu thường xảy ra.
Ở Bắc Mỹ, cứ 20 bệnh nhân thì chỉ có 1 bệnh nhân được chẩn đoán xác định sự hiện diện của thuyên tắc phổi khi họ đến khoa cấp cứu. Tỷ lệ lưu hành này đã duy trì ổn định trong hai thập kỷ và thấp hơn bốn lần so với tỷ lệ được báo cáo ở các bệnh nhân ở Châu Âu. Các hướng dẫn đã được ban hành không quy định bệnh nhân nào nên làm xét nghiệm về sự hiện diện của thuyên tắc phổi. Nghiên cứu định tính cho thấy rằng các tiêu chuẩn của bác sĩ và y tế địa phương là những động lực chính trong quyết định xét nghiệm thuyên tắc phổi. Các xét nghiệm không xâm lấn để loại trừ chẩn đoán dựa trên đánh giá lâm sàng của thuyên tắc phổi là cực kỳ hiệu quả trong việc giảm sử dụng chụp cắt lớp vi tính (CT) một cách an toàn, kết quả là chỉ có 30 đến 40% bệnh nhân nghi ngờ thuyên tắc phổi sau đó được chẩn đoán hình ảnh.
Trong trường hợp các bác sĩ có ý thức ngầm rằng bệnh nhân của họ rất không giống bị thuyên tắc phổi (khả năng ước tính,<15%), các nghiên cứu thuần tập lớn đã chỉ ra rằng quy tắc Tiêu chí loại trừ thuyên tắc phổi (PERC) có thể loại trừ thuyên tắc phổi một cách an toàn mà không cần chẩn đoán thêm hình ảnh. Tuy nhiên, trên thực tế, ước tính ngầm thường đánh giá quá cao xác suất thuyên tắc phổi, điều này có thể hạn chế việc sử dụng quy tắc PERC. Các bác sĩ nên làm quen với quy tắc quyết định đã được xác thực để hướng dẫn sử dụng xét nghiệm D-dimer. Trong số những bệnh nhân có điểm xác suất lâm sàng cấu trúc thấp – điểm Wells từ 4.0 trở xuống (được tìm thấy ở 80% bệnh nhân được kiểm tra ở Bắc Mỹ16), điểm Geneva đã sửa đổi là 10 hoặc thấp hơn (trên thang điểm từ 0 đến 22, với cao hơn điểm cho thấy xác suất thuyên tắc phổi cao hơn) và điểm Geneva đơn giản là 4 trở xuống (trên thang điểm từ 0 đến 9, với điểm cao hơn cho thấy xác suất thuyên tắc phổi cao hơn) – thuyên tắc phổi có thể được loại trừ một cách an toàn trên cơ sở của các mức D-dimer khi sử dụng các ngưỡng giới hạn do nhà sản xuất khuyến nghị (độ nhạy, 98 đến 99%; độ đặc hiệu, 37 đến 40%). Các chi tiết bổ sung về hệ thống tính điểm và việc sử dụng chúng được cung cấp trong Hình 1. Dữ liệu cũ hơn từ một xét nghiệm D-dimer khác cho rằng mức D-dimer dưới 500 ng trên mililit có thể được sử dụng để loại trừ thuyên tắc phổi mà không cần xem xét đến lâm sàng các yếu tố rủi ro, nhưng cần thêm dữ liệu để xác nhận tính hữu ích của phương pháp này với các thử nghiệm hiện tại và so với các chiến lược được đề xuất hiện nay. Độ chính xác chẩn đoán của xét nghiệm D-dimer ở bệnh nhân mắc bệnh coronavirus 2019 (Covid19) vẫn không thay đổi.
Các phương pháp tiếp cận mới hơn đã điều chỉnh ngưỡng D-dimer để loại trừ thuyên tắc phổi và được xác nhận cho các xét nghiệm D-dimer mà ngưỡng giới hạn do nhà sản xuất khuyến nghị là tương đương 500 ng/ml. Các chiến lược này bao gồm nồng độ D-dimer được điều chỉnh theo tuổi (độ nhạy được báo cáo đối với phương pháp điều chỉnh theo tuổi nằm trong khoảng từ 97 đến 99% và độ đặc hiệu từ 42 đến 47%) hoặc được điều chỉnh theo thuật toán YEARS để loại trừ thuyên tắc phổi (độ nhạy, 96 đến 98%; độ đặc hiệu, 54 đến 61%) hoặc điểm Wells (độ nhạy, 93 đến 97%; độ đặc hiệu, 61 đến 67%). Thiếu các thử nghiệm ngẫu nhiên so sánh các chiến lược D-dimer khác nhau ở bệnh nhân thuyên tắc phổi.
Chẩn đoán hình ảnh được dành riêng cho những bệnh nhân không thể loại trừ thuyên tắc phổi trên cơ sở quy tắc ra quyết định, do những tác hại tiềm tàng của việc tiếp xúc với bức xạ. Chụp CT mạch máu phổi thường là kỹ thuật hình ảnh kịp thời và dễ tiếp cận nhất; tuy nhiên, để giảm thiểu chiếu xạ phổi và mô vú ở những bệnh nhân trẻ tuổi, CT phát xạ photon đơn tưới máu (SPECT) là một lựa chọn bức xạ thấp. Tỷ lệ dương tính giả khi sàng lọc bằng Ctcan thay đổi giữa các nhà cung cấp và có thể cao tới 5%. Trong vòng 3 tháng sau khi có kết quả bình thường trên CT đã được thực hiện vì nghi ngờ thuyên tắc phổi, 1,2% bệnh nhân được chẩn đoán huyết khối tĩnh mạch. Ngược lại, hiệu quả chẩn đoán của SPECT thông khí – tưới máu vẫn chưa được thiết lập tốt.
Nhiều bệnh nhân nhập viện vì tình trạng không liên quan cũng được xét nghiệm thuyên tắc phổi; có ít bằng chứng hướng dẫn sử dụng D-dimer ở những bệnh nhân này. Mặc dù nồng độ D-dimer vẫn có thể nhạy cảm cao đối với những bệnh nhân đang nằm viện xét nghiệm, chúng ít hữu ích hơn trong việc loại trừ thuyên tắc phổi vì nồng độ thường tăng cao trong thời gian bị bệnh và sau khi phẫu thuật
ĐIỀU TRỊ
Quản lý ban đầu
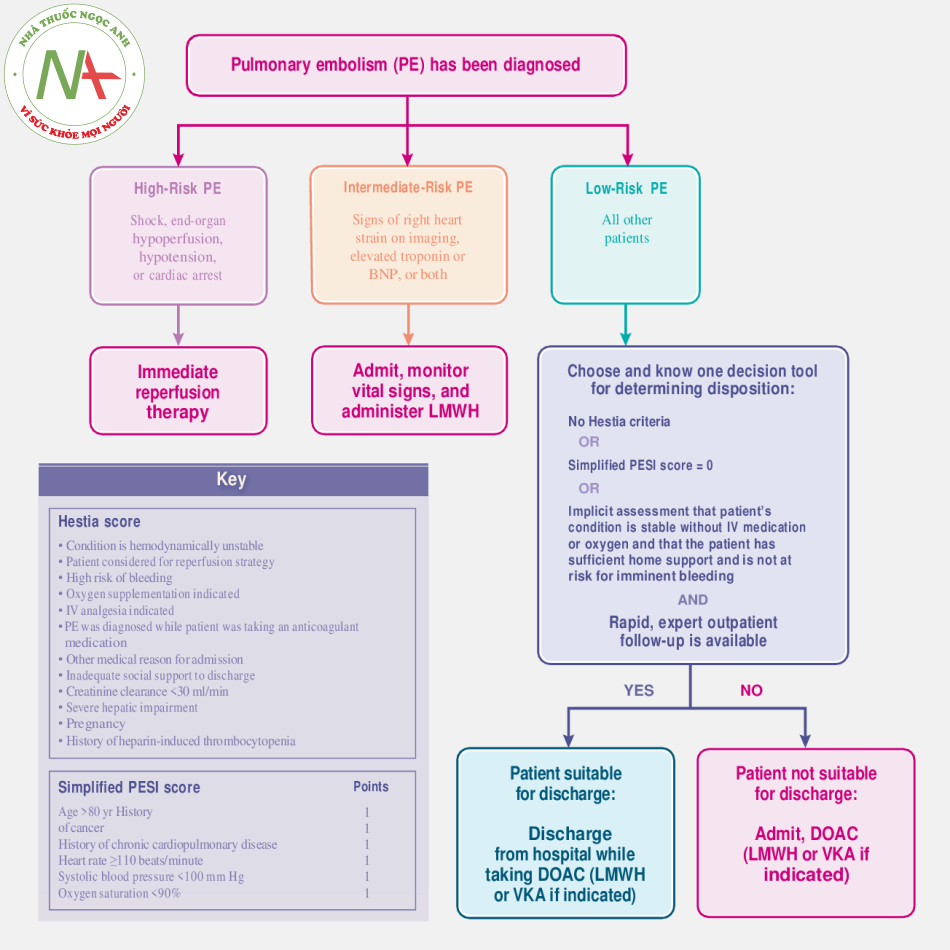
Điều trị ban đầu của thuyên tắc phổi được hướng dẫn bởi sự phân tầng nguy cơ của thuyên tắc phổi thành nguy cơ cao, trung bình hoặc thấp trên cơ sở biểu hiện lâm sàng của bệnh nhân (Hình 2). Danh pháp “khối lớn massive” và “khối nhỏ submassive” trong mô tả thuyên tắc phổi là khó hiểu, vì kích thước cục máu đông không quyết định liệu pháp điều trị.
Nguy cơ cao
Khoảng 5% bệnh nhân bị thuyên tắc phổi có nguy cơ cao, liên quan đến sốc, giảm tưới máu cơ quan đích, hạ huyết áp (huyết áp tâm thu <90 mm Hg hoặc giảm huyết áp tâm thu> 40 mm Hg mà không phải do nhiễm trùng huyết, rối loạn nhịp tim, hoặc giảm thể tích tuần hoàn), hoặc ngừng tim. Dữ liệu quan sát hỗ trợ việc đánh giá bệnh nhân thuyên tắc phổi nguy cơ cao để điều trị tái tưới máu ngay lập tức bằng cách loại trừ các trường hợp chống chỉ định (ví dụ: di căn não, rối loạn chảy máu và phẫu thuật gần đây). Tiêu huyết khối toàn thân qua đường tĩnh mạch là lựa chọn sẵn có nhất để tái tưới máu, và các phác đồ bao gồm một liều tenecteplase dựa trên cân nặng, alteplase với liều 0,6 mg cho mỗi kg trọng lượng cơ thể, hoặc alteplase với liều 100 mg dùng trong khoảng thời gian 1 đến 2 giờ. Không có đủ bằng chứng để hỗ trợ một trong những tác nhân này hơn tác nhân kia; tuy nhiên, tenecteplase có thể được sử dụng như một liều bolus trong trường hợp khẩn cấp và liều lượng dựa trên cân nặng có thể thích hợp hơn ở bệnh nhân cao tuổi hoặc bệnh nhân có trọng lượng cơ thể thấp. Các phương pháp tái tưới máu thay thế bao gồm phẫu thuật lấy huyết khối và tiêu huyết khối trực tiếp dưới hướng dẫn cathete (có hoặc không lấy huyết khối). Các biện pháp hỗ trợ bổ sung bao gồm sử dụng thuốc trợ tim và sử dụng các biện pháp hỗ trợ sự sống ngoài cơ thể ECMO.
Nguy cơ trung bình
Bệnh nhân có bằng chứng siêu âm tim hoặc CT về dãn thất phải, các men tim tăng cao (như troponin hoặc BNP), hoặc cả hai được coi là có nguy cơ trung bình thuyên tắc phổi. Tiêu huyết khối toàn thân thường không được khuyến cáo cho những bệnh nhân này; trong một thử nghiệm ngẫu nhiên có đối chứng đánh giá việc bổ sung tenecteplase đến heparin, điều trị bằng tenecteplase làm giảm tuyệt đối nguy cơ mất bù huyết động 3 điểm phần trăm, với tăng 9 điểm phần trăm nguy cơ mắc chảy máu nặng (và tăng 2 điểm phần trăm nguy cơ đột quỵ do xuất huyết).
Thay vào đó, bệnh nhân thuyên tắc phổi nguy cơ trung bình nên được điều trị chống đông máu và được theo dõi chặt chẽ để xác định vì 1 trong 20 bệnh nhân có thể bị sốc sau đó (tại thời điểm đó có thể thực hiện liệu pháp tái tưới máu). Không có hướng dẫn nào về thời gian cửa-kim để điều trị thuyên tắc phổi giống như những hướng dẫn hiện có trong điều trị nhồi máu cơ tim và đột quỵ.
Trên cơ sở ý kiến chuyên gia, heparin trọng lượng phân tử thấp là thuốc chống đông tức thời được ưu tiên cho bệnh nhân thuyên tắc phổi nguy cơ trung bình. Hiệu quả điều trị của việc điều trị ngay lập tức bằng thuốc chống đông đường uống trực tiếp rivaroxaban và apixaban so với heparin trọng lượng phân tử thấp chưa được nghiên cứu ở những bệnh nhân có nguy cơ trung bình thuyên tắc phổi và heparin không phân đoạn gây chảy máu quá mức. Khi có sẵn, tiêu huyết khối trực tiếp qua cathete vẫn là một lựa chọn cho những bệnh nhân có nguy cơ trung bình bị thuyên tắc phổi đoạn gần, trung tâm; tuy nhiên, không có đủ bằng chứng để hỗ trợ dùng tiêu huyết khối trực tiếp qua cathete hơn là heparin trọng lượng phân tử thấp ở những bệnh nhân này.
Nguy cơ thấp
Bệnh nhân thuyên tắc phổi có tình trạng huyết động ổn định và không có dãn thất phải và men tim bình thường được coi là có nguy cơ thuyên tắc phổi thấp. Hầu hết những bệnh nhân này có thể được điều trị bằng thuốc chống đông máu đường uống trực tiếp (trên cơ sở dữ liệu thử nghiệm chất lượng cao) và được đánh giá để điều trị ngoại trú. Quyết định cho bệnh nhân được điều trị tại nhà có thể được hướng dẫn bởi điểm số trong Chỉ số mức độ nghiêm trọng của thuyên tắc phổi đơn giản (PESI) hoặc điểm Hestia (Hình 2). Trái ngược với điểm Hestia (một danh sách các tiêu chí loại trừ điều trị tại nhà), điểm trên PESI đơn giản dự đoán nguy cơ tử vong hơn là các biến chứng không tử vong và không tính đến các biến quan trọng như sự sẵn sàng hỗ trợ cho bệnh nhân tại nhà. Kết quả của một thử nghiệm ngẫu nhiên, có đối chứng cho thấy nguy cơ thấp xảy ra các biến cố ngoại ý ở những bệnh nhân không có tiêu chí Hestia hoặc bị điểm 0 trên PESI đơn giản, những người được điều trị như bệnh nhân ngoại trú.
Quản lý tiếp theo
Thuốc chống đông máu đường uống trực tiếp là phương pháp điều trị đầu tay cho hầu hết bệnh nhân. Các thử nghiệm ngẫu nhiên đã chỉ ra rằng thuốc chống đông máu đường uống trực tiếp, không cần theo dõi, có hiệu quả làm giảm nguy cơ tái phát huyết khối tĩnh mạch như thuốc đối kháng vitamin K và làm giảm nguy cơ chảy máu lớn. Do thiếu so sánh giữa các thuốc chống đông máu đường uống trực tiếp, nên việc lựa chọn thuốc được hướng dẫn bởi các đặc tính dược lý, đặc điểm và sở thích của bệnh nhân (ví dụ, các thuốc tương tác đồng thời và sự ưa thích của bệnh nhân đối với thuốc một lần hoặc hai lần mỗi ngày). Ở bệnh nhân ung thư, các thử nghiệm ủng hộ tính an toàn và hiệu quả của thuốc chống đông máu đường uống trực tiếp apixaban, edoxaban và rivaroxaban như là những lựa chọn thay thế cho việc điều trị bằng heparin trọng lượng phân tử thấp.
Thuốc đối kháng vitamin K được ưu tiên hơn thuốc chống đông đường uống trực tiếp ở những bệnh nhân mắc bệnh thận hoặc gan tiến triển và ở những bệnh nhân có hội chứng kháng phospholipid với ba dương tính (tức là dương tính với thuốc chống đông máu lupus, kháng cardiolipin và kháng thể kháng β2-glycoprotein I), có hiệu giá kháng thể cao, hoặc có tiền sử huyết khối động mạch.
| Table 1. Anticoagulant Treatment Regimens for Pulmonary Embolism.* | ||
| Initial Phase of Anticoagulation | Short-Term Phase of Anticoagulation (3–6 mo) | Indefinite Phase of Anticoagulation (after 3–6 mo) |
| Apixaban, administered orally, 10 mg twice aday for 7 days | Apixaban, administered orally, 5 mg twicea day | Apixaban, administered orally, 5 mg twice aday or 2.5 mg twice a day† |
| Rivaroxaban, administered orally, 15 mg twice 21 days | Rivaroxaban, administered orally, 20 mga day for once a day | Rivaroxaban, administered orally, 20 mgonce a day or 10 mg once a day† |
| Low-molecular-weight heparin‡ | ||
| Administered subcutaneously for a minimum of 5 days§ | Dabigatran, administered orally, 150 mg twice a day | Dabigatran, administered orally, 150 mgtwice a day |
| Administered subcutaneously for a minimum of 5 days§ | Edoxaban, administered orally, 60 mg once day¶ | Edoxaban, administered orally, 60 mg oncea a day¶ |
| Administered subcutaneously for a minimum of 5 days,§ plus vitamin K an- tagonist, administered orally, with INR ≥2 for 2 days | Vitamin K antagonist, administered orally, with target INR of 2 to 3 | Vitamin K antagonist, administered orally, with target INR of 2 to 3 |
* Direct oral anticoagulants and low-molecular-weight heparin are contraindicated in patients with severe renal impairment. Dosing of these medications in patients with renal impairment differs with the specific agent and among jurisdictions. With regard to use of direct oral an- ticoagulants in patients with obesity, post hoc analyses of phase 3 trials, observational data, and pharmacokinetic and pharmacodynamic data suggest that direct oral anticoagulants and vitamin K antagonists have similar effectiveness and safety in patients with body weight upto 120 kg or a body-mass index (BMI; the weight in kilograms divided by the square of the height in meters) of up to 40. For patients who weigh more than 120 kg or have a BMI higher than 40, standard doses of rivaroxaban or apixaban are among appropriate anticoagulant op-tions; fewer supportive data exist for apixaban than for rivaroxaban. Other options include vitamin K antagonists, weight-based low-molecu-lar-weight heparin (administered according to manufacturer recommendations), and fondaparinux.52 INR denotes international normalized ratio.
† A reduction in dose may be considered after 3 to 6 months of therapy.
‡ Low-molecular-weight heparin may be administered subcutaneously throughout initial, short-term, and indefinite phases of treatment, withdosage according to body weight.
- Low-molecular-weight heparin should be administered for 5 to 10 days before the initiation of dabigatran or edoxaban and concurrent toinitiating vitamin K antagonists.
¶Edoxaban should be administered at a dose of 30 mg daily if the creatinine clearance is 15 to 50 ml per minute, if the patie nt’s body weightis less than 60 kg, or if potent P-glycoprotein inhibitors are being used.
Heparin trọng lượng phân tử thấp nên được sử dụng để điều trị cho phụ nữ có thai bị thuyên tắc phổi, vì thuốc đối kháng vitamin K và thuốc chống đông máu đường uống trực tiếp đi qua nhau thai và có liên quan đến kết cục thai nghén bất lợi.
Thời gian điều trị
Bệnh nhân bị thuyên tắc phổi cấp tính nên được điều trị chống đông máu trong ít nhất 3 tháng để giảm nguy cơ thuyên tắc thêm, lan rộng huyết khối, tái phát sớm huyết khối tĩnh mạch và tử vong (Bảng 1) . Việc điều trị ngừng sau 3 tháng hay tiếp tục vô thời hạn tùy thuộc về việc giảm nguy cơ tái phát huyết khối tĩnh mạch khi tiếp tục điều trị chống đông có lớn hơn nguy cơ chảy máu tăng lên hay không, và quyết định nên tính đến sự đồng ý của bệnh nhân.
Trong số những bệnh nhân bị thuyên tắc phổi bị thúc đẩy bởi một yếu tố nguy cơ lớn nhất thời (tức là có thể hồi phục) (ví dụ, phẫu thuật với gây mê toàn thân kéo dài> 30 phút, nằm tại giường trong bệnh viện ≥3 ngày do bệnh cấp tính hoặc chấn thương nặng hoặc gãy xương), nguy cơ tái phát huyết khối tĩnh mạch lâu dài là thấp và có thể ngừng điều trị chống đông máu sau 3 tháng. Nếu tắc mạch phổi rất lớn hoặc có liên quan đến rối loạn chức năng trung bình của tâm thất phải hoặc nếu bệnh nhân có các triệu chứng tồn lưu dai dẳng, một số chuyên gia khuyến cáo nên điều trị kéo dài đến 6 tháng.
Ở những bệnh nhân có các yếu tố thúc đẩy dai dẳng như ung thư đang hoạt động hoặc hội chứng kháng phospholipid hoặc những người đã có các đợt huyết khối tĩnh mạch vô căn trước đó, nguy cơ tái phát lâu dài là cao và khuyến cáo điều trị kháng đông vô thời hạn. Việc ra quyết định có nhiều sắc thái hơn ở những bệnh nhân bị thuyên tắc phổi lần đầu không vô căn hoặc bị yếu tố thúc đẩy yếu (tức là liên quan đến một yếu tố nguy cơ thoáng qua nhỏ, chẳng hạn như liệu pháp estrogen, mang thai, tiểu phẫu hoặc chấn thương nhẹ ở chân). Trong số những bệnh nhân này, nguy cơ tái phát huyết khối tĩnh mạch và thuyên tắc phổi gây tử vong sau khi ngừng điều trị chống đông lần lượt là 10% và 0,4% sau 1 năm, 36% và 1,5% sau 10 năm; rủi ro ở nam giới cao hơn ở nữ giới. Các thử nghiệm đã chỉ ra rằng liệu pháp chống đông kéo dài, so với thời gian dùng kháng đông ngắn hơn, có hiệu quả cao trong việc ngăn ngừa tái phát huyết khối tĩnh mạch. Tuy nhiên, trong một phân tích tổng hợp (bao gồm 14 thử nghiệm ngẫu nhiên, có đối chứng và 13 nghiên cứu thuần tập), chống đông kéo dài với thuốc chống đông uống trực tiếp có liên quan đến nguy cơ biến cố chảy máu nặng 1,12 trên 100 người-năm (trường hợp tử vong, 9,7%), và kéo dài thời gian chống đông máu bằng thuốc đối kháng vitamin K có nguy cơ gây ra biến cố chảy máu nặng 1,74 trên 100 người-năm (theo trường hợp tử vong, 8,3%). Nguy cơ chảy máu cao hơn ở những bệnh nhân lớn tuổi và ở những bệnh nhân có độ thanh thải creatinin dưới 50 ml/phút, có tiền sử chảy máu, đã được điều trị chống kết tập tiểu cầu trước đó, hoặc có mức hemoglobin dưới 10 g/dl
Mặc dù điều trị vô thời hạn bằng thuốc chống đông máu thường được khuyến cáo sau sự kiện thuyên tắc huyết khối tĩnh mạch không rõ nguyên nhân đầu tiên hoặc sau yếu tố khởi phát yếu, đặc biệt ở những bệnh nhân không có nguy cơ chảy máu cao, điều trị có giới hạn thời gian có thể thích hợp ở một số bệnh nhân, bao gồm cả những người có nguy cơ ước tính tái phát huyết khối tĩnh mạch dưới 5% trong vòng năm đầu tiên sau khi ngừng điều trị chống đông máu. Việc đưa ra quyết định liên quan đến điều trị huyết khối tĩnh mạch ở phụ nữ có thể được hướng dẫn bởi quy tắc HERDOO2, một điểm số dự đoán có giá trị tiền cứu xác định một số phụ nữ có biến cố thuyên tắc huyết khối tĩnh mạch vô căn đầu tiên hoặc do yếu tố khởi phát yếu mà họ có thể ngừng điều trị chống đông máu một cách an toàn (Bảng S1 trong Phụ lục bổ sung, có toàn văn của bài báo này tại NEJM.org).
Hiện không có điểm xác thực nào được sử dụng cho nam giới bị thuyên tắc phổi vô cớ lần đầu hoặc do yếu tố khởi phát yếu, và nhiều chuyên gia khuyên bạn nên tiếp tục điều trị chống đông máu vô thời hạn ở những bệnh nhân này.
Ở những bệnh nhân tiếp tục dùng thuốc chống đông vô thời hạn, dữ liệu từ các thử nghiệm ngẫu nhiên chỉ ra rằng phác đồ điều trị chống đông đường uống trực tiếp liều thấp (tức là rivaroxaban hoặc apixaban) sau 6 tháng đầu dùng kháng đông liều đầy đủ có hiệu quả và độ an toàn tương tự như phác đồ dùng đủ liều và hiệu quả cao hơn aspirin. Tuy nhiên, phác đồ liều thấp chưa được đánh giá trong thuyên tắc phổi ở bệnh nhân ung thư, ở những người bị thuyên tắc phổi về mặt giải phẫu, hoặc ở những người có nguy cơ cao bị thuyên tắc phổi tái phát. Các yếu tố có thể ảnh hưởng đến việc lựa chọn phác đồ chống đông không thời hạn được trình bày trong Bảng S2.
XÉT NGHIỆM KHÁC
Ung thư ẩn giấu được phát hiện ở 5,2% bệnh nhân trong vòng 1 năm sau khi được chẩn đoán thuyên tắc phổi vô căn. Một chiến lược sàng lọc mở rộng có thể phát hiện nhiều ung thư hơn so với sàng lọc hạn chế, nhưng dữ liệu còn hạn chế về việc liệu việc sàng lọc đó có liên quan đến kết cục tốt hơn của bệnh nhân hay không. Các chuyên gia khuyến nghị tầm soát ung thư hạn chế được hướng dẫn bởi tiền sử bệnh, khám sức khỏe, các xét nghiệm cơ bản và chụp X quang phổi, và tầm soát ung thư cụ thể theo tuổi và giới tính.
Bệnh nhân nên được đánh giá từ 3 đến 6 tháng sau khi bệnh thuyên tắc phổi cấp được chẩn đoán để đánh giá tình trạng khó thở hoặc hạn chế chức năng, có thể cho thấy sự phát triển của hội chứng sau thuyên tắc phổi hoặc tăng áp động mạch phổi mãn tính do huyết khối tắc mạch. Nếu quyết định tiếp tục chống đông vô thời hạn được đưa ra tại thời điểm chẩn đoán thuyên tắc phổi, quyết định này nên được đánh giá lại hàng năm hoặc thường xuyên hơn; Có thể phải ngừng thuốc kháng đông nếu nguy cơ chảy máu tăng lên, xảy ra biến cố chảy máu lớn hoặc bệnh nhân muốn ngừng điều trị.
CÁC HƯỚNG DẪN
Các hướng dẫn hiện tại về quản lý thuyên tắc phổi bao gồm các hướng dẫn do Đại học Bác sĩ lồng ngực Hoa Kỳ (ACCP), Hiệp hội Huyết học Hoa Kỳ (ASH) và Hiệp hội Tim mạch Châu Âu (ESC) ban hành. Tóm tắt các khuyến nghị chính trong các nguyên tắc này được cung cấp trong Bảng 2.
Các đề xuất của chúng tôi phù hợp với các nguyên tắc này, phần lớn là phù hợp nhưng khác nhau về độ mạnh của các đề xuất đối với một số chủ đề. Các hướng dẫn của ACCP và ASH khuyến cáo ngừng chống đông sau 3 tháng trong trường hợp thuyên tắc phổi lần đầu do yếu tố nguy cơ thoáng qua yếu, một khuyến cáo khác với hướng dẫn của ESC, khuyến cáo nên xem xét chống đông vô thời hạn ở những bệnh nhân này. Cách tiếp cận của chúng tôi đối với tình huống này thường phù hợp với các hướng dẫn ACCP và ASH trong khi tính đến các yếu tố ảnh hưởng đến nguy cơ tái phát (ví dụ: giới tính nam hoặc tuổi lớn hơn) và sở thích của bệnh nhân.
Vùng chưa chắc chắn
Việc xử trí thích hợp thuyên tắc phổi nhánh dưới phân thùy (một thuyên tắc phổi nhánh dưới phân thùy đơn lẻ hoặc nhiều thuyên tắc, không có sự hiện diện của thuyên tắc phổi ở nhánh phân thùy hoặc ở những mạch máu gần gốc hơn và không có huyết khối tĩnh mạch sâu ở chân) là không chắc chắn. Mặc dù một số hướng dẫn đề xuất theo dõi lâm sàng thêm thay vì dùng kháng đông ở bệnh nhân thuyên tắc phổi nhánh dưới phân thùy nguy cơ thấp, một nghiên cứu thuần tập tiền cứu gần đây liên quan đến những bệnh nhân như vậy được điều trị mà không dùng chống đông cho thấy tỷ lệ biến cố thuyên tắc huyết khối tĩnh mạch tái phát cao hơn mong đợi suốt 90 ngày theo dõi. Một thử nghiệm ngẫu nhiên, có đối chứng với giả dược về giám sát lâm sàng so với kháng đông ở nhóm bệnh nhân này đang diễn ra (số ClinicalTrials.gov, NCT04263038). Liệu một loại thuốc chống đông máu uống trực tiếp cụ thể có thích hợp hơn để điều trị thuyên tắc phổi hay không vẫn chưa được biết. Các thử nghiệm ngẫu nhiên đang diễn ra đang đánh giá apixaban so với rivaroxaban trong điều trị ban đầu ở bệnh nhân thuyên tắc huyết khối tĩnh mạch (NCT03266783) và các liều lượng khác nhau của các loại thuốc này để điều trị kéo dài cho những bệnh nhân này (NCT03285438).
Một thử nghiệm đa quốc gia, ngẫu nhiên, có đối chứng đang được tiến hành để đánh giá hiệu quả và độ an toàn của liệu pháp liên quan đến giảm liều thuốc tiêu huyết khối ở bệnh nhân thuyên tắc phổi cấp nguy cơ trung bình (NCT04430569). Dữ liệu chất lượng cao là cần thiết để cung cấp thông tin về lợi ích và nguy cơ của phương pháp tiếp cận lấy cục máu đông và tiêu huyết khối nội mạch trong điều trị bệnh nhân thuyên tắc phổi.
KẾT LUẬN VÀ KHUYẾN CÁO
Bệnh nhân khó thở được mô tả trong minh họa được ước tính có khả năng thuyên tắc phổi cao hơn 15%. Trong bối cảnh điểm số Wells thấp của bệnh nhân đối với thuyên tắc phổi, xét nghiệm D-dimer được bảo đảm để hướng dẫn nhu cầu chẩn đoán bằng hình ảnh; CT được chỉ định, với mức D-dimer hơn 1000 ng/ml. Theo giả định rằng chụp CT của bệnh nhân xác nhận thuyên tắc phổi và cho thấy kích thước tâm thất phải bình thường, anh ta sẽ được phân loại là bị thuyên tắc phổi nguy cơ thấp, với mức troponin bình thường của anh ta. Điều trị bằng thuốc chống đông đường uống trực tiếp nên được bắt đầu ngay lập tức và bệnh nhân cần được cung cấp thông tin về chẩn đoán thuyên tắc phổi. Trong trường hợp không có chống chỉ định điều trị ngoại trú (không có tiêu chí Hestia), bệnh nhân có thể được xuất viện trực tiếp từ khoa cấp cứu với sự theo dõi sát lâm sàng. Chúng tôi khuyên anh ấy nên khám sàng lọc ung thư phù hợp với độ tuổi và yếu tố nguy cơ cá nhân của anh ấy. Sau khi bệnh nhân được điều trị từ 3 đến 6 tháng với thuốc chống đông máu đường uống trực tiếp được sử dụng ở liều điều trị, trong trường hợp không tăng nguy cơ chảy máu và cân nhắc sở thích của anh ta, chúng tôi khuyên bạn nên chuyển sang dùng thuốc chống đông máu đường uống trực tiếp liều thấp trên một thời gian lâu dài để phòng ngừa thứ cấp.
Tài liệu tham khảo
- Jiménez D, Aujesky D, Díaz G, et al. Prognostic significance of deep vein thrombosis in patients presenting with acute symptomatic pulmonary embolism. Am J Respir Crit Care Med 2010;181:983- 91.
- Lehnert P, Lange T, Møller CH, Olsen PS, Carlsen J. Acute pulmonary embolism in a national Danish cohort: increasing incidence and decreasing mortality. Thromb Haemost 2018;118:539-46.
- Payne JG, Tagalakis V, Wu C, LazoLangner A. Current estimates of the incidence of acute venous thromboembolic disease in Canada: a meta-analysis. Thromb Res 2021;197:8-12.
- Calder KK, Herbert M, Henderson SO. The mortality of untreated pulmonary embolism in emergency department patients. Ann Emerg Med 2005;45:302-10.
- Kempny A, McCabe C, Dimopoulos K, et al. Incidence, mortality and bleeding rates associated with pulmonary embolism in England between 1997 and 2015. Int J Cardiol 2019;277:229-34.
- Ende-Verhaar YM, Cannegieter SC, Vonk Noordegraaf A, et al. Incidence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism: a contemporary view of the published literature. Eur Respir J 2017;49(2):1601792.
- Tran A, Redley M, de Wit K. The psychological impact of pulmonary embolism: a mixed-methods study. Res Pract Thromb Haemost 2021;5:301-7.
- Kahn SR, Hirsch AM, Akaberi A, et al. Functional and exercise limitations after a first episode of pulmonary embolism: results of the ELOPE prospective cohort study. Chest 2017;151:1058-68.
- Tavoly M, Utne KK, Jelsness-Jørgensen L-P, et al. Health-related quality of life after pulmonary embolism: a cross-sectional study. BMJ Open 2016;6(11):e013086.
- Zarabi S, Chan TM, Mercuri M, et al. Physician choices in pulmonary embolism testing. CMAJ 2021;193:E38-E46.
- Pollack CV, Schreiber D, Goldhaber SZ, et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry). J Am Coll Cardiol 2011;57:700-6.
- West J, Goodacre S, Sampson F. The value of clinical features in the diagnosis of acute pulmonary embolism: systematic review and meta-analysis. QJM 2007;100: 763-9.
- Germini F, Zarabi S, Eventov M, Turcotte M, Li M, de Wit K. Pulmonary embolism prevalence among emergency department cohorts: a systematic review and meta-analysis by country of study. J Thromb Haemost 2021;19:173-85.
- Lim W, Le Gal G, Bates SM, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: diagnosis of venous thromboembolism. Blood Adv 2018;2: 3226-56.
- Kline JA, Courtney DM, Kabrhel C, et al. Prospective multicenter evaluation of the pulmonary embolism rule-out criteria. J Thromb Haemost 2008;6:772-80.
- Kearon C, de Wit K, Parpia S, et al. Diagnosis of pulmonary embolism with D-dimer adjusted to clinical probability. N Engl J Med 2019;381:2125-34.
- Geersing G-J, Takada T, Klok FA, et al. Ruling out pulmonary embolism across different healthcare settings: a systematic review and individual patient data meta-analysis. PLoS Med 2022;19(1): e1003905.
- Elberts SJ, Bateman R, Koutsoubis A, London KS, White JL, Fields JM. The impact of COVID-19 on the sensitivity of D-dimer for pulmonary embolism. Acad Emerg Med 2021;28:1142-9.
- Righini M, Van Es J, Den Exter PL, et al. Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: the ADJUST-PE study. JAMA 2014;311:1117-24.
- Robert-Ebadi H, Robin P, Hugli O, et al. Impact of the age-adjusted D-dimer cutoff to exclude pulmonary embolism: a multinational prospective real-life study (the RELAX-PE study). Circulation 2021; 143:1828-30.
- van der Hulle T, Cheung WY, Kooij S, et al. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study. Lancet 2017;390:289-97.
- Miller WT Jr, Marinari LA, Barbosa E Jr, et al. Small pulmonary artery defects are not reliable indicators of pulmonary embolism. Ann Am Thorac Soc 2015;12: 1022-9.
- Mos ICM, Klok FA, Kroft LJM, De Roos A, Dekkers OM, Huisman MV. Safety of ruling out acute pulmonary embolism by normal computed tomography pulmonary angiography in patients with an indication for computed tomography: systematic review and meta-analysis. J Thromb Haemost 2009;7:1491-8.
- Le Roux P-Y, Robin P, Tromeur C, et al. Ventilation/perfusion SPECT for the diagnosis of pulmonary embolism: a systematic review. J Thromb Haemost 2020; 18:2910-20.
- Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). EurHeart J 2020;41:543-603.
- Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediaterisk pulmonary embolism. N Engl J Med 2014;370:1402-11.
- Jimenez D, Martin-Saborido C, Muriel A, et al. Efficacy and safety outcomes of recanalisation procedures in patients with acute symptomatic pulmonary embolism: systematic review and network meta-analysis. Thorax 2018;73:464-71.
- Robertson L, Jones LE. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for the initial treatment of venous thromboembolism. Cochrane Database Syst Rev 2017;2:CD001100.
- van Es N, Coppens M, Schulman S, Middeldorp S, Büller HR. Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials. Blood 2014;124:1968-75.
- Stevens SM, Woller SC, Kreuziger LB, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. Chest 2021; 160(6):e545-e608.
- Roy P-M, Penaloza A, Hugli O, et al. Triaging acute pulmonary embolism for home treatment by Hestia or simplified PESI criteria: the HOME-PE randomized trial. Eur Heart J 2021;42:3146-57.
- Chan N, Sobieraj-Teague M, Eikelboom JW. Direct oral anticoagulants: evidence and unresolved issues. Lancet 2020; 396:1767-76.
- Key NS, Khorana AA, Kuderer NM, et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: ASCO clinical practice guideline update. J Clin Oncol 2020;38:496-520.
- Mulder FI, Bosch FTM, Young AM, et al. Direct oral anticoagulants for cancerassociated venous thromboembolism: a systematic review and meta-analysis. Blood 2020;136:1433-41.
- Dufrost V, Wahl D, Zuily S. Direct oral anticoagulants in antiphospholipid syndrome: meta-analysis of randomized controlled trials. Autoimmun Rev 2021;20(1): 102711.
- Zuily S, Cohen H, Isenberg D, et al. Use of direct oral anticoagulants in patients with thrombotic antiphospholipid syndrome: guidance from the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. J Thromb Haemost 2020;18: 2126-37.
- Bates SM, Rajasekhar A, Middeldorp S, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: venous thromboembolism in the context of pregnancy. Blood Adv 2018;2:3317-59.
- Kearon C. A conceptual framework for two phases of anticoagulant treatment of venous thromboembolism. J Thromb Haemost 2012;10:507-11.
- Kearon C, Kahn SR. Long-term treatment of venous thromboembolism. Blood 2020;135:317-25.
- Kearon C, Ageno W, Cannegieter SC, Cosmi B, Geersing G-J, Kyrle PA. Categorization of patients as having provoked or unprovoked venous thromboembolism: guidance from the SSC of ISTH. J Thromb Haemost 2016;14:1480-3.
- Witt DM, Nieuwlaat R, Clark NP, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: optimal management of anticoagulation therapy. Blood Adv 2018;2:3257-91.
- Khan F, Rahman A, Carrier M, et al. Long term risk of symptomatic recurrent venous thromboembolism after discontinuation of anticoagulant treatment for first unprovoked venous thromboembolism event: systematic review and meta-analysis. BMJ 2019;366:l4363.
- Khan F, Tritschler T, Kimpton M, et al. Long-term risk for major bleeding during extended oral anticoagulant therapy for first unprovoked venous thromboembolism: a systematic review and meta-analysis. Ann Intern Med 2021;174:1420-9.
