Nhiễm trùng phổi biến chứng ARDS File pdf ở đây
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Nhiễm trùng phổi là một trong những biến chứng chính xảy ra ở những bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính (ARDS). Bên cạnh các yếu tố nguy cơ truyền thống, rối loạn điều hòa hệ miễn dịch phổi và hệ vi sinh vật có thể đóng một vai trò quan trọng ở bệnh nhân ARDS. Tư thế nằm sấp dường như không liên quan đến nguy cơ nhiễm trùng phổi cao hơn. Mặc dù vi khuẩn liên quan đến viêm phổi liên quan đến thở máy (VAP) ở bệnh nhân ARDS tương tự như ở bệnh nhân không mắc ARDS, mầm bệnh không điển hình (Aspergillus, virus herpes simplex và cytomegalovirus) cũng có thể là nguyên nhân gây nhiễm trùng ở bệnh nhân ARDS. Chẩn đoán nhiễm trùng phổi ở bệnh nhân ARDS là một thách thức và đòi hỏi sự kết hợp của các tiêu chí lâm sàng, sinh học và vi sinh. Vai trò của các công cụ hiện đại (ví dụ: phương pháp phân tử, giải trình tự metagenomic, v.v.) vẫn được đánh giá trong bối cảnh này. Một trong những thách thức của điều trị kháng sinh là sự khuếch tán kháng sinh vào phổi. Mặc dù việc cung cấp kháng sinh có mục tiêu bằng cách sử dụng khí dung có thể thú vị, nhưng vị trí của chúng ở bệnh nhân ARDS vẫn còn phải được khám phá. Việc sử dụng oxygen hóa qua màng ngoài cơ thể ở những bệnh nhân nặng nhất có liên quan đến tỷ lệ nhiễm trùng cao và đặt ra một số thách thức, vấn đề chẩn đoán và thay đổi dược động học/dược lực học được đặt lên hàng đầu. Phòng ngừa nhiễm trùng phổi là vấn đề then chốt ở bệnh nhân ARDS, nhưng không có biện pháp đặc hiệu nào cho những bệnh nhân có nguy cơ cao này. Tăng cường các biện pháp phòng ngừa bằng cách sử dụng gói dường như là lựa chọn tốt nhất.
Tin nhắn mang về nhà
Bội nhiễm phổi ở bệnh nhân ARDS ảnh hưởng đáng kể đến tiên lượng của bệnh nhân, điều này được ủng hộ bởi sự thay đổi hệ thống phòng thủ miễn dịch tại chỗ và toàn thân. Kết quả tồi tệ của ARDS với bội nhiễm phổi có lẽ liên quan đến việc thiếu các phương pháp chẩn đoán chính xác sớm và khó khăn trong việc tối ưu hóa liệu pháp.
Giới thiệu
Hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome − ARDS) tập hợp lại một loạt các bệnh mà hậu quả là viêm phổi, tổn thương phế nang và phù phổi [1]. Dù tổn thương phổi ban đầu là gì, bệnh nhân mắc ARDS đều dễ bị nhiễm trùng phổi thứ phát, đặc hiệu là viêm phổi liên quan đến máy thở (ventilator- associated pneumonia − VAP). Dữ liệu gần đây từ Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh cho thấy tỷ lệ VAP không giảm ở Hoa Kỳ bất chấp những nỗ lực phòng ngừa của các bang [2]. VAP biến chứng từ ARDS dường như là một vấn đề phổ biến, ảnh hưởng từ 20 đến 40% bệnh nhân [3,4]. Tần suất cao này có thể được giải thích bởi các yếu tố truyền thống như ô nhiễm phế quản do thời gian đặt nội khí quản và thở máy (mechanical ventilation − MV), nhưng cũng do suy giảm khả năng phòng vệ tại chỗ (phế nang) và toàn thân, cũng như các yếu tố đặc hiệu và không đặc hiệu khác [5]. Trong bài viết này, chúng tôi sẽ xem xét những thách thức đặc hiệu liên quan đến bệnh nhân ARDS, đặc biệt là các yếu tố nguy cơ đặc hiệu, thách thức chẩn đoán, mầm bệnh bất thường, các vấn đề về điều trị kháng sinh và phòng ngừa nhiễm trùng.
Sinh lý bệnh
Bảo vệ miễn dịch và hệ vi sinh đường hô hấp
Bệnh nhân mắc ARDS minh họa cho trạng thái miễn dịch nghịch lý rõ ràng của bệnh nhân bị bệnh nặng, theo đó các tế bào miễn dịch được kích hoạt làm trung gian cho tổn thương cơ quan trong khi biểu hiện khả năng phòng vệ chống vi trùng bị suy yếu [6]. Các chức năng tế bào bị suy giảm đã được xác định trên cả hai nhánh bẩm sinh và thích nghi của hệ thống miễn dịch [7, 8], và dường như mang tính rập khuôn hơn là đặc hiệu đối với bất kỳ nguyên nhân gây ra ARDS nào [9]. Tình trạng có vẻ nghịch lý này là do khả năng của các phân tử tiền viêm và tổn thương mô dẫn đến rối loạn chức năng miễn dịch [9, 10].
Các tế bào miễn dịch rối loạn chức năng được tìm thấy trong phổi cũng như máu ngoại vi [9]. Điều thú vị là các khiếm khuyết miễn dịch niêm mạc phổi bị kéo dài sau khi chữa khỏi viêm nguyên phát, do đó làm tăng tính nhạy cảm với viêm phổi mắc phải tại bệnh viện và ARDS trong nhiều tuần sau khi viêm toàn thân [11]. Sau khi thực hiện viêm phổi thực nghiệm, các đại thực bào phổi và tế bào đuôi gai đã chứng minh sự ức chế kéo dài các chức năng miễn dịch làm tăng tính nhạy cảm với nhiễm trùng thứ cấp [12]. Sự mở rộng của các tế bào T điều hòa miễn dịch (Treg) cũng được nhìn thấy và có thể làm trung gian cho chức năng miễn dịch bẩm sinh cũng như thích ứng bị suy giảm [13]. Bệnh nhân nghi ngờ mắc VAP, bao gồm cả những người mắc ARDS, đã chứng minh chức năng thực bào của bạch cầu trung tính phế nang bị suy giảm, điều thú vị là chúng dường như được trung gian bởi các chất trung gian khác với những chất điều khiển rối loạn chức năng trong máu ngoại vi [9]. Mặc dù chúng tôi ngày càng hiểu biết về các chất trung gian điều khiển rối loạn chức năng và các cơ chế nội bào điều khiển chúng [14], nhưng chúng tôi vẫn chưa có các liệu pháp đã được chứng minh mặc dù có nhiều tác nhân tiềm năng [7].
Khi nhắm đến việc điều chỉnh khả năng miễn dịch trong quá trình viêm, điều quan trọng là phải phân biệt các phản ứng của tế bào miễn dịch bẩm sinh và thích ứng. Trong khi kiệt sức và chết theo chương trình dường như là trung tâm của các khiếm khuyết tế bào lympho được quan sát thấy ở những bệnh nhân bị bệnh nặng [15], một số tế bào miễn dịch bẩm sinh trải qua quá trình tái lập trình liên quan đến tái lập trình biểu sinh và tăng chuyển hóa tế bào, một hiện tượng được gọi là miễn dịch được huấn luyện, dẫn đến sản xuất nhiều các cytokine gây viêm như dưới dạng IL-6 và TNFα trong thử thách miễn dịch thứ cấp [16]. Mặc dù glucocorticoid được coi là thuốc ức chế miễn dịch một cách cổ điển, nhưng người ta đã chứng minh rằng chúng có thể ngăn chặn quá trình tái lập trình miễn dịch được quan sát thấy sau phản ứng viêm [16], do đó hạn chế tính nhạy cảm của bệnh nhân được đưa vào đơn vị chăm sóc đặc biệt (ICU) đối với các biến chứng hô hấp như viêm phổi hoặc ARDS và cải thiện kết quả của bệnh nhân mắc ARDS [17].
Một phần của sự phức tạp của siêu nhiễm trùng phổi phát sinh từ sự tương tác giữa vật chủ bị thương với hệ vi sinh vật phổi của họ. Mặc dù ít phong phú và đa dạng hơn đáng kể so với hệ vi sinh vật đường tiêu hóa được nghiên cứu kỹ hơn [18], nhưng hệ vi sinh vật phổi ngày càng được xác định rõ ràng và trải qua những thay đổi đáng kể trong giai đoạn bệnh nặng và ARDS [19]. Vai trò chính của hệ vi sinh vật đường hô hấp đối với khả năng miễn dịch niêm mạc và chức năng hô hấp đối với sức khỏe cho thấy những thay đổi của nó có thể liên quan đến các biến chứng hô hấp được quan sát thấy ở những bệnh nhân bị bệnh nặng [20]. Thật vậy, những bệnh nhân thở máy bị giảm sự đa dạng của vi khuẩn phổi và gia tăng các sinh vật đường ruột, ngay cả khi không có nhiễm trùng rõ ràng [21].
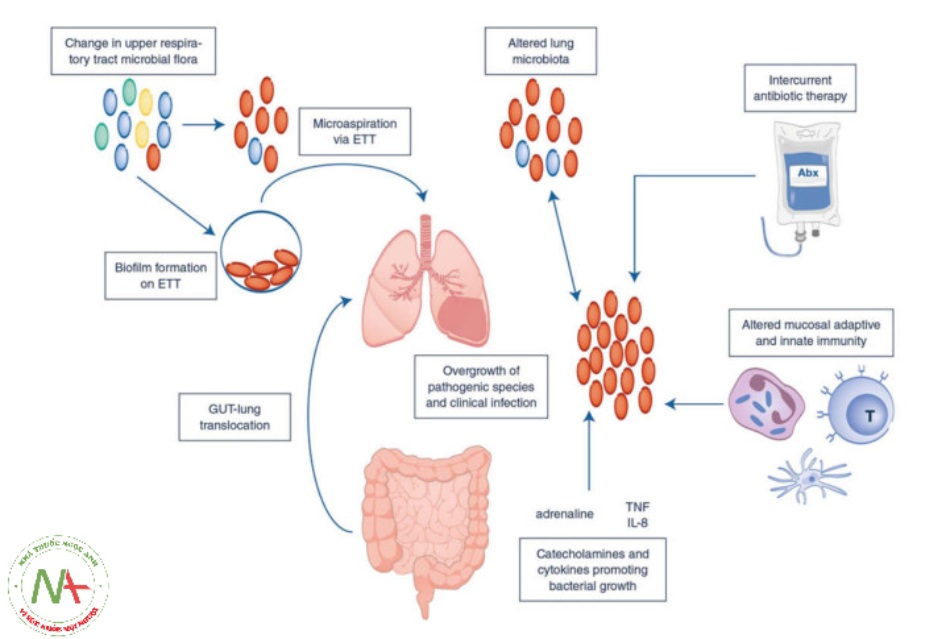
Những thay đổi sớm của hệ vi sinh vật phổi, đáng chú ý là tăng gánh nặng vi khuẩn và hình thành màng sinh học, làm giàu vi khuẩn liên quan đến đường ruột và mất tính đa dạng, có liên quan đến nguy cơ mắc ARDS và thời gian hỗ trợ MV ở bệnh nhân nặng [22]. Rối loạn vi khuẩn có sẵn, chẳng hạn như do khói thuốc lá gây ra, cũng có thể ảnh hưởng đến sự phát triển của ARDS sau chấn thương lớn [23]. Bên cạnh những thay đổi về loài vi khuẩn, người ta thường tìm thấy sự tái hoạt động của herpesviridae tiềm ẩn như virus herpes simplex (HSV) và cytomegalovirus (CMV) [24]. Trình điều khiển của những thay đổi này chưa được hiểu đầy đủ nhưng có nhiều yếu tố, với các cơ chế có thể được minh họa trong Hình 1 [13, 22, 25]. Điều phức tạp hơn nữa là khả năng bản thân vi khuẩn có thể gây ra rối loạn chức năng miễn dịch hơn nữa [26]. Do đó, VAP nên được khái niệm hóa ít hơn là nhiễm trùng mới do mầm bệnh ngoại sinh, mà là phản ứng rối loạn sinh học đối với bệnh hiểm nghèo với sự phát triển quá mức của các loại vi khuẩn đặc hiệu [27]. Liệu pháp kháng sinh thích hợp nhắm vào các loài chiếm ưu thế, những loài thường được phát hiện bằng nuôi cấy, là chìa khóa ở một số bệnh nhân nhưng có nguy cơ làm trầm trọng thêm tình trạng rối loạn vi khuẩn và gây hại thêm cho bệnh nhân [28]. Điều vẫn cần được chứng minh là liệu các biện pháp can thiệp để khôi phục lại sự cộng sinh, tức là tăng tính đa dạng của vi khuẩn thay vì chỉ loại bỏ các loài chiếm ưu thế, có thể cải thiện kết quả hay không [27]. Mặc dù kinh nghiệm cấy ghép phân trong bệnh tiêu chảy liên quan đến Clostridium difficile gợi ý rằng cấy ghép vi sinh vật có thể là một hình thức trị liệu hiệu quả [29], trải nghiệm tiêu cực về men vi sinh trong viêm tụy và các ví dụ gần đây về vi khuẩn ‘probiotic’ gây nhiễm trùng là một lưu ý cần thận trọng [30, 31]. Việc phát triển các liệu pháp hiệu quả cho rối loạn vi sinh hô hấp (respiratory dysbiosis) sẽ yêu cầu các công cụ để lập hồ sơ chức năng tế bào miễn dịch ngoại biên và phổi của vật chủ cũng như hệ vi sinh vật phổi [8].
Hình 1 Các cơ chế dẫn đến thay đổi hệ vi sinh vật trong phổi và do đó gây nhiễm trùng. ETT: Ống nội khí quản, TNF: yếu tố hoại tử khối u, IL: interleukin
Tăng oxy máu là một yếu tố nguy cơ gây nhiễm trùng phổi
Tình trạng tăng oxy máu thường gặp ở những bệnh nhân dùng MV do ARDS. Một phân tích thứ cấp của thử nghiệm LUNG SAFE [32] báo cáo rằng 30% bệnh nhân được phân tích năm 2005 bị tăng oxy máu vào ngày đầu tiên và 12% bị tăng oxy máu kéo dài. Trong khi hai thử nghiệm ngẫu nhiên có kiểm soát cho thấy hiệu quả có lợi trong việc tránh tăng oxy [33, 34], một thử nghiệm đa trung tâm quốc tế lớn gần đây đã chứng minh không có tác dụng của liệu pháp oxy hạn chế ở một nhóm bệnh nhân bị bệnh nặng [35]. Tuy nhiên, một nghiên cứu phụ sau đó đã nêu lên khả năng gây hại quan trọng về mặt lâm sàng với liệu pháp oxy hạn chế ở bệnh nhân nhiễm trùng huyết [36].
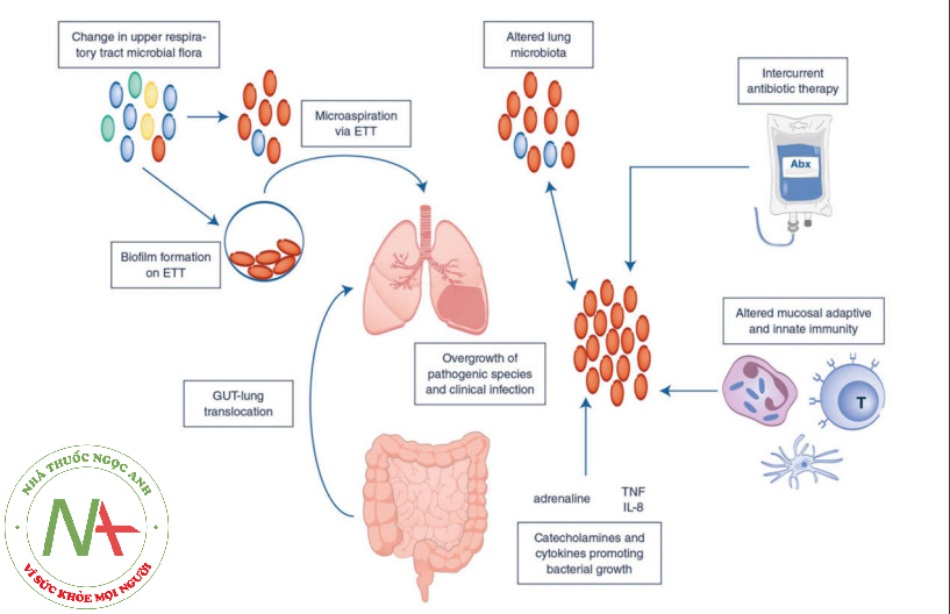
Độc tính của oxy chủ yếu liên quan đến sự hình thành các loại gốc tự do oxy hóa (ROS), đặc biệt là trong quá trình thiếu oxy/tái oxygen hóa và tiếp xúc lâu với oxy. Mức oxy hít vào cao là nguyên nhân gây ra hiện tượng khử nitơ và ứcchế sản xuất chất hoạt động bề mặt thúc đẩy sự xẹp phổi và xẹp phổi khi thở ra [37]. Xẹp phổi hấp thu xảy ra trong vòng vài phút sau khi thở O2 nguyên chất. Ở những bệnh nhân thở máy, xẹp phổi làm suy giảm nghiêm trọng phản xạ ho và làm sạch chất nhầy dẫn đến dịch tiết nhiều ở đường hô hấp dưới và nguy cơ mắc VAP cao hơn. Tình trạng tăng oxy kéo dài cũng làm suy yếu hiệu quả của các đại thực bào phế nang trong việc di chuyển, thực bào và tiêu diệt vi khuẩn, dẫn đến giảm độ thanh thải vi khuẩn [38]. Tăng oxy máu làm tăng đáng kể tỷ lệ tử vong của chuột trong mô hình chuột bị viêm phổi Pseudomonas aeruginosa [39]. Ngoài ra, O2 có thể gây ra hiệu ứng độc hại đặc hiệu cho phổi được gọi là tổn thương phổi cấp tính do tăng oxy máu (hyperemic acute lung injury − HALI) (Hình 2).
Hình 2 Các cơ chế của mối quan hệ giữa tăng oxy máu và viêm phổi liên quan đến máy thở. VAP: Viêm phổi liên quan đến thở máy, HALI: tổn thương phổi cấp tính do tăng oxy máu
Mặc dù các nghiên cứu trước đây đã báo cáo mối liên hệ giữa FiO2 cao và xẹp phổi, nhưng cần có các nghiên cứu sâu hơn để đánh giá mối liên hệ giữa tình trạng tăng oxy máu và tỷ lệ tử vong hoặc VAP. Trong một nghiên cứu đoàn hệ tại một trung tâm trên 503 bệnh nhân, trong đó 128 (28%) mắc VAP, phân tích đa biến xác định số ngày bị tăng oxy máu [OR = 1,1, KTC 95%: (1,04–1,2) mỗi ngày, p = 0,004], như một yếu tố nguy cơ độc lập đối với VAP. Tuy nhiên, nghiên cứu này là hồi cứu, được thực hiện ở một trung tâm duy nhất và định nghĩa được sử dụng cho tăng oxy máu (ít nhất một giá trị PaO2 > 120 mmHg mỗi ngày) có thể gây tranh cãi [40].
Trong thử nghiệm ngẫu nhiên có đối chứng HYPERS2S gần đây [34], tỷ lệ bệnh nhân bị xẹp phổi tăng gấp đôi ở những bệnh nhân bị tăng oxy máu so với những bệnh nhân có oxy bình thường (12% so với 6%, p = 0,04). Tuy nhiên, không có sự khác biệt đáng kể về tỷ lệ VAP giữa nhóm tăng oxy máu và nhóm đối chứng (15% so với 14%, p= 0,78). Tuy nhiên, VAP không phải là kết quả chính của thử nghiệm này và không có định nghĩa rõ ràng về viêm phổi mắc phải tại ICU. Các nghiên cứu được thiết kế tốt hơn là cần thiết để xác định mối quan hệ giữa tăng oxy máu và VAP.
Tư thế nằm sấp là một yếu tố nguy cơ gây nhiễm trùng phổi
Tư thế nằm sấp được khuyến nghị ở những bệnh nhân mắc ARDS nặng và thường được sử dụng ở nhóm đối tượng này. Có một lý do cơ bản ủng hộ tác dụng có lợi của tư thế nằm sấp đối với tỷ lệ mắc VAP, vì nó tạo điều kiện dẫn lưu chất bài tiết và cho phép giải quyết tình trạng xẹp phổi. Các nghiên cứu trên người và động vật trước đây đã chỉ ra rõ ràng mối liên hệ giữa xẹp phổi và VAP, đồng thời báo cáo rằng dẫn lưu dịch tiết hiệu quả có thể dẫn đến tỷ lệ mắc VAP thấp hơn [37]. Mặt khác, tư thế nằm sấp có thể tạo điều kiện thuận lợi cho vi sinh vật phát tán và tăng khả năng vi hút các chất tiết bị ô nhiễm.
Kết quả của các nghiên cứu về mối quan hệ giữa tư thế nằm sấp và VAP nên được giải thích một cách thận trọng, do một số hạn chế như thiết kế quan sát, số lượng bệnh nhân nhỏ và các yếu tố gây nhiễu. Năm nghiên cứu gần đây đã được thực hiện ở những bệnh nhân có MV bảo vệ phổi, bao gồm bốn nghiên cứu ngẫu nhiên có kiểm soát và một đoàn hệ quan sát lớn. Mounier và cộng sự.[41] báo cáo không giảm đáng kể tỷ lệ mắc VAP trong một đoàn hệ lớn (n = 2409) của bệnh nhân thiếu oxy được đặt ở tư thế nằm sấp, so với những người không nhận được can thiệp này [HR 1,64 (KTC 95% 0,7–3,8)]. Một thử nghiệm ngẫu nhiên có kiểm soát đã báo cáo giảm nguy cơ mắc VAP ở những bệnh nhân đa chấn thương nằm sấp liên tục so với những người không nằm sấp (p = 0,048) [42]. Tuy nhiên, tỷ lệ mắc VAP rất cao ở nhóm đối chứng (89%) và số lượng bệnh nhân tham gia cũng ít (n = 40). Ba thử nghiệm đối chứng ngẫu nhiên khác báo cáo không có mối quan hệ đáng kể nào giữa tư thế nằm sấp và VAP [4, 43, 44]. Tuy nhiên, những nghiên cứu này thiếu thông tin về các biện pháp phòng ngừa VAP hiệu quả, chẳng hạn như sử dụng dẫn lưu dịch tiết dưới thanh môn hoặc kiểm soát liên tục áp lực khí quản, và VAP không phải là kết quả chính của họ. Tóm lại, dữ liệu hiện có không hỗ trợ mối quan hệ đáng kể giữa tư thế nằm sấp và VAP, mặc dù nó đã chứng minh tác dụng có lợi đối với tỷ lệ tử vong ở ARDS nặng.
Thách thức chẩn đoán
Chẩn đoán nhiễm trùng phổi ở bệnh nhân ARDS là một thách thức [45]. Chẩn đoán viêm phổi, bệnh nhiễm trùng đường hô hấp chiếm ưu thế trong ARDS, cuối cùng là chẩn đoán mô bệnh học đòi hỏi phải có sự hiện diện của viêm trong khoảng khí (airspace) và sinh vật lây nhiễm. Tuy nhiên, việc lấy mô phổi để chẩn đoán hiếm khi thực tế hoặc mong muốn ở những bệnh nhân thở máy [5]. Các đặc điểm lâm sàng của viêm toàn thân và các dấu hiệu khu trú ở ngực như ran nổ và tiếng thở phế quản là không đặc hiệu và không nhạy cảm. Mặc dù bằng chứng X quang về thâm nhiễm của khoảng khí là hữu ích, nhưng tiêu chuẩn vàng của chụp cắt lớp vi tính không thực tế đối với hầu hết bệnh nhân, khiến các bác sĩ dựa vào X quang và siêu âm đơn giản, và thậm chí cả chụp cắt lớp vi tính không phải lúc nào cũng có thể phân biệt một cách đáng tin cậy giữa nguyên nhân lây nhiễm và không lây nhiễm của thâm nhiễm khoảng khí [5, 45]. Việc chỉ sử dụng các tiêu chí lâm sàng và chụp X quang có khả năng đánh giá quá cao đáng kể tỷ lệ viêm phổi và dẫn đến việc sử dụng kháng sinh quá mức, có khả năng gây hại [28]. Điều quan trọng cần nhắc lại là bản thân viêm phổi là nguyên nhân phổ biến nhất của ARDS, cùng với sự thay đổi trên phim X quang hai bên ở bệnh nhân ARDS, tạo ra một thách thức bổ sung cho việc xác định “thâm nhiễm phổi mới hoặc xấu đi”, một tình trạng cần thiết cho lâm sàng. chẩn đoán VAP [5]. Một thách thức khác là sự khác biệt giữa viêm khí phế quản liên quan đến máy thở (ventilator-associated tracheobronchitis − VAT) và VAP. VAT được định nghĩa là nhiễm trùng đường hô hấp dưới mà không có sự tham gia của nhu mô phổi (và do đó không có thâm nhiễm X-quang ngực mới/tiến triển). Sự khác biệt giữa VAT và VAP ở bệnh nhân ARDS vẫn còn là một thách thức do độ chính xác kém của X quang ngực để phát hiện các thâm nhiễm mới.
Lấy mẫu từ phổi để nuôi cấy vi sinh là rất quan trọng để xác định nhiễm trùng. Tuy nhiên, có sự thay đổi đáng kể về thời gian và loại mẫu vật thu được trong thực tế [46]. Việc xác định nhiễm trùng có thể phức tạp do sự xâm lấn (colonization) của đường thở gần, xảy ra nhanh chóng sau khi đặt nội khí quản và thường gặp ở bệnh nhân ARDS [5]. Điều quan trọng là phải phân biệt giữa sự xâm nhập của vi khuẩn (sự hiện diện của vi khuẩn, thậm chí ở mật độ cao, trong đường hô hấp mà không gây nhiễm trùng phổi), một hiện tượng vô hại và nhiễm trùng. Mặc dù lấy mẫu phổi sâu được bảo vệ bằng cách rửa phế quản phế nang hoặc mẫu bàn chải được bảo vệ làm giảm nguy cơ dương tính giả so với hút nội khí quản, nhưng điều này đã không được chứng minh một cách thuyết phục để thay đổi kết quả mặc dù dữ liệu quan sát cho thấy họ có thể giảm sử dụng kháng sinh một cách an toàn [47]. Mặc dù kết quả dương tính giả từ sự xâm lấn gần là một vấn đề quan trọng, việc sử dụng kháng sinh xen kẽ là phổ biến ở bệnh nhân ARDS và làm tăng nguy cơ nuôi cấy âm tính giả. Điều này ngày càng được giải quyết bằng cách sử dụng kỹ thuật phân tử độc lập với nuôi cấy; tuy nhiên, tiện ích của các công cụ hiện có bị hạn chế bởi phạm vi hạn chế của chúng đối với các sinh vật được bao phủ và nguy cơ phát hiện quá nhạy cảm các sinh vật không liên quan dẫn đến việc sử dụng thuốc kháng sinh không hợp lý [48, 49, 50]. Các bác sĩ nên nhận thức được điểm đặc biệt này và do đó giải thích một cách thận trọng các kết quả của các xét nghiệm này. Có rất ít nghiên cứu tiến cứu chứng minh tác động của chẩn đoán phân tử đối với việc quản lý bệnh nhân và kết quả của các thử nghiệm sắp tới đang được chờ đợi. Phát hiện kháng nguyên ở đường hô hấp dưới cũng có thể hỗ trợ chẩn đoán, đặc biệt là với các sinh vật như Aspergillus nơi nuôi cấy và PCR không hoàn hảo [51]. Giá trị của PCR Aspergillus sp. và Aspergillus fumigatus đầy hứa hẹn, nhưng vẫn cần được đánh giá ở bệnh nhân ARDS. Ở những bệnh nhân mắc ARDS và thâm nhiễm X quang hai bên, vẫn còn một câu hỏi về việc lấy mẫu xâm lấn ở vùng nào. Mặc dù các thử nghiệm chưa được thực hiện để trả lời câu hỏi này một cách dứt khoát, nhưng dữ liệu quan sát cho thấy rằng khi có thâm nhiễm hai bên, việc lấy mẫu đơn thùy là đủ và giảm thiểu nguy cơ về thể tích dịch rửa và thời gian nội soi phế quản [52].
Phản ứng của vật chủ tạo nên thành phần quan trọng thứ hai của bất kỳ hội chứng nhiễm trùng nào và do đó, các dấu ấn sinh học của vật chủ có thể được sử dụng để chẩn đoán nhiễm trùng trong ARDS. Các đặc điểm huyết học của tình trạng viêm trong phòng thí nghiệm, bao gồm tăng bạch cầu, tăng bạch cầu trung tính và tăng protein phản ứng C, không đặc hiệu cho nhiễm trùng và có thể xảy ra trong các nguyên nhân vô trùng của ARDS [53]. Phản ứng viêm trong viêm phổi có tính khoang hóa cao và các cytokine phế nang và các dấu hiệu phế nang khác là yếu tố phân biệt rõ nhất đối với viêm phổi (Bảng 1) [54]. Đáng chú ý, mặc dù các cytokine ở phế nang đã thể hiện hiệu suất xét nghiệm tuyệt vời, nhưng việc đo lường các cytokine ở phổi không làm thay đổi việc kê đơn kháng sinh trong một thử nghiệm ngẫu nhiên gần đây [55]. Điều này cho thấy những thách thức trong chẩn đoán không chỉ nằm ở công nghệ mà còn ở phản ứng hành vi đối với kết quả.
Các xét nghiệm máu ngoại vi có ưu điểm là không cần lấy mẫu nội soi phế quản và do đó dễ lấy hơn; tuy nhiên, nhìn chung chúng ít có khả năng phân biệt viêm phổi với các bệnh nhiễm trùng khác và nhiều bệnh nhân thiếu độ nhạy và hoặc độ đặc hiệu đối với nhiễm trùng (Bảng 1).
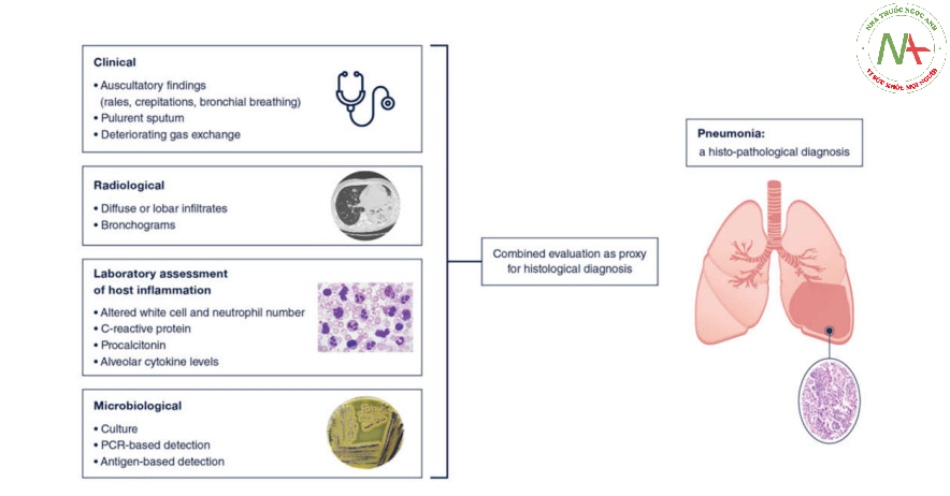
Tóm lại, chẩn đoán nhiễm trùng phổi trong ARDS là một thách thức, và các kỹ thuật hiện có là không hoàn hảo và có nguy cơ điều trị không đầy đủ và quá mức. Sự kết hợp giữa đánh giá lâm sàng, sinh học và X quang, kết hợp với lấy mẫu vi sinh từ phổi, vẫn là tiêu chuẩn vàng hiện tại (Hình 3). Sự phát triển của chẩn đoán phân tử tập trung vào cả vật chủ và mầm bệnh mang lại nhiều hứa hẹn, nhưng tác động của chúng đối với việc quản lý bệnh nhân và kết quả vẫn cần được chứng minh một cách thuyết phục.
Bảng 1 Tóm tắt các dấu ấn sinh học dựa trên vật chủ để chẩn đoán viêm phổi trong ARDS
| Marker | Performance |
| Alveolar | |
| Interleukin-1/interleukin-8 | Validated in multi-center cohort [54] but did not influence practice in an RCT [55] |
| STREM-1 | Initial report, but not validated in follow-up study [113, 114] |
| Exhaled breath markers Pentraxin-3 | Experimental with technical variation currently limiting implementation [115] |
| Pentraxin-3 | Meta-analysis suggested alveolar levels superior to plasma levels with moderate diagnostic performance, no RCT testing influence on practice [116] |
| Combination ‘bio-score’ | May be superior to individual markers, but remains to be validated [117] |
| Peripheral blood | |
| C-reactive protein | May be useful predictor of VAP, but non-specific and raised in both sterile and infective inflammation [118] |
| Procalcitonin | Lacks sensitivity for diagnosis of pneumonia, but can significantly shorten antibiotic duration [118] |
| Pro-adrenomedullin | Limited utility in diagnosis of pneumonia, but useful as marker of severity [118] |
| Pentraxin-3 | Less effective as a diagnostic than alveolar levels [116] |
| Presepsin | No reports in VAP |
| Neutrophil CD64 | Role in pneumonia uncertain [8] |
| Monocyte HLA-DR | Markers of monocyte deactivation and predictor of infection, but poor discriminant value for diagnosis of infection [8] |
Hình 3 Biểu diễn đồ họa của đánh giá kết hợp đánh giá lâm sàng, X quang và xét nghiệm về phản ứng của vật chủ và dữ liệu vi sinh để chẩn đoán viêm phổi như một đại diện cho kiểm tra mô bệnh học
Dịch tễ học nhiễm trùng phổi bệnh viện ở bệnh nhân ARDS
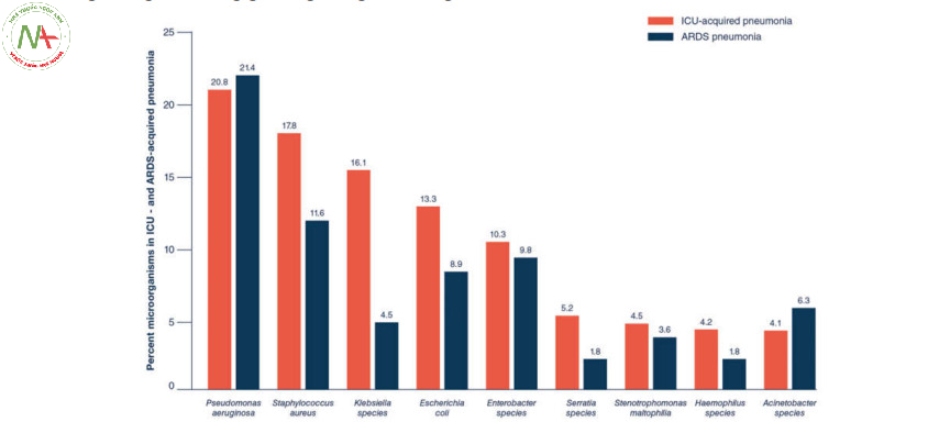
Các nguyên nhân vi khuẩn phổ biến nhất của VAP bao gồm Enterobacterales, Pseudomonas aeruginosa, Staphylococcus aureus và Acinetobacter trong quần thể bệnh nhân thở máy nói chung [56]. Các mầm bệnh liên quan đến VAP trong ARDS tương tự như các mầm bệnh được thấy ở những bệnh nhân không phải ARDS phát triển VAP (Hình 4) [4, 52, 57]. Hơn nữa, những bệnh nhân mắc ARDS trải qua quá trình oxygen hóa qua màng ngoài cơ thể (ECMO) cho thấy mầm bệnh tương tự với Pseudomonas aeruginosa và Staphylococcus aureus chiếm ưu thế [58]. Một yếu tố quan trọng, bất kể vi khuẩn gây bệnh đặc hiệu được tìm thấy trong VAP, là tình trạng kháng kháng sinh đang gia tăng trong VAP cũng như các bệnh nhiễm trùng bệnh viện khác. Vào năm 2017, Thử nghiệm Đánh giá và Giám sát Tigecycline đã mô tả những thay đổi quan trọng của châu Âu về tính nhạy cảm với kháng sinh từ năm 2004 đến 2014, với sự gia tăng tỷ lệ Escherichia coli dương tính với ESBL (từ 8,9 lên 16,9%), phức hợp MDR Acinetobacter baumannii (từ 15,4 lên 48,5%).), Klebsiella pneumoniae dương tính với ESBL (từ 17,2 đến 23,7%), và Staphylococcus aureus kháng methicillin (MRSA) (từ 27,5 đến 28,9%) [59]. Các xu hướng đáng lo ngại tương tự đối với tính nhạy cảm của vi khuẩn đối với các loại thuốc kháng sinh hiện có cũng đã được báo cáo bởi các nhà điều tra khác [60, 61]. Đáng lo ngại nhất là sự hiện diện ngày càng được công nhận của tình trạng kháng các loại kháng sinh mới được phát triển đặc biệt để điều trị VAP [62].
Hình 4 Báo cáo dịch tễ học hàng năm về các bệnh nhiễm trùng liên quan đến chăm sóc sức khỏe tại các đơn vị chăm sóc đặc biệt năm 2016. Biểu đồ thanh mô tả tỷ lệ phần trăm của các vi sinh vật được phân lập thường xuyên nhất trong các đợt viêm phổi mắc phải tại ICU năm 2016 (thanh màu đỏ) và cho bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính (ARDS) (thanh màu xanh lam). Tổng số phân lập lần lượt là 16, 869 và 112
Việc tiếp xúc với kháng sinh trước đó và những thay đổi sau đó trong hệ vi sinh vật đường thở của vật chủ do rối loạn vi khuẩn dường như làm tăng tỷ lệ vi khuẩn kháng kháng sinh gây ra VAP (Hình 5) [22, 63]. Sự hiện diện của các thiết bị xâm lấn như ống nội khí quản và sử dụng kháng sinh thúc đẩy sự xâm nhập của vi khuẩn gây bệnh do áp đảo hệ thống phòng thủ tại chỗ, dẫn đến sự phát triển của nhiễm trùng đường hô hấp trung gian được gọi là VAT [64]. VAT đại diện cho phản ứng của vật chủ được chia thành nhiều ngăn liên quan đến tiên lượng tổng thể tốt hơn so với VAP, nhưng VAT có thể kéo dài thời gian nằm viện MV và ICU [65]. Nếu phản ứng nói trên không được ngăn chặn, có khả năng tiến triển thành VAP và có thể xảy ra suy cơ quan khác bao gồm ARDS [66].
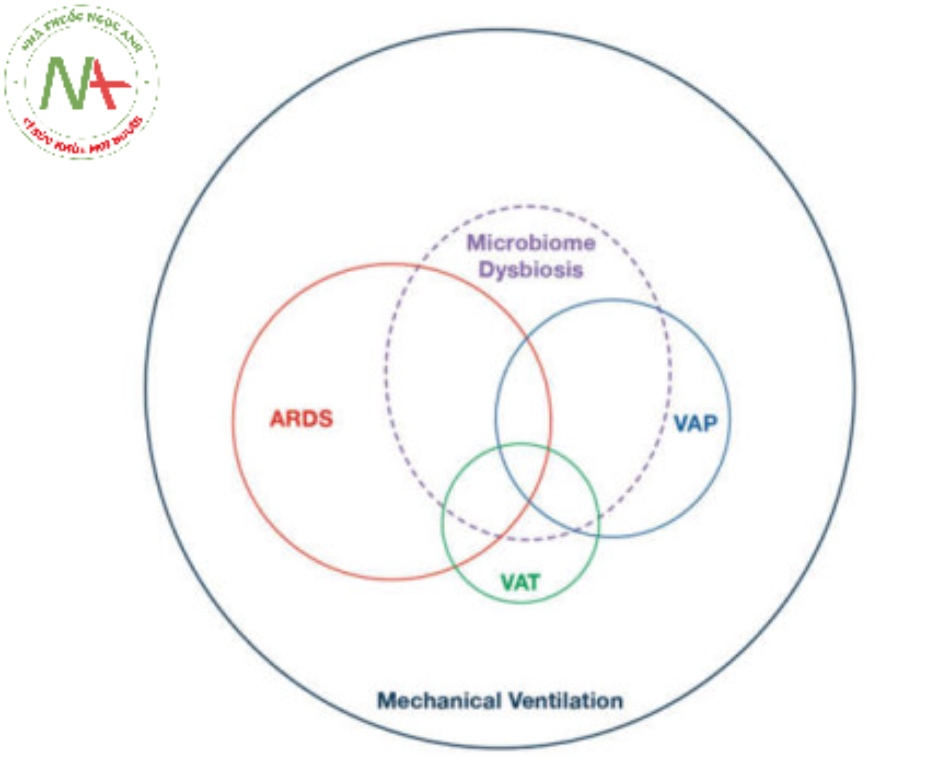
Hình 5 Biểu đồ Venn cho thấy mối quan hệ và sự chồng chéo của bệnh viêm phổi liên quan đến máy thở (VAP) và viêm khí phế quản liên quan đến máy thở (VAT) với hội chứng nguy kịch hô hấp cấp tính (ARDS). Rối loạn hệ vi sinh vật đường hô hấp cũng được chứng minh là điều kiện tiên quyết cho hầu hết các trường hợp VAP và VAT
Một trong những lo ngại chính liên quan đến nhiễm trùng phổi bệnh viện trong ARDS hiện tại và trong tương lai là sự xuất hiện ngày càng nhiều của mầm bệnh mới và nhiễm trùng vi sinh vật mà các lựa chọn điều trị hạn chế tồn tại. Khi chúng ta điều trị ARDS cho các vật chủ già hơn và suy giảm miễn dịch nhiều hơn, khả năng xuất hiện mầm bệnh mới và nhiễm vi sinh vật kháng thuốc sẽ tăng lên. Việc xác định sớm các mầm bệnh mới nổi như vậy trong ARDS là rất quan trọng. Tầm quan trọng của việc xác định sớm mầm bệnh mới là cần thiết để tạo điều kiện giám sát dịch tễ học, hạn chế sự lây lan của mầm bệnh và cung cấp phương pháp điều trị sớm như được minh họa bằng các đợt bùng phát bệnh viện gần đây của hội chứng hô hấp Trung Đông do coronavirus, SARS-CoV-2 và Escherichia coli kháng thuốc [67-70]. Trong tương lai, giải trình tự thế hệ tiếp theo của metagenomic sẽ cho phép các phương pháp điều trị sớm hơn và nhắm mục tiêu hơn đối với các mầm bệnh mới gây ra ARDS hoặc làm phức tạp quá trình điều trị của bệnh nhân mắc ARDS. Công nghệ như vậy sẽ cho phép xác định mầm bệnh sớm hơn và đẩy nhanh quá trình xử lý cũng như điều trị cả nguyên nhân lây nhiễm và không lây nhiễm của các bệnh làm phức tạp ARDS [71].
Nguyên nhân không điển hình của nhiễm trùng đường hô hấp ở bệnh nhân ARDS
Mặc dù phần lớn các bệnh nhiễm trùng đường hô hấp ở bệnh nhân ARDS là do vi khuẩn gây ra, nhưng suy giảm miễn dịch do ICU gây ra có thể gây nhiễm trùng với mầm bệnh bất thường.
Mặc dù aspergillosis phổi xâm lấn (invasive pulmonary aspergillosis − IPA) đã được báo cáo chủ yếu ở những bệnh nhân bị suy giảm miễn dịch, nhưng sự xâm lấn của Aspergillus ở đường hô hấp dưới thường liên quan đến ARDS hơn ở những bệnh nhân khác được thở máy xâm lấn trong ICU [72]. Cơ chế tổn thương liên quan đến sự kết hợp của tổn thương phế nang (do ARDS gây ra) và rối loạn điều hòa đáp ứng miễn dịch tại chỗ, cùng với ức chế miễn dịch do nhiễm trùng huyết, suy giảm khả năng miễn dịch bẩm sinh và trình diện kháng nguyên, là nguyên nhân dẫn đến sự phát triển của IPA ở những bệnh nhân đã nhiễm khuẩn trước đó [15, 73]. Đồng nhiễm cúm đã được báo cáo là một yếu tố nguy cơ đối với IPA [74]. Contou và cộng sự báo cáo phân lập Aspergillusở đường hô hấp dưới ở gần 10% bệnh nhân mắc ARDS (50% có IPA giả định hoặc đã được chứng minh) [75]. Một phát hiện quan trọng từ nghiên cứu này là thời gian trung bình giữa lúc bắt đầu MV và mẫu đầu tiên dương tính với Aspergillus spp. chỉ có 3 ngày. Hơn nữa, một nghiên cứu sau khi chết ở bệnh nhân ARDS cho thấy 10% bệnh nhân đã chết có biểu hiện IPA [76]. Nếu Aspergillus được xác định là tác nhân gây bệnh ở bệnh nhân có hệ miễn dịch bình thường, nên sàng lọc bất kỳ loại ức chế miễn dịch nào (thể dịch, tế bào hoặc kết hợp, bổ sung, v.v.).
Virus cũng có thể là nguyên nhân gây nhiễm trùng ở bệnh nhân ARDS. Do suy giảm miễn dịch sau phản ứng tiền viêm ban đầu đối với sự gây hấn, các vi rút tiềm ẩn như herpesviridae có thể kích hoạt lại ở bệnh nhân ICU [7]. HSV và CMV thường được phục hồi trong phổi hoặc máu của bệnh nhân ICU (lên đến 50%, tùy thuộc vào từng trường hợp), sự tái hoạt động của chúng có liên quan đến bệnh tật và tử vong [24, 77, 78]. Tuy nhiên, tầm quan trọng chính xác của những lần tái hoạt động này vẫn còn đang tranh cãi: những vi rút này có thể có khả năng gây bệnh thực sự và gây ra bệnh liên quan đến phổi [24, 79], do đó có vai trò trực tiếp đối với tỷ lệ mắc bệnh/tử vong được quan sát thấy khi chúng tái hoạt động; hoặc họ có thể là người ngoài cuộc, việc họ tái hoạt động chỉ là thứ yếu sau mức độ nghiêm trọng của bệnh hoặc thời gian nằm ICU kéo dài. Cho đến nay, câu trả lời vẫn chưa được biết, dữ liệu liên quan đến lợi ích tiềm tàng của việc điều trị bằng thuốc kháng vi-rút đang gây tranh cãi. Đối với HSV, thử nghiệm đối chứng ngẫu nhiên gần đây nhất không tìm thấy sự gia tăng số ngày không thở máy ở bệnh nhân dùng acyclovir, nhưng có xu hướng giảm tỷ lệ tử vong trong 60 ngày (tỷ lệ nguy cơ tử vong trong vòng 60 ngày sau khi phân ngẫu nhiên nhóm acyclovir so với nhóm chứng). là 0,61 (KTC 95% 0,37–0,99, p = 0,047) [80]. Đối với CMV, hai thử nghiệm lâm sàng ngẫu nhiên (RCT) gần đây đã được thực hiện: thử nghiệm đầu tiên cho thấy điều trị dự phòng bằng valganciclovir ở bệnh nhân có huyết thanh dương tính với CMV có liên quan đến tỷ lệ tái kích hoạt CMV thấp hơn so với giả dược, nhưng không có kết quả tốt hơn [81]; và nghiên cứu thứ hai cho thấy, so với giả dược, điều trị dự phòng bằng ganciclovir không làm giảm nồng độ Il-6 trong máu vào ngày thứ 14, nhưng bệnh nhân dùng ganciclovir có xu hướng giảm thời gian MV [82]. Bên cạnh các virus tiềm ẩn, các virus đường hô hấp (rhinovirus, cúm, adenovirus…) gần đây đã được phát hiện là nguyên nhân gây nhiễm trùng bệnh viện ở bệnh nhân thở máy hoặc không thở máy [83]. Tuy nhiên, giống như herpesviridae, tác động thực sự của chúng đối với tỷ lệ mắc bệnh/tử vong vẫn chưa được biết.
Tóm lại, HSV và CMV có thể gây ra bệnh do vi rút ở bệnh nhân ARDS và vi rút đường hô hấp có thể là nguyên nhân gây ra bệnh viêm phổi mắc phải tại bệnh viện; tuy nhiên, tác động thực sự của những ca nhiễm vi-rút này đối với kết quả vẫn còn phải được xác định.
Nhiễm trùng phổi đặc hiệu ở bệnh nhân ECMO
Oxygen hóa qua màng ngoài cơ thể tĩnh mạch (VV-ECMO) hiện là một phần của việc kiểm soát ARDS kháng trị [84, 85]. Những bệnh nhân ốm yếu này có nguy cơ cao phát triển các bệnh nhiễm trùng bệnh viện điển hình liên quan đến ICU (ví dụ: VAP hoặc nhiễm trùng máu), ngoài các bệnh nhiễm trùng đặc hiệu ECMO, bao gồm cả nhiễm trùng cục bộ tại các vị trí đặt ống thông ngoại vi. Bizarro và cộng sự đã báo cáo tỷ lệ nhiễm trùng bệnh viện phổ biến cao là 21% trong một sổ đăng ký quốc tế lớn về bệnh nhân ECMO [86], nhiễm trùng phổi được báo cáo thường xuyên nhất. Tỷ lệ lưu hành cao này có thể được giải thích là do các bệnh nền đi kèm, bệnh hiểm nghèo đi kèm, thời gian hỗ trợ cơ học kéo dài, thời gian nằm trong ICU và MV cũng như sự suy giảm hệ thống miễn dịch do mạch ngoài cơ thể thông qua rối loạn chức năng nội mô, dòng thác đông máu và giải phóng các chất trung gian gây viêm [87]. Mặc dù tỷ lệ nhiễm trùng phổi trên ECMO chưa được so sánh kỹ lưỡng với dân số mắc bệnh hiểm nghèo tương tự nhưng không có ECMO, VAP đã được báo cáo ở 32 trong số 92 bệnh nhân nhận ECMO (87% VV-ECMO) bởi Grasseli và cộng sự [88]. Trong số 220 bệnh nhân trải qua VA-ECMO trong hơn 48 giờ và trong tổng số 2942 ngày ECMO, 142 (64%) đã phát triển 222 ca nhiễm trùng bệnh viện, tương ứng với tỷ lệ 75,5 đợt nhiễm trùng trên 1000 ngày ECMO. VAP là vị trí lây nhiễm chính với 163 đợt xảy ra ở 120 bệnh nhân sau trung bình ± độ lệch chuẩn là 7 ± 12 ngày [89]. Do đó, VAP và các sinh vật kháng thuốc phổ biến trong quần thể đó [88, 89, 90]. Thời gian ECMO thường liên quan đến tỷ lệ VAP cao hơn [89, 91], ngay cả khi không thể thiết lập được mối quan hệ nhân quả. Thật vậy, thời gian chạy ECMO lâu hơn có thể là hậu quả trực tiếp của các biến chứng nhiễm trùng hơn là một yếu tố nguy cơ. Tuy nhiên, có vẻ như rõ ràng rằng những bệnh nhân ECMO mắc VAP có thời gian hỗ trợ MV và ECMO lâu hơn và tỷ lệ tử vong tại ICU tổng thể cao hơn [88, 89, 91]. Tương tự như vậy, bệnh nhân suy giảm miễn dịch và tuổi già luôn được coi là yếu tố nguy cơ liên quan đến nhiễm trùng trên ECMO [89, 92]. Chẩn đoán lâm sàng nhiễm trùng phổi ở bệnh nhân ECMO là một thách thức, vì họ có thể có dấu hiệu phản ứng viêm toàn thân, có thể do chính ECMO kích hoạt, trong khi có thể không sốt nếu nhiệt độ được kiểm soát bởi bộ trao đổi nhiệt trên màng. Ngoài ra, ứng dụng phổ biến của thông khí bảo vệ cực cao nhằm mục đích cho phổi nghỉ ngơi trên VV- ECMO và phù phổi thường xuyên trên VA-ECMO làm cho việc giải thích các thâm nhiễm mới trên X quang ngực, thường được sử dụng để nghi ngờ VAP, trở nên khó khăn. Ngoài thách thức chẩn đoán nhiễm trùng phổi trên ECMO, những thay đổi về dược động học/dược lực học (PK/PD) của thuốc kháng sinh cũng có thể góp phần trì hoãn điều trị bằng thuốc kháng sinh thích hợp và do đó làm tăng gánh nặng nhiễm trùng [93]. Trong khi chờ đợi các nghiên cứu in vivo lớn nhằm báo cáo PK/PD tương ứng của các thuốc kháng sinh trên ECMO, cần tránh các chất ưa mỡ (nghĩa là có nhiều khả năng được cô lập trên màng ECMO) [93] và theo dõi thuốc điều trị.
Kháng sinh và phổi
Ngoài nhiễm khuẩn huyết/nhiễm trùng huyết, hầu hết các bệnh nhiễm trùng đều xảy ra ở kẽ hoặc mô và do đó hiệu quả của thuốc phải liên quan đến nồng độ và tác dụng của thuốc trong các mô đó [94]. Thuốc sẽ đi qua màng cơ thể (di chuyển từ khoang tĩnh mạch vào khoang mô) nếu có “cơ chế vận chuyển” nội tại, hoặc nếu hợp chất là một phân tử nhỏ hoặc ưa mỡ [95].
Thuốc kháng sinh ưa nước (hydrophilic antimicrobials) được tìm thấy trong nước ngoài mạch máu phổi (extravascular lung water), nhưng đối với sự thâm nhập vào mô phổi liên quan thì thuốc ưa mỡ (lipophilic drugs) là quan trọng nhất [94, 95, 96, 97]. Các phân tử lớn như vancomycin, teicoplanin, aminoglycoside và colistin sẽ có nồng độ mô phổi kém khi tiêm tĩnh mạch (tỷ lệ nồng độ ELF/huyết tương << 1) [95, 96]. Betalactam xâm nhập vào nhu mô phổi tốt hơn các kháng sinh kị nước khác [96]. Tỷ lệ nồng độ ELF/huyết tương đối với glycylcycline (ví dụ: tigecycline) là khoảng 1. Các thuốc ưa mỡ như macrolide, ketolide, quinolone, oxazolidinon, thuốc chống nấm và thuốc kháng vi-rút sẽ có nồng độ mô phổi tốt (tỷ lệ nồng độ ELF/huyết tương > 1) sau khi tiêm tĩnh mạch [97]. Oxazolidinones (linezolid), glycylcycline (tigecycline) và sulfonamides (cotrimoxazole) có thể có hiệu quả trong điều trị mầm bệnh MDR; tuy nhiên, không có dữ liệu PK phổi (nồng độ ELF/huyết tương) dành riêng cho ARDS cho các loại thuốc này. Mặc dù các loại thuốc kháng sinh mới hơn (ceftolazone–tazobactam, meropenem– vaborbactam, plazomicin) có hoạt tính chống lại các mầm bệnh Gram âm kháng thuốc, nhưng có rất ít lựa chọn thay thế chống lại Acinetobacter baumaniii kháng thuốc chẳng hạn như cefiderocol đang được thử nghiệm lâm sàng giai đoạn 3.
Sự ra đời của thế hệ thiết bị phân phối mới hơn và các sinh vật MDR đã dẫn đến mối quan tâm mới trong lĩnh vực thuốc kháng sinh khí dung (nebulized antimicrobials) [98], mặc dù các thử nghiệm gần đây về bệnh viêm phổi đã không chứng minh được lợi ích lâm sàng [99, 100]. ARDS thường đi kèm với hội chứng rối loạn chức năng đa cơ quan. Do đó, khả năng đạt được nồng độ cao trong phổi với các tác dụng phụ toàn thân hạn chế rất hấp dẫn. Mặc dù các RCT được tiến hành tốt gần đây đã lập luận chống lại việc sử dụng có hệ thống thuốc kháng sinh khí dung trong viêm phổi bệnh viện [99, 100] nó vẫn có thể có một vị trí trong điều trị nhiễm trùng phổi nặng do vi khuẩn MDR. Theo quan điểm này, việc lựa chọn công thức và liều lượng kháng sinh chính xác (Bảng 2) là bước đầu tiên cần thiết, cũng như thiết bị tốt nhất, đặc hiệu là máy phun sương lưới rung (vibrating mesh nebulizer) [101]. Dữ liệu PK lâm sàng có sẵn đối với một số thuốc kháng khuẩn, thuốc kháng vi-rút và thuốc chống nấm dạng khí dung xác nhận mức độ phơi nhiễm toàn thân và phổi cao [102]. Các nghiên cứu PK đờm báo cáo tính biến thiên cao và khó diễn giải [102]. Tuy nhiên, sự lắng đọng phổi (lung deposition) của thuốc kháng sinh khí dung bị ảnh hưởng bởi nhiều yếu tố, bao gồm cả cài đặt máy thở đặc hiệu. Các cài đặt và quy trình máy thở thường được khuyến nghị để cải thiện việc cung cấp khí dung (thể tích khí lưu thông cao, nhịp thở thấp và lưu lượng hít vào thấp, thay đổi hệ thống các bộ lọc thở ra…) rất khó thực hiện ở bệnh nhân mắc ARDS, ít nhất là những bệnh nhân có dạng nặng nhất. ARDS là một tình trạng phổi không đồng nhất gây ra sự phân phối thông khí không đồng nhất có khả năng ảnh hưởng đến việc phân phối thuốc tại vị trí bị ảnh hưởng. Tăng viêm phổi cũng có thể làm tăng nồng độ toàn thân do tăng khuếch tán qua hàng rào phế nang-mao mạch, do đó ảnh hưởng đến liều lượng thuốc khí dung [103]. Các nghiên cứu PK sâu hơn điều tra thuốc kháng sinh khí dung trong ARDS là cần thiết để khuyến nghị chế độ dùng thuốc trong tình trạng này.
Bảng 2 Liều đề xuất cho thuốc kháng sinh có thể là cả IV và khí dung
| Drug | Suggested IV dose for ARDS lung infections | Notes | Suggested inhaled dose
|
| Penicillins | |||
| Ampicillin | 2 gm 6 hourly (q6h) | 1 gq 12h [119] | |
| Ampicillin-sulbactam | 3 gq 8h [120] | ||
| Cephalosporins | |||
| Ceftazidime | 2 gm 6-8 hourly | 250 mg q 12 h [121, 122] 15 mg/kg q3h [123] | |
| Carbapenems | |||
| Meropenem | 1 gm 4-6 hourly | Not recommended (no data) | |
| Imipenem | 500-1000 mg 6 hourly | 50 mg q6h [124] | |
| Quinolones | |||
| Moxifloxacin | 400 mg daily | Not recommended (no data) | |
| Ciprofloxacin | 400 mg 8 hourly | Not recommended (no data in ventilated patients) | |
| Levofloxacin | 750 mg daily up to 500 mg 12 hourly | 240 mg q 12 h [125] | |
| Sulfonamide | |||
| Trimethoprim/sulfamethoxazole | 8-10 mg trimethoprim/kg/day | Not recommended (no data) | |
| Glycopeptide | |||
| Vancomycin | 30 mg/kg loading
Same dose per day (divided or continuous infu- sion) |
Keep serum level 20-25 mg/L | 120 mg q8 h [126, 127] |
| Aminoglycosides | |||
| Gentamicin | 7 mg/kg loading dose | Used primarily to sterilize blood | 80 mg q8h [126, 127] |
| Tobramycin | 7 mg/kg loading dose | Used primarily to sterilize blood | 300 mg q12 h [128] |
| Amikacin | 25-30 mg/kg loading dose | Used primarily to sterilize blood | 25 mg/kg/day [123]
40 mg/kg/day [129] 400 mg q12h [100] |
| Polymyxins | |||
| Colistin | 4 mg/kg loading, then 500 mg 6 hourly (33.33 mg colistin=1 million units) | 4 MIU q8h [129] | |
| Phosphonic acid derivative | |||
| Fosfomycin | 4 g 6-8 hourly | Never alone | 120 mg fosfomycin q12h [99] |
| Monobactam | |||
| Aztreonam | 1 g 6 hourly | 75 mg q 8 h [130] | |
Các lĩnh vực nghiên cứu như y học nano phổi và phân phối mục tiêu bằng cách sử dụng ống thông phun khí dung trong cơ thể, trong khi vẫn đang được nghiên cứu, có khả năng vượt qua nhiều rào cản này và tăng cường nồng độ kháng khuẩn trong mô phổi [104].
Phòng ngừa nhiễm trùng phổi ở bệnh nhân ARDS
Nhiễm trùng bệnh viện có thể góp phần vào tỷ lệ tử vong liên quan đến ARDS vì những nhiễm trùng như vậy là nguyên nhân làm trầm trọng thêm tình trạng thiếu oxy trong máu và gây nhiễm trùng huyết. Do đó, việc ngăn ngừa các bệnh nhiễm trùng này phải được củng cố để tránh làm ảnh hưởng đến tiên lượng của bệnh nhân mắc ARDS. Tuy nhiên, việc giải thích các tài liệu phòng ngừa VAP trong bối cảnh này là một thách thức vì (1) không có nghiên cứu nào được thực hiện rõ ràng ở bệnh nhân ARDS; (2) một số biện pháp phòng ngừa đã được chứng minh là làm giảm tỷ lệ nhiễm trùng phổi, nhưng nhiều biện pháp ít chứng minh được tác động đến tiên lượng của bệnh nhân [105]. Nói như vậy, chiến lược chung để ngăn ngừa nhiễm trùng phổi cũng áp dụng cho bệnh nhân ARDS. Tuy nhiên, một số biện pháp phòng ngừa xứng đáng được chú trọng đặc biệt trong bối cảnh bệnh nhân ARDS (Hình 6): (1) chăm sóc răng miệng bằng chlorhexidine bị nghi ngờ làm trầm trọng thêm tình trạng suy hô hấp; (2) khử nhiễm tiêu hóa có chọn lọc (selective digestive decontamination − SDD) xứng đáng được thảo luận ở những bệnh nhân có nguy cơ cao như vậy, vì nó đã được chứng minh là có hiệu quả trong việc giảm tỷ lệ tử vong ở bệnh nhân ICU và có khả năng làm giảm tỷ lệ VAP.
Hình 6 Phòng ngừa nhiễm trùng phổi ở bệnh nhân ARDS: từ các biện pháp phòng ngừa được khuyến nghị cao đến thận trọng hoặc thậm chí không được khuyến nghị sử dụng
Không có biện pháp phòng ngừa duy nhất nào có thể ngăn chặn hoàn toàn nhiễm trùng phổi ở bệnh nhân mắc ARDS và bệnh nhân phải được tiếp cận với một gói hoặc gói biện pháp phòng ngừa [106] với điều kiện là chiến lược cai máy sớm là một phần của gói [107]. Các biện pháp phòng ngừa khác và đáng chú ý là một số thiết bị y tế đắt tiền như theo dõi áp suất bóng chèn ống nội khí quản tự động hoặc ống nội khí quản cho phép dẫn lưu dịch tiết dưới thanh môn chưa được chứng minh là có hiệu quả đối với kết cục của bệnh nhân (tỷ lệ tử vong, thời gian MV, sử dụng kháng sinh), nhưng có thể được dành riêng cho những trường hợp bệnh nhân nguy cơ cao. Tuy nhiên, việc biến nghiên cứu thành một gói chăm sóc hiệu quả để ngăn ngừa nhiễm trùng phổi vẫn là một thách thức và các cách tiếp cận hành vi để thực hiện các biện pháp cũng quan trọng như chính các biện pháp đó [108].
Việc sử dụng chlorhexidine-gluconate (CHG) để chăm sóc răng miệng ở bệnh nhân ICU có thể có hại mặc dù dữ liệu nhất quán trước đó cho thấy tác dụng có lợi của nó trong việc ngăn ngừa VAP [109]. Các tác dụng phụ niêm mạc miệng với nước súc miệng CHG 2% (w/v) trong ICU là thường xuyên, nhưng thường thoáng qua. Các tác dụng phụ được mô tả là tổn thương ăn mòn, loét, hình thành mảng bám (dễ dàng loại bỏ) và chảy máu niêm mạc ở 29 trong số 295 bệnh nhân (9,8%) nhận được 2% (w/v) CHG [110]. Một đánh giá có hệ thống và phân tích tổng hợp của Labeau và cộng sự năm 2011 đã đánh giá hiệu quả của việc khử trùng miệng bằng CHX [109]. Mười hai nghiên cứu đã được đưa vào (n = 2341). Nhìn chung, việc sử dụng CHX giúp giảm đáng kể nguy cơ VAP (RR = 0,67, KTC 95% 0,55– 0,94, p = 0,02). Các tác dụng có lợi rõ rệt hơn trong các phân tích phân nhóm đối với CHX 2% (RR = 0,53, KTC 95% 0,31–0,91) và đối với bệnh nhân phẫu thuật tim (RR = 0,41, KTC 95% 0,17– 0,98). Tuy nhiên, một phân tích tổng hợp gần đây cho thấy rằng CHG đường uống làm tăng nguy cơ tử vong một cách nghịch lý, điều này có thể do độc tính của CHG hít vào đường hô hấp dưới [111]. Do đó, vẫn chưa rõ liệu việc sử dụng CHG để chăm sóc răng miệng có ảnh hưởng đến kết quả ở những bệnh nhân bị bệnh nặng hay không.
Khử trùng tiêu hóa có chọn lọc (SDD) chắc chắn vẫn là một vấn đề gây tranh cãi [112]. Một mặt, nó làm giảm tỷ lệ tử vong ở những bệnh nhân thở máy, mặt khác, việc sử dụng nó bị hạn chế do khả năng gây ra nhiều vi khuẩn kháng thuốc hơn. Tuy nhiên, ở những bệnh nhân ARDS có nguy cơ tử vong cao với mức độ kháng thuốc cao của vi khuẩn, SDD đáng được đánh giá.
Việc hiểu rõ hơn về kiểu hình ARDS có thể tạo cơ hội để phát triển các biện pháp phòng ngừa có chọn lọc hơn trong tương lai.
Kết luận
Bội nhiễm phổi của bệnh nhân ARDS ảnh hưởng đáng kể đến tiên lượng của bệnh nhân. Nó được ưa chuộng bởi sự thay đổi hệ thống phòng thủ miễn dịch cục bộ và toàn thân.
Kết quả tồi tệ của ARDS với bội nhiễm phổi có lẽ liên quan đến việc thiếu các phương pháp chẩn đoán chính xác sớm và khó khăn trong việc tối ưu hóa liệu pháp. Bài viết này đã xem xét các kiến thức có sẵn và tiết lộ các lĩnh vực cho các cuộc điều tra trong tương lai về sinh lý bệnh, chẩn đoán, điều trị và phòng ngừa.
Tiềm năng cải tiến là rất nhiều trong tất cả các lĩnh vực:
Sinh lý bệnh
- Để nâng cao kiến thức về các yếu tố ký chủ (cả hệ thống và cục bộ) gây bội nhiễm.
- Để xác định sớm sự mất cân bằng giữa vật chủ và hệ vi sinh vật có thể thúc đẩy viêm phổi ở bệnh nhân
Chẩn đoán
- Phát hiện sớm các tiêu chí nghi ngờ VAP, VAT.
- Xác định thời điểm thích hợp để thực hiện các mẫu vi khuẩn học, và đặc biệt là phát triển phương pháp hình thái học để vạch mặt các vùng viêm phổi tại giường bệnh.
- Để xác định các xét nghiệm chẩn đoán mới giúp chẩn đoán sớm và chính xác bệnh viêm phổi.
- Để phát triển các phương pháp xác định mầm bệnh ban đầu chính xác và phân biệt bệnh nhân bị nhiễm bệnh và bệnh nhân đơn thuần (đặc biệt đối với virus và nấm).
Trị liệu
- Để đánh giá tác động của các phương pháp phân tử mới trong chẩn đoán viêm phổi ở bệnh nhân ARDS và cải thiện tiên lượng.
- Để đánh giá tác động của việc theo dõi TDM của kháng sinh đối với tiên lượng của bệnh nhân ARDS bị viêm phổi.
- Để phát triển các liệu pháp không dùng kháng sinh trong tương lai, bao gồm vắc-xin, kháng thể đơn dòng và liệu pháp
Phòng ngừa
- Đánh giá lợi ích của việc sử dụng kháng sinh và tiên lượng của việc sử dụng SDD ở bệnh nhân ARDS trong ICU có mức độ kháng vi khuẩn
Tài liệu tham khảo
- Thompson BT, Chambers RC, Liu KD (2017) Acute respiratory distress N Engl J Med 377:562–572. https://doi.org/10.1056/NEJMra1608077
- Magill SS, O’Leary E, Janelle SJ et al (2018) Changes in prevalence of health care-associated infections in US Hospitals. N Engl J Med 379:1732–1744. https://doi.org/10.1056/NEJMoa1801550
- Forel J-M, Voillet F, Pulina D et al (2012) Ventilator-associated pneumonia and ICU mortality in severe ARDS patients ventilated according to a lung-protective strategy. Crit Care 16:R65. https://doi.org/10.1186/cc11312
- Ayzac L, Girard R, Baboi L et al (2016) Ventilator-associated pneumonia in ARDS patients: the impact of prone positioning. A secondary analysis of the PROSEVA trial. Intensive Care Med 42:871–878. https://doi.org/10.1007/s00134-015-4167-5
- Papazian L, Klompas M, Luyt C-E (2020) Ventilator-associated pneumonia in adults: a narrative Intensive Care Med. https://doi.org/10.1007/s00134-020-05980-0
- Leliefeld PHC, Wessels CM, Leenen LPH et al (2016) The role of neutrophils in immune dysfunction during severe inflammation. Crit Care 20:73. https://doi.org/10.1186/s13054-016-1250-4
- Hotchkiss RS, Monneret G, Payen D (2013) Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic Lancet Infect Dis 13:260–268. https://doi.org/10.1016/S1473- 3099(13)70001-X
- Morris AC, Datta D, Shankar-Hari M et al (2018) Cell-surface signatures of immune dysfunction risk-stratify critically ill patients: INFECT Intensive Care Med 44:627–635. https://doi.org/10.1007/s00134-018- 5247-0
- Morris AC, Kefala K, Wilkinson TS et al (2009) C5a mediates peripheral blood neutrophil dysfunction in critically ill patients. Am J Respir Crit Care Med 180:19–28. https://doi.org/10.1164/rccm.200812-1928OC
- Vourc’h M, Roquilly A, Asehnoune K (2018) Trauma-induced damage-associated molecular patterns- mediated remote organ injury and immunosuppression in the acutely ill Front Immunol 9:1330. https://doi.org/10.3389/fimmu.2018.01330
- Bouras M, Asehnoune K, Roquilly A (2018) Contribution of dendritic cell responses to sepsis-induced immunosuppression and to susceptibility to secondary pneumonia. Front Immunol 9:2590. https://doi.org/10.3389/fimmu.2018.02590
- Roquilly A, Jacqueline C, Davieau M et al (2020) Alveolar macrophages are epigenetically altered after inflammation, leading to long-term lung immunoparalysis. Nat Immunol 21:636–648. https://doi.org/10.1038/s41590-020-0673-x
- Roquilly A, McWilliam HEG, Jacqueline C et al (2017) Local modulation of antigen-presenting cell development after resolution of pneumonia induces long-term susceptibility to secondary infections. Immunity 47:135-147.e5. https://doi.org/10.1016/j.immuni.2017.06.021
- Wood AJ, Vassallo AM, Ruchaud-Sparagano M-H et al (2020) C5a impairs phagosomal maturation in the neutrophil through phosphoproteomic remodelling. JCI Insight. https://doi.org/10.1172/jci.insight.137029
- Boomer JS, To K, Chang KC et al (2011) Immunosuppression in patients who die of sepsis and multiple organ failure. JAMA 306:2594–2605. https://doi.org/10.1001/jama.2011.1829
- Netea MG, Joosten LAB (2018) Trained immunity and local innate immune memory in the Cell 175:1463–1465. https://doi.org/10.1016/j.cell.2018.11.007
- Villar J, Ferrando C, Martínez D et al (2020) Dexamethasone treatment for the acute respiratory distress syndrome: a multicentre, randomised controlled trial. Lancet Respir Med 8:267–276. https://doi.org/10.1016/S2213-2600(19)30417-5
- The Lancet Respiratory Medicine (2019) Harnessing the microbiome for lung Lancet Respir Med 7:827. https://doi.org/10.1016/S2213-2600(19)30307-8
- Dickson RP, Singer BH, Newstead MW et al (2016) Enrichment of the lung microbiome with gut bacteria in sepsis and the acute respiratory distress syndrome. Nat Microbiol 1:16113. https://doi.org/10.1038/nmicrobiol.2016.113
- Dickson RP, Erb-Downward JR, Falkowski NR et al (2018) The lung microbiota of healthy mice are highly variable, cluster by environment, and reflect variation in baseline lung innate immunity. Am J Respir Crit Care Med 198:497–508. https://doi.org/10.1164/rccm.201711-2180OC
- Zakharkina T, Martin-Loeches I, Matamoros S et al (2017) The dynamics of the pulmonary microbiome during mechanical ventilation in the intensive care unit and the association with occurrence of Thorax 72:803–810. https://doi.org/10.1136/thoraxjnl-2016-209158
- Dickson RP, Schultz MJ, van der Poll T et al (2020) Lung microbiota predict clinical outcomes in critically ill patients. Am J Respir Crit Care Med 201:555–563. https://doi.org/10.1164/rccm.201907-1487OC
- Panzer AR, Lynch SV, Langelier C et al (2018) Lung microbiota is related to smoking status and to development of acute respiratory distress syndrome in critically ill trauma patients. Am J Respir Crit Care Med 197:621–631. https://doi.org/10.1164/rccm.201702-0441OC
- Luyt C-E, Combes A, Deback C et al (2007) Herpes simplex virus lung infection in patients undergoing
prolonged mechanical ventilation. Am J Respir Crit Care Med 175:935–942.
https://doi.org/10.1164/rccm.200609-1322OC - Luyt C-E, Combes A, Deback C et al (2007) Herpes simplex virus lung infection in patients undergoing prolonged mechanical ventilation. Am J Respir Crit Care Med 175:935–942. https://doi.org/10.1164/rccm.200609-1322OC
- Ravi A, Halstead FD, Bamford A et al (2019) Loss of microbial diversity and pathogen domination of the gut microbiota in critically ill patients. Microb Genom. https://doi.org/10.1099/mgen.0.000293
- Robak OH, Heimesaat MM, Kruglov AA et al (2018) Antibiotic treatment-induced secondary IgA deficiency enhances susceptibility to Pseudomonas aeruginosa pneumonia. J Clin Invest 128:3535–3545. https://doi.org/10.1172/JCI97065
- Roquilly A, Torres A, Villadangos JA et al (2019) Pathophysiological role of respiratory dysbiosis in hospital- acquired Lancet Respir Med 7:710–720. https://doi.org/10.1016/S2213-2600(19)30140-7
- Arulkumaran N, Routledge M, Schlebusch S et al (2020) Antimicrobial-associated harm in critical care: a narrative Intensive Care Med 46:225–235. https://doi.org/10.1007/s00134-020-05929-3
- van Nood E, Vrieze A, Nieuwdorp M et al (2013) Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 368:407–415. https://doi.org/10.1056/NEJMoa1205037
- Besselink MG, van Santvoort HC, Buskens E et al (2008) Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial. Lancet 371:651–659. https://doi.org/10.1016/S0140-6736(08)60207-X
- Yelin I, Flett KB, Merakou C et al (2019) Genomic and epidemiological evidence of bacterial transmission from probiotic capsule to blood in ICU Nat Med 25:1728–1732. https://doi.org/10.1038/s41591- 019-0626-9
- Madotto F, Rezoagli E, Pham T et al (2020) Hyperoxemia and excess oxygen use in early acute respiratory distress syndrome: insights from the LUNG SAFE study. Critical Care (London, England) 24:125. https://doi.org/10.1186/s13054-020-2826-6
- Girardis M, Busani S, Damiani E et al (2016) Effect of conservative vs conventional oxygen therapy on mortality among patients in an intensive care unit: the oxygen-ICU randomized clinical JAMA 316:1583– 1589. https://doi.org/10.1001/jama.2016.11993
- Asfar P, Schortgen F, Boisramé-Helms J et al (2017) Hyperoxia and hypertonic saline in patients with septic shock (HYPERS2S): a two-by-two factorial, multicentre, randomised, clinical Lancet Respir Med. https://doi.org/10.1016/S2213-2600(17)30046-2
- ICU-ROX Investigators and the Australian and New Zealand Intensive Care Society Clinical Trials Group M, Mackle D, Bellomo R et al (2020) Conservative oxygen therapy during mechanical ventilation in the N Engl J Med 382:989–998. https://doi.org/10.1056/NEJMoa1903297
- Young P, Mackle D, Bellomo R et al (2020) Conservative oxygen therapy for mechanically ventilated adults with sepsis: a post hoc analysis of data from the intensive care unit randomized trial comparing two approaches to oxygen therapy (ICU-ROX). Intensive Care Med 46:17–26. https://doi.org/10.1007/s00134- 019-05857-x
- Kallet RH (2013) Adjunct therapies during mechanical ventilation: airway clearance techniques, therapeutic aerosols, and Respir Care 58:1053–1073. https://doi.org/10.4187/respcare.02217
- Entezari M, Javdan M, Antoine DJ et al (2014) Inhibition of extracellular HMGB1 attenuates hyperoxia- induced inflammatory acute lung injury. Redox Biol 2:314–322. https://doi.org/10.1016/j.redox.2014.01.013
- Six S, Jaffal K, Ledoux G et al (2016) Hyperoxemia as a risk factor for ventilator-associated pneumonia. Crit
Care. https://doi.org/10.1186/s13054-016-1368-4 - Kikuchi Y, Tateda K, Fuse ET et al (2009) Hyperoxia exaggerates bacterial dissemination and lethality in Pseudomonas aeruginosa pneumonia. Pulm Pharmacol Ther 22:333–339. https://doi.org/10.1016/j.pupt.2008.12.021
- Six S, Jaffal K, Ledoux G et al (2016) Hyperoxemia as a risk factor for ventilator-associated Crit Care. https://doi.org/10.1186/s13054-016-1368-4
- Mounier R, Adrie C, Français A et al (2010) Study of prone positioning to reduce ventilator-associated pneumonia in hypoxaemic patients. Eur Respir J 35:795–804. https://doi.org/10.1183/09031936.00057509
- Fernandez R, Trenchs X, Klamburg J et al (2008) Prone positioning in acute respiratory distress syndrome: a multicenter randomized clinical trial. Intensive Care Med. https://doi.org/10.1007/S00134-008-1119-3
- Guerin C, Gaillard S, Lemasson S et al (2004) Effects of systematic prone positioning in hypoxemic acute respiratory failure: a randomized controlled trial. JAMA 292:2379–2387. https://doi.org/10.1001/jama.292.19.2379
- Voggenreiter G, Aufmkolk M, Stiletto RJ et al (2005) Prone positioning improves oxygenation in post- traumatic lung injury—a prospective randomized trial. J Trauma 59:333–341. https://doi.org/10.1097/01.ta.0000179952.95921.49
- Fernando SM, Tran A, Cheng W et al (2020) Diagnosis of ventilator-associated pneumonia in critically ill adult patients-a systematic review and meta-analysis. Intensive Care Med 46:1170–1179. https://doi.org/10.1007/s00134-020-06036-z
- Browne E, Hellyer TP, Baudouin SV et al (2014) A national survey of the diagnosis and management of suspected ventilator-associated pneumonia. BMJ Open Respir Res 1:e000066. https://doi.org/10.1136/bmjresp-2014-000066
- Berton DC, Kalil AC, Teixeira PJZ (2014) Quantitative versus qualitative cultures of respiratory secretions for clinical outcomes in patients with ventilator-associated pneumonia. Cochrane Database Syst Rev. https://doi.org/10.1002/14651858.CD006482.pub4
- Luyt C-E, Hékimian G, Bonnet I et al (2020) Usefulness of point-of-care multiplex PCR to rapidly identify pathogens responsible for ventilator-associated pneumonia and their resistance to antibiotics: an observational Crit Care 24:378. https://doi.org/10.1186/s13054-020-03102-2
- Conway Morris A, Gadsby N, McKenna JP et al (2017) 16S pan-bacterial PCR can accurately identify patients with ventilator-associated pneumonia. Thorax 72:1046–1048. https://doi.org/10.1136/thoraxjnl-2016- 209065
- Peiffer-Smadja N, Bouadma L, Mathy V et al (2020) Performance and impact of a multiplex PCR in ICU patients with ventilator-associated pneumonia or ventilated hospital-acquired pneumonia. Crit Care 24:366. https://doi.org/10.1186/s13054-020-03067-2
- Schauwvlieghe AFAD, Rijnders BJA, Philips N et al (2018) Invasive aspergillosis in patients admitted to the intensive care unit with severe influenza: a retrospective cohort study. Lancet Respir Med 6:782–792. https://doi.org/10.1016/S2213-2600(18)30274-1
- Meduri GU, Reddy RC, Stanley T, El-Zeky F (1998) Pneumonia in acute respiratory distress A prospective evaluation of bilateral bronchoscopic sampling. Am J Respir Crit Care Med 158:870–875. https://doi.org/10.1164/ajrccm.158.3.9706112
- Rebetz J, Semple JW, Kapur R (2018) The pathogenic involvement of neutrophils in acute respiratory distress syndrome and transfusion-related acute lung injury. Transfus Med Hemother 45:290–298. https://doi.org/10.1159/000492950
- Luyt C-E, Hékimian G, Koulenti D, Chastre J (2018) Microbial cause of ICU-acquired pneumonia: hospitalacquired pneumonia versus ventilator-associated pneumonia. Curr Opin Crit Care 24:332–338.
https://doi.org/10.1097/MCC.0000000000000526 - Morris AC, Kefala K, Wilkinson TS et al (2010) Diagnostic importance of pulmonary interleukin-1beta and interleukin-8 in ventilator-associated pneumonia. Thorax 65:201–207. https://doi.org/10.1136/thx.2009.122291
- Hellyer TP, McAuley DF, Walsh TS et al (2020) Biomarker-guided antibiotic stewardship in suspected ventilator-associated pneumonia (VAPrapid2): a randomised controlled trial and process Lancet Respir Med 8:182–191. https://doi.org/10.1016/S2213-2600(19)30367-4
- Luyt C-E, Hékimian G, Koulenti D, Chastre J (2018) Microbial cause of ICU-acquired pneumonia: hospital- acquired pneumonia versus ventilator-associated pneumonia. Curr Opin Crit Care 24:332–338. https://doi.org/10.1097/MCC.0000000000000526
- Markowicz P, Wolff M, Djedaïni K et al (2000) Multicenter prospective study of ventilator-associated pneumonia during acute respiratory distress syndrome. Incidence, prognosis, and risk factors. ARDS study group. Am J Respir Crit Care Med 161:1942–1948. https://doi.org/10.1164/ajrccm.161.6.9909122
- Schmidt M, Bréchot N, Hariri S et al (2012) Nosocomial infections in adult cardiogenic shock patients supported by venoarterial extracorporeal membrane oxygenation. Clin Infect Dis 55:1633–1641. https://doi.org/10.1093/cid/cis783
- Rodloff AC, Dowzicky MJ (2017) Antimicrobial susceptibility among european gram-negative and gram- positive isolates collected as part of the Tigecycline Evaluation and Surveillance Trial (2004–2014). Chemotherapy 62:1–11. https://doi.org/10.1159/000445022
- Sader HS, Castanheira M, Arends SJR et al (2019) Geographical and temporal variation in the frequency and antimicrobial susceptibility of bacteria isolated from patients hospitalized with bacterial pneumonia: results from 20 years of the SENTRY Antimicrobial Surveillance Program (1997–2016). J Antimicrob Chemother 74:1595–1606. https://doi.org/10.1093/jac/dkz074
- Marston HD, Dixon DM, Knisely JM et al (2016) Antimicrobial JAMA 316:1193–1204. https://doi.org/10.1001/jama.2016.11764
- Rodríguez-Núñez O, Periañez-Parraga L, Oliver A et al (2019) Higher MICs (> 2 mg/L) predict 30-day mortality in patients with lower respiratory tract infections caused by multidrug- and extensively drug- resistant Pseudomonas aeruginosa treated with ceftolozane/tazobactam. Open Forum Infect Dis 6:ofz416. https://doi.org/10.1093/ofid/ofz416
- Kelly BJ, Imai I, Bittinger K et al (2016) Composition and dynamics of the respiratory tract microbiome in intubated Microbiome 4:7. https://doi.org/10.1186/s40168-016-0151-8
- Keane S, Vallecoccia MS, Nseir S, Martin-Loeches I (2018) How can we distinguish ventilator-associated tracheobronchitis from pneumonia? Clin Chest Med 39:785–796. https://doi.org/10.1016/j.ccm.2018.08.003
- Keane S, Martin-Loeches I (2019) Host-pathogen interaction during mechanical ventilation: systemic or compartmentalized response? Crit Care 23:134. https://doi.org/10.1186/s13054-019-2410-0
- Zampieri FG, Póvoa P, Salluh JI et al (2020) Lower respiratory tract infection and short-term outcome in patients with acute respiratory distress syndrome. J Intensive Care Med 35:588–594. https://doi.org/10.1177/0885066618772498
- Eyre DW, Sheppard AE, Madder H et al (2018) A Candida auris outbreak and its control in an intensive care setting. N Engl J Med 379:1322–1331. https://doi.org/10.1056/NEJMoa1714373
- Li Q, Guan X, Wu P et al (2020) Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. N Engl J Med 382:1199–1207. https://doi.org/10.1056/NEJMoa2001316
- Lugosi M, Alberti C, Zahar J-R et al (2014) Aspergillus in the lower respiratory tract of immunocompetent
critically ill patients. J Infect 69:284–292. https://doi.org/10.1016/j.jinf.2014.04.010 - McGann P, Snesrud E, Maybank R et al (2016) Escherichia coli harboring mcr-1 and blaCTX-M on a novel IncF plasmid: first report of mcr-1 in the United States. Antimicrob Agents Chemother 60:4420–4421. https://doi.org/10.1128/AAC.01103-16
- Arabi YM, Balkhy HH, Hayden FG et al (2017) Middle east respiratory N Engl J Med 376:584–594. https://doi.org/10.1056/NEJMsr1408795
- Wilson MR, Sample HA, Zorn KC et al (2019) Clinical metagenomic sequencing for diagnosis of meningitis and encephalitis. N Engl J Med 380:2327–2340. https://doi.org/10.1056/NEJMoa1803396
- Lugosi M, Alberti C, Zahar J-R et al (2014) Aspergillus in the lower respiratory tract of immunocompetent critically ill patients. J Infect 69:284–292. https://doi.org/10.1016/j.jinf.2014.04.010
- Camargo JF, Husain S (2014) Immune correlates of protection in human invasive Clin Infect Dis 59:569–577. https://doi.org/10.1093/cid/ciu337
- Martin-Loeches I, Schultz J, Vincent J-L et al (2017) Increased incidence of co-infection in critically ill patients with influenza. Intensive Care Med 43:48–58. https://doi.org/10.1007/s00134-016-4578-y
- Contou D, Dorison M, Rosman J et al (2016) Aspergillus-positive lower respiratory tract samples in patients with the acute respiratory distress syndrome: a 10-year retrospective study. Ann Intensive Care 6:52. https://doi.org/10.1186/s13613-016-0156-2
- de Hemptinne Q, Remmelink M, Brimioulle S et al (2009) ARDS: a clinicopathological Chest 135:944–949. https://doi.org/10.1378/chest.08-1741
- Limaye AP, Kirby KA, Rubenfeld GD et al (2008) Cytomegalovirus reactivation in critically ill immunocompetent patients. JAMA 300:413–422. https://doi.org/10.1001/jama.300.4.413
- Ong DSY, Bonten MJM, Spitoni C et al (2017) Epidemiology of multiple herpes viremia in previously immunocompetent patients with septic shock. Clin Infect Dis 64:1204–1210. https://doi.org/10.1093/cid/cix120
- Papazian L, Hraiech S, Lehingue S et al (2016) Cytomegalovirus reactivation in ICU Intensive Care Med 42:28–37. https://doi.org/10.1007/s00134-015-4066-9
- Luyt C-E, Forel J-M, Hajage D et al (2019) Acyclovir for mechanically ventilated patients with herpes simplex virus oropharyngeal reactivation: a randomized clinical trial. JAMA Intern Med. https://doi.org/10.1001/jamainternmed.2019.5713
- Cowley NJ, Owen A, Shiels SC et al (2017) Safety and efficacy of antiviral therapy for prevention of cytomegalovirus reactivation in immunocompetent critically ill patients: a randomized clinical trial. JAMA Intern Med 177:774–783. https://doi.org/10.1001/jamainternmed.2017.0895
- Limaye AP, Stapleton RD, Peng L et al (2017) Effect of ganciclovir on IL-6 levels among cytomegalovirus- seropositive adults with critical illness: a randomized clinical trial. JAMA 318:731–740. https://doi.org/10.1001/jama.2017.10569
- Loubet P, Voiriot G, Houhou-Fidouh N et al (2017) Impact of respiratory viruses in hospital-acquired pneumonia in the intensive care unit: a single-center retrospective study. J Clin Virol 91:52–57. https://doi.org/10.1016/j.jcv.2017.04.001
- Papazian L, Aubron C, Brochard L et al (2019) Formal guidelines: management of acute respiratory distress syndrome. Ann Intensive Care 9:69. https://doi.org/10.1186/s13613-019-0540-9
- Combes A, Hajage D, Capellier G et al (2018) Extracorporeal membrane oxygenation for severe acute respiratory distress N Engl J Med 378:1965–1975. https://doi.org/10.1056/NEJMoa1800385
- Bouglé A, Bombled C, Margetis D et al (2018) Ventilator-associated pneumonia in patients assisted by venoarterial extracorporeal membrane oxygenation support: Epidemiology and risk factors of treatment failure.
PLoS ONE 13:e0194976. https://doi.org/10.1371/journal.pone.0194976 - Bizzarro MJ, Conrad SA, Kaufman DA, Rycus P (2011) Infections acquired during extracorporeal membrane oxygenation in neonates, children, and adults. Pediatr Crit Care Med 12:277–281. https://doi.org/10.1097/PCC.0b013e3181e28894
- Al-Fares A, Pettenuzzo T, Del Sorbo L (2019) Extracorporeal life support and systemic Intensive Care Med Exp 7:46. https://doi.org/10.1186/s40635-019-0249-y
- Grasselli G, Scaravilli V, Di Bella S et al (2017) Nosocomial infections during extracorporeal membrane oxygenation: incidence, etiology, and impact on patients’ outcome. Crit Care Med 45:1726–1733. https://doi.org/10.1097/CCM.0000000000002652
- Schmidt M, Brechot N, Hariri S et al (2012) Nosocomial infections in adult cardiogenic shock patients supported by venoarterial extracorporeal membrane oxygenation. Clin Infect Dis 55:1633–1641. https://doi.org/10.1093/cid/cis783
- Bouglé A, Bombled C, Margetis D et al (2018) Ventilator-associated pneumonia in patients assisted by veno- arterial extracorporeal membrane oxygenation support: Epidemiology and risk factors of treatment failure. PLoS ONE 13:e0194976. https://doi.org/10.1371/journal.pone.0194976
- Aubron C, Cheng AC, Pilcher D et al (2013) Infections acquired by adults who receive extracorporeal membrane oxygenation: risk factors and outcome. Infect Control Hosp Epidemiol 34:24–30. https://doi.org/10.1086/668439
- Schmidt M, Schellongowski P, Patroniti N et al (2018) Six-month outcome of immunocompromised severe ARDS patients rescued by An international multicenter retrospective study. Am J Respir Crit Care Med. https://doi.org/10.1164/rccm.201708-1761OC
- Shekar K, Fraser JF, Smith MT, Roberts JA (2012) Pharmacokinetic changes in patients receiving extracorporeal membrane oxygenation. J Crit Care 27(741):e9-18. https://doi.org/10.1016/j.jcrc.2012.02.013
- Craig WA (1998) Pharmacokinetic/pharmacodynamic parameters: rationale for antibacterial dosing of mice and Clin Infect Dis 26:1–10. https://doi.org/10.1086/516284(quiz 11–12)
- Blot SI, Pea F, Lipman J (2014) The effect of pathophysiology on pharmacokinetics in the critically ill patient– concepts appraised by the example of antimicrobial agents. Adv Drug Deliv Rev 77:3–11. https://doi.org/10.1016/j.addr.2014.07.006
- Heffernan AJ, Sime FB, Lipman J et al (2019) Intrapulmonary pharmacokinetics of antibiotics used to treat nosocomial pneumonia caused by Gram-negative bacilli: a systematic review. Int J Antimicrob Agents 53:234–245. https://doi.org/10.1016/j.ijantimicag.2018.11.011
- Rodvold KA, George JM, Yoo L (2011) Penetration of anti-infective agents into pulmonary epithelial lining fluid: focus on antibacterial Clin Pharmacokinet 50:637–664. https://doi.org/10.2165/11594090- 000000000-00000
- Dhanani JA, Cohen J, Parker SL et al (2018) A research pathway for the study of the delivery and disposition of nebulised antibiotics: an incremental approach from in vitro to large animal Intensive Care Med Exp 6:17. https://doi.org/10.1186/s40635-018-0180-7
- Kollef MH, Ricard J-D, Roux D et al (2017) A randomized trial of the amikacin fosfomycin inhalation system for the adjunctive therapy of Gram-negative ventilator-associated pneumonia: IASIS trial. Chest 151:1239– 1246. https://doi.org/10.1016/j.chest.2016.11.026
- Niederman MS, Alder J, Bassetti M et al (2020) Inhaled amikacin adjunctive to intravenous standard-of-care antibiotics in mechanically ventilated patients with Gram-negative pneumonia (INHALE): a double-blind,
- Kalil AC, Metersky ML, Klompas M et al (2016) Management of adults with hospital-acquired and ventilatorassociated pneumonia: 2016 clinical practice guidelines by the infectious diseases Society of America and the
American Thoracic Society. Clin Infect Dis 63:e61–e111. https://doi.org/10.1093/cid/ciw353 - randomised, placebo-controlled, phase 3, superiority trial. Lancet Infect Dis 20:330–340. https://doi.org/10.1016/S1473-3099(19)30574-2
- Dhanani J, Fraser JF, Chan H-K et al (2016) Fundamentals of aerosol therapy in critical Crit Care 20:269. https://doi.org/10.1186/s13054-016-1448-5
- Stockmann C, Roberts JK, Yellepeddi VK, Sherwin CMT (2015) Clinical pharmacokinetics of inhaled antimicrobials. Clin Pharmacokinet 54:473–492. https://doi.org/10.1007/s40262-015-0250-x
- Rouby J-J, Bouhemad B, Monsel A et al (2012) Aerosolized antibiotics for ventilator-associated pneumonia: lessons from experimental studies. Anesthesiology 117:1364–1380. https://doi.org/10.1097/ALN.0b013e3182755d7a
- Selting K, Waldrep JC, Reinero C et al (2008) Feasibility and safety of targeted cisplatin delivery to a select lung lobe in dogs via the AeroProbe intracorporeal nebulization catheter. J Aerosol Med Pulm Drug Deliv 21:255–268. https://doi.org/10.1089/jamp.2008.0684
- Bouadma L, Wolff M, Lucet J-C (2012) Ventilator-associated pneumonia and its Curr Opin Infect Dis 25:395–404. https://doi.org/10.1097/QCO.0b013e328355a835
- Kalil AC, Metersky ML, Klompas M et al (2016) Management of adults with hospital-acquired and ventilator- associated pneumonia: 2016 clinical practice guidelines by the infectious diseases Society of America and the American Thoracic Society. Clin Infect Dis 63:e61–e111. https://doi.org/10.1093/cid/ciw353
- Leone M, Bouadma L, Bouhemad B et al (2018) Brief summary of French guidelines for the prevention, diagnosis and treatment of hospital-acquired pneumonia in ICU. Ann Intensive Care 8:104. https://doi.org/10.1186/s13613-018-0444-0
- Bouadma L, Mourvillier B, Deiler V et al (2010) Changes in knowledge, beliefs, and perceptions throughout a multifaceted behavioral program aimed at preventing ventilator-associated Intensive Care Med 36:1341–1347. https://doi.org/10.1007/s00134-010-1890-9
- Labeau SO, Van de Vyver K, Brusselaers N et al (2011) Prevention of ventilator-associated pneumonia with oral antiseptics: a systematic review and meta-analysis. Lancet Infect Dis 11:845–854. https://doi.org/10.1016/S1473-3099(11)70127-X
- Plantinga NL, Wittekamp BHJ, Leleu K et al (2016) Oral mucosal adverse events with chlorhexidine 2% mouthwash in ICU. Intensive Care Med 42:620–621. https://doi.org/10.1007/s00134-016-4217-7
- Klompas M, Speck K, Howell MD et al (2014) Reappraisal of routine oral care with chlorhexidine gluconate for patients receiving mechanical ventilation: systematic review and meta-analysis. JAMA Intern Med 174:751–761. https://doi.org/10.1001/jamainternmed.2014.359
- Timsit J-F, Bassetti M (2018) Antipathy against SDD is justified: Intensive Care Med 44:1165–1168. https://doi.org/10.1007/s00134-018-5183-z
- Gibot S, Cravoisy A, Levy B et al (2004) Soluble triggering receptor expressed on myeloid cells and the diagnosis of pneumonia. N Engl J Med 350:451–458. https://doi.org/10.1056/NEJMoa031544
- Oudhuis GJ, Beuving J, Bergmans D et al (2009) Soluble triggering receptor expressed on myeloid cells-1 in bronchoalveolar lavage fluid is not predictive for ventilator-associated pneumonia. Intensive Care Med 35:1265–1270. https://doi.org/10.1007/s00134-009-1463-y
- van Oort PM, Povoa P, Schnabel R et al (2018) The potential role of exhaled breath analysis in the diagnostic process of pneumonia-a systematic review. J Breath Res 12:024001. https://doi.org/10.1088/1752- 7163/aaa499
- Ye W, Huang Q-D, Tang T-Y, Qin G-Y (2020) Diagnostic value of pentraxin 3 in respiratory tract infections: a meta-analysis. Medicine (Baltimore) 99:e19532. https://doi.org/10.1097/MD.0000000000019532
- Radhakrishnan M, Jaganath A, Rao GSU, Kumari HBV (2008) Nebulized imipenem to control nosocomial
pneumonia caused by Pseudomonas aeruginosa. J Crit Care 23:148–150.
https://doi.org/10.1016/j.jcrc.2007.10.037 - Grover V, Pantelidis P, Soni N et al (2014) A biomarker panel (Bioscore) incorporating monocytic surface and soluble TREM-1 has high discriminative value for ventilator-associated pneumonia: a prospective observational study. PLoS ONE 9:e109686. https://doi.org/10.1371/journal.pone.0109686
- Salluh JIF, Souza-Dantas VC, Póvoa P (2017) The current status of biomarkers for the diagnosis of nosocomial pneumonias. Curr Opin Crit Care 23:391–397. https://doi.org/10.1097/MCC.0000000000000442
- Máiz L, Del Campo R, Castro M et al (2012) Maintenance treatment with inhaled ampicillin in patients with cystic fibrosis and lung infection due to methicillin-sensitive Staphylococcus aureus. Arch Bronconeumol 48:384. https://doi.org/10.1016/j.arbres.2012.04.002
- Horianopoulou M, Kanellopoulou M, Paraskevopoulos I et al (2004) Use of inhaled ampicillin-sulbactam against multiresistant Acinetobacter baumannii in bronchial secretions of intensive care unit Clin Microbiol Infect 10:85–86. https://doi.org/10.1111/j.1469-0691.2004.00806.x
- Claridge JA, Edwards NM, Swanson J et al (2007) Aerosolized ceftazidime prophylaxis against ventilator- associated pneumonia in high-risk trauma patients: results of a double-blind randomized Surg Infect (Larchmt) 8:83–90. https://doi.org/10.1089/sur.2006.042
- Wood GC, Boucher BA, Croce MA et al (2002) Aerosolized ceftazidime for prevention of ventilator-associated pneumonia and drug effects on the proinflammatory response in critically ill trauma patients. Pharmacotherapy 22:972–982
- Lu Q, Yang J, Liu Z et al (2011) Nebulized ceftazidime and amikacin in ventilator-associated pneumonia caused by Pseudomonas aeruginosa. Am J Respir Crit Care Med 184:106–115. https://doi.org/10.1164/rccm.201011-1894OC
- Radhakrishnan M, Jaganath A, Rao GSU, Kumari HBV (2008) Nebulized imipenem to control nosocomial pneumonia caused by Pseudomonas aeruginosa. J Crit Care 23:148–150. https://doi.org/10.1016/j.jcrc.2007.10.037
- Geller DE, Flume PA, Staab D et al (2011) Levofloxacin inhalation solution (MP-376) in patients with cystic fibrosis with Pseudomonas aeruginosa. Am J Respir Crit Care Med 183:1510–1516. https://doi.org/10.1164/rccm.201008-1293OC
- Palmer LB, Smaldone GC (2014) Reduction of bacterial resistance with inhaled antibiotics in the intensive care unit. Am J Respir Crit Care Med 189:1225–1233. https://doi.org/10.1164/rccm.201312-2161OC
- Palmer LB, Smaldone GC, Chen JJ et al (2008) Aerosolized antibiotics and ventilator-associated tracheobronchitis in the intensive care unit. Crit Care Med 36:2008–2013. https://doi.org/10.1097/CCM.0b013e31817c0f9e
- Hallal A, Cohn SM, Namias N et al (2007) Aerosolized tobramycin in the treatment of ventilator-associated pneumonia: a pilot Surg Infect (Larchmt) 8:73–82. https://doi.org/10.1089/sur.2006.051
- Rouby JJ, Sole-Lleonart C, Rello J, Network EI, for Nebulized Antibiotics in Ventilator-associated Pneumonia (2020) Ventilator-associated pneumonia caused by multidrug-resistant Gram-negative bacteria: understanding nebulization of aminoglycosides and colistin. Intensive Care Med 46:766–770. https://doi.org/10.1007/s00134-019-05890-w
- McCoy KS, Quittner AL, Oermann CM et al (2008) Inhaled aztreonam lysine for chronic airway Pseudomonas aeruginosa in cystic fibrosis. Am J Respir Crit Care Med 178:921–928. https://doi.org/10.1164/rccm.200712-1804OC