Bệnh da liễu
Laser mạch máu và điều trị ban đỏ – Bs. Trương Minh Tấn Vũ
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Biên dịch: Bác sĩ Trương Minh Tấn Vũ
nhathuocngocanh.com – Để tải file PDF của bài viết Laser mạch máu và điều trị ban đỏ, xin vui lòng click vào link ở đây.
Lựa chọn bước sóng
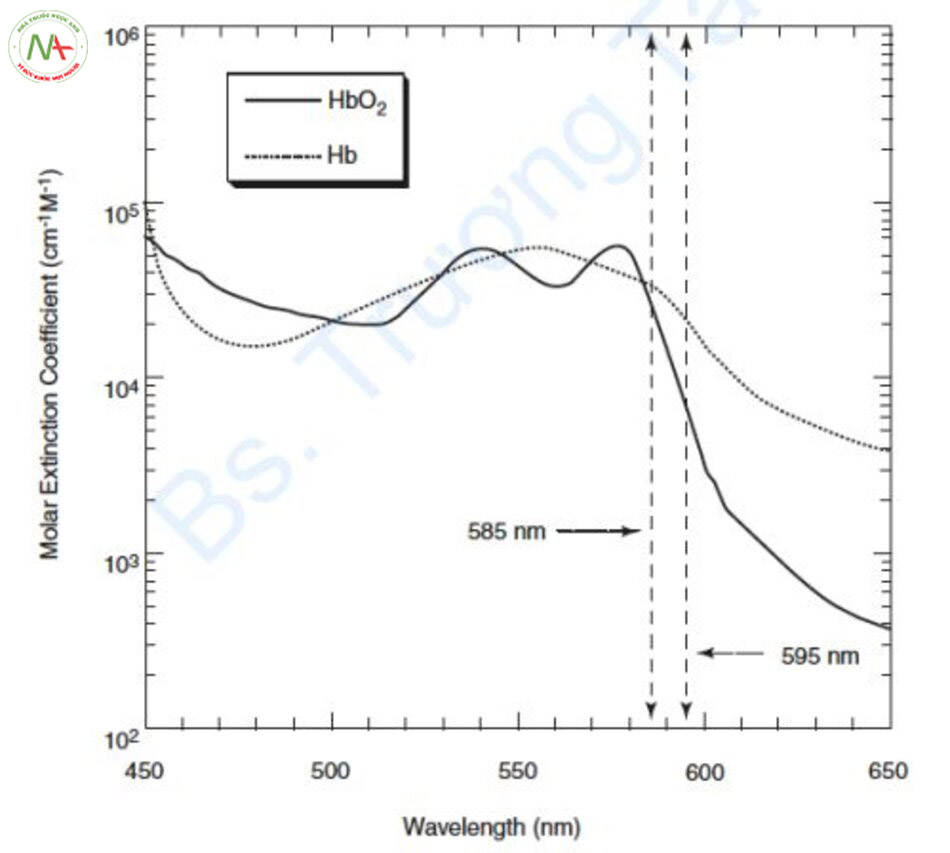
Đường cong hấp thụ của Hemoglobin
Hemoglobin (Hb) bao gồm oxyhemoglobin liên kết với oxy (HbO2), deoxyhemoglobin không có oxy (deoxyHb) và methemoglobin (metHb) bị biến tính protein bởi nhiệt. Đường cong hấp thụ của HbO2 đạt điểm cực đại ở 418 nm, đạt điểm cực đại nhỏ hơn ở 542 nm và 577 nm, sau đó giảm dần, và cuối cùng đạt điểm cực đại nhỏ hơn ở 940 nm. DeoxyHb đạt điểm cực đại ở 430 và 555 nm và đạt điểm cực đại một lần nữa giữa 800 và 1200 nm (Hình 6.1) [1, 2].
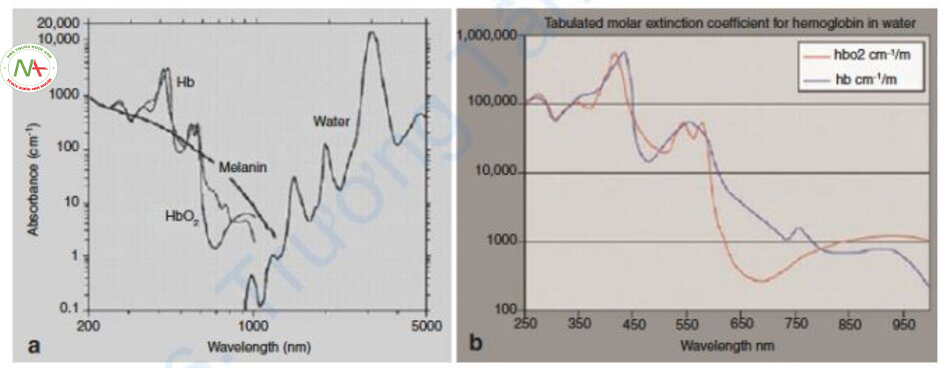
HbO2 chiếm 99% Hb trong máu động mạch và 60–70% trong máu tĩnh mạch. DeoxyHb chiếm phần còn lại của Hb. Nói cách khác, vì deoxyHb không chiếm hết phần Hb trong tĩnh mạch nên khi sử dụng thực tế laser mạch máu, hệ số hấp thụ của HbO2 được sử dụng chủ yếu trong máu tĩnh mạch hơn là hệ số hấp thụ của deoxyHb [4].
Khi lựa chọn bước sóng, laser có hệ số hấp thụ cao nhất trong đường cong hấp thụ của một nhóm chromophore cụ thể có thể bị nhầm lẫn là laser tốt nhất. Tuy nhiên, xem xét các nguyên lý của laser, nếu chỉ có một hệ số hấp thụ cho một chromophore cụ thể, thì ngay cả một laser cóhệ sốhấp thụ thấp cũng cóthể làm tăng nhiệt độcủa chromophore
bằng cách tăng đáng kể mật độ năng lượng. Do đó, bất kỳ laser nào có hệ số hấp thụ đối với Hb đều có thể được sử dụng làm laser mạch máu.
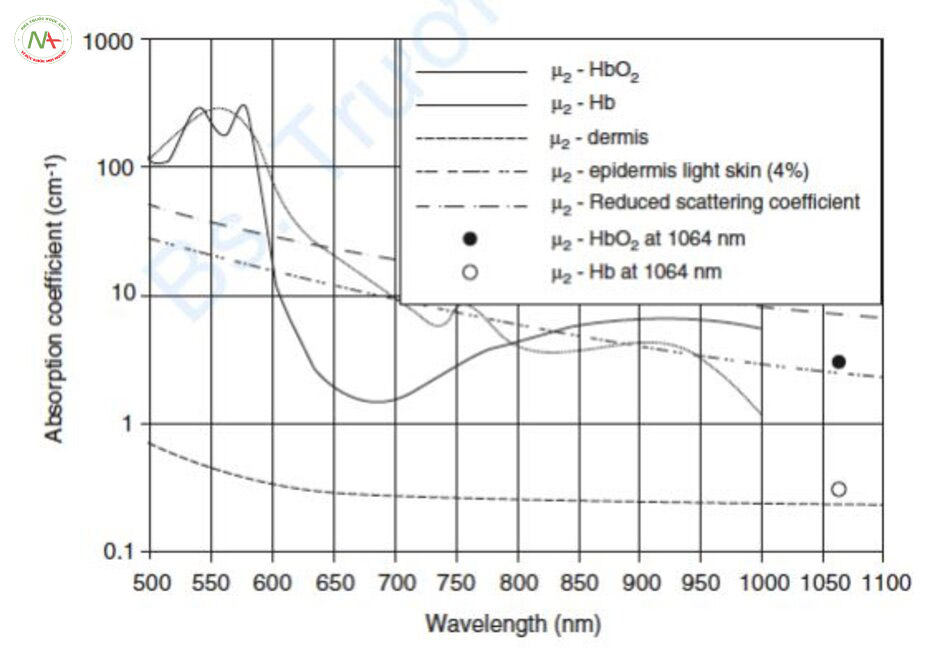
Tất nhiên, lựa chọn laser có bước sóng trong hệ số hấp thụ của mô đích cao hơn so với mô xung quanh có thể gây tổn thương mô đích một cách chọn lọc. Khi giải thích đường cong hấp thụ của HbO2, có thể bị hiểu nhầm rằng chỉ có thể sử dụng các loại laser có bước sóng 500–600 nm (ánh sáng xanh lục-vàng) có độ hấp thụ Hb cao hơn melanin làm laser mạch máu và không thể sử dụng laser cận hồng ngoại (NIR) làm laser mạch máu hoặc có tác dụng phụ.
Trong một tài liệu về quang nhiệt có chọn lọc, Richard R. Anderson đã nói rằng hệ số hấp thụ của mục tiêu và các mô xung quanh phải khác nhau hơn mười lần và ít nhất hai lần để có thể áp dụng cho lý thuyết quang nhiệt chọn lọc [5].
Về mặt mô học, mô xung quanh bên cạnh mạch máu không phải là hắc tố mà là lớp bì không có mạch máu. Khi tỷ lệ hệ số hấp thụ giữa mạch máu và lớp bì chênh lệch nhau hơn mười lần hoặc hơn hai lần, thì laser bước sóng 500–600 nm và laser NIR đều có thể được sử dụng như laser mạch máu và thậm chí là laser ruby với hệ số hấp thụ thấp nhất với Hb cũng có thể điều trị các mạch máu về mặt lý thuyết (Hình 6.2). Tất nhiên, các photon của tia laser di chuyển qua lớp biểu bì và vào lớp bì, do đó lớp biểu bì cũng là một mô cạnh tranh. Tuy nhiên, theo nghĩa chặt chẽ, toàn bộ lớp biểu bì bao gồm cả melanin, là mô cạnh tranh. Đường cong hấp thụ của toàn bộ lớp biểu bì được biểu diễn bằng đường chấm (- •• – •• -) trong Hình 6.2. Do đó, có thể sử dụng laser có bước sóng 500–600 nm và laser có bước sóng từ 850 nm trở lên để điều trị mạch máu.
Đường cong hấp thụ của Methemoglobin
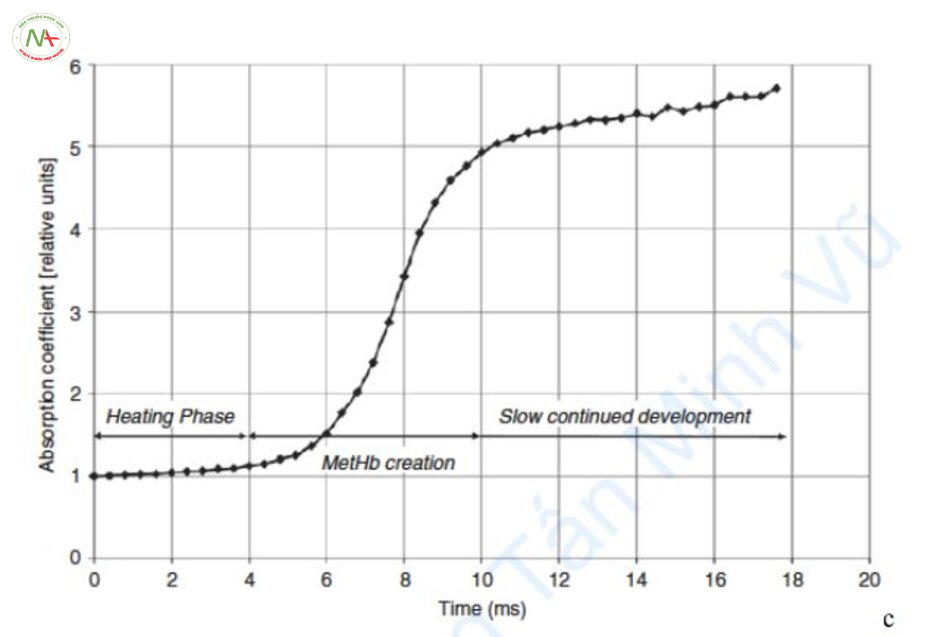
Chiếu laser vào máu tạo ra metHb [7]. Đường cong hấp thụ của metHb thấp hơn HbO2 và deoxyHb ở bước sóng 500–600 nm và cao hơn ở vùng hồng ngoại gần (Hình 6.3). Hiện tượng dịch chuyển đường cong hấp thụ sang phải được gọi là dịch chuyển phổ hấp thụ hay dịch chuyển hướng màu đỏ [8].
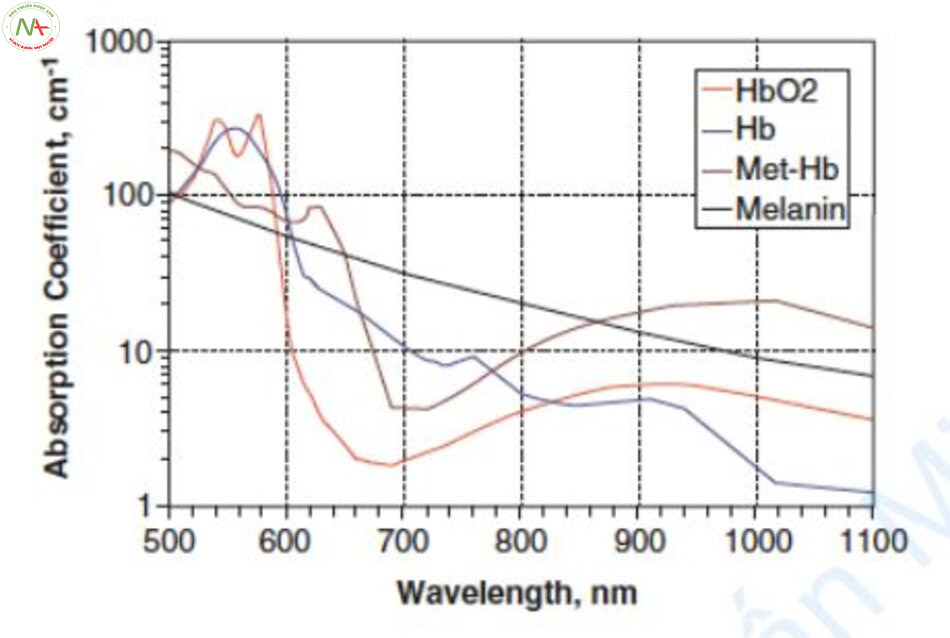
Có ba phương pháp điều trị mạch máu bằng cách sử dụng dịch chuyển phổ hấp thụ. Thứ nhất, metHb được tạo ra bằng cách chiếu tia laser 595nm và sau đó chiếu tia laser 1064 nm trong vùng hồng ngoại gần với hệ số hấp thụ cao. Laser sử dụng nguyên lý này là laser kết hợp bước sóng 595nm và 1064nm (Cynergy™, Cynosure, Chelmsford, MA, USA) [7]. Thứ hai, một loại IPL mới đây sử dụng metHb bằng cách giảm sự dịch chuyển quang phổ và tạo ra hai dải bước sóng 500–670nm và 870–1200 nm (Icon ™, Cynosure, Westford, MA). Thứ ba, laser Nd: YAG xung dài 1064 nm điều trị mạch máu bằng cách sử dụng metHb thay vì HbO2. Khi tia laser Nd: YAG xung dài được chiếu, metHb được tạo ra và hệ số hấp thụ tăng lên. Có thể điều trị mạch máu bằng laser Nd: YAG xung dài với hệ số hấp thụ HbO2 thấp vì metHb. Ban đầu, hệ số hấp thụ của HbO2 thấp hơn của melanin ở bước sóng 1064 nm, nhưng khi metHb được hình thành, hệ số hấp thụ được tăng lên ba lần, dẫn đến hệ số hấp thụ cao hơn melanin.
Một điểm quan trọng trong điều trị với metHb là hệ số hấp thụ của metHb chỉ tăng lên khi thời gian xung ít nhất là 4 ms hoặc lâu hơn (Hình 6.4) [9].
Trong trường hợp laser đa kết hợp, metHb nên được tạo ra bằng cách chiếu laser có bước sóng 595 nm. Nếu thời gian xung nhỏ hơn 4 ms với PDL 585 nm, ngay cả khi metHb được tạo ra, tỷ lệ này không tăng đủ để thay đổi hệ số hấp thụ và việc chiếu 1064 nm tiếp theo, tức là sử dụng “laser đa kết hợp” là vô nghĩa. Do đó, laser đa kết hợp không có tác dụng nhiều đối với hồng ban, tương ứng với TRT 4 ms trở xuống. Trong trường hợp này, chỉ có 0,45 ms của PDL 585 nm đơn độc có thể được sử dụng làm phương pháp điều trị.
Laser đa kết hợp
Để tham khảo, hãy xem xét các laser đa kết hợp. Nhiệt độ do PDL 0,5 ms tạo ra tăng cao nhất trong các mạch máu có kích thước 100 µm tương ứng với TRT 4,5 ms, và nhiệt độ do laser đa kết hợp tăng cao nhất ở các mạch máu có kích thước 300 µm trở lên tương ứng với TRT 40 ms trở lên (Hình 6.5). Như đề cập trước đó, kết quả phù hợp với thực tế là PDL 595 nm có hiệu quả đối với ban đỏ và laser đa kết hợp có hiệu quả đối với các mạch máu nhìn thấy được.
![Laser mạch máu và điều trị ban đỏ - Bs. Trương Minh Tấn Vũ 44 Hình 6.5 Tính toán độ tăng nhiệt độ đỉnh của mạch máu dựa trên mô hình phân tích được công bố trên Mirkov et al. [10]. Mật độ năng lượng của laser PDL là 12 J/cm2 trong 0,5 hoặc 40 ms; mật độ năng lượng Nd: YAG là 50 J/cm2 trong 40 ms. Trong kết hợp PDL / Nd: YAG, PDL 40 ms được chiếu đầu tiên.](https://nhathuocngocanh.com/wp-content/uploads/2022/09/laser-mach-mau-va-dieu-tri-ban-do-anh-5.jpg)
Trước đây, laser Nd: YAG xung dài không đủ công suất, vì vậy chỉ có laser đa kết hợp sử dụng metHb mới có hiệu quả trong điều trị mạch máu. Tuy nhiên, hiện nay, công suất của laser Nd: YAG xung dài rất cao, do đó, chỉ riêng laser Nd: YAG xung dài là đủ để điều trị mạch máu. Vì vậy, tôi cho rằng không nhất thiết phải mua các loại laser đa kết hợp đắt tiền. Ngoài ra, vì laser Nd: YAG xung dài thường có thời lượng xung từ 5 ms trở lên, nên chắc chắn, metHb đã được tạo ra.
Độ xuyên sâu quang học theo bước sóng
Các mạch máu tồn tại ở nhiều vị trí khác nhau, từ các mạch rất nông như u máu tuổi già đến các mạch máu nằm trong lớp bì sâu và lớp mỡ dưới da và các tĩnh mạch chân nằm sâu cách lớp thượng bì vài mm. Để điều trị các mạch máu khác nhau này, tia laser phải xâm nhập vào các độ sâu khác nhau.
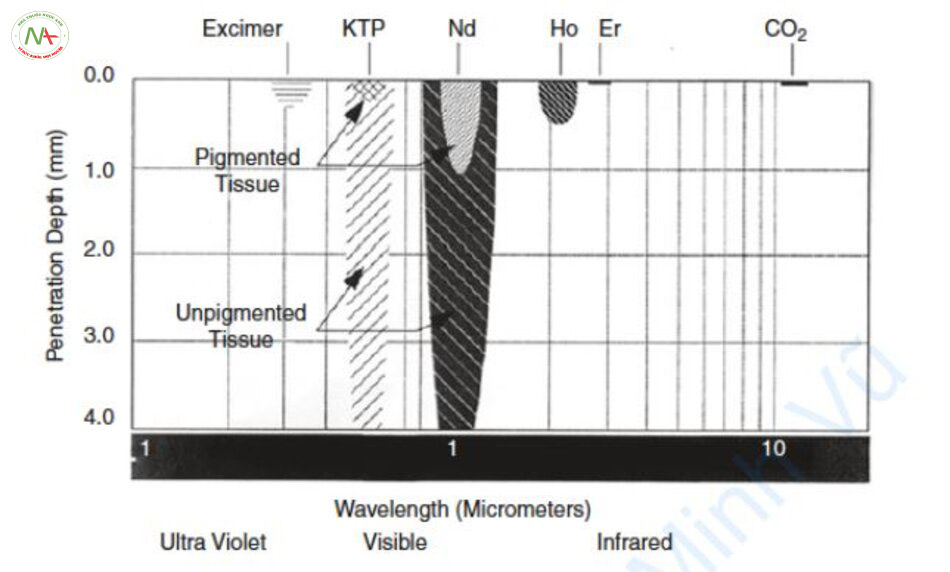
Độ xuyên sâu quang (optical penetration depth, OPD) của laser là vị trí mà mật độ năng lượng giảm 37%, là 1/e. Trong các mạch máu da nằm sâu hơn OPD, hiệu quả điều trị giảm đáng kể vì mật độ năng lượng đạt dưới 37%. Do đó, laser 532 nm và 595 nm và IPL không thể điều trị các mạch máu da nằm sâu hơn 1,2–2,0 mm. Ngược lại, các laser 755, 800 và 1064 nm có thể điều trị cả mạch máu nông và sâu (Hình 6.6) [7].
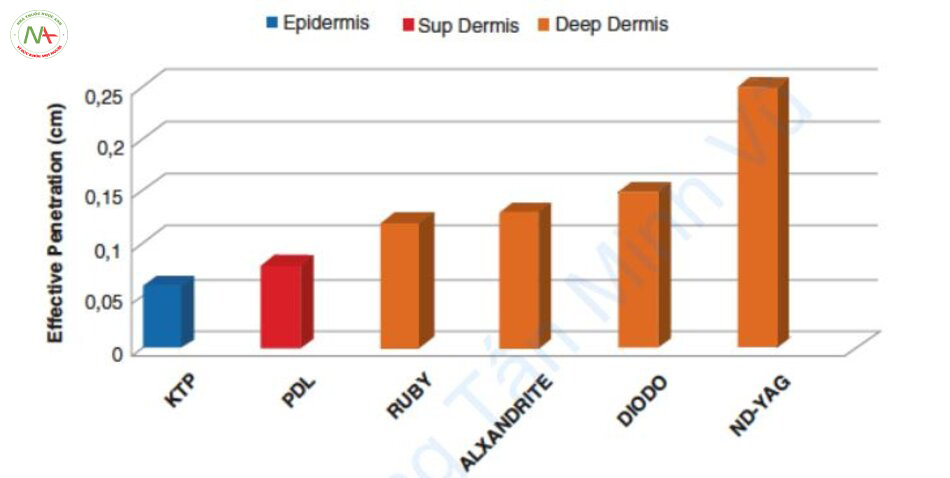
Độ dày của mạch máu theo bước sóng
Vì mạch máu sâu dày hơn, mạch máu gần lớp biểu bì mỏng hơn và bước sóng dài hơn có OPD sâu hơn, laser bước sóng 500–600 nm được sử dụng để điều trị mạch máu mỏng và laser NIR được sử dụng để điều trị mạch máu dày. Tuy nhiên, đây không phải là lý do duy nhất mà liệu pháp laser mạch máu thay đổi theo bước sóng.
OPD của laser chỉ là độ xuyên sâu lý thuyết. Độ sâu thâm nhập thực tế phụ thuộc vào tình trạng da của bệnh nhân (Hình 6.7). Ví dụ, laser 532 nm được biết là có OPD khoảng 1 mm. Tuy nhiên, nếu người da trắng được chiếu laser 532 nm hoặc nếu chiếu laser 532 nm sau khi loại bỏ sắc tố biểu bì, tia laser có thể xuyên qua đến 4 mm hoặc hơn. Vậy 532 nm có thể điều trị các tĩnh mạch dày? Laser xung dài 532 nm được biết là không thể điều trị các tĩnh mạch dày. Tại sao như vậy?
Ross và cộng sự đo nhiệt độ của lớp bì bằng cách sử dụng một mô hình toán học và nhiều loại laser [13]. Phương pháp điều trị mạch máu lý tưởng tốt nhất là toàn bộ thành mạch đông tụ và kết dính lại, làm cho các mạch máu biến mất. Nếu có phần nào của mạch máu không đông tụ thì sau này sẽ tái tạo lại và mạch máu đó sẽ không biến mất. Do đó, điều kiện để co mạch máu là ưu tiên, vì số lượng photon giảm dần khi photon đi xuống từ đỉnh da khi nhìn theo mặt cắt ngang, thành mạch máu sâu nhất phải bị đông tụ. Vì vậy, mối quan tâm chính của chúng tôi là thành mạch máu sâu nhất. Thứ hai, vì mạch máu vỡ trên 100°C, nhiệt độ của thành mạch máu nông nhất gần với lớp biểu bì không được vượt quá 100°C.
Ross và cộng sự đã đo sự thay đổi nhiệt độ khi chiếu laser vào một tĩnh mạch cỡ trung bình có độ dày 500 µm ở độ sâu 500 µm bằng các tia laser khác nhau và các khoảng thời gian xung khác nhau ((1) 532 nm, 20 ms, 10.5 J/cm2, (2) 595 nm, 20 ms, 13.5 J/cm2, (3) 595 nm, 0.45 ms, 8.9 J/cm2, (4) 1064 nm, 20 ms, 89 J/cm2). Bài báo này xem nhiệt độ đông tụ là 70°C. Không có laser nào vượt quá 100°C, nhưng chỉ (4) laser Nd: YAG vượt quá 70°C, nhiệt độ mà thành mạch máu sâu nhất đông tụ. Các laser khác không thể làm đông thành mạch máu. Nói cách khác, các laser khác không hiệu quả trong việc điều trị tĩnh mạch cỡ trung bình. Tuy nhiên, đối với các mạch máu dày 120 µm, hai laser sẽ có hiệu quả: (2) 595 nm với thời gian xung 20 ms và (4) laser Nd: YAG. Đối với các mạch máu dày 60 µm, cả bốn tia laser sẽ có hiệu quả.
Tại sao lại có hiện tượng này? Nguyên nhân cũng giống như nguyên nhân tại sao laser CO2 không xâm nhập sâu trong da là do hệ số hấp thụ nước cao. Các laser có bước sóng 500 đến 600 nm có độ hấp thụ cao đối với mạch máu và do đó không thể xâm nhập sâu vào mạch. Khi các photon đi vào lớp bì, có hai yếu tố quyết định OPD: hệ số hấp thụ và hệ số tán xạ. Trong đó, hệ số tán xạ có ảnh hưởng quan trọng đến độ xuyên sâu của ánh sáng, nhưng một khi photon đi vào mạch máu, hệ số hấp thụ có ảnh hưởng quan trọng hơn hệ số tán xạ. (xem Sect. 3.3.2 trong “Chương 3.).
Nói cách khác, khi lựa chọn bước sóng để điều trị mạch máu, cần tính đến độ dày của mạch máu cũng như vị trí của mạch máu. Nói cách khác, laser có bước sóng 500–600 nm không thể điều trị các mạch máu dày vì chúng không chỉ có OPD nông mà hệ số hấp thụ Hb cũng cao. Tuy nhiên, laser NIR có thể điều trị cả mạch máu mỏng và dày vì hệ số hấp thụ Hb thấp và OPD sâu. Do đó, chỉ xét riêng về bước sóng, laser NIR có phạm vi điều trị rộng hơn so với laser có bước sóng 500–600 nm.
Tuy nhiên, điều trị bớt rượu vang phì đại hoặc u máu lớn ít khi được thực hiện trong phòng khám tư nhân. Thông thường chỉ điều trị các mạch máu mỏng trên mặt. Do đó, các laser có bước sóng 500–600 nm có thể được sử dụng hiệu quả.
Các loại laser mạch máu
Laser mạch máu bước sóng 500–600 nm và melanin
Các loại laser mạch máu có thể được phân loại rộng rãi thành laser bước sóng 500– 600 nm và laser cận hồng ngoại (near-infrared, NIR). Các laser có bước sóng 500–600 nm gồm KTP 532-nm, PDL 585-nm, PDL 595-nm và laser NIR gồm laser Nd: YAG xung dài 1064 nm.
Các laser có bước sóng 500–600 nm có hệ số hấp thụ melanin cao, dễ gây tác dụng phụ trên biểu bì. Ví dụ, mật độ năng lượng cần thiết để điều trị các mao mạch 0,25 mm bằng laser KTP 532-nm là 10 J/cm2, nhưng chỉ cần mật độ năng lượng 6–8 J/cm2 để điều trị đốm nâu bằng cùng một loại laser [13]. Nói cách khác, điều trị mạch máu bằng laser KTP cũng có thể điều trị đốm nâu nhưng có thể gây ra tác dụng phụ do năng lượng quá cao cho việc điều trị đốm nâu. Ngoài ra, bởi vì nhiều photon đã được hấp thụ bởi đốm nâu, các photon đến mạch máu bị giảm và năng lượng được hấp thụ thấp dẫn đến việc điều trị không hiệu quả.
Khi điều trị mạch máu da ở vùng da sẫm màu hoặc da bị cháy nắng gần đây, ngay cả khi thực hiện làm mát biểu bì, nhiệt sinh ra từ biểu bì có thể áp đảo nhiệt độ làm mát, gây bóng nước hoặc bỏng da. Trong trường hợp mối quan hệ giữa mô đích và mô cạnh tranh là theo chiều dọc, biện pháp thích hợp nhất là làm mát biểu bì (xem Phần 3.8 trong “Chương 3”), nhưng ba phương pháp sau đây có thể được thử [7]. Đầu tiên, thử test shot và đánh giá sau 24–48 giờ để tìm ra năng lượng thích hợp cho việc điều trị. Thứ hai, da rám nắng có thể được điều trị sau khi đợi 4 tuần để sắc tố melanin giảm đi. Thứ ba, có thể sử dụng laser NIR với hệ số hấp thụ melanin thấp. Tất nhiên, các laser NIR không hoàn toàn không bị melanin hấp thụ, vì vậy việc làm mát biểu bì phải được thực hiện đầy đủ.
Phương pháp thứ nhất và thứ hai trong ba phương pháp trên không thích hợp trong phòng khám tư nhân, vì việc điều trị phải trì hoãn trong 1-2 ngày hoặc thậm chí một tháng. Do đó, đối với những người Hàn Quốc có lượng lớn hắc tố trong lớp biểu bì (loại da Fitzpatrick ≥ IV), thì phương pháp thứ ba, laser NIR là lựa chọn thích hợp.
Cũng khi điều trị bằng laser mạch máu NIR, sẽ tốt hơn nếu áp dụng phương pháp thứ hai và điều trị theo quy trình tuần tự. Nói cách khác, nên điều trị sắc tố biểu bì trước rồi mới điều trị mạch máu da [13]. Ngay cả trong trường hợp này, sử dụng laser NIR sẽ an toàn hơn vì sắc tố biểu bì cao hơn so với người da trắng.
Laser mạch máu hồng ngoại gần (Near-Infrared, NIR)
Ngoài laser Nd: YAG xung dài, laser NIR trong điều trị mạch máu còn bao gồm laser alexandrite755 nm xung dài, laser diode 810 nm và laser 940 nm. Nhưng những laser này ít khi được sử dụng, tại sao như vậy?
Trước tiên, xem xét laser alexandrite xung dài 755 nm. Tỷ lệ hệsốhấp thụ melanin-Hb là 0,7 đối với 595 nm, 5,5 đối với 755 nm và 3,2 đối với 1064 nm [14], tức là tỷ lệ hệ số hấp thụ melanin-Hb của laser alexandrite cao hơn so với laser Nd: YAG. Do đó, chỉ cóthể sử dụng laser alexandrite một cách an toàn và hiệu quả ở người da trắng. Tuy nhiên, lớp biểu bì phải được làm mát. Ngoài ra, tỷ lệ hệ số hấp thụ melanin-Hb cao làm cho tia laser khó được dùng cho các mạch máu nhỏ có TRT tương tự như lớp biểu bì. Do đó, bằng cách áp dụng tính nhiệt động học chọn lọc, laser có thể được áp dụng cho các mạch lớn, màu xanh lam được làm mát từ từ. Cũng vì các mạch lớn có deoxyHb cao hơn HbO2, nên laser alexandrite 755 nm với hệ số hấp thụ dexoxy-HbO2 cao có hiệu quả. Do đó, laser alexandrite không thích hợp để điều trị ban đỏ lan tỏa trên mặt. Laser alexandrite xung dài chủ yếu được sử dụng để triệt lông bằng laser và điều trị sắc tố.
Thứ hai, laser diode 810 nm có công suất rất thấp và không thể tạo ra thời gian xung ngắn. Do đó, chỉ có thể điều trị được những mạch máu dày từ 2–4 mm [13]. Vì các mạch máu trên mặt thường nhỏ hơn 1 mm nên laser 800 nm cũng hiếm khi được sử dụng để điều trị mạch máu.
Cuối cùng, laser Nd: YAG xung dài là một laser NIR điển hình. Tỷ lệ hệ số hấp thụ melanin-Hb cao hơn so với laser 595-nm, nhưng khi metHb được tạo ra và hệ số hấp thụ được tăng lên, có thể làm giảm tỷ lệ hệ số hấp thụ melanin-Hb. Tia laser cũng xâm nhập sâu và có thể điều trị các mạch máu dày. Vậy nhược điểm của laser Nd: YAG xung dài là gì? Thứ nhất, vì hệ số hấp thụ của Hb thấp hơn so với laser bước sóng 500–600 nm, nên nó phải có công suất cao để có hiệu quả, nhưng có giới hạn về công suất. Do đó, khó để tạo ra thời gian xung ngắn. Ngoài ra, vì laser sử dụng metHb nên cần có thời gian để metHb được tạo ra. Vì metHb bắt đầu được tạo ra ở hơn 4 ms và thường được tạo ra nhiều nhất ở 10 ms, nên rất khó để điều trị các mạch máu mỏng có TRT từ 4–5 ms trở xuống. TRT 5 ms là mạch máu dày 0,1 mm, tương ứng với độ dày mạch máu nhỏ nhất có thể quan sát được bằng mắt (Hình 6.8). Nói cách khác, mạch máu nhỏ hơn 0,1 mm tương ứng với ban đỏ không nhìn thấy rõ mạch máu. Do đó, laser Nd: YAG xung dài không thể điều trị ban đỏ. Thứ hai, mặc dù laser Nd: YAG xung dài có hệ số hấp thụ metHb cao hơn các chromophore khác, nhưng nó cũng bị hấp thụ bởi melanin và nước nên có nguy cơ bị bóng nước và bỏng. Ngoài ra, laser Nd: YAG xung dài có OPD sâu. Do đó, khi bị bỏng, lớp bì sâu bị tổn thương dẫn đến bỏng nặng. Do đó, việc làm mát biểu bì cũng rất quan trọng đối với laser Nd: YAG xung dài và mật độ năng lượng cần được điều chỉnh cẩn thận.
Dựa trên những phát hiện này, trong một bài báo của Ross đề xuất để điều trị mạch máu mặt [14]. Đầu tiên, khi màu da sáng hoặc làm mát biểu bì đầy đủ, bước sóng 532– 595 nm được khuyến nghị để điều trị mạch máu 0,1–0,5 mm. Thứ hai, ở những bệnh nhân có loại da Fitzpatrick I và II, và khi làm mát biểu bì đầy đủ, bước sóng 755-nm được khuyến nghị cho các mạch máu từ 0,4–1,6 mm vì ít đau hơn. Thứ ba, laser 940 nm, 980 nm và 1064 nm được khuyến nghị để điều trị bệnh nhân có da sẫm màu hơn hoặc mạch máu từ 0,7–1,6 mm, spot size nhỏ và mật độ năng lượng thấp nhất có thể để co mạch máu được sử dụng. Bước sóng 755 nm không phù hợp với người Hàn Quốc vì có nhiều loại da Fitzpatrick III, IV và V hơn loại da Fitzpatrick I và II. Do đó, khi điều trị cho người Hàn Quốc, đầu tiên, có thể lựa chọn laser mạch máu 532– 595-nm trên cơ sở làm mát
biểu bì đầy đủ. Nhược điểm là chỉ điều trị được các mạch máu có độ dày 0,1–0,5 mm và các mạch máu dày hơn rất khó điều trị. Thứ hai, các bước sóng 940, 980 và 1064-nm được khuyên dùng vì chúng an toàn cho làn da sẫm màu. Tuy nhiên, do hiện nay trên thị trường có ít loại laser có bước sóng 940 hoặc 980 nm nên bước sóng 1064 nm có vẻ phù hợp.
Các loại laser mạch máu theo thời gian xung
Bây giờ xem xét thời gian xung mà không tính đến bước sóng. TRT của các mạch máu 30–100 µm là 0,4–4,5 ms và chúng có thể được xử lý bằng PDL 585 nm với thời gian xung 450 µs (Bảng 6.1). Mặt khác, khoảng thời gian xung PDL 585 nm là quá ngắn để xử lý mạch máu dày hơn với TRT từ 4,5 ms trở lên. Ngoài ra, các mạch máu dày hơn 0,1 mm có TRT từ 4,5 ms trở lên và có thể được điều trị bằng PDL xung dài 595 nm với thời gian xung 1,5 ms trở lên, nhưng các mạch máu mỏng có TRT từ 1,5 ms trở xuống thì không thể điều trị được.
Bảng 6.1 Các loại laser mạch máu và TRT
| Loại laser | Bước sóng (nm) | Thời gian xung | TRT | Mục tiêu |
| Pulsed dye laser | 585 | 450 µs | 0.4–4.5 ms | Mạch máu |
| Long-pulsed dye laser | 595 | 1,5 ms (0,45–40 ms) | > 4.5 ms | Mạch máu (> 0,1 mm) |
| KTP | 532 | 1–100 ms | < 446.4 ms | Mạch máu (lên đến 1 mm) |
| Long-pulsed Nd:YAG | 1064 | 5–300 ms | ||
| IPL | 500-12,000 | 2–200 ms | ||
| Copper bromide | 577,511 | 10–1000 ms, quasi-continuous wave | 10–1000 ms, quasi-continuous wave | 10–1000 ms, quasi-continuous wave |
Chỉ xem xét thời lượng xung, không thể điều trị các mạch máu ở mọi kích thước chỉ với một loại laser mạch máu. Hiện tại, PDL xung dài 595 nm được phát triển để tạo ra dải thời gian xung từ 0,45 đến 40 ms, có thể chữa được nhiều mạch máu. Tuy nhiên, như đã đề cập trước đó, bất kể thời gian xung dài bao nhiêu, đều có giới hạn về bước sóng, do đó các mạch máu lớn không thể điều trị được. Do đó, cần ít nhất hai hoặc nhiều laser mạch máu để điều trị các mạch máu ở mọi kích thước.
Vậy thì chúng ta nên mua loại laser nào? Tôi khuyên nên mua laser Nd: YAG 1064 nm xung dài trước và sau đó là PDL 595 nm. Lý do cho điều này là như sau. Đầu tiên, chi phí mua laser Nd: YAG xung dài thấp hơn. Thứ hai, như đã giải thích ở trên, laser NIR có thể điều trị cả mạch máu mỏng và dày và do đó có thể điều trị nhiều mạch máu. Thứ ba, do hiệu ứng bỏ qua biểu bì, laser NIR có ít tác dụng phụ lên biểu bì hơn so với laser bước sóng 500–600 nm. Tuy nhiên, laser Nd: YAG xung dài không thể điều trị hồng
ban, mạch máu tương ứng với TRT dưới 5 ms. Trong trường hợp này, sử dụng kỹ thuật genesis của laser Nd: YAG xung dài đầu tiên giúp cải thiện ban đỏ ở một mức độ nào đó.
Tất nhiên, hầu hết các mạch máu trên mặt không phải là các mạch máu dày. Các PDL được sản xuất gần đây có ít ban xuất huyết hơn và ít tác dụng phụ hơn so với laser Nd: YAG xung dài 1064 nm. Vì vậy, nếu chúng ta chỉ cần chọn một laser mạch máu, chúng ta nên mua PDL 595-nm. Trong nhiều tài liệu laser, tiêu chuẩn vàng cholaser mạch máu mặt được biết là PDL 595 nm xung dài. Tuy nhiên, vấn đề là chi phí mua và chi phí bảo trì cao. Tôi khuyên bạn nên mua laser Nd: YAG xung dài 1064 nm trước hoặc nếu bạn muốn đặt hiệu quả lên hàng đầu, bất kể giá cả như thế nào, tôi khuyên bạn nên mua PDL 595 nm xung dài.
Để tham khảo, phạm vi TRT có thể có hiệu quả trong một khoảng thời gian xung cụ thể là bao nhiêu? Khoảng thời gian xung phải nhỏ hơn hoặc bằng TRT. Nếu thời gian xung bằng TRT thì không có vấn đề gì, nhưng nếu thời gian xung nhỏ thì thời gian xung có thể nhỏ đến mức nào để nó vẫn hiệu quả? Mặc dù chưa được biết về điều này, nhưng dựa trên thực tế là thời gian xung 450 µs có hiệu quả lên TRT đến 4,5 ms (Bảng 6.1), tôi nghĩ rằng có thể có hiệu quả với TRT gấp khoảng 10 lần thời gian xung và có thể không hiệu quả với TRT gấp hơn 10 lần.
Laser mạch máu cho người Hàn Quốc
Bây giờ xem xét cụ thể chi tiết về ưu và nhược điểm của từng loại laser mạch máu và những vấn đề gặp phải khi áp dụng cho người Hàn Quốc.
Laser KTP 532-nm có cùng hệ số hấp thụ của máu với PDL 585-nm [2], trong khi thời gian xung thay đổi từ 1 đến 100 ms [15] cho phép điều trị nhiều loại mạch máu và vì nó có xung dài thực sự, ban xuất huyết hiếm khi xảy ra. Tuy nhiên, laser KTP 532 nm không có OPD sâu hơn 585 nm và có hệ số hấp thụ Hb cao nên không điều trị được mạch máu lớn và có hệ số hấp thụ hắc tố cao nên không phù hợp với người Châu Á và da sẫm màu [2].
Laser hơi đồng 577 nm có hệ số hấp thụ Hb cao nhất, nhưng cũng giống như KTP 532 nm, laser vẫn có hệ số hấp thụ melanin cao nên không phù hợp với da sẫm màu, đặc biệt là da Fitzpatrick loại V [16]. Ngoài ra, vì tia laser có xung gần như liên tục và thời gian xung từ 10 ms trở lên, nên nó không thể điều trị các mạch máu nhỏ tương ứng với TRT 10 ms trở xuống (Bảng 6.1).
Khi điều trị bớt rượu vang (PWS) trên da Fitzpatrick loại IV và V bằng PDL 585 nm, tiến độ điều trị chậm hơn so với người da trắng, cần phải điều trị nhiều lần và hiệu quả điều trị được báo cáo là thấp hơn. Tuy nhiên, hiệu quả điều trị giãn mạch với PDL 585-nm không khác nhau theo dân tộc [16]. Do đó, không cần thiết phải loại hoàn toàn
PDL 585 nm khỏi phương pháp điều trị mạch máu của người Châu Á do thực tế là PWS cần nhiều lần điều trị và hiệu quả điều trị có phần kém hơn [2]. Nhược điểm của PDL 585 nm là cần thời gian nghỉ dưỡng khi ban xuất huyết xảy ra và không thể điều trị được các mạch máu lớn hơn 0,1 mm.
PDL 595 nm xung dài sử dụng bước sóng 595 nm với hệ số hấp thụ melanin thấp hơn và OPD sâu hơn để cải thiện những thiếu sót của PDL 585 nm (Hình 6.9). Laser đã được cải tiến để sử dụng trong điều trị các mạch máu có kích thước khác nhau bằng cách tăng thời gian xung và giảm tác dụng phụ thông qua việc làm mát biểu bì. Do đó, laser này hiện là laser tối ưu nhất cho PWS ở người Châu Á và ban xuất huyết cũng hiếm khi xảy ra [2]. Tuy nhiên, do hệ số hấp thụ của Hb thấp hơn PDL 585 nm nên công suất phải tăng lên, dẫn đến chi phí mua và bảo trì cao.
IPL cũng được biết đến như một phương pháp hiệu quả để điều trị PWS, nhưng chỉ nên được thực hiện bởi những người có nhiều kinh nghiệm [2]. Laser Nd: YAG 1064 nm xung dài có thể được sử dụng để điều trị các mạch máu không chỉ trên mặt mà còn trên mọi bộ phận của cơ thể. Các tác dụng phụ về sắc tố như giảm sắc tố da được ghi nhận không xảy ra. Đây là loại laser phù hợp nhất cho da có sắc tố sẫm màu. Tuy nhiên, ban đỏ không thể điều trị bằng laser này [2].
Xác định thời gian xung
TRT của các mạch máu rất khác nhau tùy thuộc vào kích thước của mạch máu (Bảng 6.2). Từ mạch máu khó nhìn thấy (100 µm) đến mạch lớn nhất có thể nhìn thấy trên mặt (1 mm), có sự chênh lệch 100 lần về TRT từ 4,8 đến 446,4 ms. Có vẻ như rất khó để xác định thời gian xung cho một dải TRT rộng như vậy. Có thực sự như vậy ?
Bảng 6.2 Thời gian giãn nhiệt (TRT) của mạch máu
| Kích thước (µm) | TRT (ms) | Độ sâu (µm) | Chú thích |
| 10 | 0.048 | 100 | Hồng ban đồng nhất |
| 20 | 0.19 | ||
| 50 | 1.2 | ||
| 100 | 4.8 | Kích thước mạch máu nhỏ nhất có thể nhìn thấy được | |
| 200 | 19.0 | 250 | |
| 300 | 42.6 | ||
| 400 | 80 | ||
| 800 | 300 | ||
| 1000 | 446.4 |
Có ba cách để tính TRT của mạch máu. Đầu tiên tuân theo lý thuyết về quang nhiệt chọn lọc, trong đó nhiệt của máu được truyền đến thành mạch máu và bị đông tụ. Trong trường hợp này, TRT có thể được tính bằng cách chỉ coi máu bên trong thành mạch là mô đích [TRT]. Thứ hai, cũng theo lý thuyết về quang nhiệt, trong đó mạch máu là mô đích. Trong trường hợp này, TRT có thể được tính bằng cách tính TRT của chính mạch máu. Đây là TRT mà chúng tôi hiện đang sử dụng (Bảng 1.13). Chúng tôi sẽ định nghĩa điều này là TRT’ trong cuốn sách này. Thứ ba, TRT có thể được tính bằng cách sử dụng thời gian tổn thương nhiệt (thermal damage time, TDT), là thời gian nhiệt của mạch máu truyền đến thành mạch theo lý thuyết mở rộng của quá trình quang nhiệt chọn lọc [19]. So sánh ba yếu tố này, TRT của máu bên trong mạch máu là ngắn nhất, TDT đến thành mạch theo lý thuyết mở rộng là dài nhất và TRT′ được tính bằng cách coi mạch máu là mô đích ở giữa (TRT < TRT ‘<TDT).
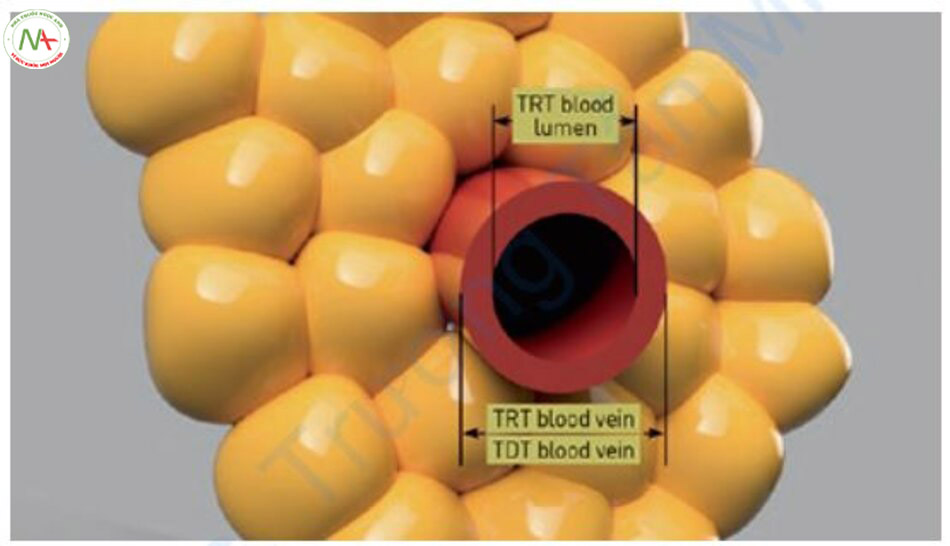
Christianen và cộng sự đo đường kính mạch máu và độ dày thành mạch và nghiên cứu thời gian phát xung thích hợp theo độ dày của mạch khi sử dụng laser Nd: YAG xung dài [19]. Các phép đo đường kính mạch và độ dày thành mạch cho thấy những sự thật thú vị. Các mạch máu từ 0,25 mm trở xuống có độ dày tương tự về đường kính mạch và độ dày thành mạch. Đối với mạch máu từ 0,25 mm trở lên, mặc dù đường kính mạch tăng lên nhưng bề dày thành mạch không tăng nhiều nên thành mạch máu trở nên tương đối mỏng so với bề dày của toàn bộ mạch máu (Bảng 6.3).
Bảng 6.3 TRT và TDT theo Altshuler et al. [20] trong Nd: YAG 1064 nm điều trị giãn mạch.
| Đường kính mạch máu d (mm) | Độ dày thành mạch tw (mm) | Đường kính lòng mạch di (mm) | TRT máu lòng mạch (ms) | TRT toàn mạch (ms) |
TDT toàn mạch (ms) |
| 0.1 | 0.035 | 0.03 | 0.4 | 5 | 140 |
| 0.25 | 0.08 | 0.09 | 3.9 | 30 | 610 |
| 0.5 | 0.12 | 0.27 | 32.5 | 120 | 1200 |
| 1.0 | 0.15 | 0.7 | 236 | 480 | 2400 |
TRT máu lòng mạch được tính toán theo lý thuyết quang nhiệt chọn lọc và TRT toàn mạch là TRT′ được tính bằng cách xem cả mạch máu là mô đích và TDT toàn mạch là TDT được tính theo lý thuyết mở rộng (TRT máu lòng mạch <TRT toàn mạch <TDT toàn mạch, Hình 6.10). Khi áp dụng lý thuyết mở rộng, thời gian xung phải bằng hoặc ngắn hơn TDT toàn mạch và dài hơn TRT máu lòng mạch (TDT ≥ PD> TRT).
Điều trị mạch máu chủ yếu sử dụng quá trình đông tụ xảy ra ở nhiệt độ dưới 100°C, vì vậy phương trình Arrhenius áp dụng cho nhiệt độ dưới 100°C được sử dụng (xem Mục 3.6.3 trong “Chương 3”). Do đó, bất kỳ khoảng thời gian xung nào dài hơn TRT và bằng hoặc nhỏ hơn TDT đều tạo ra hiệu quả tương tự. Tuy nhiên, thời gian xung càng dài thì tác dụng phụ càng ít (phương pháp B trong trẻ hóa không bóc tách), do đó dựa trên TRT toàn mạch máu (TRT′), thời gian xung phải bằng hoặc ngắn hơn TDT toàn mạch và dài hơn TRT toàn mạch máu. (TDT ≥ PD> TRT′). Mặt khác, thời gian xung càng dài, càng đau nhiều. Đặc biệt, bước sóng 1064 nm có khả năng hấp thụ nước cao nên gây ra cảm giác đau đáng kể trong thời gian phát xung dài. Xem xét hai điểm này, chúng ta hãy nghĩ về thời gian xung của hai mạch máu.
Đầu tiên, thời gian xung cho mạch máu nhỏ hơn 0,25 mm phải nằm giữa TRT toàn mạch máu và TDT toàn mạch máu và gần với TRT toàn mạch máu (TRT′ <PD ≤ TDT). Thứ hai, trong các mạch máu lớn hơn 0,25 mm, do thời gian xung khá dài và thành mạch tương đối mỏng so với toàn mạch, bằng cách bỏ qua thành mạch và áp dụng lý thuyết quang nhiệt chọn lọc, có thể đặt thời gian xung bằng hoặc ít hơn TRT máu lòng mạch (PD ≤ TRT).
Thông qua những giả thuyết này, Christiansen và cộng sự nhận thấy rằng đối với các mạch máu nhỏ hơn 0,25 mm, thời gian xung vượt quá TRT toàn mạch máu một chút là phù hợp. Và đối với các mạch máu lớn hơn 0,25 mm, thời gian xung ngắn hơn hoặc bằng TRT máu lòng mạch là thích hợp.
Thời gian xung hiệu quả thực tế theo kích thước của mạch máu (Bảng 6.4) cho thấy thời gian xung của các mạch máu nhỏ dưới 0,3 mm là 12–25 ms, lớn hơn so với TRT toàn mạch (5 ms) và nhỏ hơn nhiều hơn TDT toàn mạch (140 ms). Thời gian xung của các mạch máu lớn 0,5–1,0 mm là 25–45 ms, tương tự hoặc ngắn hơn so với TRT máu lòng mạch (32,5–236 ms). Do đó, để điều trị các mạch máu từ 0,1 đến 1 mm bằng laser Nd: YAG xung dài, chỉ nên chọn thời gian xung từ 12–45 ms thay vì 4,5–446,4 ms.
Bảng 6.4 Các thông số Nd: YAG lý thuyết và đã được chứng minh lâm sàng được sử dụng điều trị với mật độ năng lượng cố định
| Kích thước mạch máu (mm) | Mạch máu xanh | Mạch máu đỏ | ||||
| Thời gian xung (ms) | Spot size (mm) | Mật độ năng lượng (J/cm2) | Thời gian xung (ms) | Spot size (mm) | Mật độ năng lượng (J/cm2) | |
| < 0.3 | 25 | 1.5 | 210 | 12 | 1.5 | 210 |
| 0.3- 0.5 | 32 | 3 | 250 | 16 | 1.5 | 250 |
| 0.5-1.0 | 45 | 3 | 285 | 25 | 3 | 285 |
| 1.0-2.5 | 64 | 5 | 200 | – | – | – |
Trong một tài liệu laser đã cho thấy rằng rằng thời gian xung 0,5 ms (hoặc 0,45 ms) cho độ dày 60–100 µm (hồng ban) và thời gian xung 10 ms cho độ dày 150–300 µm là lý tưởng. Trong trường hợp laser kết hợp chiếu đồng thời 595 nm và 1064 nm, báo cáo cho rằng mạch máu 150–400 µm được xử lý hiệu quả nhất bằng thời gian xung 10 ms và mạch máu 400–1000 µm ở thời gian xung 40 ms [7]. Do đó, khi điều trị các mạch máu của mặt, chỉ cần sử dụng bốn thời gian xung (0,45, 5, 10 và 40 ms). Theo nhiệt động học chọn lọc, việc điều trị có thể được thực hiện tuần tự từ khoảng thời gian xung lớn đến khoảng thời gian xung nhỏ là 40, 10, 5 và 0,45 ms. Vì hầu hết các giãn mạch xảy ra trên mặt là các mạch máu mỏng nhỏ hơn 200 µm, tôi hiếm khi sử dụng khoảng thời gian xung là 40 ms, mà chủ yếu sử dụng 10, 5 và 0,45 ms.
Ngoài ra, khi xem xét thời gian xung, hai laser là laser Nd: YAG xung dài 1064 nm có thời gian xung từ 5 ms trở lên và PDL 595 nm có thời gian xung 0,45-40 ms nên được mua.
Kích thước điểm (Spot size)
Các mạch máu nằm ở nhiều độ sâu khác nhau trong lớp bì. Do đó, các laser có OPD sâu hơn được khuyến khích sử dụng. Nếu vậy, tốt hơn là tăng spot size để OPD trở nên sâu hơn. Ngay cảvới cùng một mật độnăng lượng, spot size lớn hơn cầnnhiều photon hơn được chiếu ra, do đó yêu cầu công suất cao hơn. Laser Nd: YAG xung dài cần công suất cao hơn để tăng spot size. Laser Nd: YAG xung dài đã được tăng công suất do mức hấp thụ của Hb thấp và rất khó để tăng công suất hơn nữa. Chúng ta nên làm gì?
Có ba yếu tố liên quan đến OPD: spot size, bước sóng và mật độ công suất. Yếu tố nào trong số những yếu tố này là quan trọng nhất đối với OPD? Yếu tố quan trọng nhất là bước sóng. Christianen và cộng sự phát biểu rằng vì KTP 532-nm hoặc PDL 575–595 nm có hệ số tán xạ lớn (30–35 mm-1), OPD bị giới hạn ở 2 mm hoặc nhỏ hơn ngay cả khi spot size tăng lên 6–8 mm [19]. Tuy nhiên, hệ số tán xạ của laser 1064 nm Nd: YAG là 12 mm-1, chỉ bằng 1/3 so với laser bước sóng 500–600 nm và OPD là 2,5 mm hoặc hơn ngay cả khi spot size giảm xuống còn 1,5–3 mm. Do đó, Christiansen và cộng sự đã mô tả rằng laser 1064 nm Nd: YAG thâm nhập sâu hơn laser bước sóng 500–600 nm.
Do đó, laser Nd: YAG xung dài có OPD sâu mà không cần tăng spot size. Đúng hơn, laser Nd: YAG có lợi thế là sử dụng spot size nhỏ. Đầu tiên, ngay cả khi các tác dụng phụ xảy ra, phạm vi tác dụng phụ là rất nhỏ. Thứ hai, spot size nhỏ cần năng lượng cao hơn spot size lớn, nhưng vì tổng năng lượng nhỏ, spot size nhỏ ít gây đau hơn spot size lớn. Do đó, sẽ an toàn hơn khi sử dụng spot size nhỏ khi điều trị mạch máu bằng laser Nd: YAG xung dài. Nhược điểm là do spot size nhỏ nên thời gian thực hiện kéo dài khi điều trị toàn bộ khuôn mặt.
Ross và cộng sự đề xuất liên hệ spot size với độ dày mạch máu để có bước sóng xuyên sâu [6]. Nói cách khác, điều trị mạch máu dày 2 mm với spot size 2 mm là phù hợp. Thông thường, các mạch máu lớn hơn 1 mm không phổ biến trên mặt. Ngoài ra, trong trường hợp sinh thiết đục lỗ 2–3 mm, người ta biết rằng ngay cả khi vết thương không được may, thời gian tái tạo vết thương có thể chậm nhưng về mặt thẩm mỹ thì không có vấn đề gì [21]. Do đó, tôi sử dụng spot size nhỏ hơn 3 mm khi điều trị mạch máu bằng laser Nd: YAG xung dài.
Điểm kết thúc lâm sàng (End point)
Wanner và cộng sự đề xuất các end point khác nhau của liệu pháp điều trị mạch máu cho từng tổn thương mạch máu [22]. Trong bớt rượu vang (PWS), end point được đề xuất cho PDL là ban xuất huyết giới hạn ở spot size, trong khi end point được đề xuất cho cả laser alexandrite xung dài 755 nm và laser Nd: YAG xung dài 1064 nm là sự chuyển đổi sang màu xanh tím. Trong u mạch máu ở trẻ sơ sinh, end point được đề xuất là ban xuất huyết nhẹ tạm thời hoặc thâm đen nhẹ tổn thương trong vòng 1 phút. Trong giãn mạch, sự sẫm màu tức thời của mạch máu hoặc biến mất mạch máu ngay lập tức được đề xuất là end point. Trong u máu tuổi già, ban xuất huyết không có chấm xuất huyết được đề xuất là end point, và trong trường hợp hồ tĩnh mạch, tối hoặc biến mất mạch máu được đề xuất là end point.
Chúng ta hãy xem xét chi tiết end point của giãn mạch. Tại sao các mạch máu sẫm màu hoặc biến mất? Và điều gì xảy ra nếu dùng mức năng lượng cao hơn?
Suthamjariya và cộng sự đã sử dụng laser Nd: YAG xung dài 532 nm và 1064 nm để chiếu các mạch nhỏ trong má của chuột hamster với nhiều mức năng lượng khác nhau và ghi lại những thay đổi trong các mạch máu đó bằng máy ảnh tốc độ cao [23].
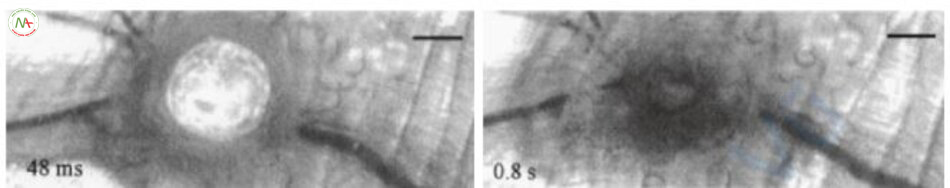
Kết quả cho thấy một loạt các thay đổi khác nhau khi năng lượng tăng lên. Theo thứ tự mật độnăng lượng từ thấp đến cao, dựa vàongưỡng đông tụ và ngưỡng tạo khoang, không ghi nhận các thay đổi trong mạch máu hoặc đôi khi giãn mạch tạm thời dưới ngưỡng đông tụ. Trong ngưỡng đông tụ, khối máu đông xuất hiện trong mạch máu, đôi khi di chuyển theo dòng máu nhưng phần lớn bám vào thành mạch máu. Trên ngưỡng đông tụ, các mạch máu co lại và khối máu đông kéo dài ra, dẫn đến hình dạng giống như sợi chỉ hoặc biến mất mạch (Hình 6.11).
Trong ngưỡng tạo khoang, hiện tượng tạo khoang trong lòng mạch xảy ra và sự tạo khoang đẩy ra khối máu đông chặn dòng máu dẫn đến làm mạch máu biến mất hoặc vỡ thành mạch (Hình 6.12). Ở mật độ năng lượng cao hơn, hiện tượng tạo khoang ngoài mạch xuất hiện và không bào phát triển với độ dày gấp 20 lần độ dày của mạch máu ở năng lượng rất cao. Điều này dẫn đến vỡ thành mạch và xuất huyết, corút môquanh mạch và tổn thương mô xung quanh (Hình 6.13).
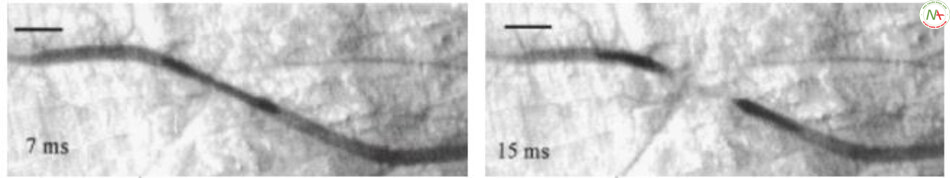
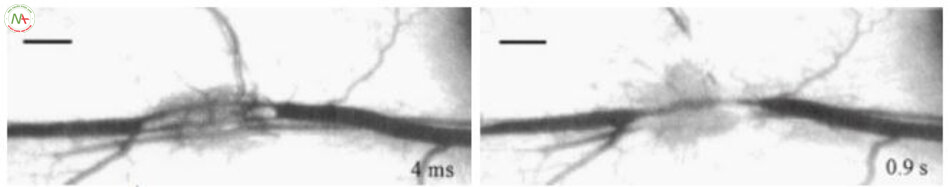
Tôi tóm tắt những điều trên thành sáu hiện tượng (Bảng 6.5). Các hiện tượng trên được mô tả qua quan sát bằng kính hiển vi. Dưới mắt bác sĩ laser, những hiện tượng này trông như thế nào về mặt lâm sàng và phương pháp điều trị mạch máu nào là lý tưởng nhất?
Bảng 6.5 Tóm tắt các biến đổi của mạch máu theo năng lượng
| Phát hiện trên kính hiển vi | Ngưỡng và điểm kết thúc lâm sàng |
| Đông máu | Ngưỡng đông máu. Làm tối màu |
| Co mạch, biểu hiện giống như sợi chỉ | Làm tối màu |
| Mạch máu biến mất | End point giá trị liên quan đến kết quả tốt. Mạch máu biến mất |
| Tạo khoang nội mạch | Ngưỡng tạo khoang. Mạch máu biến mất, ban xuất huyết nhỏ |
| Tạo khoang ngoại mạch, vỡ thành mạch và xuất huyết | Ban xuất huyết (~ 10–14 ngày) |
| Sự co lại của mô quanh mạch | Đổi màu xám và trắng |
Thứ nhất, đông máu không phải là một hiện tượng thích hợp để điều trị mạch máu. Nếu chỉ xuất hiện khối máu đông và mạch máu không bị tắc thì tới lúc nào đó khối máu đông sẽ tự rã và mạch máu không thay đổi. Thứ hai, ở dạng co mạch và giống như sợi chỉ, mạch máu có thể biến mất sau khi tắc nghẽn mạch máu hoặc mạch máu có thể tái tạo do quá trình tái tạo mạch. Vì vậy sự co mạch và hình dạng giống như sợi chỉ có thể đạt hoặc không kết quả chúng ta mong muốn. Tuy nhiên, tác dụng phụ do co mạch và biểu hiện giống sợi chỉ sẽ không xảy ra. Trên lâm sàng quan sát thấy các mạch máu trở nên tối màu. Tuy nhiên, các mạch máu rất nhỏ rất khó phân biệt do màu sắc thay đổi không đáng kể và cũng khó phân biệt với hiện tượng đông máu. Thứ ba, các tác giả của bài báo coi
sự biến mất của mạch máu là đáp ứng thích hợp. Về mặt lâm sàng, có một đáp ứng riêng biệt, trong đó các mạch máu biến mất. Thứ tư, hiện tượng tạo khoang trong lòng mạch dễ gây biến mất mạch máu hơn vì nó có tác dụng làm tắc mạch máu hơn nữa bằng cách đẩy khối máu đông trong mạch. Tuy nhiên, đôi khi xuất huyết xuất hiện, và trên lâm sàng, các mạch máu biến mất, nhưng có thể xuất hiện ban xuất huyết. Mặc dù đây có thể là một đáp ứng thích hợp với điều trị mạch máu, nhưng có thể cần thời gian nghỉ dưỡng. Thứ năm, tạo khoang ngoại mạch làm vỡ mạch máu, dẫn đến biến mất các mạch máu. Xuất hiện ban xuất huyết trên lâm sàng kéo dài đến 10-14 ngày. Vấn đề này không thể che bằng lớp trang điểm, gây khó khăn cho cuộc sống xã hội bình thường của bệnh nhân. Vì vậy, mặc dù đây có thể là một trong những biện pháp điều trị mạch máu, nhưng nó không phải là một biện pháp thích hợp. Ngoài ra, các mạch máu có thể tái tạo và tái phát. Thứ sáu, sự co rút của các mô quanh mạch xảy ra do sự tạo khoang ngoài mạch máu không kết thúc với ban xuất huyết mà làm tổn thương các mô xung quanh mạch máu. Hiện tượng này có nguy cơ cao để lại sẹo. Trên lâm sàng có thể thấy sự đổi màu trắng xám.
Trong sáu hiện tượng, tôi cho rằng hiện tượng thứ hai (co mạch, xuất hiện giống sợi chỉ) và hiện tượng thứ ba (biến mất mạch máu) là thích hợp nhất cho liệu pháp mạch máu. Sự biến mất hoặc sẫm màu của các mạch máu được coi là dấu hiệu kết thúc lâm sàng. Tất nhiên, hiện tượng thứ hai có thể tái phát sau đó, nhưng tôi nghĩ thà tái phát còn hơn là có tác dụng phụ. Nếu tái phát thì có thể được điều trị lại.
Hiện tượng thứ tư (tạo khoang trong lòng mạch) cũng dẫn đến biến mất mạch, nhưng tôi nghĩ khả năng cao là có tác dụng phụ. Để xảy ra hiện tượng tạo khoang trong lòng mạch, máu phải hóa hơi. Tại thời điểm này, tôi không nghĩ rằng chỉ xảy ra hiện tượng hóa hơi. Khi nhiệt độ tăng, ngưỡng tổn thương của thoái hóa protein và ngưỡng sống sót của hoại tử mô xảy ra trước khi hóa hơi (Phần 9.2.4 trong “Chương 9”). Như vậy, hiện tượng hóa hơi có nghĩa là mô đã bị hoại tử. Nói cách khác, sẹo có thể xảy ra sau đó. Vì lý do tương tự, tôi cho rằng sự tạo khoang ngoài mạch của laser PDL 585–595 nm và laser xung dài là khác nhau. Trong cả hai laser, các mạch máu bị vỡ và xuất hiện ban xuất huyết ở nhiệt độ cao hơn nhiệt độ hóa hơi. Tuy nhiên, khi sử dụng laser PDL, mật độ công suất tăng lên trong thời gian ngắn, do đó tổn thương cơ học lớn hơn tổn thương nhiệt, như laser Q-switched hoặc laser Er: YAG. Ngược lại, khi sử dụng laser xung dài thì khả năng để lại sẹo cao do nhiệt năng cao như laser CO2. Do đó, trong trường hợp tạo khoang ngoài mạch do PDL, ban xuất huyết có thể xảy ra nhưng khó có thể để lại sẹo. Mặt khác, laser xung dài có nhiều khả năng gây sẹo sau đó cũng như ban xuất huyết.
Nhược điểm của laser Nd: YAG xung dài
Wang và cộng sự đã nghiên cứu trên 61 bệnh nhân có bớt rượu vang phẳng (PWS) trên mặt chưa từng được điều trị [24]. Một phần của tổn thương được chiếu tia với PDL
595 nm và nửa còn lại bằng laser kết hợp với bước sóng 595 nm và 1064 nm. Kết quả cho thấy không có sự khác biệt về hiệu quả giữa bên chỉ dùng PDL và bên kết hợp laser. Tuy nhiên, đóng vảy hoặc bóng nước xảy ra ở hai bệnh nhân (3%) ở bên chỉ dùng PDL và 19 bệnh nhân (31%) ở bên kết hợp laser. Sẹo xuất hiện ở ba bệnh nhân ở bên kết hợp laser.
Nghiên cứu này so sánh các hiệu quả và tác dụng phụ của 595-nm PDL và laser kết hợp (595-nm PDL được chiếu trước, và Nd: YAG 1064-nm được chiếu sau khoảng thời gian 1s). Mặc dù laser kết hợp chiếu tia PDL 595 nm, hiệu quả tương tự như khi sử dụng riêng laser Nd: YAG xung dài, bởi vì được thực hiện trước, metHb được tạo ra từ PDL và laser Nd: YAG 1064 nm xung dài tăng nhiệt độ lên vì là chromophore. Kết quả cho thấy laser Nd: YAG xung dài có tác dụng phụ cao hơn, như đã giải thích trước đây về sự khác biệt về tác dụng phụ giữa PDL và laser xung dài.
Yang và cộng sự đã điều trị bớt rượu vang (PWS) ở 17 bệnh nhân. Tổn thương được chia thành bốn vùng [25]. Một vùng được xử lý với PDL 595-nm (Scleroplus; Candela Corp, Wayland, MA) với các thông số là 8 J/cm2, 7 mm, 1,5 ms. Ba vùng còn lại được điều trị bằng laser Nd:YAG 1064-nm (Modified Coolglide; Altus Medical, Inc., Brisbane, CA) với mật độ năng lượng bằng 1.0, 0.8 và 0.6 lần liều gây ban xuất huyết tối thiểu (minimum purpura dose, MPD). MPD được định nghĩa là mật độ năng lượng với đáp ứng làm tối màu (ban xuất huyết) kéo dài ít nhất 15 phút sau ít nhất hai đến ba lần chiếu tia. Kết quả cho thấy rằng, trước tiên, MPD của laser Nd:YAG xung dài thay đổi rất nhiều từ 40 đến 250 J/cm2 khi được đo bằng mật độ năng lượng. Thứ hai, sự cải thiện mục tiêu giữa PDL và laser Nd:YAG xung dài (MPD 1.0) là 50–75%, tức là không có sự khác biệt. Thứ ba, mức độ hài lòng của bệnh nhân được đo bằng VAS (visual analog scale) lần lượt là 4,85 và 5,84. Laser Nd:YAG xung dài cho thấy mức độ hài lòng cao hơn (p <0,05). Ban xuất huyết trong laser Nd:YAG xung dài kéo dài 3 ngày, trong khi ban xuất huyết trong PDLs kéo dài 7–10 ngày. Nói cách khác, thời gian hồi phục của bệnh nhân với laser Nd:YAG xung dài là ngắn. Thứ tư, khi bắt đầu nghiên cứu, laser Nd:YAG xung dài, giống như PDL, được thực hiện với các thông số xác định. Nhưng sau khi sẹo xuất hiện ở bệnh nhân đầu tiên, nghiên cứu được tiến hành sau khi xác định MPD. Năng lượng đã dùng trên bệnh nhân có sẹo gấp 1,2 lần và 1,7 lần MPD.
Như có thể thấy trong nghiên cứu này, cả laser PDL và laser Nd:YAG xung dài đều có tác dụng như nhau nếu chúng có cùng mức năng lượng gây ra phản ứng giống nhau đối với mô. Tuy nhiên, ngay cả khi laser Nd:YAG xung dài chỉ dùng mức gấp 1,2 lần MPD, các tác dụng phụ như sẹo có thể xảy ra. Mặt khác, PDL được biết là an toàn ngay cả khi được chiếu với năng lượng gấp hai lần MPD mà không làm lạnh biểu bì. Nói cách khác, laser Nd:YAG xung dài có cửa sổ điều trị hẹp hơn PDL. Ngoài ra, MPD trong laser Nd:YAG xung dài thay đổi từ 40 đến 250 J/cm2 khi được đo bằng mật độ năng lượng. Do đó mật độ năng lượng rất khó điều chỉnh và có thể để lại sẹo trong quá trình
thử nghiệm. Tuy nhiên, do thời gian ban xuất huyết ngắn nên sự hài lòng đối với laser Nd:YAG xung dài cao hơn so với PDL, nhưng nếu PDL cũng có công nghệ giảm năng lượng và giảm thiểu ban xuất huyết, tôi nghĩ sự hài lòng của bệnh nhân sẽ tương tự (điều này sẽ được giải thích một lần nữa trong “macropulse lý tưởng”).
Tại sao laser Nd:YAG xung dài có cửa sổ điều trị hẹp và các MPD khác nhau? Đầu tiên, khi chiếu tia laser Nd:YAG xung dài 1064 nm, hệ số hấp thụ tăng lên ba lần do sản sinh metHb. Ngoài ra, khối máu đông xảy ra và sự mất nước làm tăng nồng độ của chromophore. Do đó, laser Nd:YAG có thời gian xung dài và kết quả là nhiệt độ tăng nhanh. Thứ hai, tỷ lệ phần trăm mạch máu ở da là 0,05 ở PWS màu hồng và 0,25 ở PWS màu tím sẫm và phì đại. Sự tăng nhiệt ở khối da tỷ lệ với tổng năng lượng trên một đơn vị thể tích. Tổng năng lượng không chỉ liên quan đến nhiệt độ mà còn liên quan đến tỷ lệ của các mạch máu. Do đó, MPD khác nhau đối với từng tổn thương và phạm vi điều trị bị thu hẹp do tia laser Nd:YAG thâm nhập sâu hơn PDL và do đó làm tăng tỷ lệ mạch máu [25].
Mặt khác, tại sao PDL an toàn? Tiếp theo, chúng ta sẽ xem xét macropulse được sử dụng trong PDL xung dài.
Laser nhuộm xung (PDL)
Macropulse
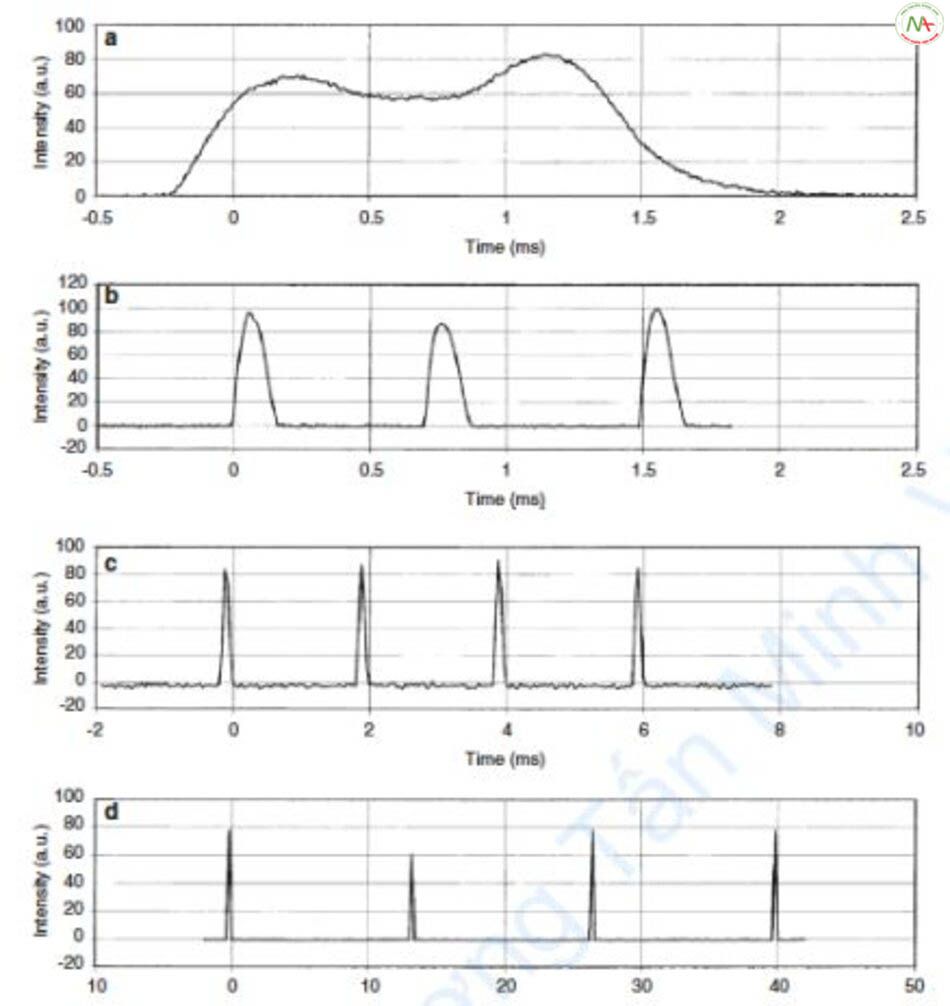
Macropulse là phương pháp chiếu một số xung nhỏ (subpulse) liên tiếp để làm cho thời gian tồn tại của xung dài hơn thời gian của các xung nhỏ [2]. Nó còn được gọi là “xung tàu lửa”, bởi vì kết nối của các xung tương tự như kết nối của tàu lửa. Laser có xung macropulse điển hình là PDL.
Nếu khoảng thời gian xung ban đầu là 1,5 ms, tia laser phải được chiếu liên tục trong 1,5 ms (Hình 6.14a) và quá trình chiếu tia phải hoàn thành sau 1,5 ms. Đây được gọi là “xung dài thực sự” [16]. Tuy nhiên, PDL thực tế mà chúng tôi sử dụng, V-beam, không thể tạo ra thời gian xung dài 1,5 ms, mà chỉ 0,45 ms. Vì vậy, 0,45 ms được chiếu xạ ba lần liên tiếp để tăng nhiệt độ trong 1,5 ms, tương tự như một xung dài thực sự.
Lý do tạo macropulse như sau. Để tạo ra một xung dài thực sự, cần phải có công suất cao, nhưng rất khó để tạo ra công suất cao khi laser xung dài đã đang được phát triển. Lúc này, người ta thấy rằng chiếu tia một lần và chiếu tia nhiều lần đều có kết quả như nhau. Do đó, một laser xung dài dùng macropulse bằng cách chiếu liên các subpulses có mức năng lượng thấp (Hình 6.15).
Macropulse được áp dụng cho các loại laser khác nhau. Như đã thấy trước đó, laser PDL và Er:YAG cũng sử dụng các macropulse. Tôi cũng nghĩ rằng chế độ PTP của laser Q-switched Nd: YAG 1064 nm và laser diode công suất thấp (ví dụ: laser Soprano trong triệt lông) cũng áp dụng khái niệm macropulse.
Vậy sự khác biệt giữa macropulse và xung dài thực sự là gì? Đầu tiên, điểm khác biệt chính là rất khó để các macropulse tạo ra nhiệt độ cao hơn các xung dài thực sự. Trong thời gian nghỉ giữa các subpulses, nhiệt độ giảm xuống, dẫn đến nhiệt độ thấp hơn so với xung dài thực. Tuy nhiên, điều này có thể đóng vai trò là một lợi thế vì nhiệt độ thấp hơn có ít tác dụng phụ hơn (xem “xung dài thực và xung dài giả (macropulse)”).
Thứ hai, các đặc tính của subpulse vẫn còn [2]. Ví dụ, trong trường hợp PDL, khi thời gian xung dài tính bằng mili giây được tạo ra với macropulse, ban xuất huyết sẽ không xảy ra do hiệu ứng quang nhiệt. Tuy nhiên, các đặc tính của subpulse dưới 0,45 ms vẫn còn và ban xuất huyết xảy ra do hiệu ứng quang cơ.
Thứ ba, ngay cả với cùng một loại laser, đáp ứng và mật độ năng lượng thực tế của mỗi tia laser có thể khác nhau ngay cả khi sử dụng cùng thời gian xung và mật độ năng lượng. Điều này là do thời gian xung và hình dạng của subpulse, mật độ năng lượng và số lượng tia subpulse khác nhau giữa các nhà sản xuất.
Các thông số laser có thể hoán đổi cho nhau không?
Người ta thường cho rằng ngay cả các laser có cùng bước sóng cũng không thể chia sẻ các thông số laser vì sự chênh lệch của năng lượng thực tế. Điều này có đúng không? Máy laser là loại máy chuyển đổi năng lượng ánh sáng có công suất yếu thành tia laser có công suất lớn. Các loại đèn flash khác nhau sử dụng lượng photon khác nhau nhưng tạo ra các photon có cùng bước sóng. Ngoài ra, nếu cùng một lượng photon được đo ở đầu ra, thì năng lượng sẽ giống nhau ngay cả khi các nhà sản xuất khác nhau. Do đó, ngay cả khi các nhà sản xuất khác nhau, các thông số laser có thể được chia sẻ nếu các giá trị đầu ra đo được giống nhau.
Nhưng macropulse là một ngoại lệ. Macropulse không thể chia sẻ các thông số laser vì các nhà sản xuất khác nhau có thời gian xung khác nhau và hình dạng của subpulse, mật độ năng lượng và số lượng tia subpulse [19]. Nói cách khác, nếu đó là laser xung thực, ngay cả laser do các nhà sản xuất khác sản xuất cũng có thể chia sẻ thông số. Đặc biệt, laser Q-switched là xung thực, cho phép chúng ta chia sẻ các thông số. Do đó, có thể thu được kết quả tương tự với các thông số giống nhau ngay cả khi sử dụng máy laser khác với máy được trình bày trong tài liệu.
Tuy nhiên, rất khó để chia sẻ 100% tất cả các thông số giữa các máy laser. Bên cạnh cấu trúc xung như macropulse, thông số kỹ thuật tay cầm (loại và chất lượng chùm tia) và các thiết bị làm mát là khác nhau giữa các nhà sản xuất. Ngoài ra, khi laser được dùng, công suất của đèn bị giảm, do đó mật độ năng lượng thực tế bị giảm so với mật độ năng lượng hiển thị trên bảng điều khiển thiết bị. Do đó, các thông số năng lượng có thể khác nhau giữa các máy laser của cùng một nhà sản xuất.
Vậy dựa trên cơ sở nào để chúng ta có thể so sánh các kết quả với nhau và lựa chọn các thông số dựa trên kết quả trong nghiên cứu? Những gì chúng ta có thể đặt làm tham chiếu là end point [7]. Nói cách khác, mức năng lượng có thể được ước tính thông qua phản ứng mô do tia laser gây ra. Ví dụ: nếu đốm nâu sậm đi ở 16 J/cm2 với laser alexandrite xung dài 755 nm của nhà sản xuất A và sậm đi ở 20 J/cm2 với với laser của nhà sản xuất B, thì chúng ta có thể kết luận rằng mặc dù các mật độ năng lượng khác nhau, nhưng mức năng lượng là tương tự. Tất nhiên, không thể so sánh mức năng lượng chính xác với end point. Có sai sót khi quan sát, sai lệch nhiều, và trên hết, trong một số trường hợp end point không xảy ra.
Xung dài thực và xung dài giả (macropulse)
Đặc biệt, chúng ta phải lưu ý sự khác biệt đầu tiên giữa macropulse và xung dài thực. Trái ngược với xung dài thực, marcopulse còn được gọi là xung dài giả. Khi so sánh IPL, một ví dụ điển hình của xung dài thực và PDL, một ví dụ điển hình về xung dài giả, một số người nói rằng IPL tốt hơn. Nó có tốt hơn chỉ vì nó được đặt tên là ” thực?” Sự khác biệt cụ thể giữa một xung dài thực sự và một xung dài giả (macropulse) là gì?
Những gì chúng ta muốn cuối cùng là làm tăng nhiệt độ đến ngưỡng mà các mạch máu đông tụ và co lại. Tuy nhiên, không chỉ nhiệt độ mà thời gian cũng đóng một vai trò quan trọng trong sự thay đổi nhiệt dưới 100°C. Nói cách khác, nó tuân theo phương trình Arrhenius (xem Mục 9.2.3 trong “Chương 9”). Có hai phương pháp xử lý có thể áp dụng theo phương trình Arrhenius. Thứ nhất, phương pháp tăng nhiệt độ cao trong thời gian ngắn (phương pháp A), và phương pháp thứ hai, tăng nhiệt độ thấp trong thời gian dài (phương pháp B). Cả hai phương pháp đều có tác dụng như nhau. Tuy nhiên, phương án B có ít tác dụng phụ hơn và cửa sổ điều trị rộng hơn (xem Phần 9.2.6 trong “Chương 9”).
Trong IPL, nhiệt độ được tăng lên trong thời gian ngắn do ánh sáng liên tục được chiếu trong suốt thời gian xung. Mặt khác, trong PDL, nhiệt độ tăng lên trong quá trình của chiếu của subpulse, nhưng nhiệt độ lại giảm xuống khi bị nguội ở thời gian chờ. Subpulse thứ hai được chiếu mà không bị giảm xuống nhiệt độ ban đầu, do đó nhiệt độ tạo ra cao hơn nhiệt độ tạo ra trong subpulse thứ nhất. Lặp đi lặp lại, nhiệt độ tăng chậm trong thời gian dài. Điều này tương ứng với phương pháp B trong phương trình Arrhenius.
Do đó, tôi tin rằng cả IPL và PDL đều có tác dụng như nhau nếu chọn thời gian xung thích hợp và mật độ năng lượng thích hợp, nhưng PDL an toàn hơn IPL.
Hãy cùng tìm hiểu lý do tại sao phương trình Arrhenius lại áp dụng cho liệu pháp laser mạch máu hơn là lý thuyết về quá trình quang nhiệt có chọn lọc.
Phương trình Arrhenius
Ba giai đoạn của mô hình quang nhiệt là giai đoạn quang, giai đoạn nhiệt và quá trình biến tính mô (xem Phần 3.7.1 trong “Chương 3”). Đầu tiên, trong giai đoạn quang, bước sóng và độ sâu của mô đích được xem xét. Thứ hai, giai đoạn nhiệt là quá trình làm nóng nhiệt động. Đây là một quá trình áp dụng lý thuyết quang nhiệt chọn lọc và lý thuyết mở rộng về quang nhiệt chọn lọc như một quá trình tăng nhiệt độ tại chỗ. Do đó, thời gian xung nên được xem xét. Thứ ba, quá trình biến tính mô là một quá trình hóa học. Nếu chỉ tăng nhiệt độ cục bộ bởi pha nhiệt, mô không bị biến tính. Để sự biến tính của mô xảy ra trong hiệu ứng quang nhiệt dưới 100°C, cần có đủ thời gian cộng với nhiệt độ (phương trình Arrhenius).
Dựa trên khái niệm này, Murphy và cộng sự xác định các thời điểm khác nhau trong quá trình chiếu tia laser (Hình 6.16) [26].
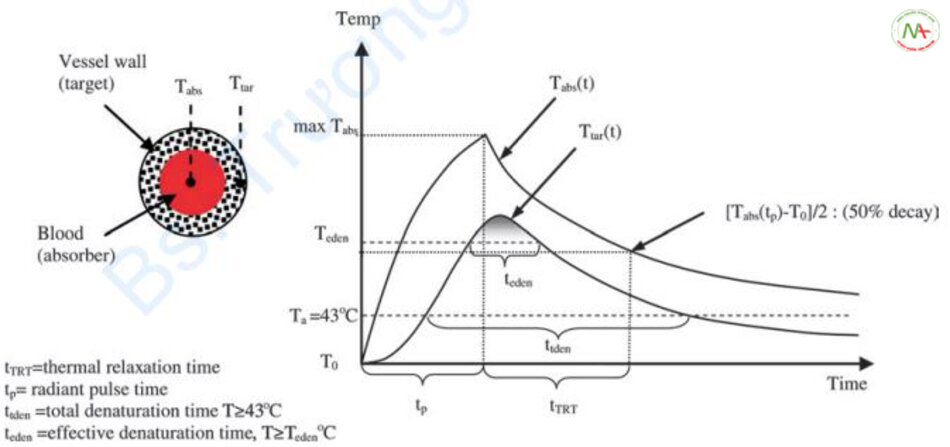
Đầu tiên, thời gian xung (độ rộng xung, tp). Thời gian xung xác định tổng năng lượng đi vào mô. Thứ hai, tổng thời gian biến tính (ttden). Đây là thời gian mà nhiệt độ trên 43°C trong mô. Nhiệt độ tối thiểu xảy ra biến tính mô được biết là trên 5°C nhiệt độ cơ thể. Murphy và cộng sự coi nhiệt độ này là 43°C. Thứ ba, thời gian biến tính hiệu quả (teden). Đây là thời điểm mà 99% các mô thực tế bị biến tính. Nhiệt độ tại thời điểm này có thể được định nghĩa là nhiệt độ hiệu quả (hoặc ngưỡng) (Teden). Do đó, thời gian biến tính hiệu quả nhỏ hơn hoặc bằng tổng thời gian biến tính (teden ≤ ttden). Thứ tư là TRT (tTRT) được định nghĩa bởi lý thuyết quang nhiệt có chọn lọc và lý thuyết mở rộng về quang nhiệt chọn lọc.
Thực tế quan trọng ở đây là không có mối liên hệ giữa thời gian biến tính hiệu quả mong muốn (teden) và TRT (tTRT), là cơ sở của thời gian xung trong điều trị bằng laser trong quá trình gia nhiệt thoáng qua.
Bây giờ chúng ta hãy xem xét điều trị mạch máu dựa trên phương trình Arrhenius (Hình 6.17). Với 33 ms, nhiệt độ đông tụ cho máu, collagen động mạch và khối da lần lượt là 90.4, 88 và 70°C. Do đó, theo phương trình Arrhenius, nếu nhiệt độ của toàn bộ da tăng lên, collagen trong động mạch hoặc khối da sẽ biến tính trước khi máu đông lại và gây ra các phản ứng phụ. Một cách để khắc phục điều này là sử dụng lý thuyết quang nhiệt có chọn lọc hoặc lý thuyết mở rộng về quang nhiệt có chọn lọc. Đó là lý do tại sao TRT (hoặc TDT) có tầm quan trọng hàng đầu. Tuy nhiên, cuối cùng, sự biến tính của mô dựa trên phương trình Arrhenius. Trong trường hợp này, thời điểm quan trọng là Teden, không phải TRT.
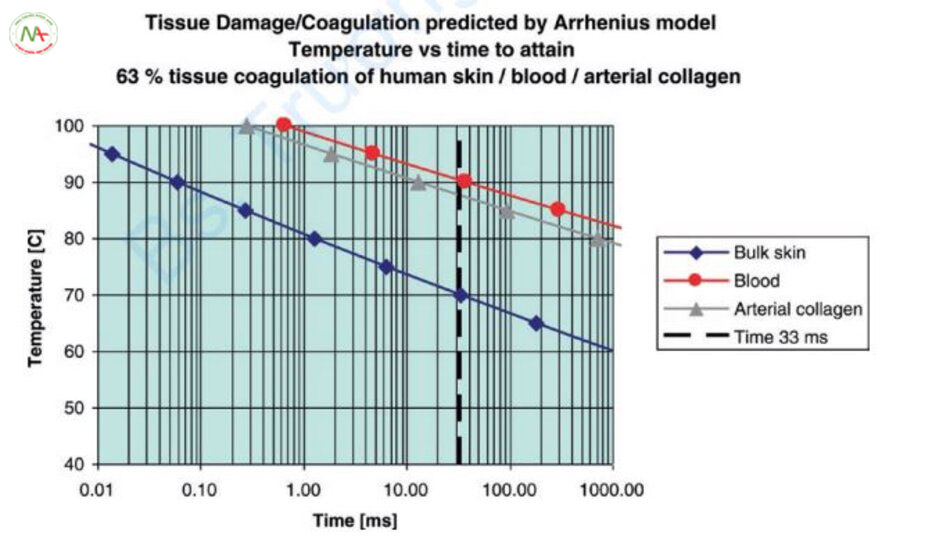
Hiện tượng không được điều trị bằng TRT thực tế đã được ghi nhận thấy trong điều trị mạch máu. Độ dày mạch máu của PWS là 10–300 µm và TRT tương ứng là 0,057–51 ms. Khoảng thời gian xung 0,0003–0,36 ms được sử dụng trong PDL theo TRT, nhưng các mạch máu kháng điều trị đã được thấy. Tại sao lại có hiện tượng này? Collagen động mạch phải trên 99,4°C và mạch máu phải trên 101°C để quá trình biến tính collagen xảy ra dưới 0,36 ms. Do đó, hiện tượng tạo khoang nội mạch xảy ra và thành mạch máu bị phá hủy, dẫn đến ban xuất huyết [26]. Đây không phải là kết quả mong muốn vì các mạch máu có thành bị phá hủy có thể được tái tạo.
Ngược lại, hãy xem các mạch máu có độ dày tối thiểu có thể được điều trị theo phương trình Arrhenius (Hình 6.17). Collagen động mạch phải ít nhất là 100°C. Lúc này, thời gian tương ứng với mô hình Arrhenius là 0,296 ms. Chiều dày mạch máu tương ứng với TRT 0,296 ms là 25,5 µm. Do đó, bất kể thời gian xung của laser PDL ngắn đến đâu, cũng không thể điều trị các mạch máu có kích thước 25,5 µm trở xuống chỉ bằng hiệu ứng quang nhiệt. Ban đỏ biểu hiện với nhiều màu sắc khác nhau tùy thuộc vào độ dày của mạch máu. Các mạch máu từ 10 đến 20 micromet biểu hiện dưới dạng màu hồng lan tỏa và các mạch máu tương đối lớn 50 µm xuất hiện dưới dạng màu tím [7]. Vì vậy, PDL không thể điều trị ban màu hồng.
Lần này, chúng ta hãy xem xét các mạch máu có độ dày tối đa có thể điều trị được. Ví dụ, giả sử rằng có một tia laser PDL có thời gian xung 1,5–10 ms, nhiệt độ collagen của động mạch tương ứng với thời gian xung là 95.7 và 90.7°C, và nhiệt độ của máu không vượt quá 100°C. Nếu phương pháp chiếu tia là chiếu liên tục, tức là xung dài thực, thì có thể xử lý các mạch máu dày tới 150 µm tương ứng với TRT 10 ms. Do đó, laser PDL có thời gian xung tối đa 10 ms không thể điều trị các mạch máu lớn hơn 150 µm [26].
Dựa trên những điều trên, hãy xem tại sao macropulse được sử dụng trong laser PDL. Ví dụ: xem xét một PDL có xung thực là thời gian xung 0,45 ms. Khoảng thời gian xung 0,45 ms có thể điều trị các mạch máu tương ứng với độ dày từ 30–100 µm. Nếu tia laser được chiếu với thời gian xung 0,45 ms với xung thực, các mạch máu có thể được điều trị mà không có ban xuất huyết. Tuy nhiên, xem xét công thức Arrhenius, phương pháp sử dụng năng lượng cao trong thời gian xung ngắn (phương pháp A) có một cửa sổ điều trị hẹp. Ngoài ra, khi mạch máu vỡ ra ở nhiệt độ trên 100°C, ban xuất huyết có thể xuất hiện, dẫn đến tái phát mạch máu. Mặt khác, trong phương pháp sử dụng năng lượng thấp trong thời gian xung dài (phương pháp B), do thời gian xung dài (ví dụ: 4,5 ms), các mạch máu 30–100 µm tương ứng với thời gian xung 0,45 ms bị bỏ qua và không thể được điều trị do tính chọn lọc nhiệt động học (TRT <PD) trong giai đoạn nhiệt của mô hình quang nhiệt. Tóm lại, phương pháp B không thể điều trị mạch máu vì tính chọn lọc nhiệt động học (thermal kinetic selectivity, TKS). Để khắc phục điều này, macropulse được sử dụng. Khi sử dụng một macropulse bằng cách chiếu các subpulse năng lượng thấp (0,45
ms) nhiều lần, các photon được hấp thụ cóchọn lọc trong các mạch máu 30–100 µm (TRT ≥ PD), và vì subpulse được lặp lại và có thời gian xung dài, mạch máu không bị vỡ và phạm vi điều trị có thể được mở rộng.
Macropulse cũng có thể được sử dụng để điều trị các mạch máu dày. Ví dụ, nếu nhiệt độ duy trì tối thiểu do subpulse tạo ra là khoảng 88°C và được duy trì trong khoảng thời gian 40 ms, thì các mạch máu có độ dày lên đến 300 µm có thể được xử lý.
6.6.5 Tái tạo và tái xuất hiện mạch máu
Nghiên cứu được đề cập trước đó bởi Murphy và cộng sự dựa trên tiền đề rằng nhiệt độ của máu không được trên 100°C vì hiện tượng ban xuất huyết không nên xảy ra. Tại sao không nên có ban xuất huyết trong quá trình PDL?
Sau khi điều trị bằng laser mạch máu, các mạch máu tái tạo và các triệu chứng tái phát. Hiện tượng tân mạch xảy ra ngay cả sau liệu pháp xơ hóa để điều trị giãn tĩnh mạch cũng như sau laser mạch máu [2]. Điều này rất khó hiểu, nhưng vẫn có rất ít nghiên cứu về hiện tượng này.
Cơ chế xảy ra được giả định như sau. Trong quá trình lành thương, mô được tái tạo khi mô bị tổn thương được thay thế bằng các mạch máu mới. Laser mạch máu cũng làm tổn thương da và các mạch máu mới tái tạo và tái xuất hiện. Người ta tin rằng các tế bào viêm được tạo ra trong quá trình chữa lành vết thương tiết ra các cytokine khác nhau, đặc biệt là các cytokine làm tăng các yếu tố tạo mạch.
Các phương pháp phòng ngừa như sau. Đầu tiên, chúng ta có thể thử dùng Rapamune (Pfizer Inc. New York, NY, USA), một loại thuốc để ngăn chặn phản ứng đào thải ở bệnh nhân ghép thận. Rapamune được biết là có tác dụng ức chế sản xuất cytokine và có một số báo cáo rằng nó có hiệu quả trong việc tái tạo mạch máu sau khi điều trị bằng laser. Thứ hai, imiquimod là một chất điều hòa miễn dịch được sử dụng để ngăn ngừa tái phát sau khi dùng laser trên PWS, nhưng kết quả rất kém.
Xem xét các cơ chế tái tạo và tái phát mạch máu, tôi tin rằng thu nhỏ mạch máu hoặc tạo đông máu nội mạch để làm tắc nghẽn mạch máu là cách để giảm tái tạo và tái phát mạch máu, chứ không phải là làm vỡ mạch máu và phát triển thành viêm. Vậy làm thế nào để chúng ta giữ được nhiệt độ duy trì tối thiểu cho quá trình đông máu trong khi nhiệt độ subpulse không vượt quá 100°C?
Macropulse lý tưởng
Hình 6.18 cho thấy mật độ năng lượng trong đó ban xuất huyết xảy ra theo thời gian xung và số lượng subpulse. Hình này cho thấy ngưỡng ban xuất huyết tăng lên khi lượng subpulse tăng lên. Thực tế là “ngưỡng ban xuất huyết tăng lên khi tăng lượng subpulse ” có nghĩa là gì?
![Laser mạch máu và điều trị ban đỏ - Bs. Trương Minh Tấn Vũ 57 Hình 6.18 Ngưỡng xuất huyết so với số lượng subpulse. Dữ liệu thực nghiệm dành cho laser PDL 595 nm, thời gian xung 40 ms [27]. Tính toán mô hình hóa (đường liền nét) cho 40, 20, 10 và 6 ms theo Mirkov et al. [10]. Sự gia tăng số lượng các subpulse có tác động lớn hơn, làm tăng ngưỡng ban xuất huyết đối với các xung dài hơn.](https://nhathuocngocanh.com/wp-content/uploads/2022/09/laser-mach-mau-va-dieu-tri-ban-do-anh-18.jpg)
Trong Hình 6.19, khi số lượng subpulse là 3, 6 và 8, mật độ năng lượng của mỗi subpulse lần lượt là 2.3, 1.9 và 1.6 J/cm2. Khi số lượng subpulse tăng lên, mật độ năng lượng của mỗi subpulse sẽ giảm. Nói cách khác, thay vì nghĩ rằng “ngưỡng ban xuất huyết tăng khi lượng subpulse tăng lên” thì tốt hơn nên nghĩ rằng “năng lượng của mỗi subpulse giảm khi lượng subpulse tăng lên”.
Vậy sự khác biệt giữa một số lượng nhỏ các subpulse và một số lượng lớn các subpulse là gì?
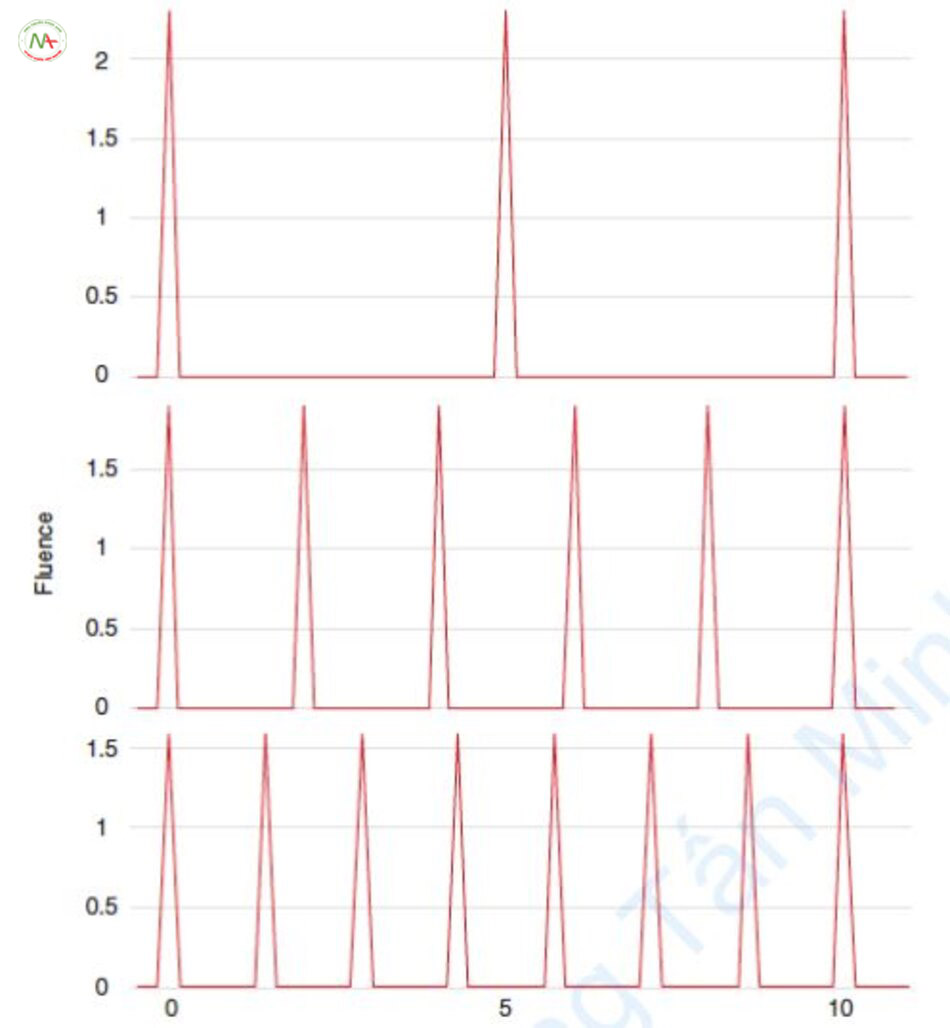
Trước đó, đã được biết rằng nhiệt độ duy trì tối thiểu của subpulse phải được duy trì, ví dụ 88°C mà không vượt quá 100°C. Sự thay đổi nhiệt độ của macropulse tăng lên đến nhiệt độ cao khi chiếu subpulse, và sau đó nhiệt độ giảm xuống trong thời gian chờ khi không chiếu tia. Nhiệt độ thấp nhất phải trên 88°C, nhiệt độ duy trì tối thiểu. Nhiệt độ của subpulse càng cao thì nhiệt độ tối thiểu tại thời điểm chờ càng cao. Tuy nhiên, khi nhiệt độ của subpulse quá cao vượt quá 100°C, ban xuất huyết sẽ xuất hiện. Đặc biệt, ban xuất huyết sẽ xảy ra nếu nồng độ chromophore cao mặc dù năng lượng của subpulse là như nhau. Ngoài ra, ngay cả khi nhiệt độ tạo ra bởi subpulse không vượt quá 100°C, nếu nhiệt độ cao lặp lại, rất có thể sẽ xảy ra ban xuất huyết vì cuối cùng nó vượt quá 100°C. Vậy làm thế nào để subpulse có thể duy trì nhiệt độ duy trì tối thiểu trên 88°C mà không vượt quá 100°C? Điều này được thực hiện bằng cách tăng số lượng subpulse. Nếu subpulse được chiếu trước khi nhiệt độ giảm đủ trong thời gian chờ sau subpulse, thì nhiệt độ duy trì tối thiểu có thể được tăng lên, trong khi nhiệt độ subpulse có thể hạ xuống. Do đó, có báo cáo cho rằng PDL với 8 subpulse, so với PDL với 4 subpulse trước đây, đã
giảm năng lượng của subpulse, do đó không có ban xuất huyết ngay lập tức hoặc chậm để có thể thực hiện điều trị mạch máu mà không cần thời gian nghỉ dưỡng [28].
Để tham khảo, thời gian xung càng ngắn, năng lượng của subpulse càng thấp. Ví dụ, trong Hình 6.18, có thể thấy rằng khi số lượng subpulse tăng lên ở khoảng thời gian xung 6 ms, thì sự gia tăng của ngưỡng ban xuất huyết là nhỏ. Điều này là do năng lượng của mỗi subpulse giảm nhanh chóng vì không có đủ thời gian để làm mát giữa các subpulse.
Vậy mật độ năng lượng thích hợp trong macropulse là gì? Hãy xem lại Hình 6.18 một lần nữa. Biểu đồ trong hình này mô tả mật độ năng lượng đại diện ngưỡng ban xuất huyết. Đáp ứng mong muốn là co mạch hoặc tắc mạch do đông máu nội mạch mà không có ban xuất huyết. Do đó, năng lượng thấp hơn ngưỡng ban xuất huyết nên được sử dụng. Ví dụ, ngưỡng ban xuất huyết của PDL với 8 subpulse ở 20 ms là 16 J/cm2. Có báo cáo rằng PDL với 8 subpulse ở 20 ms đã điều trị thành công các mạch máu dưới 600 µm mà không cần thời gian nghỉ dưỡng chỉ với mật độ năng lượng 9–10 J/cm2.
Các thông số cho liệu pháp laser mạch máu
Dựa vào phần trên để tóm tắt các thông số cho liệu pháp laser mạch máu.
Đầu tiên, tùy thuộc vào bước sóng, có các loại laser có bước sóng 500–600 nm (laser 532 nm xung dài, PDL 585 nm, PDL 595 xung dài nm và IPL), Nd: YAG 1064 nm xung dài laser và laser kết hợp chiếu cả 595 và 1064 nm. Trong số này, laser Nd:YAG xung dài có chi phí mua hoặc bảo trì rẻ hơn. Vì một số ít người châu Á bị ban đỏ là triệu chứng chính, nên loại laser đầu tiên tôi khuyên dùng là laser Nd:YAG xung dài 1064-nm. Giãn mạch có thể được điều trị bằng laser Nd:YAG và điều trị ban đỏ có thể được điều trị thử trước tiên bằng kỹ thuật Genesis. Để điều trị ban đỏ không giải quyết được, có thể cần mua thêm PDL 595 nm xung dài, đắt tiền nhưng an toàn và hiệu quả. Thứ hai, thời gian xung phải bắt đầu với 30–40 ms nếu xét đến độ dày mạch máu và nhiệt động học chọn lọc, sau đó giảm tuần tự xuống 10 ms, 5 ms, 1.5 ms hoặc 450 µs trong khi kiểm tra các điểm end point. Thứ ba, spot size lớn tốt cho sự thâm nhập sâu, nhưng spot size nhỏ tốt hơn cho laser Nd:YAG xung dài. Thứ tư, mật độ năng lượng được xác định bằng cách quan sát các điểm end point. End point tốt nhất là biến mất mạch máu. Tình trạng sậm màu đi không phải là end point tốt nhất, nhưng được coi là end point tốt. Sự vỡ mạch máu và sự phát triển của ban xuất huyết có thể được coi là end point, nhưng do sự tái phát thường xuyên và thời gian nghỉ dưỡng lâu, tôi không khuyến nghị end point này. Tuy nhiên, khi sử dụng laser Nd:YAG xung dài, ban xuất huyết không nên để xảy ra. Do đó, nên sử dụng năng lượng bằng hoặc thấp hơn mật độ năng lượng gây biến mất mạch máu. Thứ năm, mật độ năng lượng phải thấp hơn ngưỡng ban xuất huyết, khi sử dụng macropulse của PDL hoặc multipulse của IPL. Chồng xung PDL hoặc IPL có hiệu quả mà không có bất kỳ tác dụng phụ nào đáng kể, nhưng laser Nd:YAG xung dài không bao giờ được chồng lên nhau, có thể sinh ra nhiều nhiệt dư và khả năng cao để lại sẹo. Thứ sáu, làm mát biểu bì là điều cần thiết để điều trị mạch máu.
Tác dụng phụ của liệu pháp laser mạch máu
Việc sử dụng laser mạch máu có thể gây ra nhiều tác dụng phụ. Có thể có đau. Trong PDL, có thể có cảm giác đau và bỏng. Có thể dùng thuốc tê tại chỗ để giảm đau. Khi sử dụng laser mạch máu, tốt hơn nên sử dụng thuốc tê tại chỗ không co mạch (tetracine, Ametop®) hơn là gây tê tại chỗ có co mạch (lidocain và prilocaine, Emla®) [1]. Bôi tê tại chỗ cũng làm xuất hiện ban đỏ, có thể cản trở việc điều trị. Ngoài ra, tốt hơn là không nên bôi thuốc tê tại chỗ khi điều trị mạch máu vì lý do đau, đau là dấu hiệu của các phản ứng phụ có thể xảy ra, có thể bị bỏ qua và các tác dụng phụ nghiêm trọng có thể không được chú ý.
Ban xuất huyết (bầm tím) có thể xảy ra, đặc biệt là trong khi điều trị PDL, thường kéo dài 7–10 ngày, tối đa 15 ngày. Ban xuất huyết không thể được che phủ bởi lớp trang điểm, vì vậy cần phải tư vấn đầy đủ với bệnh nhân trước khi điều trị. Da bị đổi màu, bóng nước hoặc đóng vảy là rất hiếm, chúng có thể do điều trị hoặc sử dụng năng lượng quá mức. Trong những trường hợp này, lớp biểu bì trở nên xám hoặc tái nhạt sau khi điều trị. Cần khuyên người bệnh đến bệnh viện thăm khám ngay nếu có những hiện tượng này và cần điều trị tích cực. Nhiễm trùng và herpes có thể xảy ra, nhưng điều này không phổ biến. Tăng sắc tố hoặc giảm sắc tố có thể xuất hiện nhưng cũng không phổ biến. Năng lượng quá mức có thể gây ra thay đổi kết cấu da hoặc để lại sẹo. Đặc biệt, hiếm gặp sẹo ở PDL, nhưng cần thận trọng với laser Nd:YAG xung dài, có tỷ lệ xuất hiện cao và có thể nặng. Tác dụng phụ cuối cùng là tổn thương tồn tại dai dẳng (không đáp ứng), tức là các tổn thương vẫn tồn tại mặc dù điều trị bằng laser.
Điều trị không dùng laser trong điều trị mạch máu và ban đỏ
Chúng ta đã xem xét laser trong điều trị các mạch máu và ban đỏ. Tuy nhiên, laser mạch máu, đặc biệt là PDL, rất tốn kém để mua và duy trì. Có cách nào điều trị mạch máu và ban đỏ mà không tốn kém nhiều không? Tôi đề nghị bốn phương pháp sau đây.
Đầu tiên, laser Nd:YAG 1064 nm xung dài có thể được sử dụng để thực hiện kỹ thuật Genesis. Schmults và cộng sự đã thực hiện kỹ thuật Genesis trên 9 bệnh nhân bằng laser Nd:YAG xung dài và nhận thấy độ dày của sợi collagen giảm, chất lượng da được cải thiện và ban đỏ được cải thiện [29].
Thứ hai, laser CO2 có thể được sử dụng để điều trị các mạch máu. Chung và cộng sự đã sử dụng kỹ thuật bắn lỗ (pinhole) với spot size 1 mm, 1 W, chế độ liên tục bằng laser CO2 [30]. Lớp bì nhú được chiếu tia với khoảng cách 3 mm. Một trường hợp cải thiện giãn mạch trên mặt đã được báo cáo. Tất nhiên, liệu pháp điều trị bắn lỗ bằng laser CO2 có thể có các tác dụng phụ như PIH hoặc tái tạo mạch máu và tái phát. Tuy nhiên, đối với một số ít trường hợp giãn mạch, u máu tuổi già và u mạch máu mạng nhện, liệu pháp bắn lỗ bằng laser CO2 có thể được sử dụng.
Thứ ba, có thể sử dụng botulinum toxin. Bloom và cộng sự trộn 300 đơn vị botulinum toxin (Dysport) với 3 mL nước muối sinh lý thông thường và sử dụng tổng cộng 15–45 đơn vị (trung bình 25 đơn vị) để tiêm da mũi, má, trán và cằm giúp cải thiện ban đỏ [31]. Bloom và cộng sự suy đoán rằng acetylcholine đóng một vai trò quan trọng trong việc giãn mạch và cải thiện ban đỏ vì độc tố botulinum ức chế acetylcholine. Kim và cộng sự so sánh và quan sát sự tiến triển trong 12 tuần của 24 bệnh rosacea dạng ban đỏ từ nhẹ đến trung bình bằng cách tiêm dưới da botulinum toxin vào một bên má và nước muối thông thường ở má bên kia [32]. Botulinum toxin (prabotulinum toxin A; NABOTA, Daewoong Pharmaceutical, Seoul, Korea) được trộn với nước muối thông thường đến nồng độ rất thấp là 1 U trên 0,1 mL. Tổng cộng 15 U được tiêm trong da vào 30 điểm với 0,05 mL tại mỗi điểm với khoảng cách 1 cm. Kết quả cho thấy ban đỏ được cải thiện từ 4 đến 8 tuần. Ngoài ban đỏ, tăng độ đàn hồi của da và hydrat hóa da có ý nghĩa thống kê.
Thứ tư, có thể dùng thuốc. Mặc dù việc điều trị các mạch máu hoặc ban đỏ là điều quan trọng, nhưng điều quan trọng hơn là phải biết tại sao chúng lại phát triển ngay từ đầu (Bảng 6.6). Có nhiều nguyên nhân khác nhau gây ra hiện tượng đỏ bừng mặt hoặc ban đỏ, tất cả đều có thể làm cho mặt đỏ lên. Vì vậy, cần thăm khám chi tiết và chẩn đoán chính xác trước khi điều trị bằng laser. Nếu thực hiện chẩn đoán thích hợp, điều trị chỉ riêng bằng thuốc có thể là đủ. Ví dụ, mụn trứng cá nên được điều trị bằng retinoids (isotretinoin) hoặc kháng sinh (doxycycline) trước khi điều trị bằng laser. Đối với viêm da cơ địa dị ứng, có thể dùng pimecrolimus bôi tại chỗ (kem Elidel 1%) hoặc kem tacrolimus. Kem bôi steroid nhẹ hoặc ketoconazole tại chỗ có thể có hiệu quả đối với bệnh viêm da tiết bã nhờn trên mặt. Đối với viêm da quanh miệng, doxycycline trong 6-12 tuần có thể có tác dụng mạnh lên ban đỏ [33].
Bảng 6.6 Nguyên nhân cấp tính và mãn tính của “mặt đỏ”
| Cấp tính | Mãn tính |
| Viêm quầng
Đợt bùng phát cấp tính của bệnh chàm:
Phát ban do ngộ độc ánh sáng |
Mụn trứng cá
Mụn trứng cá tối cấp Bệnh trứng cá đỏ Viêm da mặt mủ Bệnh chàm tiết bã Viêm da quanh miệng / mắt Bệnh vẩy nến Lupus ban đỏ dạng đĩa / ban đỏ toàn thân Viêm nang lông do vi khuẩn gram âm Thuốc gây ra:
|
Đặc biệt, bệnh trứng cá đỏ là một trong những nguyên nhân phổ biến nhất gây ra ban đỏ nên việc khám và chẩn đoán chi tiết là rất cần thiết. Để điều trị bệnh trứng cá đỏ, có thể sử dụng metronidazole (MetroGel) bôi tại chỗ mỗi ngày một lần và axit azelaic 20% có thể được sử dụng một hoặc hai lần một ngày. Có thể dùng doxycycline uống 100– 200 mg/ngày. Cũng có thể sử dụng isotretinoin 0,5 mg/kg/ngày trong 20 tuần. Đối với đỏ bừng và ban đỏ do bệnh trứng cá đỏ, có thể sử dụng gel brimonidine tại chỗ 0,33% (gel Mirvaso) như chất chủ vận alpha2-adrenergic. Ngay cả với liều lượng bằng hạt đậu, mỗi ngày một lần cũng có thể có hiệu quả. Đối với đỏ bừng và ban đỏ do bệnh trứng cá đỏ, có thể tăng dần thuốc chẹn beta-adrenergic 3,125–6,25 mg đường uống từ hai đến ba lần một ngày đến 31,25 mg. Cải thiện đáng kể có thể được nhìn thấy trong vòng 3 tuần [21].
Vì viêm da quanh miệng hoặc bệnh trứng cá đỏ là bệnh không chữa khỏi và tái phát liên tục nên việc chẩn đoán chính xác và giải thích đầy đủ cho bệnh nhân là điều quan trọng trước khi bắt đầu điều trị.
Điều trị vết bầm (ecchymoses) bằng laser mạch máu và IPL
Gần đây, khi các thủ thuật tiêm chất làm đầy hoặc botulinum toxin tăng lên, sự quan tâm đến việc ngăn ngừa và điều trị vết bầm do thủ thuật này tăng lên. Đặc biệt, nhiều nghiên cứu đã được thực hiện để xóa vết bầm nhanh chóng bằng laser mạch máu hoặc IPL.
Trước tiên, hãy tóm tắt các thuật ngữ khác nhau cho vết bầm tím [34]. Vết bầm dùng để chỉ hiện tượng máu thoát ra ngoài từ các mạch máu bị vỡ, khiến da chuyển sang màu đỏ hoặc xanh. Nó thường là một mảng dài từ 1 cm trở lên, với ranh giới rộng và
không rõ ràng. Vết bầm không phải là giãn mạch, do đó không biến mất bằng phương pháp ấn đè. Nguyên nhân bao gồm cả nguyên nhân chấn thương và không chấn thương. Mặt khác, vết bầm tím là vết bầm do tổn thương. Do đó, hiện tượng xảy ra sau thủ thuật tiêm botulinum toxin hoặc tiêm chất làm đầy là vết bầm.
Ban xuất huyết có bờ rõ ràng với các đốm hoặc mảng màu tím sẫm có kích thước 4–10 mm. Ban xuất huyết gần với phát ban hơn là vết bầm. Thử nghiệm ấn đè là cần thiết để chẩn đoán phân biệt với giãn mạch. Không giống như các vết bầm, ban xuất huyết không phải do tổn thương mà là do nhiễm trùng, thuốc và rối loạn đông máu. Các đốm xuất huyết có cùng nguyên nhân và triệu chứng như ban xuất huyết, nhưng nhỏ hơn 4 mm, do các mao mạch vỡ ra.
Các vết bầm thường đi kèm với đau và viêm các mô xung quanh và màu sắc của da thay đổi tuần tự khi oxyHb thoái hoá. Trong diễn tiến lâm sàng của vết bầm, các tế bào hồng cầu (RBCs) đầu tiên rò rỉ ra khỏi mạch máu bị phá vỡ và Hb được giải phóng, khiến da có màu đỏ. Trong vòng 1–2 ngày, chất sắt màu đỏ trong máu thay đổi và da chuyển từ đỏ sang xanh hoặc tím. Ở ngày thứ 6, da chuyển sang màu xanh lục và ở ngày thứ 9, heme phân hủy thành biliverdin (màu xanh lá cây) và bilirubin (màu vàng), biến da màu vàng nâu. Hầu hết các vết bầm sẽ hồi phục trong vòng 2-3 tuần và trở lại màu da bình thường.
Các vùng phổbiến nhất của vết bầm sau khitiêm chất làm đầy là vùng quanh miệng và quanh hốc mắt và ở lớp da, nó xuất hiện ngay dưới da, ở các lớp bì nông và ngay lớp hạ bì. Tiêm sâu hơn được biết là làm giảm vết bầm tím và kỹ thuật rẻ quạt hoặc cấy chỉ được biết là làm tăng khả năng xuất hiện vết bầm. Đặc biệt, vết bầm ít xảy ra hơn khi sử dụng kỹ thuật tiêm điểm sâu ở mức độ trên màng xương. Trong số các bệnh nhân, bệnh nhân trung niên và tuổi già dễ bị bầm tím hơn do da và lớp mỡ dưới da mỏng và chức năng đông máu giảm.
Các biện pháp phòng ngừa để giảm vết bầm trong quá trình tiêm chất làm đầy bao gồm, đầu tiên, ngừng sử dụng thuốc chống đông máu như aspirin hoặc warfarin (aspirin, warfarin, dipyridamole, clopidogrel, thuốc chống viêm không steroid NSAID, dầu cá, viên bổ sung vitamin E, St. John’s Wort, viên tỏi nén, gingko biloba và nhân sâm) 10 ngày trước khi làm thủ thuật. Thứ hai, nên sử dụng kim mỏng nhất hoặc cannula cùn, tiêm chậm và giảm thiểu số lượng điểm tiêm. Thứ ba, nên chườm đá hoặc chườm lạnh trong vài phút ngay sau khi tiêm. Thứ tư, người bệnh phải được hướng dẫn tránh vận động mạnh trong 24 h đầu để tránh tăng huyết áp.
Theo truyền thống, theo dõi được coi là lựa chọn xử lý các vết bầm tím đã xuất hiện [35]. Ép lạnh, hydrogen peroxide 15% hoặc các sản phẩm OTC (không kê đơn) như kem vitamin K đã được sử dụng, nhưng chúng không mang lại hiệu quả cao.
Gần đây, nhiều nghiên cứu đã được thực hiện về điều trị vết bầm bằng laser mạch máu như PDL và IPL [34]. DeFatta RJ và cộng sự đã chiếu PDL (V-beam, Candela) với spot size 10 mm, 6 J/cm2 và 10 ms cho 20 bệnh nhân bị bầm sau phẫu thuật. Kết quả cho thấy rằng tình trạng vết bầm giảm ở 63% bệnh nhân và những bệnh nhân được điều trị PDL sớm có kết quả tốt hơn. Karen và cộng sự chiếu PDL ở 7,5 J/cm2 và 6 ms với spot size 10 mm cho 10 bệnh nhân. Kết quả cho thấy kích thước vết bầm tím ở các vị trí được chiếu PDL thấp hơn nhiều so với các vị trí không được chiếu PDL, và cách điều trị hiệu quả nhất là khi PDL được chiếu 24-48 giờ sau khi bị tổn thương, khi Hb nhiều nhất. Mayo và cộng sự báo cáo rằng việc sử dụng PDL ngay sau khi làm thủ thuật có hiệu quả hơn so với việc chườm lạnh, hydrogen peroxide và các loại kem trị vết bầm. Alegre-Sánchez và cộng sự quan sát thấy các vết bầm tím gần như biến mất hoặc cải thiện đáng kể trong 24 giờ sau thủ thuật PDL, và quan sát thấy các vết bầm nông, sẫm màu hơn và ít phù nề dễ điều trị hơn các vết bầm sâu, ít thay đổi màu sắc và phù nề nặng. Verner I và cộng sự chiếu IPL (Dye-VL, Alma Beauty Rejuve, Alma Lasers US, Buffalo Grove, IL) với bước sóng từ 500 đến 600 nm ở 7–10 J/cm2, 10 ms, spot size 3 cm2 cho 11 bệnh nhân có vết bầm tím sau tiêm chất làm đầy [34]. Kết quả cho thấy tất cả các vết bầm được cải thiện trong 48 giờ sau IPL, tất cả các vết bầm đều được cải thiện.
Cơ chế tác động của laser mạch máu cải thiện vết bầm vẫn chưa được rõ, nhưng người ta cho rằng khi chiếu laser vào Hb của hồng cầu bị rò rỉ ra khỏi mạch máu, năng lượng sẽ được truyền đến màng tế bào và màng tế bào bị biến dạng và xảy ra quá trình ly giải tế bào, cải thiện vết bầm tím [36]. Điều trị PDL ít hiệu quả hơn trong đối với các vết bầm tím muộn, so với các vết bầm sớm, được cho là do bilirubin. Bilirubin có màu vàng và đường cong hấp thụ cao nhất ở 460 nm, rất xa so với 585 nm hoặc 595 nm được sử dụng trong laser PDL, vì vậy rất khó để xử lý bilirubin bằng PDL vì độ hấp thụ của nó thấp. Vết bầm vàng là hiện tượng muộn, vì vậy nên sử dụng PDL sớm. Cũng vì lý do đó, người ta cho rằng vết bầm ở sâu, ít đổi màu và bị phù nề nặng thì ít phù hợp để điều trị hơn vì có ít Hb hơn, chromophore và laser ở độ sâu khó xuyên qua.
Alegre-Sánchez A và cộng sự chiếu PDL sử dụng spot size 10 mm ở các khoảng thời gian xung khác nhau (0,5 so với 6 ms) và các năng lượng khác nhau (5 J/cm2 so với 8 J/cm2) [36]. Kết quả là, phương pháp sử dụng năng lượng cao (8 J/cm2) ở khoảng thời gian xung ngắn (0,5 ms) là hiệu quả nhất. Tuy nhiên, các thông số năng lượng cao ở khoảng thời gian xung ngắn có thể gây khó chịu cho bệnh nhân và các tác dụng phụ như đóng vảy, bóng nước, thay đổi sắc tố tạm thời và thậm chí làm trầm trọng thêm vết bầm. Vì vậy, đối với vết bầm sau các thủ thuật thẩm mỹ như chất làm đầy, nên sử dụng năng lượng thấp với thời gian xung dài.
Tài liệu tham khảo
- Allemann IB, Goldberg DJ (2011) Basics in dermatological laser applications. Karger Medical and Scientific Publishers
- Goldman MP (2006) Cutaneous and cosmetic laser surgery. Mosby Elsevier, Philadelphia, PA
- Nouri K (2018) Lasers in dermatology and medicine: dermatologic applications. Springer International Publishing
- Park SH, Yeo WC, Koh WS, Park JW, Noh NK, Yoon CS (2014) Laser dermatology plastic surgery, 2nd edn. (Korean). Koonja, Seoul
- Anderson RR, Parrish JA (1983) Selective photothermolysis: precise microsurgery by selective absorption of pulsed radiation. Science 220(4596): 524–527
- Ross EV, Domankevitz Y (2005) Laser treatment of leg veins: physical mechanisms and theoretical considerations. Lasers Surg Med 36(2):105–116
- Raulin C, Karsai S (2011) Laser and IPL technology in dermatology and aesthetic medicine. Heidelberg: New York
- Keyvan N (2012) Lasers in dermatology and medicine. Springer-Verlag, London
- Welch AJ, Gemert MJCV (2011) Optical-thermal response of laser-irradiated tissue. Dordrecht: London
- Mirkov M, Sherr EA, Sierra RA, Lloyd JR, Tanghetti E (2006) Analytical modeling of laser pulse heating of embedded biological targets: an application to cutaneousvascular lesions. JAppl Phys 99(11):114701
- Issa MCA, Tamura B (2018) Lasers, lights and other technologies. Springer
- (2000) Appendix. Laryngoscope 110(S95):31–37
- Ross EV, Smirnov M, Pankratov M, Altshuler G (2005) Intense pulsed light and laser treatment of facial telangiectasias and dyspigmentation: some theoretical and practical comparisons. Dermatol Surg 31(9 Pt 2):1188–1198
- Ross EV, Meehan KJ, Domankevitz Y, Trafeli JP, Annandono J, Jacoby M (2010) Use of a variable long-pulse alexandrite laser in the treatment of facial telangiectasia. Dermatol Surg 36(4):470–474
- Stratigos A, Dover JS (2000) Overview of lasers and their properties. Dermatol Ther 13(1):2–16
- Kauvar A, Hruza G (2005) Principles and practices in cutaneous laser surgery. CRC Press
- Kimel S, Svaasand LO, Cao D, Hammer-Wilson MJ, Nelson JS (2002) Vascular response to laser photothermolysis as a function of pulse duration, vessel type, and diameter: implications for port wine stain laser therapy. Lasers Surg Med 30(2):160–169
- Lee W (2008) Principles of IPL and its uses (Korean). MDworld, Seoul
- .Christiansen K, Drosner M, Bjerring P (2015) Optimized settings for Nd:YAG laser treatments of leg telangiectasias. J Cosmet Laser Ther 17(2):69–76
- Altshuler GB, Anderson RR, Manstein D, Zenzie HH, Smirnov MZ (2001) Extended theory of selective photothermolysis. Lasers Surg Med 29(5):416–432
- Habif TP (2015) Clinical dermatology. Elsevier, St. Louis, MO
- Wanner M, Sakamoto FH, Avram MM, Chan HH, Alam M, Tannous Z et al (2016) Immediate skin responses to laser and light treatments: therapeutic endpoints: how to obtain efficacy. J Am Acad Dermatol 74(5):821–833. quiz 34, 33
- Suthamjariya K, Farinelli WA, Koh W, Anderson RR (2004) Mechanisms of microvascular response to laser pulses. J Invest Dermatol 122(2):518–525
- Wang T, Chen D, Yang J, Ma G, Yu W, Lin X (2018) Safety and efficacy of dual-wavelength laser (1064 + 595 nm) for treatment of non-treated port-wine stains. J Eur Acad Dermatol Venereol 32(2):260–264
- Yang MU, Yaroslavsky AN, Farinelli WA, Flotte TJ, Rius-Diaz F, Tsao SS et al (2005) Long-pulsed neodymium:yttrium-aluminum-garnet laser treatment for port-wine stains. J Am Acad Dermatol 52(3 Pt 1):480–490
- Murphy MJ, Torstensson PA (2014) Thermal relaxation times: an outdated concept in photothermal treatments. Lasers Med Sci 29(3):973–978
- Tanghetti E (2003) Extended pulse format dye laser and itseffectson therapeutic efficacy. Lasers Surg Med 15:29
- Ross EV, Uebelhoer NS, Domankevitz Y (2007) Use of a novel pulse dye laser for rapid single-pass purpura-free treatment of telangiectases. Dermatol Surg 33(12):1466–1469
- Schmults CD, Phelps R, Goldberg DJ (2004) Nonablative facial remodeling: erythema reduction and histologic evidence of new collagen formation using a 300-microsecond 1064-nm Nd:YAG laser. Arch Dermatol 140(11):1373–1376
- Chung BY, Han SS, Moon HR, Lee MW, Chang SE (2014)Treatment with the pinhole technique using erbium-doped yttrium aluminium garnet laser for a cafe au lait macule and carbon dioxide laser for facial telangiectasia. Ann Dermatol 26(5):657–659
- Bloom BS, Payongayong L, Mourin A, Goldberg DJ (2015) Impact of intradermal abobotulinumtoxinA on facial erythema of rosacea. Dermatol Surg 41(Suppl 1):S9–S16
- Kim MJ, Kim JH, Cheon HI, Hur MS, Han SH, Lee YW et al (2019) Assessment of skin physiology change and safety after intradermal injections with botulinum toxin: a randomized, double-blind, placebo-controlled, split-face pilot study in rosacea patients with facial erythema. Dermatol Surg 45(9):1155–1162
- Layton AM (2009) Dermatological causes of a ‘red face’. Medicine 37(5):249–254
- Verner I, Prag Naveh H, Bertossi D (2019) Treatment of injection-induced ecchymoses with light/laser-assisted technology. Dermatol Ther 32(3):e12861
- Jeong GJ, Kwon HJ, Park KY, Kim BJ (2018) Pulsed-dye laser as a novel therapeutic approach for post-filler bruises. Dermatol Ther 31(6):e12721
- Alegre-Sanchez A, Saceda-Corralo D, Segurado-Miravalles G, de Perosanz-Lobo D, Fonda-Pascual P, Moreno-Arrones OM et al (2018) Pulsed dye laser on ecchymoses: clinical and histological assessment. Lasers Med Sci 33(3):683–688