COVID-19
Huyết tương hồi phục trong Covid-19: Các cơ chế hoạt động có thể xảy ra
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Để tải bài viết Huyết tương hồi phục trong Covid-19: Các cơ chế hoạt động có thể xảy ra file PDF vui lòng click vào link ở đây.
Tác giả: Manuel Rojasa, Yhojan Rodrígueza, Diana M. Monsalvea, Yeny Acosta-Ampudiaa, Bernardo Camachoc, Juan Esteban Gallod, Adriana Rojas-Villarragae, Carolina Ramírez-Santanaa, Juan C. Díaz-Coronadof, Rubén Manriqueg, Ruben D. Mantillaa, Yehuda Shoenfeldh,i, Juan-Manuel Anayaa
Biên dịch: ThS. BS. Đào Thị Mỹ Vân

Hội chứng hô hấp cấp tính nghiêm trọng coronavirus 2 (SARS-CoV-2) là nguyên nhân gây ra đại dịch coronavirus 2019 (COVID-19). Các lựa chọn điều trị bao gồm thuốc chống sốt rét, kháng vi-rút và vắc-xin đang được nghiên cứu. Trong khi đó, đại dịch hiện nay đã thu hút sự chú ý hơn các công cụ trị liệu cũ để điều trị các bệnh truyền nhiễm. Huyết tương hồi phục (HTHP) là lựa chọn đầu tiên trong tình huống hiện tại, vì nó đã được sử dụng thành công trong các đợt bùng phát coronavirus khác. Ở đây, chúng tôi thảo luận về các cơ chế hoạt động có thể có của HTHP và tác động trở lại của chúng trong bệnh sinh COVID-19, bao gồm trung hòa trực tiếp vi rút, kiểm soát hệ thống miễn dịch hoạt động quá mức (tức là bão cytokine, tỷ lệ Th1/ Th17, kích hoạt bổ thể) và điều hòa miễn dịch của trạng thái tăng đông máu. Tất cả những lợi ích này của HTHP được kỳ vọng sẽ đạt được tốt hơn nếu được sử dụng cho những bệnh nhân nhập viện thể không nghiêm trọng, với hy vọng giảm tỷ lệ biến chứng và tử vong.
Viết tắt: 2019-nCoV: 2019 coronavirus chủng mới; ACE-2: men chuyển Angiotensin-2; ADE: Tăng cường phụ thuộc kháng thể; BAFF: yếu tố kích hoạt tế bào B; BCR: thụ thể tế bào B; COVID-19: bệnh do Coronavirus 2019; CP: Huyết tương hồi phục; DCs: Tế bào đuôi gai; E: Phong bì; HIV: vi rút ức chế miễn dịch ở người; ICU: Đơn vị chăm sóc đặc biệt; IgG: Immunoglobulin G; IgM: Immunoglobulin M; IVIg: Globulin miễn dịch tiêm tĩnh mạch; M: Màng; MERS: hội chứng hô hấp Trung Đông; MERS-CoV: coronavirus MERS; N: Nucleoprotein; NAbs: Kháng thể trung hòa; NAT: Thử nghiệm axit nucleic; S1-RBD: protein liên kết thụ thể Spike1; SARS: Coronavirus hội chứng hô hấp cấp tính nghiêm trọng; SARS-CoV: SARS coronavirus.
⁎Tác giả nghiên cứu tại: Trung tâm Nghiên cứu Bệnh Tự miễn (CREA), Trường Y khoa và Khoa học Sức khỏe, Đại học University of Rosario, Carrera 26-63-B-51, 110010 Bogota, Colombia
1. Giới thiệu
Virus thuộc họ Coronaviridae có cấu trúc RNA sợi đơn, cảm nhận dương với chiều dài từ 26 đến 32 kilobases [1]. Coronavirus đã được nhận ra ở nhiều vật chủ là gia cầm và ở một số động vật có vú, chẳng hạn như dơi, lạc đà, chuột, mèo, chó và gần đây là ở thú ăn kiến có vảy [2-4]. Hầu hết các Coronavirus đều gây bệnh cho người nhưng chúng tạo ra các triệu chứng nhẹ hoặc nhiễm trùng không triệu chứng. Tuy nhiên, trong hai thập kỷ qua, hai loại virus gây chết người đã xuất hiện trong họ này: coronavirus gây hội chứng hô hấp cấp tính (SARS) (SARS-CoV) [5], và coronavirus gây hội chứng hô hấp Trung Đông (MERS) (MERS-CoV) [6]. Chúng được đặc trưng bởi sốt nặng (85%), ho không dứt (69%), đau cơ (49%) và khó thở (42%), với tần suất cao nhập viện chăm sóc đặc biệt (ICU) [5, 7].
Vào tháng 12 năm 2019, một thành viên mới của họ Coronaviridae có liên quan đến bệnh viêm phổi nặng đã được phát hiện ở Vũ Hán, Trung Quốc [8]. Bệnh nhân có biểu hiện lâm sàng tương tự đối với SARS-CoV và MERS-CoV như sốt cao, khó thở và phim chụp X quang phổi cho thấy tổn thương xâm lấn đa thùy [9,10]. Ban đầu, virus này được gọi là coronavirus mới 2019 (2019-nCoV) [8] và hiện được gọi là SARSCoV-2 tạo ra bệnh coronavirus 2019 (COVID-19). Tuy nhiên, nguồn gốc của vi rút vẫn chưa được biết rõ, một nghiên cứu gần đây cho thấy vi rút này có 88% đặc điểm nhận dạng với các coronavirus SARS giống dơi có tên bat-SL-CoVZC45 và batSL-CoVZXC21, cho thấy dơi là ổ chứa nhiều khả năng nhất. [4]. Điều thú vị là, phân tích phát sinh chủng loại cho thấy SARS-CoV và MERS-CoV sít sao với COVID-19 tương ứng khoảng 79% và 50%. Gần đây, người ta đã thảo luận rằng trình tự tương tự của virus với protein của con người có thể gây hại và liên quan đến các hiện tượng tự miễn dịch [11,12]. Mặc dù hiện tại có nhiều tranh luận về các chiến lược tiêm chủng nhanh chóng, nhưng có ý kiến cho rằng sẽ an toàn hơn nếu kiểm tra phản ứng chéo của các kháng nguyên vi rút khác nhau với kháng nguyên ở người để giảm xác suất phản ứng tự miễn dịch (tức là bắt chước phân tử), đặc biệt là ở những người có nền tảng di truyền bệnh tự miễn. [11,13].
Hiện nay, việc điều trị bệnh đang gặp nhiều thách thức và nguyên tắc là thiếu bằng chứng lâm sàng với các thuốc kháng vi-rút. Các chương trình điều trị với Lopinavir/ Ritonavir không chứng minh được việc giảm tỷ lệ tử vong nói chung [14]. Một thử nghiệm ngẫu nhiên có đối chứng gần đây với HydroXychloroquine, cho thấy nhiệt độ cơ thể giảm và thuyên giảm ho ở nhóm can thiệp so với nhóm chứng [15]. Tuy nhiên, cỡ mẫu nhỏ và thời gian theo dõi ngắn, không thể đưa ra kết luận về tính khả thi của nó. Một nghiên cứu khác cho rằng Azithromycin cộng với HydroXychloroquine có thể làm giảm tải lượng virus, tuy nhiên, đáp ứng lâm sàng liên quan đến phương pháp này chưa được đánh giá và vẫn chưa được xác định [16]. Sự kết hợp này gần đây có liên quan đến kết quả tồi tệ hơn khi sử dụng HydroXychloroquine ở liều cao (kéo dài QTc và tỷ lệ tử vong cao hơn) [17]. Do đó, không có một loại thuốc nào hiệu quả cũng như an toàn để quản lý COVID-19.
Do thiếu bằng chứng về điều trị COVID-19 và vắc-xin, các biện pháp can thiệp cổ điển và lịch sử được coi là lựa chọn để kiểm soát dịch bệnh. Đó là trường hợp của huyết tương hồi phục (HTHP), một chiến lược tạo miễn dịch thụ động đã được sử dụng trong phòng ngừa và quản lý các bệnh truyền nhiễm từ đầu thế kỷ 20 [18]. HTHP thu được bằng cách sử dụng phương pháp thẩm tách ở những người sống sót với các bệnh nhiễm trùng trước đó, thành phần HTHP có các kháng thể chống lại tác nhân gây bệnh. Mục tiêu chính là vô hiệu hóa mầm bệnh để diệt trừ nó [19]. Với khả năng thu được nhanh chóng, HTHP đã được coi là một biện pháp can thiệp khẩn cấp trong một số đại dịch, bao gồm vi rút Tây Ban Nha, SARS-CoV, vi rút West Nile, và gần đây là vi rút Ebola [20–24]. HTHP được sử dụng sớm sau khi các triệu chứng khởi phát cho thấy giảm tỷ lệ tử vong so với giả dược hoặc không điều trị trong các bệnh nhiễm trùng đường hô hấp cấp tính nặng do nguyên nhân virus như cúm và SARS-CoV, tuy nhiên, không đáp ứng tương tự ở bệnh do vi rút Ebola [20,25].
Trong quá trình ngưng kết, ngoài các kháng thể trung hòa (NAbs), các protein khác như các cytokine chống viêm, các yếu tố đông máu, các kháng thể tự nhiên, defensin, pentraxins và các protein chưa xác định khác được thu nhận từ người hiến tặng [26]. Theo nghĩa này, việc truyền HTHP cho những bệnh nhân mắc bệnh có thể mang lại những lợi ích hơn nữa, chẳng hạn như điều chỉnh miễn dịch thông qua cải thiện đáp ứng với quá trình viêm nặng [27]. Hơn thế nữa, bệnh COVID-19 hoạt hóa quá mức hệ thống miễn dịch gây ra siêu phản ứng viêm hệ thống hoặc “cơn bão cytokine” được điều khiển bởi IL-1β, IL-2, IL-6, IL-17, IL-8, TNFα và CCL2. Phản ứng viêm này có thể gây tổn thương phổi kéo dài dẫn đến xơ hóa và giảm dung tích phổi [28,29]. Trong tài liệu này, chúng tôi đề xuất các cơ chế có thể có lợi của việc quản lý HTHP cho bệnh nhân COVID-19 và cung cấp tóm tắt bằng chứng về chiến lược này trong đại dịch hiện nay. Ở giai đoạn chứng minh của bài báo này, đã có 56 thử nghiệm lâm sàng được đăng ký tại www.clinicaltrials.gov, bao gồm cả của chúng tôi (NCT04332835, NCT04332380), trong đó vai trò của HTHP trong COVID-19 sẽ được đánh giá.
2. Sản phẩm và thành phần
2.1. Quan điểm lịch sử
Nguyên tắc truyền HTHP được thiết lập vào năm 1880 khi nó được chứng minh khả năng miễn dịch chống lại bệnh bạch hầu dựa trên các kháng thể đã có sẵn trong máu của động vật đã có miễn dịch chủ ý với liều lượng độc tố không gây chết người, có thể được truyền sang động vật có khả năng chống lại bệnh bạch hầu đang hoạt động [30, 31]. Sau đó, người ta nhận ra rằng huyết tương miễn dịch không chỉ vô hiệu hóa mầm bệnh mà còn cung cấp các đặc tính điều hòa miễn dịch thụ động cho phép người nhận kiểm soát dòng thác gây viêm quá mức do một số tác nhân truyền nhiễm hoặc nhiễm trùng huyết gây ra [26,31]. Vào đầu những năm 1950, việc tinh chế và tập trung các globulin miễn dịch từ những người hiến tặng khỏe mạnh hoặc những bệnh nhân đã hồi phục cung cấp một lựa chọn để điều trị các bệnh truyền nhiễm nghiêm trọng cũng như các tình trạng miễn dịch bao gồm suy giảm miễn dịch nguyên phát, dị ứng và các bệnh tự miễn [30,32,33].
Một số sản phẩm máu dưỡng bệnh như immunoglobulin tĩnh mạch (IVIg) và kháng thể đa dòng hoặc đơn dòng đã được phát triển để điều trị các tình trạng nhiễm trùng [18]. Tuy nhiên, trong trường hợp khẩn cấp, chúng rất khó sản xuất và đắt tiền, và có thể không mang lại hiệu quả kiểm soát lây nhiễm thích hợp. Vì vậy, việc sử dụng HTHP đã được sử dụng rộng rãi trong các đợt bùng phát khác nhau như là lựa chọn điều trị đầu tiên do thiếu thuốc hoặc vắc-xin, và thường là cơ hội cuối cùng hoặc điều trị thử nghiệm [26].
Từ đại dịch cúm Tây Ban Nha đến đại dịch hiện tại do SARS-Cov-2 gây ra, người ta đã quan sát thấy rằng việc sử dụng HTHP làm giảm đáng kể tỷ lệ tử vong của ca bệnh. Đó là trường hợp nhiễm Cúm A (H1N1) pdm09, Cúm A Tây Ban Nha (H1N1) và SARS-CoV, trong đó việc sử dụng HTHP có liên quan đến việc giảm tỷ lệ tử vong, tỷ lệ tử vong (Bảng 1) [5,34–45,111] , và các tác dụng ngoại ý nhẹ (Bảng 2) [25,46–49]. Hơn nữa, việc sử dụng HTHP trong các coronavirus khác như SARS-CoV, làm giảm số ngày nằm viện ở những bệnh nhân nặng [42,50]. Liên quan đến việc sử dụng thở máy, ở bệnh Cúm A (H1N1) pdm09 và cúm gia cầm A (H5N1), việc sử dụng HTHP đã làm giảm thời gian thở máy xâm nhập [47,51]. Ngoài ra, người ta đã mô tả rằng việc sử dụng HTHP trong SARS-CoV và cúm gia cầm A (H5N1) đã làm giảm tải lượng vi rút trong đường hô hấp [46,49]. Hiện tại, HTHP được sử dụng trên bệnh nhân COVID-19 đã được chứng minh là làm giảm tải lượng vi rút và cải thiện tình trạng lâm sàng [38,39]. Tuy nhiên, cần phải tiến hành các thử nghiệm ngẫu nhiên có đối chứng để xác nhận tính hữu ích của can thiệp này ở cả bệnh nhân nhập viện với các triệu chứng nhẹ/ nặng và những bệnh nhân trong
ICU.
Sự an toàn của việc sử dụng HTHP là một vấn đề khác có liên quan đến dịch bệnh trong lịch sử. Hiện tại, đã có bằng chứng về sự an toàn của HTHP trong các tình huống khẩn cấp (Bảng 2). Trong các vụ dịch Cúm A (H1N1), SARS-CoV và MERS-CoV, các nghiên cứu không tìm thấy bất kỳ tác dụng phụ nào liên quan đến việc quản lý HTHP. Trong trường hợp Ebola, việc sử dụng HTHP có liên quan đến các phản ứng có hại nhẹ như buồn nôn, mẩn ngứa trên da và sốt [25]. Trong COVID-19, các báo cáo đã chỉ ra rằng việc sử dụng HTHP là an toàn và nó không gây ra các tác dụng phụ lớn. Do đó, do khả năng dung nạp và khả năng bảo vệ tiềm ẩn, HTHP là một ứng cử viên sáng giá được đánh giá như một lựa chọn điều trị để kiểm soát đại dịch hiện nay.
2.2. Thu nhận và thành phần huyết tương
Những người hiến tặng đang dưỡng bệnh phải trải qua quá trình đánh giá trước khi hiến tặng tiêu chuẩn để đảm bảo tuân thủ các quy định hiện hành về hiến huyết tương [52]. Hiện tại, những người hiến tặng đang dưỡng bệnh từ 18 đến 65 tuổi không có triệu chứng nhiễm trùng và xét nghiệm âm tính với COVID19 sau 14 ngày hồi phục được xem là đối tượng có thê hiến tặng huyết tương. Các thử nghiệm này phải được lặp lại 48 giờ sau đó và tại thời điểm hiến tặng [39,52]. Người hiến tặng từ các khu vực có các bệnh nhiệt đới khác lưu hành (ví dụ, sốt rét) nên được loại trừ. Ngoài các xét nghiệm phân tử, điều quan trọng là nhận ra tình trạng cảm xúc, khám phá tính nhạy cảm và đảm bảo không lợi dụng người hiến tặng
[53].
Thẩm tách là quy trình được khuyến nghị để lấy huyết tương. Quy trình này dựa trên việc ly tâm liên tục máu từ người hiến tặng để cho phép lấy huyết tương chọn lọc. Hiệu quả của kỹ thuật này là khoảng 400–800 mL từ một lần hiến máu. Lượng huyết tương này có thể được lưu trữ trong các đơn vị 200 hoặc 250 mL, và được đông lạnh trong vòng 24 giờ sau khi thu thập để được sử dụng trong các lần truyền tiếp theo
[54].
Vì sản xuất HTHP đòi hỏi tiêu chuẩn chất lượng cao, nó yêu cầu không có bất kỳ sự lây nhiễm nào, vì vậy các xét nghiệm tìm vi rút suy giảm miễn dịch ở người (HIV), bệnh viêm gan B, viêm gan C, giang mai, vi rút gây nhiễm trùng tế bào lympho T ở người type 1 và 2 (Human T-cell lymphotropic virus – HTLV), và Trypanosoma cruzi (nếu sống trong vùng lưu hành) nên được thực hiện [52,55]. Theo nghĩa này, xét nghiệm axit nucleic đối với vi rút HIV và viêm gan là bắt buộc để đảm bảo an toàn cho người nhận [56]. Các quy trình khác đề xuất việc bất hoạt mầm bệnh bằng riboflavin hoặc psoralen cộng với việc tiếp xúc với tia cực tím để cải thiện tính an toàn của HTHP [57].
Bảng 1: Huyết tương dưỡng sinh ở bệnh nhân nhiễm trùng đường hô hấp do Coronavirus (SARS, MERS và COVID-19).
| Tác giả | Quốc gia | Loại nghiên cứu | Căn nguyên virut | Chẩn đoán | Bao gồm các đối tượng | Không điều trị bằng HTHP | Trạng thái lâm sàng trước khi dùng HTHP | Liều HTHP | Can thiệp | Kết quả | Tử vong |
| Zhang và cộng sự
(2020) [111] |
Trung
Quốc |
Nghiên cứu hàng loại ca bệnh | Covid-19 | RT-PCR | Can thiệp: 4 | Lopinavir/Ritonavir, Interferon alpha-2b, oseltamivir, Ribavirin | Suy thoái lâm sàng | Không xác định | 200-400 mL trong một hoặc hai lần truyền liên tiếp.Một bệnh nhân nhận được 2.400 mL chia làm tám lần truyền liên tiếp | Phục hồi lâm sàng và xuất viện | 0% nhóm can thiệp |
| Shen và cộng sự
(2020) [38] |
Trung
Quốc |
Nghiên cứu hàng loại ca bệnh | Covid-19 | RT-PCR | Can thiệp: 5 | Tất cả bệnh nhân được quản lý bằng thuốc kháng vi-rút trong quá trình điều trị | Suy thoái lâm sàng | HTHP từ cùng người hiến tặng | HTHP 200–250 mL hai lần truyền liên tiếp HTHP 200 mL liều duy nhất | Cải thiện tải lượng virus và tăng kháng thể | 0% nhóm can thiệp |
| Duan và cộng sự
(2020) [39] |
Trung
Quốc |
Thử nghiệm lâm sàng | COVID-
19 |
RT-PCR | Can thiệp: 19 | Ribavirin, Cefoperazone,
Levoflaxacin, Methylprednisolone, Interferon, Peramivir, Caspofungin. |
Suy thoái lâm sàng | HTHP từ cùng người hiến tặng | HTHP 200 liều duy nhất | Cải thiện tải lượng virus và hình ảnh phổi | Giảm tải lượng virus và cải thiện hình ảnh phổi |
| Ye và cộng sự (2020)
[37] |
Trung
Quốc |
Nghiên cứu hàng loạt ca bệnh | COVID-
19 |
RT-PCR | Can thiệp: 6 | Không báo cáo | Suy thoái lâm sàng | Không xác định | HTHP 200–250 mL hai lần truyền
và tăng kháng thể |
Giảm tải lượng virus
liên tiếp kháng SARS-CoV-2 IgG và IgM |
0% nhóm can thiệp |
| Anh và cộng sự
(2020) [34] |
Hàn Quốc | Nghiên cứu một trường hợp bệnh | COVID-
19 |
RT-PCR | Can thiệp: 2 | Lopinavir/Ritonavir, hydroXychloroquine và empirical antibiotics | Suy thoái lâm sàng | Không xác định | Không xác định | Giảm tải lượng virus
liên tiếp kháng SARS-CoV-2 IgG và IgM |
0% nhóm can thiệp |
| Soo và cộng sự (2004)
[40] |
Trung
Quốc |
Nghiên cứu so sánh thuần tập | SARS-
CoV |
Định nghĩa ca bệnh theo CDC | Can thiệp: 19,
Kiểm soát: 21 |
Nhóm can thiệp: Ribavirin, 3 liều Methylprednisolone (15 g). Nhóm kiểm soát: Ribavirin, từ 4 liều trở lên Methylprednisolone (1∙5 g). | Suy thoái lâm sàng | Không xác định | HTHP 200-400 mL ngày 11 và 42 sau khi xuất hiện các triệu chứng | Tỷ lệ tử vong, thời gian nằm viện, các tác dụng phụ | Giảm 23% (p
= .03) |
| Cheng và cộng sự
(2005) [41] |
Trung
Quốc |
Nghiên cứu hàng loạt ca bệnh | SARS-
CoV |
Định nghĩa ca bệnh theo CDC và huyết thanh học | Can thiệp: 80 | Không xác định | Suy thoái lâm sàng | Không xác định | HTHP 279 mL mỗi ngày 14 | Tỷ lệ tử vong, thời gian nằm viện, các tác dụng phụ | 12.5% nhóm
can thiệp |
| Nie và cộng sự (2003) [5] | Trung
Quốc |
Nghiên cứu hàng loạt ca bệnh | SARS-
CoV |
không xác định | Can thiệp: 40 | Không xác định | Không xác định | Không xác định | HTHP liều lượng không xác định | Tử vong | 0% nhóm can thiệp |
| Yeh và cộng sự (2005)
[42] |
Đài Loan | Nghiên cứu hàng loạt ca bệnh | SARS-
CoV |
Huyết thanh học | Can thiệp: 3 | Ribavirin, MoXifloXacin,
Methylprednisolone |
Suy thoái lâm sàng | Không xác định | HTHP không rõ liều lượng vào ngày thứ 11 khi khởi phát triệu chứng | Tỷ lệ tử vong, kháng thể, tải lượng vi rút, các tác dụng phụ | 0% nhóm can thiệp |
| Zhou và cộng sự
(2003) [43] |
Trung
Quốc |
Nghiên cứu hàng loạt ca bệnh | SARS-
CoV |
Định nghĩa ca bệnh theo CDC | Can thiệp: 1
Kiểm soát: 28 |
Tất cả BN dùng Ribavirin,
Azithromycin, LevofloXacin, Steroids,thở máy xâm lân |
Người lớn tuổi có bệnh đi kèm | Không xác định | HTHP 50 mL liều duy nhất vào ngày thứ 17 khi khởi phát triệu chứng | Tỷ lệ tử vong, thời gian nằm viện | Giảm 7% (p
= .93) |
| Kong (2003)
[44] |
Trung
Quốc |
Nghiên cứu một trường hợp bệnh | SARS-
CoV |
Chẩn đoán lâm sàng | Can thiệp: 1 | Antivirals, Steroids, thở máy | Suy thoái lâm sàng | HTHP từ cùng người hiến tặng | HTHP 250 mL 2 liều vào ngày thứ 7 khi bắt đầu có triệu chứng | Tử vong | 0% nhóm can thiệp |
| Wong và cộng sự (2003) [45] | Trung
Quốc (Hongk ong) |
Nghiên cứu một trường hợp bệnh | SARS-
CoV |
Định nghĩa ca bệnh theo
WHO |
Can thiệp: 1 | Cefotaxime, LevofloXacin | Suy thoái lâm sàng | HTHP từ cùng người hiến tặng | 200 mL HTHP vào ngày thứ 14 khi bắt đầu có triệu chứng | Tử vong | 0% nhóm can thiệp |
| Ko và cộng sự (2018)
[35] |
Hàn Quốc | Nghiên cứu hàng loạt ca bệnh | MERS –
CoV |
RT-PCR | Can thiệp: 3 | Steroids | Suy thoái lâm sàng | Không xác định | HTHP không xác định liều lượng | Hiệu giá kháng thể | 0% nhóm can thiệp |
CDC: Trung tâm kiểm soát và phòng ngừa dịch bệnh; COVID-19: Bệnh do coronavirus 2019; CP: Huyết tương hồi phục; MERS-CoV: coronavirus hội chứng hô hấp Trung Đông; mL: Mililit; IgM: Immunoglobulin M; IgG: Immunoglobulin G; NA: Không có sẵn; RT PCR: Phản ứng chuỗi polymerase sao chép ngược; SARS-CoV: Coronavirus hội chứng hô hấp cấp tính nặng; WHO: Tổ chức y tế thế giới. Lấy và chỉnh sửa từ [20].
Bảng 2: Các tác dụng ngoại ý liên quan đến huyết tương hồi phục trong các đợt dịch khác nhau.
| Tác giả | Quốc gia | Căn nguyên của virus | Tác dụng phụ |
| Zhang; và cộng sự (2020) [111] | Trung Quốc | COVID-19 | Không |
| Shen và cộng sự (2020) [38] | Trung Quốc | COVID-19 | Không |
| Duan và cộng sự (2020) [39] | Trung Quốc | COVID-19 | Ban đỏ mặt tự giới hạn ở 2/10 bệnh nhân. Không có sự kiện bất lợi lớn. |
| Ye và cộng sự (2020) [37] | Trung Quốc | COVID-19 | Không |
| Anh và cộng sự (2020) [34] | Hàn Quốc | COVID-19 | Không |
| Soo và cộng sự (2004) [40] | Trung Quốc | SARS-CoV | Không |
| Cheng et al (2005) [41] | Trung Quốc | SARS-CoV | Không |
| Nie và cộng sự (2003) [5] | Trung Quốc | SARS-CoV | Không |
| Yeh và cộng sự (2005) [42] | Đài Loan | SARS-CoV | Không |
| Zhou và cộng sự (2003) [43] | Trung Quốc | SARS-CoV | Không |
| Kong và cộng sự (2003) [44] | Trung Quốc | SARS-CoV | Không |
| Wong và cộng sự (2003) [45] | Trung Quốc | SARS-CoV | Không |
| Ko và cộng sự (2018) [35] | Hàn Quốc | MERS-CoV | Không |
| Van Griensven và cộng sự (2016) [25] | Guinea | Ebola | Buồn nôn, ban đỏ da, sốt. Không có sự kiện bất lợi lớn. |
| Hung và cộng sự (2011) [46] | Trung Quốc | Influenza A(H1N1) | Không |
| Chan và cộng sự (2010) [47] | Trung Quốc | Influenza A(H1N1) | Không |
| Yu và cộng sự (2008) [48] | Trung Quốc | Influenza A(H5N1) | Không |
| Kong và cộng sự (2006) [49] | Trung Quốc | Influenza A(H5N1) | Không |
COVID-19: Bệnh do coronavirus 2019; MERS-CoV: coronavirus hội chứng hô hấp Trung Đông; SARS-CoV: Coronavirus hội chứng hô hấp cấp tính nghiêm trọng.
Không có liều lượng truyền HTHP tiêu chuẩn. Trong các nghiên cứu khác nhau đối với coronavirus, việc sử dụng HTHP nằm trong khoảng từ 200 đến 500 mL với liều lượng đơn hoặc kép (Bảng 1). Hiện tại, khuyến cáo dùng 3 mL/ kg mỗi liều trong hai ngày [54]. Chiến lược này tạo điều kiện thuận lợi cho việc phân phối các đơn vị huyết tương (250 mL mỗi đơn vị) và cung cấp một lựa chọn phân phối tiêu chuẩn trong các chiến lược y tế công cộng.
Thành phần của HTHP có thể thay đổi và bao gồm nhiều thành phần khác nhau có nguồn gốc từ máu. Huyết tương chứa hỗn hợp muối vô cơ, hợp chất hữu cơ, nước và hơn 1000 protein. Trong thành phần protein, chúng tôi tìm thấy albumin, immunoglobulin, bổ thể, đông máu và các yếu tố chống huyết khối trong số những yếu tố khác [58] (Hình. 1A). Điều thú vị là, người ta cho rằng huyết tương từ những người hiến tặng khỏe mạnh cung cấp các hoạt động điều hòa miễn dịch thông qua việc truyền vào các cytokine chống viêm và các kháng thể có vai trò ức chế bổ thể, các cytokine gây viêm và các kháng thể tự thân [27]. Những yếu tố này có thể ảnh hưởng đến khả năng điều hòa miễn dịch của HTHP ở bệnh nhân COVID-19 (xem chi tiết bên dưới).
3. Cơ chế chống vi rút
Kháng thể trung hòa (Neutralizing Antibodies-NAbs) rất quan trọng trong việc loại bỏ vi rút và được coi là thiết yếu trong việc bảo vệ chống lại các bệnh do vi rút gây ra. Miễn dịch thụ động do HTHP thúc đẩy có thể cung cấp các NAb này để hạn chế nhiễm trùng. Hiệu quả của liệu pháp này có liên quan đến nồng độ NAbs trong huyết tương của những người hiến tặng đã hồi phục [25,112]. Trong SARS-CoV và MERS được phát hiện ra rằng NAbs liên kết với protein liên kết thụ thể spike1 (S1-RBD), vùng tận cùng S1-N và S2, do đó ức chế sự xâm nhập của chúng, hạn chế sự sao chép của virus [59]. Hơn nữa, các con đường khác qua trung gian kháng thể như kích hoạt bổ thể, gây độc tế bào phụ thuộc vào kháng thể và/ hoặc thực bào cũng có thể thúc đẩy hiệu quả điều trị của HTHP.
Tian và cộng sự. [60], cho thấy qua ELISA và phép đo giao thoa Biolayer ràng buộc rằng một kháng thể đặc hiệu SARS-CoV, CR3022 và quan trọng hơn là kháng thể này không cho thấy bất kỳ sự cạnh tranh nào với thụ thể chuyển đổi men chuyển angiotensin-2 (ACE-2) để liên kết với vùng RBD COVID-19. RBD của COVID-19 rất khác nhau so với SARS-CoV ở đầu C tận cùng. Mặc dù sự khác biệt này không cho phép COVID-19 liên kết với thụ thể ACE-2, nhưng nó ảnh hưởng đến phản ứng chéo của
NAbs [60].
Một xét nghiệm trung hòa dựa trên vector giả của vi rút chậm-lentiviral để xác định chắc chắn NAbs cụ thể trong huyết tương từ những bệnh nhân đã hồi phục với SARS-CoV-2 cho thấy sự khác biệt về hiệu giá NAbs, khoảng 30% bệnh nhân không phát triển hiệu giá NAbs cao sau khi nhiễm trùng [61]. Những biến đổi này có liên quan đến tuổi, số lượng tế bào lympho và nồng độ protein phản ứng C trong máu, cho thấy rằng các thành phần khác từ huyết tương góp phần vào sự phục hồi của những bệnh nhân này.
Trong huyết tương, ngoài NAbs, còn có các kháng thể bảo vệ khác, bao gồm immunoglobulin G (IgG) và immunoglobulin M (IgM). Các thành phần không phải kháng thể trung hòa liên kết với vi-rút, tuy không phát huy được khả năng ức chế sao chép của virút, nhưng có thể góp phần phòng ngừa lây nhiễm và/hoặc cải thiện triệu chứng [54] (Hình 1B).
Cơ thể người bệnh nhiễm SARS-CoV sẽ sản xuất kháng thể IgG chống lại nucleoprotein (N) có thể được phát hiện vào ngày thứ 4 sau khi bệnh khởi phát và với sự chuyển đổi huyết thanh vào ngày thứ 14 [62]. Trong trường hợp nhiễm SARS, 89% bệnh nhân khỏi bệnh cho thấy có IgG đặc hiệu và NAbs tồn tại sau nhiễm bệnh 2 năm [63]. Hơn nữa, nồng độ IgM cao nhất được phát hiện vào ngày thứ chín sau khi bệnh khởi phát và việc chuyển lớp sang IgG xảy ra vào tuần thứ hai [64].
Shen và cộng sự. [38], cho thấy rằng những người hiến tặng đã hồi phục sau nhiễm COVID-19 có hiệu giá kháng thể đặc hiệu SARS-CoV-2 nằm trong khoảng từ 1.800 đến 16.200 và hiệu giá NAbs là từ 80 đến 480. Huyết tương thu được từ những người hiến tặng và được truyền cho những người nhận trên cùng ngày dẫn đến tải lượng vi rút giảm. Sau khi truyền HTHP, hiệu giá của IgG và IgM ở người nhận tăng lên tùy thuộc vào thời gian. Hơn nữa, sự hiện diện của NAbs trong người nhận đóng một vai trò quan trọng trong việc hạn chế lây nhiễm virus. Một nghiên cứu khác đánh giá động học của sự phát triển NAbs đặc hiệu SARS-CoV-2 trong suốt quá trình của bệnh. Hiệu giá NAbs ở bệnh nhân nhiễm SARS-CoV-2 thấp trước khi khởi phát bệnh 10 ngày và sau đó tăng lên, với đỉnh điểm từ 10 đến 15 ngày sau khi phát bệnh, duy trì ổn định sau đó ở tất cả bệnh nhân [61].
4. Điều hòa miễn dịch
4.1. Cơ chế F (ab´) 2
Trong lịch sử, sử dụng IVIg là một trong những can thiệp quan trọng ở bệnh nhân mắc các bệnh tự miễn cũng như các bệnh viêm tự thân, cấy ghép (tức là thải ghép mãn tính so với tình trạng chống chủ sau khi ghép tủy), suy giảm miễn dịch nguyên phát và thứ phát, các khối u ác tính huyết học trong số các điều kiện khác. Chuẩn bị IVIg bao gồm các kháng thể chống vô hiệu hóa ngăn chặn các kháng thể tự phản ứng của người nhận [36,65]. Phản ứng này rất quan trọng để kiểm soát tự kháng thể ở những bệnh nhân mắc bệnh tự miễn. Theo nghĩa này, một báo cáo gần đây ở bệnh nhân COVID-19, cho thấy những bệnh nhân bị bệnh nặng có biểu hiện tích cực với kháng thể kháng cardiolipin IgA cũng như kháng thể kháng β2glycoprotein I IgA và IgG [66]. Bằng chứng này có thể gợi ý rằng HTHPCOVID-19 có thể trung hòa loại tự kháng thể này, làm giảm tỷ lệ kháng thể gây các biến cố huyết khối (tức là bệnh giống như hội chứng kháng phospholipid), đặc biệt ở những bệnh nhân bị bệnh nặng. Đồng thời, một báo cáo gần đây về một bệnh nhân mắc hội chứng Sjögren và COVID-19 được điều trị thành công bằng HTHP có thể cho thấy rằng chiến lược này là an toàn và hiệu quả trong các tình trạng tự miễn dịch [37].
Ngoài ra, một số kháng thể ức chế dòng thác bổ thể (tức là C3a và C5a), và hạn chế sự hình thành các phức hợp miễn dịch (Hình 1C) [67,68]. Những con chuột thiếu hụt bổ thể bị nhiễm SARS-CoV có tình trạng tải lượng virus cao, tiết ra các cytokine và chemokine gây viêm, và sự xâm nhập tế bào miễn dịch trong phổi. Những kết quả này cho thấy rằng sự hoạt hóa bổ thể đóng góp phần lớn vào tình trạng viêm hệ thống và sự di chuyển của bạch cầu trung tính đến phổi, kéo dài tổn thương mô [69]. Các nghiên cứu bổ sung đã chỉ ra rằng IgG được chuyển qua huyết tương trung hòa các cytokine như IL-1β và TNFα [70]. Theo nghĩa này, miễn dịch thụ động bằng cách truyền HTHP-COVID-19 có thể hạn chế dòng thác gây viêm do các kháng thể gây bệnh thúc đẩy, cũng như tổn thương tế bào do kích hoạt dòng thác bổ thể trong môi trường viêm quá mức.
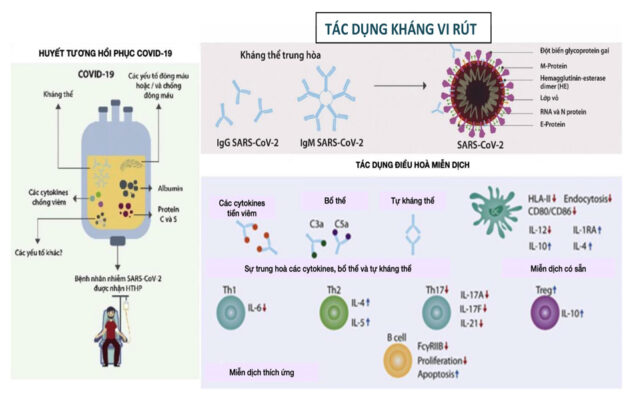
Tăng phụ thuộc vào kháng thể (ADE) là một cơ chế trong đó cường độ lây nhiễm tăng lên khi có các NAb có sẵn nghèo nàn, tạo điều kiện thuận lợi cho sự sao chép của vi rút vào đại thực bào và các tế bào khác thông qua tương tác với các thụ thể Fc và/ hoặc bổ thể [71]. Hiện tượng này thấy ở coronavirus mèo, vi rút HIV và sốt xuất huyết đã tận dụng đáp ứng miễn dịch dịch thể chống vi rút trước đó để lây nhiễm hữu hiệu cho tế bào đích của vật chủ [72,73]. Các thử nghiệm in vitro với các dòng tế bào tiền bạch cầu đơn nhân-promonocyte của người đã chứng minh rằng SARSCoV ADE chủ yếu được trung gian bởi các kháng thể chống lại các protein đột biến, làm tăng đáng kể tỷ lệ chết tế bào theo chương trình ở các tế bào này [73]. Điều này rất được quan tâm ở các vùng mà coronavirus lưu hành. Việc phát triển vắc-xin nên xem xét hiện tượng này ở những bệnh nhân có COVID-19 và việc sử dụng HTHP-COVID19 trong những lĩnh vực này nên được tiến hành một cách thận trọng vì ADE có thể nổi lên như một phản ứng có hại ở những bệnh nhân bị nhiễm trùng tiến triển [74]. Nếu nghi ngờ hiện tượng này sau khi sử dụng HTHP-COVID-19, bác sĩ lâm sàng phải thông báo ngay cho cơ quan y tế và đánh giá mức độ an toàn theo các loại coronavirus lưu hành trong khu vực.
4.2. Cơ chế Fc
FcRn là một chất điều hòa quan trọng trong chu trình bán hủy IgG. Thụ thể này hoạt động bằng cách ngăn chặn sự phân hủy và thanh thải IgG, theo cơ chế pinocytotic cho phép sự lưu thông của kháng thể trong tế bào để bài tiết sau đó [65,75]. Chất ức chế FcRn rozanolixizumab cho thấy làm giảm nồng độ IgG trong một nghiên cứu ở giai đoạn 1 [76], và nó tỏ ra rất quan trọng trong quá trình dị hóa IVIg ở bệnh nhân suy giảm miễn dịch biến đổi phổ biến [77]. Người ta đã chứng minh rằng sự bão hòa thụ thể này bằng IVIg có thể là cơ chế khả dĩ nhất để loại bỏ các tự kháng thể trong các tình trạng tự miễn dịch bằng cách rút ngắn thời gian sống của chúng [78–80]. Liệu các kháng thể có đóng một vai trò quan trọng trong cơ chế bệnh sinh COVID-19 hay không vẫn còn được làm sáng tỏ, tuy nhiên, sự bão hòa của FcRn có thể cung cấp thêm một con đường điều hòa miễn dịch ở bệnh nhân điều trị HTHP.
Các thụ thể Fcγ được tìm thấy trong hầu hết các tế bào miễn dịch. Các thụ thể này là yếu tố quan trọng trong việc điều chỉnh hoặc ức chế hoạt động của các tế bào miễn dịch, bao gồm cả tế bào lympho [75]. Sự hoạt hóa thụ thể Fcγ bởi IgG gây ra sự điều hòa FCγRIIB có liên quan đến tác dụng ức chế. Điều này đã được chứng minh ở các tế bào B, nơi điều hòa FCγRIIB có liên quan đến khả năng điều trị đào thải cấp tính sau khi ghép thận [81], và là yếu tố quyết định chính đối với đáp ứng IVIg ở bệnh nhân mắc bệnh Kawasaki [82]. Người ta gợi ý rằng quá trình sialyl hóa của thụ thể này là rất quan trọng đối với các hoạt động ức chế trong tế bào miễn dịch [83]. Tuy nhiên, nghiên cứu tế bào Th17 trong mô hình viêm não tủy tự miễn cho thấy rằng quá trình này là không thể thiếu đối với điều hòa miễn dịch đối với điều trị IVIg [84]. Bất chấp những kết quả này, truyền HTHP có thể giúp điều chỉnh phản ứng miễn dịch thông qua các thụ thể Fcγ, và đáng chú ý trong việc quản lý COVID-19 hiện tại.
4.3. Tế bào đuôi gai
Tế bào đuôi gai (DC) là cơ quan điều hòa chính của khả năng miễn dịch bẩm sinh và hoạt động như những tế bào trình diện kháng nguyên chuyên biệt. Các nghiên cứu trong ống nghiệm đã chỉ ra rằng việc sử dụng IVIg có thể làm giảm sự trưởng thành của các DC, cũng như làm giảm sản xuất IL-12. Điều thú vị là, việc sản xuất IL-10 đã được tăng cường [85]. Trong nghiên cứu được thực hiện bởi Sharma và cộng sự [86], các tác giả phát hiện ra rằng IVIg gây ra việc sản xuất IL-33, sau đó mở rộng các bạch cầu ưa kiềm sản xuất IL-4. Trong dòng này, nghiên cứu khác cho thấy IVIg có thể thúc đẩy sản xuất IL-4 và IL-13 tương quan với mức IL-33 [87]. Cơ chế điều hòa giảm FcγRIIa và IFN-γR2 qua trung gian cytokine Th2 được cho là những cơ chế có khả năng xảy ra nhất đối với hiện tượng này. Gần đây, người ta thấy rằng IVIg kích hoạt β-catenin theo cách độc lập với IgG-sialyl hóa, điều này rất quan trọng để giảm viêm
[88].
Điều hòa giảm của HLA-II và các phân tử kích thích như CD86, CD80 và CD40 ở các tế bào đuôi gai đã được báo cáo sau khi kích thích bằng IVIg [85]. Ở những bệnh nhân lupus ban đỏ hệ thống, có tồn tại chất tiền viêm cao, việc sử dụng IVIg đã loại bỏ sự trưởng thành qua trung gian IFN-α [89,90]. Tất cả cùng nhau, dữ liệu cho thấy rằng việc truyền huyết tương từ những người hiến tặng COVID-19 đã hồi phục có thể tăng cường các đặc tính chống viêm của DC, điều này có thể rất quan trọng trong các giai đoạn kích thích viêm quá mức ở bệnh nhân COVID-19.
4.4. Tế bào T
Mặc dù có khả năng tăng cường Th2 thông qua IL-33 trong DCs [87], người ta đã mô tả rằng IVIg điều chỉnh sự cân bằng giữa các tế bào T CD4 + / CD8 +, cũng như thúc đẩy sự tăng sinh và tồn tại của Tregs. Điều trị bằng IVIg dường như làm giảm sự trình diện kháng nguyên của tế bào T thông qua việc điều chế và ức chế các DC. Quá trình này độc lập với FCγRIIB [91], và các báo cáo khác cho thấy sự giảm hoạt hóa của tế bào T không phụ thuộc vào quá trình sialyl hóa IgG, bạch cầu đơn nhân hoặc tế bào B [92].
Ngoài ra, những bệnh nhân được điều trị bằng IVIg cho thấy sự giảm số lượng tế bào Th1 và nồng độ IFNγ và TNFα thấp cùng với sự gia tăng của các cytokines Th2 như IL-4 và IL-10 [93]. Về mặt lâm sàng, người ta đã chứng minh rằng bệnh nhân Cúm A (H1N1) được điều trị bằng HTHP có biểu hiện giảm IL6 và TNFα [94], với mức tăng IL-10 [46]. Điều này ủng hộ khái niệm về HTHP chống viêm nhiễm ở những đối tượng bị nhiễm virus cấp tính.
Độc tính tế bào cũng được điều chỉnh bằng cách dùng IVIg. Trong nghiên cứu của Klehmet và cộng sự [95], các tác giả phát hiện ra rằng những bệnh nhân mắc bệnh viêm đa dây thần kinh do viêm mãn tính được điều trị bằng IVIg, cho thấy giảm tế bào T CD8 với mức độ cao của bộ nhớ CD4 + T và tế bào bộ nhớ trung tâm T. Trong một nghiên cứu khác, IVIg được chứng minh là làm giảm sự hoạt hóa của tế bào T CD8 + liên quan đến sự phong tỏa thụ thể tế bào T, do đó làm giảm sự tương tác giữa hiệu ứng và tế bào đích [96]. Ở những đối tượng mắc bệnh Kawasaki, một tỷ lệ cao CD8 + được cho là có khả năng kháng IVIg, do đó cho thấy rằng những tế bào này có thể được coi là yếu tố dự báo cho đáp ứng với IVIg [97].
Các nghiên cứu gần đây đã chỉ ra rằng IVIg làm giảm sự tăng sinh của tế bào Th17, cũng như giảm sản xuất IL-17A, IL-17F, IL-21 và CCL20 [98,99]. Trong nghiên cứu khác, IVIg dường như điều chỉnh tỷ lệ Th17 / Treg có liên quan đến sẩy thai tái phát [100]. Có thể hợp lý rằng HTHP có thể hoạt động theo cách tương tự ở những bệnh nhân mắc
COVID-19 [28,29] (Hình 1C).
4.5. Tế bào B
Tế bào B rất quan trọng trong miễn dịch thích ứng thông qua sản xuất kháng thể và cytokine. Ở những bệnh nhân bị bệnh đa dây thần kinh khử myelin, việc sử dụng IVIg có liên quan đến sự biểu hiện quá mức của các tế bào tái tạo FcγRIIB trên tế bào B [101,102]. IVIg bãi bỏ các phản ứng của tế bào B phụ thuộc TLR-9. Điều này có liên quan đến sự ức chế IVIg đối với con đường tín hiệu NFκB, giảm biểu hiện CD25 và CD40, và giảm sản xuất IL-6 và IL-10 của tế bào B.
Quá trình này dường như được điều chỉnh bởi miền SH2 chứa phosphatase 1 [103].
Sự tăng sinh và tồn tại của tế bào B được thực hiện qua trung gian của yếu tố hoạt hóa tế bào B (BAFF). Trong nghiên cứu được thực hiện bởi Le Pottier và cộng sự [104], các tác giả nhận thấy rằng IVIg chứa NAbs cho BAFF. Điều này có thể giải thích cho việc giảm tốc độ tăng sinh, cũng như tăng tốc độ chết của tế bào B. Về quy trình thứ hai, người ta thấy rằng các kháng thể kháng Fas (chống CD95), có trong các chế phẩm IVIg, gây ra quá trình chết tế bào theo chương trình ở các tế bào B [105].
Ở DCs, sự điều hòa giảm của các phân tử kích thích sau khi sử dụng IVIg đã được quan sát thấy. Điều này tương tự với các tế bào B biểu hiện sự giảm hoạt động trình bày kháng nguyên thứ phát sau quá trình nội hóa IgG, đồng thời với sự giảm sản xuất IL-2 của tế bào T [106]. Hơn nữa, dùng IVIg điều chỉnh tín hiệu của thụ thể tế bào B (BCR). Trong nghiên cứu của Séïté và cộng sự. [107], các tác giả phát hiện ra rằng sự tương tác giữa BCR và CD22 dẫn đến sự điều hòa giảm quá trình phosphoryl hóa tyrosine của Lyn và các protein liên kết tế bào B, dẫn đến sự hoạt hóa bền vững Erk 1/2 và bắt giữ chu kỳ tế bào ở pha G/1.
Những cơ chế này có thể giải thích cho việc điều hòa miễn dịch đối với phản ứng viêm trong COVID-19 thứ phát sau khi dùng HTHP. Như đã trình bày ở trên, các báo cáo gần đây cho thấy việc sản xuất các kháng thể kháng phospholipid ở những bệnh nhân mắc COVID-19 cùng với hội chứng giống như antiphospholipid [66], và việc điều chỉnh dòng thác này có thể rất quan trọng để tránh các kết cục có hại ở nhóm bệnh nhân này (tức là huyết khối, rối loạn đông máu nội mạch lan tỏa).
4.6. Các tế bào miễn dịch khác
Yếu tố miễn dịch chính được nghi ngờ có liên quan đến tình trạng viêm và tổn thương phổi trong COVID-19 là sự hoạt hóa của các đại thực bào. Người ta cho rằng những bệnh nhân mắc COVID-19 có thể bị một bệnh giống như hội chứng kích hoạt đại thực bào liên quan đến sự di chuyển miễn dịch trong cơ thể đến các mô phổi [28]. Trong bối cảnh này, việc ức chế con đường miễn dịch này có thể giúp kiểm soát việc sản xuất quá mức cytokine và ngăn ngừa tổn thương phổi (tức là xơ hóa). Điều này gần đây đã được hỗ trợ bởi nghiên cứu của Blanco – Melo và cộng sự [108] người đã mô tả sự điều hòa của chemokine đối với các tế bào miễn dịch bẩm sinh ở chồn sương cũng như ở những bệnh nhân bị COVID-19. Điều thú vị là, các kết quả cho thấy kịch bản này chủ yếu xảy ra trong 7 ngày đầu tiên sau khi nhiễm bệnh, trong khi ở ngày thứ 14, các cytokine khác như IL-6 và IL-1 vẫn được kích hoạt [108]. Những dữ liệu này ảnh hưởng quan trọng đến điều trị.
Trong nghiên cứu được thực hiện bởi Kozicky và cộng sự [109], các tác giả nhận thấy rằng các đại thực bào được điều trị bằng IVIg cho thấy sự gia tăng sản xuất IL-10, với việc giảm IL-12/ 23p40, do đó gợi ý rằng việc thúc đẩy một quá trình đại thực bào chống viêm. Mặc dù không có bằng chứng về việc ức chế di chuyển qua phổi của đại thực bào bằng IVIg, một nghiên cứu về gây độc thần kinh ngoại vi cho thấy phương pháp điều trị này làm giảm sự xâm nhập của đại thực bào thần kinh ở chuột [110]. Những quan sát này đáng được chú ý ở những bệnh nhân được điều trị bằng HTHP-COVID-19 vì chúng có thể cho kết quả tích cực ở những bệnh nhân bị bệnh nặng với COVID-19
[38,39]. Trong khía cạnh này, chúng tôi chứng minh việc sử dụng HTHP-COVID19 trong giai đoạn đầu của bệnh để ngăn chặn sự di chuyển của các tế bào miễn dịch bẩm sinh và tránh tổn thương phổi.
5. Kết luận
HTHP là một chiến lược hiệu quả an toàn và tiềm năng để điều trị các mầm bệnh mới xuất hiện và tái xuất hiện, đặc biệt là trong những trường hợp không có thuốc kháng vi-rút hoặc vắc-xin đã được chứng minh. IVIg và HTHP chia sẻ cơ chế hoạt động tương tự. Các tác dụng kháng vi rút và điều hòa miễn dịch tiềm năng của HTHP hiện đang được đánh giá trong COVID-19. Theo sinh lý bệnh học của COVID-19, bệnh nhân nặng nên được ưu tiên hơn những bệnh nhân nguy kịch để giảm tỷ lệ tử vong và cải thiện kết quả.
Kinh phí
Công việc này được hỗ trợ bởi Universidad del Rosario (ABN-011), Bogota và Universidad CES (Bộ phận Nghiên cứu và Đổi mới), Medellin, Colombia.
Sự tri ân
Các tác giả cảm ơn tất cả các thành viên của CREA và “CP-Covid-19 Group” vì những đóng góp và thảo luận hiệu quả.
Tham khảo
[1] Su S, Wong G, Shi W, Liu J, Lai ACK, Zhou J, et al. Epidemiology, genetic re- combination, and pathogenesis of coronaviruses. Trends Microbiol 2016;24:490–502.https://doi.org/10.1016/j.tim.2016.03.003.[2] Cavanagh D. Coronavirus avian infectious bronchitisvirus. Vet Res 2007;38:281–97. https://doi.org/10.1051/vetres:2006055.
[3] Ismail MM, Tang AY, Saif YM. Pathogenicity of turkey coronavirus in turkeys and chickens. Avian Dis 2003;47:515–22. https://doi.org/10.1637/5917.
[4] Lu R, Zhao X, Li J, Niu P, Yang B, Wu H, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: Implications for virus origins and re- ceptor binding. Lancet 2020;395:565–74. https://doi.org/10.1016/S0140- 6736(20)30251-8.
[5] Nie Q-H, Luo X-D, Hui W-L. Advances in clinical diagnosis and treatment of severe acute respiratory syndrome. World J Gastroenterol 2003;9:1139–43. https://doi. org/10.3748/wjg.v9.i6.1139.
[6] Zaki AM, van Boheemen S, Bestebroer TM, Osterhaus ADME, Fouchier RAM. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. N Engl J Med 2012;367:1814–20. https://doi.org/10.1056/NEJMoa1211721.
[7] Phua J, Weng L, Ling L, Egi M, Lim C-M, Divatia JV, et al. Intensive care man-agement of coronavirus disease 2019 (COVID-19): Challenges and recommenda- tions. Lancet Respir Med 2020. https://doi.org/10.1016/S2213-2600(20)30161-2.
[8] Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med 2020;382:727–33. https:// doi.org/10.1056/NEJMoa2001017.
[9] Chan JF-W, Yuan S, Kok K-H, To KK-W, Chu H, Yang J, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to- person transmission: a study of a family cluster. Lancet 2020;395:514–23. https:// doi.org/10.1016/S0140-
6736(20)30154-9.
[10] Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020;395:497–506. https://doi.org/10.1016/S0140-6736(20)30183-5.
[11] Shoenfeld Y. Corona (COVID-19) time musings: Our involvement in COVID-19 pathogenesis, diagnosis, treatment and vaccine planning. Autoimmun Rev 2020;102538.https://doi.org/10.1016/j.autrev.2020.102538.
[12] Kanduc D, Shoenfeld Y. On the molecular determinants and the mechanism of the SARS-CoV-2 attack 2020. Clin Immunol 2020;215:108426. https://doi.org/10. 1016/j.clim.2020.108426.
[13] Rojas M, Restrepo-Jiménez P, Monsalve DM, Pacheco Y, Acosta-Ampudia Y, Ramírez-Santana C, et al. Molecular mimicry and autoimmunity. J Autoimmun 2018;95:100–23.https://doi.org/10.1016/j.jaut.2018.10.012.
[14] Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al. A trial of lopinavir-ritonavir in adults hospitalized with severe covid-19. N Engl J Med 2020. https://doi.org/10. 1056/NEJMoa2001282.
[15] Chen Z, Hu J, Zhang Z, Jiang S, Han S, Yan D, et al.Efficacy of hydroXychloroquine in patients with COVID19: Results of a randomized clinical trial. MedRXiv 2020.https://doi.org/10.1101/2020.03.22.20040758.
[16] Gautret P, Lagier J-C, Parola P, Hoang VT, Meddeb L, Mailhe M, et al. HydroXychloroquine and azithromycin as a treatment of COVID-19: Results of an open-label non-randomized clinical trial. Int J Antimicrob Agents 2020;105949. https://doi.org/10.1016/j.ijantimicag.2020.105949.
[17] Borba MGS, Val FFA, Sampaio VS, Alexandre MAA, Melo GC, Brito M, et al. Effect of high vs low doses of chloroquine diphosphate as adjunctive therapy for patients hospitalized with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection: A randomized clinical trial. JAMA Netw Open 2020;3:e208857https:// doi.org/10.1001/jamanetworkopen.2020.8857.
[18] Marano G, Vaglio S, Pupella S, Facco G, Catalano L, Liumbruno GM, et al. Convalescent plasma: New evidence for an old therapeutic tool? Blood Transfus 2016;14:152–7. https://doi.org/10.2450/2015.0131-15.
[19] Burnouf T, Seghatchian J. Ebola virus convalescent blood products: Where we are now and where we may need to go. Transfus Apher Sci 2014;51:120–5. https:// doi.org/10.1016/j.transci.2014.10.003.
[20] Mair-Jenkins J, Saavedra-Campos M, Baillie JK, Cleary P, Khaw F-M, Lim WS, et al. The effectiveness of convalescent plasma and hyperimmune immunoglobulin for the treatment of severe acute respiratory infections of viral etiology: A systematic review and exploratory meta-analysis. J Infect Dis 2015;211:80–90. https://doi. org/10.1093/infdis/jiu396.
[21] Rojas M, Monsalve DM, Pacheco Y, Acosta-Ampudia Y, Ramírez-Santana C, Ansari AA, et al. Ebola virus disease: An emerging and re-emerging viral threat. J Autoimmun 2020;106:102375. https://doi.org/10.1016/j.jaut.2019.102375.
[22] Planitzer CB, Modrof J, Kreil TR. West Nile virus neutralization by US plasma-derived immunoglobulin products. J Infect Dis 2007;196:435–40. https://doi.org/ 10.1086/519392.
[23] Haley M, Retter AS, Fowler D, Gea-Banacloche J, O’Grady NP. The role for in- travenous immunoglobulin in the treatment of West Nile virus encephalitis. Clin Infect Dis 2003;37:e88–90. https://doi.org/10.1086/377172.
[24] Shimoni Z, Niven MJ, Pitlick S, Bulvik S. Treatment of West Nile virus encephalitis with intravenous immunoglobulin. Emerg Infect Dis 2001;7:759. https://doi.org/ 10.3201/eid0704.010432.
[25] van Griensven J, Edwards T, de Lamballerie X, Semple MG, Gallian P, Baize S, et al. Evaluation of convalescent plasma for Ebola virus disease in Guinea. N Engl J Med 2016;374:33–42. https://doi.org/10.1056/NEJMoa1511812.
[26] Garraud O, Heshmati F, Pozzetto B, Lefrere F, Girot R, Saillol A, et al. Plasma therapy against infectious pathogens, as of yesterday, today and tomorrow. Transfus Clin Biol 2016;23:39–44. https://doi.org/10.1016/j.tracli.2015.12.003.
[27] Lünemann JD, Nimmerjahn F, Dalakas MC. Intravenous immunoglobulin in neu-rology–mode of action and clinical efficacy. Nat Rev Neurol 2015;11:80–9. https://doi.org/10.1038/nrneurol.2014.253.
[28] McGonagle D, Sharif K, O’Regan A, Bridgewood C. The role of cytokines including interleukin-6 in COVID-19 induced pneumonia and macrophage activation syndrome-like disease. Autoimmun Rev 2020. https://doi.org/10.1016/j.autrev. 2020.102537. In press:102537.
[29] Wan S, Yi Q, Fan S, Lv J, Zhang X, Guo L, et al. Characteristics of lymphocyte subsets and cytokines in peripheral blood of 123 hospitalized patients with 2019 novel coronavirus pneumonia (NCP). MedRXiv 2020. https://doi.org/10.1101/ 2020.02.10.20021832.
[30] Shahani L, Singh S, Khardori NM. Immunotherapy in clinical medicine: Historical perspective and current status. Med Clin North Am 2012;96:421–31. iX https:// doi.org/10.1016/j.mcna.2012.04.001.
[31] Shakir EM, Cheung DS, Grayson MH. Mechanisms of immunotherapy: A historical perspective. Ann Allergy Asthma Immunol 2010;105:340–7. quiz 348, 368 https:// doi.org/10.1016/j.anai.2010.09.012.
[32] Sherer Y, Levy Y, Shoenfeld Y. IVIG in autoimmunity and cancer–efficacy versus safety. EXpert Opin Drug Saf
2002;1:153–8. https://doi.org/10.1517/14740338.1. 2.153.
[33] Katz U, Achiron A, Sherer Y, Shoenfeld Y. Safety of intravenous immunoglobulin (IVIG) therapy.
Autoimmun Rev 2007;6:257–9. https://doi.org/10.1016/j.autrev. 2006.08.011.
[34] Ahn JY, Sohn Y, Lee SH, Cho Y, Hyun JH, Baek YJ, et al. Use of convalescent plasma therapy in two COVID19 patients with acute respiratory distress syndrome in Korea. J Korean Med Sci 2020;35:e149https://doi.org/10.3346/jkms.2020.35.e149.
[35] Ko J-H, Seok H, Cho SY, Ha YE, Baek JY, Kim SH, et al. Challenges of convalescent plasma infusion therapy in Middle East respiratory coronavirus infection: A single centre experience. Antivir Ther 2018;23:617–22. https://doi.org/10.3851/ IMP3243.
[36] Spalter SH, Kaveri S, Kazatchkine MD. Anti-idiotypes to autoantibodies in ther- apeutic preparations of normal polyspecific human IgG (intravenous im- munoglobulin, IVIg). editors In: Shoenfeld Y, Kennedy RC, Ferrone Infection and Cancer SBT-I in MAeditors. Idiotypes Med. Autoimmun. Infect. CancerAmsterdam: Elsevier; 1997. p. 217–25. https://doi.org/10.1016/B978-044482807-1/50021-1.
[37] Ye M, Fu D, Ren Y, Wang F, Wang D, Zhang F, et al. Treatment with convalescent plasma for COVID-19 patients in Wuhan, China. J Med Virol 2020. https://doi. org/10.1002/jmv.25882.
[38] Shen C, Wang Z, Zhao F, Yang Y, Li J, Yuan J, et al. Treatment of 5 critically ill patients with Covid-19 with convalescent plasma. JAMA 2020;323(16):1582–9. https://doi.org/10.1001/jama.2020.4783.
[39] Duan K, Liu B, Li C, Zhang H, Yu T, Qu J, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci U S A 2020. https://doi.org/10.1073/pnas.2004168117.
[40] Soo YOY, Cheng Y, Wong R, Hui DS, Lee CK, Tsang KKS, et al. Retrospective comparison of convalescent plasma with continuing high-dose methylprednisolone treatment in SARS patients. Clin Microbiol Infect 2004;10:676–8. https://doi.org/10.1111/j.1469-0691.2004.00956.X.
[41] Cheng Y, Wong R, Soo YOY, Wong WS, Lee CK, Ng MHL, et al. Use of convalescent plasma therapy in SARS patients in Hong Kong. Eur J Clin Microbiol Infect Dis 2005;24:44–6. https://doi.org/10.1007/s10096-004-1271-9.
[42] Yeh K-M, Chiueh T-S, Siu LK, Lin J-C, Chan PKS, Peng M-Y, et al. EXperience of using convalescent plasma for severe acute respiratory syndrome among health- care workers in a Taiwan hospital. J Antimicrob Chemother 2005;56:919–22. https://doi.org/10.1093/jac/dki346.
[43] Zhou X, Zhao M, Wang F, Jiang T, Li Y, Nie W, et al. Epidemiologic features, clinical diagnosis and therapy of first cluster of patients with severe acute re- spiratory syndrome in Beijing area. Zhonghua Yi Xue Za Zhi 2003;83:1018–22.
[44] Kong L. Letter to editor. Transfus Apher Sci 2003;29:101. https://doi.org/10.1016/S14730502(03)00109-5.
[45] Wong VWS, Dai D, Wu AKL, Sung JJY. Treatment of severe acute respiratory syndrome with convalescent plasma. Hong Kong Med J 2003;9:199–201.
[46] Hung IF, To KK, Lee C-K, Lee K-L, Chan K, Yan W-W, et al. Convalescent plasma treatment reduced mortality in patients with severe pandemic influenza A (H1N1) 2009 virus infection. Clin Infect Dis 2011;52:447–56. https://doi.org/10.1093/ cid/ciq106.
[47] Chan KKC, Lee KL, Lam PKN, Law KI, Joynt GM, Yan WW. Hong Kong’s experience on the use of extracorporeal membrane oXygenation for the treatment of influenza A (H1N1). Hong Kong Med J 2010;16:447–54.
[48] Yu H, Gao Z, Feng Z, Shu Y, Xiang N, Zhou L, et al. Clinical characteristics of 26 human cases of highly pathogenic avian influenza A (H5N1) virus infection in China. PLoS One 2008;3:e2985https://doi.org/10.1371/journal.pone.00 02985.
[49] Kong LK, Zhou BP. Successful treatment of avian influenza with convalescent plasma. Hong Kong Med J 2006;12:489.
[50] Wong SSY, Yuen K-Y. The management of coronavirus infections with particular reference to SARS. J Antimicrob Chemother 2008;62:437–41. https://doi.org/10. 1093/jac/dkn243.
[51] Zhang H, Zeng Y, Lin Z, Chen W, Liang J, Zhang H, et al. Clinical characteristics and therapeutic experience of case of severe highly pathogenic A/H5N1 avian influenza with bronchopleural fistula. Zhonghua jie he he hu Xi za zhi = Zhonghua jiehe he huXi zazhi = Chinese J Tuberc Respir Dis 2009;32:356–9.
[52] Tiberghien P, de Lambalerie X, Morel P, Gallian P, Lacombe K, Yazdanpanah Y. Collecting and evaluating convalescent plasma for COVID-19 treatment: Why and how. VoX Sang 2020. https://doi.org/10.1111/voX.12926.
[53] Tissot J-D, Garraud O. Ethics and blood donation: A marriage of convenience. Press Medicale 2016;45:e247–52. https://doi.org/10.1016/j.lpm.2016.06.016.
[54] Bloch EM, Shoham S, Casadevall A, Sachais BS, Shaz B, Winters JL, et al. Deployment of convalescent plasma for the prevention and treatment of COVID-19. J Clin Invest 2020. https://doi.org/10.1172/JCI138745.
[55] Dodd RY, Crowder LA, Haynes JM, Notari EP, Stramer SL, Steele WR. Screening blood donors for HIV, HCV, and HBV at the American Red Cross: 10-year trends in prevalence, incidence, and residual risk, 2007 to 2016. Transfus Med Rev 2020. https://doi.org/10.1016/j.tmrv.2020.02.001.
[56] Niazi SK, Bhatti FA, Salamat N, Ghani E, Tayyab M. Impact of nucleic acid am- plification test on screening of blood donors in Northern Pakistan. Transfusion 2015;55:1803–11. https://doi.org/10.1111/trf.13017.
[57] Bello-López JM, Delgado-Balbuena L, Rojas-Huidobro D, Rojo-Medina J. Treatment of platelet concentrates and plasma with riboflavin and UV light: Impact in bacterial reduction. Transfus Clin Biol 2018;25:197–203. https://doi. org/10.1016/j.tracli.2018.03.004.
[58] Benjamin RJ, McLaughlin LS. Plasma components: Properties, differences, and uses. Transfusion 2012;52(Suppl. 1):9S–19S. https://doi.org/10.1111/j.1537- 2995.2012.03622.X.
[59] Du L, He Y, Zhou Y, Liu S, Zheng B-J, Jiang S. The spike protein of SARS-CoV–a target for vaccine and therapeutic development. Nat Rev Microbiol 2009;7:226–36. https://doi.org/10.1038/nrmicro2090.
[60] Tian X, Li C, Huang A, Xia S, Lu S, Shi Z, et al. Potent binding of 2019 novel coronavirus spike protein by a SARS coronavirus-specific human monoclonal an- tibody. Emerg Microbes Infect 2020;9:382–5. https://doi.org/10.1080/22221751.2020.1729069.
[61] Wu F, Wang A, Liu M, Wang Q, Chen J, Xia S, et al. Neutralizing antibody re- sponses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their im- plications. MedRXiv 2020. https://doi.org/10.1101/2020.03.30.20047365.
[62] Hsueh P-R, Huang L-M, Chen P-J, Kao C-L, Yang P-C. Chronological evolution of IgM, IgA, IgG and neutralisation antibodies after infection with SARSassociated coronavirus. Clin Microbiol Infect 2004;10:1062–6. https://doi.org/10.1111/j.1469-0691.2004.01009.X.
[63] Gorse GJ, Donovan MM, Patel GB. Antibodies to coronaviruses are higher in older compared with younger adults and binding antibodies are more sensitive than neutralizing antibodies in identifying coronavirus-associated illnesses. J Med Virol 2020;92:512–7. https://doi.org/10.1002/jmv.25715.
[64] Rokni M, Ghasemi V, Tavakoli Z. Immune responses and pathogenesis of SARS-CoV-2 during an outbreak in Iran: Comparison with SARS and MERS. Rev Med Virol 2020. https://doi.org/10.1002/rmv.2107.
[65] Chaigne B, Mouthon L. Mechanisms of action of intravenous immunoglobulin. Transfus Apher Sci 2017;56:45–9. https://doi.org/10.1016/j.transci.2016.12.017.
[66] Zhang Y, Xiao M, Zhang S, Xia P, Cao W, Jiang W, et al. Coagulopathy and anti- phospholipid antibodies in patients with Covid-19. N Engl J Med 2020;382(17):e38. https://doi.org/10.1056/NEJMc2007575. In press.
[67] Lutz HU, Späth PJ. Anti-inflammatory effect of intravenous immunoglobulin mediated through modulation of complement activation. Clin Rev Allergy Immunol 2005;29:207–12. https://doi.org/10.1385/CRIAI:29:3:207.
[68] Basta M, Van Goor F, Luccioli S, Billings EM, Vortmeyer AO, Baranyi L, et al. F(ab)’2-mediated neutralization of C3a and C5a anaphylatoXins: a novel effector function of immunoglobulins. Nat Med 2003;9:431–8. https://doi.org/10.1038/ nm836.
[69] Gralinski LE, Sheahan TP, Morrison TE, Menachery VD, Jensen K, Leist SR, et al. Complement activation contributes to severe acute respiratory syndrome cor- onavirus pathogenesis. MBio 2018;9. https://doi.org/10.1128/mBio.01753-18.
[70] Abe Y, Horiuchi A, Miyake M, Kimura S. Anti-cytokine nature of natural human immunoglobulin: one possible mechanism of the clinical effect of intravenous immunoglobulin therapy. Immunol Rev 1994;139:5–19. https://doi.org/10.1111/j.1600-065X.1994.tb00854.X.
[71] Kulkarni R. Antibody-dependent enhancement of viral infections BT – Dynamics of immune activation in viral diseases. editor In: Bramhachari PV, editor. Dyn. Immune Act. Viral DisSingapore: Springer Singapore; 2020. p. 9–41. https://doi. org/10.1007/978-981-15-
1045-8_2.
[72] Vatti A, Monsalve DM, Pacheco Y, Chang C, Anaya J-M, Gershwin ME. Original antigenic sin: A comprehensive review. J Autoimmun 2017;83:12–21. https://doi. org/10.1016/j.jaut.2017.04.008.
[73] Wang S-F, Tseng S-P, Yen C-H, Yang J-Y, Tsao C-H, Shen C-W, et al. Antibody- dependent SARS coronavirus infection is mediated by antibodies against spike proteins. Biochem Biophys Res Commun 2014;451:208–14. https://doi.org/10.1016/j.bbrc.2014.07.090.
[74] Casadevall A, Pirofski L. The convalescent sera option for containing COVID-19. J Clin Invest 2020;130:1545–8. https://doi.org/10.1172/JCI138003.
[75] Nimmerjahn F, Ravetch JV. Anti-inflammatory actions of intravenous immunoglobulin. Annu Rev Immunol 2008;26:513–33. https://doi.org/10.1146/ annurev.immunol.26.021607.090232.
[76] Kiessling P, Lledo-Garcia R, Watanabe S, Langdon G, Tran D, Bari M, et al. The FcRn inhibitor rozanoliXizumab reduces human serum IgG concentration: A ran- domized phase 1 study. Sci Transl Med 2017;9. https://doi.org/10.1126/ scitranslmed.aan1208.
[77] Litzman J. Influence of FCRN expression on lung decline and intravenous im- munoglobulin catabolism in common variable immunodeficiency patients. ClinEXp Immunol 2014;178(Suppl):103–4. https://doi.org/10.1111/cei.12529.
[78] Akilesh S, Petkova S, Sproule TJ, Shaffer DJ, Christianson GJ, Roopenian D. The MHC class I-like Fc receptor promotes humorally mediated autoimmune disease. J Clin Invest 2004;113:1328–33. https://doi.org/10.1172/JCI18838.
[79] Hansen RJ, Balthasar JP. Effects of intravenous immunoglobulin on platelet count and antiplatelet antibody disposition in a rat model of immune thrombocytopenia. Blood 2002;100:2087–93.
[80] Hansen RJ, Balthasar JP. Intravenous immunoglobulin mediates an increase in anti-platelet antibody clearance via the FcRn receptor. Thromb Haemost 2002;88:898–9.
[81] Jin J, Gong J, Lin B, Li Y, He Q. FcγRIIb expression on B cells is associated with treatment efficacy for acute rejection after kidney transplantation. Mol Immunol 2017;85:283–92. https://doi.org/10.1016/j.molimm.2017.03.006.
[82] Shrestha S, Wiener H, Shendre A, Kaslow RA, Wu J, Olson A, et al. Role of acti- vating FcγR gene polymorphisms in Kawasaki disease susceptibility and in- travenous immunoglobulin response. Circ Cardiovasc Genet 2012;5:309–16. https://doi.org/10.1161/CIRCGENETICS.111.962464.
[83] Kaneko Y, Nimmerjahn F, Ravetch JV. Anti-inflammatory activity of im- munoglobulin G resulting from Fc sialylation. Science 2006;313(80):670–3. https://doi.org/10.1126/science.1129594.
[84] Othy S, Topcu S, Saha C, Kothapalli P, LacroiXDesmazes S, Kasermann F, et al. Sialylation may be dispensable for reciprocal modulation of helper T cells by in- travenous immunoglobulin. Eur J Immunol 2014;44:2059–63. https://doi.org/10.1002/eji.201444440.
[85] Bayry J, LacroiX-Desmazes S, Carbonneil C, Misra N, Donkova V, Pashov A, et al. Inhibition of maturation and function of dendritic cells by intravenous im- munoglobulin. Blood 2003;101:758–65. https://doi.org/10.1182/blood-2002-05-1447.
[86] Sharma M, Schoindre Y, Hegde P, Saha C, Maddur MS, Stephen-Victor E, et al. Intravenous immunoglobulininduced IL-33 is insufficient to mediate basophil expansion in autoimmune patients. Sci Rep 2014;4:5672. https://doi.org/10. 1038/srep05672.
[87] Tjon ASW, van Gent R, Jaadar H, Martin van Hagen P, Mancham S, van der Laan LJW, et al. Intravenous immunoglobulin treatment in humans suppresses dendritic cell function via stimulation of IL-4 and IL-13 production. J Immunol 2014;192:5625–34. https://doi.org/10.4049/jimmunol.1301260.
[88] Karnam A, Rambabu N, Das M, Bou-Jaoudeh M, Delignat S, Käsermann F, et al. Therapeutic normal IgG intravenous immunoglobulin activates Wnt-β-catenin pathway in dendritic cells. Commun Biol 2020;3:96. https://doi.org/10.1038/s42003-020-0825-4.
[89] Bayry J, LacroiX-Desmazes S, Delignat S, Mouthon L, Weill B, Kazatchkine MD, et al. Intravenous immunoglobulin abrogates dendritic cell differentiation induced by interferon-alpha present in serum from patients with systemic lupus er- ythematosus. Arthritis Rheum 2003;48:3497–502. https://doi.org/10.1002/art. 11346.
[90] Sharma M, Saha C, Schoindre Y, Gilardin L, Benveniste O, Kaveri SV, et al. Interferon-α inhibition by intravenous immunoglobulin is independent of mod- ulation of the plasmacytoid dendritic cell population in the circulation: Comment on the article by Wiedeman et al. Arthritis Rheumatol 2014;66:2308–9. https:// doi.org/10.1002/art.38683.
[91] Aubin E, LemieuX R, Bazin R. Indirect inhibition of in vivo and in vitro T-cell responses by intravenous immunoglobulins due to impaired antigen presentation. Blood 2010;115:1727–34. https://doi.org/10.1182/blood-2009-06-225417.
[92] Issekutz AC, Rowter D, Miescher S, Käsermann F. Intravenous IgG (IVIG) and subcutaneous IgG (SCIG) preparations have comparable inhibitory effect on T cell activation, which is not dependent on IgG sialylation, monocytes or B cells. Clin Immunol 2015;160:123–32.
https://doi.org/10.1016/j.clim.2015.05.003.
[93] Ahmadi M, Abdolmohammadi-Vahid S, Ghaebi M, Aghebati-Maleki L, Afkham A, Danaii S, et al. Effect of intravenous immunoglobulin on Th1 and Th2 lymphocytes and improvement of pregnancy outcome in recurrent pregnancy loss (RPL). Biomed Pharmacother 2017;92:1095–102. https://doi.org/10.1016/j.biopha. 2017.06.001.
[94] Hung IFN, KKW To, Lee C-K, Lee K-L, Yan W-W, Chan K, et al. Hyperimmune IV immunoglobulin treatment: a multicenter double-blind randomized controlled trial for patients with severe 2009 influenza A(H1N1) infection. Chest 2013;144:464–73. https://doi.org/10.1378/chest.12-2907.
[95] Klehmet J, Goehler J, Ulm L, Kohler S, Meisel C, Meisel A, et al. Effective treatment with intravenous immunoglobulins reduces autoreactive T-cell response in pa- tients with CIDP. J Neurol Neurosurg Psychiatry 2015;86:686–91. https://doi.org/ 10.1136/jnnp-2014-
307708.
[96] Trépanier P, Chabot D, Bazin R. Intravenous immunoglobulin modulates the ex- pansion and cytotoXicity of CD8+ T cells. Immunology
2014;141:233–41. https:// doi.org/10.1111/imm.12189.
[97] Ye Q, Gong F-Q, Shang S-Q, Hu J. Intravenous immunoglobulin treatment re- sponsiveness depends on the degree of CD8+ T cell activation in Kawasaki dis- ease. Clin Immunol 2016;171:25–31. https://doi.org/10.1016/j.clim.2016.08. 012.
[98] Maddur MS, Vani J, Hegde P, LacroiX-Desmazes S, Kaveri SV, Bayry J. Inhibition of differentiation, amplification, and function of human TH17 cells by intravenous immunoglobulin. J Allergy Clin Immunol 2011;127:823–7. https://doi.org/10.1016/j.jaci.2010.12.1102.
[99] Maddur MS, Kaveri SV, Bayry J. Comparison of different IVIg preparations on IL- 17 production by human Th17 cells. Autoimmun Rev 2011;10:809–10. https:// doi.org/10.1016/j.autrev.2011.02.007.
[100] Kim DJ, Lee SK, Kim JY, Na BJ, Hur SE, Lee M, et al. Intravenous immunoglobulin G modulates peripheral blood Th17 and FoXp3(+) regulatory T cells in pregnant women with recurrent pregnancy loss. Am J Reprod Immunol 2014;71:441–50. https://doi.org/10.1111/aji.12208.
[101] Tackenberg B, Jelcic I, Baerenwaldt A, Oertel WH, Sommer N, Nimmerjahn F, et al. Impaired inhibitory Fc gamma receptor IIB expression on B cells in chronic inflammatory demyelinating polyneuropathy. Proc Natl Acad Sci U S A 2009;106:4788–92. https://doi.org/10.1073/pnas.0807319106.
[102] Nikolova KA, Tchorbanov AI, Djoumerska-Alexieva IK, Nikolova M, Vassilev TL. Intravenous immunoglobulin up-regulates the expression of the inhibitory Fc gamma IIB receptor on B cells. Immunol Cell Biol 2009;87:529–33. https://doi. org/10.1038/icb.2009.36.
[103] Séité J-F, Guerrier T, Cornec D, Jamin C, Youinou P, Hillion S. TLR9 responses of B cells are repressed by intravenous immunoglobulin through the recruitment of phosphatase. J Autoimmun 2011;37:190–7. https://doi.org/10.1016/j.jaut.2011.05.014.
[104] Le Pottier L, Bendaoud B, Dueymes M, Daridon C, Youinou P, Shoenfeld Y, et al. BAFF, a new target for intravenous immunoglobulin in autoimmunity and cancer. J Clin Immunol 2007;27:257–65. https://doi.org/10.1007/s10875-007-9082-2.
[105] Prasad NK, Papoff G, Zeuner A, Bonnin E, Kazatchkine MD, Ruberti G, et al. Therapeutic preparations of normal polyspecific IgG (IVIg) induce apoptosis in human lymphocytes and monocytes: a novel mechanism of action of IVIg invol- ving the Fas apoptotic pathway. J Immunol 1998;161:3781–90.
[106] Paquin ProulX D, Aubin E, LemieuX R, Bazin R. Inhibition of B cell-mediated an- tigen presentation by intravenous immunoglobulins (IVIg). Clin Immunol 2010;135:422–9. https://doi.org/10.1016/j.clim.2010.01.001.
[107] Séïté J-F, Cornec D, Renaudineau Y, Youinou P, Mageed RA, Hillion S. IVIg modulates BCR signaling through CD22 and promotes apoptosis in mature human B lymphocytes. Blood 2010;116:1698–704. https://doi.org/10.1182/blood-2009- 12-261461.
[108] Blanco-Melo D, Nilsson-Payant BE, Chun Liu W, Uhl S, Hoagland D, Møller R, et al. Imbalanced host response to SARS-CoV-2 drives development of COVID-19. Cell 2020. https://doi.org/10.1016/j.cell.2020.04.026. In press.
[109] Kozicky LK, Zhao ZY, Menzies SC, Fidanza M, Reid GSD, Wilhelmsen K, et al. Intravenous immunoglobulin skews macrophages to an anti-inflammatory, IL-10- producing activation state. J Leukoc Biol 2015;98:983–94. https://doi.org/10. 1189/jlb.3VMA0315-078R.
[110] Meregalli C, Marjanovic I, Scali C, Monza L, Spinoni N, Galliani C, et al. High-dose intravenous immunoglobulins reduce nerve macrophage infiltration and the se- verity of bortezomib-induced peripheral neurotoXicity in rats. J Neuroinflammation 2018;15:232. https://doi.org/10.1186/s12974-0181270-X.
[111] Zhang Bin, Liu Shuyi, Tan Tan, Huang Wenhui, Dong Yuhao, Chen Luyan, et al. Treatment With Convalescent Plasma for Critically Ill Patients With SARS-CoV-2 Infection. Chest 2020. https://doi.org/10.1016/j.chest.2020.03.039. In press.
[112] Rajendran Karthick, Narayanasamy Krishnasamy, Rangarajan Jayanthi, Rathinam Jeyalalitha, Natarajan Murugan, Ramachandran Arunkumar. Convalescent plasma transfusion for the treatment of COVID‐19: Systematic review. J Med Virol 2020. https://doi.org/10.1002/jmv.25961. In press.

