Kỹ thuật y khoa
Hội chứng suy hô hấp và liệu pháp surfactant trong thông khí hỗ trợ cho trẻ sơ sinh
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Bài viết Hội chứng suy hô hấp và liệu pháp surfactant trong thông khí hỗ trợ cho trẻ sơ sinh được biên dịch bởi Thạc sĩ – Bác sĩ Đặng Thanh Tuấn công tác tại Khoa Hồi sức ngoại – Bệnh viện Nhi đồng I.
Nội dung chính
- Hội chứng suy hô hấp (respiratory distress syndrome — RDS) là vấn đề về phối thường gặp nhất ở trẻ sinh non thứ phát do tổng hợp surfactant không đầy đủ. Chán đoán dựa trên hình ảnh lâm sàng cổ điển với bằng chúng X-quang hỗ trợ hình mở đồng nhất của phổi. Các chiến lược xử trí bao gồm: Corticosteroid (CS) trước khi sinh, thông khí không xâm lần trong phòng sinh, liều pháp surfactant chọn lọc sớm và giảm thiểu tiếp xúc với thỏ máy.
- Các biến chứng có thể được ngăn ngừa bằng các biện pháp. Áp dụng liệu pháp caffein sớm, tăng CO, máu cho phép, dùng steroid sau khi sinh ở một số bệnh nhân được chọn lọc và tối ưu hóa chế độ dinh dưỡng.
Giới thiệu
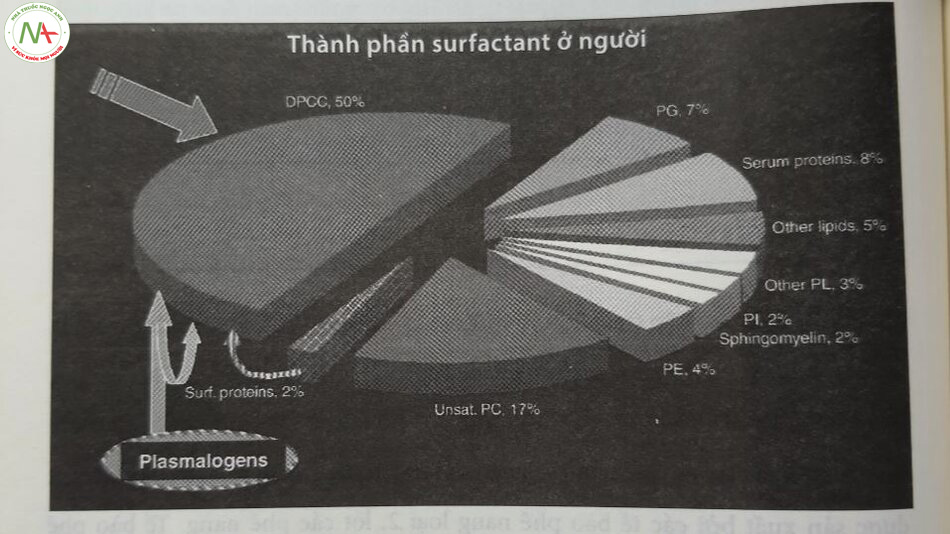
Hội chứng suy hô hấp (respiratory distress syndrome – RDS), còn được gọi là bệnh màng trong (hyaline membrane disease – HMD) do thiếu hụt surfactant, là nguyên nhân chính gây ra tình trạng suy hô hấp ở trẻ sinh non, cần được can thiệp ngay trong quá trình chuyển đổi từ bào thai sang sơ sinh. Surfactant được sản xuất bởi các tế bào phế nang loại 2, lót các phế nang. Tế bào phê năng loại 2 bao phủ khoảng 10% diện tích bề mặt phế nang, đồng thời đóng vai trò quan trọng trong chuyển hóa và bài tiết surfactant. Surfactant bao gồm: Phosphatidylcholine (PC), protein liên kết surfactant, plasmalogen (PLMGN), phosphatidylglycerol (PG), và các phospholipid có tính axit khác (Hình 24,1).
Thành phần quan trọng nhất của surfactant là dipalmitoyl PC hoặc DPPC. Bốn protein liên kết với surfactant, cụ thể là SP-A, SP-B, SP-C và SP-D, đã được xác định cho đến nay. SP-A và SP-A thuộc về một nhóm protein, được gọi là lectin, hoạt động giống như chất kháng sinh nội sinh. SP-A và SP-D là các protein ưa nước, giúp duy trì “tính vô trùng” của phổi nhờ vai trò của chúng trong phòng thủ của vật chủ. SP-B và SP-B cực kỳ ưa mỡ, giúp duy trì “sự ổn định” của phối bằng cách giảm lực căng bề mặt trong phổi, cũng như giúp duy trì dung tích cặn chức năng (FRC). Thiếu SP-B đồng hợp tử dẫn đến suy hô hấp nghiêm trọng và cần ghép phổi để sống sót. DPPC yêu cầu SP-B, SP-C, và plasmalogen phospholipid chống oxygen hóa để lan truyền và hấp thụ lên toàn bộ diện tích bề mặt của phổi, nhằm giảm sức căng bề mặt.
Chuyển hóa Surfactant
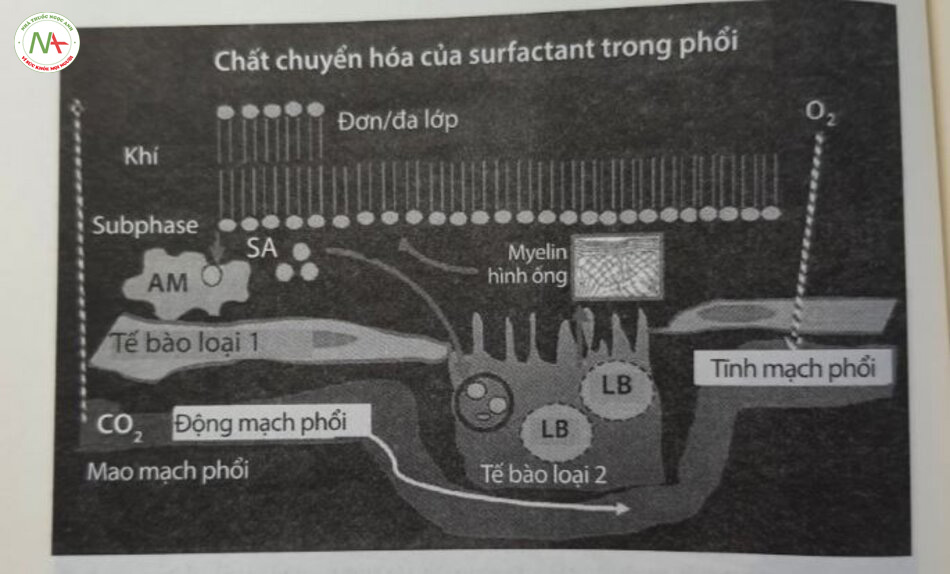
- Tổng hợp: Được tổng hợp trong các microsome và được vận chuyển như các thể phiến (lamellar bodies – LB). Các protein surfactant được tạo ra trong lưới nội chất và được glycosyl hóa trong các thể Golgi trước khi lưu trữ. Các thế phiến chứa SP-A, SP-B và SP-C là dạng dự trữ nội bào của surfactant (Hình 24.2).
- Vận chuyển: Các protein vận chuyển, chẳng hạn như protein cassette liên kết ATP-A3 (ABCA3), chịu trách nhiệm hình thành và bài tiết thể phiến. Bệnh nhân bị đột biến nối ABCA 3 có thể phiền nhỏ hơn, đặc hơn và phát triển RDS nghiêm trọng. Bằng quá trình xuất bào (exocytosis), các thế phiến được tiết vào tiểu phế nang và với sự hiện diện của SP-A tạo thành myelin hình ống. Myelin hình ống tách ra để tạo thành đơn lớp hoặc nhiều lớp ở bề mặt phân cách không khí – chất lỏng, do đó làm giảm sức căng bề mặt.
- Tái sử dụng: Surfactant dư được tái sử dụng hiệu quả bằng quá trình nhập bảo (endocytosis) vào các tế bào phối loại 2, được đóng gói lại, và tiết ra trở lại. Tái chế làm giảm nhu cầu tổng hợp mới. Gần 95% surfactant tiết ra được tái sử dụng. Surfactant ngoại sinh được sử dụng cũng được tái sử dụng.
- Thanh thải: Các đại thực bào phế nang (alveolar macrophage – AM) dị hóa phần còn sót lại của surfactant, và một số surfactant bị mất trong khi thở ra.
- Lượng surfactant cao nhất có ở trẻ sinh đủ tháng là 100 mg/kg, trong khi kích cỡ gộp ước tính ở trẻ sơ sinh non tháng mắc RDS nằm trong khoảng 3–5 mg/kg.
- Có một số điều kiện hoặc kích thích tố gây ảnh hưởng đến quá trình chuyển hóa surfactant. Các yếu tố đẩy nhanh quá trình trưởng thành của phổi là: Tăng huyết áp mãn tính ở người mẹ, hạn chế tăng trưởng trong tử cung, tăng huyết áp do mang thai, viêm màng đệm, corticosteroid, hormone tuyến giáp, beta-agonist và methylxanthine. Tương tự, một số yếu tố cũng làm chậm quá trình trưởng thành của phổi hoặc sản xuất surfactant, bao gồm: Bệnh tiểu đường ở bà mẹ không được kiểm soát hoặc kiểm soát kém, đóng miễn dịch (isoimmunization) Rh, sinh đôi lần thứ hai, giới tính nam, sinh mổ, insulin và nội tiết tố androgen.
Chức năng của surfactant
- Giảm sức căng bề mặt (surface tension).
- Tăng độ giãn nở của phổi (lung compliance).
- Giảm công thở.
- Phòng ngừa xếp phế nang ở cuối thì thở ra,
- Tăng cường thanh thải dịch.
- Giảm áp lực mở (opening pressure).
- Giảm trương lực tiên mao mạch (precapillary tone).
- Bảo vệ vật chủ.
Surfactant làm giảm sức căng bề mặt tại mặt phân cách không khí – chất lỏng một cách linh hoạt. Sức căng bề mặt tăng cao khi đường kinh phế nang trở nên nhỏ hơn vào cuối thì thở ra. Trẻ sơ sinh bị thiếu hụt surfactant phát triển thành xẹp phổi giai đoạn cuối thì thở ra. Mối quan hệ giữa áp lực xẹp và sức căng bề mặt được mô tả bằng phương trình LaPlace: Áp lực = 2 × Sức căng bề mặt/Bán kính.
Sinh lý bệnh của RDS
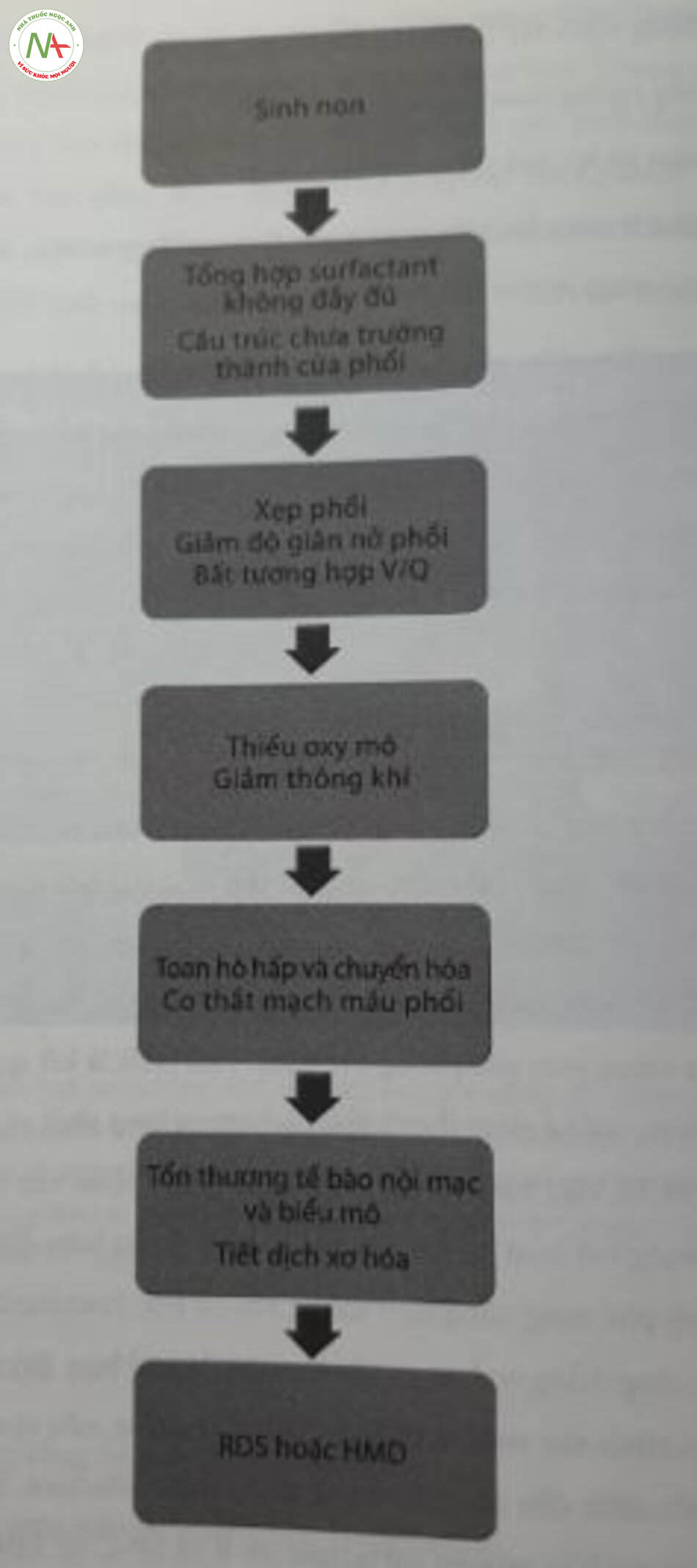
Tình trạng tổng hợp surfactant không đầy đủ ở trẻ sinh non dẫn đến giảm độ giãn nở của phổi và giảm thể tích cuối thì thở ra. Xẹp phổi gây ra sự bất tương hợp thông khi tưới máu. Điều này dẫn đến tình trạng thiếu oxy mô và giảm thông khí. Tổn thương phối do thông khi áp lực dương và/hoặc bổ sung oxy gây ra viêm, qua trung gian giải phóng cytokine. Phù phổi là kết quả cuối cùng của tình trạng viêm, với sự giảm thanh thải dịch trong lòng phổi và lượng nước tiểu thấp (Hình 24.3). Việc bất hoạt surfactant cũng góp phần vào sự phát triển của RDS. Tình trạng bất hoạt có thể xảy ra thứ phát do sự hiện diện của máu hoặc phân su trong phế nang cũng như thông khi cơ học (mechanical ventilation MV), gây ra căng thẳng cơ học và tổn thương do oxy hóa. Do sự điều hòa phát triển của quá trình sản xuất và phóng thích surfactant, nên sinh non là nguyên nhân phổ biến nhất dẫn đến tình trạng thiếu hụt surfactant. Ngoài ra, các đột biến trong gen mã hóa protein surfactant SP-B và SP-C và ABCA3 cũng có thể gây ra tình trạng thiếu surfactant, đi kèm với rối loạn chức năng surfactant và suy hô hấp đặc biệt ở trẻ sinh non tháng muộn hoặc đủ tháng (Bảng 24.1).
| Bảng 24.1 Đặc điểm của các đột biến ABCA3 đơn dòng gốc Châu Âu và Châu Phi đối với RDS sơ sinh | ||||||
| Đặc điểm | Gốc châu Âu | P | Gốc châu Phi | P | ||
| RDS (n=112) | Non-RDS (n=161) | RDS (n=44) | Non-RDS (n=196) | |||
| Giới tính | 0,51 | <0,001 | ||||
| Nữ giới | 47 (0,42) | 74 (0,46) | 10 (0,23) | 101 (0,52) | ||
| Nam giới | 65 (0,58) | 87 (0,54) | 34 (0,77) | 95 (0,48) | ||
| Tuổi thai, trung bình ± SD (kg) | 37,0 ± 1,7 | 38,2 ± 1,6 | < 0,001 | 37,7 ± 2,7 | 38,9 ± 1,7 | 0,003 |
| Đường sinh | 0,54 | <0,001 | ||||
| Ngả âm đạo | 55 (0,49) | 73 (0,45) | 15 (0,34) | 133 (0,68) | ||
| Mổ lấy thai | 57 (0,51) | 88 (0,55) | 29 (0,66) | 63 (0,32) | ||
| Nguồn: Được điều chỉnh từ Wambach JA, Wegner DJ, Depass K, Heins H, Druley TE, Mitra RD và công su. Single ABCA3 mutations increase risk for neonatal respiratory distress syndrome (tạm dịch: Các đột biến ABCA3 đơn dòng làm tăng nguy cơ mắc hội chứng suy hô hấp ở trẻ sơ sinh). Pediatrics 2012;130:e1575– e1582. SD, độ lệch chuẩn. | ||||||
Dịch tễ học của RDS
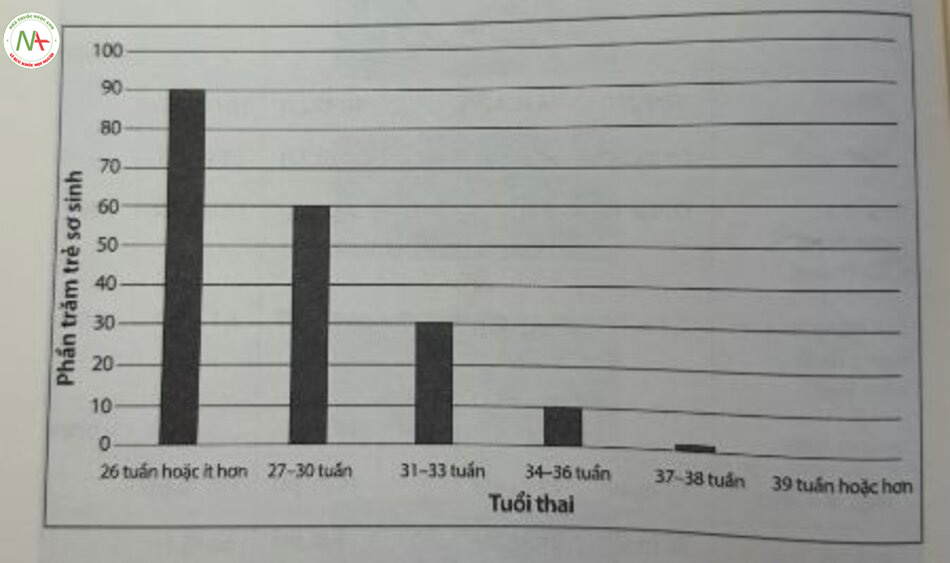
Hơn một nửa số trẻ sinh ra trước 28 tuần phát triển RDS so với khoảng một phần ba ở trẻ sinh từ 28 đến 34 tuần tuổi thai (Hình 24.4). RDS là nguyên nhân chính gây tử vong cũng như khuyết tật ở trẻ sơ sinh thiếu tháng. Trẻ sinh cực non tháng có nguy cơ phát triển RDS cao nhất xảy ra với hơn 95% đối với trẻ sinh ra dưới 26 tuần tuổi thai. Tỷ lệ mắc bệnh thấp hơn khi tuổi thai tăng lên trong khoảng 5%–10% trẻ sơ sinh ≥ 34 tuần tuổi thai. Ngoài ra, có tới 1% trẻ sinh đủ tháng ở tuần thai 37 và 38 cũng phát triển RDS (Hình 24.4). Chủng tộc da trắng và giới tính nam gây ra nhiều nguy cơ hơn ở tuổi thai 34–39 tuần. Tuổi thai dưới 39 tuần, bệnh tiểu đường ở mẹ sau sinh và viêm màng ối ở mẹ cũng là những yếu tố nguy cơ khác trong nhóm thuần tập này.
Chẩn đoán RDS trước khi sinh
RDS có thể được chẩn đoán trước khi sinh bằng cách sử dụng các xét nghiệm khác nhau được thực hiện trên nước ối, chẳng hạn như tỷ lệ lecithin sphingomyelin, mức phosphatidyl glycerol và số lượng thể phiến (Bảng 24.2). Mặc dù xét nghiệm độ trưởng thành phổi của thai nhi có thể giúp xác định thai nhi có nguy cơ RDS, song kết quả xét nghiệm giai đoạn thai nhi trưởng thành có thể không đưa ra dự đoán đáng tin cậy về các kết quả bất lợi khác và không nên biện minh cho việc sinh con mà không có các chỉ định khác.
| Bảng 24.2 Các xét nghiệm trước khi sinh về sự trưởng thành phổi của thai nhi | |
| Xét nghiệm nước ối | Giá trị dự đoán của RDS (%) |
| Tỷ lệ L/S > 2,0 | < 0,5 |
| Tỷ lệ L/S < 1.0 | 100 |
| Sự hiện diện của phosphatidylglycerol (PG) | < 0,5 |
| Tỷ lệ L/S > 2,0; không có PG | > 80 |
| Tỷ lệ L/S > 3,0; PG+ | 0 |
| Tỷ lệ L/S > 2,0 và bệnh tiểu đường hoặc đồng miễn dịch Rh | 13 |
| Số lượng thế phiến > 50.000 | 0 |
| L/S, lecithin/sphingomyelin | |
Đặc điểm lâm sàng
Các triệu chứng có thể xảy ra ở hầu hết trẻ sơ sinh bị bệnh trong vòng vài phút sau khi sinh trong phòng sinh, vì chức năng phổi không hoạt động tương đương với việc hỗ trợ áp lực dương. Một số trẻ sơ sinh bị bất hoạt surfactant có thể không biểu hiện khi mới sinh, nhưng dần dần xấu đi trong vài giờ đầu sau sinh.
Biểu hiện lâm sàng
- Thở nhanh.
- Phập phồng cánh mũi.
- Thở nên.
- Rút lõm liên sườn và dưới sườn.
- Các trường hợp nặng: Ngưng thở và tím tái.
- Khám lâm sàng: Giảm âm thờ hai bên khi nghe phổi.
Diễn tiến lâm sàng
Diễn biến tự nhiên của RDS bao gồm tình trạng xấu dần đi trong 48–72 giờ đầu tiên, sau đó là tình trạng cải thiện do tổng hợp surfactant nội sinh. Với sự ra đời của surfactant ngoại sinh, việc phục hồi có thể nhanh hơn khi chức năng phổi hoạt động trở lại trong vòng vài giờ sau khi điều trị.
Dấu hiệu xét nghiệm và chẩn đoán
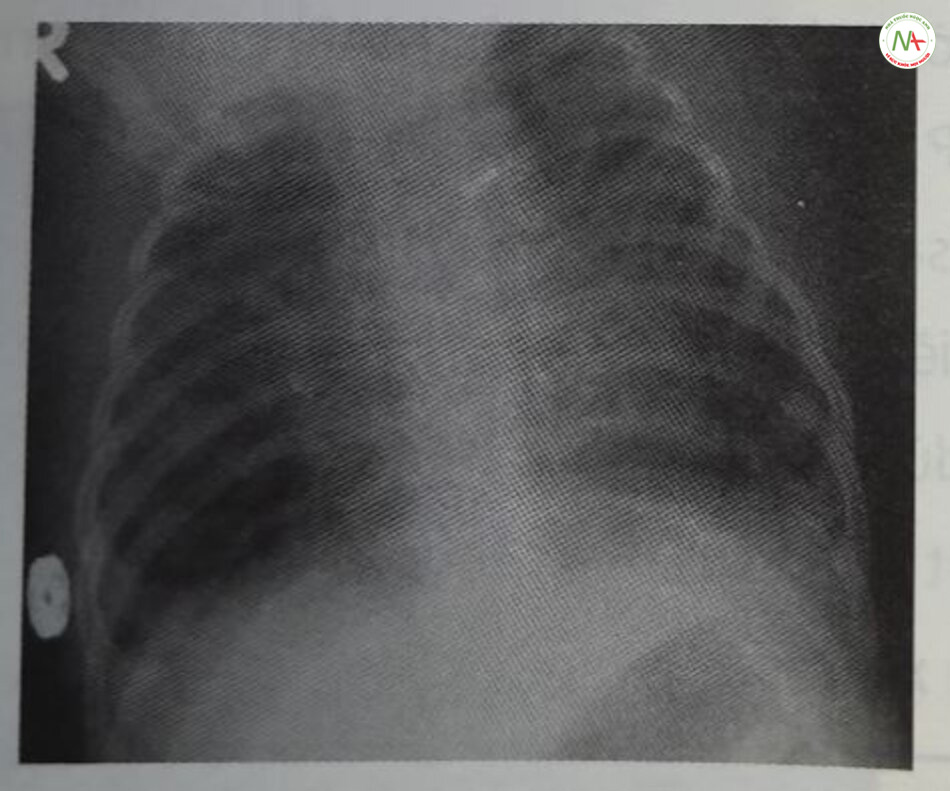
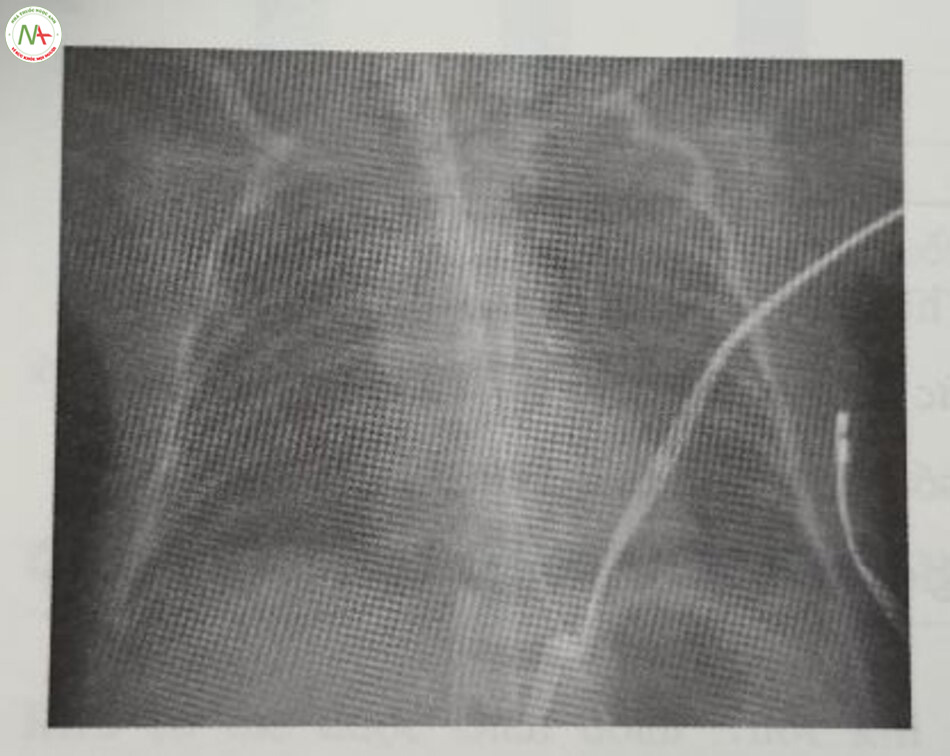
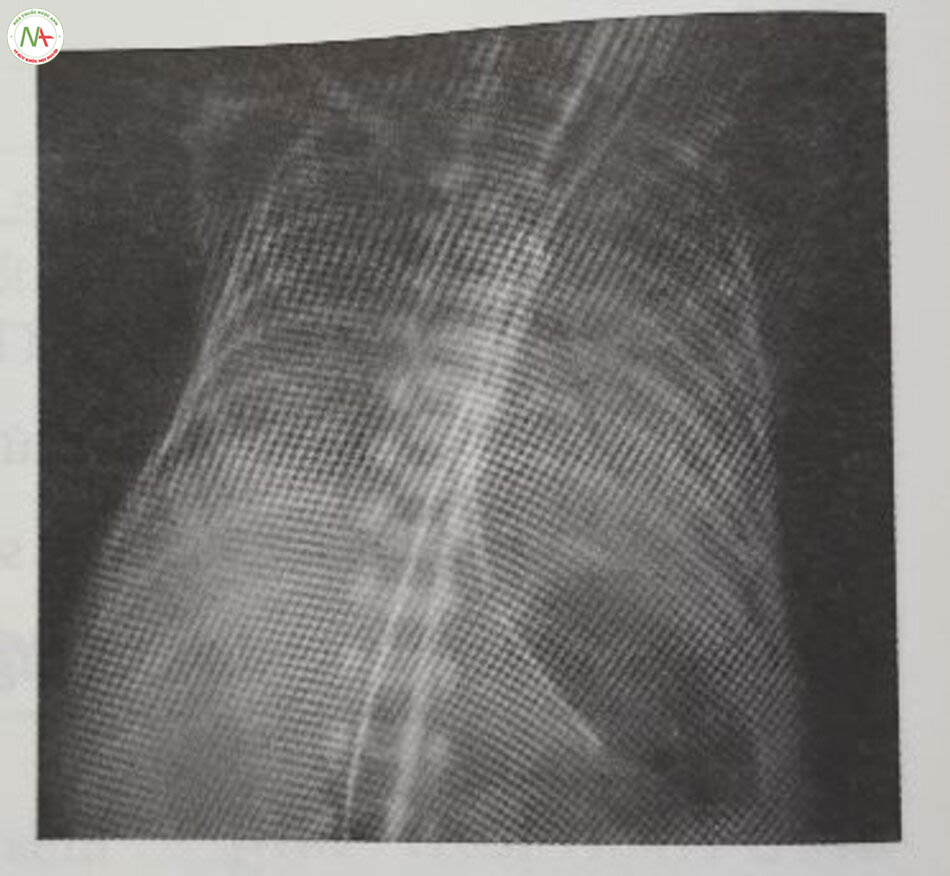
Chẩn đoán dựa trên lâm sàng với biểu hiện cổ điển về chức năng phổi xấu đi sau khi sinh được hỗ trợ bởi các dấu hiệu X-quang kiểu lưới hạt hoặc kính mờ đồng nhất trong nhu mô phổi với hình ảnh khí phế quản đồ và thể tích phổi thấp (Hình 24.5 và 24.6). Các dấu hiệu về khí máu bao gồm giảm oxy máu và tăng CO2 máu. Siêu âm phổi cũng ngày càng được sử dụng để chẩn đoán RDS.
Chẩn đoán phân biệt
Một số tình trạng bắt chước RDS trên lâm sàng, nhưng có thể được phân biệt bằng X-quang cũng như xét nghiệm. Nhịp thở nhanh thoáng qua ở trẻ sơ sinh thường xảy ra ở trẻ sơ sinh trưởng thành hơn. Nó biểu hiện với các triệu chứng nhẹ hơn và hồi phục sớm mà không cẩn hỗ trợ máy thở cơ học nhiều. Trần khí màng phổi là một biến chứng của RDS thứ phát sau vỡ phế nang và có thể được chẩn đoán bằng X-quang khi có rò rỉ khí ngoài phổi. Viêm phổi do vi khuẩn có hoặc không kèm theo nhiễm trùng huyết có thể có biểu hiện giống nhau và nhìn chung khó phân biệt, vì cả các dấu hiệu lâm sàng lẫn X-quang có thể tương tự nhau trong cả hai bệnh lý này. Việc xác định vi khuẩn trong dịch hút khí quản hoặc cấy máu có thể giúp đưa ra chẩn đoán chính xác. Các bệnh phổi hiếm gặp khác như thiếu protein surfactant bẩm sinh, giảm sản phổi, và các dị tật khác đôi khi bắt chước biểu hiện của RDS (Bảng 24.3).
| Bảng 24.3 Chẩn đoán phân biệt RDS | |
| Tình trạng | Cách phân biệt |
| Nhịp thở nhanh thoáng qua ở trẻ sơ sinh |
|
| Tràn khí màng phổi |
|
| Viêm phổi do vi khuẩn |
|
| Giảm sản phổi |
|
| Dị tật phổi |
|
| CRP, protein phản ứng C; PPHN, tăng áp phổi dai dẳng ở trẻ sơ sinh. | |
Xử trí RDS
Mục đích của xử trí RDS là tăng cường khả năng sống sót và giảm thiểu các kết quả bất lợi lâu dài như loạn sản phế quản phổi (BPD). Nhiều chiến lược điều trị đã được phát triển trong bốn thập kỷ qua. Một số thử nghiệm lâm sàng vẫn đang tiếp tục đánh giá các liệu pháp mới cả về dự phòng và điều trị. Nội dung tóm lược về xử trí RDS được trình bày trong Bảng 24.4.
| Bảng 24.4 Xử trí RDS | |
| Thời gian | Chiến lược |
| Xử trí trước khi sinh |
|
| Xử trí phòng sinh |
|
| Điều trị sớm ở NICU |
|
| Điều trị sau khi ổn định |
|
| Điều trị hỗ trợ | Duy trì nhiệt độ từ 36,5 – 37,5ºC
Hạn chế dịch nhập trong 2 tuần đầu Chế độ dinh dưỡng sớm được tối ưu hóa Chế độ dinh dưỡng hoàn toàn từ sữa mẹ (human milk – HM) Chỉ dùng kháng sinh khi cần thiết Duy trì huyết áp và kiểm soát PDA |
| INSURE, đặt nội khí quản-surfactant-rút nội khí quản; PDA, còn ống động mạch. | |
Xử trí trước khi sinh
Xử trí RDS bắt đầu trước khi sinh nếu không thể ngăn ngừa được tình trạng chuyển dạ sớm. Đối với những ca sinh non sắp xảy ra, các biện pháp can thiệp kéo dài thời gian mang thai thậm chí lên tới vài ngày có thể chuẩn bị cho thai nhỏ một kết quả tốt hơn. Các biện pháp chẩn đoán như đo chiều dài cổ tử cung và xét nghiệm fibronectin của thai nhi có thể giúp xác định việc chuyển dạ sắp xảy ra, đồng thời có thể được xử trí tích cực hơn. Sử dụng thuốc giảm co cơ tử cung (tocolytic) có thể giúp làm chậm quá trình chuyển dạ, cho phép chuyển đến trung tâm được trang bị đầy đủ hơn với các chuyên viên giàu kinh nghiệm để chăm sóc trẻ sinh non, hoặc có thời gian để corticosteroid trước sinh phát huy hết tác dụng.
Liệu pháp corticosteroid trước sinh
Năm 1969, Liggins phát hiện ra rằng: Cừu non có không khi trong phổi sau khi cừu mang thai được tiêm dexamethasone. Thử nghiệm ngẫu nhiên, có dõi chứng đầu tiên được thực hiện bởi Liggins vào năm 1972 trên người sử dụng betamethasone ở 282 phụ nữ mang thai bị dọa chuyển dạ hoặc chuyển dạ có kế hoạch trước 37 tuần tuổi thai. Nghiên cứu cho thấy RDS giảm 6 lần đối với trẻ sinh dưới 32 tuần và tử vong nói chung giảm 5 lần. Kể từ đó, một số nghiên cứu đã chỉ ra lợi ích của việc sử dụng steroid trước sinh trong trường hợp dọa sinh non. Một đánh giá gần đây của Cochrane khi so sánh kết quả từ 30 nghiên cứu đã nhận định rằng: Sử dụng corticosteroid làm giảm nguy cơ tử vong chu sinh, tử vong sơ sinh, RDS và xuất huyết não thất ở trẻ sinh non.
Cơ chế tác động
- Những thay đổi trưởng thành hơn trong cấu trúc phổi của thai nhìn
- Tăng tổng hợp surfactant.
- Tăng giải phóng surfactant.
Khuyến cáo
- Tất cả phụ nữ mang thai từ 23 đến 34 tuần có nguy cơ sinh 50%. Trong vòng 7 ngày tới, nhằm ngăn ngừa hoặc giảm mức độ nghiêm trọng của RDS sơ sinh.
- Một liệu trình duy nhất dành cho phụ nữ mang thai từ 34 0/7 đến 6/7 tuần tuổi thai có nguy cơ sinh non trong vòng 7 ngày và những người chưa điều trị một đợt corticosteroid trước sinh.
- Có thể xem xét một đợi điều trị steroid lặp lại, trong trường hợp không xảy ra tình trạng sinh non trong vòng một tuần sau đợt điều trị đ tiền và đánh giá sau đó chứng tỏ rằng có nguy cơ sinh non cao trong). ngày tới theo khuyến cáo của WHO (World Health Organization – là chức Y tế Thế giới).
Thời gian điều trị tối ưu cho đến lúc chuyển dạ là hơn 24 giờ và ít hơn 7 ngày sau khi bắt đầu điều trị bằng steroid. Liệu có nên điều trị lặp lại sterone trong 1 hoặc 2 tuần sau đợt điều trị đầu tiên cho phụ nữ dọa sinh non hay không vẫn còn là vấn để gay nhiều tranh cãi. Các đợt điều trị lặp lại không cho thấy bãi kỳ khả năng giảm tử vong sơ sinh nào, nhưng đã cho thấy tác dụng làm giảm RDS và các vấn đề sức khỏe ngắn hạn khác, song cái giá phải trả là giảm trọng lượng sơ sinh và giảm thiểu các tác dụng có lợi lâu dài. Các đợt điều trị lặp lại được đưa ra sau 32 tuần tuổi thai không có khả năng cải thiện kết quả, đồng thời không cho thấy bất kỳ lợi ích nào về giảm tử vong hoặc khuyết tật khi trẻ 5 tuổi.
Xử trí tại phòng sinh
Trẻ sơ sinh bị RDS gặp khó khăn trong việc duy trì oxygen hóa cũng như thông khi sau khi sinh. Hướng dẫn Chương trình Hồi sức Sơ sinh Cập nhật (Updated Neonatal Resuscitation Program Guidelines) được xuất bản vào năm 2016, đã nêu bật các phương pháp tiếp cận dựa trên bằng chứng gần đây để đánh giá và hỏ trợ trẻ sơ sinh trong giai đoạn ngay sau sinh. Các khóa đào tạo về hồi sức thường tập trung vào trẻ bị ngưng thở thứ phát do thiếu oxy kéo dài, với trọng tâm là đạt được thông khi áp lực dương bằng cách quan sát sự nàng lồng ngực lên và xác định trẻ khỏe mạnh trong khi theo dõi tình trạng bão hòa oxy. Trẻ sinh non bị RDS có thể cần nhiều thời gian hơn để chuyển tiếp, do đó người ta phải hạn chế để những trẻ này tiếp xúc với một số can thiệp tối thiểu có thể gây hại.
Không khí và oxy được hòa trộn
Không khi tốt hơn oxy trong quá trình hồi sức cho trẻ đủ tháng, giúp giảm tỷ lệ tử vong; trong khi đó, oxy 100% có hại cho trẻ sinh non do tăng stress oxy hóa, Để đạt được độ bão hòa oxy chuyển tiếp bình thường được đo bằng phương pháp đo độ bão hòa oxy mạch này (pulse oximetry), trẻ sơ sinh cực nhẹ cân thường cần oxy từ 30% đến 40%. Nên bắt đầu với lượng oxy bổ sung thấp hơn và tăng lên khi cần thiết, thay vì bắt đầu với lượng oxy cao rồi giảm dần để giảm stress oxy hóa, mặc dù bắt đầu với mức 21% có thể bất khả thi, song đối với những trẻ sơ sinh non tháng nhất có thể cần ít nhất khoảng 30% oxy. Một phân tích tổng hợp gần đây không cho thấy bất kỳ sự khác biệt nào về nguy cơ tử vong hoặc các bệnh sinh non thường gặp khi so sánh FIO, thấp hơn (30% hoặc ít hơn) với FiO, cao hơn (60% hoặc hơn) trong hồi sức trẻ dưới 29 tuần tuổi. Tại trung tâm của chúng tôi, chúng tôi thường bắt đầu với không khí phòng (FiO, ở mức 21%) trong quá trình hối sức và tăng oxy khi cần thiết. Ưu tiên của chúng tôi là thiết lập thông khi và tăng nhịp tim lên > 100 lần/phút trong quá trình hồi sức.
CPAP và NIV
Để cung cấp CPAP hiệu quả ngay từ khi mới sinh, thiết bị ống chữ T (T-piece device) là sự lựa chọn tốt hơn so với bóng giúp thở tự phồng (self-inflating bag). CPAP trong quá trình ổn định có thể được cung cấp bằng mặt nạ, hoặc băng giao diện mũi ngắn. Nghiên cứu của chúng tôi cho thấy rằng: Sử dụng ống thông mũi đã được điều chỉnh (modified nasal cannula) giúp cung cấp hỗ trợ không xâm lấn đầy đủ để giảm tỷ lệ đặt nội khí quản ở trẻ sơ sinh nhẹ cân mắc RDS. Đối với trẻ sinh non thở tự nhiên, chỉ cung cấp CPAP có thể là giải pháp tối ưu, còn sử dụng nhịp thở áp lực dương có thể dẫn đến nguy cơ gây tổn thương phổi chưa trưởng thành.
Bơm phồng duy trì
Bơm phồng duy trì (sustained inflation) đã cho thấy kết quả đầy hứa hẹn trong các nghiên cứu ban đầu với việc cải thiện nhịp tim và độ bão hòa oxy, giảm nhu cầu đặt nội khí quản và giảm thời gian thở máy. Hiện nay, việc sử dụng bơm phồng duy trì trong hồi sức sơ sinh chỉ được giới hạn trong các nghiên cứu. Thử nghiệm Sục khí duy trì cho phổi của trẻ sơ sinh (Sustained Aeration of Infant’s Lungs trial) trên 600 trẻ sơ sinh trong độ tuổi thai từ 23 đến 26 tuần hiện đang được tiến hành.
Liệu pháp surfacant: Loại, thời gian, kỹ thuật điều trị surfactant
Liệu pháp surfactant ngoại sinh cải thiện đáng kể sự trao đổi khí ở phổi cho đến khi sản xuất đủ surfactant nội sinh ở trẻ sinh non. Việc sử dụng surfactant ngoại sinh để ngăn ngừa và điều trị RDS đã trở thành tiêu chuẩn chăm sóc trong hơn ba thập kỷ. Một số surfactant có sẵn trên thị trường, cả surfactant tổng hợp lẫn surfactant có nguồn gốc từ động vật, đã được chứng minh là có hiệu quả lâm sàng để điều trị RDS.
Các loại surfactant
Surfactant tổng hợp
Surfactant tổng hợp thế hệ thứ nhất
Hai nghiên cứu đầu tiên được công bố vào những năm 1960 không cho thấy bất kỳ lợi ích nào khi DPPC khí dung được sử dụng để điều trị RDS. Điều này là do DPPC ở dạng gel kết tinh và dạng cứng ở nhiệt độ sinh lý, khó hấp thụ ở bề mặt phân cách khí – dịch. Năm 1987, một thử nghiệm gồm 10 trung tâm về surfactant tổng hợp, pumactant (hợp chất làm giãn nở phổi nhân tạo [artifcial lung expanding compound – ALEC]) bao gồm DPPC và PG ở trẻ rất non tháng đã cho thấy tỷ lệ tử vong và hỗ trợ hô hấp giảm đáng kể. Sự phát triển của các chất phụ gia thay thế nhằm thay thế vai trò của SP-B và SP-C cu thể là tyloxapol và hexadecanol, dẫn đến việc sản xuất surfactant không chùa protein đầu tiên được FDA chấp thuận, colfosceril palmitate (Exosurf, Burroughs Wellcome, London, Anh) dùng để điều trị RDS ở Hoa Kỳ. Trong vài năm sau đó, một số thử nghiệm làm sàng ngẫu nhiên sử dụng Exosurf để phòng ngừa và điều trị RDS cho thấy tỷ lệ tử vong sơ sinh và trẻ em cũng như ò rỉ khi được giảm đáng kể. Tuy nhiên, một phân tích tổng hợp năm 2001 cho thấy rằng: Việc điều trị bằng các surfactant tổng hợp thế hệ đầu tiên này, chẳng hạn như colfosceril palmitate hoặc pumactant, có liên quan đến việc tăng tỷ lệ tử vong và nguy cơ tràn khí màng phổi cao hơn khi so sánh với các surfactant có nguồn gốc động vật mới hơn. Sự kém cỏi của các surfactant tổng hợp thế hệ đầu tiên được cho là có liên quan đến việc thiếu SP-B và SP-C.
Surfactant tổng hợp thế hệ thứ hai
Do khả năng gây ra các biến chứng nhiễm trùng và kháng nguyên từ các surfactant có nguồn gốc động vật, đáp ứng dưới mức tối ưu với surfactant tổng hợp thế hệ thứ nhất và chi phí sản xuất cao, nên surfactant tổng hợp thế hệ thứ hai có chứa các hợp chất tương tự như cấu trúc và chức năng của SP-B hoặc SP-C đã được phát triển. Ưu điểm chính của các chế phẩm như vậy là tính nhất quán về lượng của các hợp chất này và khả năng giảm nguy cơ liên quan đến việc lây truyền bệnh nhiễm trùng. Hai surfactant tổng hợp đã trải qua các thử nghiệm lâm sàng là lusupultide (Venticute, Takeda Pharmaceuticals, Zurich, Thuy Si) và lucinactant (Surfaxin; Discovery Laboratories, Warrington, PA). Lusupultide chứa SP-C tái tổ hợp. Nó không được nghiên cứu ở trẻ sơ sinh và chủ yếu được sử dụng trong các thử nghiệm lâm sàng ở người lớn bị tổn thương phổi cấp tính, trong đó lợi ích ngắn hạn không đi kèm với cải thiện tỷ lệ sống. Lucinactant chứa hai phospholipid, một axit béo, và sinapultide (KL4), một peptit tổng hợp kỵ nước gồm 21 axit amin, có hoạt tính tương tự như SP-B. Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (Food and Drug Administration – FDA) đã phê duyệt việc sử dụng lucinactant vào năm 2012. Lucinactant có sẵn dưới dạng công thức gel trong các lọ 8,5 mL sử dụng một lần. Khi đã sẵn sàng sử dụng, nó cần được làm ấm trong 15 phút trong bộ gia nhiệt khởi khi ở 40C. Huyền phủ chảy tự do được tạo thành sau khi lúc mạnh và sau đó để nguội đến nhiệt độ cơ thể. Liêu được chấp thuận là 5,8 mL/kg. được dùng trong nội khoa thường xuyên sau mỗi 6 giờ, dùng đến 4 liệu trong 48 giờ đầu đời.
Các nghiên cứu so sánh surfactant tổng hợp với surfactant có nguồn gốc động vật
Lucinactant được so sánh với colfosceril palmitate và beractant (BE) trong một thử nghiệm trên 1.294 trẻ có tuổi thai ≤ 32 tuần. Surfactant dự phòng được sử dụng trong vòng 30 phút đầu tiên sau sinh. Tỷ lệ RDS giảm đáng kể ở thời điểm 24 giờ sau khi sinh đã được ghi nhận cùng với tình trạng giảm đáng kể tỷ lệ tử vong liên quan đến RDS ở nhóm lucinactant. Lucinactant cũng làm giảm tỷ lệ BPD ở tuần thứ 36 khi so sánh với colfosceril palmitate. Đã có sự giám đáng kể các trường hợp tử vong liên quan đến RDS ở nhóm lucinactant khi so sánh với beractant, và tỷ lệ tử vong nói chung cũng cao hơn một chút so với beractant. Tuy nhiên, không có sự khác biệt về các bệnh tật khác liên quan đến sinh non giữa nhóm lucinactant và beractant. Nghiên cứu Liệu pháp Surfarin chống lại RDS (Surfaxin Therapy Against RDS – STAR) so sánh lucinactant với poractant alpha (poractant alfa – PA) ở trẻ có tuổi thai từ 24 đến 28 tuần và cần nặng sơ sinh từ 600–1.250 g như một thử nghiệm so sánh không kém hơn (noninferiority trial). Nghiên cứu bị dùng giữa chứng do huy động chân Trong hai thử nghiệm ngẫu nhiên đã được công bố này, lucinactant đã được chứng minh là an toàn và hiệu quả trong việc giảm tỷ lệ tử vong liên quan đến RDS. Những dữ liệu này gợi ý rằng: Surfactant tổng hợp thế hệ thứ hai này có thể so sánh về mặt kết quả với các chế phẩm có nguồn gốc động vật và trên thực tế, cho thấy vượt trội hơn surfactant tổng hợp thế hệ thứ nhất. Những khó khăn khi sử dụng lucinactant là độ nhớt cao ở nhiệt độ phòng, nhu cầu làm ấm trước khi sử dụng và yêu cầu sử dụng thể tích lớn. Lucinactant đã bị rút khỏi thị trường vào năm 2015. Hiện tại, cả surfactant tổng hợp thế hệ thứ nhất là thế hệ thứ hai điều không có sẵn để sử dụng trong khi quân, giúp điều tiện ở Hoa Kỳ hoặc các nơi khác.
Surfactant có nguồn gốc động vật
Nghiên cứu tiền lâm sàng
Năm 1972, Enhorning và Robertson nhận định: Những chú thỏ sinh non được điều trị bằng surfactant tự nhiên có chứa cả phospholipid lẫn protein đã cải thiện các dấu hiệu của RDS. Năm 1973, họ đã chỉ ra rằng: Sự lắng đọng của surfactant tự nhiên ở hầu họng là có hiệu quả. Adams và cộng sự cũng đã chứng minh tác dụng có lợi khi surfactant bò tự nhiên được đưa vào khí quản của cừu còn năm 1978.
Các nghiên cứu lâm sàng với surfactant có nguồn gốc từ động vật
Surfactant ngoại sinh thành công đầu tiên được sử dụng ở trẻ sơ sinh bị RDS là vào năm 1980 ở 10 trẻ sinh non, với surfactant được điều chế từ phổi bỏ băm nhỏ (surfactant TA). Sau báo cáo này, một số thử nghiệm lâm sàng ngẫu nhiên, có đối chứng, đã được thực hiện liên quan đến các surfactant của bò hoặc lợn ở trẻ sinh non. Các surfactant khác nhau có nguồn gốc từ động vật có sẵn trên toàn thế giới. Ba surfactant chính có nguồn gốc từ động vật được nghiên cứu có các tính năng riêng, ví dụ như ngâm rửa so với chiết xuất bằng dung môi để chiết xuất surfactant phối bê (Infasurf, Forest Labs, New York, NY) và các chất phụ gia cụ thể trong chiết xuất lipid của phôi bò bằm, beractant (Survanta, Abbott Laboratories, Columbus, OH). Poractant alpha (Curosurf, Chiesi Farmilities, Parma, Ý), một surfactant của lợn được phát triển bởi Bengt Robertson và Tore Curstedt, đã được sử dụng trong một thử nghiệm lâm sàng thí điểm vào năm 1987. Poractant alpha trải qua một bước bổ sung, được gọi là sắc ký gel lỏng, tạo ra dạng tinh khiết của lipid phân cực với nồng độ phospholipid là 76 mg/ mL. Ngoài ra, poractant alpha chứa hàm lượng DPPC, SP-B và plasmalogen cao nhất so với beractant và calfactant (Bảng 24.5). Poractant alpha cũng là surfactant có độ nhớt thấp nhất, lý tưởng cho các kỹ thuật xử lý surfactant it xâm lấn hơn (LIST), ít bị trào ngược thuốc và dung nạp tốt hơn.
| Bảng 24.5 Thành phần của các surfactant thường được sử dụng trên toàn thế giới | ||||||
| Surfactant | Chuẩn bị | Phospholipid (mg/mL) | DPPC (mg/mL) | Protein toàn phần (mg/mL) | SP-B (mg/mL) | PLMGN (mol% PL toàn phần) |
| Poractant alpha (Curosurf) | Chiết xuất phổi lợn băm nhỏ – được tinh chế qua sắc ký gel lỏng | 76 | 30 | 1 | 0,45 | 3,8 ± 0,1 |
| Beractant (Survanta) | Chiết xuất phổi bò băm nhỏ / DPPC, axit almitic,tripalmitin | 25 | 11-15,5 | < 1 | Không xác định | 1,5 ± 0,24 |
| Calfactant (Infasurf) | Rửa phổi bò/DPPC, cholesterol | 35 | 16 | 0,7 | 0,26 | Không xác định |
| CLSE BLES | Rửa phổi bò | 27 | Không xác định | 0,176-0,5 | Không xác định | Không xác định |
| Thành phần của surfactant tự nhiên, được sửa đổi.
DPPC, dipalmytoylphosphatidylcholine, PLMGN, plasmalogen. Nguồn: Được chỉnh sửa từ Sardesal S, Biniwale M, Wertheimer F, Garingo A, Ramanathan Ru Evolution of surfactant therapy for respiratory distress syndrome: past, present, and | future (tạm dịch: Sự phát triển của liệu pháp surfactant cho hội chứng suy hô hấp: Quá khứ, hiện tại và tương lai). Pediatr Res 2017,81:240–248. |
||||||
| Bảng 24.6 So sánh các chế phảm surfactabt của bò và bò: Beractant so với calfactant | |||||
| Thử nghiệm (3) | N | Nhóm | GA | BW | Kết quả |
| Bloom và cộng sự | 374 | Dự phòng | ≤ 1.250 g | < 1.250 g | Chính – không có sự khác biệt khi cần dùng liều thứ hai
Phụ – CA: Khoảng thời gian dùng thuốc dài hơn sau liều thứ hai |
| 608 | Cứu hộ | ≤ 2.000 g | ≤ 2.000 g | Chính – không có sự khác biệt về liều thứ ba
Phụ – CA: Nhu cầu FiO2 và MAP trung bình thấp hơn 0,72 giờ |
|
| Attar và cộng sự | 40 | Cứu hộ | N/A | N/A | Chính – không có sự khác biệt về giãn nở của phổi |
| Bloom va Clark | 749/2.000 | Dự phòng | N/A | N/A | Chính – không có sự khác biệt về BPD ở tuần thứ 36
Kết thúc thử nghiệm sớm* |
| 1.361/2.080 | Cứu hộ | 401-2.000 g | 401-2.000 g | Chính – không có sứ khác biệt về BPD ở tuần thứ 36
Kết thúc thử nghiệm sớm * |
|
| Kết quả lâm sàng trong ba nghiên cứu so sánh (cứu hộ = 648). Beractant (Survanta) so với Calfactant (Infasurf).
BW, trọng lượng sơ sinh; GA, tuổi thai. N/A, không ghi nhận. * Việc kết thúc thử nghiệm sớm khiến chúng tôi không thể chấp nhận hoặc bác bỏ giả thuyết của mình. |
|||||
Surfactant bò
Các thử nghiệm so sánh beractant và calfactant đã không chứng minh được bất kỳ sự khác biệt đáng kể nào về kết quả lâm sàng, hoặc các biến chứng liên quan đến liều lượng. Tuy nhiên, trong số những trẻ được điều trị RDS, một nhóm nhỏ gồm những trẻ được dùng calfactant đã cải thiện về mặt lâm sàng với khoảng cách giữa các liều dài hơn, nồng độ oxy thấp hơn và áp lực đường thở trung bình thấp hơn trong 72 giờ đầu đời so với những trẻ được điều trị bằng beractant (Bảng 24.6).
Surfactant lợn
Thử nghiệm đa trung tâm đầu tiên về poractant alpha cho thấy tình trạng giảm tỷ lệ tử vong sơ sinh cũng như tỷ lệ mắc bệnh khi phế thũng mô kẽ phổi (pulmonary interstitial emphysema – PIE) và tràn khí màng phổi sau khi so sánh với nhóm chứng ở trẻ sinh non bị RDS nặng. Một thử nghiệm thứ hai của Speer đã chứng minh hiệu quả của nhiều liều poractant alpha. Có một sự cải thiện nhanh chóng oxygen hóa được phản ánh bằng sự gia tăng gấp ba lần tỷ lệ áp lực oxy động mạch/phế nang trong vòng 5 phút sau khi nhỏ surfactant được ghi nhận với các liều bổ sung. Ngoài ra, nhu cầu về thuốc giảm ở nhóm dùng nhiều liều. Các nghiên cứu tiếp theo về poractant alpha cho thấy điều trị sớm được ưu tiên hơn so với điều trị muộn hơn.
Surfactant của bò so với lợn
Sáu thử nghiệm lâm sàng ngẫu nhiên so sánh poractant alpha và beractant đã được công bố cho đến nay (Bảng 24.7). Tất cả các nghiên cứu này cho thấy rằng: Quá trình cai oxygen và áp lực đường thở trung bình nhanh hơn, ít cần dùng 2 liều trở lên, ít ngày thở máy hơn, tỷ lệ tử vong thấp hơn ở trẻ sơ sinh – 32 tuần tuổi thai, ít rò rỉ khí và còn ống động mạch (PDA) hơn, đồng thời tỷ lệ sống sót mà không có BPD cao hơn nhờ sử dụng poractant alpha khi so sánh với trẻ sơ sinh được điều trị bằng beractant.
| Bảng 24.7 Kết quả lâm sàng giữa chế phẩm surfactant của bò và lợn: Poractant alpha so với beractant | |||||
| Thử nghiệm | Surfactant | N | Loại | Bệnh nhân | Kết quả |
| Speer và cộng sự | PA so với BE | 73 | Tx | 700-1.500 g | PA: FiO2, PIP va MAP thấp hơn ở 12-24 giờ |
| Baroutis và cộng sư | PA so với BE so với BO | 80 | Tx | < 2.000 g | PA: Ít hơn trên O2 và PPV; giảm LOS |
| Ramanathan và cộng sự | PA so với BE | 293 | Tx | 750-1.750 g | PA: FiO2 thấp hơn, liều lượng ít hơn, giảm tỷ lệ tử vong < 32 tuần |
| Mailoy và cộng sự | PA so với BE | 58 | Tx | < 37 tuần tuổi | PA: FiO2 thấp hơn lên đến 48 giờ, liều lượng ít hơn, thể tích thấp hơn |
| Fujii và cộng sự | PA so với BE | 52 | Tx | < 30 tuần tuổi | PA: Cai máy nhanh hơn, ít rò rỉ khí, PDA và thởi máy ở 72 giờ |
| Dizdar và cộng sự | PA so với BE | 126 | Tx | < 37 tuần tuổi | PA: Cai máy nhanh hơn, liều lượng ít hơn, rút nội khí quản nhanh và tỷ lệ sống sót không có BPD cao hơn |
| Kết quả làm sáng trong sáu nghiên cứu so sánh (cứu hộ = 682). Poractant alpha (PA) (Curosurf) so với Beractant (BE) (Survanta).
BO, bovactant (alveofact); BPD, loạn sản phế quản phối; LOS, thời gian lưu trú; MAP áp lực đường thở trung bình; MV, thò máy; PDA, còn ông động mạch; PIP áp lục hit vào đình; PPV, thông khi áp lực dương; Tx, liệu pháp surfactant cứu hộ. |
|||||
Trong một đánh giá có hệ thống và phân tích tổng hợp năm thử nghiệm ngẫu nhiên có đối chứng, 529 trẻ sơ sinh được so sánh trong khi nhận poractant alpha hoặc beractant để điều trị cấp cứu. Tỷ lệ phụ thuộc oxy ở độ tuổi 36 tuần sau kỳ kinh cuối là tương tự nhau ở cả hai nhóm. Trẻ sơ sinh được điều trị bằng poractant alpha ở 100 mg/kg (liều thấp) hoặc 200 mg/kg (liều cao) cho thấy tình trạng giảm có ý nghĩa thống kê về tử vong, nhu cầu dùng liều lặp lại, nhu cầu oxy, thời gian điều trị oxy và thời gian thở máy. Thử nghiệm về tính không đồng nhất cho kết quả dương tỉnh về thời gian oxygen hóa và thông khí. Tử vong vẫn ở mức thấp đáng kể với poractant alpha so với beractant. Nhu cầu giảm liều với poractant alpha liểu cao ít hơn đáng kể, nhưng không phải là khi sử dụng poractant alpha liều thấp. Nhiều nghiên cứu đã chỉ ra rằng: Sử dụng liều cao hơn có liên quan đến kết quả lâm sàng tốt hơn với các chế phẩm surfactant khác nhau (Bảng 24.8). Sử dụng liều poractant alpha cao hơn cũng dẫn đến thời gian bán hủy dài hơn, chỉ số oxygen hóa thấp hơn và ít cần phải lặp lại liều hơn (Hình 24.7).
| Bảng 24.8 Kết quả lâm sàng tốt hơn với liều lượng các chế phẩm surfactant cao hơn | |||
| Nghiên cứu | Liều thấp và liều cao | Surfactant được nghiên cứu | Kết quả với liều cao |
| Konishi và cộng sự | 60 so với 120 mg/kg | Surfactant TA | Giảm BPD (P=0,01), IVH (P=0,047) và thời gian tác dụng dài hơn (P<0,05) |
| Dunn và cộng sự (một liều so với nhiều liều – tối da 4 liều), GA trong 30-36 tuần | Một liều so với nhiều liều | BLES 100 mg/kg | Nhóm nhiều liều:P Cai oxy nhanh hơn, cải thiện tỷ lệ a/A (70% 2 liều; 41% – 3 liều; 11% – 4 liều) |
| Speer và cộng sự (một liều so với nhiều liều) | Một liều so với nhiều liều | Poractant alpha | Nhóm nhiều liều: Ít PTX hơn (18% so với 9%; P <0,001 và tử vong 21% so với 13%; P < 0,05) |
| Halliday và cộng sự (liều trung bình ở nhóm liều thấp: 242 mg/kg) | Lên đến 300 so với 600 mg/kg | Poractant alpha | Ít điểm trên O2 > 40%; 48,4% so với 42,6%, P < 0,01 |
| Gortner và cộng sự | 50 so với 100 mg/kg | Alveofact | Cải thiện oxygen hóa và ít PIE hơn |
| Liều cao hơn có liên quan đến kết quả tốt hơn. Dựa trên bang chứng, Hướng dẫn Đồng thuận Châu Âu (European Consensus Guidelines – ECG) năm 2016 khuyến cáo dùng liều ban đầu 200 mg/kg poractant alpha để chỉ định RDS sớm, cứu hộ. Cũng được xác nhận bởi Hiệp hội Y học Chu sinh Châu Âu (European Association of Perinatal Medicine). “Có đáp ứng liên quan đến liều lượng”. BPD, loạn sản phế quản phổi; /VH, xuất huyết não thất; PTX, tràn khí màng phổi. | |||
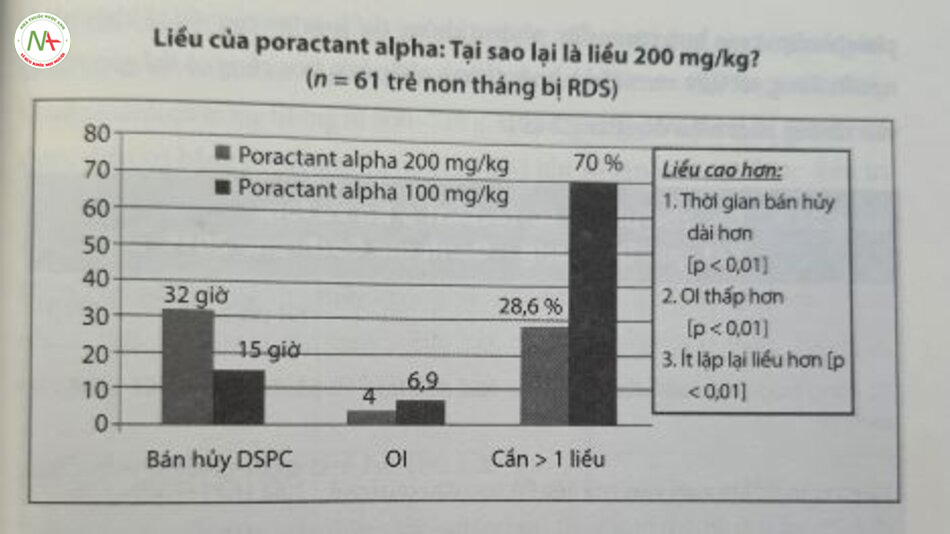
Một phân tích tổng hợp khác kết luận rằng: Kết quả của các thử nghiệm ngẫu nhiên, có đối chứng về các chế phẩm khác nhau của các surfactant có nguồn gốc động vật, trong đó poractant alpha làm giảm nhu cầu dùng thuốc lặp lại, liên quan đến ít biến chứng khi sử dụng, dẫn đến oxygen hóa ngắn hạn tốt hơn và giảm nguy cơ tử vong so với beractant. Trong các đánh giá gần đây nhất (2015) của Cochrane, đã ghi nhận sự khác biệt đáng kể về kết quả khi các thử nghiệm về beractant được so sánh với poractant alpha, bao gồm sự gia tăng đáng kể nguy cơ tử vong trước khi xuất viện, tử vong, hoặc nhu cầu oxy ở 36 tuần tuổi sau kỳ kinh cuối (postmenstrual age – PMA), PDA cần điều trị, và bệnh nhân được dùng nhiều hơn 1 liều surfactant ở trẻ sơ sinh được điều trị bằng beractant so với poractant alpha. Sự khác biệt trong các kết quả này chỉ được quan sát thấy trong các nghiên cứu sử dụng liều ban đầu cao hơn của poractant alpha. Mặc dù những nghiên cứu này cho thấy rằng sự khác biệt quan sát được giữa poractant alpha và beractant có liên quan đến liều lượng phospholipid cao hơn trước đây, nhưng không thể loại trừ các yếu tố khác như nguồn động vật (lợn so với bò), hoặc thành phần hóa học cũng có thể góp phần vào những phát hiện đó (Bảng 24,9).
| Bảng 24.9 Các chế phẩm surfactant ở bò và lợn: Kết quả lâm sàng – Đánh giá Cohrance 2015 | ||
| RR (95% CI) | NNTH | |
| Tử vong trước khi xuất viện (9 nghiên cứu, 901 trẻ sơ sinh) | 1,44 (1,04-2,00) | 20 |
| Tử vong trước khi xuất viện (với liều PA ban đầu cao hơn) | 1,62 (1,11-2,38) | 16 |
| Tử vong hoặc O2 ở PMA 36 tuần (3 nghiên cứu, 448 trẻ sơ sinh) | 1,30 (1,04-1,64) | 9 |
| Tử vong hoặc O2 ở PMA 36 tuần (với liều ban đầu cao hơn ≥ 100 mg/kg PA) | 1,39 (1,08-1,79) | 7 |
| > 1 liều surfactant (6 nghiên cứu, 786 trẻ sơ sinh) | 1,57 (1,29-1,92) | 7 |
| PDA cần Rx (3 nghiên cứu, 137 trẻ sơ sinh) | 1,86 (1,28-2,70) | 4 |
| Beractant so với poractant alpha. Đánh giá Cochrane năm 2015. NNTH, số cần thiết để gây hại, với việc sử dụng beractant; PA, poractant alpha; PMA, tuổi sau kỳ kinh cuối; PDA, còn ông động mạch; RR, nguy cơ tương đối.
Nguồn: Được chỉnh sửa từ Singh N, Halliday HL, Stevens TP, Suresh G. Soll R, Rojas- Reyes MX. Comparison of animal-derived surfactants for the prevention and treatment of respiratory distress syndrome in preterm infants (tam dich: So sánh các surfactant co nguồn gốc từ động vật để phòng ngừa và điều trị hội chứng suy họ hấp ở trẻ sinh non). Cơ sở dữ liệu Cochrane Syst Rev 2015;12:CD010249. |
||
Trong một nghiên cứu hồi cứu lớn, Ramanathan và cộng sự đã so sinh 14.173 trẻ sơ sinh được điều trị bằng poractant alpha, calfactant hoặc beractant và báo cáo đã cho thấy tỷ lệ tử vong cao hơn đáng kể ở trẻ được điều trị bằng calfactant hoặc beractant so với trẻ được điều trị bằng poractant alpha. Từ vong nói chung thấp hơn ở trẻ sơ sinh được điều trị bằng poractant alpha (3,61%) so với beractant (4,58%, P = 0,053), hoặc calfactant (5,95%, P=0,043). Ở trẻ sơ sinh có trọng lượng từ 500–749 g, tỷ lệ tử vong giảm đáng kể đối với trẻ được điều trị bằng poractant alpha (11,72%) khi so sánh với trẻ được điều trị bằng calfactant (20,67%, P < 0,001), hoặc beractant (17,39%, P < 0,011). Một nghiên cứu hồi cứu khác đánh giá hiệu quả so sánh giữa ba surfactant này ở 51.282 trẻ sơ sinh đã cho thấy không có sự khác biệt nào về tỷ lệ tử vong. Tuy nhiên, hơn 50% trẻ trong nghiên cứu này có tuổi thai trên 31 tuần. Ngoài ra, tất cả các yếu tố gây nhiễu đã biết đều không được tính đến,
Surfactant tổng hợp thế hệ thứ ba
Trong các nghiên cứu trên động vật, surfactant tổng hợp thế hệ thứ ba có chứa DPPC, 1-palmitoyl-2-oleoyl-PG (POPG), và các chất tương tự SP-B và SP-C đã được chứng minh là vượt trội hơn so với surfactant. Trong một nghiên cứu với cừu non, một surfactant tổng hợp có chứa cả chất tương tự SP-B và SP-C (CHF 5633) đã chống lại sự bất hoạt tốt hơn so với poractant alpha. Thử nghiệm làm sàng trên người giai đoạn I về surfactant tổng hợp CHF 5633 trong RDS liên quan đến 40 trẻ sinh non từ 27 đến dưới 34 tuần tuổi thai. Trong đó, 20 trẻ đầu tiên được nhận CHF 5633 với liều 100 mg/kg, còn 20 trẻ tiếp theo nhận được thuốc với liều 200 mg/kg. Cả hai liều đều được sử dụng tốt, cho thấy hiệu quả lâm sàng đầy hứa hẹn. Một thử nghiệm lâm sàng ngẫu nhiên, có đối chứng, mù đôi, đa trung tâm giai đoạn II so sánh CHF 5633 với poractant alpha để điều trị RDS hiện đang được tiến hành ở Hoa Kỳ (ClinicalTrials.gov NCT02452476).
Chỉ định sử dụng surfactant
Năm 2014, Học viện Nhi khoa Hoa Kỳ (American Academy of Pediatrics – AAP) và Hướng dẫn Đồng thuận Châu u (European Consensus Guidelines – ECG) cập nhật năm 2016 đã khuyến cáo rằng: Ban đầu, nên cung cấp nCPAP cho tất cả bệnh nhân RDS, đặt nội khí quản và sử dụng surfactant cho trẻ bị suy hô hấp nặng kéo dài hoặc trẻ ngưng thở (Bảng 24.10).
Việc sử dụng surfactant tiếp theo có thể làm giảm tỷ lệ tử vong và bệnh tật ở trẻ dưới 30 tuần tuổi thai bị RDS. Nhiều liều sử dụng kỹ thuật INSURE cũng đã được sử dụng thành công và không cho thấy kết quả xấu đi. Dự đoán ai có khả năng thất bại INSURE bằng cách sử dụng các tiêu chỉ lâm sàng và khí máu có thể giúp xác định một nhóm dân số hợp lý để duy trì áp dụng thở máy.
| Bảng 24.10 Chỉ định điều trị surfactant | |
| Tuổi thai | Yêu cầu FiO2 với CPAP/PPV |
| ≤ 26 tuần | > 30% |
| > 26 tuần | > 40% |
| Liều tiếp theo ở tất cả trẻ sơ sinh | Yêu cầu liên tục đối với oxy > 30% |
Hướng dẫn Đồng thuận Châu Âu về xử trí RDS (bản cập nhật năm 2016)
Trẻ sơ sinh bị RDS nên được cung cấp surfactant tự nhiên:
- Chỉ định surfactant cứu hộ sớm nếu có bằng chứng về RDS, hoặc cho trẻ ELBW có mẹ không được tiêm AS, hoặc trẻ được đặt nội khí quản để ổn định.
- Trẻ < 26 tuần với FiO,> 30% và trẻ > 26 tuần với FiO, >40% nên được xem xét dùng surfactant cấp cứu sớm.
- Poractant alpha 200 mg/kg tốt hơn 100 mg/kg PA hoặc beractant.
- Xem xét INSURE và rút nội khí quản sớm chuyển sang NCPAP/ NIPPV.
- Liệu pháp sử dụng surfactant ít xâm lấn (less invasive surfactant administration – LISA), hoặc surfactant xâm lấn tối thiểu (minimally invasive surfactant – MIST) có thể được sử dụng thay thế INSURE cho trẻ sơ sinh tự thở.
- Nên xem xét dùng caffeine cho tất cả trẻ sơ sinh < 1.250 g BW, đang điều trị NCPAP/NIPPV.
Loại surfactant: Dựa trên bằng chứng, việc sử dụng surfactant lợn, poractant alpha, với liều ban đầu 200 mg/kg đem lại kết quả tốt hơn và hiệu quả về mặt chi phi, đặc biệt là ở các nước hạn chế về tài nguyên, chủ yếu do giảm nhu cầu sử dụng lại, số ngày thở oxy và thở máy ít hơn, cũng như ít cần điều trị PDA hơn. Tất cả những lợi ích này góp phần làm giảm chi phí chăm sóc trẻ sinh non.
Thời điểm sử dụng surfactant: Dự phòng so với cứu hộ
Các nghiên cứu trước đó vào những năm 1990, khi chưa đầy một nửa số bà mẹ được dùng corticosteroid để làm trưởng thành phối trước khi sinh cho thấy rằng: Surfactant dự phòng được sử dụng trong vòng 15 phút đầu đời trong một phổi chứa đầy dịch có khả năng phân bố surfactant tốt hơn, cho kết quả tốt hơn so với liệu pháp cứu hộ. Với việc sử dụng nhiều hơn steroid trước sinh và sử dụng CPAP thường quy trong giai đoạn chuyển tiếp trong phòng sinh, chi định surfactant dự phòng có liên quan đến nguy cơ tử vong hoặc BPD nhiều hơn (nguy cơ tương đối [RR] 1,13, 95% CI: 1,02–1,25). Ở nhóm dân số này, với việc sử dụng nhiều steroid trước khi sinh và sử dụng thường quy thông khí không xâm lấn (noninvasive ventilation – NIV) trong phòng sinh, liệu pháp surfactant dự phòng không còn được khuyến khích.
Thời điểm sử dụng surfactant: Chỉ định surfactant sớm hoặc cứu hộ trì hoãn/chọn lọc
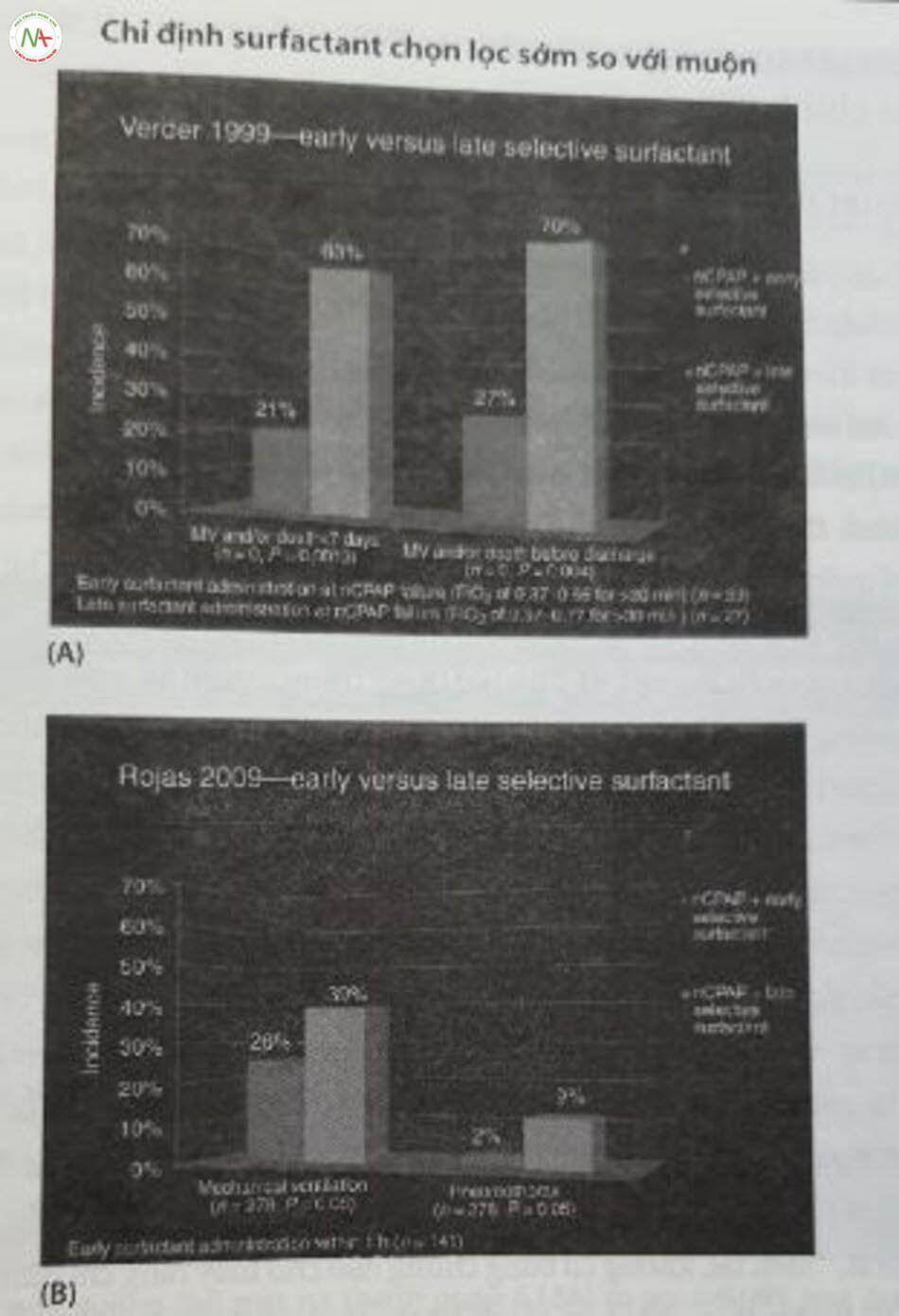
Năm 1999, trong một thử nghiệm lâm sàng, Verder đã so sánh việc sử dụng surfactant chọn lọc sớm và muộn ở trẻ sinh non thở CPAP qua đường mũi được chọn ngẫu nhiên để điều trị surfactant qua nội khí quản khi đạt nhu cầu oxy thấp hơn so với cao hơn (FiO, 37%-55% so với 56%-77% trong hơn 30 phút). Kết quả của thử nghiệm trên cho thấy rằng: Điều trị cấp cứu sớm có liên quan đến việc đặt nội khí quản ít hơn đáng kể và/hoặc tử vong trước 7 ngày sống hoặc trước khi xuất viện (Hình 24.8A). Mười năm sau, vào năm 2009, một thử nghiệm lâm sàng tương tự được công bố từ Nam Mỹ cho thấy nhu cầu đặt nội khí quản ít hơn đáng kể, cũng như ít rò rỉ khí hơn với điều trị cấp cứu sớm (Hình 24.8B). Giảm thời gian thở máy là một kết quả quan trọng, đặc biệt khi nguồn lực y tế bị hạn chế, có thể dẫn đến ít BPD hơn ở cả khu vực có nguồn lực thấp lẫn khu vực phát triển.
Thời gian chính xác để sử dụng surfactant vẫn chưa rõ ràng, đặc biệt là ở trẻ sơ sinh được thông khí không xâm lấn. Nhu cầu bổ sung oxy ít hơn có thể không phản ánh mức độ nghiêm trọng của RDS do sử dụng áp lực cao trong NIPPV, Chúng tôi đã quan sát thấy việc cai oxy nhanh hơn khi trẻ đang điều trị NIPPV so với trẻ đang điều trị NCPAP, có thể là do áp lực đường thở trung bình cao hơn và phế nang được huy động tốt hơn (quan sát cá nhân). Các nghiên cứu đánh giá thời gian dựa trên nhu cầu oxy trong khi sử dụng NIPPV hiện đang được đánh giá. Nghiên cứu trong tương lai nên tập trung vào việc tối ưu hóa thời gian cho từng bệnh nhân không chỉ cần oxy mà còn xem xét áp lực cần thiết để giữ cho phế nang mở, cung cấp thông khí cũng như oxygen hóa đẩy đủ và các dấu hiệu trên X-quang.
Thời điểm sử dụng surfactant: Sau tuần tuổi đầu tiên
Việc sử dụng surfactant muộn sau tuần đầu tiên của cuộc đời gần đây đã được đánh giá trong hai thử nghiệm ngẫu nhiên có đối chứng. Nghiên cứu của Ballard và cộng sự ở trẻ sơ sinh được sử dụng oxit nitric dạng hít (inhaled nitric oxide – iNO) không cho thấy bất kỳ sự khác biệt nào về BPD ở 36 hoặc ở 40 tuần tuổi thai được điều chỉnh khi sử dụng calfactant; tuy nhiên, giảm tỷ lệ mắc bệnh đường hô hấp trước 1 tuổi đã được ghi nhận trong nghiên cứu của Hascoe và cộng sự, trong đó các tác giả này đã sử dụng 200 mg/kg poractant alpha ở 14 ngày tuổi, làm tăng khả năng có lợi lâu dài của liệu pháp surfactant muộn. Có vẻ như liều poractant alpha cao hơn cả trong giai đoạn cấp tính của RDS lẫn giai đoạn tiến triển của BPD đều có lợi trong việc giảm tỷ lệ mắc bệnh hô hấp mãn tính (chronic respiratory morbidity – CRM).
Kỹ thuật sử dụng surfactant: INSURE so với INSURE được điều chỉnh
Kỹ thuật INSURE
Trước đây, surfactant được dùng cho tất cả trẻ sinh non dạng điều trị thờ máy do suy hô hấp từ RDS. Hiện tại, hầu hết trẻ sinh non đều được hỗ trợ NIV. Trẻ sơ sinh chỉ được đặt nội khi quản để sử dụng surfactant. Hiện tại, kỹ thuật đặt nội khi quân, surfactant và rút nội khi quản (intubation, surfactant, and extubation INSURE) được Verder mô tả lần đầu tiên cách đây hơn 24 năm đã rất phổ biến.
Quy trình INSURE bao gồm: Đặt nội khí quản và sử dụng surfactant qua ống nội khí quản, sau đó rút nội khí quản sau một thời gian ngăn MV. Thủ thuật này giảm thiểu thời gian thông khí xâm lấn. Nhưng thông thường, thuốc tiên mà (premedication) bằng opioid được sử dụng trong quá trình này. Thất bại hoặc miễn cưỡng rút ống sau khi sử dụng surfactant không phải là không thường gặp. Leone và cộng sự cho thấy rằng: Kỹ thuật INSURE dẫn đến oxygen hóa bên vững hơn so với việc sử dụng surfactant cứu hộ trong quá trình thở máy xâm lấn. Ngoài ra, trẻ sinh non được điều trị bằng INSURE ít mắc các bệnh đi kèm vẽ đường hô hấp hơn, bao gồm: Tràn khí màng phổi, BPD và BPD hoặc tử vong. Một phân tích tổng hợp gần đây bao gồm chín thử nghiệm lâm sàng (1.551 trẻ sơ sinh) và so sánh INSURE với chỉ dùng CPAP. Không có sự khác biệt có ý nghĩa thống kê giữa INSURE sớm và chỉ dùng CPAP đối với tất cả các kết cục như: Kết cục tổng hợp của BPD và/hoặc tử vong, BPD, tử vong, rò rỉ khí, IVH nặng chậm phát triển thần kinh, hoặc tử vong và/hoặc suy giảm phát triển thần kinh. Kết luận là, “hiện tại, không có bằng chứng nào cho thấy rằng chỉ dùng INSURE hoặc CPAP sớm là ưu việt hơn so với kỹ thuật còn lại”. Có lo ngại cho rằng ngay cả thông khí trong một thời gian ngắn cũng có thể gây tổn thương phổi ở phổi non tháng dễ bị tổn thương. Ngoài ra, sự phân bố surfactant có thể không tối ưu khi surfactant được sử dụng thông qua thông khí áp lực dương.
Ở trẻ sinh non bị RDS, các chiến lược tránh đặt nội khí quản dẫn đến thông khí áp lực dương xâm lấn hiện đang được tìm kiếm. Thủ thuật đặt nội khí quản có thể làm tổn thương thanh quản hoặc khí quản và việc cần sử dụng thuốc an thần cũng như thuốc giảm đau có nguy cơ gây ra các tác dụng phụ không mong muốn. Ngoài ra, áp lực dương và thở máy được áp dụng ngay trong một thời gian ngắn cũng có thể làm sang chấn phổi non tháng, và việc tránh nó hoàn toàn có thể có khả năng làm giảm tỷ lệ mắc BPD.
Sử dụng surfactant qua đường thở mặt nạ thanh quản (laryngeal mask airway – LMA) đã được mô tả trong một số nghiên cứu mới hơn nhưng nhỏ hơn, chứng minh tính an toàn và tính khả thi ở trẻ sinh non lớn hơn. Trong một thử nghiệm ngẫu nhiên so sánh LMA với kỹ thuật INSURE, Pinheiro chỉ ra rằng: Nhu cầu thở máy giảm trong nhóm LMA ở trẻ non tháng > 29 tuần và cân nặng sơ sinh > 1.000 g với RDS trung bình. Kỹ thuật này là một lựa chọn tiềm năng rất tốt cho việc xử trí surfactant ở các nước thu nhập thấp, có các nguồn lực hạn chế (Bảng 24.11).
| Bảng 24.11 So sánh surfactant được sử dụng qua đường thở mặt nạ thanh quản (LMA) với kỹ thuật INSURE | |||
| LMA (n=30) | INSURE (n=30) | P | |
| BW, g | 2.118 (1.150-3.984) | 1.945 (1.015-3.700) | NS |
| GA, ≥ 33 tuần | 63% | 40% | NS |
| Steroid tiền sản | 50% | 53% | NS |
| Tuổi trung bình tính theo ngẫu nhiên (giờ) | 17,3 (3-43) | 15,8 (3-42) | NS |
| FiO2 trung bình khi chỉ định | 37% (30-50) | 38% (30-50) | 0,003 |
| Tỷ lệ thất bại | 30% | 77%* | < 0,0001 |
| Surfactant qua đường thở mặt nạ thanh quản (LMA) so với INSURE qua ống nội khi quản (GA 29–36 tuần; BW > 1.000 g; FiO2 30%–60%; n = 60).
BW, trọng lượng sơ sinh; GA, tuổi thai; INSURE, đặt nội khí quản-surfactant-rút nội khí quản; LMA, đường thỏ mặt nạ thanh quản; Rx, điều trị. *Atropin + morphin; chỉ LMA – atropine; tỷ lệ thất bại cao trong INUSRE có khả năng là do thuốc an thần; thất bại sớm = căn thỏ máy hoặc sử dụng naloxone (3% so voi 67%). Nguồn: Được chỉnh sửa từ Pinheiro JM, Santana-Rivas Q, Pezzano C. Randomized trial of laryngeal mask airway versus endotracheal intubation for surfactant delivery (tam dịch: Thử nghiệm ngẫu nhiên giữa mặt nạ thanh quản so với đặt nội khí quản để cung cáp surfactant). J Perinatol 2016;36:196-201. |
|||
Kỹ thuật INSURE được điều chỉnh
Kỹ thuật INSURE được điều chỉnh (modified INSURE – mINSURE) thường liên quan đến việc sử dụng surfactant bằng cách dùng một ống nhỏ, giống như ông cho ăn, ông thông mạch máu, hoặc một ống thông đường kính nhỏ được chế tạo đặc biệt, trong khi trẻ đang thở tự nhiên băng NCPAP hoặc NIPPV mà không cần thuốc tiền mê/an thần. Kỹ thuật này, còn được gọi là LISA (less invasive surfactant administration – sử dụng surfactant it xâm lấn), hiện đang được nghiên cứu ở nhiều trung tâm trên thế giới. Một số tên gọi thay thế được các nhà nghiên cứu sử dụng để mô tả kỹ thuật mINSURE được trình bày trong Bảng 24.12. Vi du, MIST (minimally invasive surfactant – surfactant xâm lấn tối thiểu). Tránh thở máy (avoidance of mechanical ventilation – AMV). Surfactant không đặt nội khí quản (surfactant without intubation – SWI), Ứng dụng surfactant không đặt ống nội khí quản (nonintubated surfactant application – NINSAPP), Phương pháp Take Care, Sonda Nasogastrica SUR- factante Extubacion (SONSURE), CPAP sớm và MIST thể tích lớn (Early CPAP and Large volume MIST – ECALMIST), và Sử dụng SURF xâm lấn tối thiếu (Minimally Invasive SURF administration – MISURF) là một số thuật ngữ được sử dụng để mô tả kỹ thuật này.
Trong kỹ thuật Take Care cho trẻ sinh non áp dụng CPAP, Kanmaz đã so sánh việc sử dụng surfactant bằng ống thông mũi-dạ dày mềm vô trùng 5F trong quá trình thở tự nhiên, đi kèm NCPAP (Take Care) với quy trình INSURE bằng cách thực hiện đặt nội khí quản ngắn qua đường miệng để sử dụng surfactant. Thời lượng CPAP và thở máy ngắn hơn đáng kể ở nhóm Take Care so với nhóm INSURE. Khi nhu cầu và thời lượng thở máy giảm, tỷ lệ BPD ở nhóm Take Care đã giảm. Klebermass – Schrehof đã đánh giá kết quả của kỹ thuật LISA trong một nhóm thuần tập gồm 224 trẻ từ 23 đến 27 tuần tuổi thai tại một trung tâm duy nhất. Trong khi so sánh với các đối chứng trước đây, họ nhận thấy tỷ lệ sống sót cao hơn đáng kể (75,8% so với 64,1%), IH Ít hơn (28,1% so với 45,9%), IVH ít nghiêm trọng hơn (13,1% so với 23,9%), và nhuyễn hóa chất trắng quanh não thất (periventricular leukomalacia – PVD) (1,2% so với 5,6%) ở trẻ sơ sinh được điều trị bằng phương pháp LISA.
| Bảng 24.12 Các kỹ thuật được nghiên cứu để điều trị surfactant tối thiểu hoặc ít xâm lấn ở trẻ sinh non tự thở mà không cần sử dụng ống nội khí quản | |||
| Phương pháp | Ống/ống thông | Liều lượng và phương thức cung cấp surfactant | Tiền mê/An thần |
| Phương pháp Cologne | Ống cho ăn 4 hoặc 5 Fr | 100 mg/kg, dùng trong 1-3 phút | Atropine, an thần và giảm đau (tùy chọn) |
| SWI | Ống cho ăn 4 Fr | 100 mg/kg trong 1-5 phút | Atropine (tùy chọn) |
| Phương pháp Hobart | 16 G Angiocath | 100-200 mg/kg, dùng trong 15-30 giây | Sucrose |
| Phương pháp AMV/NINSAPP | Ống thông sử dụng kèm Magill | 100 mg/kg, dùng trong 1-3 phút | Atropine, an thần và giảm đau (tùy chọn) |
| LISA | Ống cho ăn đường kính 1,3 mm sử dụng kèm Magill | 200 mg/kg, dùng trong 2-5 phút | Không có |
| Take Care | Ống cho ăn 5 Fr | 100 mg/kg, dùng trong hơn 30-60 giây | Không có |
| SONSURE | Ống cho ăn 4 Fr | 100 mg/kg, dùng trong hơn 1-3 phút | Atropine |
| Phương pháp Karalinska | Ống thông 5 Fr x 30 cm | Dùng trong hơn 30 giây | Atropine, fentanyl |
| Nghiên cứu ECALMIST | Ống thông mạch máu 17 G, dài 133 mm | 5 mL/kg, 0,25-0,5 mL, liều bolus trên 20-30 giây | Không có |
| Thử nghiệm SAINT | Ống thông dài 300 mm | Không được chỉ định | Thuốc giảm đau |
| Thử nghiệm MiSurf | Ống cho ăn | 4 mL/kg | Không được chỉ định |
| Quy trình MIST đã sửa đổi | Ống thông mũi dạ dày 5 Fr | 4 mL/kg, dùng trong hơn 30-45 giây | Không có thuốc an thần |
| Nguồn: Được chỉnh sửa từ Sardesai S, Biniwale M. Wertheimer F. Garingo A, Ramanathan R. Evolution of surfactant therapy for respiratory distress syndrome: past, present, and future (tam dịch: Sự phát triển của liệu pháp surfactant cho hội chứng suy họ hấp. Quá khứ, hiện tại và tương lai). Pediatr Res 2017,81 240–248. | |||
Trong một nghiên cứu tương tự khác của Krajewski, liệu pháp thay thế surfactant không cần đặt nội khí quản trong khi nhận CPAP ở trẻ sinh non đã được thực hiện với một ống thông nội khí quản mỏng có liên quan đến nhu cầu đặt nội khí quản và thở máy thấp hơn đáng kể so với phương pháp INSURE (19,2% so với 65%). Ngoài ra, kết quả phổi tốt hơn cũng được ghi nhận với phương pháp thay thế surfactant mới này. BPD ở nhóm nghiên cứu thấp hơn đáng kể (15,4%) so với nhóm INSURE (40%). Trong một thử nghiệm đa trung tâm gần đây của Mạng lưới Sơ sinh Đức, kỹ thuật NINSAPP được tiến hành cho 211 trẻ non tháng ở 23-26 tuần tuổi thai cho kết quả sống sót kết hợp cao hơn đáng kể, đồng thời không để lại tác dụng phụ nghiêm trọng so với surfactant qua ống nội khí quản ở trẻ thở máy. Trong một nghiên cứu khác, kỹ thuật MIST sử dụng một ống thông rốn đưa vào bên dưới dây thanh 2cm d overline a được chứng minh là làm tăng nhanh và đồng đều thể tích phổi cuối thì thở ra, cũng như cải thiện oxygen hóa.
Đánh giá hệ thống và phân tích tổng hợp sáu thử nghiệm ngẫu nhiên có đối chứng, áp dụng kỹ thuật surfactant xâm lấn tối thiểu (mINSURE) hoặc ít xâm lấn (LIST) để sử dụng poractant alpha ở trẻ sinh non bị RDS dẫn đến giảm nguy cơ BPD ( RR = 0, 71[0, 52 + 0, 99] ; [0, 52 + 0, 99]; NNT = 21 ), tử vong hoặc BPD ( RR = 0, 74 [0, 58 + 0, 94] NNT = 15), và thất bại CPAP sớm hoặc yêu cầu thông khí xâm lấn ( RR = 0, 67 [0,53–0,84]; NNT = 8 và RR = 0, 69[0, 53 + 0, 88]; NNT = 6 ). So với INSURE, LIST giảm nguy cơ BPD hoặc tử vong ( RR = 0, 63[0, 44 + 0, 92] ; NNT = 11) và thất bại CPAP sớm (RR = 0, 71[0, 53 + 0, 96]; NNT = 11) .
Trong một phân tích tổng hợp khác, việc sử dụng kỹ thuật LISA làm giảm kết quả tổng hợp của tử vong hoặc BPD ở tuần 36 ( RR = 0, 75 [95% CI: 0,59- 0,94], P = 0, 1 ) , BPD ở 36 tuần ở những trẻ sống sót ( RR = 0, 72[0, 53 + 0, 97] , P = 0 ,03), nhu cầu thở máy trong vòng 72 giờ sau sinh ( RR = 0, 71[0, 53 + 0, 96] , P = 0 ,02) hoặc nhu cầu thở máy bất cứ lúc nào trong thời gian nằm viện chăm sóc đặc biệt cho trẻ sơ sinh ( RR = 0, 66[0, 47 + 0, 93] . P = 0, 2 ) Không có sự khác biệt nào được ghi nhận về kết quả tử vong và các bệnh tật khác ở trẻ sơ sinh. Tỷ lệ thất bại của quy trình trong lần thử đầu tiên và nhu cầu bổ sung liều surfactant không khác nhau giữa các nhóm can thiệp (Bảng 24.13).
| Bảng 24.13 Đặc điểm của các nghiên cứu so sánh giữa thông khí ít xâm lấn và kỹ thuật INSURE | |||||
| Nghiên cứu (6); N= 895 | Dân số/điều trị surfactant | Tiêu chuẩn điều trị surfactant | Nhóm LISA | Quy trình INSURE | Thuốc tiền mê |
| Gopel và cộng sự | GA: 26-28 tuần; Đức – 12 NICU Curosurf/ bò 100 [80% Curourf] | NCPAP + FiO2 ≥ 30% đối với LISA; FiO2 thay đổi đối với INSURE | N= 108 ống thông 2,5 – 5 Fr; kềm Magill | N =112; có | ± |
| Kanmaz và cộng sự | < 32 tuần; Thổ Nhĩ Kỳ – Curosurf 100 | NCPAP + FiO2 ≥ 40% | N = 100; ống cho ăn 5 Fr | N = 100; có | Không |
| Mirnia và cộng sự | 27-32 tuần; Iran – 2 NICU; Curosurf 200 | NCPAP + FiO2 ≥ 30% | N = 66; ống cho ăn 5 Fr | N = 70; có | Atropine |
| Bao và cộng sự | 28-32 tuần; Trung Quốc – 200 Curosuft | NCPAP + FiO2 ≥ 30% hoặc ≥ 35% | N = 47; ống thông 16 G | N = 43; có | —– |
| Mohammadizadeh và cộng sự | < 34 tuần; Iran – 2 NICU Curosurf 200 | NCPAP + FiO2 ≥ 30% và Silverman ≥ 5 | N = 19; ống cho ăn 4 Fr; kềm Magill | N = 19; có | Atropine |
| Kribs và cộng sự | 23-27 tuần; Đức – 13 NICU; Curosuft 100 | NCPAP + FiO2 ≥ 30% và Silverman ≥ 5 | N = 107; ống thông 4 Fr; kềm Magill | N = 104; có | ± |
| LISA SO VỚI INSURE sử dụng Curosurf/NCPAP: Phân tích tổng hợp. LISA: Ít cần PPV, giảm tử vong hoặc BPD và BPD.
Nguồn: Được chỉnh sửa từ Aldana-Aguirre JC, Pinto M, Featherstone RM, Kumar M. Less invasive surfactant administration versus intubation for surfactant delivery in preterm infants with respiratory distress syndrome: a systematic review and meta-analysis (tam dịch. Sử dụng surfactant it xâm lấn hơn so với đặt nội khí quản để cung cấp surfactant ở trẻ sinh non có hội chứng suy họ hấp. Một đánh giá tổng quan hệ thống và phân tích tong hop). Arch Dis Child Fetal Neonatal Ed 2017;102:F17-F23. |
|||||
Một thử nghiệm đối chứng ngẫu nhiên, đa trung tâm, đã quốc gia lớn ở trẻ sinh non 25–28 tuần tuổi thai, nhằm so sánh giữa việc cung cấp surfactant bằng cách sử dụng ống thông bán cứng nhỏ giọt surfactant (phương pháp Horbart) với điều trị giả hiện đang được tiến hành.
Thử nghiệm ghép đôi MIST (OPTIMIST)
- RCT đa quốc gia.
- Tuổi thai 25–28 tuần trên NCPAP/NIPPV.
- < 6 giờ tuổi, trên FiO2 > 30%.
- MIST: Curosurf 200 mg/kg liều ban đầu.
- Tiêu chuẩn đặt nội khí quản: FiO2 >45%.
- Cỡ mẫu: 606 (đang huy động).
Cần phải tiến hành các nghiên cứu sâu hơn để xác định các kỹ thuật nhỏ thuốc an toàn nhất, sử dụng thuốc an thần hoặc giảm đau, lựa chọn liều surfactant tối ưu và lựa chọn trẻ sinh non có lợi nhất.
Kỹ thuật: Chúng tôi khuyên bạn nên sử dụng kỹ thuật mINSURE, sử dụng atropine để ngăn ngừa nhịp tim chậm trong quá trình đặt ống cho ăn hoặc đặt ống thông, đồng thời sử dụng sucrose để kiểm soát cơn đau trong quá trình áp dung mINSURE.
Điều trị surfactant không xâm lấn (noninvasive surfactant treatment – NIST)
Surfactant dạng khí dung
Trọng tâm hiện tại là xác định các phương pháp “nhẹ nhàng hơn” để cung cấp surfactant, chẳng hạn như thông qua khí dung hóa (aerosolization), phun khí dung (nebulization) hoặc nguyên tử hóa (atomization). Các ưu điểm tiềm năng của việc sử dụng surfactant dạng khí dung bao gồm: Dễ sử dụng, tránh giảm oxy máu, phân bố đồng đều hơn, ít khả năng biến chứng đường thở cũng như thở máy hơn, và ít thể tích hơn. Mặc dù các nghiên cứu trên động vật đã cho thấy kết quả đẩy hứa hẹn, nhưng chỉ có rất ít nghiên cứu lâm sàng chứng minh hiệu quả của việc sử dụng surfactant dạng khí dung. Finer và cộng sự đã công bố một nghiên cứu thử nghiệm nhãn mở về hoạt chất khi dung ở trẻ sơ sinh non tháng trên CPAP để ngăn ngừa RDS ở 17 trẻ sơ sinh. Họ kết luận rằng: Surfactant dạng khi dung có thể được cung cấp một cách an toàn qua CPAP như một biện pháp thay thế cho việc sử dụng surfactant qua ống nội khí quản. Hai liệu beractant được dùng dưới dạng khí dung, sử dụng 100 mg phospholipid/kg hoặc 200 mg phospholipid/kg, hiện cũng đang được đánh giá (NCT02294630).
Liệu pháp kết hợp với surfactant
Bệnh hô hấp mãn tính (chronic respiratory morbidity – CRM) có thể được gây ra bởi sự kết hợp của tình trạng viêm dai dẳng, được kích hoạt bởi nhiễm trùng MV, cũng như oxy. Kết quả giải phóng các cytokine tiến viêm có thể dẫn đến việc sửa chữa phổi đang phát triển ở trẻ sinh non. Liệu pháp chống viêm kết hợp với surfactant có thể giúp giảm BPD, do đó làm giảm bệnh hô hấp mãn tính.
Surfactant làm phương tiện
Viêm phổi đóng một vai trò quan trọng trong cơ chế bệnh sinh của BPD, và điều trị bằng glucocorticoid dạng hít là một liệu pháp tiềm năng để ngăn ngừa BPD.
Trong một nghiên cứu thử nghiệm của Yeh, việc nhỏ budesonide trong khí quản sớm bằng cách sử dụng surfactant như một phương tiện ở 116 trẻ sơ sinh rất nhẹ cần có bằng chứng chụp X-quang cho thấy tình trạng RDS nghiêm trọng, cần phải thở máy, dẫn đến tử vong hoặc BPD ít hơn đáng kể so với trẻ trong nhóm chứng đã được sử dụng surfactant mà không có budesonide. Gần đây, các nhà điều tra đã hoàn thành một nghiên cứu đa trung tâm ngẫu nhiên về việc sử dụng surfactant với budesonide ở 265 trẻ sơ sinh rất nhẹ cân. Tỷ lệ tử vong hoặc BPD là 42% ở nhóm can thiệp, thấp hơn đáng kể so với nhóm chứng (66%), trong khi số người cần điều trị (number needed to treat – NNT) để ngăn ngừa tử vong hoặc BPD ở nhóm can thiệp là 4,1 (95% CI: 2,8–7,8, Ps 0,001) (Bảng 24,14).
Cần có nhiều nghiên cứu sử dụng kỹ thuật này hơn nữa, vì cả hai nghiên cứu trên đều có tỷ lệ BPD cao trong nhóm dân số đối chứng. Trong tương lai, việc nhỏ budesonide trong khí quản, sử dụng surfactant như một phương tiện có thể đóng một vai trò nào đó nhờ tác dụng chống viêm, giúp giảm tỷ lệ BPD ở trẻ sơ sinh cực nhẹ cân.
| Bảng 24.14 Tác dụng của budesonide trong khí quản, giúp ngăn ngừa tử vong hoặc BPD | ||||
| Surfactant + budesonide (n=131) | Chỉ surfactqant (n=134) | Nguy cơ tương đối (95% CI) | P | |
| Tử vong hoặc BPD | 42% | 66% | 0,58 (0,44-0,77) | < 0,001 (NNT = 4,1 [2,8-7,8]) |
| Budesonide nội khí quản sớm (Pulmicort] (0,25 mg/kg) + surfactant (100 mg/kg) để ngăn ngừa BPD ở trẻ có cân nặng khi sinh rất thấp, còn gọi là trẻ sơ sinh rất nhẹ cân (very low birth weight – VLBW): RCT (n = 265).
Nguồn: Được điều chính từ Yeh TF, Chen CM, Wu SY, Husan Z, Li TC, Hsieh WS và cộng sự. Intratracheal administration of budesonide/surfactant to prevent bronchopulmonary dysplasia (tạm dịch: Sử dụng budesonide/surfactant trong khi quản đề ngăn ngừa loạn sản phế quản phối). Arn J Respir Crit Care Med 2016;19386–95. |
||||
Surfactant với oxit nitric
Trong một thử nghiệm, 85 trẻ sơ sinh cực nhẹ cần được thở máy từ 7–14 ngày đã được chỉ định ngẫu nhiên để nhận tối đa 5 liều surfactant protein B của phổi (SP-B) có chứa surfactant (calfactant), cộng với thở iNO kéo dài so với chỉ dùng iNO. Tình trạng lâm sàng và sự phục hồi của SP-B từ hút khí quản được cải thiện tạm thời. Tuy nhiên, các tác dụng này giảm dần sau 1 ngày và các tác dụng có lợi cho phổi không được duy trì.
Club cell protein tại tổ hợp (rhCC-10)
Club cell protein-10 (CC-10) là một trong những protein phong phú nhất được sản xuất nội sinh bởi các tế bào biểu mô đường thở. Loại protein này đóng vai trò quan trọng trong việc điều chỉnh các phản ứng viêm, bảo vệ tính toàn vẹn cấu trúc của mô phổi, trong khi vẫn bảo tồn chức năng phổi vào những lần tổn thương khác nhau nhờ ức chế con đường NF-kB trong đường thở. Trẻ sinh non bị RDS/BPD bị thiếu CC-10. Một thử nghiệm giai đoạn II đánh giá việc sử dụng thCC-10 trong khi quản ở trẻ sinh non được điều trị surfactant đã được hoàn thành và kết quả đang chờ xử lý (NCT 01941745).
Viêm phổi: Bất hoạt surfactant cũng có liên quan đến viêm phổi. Trong một thử nghiệm ngẫu nhiên nhỏ, nhóm trẻ sơ sinh bị nhiễm trùng huyết cho thấy sự cải thiện về oxygen hóa và giảm nhu cầu ECMO. Trẻ sơ sinh bị viêm phối hoặc nhiễm trùng huyết khi dùng surfactant cũng cho thấy tình trạng trao đổi khi được cải thiện so với trẻ không được dùng surfactant.
Xuất huyết phổi: Surfactant để điều trị xuất huyết phổi đã được chứng minh là có lợi trong các nghiên cứu quan sát, vì sự hiện diện của máu trong phế nang có thể ức chế chức năng của surfactant. Trong một nghiên cứu khác, liệu pháp surfactant được phát hiện là có lợi cho bệnh xuất huyết phổi nặng, giúp cải thiện chức năng phổi và rút ngắn thời gian nhu cầu oxy cao (Bảng 24.15).
Phối giảm sản: Phổi giảm sản do thoát vị hoành bẩm sinh có thể bị thiếu hụt surfactant. Điều trị surfactant ở một loạt lớn trẻ sơ sinh bị thoát vị hoành bẩm sinh không cho thấy kết quả nào được cải thiện. Ngược lại, nhu cầu về ECMO, tỷ lệ mắc bệnh phổi mãn tính và tỷ lệ tử vong đã tăng lên khi sử dụng surfactant.
| Bảng 24.15 Nghiên cứu dùng surfactant trong xuất huyết phổi cho thấy oxygen hóa được cải thiện | ||||
| Có surfactant (n=4) | Không surfactant (n=8) | |||
| A-aDO2 | OI | A-aDO2 | OI | |
| GA (tuần) | 27 (1,4) | 27 (1,45) | NS | |
| Trọng lượng sơ sinh (g) | 903 (252) | 859 (253) | NS | |
| 0-1 giờ | 563 (122) | 37,8 (9,3) | 525 (71) | 28 (21) |
| 1-2 giờ | 465 (131) | 29 (17) | 489 (115) | 27 (15) |
| 2-4 giờ | 335 (144)* | 17 (7) | 471 (136) | 21 (15+) |
| Thời gian để đạt FiO2 < 40% (giờ) | 13 (11-16) | 41 (8-108) | ||
| Quy trình điều trị: Xit epinephrine trong khi quản (1:10.000) 0,5 mL pha loãng với 1 mL không khí; HFOV, hiệu chính của DIC; điều trị surfactant trong vòng 0,5–1,5 giờ của Nge.
Surfactant cho xuất huyết phối (VLBW, 2006–11; n = 12): Cải thiện oxygen hoa. *So với dữ liệu 0-1 giờ; P < 0,05. * So sánh hai nhóm; P = 0,05. Nguồn: Được chính sửa từ Yên TA, Wang CC, Hsieh WS, Chou HC, Chen CY, Tsao PN. Short-term outcome of pulmonary hemorrhage in very-lowbirth weight preterm infants (tarn dịch: Kết cục ngắn hạn của xuất huyết phối ở trẻ sinh non rất nhẹ cần). Pediatr Neonatol 2013;54:330-334. |
||||
Điều trị surfactant cho RDS cấp tỉnh (ARDS)
Nên sử dụng khi nào
- Có: MAS, viêm phổi, ARDS do nhiễm trùng huyết, thiếu SP-B, viêm phổi do hít, điểm ECMO có ARDS, xuất huyết phối.
- Không: Thoát vị hoành bẩm sinh.
Làm thế nào để sử dụng?
Bơm qua ống.
Sử dụng những gì?
Poractant alpha do thể tích nhỏ hơn, lượng DPPC, SP-B và plasmalogen cao hơn, cũng như độ nhớt thấp hơn.
Liều lượng:
50–100 mg/kg/liều trong mỗi 6–12 giờ.
Bổ sung oxy không ổn định trong quá trình xử tri RDS
Hiện vẫn còn nhiều tranh luận xoay quanh việc xác định mục tiêu bão hòa tối ưu cho trẻ sinh non, tránh các tác động tiêu cực của độc tính oxy như bệnh võng mạc do sinh non (retinopathy of prematurity – ROP), cân bằng với các tác động tiêu cực của tình trạng thiếu oxy dẫn đến tăng tỷ lệ tử vong hoặc kết cục bất lợi về phát triển thần kinh.
Đội ngũ cộng tác của NeOProM đã phân tích kết quả của năm thử nghiệm làm sáng ngẫu nhiên lớn, với thiết kế nghiên cứu tương tự từ các vùng khác nhau trên thế giới, nhằm mang lại tính khả thi lớn hơn trong việc phát hiện những khác biệt nhỏ nhưng quan trọng về kết quả, chẳng hạn như tỷ lệ tử vong. Tất cả các thử nghiệm này đều được thiết kế để so sánh giữa nhằm mục tiêu bão hòa trong phạm vi thấp hơn (85%–89%) và nhằm mục tiêu bảo hòa trong phạm vi cao hơn (91%-95%) với máy đo độ bão hòa oxy mù. Thủ nghiệm SUPPORT từ Hoa Kỳ cho thấy: Nhóm bão hòa thấp có ROP giảm, nhưng tỷ lệ tử vong tăng 3,7%. Khi kết hợp các dữ liệu này cùng với các thử nghiệm BOOST-II của Vương quốc Anh và Úc đã xác nhận tỷ lệ tử vong vụ mức ở nhóm có độ bão hòa thấp hơn. Do đó, việc ghi danh ở Anh và Úc/Ne Zealand đã bị dừng lại. Thử nghiệm Oxy của Canada không báo cáo bất kỳ sư khác biệt đáng kể nào về tử vong hoặc tình trạng khuyết tật thần kinh đáng kể cũng như không báo cáo bất kỳ sự khác biệt đáng kể nào về tỷ lệ ROP. Phân tích gop NeoProM (Neonatal Oxygenation Prospective Meta-analysis) xác nhận rằng: Phạm vi mục tiêu bão hòa oxy thấp hơn (85%–89%) có liên quan đến tỷ lệ tử vong gia tăng đáng kể, nhưng không có bất kỳ sự khác biệt nào giữa cả hai nhóm về tử vong hoặc khuyết tật ở 18–24 tháng. Phân tích gộp được lập kế hoạch có chủ đích về dữ liệu của từng người tham gia từ năm thử nghiệm làm sảng ngẫu nhiên lớn thu nhận trẻ sinh trước 28 tuần tuổi thai (4.965 trẻ) đã xác nhận rằng: Không có sự khác biệt đáng kể giữa phạm vi mục tiêu bão hòa oxy thấp hơn (85%–89%) được so sánh với phạm vi mục tiêu bão hòa oxy cao hơn (91%–95%), dựa trên kết cục tổng hợp chính là tử vong hoặc khuyết tật nặng ở độ tuổi đã điều chỉnh là 18–24 tháng. Khoảng mục tiêu SpO, thấp hơn có liên quan dén nguy cơ tử vong và viêm ruột hoại tử (necrotizing enterocolitis – NEC) cao hơn, nhưng nguy cơ bệnh võng mạc thấp hơn khi điều trị ROP (Bảng 24.16 và 24,17).
| Bảng 24.16 Nguy cơ tử vong hoặc khuyết tật ở đọ tuổi 18-24 tháng từ phân tích tổng hợp NeOProM | ||||
| SpO2 (thấp so với cao) | 85% – 89% | 91% – 95% | RR (95% CI) | Giá trị P |
| BOOST (thử nghiệm ở Úc) | 45% | 40% | 1,11 (0,97 – 1,27) | 0,12 |
| BOOST (thử nghiệm ở Vương quốc Anh ) | 52% | 47% | 1,10 (0,97-1,26) | 0,11 |
| BOOST (thử nghiệm ở New Zeland) | 39% | 45% | 0,88 (0,69-1,13) | 0,31 |
| COT (thử nghiệm ở Hoa Kỳ và Canada) | 52% | 50% | 1,01 (0,91-1,13) | 0,80 |
| SUPPORT (thử nghiệm ở Hoa Kỳ) | 59% | 60% | 0,99 (0,90-1,09) | 0,89 |
| Tổng thể | 51% | 49% | 1,04 (0,98-1,09) | 0,20 |
| RR, nguy cơ tương đối.
Nguồn: Được điều chính từ Askie LM, Darlow BA, Finer N, Schmidt B, Stenson B Tarnow-Mordi W và công su. Neonatal oxygenation prospective metaanalysis (NeOProM) collaboration. Association between oxygen saturation targeting and death or disability in extremely preterm infants in the neonatal oxygenation prospective meta-analysis collaboration (tạm dịch: Hợp tác phân tích tổng hợp tiềm năng oxygen hoa sơ sinh (NeOProM). Mối liên quan giữa nhằm mục tiêu độ bao hoa oxy và tử vong hoặc khuyết tật ở trẻ sơ sinh cực non tháng trong sự hợp tác phân tích tổng hợp tiền cừu oxy sơ sinh) JAMA 2018,319:2190–2201. |
||||
| Bảng 24.17 Các kết quả phụ đáng kể từ phân tích tổng hợp NeOProM | ||||
| SpO2 (thấp so với cao) | 85% – 89% | 91% – 95% | RR (95% CI) | Giá trị P |
| Tử vong khi được điều chỉnh từ 18-24 tháng | 19,9% | 17,1% | 1,17 (1,04-1,31) | 0,01 |
| ROP cần điều trị | 10,9% | 14,9% | 0,74 (0,63-0,86) | < 0,001 |
| NEC nghiêm trọng | 9,2% | 6,9% | 1,33 (1,10-1,61) | 0,003 |
| PDA được điều trị phẫu thuật | 11,4% | 9,7% | 1,18 (1,00-1,39) | 0,046 |
| Bổ sung oxy ở tuần 36 PMA | 24,9% | 30,2% | 0,81 (0,74-0,90) | < 0,001 |
| NFC, viêm ruột hoại tử, PMA, tuổi sau kỳ kinh cuối; ROP bệnh võng mạc do sinh non; RR, nguy cơ tương đối.
Nguồn: Được chỉnh sửa từ Askie LM, Darlow BA, Finer N, Schmidt B, Stenson B, Tarnow- Mordi W và cộng sự. Neonatal oxygenation prospective metaanalysis (NeOProM) collaboration. Association between oxygen saturation targeting and death or disability in extremely preterm infants in the neonatal oxygenation prospective meta-analysis collaboration (tạm dịch: Hợp tác phân tích tổng hợp tiềm năng oxygen hoa sơ sinh (NeOProM). Mối liên quan giữa nhằm mục tiêu độ bao hoa oxy và tử vong hoặc khuyết tật ở trẻ sơ sinh cực non tháng trong sự hợp tác phân tích tổng hợp tiên cứu oxy so sinh) JAMA 2018,319:2190–2201. |
||||
Phân tích tổng hợp theo dõi sau 18–24 tháng từ các thử nghiệm BOOST II, COT và SUPPORT không cho thấy bất kỳ sự khác biệt nào về tỷ lệ tử vong.
Khả năng duy trì độ bão hòa trong mục tiêu xác định trước có thể gây ra vấn đề, đặc biệt là khi độ bão hòa liên tục dao động. Nhiều trẻ sơ sinh dành nhiều thời gian ngoài phạm vi mục tiêu, với các đợt thiếu oxy và tăng oxy thường xuyên kéo dài. Cung cấp oxy được kiểm soát tự động cho thấy nhiều hứa hẹn trong việc duy trì trẻ sơ sinh trong phạm vi mục tiêu mong muốn lâu hơn so với kiểm soát thủ công. Gần đây, chúng tôi đã báo cáo kết quả từ một nghiên cứu hồi cứu lớn, với việc sử dụng nhắm mục tiêu SpO, được phân loại. Chúng tôi đã sử dụng 85%–89% trong giai đoạn I của ROP và 90%–94% trong giai đoạn II của ROP (Bảng 24.18).
| Bảng 24.18 Tỷ lệ mắc bệnh võng mạc ở trẻ sinh non với độ bão hòa oxy được phân loại | |||||
| Kết quả lâm sàng | Nhóm 1, 1995-2001 SpO2 tĩnh | Nhóm 2, 2003-10 SpO2 phân loại | OR* | 95% CI* | P* |
| Kết quả chính | n= 267 | n = 220 | |||
| ROP nặng (giai đoạn III trở lên) | 48,3% | 21,3 % | 0,18 | (0,11-0,30) | < 0,001 |
| Điều trị bằng laser | 34,9% | 19,7% | 0,31 | (0,18-0,52) | < 0,001 |
| Nhằm mục tiêu SpO2 được phân loại và ROP. * Các giá trị được điều chỉnh bằng hỏi quy logistic.
” Một trẻ sơ sinh đã được điều trị bằng Bevacizumab (Avastin). Dữ liệu từ Cayabyab R, Arora V, WerAZtheimer F, Durand M, Ramanathan R. Graded oxygen saturation targets and retinopathy of prematurity in extremely preterm infants (tạm dịch: Mục tiêu độ bão hòa oxy được phân loại và bệnh võng mạc do sinh non ở trẻ cực non tháng). Pediatr Res 2016;80401–406. |
|||||
Hướng dẫn nhắm mục tiêu SpO2 được phân loại của chúng tôi được trình bày trong Hình 24.9.

Liệu pháp caffeine
Liệu pháp caffein đã là phương pháp tiêu chuẩn ở nhiều trung tâm trong việc xử trí trẻ sinh non. Thử nghiệm Caffeine cho Ngưng thở ở trẻ sinh non (Caffeine for Apnea of Prematurity – CAP) cho thấy rằng: Caffeine có liên quan đến việc rút ống nội khí quản sớm hơn, dẫn đến giảm BPD và theo dõi sau 18 tháng cho thấy giảm thiểu năng thần kinh. Việc sử dụng caffeine sớm thay vì muộn hơn đã được ủng hộ bởi nhiều nghiên cứu, nhằm giúp cải thiện kết quả như BPD. Liêu tiêu chuẩn của caffeine citrate là liều tải 20 mg/kg, sau đó là 5–10 mg/kg duy trì hằng ngày.
Tăng CO2 cho phép
Việc dung nạp áp lực riêng phần của carbon dioxide (partial pressure of carbon dioxide – PCO,) cao hơn ở trẻ sơ sinh cực nhẹ cần được thở máy có thể làm giảm tổn thương phổi gây ra do máy thở và BPD.
Phân tích hậu kỳ dữ liệu từ thử nghiệm SUPPORT cho thấy mối liên quan giữa PaCO, cao hơn và nguy cơ tử vong, xuất huyết não thất, BPD và kết cục bất lợi về phát triển thần kinh, từ đó thấy rõ sự cần thiết phải đánh giá thêm các mục tiêu PaCO, lý tưởng (thử nghiệm SUPPORT). Thử nghiệm PHELBI đã điều chỉnh trẻ sinh non thở máy < 29 tuần tuổi và < 1.000 g trọng lượng sơ sinh đến hai mức PaCO, mục tiêu trong 14 ngày thông khí đầu tiên; nhóm cao hơn đạt khoảng 10 kPa và nhóm thấp hơn đạt khoảng 8 kPa. Nhằm mục tiêu PCO, cao hơn không làm giảm tỷ lệ BPD hoặc tử vong ở trẻ sinh non được thở máy. Tỷ lệ tử vong, xuất huyết não thất và bệnh võng mạc không khác nhau giữa các nhóm.
Steroid sau khi sinh
Các chiến lược giảm viêm phổi (lung inflammation) trong giai đoạn cấp tính của RDS có thể hạn chế thời gian sử dụng MV. Dexamethasone sau khi sinh làm giảm BPD, nhưng việc sử dụng loại thuốc này đã suy giảm đáng kể củng với mối liên quan của nó, dẫn đến tăng nguy cơ bại não. Ngược lại, BPD cũng có liên quan đến kết quả bất lợi về thần kinh, nguy cơ mắc BPD càng cao thì lợi ích tiềm năng từ việc dùng dexamethasone càng nhiều. Dexamethasone liều thấp (< 0,2 mg/kg/ngày) hiện được khuyến cáo cho những trẻ còn đặt nội khí quản, đặc biệt là sau 1–2 tuần.
Budesonide dạng hít có thể là một giải pháp thay thế khả thi cho steroid toàn thân. Một RCT lớn gần đây đã xác nhận việc sử dụng budesonide dạng hút dự phòng làm giảm cả còn ống động mạch (persistent ductus arteriosus – PDA) lån BPD.
Oxit nitric dạng hít
Các thử nghiệm làm sàng đã không cho thấy bất kỳ lợi ích nào khi oxit nitric dạng hit (inhaled nitric oxide – iNO) được sử dụng như một liệu pháp cứu hộ hoặc điều trị thưởng quy ở trẻ sinh non bị RDS, nhằm giảm tỷ lệ tử vong hoặc nguy cơ mắc BPD. Không nên sử dụng oxit nitric để điều trị trẻ sinh non bị RDS, ngoại trừ một số trường hợp hiếm gặp là tăng áp phối hoặc giảm sản
Xử trí hỗ trợ
Ngoài việc kiểm soát thông khí, trẻ sơ sinh bị RDS cũng cần được chăm sóc thiết yếu về các khía cạnh chuyển hóa, dinh dưỡng và tim mạch. Các biện pháp này giúp giảm tỷ lệ mắc bệnh bằng cách giảm lượng calo tiêu thụ cũng như nhu cầu oxy. Ngoài ra, tối ưu hóa dinh dưỡng vẫn là chia khóa thành công trong khi chăm sóc trẻ, vì không chỉ cung cấp đủ năng lượng cho nhu cầu chuyển hóa mà còn giúp tăng trưởng.
Kiểm soát nhiệt độ
Duy trì nhiệt độ cơ thể giữa 36,5 và 37,5°C trong quá trình ổn định tại phòng sinh cũng như khi nhập viện NICU đóng vai trò cực kỳ quan trọng đối với trẻ sơ sinh bị RDS. Vào thời điểm sinh non, các đơn vị chuyên về chuyển dạ và đỡ đẻ nên để nhiệt độ môi trường trên 25°C. Quá trình ổn định ban đầu của trẻ sơ sinh dưới 32 tuần nên được thực hiện bằng cách sử dụng túi polyetylen phía dưới giường sưởi bức xạ (radiant warmer). Làm ấm và làm ẩm các khí cần thiết cho quá trình ổn định cũng cho thấy khả năng có thể cải thiện được nhiệt độ. Sau khi nhập viện NICU, nên xử trí trẻ sinh non trong lồng ấp có kiểm soát bằng servo đặt ở 36,5°C với độ ẩm tương đối cao để giảm mất nước không nhận biết (insensible water loss – IWL). Đối với trẻ sinh non có làn da dạng keo (gelatinous skin), độ ẩm ban đầu là 60%–80% và giảm dần trong 2 tuần tiếp theo khi tính toàn vẹn của da được cải thiện. Nên duy trì môi trường trung hòa nhiệt cho trẻ sơ sinh trong khi duy trì nhiệt độ lõi từ 36,5 đến 37,5°C suốt thời gian trẻ ở NICU.
Xử trí dịch
Duy trì sự cân bằng dịch có thể là một thách thức, trẻ sơ sinh nhỏ nhất có thể bị mất một lượng nước rất lớn qua da non. Lượng dịch cần được điều chỉnh để duy trì ở mức cân bằng ẩm nhẹ. Lượng dịch nhập quá mức có thể góp phần làm tăng nguy cơ PDA, NEC và BPD. Nên tránh sử dụng thường quy thuốc lợi tiểu (đặc biệt là furosemide) ở trẻ sinh non bị RDS do không có lợi ích. Thông thường, sử dụng thuốc lợi tiểu dẫn đến bất thường điện giải, đặc biệt là hạ natri máu và hạ kali máu, do mất natri và kali qua nước tiểu, cũng như giảm cho máu có thể làm tăng bicarbonat và carbon dioxide, đòi hỏi phải sử dụng các cài đặt máy thở cao hơn.
Dinh dưỡng
Nên bắt đầu dinh dưỡng qua đường tĩnh mạch ngay sau khi trẻ nhập viện NICU. Sự bắt đầu sớm của các axit amin giúp cân bằng nitơ dương, giảm thời gian lấy lại trọng lượng sơ sinh, dẫn đến tăng cân khi xuất viện. Nên bắt đầu dinh dưỡng đường ruột tối thiểu bằng sữa mẹ càng sớm càng tốt. Sữa mẹ là lựa chọn ưu tiên để bắt đầu cho ăn; tuy nhiên, nếu không có sẵn, thì sữa mẹ của người hiến tặng đã được chứng minh là tốt hơn so với sữa công thức, vì sữa mẹ đã được chứng minh là làm giảm nguy cơ NEC.
Sử dụng thuốc kháng sinh
Trước đây, sử dụng thuốc kháng sinh từng được coi là phương pháp thực hành hiệu quả khi sàng lọc trẻ sơ sinh bị suy hô hấp sớm để tìm nhiễm trùng cũng như nhiễm trùng do mẹ có thể dẫn đến sinh non. Tuy nhiên, việc sử dụng kháng sinh thường quy mà không có bất kỳ bằng chứng nào cho thấy sự hiện diện của nhiễm trùng có thể gây hại, do đó không được khuyến khích. Nên ngừng dùng kháng sinh khi có kết quả cấy máu âm tính trong vòng 36–48 giờ, cùng với đó là kiểm tra lại công thức máu và đo protein phản ứng C (C-reactive protein – CRP). Không phải là không có lý khi tránh dùng kháng sinh thường
quy ở trẻ sinh non bị RDS trong các tỉnh huống nguy cơ thấp, chẳng hạn như sinh theo chương trình bằng phương pháp mổ lấy thai chọn lọc do các chỉ định của người mẹ.
Xử trí tim mạch
Ở trẻ sinh non, huyết áp thấp hơn trong vài giờ đầu sau sinh và tăng dần trong 24 giờ đầu sau sinh. Huyết áp thay đổi theo tuổi thai cũng như theo thời gian (Bảng 24.19). Tụt huyết áp ở trẻ bị RDS có thể bắt nguồn từ việc giảm thể tích tuần hoàn, shunt lớn từ trái sang phải của ống động mạch, hoặc rối loạn chức năng cơ tim. Có thể giảm thiểu tình trạng giảm thể tích tuần hoàn bằng cách trì hoãn việc kẹp dây rốn. Dopamine đã được chứng minh là có hiệu quả hơn dobutamine trong việc làm tăng huyết áp và cũng có thể cải thiện lưu lượng máu não ở trẻ bị hạ huyết áp. Epinephrine và hydrocortisone thường được chỉ định trong hạ huyết áp kháng trị, trong trường hợp dopamine và dobutamine không thể tối ưu hóa huyết áp cũng như tưới máu toàn thân.
| Bảng 24.19 Toán đồ giá trị huyết áp trung bình ở trẻ sơ sinh trong 3 ngày đầu sau sinh phụ thuộc vào tuổi thai và tuổi sau sinh | |||||||
| Tuổi thai | Lúc sinh | 12 giờ tuổi | 24 giờ tuổi | 36 giờ tuổi | 48 giờ tuổi | 60 giờ tuổi | 72 giờ tuổi |
| 23-26 | 23 | 24 | 25 | 26 | 28 | 29 | 30 |
| 27-32 | 29 | 30 | 32 | 33 | 34 | 35 | 36 |
| 33-36 | 35 | 36 | 37 | 38 | 40 | 41 | 43 |
| 37-43 | 43 | 44 | 45 | 46 | 47 | 49 | 50 |
| Nguồn: Phỏng theo Nuntnarumit P., Yang W, Bada-Ellzey HS. Blood pressure measurements in the newborn (tạm dịch: Đo huyết áp ở trẻ so sinh). Clin Perinatol 1999,26:981-996. | |||||||
PDA ở trẻ rất non tháng bị RDS có thể gây ra huyết áp thấp, giảm tưới máu mô hệ thống, phù phổi và khó cai máy thở. Sự dung nạp cho phép của PDA ở trẻ không cho thấy tính bất ổn về mặt huyết động là một chiến lược có thể chấp nhận được, miễn sao trẻ phát triển, dung nạp với việc bú mẹ và cần hỗ trợ hô hấp tối thiểu. Các chất ức chế cyclooxygenase như indomethacin hoặc ibuprofen thường có tác dụng đóng ống động mạch. Phẫu thuật thắt PDA có liên quan đến kết quả phát triển thần kinh lâu dài và tệ hơn. Chỉ nên xem xét phẫu thuật sau khi liệu pháp nội khoa thất bại. Gần đây hơn, paracetamol đã được chứng minh là có tác dụng thúc đẩy quá trình đóng ống động mạch, mặc dù cần có nhiều thử nghiệm hơn, đi kèm với thời gian theo dõi lâu dài, trước khi khuyến cáo sử dụng paracetamol thường quy.
Các biến chứng của RDS
Với sự tiến bộ của các liệu pháp điều trị, bao gồm thuốc điều trị trước sinh và sử dụng surfactant, phần lớn biến chứng của RDS (Bảng 24.20) đã được giảm bớt. Các biến chứng có thể liên quan đến tiến triển tự nhiên của bệnh, hoặc do các can thiệp điều trị, chẳng hạn như: Đặt ống thông động mạch, bổ sung oxy, thông khí áp lực dương và sử dụng ống nội khí quản.
Biến chứng ống nội khí quản
Các biến cố bất lợi liên quan đến đặt nội khí quản có thể cao tới 40% ở NICU. Đôi khi có thể xảy ra tình trạng dịch chuyển ống, hoặc đặt ống nội khí quản sai vị trí. Đặt ống nội khí quản vào phế quản gốc bên phải là biến chứng thường gặp nhất, dẫn đến siêu bơm phồng phổi (hyperinflation) của phổi được thông khí, trong khi xẹp phổi xảy ra ở phổi bên đối diện. Siêu bơm phồng phổi có thể góp phần làm rò rỉ khí. Các biến chứng khác liên quan đến đặt nội khí quản bao gồm: Hẹp dưới thanh môn (subglottic stenosis) và xẹp phổi sau khi rút nội khí quản. Thủng thực quản và thủng vùng hầu họng hiếm khi xảy ra, đặc biệt là với nhân sự thiếu kinh nghiệm hoặc trẻ sơ sinh cực kỳ mỏng manh, yếu ớt.
| Bảng 24.20 Các biến chứng của RDS | ||
| Biến chứng | Chẩn đoán | Xử trí |
| Các biến chứng liên quan đến ống nội khí quản | ||
| Xẹp phổi và siêu bơm phồng | X-quang để xác nhận vị trí ống | Điều chỉnh ống |
| Hẹp dưới thanh môn | Nội soi thanh quản | Tốt nhất nên tránh bằng cách giới hạn thời gian đặt nội khí quản |
| Rò rỉ khí phổi | Xem chương 13b – “Hội chứng rò rỉ khí phổi” (tên chương gốc: “Pulmonary air leaks”) trong ấn bản gốc của cuốn sách này | |
| Tràn khí màng phổi | Xác nhân bằng X-quang | Xử trí hỗ trợ, chọc hút bằng kim hoặc đặt ống dẫn lưu ngực |
| Tràn khí trung thất | Xác nhân bằng X-quang | Xử trí hỗ trợ |
| Khí phế thũng mô kẽ phổi | Xác nhân bằng X-quang | Thông khí tần số cao được ưu tiên hơn so với thông khí thông thường
Áp lực đường thở trung bình thấp |
| Rò phế quản màng phổi | Xác nhân bằng X-quang và sủi bọt của ống dẫn lưu liên sườn | Xử trí hỗ trợ (xem phần “Xử trí thông khí các biến chứng của RDS”) |
| Loạn sản phế quản phổi | Nhu cầu oxy ở 36 tuần tuổi thai được điều chỉnh | Xem chương 27 – “Loạn sản phế quản phổi” trong cuốn sách này |
Rò rỉ khí phổi
Rò rỉ khí phổi (pulmonary air leak) là biến chứng cấp tính thường gặp của RDS, với tỷ lệ được báo cáo là khoảng 6,3% ở trẻ nhẹ cân. Rò rỉ khí bắt nguồn tử việc vỡ các phế nang quá căng và có thể xảy ra tự phát hoặc do áp lực dương nhận được khi thở máy. Không khí có thể bóc tách về phía rốn phổi, dẫn đến tràn khí trung thất hoặc vào khoang màng phổi, gây tràn khí màng phổi. Ít phổ biến hơn, không khí có thể xâm nhập vào khoang màng tim, mô dưới dạ hoặc khoang phúc mạc, từ đó có thể dẫn đến các tình trạng tương ứng là trận khi màng tim, khí phế thũng dưới da và tràn khí màng bụng. Ở trẻ sinh non, mộ liên kết quanh mạch máu phong phú hơn và giãn nở hơn, cho phép bẫy khi trong khoảng quanh mạch máu, từ đó có thể dẫn đến PIE.
Tràn khí màng phổi có thể xảy ra một cách tự phát, thứ phát sau thông khí hỗ trợ với áp lực cao, đặc biệt ở trẻ có tuổi thai sớm hoặc khi có sự thay đổi về độ giãn nở sau khi dùng surfactant ở bệnh nhân bị RDS. Trẻ sơ sinh bị PIE đang tiến triển có nguy cơ bổ sung. Tràn khí màng phối tự phát có thể xảy ra trong vải nhịp thở đầu tiên và có thể xuất hiện kèm theo thở nhanh, thở rên và rút lõm ngực, rất khó để phân biệt với RDS. Tràn khí màng phổi ở bệnh nhận đã được hỗ trợ thông khi biểu hiện rõ hơn với tình trạng suy giảm cấp tỉnh các dấu hiệu sinh tồn, cụ thể là thiếu oxy, tăng CO, máu cùng với nhịp tim tăng và giảm huyết áp đột ngột. Nên nghi ngờ tràn khí màng phổi ở bệnh nhân sau khi dùng surfactant, nếu xảy ra tình trạng suy giảm đột ngột thay vì cải thiện oxygen hóa.
Rò phế quản phổi là đường thông giữa cây phế quản và khoang màng phổi. Về mặt lâm sàng, nó có thể được hình thành như một sự rò rỉ khí dai dẳng hoặc không thể tái bơm phồng phổi mặc dù đã dẫn lưu ngực trong 24 giờ. Các vấn để chính của lỗ rò lớn ở bệnh nhân thở máy gồm có: Không thể cung cấp thể tích khí lưu thông cố định, không thể áp dụng PEEP đã đặt, xẹp phổi dai dẳng, và cai máy thở muộn.
Xử trí máy thở ở bệnh nhân RDS
Hỗ trợ hô hấp không xâm lấn
Thông khí không xâm lấn (non-invasive ventilation – NIV) được coi là phương pháp ưu tiên để hỗ trợ trẻ sinh non bị RDS, bao gồm CPAP, thông khí áp lực đường ngắt quãng qua môi (nasal intermittent positive pressure ventilation . NIPPV), và cung cấp oxy âm bằng ống thông mũi lưu lượng cao ( HF). Trước đây, các phương pháp không xâm lấn được sử dụng như một bước giảm bớt thông khi qua ống nội khí quản, và ban đầu CPAP là phương pháp duy nhất được sử dụng. Các nghiên cứu sâu hơn cho thấy rằng: Nên bắt đầu CPAP từ phòng sinh thay vì đặt nội khi quan thường quy, nhằm ổn định hoặc sử dụng surfactant dự phòng tốt hơn để giảm thiếu tổn thương phối.
NIPPV cũng được sử dụng như một biện pháp hỗ trợ hô hấp chính ở nhiều trung tâm, với máy thở thông thường được sử dụng để cung cấp áp qua ngành mũi lực hít vào đỉnh (PIP), có hoặc không đồng bộ, nhưng thông NIPPV đã cho thấy làm giảm thất bại khi rút nội khí quản, nhưng không đem lại lợi ích nhất quán trong việc giảm BPD. Các nghiên cứu cho thấy NIPPV thành công nhất đã sử dụng đồng bộ hóa áp lực hít vào thông qua tín hiệu từ viên nang Graseby ở bụng. Các máy thở này không được phổ biến rộng rãi, đồng thời việc cung cấp đồng bộ hóa hiệu quả bằng cách sử dụng cảm biến lưu lượng là một thách thức, do rò rỉ lớn trong quá trình CPAP và không rõ liệu NIPPV không đồng bộ có hiệu quả hay không.
Việc sử dụng HF được làm ẩm và ấm thay thế cho CPAP đã ngày càng phổ biến. Một phân tích tổng hợp gần đây của 15 nghiên cứu so sánh HF với các phương thức hỗ trợ hỗ hấp không xâm lấn khác cho thấy: Tỷ lệ hiệu quả tương tự như các hình thức hỗ trợ hỗ hấp không xâm lấn khác ở trẻ sinh non giúp ngăn ngừa thất bại điều trị, tử vong và bệnh phổi mãn tính (chronic lung disease – CLD). Sau khi rút nội khí quản, HF ít liên quan đến chấn thương mũi hơn và có thể làm giảm tràn khí màng phổi so với CPAP qua mũi. Một cơ chế tiềm ẩn có thể là sự rửa trôi carbon dioxide khỏi khoang mũi họng; tuy nhiên, với lưu lượng cao hơn, trẻ sơ sinh có thể nhận được CPAP bổ sung. Lưu lượng 4–8 L/phút thường được sử dụng, với việc cai lưu lượng được xác định trên lâm sàng bằng mức FiO2 duy trì ở mức thấp và công thở. HF được sử dụng làm phương thức hỗ trợ hô hấp chính trong phòng sinh trong một nghiên cứu nhỏ cho thấy tính khả thi. Tuy nhiên, trong một thử nghiệm lâm sàng đa trung tâm lớn, khi HF được sử dụng như một phương thức hỗ trợ chính cho trẻ sinh non bị suy hô hấp, đã dẫn đến tỷ lệ thất bại điều trị cao hơn đáng kể so với CPAP (25,5% so với 13,3%). Cần có thêm bằng chứng để đánh giá tính an toàn và hiệu quả của HF ở các phân nhóm trẻ sơ sinh cực non tháng và nhẹ cân, cũng như để so sánh các thiết bị HF khác nhau.
Các cài đặt thở lưu lượng cao qua mũi, CPAP và NIPPV được đề xuất bên dưới (Bảng 24.21 và 24.22).
| Bảng 24.21 Cài đặp áp lwucj đường thở dương liên tục (CPAP) và ống thông mũi lưu lượng cao (HFNC) cho RDS | |||||
| Cài đặt | Bắt đầu | Tăng | Tối đa | Giảm bớt | Tối thiểu |
| CPAP PEEP | 5 cm H2O | FiO2 > 30% hoặc có dấu hiệu suy hô hấp | 7 cm H2O | FiO2 21% | 4 cm H2O |
| Lưu lượng cao | 4-6 L/phút | FiO2 > 30% hoặc có dấu hiệu suy hô hấp | 8 L/phút | FiO2 21% | |
| FiO2 | 21% | Độ bão hòa trước ống < 85% | 40% | Độ bão hòa trước ống > 90% | 21% |
| Nhiệt độ | 34-37ºC | ||||
| Độ ẩm | Độ ẩm tương đối 100% | ||||
| CPAP, áp lực đường thỏ dương liên tục; FiO2 nồng độ oxy trong khi hít vào; PaO, áp lực riêng phản của oxy trong máu động mạch; PEEP, áp lực dương cuối thì thở ra | |||||
| Bảng 24.22 Cài đặt thông khí áp lực dương không xâm lấn, không đồng bộ cho RDS | |||||
| Cài đặt | Bắt đầu | Tăng | Tối đa | Giảm bớt | Tối thiểu |
| PEEP (cm H2O) | 5 | FiO2 > 30% hoặc có dấu hiệu suy hô hấp | 7 | FiO2 21% | 4 |
| PIP (cm H2O) | 20 | PCO2 > 55 mmHg | 30-35 | PCO2 < 45 mmHg | 10 |
| Tần số (nhịp thở/phút) | 40 | PCO2 > 55 mmHg | 50 | PCO2 <45 mmHg chỉ sau khi PIP = 10 cm H2O | 0 (CPAP) |
| Thời gian hít vào (giây) | 0,5 | Nếu cần để tăng số lần thở được hỗ trợ | 1 | Khi đã ổn định, trước khi cai tần số | 0,5 |
| FiO2 | 21% | Độ bão hòa trước ống < 85% | 50% (tạm thời)
Nói chung phải < 40% |
Độ bão hòa trước ống > 90% | 21% |
| Nhiệt độ | 34-37°C | ||||
| Độ ẩm | Độ ẩm tương đối 100% | ||||
| FiO2′ nồng độ oxy trong khi hút vào; PaO, áp lực riêng phần của oxy trong máu động mạch; PCO2′ áp lực riêng phân của carbon dioxide; PEEP áp lực dương cuối thì thở ra; PIP, áp lực hút vào đỉnh; iTime, thời gian hit vào. | |||||
Các chiến lược thông khí cơ học
Khoảng một nửa số trẻ cực non tháng bị RDS sẽ không dung nạp với NIV và cần được đặt nội khí quản. Mục tiêu của thở máy là cung cấp các giá trị khi máu hợp lý mà không gây nguy cơ tổn thương phổi hoặc giảm CO, máu. Nguyên tắc của thở máy là cung cấp đường thở ổn định, huy động phổi bằng cách bơm phong phổi và tối ưu hóa thể tích phổi. Siêu bơm phồng phổi làm tăng nguy cơ rò rỉ khi, bao gồm tràn khí màng phổi và PIE. Mặt khác, áp lực tháp hơn dẫn đến xẹp phổi khi thở ra.
Thông khí giới hạn áp lực, chu kỳ lưu lượng và thông khi mục tiêu thể tích là những phương thức phổ biến nhất được sử dụng. Thông khí giới hạn áp lực không có bất kỳ sự kiểm soát nào đối với thể tích được tạo ra và có khả năng dẫn đến quá mức thể tích, đặc biệt là khi độ giãn nở thay đổi sau khi sử dụng surfactant. Thể tích khí lưu thông cao quá mức có thể làm tổn thương phổi do chấn thương thể tích và cũng có thể gây giảm CO, máu, có thể dẫn đến tổn thương não như nhuyễn hóa chất trắng quanh não thất hoặc xuất huyết não thất. Ngược lại, thể tích khí lưu thông thấp gây ra sự phân bố không đồng đều, làm tăng công thở, kích thích trẻ sơ sinh dẫn đến giảm thông khí và tăng CO, máu. Chế độ mục tiêu thể tích có thể cho phép các bác sĩ thông khí với thể tích khí lưu thông được kiểm soát, đồng thời giảm áp lực khi độ giãn nở của phổi được cải thiện. Khi so sánh với thông khi theo chu kỳ áp lực, thông khí mục tiêu thể tích có thể làm giảm BPD hoặc tử vong và xuất huyết não thất, cũng như giảm thời gian thở máy.
Các cài đặt thông khí thông thường được thể hiện rõ trong Bảng 24.23.
| Bảng 24.23 Cài đặt thông khí áp lực dương xâm lấn cho RDS | |||||
| Cài đặt | Bắt đầu | Tăng | Tối đa | Giảm bớt | Tối thiểu |
| PEEP (cm H2O) | 5 | FiO2 > 30%, hoặc có dấu hiệu suy hô hấp | 7 | FiO2 21% | 4 |
| PIP (cm H2O | 16 | PCO2 > 55 mmHg | 24-26 | PCO2 < 45 mmHg | 10 |
| Tần số (nhịp thở/phút) | 30 | PCO2 > 55 mmHg | 40-45 | PCO2 < 45 mmHg chỉ sau khi PIP -= 10cm H2O | 10-15 |
| Thời gian hít vào (giây) | 0,3 | Nếu cần để tăng số lần thở được hỗ trợ | 0,4 | Khi đã ổn định, trước khi cai tần số | 0,3 |
| FiO2 | 21% | Độ bão hòa trước ống < 85% | 50% (tạm thời)
Nói chung phải < 40% |
Độ bão hòa trước ống > 90% | 21% |
| Nhiệt độ | 34-37°C | ||||
| Độ ẩm | 100% độ ẩm tương đối | ||||
| FiO2′, nồng độ oxy trong khi hít vào; PaO2′ áp lực riêng phần của oxy trong máu động mạch; PCO2′ áp lực riêng phần của carbon dioxide; PEEP, áp lực dương cuối thì thở ra; PIP, áp lực hít vào đỉnh. | |||||
Khi cần có áp lực cao để đạt được mức độ bơm phóng phổi đây đủ, thông Khi dao động tần số cao (high-frequency oscillatory ventilation – HFOV) là một lựa chọn thay thế ưu tiên cho MV. HFOV cho phép trao đổi khi ở thể tích khi lưu thông rất thấp được cung cấp với tần số rất nhanh, trong khi phối được giữ mở ở mức bơm phóng phối tối ưu bởi áp lực căng liên tục. Một phân tích tổng hợp cập nhật gần đây về RCT khi so sánh HFOV với cách điều trị thông thường đã chỉ ra rằng: Sử dụng HFOV chọn lọc so với thở máy thông thường dẫn đến giảm nhẹ nguy cơ mắc BPD; tuy nhiên, bằng chứng đã bị suy yếu do tác dụng này không nhất quán giữa các thử nghiệm. Ngoài ra, lợi ích có thể bị phản tác dụng do tăng nguy cơ rò rỉ khi cấp tính. Các tác động bất lợi lên kết quả thần kinh ngắn hạn đã được quan sát thấy trong một số nghiên cứu, nhưng những tác động này không đạt được ý nghĩa tổng thể. Hầu hết các thử nghiệm báo cáo kết quả dài hạn không xác định được bất kỳ sự khác biệt nào.
Chúng tôi nhận thấy HFOV tốt hơn trong những trường hợp RDS nặng hơn, trong đó nguy cơ biến chứng cao. Các cài đặt cho HFOV có thể được liệt kẻ ở Bảng 24.24.
Trẻ sơ sinh không đáp ứng với HFOV, hoặc những trẻ dễ bị các biến chứng như rỏ rỉ khí hoặc PIE, có thể được xử trí hiệu quả bảng thông khi phản lực tấn số cao (high-frequency jet ventilator – HFJV). Thông khí phản lực tạo ra một số lợi thế về lý thuyết, bao gồm thời gian thở ra cao hơn, nhịp thở sâu bổ sung và tần số thấp hơn so với HFOV. Bảng 24.25 minh họa các cài đặt cho HFJV trong xử trí trẻ sơ sinh bị RDS.
Trong thời gian thở máy, nên tránh giảm CO, máu cũng như tăng CO, máu vì chúng có liên quan đến việc tăng nguy cơ mắc BPD, nhuyễn hóa chất trắng quanh não thất và xuất huyết não thất; ngoài ra, đánh giá CO, liên tục có thể hữu ích, đặc biệt là trong vài ngày đầu thông khí. Nên bắt đầu cai máy thở ngay sau khi trao đổi khí hiệu quả và cải thiện độ giãn nở. Chế độ mục tiêu thể tích sẽ tốt hơn, vì cai máy thở tự động được thực hiện bằng cách giảm áp lực hít vào đỉnh cùng với sự cải thiện về độ giãn nở. Trẻ sơ sinh bị RDS cải thiện nhanh chóng sau khi dùng surfactant và có thể được rút nội khí quản chuyển sang chế độ không xâm lấn. Rút nội khí quản chuyển sang mức áp lực CPAP tương đối cao hơn có thể cải thiện cơ hội cai máy thở thành công.
| Bảng 24.24 Cài đặt thông khí dao động tần số cao (HFOV) cho RDS | |||||
| Cài đặt | Bắt đầu | Tăng | Tối đa | Giảm bớt | Tối thiểu |
| MAP (P) (cm H2O) | 10-12 hoặc > 2 MAP trên máy thở thông thường | Giảm oxy máu (độ bão hòa trước ống < 85% và/hoặc thể tích phổi thấp (mở rộng phổi < xương sườn 8) | Khi cần thiết để đạt được mở rộng phổi đến xương sườn 10 | Mở rộng quá mức (mở rộng phổi > xương sườn 10), hoặc FiO2 < 30% | 9 |
| Biên độ (rP) (cm H2O) | 25 (điều chỉnh để có được rung lồng ngực) | PCO2 > 55 mmHg | 40-45 | PCO2 < 45 mmHg | 12 |
| Tần số (Hz) | 12-15 | PCO2 < 45 mmHg (sau khi điều chỉnh biên độ) | 15 | PCO2 > 55 mmHg (sau khi điều chỉnh biên độ) | 6-8 |
| % thời gian hít vào | 33 | Các thay đổi thường không cần thiết | |||
| Lưu lượng nền (L/phút) | 15 | Nếu không thể duy trì MAP mong muốn | 20 | 15 | |
| FiO2 nồng độ oxy trong khi hít vào; MAP (P), áp lực đường thở trung bình; PCO2 áp lực riêng phần của carbon dioxide; PIP, áp lực hít vào đỉnh. | |||||
Trong thời gian thở máy, nên tránh giảm CO, máu cũng như tăng CO, máu vì chúng có liên quan đến việc tăng nguy cơ mắc BPD, nhuyễn hóa chất trắng quanh não thất và xuất huyết não thất; ngoài ra, đánh giá CO, liên tục có thể hữu ích, đặc biệt là trong vài ngày đầu thông khí. Nên bắt đầu cai máy thở ngay sau khi trao đổi khí hiệu quả và cải thiện độ giãn nở. Chế độ mục tiêu thế tích sẽ tốt hơn, vì cai máy thở tự động được thực hiện bằng cách giảm áp lực hít vào đỉnh cùng với sự cải thiện về độ giãn nở. Trẻ sơ sinh bị RDS cải thiện nhanh chóng sau khi dùng surfactant và có thể được rút nội khí quản chuyển sang chế độ không xâm lấn. Rút nội khí quản chuyển sang mức áp lực CPAP tương đối cao hơn có thể cải thiện cơ hội cai máy thở thành công.
| Bảng 24.25 Cài đặt máy thở phản lực tần số cao cho RDS | |||||
| Cài đặt | Bắt đầu | Tăng | Tối đa | Giảm bớt | Tối thiểu |
| PEEP (cm H2O) | 7-12 hoặc MAP máy thở thông thường, hoặc < 1-2 so với MAP của HFPV | Giảm oxy máu (độ bão hòa trước ống < 85%), ngay cả khi tăng mở rộng phổi hoặc duy trì MAP khi cai PIP | Khi cần thiết để đạt được mục tiêu mở rộng phổi và độ bão hòa | Nếu cung lượng tim bị suy giảm (tức bóng tim nhỏ, giảm cung lượng tim), hoặc nếu oxygen hóa ổn định với FiO2 < 30% | 6 |
| PIP phản lực (cm H2O) | 20 hoặc < 1-2 PIP thông thường | PCO2 > 55 mmHg | 40-45 | PCO2 < 45 mmHg | 16 |
| Tần số phản lực (nhịp thở/phút) | 360 | Đề giảm mức PCO2 | 420 | PEEP đo được > 2 cm H2O so với PEEP cài đặt, hoặc PCO2 > 55 mmHg (sau khi điều chỉnh PIP) hoặc bẫy khí/ thay đổi PIE | 240 |
| Thời gian hít vào phản lực (giây) | 0,02 | Các thay đổi nói chung là không cần thiết. Có thể tăng lên 0,024 nếu PIP = 40 cm H2O và PCO2 > 55 mmHg | |||
| PIP dự phòng (cm H2O) | Đủ cho ngực nâng lên | Để ngăn ngừa xẹp phổi | 1 < PIP phản lực | Giảm thiểu để ngăn ngừa chấn thương phổi | |
| Tần số dự phòng (nhịp/thở/phút) | 0-2 | Để ngăn ngừa xẹp phổi
Không có tỷ lệ dự phòng cho trẻ sơ sinh bị rò rỉ khí |
5 | Sau khi đạt được PEEP tối ưu | 0 |
| Thời gian hít vào dự phòng (giây) | 0,4 | Các thay đổi thường không cần thiết | |||
| HFOV, máy thở dao động tần số cao; MAP, áp lực đường thờ trung bình; PaO2 áp lực riêng phần của oxy trong máu động mạch; PCO2 áp lục riêng phần của carbon dioxide; PEEP, áp lực dương cuối thì thở ra; PIP áp lực hít vào đỉnh; iTime, thời gian hít vào. | |||||
Xử trí thông khí các biến chứng của RDS
Xử trí tràn khí màng phổi dựa trên nguyên nhân và mức độ bệnh. Hầu hết các trường hợp tràn khí màng phổi đều là tự giải quyết, đồng thời cần được kiểm soát chỉ bằng cách điều chỉnh sự hỗ trợ của máy móc và theo dõi cẩn thận. Ở trẻ sơ sinh được hỗ trợ thở máy thông thường hoặc không xâm lấn, chúng tôi có xu hướng giữ PIP càng thấp càng tốt để giữ thể tích khí lưu thông vào khoảng 15 mL/kg, giảm thời gian hút vào (0,3 giây) và tăng tần số máy thở trong khi văn duy trì cùng một phương thức hỗ trợ hô hấp. Nhìn chung, pH được duy trì a muc 7,25–7,3 và tăng CO2 cho phép với PCO2 từ 50 đến 60 được ưu tiên áp dụng, nhằm giảm thiểu tổn thương thêm cho phối. Tràn khí màng phổi có áp lực (tension pneumothorax) đòi hỏi phải chọc hút bằng kim, sau đó đặt ống dẫn lưu ngực để dẫn lưu khi. Tràn khí màng phổi dai dẳng, hoặc suy giảm hô hấp đột ngột dẫn đến thiếu oxy hoặc tăng CO2 máu, được xử trí tốt nhất bằng thông khi tần số cao. Không có PIP cao, thời gian hit vào tuyệt đối rất ngắn và thể tích khi lưu thông nhỏ do HFV tạo ra là những yếu tố chính hỗ trợ cho sự hồi phục.
Chỉ định cho HFOV:
PIP cao (> 24 ở trẻ non tháng và > 26 ở trẻ đủ tháng).
MAP > 11 đến 12 trên máy thở thông thường.
FiO2 > 50% và tăng với máy thở thông thường để phối giãn nở đầy đủ.
Rò rỉ khí liên tục hoặc tái phát.
PIE tệ hơn.
Cài đặt HFOV bắt đầu được đề xuất là MAP giống hoặc thấp hơn một chút so với máy thở thông thường, khoảng 8–9 cm H,O, tần số hô hấp 12–15 Hz với biên độ (amplitude – Amp) đủ để rung ngực. Thông số cài đặt được tăng dần nếu không cải thiện. Trẻ sơ sinh thường được duy trì áp dụng HFOV cho đến khi hồi phục hoàn toàn tràn khí màng phổi và thường được rút nội khí quản trực tiếp để hỗ trợ không xâm lấn.
Trẻ sơ sinh bị PIE được xử trí một cách thận trọng. Đặc điểm chính của những trẻ này là cực kỳ non tháng và đã được nhận hỗ trợ thông khí cao, Thông thường, những trẻ này yêu cầu chuyển thông khi sang HFOV hoặc HFIV. Áp lực đỉnh thấp hơn do máy thở tần số cao cung cấp giúp giảm rõ rỉ khi trong khi chưa lành các đường thở ở xa. Trẻ nhỏ hơn có thể yêu cầu biên độ (amplitude) cao hơn khi trao đổi khí, cũng như xẹp đường thời thấp hơn làm trầm trọng thêm tình trạng bẫy khí. MAP giống như máy thủ thông thường được ưa thích hơn, nhưng không phải lúc nào cũng có thể thực hiện được do phổi không trưởng thành. Chúng tôi có xu hướng xử trí những trẻ này bằng cách thường xuyên điều chỉnh biên độ để xử trí PCO, trong khi đó vẫn giữ nguyên tấn số (12–15 Hz). Đôi khi, có thể cần thay đổi tần số thành 8–10 Hz thay vì tăng MAP, nếu quá trình oxygen hóa không được tối ưu hóa.
Chúng tôi thường sử dụng thông khí phản lực tấn số cao để xử trí những trẻ không đáp ứng với HFOV. Chế độ này giúp tăng cường thông khí ở áp lực đình và áp lực đường thở trung bình thấp hơn, trong khi vẫn giữ cho thời gian hít vào không đối với PIE phục hồi nhanh hơn. Thông thường, MAP trên HFJV được giữ nguyên như phương thức trước đó và PIP được hạ thấp nhất có thể để cung cấp vừa đủ delta P (PIP – PEEP) cho sự thanh thải CO, Tần số bắt đầu điển hình được sử dụng là 360 lần/phút, có thể phải điều chỉnh tùy thuộc vào PCO, và bơm phóng phổi trong khi vẫn giữ thời gian hít vào ở mức 0,02 giây. Người ta có thể phải giảm tần số xuống 240 lần/phút để giảm thiểu bẫy khí. Độ pH mục tiêu là từ 7,25 đến 7,3, nhưng hiếm khi chúng tôi đưa mục tiêu xuống 7,20 nếu tình trạng của trẻ sơ sinh nguy kịch. Tăng CO, máu cho phép được ưu tiên hơn, với các giá trị PCO, chủ yếu từ 55 đến 65. Trong thời gian ngắn, có thể phải chấp nhận với nhu cầu FiO, tăng lên (0,5–0,75) để chữa lành PIE nặng, trong khi vẫn giữ PIP và PEEP thấp. Không nên đặt nhịp thở sâu (sigh) để xử trí trẻ sơ sinh bị rò rỉ khí. PIE khu trú được xử trí bằng cách đặt trẻ sơ sinh nằm nghiêng bên bị ảnh hưởng, nhằm giảm thiểu thông khí phổi sang bên đó. Những trường hợp nặng có thể phải đặt nội khí quản vào phế quản có chọn lọc.
Các chiến lược xử trí đối với lỗ rò phế quản-màng phổi chủ yếu bao gồm các biện pháp bảo tồn như đặt một hoặc nhiều ông dẫn lưu ngực lớn. Ở bệnh nhãn thở máy, mục đích là để duy trì thông khí và oxygen hóa đầy đủ, đồng thời giảm thiểu lưu lượng của lỗ rò để phổi lành lại. Điều này có thể bao gồm các chiến lược kết hợp để giảm PTP, thể tích khi lưu thông, tần số hô hấp, PEEP và thời gian hit vào, đồng thời chấp nhận tình trạng tăng CO, và giảm độ bão hòa oxy cho phép. Hầu hết các rò rỉ khí sẽ tự khỏi trong vài ngày, nếu bệnh nhân có thể được cai máy thở bằng phương pháp hô hấp tự nhiên mà không cán hỗ trợ hô hấp cao. Các vết rách hoặc vết thủng nhỏ thường mau lành, trong khi tổn thương cấu trúc lớn hơn ở phổi hoặc phế quản lớn sẽ không lành với điều trị bảo tồn, đặc biệt nếu cần áp lực cao để trao đổi khí đầy đủ. Có thể cần sử dụng HFV và thông khí phổi khác biệt qua ống nội khí quản hai nòng (double-lumen). Đối với rò rỉ gần, nội soi phế quản sợi quang và áp dụng trực tiếp chất bịt kín đã được nỗ lực triển khai, đem lại một số thành công. Các trường hợp kháng trị có thể cần phải được phẫu thuật sửa chữa băng phẫu thuật tạo hình lồng ngực, cắt/kẹp phổi, chà nhám/bóc tách màng phổi, hoặc các kỹ thuật khác.
Tổng kết và khuyến nghị
- RDS là một trong những chẩn đoán phổ biến nhất ở trẻ sinh non trong NICU.
- Chẩn đoán RDS chủ yếu dựa vào nhu cầu oxy.
- Sử dụng steroid trước sinh rất cần thiết trong trường hợp dọa sinh non. Cần phải tích cực thực hiện CPAP và thông khí không xâm lấn tại phòng sinh.
- Liệu pháp surfactant ngoại sinh đã trở thành một trong những thô thuật phổ biến nhất được thực hiện để điều trị RDS ở trẻ sinh non trên toàn cầu.
- Thành phần, thời gian và kỹ thuật sử dụng surfactant đã được phát triển theo thời gian.
- Phương pháp INSURE hiện đang được ưa chuộng hơn khi sử dụng. surfactant.
- Liệu pháp surfactant dự phòng có thể chỉ đóng một vai trò hạn chế khi tỷ lệ sử dụng corticosteroid trước sinh thấp.
- Hiện tại, các surfactant có nguồn gốc từ động vật đang là tiêu chuẩn chăm sóc bệnh nhân bị RDS.
- Hạn chế thở máy để giảm tỷ lệ mắc bệnh.
- Các liệu pháp bổ trợ như caffeine, chế độ thông khí nhằm mục tiêu thể tích ở trẻ sơ sinh đặt nội khí quản, tăng CO, máu cho phép, và sử dụng oxy một cách thận trọng vẫn là những yếu tố chính.
- Điều trị toàn diện cho trẻ sơ sinh bị RDS bao gồm: Dinh dưỡng tối ưu dựa trên chế độ ăn hoàn toàn dựa vào sữa mẹ, điều hòa nhiệt độ và ổn định tim mạch.
- Nghiên cứu trong tương lai về liệu pháp surfactant nên tập trung vào việc sử dụng surfactant như một phương tiện để cung cấp các phân tử chống viêm, cũng như các phương thức sử dụng surfactant ít xâm lấn hoặc không xâm lấn.
Các trường hợp ví dụ
Trường hợp 1
Một bà mẹ G3P1 38 tuổi đã chuyển dạ và sinh con với bệnh tăng huyết áp mãn tính và thai nhi bị hạn chế tăng trưởng trong tử cung, đi kèm với tình trạng không có lưu lượng máu cuối tâm trương khi thai được 25 tuần. Người mẹ được nhập viện để kiểm soát huyết áp và loại trừ chứng tiền sản giật. Người mẹ đã từng bị tiền sản giật trước đó khi thai được 26 tuần tuổi. Cô báo cáo rằng đứa trẻ trước đó “khỏe mạnh” và không có bất kỳ biến chứng nào. Người mẹ nhận được 1 liều betamethasone và magnesium sulfate bắt đầu để bảo vệ thần kinh,
Quyết định tiến hành sinh mổ là thứ phát, do người mẹ bị tăng huyết áp không kiểm soát được và hội chứng HELLP. Trẻ sơ sinh được sinh ra bởi phẫu thuật mổ bắt con cổ điển. Các bác sĩ sản khoa đã lấy túi ối ra khỏi tử cung và đỡ đẻ cho trẻ sơ sinh bằng túi này. Bệnh nhân nặng 400 g được đưa đến giường sưởi bức xạ ở giây thứ 25, được đặt trong túi polyurethane vẫn còn dây rốn và nhau thai. Trẻ sơ sinh khóc yếu, và do đó NIPPV bắt đầu bằng Ram cannula (PIP là 25 và PEEP là 5).Nhịp tim lúc 1 phút thấp hơn 100. Đầu dò máy đo độ bão hòa oxy mạch này được áp dụng vào vùng động mạch quay bên phải, đồng thời đặt ống thông mũi-dạ dày. Nhóm nghiên cứu đã không thể có được kết quả tốt từ đầu dò máy đo độ bão hòa oxy mạch này cho đến phút thứ hai. Không thể duy trì độ bão hòa thích hợp mặc dù trẻ được giữ kín miệng, vì vậy đã chuyển sang NIPPV với mặt nạ và ống nối chữ T, và trẻ có đáp ứng tốt. Sau đó, trẻ được chuyển trở lại NIPPV thông qua Ram cannula, yêu cầu FiO2 là 40% trong quá trình vận chuyển đến NICU, nhưng nhanh chóng được cai trở lại 21% trước khi chuyển trẻ sang lồng ấp.
Ban đầu, trẻ sơ sinh được đặt trên NIPPV trong NICU. ABG ban đầu khi nhập viện là pH 7,20/CO, 62/BE-8. Trẻ đã bị giảm độ bão hòa, làm tăng nhu cầu FIO, lên 70%. Đặt nội khí quản với ống nội khí quản 2,5 và chế độ SIMV với áp lực hỗ trợ 20/5 và tần số 40. Trẻ sơ sinh được dùng liều surfactant đầu tiên, vì trẻ cần FiO2 cao hơn trên máy thở thông thường. Chụp X-quang ngực gợi ý RDS (Hình 24.10). Lúc đầu, trẻ đáp ứng với surfactant, hình ảnh X-quang ngực cho thấy sự giãn nở tốt hơn và FIO, đã được cai xuống (Hình 24,11).
Trong hai ngày tiếp theo, trẻ bị ứ CO2 với ABG cho thấy pH 7,14/CO 70/BE-8 và tại thời điểm này, cài đặt của trẻ sơ sinh trên máy thở thông thường là: Áp lực 24/6, tần số 40 và FiO, 60%. Hỗ trợ hô hấp đã được chuyển sang máy thở dao động tần số cao, vì áp lực đường thở trung bình của trẻ sơ sinh đang trên máy thở thông thường quá cao (MAP = 11). Trẻ sơ sinh được bổ sung 2 liều surfactant trong 48 giờ tiếp theo sau khi bệnh phổi nặng hơn, cũng như tăng cài đặt máy thở dao động (MAP tăng từ 13 lên 15, Amp tặng từ 20 lên 24). Siêu âm tim vào thời điểm này cho thấy PDA lớn với chuyển hướng chủ yếu từ trái sang phải. Trẻ sơ sinh nhận được hai liệu trình indomethacin để đóng PDA.
Trẻ sơ sinh tiếp tục yêu cầu cái đặt cao trên máy thờ dao động với MAP 15, Amp 24, Hz 12 và nhận thêm liều surfactant khi X-quang tiếp tục cho thấy tình trạng RDS (Hình 24.12). Trẻ sơ sinh đáp ứng liều này với sự cải thiện về CO, trên ABG 7,30/52/–2. Trẻ được cai máy thở từ từ đến mức cài đặt MAP 10, Amp 16, sau đó được chuyển sang máy thỏ thông thường với cài đặt áp lực 24/6 và tần số 40. Bệnh nhân được rút nổi khi quản sau vài ngày ổn định và cai máy thơ bằng NIPPV nhờ sử dụng Ram cannula trên máy thở áp lực thông thường với áp lực ở mức cài đặt 18/6, tần số 20 cho đến mức áp lực 25/5, tần số 40, FIO, là 30%. Áp lực qua Ram cannaula đã được cai dân trong tháng kể tiếp, đồng thời tập trung vào dinh dưỡng và tăng trưởng. Cho ăn đã được thiết lập trong 2 tuần kể tiếp. Sau khi áp lực là 10/5, tần số được cai mỗi 2 nhịp thở phút cứ sau mỗi 12 giờ cho đến khi tần số còn 10.
Trẻ sơ sinh được chuyển sang CPAP ở mức 6 cm H,O khi trẻ được 33 tuần tuổi thai điều chỉnh và được cai máy thở sang ống thông mũi 2 U phút trong những ngày kế tiếp sau khi chuyển sang CPAP.
Trẻ sơ sinh được cai dàn máy thở khỏi ống thông mũi trong 2 tuần kế tiếp. Trẻ đã có những giai đoạn giảm độ bão hòa, đặc biệt là khi bú trong 2 tuần tiếp theo. Chụp X-quang cho thấy bệnh phổi còn lại (Hinh 24.13). Với chế độ dinh dưỡng đầy đủ và tăng trưởng, trẻ sơ sinh được cải thiện mà không bị giảm độ bão hòa khi ở 36 tuần tuổi thai được điều chỉnh. Trẻ đã vượt qua bài kiểm tra thử thách oxy và được xuất viện về nhà mà không cần bổ sung oxy.
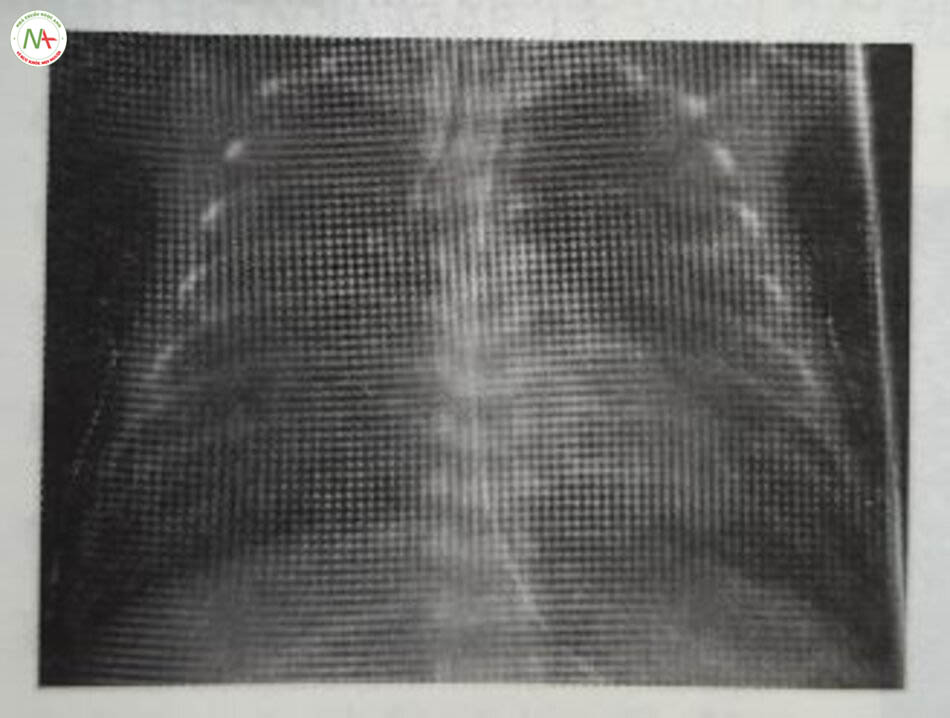
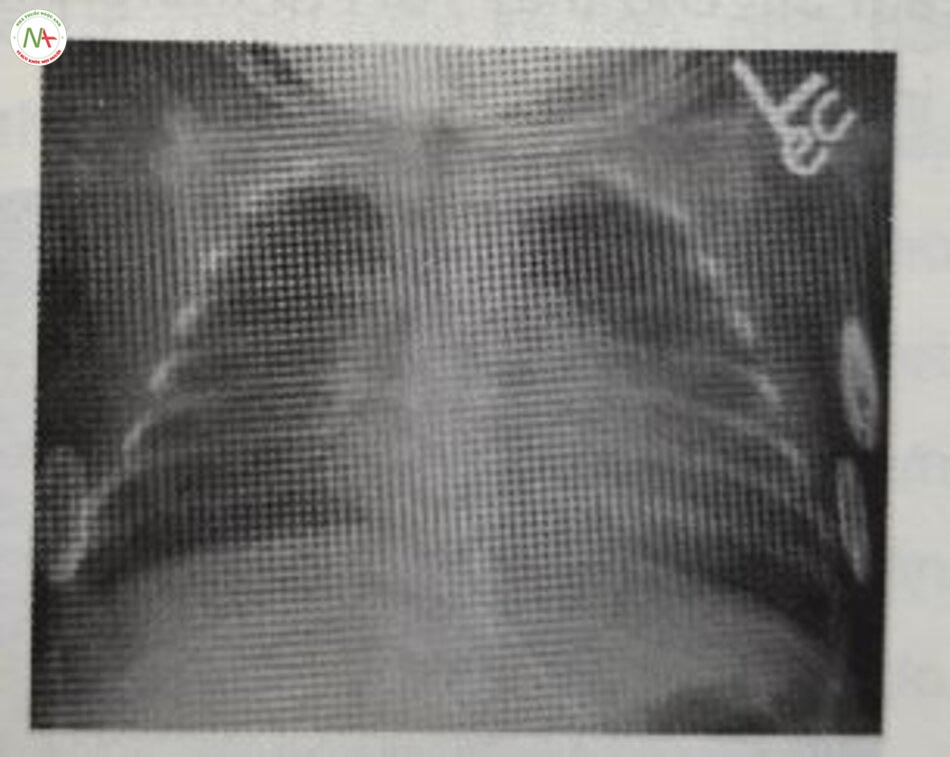
Trường hợp 2
Một trẻ nữ sinh non 24 1/7 tuần được sinh ra bởi một bà mẹ G2P2 16 tuổi. Người mẹ bị chảy máu âm đạo liên quan đến chuyển dạ sinh non do mạch máu tiền đạo (vasa previa) trước khi sinh và được chuyển từ bệnh viện bên ngoài đến bệnh viện để sinh. Cô đã nhận được beta- methasone x 2 liều trước khi chuyển viện cùng với magnesium để bảo vệ thần kinh và ampicillin. Khi nhập viện chuyển dạ và sinh, người mẹ bắt đầu xuất hiện các cơn co thắt sau mỗi 10–15 phút và kéo dài qua đêm thành các cơn co thắt sau mỗi 2–5 phút.
Trẻ sơ sinh được sinh ra bằng cách sinh tự nhiên qua đường âm đạo. Bệnh nhân nặng 600 g được đưa đến giường sưởi mà không có kẹp dây rốn muộn. Dây rốn quấn cổ đã được ghi nhận khi chuyển dạ. Bệnh nhân được đặt trong túi và nằm trên nệm hóa học. Trẻ đã được lau khô, kích thích và hút đàm. Ram cannula được đặt cấp cứu sau khi trẻ chuyền đến giường sưởi, với cài đặt áp lực 26/6, FiO, tăng lên 50% và sau đó giảm xuống khi cải thiện độ bão hòa oxy. Nhịp tim ban đầu dưới 100 trong 1 phút, sau đó được cải thiện lên hơn 100 với NIPPV.
Bệnh nhân được chuyển đến NICU trên NIPPV. Chụp X-quang ngực gợi ý RDS nhẹ (Hình 24.14). pH khí mẫu ban đầu 7,26/50/–5. Trẻ sơ sinh được sử dụng surfactant bằng phương pháp INSURE. Trong tuần đầu tiên sau sinh, tình trạng hô hấp của trẻ sơ sinh được cải thiện. Siêu âm tim cho thấy PDA từ trung bình đến lớn, yêu cầu cần phải điều trị indomethacin.
Tuần thứ hai của trẻ được ghi nhận là có tăng công thở, đòi hỏi phải đặt nội khí quản (Hình 24.15) và được bổ sung hai liều surfactant. Trẻ được đặt trên máy thở thông thường, áp dụng cài đặt SIMV với hỗ trợ áp lực 24/6, tần số 30, FiO, trong khoảng 21% đến 30% và thời gian hit vào 0,3 giây. Trong 24 giờ tiếp theo, trẻ sơ sinh xấu đi khi chụp X-quang phổi, cho thấy những thay đổi gợi ý đến dạng lưới hạt và ABG 7,16/681–7. Nuôi cấy dịch hút qua ống nội khí quản cho thấy Klebsiella pneumoniae, cần tiêm tĩnh mạch cefotaxime.
Trẻ sơ sinh được chuyển sang máy thở dao động tần số cao do ở CO, (ABG là 7,22/66/–6,5), bất chấp cài đặt cao trên máy thở thông thường láp lực 25/6, tần số 40, MAP 11, FIO, 50%). Cài đặt lúc bắt đầu HFOV là MAP 13, Amp 24, Hz 15. Trong tuần kế tiếp, phổi bắt đầu xuất hiện nang. Áp lực đường thở trung bình (MAP) cao trên máy thở dao động tần số cao (MAP 16, Amp 30, Hz 10) ở trẻ có FiO, cao 50%–70% nên được chuyển sang máy thở phản lực tần số cao (Jet PEEP 14, PIP 36, tần số 360). Siêu âm tim được thực hiện tại thời điểm này cho thấy PDA lớn. Mặc dù điều trị bằng thuốc, song PDA vẫn không đóng lại. Phẫu thuật cột thật PDA được thực hiện thứ phát, do tình trạng phối và huyết động xấu đi.
Trẻ sơ sinh nhận được một đợt điều trị dexamethasone trong 9 ngày (liều khởi đầu 0,1 mg/kg/ngày chia làm hai lần, 3 ngày một lần) để điều trị BPD sắp xảy ra (Hình 24.16). Trẻ đáp ứng một phần (ABG 7,32/56/+4) và được cai máy thở bằng máy thở thông thường. Tuy nhiên, trẻ sơ sinh được đặt trở lại máy thở phản lực do suy giảm hô hấp (ABG 7,26/64/+3). Cho ăn được thiết lập trong khi tiếp tục hỗ trợ hô hấp bằng máy thở phản lực. Với việc giải quyết nhiễm trùng, không có PDA và dung nạp với sữa mẹ của trẻ sơ sinh được cải thiện. Với một đợt dùng dexamethasone khác, trẻ dần dần được cai máy thở và chuyển sang NIPPV.
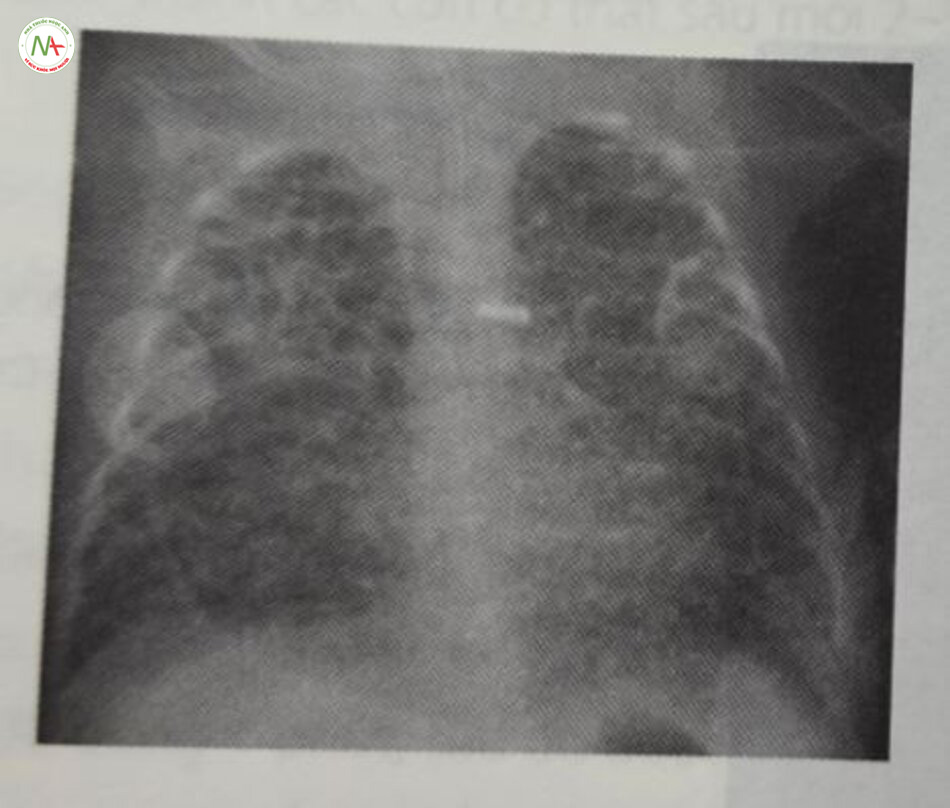
Trong tháng kế tiếp, NIPPV đã được cai máy thở sang ống thông mũi (nasal cannula). Trẻ sơ sinh cũng được bắt đầu dùng thuốc lợi tiểu và steroid dạng hít với thuốc giãn phế quản. Trẻ sơ sinh từ từ cải thiện tình trạng giảm độ bão hòa hô hấp và ổn định để về nhà với oxy lưu lượng thấp (Hình 24.17). Siêu âm tim không cho thấy tình trạng tăng áp phổi.