Bệnh da liễu
Tổng quan về liệu pháp steroid trong điều trị sẹo
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Tổng quan về liệu pháp steroid trong điều trị sẹo – tải pdf tại đây.
Tác giả: loannis Goutos.
Dịch: Bs. Trương Tấn Minh Vũ.
Lịch sử ứng dụng steroid trong điều trị sẹo
Báo cáo đầu tiên về việc sử dụng steroid trong tài liệu quốc tế bắt đầu từ năm 1950 với Behrmann và Goodwin ghi nhận sự cải thiện của sẹo lồi ở những bệnh nhân được dùng kết hợp hormone vỏ thượng thận (ACTH) và cortisone [1]. Trong cùng năm đó, Baker và Whitaker đã chứng minh rằng việc bôi steroid tại chỗ trong một thời gian dài sẽ làm mỏng da ở mô hình động vật [2].
Một năm sau, vào năm 1951, Polson, Pattee và Woolhouse công bố một báo cáo trường hợp trong đó họ sử dụng cortisone tiêm bắp trước phẫu thuật kết hợp với uống và tiêm bắp kết hợp với phẫu thuật cắt sẹo lồi; tuy nhiên họ xác định rằng cách tiếp cận này không thành công trong việc ngăn ngừa tái phát [3].
Conway và Stark năm 1951 đã thử nghiệm sự kết hợp giữa phẫu thuật và tiêm ACTH sau phẫu thuật để điều trị hai vết sẹo lồi và ghi nhận không tái phát sau 5 và 8 tháng. Ngoài ra, bốn trường hợp được điều trị bằng cách tiêm trong sẹo ACTH và hyaluronidase; giảm triệu chứng (đau và ngứa) đã được ghi nhận, tuy nhiên, một sự thay đổi đáng kể về bề ngoài chỉ được ghi nhận ở một trong số tổn thương được điều trị [4].
Goldman, Thompson và Trice là những tác giả đầu tiên nghiên cứu giá trị của kem cortisone đối với sẹo lồi với kết quả thất vọng [5]. Coste, Degos và cộng sự báo cáo tác dụng có lợi của việc tiêm tại chỗ hydrocortisone acetate vào sẹo lồi [6], trong khi De Kleine lưu ý rằng việc tiêm cortisone tại chỗ (0,25 mg/cc) sau khi cắt bỏ sẹo lồi ở hai bệnh nhân dẫn đến chậm tái phát ở một người và mức độ tái phát thấp hơn ở người còn lại [7].
Năm 1961, Hollander sử dụng dẫn xuất steroid flo hóa triamcinolone để điều trị sẹo lồi và cho thấy sự giảm thành công trong nhóm điều trị cũng như giảm triệu chứng đáng kể [8]. Năm 1963, Murray đề xuất tiêm steroid vào các rìa của sẹo đã được cắt bỏ để ngăn ngừa tái phát [9], báo trước việc sử dụng steroid dạng tiêm như một loại thuốc hỗ trợ quanh vị trí phẫu thuật. Vào cuối những năm 1960, Maguire HC, Griffith BH và Minkowitz F đã báo cáo thành công điều trị sẹo bằng triamcinolone và đưa thành phần này thành steroid phổ biến nhất trong điều trị sẹo lồi [10-12]. Bảng 12.1 minh họa các mốc quan trọng liên quan đến việc sử dụng corticosteroid trong lĩnh vực điều trị sẹo.
Bảng 12.1 Tóm tắt các mốc quan trọng liên quan đến việc sử dụng các chế phẩm corticosteroid trong quản lý sẹo
| Tác giả | Năm | Mô tả |
| Berhman | 1950 | Đầu tiên sử dụng steroid đường uống/ tiêm trong điều trị sẹo lồi |
| Polson và cộng sự,
Goodwin |
1951 | Sử dụng steroid hỗ trợ trong điều trị bằng phẫu thuật |
| Goldman và Trice | 1952 | Báo cáo đầu tiên về ứng dụng kem cortisone đối với sẹo lồi |
| Coste và Degos | 1953 | Tiêm tại chỗ hydrocortisone acetate như đơn trị liệu |
| Hollander | 1961 | Dẫn xuất triamcinolone flo hóa cho thấy sự hồi phục sẹo thành công cũng như giảm triệu chứng |
| Murray | 1963 | Tiêm steroid vào các cạnh của sẹo đã cắt để ngăn ngừa tái phát |
| Maguire HC Griffith BH Minkowitz F |
1965 1966 1967 |
Điều trị thành công sẹo bằng triamcinolone như một chất chính trong điều trị sẹo lồi |
Cấu trúc hóa học và cơ chế hoạt động của steroid
Steroid là dẫn xuất của cholesterol và được chia thành hai loại, là mineralocorticoid và glucocorticoid. Corticosteroid nội sinh chính (hydrocortisone) ảnh hưởng đến chuyển hóa carbohydrate và protein, đồng thời có tác dụng chống viêm và ức chế miễn dịch đáng kể; các hoạt tính sinh học sau được khai thác trong thực hành lâm sàng liên quan đến điều trị sẹo [13]. Các thụ thể glucocorticoid có trong tất cả các loại tế bào, điều này giải thích khả năng steroid gây ra nhiều tác dụng phụ tại chỗ và toàn thân ở những bệnh nhân đang điều trị sẹo phì đại và sẹo lồi [14].
Steroid ngăn chặn quá trình viêm / hình thành sẹo theo các cơ chế chính sau đây [15, 16]:
- Ức chế sự di chuyển và thực bào của bạch cầu / bạch cầu đơn nhân.
- Co mạch, làm giảm sự cung cấp oxy và chất dinh dưỡng đến nền vết thương.
- Tác dụng chống phân bào thông qua ức chế tăng sinh nguyên bào sợi (bằng cách giảm các yếu tố phân bào như TGF-beta 1, VEGF và IGF-1) và thúc đẩy thoái hóa tế bào.
- Giảm tổng hợp collagen và tăng cường thoái hóa collagen thông qua giảm mức alpha-2 macroglobulin và alpha-1 antitrypsin (chất ức chế collagenase mạnh).
Steroid có thể được sử dụng theo nhiều cách khác nhau đối với các sẹo phì đại và sẹo lồi, bao gồm dạng tiêm, thuốc mỡ và dạng băng dán. Chương này không phân biệt rõ ràng giữa việc sử dụng steroid đối với sẹo phì đại và sẹo lồi; điều này liên quan đến thực tế là các lý thuyết hiện tại ủng hộ quan điểm rằng cả hai đều nằm trên phổ hình thành sẹo không thuận lợi với sẹo lồi là điểm kết thúc cực đại của sẹo phì đại [17]. Hơn nữa, phần lớn các báo cáo y văn thiếu sự phân biệt về mô học hoặc lâm sàng khách quan rõ ràng giữa sẹo lồi và sẹo phì đại, khiến cho việc cung cấp chính xác các bằng chứng hiện có trở nên khó khăn.
=> Đọc thêm: Cập nhật các phương pháp điều trị sẹo mụn ở phòng khám da liễu Hàn Quốc.
Phương pháp điều trị steroid
Steroid dạng tiêm
Các chế phẩm và liều dùng steroid phổ biến
Nhiều loại steroid tiêm đã được sử dụng trong nhiều thập kỷ, bao gồm hydrocortisone acetate (25 mg/mL), dexamethasone (4 mg/mL) và methylprednisolone (4 mg/mL) [13, 18].
Cho đến nay, chế phẩm được sử dụng phổ biến nhất là triamcinolone acetonide (TAC), được bán trên thị trường ở dạng chế phẩm 10 và 40 mg/mL ở Anh và Mỹ. Dẫn xuất flo hóa của prednisolon này mạnh gấp bốn lần hydrocortisone; điều này là do giảm khả năng hòa tan và dẫn đến khả năng duy trì hoạt tính sinh học tại vị trí tiêm trong thời gian dài hơn [19-21].
Mặc dù steroid dạng tiêm, đặc biệt là triamcinolone, là loại steroid phổ biến nhất để điều trị sẹo lồi và sẹo phì đại, nhưng có rất ít bằng chứng khách quan để hỗ trợ các khuyến nghị về phác đồ điều trị. Tần suất sử dụng thuốc rất khác nhau trong các tài liệu và dao động từ hai lần một tuần [7] đến 6 tuần cách nhau giữa mỗi đợt điều trị [22, 23].
Một cuộc khảo sát trong số hơn một trăm bác sĩ phẫu thuật thẩm mỹ quốc tế cho thấy chế phẩm steroid phổ biến nhất để kiểm soát sẹo là TAC (40 mg/mL) và khoảng thời gian giữa các lần tiêm thường được khuyên là 3 đến 4 tuần (31%), tiếp theo là 4- 5 tuần (26%) [24]. Darzi đề xuất một chương trình dùng thuốc theo thể tích mô sẹo trong mỗi liệu trình như sau: 20-40 mg triamcinolone cho các tổn thương có diện tích bề mặt 1-2 cm2, 40-80 mg cho những người có 2-6 cm2 và 80-120 mg đối với sẹo có diện tích bề mặt từ 6-12 cm2 với khoảng cách giữa các lần tiêm từ 1 đến 2 tuần [25]. Jalali đề xuất một phương pháp tương tự dựa trên chiều dài của sẹo dài, tức là 0,1 mL với 10 mg TAC trên mỗi cm chiều dài của sẹo được lặp lại sau mỗi 4-6 tuần cho đến khi sẹo giảm thành công [13]. Một nhóm khác đã đề xuất liều tối đa 5 mg triamcinolone mỗi lần nhằm cố gắng tránh hiện tượng kinh nguyệt không đều cũng như giảm sắc tố và teo da ở vùng điều trị [26]. Năm 2010, một hội đồng chuyên gia quốc tế đã khuyến nghị tiêm triamcinolone 2,5-20 mg mỗi mL cho vùng mặt và 20-40 mg mỗi mL cho phần còn lại của cơ thể, lặp lại hàng tháng; thú vị nhất là vẫn chưa có liều lượng cụ thể cho trẻ em được đưa ra [27].
Kỹ thuật tiêm
Kỹ thuật tiêm trong tổn thương
Tiêm corticosteroid trong tổn thương là phương pháp điều trị chính cho sẹo phì đại và sẹo lồi. Một trong những nghiên cứu được thiết kế tốt nhất chứng minh hiệu quả của phương pháp này đã sử dụng phép đo ảnh lập thể ba chiều được xác thực để đánh giá định lượng thể tích sẹo khách quan. Trong một nhóm gồm 12 người lớn bị sẹo lồi, TAC (0,54 mL tùy thuộc vào kích thước tổn thương) được tiêm trong tổn thương và đánh giá sẹo trước và sau ít nhất 8 tuần điều trị bằng steroid. Kết quả cho thấy mức giảm thể tích sẹo trung bình có ý nghĩa thống kê [thay đổi từ 0,73 ± 0,701 cm3 đến 0,14 ± 0,302 cm3 (p <0,001)], với phần lớn bệnh nhân đạt được đáp ứng trên 50% trong vòng 8 tuần [28].
Một số mẹo về kỹ thuật đã được mô tả trong tài liệu để tăng hiệu quả của việc sử dụng và giảm thiểu sự khó chịu cho bệnh nhân.
Kim có đường kính nhỏ (dao động từ 25 đến 30 gauge) kết hợp với ống tiêm có khóa Luer hoặc ống tiêm insulin với kim tích hợp được ủng hộ cho việc tiêm trong tổn thương để chịu được áp lực gặp phải khi tiêm vào các vết sẹo cứng [22, 29] . Về các khuyến nghị liên quan đến kỹ thuật tiêm, một số tác giả đã khuyên rằng nên đưa kim vào lớp bì nhú (nơi tạo ra collagenase) và tiêm trong khi rút kim [29, 30]. Các tác giả khác đã ủng hộ việc tiêm ở giữa lớp bì để tránh teo biểu bì không hồi phục, nhiều khả năng xảy ra hơn với việc tiêm nông [31]. Làm trắng /giảm căng hoàn toàn vết sẹo trong quá trình tiêm điều trị được coi là một endpoint phù hợp của thủ thuật; kinh nghiệm lâm sàng cho thấy rằng những sẹo trẻ hơn đáp ứng điều trị tốt hơn so với những sẹo lâu năm hơn [7, 30]. Nguyên tắc đưa kim vào trong tổn thương sẹo lồi (trái ngược với vùng da lành lân cận) để tránh sự phát triển sẹo lồi do thủ thuật đã được báo cáo nhưng không được chứng minh chắc chắn trong y văn [32]. Một loạt các kỹ thuật đã được mô tả để giảm bớt sự khó chịu khi tiêm steroid, bao gồm:
- Sử dụng kem gây tê tại chỗ trước khi làm thủ thuật hoặc kết hợp dung dịch gây tê cục bộ với steroid trong cùng một ống tiêm. Mặc dù cách sau không làm dịu cơn đau ban đầu khi tiêm, nhưng về mặt lý thuyết, nó cho phép thực hiện các mũi tiêm nối tiếp trong tổn thương và giảm đau sau thủ thuật [29].
- Sử dụng thiết bị phun áp lực [23, 33] hoặc bơm điện (với tốc độ phun 3-6 mL mỗi h) đã được chứng minh là có hiệu quả trong việc giảm thiểu sự khó chịu [34].
- Sử dụng nitơ lỏng (với thời gian chu kỳ đông lạnh 10-15 giây) [35] đã được báo cáo là làm giảm bớt sự khó chịu liên quan đến tiêm và cải thiện việc lưu giữ steroid; điều này được cho là xảy ra do gây ra tổn thương tế bào và phù nề trong sẹo [36].
Thuốc tiêm steroid đã được chứng minh là có hiệu quả đặc biệt trong việc giảm các triệu chứng ngứa và đau cũng như giảm số lượng lớn các vết sẹo. Cần sử dụng lặp lại theo chu kỳ và ngừng điều trị khi:
- Sẹo giảm đáng kể / giảm triệu chứng đáng kể.
- Phát triển các tác dụng phụ tại chỗ hoặc toàn thân trong quá trình điều trị.
- Thất bại trong gây ra sự thoái triển sẹo đáng kể. Trong thực tế lâm sàng, người ta đã công nhận rộng rãi rằng một nhóm sẹo không đáp ứng với steroid tiêm và nghiên cứu gần đây đã chỉ ra rằng điều này có thể liên quan đến một dạng biểu hiện khác của các thụ thể glucocorticoid trong mô tạo ra một nhóm sẹo kháng steroid [30].
- Bệnh nhân kém tuân thủ. Một nghiên cứu mô tả ở những bệnh nhân châu Á bị sẹo lồi được điều trị bằng cách tiêm triamcinolone bốn tuần (1-10 mg trong 10 mg/mL) đã cho thấy rằng 33% bệnh nhân từ bỏ điều trị trong vòng mười lần tiêm do sự kết hợp của đau do thủ thuật và thiếu cải thiện về mặt lâm sàng [37 ].
Kỹ thuật tiêm dưới tổn thương
Các tổng quan tài liệu về phương pháp tiêm trong tổn thương cho thấy một số thiếu sót bao gồm sự phát triển của các tác dụng phụ tại chỗ cũng như đau liên quan đến thủ thuật ảnh hưởng đến sự tuân thủ của bệnh nhân. Kỹ thuật tiêm dưới tổn thương nhắm đến việc cung cấp steroid vào phần sâu nhất của lớp bì nhằm khắc phục những thiếu sót của phương pháp tiêm trong tổn thương.
Kỹ thuật này sử dụng 20-40 mg/mL Kenacort đã được báo cáo trong một ấn phẩm duy nhất về sẹo lồi lâu năm do bỏng (vào cuối năm phát triển thứ hai của chúng) [38]. Các tác giả đã sử dụng ánh sáng và kính hiển vi điện tử kiểm tra các vết sẹo được điều trị và cho thấy rằng những thay đổi tích cực về mô học xuất hiện sớm hơn so với những thay đổi đạt được với phương pháp tiêm trong tổn thương với mô hình tác dụng phụ tương tự, bao gồm teo, giảm sắc tố và giãn da. Việc áp dụng phương pháp này đã được ủng hộ trong một ấn phẩm gần đây [26] và cũng đại diện cho phương pháp tiếp cận ưa thích của tác giả, đặc biệt là đối với sẹo lâu năm, không đáp ứng.
Sử dụng steroid như một biện pháp hỗ trợ phẫu thuật cắt bỏ sẹo
Steroid thường được sử dụng như một biện pháp hỗ trợ cho phẫu thuật sẹo và một loạt các phương pháp đã được mô tả liên quan đến thời điểm sử dụng (tức là trước, trong cũng như sau phẫu thuật) cũng như vị trí chính xác của việc đưa thuốc vào (tức là trong- so với tiêm ngoài tổn thương).
Sử dụng steroid trước khi phẫu thuật
Việc sử dụng thuốc tiêm steroid trước khi phẫu thuật đã được mô tả; Nguyên tắc cơ bản là tạo ra sự teo sẹo cho đến khi không ghi nhận được sự thoái triển nào nữa trước khi phẫu thuật cắt bỏ phần sẹo còn lại trong một vùng giảm khả năng viêm. Các tác giả khác nhau đã đề xuất các chế độ khác nhau bắt đầu tiêm từ 1 đến 3 tháng trước phẫu thuật và tiếp tục trong một khoảng thời gian khác nhau với việc tiêm sau khi cắt bỏ sẹo [22, 39]. Nghiên cứu duy nhất đánh giá việc sử dụng corticosteroid trước phẫu thuật trong điều trị sẹo lồi bao gồm một thử nghiệm tiền cứu ngẫu nhiên; một nhóm gồm những bệnh nhân nhận được hai liều triamcinolone trước phẫu thuật và ba liều sau phẫu thuật và nhóm còn lại phẫu thuật cộng với colchicine đường uống (1,2 mg/ngày). Các tác giả kết luận rằng không có sự khác biệt đáng kể về tỷ lệ tái phát giữa hai nhóm nhưng nhận xét về sự chấp nhận hạn chế của phác đồ nghiên cứu để đưa ra bất kỳ kết luận xác đáng nào về giá trị của việc dùng steroid trước phẫu thuật [18].
Cắt bỏ trong tổn thương và tiêm sau phẫu thuật
Nguyên tắc của kỹ thuật này là cắt bỏ phần lớn tổn thương và để lại một vành sẹo lồi ở ngoại vi, cho phép đóng các vạt sẹo lồi bằng cách bảo tồn khung sẹo ngoại vi. Thực hành này đặc biệt phổ biến ở Anh và cho phép sử dụng steroid sau phẫu thuật dễ dàng hơn vào các vết sẹo ngoại vi.
Việc tiêm steroid đã được báo cáo vào các khoảng thời gian khác nhau sau khi phẫu thuật, thay đổi từ ngay sau khi đóng da [40] đến thời điểm cắt bỏ chỉ khâu (10-14 ngày); Các lần tiêm tiếp theo được hẹn vào các khoảng thời gian thay đổi (2-4 tuần) trong một số báo cáo [41, 42]. Tang đề xuất sự kết hợp giữa cắt trong sẹo, làm giảm sức căng, tiêm TAC 10-30 mg ở rìa vết thương trong phẫu thuật và tiêm sau mổ theo dõi trong tối đa 5 tháng. Trong các trường hợp được công bố gồm 11 sẹo lồi và sẹo phì đại được điều trị bằng phương pháp này với thời gian theo dõi trung bình là 15 tháng (từ 12-36), tỷ lệ tái phát được báo cáo là 8,2% [42].
Cắt bỏ ngoài tổn thương và tiêm sau phẫu thuật
Cơ sở lý luận của phương pháp này là để loại bỏ toàn bộ tổn thương sẹo và giảm thiểu sự tái phát tại vị trí phẫu thuật cắt bỏ bằng cách làm giảm phản ứng viêm bằng sử dụng các chế phẩm steroid đưa vào rìa vết thương. Các thực hiện khác nhau đã được mô tả liên quan đến liều lượng các chế phẩm steroid cũng như thời gian sử dụng. Một số báo cáo ủng hộ việc tiêm vùng da quanh rìa tổn thương trước khi cắt bỏ [43], trong khi những báo cáo khác bắt đầu dùng steroid ngay tại thời điểm đóng vết thương [44-47] với một số lần tiêm hàng tháng khác nhau. Một báo cáo trong các tài liệu ủng hộ khái niệm bắt đầu tiêm ít nhất 10 ngày sau khi cắt bỏ ngoài sẹo để cố gắng giảm nguy cơ nhiễm trùng / vỡ vết thương [48]. Một nghiên cứu đã đánh giá sự biểu hiện mô học của các vết sẹo sau khi cắt bỏ sẹo lồi và tiêm triamcinolone ngay lập tức so với trì hoãn (sau 2 tuần). Nó cho thấy sự điều hòa giảm của collagen loại 1 được tạo ra bằng cách tiêm TA ngay lập tức sau khi cắt bỏ sẹo lồi và kết quả là quá trình lành vết thương không bị ảnh hưởng. Hơn nữa, kiểm tra các vùng được điều trị tức thời cho thấy các bó collagen mỏng hơn và ít dày đặc hơn so với nhóm tiêm trễ [49]. Các phát hiện của nghiên cứu này cung cấp một số bằng chứng ủng hộ việc tiêm cạnh vết thương ngay lập tức sau cắt ngoài sẹo lồi. Chowdhury và cộng sự thực hiện một nghiên cứu trên 58 bệnh nhân có sẹo phì đại và sẹo lồi đã trải qua phẫu thuật cắt bỏ và tiêm triamcinolone acetonide cùng thời điểm phẫu thuật cũng như sau phẫu thuật (ban đầu tiêm cách 2-5 tuần sau đó hàng tháng trong 4-6 tháng). Tất cả các bệnh nhân đạt được một số mức độ giảm triệu chứng và không tái phát khi theo dõi trung bình trong 30 tháng ở 92% bệnh nhân sẹo lồi và 95% bệnh nhân sẹo phì đại [45].
Tác dụng phụ của Corticosteroid
Tác dụng phụ tại chỗ
Có tới 63% bệnh nhân gặp tác dụng phụ sau khi điều trị bằng corticosteroid đối với sẹo phì đại và sẹo lồi; những điều này nhiều khả năng xảy ra hơn nếu chế phẩm được tiêm tràn vào lớp bì hoặc mô dưới da ở xung quanh hoặc được đặt sai vị trí gần với lớp biểu bì [50-52]. Các tác dụng phụ được báo cáo phổ biến nhất bao gồm [29, 53-55]:
- Giảm sắc tố (điều này có thể tồn tại vĩnh viễn hoặc hết sau 6-12 tháng).
- Teo da.
- Giãn mạch.
- Hình thành mảng lắng đọng màu vàng.
- Loét / hoại tử da tại chỗ.
- Teo tuyến tính đã được báo cáo ở những bệnh nhân sau tiêm triamcinolone, sẽ thoái triển trong khoảng thời gian vài tháng.
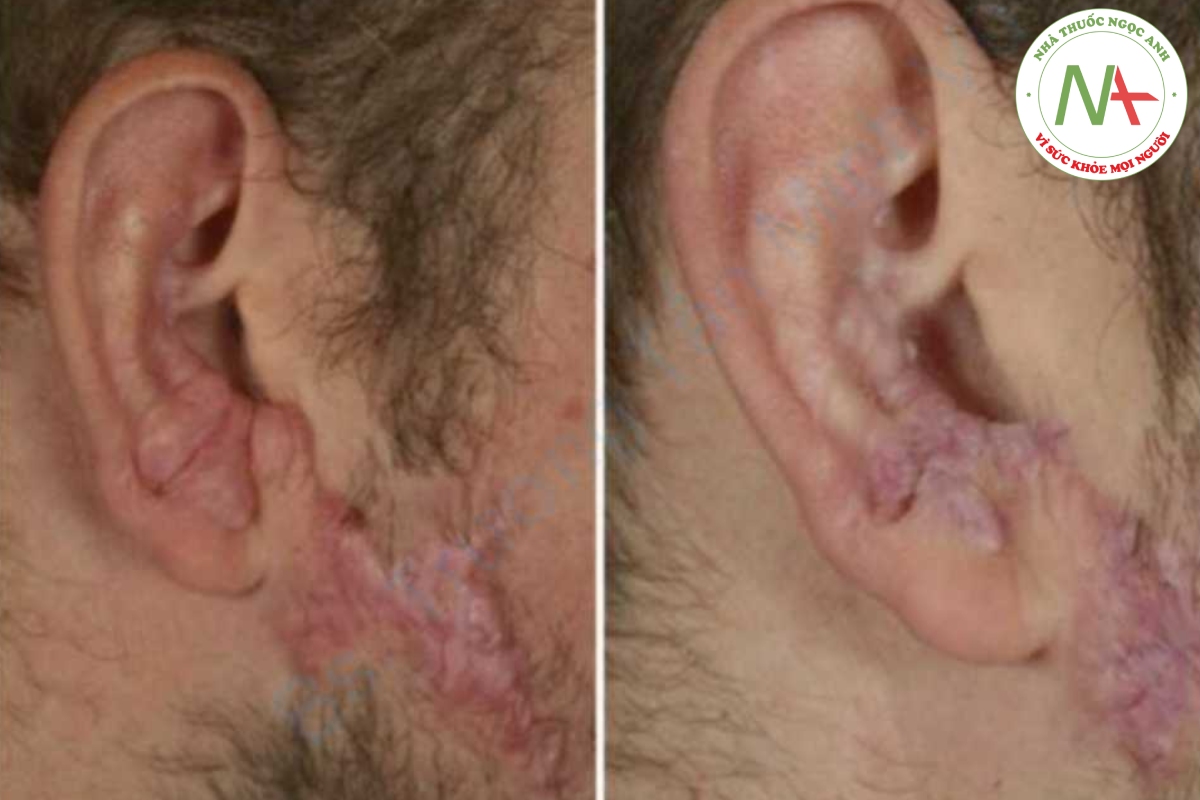
Ngoài nguy cơ tác dụng phụ cục bộ khi dùng steroid, còn tồn tại sự tăng quá mức nồng độ toàn thân của steroid; điều này có thể dẫn đến ức chế tuyến thượng thận và phát triển hội chứng Cushing (Bảng 12.2) [14, 24]. Liều cao của triamcinolone dường như làm giảm sự thanh thải toàn bộ cơ thể thông qua sự bão hòa của các cơ chế thải trừ sinh lý; điều này kết hợp với công thức giải phóng chậm của TAC có thể giải thích kết quả ức chế tuyến thượng thận ở những bệnh nhân được tiêm nhiều lần [56].
Một đánh giá hệ thống từ năm 1950 đến năm 2012 đã xác nhận 18 trường hợp mắc hội chứng Cushing sau khi tiêm TAC qua trong tổn thương [24]. Các chỉ số khách quan để thiết lập liều dùng thuốc an toàn không tồn tại do thiếu các nghiên cứu về khả năng hấp thu đối với glucocorticoid tiêm trong da. Tuy nhiên, có vẻ như các yếu tố nội tại như sự nhạy cảm của cá nhân với steroid có thể đóng một vai trò trong xu hướng phát triển hội chứng Cushing [57].
Các đặc điểm phân biệt nhất của hội chứng Cushing (tích tụ toàn thân của glucocorticoid) là mặt phù, dễ bầm, bệnh cơ gần và rạn da tím lan rộng [58]. Thời gian trung bình để phát triển các triệu chứng ban đầu của hội chứng Cushing là 6,5 tuần (từ 2 tuần – 9 tháng), và đánh giá theo dõi trong vòng 2 tuần đã được khuyến nghị để đảm bảo phát hiện sớm và xử trí các tác dụng phụ toàn thân có thể xảy ra sau khi bắt đầu sử dụng corticosteroid [24]. Bảng 12.2 tóm tắt các biểu hiện toàn thân của hội chứng Cushing.
Bảng 12.2 Tóm tắt các tác dụng phụ toàn thân của việc sử dụng steroid
| Hệ thống | Tác dụng phụ |
| Mắt | Tăng nhãn áp dẫn đến glaucoma |
| Cơ xương khớp | Tái hấp thu canxi dẫn đến loãng xương, yếu cơ, còi cọc ở trẻ em |
| Miễn dịch | Suy giảm miễn dịch, dễ bị nhiễm trùng |
| Tim mạch | Tăng cung lượng tim và giảm sức cản ngoại vi |
| Thần kinh | Từ rối loạn giấc ngủ nhẹ đến rối loạn tâm thần, co giật, đau đầu và giảm ham muốn tình dục |
| Da | Mụn trứng cá, rạn da tím và bầm tím |
| Sự trao đổi chất | Tăng cân, tăng đường huyết và đái tháo đường, tái phân phối mỡ (bướu trâu, phù mặt, mỡ thượng đòn) |
Tổng quan tài liệu cho thấy 80% các báo cáo về hội chứng Cushing liên quan đến bệnh nhân nhi với phần lớn những bệnh nhân này đã dùng hơn 40 mg corticosteroid trong vòng một tháng. Vẫn chưa rõ liệu trẻ em có dễ bị tác dụng phụ toàn thân hơn về mặt sinh lý do tiêm corticosteroid bất kể liều lượng được cân nhắc trên mỗi kg hay không; tuy nhiên với xu hướng được báo cáo trong y văn, cần phải tăng cường thận trọng khi sử dụng steroid trong các vết sẹo ở trẻ em (liều tối đa được khuyến cáo là 30 mg TAC mỗi tháng) [24]. Về hướng dẫn liều lượng cho người lớn, năm 2010, hội đồng chuyên gia quốc tế đã khuyến nghị tiêm triamcinolone 2,5-20 mg mỗi mL cho sẹo trên mặt và 20-40 mg mỗi mL (cho các vị trí còn lại trên cơ thể) lặp lại hàng tháng [28].
Thuốc mỡ steroid
Một số ít các công bố đã nghiên cứu hiệu quả của thuốc mỡ steroid trong điều trị sẹo phì đại và sẹo lồi. Marsden và cộng sự nghiên cứu việc sử dụng kem fluocinolone acetonide 0,25% bôi 3 lần/ngày ở 192 bệnh nhân với nhiều bệnh da liễu, bao gồm cả liken hóa, bệnh vẩy nến cũng như 12 trường hợp sẹo lồi. Kết quả cho thấy đáp ứng hoặc sạch đáng kể ở 9 trong số 12 trường hợp; tuy nhiên không thể đánh giá kéo dài của đáp ứng này do thời gian theo dõi nghiên cứu không được chỉ định [59].
Một nghiên cứu quan sát tiền cứu đã khảo sát hiệu quả của nhũ tương triamcinolone ở 32 bệnh nhân sẹo phì đại và 9 bệnh nhân sẹo lồi. Sản phẩm được bôi hai lần một ngày trên các vết sẹo với một phần liền kề của tổn thương chưa được điều trị để hoạt động như vùng so sánh. Đánh giá được thực hiện bằng cách sử dụng thông số thang năm điểm (màu sắc, độ nhô cao, cấu trúc, ngứa và đau) và kết quả có lợi được xem xét nếu vết sẹo được cải thiện ít nhất 3/5. Ở nhóm sẹo phì đại, 84,4% cho thấy sự cải thiện, trong khi ở nhóm sẹo lồi, tỷ lệ đáp ứng là 44,5%. Tuy nhiên, tất cả các bệnh nhân đều giảm triệu chứng đau và ngứa [60]. Một trong những hạn chế chính của nghiên cứu là thời gian rất ngắn (tối đa 7 tháng), làm cho kết luận nào về giá trị của chế phẩm là thách thức.
Một báo cáo y văn khác đã nghiên cứu hiệu quả của phác đồ kết hợp giữa phẫu thuật cắt bỏ, tiêm steroid trong tổn thương (20 mg/mL triamcinolone acetonide) và bôi thuốc mỡ steroid [61]. Sau khi cắt bỏ hoàn toàn vết sẹo, mũi tiêm steroid đầu tiên được tiêm vào thời điểm cắt bỏ chỉ khâu (7 ngày sau phẫu thuật) và sau đó 2 tuần một lần trong 5 lần điều trị. Các sản phẩm thuốc mỡ steroid được sử dụng hai lần mỗi tuần trong 6 tháng sau khi cắt bỏ chỉ khâu (diflorasone diacetate: 2 tháng đầu, difluprednate: tháng thứ ba và thứ tư, betamethasone valerate: tháng thứ năm và thứ sáu).
Khi theo dõi trung bình 32 tháng, 14,3% sẹo lồi và 16,7% sẹo phì đại đã tái phát (được định nghĩa là độ cao da có thể thấy được tại vị trí cắt bỏ). Rõ ràng là bằng chứng từ tài liệu cho thấy việc sử dụng thuốc mỡ steroid cho các sẹo phì đại và sẹo lồi là rất yếu; điều này liên quan đến quy mô nhóm nghiên cứu nhỏ, tính chất không ngẫu nhiên của các báo cáo hiện có cũng như các khoảng thời gian theo dõi ngắn được sử dụng.
Băng steroid
Sử dụng steroid thẩm thấu qua da bằng băng dán được giới thiệu vào năm 1960 [62] và hiện có một số chỉ định trong điều trị sẹo, gồm [26, 63]:
- Điều trị đầu tiên cho sẹo lồi và sẹo phì đại kích thước nhỏ/mỏng.
- Sử dụng hỗ trợ khi sẹo thoái triển bằng tiêm steroid, xạ trị hoặc phẫu thuật.
- Dự phòng cho những bệnh nhân có nguy cơ cao bị sẹo phì đại bắt đầu ngay sau khi vết thương hoàn thành tái tạo biểu mô.
Băng steroid bao gồm một chất mang không hoạt tính về mặt dược lý (băng dính) và một thành phần steroid, khác nhau ở các nơi trên thế giới.
Tại Nhật Bản, có sản phẩm fludroxycortide 4 pg/cm2 (hiệu lực trung bình) và 20 pg/cm2 deprodone propionate (hiệu lực cao), trong khi ở Mỹ và Anh chỉ có sản phẩm có hiệu lực trung bình – 4 pg/cm2 flurandrenolide (Mỹ) và fludroxycortide (Anh). Băng steroid được dán lên sẹo với mức chồng tối thiểu lên vùng da bình thường. Bệnh nhân có thể thực hiện vệ sinh cá nhân như bình thường và chỉ cần vuốt nhẹ vùng khô trên băng, nên thay băng trong vòng 48 giờ để duy trì hiệu quả sinh học của băng [26].
Cơ chế hoạt động của các băng dán liên quan cùng với các tác dụng dược lý được của steroid trên mô sẹo, về các tác dụng không phải dược lý của băng dán gồm:
- Bít tắc. Người ta đã công nhận rằng bít tắc làm tăng hấp thu steroid qua da. Các cơ chế được đề xuất cho hiệu quả điều trị của bít tắc gồm duy trì độ ẩm lớp sừng cũng như giữ nhiệt bên dưới băng [64, 65]. Điều thú vị là các nghiên cứu đã xác nhận rằng sự bít tắc hoàn toàn là không cần thiết để hiệu ứng sinh lý này xảy ra; băng bán tắc có thể làm trung gian hiệu ứng này và có lợi thế là ngăn ngừa một số tác dụng phụ, bao gồm cảm giác đau rát và kích ứng da [66, 67].
- Sự co mạch. Một trong những cơ chế hoạt động chính của steroid liên quan đến tác dụng tăng hoạt mạch mạnh, có vẻ như tăng thêm do sự bít tắc. Sự co mạch được cho là qua trung gian các thụ thể glucocorticoid ảnh hưởng đến một số con đường có thể xảy ra, bao gồm giải phóng norepinephrine cục bộ, chức năng tế bào mast ở da và hoạt động của phospholipase A [23-27].
- Hỗ trợ sẹo. Người ta chấp nhận rằng sức căng trên vết sẹo có thể là một yếu tố góp phần dẫn đến phì đại; do đó sự hỗ trợ cơ học do băng dán tác động có thể góp phần vào sự hình thành của sẹo lồi và sẹo phì đại hoạt động trên các con đường dẫn truyền cơ học phức tạp trong mô sẹo [68].
Băng dán steroid được giới thiệu dựa trên một số đặc tính có lợi so với thuốc tiêm/ thuốc mỡ steroid, bao gồm [69]:
- Dễ sử dụng.
- Bản chất không xâm lấn so với chế phẩm tiêm.
- Tăng hấp thụ do sự bít tắc.
- Bảo vệ khỏi kích ứng cơ học.
- Kiểm soát việc phân phối thuốc; một trong những ưu điểm lý thuyết của sản phẩm dạng băng là tránh được các đỉnh và đáy của nồng độ steroid khi sử dụng định kỳ dạng thuốc tiêm. Việc cung cấp thuốc liên tục có thể rất quan trọng trong việc kiểm soát biểu hiện viêm của sẹo từ trung tâm sẹo đến sinh lý sẹo lồi và sẹo phì đại [70, 71].
- Cơ sở bằng chứng cho việc sử dụng băng steroid trong điều trị sẹo
Việc sử dụng băng steroid trên sẹo lồi và sẹo phì đại được báo cáo lần đầu tiên trong y văn Anh vào năm 1967 trong một nhóm gồm 285 bệnh nhân bị bệnh da liễu [61]. Sau đó, một số báo cáo bổ sung đã cung cấp bằng chứng sơ bộ hỗ trợ việc sử dụng băng steroid trong lĩnh vực điều trị sẹo.
Một nghiên cứu trên 74 bệnh nhân mắc các bệnh về da khác nhau bao gồm cả sẹo phì đại / sẹo lồi đã khảo sát tác dụng của băng flurandrenolide (4 pg/cm2). Thời gian sử dụng băng cho mỗi nhóm thay đổi từ 12 giờ đến 7 ngày. Mười chín bệnh nhân bị sẹo phì đại (được định nghĩa là sẹo xuất hiện dưới 12 tháng) và được điều trị trong khoảng thời gian từ 2 đến 120 ngày (trung bình là 51 ngày). Đáp ứng xuất sắc (biến mất hoàn toàn sẹo quá mức) được thấy ở tám bệnh nhân, trong khi đáp ứng tốt được thấy ở mười và một phần ở bốn bệnh nhân. Trong nhóm sẹo lồi (được định nghĩa là thời gian sẹo trên 12 tháng) gồm 12 bệnh nhân được điều trị trong thời gian từ 7 đến 288 ngày (trung bình 77 ngày). Hai bệnh nhân có kết quả xuất sắc và bốn bệnh nhân có kết quả tốt, trong khi sự cải thiện một phần được quan sát thấy ở bốn bệnh nhân. Tác giả của báo cáo này kết luận rằng “những cá nhân có sự cải thiện một phần và tốt trong nhóm sẹo phì đại có thể được chuyển đổi thành loại xuất sắc bằng cách kiên trì sử dụng băng dán thường xuyên hơn và bằng cách tăng thời gian điều trị”. Hơn nữa, đối với những trường hợp sẹo lồi đã được định hình rõ, cần thời gian điều trị dài [72].
Một thử nghiệm lâm sàng khác tại Bệnh viện Glasgow Western, Vương quốc Anh, đã đánh giá việc sử dụng băng steroid trên 11 sẹo lồi trong một nhóm 40 bệnh nhân bị nhiều loại bệnh da liễu. Độ tuổi của nhóm sẹo lồi là từ 2 đến 76 tuổi và băng được dán trong 12-24 giờ một ngày trong suốt 18 tháng thử nghiệm. Diện tích dán băng trong hầu hết các trường hợp nhỏ hơn 0,5% tổng diện tích bề mặt cơ thể (total body surface area, TBSA) và chỉ có hai trẻ em có tới 5% TBSA được điều trị bằng băng steroid. Tác giả của thử nghiệm này nói rằng “đáp ứng hài lòng nhất đối với dùng băng dán là ở những trường hợp bị sẹo lồi, đặc biệt là trẻ em’. Phần lớn các sẹo được cải thiện bằng cách trở nên phẳng hơn và nhạt hơn so với vùng da xung quanh và các vết mẩn đỏ và kích ứng biến mất ở những bệnh nhân bị ảnh hưởng nặng nhất [73].
Việc sử dụng băng steroid cũng đã được nghiên cứu trong những năm gần đây ở các tài liệu Nhật Bản. Một thử nghiệm mở sử dụng miếng dán deprodone propionate cho một nhóm lớn bệnh nhân mắc các bệnh da liễu bao gồm 24 sẹo phì đại và 30 sẹo lồi có độ tuổi từ 10 đến 70 tuổi. (Băng được dán trong 15 giờ một ngày trong vòng 6 tuần và kết quả được đánh giá dựa trên các báo cáo chủ quan của bác sĩ). Băng dán được thấy rất hiệu quả ở 3 bệnh nhân, có hiệu quả ở 21 bệnh nhân, trong khi đáp ứng ít ở 18 bệnh nhân và không có đáp ứng ở 12 bệnh nhân [74].
Một báo cáo khác đã đánh giá việc sử dụng băng dán fludroxycortide ở 60 sẹo phì đại và sẹo lồi ở 30 bệnh nhân trưởng thành (tuổi trung bình: 37 tuổi, từ 23-67) và 30 bệnh nhân trẻ em (tuổi trung bình: 7,2 tuổi, từ 2-15 tuổi). Các vết sẹo trên 1 năm và được băng dán được dùng ít nhất 1 năm trong 24 giờ/ngày; TBSA chính xác không được cụ thể trong nghiên cứu.
Trong đo lường kết quả, thang đo của Japan Scar Workshop được sử dụng; dựa trên các yếu tố nguy cơ cũng như các triệu chứng của sẹo để xác định điểm từ 0 đến 25 (điểm càng cao thì càng có nhiều sẹo được coi là thuộc nhóm phì đại / sẹo lồi). 20% người lớn và 80% bệnh nhi được cải thiện với băng fludroxycortide từ 18 đến dưới 2 điểm trên thang điểm (sẹo gần như trưởng thành). Phân nhóm người lớn không đáp ứng được bắt đầu sử dụng deprodone proprionate sau 12 tháng dùng băng có hiệu lực trung bình, và kết quả là 17 trong số 24 trường hợp được cải thiện dưới hai điểm (70,8%). Bằng chứng xuất phát từ báo cáo này cho thấy rằng bệnh nhân người lớn được hưởng lợi từ băng dán có hiệu lực mạnh hơn để đạt được đáp ứng điều trị thỏa đáng, trong khi băng hiệu lực trung bình (fludroxycortide) có vẻ đủ dùng cho trẻ em; Phát hiện này có thể liên quan đến việc giảm độ dày của da trong thời thơ ấu [26].
Tác dụng phụ. Năm tác dụng phụ tại chỗ được báo cáo phổ biến nhất của băng steroid theo thứ tự tần suất giảm trung bình [33]:
- Cảm giác bỏng / châm chích: 12,21%.
- Viêm da tiếp xúc: 11%.
- Kích ứng da tại chỗ: 10,6%.
- Viêm nang lông: 8,79%.
- Sự hình vết trợt: 4,9%.
Một trong những câu hỏi về việc sử dụng băng steroid để trị sẹo liên quan đến tổng diện tích bề mặt cơ thể tối đa và thời gian sử dụng trước khi các tác dụng phụ toàn thân có thể phát triển. Một cuộc tìm kiếm cơ sở dữ liệu (nhóm nghiên cứu không sẹo) cho đến nay đã tiết lộ rằng có một nghiên cứu đơn cấp một ở bệnh nhân vẩy nến, cho thấy rằng liệu trình điều trị trong 2 tuần với việc sử dụng băng dán flurandrenolide hiệu lực trung bình kéo dài 24 giờ (4 microgram/cm2) có hiệu quả mà không có bất kỳ tác dụng phụ toàn thân nào được báo cáo [75].
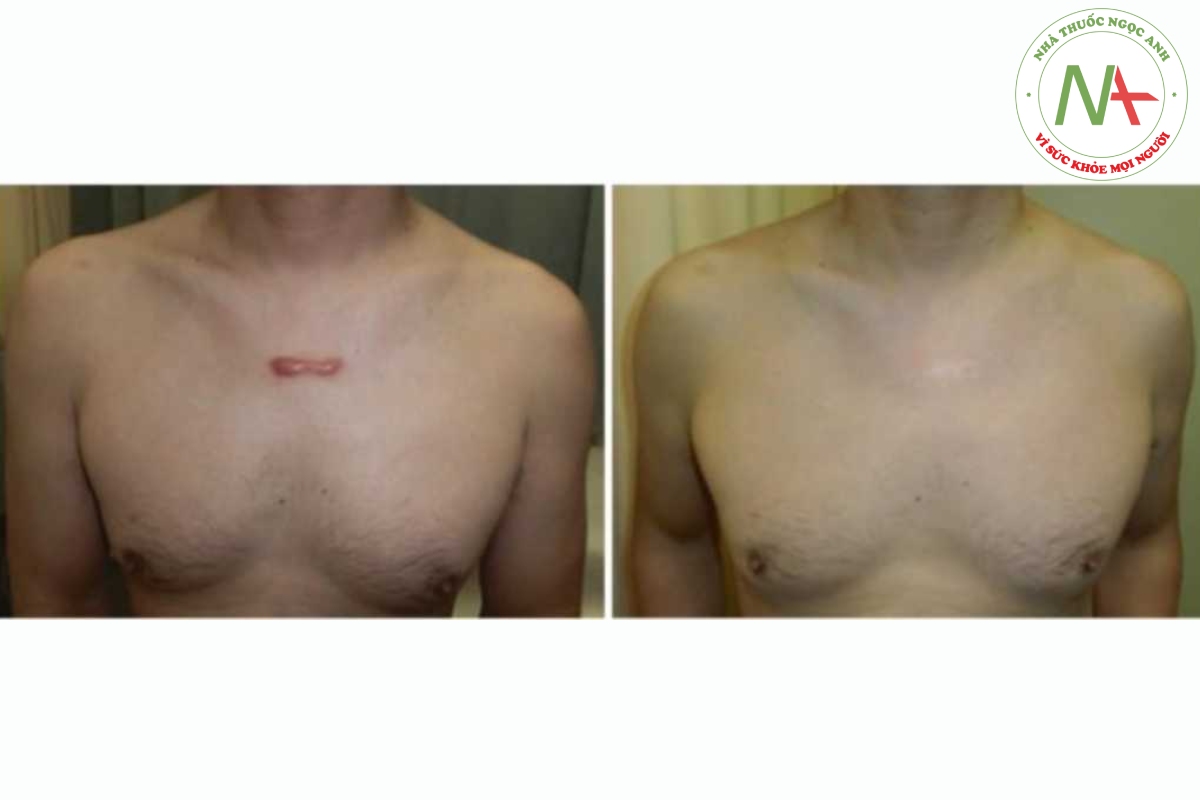
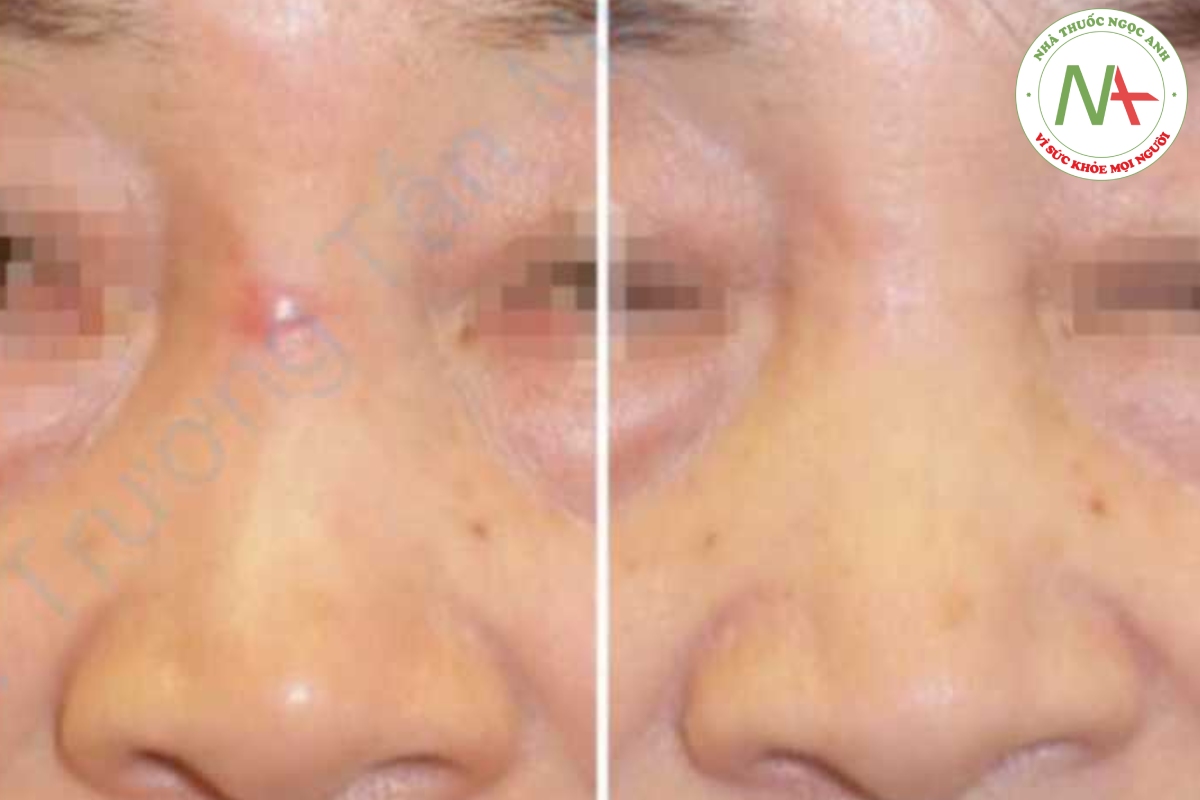
Dựa trên dữ liệu có sẵn từ các nghiên cứu cụ thể về sẹo, có vẻ như việc sử dụng băng dán hiệu lực trung bình hàng ngày (ví dụ 4 microgam/cm2) cho các sẹo phì đại và sẹo lồi có kích thước nhỏ lên đến 5% TBSA trong ít nhất 6-8 tuần là không có báo cáo tác dụng phụ toàn thân; Điều thú vị nhất là ấn phẩm gần đây nhất của Nhật Bản báo cáo việc sử dụng băng dán fludroxycortide trong ít nhất 1 năm ở nhóm nghiên cứu hỗn hợp người lớn và trẻ em mà không có báo cáo liên quan nào về độc tính [26].
Kết luận, tổng quan tài liệu cho thấy rằng sau đỉnh cao của hoạt động nghiên cứu vào những năm 1960 và 1970, hiện đang có mối quan tâm mới đối với việc sử dụng băng dán steroid trong điều trị sẹo, đặc biệt là ở Phương Đông (Nhật Bản) nơi băng dán steroid đại diện cho tiêu chuẩn chăm sóc chính [ 26]. Các nghiên cứu hiện có sẵn bao gồm các nghiên cứu quan sát không kiểm soát với kết quả do bác sĩ hoặc bệnh nhân báo cáo và một trong những yếu tố hạn chế đối với việc áp dụng rộng rãi băng dán là thiếu dữ liệu hấp thụ cho bệnh nhân người lớn và trẻ em. Tuy nhiên, bằng chứng sơ bộ cho thấy băng dán steroid là sản phẩm hỗ trợ thân thiện với bệnh nhân và ít rủi ro để điều trị sẹo trong các trường hợp sẹo phì đại và sẹo lồi được lựa chọn phù hợp.
Sự phát triển về vai trò của steroid trong các phác đồ điều trị sẹo
Steroid đã là một phần không thể thiếu trong các phương pháp điều trị sẹo trong những thập kỷ qua; tuy nhiên, vai trò của chúng đã phát triển liên quan đến việc chúng đại diện cho các lựa chọn đầu tay hay thứ hai và việc sử dụng chúng như một phương thức riêng biệt hoặc kết hợp trong điều trị sẹo.
Năm 2002, một tuyên bố đồng thuận từ hội đồng cố vấn quốc tế về điều trị sẹo đã được công bố và khuyến nghị sử dụng tiêm steroid trong tổn thương để dự phòng chống lại sự hình thành sẹo phì đại; chúng có thể được sử dụng đồng thời với các chỉ định đầu tay (băng dán / tấm silicone không gây dị ứng) trong những trường hợp nghiêm trọng của sẹo phì đại tuyến tính đã hình thành. Đối với sẹo lồi, khuyến cáo kết hợp giữa miếng dán gel silicon và steroid trong tổn thương; trong trường hợp không cải thiện được lâm sàng, phẫu thuật với steroid và silicone theo sau đã được đề xuất [28].
Vào năm 2013, các hướng dẫn riêng cho bệnh nhân châu Á đã được xuất bản và những người này đồng tình về việc sử dụng steroid như một liệu pháp thứ hai cho các sẹo phì đại, sau khi thử nghiệm các sản phẩm silicone. Về sẹo lồi, steroid được đề xuất là chỉ định đầu tiên (có thể là đơn trị liệu để kiểm soát triệu chứng hoặc hỗ trợ cho phẫu thuật cắt bỏ) [76].
Trong năm 2014, một cuộc đánh giá lại quy trình đã được thực hiện bởi ban cố vấn về điều trị sẹo; công trình đã củng cố vị trí nổi bật của steroid trong điều trị sẹo, tuy nhiên đã sửa đổi các khía cạnh khác nhau của các khuyến nghị trước đó như được mô tả dưới đây [77, 78]:
- Đối với sẹo phì đại nghiêm trọng, nên phẫu thuật cắt bỏ và đồng thời tiêm triamcinolone và các mũi tiêm sau đó hàng tháng được khuyến khích. Một chiến lược được đề xuất bổ sung cho nhóm nhỏ sẹo này, là sự kết hợp của TAC với 5-fluorouracil (5-FU) được lặp lại hàng tháng.
- Đối với sẹo lồi nhỏ, khuyến cáo đầu tiên là steroid cùng với tấm/gel silicon và trong những trường hợp kháng trị, phương pháp kết hợp với 5-FU đã được đưa ra.
- Đối với sẹo lồi lớn, steroid tiêm trong tổn thương cùng với hoặc không kèm theo phương pháp áp lạnh bổ trợ được khuyến cáo đầu tiên và kết hợp steroid và 5FU như là phương pháp thứ hai.
Các tác giả của công trình này nhấn mạnh sự cần thiết phải sử dụng kết hợp các tác nhân để mang lại khả năng tối đa cho việc điều trị sẹo thành công và đề xuất việc áp dụng bổ sung công nghệ laser fractional bóc tách kết hợp với triamcinolone như một liệu pháp hiệu quả, an toàn để điều trị sẹo. Họ cũng ủng hộ việc sử dụng liều thấp steroid trong nỗ lực để giúp giảm thiểu các tác dụng phụ, bao gồm teo da, giãn mạch và giảm sắc tố.
Vào năm 2014, các hướng dẫn đồng thuận của Châu Âu về điều trị sẹo lồi và sẹo phì đại đã chấp nhận việc sử dụng steroid như là lựa chọn thứ hai để điều trị sẹo phì đại tuyến tính (sau 6 tháng điều trị bằng các sản phẩm silicone và băng ép) và khuyến nghị liều 40 mg/mL TAC ở mức 2 -4 tuần. Đối với sẹo phì đại rộng, việc sử dụng tiêm corticosteroid nên bắt đầu sớm hơn (6 tuần sau chấn thương) và kết hợp với các thuốc khác như 5-FU để điều trị sẹo kháng trị. Liên quan đến sẹo lồi, tiêm steroid trong tổn thương được khuyến cáo nên bắt đầu từ 4 tuần kết hợp với các thuốc khác như 5-FU bên cạnh các điều trị đầu tay (silicone và băng ép) [79]. Rõ ràng là steroid giữ một vị trí trung tâm trong các quy trình điều trị sẹo trên thế giới và xu hướng hiện tại tập trung vào việc tối đa hóa lợi ích của việc sử dụng steroid và giảm thiểu tác dụng phụ thông qua phương pháp kết hợp với các biện pháp bổ trợ khác bao gồm laser và hóa chất trị liệu.
=> Tham khảo: Tổng quan về liệu pháp laser trong điều trị sẹo.
Bằng chứng so sánh việc sử dụng steroid trong điều trị sẹo
Bằng chứng từ các hiểu biết hiện tại cho thấy steroid đại diện cho một chất hỗ trợ có giá trị để điều trị sẹo. Sẽ thú vị khi xem so sánh steroid với các phương thức được áp dụng rộng rãi khác theo các bằng chứng trong tài liệu có sẵn.
Steroid và xạ trị
Một thử nghiệm ngẫu nhiên có đối chứng đã khảo sát tỷ lệ tái phát sau khi cắt bỏ sẹo lồi ở dái tai (N = 31) với tiêm corticosteroid (1-4 lần tiêm sau phẫu thuật 0,4 mL triamcinolone 40 mg/mL) so với xạ trị (7-10 Gy X-quang hoặc chùm điện tử bề mặt). Theo dõi tối thiểu 12 tháng, tỷ lệ tái phát sau phẫu thuật và xạ trị là 12,5% so với 33% sau phẫu thuật và tiêm steroid. Mặc dù không quan sát thấy sự khác biệt có ý nghĩa thống kê trong nghiên cứu, nhưng xạ trị có vẻ hiệu quả hơn tiêm steroid trong việc ngăn ngừa tái phát sẹo lồi. Ngoài ra, nhóm nghiên cứu xạ trị cho thấy sự tuân thủ tốt hơn so với nhóm tiêm corticosteroid [80].
Trong một thử nghiệm ngẫu nhiên có đối chứng khác gồm 58 sẹo lồi và 42 sẹo phì đại, một số nhóm điều trị đã được đánh giá như sau:
- Chỉ bức xạ beta (16 Gy trên 4 phần nhỏ) (N = 58).
- Chỉ tiêm triamcinolone trong tổn thương với bốn lần tiêm cách nhau 1-2 tuần (20-120 mg tùy thuộc vào kích thước mỗi liệu trình) (N = 17).
- Phẫu thuật cắt bỏ và chiếu xạ trước và sau phẫu thuật (N = 15).
- Phẫu thuật cắt bỏ và chiếu xạ sau phẫu thuật (15KS).
So sánh giữa hai phân nhóm đầu tiên cho thấy rằng steroid góp phần làm giảm triệu chứng tốt hơn mặc dù không có ý nghĩa thống kê; đáp ứng về giảm độ dày sẹo nổi bật hơn đáng kể ở nhóm dùng steroid [25]. Nghiên cứu có một số hạn chế gồm kích thước mẫu nhỏ và thiếu phân bổ làm mù giữa các nhóm, điều này làm cho các kết luận xác thực trở nên khó khăn.
Steroid và phương pháp áp lạnh
Phương pháp áp lạnh sử dụng thiết bị phun hoặc đầu dò đưa vào tổn thương để tạo ra hoại tử do lạnh trong mô sẹo. Phương thức này đã được kết hợp với tiêm steroid trong một số ít nghiên cứu; Cơ sở lý luận của phương pháp này phụ thuộc vào liệu pháp áp lạnh tạo ra phù nề và phá vỡ tế bào, do đó tạo điều kiện thuận lợi cho việc sử dụng steroid sau đó.
Một nghiên cứu RCT nhỏ (n = 11) với thời gian theo dõi ngắn (8 tuần) cho thấy phương pháp áp lạnh có hiệu quả hơn triamcinolone về mặt làm phẳng sẹo mạch máu ‘sớm’ [81]. Một nghiên cứu khác cũng đồng tình về tác dụng hiệp đồng của phương pháp áp lạnh và tiêm TAC 10-20 mg/mL; tuy nhiên, các tác giả báo cáo rằng cần phải tiêm nhiều mũi để đạt được hiệu quả điều trị, điều này trở nên rõ ràng sau 8 tuần sau khi điều trị [35].
Steroid và 5FU
Five-fluorouracil (5-FU) là một chất tương tự pyrimidine, ức chế tổng hợp axit deoxyribonucleic thông qua ức chế tổng hợp thymidine. Ngoài ra, biểu hiện gen collagen loại I và tác động của yếu tố tăng trưởng khối u beta được cho là bị cản trở, và kết quả là các tế bào đang phân chia nhanh chóng bị dừng lại và thúc đẩy quá trình phá vỡ sẹo [82].
Một RCT so sánh tiêm hàng tuần 50 mg/mL 5-FU với 40 mg mL triamcinolone ở 44 bệnh nhân bị sẹo lồi. Cả hai phác đồ đều có hiệu quả như nhau trong việc giảm khối lượng sẹo lồi nhưng tác dụng phụ ở nhóm 5-FU (đau và loét bề mặt) nặng hơn rõ rệt [83]. Kết quả tương tự cũng thu được trong một thử nghiệm so sánh khác về tiêm 5-FU 50mg/mL hàng tuần so với 40 mg/mL TAC ở 30 bệnh nhân bị sẹo lồi trong 4 tuần. Một sự khác biệt có ý nghĩa thống kê đã được nhìn thấy về mức độ làm phẳng nghiêng về 5-FU (87% so với 64%) với tỷ lệ biến chứng cao hơn (tuy nhiên không có ý nghĩa thống kê) [84].
Một số nghiên cứu đã nghiên cứu về lợi ích điều trị và các tác dụng phụ của việc sử dụng steroid và 5FU kết hợp. Một thử nghiệm với 150 bệnh nhân đã đánh giá kết quả của 0,25 mL 40 mg/mL TAC pha loãng với 0,75 mL nước muối thông thường hoặc 0,9 mL 50 mg/mL 5-FU trộn với 0,1 mL TAC 40 mg/mL. Một sự cải thiện đáng kể đã được thấy ở bệnh nhân 5-FU/TAC so với đơn trị liệu TAC (84% so với 68%) và không có báo cáo về sẹo tái phát sau 6 tháng theo dõi. Tuy nhiên, tỷ lệ biến chứng ở nhóm phối hợp lại cao hơn (24% so với 8%) [85].
Trong một thử nghiệm lâm sàng mù đôi kéo dài 12 tuần trên 40 sẹo lồi và sẹo phì đại, các bệnh nhân được chọn ngẫu nhiên để được tiêm hàng tuần 10 mg TAC hoặc hỗn hợp 4 mg TAC và 45 mg 5-FU cho tám lần điều trị. Sự giảm chiều dài, chiều rộng, chiều cao, ban đỏ và độ cứng có ý nghĩa thống kê nghiêng về nhóm kết hợp. Cả bệnh nhân và quan sát viên đều đánh giá cao hơn đối với nhóm TAC/5-FU, chỉ kết quả do bệnh nhân báo cáo đạt ý nghĩa thống kê (20% so với 55%, p = 0,02) [86]. Tính ưu việt của sự kết hợp 5-fluorouracil và triamcinolone trong điều trị sẹo được chứng minh trong các nghiên cứu sâu hơn về hiệu quả cao hơn và thông tác dụng phụ tốt hơn, cụ thể là các thay đổi về ban đỏ và viêm (giảm trung bình 92% kích thước tổn thương khi kết hợp so với 73% với đơn trị liệu steroid) trong một số nghiên cứu khác [82, 87].
Steroid và Laser
Một nghiên cứu RCT đã so sánh các phương pháp điều trị sẹo phì đại và sẹo lồi sau đây:
- Laser PDL (585 nm 5 J/cm2).
- Tiêm triamcinolone trong tổn thương (20 mg/mL mỗi 4 tuần với 6 lần điều trị), 5-FU tiêm trong tổn thương (50 mg/mL với mười lần điều trị).
- Hỗn hợp (1 mg/mL triamcinolone trộn với 45 mg/mL 5-FU cho 10 lần điều trị).
Là một phần của nghiên cứu, một phần của vết sẹo không được điều trị để đối chứng. Có sự cải thiện lâm sàng có ý nghĩa thống kê ở tất cả các phần được điều trị nhưng không có sự khác biệt đáng kể về kết quả (chiều cao sẹo / ban đỏ) được ghi nhận đối với một phương pháp cụ thể [88]. Các tác dụng ngoại ý (giảm sắc tố, giãn mạch và teo da) đã được quan sát thấy ở 50% các phần được điều trị bằng tiêm steroid đơn thuần. Hạn chế của nghiên cứu bao gồm kích thước mẫu nhỏ, thời gian theo dõi hạn chế trong 32 tuần, không có báo cáo về kỹ thuật ngẫu nhiên hoặc về việc có đánh giá kết quả mù hay không.
Trong một thử nghiệm mù đơn kéo dài 12 tuần, 69 bệnh nhân (sẹo lồi và sẹo phì đại) được chia ngẫu nhiên thành ba nhóm nghiên cứu:
- Nhóm 1 (10 mg/mL TAC cách nhau hàng tuần trong 8 tuần).
- Nhóm 2 (0,1 mL TAC và 0,9 mL 50 mg/mL 5-FU cách nhau hàng tuần trong 8 tuần).
- Nhóm 3 (như nhóm 2 và laser PDL 585 nm: 5-7 J/cm2 ở tuần thứ 1, 4 và 8).
Cuối nghiên cứu (12 tuần), sự cải thiện ở nhóm 2 và 3 được ghi nhận là có ý nghĩa thống kê bởi người quan sát mù trái ngược với nhóm 1 (lần lượt là 40% và 70% so với 25%). Cả bệnh nhân và người quan sát mù báo cáo về cải thiện tốt đến xuất sắc (cải thiện> 50%) đều nghiêng về nhóm 2 và 3 có ý nghĩa thống kê, cho thấy hiệu quả đầy hứa hẹn của laser trong nhóm sẹo hỗn hợp (phì đại và sẹo lồi) này [89] .
Một báo cáo y văn khác đã so sánh các vết sẹo được điều trị bằng laser PDL có và không có tiêm steroid trong tổng số 22 bệnh nhân nữ có sẹo phì đại hai bên vú (thời gian sẹo trung bình là 18,5 tháng, từ 4-72). Bệnh nhân có một vết sẹo dưới vú được điều trị bằng laser đơn độc, trong khi bên cạnh được điều trị bổ sung bằng corticosteroid (10-20 mg) với 2 buổi và khoảng cách điều trị 6 tuần. Đánh giá được thực hiện trước và 6 tuần sau lần điều trị thứ hai và cuối cùng bởi hai chuyên gia đánh giá độc lập cũng như một bác sĩ da liễu. Kết quả cho thấy rằng việc điều trị sẹo bằng laser tạo ra sự cải thiện đáng kể về mặt lâm sàng và mô học trong tất cả các phẫu thuật, trong khi việc sử dụng corticosteroid không cải thiện đáng kể kết quả lâm sàng ngoài việc giảm ngứa ở các sẹo có triệu chứng. Những kết quả này có thể phản ánh liều steroid thấp được sử dụng trong nghiên cứu [90].
Nhiều chiến lược đã được áp dụng để tăng cường phân phối steroid tại chỗ vào mô sợi sẹo bao gồm kỹ thuật phân phối có hỗ trợ bằng laser (L.A.D.), tận dụng sự giảm hàng rào tạm thời do các phương thức quang nhiệt phân đoạn bóc tách và không bóc tách khác nhau. Một số trường hợp gồm 15 bệnh nhân có sẹo phì đại đã sử dụng kết hợp sử dụng laser phân đoạn bóc tách và bôi triamcinolone (10-20 mg/mL) trong cùng một đợt điều trị. Kết quả chỉ ra rằng sau 3-5 lần điều trị cách nhau 2-3 tháng, có sự cải thiện tổng thể về các thông số sẹo, với kết cấu cho thấy mức độ cải thiện đáng kể nhất và rối loạn sắc tố ít thay đổi nhất [91].
Martin và cộng sự kết hợp laser fractional CO2 (10.600 nm), laser PDL (585 nm) với tiêm triamcinolone (40 mg/mL) hàng tháng trong bảy buổi để điều trị sẹo lồi cho kết quả tốt với độ phẳng tối thiểu, giảm ngứa và sắc tố nhẹ hơn tuy nhiên ít ảnh hưởng đến kích thước [92]. Son và cộng sự cho thấy 42% bệnh nhân đã cải thiện hơn 75% sau khi điều trị sẹo lồi và sẹo phì đại bằng laser đồng bromua 578 nm kết hợp với tiêm steroid (10 mg/mL triamcinolone) cách nhau 4 tuần [93]. Các chỉ số bao gồm ban đỏ, ngứa và giãn mạch. Rõ ràng rằng việc phân phối steroid có hỗ trợ bằng laser cho các tổn thương sẹo là một phương thức đầy hứa hẹn, tuy nhiên cần được đánh giá thêm.
Kết luận
Sử dụng steroid vẫn là phương thức chính để điều trị sẹo phì đại và sẹo lồi trong nhiều thập kỷ qua. Phương thức phổ biến nhất trên thế giới là tiêm trong tổn thương, sau đó là qua da (băng dán) cũng như các phương thức được hỗ trợ bằng laser đang phát triển. Cần có các nghiên cứu so sánh có chất lượng cao hơn nữa để xác định giá trị chính xác của các chế phẩm steroid khác nhau như các chiến lược độc lập và kết hợp trong các phác đồ điều trị sẹo.
Tài liệu tham khảo
- Behrman HT, Goodman JJ. Skin complications of cortisone and ACTH therapy. JAMA.1950;144(3):218-21.
- Baker BL, Whitaker WL. Interference with wound healing by the local action of adrenocortical steroids. Endocrinology. 1950;46(6):544-51.
- Polson JS, et al. Keloid. Can Med Assoc J. 1951;65(5):447-9.
- Conway H, Stark RB. ACTH in plastic surgery. Plast Reconstr Surg (1946). 1951;8(5):354-77.
- Goldman L, Thompson RG, Trice ER. Cortisone acetate in skin disease; local effect in the skin from topical application and local injection. AMA Arch Derm Syphilol. 1952;65(2):177-86.
- Coste F, Piguet B, Civitte J, Degos R, Vial-Weissenbach V, Grupper C. Traitement de Chelloides par Injections Locales d’Hydrocortisone. Trans Soc Franc de Derm et de Syph Presse med. 1953;61:1157.
- De Kleine EH. Observations on the effect of cortisone on wound healing and scar formation. Plast Reconstr Surg. 1954;88:429.
- Hollander A. Intralesional injections of triamcinolone acetonide; a therapy for dermatoses. Antibiotic Med Clin Ther (New York). 1961;8:78-83.
- Murray RD. Kenalog and the treatment of hypertrophied scars and keloids in Negroes and whites. Plast Reconstr Surg. 1963;31:275-80.
- Maguire HC Jr. Treatment of keloids with triamcinolone acetonide injected intralesionally. JAMA. 1965;192:325-6.
- Griffith BH. The treatment of keloids with triamcinolone acetonide. Plast Reconstr Surg. 1966;38(3):202-8.
- Minkowitz F. Regression of massive keloid following partial excision and post-operative intralesional administration of triamcinolone. Br J Plast Surg. 1967;20(4):432-5.
- Jalali M, Bayat A. Current use of steroids in management of abnormal raised skin scars. Surgeon. 2007;5(3):175-80.
- McMaster A, Ray DW. Drug insight: selective agonists and antagonists of the glucocorticoid receptor. Nat Clin Pract Endocrinol Metab. 2008;4(2):91-101.
- Kang N, Sivakumar B, Sanders R, Nduka C, Gault D. Intralesional injections of collagenase are ineffective in the treatment of keloid and hypertrophic scars. J Plast Reconstr Aesthet Surg. 2006;59(7):693-9.
- McCoy BJ, Diegelmann RF, Cohen IK. In vitro inhibition of cell growth, collagen synthesis, and prolyl hydroxylase activity by triamcinolone acetonide. Proc Soc Exp Biol Med. 1980;163(2):216-22.
- Ogawa R. Keloid and hypertrophic scars are the result of chronic inflammation in the reticular dermis. Int J Mol Sci. 2017;18(3):E606.
- Lawrence WT. In search of the optimal treatment of keloids: report of a series and a review of the literature. Ann Plast Surg. 1991;27(2):164-78.
- Doggrell SA. Triamcinolone: new and old indications. Expert Opin Pharmacother. 2001;2(7):1177-86.
- Lucky AW. Principles of the use of glucocorticosteroids in the growing child. Pediatr Dermatol. 1984;1:226-35.
- Grumbine N, Dobrowolski C, Bernstein A. Retrospective evaluation of postoperative intralesional steroid injections on wound healing. J Foot Ankle Surg. 1998;37(2):135-44. discussion 74.
- Brissett AE, Sherris DA. Scar contractures, hypertrophic scars, and keloids. Facial Plast Surg. 2001;17(4):263-72.
- Kill J. Kleoids treated with topical injections of triamcinolone acetonide (Kenalog). Scand J Plast Reconsrt Surg. 1977;11:169-72.
- Fredman R, Tenenhaus M. Cushing’s syndrome after intralesional triamcinolone acetonide: a systematic review of the literature and multinational survey. Burns. 2013;39(4):549-57.
- Darzi MA, Chowdri NA, Kaul SK, Khan M. Evaluation of various methods of treating keloids and hypertrophic scars: a 10-year follow-up study. Br J Plast Surg. 1992;45(5):374-9.
- Ogawa R, Akaishi S, Kuribayashi S, Miyashita T. Keloids and hypertrophic scars can now be cured completely: recent progress in our understanding of the pathogenesis of keloids and hypertrophic scars and the most promising current therapeutic strategy. J Nippon Med Sch. 2016;83(2):46-53.
- Mustoe TA, Cooter RD, Gold MH, Hobbs FD, Ramelet AA, Shakespeare PG, et al. International clinical recommendations on scar management. Plast Reconstr Surg. 2002;110(2):560-71.
- Ardehali B, Nouraei SA, Van Dam H, Dex E, Wood S, Nduka C. Objective assessment of keloid scars with three-dimensional imaging: quantifying response to intralesional steroid therapy. Plast Reconstr Surg. 2007;119(2):556-61.
- Kelly AP. Update on the management of keloids. Semin Cutan Med Surg. 2009;28(2):71- 6.
- Rutkowski D, Syed F, Matthews LC, Ray DW, McGrouther DA, Watson RE, et al. An abnormality in glucocorticoid receptor expression differentiates steroid responders from nonresponders in keloid disease. Br J Dermatol. 2015;173(3):690-700.
- Gupta S, Sharma VK. Standard guidelines of care: keloids and hypertrophic scars. Indian J Dermatol Venereol Leprol. 2011;77(1):94-100.
- Mandal A, Imran D. Painless steroid injections for hypertrophic scars and keloids. Br J Plast Surg. 2003;56(1):79.
- Vallis CP. Intralesional injection of keloids and hypertrophic scars with the Dermo-Jet. Plast Reconstr Surg. 1967;40(3):255-62.
- Ono N. Pain-free intralesional injection of triamcinolone for the treatment of keloid. Scand J Plast Reconstr Surg Hand Surg. 1999;33(1):89-91.
- Ceilley RI, Babin RW. The combined use of cryosurgery and intralesional injections of suspensions of fluorinated adrenocorticosteroids for reducing keloids and hypertrophic scars. J Dermatol Surg Oncol. 1979;5(1):54-6.
- Zuber TJ, DeWitt DE. Earlobe keloids. Am Fam Physician. 1994;49(8):1835-41.
- Muneuchi G, Suzuki S, Onodera M, Ito O, Hata Y, Igawa HH. Longterm outcome of intralesional injection of triamcinolone acetonide for the treatment of keloid scars in Asian patients. Scand J Plast Reconstr Surg Hand Surg. 2006;40(2):111 – 6.
- Boyadjiev C, Popchristova E, Mazgalova J. Histomorphologic changes in keloids treated with Kenacort. J Trauma. 1995;38(2):299-302.
- Brown LA Jr, Pierce HE. Keloids: scar revision. J Dermatol Surg Oncol. 1986;12(1):51- 6.
- Barton RP. Auricular keloids: a simple method of management. Ann R Coll Surg Engl. 1978;60(4):324-5.
- Donkor P. Head and neck keloid: treatment by core excision and delayed intralesional injection of steroid. J Oral Maxillofac Surg. 2007;65(7):1292-6.
- Tang YW. Intra- and postoperative steroid injections for keloids and hypertrophic scars. Br J Plast Surg. 1992;45(5):371-3.
- Golladay ES. Treatment of keloids by single intraoperative perilesional injection of repository steroid. South Med J. 1988;81(6):736-8.
- Tripoli M, Cordova A, Melloni C, Zabbia G, Maggì F, Moschella F. The use of triamcinolone combined with surgery in major ear keloid treatment: a personal two stages approach. Eur J Plast Surg. 2015;38(3):20s-10.
- Chowdri NA, Masarat M, Mattoo A, Darzi MA. Keloids and hypertrophic scars: results with intraoperative and serial postoperative corticosteroid injection therapy. Aust N Z J Surg. 1999;69(9):655-9.
- Park TH, Seo SW, Kim JK, Chang CH. Clinical characteristics of facial keloids treated with surgical excision followed by intra- and postoperative intralesional steroid injections. Aesthetic Plast Surg. 2012;36(1):169-73.
- Rosen DJ, Patel MK, Freeman K, Weiss PR. A primary protocol for the management of ear keloids: results of excision combined with intraoperative and postoperative steroid injections. Plast Reconstr Surg. 2007;120(5):1395-400.
- Moustafa MFH, Abdel-Fattah AMA. Keloids of the ear lobes in Egypt: their rarity in childhood and their treatment. Br J Plast Surg. 1976;29:59.
- Kauh YC, Rouda S, Mondragon G, Tokarek R, di Leonardo M, Tuan RS, et al. Major suppression of pro-alpha1(I) type I collagen gene expression in the dermis after keloid excision and immediate intrawound injection of triamcinolone acetonide. J Am Acad Dermatol. 1997;37(4):586-9.
- Sproat JE, Dalcin A, Weitauer N, Roberts RS. Hypertrophic sternal scars: silicone gel sheet versus Kenalog injection treatment. Plast Reconstr Surg. 1992;90(6):988-92.
- Al-Attar A, Mess S, Thomassen JM, Kauffman CL, Davison SP. Keloid pathogenesis and treatment. Plast Reconstr Surg. 2006;117(1):286-300.
- Murray JC. Scars and keloids. Dermatol Clin. 1993;11(4):697-708.
- Ledon JA, Savas J, Franca K, Chacon A, Nouri K. Intralesional treatment for keloids and hypertrophic scars: a review. Dermatol Surg. 2013;39(12):1745-57.
- Shaffer JJ, Taylor SC, Cook-Bolden F. Keloidal scars: a review with a critical look at therapeutic options. J Am Acad Dermatol. 2002;46(2 Suppl Understanding):S63-97.
- Jemec GB. Linear atrophy following intralesional steroid injections. J Dermatol Surg Oncol. 1988;14(1):88-9.
- Mollmann H, Rohdewald P, Schmidt EW, Salomon V, Derendorf H. Pharmacokinetics of triamcinolone acetonide and its phosphate ester. Eur J Clin Pharmacol. 1985;29:85-9.
- Meikle AW, Clarke DH, Tyler FH. Cushing syndrome form low doses of dexamethasone a result of slow plasma clearance. JAMA.1976;235:1592-3.
- Ross EJ, Linch DC. Cushing’s syndrome—killing disease: discriminatory value of signs and symptoms aiding early diagnosis. Lancet (London, England). 1982;2(8299):646-9.
- Marsden CW. Fluocinolone acetonide 0.25 cream-a co-operative clinical trial. Br J Dermatol. 1968;80:614-7.
- Yi NW, Frame JD. Evaluation of cynthaskin and topical steroid in the treatment of hypertrophic scars and keloids. Eur J Plast Surg. 1996;19:162-5.
- Hayashi T, Furukawa H, Oyama A, Funayama E, Saito A, Murao N, Yamamoto Y. A new uniform protocol of combined corticosteroid injections and ointment application reduces recurrence rates after surgical keloid/hypertrophic scar excision. Dermatol Surg. 2012;38:893-7.
- Goldman L, Igelman JM, Kitzmiller KW. Clinical investigative studies with flurandrenolone tape. Cutis. 1967;3:367-71.
- Rauscher GE, Kolmer WL. Treatment of recurrent earlobe keloids. Cutis. 1986;37:67-8.
- Tillman WJ, Higuchi T. Quantitative evaluation of the interaction of callus strips with some hydroxylic solvents. J Invest Dermatol. 1961;27:87.
- Frank L, Rapp Y. Occlusive topical corticosteroids and heat in psoriasis. Arch Dermatol. 1963;87:32.
- Riley K. Flurandrenolone (Cordran) tape as occlusive therapy. JSC Med Assoc. 1969;65:171-2.
- Fisher LB, Maibach HI, Trancik RJ. Effects of occlusive tape systems on the mitotic activity of epidermis with and without corticosteroids. Arch Dermatol. 1978;114:384-6.
- Widgerow AD, Chait LA, Stals R, et al. New innovations in scar management. Aesthetic Plast Surg. 2000;24:227-34.
- Goutos I, Ogawa R. Steroid tape: a promising adjunct to scar management. Scars, Burn Heal. 2017;3:2059513117690937.
- Huang C, Akaishi S, Hyakusoku H, Ogawa R. Are keloid and hypertrophic scar different forms of the same disorder? A fibroproliferative skin disorder hypothesis based on keloid findings. Int Wound J. 2014;11(5):517-22.
- Huang C, Murphy GF, Akaishi S, Ogawa R. Keloids and hypertrophic scars: update and future directions. Plast Reconstr Surg Glob Open. 2013;1(4):e25.
- Goldblatt S. The use of Cordran tape in dermatology. Ohio State Med J. 1969;65(11):1118-21. 73. Ratzer MA. A clinical trial of flurandrenolone tape. Br J Clin Pract. 1970;24:185-9.
- DP Study Group. Analysis of clinical outcomes of deprodone propionate plaster for various skin diseases. Rinsholyaku. 1989;5:2177-85. (in Japanese).
- Labow TA, Eisert J, Sanders SL. Flurandrenolide tape in the treatment of psoriasis. NY State J Med. 1969;69:3138-40.
- Kim S, Choi TH, Liu W, Ogawa R, Suh JS, Mustoe TA. Update on scar management: guidelines for treating Asian patients. Plast Reconstr Surg. 2013;132:1580.
- Gold MH, Berman B, Clementoni MT, Gauglitz GG, Nahai F, Murcia C. Updated international clinical recommendations on scar management: part 1—evaluating the evidence. Dermatol Surg. 2014;40(8):817-24.
- Gold MH, McGuire M, Mustoe TA, Pusic A, Sachdev M, Waibel J, et al. Updated international clinical recommendations on scar management: part 2—algorithms for scar prevention and treatment. Dermatol Surg. 2014;40(8):825-31.
- Meaume S, Le Pillouer-Prost A, Richert B, Roseeuw D, Vadoud J. Management of scars: updated practical guidelines and use of silicones. Eur J Dermatol. 2014;24(4):435—43.
- Sclafani AP, Gordon L, Chadha M, Romo T 3rd. Prevention of earlobe keloid recurrence with postoperative corticosteroid injections versus radiation therapy: a randomized, prospective study and review of the literature. Dermatol Surg. 1996;22(6):569—74.
- Layton AM, Yip J, Cunliffe WJ. A comparison of intralesional triamcinolone and cryosurgery in the treatment of acne keloids. Br J Dermatol. 1994;130:498-501.
- Shah VV, Aldahan AS, Mlacker S, Alsaidan M, Samarkendy S, Nouri K. 5_Fluorouracil in the treatment of keloids and hypertrophic scars: a comprehensive review of the literature. Dermatol Ther. 2016;6:169-83.
- Saha AK, Mukhopadhyay M. A comparative clinical study on role of 5-fluorouracil versus triamcinolone in the treatment of keloids. Indian J Surg. 2012;74(4):326-9.
- Prabhu A, et al. A randomized controlled trial comparing the efficacy of intralesional 5-fluorouracil versus triamcinolone acetonide in the treatment of keloids. J Sci Soc. 2012;39(1):19.
- Khan MA, Bashir MM, Khan FA. Intralesional triamcinolone alone and in combination with 5-fluorouracil for the treatment of keloid and hypertrophic scars. J Pak Med Assoc. 2014;64(9):1003- 7.
- Darougheh A, Asilian A, Shariati F. Intralesional triamcinolone alone or in combination with 5-fluorouracil for the treatment of keloid and hypertrophic scars. Clin Exp Dermatol.2009;34(2):219-23.
- Davison SP, Dayan JH, Clemens MW, Sonni S, Wang A, Crane A. Efficacy of intralesional 5-fluorouracil and triamcinolone in the treatment of keloids. Aesthet Surg J. 2009;29:40-6.
- Manuskiatti W, Fitzpatrick RE. Treatment response of keloidal and hypertrophic sternotomy scars: comparison among intralesional corticosteroid, 5-fluorouracil, and 585 nm flashlamp-pumped pulsed-dye laser treatments. Arch Dermatol. 2002;138:1149-55.
- Asilian A, Darougheh A, Shariati F. New combination of triamcinolone, 5-Fluorouracil, and pulsed-dye laser for treatment of keloid and hypertrophic scars. Dermatol Surg. 2006;32(7):907-15.
- Alster T. Laser scar revision: comparison study of 585-nm pulsed dye laser with and without intralesional corticosteroids. Dermatol Surg. 2003;29:25-9.
- Waibel JS, Wulkan AJ, Shumaker PR. Treatment of hypertrophic scars using laser and laser assisted corticosteroid delivery. Lasers Surg Med. 2013;45(3):135-40.
- Martin MS, Collawn SS. Combination treatment of CO2 fractional laser, pulse dye laser and triamcinolone acetonide injection for refractory keloid scars on the upper back. J Cosmet Laser Ther. 2013;15(3):166-70.
- Son IP, Park KY, Kim B, et al. Pilot study of the efficacy of 578 nm copper bromide corporate laser combined with intralesional corticosteroid injection for treatment of keloids and hypertrophic scars. Ann Dermatol. 2014;26:156-61.
