Bệnh sản phụ khoa
Mang thai ở phụ nữ bi lupus ban đỏ hệ thống – Bà bầu cần biết
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Biên dịch: Bác sĩ Vũ Tài – Học viện Quân y
Authors: Bonnie L Bermas, MD, Nicole A Smith, MD, MPH
Section Editors: David s Pisetsky, MD, PhD, Charles J Lockwood, MD, MHCM
Deputy Editor: Monica Ramirez Curtis, MD, MPH
nhathuongocanh.com – Chủ đề: Mang thai ở phụ nữ bi lupus ban đỏ hệ thống – Bà bầu cần biết
Bạn có thể tải file PDF Tại đây.
GIỚI THIỆU
Bệnh lupus ban đỏ hệ thống (SLE) chủ yếu ảnh hưởng đến phụ nữ trong độ tuổi sinh đẻ. Khả năng sinh sản ở bệnh nhân bị SLE dường như không bị thay đổi bởi bản thân bệnh; tuy nhiên, giảm dự trữ buồng trứng có thể xảy ra ở phụ nữ phơi nhiễm với cyclophosphamide
Mang thai ở phụ nữ bị SLE gây ra các nguy cơ cao hơn cho mẹ và thai nhi so với mang thai ở phụ nữ khỏe mạnh. Tiên lượng tốt nhất cho cả mẹ và con là khi SLE đã ổn định ít nhất sáu tháng trước khi mang thai. Các đợt bùng phát bệnh trong khi mang thai ở bệnh nhân bị SLE đặt ra những thách thức trong việc phân biệt những thay đổi sinh lý liên quan đến thai kỳ với các biểu hiện liên quan đến bệnh. Vì vậy, một cách tiếp cận đa chuyên khoa với sự theo dõi chặt chẽ về nội khoa, sản khoa và sơ sinh là cần thiết để tối ưu hóa kết cục của cả mẹ và thai nhi.
Tổng quan chủ đề này sẽ thảo luận về những nguy cơ chính liên quan đến thai kỳ ở bệnh nhân bị SLE, cũng như các khuyến cáo quản lý. Các vấn đề liên quan đến hoạt động kinh nguyệt, mãn kinh, liệu pháp thay thế estrogen và sử dụng thuốc tránh thai ở phụ nữ mắc bệnh lupus ban đỏ hệ thống được trình bày ở chủ đề riêng (see “Menstrual function, menopause, and hormone replacement therapy in women with systemic lupus erythematosus” and “Approach to contraception in women with systemic lupus erythematosus”). Các vấn đề liên quan đến thai kỳ ở bệnh nhân suy giảm chức năng thận hoặc mắc hội chứng kháng phospholipid (APS) cũng được trình bày ở chủ đề khác. (See “Pregnancy ỉn women with nondialysis chronic kidney disease” and “Antiphospholipid syndrome: Pregnancy implications and management in pregnant women” and “Neonatal lupus: Epidemiology, pathogenesis, clinical manifestations, and diagnosis”,)
LẬP KẾ HOẠCH MANG THAI
Tốt nhất, bệnh nên ổn định trong sáu tháng trước khi bệnh nhân bị lupus ban đỏ hệ thống (SLE) cố gắng thụ thai. SLE hoạt động tại thời điểm thụ thai là một yếu tố dự đoán mạnh các kết cục bất lợi về sản khoa và đối với mẹ [1-3]. Bất chấp nguy cơ này, phần lớn các trường hợp mang thai như vậy vẫn dẫn đến những ca sinh sống. Các nghiên cứu sau đây minh họa cho điều này:
- Nghiên cứu quan sát lớn nhất, bao gồm 385 bệnh nhân lupus mang thai với bệnh không hoạt động hoặc nhẹ hoặc trung bình khi thụ thai, phát hiện 81% đối tượng mang thai không biến chứng [4]. Sau khi kiểm soát các yếu tố nguy cơ ban đầu như chống đông lupus, điều trị tăng huyết áp, giảm tiểu cầu, bùng phát bệnh hoặc mức độ hoạt động bệnh trung bình ở thời điểm ban đầu, bệnh nhân da trắng không phải gốc Tây Ban Nha có tỷ lệ kết cục thai kỳ bất lợi là 8%. Tuy nhiên, quần thể nghiên cứu bị hạn chế vì đã loại trừ những phụ nữ có mức độ hoạt động bệnh cao, viêm thận lupus đang hoạt động, tàng huyết áp không kiểm soát và bệnh đái tháo đường.
- Một nghiên cứu trên 267 trường hợp mang thai trong một đoàn hệ bệnh nhân lupus phát hiện những phụ nữ có mức độ hoạt động bệnh cao so với mức độ hoạt động bệnh thấp trong 3 tháng đầu và ba tháng giữa thai kỳ cho thấy tỷ lệ sảy thai (sảy thai và tử vong chu sinh) tăng gấp ba lần. Tuy nhiên, nhìn chung không có sự khác biệt có ý nghĩa thống kê về số trẻ sinh sống giữa những phụ nữ có mức độ hoạt động bệnh cao so với phụ nữ có mức độ hoạt động bệnh thấp (tương ứng là 77% so với 88%).
Cách tiếp cận của chúng tôi đối với việc lập kế hoạch mang thai và quản lý SLE nhìn chung phù hợp với các khuyến cáo được phát triển bởi European League Against Rheumatism (EULAR) [5] and the American College of Rheumatology (ACR) [6].
Đánh giá trước khi mang thai
Đánh giá trước khi mang thai là vô cùng cần thiết ở phụ nữ bị SLE để xác định xem liệu việc mang thai có thể gây ra nguy cơ cao không thể chấp nhận được cho mẹ hoặc thai nhi hay không, để bắt đầu các biện pháp can thiệp nhằm tối ưu hóa mức độ hoạt động của bệnh và điều chỉnh thuốc với những loại thuốc ít gây hại nhất cho thai nhi.
Phụ nữ nên được khuyên rằng việc ngừng các loại thuốc dùng để kiểm soát hoạt động của bệnh sẽ làm tăng nguy cơ bùng phát bệnh lupus và các biến chứng khi mang thai. Tốt nhất, những phụ nữ đang cân nhắc việc mang thai nên được duy trì bằng các loại thuốc phù hợp với thai kỳ và nên tiếp tục sử dụng các loại thuốc này trong thai kỳ. Các đặc điểm lâm sàng đặc trưng cho thai kỳ trong bối cảnh SLE được thảo luận dưới đây. Một cuộc thảo luận chung hơn về chăm sóc trước khi mang thai và đánh giá nguy cơ ở tất cả phụ nữ được trình bày ở chủ đề riêng. (See “The preconception office visit”.)
Đánh giá nguy cơ
Đánh giá trước khi mang thai ở phụ nữ bị SLE nên bao gồm đánh giá mức độ hoạt động của bệnh và sự ảnh hưởng đến các cơ quan chính, cũng như các rối loạn tăng động hoặc nội khoa đồng thời có thể ảnh hưởng đến thai kỳ. Các kết cục sản khoa trước đó nên được xem xét, đặc biệt chú ý đến tiền sử thai nhỏ so với tuổi thai, tiền sản giật, thai chết lưu, sảy thai và sinh non. Một cách tiếp cận để đánh giá mức độ hoạt động của bệnh và mức độ nặng của SLE được thảo luận ở chủ đề riêng. (See “Overview of the management and prognosis of systemic lupus erythematosus in adults”, section on ‘Assessment of disease activity and severity’,)
Bệnh nhân có bằng chứng SLE đang hoạt động, đặc biệt là viêm thận lupus, nên được khuyên trì hoãn việc mang thai cho đến khi bệnh được kiểm soát tốt trong ít nhất sáu tháng. Đối với những người bị suy thận, tư vấn nên bao gồm đánh giá nguy cơ suy giảm chức năng thận tạm thời hay vĩnh viễn. (See “Pregnancy in women with nondialysis chronic kidney disease”.)
Sự gia tăng mức độ nặng của bệnh mẹ nhìn chung tương quan với nguy cơ cao hơn ở mẹ và thai nhi trong thai kỳ. Vì vậy, đột guỵ gần đây, ảnh hưởng đến tim, tăng áp động mạch phổi, bệnh phổi kẽ nặng và suy thận tiến triển có thể gây nguy hiểm cho cả mẹ và thai nhi. Phụ nữ có những bệnh lý này hoặc các tình trạng bệnh lý đáng lo ngại khác nên được tư vấn cẩn thận bởi bác sĩ chuyên khoa y học mẹ và bào thai về hồ sơ nguy cơ cá nhân của họ, thảo luận rõ ràng về các nguy cơ bệnh tật và tử vong cho cả mẹ và thai nhi liên quan đến thai kỳ. Nên đưa ra các phương án thay thế như mang thai hộ và nhận con nuôi. Nếu họ quyết định theo đuổi việc mang thai, họ nên được theo dõi đa chuyên khoa ở một trung tâm có chuyên khoa thai kỳ nguy cơ cao [7,8].
Cần đánh giá tình trạng kháng thể đặc hiệu của mẹ như kháng thể kháng phospholipid (aPLs) và kháng thể kháng Ro/La. aPLs có thể làm tăng các nguy cơ sản khoa như sảy thai liên tiếp, thai chết lưu và tiền sản giật trong khi các kháng thể kháng Ro/La có khuynh hướng gây bệnh lupus sơ sinh (NL) [ 7 ]. (See “Neonatal lupus: Epidemiology, pathogenesis, clinical manifestations, and diagnosis” and “Antiphospholipid syndrome: Pregnancy implications and management in pregnant women”.)
Xét nghiệm cận lâm sàng đặc hiệu
Ngoài các xét nghiệm thường quy trước khi mang thai, cần xem xét các xét nghiệm sau trong quá trình đánh giá trước khi mang thai (see “Overview of the management and prognosis of systemic lupus erythematosus in adults”, section on ‘Laboratory evaluation’):
- aPL: kháng thể chống đông lupus (LA), kháng thể kháng cardiolipin (aCL) IgM và IgG, và kháng thể kháng beta2-glycoprotein (GP) I IgG và IgM
- Kháng thể kháng Ro/SSA và kháng La/SSB
- Chức năng thận (creatinine, tổng phân tích nước tiểu với cặn lắng trong nước tiểu, tỷ lệ protein/creatinine ở mẫu nước tiểu ngẫu nhiên)
- Công thức máu toàn bộ (CBC)
- Xét nghiệm chức năng gan
- Kháng thể kháng acid deoxyribonucleic chuỗi kép (dsDNA)
- Bổ thể (CH50, hoặc C3 và C4)
Các thuốc
Các thuốc phải được xem xét và điều chỉnh trước khi thụ thai với mục tiêu duy trì kiểm soát bệnh bằng các thuốc có dữ liệu an toàn tốt nhất trong thai kỳ. Mặc dù một số thuốc dùng để điều trị SLE có khả năng gây hại hoặc chống chỉ định trong thai kỳ, nhưng vẫn có những lựa chọn an toàn. Thông tin về việc sử dụng các thuốc ức chế miễn dịch ở bệnh nhân mang thai bị SLE có thể được tìm thấy bên dưới và ở một chủ đề riêng (see “Safety of rheumatic disease medication use during pregnancy and lactation”) .Các thuốc được sử dụng phổ biến nhất để điều trị bệnh nhân bị SLE được xem xét ngắn gọn bên dưới.
Khuyến cáo trong thai kỳ
Hydroxychloroguine – Chúng tôi tiếp tục sử dụng hydroxychloroquine (HCQ) trong thai kỳ ở tất cả bệnh nhân bị SLE, trừ khi có chống chỉ định khác. Một số nghiên cứu đã chứng minh ít các đợt bùng phát bệnh hơn và kết cục tốt hơn ở những bệnh nhân tiếp tục dùng HCQ trong thai kỳ, không gia tăng các biến cố bất lợi hoặc dị tật bẩm sinh [ 9-17 ].
Một thử nghiệm ngẫu nhiên bao gồm 20 bệnh nhân mang thai liên tiếp bị SLE không phát hiện sự khác biệt giữa tỷ lệ bùng phát bệnh, nhưng bệnh nhân trong nhóm HCQ có thể giảm liều prednisone. Ngoài ra, nhóm HCQ có điểm số mức độ hoạt động của bệnh sau khi sinh thấp hơn đáng kể so với nhóm dùng giả dược. Kết quả từ một nghiên cứu tiến cứu lớn hơn với 257 trường hợp mang thai ở 197 phụ nữ cũng cho thấy rằng ngừng sử dụng HCQ trong thai kỳ có liên quan đến tỷ lệ bùng phát bệnh cao hơn so với những phụ nữ tiếp tục HCQ trong khi mang thai hoặc không bao giờ dùng nó [ 9 Ị. Ngoài ra, mức độ hoạt động bệnh cao xảy ra nhiều gấp đôi ở những thai kỳ ngừng dùng HCQ so với những người tiếp tục dùng HCQ. Tính an toàn tương đối của HCQ trong thai kỳ được thảo luận chi tiết ở chủ đề riêng (See “Safety of rheumatic disease medication use during pregnancy and lactation”, section on ‘Hydroxychloroguine’).
Ngoài ra, một số dữ liệu cho thấy giảm sự xuất hiện block tim bẩm sinh ở thai nhi có nguy cơ của những bà mẹ có kháng thể kháng Ro/SSA và kháng LA/SSB phơi nhiễm với HCQ [ 18], (See “Neonatal lupus: Epidemiology, pathogenesis, clinical manifestations, and diagnosis”, section on ‘Heart block’.)
Aspirin liều thấp – Chúng tôi bắt đầu aspirin liều thấp ở tất cả phụ nữ bị SLE, bắt đầu từ khoảng 12 tuần tuổi thai, để giảm nguy cơ tiền sản giật và các hậu quả của nó (ví dụ: thai chậm tăng trưởng), bất chấp sự hiện diện của kháng thể kháng phospholipid (aPLs ). Cách tiếp cận này phù hợp với khuyến cáo của United States Preventive Services Task Force về việc sử dụng aspirin liều thấp ở phụ nữ có nguy cơ cao xuất hiện tiền sản giật, bao gồm cả phụ nữ bị SLE [ 19 Ị. Khuyến cáo sử dụng dự phòng aspirin liều thấp trong thai kỳ để phòng ngừa tiền sản giật được thảo luận chi tiết ở chủ đề riêng. (See “Safety of rheumatic disease medication use during pregnancy and lactation”, section on ‘NSAIDs’ and “Preeclampsia: Prevention”).
Được phép sử dụng có chọn lọc trong thai kỳ – Các loại thuốc sau đây có tính an toàn thích hợp trong thai kỳ, nhưng có một số hạn chế nhất định khi sử dụng chúng. Thuốc chống viêm không steroid (NSAID), glucocorticoid, azathioprine , và một số thuốc hạ huyết áp được đưa vào trong danh mục này. Mỗi loại thuốc đều có một nguy cơ nhỏ gây hại cho thai nhi, nhưng việc sử dụng chúng có thể được chấp nhận nếu cần để kiểm soát các biểu hiện của SLE trong thai kỳ.
Thuốc chống viêm không steroid – Sử dụng NSAID không liên quan đến dị tật bẩm sinh. Có bằng chứng mâu thuẫn về việc liệu việc phơi nhiễm với NSAID trong ba tháng đầu có làm tăng nguy cơ sảy thai tự nhiên hay không; ở những phụ nữ khó thụ thai, có thể cân nhắc tránh dùng những loại thuốc này trong ba tháng đầu. Sau tam cá nguyệt đầu tiên, NSAID có thể được sử dụng cho đến khi thai được 30 tuần. Vì thiểu ối thoáng qua đã được báo cáo khi sử dụng diclofenac hàng ngày, nên sử dụng những loại thuốc này một cách thận trọng. Sử dụng NSAIDs sau 30 tuần tuổi thai có thể gây đóng sớm ống động mạch cũng như các biến chứng khác, và cần tránh trong khoảng thời gian đó.
Glucocorticoid – Glucocorticoid được sử dụng cho nhiều bệnh của mẹ trong thai kỳ. Chúng tôi đề nghị kiểm soát bệnh với liều prednisone thấp nhất có thể, tốt nhất là dưới 10 mg/ngày. Trong khi có một số báo cáo về việc sử dụng glucocorticoid trong ba tháng đầu có liên quan đến sứt môi, có và không có hở hàm ếch, các nghiên cứu sau đó đều không chứng minh được sự gia tăng nguy cơ dị tật này. Các tác dụng bất lợi đối với mẹ và thai nhi của glucocorticoid được thảo luận chi tiết ở chủ đề riêng. (See “Safety of rheumatic disease medication use during pregnancy and lactation”, section on ‘Glucocorticoids’.)
Azathioprine – Azathioprine tương thích với thai kỳ, nhưng liều không được vượt quá 2 mg/kg/ngày. (See “Safety of rheumatic disease medication use during pregnancy and lactation”, section on ‘Azathioprine and 6-mercaptopurine’.)
Cyclosporine – Các quan sát hạn chế gợi ý rằng trẻ em phơi nhiễm với cyclosporine trong tử cung có chức năng thận và huyết áp bình thường. Nhà sản xuất gợi ý nên giới hạn sử dụng trong thai kỳ khi lợi ích của mẹ cao hơn nguy cơ đối với thai nhi. (See “Safety of rheumatic disease medication use during pregnancy and lactation”, section on ‘Cyclosporine’.)
Tacrolimus – Mối quan hệ nhân quả giữa việc sử dụng tacrolimus và dị tật bẩm sinh vẫn chưa được phát hiện, mặc dù có số lượng nhỏ thai nhi bị phơi nhiễm trong tử cung. Một loạt trường hợp nhỏ gồm 9 bệnh nhân lupus mang thai báo cáo duy trì bệnh thành công hoặc kiểm soát các đợt bùng phát viêm thận lupus bằng tacrolimus [ 20 ] (See “Safety of rheumatic disease medication use during pregnancy and lactation”, section on ‘Tacrolimus’.)
Thuốc hạ huyết áp – Methyldopa , labetalol , nifedipine vá hydralazine là những thuốc hạ huyết áp được sử dụng phổ biến nhất trong thai kỳ. Bằng cách so sánh, thuốc ức chế men chuyển (ACE) và thuốc chẹn thụ thể angiotensin II bị chống chỉ định trong thai kỳ. Thuốc lợi tiểu nên được sử dụng một cách thận trọng. Nitroprusside là thuốc cuối cùng dùng để kiểm soát khẩn cấp tình trạng tăng huyết áp nặng kháng trị; sử dụng nó nên được giới hạn trong một khoảng thời gian ngắn ở tình huống khẩn cấp. (See “Treatment of hypertension in pregnant and postpartum women” and “Adverse effects of angiotensin converting enzyme inhibitors and receptor blockers in pregnancy”.)
Sử dụng có chọn lọc một cách thận trọng trong thai kỳ
Thuốc sinh học – Dữ liệu về việc sử dụng thuốc sinh học như kháng thể làm suy giảm tế bào B, rituximab hoác thuốc ức chế BAFF, belimumab , trong thai kỳ còn hạn chế. Do IgG không đi qua nhau thai với số lượng đáng kể cho đến tuần 12 của thai kỳ, chúng tôi tiếp tục sử dụng các loại thuốc này qua thời điểm thụ thai (tức là chậm chu kỳ kinh đầu tiên ở phụ nữ có chu kỳ kinh đều). Trong thực hành của chúng tôi, mặc dù chúng tôi không khuyến khích sử dụng rituximab nếu có một lựa chọn khác, nhưng chúng tôi sẽ tiếp tục ủng hộ việc dùng nó trong suốt thai kỳ vì tốt hơn là để bùng phát SLE. (See “Safety of rheumatic disease medication use during pregnancy and lactation”, section on ‘Rituximab’.)
Chống chỉ định trong thai kỳ
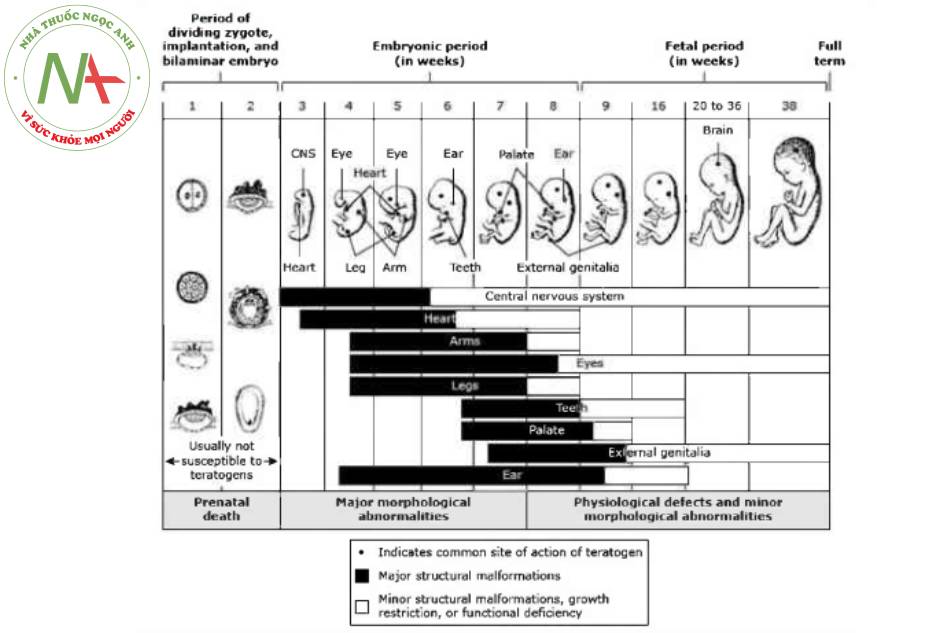
Cyclophosphamide – Cyclophosphamide có liên quan đến dị tật bẩm sinh (hoặc thai nhi) và nên tránh dùng trong 10 tuần đầu của thai kỳ, khi thai nhi dễ bị quái thai nhất (E3 figure 1 ). Tuy nhiên, trong các tình huống lâm sàng đe dọa đến tính mạng, thuốc này được sử dụng vào cuối thai kỳ. (See “Safety of rheumatic disease medication use during pregnancy and lactation”, section on ‘Cyclophosphamide’.)
Mycophenolate mofetil – Dị tật bẩm sinh đã được báo cáo ở trẻ sơ sinh phơi nhiễm với mycophenolate mofetil trong thai kỳ. Thuốc này nên tránh trong thai kỳ. (See “Safety of rheumatic disease medication use during pregnancy and lactation”, section on ‘Mycophenolate mofetil’.)
Azathioprine hoặc tacrolimus có thể được dùng thay thế cho mycophenolate trước và trong khi mang thai, hoặc, cách khác, glucocorticoid có thể được sử dụng ở liều thấp nhất để kiểm soát mức độ hoạt động của bệnh. Tốt nhất, quá trình chuyển đổi thuốc này nên diễn ra sáu tháng trước khi thụ thai. (Xem “An toàn khi sử dụng thuốc trị bệnh thấp khớp trong thời kỳ mang thai và cho con bú”, phần ‘Azathioprine và 6-mercaptopurỉne’ .)
Methotrexate – Methotrexate gây quái thai và không nên dùng trong thai kỳ. (See “Safety of rheumatic disease medication use during pregnancy and lactation”, section on ‘Methotrexate’.)
Leflunomide – Mặc dù không phải là thuốc gây quái thai rõ ràng, nhưng nên tránh dùng thuốc này trong thai kỳ. Bệnh nhân dùng thuốc này muốn thụ thai nên xét nghiệm nồng độ cholestyramine cho đến khi không phát hiện được trong máu. (See “Safety of rheumatic disease medication use during pregnancy and lactation”.)
Lý tưởng nhất là chỉ nên cố gắng thụ thai khi tình trạng bệnh thuyên giảm hoặc ổn định với các loại thuốc phù hợp với thai kỳ. Tuy nhiên, nếu mang thai xảy ra trong thời kỳ bệnh đang hoạt động, các thuốc sẽ cần được điều chỉnh để đảm bảo an toàn cho mẹ và thai nhi.
CÁC XEM XÉT CỤ THỂ TRONG THAI KỲ
Đợt cấp SLE
Mặc dù người ta thường chấp nhận rằng thai kỳ và thời kỳ hậu sản có liên quan đến tỷ lệ bùng phát bệnh lupus ban đỏ hệ thống (SLE) cao hơn, nhưng tỷ lệ được báo cáo biến thiên rộng, dao động từ 25 đến 60% [ 3,8,21, 22 ]. Một số sự khác biệt này có thể là do thiết kế nghiên cứu không đồng nhất, bệnh nhân và nhóm chứng đa dạng, và các định nghĩa khác nhau về đợt bùng phát được sử dụng trong các nghiên cứu. Để so sánh, tỷ lệ bùng phát nền của SLE là khoảng 30% mỗi năm.
Các yếu tố sau có liên quan đến việc tăng nguy cơ bùng phát SLE trong thai kỳ:
- Bệnh hoạt động trong vòng sáu tháng trước khi thụ thai
- Tiền sử viêm thận lupus
- Ngừng hydroxychloroquine (HCQ)
- Mang thai lần đầu
Tác động của bệnh lupus đối với thai kỳ
Mang thai trong bối cảnh SLE có liên quan đến nguy cơ biến chứng cao hơn so với phụ nữ khỏe mạnh. Nghiên cứu lớn nhất đánh giá các biến chứng của mẹ và thai kỳ liên quan đến SLE bao gồm 13.555 trường hợp mang thai [ 26]. Phụ nữ bị SLE cũng có tỷ lệ biến chứng sản khoa tăng gấp 2-4 lần bao gồm chuyển dạ sinh non, sinh mổ không có kế hoạch, thai chậm tăng trưởng, tiền sản giật và sản giật. Bệnh nhân bị SLE cũng có nguy cơ huyết khối, nhiễm trùng, giảm tiểu cầu và truyền máu cao hơn đáng kể. Nghiên cứu này cũng báo cáo rằng tỷ lệ tử vong mẹ cao hơn 20 lần ở những phụ nữ bị SLE; tuy nhiên, tỷ lệ tử vong ở những bệnh nhân bị SLE với độ tuổi tương tự không mang thai thậm chí còn cao hơn. Một nghiên cứu khác cho thấy tỷ lệ tăng huyết áp khi mang thai, sinh non, sinh mổ không có kế hoạch, băng huyết sau sinh, và thuyên tắc huyết khối tĩnh mạch ở mẹ thường xuyên hơn ở phụ nữ bị SLE khi so sánh với thai kỳ của phụ nữ không bị SLE [ 27]. Thật đáng mừng, một nghiên cứu dựa trên dân số lớn cho rằng các biến chứng thai kỳ bao gồm tỷ lệ tử vong đang giảm ở những người bị SLE, mặc dù vẫn cao hơn so với những người không bị SLE [ 28 ].
Một số yếu tố dự báo kết cục thai kỳ bất lợi ở phụ nữ bị SLE đã được xác định và bao gồm bệnh đang hoạt động, sử dụng thuốc hạ huyết áp, viêm thận lupus trước đó, có kháng thể kháng phospholipid (aPLs), và giảm tiểu cầu [ 4,29 ]. Hơn nữa, ở những người mang thai lần đầu có nguy cơ bị các biến chứng thai kỳ cao hơn [ 25 ]
Tiền sản giật
Tiền sản giật là một trong những biến chứng thai kỳ thường gặp nhất ở SLE, xảy ra ở 16 đến 30 % phụ nữ bị SLE, so với 4,6 % thai kỳ trong quần thể sản khoa nói chung [3,30- 32]. Các yếu tố nguy cơ của tiền sản giật ở phụ nữ bị SLE cũng giống như ở phụ nữ khỏe mạnh và được thảo luận riêng (see “Preeclampsia: Clinical features and diagnosis”, section on ‘Risk factors’). Các yếu tố nguy cơ khác của tiền sản giật đặc hiệu cho bệnh nhân SLE bao gồm tiền sử viêm thận lupus hoạt động hoặc trước đó, giảm nồng độ bổ thể và giảm tiểu cầu. Dữ liệu về việc liệu aPL có dẫn đến tiền sản giật hay không vẫn chưa rõ ràng, mặc dù một số nghiên cứu cho thấy mối liên quan [30,33],
Sinh non
Sinh non là biến chứng sản khoa phổ biến nhất ở phụ nữ bị SLE. Tỷ lệ sinh non được báo cáo từ 15 đến 50 %, với tỷ lệ gia tăng ở phụ nữ bị viêm thận lupus hoặc mức độ hoạt động bệnh cao. Con số này so với 12% thai kỳ trong quần thể sản khoa Hoa Kỳ nói chung [1,24,30]. Ở phụ nữ bị SLE, phần lớn các ca sinh non được chỉ định về mặt y tế do tiền sản giật hoặc do mức độ hoạt động SLE của mẹ [ 34 Ị. Sự hiện diện của bệnh viêm thận lupus và bệnh đang hoạt động là những yếu tố dự báo mạnh nhất cho việc sinh sớm. Tỷ lệ sinh non có thể thấp hơn ở những phụ nữ không có các yếu tố nguy cơ này [4].

Các biến chứng thai nhi
Các biến chứng thai nhi trong thai kỳ ở bệnh nhân bị SLE bao gồm sảy thai, thai chết lưu, chậm tăng trưởng, hội chứng lupus sơ sinh (NL) và các biến chứng sinh non.
Mất thai – Trước đây, tỷ lệ sảy thai ở cả giai đoạn đầu và cuối thai kỳ đều tăng lên đáng kể ở phụ nữ bị SLE. Nhiều nghiên cứu hiện đại nhóm tất cả các sảy thai từ giai đoạn phôi thai (lên đến 9 đến 10 tuần tuổi thai) đến thai chết lưu (thai chết ở tuần thứ 20 trở lên) dưới thuật ngữ “mất thai”, khiến việc giải thích nguy cơ sảy thai sớm so với thai chết muộn trở thành thách thức
Ảnh hưởng của SLE đối với sự mất phôi thai còn gây tranh cãi, với nguy cơ có thể tăng nhẹ. Phụ nữ bị SLE gia tăng nguy cơ tử vong thai nhi sau 10 tuần tuổi, đặc biệt khi có SLE đang hoạt động, viêm thận lupus và hội chứng kháng phospholipid (APS). Nhìn chung, tỷ lệ mất thai ở những bệnh nhân bị SLE đang giảm trong những thập kỷ qua, với tỷ lệ sinh sống ngày càng tăng [ 1,35,36 ]. Một nghiên cứu đoàn hệ quan sát lớn trên những bệnh nhân lupus không hoạt động hoặc mức độ hoạt động bệnh từ nhẹ đến trung bình lúc thụ thai phát hiện rằng 5% thai kỳ kết thúc bằng tử vong thai nhi hoặc sơ sinh [ 4 1. Để so sánh, nguy cơ sảy thai trong dân số khi tuổi thai dưới 20 tuần dao động từ 8 đến 20 % [ 37,38 ].
Thai chậm tăng trưởng – Khoảng 10 đến 30 % thai kỳ ở phụ nữ bị SLE là phức tạp do thai chậm tăng trưởng và trẻ nhỏ so với tuổi thai so với khoảng 10 % thai kỳ ở quần thể sản khoa nói chung [ 21,24,39 Ị. Cũng như các biến chứng khác, nguy cơ cao hơn khi có bệnh đang hoạt động, tăng huyết áp và viêm thận lupus. Cân nặng khi sinh thấp hơn ở mọi tuổi thai cũng phổ biến hơn ở phụ nữ bị SLE [ 27 Ị.
Bệnh lupus sơ sinh (NL) – NL là một bệnh tự miễn dịch chuyển thụ động xảy ra ở một số trẻ sinh ra từ mẹ có kháng thể kháng Ro/SSA hoặc kháng LA/SSB, những người này có thể mang / không mang chẩn đoán SLE hoặc Sjogren’s. Các biểu hiện chính của NL ở da hoặc tim, nhưng các biểu hiện khác của NL bao gồm các bất thường về huyết học và gan.
Biến chứng nghiêm trọng nhất ở trẻ sơ sinh là block tim hoàn toàn bẩm sinh, xảy ra ở khoảng 2 % trẻ sinh ra từ những phụ nữ mang thai lần đầu có kháng thể kháng Ro/SSA [40]. Ở những phụ nữ đã từng sinh con bị block tim hoàn toàn bẩm sinh, nguy cơ block tim hoàn toàn tăng khoảng 16-18% ở những lần mang thai tiếp theo, hoặc 10 đến 15% khi đứa trẻ trước đó có NL ngoài da [41-43]. Dữ liệu cho thấy rằng block tim bẩm sinh có thể xảy ra thường xuyên hơn trong trường hợp có kháng thể kháng Ro52, trái ngược với kháng thể kháng Ro60 hoặc kháng La; tuy nhiên, ở thời điểm này, theo dõi trẻ sơ sinh không làm thay đổi loại kháng thể và việc phân biệt kháng thể Ro không được thực hiện thường quy để hướng dẫn chăm sóc sản khoa [44,45], Bệnh sinh, biểu hiện lâm sàng, tầm soát, phòng ngừa và điều trị NL được thảo luận ở chủ đề riêng (See “Neonatal lupus: Epidemiology, pathogenesis, clinical manifestations, and diagnosis” and “Congenital third degree (complete) atrioventricular block”.)
SLE dường như không gây nguy cơ cho các bất thường bẩm sinh có thể xác định khác [46,47]. Một số nghiên cứu đã phát hiện ra rằng tình trạng khuyết tật học tập có thể xảy ra thường xuyên hơn ở trẻ em, đặc biệt là con trai, của các bà mẹ bị SLE, trong khi các nghiên cứu khác ủng hộ các kết cục phát triển thần kinh tương tự ở trẻ em của phụ nữ bị và không bị SLE [48-51].
Các xem xét đặc biệt
Viêm thận lupus – Phụ nữ bị viêm thận lupus đang hoạt động nên được khuyến khích trì hoãn mang thai cho đến khi bệnh không hoạt động ít nhất sáu tháng để tối ưu hóa kết cục của mẹ. Như đã thảo luận ở trên, tiền sử viêm thận lupus trước đó hoặc viêm thận lupus đang hoạt động trong thai kỳ có liên quan đến tỷ lệ biến chứng ở mẹ và thai nhi cao hơn. Các ví dụ sau được dùng để minh họa:
- Một nghiên cứu quan sát với 193 thai kỳ của 104 phụ nữ bị SLE, trong đó 81 thai kỳ xảy ra khi có bệnh thận đang hoạt động, phát hiện rằng cân nặng khi sinh thấp thường xảy ra hơn ở những thai kỳ bị bệnh thận [ 23 ]. Sự hiện diện của bệnh thận đang hoạt động trong thai kỳ cũng liên quan đến việc tăng tần suất tăng huyết áp do thai kỳ và bùng phát bệnh lupus.
- Một nghiên cứu hồi cứu khác trên 95 thai kỳ ở phụ nữ bị SLE cho thấy tiền sử viêm thận lupus trước đó là một yếu tố dự báo cho các kết cục bất lợi ở mẹ [ 24 ]. Những phụ nữ bị viêm thận trước đó mang thai có nguy cơ bị biến chứng mẹ cao hơn (88% so với 43%, tương ứng) và tỷ lệ bùng phát bệnh cao hơn (54% so với 25%, tương ứng), hầu hết là bùng phát ở thận. Tuy nhiên, hầu hết các đợt bùng phát ở thận trong đoàn hệ này không nặng, đáp ứng với prednisone liều cao và không dẫn đến sảy thai.
- Một nghiên cứu hồi cứu trên 90 thai kỳ trong số 58 bệnh nhân lupus cho thấy tỷ lệ tiền sản giật, sinh non và mất thai ở phụ nữ bị viêm thận lupus thuyên giảm thấp hơn đáng kể so với những phụ nữ bị viêm thận lupus đang hoạt động (35, 30 và 25% so với 57, 52, và 35 %, tương ứng) [ 35 ].
Vì vậy, những phụ nữ này cần được theo dõi cẩn thận trong thai kỳ, và có thể phải dùng thuốc để kiểm soát bệnh của họ. Một cuộc thảo luận chi tiết về thai kỳ ở phụ nữ mắc bệnh thận nền được trình bày riêng (see “Pregnancy in women with nondialysis chronic kidney disease”), và cách tiếp cận điều trị đợt bùng phát bệnh lupus trong thai kỳ được thảo luận dưới đây. (See ‘Management during pregnancy’ below.)
Những phụ nữ bị SLE đã được ghép thận có kết cục thai kỳ tương tự như những người được ghép thận khác [ 52 Ị. Quản lý thai kỳ sau khi ghép thận được thảo luận riêng. (See “Kidney transplantation ìn adults: Sexual and reproductive health after kidney transplantation”, section on ‘Pregnancy’.)
Sự hiện diện của các kháng thể kháng phospholipid – aPLs có ở khoảng một phần tư đến một nửa số bệnh nhân bị SLE; tuy nhiên, một số ít bệnh nhân bị các biến chứng sản khoa hoặc huyết khối liên quan đến APS.
Phụ nữ mang thai bị SLE có tiền sử sản khoa gợi ý APS (thai chết sau 10 tuần hoặc sẩy thai liên tiếp từ ba lần trở lên, hoặc sinh non < 34 tuần do tiền sản giật hoặc suy nhau thai) hoặc biến cố huyết khối tĩnh mạch hoặc động mạch không rõ nguyên nhân, cần được xét nghiệm sự hiện diện của aPLs (tức là kháng thể chống đông lupus [LA], và kháng thể kháng cardiolipin [aCL] IgM và IgG, và kháng thể kháng beta2-glycoprotein [GP] I IgM và IgG ). Các biểu hiện lâm sàng, chẩn đoán và quản lý phụ nữ có aPL dự định mang thai hoặc đang mang thai được thảo luận chi tiết hơn. (See “Antiphospholipid syndrome: Pregnancy implications and management in pregnant women” and “Diagnosis of antiphospholipid syndrome”.)
Không rõ liệu phụ nữ có aPLs mà không được chẩn đoán APS có tảng nguy cơ sảy thai hay không [ 53 Ị. Các vấn đề liên quan đến sự hiện diện của các tự kháng thể này ở phụ nữ mang thai và quản lý các bệnh nhân này được thảo luận riêng. (See “Antiphospholipid syndrome: Pregnancy implications and management in pregnant women”, section on ‘Management’.)
Sự hiện diện của kháng thể kháng Ro và kháng La – Như đã đề cập ở trên, thai nhi phơi nhiễm với kháng thể kháng Ro/SSA và / hoặc kháng La/SSB gia tăng nguy cơ phát triển block tim hoàn toàn bẩm sinh hoặc NL (see ‘Fetal complications’ above). Trong hầu hết các trường hợp, block tim bẩm sinh phát triển từ 18 đến 24 tuần tuổi thai. Vì vậy, ở một số trung tâm, những phụ nữ có kháng thể kháng Ro/SSA và / hoặc La/SSB được tăng cường giám sát thai nhi đối với block tim, với các quy trình giám sát khác nhau giữa các trung tâm. Mặc dù không có can thiệp điều trị nào được chứng minh là có thể ngăn ngừa sự tiến triển, nhưng việc phát hiện sớm cho phép tăng cường theo dõi. Theo dõi và quản lý block tim bẩm sinh liên quan đến bệnh lupus sơ sinh được thảo luận chi tiết ở chủ đề riêng. (See “Neonatal lupus: Epidemiology, pathogenesis, clinical manifestations, and diagnosis”, section on ‘Heart block’ and “Neonatal lupus: Epidemiology, pathogenesis, clinical manifestations, and diagnosis”, section on ‘Fetal surveillance for heart block* and “Neonatal lupus: Management and outcomes”, section on ‘In utero management’.)
Sử dụng HCQ trong thai kỳ có liên quan đến việc giảm tỷ lệ block tim bẩm sinh [18,54,55] (See “Neonatal lupus: Management and outcomes”, section on ‘Prevention of NL in subseguent pregnancies’.)
Phụ nữ có anti-Ro/SSA và anti-La/SSB có thể phát hiện được lượng kháng thể này trong sữa mẹ, nhưng không có bằng chứng nào cho thấy NL là hậu quả của việc cho con bú sữa mẹ [56].
QUẢN LÝ TRONG THAI KỲ
Quản lý thai phụ mắc bệnh lupus ban đỏ hệ thống (SLE) cần có sự hợp tác chặt chẽ giữa bác sĩ thấp khớp và bác sĩ sản khoa có kinh nghiệm trong việc chăm sóc các bà mẹ có nguy cơ cao. Cách tiếp cận theo dõi thai phụ mắc SLE cũng như điều trị SLE hoạt động trong thai kỳ được trình bày dưới đây.
Theo dõi mức độ hoạt động của SLE
Phụ nữ nên được bác sĩ thấp khớp học đánh giá mức độ hoạt động của bệnh ít nhất ba tháng/lần và thường xuyên hơn nếu họ có SLE hoạt động. Kế hoạch theo dõi bao gồm:
Đánh giá ban đầu – Ở lần khám đầu tiên sau khi (hoặc tại thời điểm) mang thai được xác nhận, các thăm khám, xét nghiệm sau sau được khuyến nghị [57]:
- Khám lâm sàng, bao gồm cả đo huyết áp
- Chức năng thận (creatinin, phân tích nước tiểu, tỷ lệ protein/creatinin ở mẫu nước tiểu ngẫu nhiên)
- Công thức máu toàn bộ (CBC)
- Xét nghiệm chức năng gan
- Kháng thể kháng Ro/SSA và kháng La/SSB
- Các xét nghiệm kháng thể chống đông lupus (LA) và kháng cardiolipin (aCL)
- Kháng thể kháng DNA chuỗi kép (dsDNA)
- Bổ thể (CH50, hoặc C3 và C4)
- Axit uric huyết thanh
Một số thay đổi sinh lý của thai kỳ có thể chồng lấp với các đặc điểm của SLE hoạt động, gây khó khăn cho việc phân biệt. Ví dụ, các dấu hiệu cận lâm sàng có thể được quan sát thấy trong thai kỳ bình thường bao gồm thiếu máu nhẹ, giảm tiểu cầu nhẹ, tăng tốc độ lắng hồng cầu (ESR) và protein niệu. Sự bài xuất protein tăng ở thai kỳ bình thường, nhưng vẫn dưới 300 mg/24 giờ. Lấy mẫu nước tiểu 24 giờ ban đầu có thể hữu ích trong việc phân biệt đợt bùng phát lupus với tiền sản giật và những thay đổi bình thường sau này của thai kỳ (see ‘Preeclampsia versus lupus nephritis’ below). Ngoài ra, trong thai kỳ bình thường, nồng độ bổ thể có thể tăng từ 10 đến 50 % và dường như có thể vẫn bình thường mặc dù SLE hoạt động. Do đó, xu hướng của nồng độ bổ thể thường mang lại nhiều thông tin hơn giá trị thực tế.
Do đó, xét nghiệm cận lâm sàng phải được phiên giải trong bối cảnh lâm sàng và những phụ nữ có bằng chứng về sự gia tăng hoạt tính huyết thanh học nhưng vẫn không có triệu chứng nên được theo dõi chặt chẽ hơn. Chúng tôi không bắt đầu điều trị với các dấu hiệu huyết thanh học đơn thuần.
Xét nghiệm cận lâm sàng – Ngoài việc khám lâm sàng với đo huyết áp, các xét nghiệm cận lâm sàng sau đây được khuyến nghị thường xuyên trong thai kỳ:
- Công thức máu toàn bộ (CBC)
- Creatinine
- Phân tích nước tiểu với kiểm tra cặn nước tiểu
- Tỷ lệ protein/creatinine ở mẫu nước tiểu ngẫu nhiên hoặc mẫu nước tiểu 24 giờ
Các xét nghiệm cận lâm sàng sau đây nên được thực hiện ở những bệnh nhân mắc bệnh đang hoạt động hoặc những người trước đó đã có biểu hiện thay đổi ở các mức độ này với đợt bùng phát:
- Kháng thể kháng dsDNA
- Bổ thể (CH50, hoặc C3 và C4)
Chỉ định thêm các xét nghiệm cận lâm sàng như xét nghiệm chức năng gan và axit uric huyết thanh tùy theo biểu hiện lâm sàng. Tần suất xét nghiệm cận lâm sàng được cá nhân hóa và thay đổi theo mức độ hoạt động của bệnh. Những bệnh nhân mắc bệnh ổn định, tốt nhất nên làm xét nghiệm mỗi ba tháng, nhưng những người mắc bệnh lupus đang hoạt động sẽ cần xét nghiệm thường xuyên hơn.
Xét nghiệm cận lâm sàng sau sinh – Một số phụ nữ sẽ trải qua các đợt cấp của SLE trong thời kỳ hậu sản. Những người mắc bệnh đang hoạt động khi thụ thai và những người bị tổn thương cơ quan đích đáng kể có nguy cơ bùng phát bệnh trong thời kỳ hậu sản cao hơn so với những phụ nữ mắc bệnh không hoạt động [ 58 Ị. Vì vậy, đánh giá định kỳ mức độ hoạt động của bệnh được cho phép sau sinh. Các xét nghiệm cận lâm sàng sau đây được khuyến nghị lúc một tháng sau sinh không biến chứng [ 57 Ị:
- Phân tích nước tiểu, tỷ lệ protein/creatinin trong nước tiểu
- Chức năng thận nếu phân tích nước tiểu bất thường
- Công thức máu toàn bộ (CBC)
Chúng tôi cũng kiểm tra các xét nghiệm cận lâm sàng sau đây ở những bệnh nhân mắc bệnh nặng hoặc ở những bệnh nhân có mức anti-dsDNA và bổ thể tương quan tốt với mức độ hoạt động của bệnh:
- Anti-dsDNA
- Bổ thể (CH50, hoặc C3 và C4)
Điều trị cho phụ nữ sau sinh bị SLE hoạt động giống như đối với phụ nữ không mang thai. Một số thuốc được sử dụng để quản lý SLE hoạt động không tương thích với việc cho con bú; do đó, phụ nữ cho con bú sẽ cần thảo luận kỹ lưỡng với bác sĩ của họ về nguy cơ và lợi ích của các phương pháp điều trị khác nhau. Trong nhiều trường hợp, tính an toàn của thuốc trong thai kỳ khác với tính an toàn của thuốc trong thời kỳ cho con bú. (See ‘Breastfeeding1 below.)
Theo dõi mẹ – thai nhi
Lịch trình theo dõi tối ưu để đảm bảo sức khỏe mẹ và thai nhi trong suốt thai kỳ thì không rõ. Những phụ nữ có các yếu tố nguy cơ hoặc các chỉ số tiên lượng xấu sẽ cần theo dõi thường xuyên hơn. Ngoài việc chăm sóc tiền sản thường quy, theo dõi thai nhi ở những phụ nữ bị SLE bao gồm:
- Đánh giá siêu âm ba tháng đầu để xác định ngày dự sinh. Một cuộc khảo sát về giải phẫu thai nhi được thực hiện khi tuổi thai khoảng 18 tuần.
- Đánh giá siêu âm về sự tăng trưởng của thai và tình trạng suy nhau thai ở ba tháng cuối. Tần suất theo dõi sự tăng trưởng của thai phụ thuộc vào sức khỏe của mẹ và thai nhi, nhưng thường sẽ được thực hiện khoảng bốn tuần một lần. Theo dõi thường xuyên hơn, bao gồm cả đo vận tốc Doppler, cũng được khuyến cáo nếu nghi ngờ thai chậm tăng trưởng hoặc suy nhau thai. (See “Fetal growth restriction: Evaluation and management”, section on ‘Pregnancy management1.)
- Đánh giá thai bằng các test nonstress và I hoặc trắc đồ sinh vật lý trong bốn đến sáu tuần cuối của thai kỳ được chỉ định ở hầu hết phụ nữ bị lupus, với các kế hoạch giám sát riêng biệt dựa trên đánh giá của mẹ và thai nhi. (See “Overview of antepartum fetal surveillance”,)
- ở những bệnh nhân có kháng thể kháng Ro/SSA và / hoặc kháng La/SSB dương tính, khuyến cáo nên tăng cường giám sát block tim bẩm sinh. (See “Neonatal lupus: Epidemiology, pathogenesis, clinical manifestations, and diagnosis”, section on ‘Fetal surveillance for heart block’ and ‘Presence of anti-Ro and anti-La antibodies’ a bo ve.)
Tiền sản giật
Phụ nữ mắc SLE có nguy cơ bị tiền sản giật cao hơn dân số chung. Những bệnh nhân này cần được cảnh giác hơn, vì biểu hiện tăng huyết áp, protein niệu, hoặc rối loạn chức năng cơ quan đích sau 20 tuần tuổi thai có liên quan đến sự phát triển tiền sản giật. Chậm tăng trưởng nặng, khởi phát sớm cũng có liên quan đến sự phát triển tiền sản giật. Trong khi tiền sản giật xuất hiện muộn hơn trong thai kỳ thường có thể xử trí theo dõi, nhưng ở những tuổi thai trước/ ranh giới thai có thể sống, chấm dứt thai kỳ được chỉ định để ngăn ngừa các biến chứng nguy hiểm cho mẹ. Vì lý do này, chẩn đoán sớm là điều vô cùng cần thiết.
Ở phụ nữ có nguy cơ cao bị tiền sản giật, bao gồm tất cả phụ nữ bị SLE, aspirin liều thấp đã được chứng minh là làm giảm nguy cơ mắc bệnh tuyệt đối khoảng 2 đến 5% khi bắt đầu từ 12 đến 16 tuần tuổi thai [ 19,59 Ị. Sử dụng aspirin liều thấp để dự phòng tiền sản giật được thảo luận chi tiết riêng (see “Preeclampsia: Prevention”, section on ‘Candidates’ and ‘Recommended during pregnancy’ above). Tiền sản giật ở phụ nữ mắc hội chứng kháng phospholipid (APS) cũng được thảo luận riêng. (See “Antiphospholipid syndrome: Pregnancy implications and management in pregnant women”.)
Tiền sản giật so với viêm thận lupus – Phân biệt tiền sản giật với viêm thận lupus hoặc một đợt bùng phát lupus có thể là một thách thức. Các đợt bùng phát viêm thận lupus trong thai kỳ có thể giống tiền sản giật, với biểu hiện tăng protein niệu, tăng huyết áp, giảm tiểu cầu và suy giảm chức năng thận. Viêm thận lupus đang hoạt động và tiền sản giật cũng có thể xảy ra đồng thời. Bằng chứng về hoạt động của lupus ở các cơ quan khác đôi khi có thể giúp phân biệt SLE với tiền sản giật.
Xét nghiệm cận lâm sàng có thể, nhưng không phải lúc nào cũng hữu ích trong việc phân biệt tiền sản giật với viêm thận hoặc đợt bùng phát lupus:
- Viêm thận lupus thường liên quan đến protein niệu và / hoặc cặn lắng nước tiểu hoạt động (trụ hồng cầu và trụ bạch cầu và trụ tế bào), trong khi protein niệu chỉ thấy trong tiền sản giật.
- Các đợt bùng phát của SLE có thể liên quan đến nồng độ bổ thể thấp hoặc giảm và tăng hiệu giá của kháng thể kháng DNA; so sánh, nồng độ bổ thể thường, nhưng không phải lúc nào cũng bình thường hoặc tăng trong tiền sản giật [ 60-62 Ị.
- Giảm tiểu cầu, tăng nồng độ men gan trong huyết thanh và tăng hoặc tăng nồng độ axit uric là những biểu hiện nổi bật trong tiền sản giật hơn là viêm thận lupus. Tuy nhiên, giảm tiểu cầu cũng có thể được thấy liên quan đến các kháng thể kháng phospholipid (aPL), ban xuất huyết giảm tiểu cầu huyết khối và giảm tiểu cầu miễn dịch, mỗi bệnh đều có thể gây biến chứng thai kỳ ở phụ nữ bị SLE.
Sự khởi phát của các triệu chứng chồng chéo này trước 20 tuần tuổi thai phù hợp hơn với bệnh viêm thận lupus. Sinh thiết thận có thể giúp phân biệt hai tình trạng này, nhưng nguy cơ biến chứng thai kỳ cao hơn sẽ hạn chế việc sử dụng trong thai kỳ. (See “Acute kidney injury in pregnancy”.)
Điều trị SLE đang hoạt động
Điều trị SLE đang hoạt động trong khi mang thai theo mức độ nặng của bệnh và mức độ ảnh hưởng đến các cơ quan, tương tự như các bệnh nhân không mang thai. Không nên ngừng điều trị do mang thai; tuy nhiên, một số thuốc dùng để điều trị SLE CÓ thể đi qua nhau thai và gây hại cho thai nhi. Do đó, nguy cơ và lợi ích của việc điều trị trong thai kỳ phải được cân nhắc với nguy cơ hoạt động của SLE có ảnh hưởng xấu đến mẹ và thai nhi. Các thuốc thường được sử dụng nhất để điều trị bệnh nhân SLE đã được xem xét ở trên (see ‘Medications’ above). Sử dụng thuốc ức chế miễn dịch trong thai kỳ được thảo luận chi tiết riêng. (See “Safety of rheumatic disease medication use during pregnancy and lactation”.)
Một cuộc thảo luận chi tiết về việc điều trị bệnh lupus hoạt động được trình bày ở chủ đề riêng. (See “Overview of the management and prognosis of systemic lupus erythematosus in adults”, section on ‘Pharmacologic therapies’.)
Viêm thận lupus trong thai kỳ cần được xem xét đặc biệt vì khả năng gây bệnh tật và có thể nhầm lẫn với tiền sản giật. (See ‘Lupus nephritis’ above and ‘Preeclampsia versus lupus nephritis’ above.)
CHO CON BÚ SỮA MẸ
Hầu hết phụ nữ mắc bệnh lupus ban đỏ hệ thống (SLE) đều được khuyến khích cho con bú. Tính an toàn của các thuốc trong thời kỳ cho con bú đôi khi khác nhau, và việc sử dụng chúng nên được thảo luận ở cấp độ cá nhân và xem xét các nguy cơ cụ thể. Trẻ sinh non hoặc trẻ bị bệnh có thể gia tăng nguy cơ phơi nhiễm với một số thuốc.
Hydroxychloroguine (HCQ), prednisone , cyclosporine , azathioprine vá tacrolimus đươc coi là tương thích với việc cho con bú. Methotrexate , mycophenolate mofetil, cyclophosphamide , leflunomide , và các phân tử nhỏ như tofacitinib không tương thích với việc cho con bú. Các thuốc sinh học, với kích thước lớn, không có khả năng đi vào sữa mẹ với nồng độ đáng kể và tương thích với việc cho con bú. Thông tin chi tiết về khả năng tương thích của các thuốc với thời kỳ cho con bú được cung cấp bởi United States National Library of Medicine (LactMed drug and lactation database) [ 63 Ị. Một cuộc thảo luận chi tiết hơn về việc sử dụng các thuốc ức chế miễn dịch trong thời kỳ cho con bú có thể được tìm thấy ở nơi khác. (See “Safety of rheumatic disease medication use during pregnancy and lactation”.)
TÓM TẮT VÀ KHUYÊN CÁO
- Tốt nhất, tất cả các thai kỳ ở phụ nữ mắc bệnh lupus ban đỏ hệ thống (SLE) nên được lên kế hoạch trong thời gian bệnh ổn định ít nhất sáu tháng trước khi thụ thai. SLE hoạt động tại thời điểm thụ thai là một yếu tố dự báo mạnh các kết cục bất lợi về sản khoa và đối với mẹ [ 1-3 Ị. Bất chấp nguy cơ này, phần lớn các trường hợp mang thai như vậy vẫn dẫn đến những ca sinh sống. (See ‘Introduction’ above and ‘Pregnancy planning’ )
- Đánh giá trước khi mang thai là vô cùng cần thiết ở phụ nữ bị SLE để xác định xem liệu việc mang thai có thể gây ra nguy cơ cao không thể chấp nhận được cho mẹ hoặc thai nhi hay không, để bắt đầu các biện pháp can thiệp nhằm tối ưu hóa mức độ hoạt động của bệnh và điều chỉnh thuốc với những loại có hồ sơ về tính an toàn tốt nhất trong thai kỳ (See ‘Preconception evaluation’ above and ‘Specific laboratory testing’ above and ‘Medications’ a bo ve.)
- Phụ nữ mang thai lần đầu và phụ nữ có tiền sử viêm thận lupus hoặc viêm thận đang hoạt động có nguy cơ bùng phát bệnh cao nhất. Tỷ lệ biến chứng cao hơn như tiền sản giật, sinh non, mất thai, chậm tăng trưởng và hội chứng lupus sơ sinh (NL) được thấy trong bệnh lupus thai kỳ. (See ‘Exacerbation of SLE’ above and ‘Impact of lupus on pregnancy’ above and ‘Fetal complications’ above and ‘Special considerations’ )
- Quản lý thai phụ mắc bệnh lupus ban đỏ hệ thống (SLE) cần có sự hợp tác chặt chẽ giữa bác sĩ thấp khớp học và bác sĩ sản khoa có kinh nghiệm trong việc chăm sóc các bà mẹ có nguy cơ cao. Đánh giá định kỳ mức độ hoạt động của bệnh nên được thực hiện trong suốt thai kỳ và thời kỳ hậu sản. (See ‘Management during pregnancy’ above and ‘Monitoring SLE activity’ )
- Đối với tất cả phụ nữ mang thai bị SLE, chúng tôi đề nghị nên tiếp tục dùng hydroxychloroguine để làm giảm nguy cơ bùng phát SLE (Grade 2C). (See ‘Recommended during pregnancy’ )
- Phụ nữ bị SLE có nguy cơ tiền sản giật cao hơn dân số chung. Khuyến cáo sử dụng dự phòng aspirin liều thấp cho tiền sản giật được thảo luận chi tiết riêng (see “Preeclampsia: Prevention”, section on ’Candidates’). Các đợt bùng phát viêm thận lupus khi mang thai có thể giống tiền sản giật, và việc phân biệt hai bệnh này có thể là một thách thức. (See ‘Preeclampsia’ above and ‘Recommended during pregnancy’)
- Những phụ nữ có các yếu tố nguy cơ hoặc các chỉ số tiên lượng xấu có thể cần theo dõi mẹ-thai nhi thường xuyên hơn. ở những bệnh nhân có kháng thể kháng Ro/SSA và / hoặc kháng La/SSB dương tính, tăng cường giám sát block tim bẩm sinh là thích hợp. (See ‘Maternal-fetal monitoring’ )
- Điều trị SLE đang hoạt động trong khi mang thai theo mức độ nặng của bệnh và mức độ ảnh hưởng đến các cơ quan, tương tự như các bệnh nhân không mang thai. Không nên ngừng điều trị do mang thai; tuy nhiên, một số thuốc dùng để điều trị SLE có thể đi gua nhau thai và gây hại cho thai nhi. Do đó, nguy cơ và lợi ích của việc điều trị trong thai kỳ phải được cân nhắc với nguy cơ hoạt động của SLE có ảnh hưởng xấu đến mẹ và thai nhi.
THAM KHẢO
- Clowse ME, Magder LS, Witter F, Petri M. The impact of increased lupus activity on obstetric outcomes. Arthritis Rheum 2005; 52:514.
- Yang H, Liu H, Xu D, et al. Pregnancy-related systemic lupus erythematosus: clinical features, outcome and risk factors of disease flares-a case control study. PLoS One 2014; 9:e104375.
- Kwok LW, Tam LS, Zhu T, et al. Predictors of maternal and fetal outcomes in pregnancies of patients with systemic lupus erythematosus. Lupus 2011; 20:829.
- Buyon JP, Kim MY, Guerra MM, et al. Predictors of Pregnancy Outcomes in Patients With Lupus: A Cohort study. Ann Intern Med 2015; 163:153,
- Andreoli L, Bertsias GK, Agmon-Levin N, et al. EULAR recommendations for women’s health and the management of family planning, assisted reproduction, pregnancy and menopause in patients with systemic lupus erythematosus and/or antiphospholipid syndrome. Ann Rheum Dis 2017; 76:476.
- Sammaritano LR, Bermas BL, Chakravarty EE, et al. 2020 American College of Rheumatology Guideline for the Management of Reproductive Health in Rheumatic and Musculoskeletal Diseases. Arthritis Rheumatol 2020; 72:529.
- Ruiz-lrastorza G, Khamashta MA. Lupus and pregnancy: ten questions and some answers. Lupus 2008; 17:416.
- Lateef A, Petri M. Managing lupus patients during pregnancy. Best Pract Res Clin Rheumatol 2013; 27:435.
- Clowse ME, Magder L, Witter F, Petri M. Hydroxychloroquine in lupus pregnancy. Arthritis Rheum 2006; 54:3640.
- Al-Herz A, Schulzer M, Esdaile JM. Survey of antimalarial use in lupus pregnancy and lactation. J Rheumatol 2002; 29:700.
- Parke AL, Rothfield NF. Antimalarial drugs in pregnancy–the North American experience. Lupus 1996; 5 Suppl 1:S67.
- Klinger G, Morad Y, Westall CA, et al. Ocular toxicity and antenatal exposure to chloroquine or hydroxychloroquine for rheumatic diseases. Lancet 2001; 358:813.
- Costedoat-Chalumeau N, Amoura z, Duhaut p, et al. Safety of hydroxychloroquine in pregnant patients with connective tissue diseases: a study of one hundred thirty-three cases compared with a control group. Arthritis Rheum 2003; 48:3207.
- Levy RA, Vilela vs, Cataldo MJ, et al. Hydroxychloroquine (HCQ) ỉn lupus pregnancy: double-blind and placebo-controlled study. Lupus 2001; 10:401.
- Sperber K, Hom c, Chao CP, et al. Systematic review of hydroxychloroquine use in pregnant patients with autoimmune diseases. Pediatr Rheumatol Online J 2009; 7:9.
- Koh JH, Ko HS, Kwok SK, et al. Hydroxychloroquine and pregnancy on lupus flares in Korean patients with systemic lupus erythematosus. Lupus 2015; 24:210.
- Eudy AM, Siega-Riz AM, Engel SM, et al. Effect of pregnancy on disease flares in patients with systemic lupus erythematosus. Ann Rheum Dis 2018; 77:855.
- Izmirly p, Saxena A, Buyon JP. Progress in the pathogenesis and treatment of cardiac manifestations of neonatal lupus. Curr Opin Rheumatol 2017; 29:467.
- LeFevre ML, U.S. Preventive Services Task Force. Low-dose aspirin use for the prevention of morbidity and mortality from preeclampsia: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med 2014; 161:819,
- Webster p, Wardle A, Bramham K, et al. Tacrolimus is an effective treatment for lupus nephritis in pregnancy. Lupus 2014; 23:1192.
- Smyth A, Oliveira GH, Lahr BD, et al. A systematic review and meta-analysis of pregnancy outcomes in patients with systemic lupus erythematosus and lupus nephritis. Clin J Am Soc Nephrol 2010; 5:2060.
- Petri M. Prospective study of systemic lupus erythematosus pregnancies. Lupus 2004; 13:688.
- Gladman DP, Tandon A, Ibanez D, Urowitz MB. The effect of lupus nephritis on pregnancy outcome and fetal and maternal complications. J Rheumatol 2010; 37:754.
- Saavedra MA, Cruz-Reyes c, Vera-Lastra o, et al. Impact of previous lupus nephritis on maternal and fetal outcomes during pregnancy. Clin Rheumatol 2012; 31:813,
- Saavedra MA, Sanchez A, Morales s, et al. Primigravida is associated with flare in women with systemic lupus erythematosus. Lupus 2015; 24:180.
- Clowse ME, Jamison M, Myers E, James AH. A national study of the complications of lupus in pregnancy. Am J Obstet Gynecol 2008; 199:127.e1.
- Yasmeen s, Wilkins EE, Field NT, et al. Pregnancy outcomes in women with systemic lupus erythematosus. J Matern Fetal Med 2001; 10:91.
- Mehta B, Luo Y, Xu J, et al. Trends in Maternal and Fetal Outcomes Among Pregnant Women With Systemic Lupus Erythematosus in the United States: A Cross-sectional Analysis. Ann Intern Med 2019; 171:164.
- Borella E, Lojacono A, Gatto M, et al. Predictors of maternal and fetal complications in SLE patients: a prospective study. Immunol Res 2014; 60:170.
- Chakravarty EF, Colon I, Langen ES, et al. Factors that predict prematurity and preeclampsia in pregnancies that are complicated by systemic lupus erythematosus. Am J Obstet Gynecol 2005; 192:1897.
- Bramham K, Hunt BJ, Bewley s, et al. Pregnancy outcomes in systemic lupus erythematosus with and without previous nephritis. J Rheumatol 2011; 38:1906.
- Abalos E, Cuesta c, Grosso AL, et al. Global and regional estimates of preeclampsia and eclampsia: a systematic review. Eur J Obstet Gynecol Reprod Biol 2013; 170:1.
- Gibbins KJ, Ware Branch D. Pre-eclampsia as a manifestation of antiphospholipid syndrome: assessing the current status. Lupus 2014; 23:1229.
- Eudy AM, Jayasundara M, Haroun T, et al. Reasons for cesarean and medically indicated deliveries in pregnancies in women with systemic lupus erythematosus. Lupus 2018; 27:351.
- Wagner SJ, Craici I, Reed D, et al. Maternal and foetal outcomes in pregnant patients with active lupus nephritis. Lupus 2009; 18:342.
- Carvalheiras G, Vita p, Marta s, et al. Pregnancy and systemic lupus erythematosus: review of clinical features and outcome of 51 pregnancies at a single institution. Clin Rev Allergy Immunol 2010; 38:302.
- Wilcox AJ, Weinberg CR, O’Connor JF, et al. Incidence of early loss of pregnancy. N Engl J Med 1988; 319:189.
- Wang X, Chen c, Wang L, et al. Conception, early pregnancy loss, and time to clinical pregnancy: a population-based prospective study. Fertil steril 2003; 79:577.
- Clowse ME. Lupus activity in pregnancy. Rheum Dis Clin North Am 2007; 33:237.
- Brucato A, Frassi M, Franceschini F, et al. Risk of congenital complete heart block in newborns of mothers with anti-Ro/SSA antibodies detected by counterimmunoelectrophoresis: a prospective study of 100 women. Arthritis Rheum 2001; 44:1832.
- Buyon JP, Hiebert R, Copel J, et al. Autoimmune-associated congenital heart block: demographics, mortality, morbidity and recurrence rates obtained from a national neonatal lupus registry. J Am Coll Cardiol 1998; 31:1658.
- Izmirly PM, Llanos c, Lee LA, et al. Cutaneous manifestations of neonatal lupus and risk of subseguent congenital heart block. Arthritis Rheum 2010; 62:1153,
- Llanos c, Izmirly PM, Katholi M, et al. Recurrence rates of cardiac manifestations associated with neonatal lupus and maternal/fetal risk factors. Arthritis Rheum 2009; 60:3091,
- Ambrosi A, Wahren-Herlenius M. Congenital heart block: evidence for a pathogenic role of maternal autoantibodies. Arthritis Res Ther 2012; 14:208.
- Hoxha A, Ruffatti A, Ambrosi A, et al. Identification of discrete epitopes of Ro52p200 and association with fetal cardiac conduction system manifestations in a rodent model. Clin Exp Immunol 2016; 186:284.
- Barnabe c, Faris PD, Quan H. Canadian pregnancy outcomes in rheumatoid arthritis and systemic lupus erythematosus. Int J Rheumatol 2011; 2011:345727.
- Nalli c, lodice A, Andreoli L, et al. Children born to SLE and APS mothers. Lupus 2014; 23:1246.
- Ross G, Sammaritano L, Nass R, Lockshin M. Effects of mothers’ autoimmune disease during pregnancy on learning disabilities and hand preference in their children. Arch Pediatr Adolesc Med 2003; 157:397.
- Vỉnet É, Pineau CA, Clarke AE, et al. Neurodevelopmental disorders in children born to mothers with systemic lupus erythematosus. Lupus 2014; 23:1099.
- Tsai PH, Yu KH, Chou I J, et al. Risk of autism spectrum disorder in children born to mothers with systemic lupus erythematosus and rheumatoid arthritis in Taiwan. Joint Bone Spine 2018; 85:599.
- Yousef Yengej FA, van Royen-Kerkhof A, Derksen RHWM, Fritsch-Stork RDE. The development of offspring from mothers with systemic lupus erythematosus. A systematic review. Autoimmun Rev 2017; 16:701.
- McGrory CH, McCloskey LJ, DeHoratius RJ, et al. Pregnancy outcomes in female renal recipients: a comparison of systemic lupus erythematosus with other diagnoses. Am J Transplant 2003; 3:35.
- Chiqhizola CB, Andreoli L, de Jesus GR, et al. The association between antiphospholipid antibodies and pregnancy morbidity, stroke, myocardial infarction, and deep vein thrombosis: a critical review of the literature. Lupus 2015; 24:980.
- Izmirly PM, Kim MY, Llanos c, et al. Evaluation of the risk of anti-SSA/Ro-SSB/La antibody-associated cardiac manifestations of neonatal lupus in fetuses of mothers with systemic lupus erythematosus exposed to hydroxychloroquine. Ann Rheum Dis 2010; 69:1827,
- Izmirly PM, Costedoat-Chalumeau N, Pisoni CN, et al. Maternal use of hydroxychloroquine is associated with a reduced risk of recurrent anti-SSA/Ro-antibody-associated cardiac manifestations of neonatal lupus. Circulation 2012; 126:76.
- Askanase AD, Miranda-Carus ME, Tang X, et al. The presence of IqG antibodies reactive with components of the SSA/Ro-SSB/La complex in human breast milk: implications in neonatal lupus. Arthritis Rheum 2002; 46:269.
- Lockshin MD, Sammaritano LR. Lupus pregnancy. Autoimmunity 2003; 36:33.
- Andrade RM, McGwin G Jr, Alarcón GS, et al. Predictors of post-partum damage accrual in systemic lupus erythematosus: data from LUMINA, a multiethnic US cohort (XXXVIII). Rheumatology (Oxford) 2006; 45:1380.
- ACOG Committee Opinion No. 743: Low-Dose Aspirin Use During Pregnancy. Obstet Gynecol 2018; 132:e44.
- Buyon JP, Cronstein BN, Morris M, et al. Serum complement values (C3 and C4) to differentiate between systemic lupus activity and pre-eclampsia. Am J Med 1986; 81:194.
- Buyon JP, Tamerius J, Ordorica s, et al. Activation of the alternative complement pathway accompanies disease flares in systemic lupus erythematosus during pregnancy. Arthritis Rheum 1992; 35:55.
- Clowse ME, Magder LS, Petri M. The clinical utility of measuring complement and anti- dsDNA antibodies during pregnancy in patients with systemic lupus erythematosus. J Rheumatol 2011; 38:1012.
- Drugs and lactation database (LactMed) of the United States National Library of Medici ne http://toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen7LACT (Accessed on March 15, 2012).

