Ung thư
Hội chứng ly giải u là gì? Cơ chế bệnh sinh và biện pháp can thiệp
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết: Hội chứng ly giải u là gì? Cơ chế bệnh sinh và biện pháp can thiệp – Tải file PDF Tại Đây
Lược dịch: NTHN
TỔNG QUAN
Hội chứng ly giải u (TLS – Tumor lysis syndrome) là cấp cứu ung thư thường gặp nhất gây đe dọa tính mạng khi điều trị những trẻ bệnh lý ác tính tăng sản dòng lympho. Các bác sĩ nên cảnh giác với tình trạng này để dự phòng và quản lý kịp thời để tránh những hậu quả nghiêm trọng.
Phương pháp dự phòng trên những bệnh nhân nguy cơ TLS bao gồm truyền dịch tích cực, kết hợp lợi tiểu và các thuốc hạ acid uric. Cả allopurinol và urate oxidase hiệu quả trong giảm acid uric huyết thanh. Allopurinol nên được dùng dự phòng trong những trường hợp nguy cơ thấp trong khi urate oxidase nên được dùng trong điều trị những trường hợp nguy cơ trung bình – cao. Việc sử dụng lợi tiểu thường quy và kiềm hóa nước tiểu không được khuyến cáo. Điều chỉnh điện giải và liệu pháp thay thế thận cũng có thể cần thiết trong điều trị TlS.
GIỚI THIỆU
Hội chứng ly giải u (TLS) là các biến chứng đe dọa tính mạng tiềm ẩn sau đợt điều trị hóa chất tấn công trong các bệnh lý ác tính ở trẻ em, đặc biệt là bệnh lý ác tính tăng sản dòng lympho. TLS đặc trưng bởi một nhóm các rối loạn điện giải và chuyển hóa cấp tính như giải phóng một lượng lớn và đột ngột các chất trong tế bào như acid nucleic acids, acid uric, phosphorus, và kali vào trong tuần hoàn do phá vỡ tế bào u. Nó thường gặp trong những ngày đàu tiên sau khi bắt đầu điều trị thuốc độc tế bào, đặc biệt trong các bệnh lý ác tính huyết học như lymphoblastic leukemia và high-grade lymphomas (đặc biệt là Burkitt’s lymphoma). TLS tự phát – phát triển khi chưa điều trị thuốc độc tế bào cũng được mô tả ở trẻ có bệnh lý huyết học ác tính. Sự phá vỡ tế bào u làm giải phóng các chất chuyển hóa tiềm ẩn gây tử vong như tăng kali máu, tăng phospho máu, hạ calci máu, và tăng acid uric máu. Biểu hiện đầu tiên của TLS có thể mơ hồ và thường gặp ở những bệnh nhân ung thư không có TLS, như buồn nôn, nôn ói, tiêu chảy, đau cơ và dị cảm. Phù, rối loạn nhịp, và co giật thường là các biểu hiện muộn.
Do đó, điểm mấu chốt trong dự phòng và điều trị TLS bao gồm chỉ số nghi ngờ cao (high index of suspicion), phát hiện sớm các biến chứng chuyển hóa và thận, quản lý kịp thời bao gồm cả điều trị và dự phòng.
ĐỊNH NGHĨA
Năm 1993, Hande-Garrow đưa ra hệ thống xác định TLS dựa vào xét nghiệm hoặc lâm sàng trong vòng 4 ngày sau khi bắt đầu điều trị hóa chất. Tuy nhiên, hệ thống này không bao gồm những bệnh nhân có bất thường xét nghiệm trước khi bắt đầu điều trị và những trẻ bất thường xét nghiệm sau 4 ngày điều trị.
Năm 2004, Cairo-Bishop đưa ra phân loại mới của TLS (Hình 1). Theo định nghĩa của Cairo- Bishop về TLS, tiêu chuẩn xét nghiệm trong chẩn đoán cần từ 2 trong các bất thường xét nghiệm sau, bao gồm tăng hoặc giảm canxi, uric acid, kali hoặc phospho từ 25% trở lên trong vòng 3 ngày trước hoặc lên đến 7 ngày sau khi bắt đầu điều trị hóa chất. Tiêu chuẩ’n trong chẩ’n đoán TLS cần có tiêu chuẩ’n xét nghiệm kết hợp với một hoặc nhiều biến chứng trên lâm sàng, có thể là suy thận (được định nghĩa là creatinine huyết thanh tăng gấp 1.5 lần giới hạn trên bình thường), rối loạn nhịp tim, co giật, hoặc đột tử.
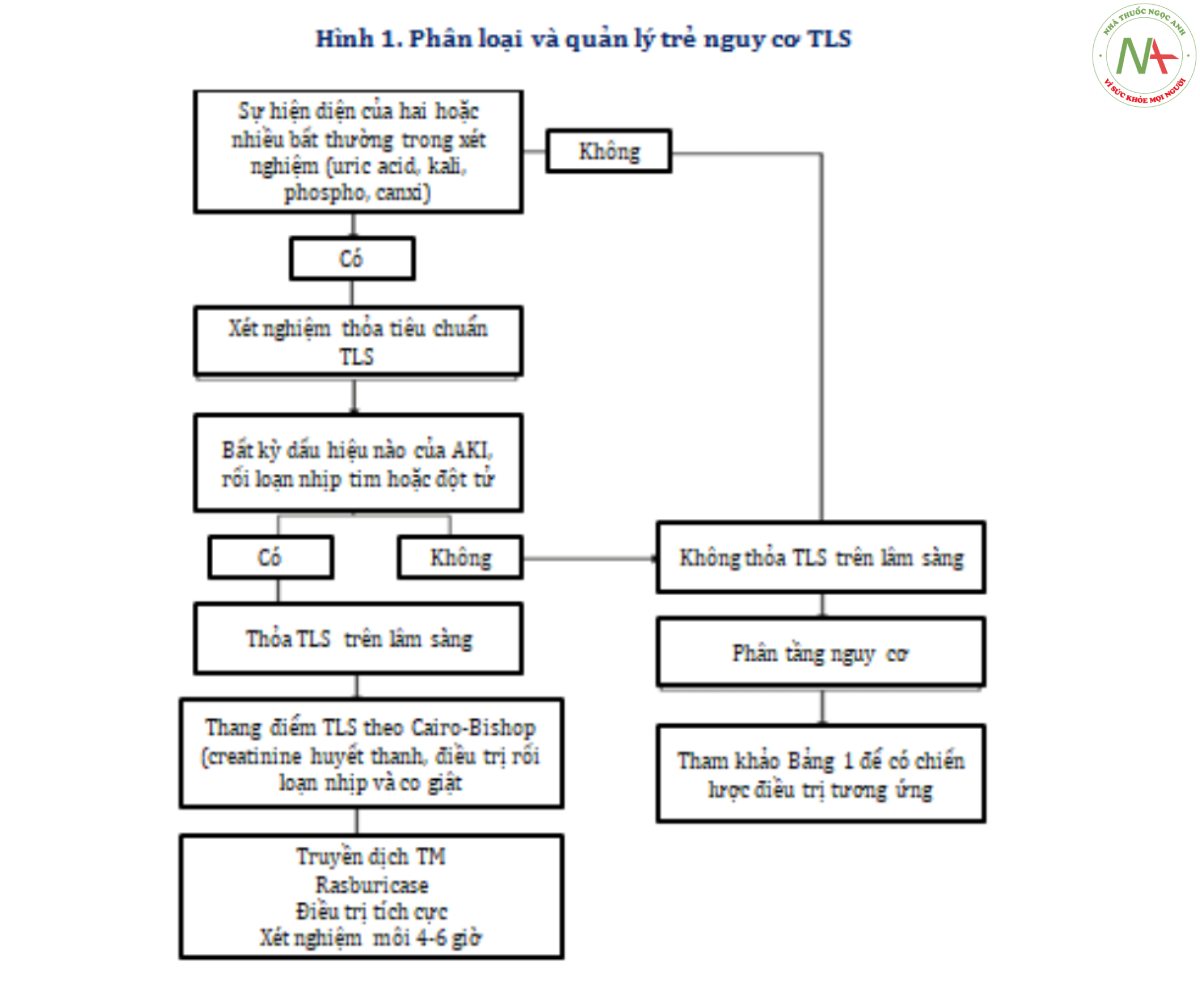
SINH LÝ BỆNH
TLS là hậu quả trực tiếp của sự ly giải nhanh chóng các tế bào ác tính gây giải phóng các chất chuyển hóa bên trong tế bào vào tuần hoàn. Vì tải lượng của các sản phẩm nội bào trong tuần hoàn tăng lên, nên cơ chế kiểm soát nội môi của các chất này bị quá mức, gây ra các hậu quả của TLS. Các chất như kali, phospho, và acid nucleic đóng vai trò chính trong cơ chế sinh lý bệnh của TLS. Mặc dù TLS có thể xuất hiện một cách tự nhiên, nhưng nó thường gặp nhất trong giai đoạn 48-72 giờ sau khi bắt đầu điều trị hóa chất.
Tăng kali máu
Tăng kali máu là biến chứng nghiêm trọng gây tử vong nhanh nhất của TLS. Nó thường là biểu hiện đầu tiên được tìm thấy trong TLS và có thể xuất hiện trong vòng 6 giờ sau khi bắt đầu điều trị hóa chất. Ly giải tế bào u gây giải phóng một lượng lớn kali – ion chủ yếu ở bên trong tế bào, vào trong tuần hoàn. Hơn thế nữa, nồng độ kali huyết thanh cũng tăng khi có tình trạng toan máu và suy thận cùng hiện diện. Biểu hiện ban đầu của tăng kali máu bao gồm tác động lên thần kinh cơ, gây yếu cơ và dị cảm, cũng như bất thường trên điện tim – sóng T cao nhọn, kéo dài PR và QRS.
Tăng phospho máu
Tế bào u có thể chứa phospho nội bào nhiều gấp 4 lần so với tế bào lympho trưởng thành bình thường. Sự giải phóng lượng phospho dự trữ có thể gây quá tải khả năng bài tiết ở thận, gây tăng phospho máu. Triệu chứng của tăng phospho máu bao gồm buồn nôn, nôn ói, tiêu chảy, lơ mơ, và co giật. Nhìn chung, tăng phospho máu thường gặp liên quan đến TLS xuấ hiện sau khi bắt đầu điều trị hóa chất hơn là TLS xảy ra tự nhiên. Điều này là do trong TLS xảy ra tự nhiên, các tế bào u có thể tí sử dụng phospho được giải phóng để hình thành tế bào u mới, và do đó ít gây tăng phospho máu.
Điều quan trọng là phospho trong máu có thể gắn với cations canxi, gây hạ canxi máu. Hạ canxi máu nặng gây rối loạn nhịp, tụt huyết áp, cơn gồng cứng, và co thắt cơ. Ngoài ra, canxi phosphate tích tụ ở ống thận và hệ thống dẫn truyền tim có thể gây suy thận và suy tim, tương ứng. Trong suy thận cấp, giảm nồng độ calcitriol cũng có thể gây hạ canxi máu.
Tăng uric máu
Ly giải tế bào u làm giải phóng purine nucleic acids, được chuyển hóa thành xanthine. Xanthine sau đó được chuyển hóa thành uric acid nhờ xanthine oxidase ở gan, gây tăng uric máu. Uric acid ít tan trong nước, và tính tan của nó kém hơn trong môi trường acid. Khi nồng độ acid uric tăng trong ống thận, làm tăng khả năng hình thành tinh thể uric acid và tích tụ, gây tắc nghẽn ống thận và bệnh lý thận urate. Với sự phát triển của các thuốc hạ uric máu, tăng uric không còn là hậu quả chính của TLS. Mặc khác, Xanthine có tính tan kém hơn uric acid. Nồng độ cao xanthine, đặc biệt trên những bệnh nhân được điều trị với allopurinol là yếu tố thúc đẩy bệnh lý thận do xanthine hoặc sỏi thận.
Tổn thương thận cấp (AKI)
TLS cũng thường liên quan đến suy thận cấp. Nguyên nhân thường gặp nhất gây suy thận cấp trong TLS là do tích tụ tinh thể acid uric ở ống thận. Giảm lưu dòng chảy ống thận và cô đặc máu ở tủy thận cũng góp phần hình thành tinh thể acid uric. Các cơ chế khác bao gồm tích tụ tinh thể canxi-phospho, tinh thể xanthine, u thâm nhiễm vào thận, bệnh thận tắc nghẽn do khối u, các thuốc gây độc tính lên thận, sepsis, giảm thể tích trước đó và/hoặc rối loạn chức năng thận. Hơn thế nữa, ly giải u làm giảm phóng cytokines, có thể bùng phát tổn thương thận cấp, hội chứng đáp ứng viêm toàn thân, và cuối cùng gây suy đa cơ quan.
| Nguy cơ | K, Ca, P, Cre, Uric acid, lượng nước tiểu | Khối u và tiềm năng ly giải u | Quản lý |
| Không đáng kể | < 1 trị số bất thường | Khối u nhỏ hoặc khu trú có thể cắt bỏ được HOẶC
Khối u kích thước trung bình với khả năng ly giải u thấp |
Không dự phòng hay theo dõi |
| Thấp | < 1 trị số bất thường | Khối u kích thước trung bình với tiềm năng ly giải u trung bình hoặc không rõ* HOẶC
Khối u to với tiềm ăn ly giải u thấp |
Truyền dịch TM
Allopurinol Xét nghiệm mỗi ngày |
| Trung bình | < 1 trị số bất thường | Khối u lớn với tiềm năng ly giải u trung bình/không rõ | Truyền dịch TM
Allopurinol hoặc rasburicase Xét nghiệm mỗi 8-12 giờ |
| Cao | Có thể không có | Khối u trung bình hoặc to với tiềm năng ly giải u cao HOẶC
Xét nghiệm chẩn đoán TLS |
Truyền dịch TM
Rasburicase Theo dõi tim Xét nghiệm mỗi 6-8 giờ |
| Chẩn đoán | > 2 trị số bất thường | Chẩn đoán TLS | Truyền dịch TM
Rasburicase Điều trị tích cực Xét nghiệm mỗi 4-6 giờ |
*Bệnh nhân không có bệnh lý thận, mất nước, toan máu, tụt huyết áp hay dùng các thuốc độc tính lên thận trước đó. Nếu có, nguy cơ nâng lên mức trung bình.
==>> Xem thêm: Nguyên bào nuôi sau đẻ di căn gan: báo cáo ca bệnh và tổng quan
YẾU TỐ NGUY CƠ
| Phân nhóm | Các yếu tố nguy cơ |
| Đặc điểm khối u | Tumor type: TLS thường gặp ở những bệnh nhân lymphoma non-Hodgkin và các bệnh lý huyết học ác tính khác, đặc biệt là lymphoma Burkitt, ALL và AML
Tumor burden: Khối u to (> 10 cm), số lượng tế bào nhiều (> 25 000 tế bào u/uL), u thâm nhiễm có bằng chứng tạng to (đặc biệt là thâm nhiễm thận hoặc tắc nghẽn hệ niệu), tham nhiễm tủy xương là các dấu hiệu tải lượng tế bào u cao Tốc độ tăng sản: LDH cao (> 2 lần giới hạn trên bình thường) – chỉ điểm khối u tăng sản, nguy cơ TLS cao hơn |
| Độ nhạy với điều trị thuốc: Bệnh lý ác tính nhạy với điều trị hóa chất có tốc độ ly giải tế bào cao hơn và do đó nguy cơ TLS cao hơn | |
| Đặc điểm bệnh nhân | Bệnh lý thận trước khi chẩn đoán ung thư: Bệnh lý thận trước đó do bất kỳ nguyên nhân gì, như tăng huyết áp và đái tháo đường, là yếu tố thúc đẩy nguy cơ TLS cao hơn
Bệnh lý trước đó hoặc đồng mắc gây giảm tưới máu thận: mất nước, giảm thể tích, tụt huyết áp. Trong những trường hợp này, lưu lượng ở ống thận giảm. Do đó, tăng cô đặc chất tan ở ống thận và có thể gây lắng đọng tinh thể, dẫn đến bệnh lý thận Tăng acid uric trước đó: Tăng nồng độ acid uric nền (> 450 umol/L) làm tăng nguy cơ TLS LDH cao trước điều trị: LDH huyết thanh nền cao hơn gấp 2 lần giới hạn trên bình thường cũng làm tăng nguy cơ TLS |
| Điều trị liên quan | Không đủ dịch: Tình trạng thiếu dịch làm giàm lưu lượng nước tiểu ở ống thận và gây hình thành tinh thể lắng đọng, gây tổn thương thận cấp
Kali ngoại sinh: Bù kali trong dịch tĩnh mạch, thuốc, hoặc thức ăn có thể tăng nguy cơ phát triển TLS Phosphate ngoại sinh Các thuốc độc tính lên thận: Vancomycin, aminoglycosides, thuốc cản quang có thể làm tăng nguy cơ tổ’n thương thận cấp trong ly giải u Trì hoãn loại bỏ acid uric: Tăng acid uric kéo dài, làm tăng nguy cơ hình thành tinh thể và tổn thương thận Điều trị hóa chất tích cực Lựa chọn hóa chất điều trị |
QUẢN LÝ
Phát hiện sớm bệnh nhân nguy cơ TLS là cần thiết trong quản lý. Quản lý tốt nhất trong TLS là dự phòng. Phương pháp dự phòng nên được áp dụng trên những bệnh nhân có nguy cơ TLS. Điều trị dự phòng bao gồm truyền dịch tích cực, sử dụng lợi tiểu và các thuốc làm giảm uric máu. Chiến lược điều trị, ngoài việc sử dụng các thuốc làm giảm acid uric máu bao gồm điều chỉnh điện giải và liệu pháp thay thế thận. Theo dõi sát các thông số tim mạch và thận cũng quan trọng trong quản lý nhóm bệnh nhân này.
Quản lý dịch
Thiếu dịch là yếu tố nguy cơ chính trong TLS. Bù dịch tích cực và lợi tiểu là căn bản trong dự phòng và quản lý TLS. Bù đủ dịch giúp cải thiện thể’ tích nội mạch, tăng cường tưới máu thận và độ lọc cầu thận, thúc đẩy bài tiết acid uric, kali và phosphate. Bù dịch tích cực được hiểu là truyền dịch tinh thể mức 2.5 (lên đến 3) L/m2/ngày để’ đạt được đích nước tiể’u ít nhất 4 ml/kg/giờ ở trẻ nhũ nhi và 100 ml/m2/giờ ở bệnh nhân lớn hơn. Sử dụng lợi tiểu quai cũng thường được khuyến cáo trong thực hành lâm sàng nếu thể tích nước tiểu dưới ngưỡng tối ưu sau khi bù đủ dịch hoặc nếu bệnh nhân có xu hướng quá tải dịch. Furosemide có thể được xem xét ở những bệnh nhân thể tích dịch bình thường có tăng kali máu hoặc ở bệnh nhân có quá tải dịch. Tuy nhiên, việc sử dụng lợi tiểu thường quy không được khuyến cáo vì sử dụng lợi tiểu có thể gây giảm thể tích và góp phần tích tụ canxi phosphate và uric acid ở ống thận trên những bệnh nhân giảm thể tích. Việc sử dụng lợi tiểu bị chống chỉ định trên những bệnh nhân có bệnh thận tắc nghẽn.
Kiềm hóa nước tiểu
Kiềm hóa nước tiểu với việc sử dụng nabicar đường tĩnh mạch được dùng trong quản lý TLS. Tuy nhiên, thực hành lâm sàng này phải được áp dụng một cách cẩn thận. Theo giả thuyết, kiểm hóa nước tiểu làm tăng khả năng hòa tan của acid uric và thúc đẩ’y bài tiết nó. Mặc khác, nó làm giảm tính tan của canxi phosphate và có thể gây tăng nguy cơ tích tụ canxi phosphate. Kiềm hóa pH huyết thanh cũng thúc đẩy gắn kết albumin-canxi và làm trầm trọng hơn tình trạng hạ canxi máu. Hơn thế nữa, tính tan của xanthine và hypoxenthine thấp hơn trong môi trường kiềm, và có thể gây tích tụ tinh thể xanthine và bệnh thận tắc nghẽn, đặc biệt là trong những trường hợp điều trị với allopurinol và rasburicase. Chỉ định duy nhất của kiềm hóa nước tiểu là bệnh nhân có tình trạng toan chuyển hóa.
Các chất ức chế xanthine oxidase
Allopurinol là xanthine analog. Nó tác động ức chế cạnh tranh với xanthine oxidase, ngăn cản sự chyển đổi của purine thành acid uric, và được cho là ngăn ngừa sự phát triển của tình trạng bệnh thận tắc nghẽn do tích tụ của tinh thể acid uric ở ống thận. Theo cơ chế này, allopurinol không làm giảm acid uric tồn tại trước đó. Do đó, giảm acid uric huyết thanh có thể cần vài ngày. Và allopurinol được khuyến cáo trong dự phòng ở những bệnh nhân TLS nguy cơ thấp – trung bình hơn là trong điều trị các trường hợp đã chẩ’n đoán TLS. Đối với bệnh nhân đã có tăng acid uric trước đó, urate oxidase là thuốc ưu được lựa chọn hơn.
Allopurinol dự phòng nên được bắt đầu ít nhất 12-24 giờ trước khi bắt đầu điều trị hóa chất và liên tục cho đến khi nồng độ acid uric bình thường, tumor burden và tế bào bạch cầu trở về nguy cơ thấp (< 50 000/pL đối với ALL và < 10 000/uL đối với AML). Allopurinol thường được dùng đường uống. Đối vơi bệnh nhân không thể uống, allopurinol có thể được dùng đường tĩnh mạch. Liều uống ở trẻ là 300-450 mg/m2/ngày chia 3 liều lên đến 400 mg hàng ngày. Ở trẻ nhũ nhi cân nặng < 10 kg, liều 3.3 mg/kg mỗi 8 giờ. Liều có thể được điều chỉnh khi có tổ’n thương thận cấp, gây giảm độ thanh thải creatinine.
Urate oxidase
Urate oxidase là enzyme chuyển đổi acid uric thành allantoin. Allantoin có khả năng hòa tan trong nước tiểu cao gấp 5-10 lần so với acid uric và dễ dàng được bài tiết. Urate oxidase được sử dụng rộng rãi ở bệnh nhân ung thư trong ngăn ngừa và điều trị tăng acid uric máu.
Rasburicase được phát triển từ năm 2001, là thuốc được lựa chọn ở những bệnh nhân nguy cơ TLS trung bình-cao. Rasburicase được dùng đường tĩnh mạch với liều 0.2 mg/kg/liều một lần hàng ngày lên đến 5 ngày. Thời gian điều trị tối ưu vẫn chưa được xác định.
Điều chỉnh điện giải
Tăng kali máu trong TLS có thể gây đột tử do rối loạn nhịp tim. Kali uống hoặc tiêm nên được hạn chế hoặc loại bỏ ở những bệnh nhân nguy cơ TLS. Điều trị chuẩn tình trạng tăng kali máu không triệu chứng bao gồm sodium polystyrene sulfonate đường uống hoặc trực tràng.
Đối với bệnh nhân có triệu chứng, điều trị tích cực bao gồm insulin tác dụng nhanh và truyền dextrose – giúp kali di chuyển từ khoang ngoại bào vào bên trong tế bào. Kali huyết thanh > 7 mmol/L là tình trạng cấp cứu và có thể phải cần lọc máu. Trong những trường hợp tăng kali nặng gây thay đổi điện tim, rối loạn nhịp, rối loạn chức năng tim, và rối loạn chức năng thần kinh như co giật, truyền chậm canxi gluconate với theo dõi tim nên được xem xét để ngăn chặn tác động của kali lên màng tế bào cơ tim.
Điều trị thay thế thận
Chỉ định điều trị thay thế thận ở những bệnh nhân TLS cũng tương tự với các nhóm bệnh nhân suy thận do nguyên nhân khác như quá tải dịch, tăng acid uric máu, rối loạn điện giải nặng, rối loạn chuyển hóa. Điều này đặc biệt đúng ở những trường hợp TLS có thiểu niệu vì giải phóng nhanh chóng và tích tụ điện giải và các chất chuyển hóa có thể gây đột tử.
==>> Xem thêm: Chẩn đoán U phổi qua các đặc điểm và biểu hiện lâm sàng
THEO DÕI
Bác sĩ nên phân tầng nguy cơ TLS trên những bệnh nhân có bệnh lý ác tính. Theo dõi thường xuyên và đánh giá là cần thiết trên những bệnh nhân nguy cơ cao TLS, vì có thể bệnh nhân sẽ được chuyển đến các khoa điều trị tích cực.
Theo dõi chức năng thận – lượng nước tiểu là quan trọng trong quản lý TLS. Cân bằng dịch nên được theo dõi với lượng nước tiểu vì TLS có thể gây thiểu niệu do bệnh thận tắc nghẽn với sự tích tụ canxi-phosphate, xanthine và acid uric. Hơn thế nữa, bù dịch tích cực có thể gây quá tải dịch. Kiểm tra điện giải, creatinine, acid uric nên được làm mỗi 6-8 giờ ở những bệnh nhân nguy cơ cao TLS sau khi bắt đầu điều trị thuốc độc tế bào.