Sản xuất Dược phẩm
Các phương pháp đánh giá tiểu phân nano về đặc tính lý hóa và tác dụng sinh học
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: PGS.TS. Nguyễn Ngọc Chiến, ThS. Hồ Hoàng Nhân
Bài viết Các phương pháp đánh giá tiểu phân nano về đặc tính lý hóa và tác dụng sinh học được trích trong chương 3 sách Công nghệ nano và ứng dụng trong sản xuất thuốc – Bộ môn Công nghiệp Dược – Trường Đại học Dược Hà Nội.
MỤC TIÊU HỌC TẬP
- Trình bày được nguyên tắc của các phương pháp đánh giá đặc tính lý hóa của tiểu phân nano.
- Trình bày được các phương pháp và mô hình đánh giá tác dụng sinh học in vitro và in vivo của tiểu phân nano.
- Phân tích được đặc điểm của các phương pháp đánh giá đặc tính lý hóa của tiểu phân nano.
Trong chương này, chỉ tập trung giới thiệu các phương pháp đánh giá các đặc tính của tiểu phân nano, riêng các tính chất của thành phẩm chứa tiểu phân nano có thể tham khảo thêm ở chương tiếp theo.
1. CÁC PHƯƠNG PHÁP ĐÁNH GIÁ ĐẶC TÍNH LÝ HÓA
1.1. Đánh giá kích thước tiểu phân
KTTP là một trong những thông số cơ bản nhất của tiểu phân nano, là yếu tố xác định chính khả năng phân bố và lưu giữ của các tiểu phân nano ở cơ quan đích. Phương pháp tán xạ ánh sáng động (Dynamic light scattering – DLS) là phương pháp phổ biến nhất được sử dụng để xác định KTTP với kết quả thu được của phép đo thường là KTTP trung binh (gọi tắt là KTTP) của các lần đo lặp lại.
Nguyên tắc của phương pháp DLS là đo sự chuyển động Brown của các tiểu phân nano trong hỗn dịch và thể hiện mối liên quan đến vận tốc chuyển động của chúng thông qua hệ số khuếch tán D. Hệ số khuếch tán D phụ thuộc vào KTTP của các tiều phân nano được thể hiện qua phương trình Stokes-Einstein như sau:
D = kT/3πηd
D: Hệ số khuếch tán
k: Hằng số Boltzmann
T: Nhiệt độ
η: Độ nhớt môi trường phân tán
d: đường kính trung binh các hạt nano trong mẫu khảo sát
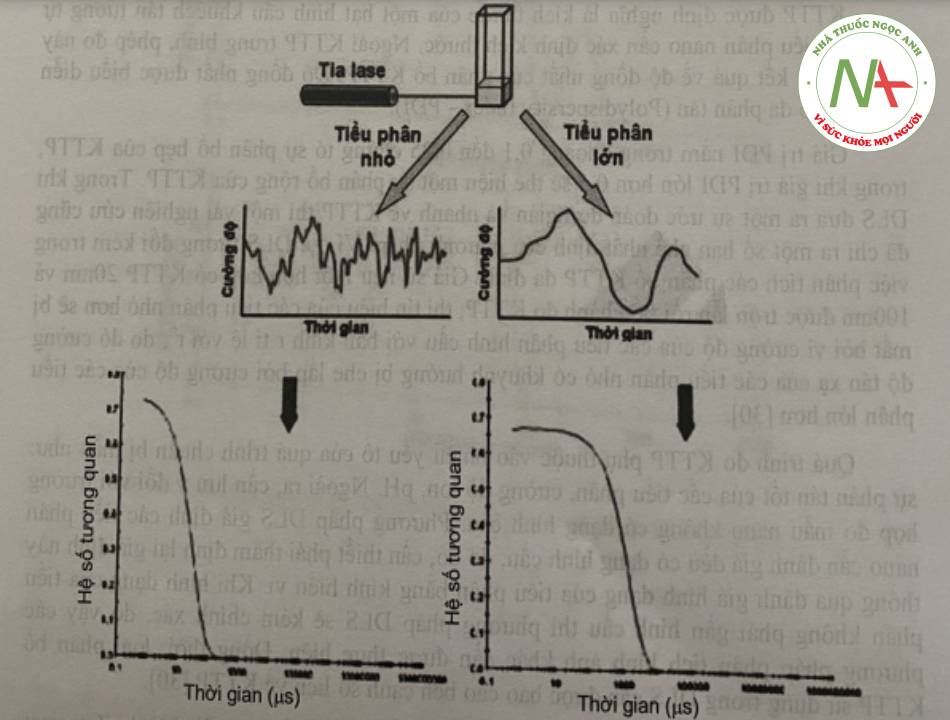
KTTP được định nghĩa là kích thước của một hạt hình cầu khuếch tán tương tự như các tiểu phân nano cần xác định kích thước. Ngoài KTTP trung binh, phép đo này còn đưa ra kết quả về độ đồng nhất của phân bố KTTP. Độ đồng nhất được biểu diễn bằng hệ số đa phân tán (Polydispersity Index – PDI).
Giá trị PDI nằm trong khoảng 0,1 đến 0,25 chứng tỏ sự phân bố hẹp của KTTP, trong khi giá trị PDI lớn hơn 0,5 sẽ thể hiện một sự phân bô rộng của KTTP. Trong khi DLS đưa ra một sự ước đoán đơn giản và nhanh về KTTP thì một vài nghiên cứu cũng đã chỉ ra một số hạn chế nhất định của phương pháp. Ví dụ, DLS tương đối kém trong việc phân tích các phân bố KTTP đa đỉnh. Giả sử nếu một hỗn hợp có KTTP 20nm và 100nm được trộn lẫn rồi tiến hành đo KTTP, thì tín hiệu của các tiểu phân nhỏ hơn sẽ bị mất bởi vì cường độ của các tiểu phân hình cầu với bán kính r tỉ lệ với r6, do đó cường độ tán xạ của các tiểu phân nhỏ có khuynh hướng bị che lấp bởi cường độ của các tiểu phân lớn hơn.
Quá trình đo KTTP phụ thuộc vào nhiều yếu tố của quá trình chuẩn bị mẫu như: sự phân tán tốt của các tiểu phân, cường độ ion, pH. Ngoài ra, cần lưu ý đối với trường hợp đo mẫu nano không có dạng hình cầu. Phương pháp DLS giả định các tiểu phân nano cần đánh giá đều có dạng hình cầu, do đó, cần thiết phải thẩm định lại giả định này thông qua đánh giá hình dạng của tiểu phân bằng kính hiển vi. Khi hình dạng của tiểu phân không phải gần hình cầu thì phương pháp DLS sẽ kém chính xác, do vậy các phương pháp phân tích hình ảnh khác cần được thực hiện. Đồng thời, loại phân bố KTTP sử dụng trong DLS cần được báo cáo bên cạnh số liệu về KTTP.
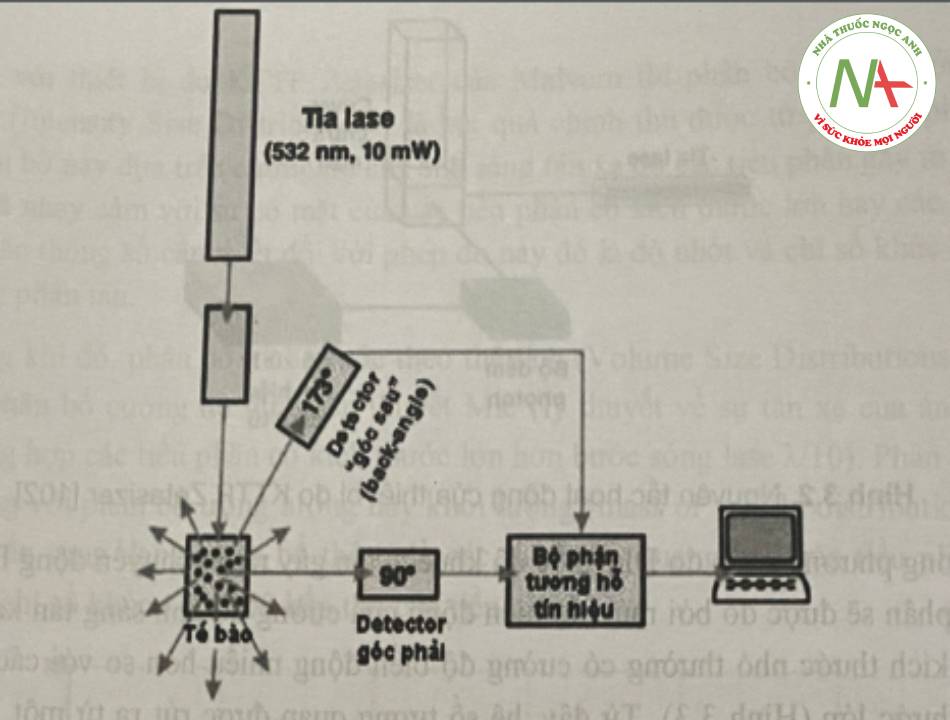
Thiết bị hay được sử dụng để đo KTTP của các tiểu phân nano là thiết bị Zetasizer của hãng Malvem với hình ảnh minh họa nguyên tắc hoạt động như sau:
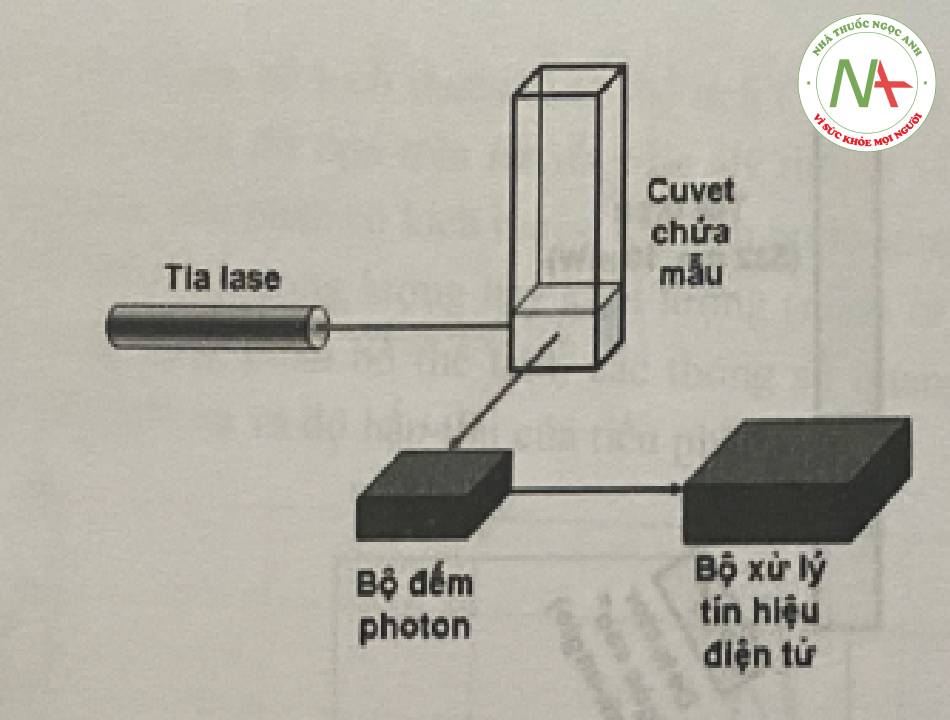
Trong phương pháp đo DLS, tốc độ khuếch tác gây ra do chuyển động Brow của các tiểu phân sẽ được đo bởi mức độ biến động của cường độ ánh sáng. Các tiểu phân có kích thước nhỏ thường có cường độ biến động nhiều hơn so với các tiểu phân có kích thước lớn.
Đối với thiết bị đo KTTP Zetasizer của Malvem thì phân bố kích thước theo cường độ (Intensity Size Distributions) là kết quả chính thu được từ phương pháp đo DLS. Phân bố này dựa trên cường độ của ánh sáng tán xạ do các tiểu phân gây ra và kết quả đó khá nhạy cảm với sự có mặt của các tiểu phân có kích thước lớn hay các kết tụ, bụi bẩn. Các thông số cần thiết đối với phép đo này đó là độ nhớt và chỉ sô khúc xạ của môi trường phân tán.
Trong khi đó, phân bố kích thước theo thể tích (Volume Size Distributions) được suy ra từ phân bố cường độ dựa trên thuyết Mie (lý thuyết về sự tán xạ của ánh sáng trong trường hợp các tiểu phân có kích thước lớn hơn bước sóng lase λ/10). Phân bố này tương đương với phân bố trọng lượng hay khối lượng (mass or weight distribution). Để có thể chuyển sang dạng phân bố thể tích, các thông số quang học của tiểu phân cần cung cấp là chỉ số khúc xạ và độ hấp thụ của tiểu phân.
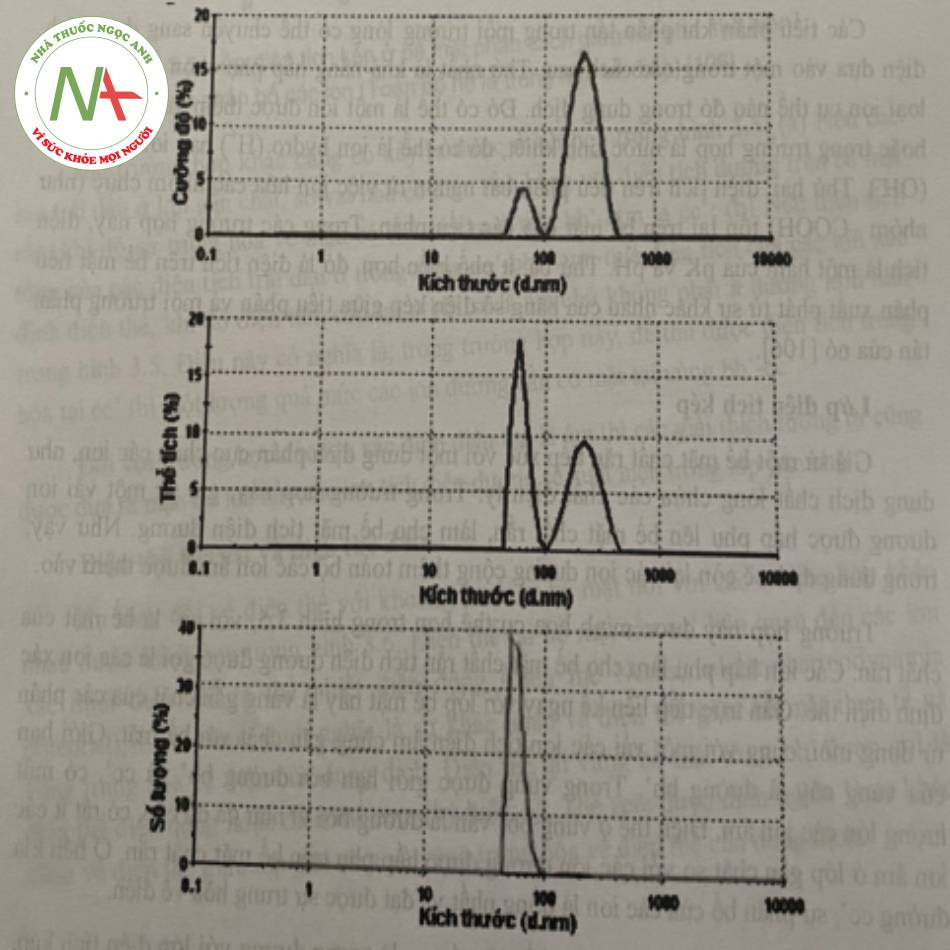
Tương tự, phân bố kích thước theo số lượng (Number Size Distributions) cũng được suy ra từ phân bố cường độ dựa trên thuyết Mie. Để có thể chuyển sang dạng phân bố số lượng, các thông số quang học của tiểu phân cần cung cấp là chỉ số khúc xạ và độ hấp thụ của tiểu phân.
Cần lưu ý rằng để có thể chuyển từ phân bố cường độ sang phân bố thể tích hay phân bố số lượng cần đảm bảo tất cả các tiểu phân đo có dạng hình cầu, đồng nhất và có tỉ trọng tương đương và biết rõ các đặc tính quang học của tiểu phân như chỉ số khúc xạ và độ hấp thụ. Thông thường, phân bố cường độ được sử dụng để báo cáo kích thước của từng pic trong phân bố, còn phân bố thể tích hay phân bố số lượng được sử dụng đê báo cáo số lượng tương đối của từng pic trong phân bô.
1.2. Đánh giá điện tích bề mặt
Các tiểu phân khi phân tán trong môi trường lỏng có thể chuyển sang dạng tích điện dựa vào một trong các cách sau. Thứ nhất là khả năng hấp phụ chọn lọc của một loại ion cụ thể nào đó trong dung dịch. Đó có thể là một ion được thêm vào dung dịch hoặc trong trường hợp là nước tinh khiết, đó có thể là ion hydro (H+) hay ion hydroxyl (OH–). Thứ hai, điện tích trên tiểu phân bắt nguồn từ việc ion hóa các nhóm chức (như nhóm -COOH) tồn tại trên bề mặt của các tiểu phân. Trong các trường hợp này, điện tích là một hàm của pK và pH. Thứ ba, ít phổ biến hơn, đó là điện tích trên bê mặt tiểu phân xuất phát từ sự khác nhau của hằng số điện kép giữa tiêu phân và môi trường phân tán của nó.
Lớp điện tích kép
Giả sử một bề mặt chất rắn tiếp xúc với một dung dịch phân cực chứa các ion, như dung dịch chất lỏng chứa các chất điện ly. Trong trường hợp này, giả sử một vài ion dương được hấp phụ lên bề mặt chất rắn, làm cho bề mặt tích điện dương. Như vậy, trong dung dịch sẽ còn lại các ion dương cộng thêm toàn bộ các ion âm được thêm vào.
Trường hợp này được minh họa cụ thể hơn trong hình 3.5, với aa’ là bề mặt của chất rắn. Các ion hấp phụ làm cho bề mặt chất rắn tích điện dương được gọi là các ion xác định điện thế. Gắn trực tiếp liền kề ngay với lớp bề mặt này là vùng gắn chặt của các phân tử dung môi, cùng với một vài các ion tích điện âm cũng gắn chặt với bề mặt. Giới hạn của vùng này là đường bb’. Trong vùng được giới hạn bởi đường bb’ và cc’, có một lượng lớn các ion âm. Điện thế ở vùng bb’ vẫn là dương bởi vì như đã đề cập, có rất ít các ion âm ở lớp gắn chặt so với các ion dương được hấp phụ trên bề mặt chất rắn. Ở bên kia đường cc’, sự phân bố của các ion là đồng nhất và đạt được sự trung hòa về điện.
Ngoài ra, phân bố điện tích tại bề mặt chung là tương đương với lớp điện tích kép, lớp gắn chặt đầu tiên (kéo dài từ aa’ đến bb’) và lóp thứ hai khuếch tán hơn (từ bb’ đến cc’). Do đó, lớp được gọi là lớp điện tích kép kéo dài từ aa’ đến cc’.
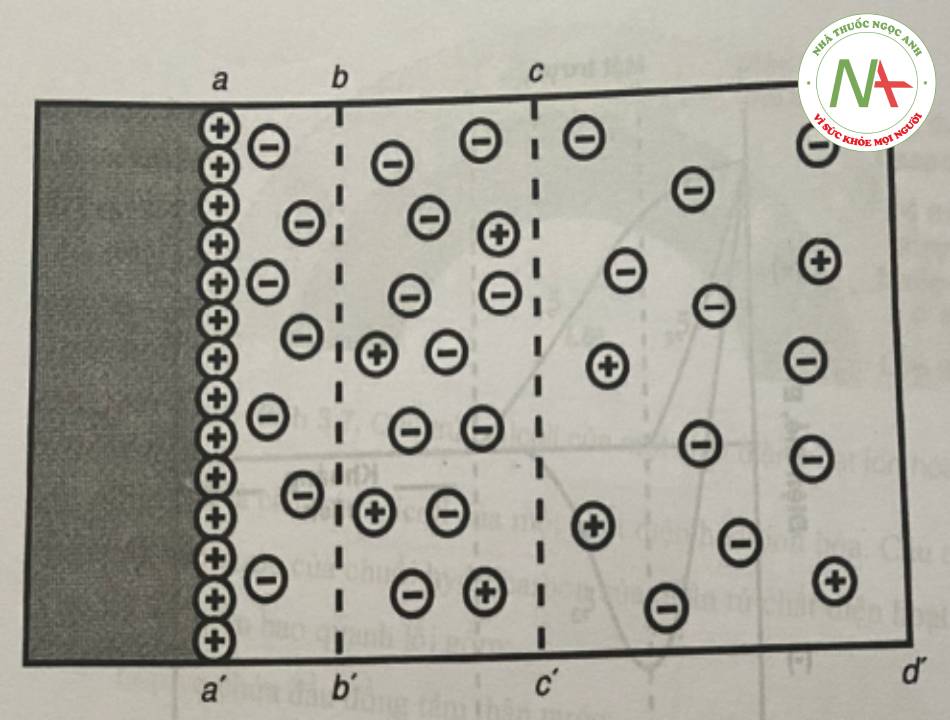
Hai trường hợp khác cũng có xảy ra được minh họa trong hình 5: (a) Nếu các ion trái dấu ở lớp gắn chặt, solvat hóa có điện tích bằng với điện tích dương trên bề mặt rắn, khi đó sự trung hòa về điện có thể xảy ra ở mặt bb’ hơn là cc’; (b) Nếu điện tích tồng của các điện tích trái dấu ở trong vùng aa’-bb’ vượt quá điện tích của các ion xác định điện thế, khi đó điện tích còn lại ở bb’ sẽ là âm chứ không phải ít dương hơn như trong hình 5. Điều này có nghĩa là, trong trường hợp này, để thu được điện tích trung hòa tại cc’ thì một lượng quá mức các ion dương cần có mặt tại vùng bb’-cc.
Đối với trường hợp các ion xác định điện thế là âm thì các giải thích tương tự cũng được đưa ra mặc dù lúc này các ion tích điện dương sẽ xuất hiện trong lớp gắn chặt.
Điện thế Nernst và điện thế Zeta
Sự thay đổi về điện thế với khoảng cách từ bề mặt đối với các trường hợp khác nhau được minh họa trong hình 3.6. Điện thế tại bề mặt rắn aa’ liên quan đến các ion xác định điện thế là thế nhiệt điện động (điện thế Nemst, electrothermodynamic potential), E, và được định nghĩa là sự khác nhau về điện thế giữa bề mặt thực tế và vùng trung hòa về điện của dung dịch. Điện thế tại vùng bề mặt trượt bb’ được gọi là điện thế điện động hoặc điện thế zeta (ký hiệu: Q. Thế zeta được đinh nghĩa là sự khác nhau vê điện thê giữa lớp n chặt và vùng trung hòa về điện thế của dung dịch.
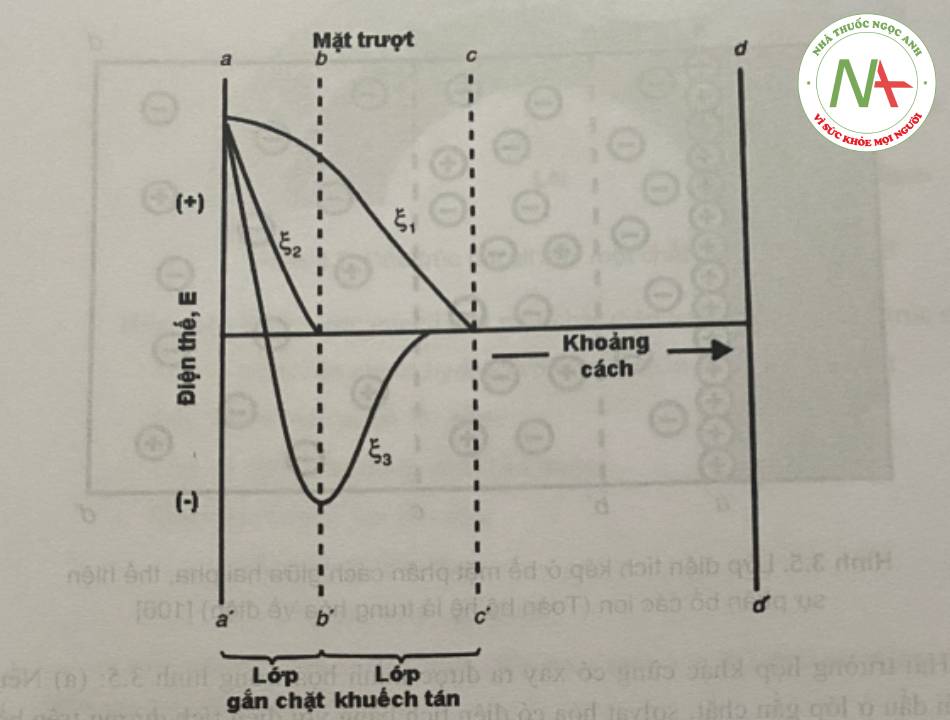
Như minh họa trong hình 6, điện thế bắt đầu giảm nhanh, sau đó bắt đầu giảm từ từ khi khoảng cách từ bề mặt tăng. Điều này bởi vì các ion trái dấu gần với bề mặt đóng vai trò như một màng chắn làm giảm lực hút tĩnh điện giữa bề mặt tích điện và những ion trái dấu nằm xa bề mặt.
Thế zeta có ứng dụng thực tế trong việc ổn định hệ chứa các tiểu phân phân tán bởi vì điện thế này không phải là thế Nernst chịu trách nhiệm mức độ đẩy của các tiểu phân phân tán có cùng điện tích gần nhau. Nếu thế zeta giảm đến dưới một giá trị nào đó (phụ thuộc vào hệ cụ thể được sử dụng), lực hút vượt quá lực đẩy và các tiểu phân sẽ tiến gần đến với nhau. Hiện tượng này được gọi là sự kết tụ.
Hình dưới đây mô tả rõ hơn về thế zeta đối với cấu trúc micell của chất diện hoạt ion hóa.
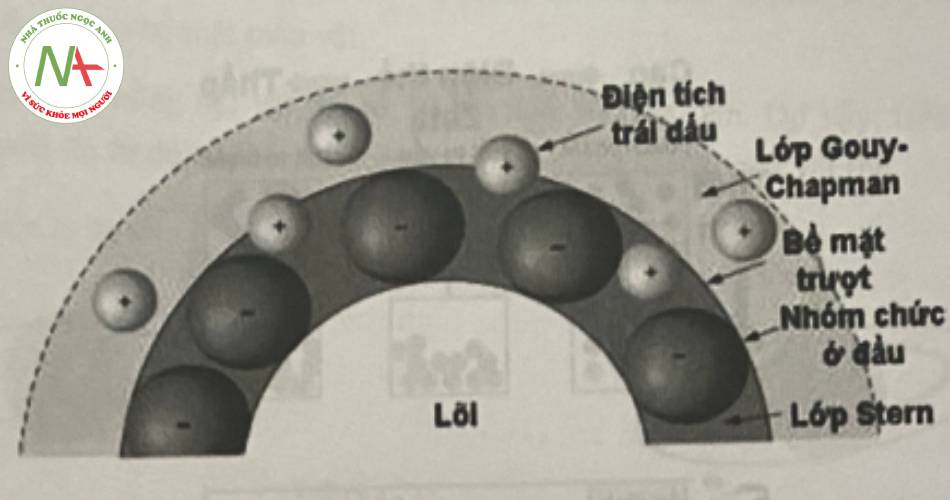
Hình trên là cấu trúc micell của một chất diện hoạt ion hóa. Cấu trúc này gồm:
– Lõi sơ nước của chuỗi hydrocarbon của phân tử chất diện hoạt
– Lớp Stern bao quanh lõi gồm:
+ Lớp vỏ chứa đầu đồng tâm thân nước
+ Gắn với (1-α)N ion trái dấu:
α là mức độ ion hóa,
N = số phân tử trong micell.
Đối với hầu hết micell chất diện hoạt ion, α = 0,2-0,3; có nghĩa có thê coi 70- 80% ion trái dấu gắn với micell.
Bề mặt trượt (shear surface): gắn chặt đầu tích điện thân nước của chất diện hoạt là các ion trái dấu với điện tích đầu thân nước của chất diện hoạt đó, tạo bề mặt trượt.
Lớp điện kép Gouy-Chapman bao quanh lớp Stern, lớp này là lớp khuếch tán (diffuse layer), có chứa αN ion trái dấu cần để trung hòa hết điện tích của lớp micell. Độ dày của lớp điện kép phụ thuộc vào cường độ ion trong dung dịch và sự có mặt của chất điện ly.
Thế zeta: sự chênh lệch thế giữa bề mặt trượt (shear surface, hoặc lớp tích điện liên kết chặt với bề mặt) và vùng trung tính của dung dịch bên ngoài.
Nguyên tắc cơ bản của việc đo thế zeta dựa trên tần số chuyển động của hạt nano trong vùng điện trường quan sát được nhờ nhiễu xạ tia laser. Khi đặt 1 điện trường lên hệ, tiểu phân sẽ di chuyển về phía điện cực trái dấu với vận tốc tỷ lệ với thế zeta. Thế zeta được xác định dựa vào độ nhớt môi trường và định luật Smoluchowski – Huckel. Trong thực nghiệm, hệ phân tán nano có giá trị tuyệt đối của thế zeta giữa 30 và 60 mV sẽ tạo sự ổn định tĩnh điện học nhờ lực đẩy giữa các tiểu phân nano tích điện cùng dấu, nếu giá trị này từ 5 đến 15 mV sẽ giới hạn độ bền vững của hệ phân tán, thế zeta từ 3 đến 5 mV thường xuất hiện các hiện tượng không bền.
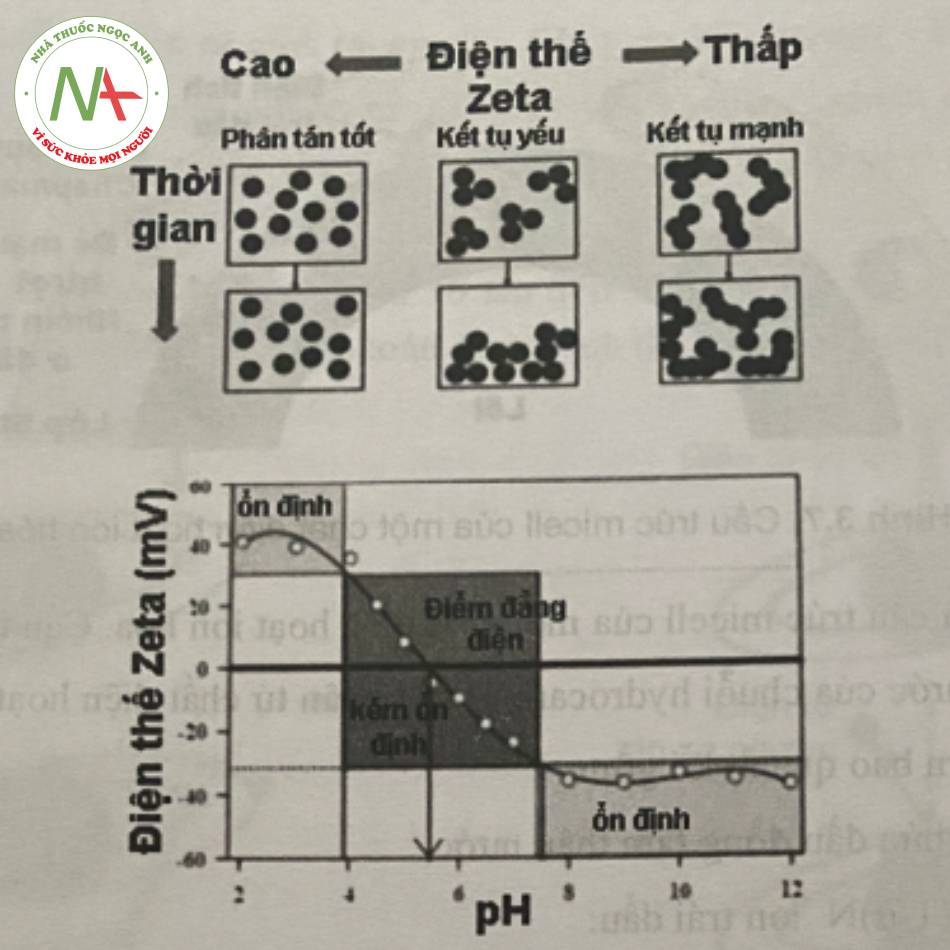
Do đó, thế zeta là một công cụ quan trọng để tìm hiểu trạng thái bề mặt của các tiểu phân nano, giúp dự đoán độ ổn định dài hạn của các tiểu phân nano. Thế zeta rất hữu ích trong việc phát hiện sự thay đổi đặc tính bề mặt của nano.
Thế zeta nhạy cảm với các thay đổi về môi trường như pH và cường độ, hóa trị của ion. Do đó, cần thận trọng trong quá trình chuẩn bị mẫu khi đo thế zeta. Mẫu cần đảm bảo đơn phân tán, pha trong dung môi phân cực và có nồng độ đủ lớn để đảm bảo sự tán xạ hiệu quả. Tổng nồng độ muối phải nhỏ (độ dẫn điện dưới 1 mS/cm) bởi vì sự di chuyển của các ion dẫn điện có thể làm phân hủy và phân cực điện cực.
Thế zeta có hên quan với khả năng di động điện tích (electrophoretic mobility) thông qua phương trình Henry:
UE = 2εZf(Ka)/3η
Trong đó, UE là khả năng di động điện tích; Z: thế zeta; ε: hằng số điện môi, η: độ nhớt, và f(Ka) là hàm số Henry; (Ka là tỉ lệ giữa bán kính tiểu phân (a) và bề dày lớp điẹn tích kep (1/K: bề dày của lớp điện tích kép hay chiều dài Debye); trong môi trường ước lượng Huckel và trong môi trường phân cực ~1,5 dựa theo ước lượng Smoluchowski).
1.3. Đánh giá hình thái cấu trúc tiểu phân
1.3.1.Kính hiển vi điện tử quét (Scanning Electron Microscope – SEM)
Nguyên tắc: dùng chùm điện tử quét trên bề mặt mẫu nghiên cứu. Việc tạo ảnh được thực hiện thông qua việc ghi nhận và phân tích các bức xạ phát ra từ sự tương tác của chùm điện tử với bề mặt mẫu vật.
SEM có thể phóng đại vật thể từ 10 lần đến 300,000 lân. Do vậy, trên ảnh SEM thường có thang đo từ đó có thể tính toán được kích thước thật của vật thể.
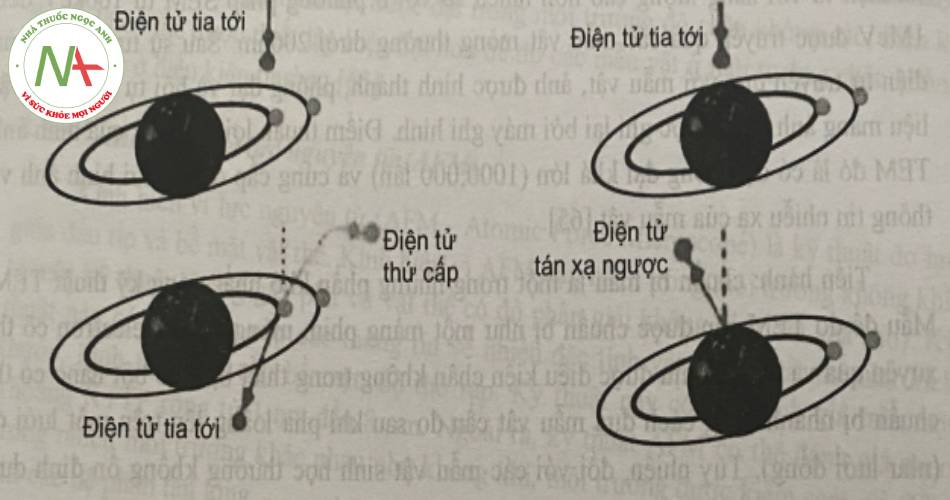
Các bức xạ phát ra thường ở dưới dạng các tín hiệu của điện tử thứ cấp (Secondary electrons), điện tử tán xạ ngược (Backscattered electrons), điện tử Auger (Auger electrons) và các tia X đặc trưng chứa đựng các thông tin về hình thái bề mặt và thành phần của vật thê, trong đó bức xạ thứ cấp và bức xạ tán xạ ngược là hai bức xạ chủ yếu thường được sử dụng.
Mầu vật chuẩn bị đo SEM nên dẫn được điện để các tia điện tử có thể quét lên bề mặt và để các điện tử có thể tiếp đất từ đó cho kết quả của một hình ảnh SEM thông thường. Việc đo các vật liệu không dẫn điện cụ thể như các polyme, các vật liệu sinh học thường gặp một số trở ngại như phân hủy bởi nhiệt, hỏng do tia xạ và sự bay hơi mẫu vật ở điều kiện chân không cao. Các mẫu vật rắn không dẫn điện thường được bao bởi một lóp vật liệu dẫn điện như vàng hoặc platin.
Ngoài hình ảnh bề mặt, phương pháp SEM còn có thể sử dụng để phân tích thành phân nguyên tố của mẫu vật khi kết hợp với đầu thu phổ tán sắc năng lượng tia X (EDX – Energy dispersive X-ray Spectroscopy). Các nguyên tố có số hiệu nguyên tử Z thấp khó có thể được phát hiện bằng phổ EDX.
Tuy nhiên, hiện nay kính hiển vi điện tử quét phát xạ trương (FESEM – Field Emission SEM) và phổ EDX tương ứng có thể khắc phục được hạn chế này. h hiển vi điện tử quét môi trường (ESEM – Environmental SEM) và FESEM vận hành lần lượt ở điện thế thấp – chân không cao và chân không thấp – điện thể cao nên có thể áp dụng cho các vật liệu có bản chất tự nhiên như ẩm, dầu, dễ bay hơi và không dân điện.
1.3.2. Kính hiển vi điện tử truyền qua (TEM)
Nguyên tắc: đối với phương pháp TEM (Transmission Electron Microscope), các tia điện tử với năng lượng cao hơn nhiều so với ở phương pháp SEM từ 100 keV đến 1 MeV được truyền qua các mẫu vật mỏng thường dưới 200nm. Sau sự tương tác của điện tử truyền qua với mẫu vật, ảnh được hình thành, phóng đại và hội tụ trên các vật liệu mang ảnh hoặc được ghi lại bởi máy ghi hình. Điểm thuận lợi lớn nhất của hình ảnh TEM đó là có độ phóng đại khá lớn (1000,000 lần) và cung cấp đồng thời hình ảnh và thông tin nhiễu xạ của mẫu vật.
Tiến hành: chuẩn bị mẫu là một trong những phần khó nhất trong kỹ thuật TEM. Mẫu để đo TEM cần được chuẩn bị như một màng phim mỏng để các electron có thể xuyên qua và có thể chịu được điều kiện chân không trong thiết bị. Các bột nano có thể chuẩn bị nhanh bằng cách đưa mẫu vật cần đo sau khi pha loãng lên trên một lưới đỡ (như lưới đồng). Tuy nhiên, đối với các mẫu vật sinh học thường không ổn đinh dưới điều kiện chân không do đó thường được kết hợp với glutaraldehyd và paraformaldehyd, dehyrat hóa và ổn định trong resin trước khi đặt vào môi trường chân không. Ngoài ra, độ tương phản của mẫu vật có thể được tăng cường bằng cách sử dụng các chất nhuộm màu kim loại như chì citrat, uranyl acetat, và acid phosphotungstic.
Tuy nhiên, để có thể quan sát cấu trúc 3D của các đại phân tử sinh học ở trạng thái hydrat hóa (vốn bản chất tồn tại trong các cơ thể sống) thì có hai vân đế khó khăn khi sử dụng kỹ thuật TEM. Đó là các mẫu quan sát cần phải đặt trong môi trường chân không, thứ hai là sự phá hỏng mẫu do sự bức xạ tia điện tử lớn. Vì vậy, kỹ thuật Cryo-TEM hay còn gọi là kỹ thuật gắn đá (ice-embedding) ra đời nhằm giải quyết những hạn chế này để có thể quan sát các vật thể ở độ phân giải nguyên tử trong khi giữ chúng ở trạng thái hydrat hóa.
Ngoài ra, hiện nay, kỹ thuật High-resolution TEM (HR-TEM) ra đời với khả năng phân giải đến 1Å. Các mẫu vật được đặt trong môi trường độ chân không cao, hiện kỹ thuật đã có thể được thiết lập hiện đại hơn để đo các mẫu vật ở môi trường chân không thấp hoặc ở điều kiện thường.
1.3.3. Kính hiển vi lực nguyên tử (AFM)
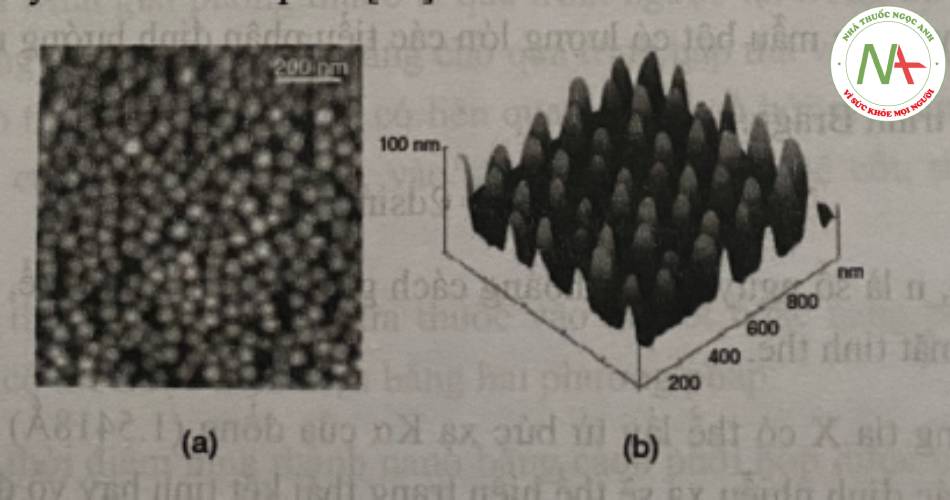
Kính hiển vi lực nguyên tử (AFM – Atomic Force Microscope) là kỹ thuật đo lực giữa đầu tip và bề mặt vật thể. Kính hiển vi AFM vận hành trong môi trường không khí, là một kỹ thuật không gây phá vỡ vật thể có độ phân giải không gian 3D khá cao). Kỹ thuật này có thể cung cấp các thông tin về nhiều đặc tính vật lý của vật thể như kích thước, hình thái, kết cấu bề mặt, độ thô ráp. Kỹ thuật này có thể đánh giá trên một khoảng KTTP rộng từ 1 nm đến 8 μm. Ngoài ra, kỹ thuật AFM có thể đánh giá nano trong nhiều môi trường khác nhau như không khí, môi trường được kiểm soát, và thậm chí các hệ phân tán lỏng.
Chuẩn bị mẫu: việc chuẩn bị mẫu có thể được chia làm hai đối với từng nhóm vật liệu khác nhau. Nhóm đầu tiên, các vật liệu có khả năng bám dính cao như các vật liệu nano composite hay các kết tủa nano thì các tiểu phân nano này có thể được đưa lên bề mặt của một cấu trúc rắn ví dụ một mảnh nhỏ mica. Nhóm thứ hai bao gồm các tiểu phân nano gắn lỏng lẻo lên bề mặt giá đỡ như hệ phân tán của nano trong môi trường lỏng hoặc khô. Do vậy, đối với trường hợp thứ hai, để tránh phát hiện các tạp nhiễu (artifact) thì chế độ đo gần hay CFM (crystal sensing) cần được sử dụng, đồng thời sử dụng các bề mặt của các chất có khả năng bám dính cao như băng keo dính hai mặt, mica, các tấm “Tacky Dot” và TempFix.
1.4. Đánh giá thành phần, tương tác hóa học và trạng thái kết tinh
1.4.1. Phổ hồng ngoại FT-IR
Đo phổ hồng ngoại là phương pháp được sử dụng để phát hiện các liên kết hóa học và trạng thái tập hợp (crowding environment) của các nguyên tử trong hệ thống phân tử (molecular systems). Kỹ thuật này dựa vào hiệu ứng là các hợp chất hóa học có khả năng hấp thụ chọn lọc các bức xạ hồng ngoại tạo ra các kiểu dao động và quay khác nhau, từ đó hình thành nên các dải phổ hấp thụ đối với từng hợp chất. Từ phổ hồng ngoại, có thể phát hiện ra các thành phần chưa biết dựa vào tần số đặc trưng của dải hấp thụ và có thể xác định được hàm lượng của thành phần trong một mẫu. Ngoài ra, nó còn cho biết cấu trúc phân tử (như các nhóm chức, các liên kết), xác định đồng phân. Phương pháp này có thể được sử dụng để đo các mẫu ở trạng thái khí, lỏng và rắn.
Trong đó, vùng hồng ngoại có số sóng từ 4000-400 cm–1 (25 – 2,5 μm) là vùng cung cấp những thông tin quan trọng về dao động của các phân tử từ đó có thể xác định được cấu trúc của các phân tử.
Đối với phương pháp FTIR, phổ hấp thụ có thể được rút ra từ các phép đo độ truyền qua một viên KBr đã trộn lẫn với các tiểu phân nano hoặc trực tiếp trên các tiểu phân nano thông qua phép đo ở chế độ phản xạ (DRIFT – Diffuse Reflection Infrared Spectroscopy).
1.4.2. Phổ X-ray
Phương pháp phổ nhiễu xạ tia X (XRD, X-ray diffraction) là phương pháp được sử dụng phổ biến nhất để xác định cấu trúc của một tinh thể chưa biết bằng cách sử dụng một chùm tia X song song, hẹp, đơn sắc chiếu vào mẫu.
Phương pháp XRD dựa trên một phương trình cơ bản, đó là phương trình Bragg, trong đó liên kết khoảng cách mạng tinh thể với các góc quan sát của các nhiễu xạ khi tia X tán xạ từ một vật liệu kết tinh. Đối với các vật liệu nano, các phép đo thường được tiến hành đối với các mẫu bột có lượng lớn các tiểu phân định hướng ngẫu nhiên.
Phương trình Bragg:
nλ = 2dsinθ
Trong đó, n là số nguyên, d: khoảng cách giữa các mặt tinh thể, θ là góc chiếu của tia X vào các mặt tinh thể.
Bước sóng tia X có thể lấy từ bức xạ Kα của đồng (1.5418Å). Sự xuất hiện hay biến mất các định nhiễu xạ sẽ thể hiện trạng thái kết tinh hay vô định hình của mẫu.
1.4.3. Phổ quang điện tử tia X (XPS)
Phương pháp XPS (X-Ray Photoelectron Spectroscopy) cho phép xác định hóa học bề mặt và con đường mà thành phần hóa học thay đổi ở bề mặt hoặc vùng gần bề mặt. XPS cung cấp các thông tin về bản chất hóa học và thành phần nguyên tô một cách định lượng với đặc trưng bề mặt cao (với khoảng cách 10nm từ bề mặt tiểu phân). Các quá trình như lai hóa, liên kết, chức năng hóa, tiến trình của phản ứng là một trong những quá trình có thể được phỏng đoán bằng phương pháp XPS.
1.4.4. Phân tích nhiệt vi sai (DSC)
Phân tích nhiệt vi sai DSC (Differential Scanning Calorimetry) có thể được sử dụng để xác đinh bản chất và sự hình thành tinh thể bên trong nano thông qua việc đo nhiệt độ chuyển hóa thủy tinh, nhiệt độ nóng chảy và các năng lượng enthalpy có liên quan của chúng. Cùng với phương pháp XRD, phương pháp này thường được sử dụng để xác định mức độ của các pha tồn tại bên trong tiểu phân hoặc mức độ của các thành phần bao gồm cả dược chất, tá dược tương tác với nhau.
Ngoài ra, còn có một số phương pháp quang phổ khác có thể được sử dụng để đánh giá sự có mặt của các thành phần cũng như tương tác lý hóa, trạng thái vật lý của các thành phần này như phổ Raman, phổ hồng ngoại gần (Near Infrared Spectroscopy), phổ cộng hưởng từ hạt nhân proton (Proton Nuclear Magnetic Resonance Spectroscopy),…
1.5. Đánh giá khả năng nạp thuốc và hiệu suất nano hóa
Khả năng “chuyên chở” thuốc (đặc tính nạp thuốc và giải phóng) xác định tính chất của một hệ phân phối thuốc. Việc mang thuốc (nano hóa) hoặc liên hợp một chất có hoạt tính vào một hệ chất mang có thể bảo vệ các phân tử thuốc khỏi sự mất hoạt tính và giúp giữ hoạt tính của thuốc trong một thời gian dài, giảm độc tính cũng như có thể phù hợp với nhiều đường dùng khác nhau.
Ngược lại, quá trình giải phóng thuốc là quá trình ngược lại trong đó các phân tử thuốc được giải phóng từ pha rắn và sẵn sàng cho quá trình hấp thu và tác dụng dược lý. Do đó, khả năng nạp thuốc và giải phóng có liên quan với nhau bởi vì chúng phụ thuộc vào đặc tính lý hóa của hệ cốt và thuốc, vào sự tương tác giữa hệ cốt, thuốc và môi trường.
Quá trình nạp thuốc là quá trình đưa thuốc vào hệ cốt hoặc nang polyme, lipid. Quá trình nạp thuốc có thể được thực hiện bằng hai phương pháp:
– Kết hợp tại thời điểm hình thành nano bằng cách phối hợp dược chất trước khi hình thành nano. Trường hợp này phần lớn dược chất sẽ được bao gói trong tiểu phân nano do vậy hạn chế được khả năng giải phóng ồ ạt ban đầu. Đồng thời phương pháp này cho khả năng nạp thuốc cao hơn so với phương pháp hấp phụ.
– Hấp phụ thuốc sau khi hình thành nano bằng cách ủ hệ chất mang với một dung dịch thuốc đậm đặc. Thuốc sẽ được hấp phụ quá mức lên một diện tích bề mặt lớn của chất mang, là nguyên nhân dẫn đến sự giải phóng ồ ạt ban đầu sau đó. Ngoài ra, phương pháp này cho khả năng nạp thuốc thấp. Thời gian ủ có thể ảnh hưởng đến khả năng nạp thuốc, và thời gian ủ phải đủ để đạt đến trạng thái cân bằng cho khả năng nạp thuốc tối đa.
Khả năng nạp thuốc (LC – loading capacity, %, gọi là tỷ lệ dược chất nano hóa) được định nghĩa bằng công thức sau:
LC (%) = Khối lượng dược chất được nano hóa x 100% / Khối lượng tiểu phân
Hiệu suất nano hóa thuốc (EE – Encapsulation/Entrapment Efficiency, %) được định nghĩa bằng công thức sau:
EE (%) = Khối lượng dược chất được nano hóa x 100% / Tổng lượng dược chất ban đầu
Trong quá trình nạp thuốc, thông thường, dược chất sẽ được hòa tan, bẫy, hấp phụ, bao gói hoặc gắn vào một cốt polyme hoặc cốt lipid có kích thước nano, được gọi chung là được nano hóa. Các dược chất có thể được gắn vào các tiểu phẫn nano thông qua các liên kết hydro, tương tác ion, tương tác lưỡng cực, bẫy/bao gói vật lý, kết tủa, liên kết cộng hóa trị hoặc hấp phụ trên bề mặt. Trong hầu hết các hệ mang thuốc, thường có hơn một cơ chế liên quan đến quá trình nạp thuốc.
Việc xác định những thông số này đôi khi có thể gặp khó khăn liên quan đến độ chính xác của việc phân tích dược chất. Việc kết hợp các phương pháp phân tách và phân tích thích hợp cần được sử dụng. Các phương pháp có khả năng phân tách dược chất phân tử tự do và dược chất được nano hóa như thẩm tích, siêu ly tâm (ultracentrifugation), lọc gel (gel filtration), lọc ly tâm hay lọc màng (centrifugal ultrafiltration), sắc ký cột có thể được sử dụng.
Nguyên tắc của hầu hết các phương pháp đo hiệu suất nano hóa là tách các tiểu phân nano khỏi môi trường phân tán và dựa trên việc định lượng phần dược chất phân tử tự do để xác định gián tiếp phần dược chất được nano hóa. Một vấn đề cần lưu ý đối với việc sử dụng bất kỳ một phương pháp tách vật lý kể trên là quá trình tách có thể không hoàn toàn hoặc không hiệu quả.
Đối với phương pháp siêu ly tâm, quá trình tách đạt được bằng cách làm lắng các tiểu phân dưới một lực ly tâm lớn trong thời gian tương đối dài, đặc biệt khi tỉ trọng của các tiểu phân và môi trường xung quanh gần bằng nhau. Sau quá trinh sa lăng, nồng độ dược chât ở phần bên trên và/hoặc trong phần cắn sa lắng được xác định để ước đoán tỉ lệ dược chất được nano hóa hoặc không được nano hóa. Như để xác định EE và LC của nano chứa acid glycyrrhetic được bao bởi CS có KTTP lớn hơn hoặc gần bằng 300 nm, hỗn dịch nano đã được ly tâm ở tốc độ 154.000 x g ở 25°c trong 30 phút. Đối với các tiểu phân có kích thước nhỏ hơn, cần tiến hành ly tâm hỗn dịch tạo thành ở tốc độ cao hơn trong khoảng thời gian dài hơn. Chẳng hạn, để sa lắng hiệu quả các liposome cấu trúc một lớp có kích thước nhỏ, cần tiến hành ly tâm ở tốc độ 200.000 x g trong thời gian từ 10 giờ đến 20 giờ, hay như trong nghiên cứu của Wallace, thậm chí đã sử dụng tốc độ ly tâm cao đến 300.000 x g trong thời gian 8 giờ, tuy nhiên vẫn không thể sa lắng hoàn toàn các tiểu phân có kích thước dưới 100 nm. Ngoài việc không thể tách hoàn toàn các tiểu phân khỏi phần dược chất phân tử tự do, thời gian ly tâm dài ở tốc độ ly tâm quá cao có thể dẫn đến sự rối loạn trong tương tác dược chất – nano, từ đó có thể dẫn đến sự giải phóng dược chất giả tạo.
Với phương pháp lọc màng, nguyên tắc được dựa trên việc sử dụng một dụng cụ gồm một ống ly tâm Eppendorf tách rời với một ống kèm theo bên trong bởi một màng siêu lọc, từ đó cho phép tách các tiểu phân nano từ những thể tích nhỏ cỡ vài microlít của môi trường phân tán trên một thiết bị ly tâm. Việc phân tách mẫu sử dụng phương pháp này có thể sẽ gặp trở ngại đối với các hệ phân tán có nồng độ tiểu phân cao do quá trình va chạm và làm tắc màng lọc. Ngược lại, phương pháp này có một vài ưu điểm so với phương pháp siêu ly tâm như quá trình tách nhanh chỉ vài phút và lực ly tâm khá thấp (ví dụ: từ 2.000-4.000 x g). Do sử dụng lực ly tâm tương đối thấp, ít có khả năng gây biến dạng các tiểu phân và do đó, ít tác động đến sự toàn vẹn của tiểu phân. Kích thước lỗ lọc của màng càng nhỏ (dựa trên MWCO – Molecular weight cut off của màng, tính bằng đơn vị Dalton) thì lượng nano có kích thước nhỏ đi qua màng càng ít. Màng lọc có kích thước lỗ lọc dưới 50 kDa cho thấy có khả năng phân tách tốt. Tuy nhiên, hiệu suất tách với thể tích thấp là một trong những hạn chế của phương pháp này.
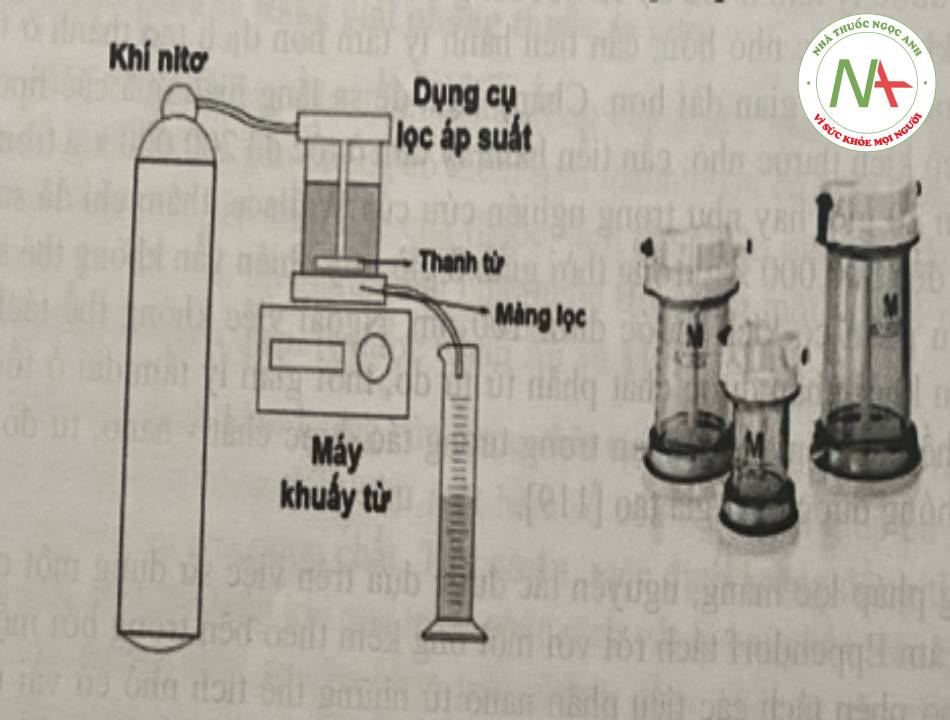
Ngược với phương pháp lọc màng, phương pháp lọc áp suất (hay lọc nén, pressure ultrafiltration) sử dụng áp suất tác động lên bề mặt phía trên của hệ phân tán để gây ra một áp lực thủy tĩnh đối với các tiểu phân. Các thành phần bên trong ống lọc áp suất sẽ được khuấy trộn liên tục để ngăn cản các tiểu phân làm tắc lỗ lọc. Quá trình tách diễn ra nhanh, khoảng dưới 5 phút, tùy thuộc vào nồng độ tiểu phân trong công thức, đông thời thu được thể tích dịch lọc lớn hơn
Trong khi đó, phương pháp thẩm tích cũng cho thấy có hiệu quả tách tốt, tuy nhiên cũng có một số hạn chế nhất định như thời gian thẩm tích kéo dài có thể hơn 3 giờ, cần tối ưu các điều kiện thẩm tích (cũng như các đặc tính của dược chất và nano) để đạt được trạng thái cân bằng.
Ngoài ra, còn có một số phương pháp khác mặc dù có khả năng phân tách tốt những quy trình khá phức tạp, đòi hỏi có các dụng cụ, thiết bị hiện đại để tách được các tiểu phần này như lọc gel, sắc ký cột. Tỷ lệ dược chất nano hóa (khả năng nạp thuốc) phụ thuộc vào loại nano và phương pháp bào chế. Việc lựa chọn đúng loại polyme, phức hợp các polyme (khối lượng phân tử, sự có mặt của các nhóm chức, điện tích, tỉ lệ các monome), các nhóm chức trên polyme, tỉ lệ giữa polyme và đồng polyme, bản chất của thuốc (acid, base hay dạng muối), điều kiện nạp thuốc (điều chỉnh pH, nhiệt độ, việc thêm các tá dược), khả năng nạp thuốc lý thuyết là những thông số quyết định để tối ưu hiệu suất nano hóa. Khi tăng tương tác (chủ yếu là lực tương tác ion) dược chất với hệ chất mang, tỷ lệ dược chất nano hóa cũng như hiệu suất nano hóa tăng. Tuy nhiên, tốc độ giải phóng có thể bị suy giảm.
Nếu thuốc được nạp bằng phương pháp kết hợp (incorporation method), thuốc sẽ có một hiệu ứng “ồ ạt” (burst effect) tương đối nhỏ và có đặc tính giải phóng kéo dài tốt hơn. Khi nano được bao bởi một polyme, quá trình giải phóng sẽ được kiểm soát bởi sự khuếch tán thuốc từ trong cốt đi qua màng polyme. Màng bao đóng vai trò như một lớp rào cản đối với quá trình giải phóng, do đó, độ tan của dược chất và sự khuếch tán qua màng polyme là các yếu tố xác định sự giải phóng dược chất.
1.6. Đánh giá khả năng giải phóng thuốc in vitro
Một trong những đặc điểm quan trọng của nhiều loại thuốc ứng dụng công nghệ nano đó là khả năng giải phóng có kiểm soát thành phần có hoạt tính. Điều này làm thay đổi khả năng phân bố sinh học của thuốc, làm tăng hiệu quả và giảm độc tính tại vị trí tác dụng. Do đó, tốc độ giải phóng của thuốc trở thành một yếu tố rất quan trọng được xem xét bởi cơ quan quản lý dược Châu Âu và Mỹ.
Việc xác định hàm lượng của dược chất tự do (không gắn) và tỉ lệ dược chất được bao gói trong một công thức như một hàm số của thời gian giúp có thể tính toán được tốc độ giải phóng của dược chất. Tuy nhiên, việc định lượng đồng thời như vậy không phải là một điều dễ dàng khi quá trình phân tách vật lý hai phần trên (gắn và không gắn) có thể ảnh hưởng đến sự cân bằng giải phóng dược chất từ các tiểu phân, từ đó ảnh hưởng đến trạng thái được đo. Điều này là vấn đề rất quan trọng trong trường hợp giải phóng trong môi trường sinh học phức tạp, khi các thành phần như tế bào máu hay protein có thể hình thành các phức hợp thuận nghịch với dược chất ở trạng thái cân bằng với dược chất không gắn, từ đó làm giảm nồng độ của dược chất không gắn có hoạt tính.
Khi sử dụng tiểu phân nano để vận chuyển thuốc, khả năng giải phóng thuốc ra khỏi tiểu phân nano sẽ được đánh giá qua một khoảng thời gian nhất định, việc đó sẽ giúp xác đinh sinh khả dụng của thuốc tại vị trí đích, giúp đánh giá được hiệu quả điều trị của dạng bào chế về khả năng giải phóng thuốc, có thể bao gồm ba cơ chế như sau: sự phản hấp phụ của thuốc gắn/hấp phụ ở bề mặt, khuếch tán khỏi hệ polyme, và quá trình giải phóng tiếp theo do sự ăn mòn polyme. Trong trường hợp nano polyme dạng cốt, trong đó dược chất được phân bố đồng nhất trong hệ cốt thì quá trình giải phóng dược chất diễn ra là do quá trình khuếch tán và/hoặc ăn mòn của hệ cốt. Nếu quá trình khuếch tán diễn ra nhanh hơn tốc độ phân hủy hệ cốt, thì khuếch tán dường như đóng vai trò là cơ chế chính của quá trình giải phóng thuốc. Quá trình giải phóng nhanh ban đầu được cho là do lượng thuốc được hấp phụ hoặc gắn kết yếu lên bề mặt của các tiểu phân nano. Quá trình giải phóng thuốc từ tiểu phân nano được nghiên cứu ít nhất theo một trong ba cách sau: lấy mẫu và phân tách, khuếch tán qua màng thẩm tích, kỹ thuật phân tích in situ, hoặc có thể được chia thành nhóm các phương pháp sắc ký (sắc ky ray phân tử – size exclusion chromatography, chiết pha rắn), chiết lỏng-lỏng, nhóm các phương pháp có trạng thái cân băng (như thâm tích, siêu ly tâm, siêu lọc (lọc màng).
Trong kỹ thuật lấy mẫu và phân tách, thuốc được giải phóng sẽ được tách ra khỏi tiểu phân nano bằng cách lọc, ly tâm, lọc màng, hoặc lọc áp suất và được định lượng bằng nhiều phương pháp phân tích khác nhau. Sau đó, tiểu phân nano được bổ sung môi trường giải phóng mới, phân tán lại và ủ tiếp tục cho đợt lấy mẫu tiếp theo. Trong khi phương pháp này có thể tiến hành với một lượng mẫu nhỏ và các thiết bị phân tích đơn giản, vẫn tồn tại một vài hạn chế. Ví dụ nếu không chú ý đến phương pháp thì quy trình này tương đối chậm và không hiệu quả, điều này có thể không phù hợp trong trường hợp nghiên cứu các tiểu phân nano có khả năng giải phóng thuốc nhanh. Ngoài ra, trong trường hợp các tiểu phân nano có kích thước tương đối nhỏ, cần lực ly tâm hay lực chia cắt lớn hơn để lọc và tách nano, dẫn đến có thể làm thay đổi các tiểu phân nano và động học giải phóng.
Quá trình khuếch tán qua màng thẩm tích phụ thuộc vào sự khuếch tán liên tục qua màng thẩm tích, trong đó bao gồm phương pháp sử dụng túi thẩm tích, phương pháp sử dụng túi thẩm tích đảo ngược, phương pháp thẩm tích với thiết bị giỏ quay. Ưu điểm của các phương pháp này là các tiểu phân nano không bị tác động do quá trình phân tách và quá trình lấy mẫu nhanh, đơn giản. Ngược lại, màng thẩm tích có thể làm giảm quá trình giải phóng thuốc với vai trò như là một rào cản của quá trình khuếch tán hay bề mặt hấp phụ, do đó một thí nghiệm kiểm chứng với dạng thuốc tự do cần được tiến hành để minh chứng cho hiệu quả của màng. Phương pháp khuếch tán qua màng thường sử dụng một lượng lớn thể tích môi trường giải phóng. Trong khi một lượng thể tích lớn giúp duy trì điều kiện “sink” cho quá trình giải phóng thuốc thì quá trình phân tích thuốc có thể trở nên khó khăn do nồng độ thuốc trong môi trường thấp.

Kỹ thuật phân tích tại chỗ (in situ) hay hòa tan động khá tiện lợi trong nghiên cứu các nano tinh thể, chủ yếu gồm một dược chất. Kỹ thuật này phân tích đặc điểm của tiểu phân nano tại chỗ để xác đinh lượng thuốc giải phóng (hòa tan) một cách gián tiếp. Rất nhiều kỹ thuật phân tích khác nhau như phân tích điện hóa, phương pháp đo nhiệt lượng, phương pháp đo độ đục và kỹ thuật tán xạ ánh sáng đều được áp dụng cho mục đích này. Kỹ thuật này không cần phải phân tách nano và có thể đánh giá động học giải phóng ngay tức thì. Tuy nhiên, phương pháp này cũng có hạn chế trong việc xác định tính nguyên vẹn của thuốc được giải phóng.
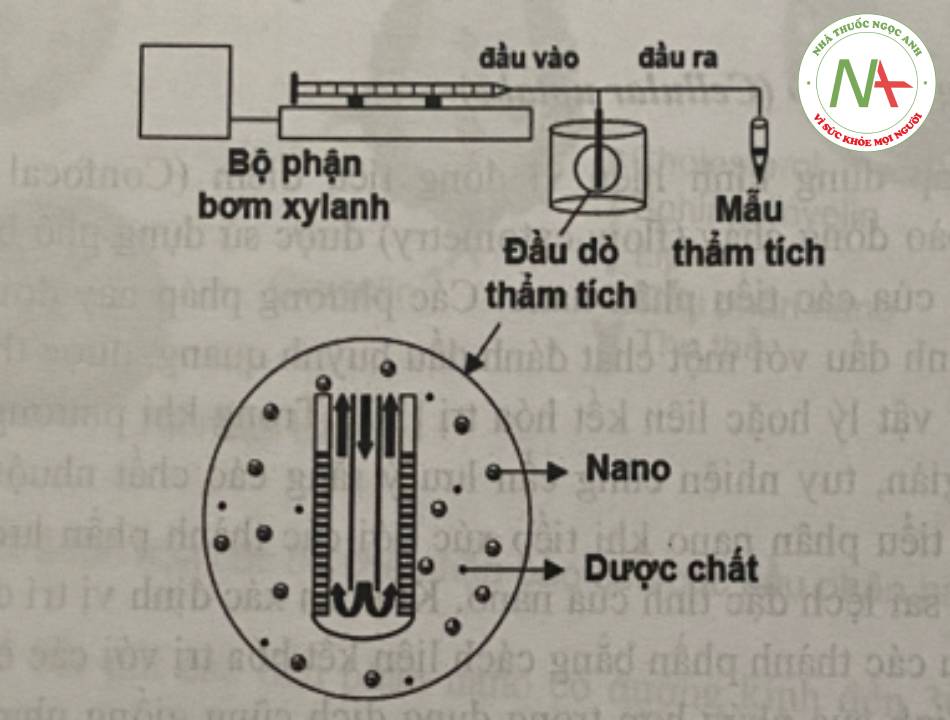
Ngoài ra, còn có một số phương pháp đánh giá khả năng hòa tan khác được sử dụng như sử dụng dụng cụ hòa tan IV với kiểu dòng chảy trong USP, sử dụng đầu dò thẩm tích (microdialysis probe).
Ngoài đánh giá khả năng giải phóng thuốc in vitro, có thế nghiên cứu khả năng giải phóng thuốc in vivo dựa trên việc thăm dò vị trí của cả dược chất và các thành phần của tiểu phân nano bằng phương pháp đánh dấu đồng vị phóng xạ hoặc bằng phương pháp định lượng hóa học hoặc sinh học bổ sung nhằm theo dõi các thành phần không được đánh dấu. Tuy nhiên, việc sử dụng đồng vị phóng xạ nhìn chung tương đối khó thực hiện ở hầu hết các phòng thí nghiệm và việc thăm dò/phát hiện các thành phần của tiểu phân nano không bị đánh dấu là khá phức tạp do sự liên quan giữa bản chất sinh hóa của chúng với quá trình chuyển hóa trong cơ thể.
2. PHƯƠNG PHÁP ĐÁNH GIÁ TÁC DỤNG SINH HỌC IN VITRO
Sau khi đánh giá các đặc tinh lý hóa, tác dụng sinh học của các tiểu phân nano sẽ được đánh giá trên các mô hình tế bào trước khi tiến hành các thử nghiệm in vivo tiếp về sau.
2.1. Nuôi cấy tế bào đơn lớp 2 chiều
Trong quy trình nuôi cấy tế bào 2D (Two-dimensional (2D) monolayer cell culture), các tế bào phát triển thành một lớp trên bề mặt giếng của đĩa hoặc binh nuôi (flask), đã được xử lý bằng phương pháp vật lý hoặc vật liệu bám dính sinh học để thuận lợi cho tế bào bám dính. Các tế bào được đặt trong môi trường nuôi cấy có bổ sung các chất dinh dưỡng và phát triển ở 37°C trong môi trường âm có kiểm soát lượng oxy và carbon dioxyd. Những điều kiện này cung cấp các điều kiện tối thiểu để duy trì sự sống của tế bào. Do vậy, mô hình nuôi cấy tế bào đơn lớp này thật sự thuận lợi đối với việc xác định nhanh khả năng ẩm bào và nội thực bào của các tiểu phân nano, tác dụng sinh học của thuốc trong hệ mang thuốc nano, và độc tính của hệ mang thuốc. Nghiên cứu này có thể thực hiện được trên nhiều dòng tế bào..
2.1.1. Khả năng ẩm bào (Cellular uptake)
Phương pháp dùng kính hiển vi đồng tiêu điểm (Confocal microscopy) hay phương pháp tế bào dòng chảy (flow cytometry) được sử dụng phổ biến để nghiên cứu khả năng ẩm bào của các tiểu phân nano. Các phương pháp này đòi hỏi các tiểu phân nano cần được đánh dấu với một chất đánh dấu huỳnh quang, được thực hiện thông qua phương pháp bẫy vật lý hoặc liên kết hóa trị. Trong khi phương pháp đầu tiên có ưu điểm là đơn giản, tuy nhiên cũng cần lưu ý rằng các chất nhuộm thân dầu có thể thoát ra khỏi các tiểu phân nano khi tiếp xúc với các thành phần lưỡng tính hoặc thân dầu và làm mô tả sai lệch đặc tính của nano. Khi cần xác định vị trí của hệ mang thuốc, cần thiết đánh dấu các thành phần bằng cách liên kết hóa trị với các chất nhuộm và đảm bảo được sự ổn định của phức hợp trong dung dịch cũng giống như trong dịch sinh lý của cơ thể. Lý tưởng hơn, thuốc và hệ mang thuốc nên được đánh dấu riêng biệt để có thể đánh giá chính xác sự vận chuyển thuốc là do hệ mang thuốc.
Phương pháp dùng kính hiển vi đồng tiêu điểm giúp xác định vị trí của nano trong tế bào, phương pháp tế bào dòng chảy giúp phân tích định lượng khả năng ẩm bào của tiều phân nano. Trong phương pháp tế bào dòng chảy, các tế bào ở dạng hỗn dịch được cho đi qua một điểm “do” (interrogation point) nơi mà các tế bào được kiểm tra riêng biệt bởi một tia lase dựa vào đặc điểm quang học và huỳnh quang của chúng. Kết quả sẽ thu được các thông tin định lượng dựa trên số lượng các tế bào có khả năng phát huỳnh quang hoặc cường độ huỳnh quang trung bình của các tế bào. Các thông tin này được sử dụng để xác định tỉ lệ tế bào bị diệt bởi phương pháp trị liệu hoặc xác định lượng thuốc huỳnh quang xâm nhập vào trong tế bào. Hay một cách khác, khả năng âm bào còn có thể định lượng bằng cách đo trực tiếp lượng thuốc hoặc hàm lượng chất nhuộm bên trong tế bào. Trong quá trình này, các tế bào sẽ được phá hủy ở cuối giai đoạn trị liệu để định lượng thuốc giải phóng bên trong tế bào. Trong phương pháp tế bào dòng chảy, coumarin-6 là một trong những chất huỳnh quang thường được sử dụng.
2.1.2. Cơ chế ẩm bào
Ngoài khả năng ẩm bào (số lượng các tiểu phân được ẩm bào), cơ chế của các tiểu phân nano đi vào tế bào cũng rất quan trọng bởi vì các quá trình tiếp theo trong nội bào phụ thuộc vào cơ chế ẩm bào. Các tiểu phân nano có thể đi vào tế bào theo nhiều con đường khác nhau phụ thuộc vào đặc tính lý hóa của hệ. Ví dụ đối với các tiểu phân có kích thước từ 1-10μm, quá trình đi vào tế bào của tiểu phân phụ thuộc vào quá trình thực bào. Các tiểu phân có kích thước nhỏ hơn có thể bị bắt giữ bởi quá trình đại ẩm bào (marcopinocytosis), nội thực bào qua trung gian của clathrin hay caveola.
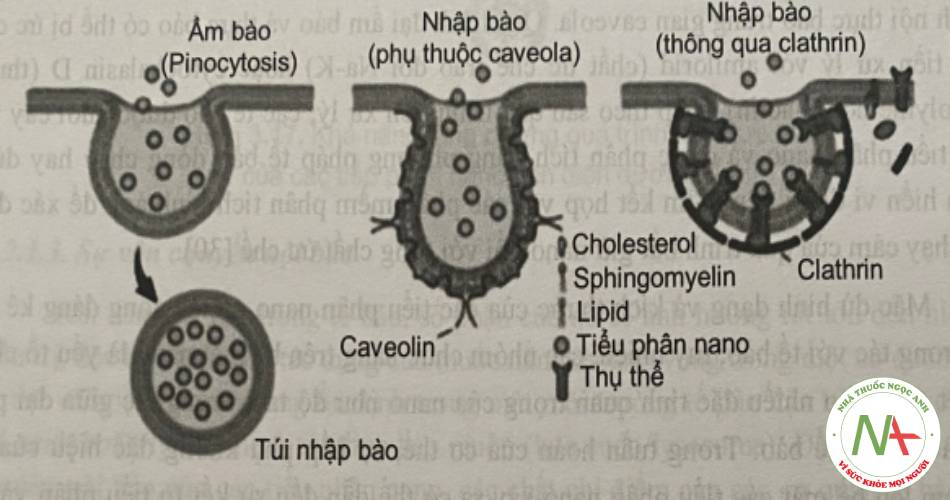
Tế bào có thể bắt giữ các tiểu phân nano có đường kính đến 300 nm thông qua quá trình đại thực bào (macropinocytosis), trong đó màng tế bào nhô ra và nối trở lại với phần khác của màng tế bào để tạo thành một túi lớn bọc lấy các tiểu phẫn nano. Quá trình nội thực bào qua trung gian clathrin xảy ra khi các protein clathrin trong màng tế bào polyme hóa và hình thành các túi (-100 nm) bọc lấy nano, sau đó được vận chuyển vào túi thực bào sớm (early endosome). Một vài nano sử dụng con đường caveola, trong đó màng tế bào được bao bởi caveolin cùng với cholesterol, các lipid và hình thành các lỗ lõm vào hình bình cầu (flask-shaped invagination) gọi là các caveola.
Quá trình nội thực bào theo con đường qua trung gian clathrin hay caveola liên quan đến các thụ thể của tế bào. Các phối tử đặc hiệu như acid folic, transferin, hay albumin giúp tạo điều kiện thuận lợi cho quá trình nội thực bào hay xuyên bào của những phân tử này. Vì vậy, các tiểu phân nano mang những phối tử này được nghiên cứu khá nhiều như là một cách đưa nano đến đích tế bào.
Ngoài kích thước tiểu phân, quá trình nhập bào còn bị ảnh hưởng bởi loại tế bào. Sự khác biệt về quá trình nhập bào này phụ thuộc vào con đường nhập bào ưu tiên của từng loại tế bào. Ví dụ như các tế bào ưu tiên nhập bào thông qua quá trình đại ẩm bào (marcopinocytosis) sẽ có khả năng bắt giữ nhiều hơn các tiêu phân co kích thước lớn hơn 200 nm so với các tế bào ưu tiên nhập bào thông qua quá trinh nội thực bào trung gian clatherin hay phụ thuộc caveola.
Để nghiên cứu con đường bắt giữ nano, các tế bào được xử lý bằng các chất ức chế đặc hiệu đối với các con đường nội bào đặc hiệu trước khi ủ với các tiểu phân nano đã được đánh dấu huỳnh quang. Clorpromazin là chất ức chế quá trình nội thực bao trung gian clathrin. Filip in và methyl-p-cylcodextrin (MpCD) là các chất ức chế quá trình nội thực bào trung gian caveola. Quá trình đại ẩm bào và thực bào có thể bị ức chế bởi tiền xử lý với amilorid (chất ức chế trao đổi Na-K) hoặc cytochalasin D (thuốc depolyme hóa F-actin). Tiếp theo sau quá trình tiền xử lý, các tế bào được nuôi cấy với các tiểu phân nano và được phân tích bằng phương pháp tế bào dòng chảy hay dùng kính hiển vi đồng tiêu điểm kết hợp với các phần mềm phân tích hình ảnh để xác định độ nhạy cảm của quá trình bắt giữ nano đối với từng chất ức chế.
Mặc dù hình dạng và kích thước của các tiểu phân nano có tác động đáng kể đến sự tương tác với tế bào, tuy nhiên, các nhóm chức năng trên bề mặt nano là yếu tố chính quyết định cho nhiều đặc tính quan trọng của nano như độ tan, tương tác giữa đại phân tử và bề mặt tế bào. Trong tuần hoàn của cơ thể, sự hấp phụ không đặc hiệu của các protein lên bề mặt các tiểu phân nano xảy ra có thể dẫn đến sự kết tụ tiểu phân và thải trừ ra khỏi hệ thống lưới nội mô, làm ngăn cản quá trình phân phối thuốc hay gen đến đích tác dụng.
Để hạn chế điều này, các tiểu phân nano có thể được bao với một phối tử trung hòa về điện được dùng phổ biến như PEG với tác dụng kháng lại sự hấp phụ của protein. Ngoài ra, điện tích bề mặt trung hòa trên các tiểu phân nano có thể thu được bằng cách sử dụng các phối tử ion lưỡng tính, kết quả cũng giúp làm giảm sự tương tác và bắt giữ bởi tế bào. Đồng thời, các phối tử trung hòa về điện tích này cũng có thể tạo ra một giải pháp hữu hiệu để giảm sự tương tác không đặc hiệu của các tiểu phân nano với môi trường sinh học nếu được gắn kết thích hợp trên bề mặt các tiểu phân.
Trong khi các nhóm chức trung hòa về điện có tác dụng ngăn cản các tương tác không mong muốn giữa nano và các thành phần sinh học của máu thì hầu hết các nhóm chức năng tích điện chịu trách nhiệm cho các tương tác chủ động của nano với tế bào. Các tiếu phân nano tích điện âm có xu hướng chống lại sự nhập bào, ngược lại các tiểu phân tích điện dương giúp tăng cường khả năng nhập bào do bản chất của các nhóm tích điện âm (như acid sialic) của màng tế bào, đặc biệt là các tế bào của khối u. Bởi vì các tiểu phân tích điện dương có hiệu quả tốt trong việc xâm nhập màng tế bào và đi vào nội bào nên chúng được ứng dụng trong nhiều hệ mang thuốc và gen.
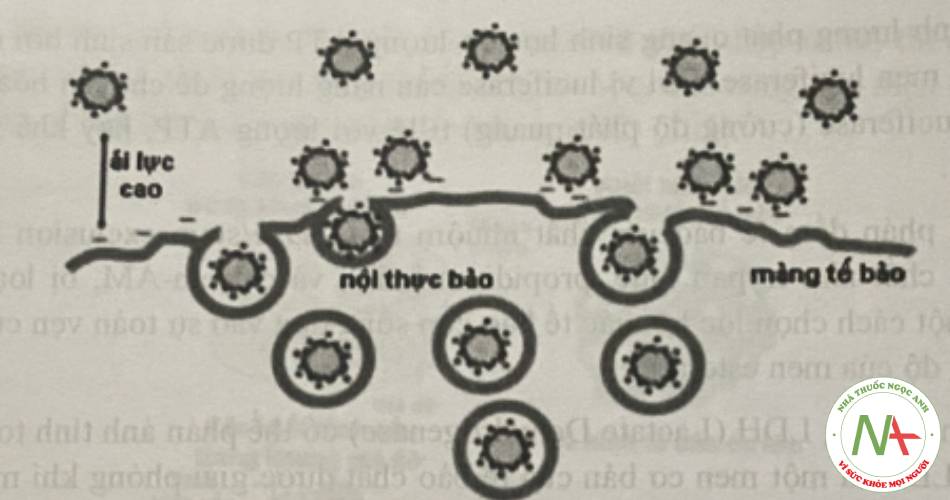
2.1.3. Sự vận chuyển nội bào
Khi nano đi vào trong tế bào, số phận của nó sẽ ảnh hưởng rất lớn đến hiệu quả điều trị, đặc biệt khi đích tác dụng của thuốc nằm khoanh vùng trong một cơ quan tế bào cụ thể và/hoặc thuốc không ổn đinh trong một môi trường tế bào đặc hiệu nào đó (như pH acid, hoặc lysozyme ở túi thực bào muộn (late endo/lysosome). Để xác định sự vận chuyến nội bào của các tiểu phân nano, các chất chỉ điểm của các cơ quan tế bào được xác định cùng với các tiểu phân nano và quan sát trong một khoảng thời gian. Hay một cách khác, các cơ quan tế bào được xác định bằng cách sử dụng các kháng thể được đánh dấu huỳnh quang sau khi cố định và gây thấm (permeabilization) tế bào. Một trong những hạn chế của kỹ thuật sử dụng các kháng thể này là khả năng có các tạp nhiễu do quá trình cố định/gây thấm như chiết tách và xác định lại vị trí các protein.
2.1.4. Tác dụng gây độc tế bào
Khi tiểu phân nano được sử dụng làm hệ mang thuốc, việc đánh giá xem hiệu lực của thuốc có thay đổi và/hoặc tính đặc hiệu hướng đích của thuốc có được tăng cường khi sử dụng hệ vận chuyển thuốc này hay không là rất cần thiết. Đối với thuốc chống ung thư khi bào chế dưới dạng nano, nhiều phương pháp khác nhau đo hoạt động chuyển hóa hay sự toàn vẹn của màng tế bào có thể được sử dụng để ước lượng được khả năng sống sót của các tế bào khi dùng thuốc.
Các phương pháp định lượng đo màu như các phép định lượng sử dụng các muối tetrazolium như MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromid), MTS (3-(4,5-dimethylthiazol-2yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H- tetrazolium), XTT (2,3-bis(2-methoxy-4-mtro-5-sulfophenyl)-5[(phenylamino) carbonyl]-2H-tetrazolium hydroxyd) để đo chức năng của ty thể của các tế bào sống, dựa vào khả năng khử các muôi tetrazolium này thành chất nhuộm formazan có cường độ màu cao.
Phép định lượng phát quang sinh học đo lượng ATP được sản sinh bởi các tế bào sống sử dụng men luciferase. Bởi vì luciferase cần năng lượng để chuyển hóa luciferin, hoạt độ của luciferase (cường độ phát quang) tỉ lệ với lượng ATP, hay khả năng song sót của tế bào.
Phương pháp đếm tế bào với chất nhuộm màu (Dye/stain exclusion assays) sư dụng các hóa chất như trypan blue, propidium iodid, và calcein-AM, bị loại trừ khỏi hoặc bị bẫy một cách chọn lọc bởi các tế bào còn sống dựa vào sự toàn vẹn của màng tế bào hoăc họat độ của men esterase.
Phép định lượng LDH (Lactate Dehydrogenase) có thể phản ảnh tính toàn vẹn của màng tế bào. LDH là một men cơ bản của tế bào chất được giải phóng khi màng tế bào bị tổn thương. Do đó hoạt độ của LDH trong môi trường của tế bào tỉ lệ với lượng tế bào bị chết.
2.2. Nuôi cấy tế bào 3 chiều
Trong nuôi cấy tế bào hai chiều in vitro, các tế bào đích được tiếp xúc trực tiếp và đồng nhất với các tiểu phân nano trong một khoảng thời gian mong muốn mà không có giới hạn nào về nồng độ cuối cùng. Tuy nhiên, điều này không phản ảnh hoàn toàn chính xác các tình huống xảy ra trong môi trường in vivo ở các khối 3D như các khối u rắn, nơi các tiểu phân đối diện với nhiều rào cản để đến được các tế bào đích.
Ngoài ra, liên quan đến các đặc tính cơ học và hình học bất thường cao, có thể các tế bào được nuôi cấy 2D làm hạn chế khả năng bộc lộ kiểu hình và chức năng di truyền của các mô sống, điều này có thể ảnh hưởng đáp ứng của chúng đến các kích thích hóa học. Thực tế hiệu quả in vivo đôi khi đi ngược lại các kết quả sàng lọc thuốc thu được trong quá trình nuôi cấy tế bào 2D. Do đó, các nỗ lực đã được tiến hành nhằm phát triển các mô hình tế bào 3D (three dimensional approach), giúp bắt chước tốt hơn các tương tác tế bào – tế bào và tế bào – khuôn nền ngoại bào (extracellular matrix) ở các cơ quan sống.
Các mô hình thường được sử dụng là (i) tế bào được bao gói trong các khung giá đỡ, (ii) các hình cầu đa tế bào, (iii) sự kết hợp của các khung giá đỡ và các hình cầu và (iv) các mô hình tế bào đa lớp .
Trong đó, các khung dạng sợi nano đang thu hút khá nhiều nghiên cứu vì chúng thê hiện cấu trúc sinh lý rất giống với các sợi nano protein trong khuôn nền ngoại bào. Trong ba kỹ thuật bào chế hệ sợi nano thông dụng, phun điện trường electrospinning là một kỹ thuật đơn giản và thực tế, thích hợp để tạo các cấu trúc 3D phức tạp và được định vị; kỹ thuật tự lắp ráp mô phỏng quá trình lắp ráp của khuôn nền ngoại bào và từ đó có thể tạo thành các sợi nano rất mỏng; và kỹ thuật tách pha cho phép tạo ra các mạng lưới sợi liên tục với cấu trúc lỗ hổng có thể điều chỉnh và hình thành các khung giống như bọt biển. Mặt khác, các khung dựa trên phức hợp nano (nanocomposite như nanohydroxyapatit, collagen) cũng rất phổ biến trong việc thiết kế các mô cứng, như việc phục hồi các mô xương. Ngoài các sợi nano, thì các ống nano carbon cũng thu hút nhiều sựu chú ý do độ bền cơ học, khả năng dẫn điện của chúng và bởi vì chúng có thể liên quan đến cấu trúc 3D.
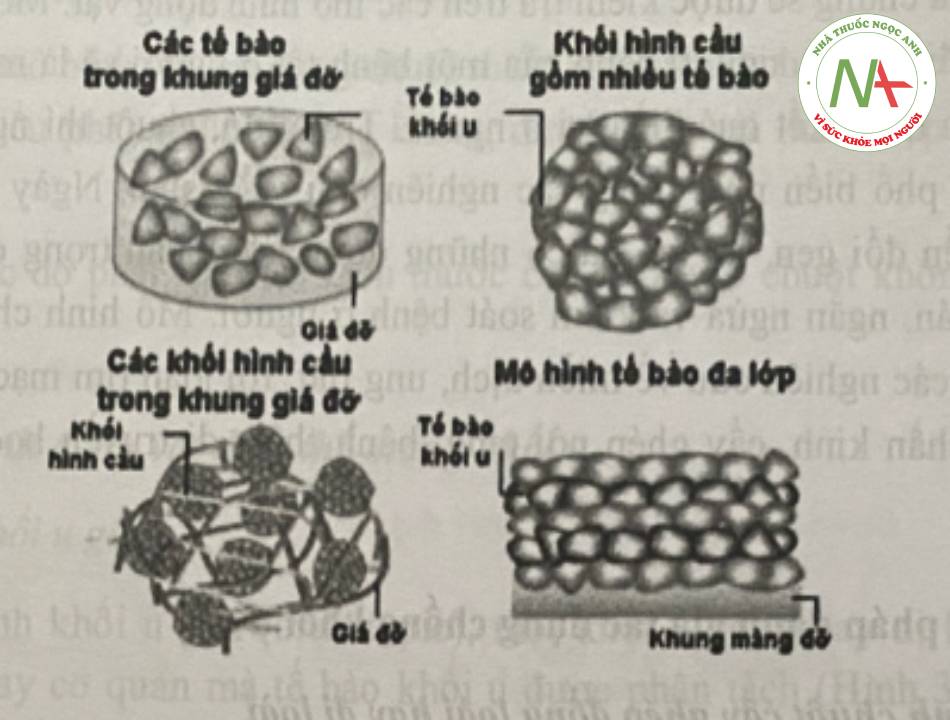
Việc ứng dụng các khung sợi và phức hợp nano để phục hồi nhiều mô khác nhau (như thần kinh, xương, cơ tim/xương, mạch máu và gan) hiện đang được nghiên cứu khá rộng rãi. Trong đó, các tế bào được nuôi cấy trong các khung có cấu trúc nano, tương thích sinh học, có khả năng lắp ráp thành các cấu trúc chức năng tương tự các mô tự nhiên dưới sự kích thích của các yếu tố phát triển được cung cấp bởi các tiểu phân nano theo không gian và thời gian. Các mồ phức tạp như phân thùy của gan, có thể được thiết kế với sự trợ giúp của các dụng cụ được thiết kế bởi công nghệ nano.

3. PHƯƠNG PHÁP ĐÁNH GIÁ TÁC DỤNG SINH HỌC IN VIVO
Khi các tiểu phân nano được minh chứng hiệu quả ỉn vitro, thì độ an toàn và hiệu quả điều trị của chúng sẽ được kiểm tra trên các mô hình động vật. Mô hình động vật có thể phản ánh điều kiện sinh lý bệnh của một bệnh tật ở người sẽ là một công cụ vô giá trong việc tiên đoán kết quả điều trị ở người. Trong đó, chuột thí nghiệm là động vật được sử dụng phổ biến nhất trong các nghiên cứu về y sinh. Ngày nay, có nhiều mô hình chuột biến đổi gen, lai tạo đã có những đóng góp quan trọng cho những tiến bộ trong chẩn đoán, ngăn ngừa và kiểm soát bệnh ở người. Mô hình chuột được sử dụng rộng rãi trong các nghiên cứu về miễn dịch, ung thư, rối loạn tim mạch, rối loạn chuyên hóa, rói loạn thần kinh, cấy ghép nội tạng, bệnh thận, di truyền học, độc chất học và hành vi.
3.1. Phương pháp đánh giá tác dụng chống khối u
3.1.1. Mô hình chuột cấy ghép đồng loài hay dị loài
Các mô hình chuột với các khối u đồng loài hay dị loài của người được ứng dụng rộng rãi trong việc đánh giá các tiểu phân nano vivo. Trong các mô hình này, các tế bào ung thư được tiêm hoặc các mô khối u được cấy (thường là dưới da) vào chuột có hệ miễn dịch bình thường hoặc chuột bị thiếu hụt miễn dịch (chuột nude không có tuyến ức hoặc chuột thiếu hụt miễn dịch phối họp cấp) để có thể phát triển thành các khối u có thể nhìn thấy được, sau đó các chuột này sẽ được cho dùng các trị liệu để xem xét các thông số dược động học, sự phân bố sinh học và các tác dụng dược Ịý.
Tuy nhiên, hiệu quả của các tiểu phân nano trong các mô hình động vật này không phải luôn luôn tiên đoán đúng các kết quả lâm sàng. Do đó, có một vài hạn chế của mô hình động vật hiện tại có thể được xem xét nhằm lý giải khoảng cách giữa các kết quả trên mô hình loại gặm nhấm và kết quả lâm sàng.
Thứ nhất, các cấy ghép khối u dưới da thường sử dụng không đại diện cho các ung thư chính ở người (như phổi, đại tràng, ngực) cũng như không phải vị trí hay gặp của di căn (như gan trong di căn của ung thư đại tràng). Thay vào đó, các khối u đồng loài (allograft) hay dị loài (xenograft) được tiêm dưới da (giúp thuận lợi hơn), nơi khối u phát triển ở môi trường hoàn toàn khác với các cơ quan chính ở trên nên làm giảm khả năng di căn.
Thứ hai, các dòng tế bào ung thư thường dùng trong các mô hình như nguồn ghép dị loài được duy trì qua quá nhiều chu kỳ nuôi cấy trong môi trường nên có thể mất các đặc tính cấu trúc và tế bào điển hình của khối u ban đầu.
Thứ ba, khi ghép dị loài trên mô hình chuột, các khôi u sẽ phát triển các chất nền và hệ thống mạch máu khác với nguồn gốc của chuột. Và các tác động này hiếm khi được xem xét trong việc thiết kế mô hình và biện luận kết quả nghiên cứu tiền lâm sàng.
Thứ tư, các mô hình này sử dụng chuột thiếu hụt miễn dịch nên các đáp ứng miễn dịch đối với các tiểu phân nano thường không được đánh giá thích hợp trong các mô hình này.
Thứ năm, tốc độ phát triển và kích thước của khối u ở chuột không thể so sánh như ở người.
3.1.2. Các mô hình động vật thay thế mang khối u
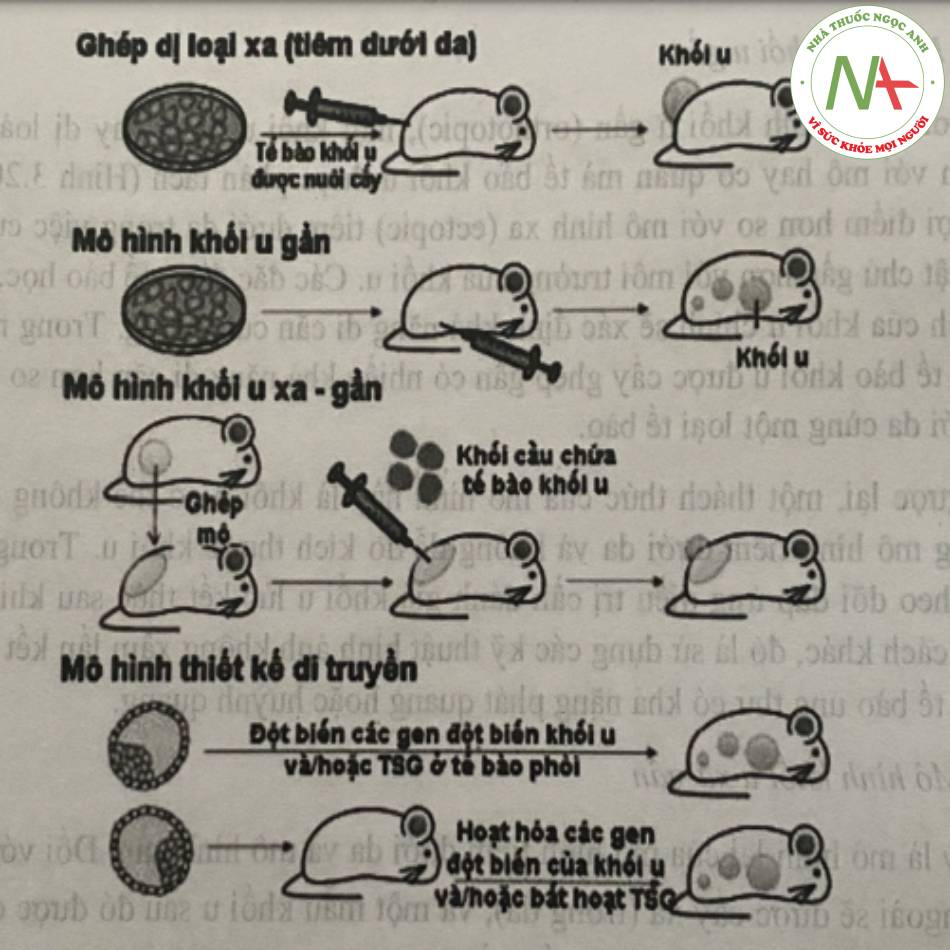
a. Mô hình khối u gần
Trong mô hình khối u gần (orthotopic), một khối u đồng hay dị loài được phát triển gần với mô hay cơ quan mà tế bào khối u được phân tách. Mô hình gần có lợi điểm hơn so với mô hình xa (ectopic) tiêm dưới da trong việc cung cấp môi trường vật chủ gần hơn với môi trường của khối u. Các đặc điểm tế bào học, sinh hóa và miễn dịch của khối u chính sẽ xác định khả năng di căn của chúng. Trong nhiều trường hợp, các tế bào khối u được cấy ghép gần có nhiều khả năng di căn hơn so với việc cấy ghép dưới da cùng một loại tế bào.
Ngược lại, một thách thức của mô hình này là khối u có thể không dễ phát hiện như trong mô hình tiêm dưới da và không dễ đo kích thước khối u. Trong trường hợp này, để theo dõi đáp ứng điều trị cần đánh giá khối u lúc kết thúc sau khi hy sinh con vật. Một cách khác, đó là sử dụng các kỹ thuật hình ảnh không xâm lấn kết hợp với việc dùng các tế bào ung thư có khả năng phát quang hoặc huỳnh quang.
b. Mô hình khối u xa-gần
Đây là mô hình lai của mô hình tiêm dưới da và mô hình gần. Đối với hệ này một mẫu mô ngoài sẽ được cấy xa (trong da), và một mẫu khối u sau đó được cấy bên trong chỗ ghép mô vừa cấy. Ví dụ, mô tuyến tiền liệt từ chuột đực, phổi hoặc gan được tách ra thành các mảnh mô nhỏ, rồi được cấy ghép dưới da của vật chủ. Tiếp theo, các mô khối u dưới dạng các khối hình cầu được đưa vào chỗ mô vừa cấy ghép, giúp tạo môi trường gần cho các mô khối u. Để có thể quan sát được mức độ tăng sinh mạch máu cũng như sự phát triển khối u, các mô có thể được cấy vào vùng da lưng của vật chủ.
c. Mô hình chuột được nhân tính hóa
Khái niệm chuột được nhân tính hóa liên quan đến mô hình động vật trong đó các tế bào của người hoặc các tế bào gốc của máu được chuyển vào chuột nên hệ miễn dịch của người được hình thành ờ chuột ít nhất một phần.
d. Mô hình chuột được thiết kế di truyền
Trong mô hình chuột được thiết kế di truyền (GEM – genetically engineered mouse), các khối u được hình thành dựa trên việc điều khiển yếu tố di truyền của động vật. GEM được tạo thành bằng cách hoạt hóa các gen đột biến của khối u hoặc bất hoạt các gen kìm hãm khối u thông qua các đột biến. Một ưu điểm chính của mô hình GEM đó là chúng phản ánh những thay đổi di truyền tạo ra các khối u đặc hiệu và các tương tác vật chủ – khối u đồng hê, do vậy chúng rất có lợi cho việc nghiên cứu vai trò của các gen đột biến và tương tác giữa tế bào ung thư và vệ môi trường. Tuy nhiên, GEM không được sử dụng phổ biến như các mô hình khác trong đánh giá thường quy nano do chi phí cao, thời gian và vấn đề sở hữu trí tuệ.
3.2. Phương pháp đánh giá các tác dụng sinh học khác
Nhiều mô hình chuột khác nhau có thể được sử dụng để đánh giá các tác dụng sinh học khác của tiểu phẫn nano như mô hình chuột bị gây bệnh đái tháo đường type 2, mô hình chuột để thử độc tính, mô hình chuột với các bệnh về da,… để nghiên cứu về tác dụng hạ đường huyết, thử độc tính, điều trị các bệnh về da,…
Tuy nhiên, trong phạm vi tài liệu này, chỉ tập trung đề cập về các mô hình chuột mang khối u được sử dụng khi đánh giá tác dụng sinh học của các tiểu phân nano.
CÂU HỎI LƯỢNG GIÁ
- Trình bày nguyên tắc của các phương pháp sử dụng trong đánh giá kích thước và hình thái tiểu phân.
- Trình bày các đặc điểm của các phương pháp sử dụng trong đánh giá thành phân, tương tác hóa học và trạng thái kết tinh của các thành phần trong công thức chứa tiểu phân nano.
- Phân tích đặc điểm của các phương pháp sử dụng trong đánh giá khả năng nạp thuốc, hiệu suất nano hóa, khả năng giải phóng thuốc in vitro.
- Phân tích đặc điểm của các phương đánh giá tác dụng sinh học in vitro.
- Trình bày đặc điểm của các mô hình đánh giá tác dụng sinh học in vivo.