Bệnh tim mạch
Ảnh hưởng của tăng huyết áp và đột quỵ tới tuần hoàn mạch não
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Bài viết Ảnh hưởng của tăng huyết áp và đột quỵ tới tuần hoàn mạch não của tác giả Anne M. Dorrance.
Lưu lượng máu não phải được điều hòa chặt chẽ để đảm bảo rằng các nhu cầu trao đổi chất của tế bào thần kinh luôn được đáp ứng [1]. Cơ chế kiểm soát tinh tế này được hỗ trợ bởi hai cơ chế sinh lý và cơ chế tự điều hòa của bộ đôi thần kinh- mạch máu. Chương này sẽ thảo luận về các cơ chế này và làm thế nào mà chúng bị rối loạn bởi TĂNG HUYẾT ÁP và thiếu máu cục bộ não. sức cản động mạch cũng góp phần vào việc điều tiết lưu lượng máu não. Tăng huyết áp gây ra Tăng huyết ápy đổi cấu trúc trong các động mạch não làm tăng sức cản động mạch và gây ra tổn thương do thiếu máu cục bộ não. Các cơ chế liên quan vấn đề này cũng sẽ được thảo luận. đột quỵ thiếu máu cục bộ hay gặp nhất ; do đó ở đây sẽ nói phần lớn về kiểu đột quỵ này. Các vấn đề kiểm soát mạch máu não phụ thuộc vào thời gian và vùng thiếu máu cục bộ trong cơn đột quỵ, do đó cấu trúc và chức năng của chúng là yếu tố quyết định quan trọng tới độ lớn cuối cùng của vùng nhồi máu và kết quả lâm sàng [2].
Giải phẫu động mạch não
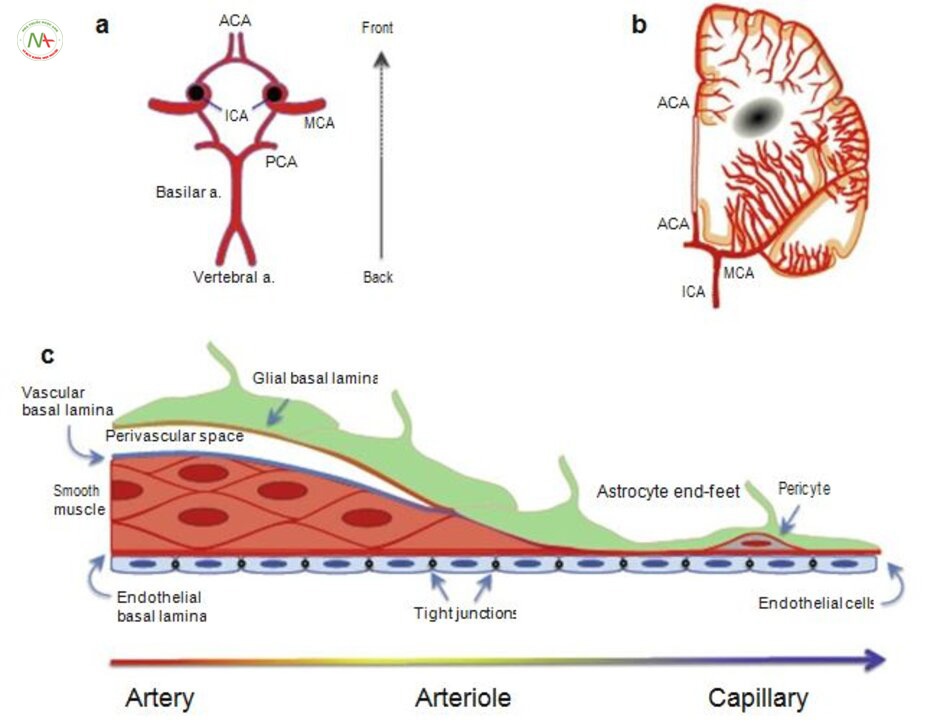
Trước khi thảo luận về những tác động của tăng huyết áp trên động mạch não cần tạm dừng để mô tả một số sinh lý cơ bản của tuần hoàn não. Các động mạch não cũng có cấu trúc phù hợp để ngăn chặn suy giảm lưu lượng máu đến nhu mô trong trường hợp đột quỵ thiếu máu cục bộ [3, 4]. vòng Willis là một vòng động mạch có các nhánh nối tại đáy não (Hình. 5.1a). Cấu trúc này cho phép tưới máu ngang sang bán cầu não, và lưu lượng máu trong vòng tròn của Willis có thể được đảo ngược để cấp. Các động mạch màng mềm bao phủ bề mặt của não cũng cấp máu bảo vệ não nếu thiếu máu cục bộ. có 1 số lượng lớn các chỗ nối kết nối các động mạch phân nhánh sau và động mạch não giữa và phía trước với động mạch não giữa [5]. Những vòng nối này cấp máu Tăng huyết ápy thế trong trường hợp 1 động mạch nhỏ bề mặt bị tắc [6-8]. Các động mạch màng mềm được phân bố theohệ thần kinh ngoại biên [9], và các dây thần kinh giao cảm và phó giao cảm giúp điều chỉnh trương lực của mạch máu giúp co mạch (norepinephrine và neuropeptide Y) và giãn mạch (acetylcholine và oxit nitric) tương ứng [9-11].
Các tiểu động mạch và tiểu động mạch từ động mạch màng mềm lại đi vào nhu mô để điều tiết vi tuần hoàn trong nhu mô (5.1b hình.) [12].
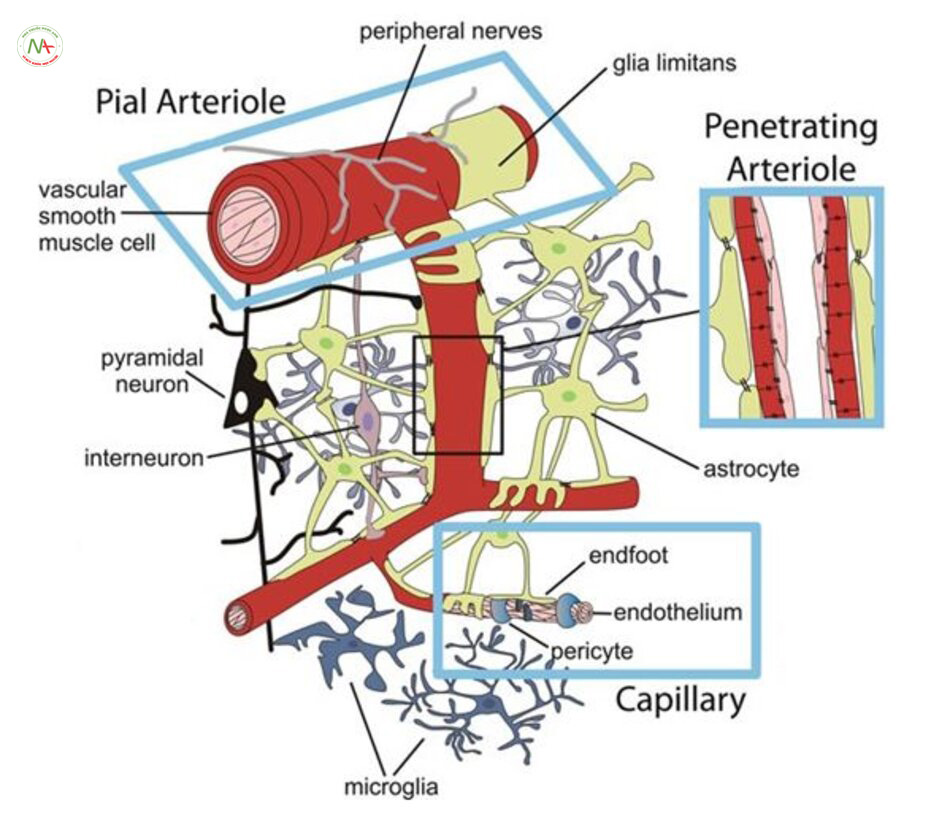
Nhưng các tiểu động mạch xâm nhập vào nhu mô lại có rất ít nhánh, do đó tắc một tiểu động mạch đi vào nhu mô có thể gây tổn thương đáng kể tới vỏ não xung quanh [13]. Dòng chảy của tiểu động mạch chi phối bởi tế bào thần kinh neuropil (Hình. 5.2) [9]. Hầu hết các dây thần kinh có các tế bào hình sao xung quanh động mạch giúp truyền tín hiệu chuyển tiếp từ tế bào thần kinh sang các tiểu động mạch để tăng tưới máu trong thời gian cần nhu cầu trao đổi chất cao [14, 15].
Một mạng lưới dày đặc các mao mạch não phát sinh từ các tiểu động mạch xâm nhập [16], và có khả năng dự phòng quan trọng để cung cấp máu giúp bảo vệ khi có thiếu máu cục bộ não [17]. Các mao mạch được bao quanh bởi các tế bào quanh mạch (pericytes) giúp điều chỉnh tưới máu [18]. Tuy nhiên, nhiều nghiên cứu gần đây cho thấy pericytes không chứa các protein alpha gây co sợi actin cơ trơn, và chúng không điều chỉnh lưu lượng máu để đáp ứng với kích thích thần kinh hoặc giảm tưới máu lan rộng [19]. Tuy nhiên, mật độ tế bào pericyte cao.
Theo quan sát thấy các tế bào này đóng một vai trò sinh lý quan trọng trong não [20, 21]. Các pericytes là một phần của các đơn vị thần kinh mạch máu, mà cũng có chứa các tế bào cơ trơn mạch máu, tế bào nội mô, tế bào hình sao và tế bào thần kinh (Hình. 5.2). Các pericytes có thể hoạt động như một cầu nối để chuyển tiếp thông tin giữa hệ thần kinh và mạch máu trong não [19].
Bộ đôi thần kinh mạch máu
Bội đôi thần kinh mạch máu đi với nhau phục vụ nhu cầu trao đổi chất của tế bào thần kinh để tưới máu não [13]. Điều này đòi hỏi tín hiệu tích hợp nhanh chóng giữa các tế bào thần kinh, thần kinh quanh mạch, thần kinh đệm và các tế bào trong mạch máu [25, 26]. Các tế bào kích thích gây giãn tiểu động mạch và nhánh động mạch đi vào nhu mô. Bộ đôi thần kinh mạch máu hoạt động nhờ ba con đường giãn mạch chính: oxit nitric (NO) [29, 30], cyclooxygenase (COX) -2 [31], và axit epoxyeicosatrienoic (Eets) [32]. mô tả chi tiết về các cơ chế truyền tín hiệu liên quan đến bộ đôi thần kinh mạch máu xin vui lòng xem [25].
Ảnh hưởng của tăng huyết áp trên thần kinh – mạch máu
Các nghiên cứu về ảnh hưởng của tăng huyết áp trên thần kinh mạch máu ở người còn hạn chế. 1 số các nghiên cứu cho thấy angiotensin II có thể có tác động trực tiếp vào mạch máu thần kinh mà không liên quan đến sự gia tăng huyết áp.
Điều trị hạ huyết áp với losartan, chẹn thụ thể angiotensin (ARB), không có tác dụng có lợi trên bộ đôi thần kinh mạch máu [37]. Nó cũng cho thấy hiệu quả bộ đôi thần kinh mạch máu bị suy giảm không phụ thuộc vào huyết áp. Nghiên cứu này rõ ràng là mâu thuẫn với các nghiên cứu trước đây đã mô tả ở những con chuột bị tăng huyết áp phụ thuộc angiotensin II. Những con chuột được điều trị bằng losartan (30 tuần) đã tăng huyết áp ít nhất hai phần ba cuộc đời của chúng. Do đó, có thể là thuốc không có hiệu quả vì các tổn thương mạch máu qua tác động trung gian của tăng huyết áp kéo dài không thể đảo ngược.
Ảnh hưởng của đột quỵ trên thần kinh mạch máu
Nghiên cứu về thần kinh mạch máu ở người sau đột quỵ đã mang lại kết quả khác nhau. Điều thú vị là khi dùng thuốc để giãn động mạch não mạnh, acetazolamide không làm tăng lưu lượng máu trong vỏ não cùng bên. Acetazolamide được sử dụng để đo khả năng dự trữ mạch máu não hoặc tưới máu tối đa có thể trong não. Nghiên cứu này cho thấy rằng thiếu máu cục bộ làm giảm khả năng dự trữ mạch máu mà không làm suy yếu thần kinh mạch máu, do đó các cơ chế làm giãn mạch máu xuất hiện để bù trừ giảm tưới máu não sau thiếu máu cục bộ.
Các nghiên cứu sử dụng PET và kích thích thị giác ở những bệnh nhân hẹp động mạch cảnh cả hai mắt thấy có tăng tưới máu cho cả vỏ não và thị giác ở tất cả các bệnh nhân. Hầu hết bệnh nhân có giảm lưu lượng máu ở bán cầu bị tổn thương khi so với bán cầu bên đối diện. Sự giảm lưu lượng máu trong các khu vực xung quanh vỏ não, thị giác có thể là hậu quả của sự phân phối lại dòng máu trong não, tức là, sự gia tăng lưu lượng máu đến vỏ não thị giác có thể ăn cắp máu từ các vùng lân cận [39].
Các phản ứng thần kinh mạch máu bị suy giảm ở vùng nhồi máu trong cùng 1 bán cầu. cần lưu ý rằng trong nghiên cứu chức năng của não có thể giảm sau đột quỵ vì sử dụng glucose [40];. Ba giờ sau khi thiếu máu cục bộ gây giảm đáng kể tưới máu não để đáp ứng với kích thích thần kinh, sự giảm tưới máu não nguy hiểm hơn suy giảm đáp ứng thần kinh- mạch máu [43, 44].
Tự điều chỉnh mạch não
Trước khi thảo luận về ảnh hưởng của tăng huyết áp và đột quỵ với sự tự điều chỉnh mạch não, chúng ta chú ý 2 định nghĩa quan trọng: trương lực mô cơ và phản ứng mô cơ (myogenic). Trương lực mô cơ là khả năng nội tại của động mạch và tiểu động mạch để duy trì một lực co bóp hoạt động trong các tế bào cơ trơn của thành mạch máu. Trương lực cơ trơn được quy định bởi một số yếu tố như áp lực nội mô, dẫn truyền kali, hoạt động kênh canxi và nhạy cảm của quá trình truyền tín hiệu tới canxi. Trương lực cơ trơn phụ thuộc bởi các tế bào cơ trơn mạch máu, nhưng nội mạc có thể điều chỉnh trương lực [45, 46] thông qua việc sản xuất NO [47], prostacyclin [48], và yếu tố phân cực có nguồn gốc nội mô (EDHF) [49]. Các phản ứng cơ trơn thể hiện khả năng đáp ứng của động mạch, Tăng huyết ápy đổi phù hợp với những biến động trong áp lực trong lòng mạch để duy trì không đổi lưu lượng máu. Những cơ chế của mô cơ chịu trách nhiệm duy trì trương lực mạch máu giúp điều chỉnh kháng mạch máu não [50].
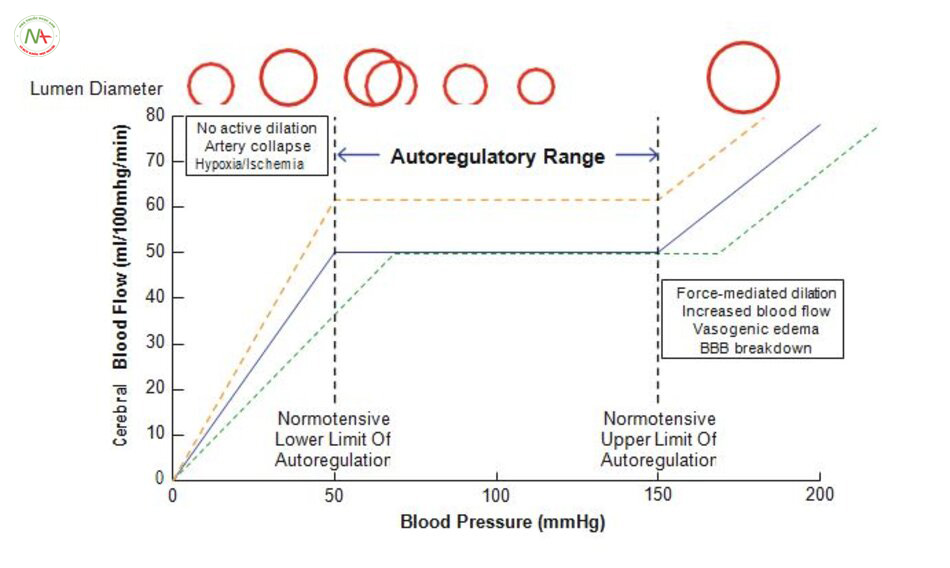
Tự điều hòa mạch não hoặc các hiệu ứng Bayliss góp phần vào khả năng điều chỉnh của não bộ để duy trì dòng máu liên tục trong khi áp lực tưới máu đang dao động (Hình. 5.3). động mạch não tự điều chỉnh áp lực động mạch trung bình trong khoảng 60-150 mmHg [51]. Khi huyết áp tăng lên trong phạm vi có thể tự điều chỉnh của động mạch não thì động mạch não co lại, khi giảm huyết áp thì động mạch lại giãn ra. Sự co thắt và giãn nở này cho phép duy trì không đổi lượng máu tới não [52, 53]. khi áp lực tưới máu cao có sự phản ứng của mô cơ để tự điều tuần hoàn não, điều này đặc biệt quan trọng vì động mạch phải co lại để ngăn chặn tình trạng chảy máu [52]. Ở áp suất trên và dưới các giới hạn của cơ chế tự điều chỉnh dòng chảy tỷ lệ thuận với áp lực trong lòng mạch. Vượt quá giới hạn trên của cơ chế tự điều chỉnh sẽ gây phù nề giãn mạch áp lực trong động mạch giảm xuống dưới giới hạn dưới của sự tự điều chỉnh, sẽ giảm tưới máu và tổn thương thiếu máu cục bộ xảy ra sau đó [6]. Một số yếu tố có liên quan đến việc kiểm soát tự điều chỉnh của não do các tế bào thần kinh sản xuất NO [51, 54-56], tự cầm máu [57], co mạch qua dẫn truyền thần kinh [58] và giãn mạch cholinergic [59].
Ảnh hưởng của tăng huyết áp trên hệ trương lực mô cơ Myogenic (SHRSPs) tự điều chỉnh
Các nghiên cứu về ảnh hưởng của tăng huyết áp lên sự tự điều chỉnh và phản ứng của mô cơ trong mô hình thực nghiệm trên động vật gặm nhấm cótăng huyết áp đã mang lại kết quả khác nhau.
Các nghiên cứu gần đây tập trung vào các tiểu động mạch xuyên tâm thây trương lực cơ nội mô giảm khi được điều trị bằng thuốc hạ áp (hydralazine, hydrochloro thiazide và reserpin) sau khi tăng huyết áp.
Quá nhiều tế bào mô cơ trong các động mạch não lớn có thể cản trở lưu lượng máu não, nhưng mất hoàn toàn trương lực của chúng cũng bất lợi. Mất trương lực cơ trong các động mạch làm các tiểu động mạch nhỏ và mao mạch có nguy cơ bị vỡ nếu huyết áp tăng lên. SHRSPs có thể gây mất trương lực cơ trơn khi cho ăn nhiều muối [67]. SHRSP thường tiến triển sau đột quỵ xuất huyết trong vòng 10 tuần, lúc này các động mạch não đã mất khả năng để tạo ra trương lực và tưới máu não phần lớn là do huyết áp [68]. Điều này có thể dẫn đến tăng huyết áp ác tính trong SHRSP do ăn muối [69, 70]. Hiện nay tăng huyết áp ác tính không kiểm soát được liên quan tới suy giảm trương lực hệ mô cơ (cơ trơn)
Lão hóa ảnh hưởng tới các tế bào cơ trơn và phản ứng của chúng với tăng huyết áp.
Lão hóa làm mất các phản ứng co bóp để tăng áp lực lòng mạch có liên quan với giảm sản xuất axit icosatetraenoic co mạch 20-hydroxye- (20-HETE) [71] và giảm nhạy cảm của các tế bào cơ trơn 20-HETE [72]. Các hoạt động của các thụ thể trên kenh (TRPC6) cũng bị giảm ở những con chuột cao huyết áp nuôi lâu năm [71]. TRPC6 đã được công nhận như cảm biến trong động mạch não về nhận áp và co thắt [73].
Ảnh hưởng của đột quỵ trên hệ cơ trơn và cơ chế tự điều chỉnh
Những ảnh hưởng của thiếu máu cục bộ não lên cơ chế tự điều chỉnh của động mạch não đã được nghiên cứu [90]. thường được chấp nhận rằng chức năng của động mạch não bị suy yếu do thiếu máu cục bộ não và điều này có thể làm tăng tổn thương thiếu máu cục bộ ban đầu và góp phần chấn thương thứ phát như phù và gây xuất huyết [90]. động mạch não dãn, hoặc mất trương lực mạch để đáp ứng với tổn thương thiếu máu cục bộ; đây là hậu quả của sự tích lũy các chất chuyển hóa vận mạch như acid lactic và carbon dioxide trong nhu mô [2]. giãn nở cơ trơn nội mạch
Rất quan trọng sau đột quỵ. Khi có bất kỳ động mạch nào tắc làm áp lực tưới máu trong động mạch hạ lưu bị giảm sẽ kích thích gây giãn cơ trơn. Nói chung các phản ứng mạch máu khi có thiếu máu cục bộ / tái tưới máu là giãn mạch [91-94]; điều này xảy ra ở hầu hết 50% số bệnh nhân đột quỵ trong vòng 3 ngày sau đột quỵ [94, 95].
Trong các nghiên cứu ở động vật, việc giãn mạch này làm tăng kich thước vùng nhồi máu do thiếu máu cục bộ và làm xấu đi các dấu hiệu thần kinh khu trú sau đột quỵ [97, 98]. phản ứng giãn mạch động mạch; trong tình huống này đường kính lòng động mạch là một yếu tố quyết định quan trọng của tưới máu não. Những tác động của tăng huyết áp trên đường kính lòng động mạch não sẽ được thảo luận nhiều hơn ở những chương sau. Điều quan trọng cần lưu ý rằng sự giãn nở động mạch không xảy ra nếu áp lực trong lòng mạch giảm xuống dưới giới hạn dưới của quá trình tự điều chỉnh. Trong tình huống này, lưu lượng máu sẽ tỷ lệ thuận với áp lực lòng mạch và trong một số trường hợp, các động mạch sẽ xẹp, làm nặng tổn thương thiếu máu cục bộ. Ở chuột huyết áp bình thường, các chỗ nối giữa động mạch màng mềm sẽ giãn ra một cách nhanh chóng để đáp ứng với thiếu máu cục bộ; cơ chế này suy giảm trong SHRSP [99]. Không có khả năng làm tăng tưới máu đến vùng thiếu máu cục bộ qua các động mạch màng mềm làm tăng tổn thương thiếu máu cục bộ quan sát thấy trong trường hợp đột quỵ SHRSP (đột quỵ có TĂNG HUYẾT ÁP) [100].
Mất trương lực và đáp ứng cơ trơn cũng góp phần gây giãn mạch sau đột quỵ. Sau 2 h thiếu máu cục bộ và sau 1 phút tái tưới trương lực cơ trơn vẫn bình thường trong MCA, nhưng sau khi tái tưới máu kéo dài (24 h) thì trương lực và đáp ứng cơ trơn bị suy giảm đáng kể [101]. Thời gian thiếu máu cục bộ có tác dụng tương tự trên trương lực cơ trơn từ 6 đến 24 giờ sau tổn thương thiếu máu cục bộ ban đầu [102, 103]. MCA ở phía bên đối diện của não cũng bị suy yếu do thiếu máu cục bộ não / tái tưới máu, cho thấy có một yếu tố được sản sinh ra sau đột quỵ có thể có những tác động bất lợi tới toàn bộ các động mạch não để tự điều chỉnh [103]. yếu tố tuần hoàn này tác dụng như chất oxy hóa và không thể đảo ngược tình trạng tổn thương do thiếu máu cục bộ /tái tưới máu trên cơ trơn [98, 104]. Những nghiên cứu khác đã báo cáo tác động tương tự của đột quỵ ở bán cầu bên đối diện. Trong một nghiên cứu trương lực cơ trơn giảm liên quan tới co động mạch trong 1h và 15’ sau thiếu máu cục bộ ban đầu. Các tác giả này thấy có sự liên quan giữa tăng nitrat hóa protein sau tái tưới máu [105]
Có một sự đồng thuận chung rằng thiếu máu cục bộ sau tái tưới máu gây giảm trương lực cơ trơn ở chuột có huyết áp bình thường. ở chuột bị cao huyết áp, 2 h thiếu máu cục bộ sau 22 h tái tưới máu không có tác dụng trên đường kính mạch do MCA tắc thấy không ảnh hưởng tới trương lực cơ trơn [106]. Điều này phù hợp với các nghiên cứu rằng không có hiện tượng giãn mạch màng mềm sau đột quỵ SHRSP. Có vẻ như liên quan tới quá trình mất sợi actin trong các tế bào cơ trơn mạch máu [102].
Các nghiên cứu đã mô tả ở trên đã được tiến hành trong động mạch não giữa, và các tiểu động mạch xuyên nhu mô sau tổn thương thiếu máu cục bộ. Các nghiên cứu gần đây đã cố gắng để hiểu được cơ chế chịu trách nhiệm cho việc duy trì trương lực trong các tiểu động mạch xuyên nhu mô sau đột quỵ. Nghiên cứu này cho thấy rằng sự cân bằng giữa co mạch và giãn mạch rất quan trọng, và cả hai đều bị Tăng huyết ápy đổi trong các tiểu động mạch xâm nhập khi tái tưới máu.
Ở người tái tưới máu có thể tự phát hoặc sau kích thích hóa học. tác nhân hóa học là yếu tố hoạt hóa plasminogen mô (rTPA), và rTPA có tác dụng có hại cho động mạch não. Trong động mạch não giữa đã bị thiếu máu cục bộ sau tái tưới máu, rTPA gây giảm đáng kể trương lực cơ trơn và đáp ứng của cơ trơn. Thiếu máu cục bộ và rTPA giảm độ giãn nở của tế bào cơ trơn. Điều thú vị là, thiếu máu cục bộ và rTPA cũng làm giảm phản ứng co các động mạch với serotonin, mà có thể làm tăng tưới máu não và có khả năng gây giãn mạch.
Sử dụng nicardipin hoặc labetalol để giảm huyết áp. Người ta thấy trong 24 giờ đầu sau xuất huyết não cơ chế điều chỉnh còn nguyên vẹn [117]. các giao thức điều trị tương tự đã được sử dụng để nghiên cứu sự ảnh hưởng của thiếu máu cục bộ với cơ chế tự điều chỉnh.
Tăng huyết áp làm giảm số lượng các mao mạch trong não [119, 120]. Trong SHR việc giảm số lượng mao mạch phụ thuộc huyết áp;
Những tác động của tăng huyết áp trên động mạch màng mềm còn đang gây nhiều tranh cãi.
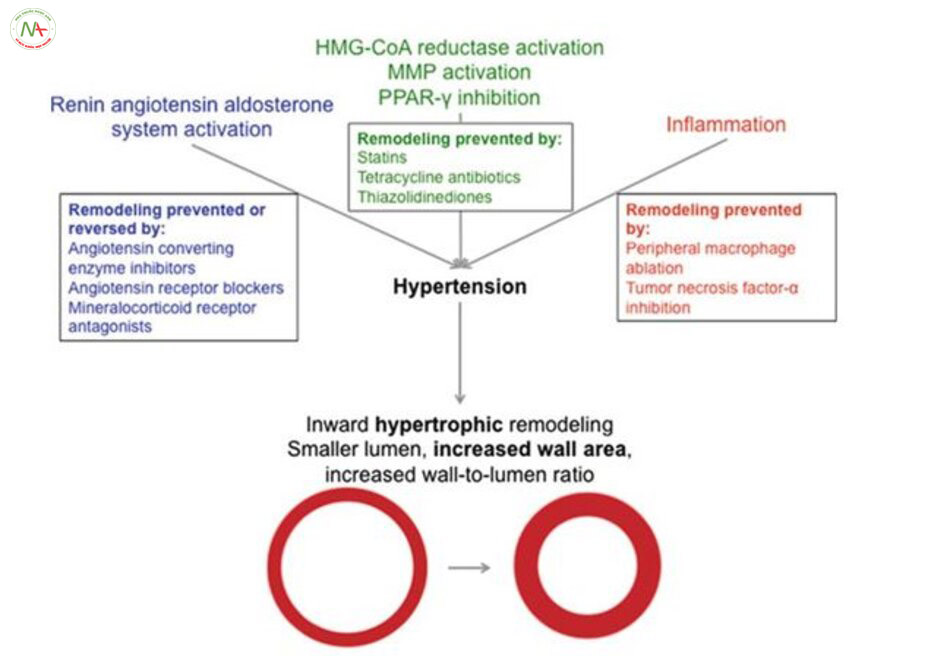
Thích nghi của động mạch não
Phục hồi động mạch là quá trình đường kính lòng mạch giảm xuống và đường kính bên ngoài tăng lên(Hình. 5.4)
Năm 1973 lần đầu tiên đưa ra giả thuyết rằng quá trình phục hồi động mạch là quá trình có hại, nhưng nó là quá trình thích ứng để bảo vệ mạch nhỏ của não với huyết áp cao, ngăn xuất huyết, phù giãn mạch [13, 136-138]. quá trình thích nghi bảo vệ này trở nên không tốt khi tăng huyết áp được duy trì và chức năng của động mạch não bị suy yếu. Ban đầu phục hồi động mạch bằng cách tăng kháng trở mạch máu [33, 139]. Tuy nhiên, với bệnh nhân cao tuổicos tăng huyết áp thì quá trình phục hồi trở thành có hại; bệnh nhân tăng huyết áp cao tuổi quá trình này làm giảm lưu lượng máu ở vỏ não trước trán và vùng chẩm, thái dương và vùng hải mã
Lão hóa là một yếu tố nguy cơ độc lập với bệnh mạch máu não tăng huyết áp, nhưng 70% dân số cao tuổi có tăng huyết áp [142. bản thân lão hóa gây ra quá trinh Tăng huyết ápy đổi động mạch và điều này có liên quan đến tiến triển của chứng mất trí [143, 144].
Quá trình Tăng huyết ápy đổi động mạch có liên quan tới sự tăng độ dày thành động mạch và giảm đường kính lòng mạch [131, 147].
Lão hóa có tác động đáng kể về cấu trúc động mạch ở SHRSP. các nghiên cứu cho thấy có sự gia tăng kháng trở mạch máu trong các động mạch nhỏ khi tăng huyết áp mạn tính [159].
Hệ Renin-Angiotensin-Aldosterone
Những loại thuốc ức chế hệ renin-angiotensin-aldosterone (RAAS) được sử dụng rộng rãi trên lâm sàng và trở thành tâm điểm của nhiều nghiên cứu về cấu trúc động mạch trong tăng huyết áp. Nghiên cứu so sánh hiệu quả của (ACEi) ức chế men chuyển, ARB và β-blockers dẫn đến việc khám phá ra hạ huyết áp không thôi thì không đủ để ngăn chặn những tác động của tăng huyết áp trên động mạch màng mềm. Tất cả các loại thuốc hạ huyết ức chế tác động của RAAS đồng thời ngăn tăng huyết áp trên động mạch màng mềm [163-166] phục hồi động mạch MCA [74, 167] trong SHR hoặc SHRSP. Việc thiếu tác dụng của β-blockers đang gây ngạc nhiên vì các thuốc này làm giảm hoạt động renin huyết tương và angiotensin II thứ phát [168]. các nghiên cứu cho thấy tưới máu não tăng khi đường kính lòng động mạch não tăng [166, 169, 170]. Điều thú vị là một nghiên cứu gần đây đã chỉ ra rằng phục hồi động mạch trong SHRSP có thể được cải thiện với điều trị hạ huyết áp mà không can thiệp trực tiếp vào hệ thống RAAS [66].
Không tác động vào hệ RAAS thấy sự phục hồi động mạch sau tăng huyết áp diễn ra khá nhanh ở chuột. Các tác giả đề xuất rằng ảnh hưởng của telmisartan (ARB) xảy ra thông qua một cơ chế phụ thuộc peroxisome proliferator kích hoạt thụ thể γ (PPARg). Candesartan cũng gây hạ huyết áp trong nghiên cứu này, nhưng không có ảnh hưởng đến cấu trúc động mạch [171]. Những tác động của PPARg trên quá trình phục hồi động mạch sẽ mô tả chi tiết hơn ở những phần sau. telmisartan không ảnh hưởng đến cấu trúc của động mạch não giữa [172]. Điều này nói lên ảnh hưởng khác nhau của ARB trên động mạch giữa não và động mạch màng mềm nhưng hiện này chưa giải thích được cơ chế
Một vai trò của angiotensin II trong phục hồi động mạch được hỗ trợ bởi các nghiên cứu trên chuột cho sản xuất angiotensinogen mà không cho sản xuất angiotensin II. Nghiên cứu này tập trung vào các động mạch nhánh Tăng huyết ápy thế và động mạch não giữa. Đường kính lòng mạch của các động mạch tăng. Những con chuột dùng angiotensinogen cũng có huyết áp thấp hơn và do đó có thể có cấu trúc động mạch bị ảnh hưởng [173]. Do đó, ACEi chỉ giúp ngăn tăng huyết áp mà không đảo ngược được quá trình phục hồi động mạch.
Aldosterone, kích hoạt các thụ thể mineralocorticoid và ảnh hưởng của nó trên động mạch não có thể bị ức chế với thuốc đối kháng thụ thể mineralocorticoid và Spironolactone cũng làm giảm tổn thương do thiếu máu cục bộ não [175]. Các nghiên cứu gần đây đã chỉ ra rằng các chất đối kháng thụ thể mineralocorticoid cải thiện cấu trúc của các tiểu động mạch xâm nhập ở chuột bị tăng huyết áp. Eplerenone tăng đường kính động mạch thâm nhập SHRSP [66]. kích hoạt thụ thể Mineralocorticoid cũng liên quan đến các rối loạn chức năng nội mô xảy ra ở động mạch não ở chuột có tăng huyết áp. Tác dụng này của aldosterone trên động mạch thân nền dường như là hậu quả gia tăng quá trình oxy hóa [176].
Angiotensin II và aldosteron làm tăng NADPH oxidase qua các phản ứng trung gian [177, 178]. Điều này làm tăng nồng độ superoxide và có thể điều khiển quá trình phục hồi động mạch não. Điều trị SHRSP với tempol, một superoxide giúp ngăn sự giảm đường kính lòng mạch MCA hay gặp trong SHRSP [179].
Thuốc kháng sinh tetracycline
Phục hồi động mạch cần có sự Tăng huyết ápm gia của matrix metalloproteinase (MMP). Quá trình phục hồi này cho phép các tế bào cơ trơn sắp xếp lại. Ức chế MMP với doxycycline làm giảm sự phát triển của tăng huyết áp liên quan phục hồi động mạch MCA. Doxycycline không có ảnh hưởng trên huyết áp nhưng lại giúp ngăn chặn tái tạo động mạch xảy ra. Điều quan trọng là những cải thiện trong cấu trúc động mạch có liên quan với việc giảm các tổn thương gây ra do thiếu máu cục bộ và cải thiện tưới máu động mạch màng mềm [158].
Kết quả cho thấy thuốc kháng sinh tetracycline có tác dụng có lợi sau đột quỵ cấp [181, 182]; những tác động này dường như không tự nhiên có trong mạch máu. Điều thú vị là tác động lên MMP được điều tiết bởi RAAS [174, 183], vì vậy điều này có thể là một cơ chế tiềm năng cho những tác động của các thuốc ức chế men chuyển, ARB và thuốc chẹn thụ thể mineralocorticoid.
Tác động nhanh của thụ thể γ Peroxisome và HMG-CoA reductase
Ức chế sản xuất NO dẫn đến tăng huyết áp và gây phục hồi các động mạch não lớn (hẹp lòng mạch và tăng đường kính ngoài). Rosiglitazone, một activator PPARg, đảo ngược quá trình phục hồi động mạch này mà không làm giảm huyết áp [184]. Nghiên cứu lớn ở New Zealand trên chuột tăng huyết áp thấy động mạch thân nền khi dùng pioglitazone, một activator PPARg, làm giảm độ dày thành mạch. Pioglitazone cũng làm hạ huyết áp [185].
HMG-CoA reductase (statin) cũng cải thiện cấu trúc động mạch thân nền ở chuột tăng huyết áp ở New Zealand bằng cách giảm độ dày thành và tăng đường kính lòng mạch[186]. Vai trò có lợi này vẫn chưa rõ ràng bởi vì liệu pháp statin gây ra giảm huyết áp đáng kể.
Quá trình viêm
Tăng huyết áp và bệnh tim mạch có liên quan với quá trình viêm [187-189], các tế bào T [189-191] và đại thực bào [192-194] có liên quan tổn thương mạch máu ngoại vi do tăng huyết áp. Các tác động của các tế bào T vào động mạch não ít được mô tả, nhưng đại thực bào là yếu tố quan trọng quyết định quá trình phục hồi MCA trong SHRSP. Giảm đại thực bào ngoại vi, trong khi huyết áp tăng nhanh, giảm số lượng đại thực bào mạch máu trong não còn 50%. Đường kính lòng mạch MCA đã tăng lên và độ dày động mạch đã giảm. suy giảm đại thực bào không ảnh hưởng đến trương lực cơ trơn nhưng cải thiện giãn mạch trung gian qua NO. Những Tăng huyết ápy đổi này xảy ra mà không làm giảm đáng kê huyết áp [195].
Các tác giả thấy khi có TĂNG HUYẾT ÁP tiến triển, việc các đại thực bào tích tụ quanh mạch trong não và góp phần vào quá trình tu sửa động mạch.
Các đại thực bào giải phóng cytokine như yếu tố hoại tử khối u (TNF) -α liên quan đến tổn thương thận do tăng huyết áp [196, 197]. Etanercept, một chất ức chế TNF-α, cải thiện cấu trúc MCA trong SHRSP. Chuột được điều trị 6-12 tuần bằng thuốc ức chế TNF-α đã làm tăng đáng kể lòng mạch và giảm độ dày thành động mạch, cải thiện tưới máu màng mềm [198].
Ảnh hưởng của thiếu máu cục bộ lên cấu trúc động mạch
Ngày càng trở nên rõ ràng rằng thiếu máu cục bộ cũng làm Tăng huyết ápy đổi cấu trúc của các động mạch não. Hiện chỉ có các nghiên cứu trong phòng thí nghiệm trên chuột, và tất cả các nghiên cứu dựa trên các mô hình liên quan đến thiếu máu cục bộ sau tái tưới máu.
Sau 24h tái tưới máu, độ dày thành mạch tăng lên để thích nghi với quá trình này [101]. Điều thú vị là, thiếu máu cục bộ sau 24 h tái tưới máu làm tăng độ cứng của MCA [199].
Quá trình oxy hóa xảy ra do tổn thường thiếu máu cục bộ / tưới máu lại có thể có một số tác động vào cấu trúc động mạch. CR-6 là một dẫn xuất của vitamin E và chất chống oxy hóa mạnh. CR-6 được dùng cho những con chuột sau khi thiếu máu cục bộ tại thời điểm tái tưới máu và điều này làm giảm diện tích tổn thương gây ra do thiếu máu cục bộ. Nó cũng làm giảm quá trình dày lên của thành động mạch sau thiếu máu cục bộ [104]. Các nghiên cứu gần đây đã xác nhận sử dụng chât một chất oxy hóa khác, acid uric [98]. Nghiên cứu này cũng nghiên cứu những tác động sau thiếu máu cục bộ trên cấu trúc động mạch. Như đã đề cập ở trên, 50% bệnh nhân đột quỵ có giãn mạch sau thiếu máu cục bộ[94, 95]. Acid uric giảm kích thước vùng nhồi máu não ở chuột có TĂNG HUYẾT ÁP. Nó không có tác dụng ở những con chuột bình thường có chảy máu sau đột quỵ. Các tác giả thấy quá trình tăng viêm gây giãn mạch vì có tăng bạch cầu đơn nhân và đại thực bào xâm nhập vào các động mạch não.
References
- Vander AJ, Sherman JH, Luciano DS. Human physiology: the mechanisms of body function. 5th ed. New York: McGraw-Hill; 1990.
- Hossmann KA. Pathophysiology and therapy of experimental stroke. Cell Mol Neurobiol. 2006;26(7–8):1057–83.
del Zoppo GJ, Hallenbeck JM. Advances in the vascular pathophysiology of ischemic stroke. Thromb Res. 2000;98(3):73–81. - Hirsch S, et al. Topology and hemodynamics of the cortical cerebrovascular system. J Cereb Blood Flow Metab. 2012;32(6):952–67.
- Coyle P. Dorsal cerebral collaterals of stroke-prone spontaneously hypertensive rats (SHRSP) and Wistar Kyoto rats (WKY). Anat Rec. 1987;218(1):40–4.
- Cipolla MJ. The cerebral circulation. San Rafael: Morgan & Claypool Life Sciences; 2009.
- Schaffer CB, et al. Two-photon imaging of cortical surface microvessels reveals a robust redistribution in blood flow after vascular occlusion. PLoS Biol. 2006;4(2), e22.
- Baran U, Li Y, Wang RK. Vasodynamics of pial and penetrating arterioles in relation to arteriolo-arteriolar anastomosis after focal stroke. Neurophotonics. 2015;2(2):025006.
- Hamel E. Perivascular nerves and the regulation of cerebrovascular tone. J Appl Physiol. 2006;100(3):1059–64.
- Edvinsson L, Krause DN. Cerebral blood flow and metabolism. Philadelphia: Lippincott, Williams & Wilkins; 2002.
- Ayata C, et al. L-NA-sensitive rCBF augmentation during vibrissal stimulation in type III nitric oxide synTăng huyết ápse mutant mice. J Cereb Blood Flow Metab. 1996;16(4):539–41.
- Nishimura N, et al. Penetrating arterioles are a bottleneck in the perfusion of neocortex. Proc Natl Acad Sci U S A. 2007;104(1):365–70.
- Iadecola C, Davisson RL. Hypertension and cerebrovascular dysfunction. Cell Metab. 2008;7(6):476–84.
- Cohen Z, Molinatti G, Hamel E. Astroglial and vascular interactions of noradrenaline termi- nals in the rat cerebral cortex. J Cereb Blood Flow Metab. 1997;17(8):894–904.
- Filosa JA, et al. Beyond neurovascular coupling, role of astrocytes in the regulation of vascu- lar tone. Neuroscience. 2015. doi:10.1016/j.neuroscience.2015.03.064.
- Gobel U, Theilen H, Kuschinsky W. Congruence of total and perfused capillary network in rat brains. Circ Res. 1990;66(2):271–81.
- Shih AY, et al. Robust and fragile aspects of cortical blood flow in relation to the underlying angioarchitecture. Microcirculation. 2015;22:204–18.
- Sa-Pereira I, Brites D, Brito MA. Neurovascular unit: a focus on pericytes. Mol Neurobiol. 2012;45(2):327–47.
- Hill RA, et al. Regional blood flow in the normal and ischemic brain is controlled by arteriolar smooth muscle cell contractility and not by capillary pericytes. Neuron. 2015;87(1):95–110.
- Dalkara T, Gursoy-Ozdemir Y, Yemisci M. Brain microvascular pericytes in health and dis- ease. Acta Neuropathol. 2011;122(1):1–9.
- Shepro D, Morel NM. Pericyte physiology. FASEB J. 1993;7(11):1031–8.
- Dirnagl U. Pathobiology of injury after stroke: the neurovascular unit and beyond. Ann N Y Acad Sci. 2012;1268:21–5.
- Hawkins BT, Davis TP. The blood-brain barrier/neurovascular unit in health and disease. Pharmacol Rev. 2005;57(2):173–85.
- Koehler RC, Gebremedhin D, Harder DR. Role of astrocytes in cerebrovascular regulation. J Appl Physiol (1985). 2006;100(1):307–17.
- Dunn KM, Nelson MT. Neurovascular signaling in the brain and the pathological conse- quences of hypertension. Am J Physiol Heart Circ Physiol. 2014;306(1):H1–14.
- Bloch S, Obari D, Girouard H. Angiotensin and neurovascular coupling: beyond hyperten- sion. Microcirculation. 2015;22(3):159–67.
- Iliff JJ, et al. Epoxyeicosanoids as mediators of neurogenic vasodilation in cerebral vessels. Am J Physiol Heart Circ Physiol. 2009;296(5):H1352–63.
- Harder DR, et al. Functional hyperemia in the brain: hypothesis for astrocyte-derived vasodi- lator metabolites. Stroke. 1998;29(1):229–34.
- Dirnagl U, et al. Coupling of cerebral blood flow to neuronal activation: role of adenosine and nitric oxide. Am J Physiol. 1994;267(1 Pt 2):H296–301.
- Lindauer U, et al. Nitric oxide: a modulator, but not a mediator, of neurovascular coupling in rat somatosensory cortex. Am J Physiol. 1999;277(2 Pt 2):H799–811.
- Niwa K, et al. Cyclooxygenase-2 contributes to functional hyperemia in whisker-barrel cor- tex. J Neurosci. 2000;20(2):763–70.
- Roman RJ. P-450 metabolites of arachidonic acid in the control of cardiovascular function. Physiol Rev. 2002;82(1):131–85.
- Jennings JR, et al. Reduced cerebral blood flow response and compensation among patients with untreated hypertension. Neurology. 2005;64(8):1358–65.
- Kazama K, et al. Angiotensin II attenuates functional hyperemia in the mouse somatosensory cortex. Am J Physiol Heart Circ Physiol. 2003;285(5):H1890–9.
- Capone C, et al. The cerebrovascular dysfunction induced by slow pressor doses of angioten- sin II precedes the development of hypertension. Am J Physiol Heart Circ Physiol. 2011;300(1):H397–407.
- Kazama K, et al. Angiotensin II impairs neurovascular coupling in neocortex through NADPH oxidase-derived radicals. Circ Res. 2004;95(10):1019–26.
- Calcinaghi N, et al. Multimodal imaging in rats reveals impaired neurovascular coupling in sustained hypertension. Stroke. 2013;44(7):1957–64.
- Inao S, et al. Neural activation of the brain with hemodynamic insufficiency. J Cereb Blood Flow Metab. 1998;18(9):960–7.
- Yamauchi H, et al. Altered patterns of blood flow response during visual stimulation in carotid artery occlusive disease. Neuroimage. 2005;25(2):554–60.
- Ginsberg MD, et al. Acute thrombotic infarction suppresses metabolic activation of ipsilat- eral somatosensory cortex: evidence for functional diaschisis. J Cereb Blood Flow Metab. 1989;9(3):329–41.
- Kunz A, et al. Neurovascular protection by ischemic tolerance: role of nitric oxide and reac- tive oxygen species. J Neurosci. 2007;27(27):7083–93.
- Ueki M, Linn F, Hossmann KA. Functional activation of cerebral blood flow and metabolism before and after global ischemia of rat brain. J Cereb Blood Flow Metab. 1988;8(4):486–94.
- Baker WB, et al. Neurovascular coupling varies with level of global cerebral ischemia in a rat model. J Cereb Blood Flow Metab. 2013;33(1):97–105.
- Shen Q, et al. Functional, perfusion and diffusion MRI of acute focal ischemic brain injury. J Cereb Blood Flow Metab. 2005;25(10):1265–79.
- Geary GG, Krause DN, Duckles SP. Estrogen reduces mouse cerebral artery tone through endothelial NOS- and cyclooxygenase-dependent mechanisms. Am J Physiol Heart Circ Physiol. 2000;279(2):H511–9.
- Cipolla MJ, Porter JM, Osol G. High glucose concentrations dilate cerebral arteries and diminish myogenic tone through an endothelial mechanism. Stroke. 1997;28(2):405–10; dis- cussion 410–1.
- Faraci FM, Brian Jr JE. Nitric oxide and the cerebral circulation. Stroke. 1994;25(3):692–703.
- Malomvolgyi B, et al. Relaxation by prostacyclin (PGI2) and 7-oxo-PGI2 of isolated cere- bral, coronary and mesenteric arteries. Acta Physiol Acad Sci Hung. 1982;60(4):251–6.
- Gonzales RJ, Krause DN, Duckles SP. Testosterone suppresses endothelium-dependent dila- tion of rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 2004;286(2):H552–60.
- Faraci FM, Baumbach GL, Heistad DD. Myogenic mechanisms in the cerebral circulation. J Hypertens Suppl. 1989;7(4):S61–4; discussion S65.
- Paulson OB, Strandgaard S, Edvinsson L. Cerebral autoregulation. Cerebrovasc Brain Metab Rev. 1990;2(2):161–92.
- Osol G, et al. Myogenic tone, reactivity, and forced dilatation: a three-phase model of in vitro arterial myogenic behavior. Am J Physiol Heart Circ Physiol. 2002;283(6):H2260–7.
- Bayliss WM. On the local reactions of the arterial wall to changes of internal pressure. J Physiol. 1902;28(3):220–31.
- Talman WT, Nitschke Dragon D. Neuronal nitric oxide mediates cerebral vasodilatation dur- ing acute hypertension. Brain Res. 2007;1139:126–32.
- Duchemin S, et al. The complex contribution of NOS interneurons in the physiology of cere- brovascular regulation. Front Neural Circuits. 2012;6:51.
- Jones SC, et al. Cortical NOS inhibition raises the lower limit of cerebral blood flow-arterial pressure autoregulation. Am J Physiol. 1999;276(4 Pt 2):H1253–62.
- Koller A, Toth P. Contribution of flow-dependent vasomotor mechanisms to the autoregula- tion of cerebral blood flow. J Vasc Res. 2012;49(5):375–89.
- Hamner JW, et al. Sympathetic control of the cerebral vasculature in humans. Stroke. 2010;41(1):102–9.
- Hamner JW, et al. Cholinergic control of the cerebral vasculature in humans. J Physiol. 2012;590(Pt 24):6343–52.
- Osol G, Halpern W. Myogenic properties of cerebral blood vessels from normotensive and hypertensive rats. Am J Physiol. 1985;249(5 Pt 2):H914–21.
- Barry DI. Cerebral blood flow in hypertension. J Cardiovasc Pharmacol. 1985;7(2):S94–8.
- Jarajapu YP, Knot HJ. Relative contribution of Rho kinase and protein kinase C to myogenic tone in rat cerebral arteries in hypertension. Am J Physiol Heart Circ Physiol. 2005;289(5):H1917–22.
- Ibrahim J, et al. Sex-specific differences in cerebral arterial myogenic tone in hypertensive and normotensive rats. Am J Physiol Heart Circ Physiol. 2006;290(3):H1081–9.
- Yamori Y, et al. Pathogenetic similarity of strokes in stroke-prone spontaneously hyperten- sive rats and humans. Stroke. 1976;7(1):46–53.
- Yamori Y, et al. Cerebral stroke and myocardial lesions in stroke-prone SHR. Jpn Heart J. 1978;19(4):609–11.
- Pires PW, Jackson WF, Dorrance AM. Regulation of myogenic tone and structure of paren- chymal arterioles by hypertension and the mineralocorticoid receptor. Am J Physiol Heart Circ Physiol. 2015;309(1):H127–36.
- Izzard AS, et al. Myogenic and structural properties of cerebral arteries from the stroke-prone spontaneously hypertensive rat. Am J Physiol Heart Circ Physiol. 2003;285(4):H1489–94.
- Smeda JS, VanVliet BN, King SR. Stroke-prone spontaneously hypertensive rats lose their ability to auto-regulate cerebral blood flow prior to stroke. J Hypertens. 1999;17(12 Pt 1):1697–705.
- Ishizuka T, et al. Involvement of thromboxane A2 receptor in the cerebrovascular damage of salt-loaded, stroke-prone rats. J Hypertens. 2007;25(4):861–70.
- Griffin KA, et al. Differential salt-sensitivity in the pathogenesis of renal damage in SHR and stroke prone SHR. Am J Hypertens. 2001;14(4 Pt 1):311–20.
- Toth P, et al. Age-related autoregulatory dysfunction and cerebromicrovascular injury in mice with angiotensin II-induced hypertension. J Cereb Blood Flow Metab. 2013;33(11):1732–42.
- Toth P, et al. Role of 20-HETE, TRPC channels, and BKCa in dysregulation of pressure- induced Ca2+ signaling and myogenic constriction of cerebral arteries in aged hypertensive mice. Am J Physiol Heart Circ Physiol. 2013;305(12):H1698–708.
- Welsh DG, et al. Transient receptor potential channels regulate myogenic tone of resistance arteries. Circ Res. 2002;90(3):248–50.
- Yamakawa H, et al. Normalization of endothelial and inducible nitric oxide synTăng huyết ápse expres- sion in brain microvessels of spontaneously hypertensive rats by angiotensin II AT1 receptor inhibition. J Cereb Blood Flow Metab. 2003;23(3):371–80.
- Touyz RM, Briones AM. Reactive oxygen species and vascular biology: implications in human hypertension. Hypertens Res. 2011;34(1):5–14.
- Paravicini TM, Sobey CG. Cerebral vascular effects of reactive oxygen species: recent evi- dence for a role of NADPH-oxidase. Clin Exp Pharmacol Physiol. 2003;30(11):855–9.
- Bryan Jr RM, et al. Endothelium-derived hyperpolarizing factor: a cousin to nitric oxide and prostacyclin. Anesthesiology. 2005;102(6):1261–77.
- Stankevicius E, et al. Opening of small and intermediate calcium-activated potassium chan- nels induces relaxation mainly mediated by nitric-oxide release in large arteries and endothelium-derived hyperpolarizing factor in small arteries from rat. J Pharmacol Exp Ther. 2011;339(3):842–50.
- Marrelli SP, Eckmann MS, Hunte MS. Role of endothelial intermediate conductance KCa channels in cerebral EDHF-mediated dilations. Am J Physiol Heart Circ Physiol. 2003;285(4):H1590–9.
- Si H, et al. Impaired endothelium-derived hyperpolarizing factor-mediated dilations and increased blood pressure in mice deficient of the intermediate-conductance Ca2+-activated K+ channel. Circ Res. 2006;99(5):537–44.
- Earley S, Brayden JE. Transient receptor potential channels and vascular function. Clin Sci (Lond). 2010;119(1):19–36.
Venkatachalam K, Montell C. TRP channels. Annu Rev Biochem. 2007;76:387–417. - Reading SA, et al. TRPC3 mediates pyrimidine receptor-induced depolarization of cerebral arteries. Am J Physiol Heart Circ Physiol. 2005;288(5):H2055–61.
- Noorani MM, Noel RC, Marrelli SP. Upregulated TRPC3 and downregulated TRPC1 chan- nel expression during hypertension is associated with increased vascular contractility in Rat. Front Physiol. 2011;2:42.
- Earley S, et al. TRPV4 forms a novel Ca2+ signaling complex with ryanodine receptors and BKCa channels. Circ Res. 2005;97(12):1270–9.
- Earley S. Endothelium-dependent cerebral artery dilation mediated by transient receptor potential and Ca2+-activated K+ channels. J Cardiovasc Pharmacol. 2011; 57(2):148–53.
- Dunn KM, et al. Elevated production of 20-HETE in the cerebral vasculature contributes to severity of ischemic stroke and oxidative stress in spontaneously hypertensive rats. Am J Physiol Heart Circ Physiol. 2008;295(6):H2455–65.
- Dorrance AM, et al. An epoxide hydrolase inhibitor, 12-(3-adamantan-1-yl-ureido)dodeca- noic acid (AUDA), reduces ischemic cerebral infarct size in stroke-prone spontaneously hypertensive rats. J Cardiovasc Pharmacol. 2005;46(6):842–8.
- Simpkins AN, et al. Soluble epoxide inhibition is protective against cerebral ischemia via vascular and neural protection. Am J Pathol. 2009;174(6):2086–95.
- Palomares SM, Cipolla MJ. Vascular protection following cerebral ischemia and reperfusion. J Neurol Neurophysiol. 2011;2011:S1-004.
- Gourley JK, Heistad DD. Characteristics of reactive hyperemia in the cerebral circulation. Am J Physiol. 1984;246(1 Pt 2):H52–8.
- Sundt Jr TM, Waltz AG. Cerebral ischemia and reactive hyperemia. Studies of cortical blood flow and microcirculation before, during, and after temporary occlusion of middle cerebral artery of squirrel monkeys. Circ Res. 1971;28(4):426–33.
- Hayakawa T, Waltz AG, Hansen T. Relationships among intracranial pressure, blood pres- sure, and superficial cerebral vasculature after experimental occlusion of one middle cerebral artery. Stroke. 1977;8(4):426–32.
- Skinhoj E, et al. Regional cerebral blood flow and its autoregulation in patients with transient focal cerebral ischemic attacks. Neurology. 1970;20(5):485–93.
- Olsen TS, et al. Focal cerebral hyperemia in acute stroke. Incidence, pathophysiology and clinical significance. Stroke. 1981;12(5):598–607.
- Macfarlane R, et al. The role of neuroeffector mechanisms in cerebral hyperperfusion syn- dromes. J Neurosurg. 1991;75(6):845–55.
- Perez-Asensio FJ, et al. Antioxidant CR-6 protects against reperfusion injury after a transient episode of focal brain ischemia in rats. J Cereb Blood Flow Metab. 2010;30(3):638–52.
- Onetti Y, et al. Middle cerebral artery remodeling following transient brain ischemia is linked to early postischemic hyperemia: a target of uric acid treatment. Am J Physiol Heart Circ Physiol. 2015;308(8):H862–74.
- Coyle P, Heistad DD. Blood flow through cerebral collateral vessels in hypertensive and normotensive rats. Hypertension. 1986;8(6 Pt 2):II67–71.
- Coyle P, Jokelainen PT. Differential outcome to middle cerebral artery occlusion in spontane- ously hypertensive stroke-prone rats (SHRSP) and Wistar Kyoto (WKY) rats. Stroke. 1983;14(4):605–11.
- Cipolla MJ, et al. Reperfusion decreases myogenic reactivity and alters middle cerebral artery function after focal cerebral ischemia in rats. Stroke. 1997;28(1):176–80.
- Cipolla MJ, et al. Threshold duration of ischemia for myogenic tone in middle cerebral arter- ies: effect on vascular smooth muscle actin. Stroke. 2001;32(7):1658–64.
- Cipolla MJ, Curry AB. Middle cerebral artery function after stroke: the threshold duration of reperfusion for myogenic activity. Stroke. 2002;33(8):2094–9.
- Jimenez-Altayo F, et al. Participation of oxidative stress on rat middle cerebral artery changes induced by focal cerebral ischemia: beneficial effects of 3,4-dihydro-6-hydroxy- 7-methoxy-2,2-dimethyl-1(2H)-benzopyran (CR-6). J Pharmacol Exp Ther. 2009; 331(2):429–36.
- Coucha M, et al. Protein nitration impairs the myogenic tone of rat middle cerebral arteries in both ischemic and nonischemic hemispheres after ischemic stroke. Am J Physiol Heart Circ Physiol. 2013;305(12):H1726–35.
- Jimenez-Altayo F, et al. Transient middle cerebral artery occlusion causes different struc- tural, mechanical, and myogenic alterations in normotensive and hypertensive rats. Am J Physiol Heart Circ Physiol. 2007;293(1):H628–35.
- Marrelli SP, et al. P2 purinoceptor-mediated dilations in the rat middle cerebral artery after ischemia-reperfusion. Am J Physiol. 1999;276(1 Pt 2):H33–41.
- Cipolla MJ, et al. SKCa and IKCa Channels, myogenic tone, and vasodilator responses in middle cerebral arteries and parenchymal arterioles: effect of ischemia and reperfusion. Stroke. 2009;40(4):1451–7.
- Cipolla MJ, Bullinger LV. Reactivity of brain parenchymal arterioles after ischemia and reperfusion. Microcirculation. 2008;15(6):495–501.
- Cipolla MJ, Li R, Vitullo L. Perivascular innervation of penetrating brain parenchymal arte- rioles. J Cardiovasc Pharmacol. 2004;44(1):1–8.
- Dabertrand F, Nelson MT, Brayden JE. Acidosis dilates brain parenchymal arterioles by con- version of calcium waves to sparks to activate BK channels. Circ Res. 2012;110(2):285–94.
- Nishimura N, et al. Limitations of collateral flow after occlusion of a single cortical penetrat- ing arteriole. J Cereb Blood Flow Metab. 2010;30(12):1914–27.
- Shih AY, et al. The smallest stroke: occlusion of one penetrating vessel leads to infarction and a cognitive deficit. Nat Neurosci. 2013;16(1):55–63.
- Marrelli SP. Altered endothelial Ca2+ regulation after ischemia/reperfusion produces potenti- ated endothelium-derived hyperpolarizing factor-mediated dilations. Stroke. 2002;33(9):2285–91.
- Marrelli SP, et al. PLA2 and TRPV4 channels regulate endothelial calcium in cerebral arter- ies. Am J Physiol Heart Circ Physiol. 2007;292(3):H1390–7.
- Cipolla MJ, et al. Mechanisms of enhanced basal tone of brain parenchymal arterioles during early postischemic reperfusion: role of ET-1-induced peroxynitrite generation. J Cereb Blood Flow Metab. 2013;33(10):1486–92.
- Powers WJ, et al. Autoregulation of cerebral blood flow surrounding acute (6 to 22 hours) intracerebral hemorrhage. Neurology. 2001;57(1):18–24.
- Powers WJ, et al. Autoregulation after ischaemic stroke. J Hypertens. 2009;27(11): 2218–22.
- Sokolova IA, et al. Rarefication of the arterioles and capillary network in the brain of rats with different forms of hypertension. Microvasc Res. 1985;30(1):1–9.
- Suzuki K, et al. Pathologic evidence of microvascular rarefaction in the brain of renal hyper- tensive rats. J Stroke Cerebrovasc Dis. 2003;12(1):8–16.
- Paiardi S, et al. Immunohistochemical evaluation of microvascular rarefaction in hyperten- sive humans and in spontaneously hypertensive rats. Clin Hemorheol Microcirc. 2009;42(4):259–68.
- Coyle P, Heistad DD. Blood flow through cerebral collateral vessels one month after middle cerebral artery occlusion. Stroke. 1987;18(2):407–11.
- Harper SL, Bohlen HG. Microvascular adaptation in the cerebral cortex of adult spontane- ously hypertensive rats. Hypertension. 1984;6(3):408–19.
- Werber AH, et al. No rarefaction of cerebral arterioles in hypertensive rats. Can J Physiol Pharmacol. 1990;68(4):476–9.
- Noon JP, et al. Impaired microvascular dilatation and capillary rarefaction in young adults with a predisposition to high blood pressure. J Clin Invest. 1997;99(8):1873–9.
- Serne EH, et al. Impaired skin capillary recruitment in essential hypertension is caused by both functional and structural capillary rarefaction. Hypertension. 2001;38(2):238–42.
- Serne EH, et al. Capillary recruitment is impaired in essential hypertension and relates to insulin’s metabolic and vascular actions. Cardiovasc Res. 2001;49(1):161–8.
- Nazzaro P, et al. Effect of clustering of metabolic syndrome factors on capillary and cerebro- vascular impairment. Eur J Intern Med. 2013;24(2):183–8.
- Mulvany MJ, et al. Vascular remodeling. Hypertension. 1996;28(3):505–6.
- Baumbach GL, Chillon JM. Effects of angiotensin-converting enzyme inhibitors on cerebral vascular structure in chronic hypertension. J Hypertens Suppl. 2000;18(1):S7–11.
- Heagerty AM, et al. Small artery structure in hypertension. Dual processes of remodeling and growth. Hypertension. 1993;21(4):391–7.
- Heistad DD, et al. Impaired dilatation of cerebral arterioles in chronic hypertension. Blood Vessels. 1990;27(2-5):258–62.
- Mulvany MJ. Small artery remodelling in hypertension. Basic Clin Pharmacol Toxicol. 2012;110(1):49–55.
- Pires PW, et al. The effects of hypertension on the cerebral circulation. Am J Physiol Heart Circ Physiol. 2013;304(12):H1598–614.
- Folkow B, et al. Importance of adaptive changes in vascular design for establishment of pri- mary hypertension, studied in man and in spontaneously hypertensive rats. Circ Res. 1973;32(1):2–16.
- Hayashi K, Naiki T. Adaptation and remodeling of vascular wall; biomechanical response to hypertension. J Mech Behav Biomed Mater. 2009;2(1):3–19.
- Baumbach GL, Heistad DD. Cerebral circulation in chronic arterial hypertension. Hypertension. 1988;12(2):89–95.
- Laurent S, Boutouyrie P, Lacolley P. Structural and genetic bases of arterial stiffness. Hypertension. 2005;45(6):1050–5.
- Kety SS, Hafkenschiel JH, et al. The blood flow, vascular resistance, and oxygen consump- tion of the brain in essential hypertension. J Clin Invest. 1948;27(4):511–4.
- Beason-Held LL, et al. Longitudinal changes in cerebral blood flow in the older hypertensive brain. Stroke. 2007;38(6):1766–73.
- Muller M, et al. Hypertension and longitudinal changes in cerebral blood flow: the SMART-MR study. Ann Neurol. 2012;71(6):825–33.
- Go AS, et al. Heart disease and stroke statistics–2014 update: a report from the American Heart Association. Circulation. 2014;129(3):e28–292.
- Tomonaga M, et al. Clinicopathologic study of progressive subcortical vascular encephalopa- thy (Binswanger type) in the elderly. J Am Geriatr Soc. 1982;30(8):524–9.
- Furuta A, et al. Medullary arteries in aging and dementia. Stroke. 1991;22(4):442–6.
- Izzard AS, et al. Small artery structure and hypertension: adaptive changes and target organ damage. J Hypertens. 2005;23(2):247–50.
- De Ciuceis C, et al. Structural alterations of subcutaneous small-resistance arteries may pre- dict major cardiovascular events in patients with hypertension. Am J Hypertens. 2007;20(8):846–52.
- Mulvany MJ. Small artery remodeling and significance in the development of hypertension. News Physiol Sci. 2002;17:105–9.
- Dorrance AM, et al. A high-potassium diet reduces infarct size and improves vascular struc- ture in hypertensive rats. Am J Physiol Regul Integr Comp Physiol. 2007;292(1):R415–22.
- Rigsby CS, Pollock DM, Dorrance AM. Spironolactone improves structure and increases tone in the cerebral vasculature of male spontaneously hypertensive stroke-prone rats. Microvasc Res. 2007;73(3):198–205.
- Baumbach GL, Heistad DD. Remodeling of cerebral arterioles in chronic hypertension. Hypertension. 1989;13(6 Pt 2):968–72.
- Deutsch C, et al. Diet-induced obesity causes cerebral vessel remodeling and increases the damage caused by ischemic stroke. Microvasc Res. 2009;78(1):100–6.
- Osmond JM, et al. Obesity increases blood pressure, cerebral vascular remodeling, and sever- ity of stroke in the Zucker rat. Hypertension. 2009;53(2):381–6.
Dorrance AM, Rupp NC, Nogueira EF. Mineralocorticoid receptor activation causes cerebral vessel remodeling and exacerbates the damage caused by cerebral ischemia. Hypertension. 2006;47(3):590–5. - Osmond JM, Dorrance AM. 11Beta-hydroxysteroid dehydrogenase type II inhibition causes cerebrovascular remodeling and increases infarct size after cerebral ischemia. Endocrinology. 2009;150(2):713–9.
- Moreau P, et al. Structure and function of the rat basilar artery during chronic nitric oxide synTăng huyết ápse inhibition. Stroke. 1995;26(10):1922–8; discussion 1928–9.
- Davidson AO, et al. Blood pressure in genetically hypertensive rats. Influence of the Y chro- mosome. Hypertension. 1995;26(3):452–9.
- Baumbach GL, et al. Mechanics of cerebral arterioles in hypertensive rats. Circ Res. 1988;62(1):56–64.
- Pires PW, et al. Doxycycline, a matrix metalloprotease inhibitor, reduces vascular remodeling and damage after cerebral ischemia in stroke-prone spontaneously hypertensive rats. Am J Physiol Heart Circ Physiol. 2011;301(1):H87–97.
- Bohlen HG. The microcirculation in hypertension. J Hypertens Suppl. 1989;7(4):S117–24.
- Chan SL, Sweet JG, Cipolla MJ. Treatment for cerebral small vessel disease: effect of relaxin on the function and structure of cerebral parenchymal arterioles during hypertension. FASEB J. 2013;27(10):3917–27.
- Arribas SM, et al. Functional reduction and associated cellular rearrangement in SHRSP rat basilar arteries are affected by salt load and calcium antagonist treatment. J Cereb Blood Flow Metab. 1999;19(5):517–27.
- Arribas SM, et al. Confocal microscopic characterization of a lesion in a cerebral vessel of the stroke-prone spontaneously hypertensive rat. Stroke. 1996;27(6):1118–22; discussion 1122–3.
- Hajdu MA, Heistad DD, Baumbach GL. Effects of antihypertensive therapy on mechanics of cerebral arterioles in rats. Hypertension. 1991;17(3):308–16.
- Chillon JM, Baumbach GL. Effects of an angiotensin-converting enzyme inhibitor and a beta-blocker on cerebral arterioles in rats. Hypertension. 1999;33(3):856–61.
- Clozel JP, Kuhn H, Hefti F. Effects of cilazapril on the cerebral circulation in spontaneously hypertensive rats. Hypertension. 1989;14(6):645–51.
- Dupuis F, et al. Comparative effects of the angiotensin II receptor blocker, telmisartan, and the angiotensin-converting enzyme inhibitor, ramipril, on cerebrovascular structure in spon- taneously hypertensive rats. J Hypertens. 2005;23(5):1061–6.
- Kumai Y, et al. Protective effects of angiotensin II type 1 receptor blocker on cerebral circula- tion independent of blood pressure. Exp Neurol. 2008;210(2):441–8.
- Blumenfeld JD, et al. Beta-adrenergic receptor blockade as a therapeutic approach for sup- pressing the renin-angiotensin-aldosterone system in normotensive and hypertensive sub- jects. Am J Hypertens. 1999;12(5):451–9.
- Dupuis F, et al. Effects of suboptimal doses of the AT1 receptor blocker, telmisartan, with the angiotensin-converting enzyme inhibitor, ramipril, on cerebral arterioles in spontaneously hypertensive rat. J Hypertens. 2010;28(7):1566–73.
- Dupuis F, et al. Captopril improves cerebrovascular structure and function in old hyperten- sive rats. Br J Pharmacol. 2005;144(3):349–56.
- Foulquier S, et al. Differential effects of short-term treatment with two AT1 receptor blockers on diameter of pial arterioles in SHR. PLoS One. 2012;7(9), e42469.
- Foulquier S, Lartaud I, Dupuis F. Impact of short-term treatment with Telmisartan on cerebral arterial remodeling in SHR. PLoS One. 2014;9(10), e110766.
- Maeda K, et al. Larger anastomoses in angiotensinogen-knockout mice attenuate early meta- bolic disturbances after middle cerebral artery occlusion. J Cereb Blood Flow Metab. 1999;19(10):1092–8.
- Rigsby CS, et al. Effects of spironolactone on cerebral vessel structure in rats with sustained hypertension. Am J Hypertens. 2011;24(6):708–15.
- Dorrance AM, et al. Spironolactone reduces cerebral infarct size and EGF-receptor mRNA in stroke-prone rats. Am J Physiol
- Regul Integr Comp Physiol. 2001;281(3):R944–50.
- Chrissobolis S, et al. Chronic aldosterone administration causes Nox2-mediated increases in reactive oxygen species production and endothelial dysfunction in the cerebral circulation. J Hypertens. 2014;32(9):1815–21.
- Touyz RM, Tabet F, Schiffrin EL. Redox-dependent signalling by angiotensin II and vascular remodelling in hypertension. Clin Exp Pharmacol Physiol. 2003;30(11):860–6.
- Queisser N, Fazeli G, Schupp N. Superoxide anion and hydrogen peroxide-induced signal- ing and damage in angiotensin II and aldosterone action. Biol Chem. 2010; 391(11):1265–79.
- Pires PW, et al. Tempol, a superoxide dismutase mimetic, prevents cerebral vessel remodel- ing in hypertensive rats. Microvasc Res. 2010;80(3):445–52.
- Galis ZS, Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis: the good, the bad, and the ugly. Circ Res. 2002;90(3):251–62.
- Switzer JA, et al. Minocycline prevents IL-6 increase after acute ischemic stroke. Transl Stroke Res. 2012;3(3):363–8.
- Switzer JA, et al. Matrix metalloproteinase-9 in an exploratory trial of intravenous minocy- cline for acute ischemic stroke. Stroke. 2011;42(9):2633–5.
- Patel VB, et al. Angiotensin-converting enzyme 2 is a critical determinant of angiotensin II-induced loss of vascular smooth muscle cells and adverse vascular remodeling. Hypertension. 2014;64(1):157–64.
- Cipolla MJ, et al. PPAR{gamma} activation prevents hypertensive remodeling of cerebral arteries and improves vascular function in female rats. Stroke. 2010;41(6):1266–70.
- Ledingham JM, Laverty R. Effects of glitazones on blood pressure and vascular structure in mesenteric resistance arteries and basilar artery from genetically hypertensive rats. Clin Exp Pharmacol Physiol. 2005;32(11):919–25.
- Ledingham JM, Laverty R. Effect of simvastatin given alone and in combination with valsar- tan or enalapril on blood pressure and the structure of mesenteric resistance arteries and the basilar artery in the genetically hypertensive rat model. Clin Exp Pharmacol Physiol. 2005;32(1-2):76–85.
- Schiffrin EL. Immune mechanisms in hypertension and vascular injury. Clin Sci (Lond). 2014;126(4):267–74.
- Crowley SD. The cooperative roles of inflammation and oxidative stress in the pathogenesis of hypertension. Antioxid Redox Signal. 2014;20(1):102–20.
- Schiffrin EL. The immune system: role in hypertension. Can J Cardiol. 2013;29(5):543–8.
- Kassan M, et al. CD4+CD25+Foxp3 regulatory T cells and vascular dysfunction in hyperten- sion. J Hypertens. 2013;31(10):1939–43.
- Schiffrin EL. Immune modulation of resistance artery remodelling. Basic Clin Pharmacol Toxicol. 2012;110(1):70–2.
- Knorr M, Munzel T, Wenzel P. Interplay of NK cells and monocytes in vascular inflammation and myocardial infarction. Front Physiol. 2014;5:295.
- Shen JZ, Young MJ. Corticosteroids, heart failure, and hypertension: a role for immune cells? Endocrinology. 2012;153(12):5692–700.
- Luft FC, Dechend R, Muller DN. Immune mechanisms in angiotensin II-induced target- organ damage. Ann Med. 2012;44(1):S49–54.
- Pires PW, et al. Improvement in middle cerebral artery structure and endothelial function in stroke-prone spontaneously hypertensive rats after macrophage depletion. Microcirculation. 2013;20(7):650–61.
- Elmarakby AA, et al. Tumor necrosis factor alpha blockade increases renal Cyp2c23 expres- sion and slows the progression of renal damage in salt-sensitive hypertension. Hypertension. 2006;47(3):557–62.
- Elmarakby AA, et al. TNF-alpha inhibition reduces renal injury in DOCA-salt hypertensive rats. Am J Physiol Regul Integr Comp Physiol. 2008;294(1):R76–83.
- Pires PW, et al. Tumor necrosis factor-alpha inhibition attenuates middle cerebral artery remodeling but increases cerebral ischemic damage in hypertensive rats. Am J Physiol Heart Circ Physiol. 2014;307(5):H658–69.
- Coulson RJ, et al. Effects of ischemia and myogenic activity on active and passive mechani- cal properties of rat cerebral arteries. Am J Physiol Heart Circ Physiol. 2002;283(6):