Bệnh tim mạch
Viêm cơ tim: Dịch tễ, nguyên nhân, cơ chế bệnh sinh, điều trị
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Viêm cơ tim: Dịch tễ, nguyên nhân, cơ chế bệnh sinh, điều trị – tải file PDF tại đây.
Biên dịch: Bs.Hoàng Nam
Cristina Basso, M.D., Ph.D.
THEO TỔ CHỨC Y TẾ THẾ GIỚI NĂM 1995 VỀ bệnh cơ tim, viêm cơtim là một bệnh viêm của cơ tim được chẩn đoán dựa vào tiêu chuẩn mô học, miễn dịch và hóa mô miễn dịch đã được thiết lập. Kể từ khi công bố tiêu chuẩn Dallas, sinh thiết nội tâm mạc được xem như phương pháp tiêu chuẩn để chẩn đoán. Tuy nhiên qua 2 thập kỷ, các bước chẩn đoán đã thay đổi nhờ các công cụ mới, chủ yếu là troponin có độ nhạy cao và chụp cộng hưởng từ tim (MRI); trong thực hành lâm sàng thường quy, kết hợp triệu chứng cơ năng và triệu chứng thực thể, các cận lâm sàng và nghiên cứu hình ảnh học thường mang lại hiệu quả xác định chẩn đoán.
Định nghĩa và chẩn đoán viêm cơ tim rất khác nhau. Đối với viêm cơ tim liên quan Covid19 hoặc vắc xin Covid19, tiêu chuẩn chẩn đoán đã được điều chỉnh từ các tiêu chuẩn do trung tâm Dự phòng và Kiểm soát bệnh tật và tổ chức hợp tác Brighton thiết lập.
DỊCH TỄ HỌC
Trước đại dịch Covid19, ước tính tỷ lệ mắc viêm cơ tim toàn cầu khoảng 1-10/100.000 bệnh nhân mỗi năm. Nguy cơ cao nhất thuộc những người trong độ tuổi 20-40 và đàn ông. Trong nhóm tuổi từ 30-39, tỷ lệ mắc là 6.1 ca/ 100.000 đàn ông và 4.4 ca/100.000 phụ nữ, tỷ lệ tương tự trong nhóm tuổi từ 20-40. Tăng sử dụng MRI tim làm gia tăng dần các ca mắc viêm cơ tim được báo cáo ở Hoa Kỳ, từ 9.5 đến 14.4 ca/100.000 bệnh nhân.
Dữ liệu chính xác về gánh nặng của viêm cơ tim chỉ có sẵn trong các bệnh cảnh lâm sàng được lựa chọn. Ví dụ, tỷ lệ mắc viêm cơ tim trên bệnh nhân suy tim thay đổi từ 0.5% – 4.0% phụ thuộc tuổi và vùng miền. Trong số các bệnh nhân đau ngực nhập khoa cấp cứu, 3% bệnh nhân bị viêm cơ tim cấp và viêm màng ngoài tim. Chẩn đoán viêm cơ tim dựa trên cơ sở MRI tim trong 1/3 bệnh nhân có chẩn đoán nhồi máu cơ tim cấp trước đó và bệnh động mạch vành không tắc nghẽn. Các nghiên cứu tử thiết ở những bệnh nhân chết đột ngột cho thấy tỷ lệ viêm cơ tim khác nhau. Tỷ lệ mắc là 12% trong sổ lưu trữ tiền cứu miền Đông Bắc Italia. Ở những bệnh nhân ung thư nặng điều trị bằng các thuốc ức chế điểm kiểm soát miễn dịch, tỷ lệ mắc là 1.14%. Trong đại dịch Covid19, 2.4 ca xác định viêm cơ tim hoặc có thể và 4.1 ca xác định có viêm cơ tim, nhiều khả năng viêm cơ tim có thể được báo cáo trên 1000 bệnh nhân nhập viện vì Covid19. Cuối cùng, phân tích dữ liệu có sẵn hiện nay vắc xin Covid19 mRNA liên quan viêm cơ tim cho thấy tỷ lệ mắc tổng thể là 0.3 – 5 ca/100.000 bệnh nhân ở Hoa Kỳ và Israel. Cơ quan quản lý thực phẩm và thuốc và Cơ quan y tế châu u hiện nay ước tính nguy cơ viêm cơ tim khoảng 1/100.000 bệnh nhân tiêm vắc xin Covid19, mà nguy cơ cao nhất là nam giới trẻ tuổi.
NGUYÊN NHÂN VÀ BỆNH NGUYÊN
Viêm cơ tim có thể do nhiều nguyên nhân nhiễm trùng và không nhiễm trùng, như nhiễm siêu vi, hoạt hóa hệ miễn dịch (tự miễn [như u hạt (sarcoidosis) hoặc kích thích miễn dịch [như vắc xin hoặc thuốc điều trị ung thư]), hoặc tiếp xúc với chất độc và thuốc, bao gồm các hợp chất sinh hóa nội sinh, phát hiện trong bệnh thoái hóa tinh bột, nhiễm độc giáp. Trong số các bệnh nguyên nhiễm trùng gây viêm cơ tim, virus là nguyên nhân phổ biến nhất. Tuy nhiên trong quần thể được lựa chọn, nhiễm trùng không do virus (như vi khuẩn [Corynebacterium dipththeriae và Borrelia burgdorferi] và ký sinh trùng [Trypansosoma cruzi]) và viêm cơ tim thấp khớp tự miễn sau liên cầu vẫn là nguyên nhân chính.
Dữ liệu về tỷ lệ viêm cơ tim do virus không sẵn có, do sinh thiết nội tâm mạc và nghiên cứu bộ gen virus hiếm khi thực hiện trong thực hành lâm sàng thường qui. Sự khác biệt về mùa, địa lý và kinh tế-xã hội và thái độ tiêm chủng vắc xin khác nhau cũng được xem xét. Viêm cơ tim qua trung gian virus có thể do virus hướng tim nguyên phát, như adenovirus và enterovirus (như coxsackievirus), các virus hướng mạch máu (như parvovirus B19 [PVB19]), virus hướng bạch huyết (như cytomegalovirus, Epstein-Barr virus và herpesvirus 6 [HHV-6]), virus gây độc tim (như virus viêm gan C, virus suy giảm hệ miễn dịch ở người [HIV] và virus cúm) và có thể enzyme chuyển hóa angiotensin 2 – virus gây độc tim nhiệt đới (như coronavirus, gồm hội chứng suy hô hấp cấp do coronavirus 2 [SARS-CoV-2]). Một sự thay đổi dịch tễ từ virus hướng tim truyền thống đến PVB19 và HHV-6 đã trở nên rõ ràng hơn trong 30 năm qua. Tuy nhiên, vì PVB19 và HHV-6 cũng có thể tìm thấy trong tim bình thường hoặc liên quan các bệnh khác, số lượng bản sao DNA của virus vượt quá ngưỡng 500 bản sao trên mỗi microgram đã được đề xuất xác định virus là nguyên nhân gây viêm cơ tim.
Tầm hiểu biết của chúng tôi về sinh lý bệnh của viêm cơ tim do virus chủ yếu bắt nguồn từ nghiên cứu thực nghiệm trên chuột về virus hướng tim, với 3 giai đoạn thời gian:virus xâm nhập vào tế bào cơ tim thông qua thụ thể xuyên màng, với hoại tử, chết chương trình và hoạt hóa miễn dịch bẩm sinh (1-7 ngày); sao chép virus và hoạt hóa đáp ứng miễn dịch thu được, với sự xâm nhập của tế bào T và các tự kháng thể (1-4 tuần) và độ thanh thải virus hoặc tiến triển thành bệnh cơ tim giãn nở (vài tháng đến vài năm). Các virus hướng tim không nguyên phát trực tiếp phá hủy mô hoặc đóng vai trò như tác nhân gây tổn thương qua trung gian miễn dịch vẫn chưa được hiểu rõ; cơ chế thứ 2 có thể liên quan đến viêm cơ tim do SARS-CoV2 và các virus hô hấp khác. Hơn thế nữa, các con đường xác định sự chuyển đổi từ viêm cơ tim sang rố loạn chức năng tâm thất mạn tính vẫn chưa được làm rõ hoàn toàn và chưa giải thích thấu đáo tại sao một số bệnh nhân hồi phục, còn số khác thì không.
Trong bối cảnh Covid19, các cơ chế tổn thương tim có thể do nhiều yếu tố và không chỉ viêm nội tâm mạc hoặc viêm cơ tim mà còn tổn thương cơ tim do không phù hợp giữa cung và cầu oxy, huyết khối mạch máunhỏ, đáp ứng viêm toàn thân và thiếu máu cục bộ cơ tim.
Nhiều thuốc có liên quan viêm cơ tim, chủ yếu là các thuốc chống loạn thần, các thuốc gây độc, thuốc miễn dịch, vắc xin và thuốc salicylate. Sự gia tăng mạnh viêm cơ tim liên quan vắc xin được báo cáo vào năm 2010, chủ yếu liên quan vắc xin đậu mùa, bệnh than và cúm. Viêm cơ tim do vắc xin thường tăng bạch cầu ái toan, như đã được chứng minh viêm cơ tim liên quan vắc xin đậu mùa. Gần đây, viêm cơ tim được công nhận là biến chứng hiếm gặp của vắc xin mARN Covid19. Mối liên hệ tạm thời này không nhất thiết gợi ý vắc xin đóng vai trò là nguyên nhân viêm cơ tim. Viêm cơ tim có thể do yếu tố thúc đẩy, tái hoạt hóa hoặc kích thích viêm cơ tim xuất hiện tự nhiên thông qua virus hoặc các cơ chế qua hệ miễn dịch.
Thuốc ức chế điểm kiểm soát miễn dịch cho thấy một cách tiếp cận mới để điều trị ung thư nặng bằng các kháng thể nhắm trúng đích kháng nguyên tế bào lympho 54 gây độc (CTLA-4), chết tế bào theo chương trình 1 (PD-1) được dùng để thúc đẩy đáp ứng miễn dịch qua trung gian tế bào T chống lại tế bào ung thư. Tuy nhiên, các biến cố bất lợi qua trung gian hệ miễn dịch, gồm viêmcơ tim đe dọa tính mạng tiềm năng, ngày càng được công nhận, đặc biệt sử dụng kết hợp thuốc ức chế điểm kiểm soát miễn dịch.
Vai trò di truyền như một yếu tố góp phần làm viêm cơ tim hiện nay đã được ghi nhận, với các biến thể được cho là gây hại trong gen liên quan cấu trúc và chức năng tế bào cơ tim xác định trong 16% trường hợp. Theo giả thuyết 2 đợt tấn công (two-hit) chất nền di truyền có thể đóng vai trò quan trọng trong kết cục kiểu hình ở những bệnh nhân tiếp xúc với các yếu tố gây độc hoặc viêm nhiễm. Bệnh nhân có các biến thể di truyền gây bệnh liên quan bệnh cơ tim di truyền hiếm khi biểu hiện lâm sàng và có đặc điểm mô bệnh học của viêm cơ tim. Xét nghiệm di truyền có thể xem xét trong tất cả các dạng viêm cơ tim có tính gia đình.
Gần đây, hệ vi sinh đường ruột được xác định như một yếu tố tiềm năng nguy cơ có thể thay đổi trong viêm cơ tim. Các peptide mô phỏng từ vi khuẩn cộng sinh có thể thúc đẩy bệnh viêm cơ tim ở những người dễ mắc bệnh di truyền.
BIỂU HIỆN LÂM SÀNG
Viêm cơ tim có biểu hiện lâm sàng rất đa dạng tùy vào mức độ các tạng liên quan (hình 1, 2 và 3). Các biểu hiện lâm sàng chính là đau ngực với bệnh cảnh lâm sàng không phức tạp (phân suất tống máu thất trái bảo tồn [LVEF] và không rối loạn nhịp thất), suy tim mới hoặc nặng hơn, suy tim mạn, rối loạn huyết động đe dọa tính mạng (như viêm cơ tim tối cấp với sốc tim và suy chức năng thất trái nặng) và rối loạn nhịp tim hoặc rối loạn dẫn truyền đe dọa tính mạng (như rối loạn nhịp thất kéo dài, block nhĩ thất và đột tử).
Trong quá khứ, chẩn đoán viêm cơ tim dựa vào sinh thiết nội mạc cơ tim, được thực hiện hầu hết trên bệnh nhân có các biến chứng trung bình hoặc nặng. Các công cụ mới cho phép chẩn đoán không can thiệp để xác định nhiều bệnh nhân nghi ngờ viêm cơ tim trên lâm sàng hơn, bao gồm những bệnh nhân có tiên lượng thuận lợi hơn.
Mặc dù rối loạn nhịp tim hoặc dẫn truyền có thể xuất hiện trong bất kỳ giai đoạn nào, bệnh nhân biểu hiện các bất thường dẫn truyền như là biểu hiện đầu tiên của viêm cơ tim chưa được đánh giá độc lập trong các nghiên cứu quốc tế.
Một tương quan chính xác giữa các đặc điểm của rối loạn nhịp thất và giai đoạn viêm cơ tim được báo cáo, với rối loạn nhịp thất không đều, đa ổ trong viêm cơ tim hoạt động và rối loạn nhịp đều, 1 ổ trong viêm cơ tim mạn.
Biểu hiện lâm sàng có thể là công cụ tiên lượng kết cục. Bệnh nhân có LVEF giảm, suy tim, block nhĩ thất nặng, rối loạn nhịp thất kéo dài hoặc sốc tim làm tăng nguy cơ tử vong hoặc ghép tim. Một phân tích dữ liệu từ các các ca đăng ký hợp tác viêm cơ tim cấp chỉ ra hầu hết bệnh nhân có 1 đợt không biến chứng, với tỷ lệ đau ngực là 97% bệnh nhân và ECG có ST chênh lên khoảng 62%,với không tỷ lệ tử vong và ghép tim trong 5 năm. Ghép tim hoặc tử vong do nguyên nhân tim hầu hết xảy ra trên bệnh nhân có LVEF <50%, rối loạn nhịp thất kéo dài, rối loạn huyết động lúc nhập viện hoặc kết hợp các yếu tố này (tỷ lệ tử vong hoặc ghép tim, 10.4% trong 30 ngày và 14.7% trong 5 năm). Một phân tích dữ liệu đa trung tâm của viêm cơ tim cấp được chẩn đoán xác định bằng sinh thiết nội tâm mạch có suy chức năng tâm thu (LVEF, <50%) cho thấy ảnh hưởng tiên lượng của tình trạng rối loạn huyết động kéo dài, với 27.8% tỷ lệ tử vong hoặc ghép tim trong 60 ngày ở những bệnh nhân sốc tim, so với 1.8% những bệnh nhân không bị sốc tim. Tiên lượng đáng kể về đặc điểm mô học của tình trạng viêm cũng được xác định, với viêm cơ tim tế bào khổng lồ có nguy cơ cao nhất.
Viêm cơ tim tế bào khổng lồ luôn luôn nên nghi ngờ trên bệnh nhân suy tim diễn tiến nhanh hoặc sốc tim, có hoặc không có rối loạn dẫn truyền, mà không đáp ứng với điều trị thông thường. Tiên lượng nghèo nàn, với 85% tỷ lệ tử vong hoặc ghép tim trong 3 năm. Tuy nhiên, chẩn đoán sớm và bắt đầu sớm dùng thuốc ức chế miễn dịch tích cực hoặc hỗ trợ thở máy có thể giảm nguy cơ tử vong hoặc nhu cầu ghép tim.
Tỷ lệ tử vong hoặc ghép tim ở những bệnh nhân viêm cơ tim tăng bạch cầu ái toan và viêm cơ tim tối cấp hơn 26% trong 60 ngày. Sử dụng glucocorticoide đã cho thấy giảm tỷ lệ tử vong khi nằm viện nhưng dữ liệu từ các nghiên cứu ngẫu nhiên vẫn còn thiếu.
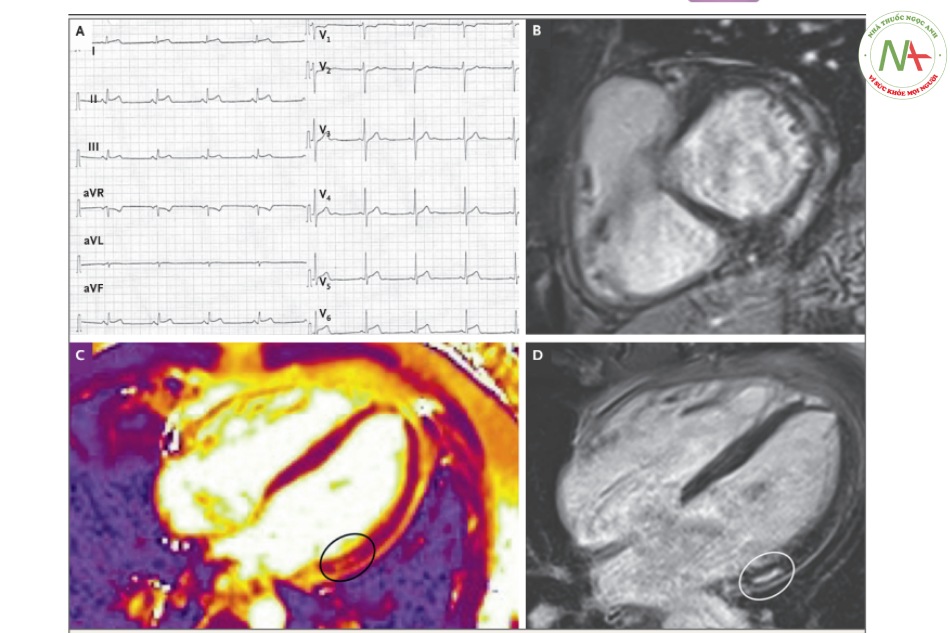
Điện tâm đồ (ECG) 12 chuyển đạo cơ bản khi bệnh nhân mới nhập viện cho thấy đoạn ST chênh lên ở các chuyển đạo phía dưới (hình A). MRI tim cho thấy tăng thuốc cản quang gadolinium muộn so với mô hình không mạch vành trong chế độ xem trục ngắn trực giao (phục hồi đảo ngược trọng số T1) (hình B). Hình chiếu 4 buồng tim cho thấy phù cơ tim như 1 dãi thành giữa trên bản đồ T2 (hình C, khoanh tròn)). Tăng thuốc cản quang gadolinium muộn với mô hình không mạch vành trong cùng 1 vùng như vằn sọc ở hình C, là bằng chứng hình chiếu 4 buồng tim (hồi phục đảo ngược trọng số T1) (hình D, khoanh tròn).
Bệnh nhân bị sarcoid tim có thể bị rối loạn dẫn truyền và suy tim. Những bệnh nhân đó có nguy cơ tử vong đột ngột và cần phải ghép máy khử rung tim. Các nghiên cứu cho thấy có đến 35% bệnh nhân bị block nhĩ thất hoàn toàn trẻ hơn 60 tuổi và 28% bệnh nhân bị nhịp nhanh thất chưa rõ nguyên nhân có thể không được chẩn đoán sarcoid tim.
VIÊM CƠ TIM LIÊN QUAN COVID19
Viêm cơ tim không phổ biến, nhưng là bệnh cảnh tối cấp được báo cáo trên 38.9% bệnh nhân được chẩn đoán xác định hoặc chẩn đoán sơ bộ.
Rối loạn huyết động, cần phải hỗ trợ tuần hoàn cơ học tạm thời và tử vong hầu như nhiều hơn trên những bệnh nhân đồng thời có viêm phổi hơn là những bệnh nhân không viêm phổi.
VIÊM CƠ TIM LIÊN QUAN VẮC XIN COVID19
Các phân tích dữ liệu hồi cứu trong các quần thể lớn cho thấy sau khi những người đủ điều kiện tiêm vắc xin mARN BNT162b2 (Pfizer – BioNTech), viêm cơ tim rất hiếm gặp, phổ biến nhất ở thanh thiếu niên và trong vòng vài ngày sau tiêm liều thứ 2, và thường tự giới hạn.
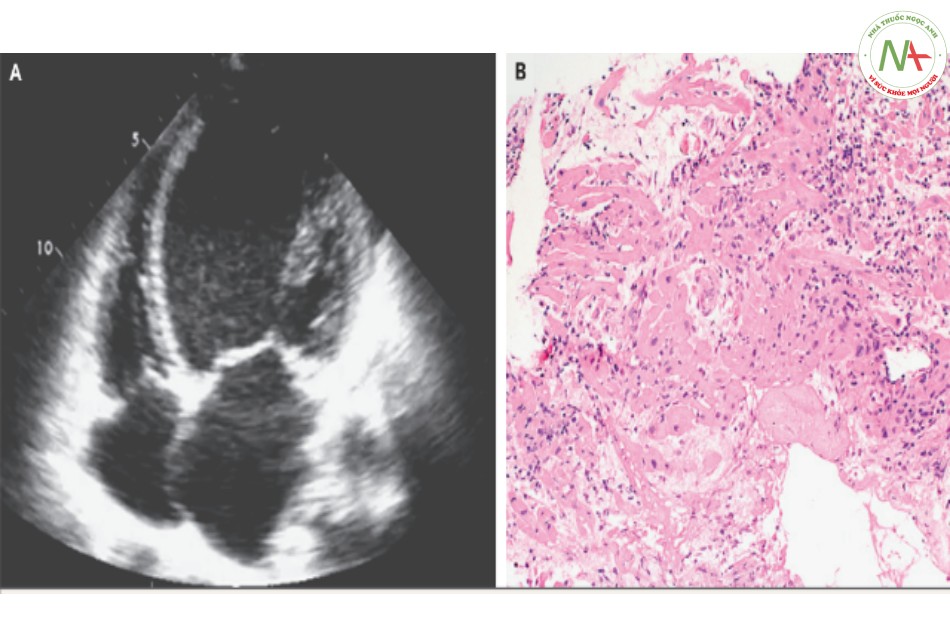
Đơn vị hồi sức tích cực (ICU) cho thấy buồng thất trái dãn nặng có LVEF giảm. Trong hình B, một mẫu mô sinh thiết nội tâm mạc biểu hiện viêm cơ tim tế bào bạch huyết lan tỏa (hematoxylin và eosin). Xét nghiệm bộ gen của virus bằng chuỗi phản ứng polymerase (PCR) và phân tích phiên mã ngược đều cho kết quả âm tính.
Gần đây, trên cơ sở giám sát thụ động tại Hoa Kỳ, tăng nguy cơ viêm cơ tim sau tiêm vắc xin Covid19 (như BNT162b2 hoặc mARN-1273 [Moderna]) được báo cáo trong nhiều độ tuổi và giới tính và cao nhất khi tiêm vắc xin liều thứ 2 ở thanh thiếu niên và vị thành niên. Trong 87% số ca, các triệu chứng đã hết sau khi xuất viện.
VIÊM CƠ TIM LIÊN QUAN LIỆU PHÁP ỨC CHẾ ĐIỂM KIỂM SOÁT MIỄN DỊCH
Phân tích dữ liệu từ các bệnh nhân viêm cơ tim liên quan ức chế điểm kiểm soát miễn dịch cho thấy khởi phát các triệu chứng sớm (khoảng trung bình sau điều trị ban đầu, 34 ngày) và tỷ lệ tử vong cao (50%). Vì lo ngại các biến chứng này cũng như tăng số lượng bệnh nhân điều trị kết hợp thuốc ức chế điểm kiểm soát miễn dịch, ECG và đo troponin nền và hàng tuần trong 6 tuần đầu điều trị được khuyến cáo, mặc dù không có bằng chứng rõ ràng về tính hiệu quả hoặc giá trị của các giá trị nền thường quy này hoặc xét nghiệm hàng loạt.
CHẨN ĐOÁN
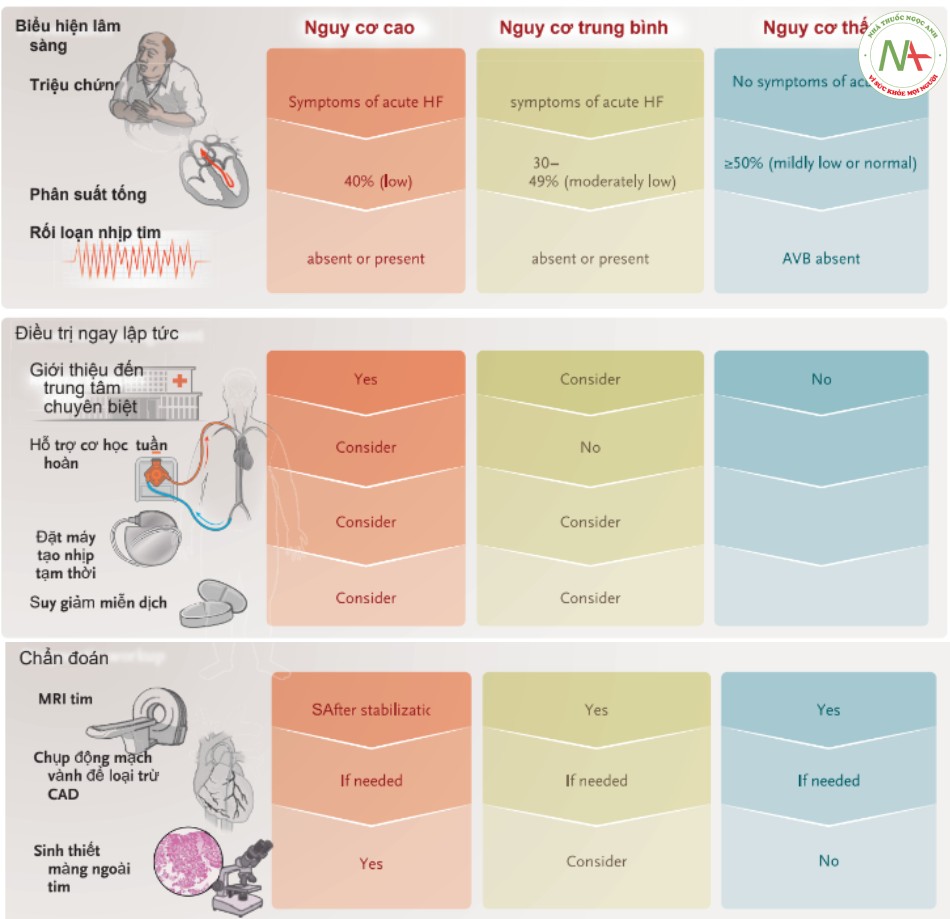
Chẩn đoán viêm cơ tim phải dựa vào nhiều nguồn dữ liệu. Theo hiệp hội tim mạch châu u (ESC),một chẩn đoán không xâm lấn giúp thành lập chẩn đoán “nghi ngờ viêm cơ trên lâm sàng”, trên cơ sở biểu hiện lâm sàng và tiêu chuẩn trong 4 loại sau: xét nghiệm cận lâm sàng; điện tâm đồ; đo holter điện tâm đồ và stress gắng sức; đánh giá chức năng và cấu trúc hình ảnh tim (siêu âm tim, chụp mạch và MRI); và đặc điểm mô học của tim trên MRI. Mặc dù ESC khuyến cáo chụp mạch vành có chọn lọc và sinh thiết nội tâm mạc trên tất cả bệnh nhân đáp ứng tiêu chuẩn chẩn đoán viêm cơ tim nghi ngờ trên lâm sàng, các khuyến cáo sinh thiết nội tâm mạc vẫn còn thay đổi trong cộng đồng khoa học. Hiệp hội tim hoa kỳ 2007 (ACC) – Trường môn tim mạch hoa kỳ (ACC) – ESC cung cấp các khuyến cáo ban đầu về vai trò sinh thiết nội tâm mạc trong các tình huống lâm sàng khác nhau. Gần đây hơn, một cách tiếp cận dựa trên nguy cơ đối với sử dụng sinh thiết nội tâm mạc đã được đề xuất trên cơ sở đồng thuận của các chuyên gia (hình 4).
Sinh thiết nội tâm mạc có thể dành cho bệnh nhân nghi ngờ viêm cơ tim trên lâm sàng và có các phát hiện sau: sốc tim hoặc suy tim cấp phải dùng thuốc tăng co bóp cơ tim hoặc hỗ trợ tuần hoàn cơ học; rối loạn nhịp nhĩ hoặc Mobitz loại II độ 2 hoặc block nhĩ thất cao độ, đặc biệt khi các triệu chứng khởi phát gần đây, với dãn thất trái nhẹ hoặc không dãn; tăng bạch cầu ái toan ngoại biên hoặc liên quan một rối loạn viêm hệ thống; giải phóng các dấu ấn hoại tử dai dẳng hoặc tái phát, đặc biệt có khả năng xảy ra một tình trạng tự miễn hoặc xuất hiện rối loạn nhịp thất và block nhĩ thất cao độ; hoặc rối loạn chức năng tim trên bệnh nhân điều trị thuốc ức chế miễn dịch. Trong các tình huống lâm sàng khác, MRI tim nên cân nhắc làm như một cách xét nghiệm chẩn đoán ban đầu để tìm viêm nhiễm và sinh thiết nội tâm mạc cũng có thể cân nhắc trên cơ sở từng ca bệnh, tùy theo khả năng phát hiện 1 rối loạn có thể điều trị được.
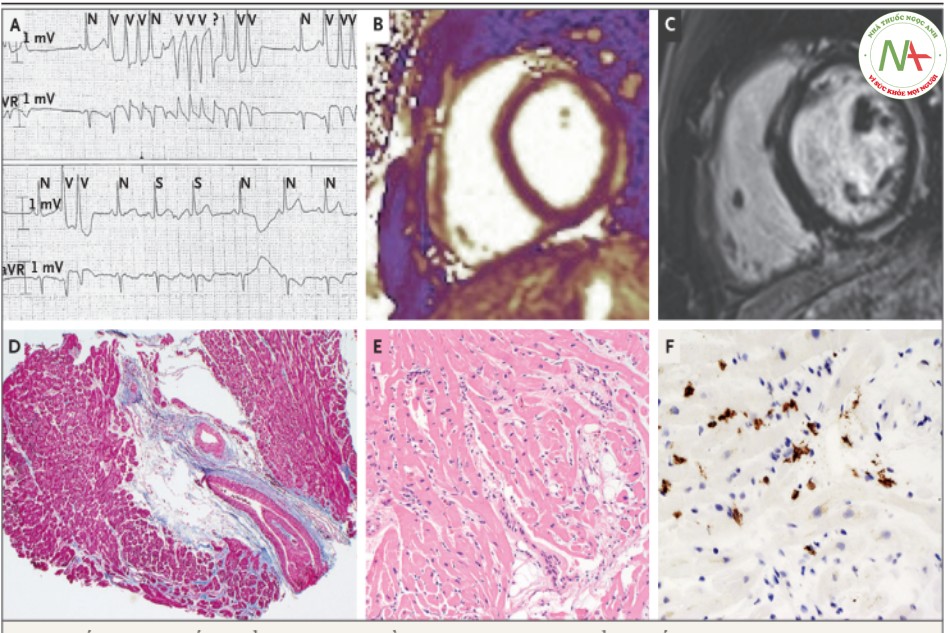
Ghi điện tâm đồ trong ICU cho thấy nhanh thất không bền vững (hình A). N biểu thị phức bộ QRS bình thường, nhịp sớm trên thất S và nhịp sớm thất V. Bệnh mạch vành được loại trừ nhờ chụp mạch máu. Chụp MRI tim cho thấy không có bằng chứng phù cơ tim trên T2 (xem trục ngắn) (hình B). MRI tim cho thấy sau khi uống thuốc cản quang bắt thuốc muộn gadolinium ở thượng tâm mạc và giữa thành, với dạng không phải mạch vành (xem trục ngắn) (hình C). Khu trú nhẹ, xơ hóa kiểu thay thế xuất hiện (màu xanh) trong mẫu sinh thiết nội tâm mạc (nhuộm 3 màu) (hình D). Phù khoảng kẽ và ít tế bào viêm cũng có thể nhìn thấy (hematoxylin và eosin) (hình E). Nhuộm hóa mô miễn dịch bằng kháng thể CD3 cho thấy sự xuất hiện của tế bào lympho T CD3 dương tính (7 trên mỗi mm2), đây là bằng chứng phù hợp viêm cơ tim mạn tính đang hoạt động (hình F).
MRI TIM
Trong các trường hợp nghi ngờ viêm cơ tim trên lâm sàng, MRI tim là một công cụ giá trị và độ nhạy cao nhất nếu làm từ 2-3 tuần sau khởi phát triệu chứng lâm sàng. MRI tim cũng hữu ích như một công cụ đánh giá sau 6 – 12 tháng để theo dõi diễn tiến của bệnh.
Hội nghị đồng thuận 2009 về MRI tim để chẩn đoán viêm cơ tim xác định các dấu ấn như sau (gọi là tiêu chuẩn Lake Louise): một tín hiệu mạnh trên hình ảnh học ngay sau khi tăng gadolinium, cho thấy tình trạng tăng thân nhiệt, tăng thời gian nghỉ T2 cơ tim hoặc tăng cường độ tín hiệu trên T2W, phản ánh phù nề mô và bắt thuốc gadolinium chậm, cho thấy hoại tử hoặc xơ hóa. Những tiêu chuẩn này được cập nhật năm 2018, có bổ sung ánh xạ T2 để phát hiện phù cơ tim và thể tích ngoại bào cũng như các dấu ấn tổn thương cơ tim. Độ nhạy và độ đặc hiệu của tiêu chuẩn gốc lần lược là 74% và 86%, so với 88% và 96% theo thứ tự của tiêu chuẩn được cập nhật.
Các loại viêm không xác định trên MRI tim.
Mặc dù phân bố theo vùng có thể là dấu hiệu cảnh báo, như sự xuất hiện của vách nền trong bệnh sarcodosis. Các đặc điểm của MRI tim cũng được dùng để phân tầng nguy cơ, vì MRI âm tính trên bệnh nhân nghi ngờ viêm cơ tim trên lâm sàng liên quan tiên lượng tốt.
Ngược lại, bắt thuốc gadolinium chậm trong lớp giữa của vách ngăn và LVEF thấp đã được xác định là yếu tố nguy cơ mạnh nhất về tiên lượng xấu.
Bắt thuốc cản quang muộn và không cóphù trên hình ảnh học là các yếu tố dự đoán âm tính, không chỉ được so sánh với độ phân giải hoàn toàn mà còn bắt thuốc cản quan gadolinium muộn và phù, có lẽ vì các phát hiện sau cho thấy 1 quá trình vẫn tiếp diễn, với tiềm năng bệnh đang phục hồi.
SINH THIẾT NỘI T M MẠC
Viêm cơ tim được chẩn đoán khi đánh giámẫu bệnh phẩm lấy từ sinh thiết nội tâm mạc cho thấy viêm thâm nhiễm, thoái hóa hoặc hoại tử các tế bào cơ lân cận. Có thể xác định các phân nhóm, như viêm cơ tim tế bào lympho, tế bào bạch cầu ưa acid và tế bào khổng lồ và sarcodosis tim, có ý nghĩa tiên lượng và điều trị cụ thể (hình 5). Sự hiện diện và mức độ xơ hóa cũng được báo cáo và mô tả như xơ hóa mô kẽ, xơ hóa nội tâm mạc và xơ hóa thay thế. Nhuộm hóa mô miễn dịch để mô tả đặc điểm các tế bào viêm làm gia tăng các phát hiện có ý nghĩa trên mẫu sinh thiết nội tâm mạc. Tiêu chuẩn định lượng cho tình trạng viêm được nêu rõ trong báo cáo ESC 2013, nhưng vẫn chưa thể xác thực trong bất kì nhóm người nào có tổ tiên không phải người châu u. Kết quả chẩn đoán sinh thiết sinh thiết nội tâm mạc cao nhất nếu thực hiện sinh thiết trong vòng 2 tuần sau khi khởi phát các triệu chứng. Độ nhạy có thể tăng bằng các tăng số lượng mẫu thử và bằng các sinh thiết nội tâm mạc theo hướng dẫn của hình ảnh học hoặc bản đồ điện giải phẫu.
Ngoài đánh giá mô học và hóa mô miễn dịch của các mẫu sinh thiết, xét nghiệm phản ứng chuỗi polymerase hoặc lai tại chỗ để sàng lọc các loại virus, mặc dù ý nghĩa lâm sàng của nhiễm virus hoặc mối liên hệ nhân quả giữa nhiễm trùng và tổn thương vẫn còn đang nghiên cứu. Cần chuẩn hóa những phương pháp xác định bộ gen và định lượng virus. Sự hiện diện của bộ gen virus trong trường hợp không có tế bào viêm không phải là chẩn đoán viêm cơ tim.
CÁC XÉT NGHIỆM KHÁC
Các dấu ấn tổn thương tế bào cơ và viêm như tốc độ lắng của máu và protein C phản ứng thường được đánh giá, mặc dù chúng không đặc hiệu và tăng không nhiều trong viêm cơ tim
Troponin là một dấu ấn nhạy hơn creatinine kinase (creatinine kinase và creatine kinase B), nhưng tăng creatinine kinase có thể gợi ý do viêm cơ tim hoặc viêm cơ xương. Xét nghiệm troponin độ nhạy cao là một công cụ giá trị chẩn đoán viêm cơ tim chính xác hơn xét nghiệm troponin thông thường. Đo petide natri lợi niệu não, như peptide natri lợi niệu pro-B-tyoe đoạn N (NT-pro BNP) cũng có thể hữu ích nhưng không đặc hiệu và khi kết quả bình thường vẫn không thể loại trừ viêm cơ tim.
Tầm soát bệnh tự miễn được khuyến cáo trên bệnh nhân nghi ngờ viêm cơ tim trên lâm sàng. Xét nghiệm huyết thanh học thường qui không được chỉ định, bởi vì nếu xét nghiệm dương tính không loại trừ nhiễm trùng cơ tim mà chỉ biểu thị sự tương tác giữa hệ miễn dịch ngoại biên với một tác nhân lây nhiễm. Có một số ngoại lệ, như nghi ngờ viêm gan C và rickettsial, HIV, B. burdorferi và nhiễm trùng T.cruzi. Các tự kháng thể tim trong huyết thanh có thể được xét nghiệm, nhưng cần có chuyên môn đặc biệt và các xét nghiệm tự kháng thể tim không có sẵn trên thị trường.
Xét nghiệm microRNA trong máu và các mẫu sinh thiết nội tâm mạc và các dấu ấn sinh học dựa trên phiên mã trong các mẫu sinh thiết nội tâm mạc đã được nghiên cứu, thu được các kết quả đầy hứa hẹn nhưng còn thiếu sự tương quan giữa mức độ mô và máu. Một nghiên cứu gần đây chỉ ra rằng một RNA lưu hành mới được tổng hợp nhờ tế bào T trợ giúp (hs-mirChr8:96) có thể được dùng để phân biệt những bệnh nhân viêm cơ tim so với các bệnh nhân nhồi máu cơ tim và nhóm chứng những người khỏe mạnh. Thông tin này cần được đánh giá trong các bệnh cảnh khác trước khi áp dụng vào lâm sàng một cách khả thi.
ĐIỀU TRỊ
Điều trị viêm cơ tim phải kết hợp điều trị rối loạn nhịp và suy tim dựa trên các hướng dẫn tiêu chuẩn và điều trị nhắm trúng nguyên nhân gây bệnh.
ĐIỀU TRỊ THÔNG THƯỜNG
Trên bệnh nhân suy tim huyết động ổn định nên điều trị bằng các thuốc lợi tiểu, thuốc ức chế men chuyển angiotensin hoặc chẹn thụ thể angiotensin và chẹn beta-adrenergic.
Điều trị bổ sung bằng các thuốc đối vận aldosterone nên cân nhắc trên bệnh nhân suy tim lâu dài bất chấp điều trị đủ. Cho dù điều trị sớm cũng nên tiến hành trên bệnh nhân LVEF bảo tồn để giảm viêm, tái cấu trúc và sẹo vẫn chưa chắc chắn.
Bệnh nhân suy tim huyết động không ổn định cần các thuốc co bóp cơ tim. Nên điều trị trong đơn vị hồi sức tích cực có thiết bị hỗ trợ tuần hoàn và hô hấp, và nên cân nhắc điều trị tại trung tâm chuyên khoa. Trên bệnh nhân sốc tim bị rối loạn chức năng thất nặng không đáp ứng điề trị nội khoa, hỗ trợ cơ học tuần hoàn bằng các thiết bị hỗ trợ thất hoặc oxy hóa qua màng ngoài cơ thể (ECMO) có thể cần thiết.
Vì viêm cơ tim là một bệnh có thể đảo ngược, các mục tiêu chính điều trị là giảm tải 2 thất, tưới máu đầy đủ tuần hoàn cơ thể và mạch vành, và thông tĩnh mạch, đây là nỗ lực nhằm dự phòng rối loạn chức năng đa cơ quan và tạo cầu nối để phục hồi, cấy ghép hoặc sử dụng thiết bị hỗ trợ lâu dài. Nên cân nhắc các thiết bị tạm thời, như bơm bóng trong động mạch chủ, ECMO động tĩnh mạch, bơm quay hoặc bơm hướng trục trong động mạch chủ. Sử dụng các thiết bị giảm hậu tải thất trái, như bơm hướng trục ly tâm hoặc trong động mạch chủ, đơn lẻ hoặc kết hợp với ECMO có nhiều khả năng thúc đẩy quá trình hồi phục cơ tim so với chỉ ECMO đơn thuần. Trong những năm gần đây, giải áp thất trái thông qua đặt thuốc qua da qua dòng chảy trục dọc (Impella; Abiomed) đã chứng minh là một lựa chọn điều trị khả thi trên bệnh nhân sốc tim, vừa là phương tiện hỗ trợ tâm thất trái duy nhất khi chức năng thất trái bảo tồn và trong việc kết hợp hỗ trợ tuần hoàn ngoài cơ thể hoặc với một bơm Impella bên phải. Trong trường hợp không có quy trình hỗ trợ cơ học tuần hoàn tạm thời, lựa chọn thiết bị phụ thuộc vào kinh nghiệm tại chỗ và chức năng thất phải. Nếu bệnh nhân không thể ngừng hỗ trợ hỗ trợ cơ học tuần hoàn cơ học sau 2 – 3 tuần, một thiết bị hỗ trợ hỗ trợ thất trái vĩnh viễn hoặc cấy ghép nên cân nhắc.
Không có các khuyến cáo đặc biệt trong điều trị rối loạn nhịp và rối loạn dẫn truyền trên bệnh nhân viêm cơ tim.
Sau đợt cấp, nên điều trị phù hợp theo các hướng dẫn hiện có trong rối loạn nhịp và cấy ghép thiết bị. Vì viêm cơ tim hoàn toàn có thể đảo ngược, một cách tiếp cận từng bước được đề nghị trong giai đoạn cấp. Tạo nhịp có lẽ cần thiết trong block nhĩ thất hoàn toàn. Sử dụng máy khử rung cấy ghép nên hoãn lại cho đến khi điều trị xong giai đoạn cấp tính, tầm 3-6 tháng sau khi bắt đầu giai đoạn cấp tính và một chiếc máy khử rung tim có thể đeo được có thể cân nhắc làm cầu nối.
Ở các vận động viên thi đấu, nên hạn chế các hoạt động trong giai đoạn viêm cơ tim cấp tính và trong khoảng thời gian từ 3 đến 6 tháng sau đó, tùy theo mức độ nghiêm trọng trên lâm sàng và thời gian cấp tính. Sau khi khỏi bệnh, đánh giá lâm sàng nên được chỉ định trước khi tiếp tục thi đấu thể thao. Sàng lọc trước khi tham gia thi đấu nên làm 6 tháng 1 lần trong quá trình theo dõi.
ĐIỀU TRỊ BỆNH CẢNH ĐẶC BIỆT
Một khi các nguyên nhân có thể điều trị được của tăng bạch cầu ái toan như thuốc và ký sinh trùng đã được loại trừ, nên dùng sớm các thuốc ức chế miễn dịch (như glucocorticoide đơn lẻ hoặc dùng chung với azathioprine, cyclosporine hoặc cả 2) là điều trị chính trong viêm cơ tim tăng bạch cầu ái toan, cũng như viêm cơ tim tế bào khổng lồ và sarcodosis tim. Không có điều trị đặc hiệu trong viêm cơ tim tế bào bạch huyết, ngoại trừ các dạng liên quan bệnh hệ thống và các chất ức chế điểm kiểm soát miễn dịch.
Mặc dù có cơ sở với điều trị ức chế miễn dịch trong giai đoạn cấp viêm cơ tim nguy cơ cao, nhưng vẫn chưa có dữ liệu từ các thử nghiệm tiền cứu. Thử nghiệm điều trị viêm cơ tim sớm chứng minh không có lợi ích của ức chế miễn dịch trên bệnh nhân viêm cơ tim có sinh thiết nội tâm mạc, mặc dù nguyên nhân không rõ ràng và trì hoãn điều trị ban đầu sau khởi phát bệnh. Một số thử nghiệm điều trị bằng prednisone và azathioprine chứng minh các kết quả thuận lợi ở bệnh nhân đã được chứng minh bằng sinh thiết nội tâm mạc, virus âm tính, bệnh cơ tim viêm mạn tính, với cải thiện LVEF.
Để sử dụng an toàn điều trị ức chế miễn dịch, các hướng dẫn của ESC khuyến cáo phân tích bộ gen virus trên mẫu sinh thiết nội tâm mạc.
Tài liệu gần đây của AHA liên quan điều trị viêm cơ tim tối cấp yêu cầu dùng ngay 1g solumedrol khi nghi ngờ mạnh mẽ một dạng viêm cơ tim qua trung gia miễn dịch, trước khi sinh thiết nội tâm mạc hoặc làm tiếp các xét nghiệm. Nếu chẩn đoán viêm cơ tim tế bào khổng lồ được xác định, các thuốc ức chế miễn dịch khác nên thêm vào điều trị.
Gần đây, điều trị theo kinh nghiệm bằng glucocorticoide đường tĩnh mạch trên bệnh nhân sốc tim hoặc viêm cơ tim cấp biến chứng suy tim, rối loạn nhịp tâm thất hoặc block nhĩ thất cao độ đã được đề xuất. Điều trị duy trì sau đó hữu ích trên bệnh nhân viêm cơ tim bạch cầu ái toan hoặc tế bào khổng lồ, sarcodosis tim hoặc một rối lọan tự miễn đã xác định. Trong các trường hợp hiếm, một virus như enterovirus, cytomegalovirus hoặc adenovirus được xác định, và có thể không điều trị tiếp ức chế miễn dịch. Trên bệnh nhân PVB19 hoặc HHV-6 dương tính, duy trì thuốc ức chế miễn dịch dựa vào đáp ứng ban đầu với điều trị và tải lượng virus.
Các phương pháp điều trị thay thế dành riêng cho các bệnh nhân mắc bệnh cơ tim viêm tự miễn hoặc âm tính với virus bao gồm loại bỏ các tự kháng thể (nghĩa là hấp thụ miễn dịch) bằng liệu pháp globulin miễn dịch tiêm mạch, một nghiên cứu lớn, đa trung tâm trên bệnh nhân mắc bệnh cơ tim dãn nở đang được tiến hành. Điều trị globulin miễn dịch tiêm mạch thông thường được dùng ở bệnh nhi, nhưng điều trị ở người lớn mắc viêm cơ tim tế bào bạch huyết đã bị hạn chế.
Dữ liệu không đủ để hỗ trợ điều trị kháng virus đối với viêm cơ tim cấp tính. Các tác động lợi ích của điều trị bằng interferon trên độ thanh thải virus và phân nhóm chức năng của Hiệp hội tim mạch New York chỉ được thể hiện với adenovirus và enterovirus.
Các thử nghiệm lâm sàng đang tiến hành nhằm đánh giá vai trò của methylprednisolone liều cao trên bệnh nhân viêm cơ tim cấp biến chứng suy tim hoặc shock tim (thử nghiệmđiều trị viêm cơ tim bằng Steroides [MYTHS]; của anakinra, một chất đối vận thụ thể Interleukin -1 (Anakinra so với giả dược trong điều trị viêm cơ tim cấp [ARAMIS], ngoại trừ những bệnh nhân có tình trạng huyết động không ổn định; và của abatacept, một đoạn định hướng CTLA-4 nhắm vào ngăn chặn đồng kích thích tế bào T bằng CD80 hoặc CD86) để điều trị viêm cơ tim do ức chế điểm kiểm soát miễn dịch [ACHLYS].
KẾT LUẬN
Trong vòng 35 năm qua, chúng ta đã đạt được những tiến bộ lớn hiểu về điều hòa và tính đa dạng của con đường viêm cơ tim liên quan đến cơ chế bệnh sinh của viêm cơ tim. Cộng đồng y tế mong muốn phát triển các phát đồ điều trị tiêu chuẩn cho bệnh nhân viêm cơ tim cấp.
CÂU HỎI LÂM SÀNG
Câu 1
Bệnh nhân nữ 32 tuổi tới phòng khám do khó thở tăng dần một tháng trước khi trở lại từ kỳ nghỉ ở Texas. Triệu chứng bắt đầu bằng khó thở khi gắng sức và đến giờ cô ta cảm giác khó thở khi ngủ mà phải ngồi dậy mới đỡ. Bệnh nhân có lối scíng năng động, nhưng hiện tại hạn chế hoạt động. Cô ta không có đau ngực, ban đỏ da, đau khớp. Bệnh nhân không có tiền sử bệnh lý. Tiền sử gia đình có ung thư tuyến giáp ở chú và ung thư phổi ở bố. Không có tiền sử gia đình về bệnh mạch vành, suy tim, ngừng tim. Cô ta không dùng chất kích thích. Bệnh nhân hiện tại sống ở New York. Nhiệt độ 37.2, huyết áp 110/70, mạch 96, nhịp thở 14. Phù mắt cá chân hai bên. Gan to 2cm dưới bờ sườn phải. Nghe phổi thấy giảm tiếng thở ở hai bên. Nghe tim thấy tiếng T3. Xquang thấy hình tim to và tràn dịch màng phổi ít. ECG thấy đoạn ST thay đổi không điển hình. Nguyên nhân gây nên những triệu chứng này ?
- Xơ vữa động mạch.
- Bệnh nhiễm nấm Coccidioides (Coccidioidomycosis).
- Bệnh mô liên kết.
- Nhược giáp.
- Bệnh Lyme.
- Nhiễm virus.
Diễn giải:
| Viêm cơ tim do virus | |
| Biểu hiện lâm sàng | Người trưởng thành trẻ tuổi (<55 tuổi)
Tiền triệu nhiễm virus (sốt, mệt mỏi, đau cơ) Suy tim (khó thở, khó thở khi nằm, phù) Đau ngực Ngừng tim đột ngột |
| Chẩn đoán | ECG: không đặc hiệu
Siêu âm tim: giãn 4 buồng tim MRI tim: tăng tín hiệu thượng tâm mạc thì muộn Sinh thiết: xâm nhiễm lympho bào, DNA và RNA virus |
| Điều trị | Thuốc (lợi niệu, ức chế ACE, chẹn beta) Thiết bị hỗ trợ tâm thất nếu cần thiết Ghép tim nếu không hồi phục |
Bệnh nhân mắc bệnh cơ tim giãn do viêm cơ tim do virus. Một số virus có thể gây bệnh cơ tim giãn, bao gồm parvovirus B19, Herpes người type 6, Adenovirus, virus cúm, coxsackievirus, HIV. Bệnh thường do đáp ứng bất thường của hệ miễn dịch với nhiễm virus cho phép nó xâm nhập vào tế bào cơ tim, dẫn tới nhiễm độc tế bào và giảm khả năng co bóp. Giảm chức năng tâm thu và giãn tâm thất (phì đại không đồng tâm).
Viêm cơ tim do virus thường ảnh hưởng tới người trẻ (<55 tuổi) và bệnh nhân thường biểu hiện bệnh cơ tim giãn và dấu hiệu, triệu chứng của suy tim mất bù. It thấy hơn, bệnh nhân có thể không tiến triển thành bệnh cơ tim giãn nhưng biểu hiện đau ngực gicíng như nhồi máu cơ tim. Ngừng tim đột ngột là hiếm gặp nhưng có thể xảy ra. Một số bệnh nhân có thể mô tả các tiền triệu của nhiễm virus (sốt, mệt mỏi, đau mỏi cơ) xuất hiện trước khi tiến triển các triệu chứng tim mạch.
ECG thường cho thấy đoạn ST thay đổi không đặc trưng, và siêu âm tim thấy 4 buồng tim giãn (trong bệnh cơ tim giãn). Sinh thiết cơ tim kết hợp PCR virus là tiêu chuẩn vàng để chẩn đoán, nhưng chẩn đoán thường hỗ trợ bởi MRI tim không xâm lấn.
Ý A: Xơ vữa mạch vành là nguyên nhân chính gây bệnh cơ tim giãn và suy tim ở người <45 tuổi. Nhưng thường không xảy ra ở người trẻ không có yếu tố nguy cơ bệnh mạch vành.
Ý B: Bệnh do nhiễm Coccidioides thường biểu hiện các triệu chứng giống với viêm phổi cộng đồng (mệt mỏi, ho, sốt). Bệnh thường gây dịch ở vùng tây nam Hoa Kỳ, bao gồm Texas, tuy nhiên thường không gây viêm cơ tim hay suy tim.
Ý C: Bệnh mô liên kết (lupus ban đỏ, viêm khớp dạng thấp) là nguyên nhân ít gặp gây bệnh cơ tim giãn. Không xuất hiện ban đỏ da hoặc đau khớp khiến chẩn đoán này không có khả năng.
Ý D: Nhược giáp nặng có thể gây bệnh cơ tim giãn nhưng ít có khả năng hơn so với viêm cơ tim do virus do bệnh nhân này không có các triệu chứng của nhược giáp (lạnh, táo bón, da khô).
Ý E: Bệnh Lyme có tổn thương tại tim biểu hiện bằng bất thường dẫn truyền (block nhĩ thất) và bệnh cơ tim giãn là biểu hiện không thường gặp. Thiếu các bất thường dẫn truyền trên ECG làm chẩn đoán này không có khả năng.
Tổng kết: Bệnh viêm cơ tim do virus là nguyên nhân chính gây bệnh cơ tim giãn ở người trẻ. Bệnh nhân thường biểu hiện với triệu chứng hoặc dấu hiệu của suy tim mất bù (khó thở, khó thở khi nằm, phù ngoại biên).
Câu 2
Nữ 32 tuổi đến phòng khám do mệt mỏi, khó thở tăng dần và phù chân trong khoảng 4-5 ngày gần đây. Cô ta không đau ngực, không có tiền sử gì ngoài bị cúm 2 tuần trước và hiện không dùng thuốc gì. Thân nhiệt 36.7 độ C, HA 110/65 mmHg, mạch 90 l/ph, nthở 20 l/ph. Thăm khám thấy ran ẩm ở đáy phổi, tăng áp lực tĩnh mạch cảnh và phù 2+ cổ chân hai bên. Công thức máu bình thường. Hình ảnh nhiều khả năng thấy trên siêu âm là gì?
- Sùi van ĐMC.
- Phì đại vách không đối xứng.
- Phì đại TTT đồng tâm.
- Giãn tâm thất kèm giảm vận động lan tỏa.
- Hẹp van 2 lá.
- Giảm vận động đoạn thành trước.
- Dày màng ngoài tim cùng tràn dịch khu trú.
Đáp án đúng là D:
| Viêm cơ tim do virus | |
| Biểu hiện lâm sàng | -Liên quan tới người trưởng thành (tuổi<55) -Có tiền triệu nhiễm virus (sốt, ban, đau mỏi cơ) -Suy tim (khó thở, khó thở khi nằm, phù) -Đau ngực -Tử vong do ngừng tim |
| Chẩn đoán | -ECG: không điển hình
-Siêu âm tim: 4 buồng giãn -MRI tim: ngoại tâm mạc bắt màu muộn -Sinh thiết: thâm nhiễm lympho, DNA hoặc ARN của virus |
| Điều trị | -Thuốc (lợi tiểu, ACEIs, ARB)
-Đặt thiết bị hỗ trợ thất tạm thời nếu cần -Ghép tim nếu không hồi phục |
Bệnh nhân này có bằng chứng của tình trạng suy tim mất bù (Decompenstated heart failure) có thể do viêm cơ tim. Tình trạng này chủ yếu ảnh hưởng tới người trẻ và thường có những tiền triệu như viêm đường hô hấp trên, viêm đường ruột.
Đa số các trường hợp viêm cơ tim có biểu hiện lâm sàng khó phát hiện nhưng một số trường hợp có thể liên quan đến tình trạng di truyền từ trước tạo thuận lợi đối với nhiễm khuẩn (virus Coxacied, adenovirus, parvovirus B19) dai dẳng với cơ tim gây ra mất khả năng co của cơ tim.
Cùng với sự giảm co dần của tâm thất hai bên, sự phì đại không đồng tâm bù trừ này sẽ tiến triển thành bệnh cơ tim giãn (Dilated cardiomyopathy, DCM). Trên siêu âm tim, DCM đặc trưng bởi tình trạng giãn các buồng tim và giảm vận động lan tỏa của thành tâm thất.
Điều trị DCM do viêm cơ tim chủ yếu là hỗ trợ và cải thiện tình trạng suy tim EF giảm (lợi tiểu, chẹn Beta, ức chế men chuyển) một số bệnh nhân có thể cải thiện được chức năng tim.
Đáp án A: Tổn thương van động mạch chủ do viêm nội tâm mạc có thể gây hở chủ dẫn tới suy tim mất bù (DHF) tuy nhiên có sốt và bạch cầu tăng.
Đáp án B: Dày vách gian thất không đối xứng đặc trưng trong bệnh cơ tim phì đại (HCM), cái không biểu hiện bằng tình trạng suy tim mất bù (DHF), HCM thường biểu hiện ngừng tim đột ngột ở bệnh nhân không có tiền triệu
Đáp án C: Phì đại tâm thất trái đồng tâm là kết quả của sự tăng áp lực trong buồng mãn tính, cái có thể xảy ra với tăng huyết áp hệ thống hoặc hẹp chủ nặng.
Đáp án E: Hẹp hai lá đặc trưng bởi tiếng thổi giữa kì tâm trương và tiếng mở van. Bệnh nhân có thể tiến triển thành DHF, nhưng hẹp hai lá không thường thấy ở bệnh nhân không có tiền sử sốt do liên cầu.
Đáp án F: Giảm vận động thành dưới đặc trưng cho nhồi máu cơ tim thành dưới, cái không thường thấy trong tình trạng không có đau ngực. Ngoài ra, nhồi máu cơ tim thành dưới thường chủ yếu ảnh hưởng đến tâm thất phải và sẽ không gây phù phổi.
Đáp án G: Màng ngoài tim dày kèm tràn dịch khu trú có thể xảy ra do viêm ngoại tâm mạc do vi khuẩn, thường là một biến chứng của viêm phổi do virus không được điều trị. Bệnh nhân thường có tình trạng cấp tính với sốt cao, mạch nhanh, đau ngực.
Tổng kết: Bệnh viêm cơ tim là một nguyên nhân có thể gây giãn cơ tim ở những người trẻ. Bệnh nhân thường biểu hiện vs tình trạng suy tim mất bù cùng các tiền triệu như viêm đường hô hấp trên và nhiễm khuẩn đường ruột. Bệnh viêm cơ tim có thể dẫn đến bệnh cơ tim giãn với hình ảnh điển hình trên siêu âm tim là giãn các buồng tim cùng giảm vận động khuếch tán của thành tâm thất.
Câu 3
Nữ 30 tuổi tới khoa cấp cứu vì lơ mơ và đứng không vững thoáng qua trong 2 tuần này. Từ hôm qua, triệu chứng trở nên tệ hơn và có nhiều lần gần ngất. Bệnh nhân không đau ngực nhưng khó thở nhẹ. Tiền sử y khoa đáng kể bao gồm béo phì, hen gián đoạn, ho kéo mạn. Cô ta mắc viêm màng bồ đào 6 tháng trước được chữa trị nhãn khoa. Cô ta hiện không dùng thuốc gì và chỉ uống rượu trong một số dịp đặc biệt. Bệnh nhân không nuôi thú cưng và sống 1 vợ 1 chồng trong 3 năm nay.
Thăm khám thấy thân nhiệt 37,2 độ C; HA 126/76 mmHg mạch 36 l/ph và nhịp thở 16 l/ph. Không có tiếng thổi. ECG thấy nhịp xoang với BAV 2:1 và LBBB. Xquang ngực thấy đám mờ vùng giữa phổi hai bên. Chẩn đoán có khả năng nhất là gì?
- Bệnh mạch vành.
- Cường giáp.
- Bệnh Lyme.
- Sarcoidosis.
- Viêm cơ tim do virus.
Đáp án đúng là D: Bệnh nhân này có tiền sử viêm màng bồ đào có khó thở nhẹ và cơn tiền ngất 2 tuần nay nhiều khả năng có bất thường trong dẫn truyền với dấu hiệu mạch chậm đáng kể có BAV và LBBB. Cô ta nhiều khả năng bị Sarcoidosis có tổn thương tim.
Các nghiên cứu trên tử thi cho thấy bằng chứng của những u không bã đậu hóa tại tim ở trên 25% bệnh nhân mắc sarcoidosis. Tuy nhiên chỉ 5% bệnh nhân có triệu chứng tại tim, gợi ý Sarcoidosis tại tim thường không được chẩn đoán hoặc chỉ ở mức cận lâm sàng. Thâm nhiễm các khối u ko bã đậu hóa dẫn tới viêm xung quanh và có thể dẫn tới rối loạn dẫn truyền (BAV hoàn toàn thường thấy), bệnh cơ tim giới hạn (biểu hiện sớm), bệnh cơ tim giãn (biểu hiện muộn) mất chức năng van, suy tim. Chết do ngừng tim có thể xảy ra do BAV hoàn toàn hoặc loạn nhịp thất.
Sarcoidosis tại tim nên được nghi ngờ ở bất kỳ bệnh nhân trẻ nào (<55 tuổi) có BAV cấp 2 không giải thích được hoặc ECG thay đổi xảy ra ở bệnh nhân mà có các triệu chứng nghi ngờ Sarcoidosis (khó thở với các khối mờ tại phổi, viêm màng bồ đào). Dấu hiệu trên chẩn đoán hình ảnh, ECG, tiền sử có ý nghĩa lớn trong chẩn đoán. Chẩn đoán xác định có thể là thách thức do sinh thiết có độ nhậy kém.
Đáp án A: Bệnh mạch vành (CAD) có thể dẫn tới tổn thương dẫn truyền do thiếu máu và suy tim. Tuy nhiên CAD sẽ là bất thường tại bệnh nhân nữ trẻ này, có tiền sử viêm màng bồ đào nhiều khả năng mắc Sarcoidosis hơn.
Đáp án B: BAV có thể hiếm xảy ra ở cường giáp, nhưng mạch nhanh thường thấy hơn. Bệnh nhân mắc cường giáp có các triệu chứng khác như sụt cân, tăng thèm ăn, mệt mỏi, người nhiệt, và chúng không biểu hiện ở bệnh nhân này.
Đáp án C: Bệnh Lyme có thể xảy ra 1-2 tháng sau nhiễm khuẩn với con ve, và BAV là bất thường hay gặp nhất. Tuy nhiên sự thiếu cơn đau tại khớp và các giả ban làm chẩn đoán này là ít khả năng.
Đáp án Ê: Viêm cơ tim có triệu chứng đặc trưng với các biểu hiện suy tim như khó thở tăng dần, phù chi dưới và khó thở khi nằ. BAV với độ cao thường ít thấy.
Tổng kết: Sarcoidosis là bệnh do các khối u ko bã đậu hóa thâm nhiễm tại cơ tim và gây ra loạn nhịp nghiêm trọng, bệnh cơ tim, suy tim và ngừng tim đột ngột.
TÀI LIỆU THAM KHẢO
- Richardson P, McKenna W, Bristow M, et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the definition and classification of cardiomyopathies. Circulation 1996; 93: 841-2.
- Aretz HT. Myocarditis: the Dallas cri teria. Hum Pathol 1987; 18: 619-24.
- Cooper LT, Baughman KL, Feldman AM, et al. The role of endomyocardial bi opsy in the management of cardiovascu lar disease: a scientific statement from the American College of Cardiology and the European Society of Cardiology. En dorsed by the Heart Failure Society of America and the Heart Failure Associa tion of the European Society of Cardiolo gy. J Am Coll Cardiol 2007; 50: 1914-31.
- Leone O, Veinot JP, Angelini A, et al. 2011 consensus statement on endomyo cardial biopsy from the Association for European Cardiovascular Pathology and the Society for Cardiovascular Pathology. Cardiovasc Pathol 2012; 21: 245-74.
- Caforio AL, Pankuweit S, Arbustini E, et al. Current state of knowledge on aeti ology, diagnosis, management, and ther apy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Peri cardial Diseases. Eur Heart J 2013; 34: 2636-48.
- Seferović PM, Tsutsui H, McNamara DM, et al. Heart Failure Association of the ESC, Heart Failure Society of America and Japanese Heart Failure Society position statement on endomyocardial biopsy. Eur J Heart Fail 2021; 23: 854-71.
- Basso C, Calabrese F, Angelini A, Car turan E, Thiene G. Classification and his tological, immunohistochemical, and molecular diagnosis of inflammatory myocardial disease. Heart Fail Rev 2013; 18: 673-81.
- Friedrich MG, Sechtem U, Schulz Menger J, et al. Cardiovascular magnetic resonance in myocarditis: a JACC white paper. J Am Coll Cardiol 2009; 53: 1475-87.
- Ferreira VM, Schulz-Menger J, Holm vang G, et al. Cardiovascular magneticresonance in nonischemic myocardial inflammation: expert recommendations. J Am Coll Cardiol 2018; 72: 3158-76.
- Gargano JW, Wallace M, Hadler SC, et al. Use of mRNA COVID-19 vaccine af ter reports of myocarditis among vaccine recipients: update from the advisory com mittee on immunization practices — United States, June 2021. MMWR Morb Mortal Wkly Rep 2021; 70: 977-82.
- Sexson Tejtel SK, Munoz FM, Al-Am mouri I, et al. Myocarditis and pericar ditis: case definition and guidelines for data collection, analysis, and presenta tion of immunization safety data. Vaccine 2022; 40: 1499-511.
- Heymans S, Cooper LT. Myocarditis after COVID-19 mRNA vaccination: clini cal observations and potential mecha nisms. Nat Rev Cardiol 2022; 19: 75-7. 13. Roth GA, Mensah GA, Johnson CO, et al. Global burden of cardiovascular dis eases and risk factors, 1990–2019: update from the GBD 2019 study. J Am Coll Car diol 2020; 76: 2982-3021.
- Pahuja M, Adegbala O, Mishra T, et al. Trends in the incidence of in-hospital mortality, cardiogenic shock, and utiliza tion of mechanical circulatory support devices in myocarditis (analysis of national inpatient sample data, 2005–2014). J Card Fail 2019; 25: 457-67.
- Cooper LT Jr, Keren A, Sliwa K, Mat sumori A, Mensah GA. The global burden of myocarditis: part 1: a systematic litera ture review for the Global Burden of Dis eases, Injuries, and Risk Factors 2010 study. Glob Heart 2014; 9: 121-9.
- Charpentier S, Beaune S, Joly LM, et al. Management of chest pain in the French emergency healthcare system: the pro spective observational EPIDOULTHO study.Eur J Emerg Med 2018; 25: 404-10.
- Pasupathy S, Air T, Dreyer RP, Tavella R, Beltrame JF. Systematic review of pa tients presenting with suspected myocar dial infarction and nonobstructive coro nary arteries. Circulation 2015; 131: 861-70.
- Rizzo S, Carturan E, De Gaspari M, Pilichou K, Thiene G, Basso C. Update oncardiomyopathies and sudden cardiac death. Forensic Sci Res 2019; 4: 202-10.
- Mahmood SS, Fradley MG, Cohen JV, et al. Myocarditis in patients treated with immune checkpoint inhibitors. J Am Coll Cardiol 2018; 71: 1755-64.
- Ammirati E, Lupi L, Palazzini M, et al. Prevalence, characteristics, and outcomes of COVID-19-associated acute myocarditis. Circulation 2022; 145: 1123-39.
- Witberg G, Barda N, Hoss S, et al. Myocarditis after Covid-19 vaccination in a large health care organization. N Engl J Med 2021; 385: 2132-9.
- Mevorach D, Anis E, Cedar N, et al. Myocarditis after BNT162b2 mRNA vac cine against Covid-19 in Israel. N Engl J Med 2021; 385: 2140-9.
- Klein NP, Lewis N, Goddard K, et al. Surveillance for adverse events after COVID-19 mRNA vaccination. JAMA 2021; 326: 1390-9.
- Montgomery J, Ryan M, Engler R, et al. Myocarditis following immunization with mRNA COVID-19 vaccines in members of the US military. JAMA Cardiol 2021; 6:1202-6.
- Block JP, Boehmer TK, Forrest CB, et al. Cardiac complications after SARS CoV-2 infection and mRNA COVID-19 vaccination — PCORnet, United States, January 2021–January 2022. MMWR MorbMortal Wkly Rep 2022; 71: 517-23.
- Tschöpe C, Ammirati E, Bozkurt B, et al. Myocarditis and inflammatory car diomyopathy: current evidence and future directions. Nat Rev Cardiol 2021; 18: 169- 93.
- Maisch B. Cardio-immunology of myo carditis: focus on immune mechanisms and treatment options. Front Cardiovasc Med 2019; 6: 48.
- Bock CT, Klingel K, Kandolf R. Hu man parvovirus B19–associated myocar ditis. N Engl J Med 2010; 362: 1248-9.
- Elsanhoury A, Kühl U, Stautner B, et al. The spontaneous course of human herpesvirus 6 DNA-associated myocardi tis and the effect of immunosuppressive intervention. Viruses 2022; 14: 299.
- Kawai C. From myocarditis to cardio myopathy: mechanisms of inflammation and cell death: learning from the past forthe future. Circulation 1999;99:1091-100.
- Ammirati E, Frigerio M, Adler ED, et al. Management of acute myocarditis and chronic inflammatory cardiomyopa thy: an expert consensus document. Circ Heart Fail 2020;13(11):e007405.
- Basso C, Leone O, Rizzo S, et al. Path ological features of COVID-19-associated myocardial injury: a multicentre cardio vascular pathology study. Eur Heart J 2020; 41:3827-35.
- Nguyen LS, Cooper LT, Kerneis M, et al. Systematic analysis of drug-associated myocarditis reported in the World Health Organization pharmacovigilance database. Nat Commun 2022;13:25.
- Johnson DB, Balko JM, Compton ML, et al. Fulminant myocarditis with com bination immune checkpoint blockade. N Engl J Med 2016;375:1749-55.
- Schneider BJ, Naidoo J, Santomasso BD, et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: ASCO guideline update. J Clin Oncol 2021;39:4073-126.
- Kontorovich AR, Patel N, Moscati A, et al. Myopathic cardiac genotypes in crease risk for myocarditis. JACC Basic Transl Sci 2021;6:584-92.
- Bariani R, Cipriani A, Rizzo S, et al. ‘Hot phase’ clinical presentation in ar rhythmogenic cardiomyopathy. Europace 2021;23:907-17.
- Ader F, Surget E, Charron P, et al. In herited cardiomyopathies revealed by clinically suspected myocarditis: high lights from genetic testing. Circ Genom Precis Med 2020;13(4):e002744.
- Gil-Cruz C, Perez-Shibayama C, De Martin A, et al. Microbiota-derived pep tide mimics drive lethal inflammatorycardiomyopathy. Science 2019;366:881-6. 40. Peretto G, Sala S, Rizzo S, et al. Ar rhythmias in myocarditis: state of the art. Heart Rhythm 2019;16:793-801.
- Peretto G, Sala S, Rizzo S, et al. Ven tricular arrhythmias in myocarditis: char acterization and relationships with myo cardial inflammation. J Am Coll Cardiol2020;75:1046-57.
- Casella M, Bergonti M, Narducci ML, et al. Prior myocarditis and ventricular arrhythmias: the importance of scar pattern. Heart Rhythm 2021;18:589-96.
- Ammirati E, Cipriani M, Moro C, et al. Clinical presentation and outcome in a contemporary cohort of patients with acute myocarditis: multicenter Lombardy registry. Circulation 2018;138:1088-99.
- Greulich S, Seitz A, Müller KAL, et al. Predictors of mortality in patients with biopsy-proven viral myocarditis: 10-year outcome data. J Am Heart Assoc 2020; 9(16):e015351.
- Ammirati E, Cipriani M, Lilliu M, et al.Myocarditis Survival and left ventricular function changes in fulminant versus nonfulmi nant acute myocarditis. Circulation 2017; 136:529-45.
- Ammirati E, Veronese G, Brambatti M, et al. Fulminant versus acute nonful minant myocarditis in patients with left ventricular systolic dysfunction. J Am Coll Cardiol 2019;74:299-311.
- Cooper LT Jr, Berry GJ, Shabetai R; Multicenter Giant Cell Myocarditis Study Group Investigators. Idiopathic giant-cell myocarditis — natural history and treatment. N Engl J Med 1997;336:1860-6.
- Montero S, Aissaoui N, Tadié JM, et al. Fulminant giant-cell myocarditis on me chanical circulatory support: manage ment and outcomes of a French multicen tre cohort. Int J Cardiol 2018;253:105-12.
- Ekström K, Lehtonen J, Kandolin R, Räisänen-Sokolowski A, Salmenkivi K, Kupari M. Long-term outcome and its predictors in giant cell myocarditis. Eur J Heart Fail 2016;18:1452-8.
- Bang V, Ganatra S, Shah SP, et al. Management of patients with giant cell myocarditis: JACC review topic of the week. J Am Coll Cardiol 2021;77:1122-34.
- Brambatti M, Matassini MV, Adler ED, Klingel K, Camici PG, Ammirati E. Eosino philic myocarditis: characteristics, treat ment, and outcomes. J Am Coll Cardiol 2017;70:2363-75.
- Al-Khatib SM, Stevenson WG, Acker man MJ, et al. 2017 AHA/ACC/HRS guide line for management of patients with ven tricular arrhythmias and the preventionof sudden cardiac death: a report of the American College of Cardiology/Ameri can Heart Association Task Force on clin ical practice guidelines and the Heart Rhythm Society. Circulation 2018;138(13): e272-e391.
- Nery PB, Beanlands RS, Nair GM, et al. Atrioventricular block as the initial manifestation of cardiac sarcoidosis in middle-aged adults. J Cardiovasc Electrophysiol 2014;25:875-81.
- Nery PB, Mc Ardle BA, Redpath CJ, et al. Prevalence of cardiac sarcoidosis in patients presenting with monomorphic ventricular tachycardia. Pacing Clin Electrophysiol 2014;37:364-74.
- Rosner CM, Genovese L, Tehrani BN, et al. Myocarditis temporally associated with COVID-19 vaccination. Circulation 2021;144:502-5.
- Oster ME, Shay DK, Su JR, et al. Myo carditis cases reported after mRNA-based COVID-19 vaccination in the US from De cember 2020 to August 2021. JAMA 2022; 327:331-40.
- Salem JE, Manouchehri A, Moey M, et al. Cardiovascular toxicities associated with immune checkpoint inhibitors: an observational, retrospective, pharmacovigilance study. Lancet Oncol 2018;19: 1579-89.
- Luetkens JA, Faron A, Isaak A, et al.Comparison of original and 2018 Lake Louise criteria for diagnosis of acute myo carditis: results of a validation cohort. Radiol Cardiothorac Imaging 2019;1(3): e190010.
- Aquaro GD, Ghebru Habtemicael Y, Camastra G, et al. Prognostic value of repeating cardiac magnetic resonance in patients with acute myocarditis. J Am Coll Cardiol 2019;74:2439-48.
- Gräni C, Eichhorn C, Bière L, et al. Prognostic value of cardiac magnetic res onance tissue characterization in risk stratifying patients with suspected myo carditis. J Am Coll Cardiol 2017;70:1964- 76.
- Caforio AL, Calabrese F, Angelini A, et al. A prospective study of biopsy-proven myocarditis: prognostic relevance of clin ical and aetiopathogenetic features at diagnosis. Eur Heart J 2007;28:1326-33. 62. Waliany S, Neal JW, Reddy S, et al. Myocarditis surveillance with high-sensi tivity troponin I during cancer treatment with immune checkpoint inhibitors. JACC CardioOncol 2021;3:137-9.
- Goldberg L, Tirosh-Wagner T, Vardi A, et al. Circulating microRNAs: a poten tial biomarker for cardiac damage, in flammatory response, and left ventricular function recovery in pediatric viral myo carditis. J Cardiovasc Transl Res 2018;11: 319-28.
- Heidecker B, Kittleson MM, Kasper EK, et al. Transcriptomic biomarkers for the accurate diagnosis of myocarditis. Circulation 2011;123:1174-84.
- Blanco-Domínguez R, Sánchez-Díaz R, de la Fuente H, et al. A novel circulat ing microRNA for the detection of acute myocarditis. N Engl J Med 2021;384:2014- 27.
- Yancy CW, Jessup M, Bozkurt B, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines and the Heart Failure Society of America. Circula tion 2017;136(6):e137-e161.
- McDonagh TA, Metra M, Adamo M, et al. 2021 ESC guidelines for the diagno sis and treatment of acute and chronic heart failure: developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the spe cial contribution of the Heart Failure As sociation (HFA) of the ESC. Eur J Heart Fail 2022;24:4-131.
- Priori SG, Blomström-Lundqvist C, Mazzanti A, et al. 2015 ESC guidelines for the management of patients with ventric ular arrhythmias and the prevention of sudden cardiac death: the Task Force for the management of patients with ventric ular arrhythmias and the prevention of sudden cardiac death of the European Son engl j med 387;16 nejm.org October 20, 2022 1499
- Asaumi Y, Yasuda S, Morii I, et al. Fa vourable clinical outcome in patients with cardiogenic shock due to fulminant myo carditis supported by percutaneous extra corporeal membrane oxygenation. Eur Heart J 2005;26:2185-92.
- Kociol RD, Cooper LT, Fang JC, et al. Recognition and initial management of fulminant myocarditis: a scientific state ment from the American Heart Association. Circulation 2020;141(6):e69-e92.
- Tschöpe C, Van Linthout S, Klein O, et al. Mechanical unloading by fulmi nant myocarditis: LV-IMPELLA, ECMELLA, BI-PELLA, and PROPELLA concepts. J Car diovasc Transl Res 2019;12:116-23.
- Pelliccia A, Solberg EE, Papadakis M, et al. Recommendations for participation in competitive and leisure time sport in athletes with cardiomyopathies, myocar ditis, and pericarditis: position statement of the Sport Cardiology Section of the Eu ropean Association of Preventive Cardiol ogy (EAPC). Eur Heart J 2019;40:19-33.
- Maron BJ, Udelson JE, Bonow RO, et al. Eligibility and disqualification recommen dations for competitive athletes with car diovascular abnormalities: Task Force 3: hypertrophic cardiomyopathy, arrhythmo genic right ventricular cardiomyopathyMyocarditis and other cardiomyopathies, and myocar ditis: a scientific statement from the American Heart Association and Ameri can College of Cardiology. Circulation 2015;132(22):e273-e280.
- Kandolin R, Lehtonen J, Salmenkivi K, Räisänen-Sokolowski A, Lommi J, Ku pari M. Diagnosis, treatment, and out come of giant-cell myocarditis in the era of combined immunosuppression. Circ Heart Fail 2013;6:15-22.
- Salem JE, Allenbach Y, Vozy A, et al. Abatacept for severe immune checkpoint inhibitor–associated myocarditis. N Engl J Med 2019;380:2377-9.
- Mason JW, O’Connell JB, Herskowitz A, et al. A clinical trial of immunosup pressive therapy for myocarditis. N Engl J Med 1995;333:269-75.
- Frustaci A, Russo MA, Chimenti C. Randomized study on the efficacy of im munosuppressive therapy in patients with virus-negative inflammatory cardiomyop athy: the TIMIC study. Eur Heart J 2009; 30:1995-2002.
- Escher F, Kühl U, Lassner D, et al. Long-term outcome of patients with virus negative chronic myocarditis or inflam matory cardiomyopathy after immuno suppressive therapy. Clin Res Cardiol 2016;105:1011-20.
- Merken J, Hazebroek M, Van Paassen P, et al. Immunosuppressive therapy im proves both short- and long-term prognosis in patients with virus-negative nonful minant inflammatory cardiomyopathy. Circ Heart Fail 2018;11(2):e004228.
- Veronese G, Ammirati E, Brambatti M, et al. Viral genome search in myocar dium of patients with fulminant myocar ditis. Eur J Heart Fail 2020;22:1277-80.
- Felix SB, Staudt A, Dörffel WV, et al. Hemodynamic effects of immunoadsorp tion and subsequent immunoglobulin substitution in dilated cardiomyopathy: three-month results from a randomized study. J Am Coll Cardiol 2000;35:1590-8.
- Amabile N, Fraisse A, Bouvenot J, Chetaille P, Ovaert C. Outcome of acute fulminant myocarditis in children. Heart 2006;92:1269-73.
- Schultheiss H-P, Piper C, Sowade O, et al. Betaferon in chronic viral cardiomy opathy (BICC) trial: effects of interferon-β treatment in patients with chronic viral cardiomyopathy. Clin Res Cardiol 2016; 105:763-73.
- Kühl U, Lassner D, von Schlippenbach J, Poller W, Schultheiss H-P. Interferon beta improves survival in enterovirus associated cardiomyopathy. J Am Coll Cardiol 2012;60:1295-6.
- Ammirati E, Bizzi E, Veronese G, et al. Immunomodulating therapies in acute myocarditis and recurrent/acute pericar ditis. Front Med (Lausanne) 2022;9: 838564.
