Sản xuất Dược phẩm
Ứng dụng công nghệ nano trong sản xuất thuốc
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: PGS.TS. Nguyễn Ngọc Chiến, ThS. Hồ Hoàng Nhân
Bài viết Ứng dụng công nghệ nano trong sản xuất thuốc được trích trong chương 4 sách Công nghệ nano và ứng dụng trong sản xuất thuốc – Bộ môn Công nghiệp Dược – Trường Đại học Dược Hà Nội.
MỤC TIÊU HỌC TẬP
- Trình bày được các ứng dụng của công nghệ nano trong bào chế thuốc tiêm, thuốc dùng đường uống, thuốc nhãn khoa, thuốc dùng ngoài da và thuốc cho đường dùng khác.
- Trình bày được tiêu chuẩn chất lượng của một số dạng thuốc chữa tiểu phân nano.
1. BÀO CHẾ THUỐC TIÊM
1.1. Các loại tiểu phân nano dùng bào chế thuốc tiêm
Để bào chế thuốc tiêm, nano tinh thể, nano polyme, nano lipid đều có thể được phối hợp vào các dạng thuốc sử dụng cho đường tiêm. Các tiểu phân sau khi được bào chế với kích thước nano bằng các phương pháp thích hợp như đã đề cập ở chương 2 sẽ được đưa vào các dạng thuốc như hỗn dịch, hoặc bột đông khô để pha tiêm.
Bảng 4.1. Các dạng bào chế chứa tiểu phân nano sử dụng đường tiêm
| Hoạt chất | Dạng bào chế | Đường dùng | Tác dụng |
| Progesterone | Gel nhạy cảm bởi nhiệt chứa hỗn dịch nano liqid rắn | Tiêm bắp ở chuột | Giúp kéo dài tác dụng và an toàn hơn progesteron tổng hợp |
| Paclitaxel | Bột đông khô chứa nano tinh thể | Tiêm tĩnh mạch ở chuột | Tăng các thông số dược động học so với dung dịch paclitaxel và Taxol |
| dẫn xuất p-terphenyl (H2) | Bột đông khô chứa nano tinh thể | Tiêm tĩnh mạch ở chuột | Tăng các thông số dược động học so với dung dịch H2 |
| Bexarotene | Bột đông khô cứa nano tinh thể | Tiêm tĩnh mạch ở chuột | Tăng sinh khả dụng so với nano dùng đường uống |
| All-trán acid retinoic | Hỗn dịch chứa hệ NLC | Tiêm tĩnh mạch ở chuột | Tăng khả năng ức chế tế bào ung thư |
| Docetaxel | Bột đông khô chứa hệ NLC | Tiêm tĩnh mạch ở chuột | Tăng khả năng ức chế khối u |
| Docetaxel | Bột đông khô chứa nano tinh thể | Tiêm tĩnh mạch ở chuộtTiêm tĩnh mạch ở chuột | Tăng khả năng ức chế khối u |
| Gemcitabin, Paclitaxel | Bột đông khô chứa nano polyme | Đường tiêm | Tăng khả năng ức chế khối u, tác dụng kéo dài |
| Amphotericin B | Hỗn dịch chứa phức hợp với lipid (dạng đĩa) | Tiêm tĩnh mạch | Tăng khả năng điều trị nấm toàn thân |
Đối với các tiêu phấn PLGA sử dụng đường tiêm, chế phẩm Eligard (Tolmar Therapeutics, Inc., Mỹ) chứa các tiểu phân micro leuprolid acetat với chất mang PLGA đã được dùng trong điều trị ung thư tiền liệt tuyến theo đường tiêm dưới da. Trong đó, các thành phần được đưa vào trong hai xylanh khác nhau và chỉ được trộn lẫn thành hỗn hợp đồng nhất ngay trước khi sử dụng. Sau khi tiêm Eligard dưới da, nó sẽ hình thành một hệ phân phối thuốc dạng khối rắn. Trong hai xylanh thì một xylanh chứa hệ đưa thuốc Atrigelo® và một xylanh chứa bột leuprolid acetat. Atrigel® là một hệ phân phối thuốc chứa PLGA được hòa tan trong dung môi N-methyl-2-pyrrolidon (NMP). Các chế phẩm này có thời gian tác dụng rất kéo dài, do đó chỉ cần dùng sau 1-6 tháng, tùy thuộc vào hàm lượng dược chất. Các thành phần của từng chế phẩm Eligard có thể tóm tắt như bảng dưới đây:
Bảng 2. Các thành phần trong chế phẩm Eligard
| Eligard® 7,5 mg | Eligard® 22,5 mg | Eligard® 30 mg | Eligard® 45mg | ||
| Xylanh chứa hệ Atrigel | Polyme | PLGA | PLGA | PLGA | PLGA |
| Đặc điểm polyme | Copolyme với nhóm carboxyl cuối | Copolyme với hexanediol | Copolyme với hexanediol | Copolyme với hexanediol | |
| Tỷ lệ PLA:PGA | 50:50 | 75:25 | 75:25 | 85:15 | |
| Tỷ lệ các thành phần | Polyme | 82,5 mg | 158,6 mg | 211,5 mg | 165 mg |
| NMP | 160,0 mg | 193,9 mg | 258,5 mg | 165 mg | |
| Leuprolid acetat | 7,5 mg | 22,5 mg | 30 mg | 45 mg | |
| Khối lượng tổng | 250 mg | 375 mg | 500 mg | 375 mg | |
| Thể tích tiêm | 0,25 ml | 0,375 ml | 0,5 ml | 0,375 ml | |
Tương tự, đối với chế phẩm Trelstar (Debio RP, Thụy Sỹ) chứa các tiểu phân micro triptorelin pamoat với chất mang PLGA cũng đã được dùng trong điều trị ung thư tiền liệt tuyến theo đường tiêm bắp. Trong đó, chế phẩm dưới dạng bột đông khô sẽ được phân tán lại thành hỗn dịch micro bằng nước pha tiêm ngay trước khi tiêm. Che phẩm sẽ bao gồm một bộ nối Mixject để gắn với lọ chứa thuốc bột đông khô và bơm tiêm chứa sẵn nước pha tiêm. Các chế phẩm này có thời gian tác dụng rất kéo dài, do đó chỉ cần dùng sau 4-24 tuần, tùy thuộc vào hàm lượng dược chất. Thành phần của lọ thuốc bột đông khô của từng chế phẩm Trelstar như sau:
Bảng 3. Các thành phần của bột đông khô trong từng chế phẩm Trelstar
| Thành phần | Trelstar 3,75 mg | Trelstar 11,25 mg | Trelstar 22,5 mg |
| Triptorelin pamoat (ứng với dạng base) | 3,75 mg | 11,25 mg | 22,5 mg |
| PLGA | 136 mg | 118 mg | 182 mg |
| Manitol | 69 mg | 76 mg | 68 mg |
| Natri carboxymethylcellulose | 24 mg | 27 mg | 24 mg |
| Polysorbat 80 | 1,6 mg | 1,8 mg | 1,6 mg |
Do vậy, ngoài các hệ micro sử dụng chất mang PLGA kể trên, các nano PLGA đã và đang thu hút rất nhiều nghiên cứu, đồng thời rất có triển vọng để có thể ứng dụng trong sản xuất thuốc tiêm.
1.2. Các dạng bào chế chứa tiểu phân nano dùng cho đường tiêm
Đối với tiểu phân nano dùng cho đường tiêm, có thể dùng dưới hai dạng hỗn dịch và bột đông khô.
Hỗn dịch nano có thể được tiêm qua nhiều đường khác nhau như tiêm vào khớp, màng bụng cho đến tiêm tĩnh mạch. Đặc biệt, đối với trường hợp tiêm tĩnh mạch, yêu cầu số lượng tiểu phân micro phải ít, cụ thể là giới hạn số lượng các tiểu phân có kích thước lớn hơn các mao mạch nhỏ nhất (5-6 μm). Do đó, có hai cách để thực hiện việc này:
– Bào chế nano và tiến hành lọc qua màng lọc 5 μm.
– Bào chế nano trong quy trình một giai đoạn tạo ra sản phẩm có độ đồng nhất cao với số lượng tối thiểu các tiêu phân micro.
Hỗn dịch nano bào chế bằng cách phân tán tiểu phân nano trong dung dịch natri clorid đẳng trương hoặc có thêm chất ổn định để hạn chế kết tập tiểu phân trong quá trình bảo quản. Một số hỗn dịch thu được ngay trong quá trình bào chế nano. Hỗn dịch nano bền vững, không sa lắng, có thể được lọc loại khuẩn, khi tiêm tĩnh mạch không có nguy cơ gây tắc mạch.
Bột đông khô thường có khả năng bị kết tụ tiểu phân trong quá trình bào chế, do vậy cần được phân tán lại kỹ trước khi dùng. Để hạn chế khả năng kết tụ, tăng độ ổn định của sản phẩm, thường phải kết hợp các tá dược tạo khung như các loại đường trong quá trình đông khô. Tiến hành đông khô với dung dịch chất tạo khung đã lọc loại khuẩn như saccarose, manitol, trehalose, glucose, lactose, dextran với tỉ lệ từ 1-20% (w/v) và các tá dược khác (nếu cần) để thu sản phẩm.
Ngoài hai dạng hỗn dịch và bột đông khô, tiểu phân nano dùng cho đường tiêm còn có thể bào chế dưới dạng bột phun sấy. So với quá trình đông khô, quá trình phun sấy là phương pháp làm khô nhanh hơn, kinh tế hơn, gồm một giai đoạn và có thể thiết kế dưới dạng một quy trình liên tục. Kỹ thuật phun sấy đã thu hút rất nhiều nghiên cứu về thiết kế công thức các hệ đưa thuốc kiểm soát giải phóng có kích thước micro hoặc nano. Bằng việc áp dụng các công nghệ mới như sử dụng thiết bị Nano spray Dryer B-90 (Buchi, Thụy Sỹ), có thể giúp thiết kế công thức chứa các hợp chất nhạy cảm bởi nhiệt như protein, men, với KTTP thu được trong khoảng 200 nm – 5 μm. Đối với việc bào chế các hệ đưa thuốc vô khuẩn chứa các tiểu phân dùng cho đường tiêm, phương pháp phun sấy này có thuận lợi do có thể được thực hiện trong điều kiện vô khuẩn đồng thời thiết bị có thể dễ dàng vệ sinh, tiệt khuẩn, cũng như không khí đầu vào có thể lọc vô khuẩn.
Ví dụ, Mizoe và cộng sự (2007) đã nghiên cứu bào chế tiểu phân micro chứa nano pranlukast hemihydrat (PLH) bằng thiết bị phun sấy với đầu phun gồm 4 đường cấp liệu, trong đó có 2 đường cấp khí và 2 đường cho dung dịch mẫu. Cụ thể, PLH được hòa tan ở tỉ lệ 0,83% (kl/tt) trong hỗn hợp dung môi natri bicarbonat 50 mM và ethanol (tỉ lệ 1:1), manitol được hòa tan trong nước ở tỉ lệ 3,33% và 8,83% (kl/tt). Quá trình phun sấy được thực hiện với các thông số như nhiệt độ đầu vào là 90°c, nhiệt độ đầu ra từ 40°c đến 45°c, tốc độ cấp dịch PLH và manitol là 5 ml/phút, tốc độ phun khí là 30 1/phút, áp suất phun khí là 8 kgf/cm2. Kết quả thu được các tiểu phân micro có kích thước khoảng 3 μm chứa các tiểu phân nano sau khi phân tán lại có KTTP lần lượt là 270 nm và 200 nm với công thức có PLHrMAN với tỉ lệ 1:4 và 1:10.
1.3. Bào chế thuốc tiêm chứa tiểu phân nano
1.3.1. Bào chế thuốc tiêm hỗn dịch nano
Việc bào chế hỗn dịch nano với tá dược là polyme hay lipid có thể thực hiện bằng các phương pháp có năng lượng thấp hay năng lượng cao. Trong quá trình bào chế tiểu phân nano cần sử dụng các chất bổ trợ như dung môi, hoặc các chất cần cho quá trình polyme hóa, do đó, sau khi bào chế xong, hỗn dịch nano tạo thành thường phải tiến hành quá trình tinh chế. Ngoài ra, các phương pháp bào chế thường chỉ tạo các hỗn dịch có nồng độ tiểu phân thấp (như phương pháp kết tủa) nên các kỹ thuật cô đặc mẫu cần được tiến hành. Một số phương pháp có thể áp dụng như cô quay, ly tâm, các kỹ thuật lọc khác (như lọc màng, lọc tiếp tuyến). Tuy nhiên, khi sử dụng các kỹ thuật tinh chế/cô đặc mẫu này, cần thận trọng để tránh ảnh hưởng chất lượng của tiểu phân nano (như khả năng kết tụ khi ly tâm hoặc hao hụt dược chất ở giai đoạn rửa).
Hỗn dịch nano để pha tiêm cần phải vô khuẩn. Tiệt khuẩn bằng hơi nước là phương pháp thường quy được sử dụng đối với các chế phẩm lỏng, tuy nhiên, thường không thể áp dụng trong trường hợp này do những tác động tiêu cực đến độ ôn định cua polyme và/hoặc các tiểu phân nano. Tiệt khuẩn bằng các tia bức xạ thường dẫn đến những thay đổi về khối lượng phân tử, cụ thể là do sự cắt mạch, mặc dù ứng dụng thành công của phương pháp này đã được giới thiệu. Ngoài kỹ thuật pha chế vô khuẩn, lọc vô khuẩn thường là kỹ thuật hứa hẹn duy nhất nhưng chỉ phù hợp đôi với các tiêu phân có kích thước đủ nhỏ.
1.3.2. Bào chế bột pha tiêm chứa tiểu phân nano
Để ngăn cản sự mất ổn định vật lý, cụ thể sự mất ổn định hóa học của các hỗn dịch nano (như sự thủy phân của các polyme như PLGA), chúng cần được chuyển sang trạng thái khô sau khi bào chế xong như bột đông khô hoặc bột phun sấy.
a. Bột phun sấy
Quá trình phun sấy cũng là một quá trình làm khô có thể xem xét để thay thế quá trình đông khô. Trong đó, các thông số như đường kính vòi phun, nhiệt độ bốc hơi, khả năng bay hơi của dung môi, sẽ ảnh hưởng đến KTTP của bột phun sấy.
Ngoài việc tăng độ ổn định, quá trình làm khô cũng giúp làm tăng nồng độ dược chất thường thấp của hỗn dịch nano gốc bởi vì các sản phẩm đã được làm khô có thê phân tán lai với môt thể tích chất lỏng nhỏ hơn để thu được hỗn dịch có nồng độ cao hơn.
b. Bột đông khô
Để chuyển hỗn dịch nano sang trạng thái khô, đông khô là phương pháp thường được sử dụng. Trong quá trình này, thường cần phải thêm các tá dược như tá dược tạo khung (thường là một loại đường như trehalose, saccarose hay manitol). Loại và nồng độ của tá dược này cần phải khảo sát để thu được thông số tối ưu cho quy tnnh đông khô.
Ở dưới dạng bột đông khô, chế phẩm khi cần sử dụng mới được phân tán trong môi trường lỏng. Ở dạng này, các tiểu phân được phân tán đều và cố định trên tá dược tạo khung trong môi trường khô nên hạn chế được hiện tượng kết tụ. Hơn nữa, bề mặt và cấu trúc của tiểu phân không bị tác động bởi pH và các ion có mặt trong mô i trường, các chất mang sử dụng kết hợp trong tiểu phân ít có nguy cơ biến đổi.
Ví dụ sau sẽ trình bày tóm tắt nghiên cứu về quy trình sản xuât bột đông khô pha tiêm chứa nano artesunat (ART).
Các giai đoạn chính bào chế bột đông khô ART như sau:
– Bước 1: bào chế nano ART sử dụng PLGA và PEG bằng phương pháp nhũ hóa – bốc hơi dung môi, với phương pháp bào chế được mô tả như sau:
PLGA, PLGA-PEG (từ 10 – 100% so với tổng lượng polyme PLGA là 50 mg) và dược chất ART (10% – 50% so với tổng lượng polyme) được hòa tan trong 5 ml dicloromethan (DCM). Hỗn hợp sau đó được nhỏ giọt từ từ bằng micropipet vào dung dịch Tween 80 (0,5% – 2,0%), đồng nhất bằng siêu âm (Sonics & Materials, Inc., Mỹ) ở công suất 100 w trong 5 phút (nhịp xung bằng 0), duy trì nhiệt độ 5 – 10°C bằng bể nước đá bên ngoài kết hợp khuấy từ. Nhũ tương thu được tiếp tục được khuấy từ trong 4 giờ ở nhiệt độ phòng. Hỗn dịch nano sau đó được tinh chế bằng cột lọc tiếp tuyến.
– Bước 2: sử dụng cột lọc tiếp tuyến có màng lọc kích thước 50 kDa (Cột polystyren 50kDa, MicroKros, SpectrumLabs, loại chưa tiệt khuẩn ký hiệu C02-S050- 05-N). Hỗn dịch được bơm tuần hoàn qua cột với tốc độ 70 vòng/phút kết hợp điều chỉnh áp suất cột bằng cách di chuyển con lăn. Áp suất trong lòng cột sẽ đẩy nước kéo các chất tan thấm qua màng lọc theo chiều vuông góc với dòng chảy, nano ART/PLGA- PEG không đi qua màng sẽ liên tục chạy qua cột. Quy trình tinh chế bằng cột lọc tiếp tuyến được thực hiện tiếp tục đến khi thu được khoảng 15 ml hỗn dịch đặc như hình 4.1.
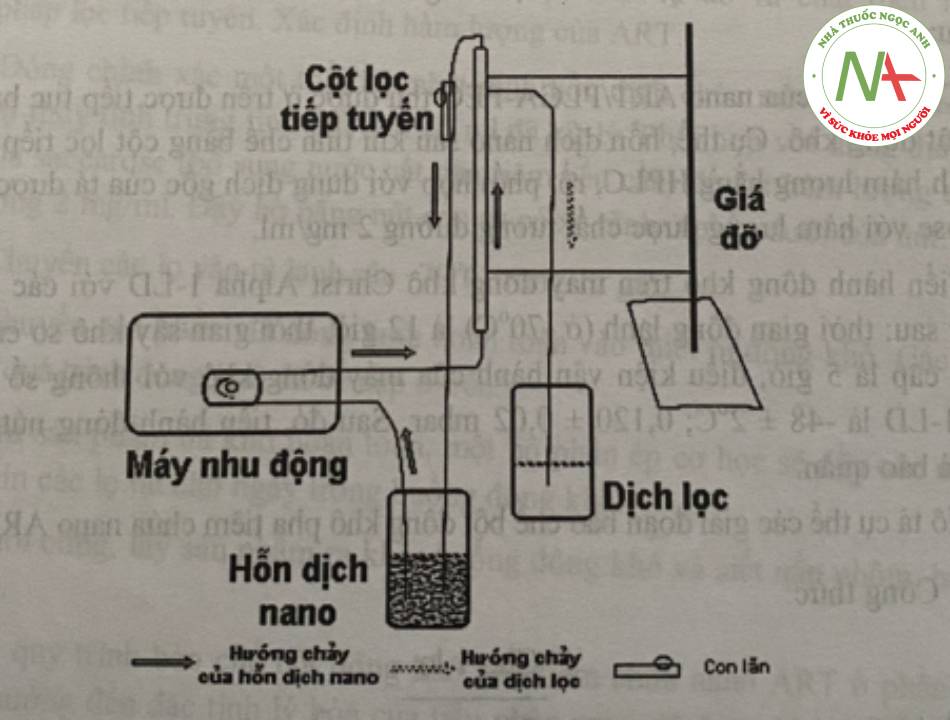
Quy trình bào chế được mô tả như hình 2:
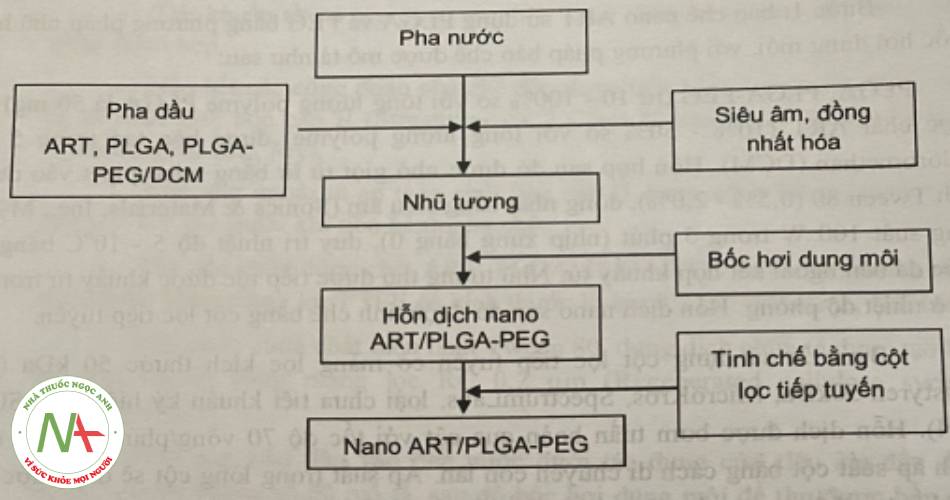
– Bước 3: tiến hành bào chế bột đông khô chứa nano ART với các bước cụ thể như sau:
Công thức của nano ART/PLGA-PEG thu được ở trên được tiếp tục bào chế dưới dạng bột đông khô. Cụ thể, hỗn dịch nano sau khi tinh chế bằng cột lọc tiếp tuyến được xác định hàm lượng bằng HPLC, rồi phối hợp với dung dịch gốc của tá dược tạo bánh là saccarose với hàm lượng dược chất tương đương 2 mg/ml.
Tiến hành đông khô trên máy đông khô Christ Alpha 1-LD với các thông số cụ thể như sau: thời gian đông lạnh (ở -70°C) là 12 giờ, thời gian sấy khô sơ cấp là 48 giờ, sấy thứ cấp là 5 giờ, điều kiện vận hành của máy đông khô với thông số cố định của model 1-LD là -48 ± 2°C; 0,120 ± 0,02 mbar. Sau đó, tiến hành đóng nút cao su, nắp nhôm và bảo quản.
Mô tả cụ thể các giai đoạn bào chế bột đông khô pha tiêm chứa nano ART như sau.
– Công thức: Cho 1 lọ
Artesunat: 20 mg
Polyme: PLGA 45%, PLGA-PEG 55%
Saccarose: 1,0 g
Nước cất vừa đủ: 10 ml
– Mô tả quá trình bào chế:
+ Tiệt khuẩn tất cả các dụng cụ, thiết bị sử dụng trong bào chế bằng các phương pháp thích hợp.
+ Hầu hết các công đoạn pha chế đều được tiến hành trong điều kiện vô khuẩn ở tủ an toàn sinh học cấp II (Streamline SC2 Class II Biological Safety Cabinets, Esco Technologies, Inc., Mỹ).
+ Khu vực ngoài tủ an toàn sinh học cấp II được xử lý bằng ethanol 70° và bật đèn ƯV 6-8 giờ trước khi tiến hành pha chế.
+ Pha dầu chứa dược chất ART, PLGA, PLGA-PEG và diclorometan sẽ được lọc loại khuẩn bằng màng lọc PTFE có kích thước lỗ lọc 0,2 μm (Finetech, Đài Loan).
+ Pha nước chứa chất diện hoạt Tween 80, dung dịch chứa tá dược tạo bánh được lọc loại khuẩn bằng màng lọc RC 0,2 μm (Regenerated cellulose syringe filter, Sartorius, Đức).
+ Phối hợp pha dầu vào pha nước dưới tác dụng của siêu âm đầu dò tạo nhũ tương với các thông số đã mô tả, sau đó bốc hơi dung môi để thu được hỗn dịch nano. Tinh chế hỗn dịch nano để loại bớt nước, dược chất tự do và chất diện hoạt bằng phương pháp lọc tiếp tuyến. Xác định hàm lượng của ART.
+ Đóng chính xác một thể tích nhất định hỗn dịch chứa nano ART sau khi tinh chế vào lọ thủy tinh trung tính thể tích 20 ml đã xử lý. Phối họp với dung dịch tá dược tạo bánh là saccarose (bổ sung nước cất pha tiêm nếu cần) để đạt hàm lượng dược chất tương đương 2 mg/ml. Đậy hờ bằng nút cao su có xẻ rãnh ở phần dưới của nút.
+ Chuyển các lọ vào tủ lạnh sâu -70°C trong 12 giờ.
+ Chuyển sản phẩm đã đông lạnh hoàn toàn vào thiết bị đông khô. Các thông số cụ thể của quá trình đông khô đã đề cập ở trên.
+ Khi sản phẩm đã khô hoàn toàn, một bộ phận ép cơ học sẽ đẩy các nút cao su làm đóng kín các lọ tại chỗ ngay trong buồng đông khô.
+ Cuối cùng, lấy sản phẩm ra khỏi buồng đông khô và siết nắp nhôm, hoàn thiện thành phẩm.
Trong quy trình bào chế bột đông khô pha tiêm chứa nano ART ở phần trên, các yếu tố ảnh hưởng đến đặc tính lý hóa của tiểu phân nano đã được khảo sát bao gồm các thông sô thuộc công thức như hàm lượng dược chất, tỉ lệ polyme, tỉ lệ pha dầu và pha nước, tỉ lệ tá dược tạo bánh, hàm lượng dược chất trước khi đông khô,… và các thông số thuộc quy trinh như cường độ siêu âm, thiết bị và quy trình tinh chế, quy trình đông khô.
Bột đông khô chứa nano ART sẽ được phân tán lại trong dung môi như nước cất pha tiêm với đường dùng dự kiến là đường tiêm tĩnh mạch.
1.4. Đánh giá các chỉ tiêu chất lượng thuốc tiêm chứa tiểu phân nano
1.4.1. Chỉ tiêu chất lượng
Chỉ tiêu chất lượng thuốc tiêm chứa tiểu phẫn nano bao gồm các chỉ tiêu chất lượng chung của thuốc tiêm và các chỉ tiêu chất lượng đặc thù của tiểu phẫn nano.
Do đó, các chế phẩm thuốc tiêm cần phải đạt các chỉ tiêu chất lượng chung của thuốc tiêm như hình thức, độ vô khuẩn, nội độc tố vi khuẩn, độ đồng đều khối lượng, độ đồng đều hàm lượng,…
Ngoài ra, đối với các chế phẩm thuốc tiêm chứa tiểu phẫn nano, các tính chất của tiểu phân nano cần được cung cấp như KTTP, phân bố KTTP, hình thái tiểu phân, đặc tính và chức năng bề mặt của tiểu phân, thành phần và độ tinh khiết, khả năng giải phóng dược chất,…
– Về tiêu chuẩn chất lượng của bột đông khô pha tiêm chứa nano ART trong mục 1.3, bao gồm các tính chất của hệ tiểu phẫn nano và các tính chất của dạng thuốc. Cụ thể như sau:
.
Bảng 4. Tiêu chuẩn cơ sở của bột đông khô pha tiêm chứa nano ART
| Chỉ tiêu | Dự kiến tiêu chuẩn |
| Tính chất của bánh thuốc trước phân tán tại | Bánh thuốc màu trắng, xốp |
| Tính chất của bánh thuốc sau khi phân tán tại | Hỗn dịch màu trắng đục, không lắng cặn, đồng nhất |
| Kích thước tiểu phân (nm)
Chỉ số đa phân tán (PDI) |
Dưới 220 nm
Dưới 0,300 |
| Độ đồng đều khối lượng | ± 10% so với khối lượng trung bình bột trong lọ |
| Tỷ lệ dược chất giải phóng theo thời gian (qua màng thẩm tích 10kDa, pH 7,4) | 1 giờ: dưới 15%
2 giờ: 15-25% 4 giờ: 25-35% |
| Tỷ lệ ART nano hóa (%) | Không ít hơn 90% so với lượng ghi trên nhãn |
| Hàm ẩm (%) | Không quá 3% (kl/kl) |
| pH của hỗn dịch sau khi pha lại | pH trong khoảng 3,5-4,5 |
| Định tính | Có mặt artesunat |
| Tạp chất liên quan | Phải đạt quy định |
| Định lượng | Từ 90,0% đến 1110,0% so với lượng ghi trên nhãn |
| Độ vô khuẩn | Thuốc phải vô khuẩn |
| Nội độc tố | Phải đạt quy định |
| Tồn dư dung môi | Diclorometan tồn dư không quá 60 ppm |
1.4.2. Phương pháp đánh giả
Các phương pháp đánh giá một số đặc tính lý hóa của tiểu phân nano như KTTP và phân bố KTTP, điện tích bề mặt, hình thái cấu trúc hạt, thành phần, tương tác hóa học và trạng thái kết tinh, khả năng nạp thuốc, hiệu suất nano hóa và khả năng giải phóng thuốc in vitro đã được trình bày trong bài Các phương pháp đánh giá tiểu phân nano về đặc tính lý hóa và tác dụng sinh học.
Áp dụng đối với bột đông khô pha tiêm chứa nano ART trong mục 1.3. các phương pháp đánh giá một số tính chất của tiểu phân nano được trình bày cụ thể như sau:
KTTP và PDI của tiểu phân sau khi đông khô
Bột đông khô sau khi phân tán lại bằng nước cất 2 lần và tiến hành pha mẫu và đo KTTP tương tự các bước ở phần đo KTTP và phân bố KTTP của nano ART.
Hình thái của tiểu phân sau khỉ sau khi đông khô
Hỗn dịch sau khi phân tán lại được tiến hành ly tâm bằng ống ly tâm gắn màng siêu lọc kích thước 10 kDa, tốc độ ly tâm 5000 vòng/phút (2879 xg) trong 30 phút, nhiệt độ 10°c trên máy ly tâm lạnh (Hermle Labortechnik GmbH, Đức). Sau đó, tiến hành rửa cắn 3 lần với 3 ml nước/lần để loại tá dược tạo bánh. Hỗn dịch cuối cùng được sử dụng để đo hình thái tiểu phân bằng phương pháp kính hiển vi điện tử quét SEM.
– Sử dụng kính hiển vi điện tử quét SEM
Tiến hành: pha loãng hỗn dịch đặc chứa tiểu phân nano polyme 50 lần, nhỏ trên giấy nhôm. Đổ khô bề mặt giấy nhôm ở nhiệt độ phòng. Sau đó quan sát mẫu bằng kính hiển vi điện tử quét JEOL JSM-7600F (JEOL Ltd., Nhật Bản) hoặc NanoSEM 450 (FEI Corp., Mỹ) hoặc Hitachi S-4800 (Nhật).
Đánh giá hiệu suất nano hóa
Tiến hành phân tán bột đông khô pha tiêm chứa TP nano ART/PLGA-PEG bằng 5 ml nước cất. Sau đó, chuyển hỗn dịch thu được vào bình định mức 10 ml, bổ sung nước cất đến vạch.
Xác định hàm lượng dược chất tự do sử dụng ống ly tâm gắn màng 10kDa. Hút chính xác 2ml hỗn dịch nano, ly tâm ở 4500 vòng/phút (2332 x g) trong 30 phút. Lấy phần dịch trong bên dưới màng lọc, sau đo tiến hành sắc ký HPLC. Hàm lượng dược chất tổng được định lượng bằng cách pha loãng mẫu với ACN, lắc đều, đậy kín và siêu âm trong 15 phút. Rồi lọc qua màng lọc 0,45 pm, sau đó tiến hành sắc ký với các điều kiện tương tự.
Đánh giá khả năng giải phóng dược chất in vitro
Tiến hành phân tán bột đông khô pha tiêm chứa tiểu phân nano ART/PLGA-PEG bằng 5 ml nước cất. Sau đó, chuyển hỗn dịch thu được vào bình định mức 10 ml, bổ sung nước cất đến vạch. Khả năng giải phóng dược chất in vitro của bột đông khô pha tiêm được tiến hành với túi thẩm tích (1 OkDa – Membra-Cel, Mỹ) chứa 5 ml hỗn dịch nano ART/PLGA-PEG. Túi thẩm tích được đặt vào ống ly tâm loại 50 ml có chứa 20 ml dung dịch salin đệm phosphat pH 6,8 hoặc 7,4. Ống ly tâm được đặt trong bể lắc điều nhiệt (Julabo, Đức) ở nhiệt độ 37 ±0,5°C với tốc độ 100 vòng/phút. Sau từng thời điểm nhất định, 1 ml thể tích môi trường bên ngoài túi thẩm tích được hút để định lượng hàm lượng dược chất giải phóng và thay thế bằng một thể tích môi trường tương ứng.
Ngoài ra, thành phần, tương tác hóa học và trạng thái kết tinh của các thành phần trong công thức bột đông khô chứa nano ART còn có thể được xác đinh thông qua phổ nhiễu xạ tia X, phổ hồng ngoại và phân tích nhiệt vi sai.
Đồng thời, bột đông khô pha tiêm chứa nano ART cũng đã được đánh giá khả năng ức chế tế bào ung thư in vitro và khả năng ức chế khối u vivo trên mô hình chuột mang khối u gây ra do tế bào ung thư phổi chuột (Lewis Lung Cancer) với đường tiêm tĩnh mạch đuôi. Kết quả nghiên cứu cho thấy công thức chứa nano ART đã làm
tăng khả năng ức chế tế bào ung thư và có khả năng ức chế sự phát triển của khối u tốt hơn so với công thức chứa ART nguyên liệu.
2. BÀO CHẾ THUỐC DÙNG ĐƯỜNG UỐNG
2.1. Các loại tiểu phân nano dùng bào chế thuốc dùng đường uống
Các nano tinh thể được sản xuất bằng kỹ thuật “top-down” (như đồng nhất hóa ở áp suất cao hay nghiền) và kỹ thuật “bottom-up” (như kết tủa) và các tiểu phân này được ổn định bằng các chất diện hoạt hay được dùng để bào chế thuốc uống. Bởi vì đây là kỹ thuật không sử dụng chất mang nên đây là công nghệ nano đơn giản nhất và dễ dàng nâng cấp quy mô để tăng sinh khả dụng đường uống của các thuốc kém tan trong nước. Và các dược chất ở dạng vô định hình, bán tinh thể hay tinh thể có thể đưa vào các công thức ở dạng lỏng hay dạng rắn. Những đặc điểm nổi bật khác của nano tinh thể bao gồm làm tăng độ tan và độ bám dính màng nhầy của ruột, giải phóng thuốc kéo dài và làm tăng thời gian bán thải của thuốc.
Tiểu phân nano giúp tăng sinh khả dụng của các thuốc kém tan, đặc biệt khi sinh khả dụng thuốc chỉ phụ thuộc vào mức độ và tốc độ hòa tan dược chất. Khi đó, dùng được chất ở kích thước nano giúp làm tăng sinh khả dụng do tăng mức độ và tốc độ hòa tan dược chất, đồng thời giúp tối đa hóa lượng thuốc được hòa tan tại vị trí hấp thu tối ưu, như cửa sổ hấp thu.
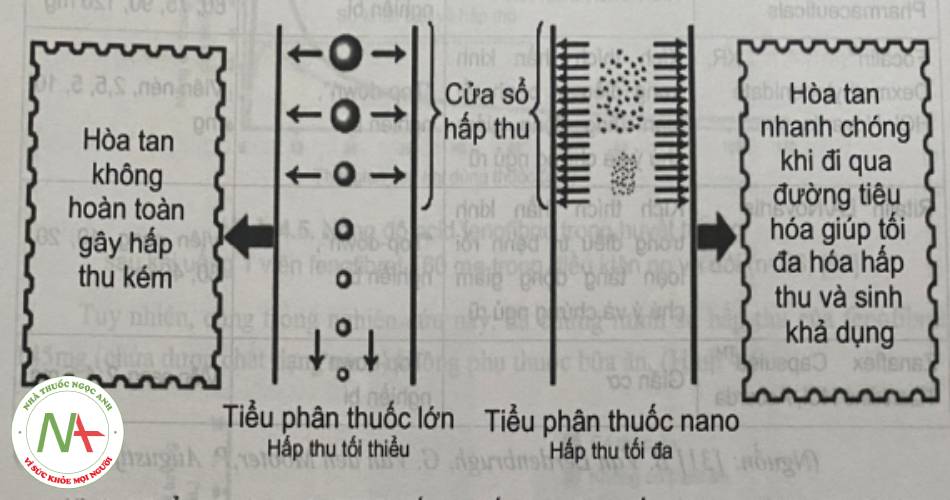
Bảng 5. Một số chế phẩm dùng đường uống sử dụng công nghệ nano trên thị trường
| Sản phẩm, Hoạt chất, Công ty | Tác dụng | Kỹ thuật, phương pháp sản xuất | Dạng bào chế, liều dùng |
| Rapamune®, Sirolimus, Wyeth | Ức chế miễn dịch | “Top-down” | Viên nén, 1 và 2mg |
| Emend®, Aprepitant, Merck | Chống nôn | “Top-down” | Viên nang, 80 và 125 mg |
| Tricor®, Fenofibrat,Abbott | Hạ cholesterol máu | “Top-down” | Viên nén, 48 và 145 mg |
| Megace® ES, Megestrol acetat,Par Pharmaceutical | Kích thích thèm ăn | “Top-down” | Hỗn dich nano, 125 mg/mL |
| Triglide®, Fenofibrat, First Horizon Pharmaceutical | Hạ cholesterol máu | “Top-down”, đồng nhất hóa | Viên nén 50 và 160mg |
| Gris-PEG®, Griseofulvin, Novartis | Chống nấm | “Bottum-up”, kết tủa | Viên nén, 125mg |
| Cesamet®, Nabilone, Lilly | Chống nôn | “Bottum-up”, kết tủa | Viên nang, 1mg |
| Avinza, Morphin, King Pharmaceuticals | Kích thích thần kinh | “Top-down” nghiền bi | Viên nang, 30, 45, 60,, 75, 90, 120mg |
| Focalin® XR, Dexmethylphenidate HCl, Novartis | Kích thíc thần kinh trong điều trị bệnh rối loạn tăng động giảm chú ý và chứng ngủ rũ | “Top-down” nghiền bi | Viên nén, 2,5; 5; 10 mg |
| Ritalin® LA/Novartis | KíchKích thíc thần kinh trong điều trị bệnh rối loạn tăng động giảm chú ý và chứng ngủ rũ | “Top-down” nghiền bi | Viên nang, 10, 20, 30, 40 mg |
| Zanaflex Capsules™, Tizanidine HCl, Accorda | Giãn cơ | “Top-down” nghiền bi | Viên nang 2, 4, 6 mg |
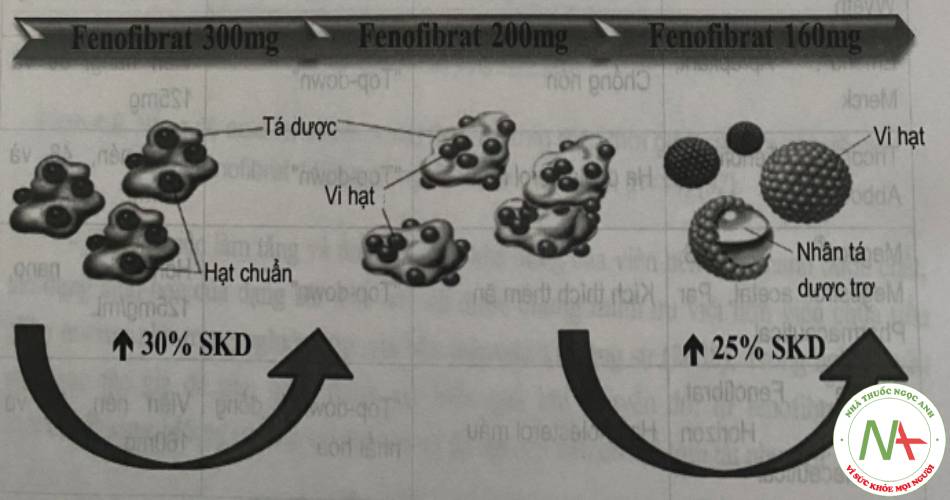
Ví dụ sau về nghiên cứu viên nén chứa tiểu phân nano fenofibrat. Fenofibrat có đặc tính thân dầu, không tan trong nước, thay đổi pH không gây ảnh hưởng đến sự hòa tan; tuy nhiên hấp thu fenofibrat tăng khi có mặt thức ăn. Khi tiến hành nano hóa fenofibrat, độ tan dược chất tăng, sinh khả dụng tăng và ổn định không phụ thuộc vào bữa ăn so với tiểu phân micron. Đồng thời tác dụng sinh học tăng rõ. Hình 4 mô phỏng mức tăng sinh khả dụng của fenofibrat khi giảm kích thước tiểu phân
Trong nghiên cứu của Sauron và cộng sự (2006), đã chỉ ra rằng sự hấp thu của fenofibrat 160mg (chứa dược chất dạng micro) tăng khi có sự hiện diện của thức ăn.
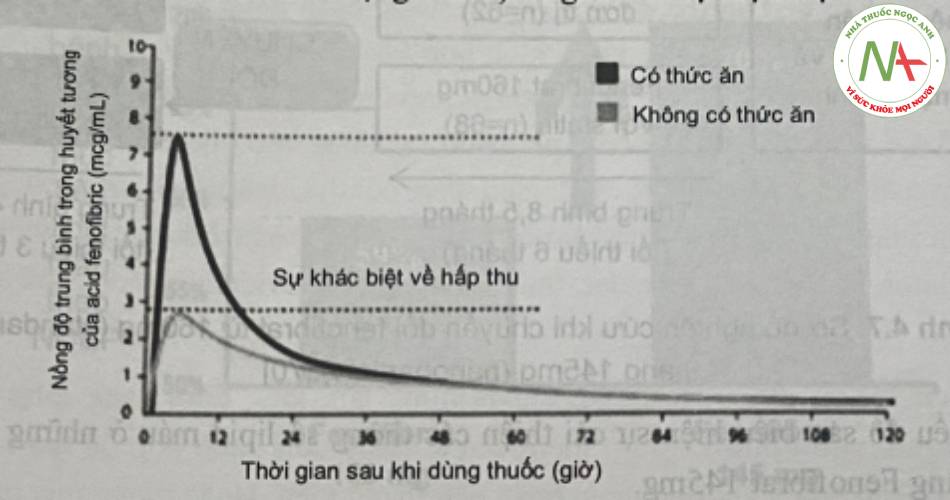
Tuy nhiên, cũng trong nghiên cứu này, đã chứng minh sự hấp thu của fenofibrat 145mg (chứa dược chất dạng nano) không phụ thuộc bữa ăn. (Hình 6).
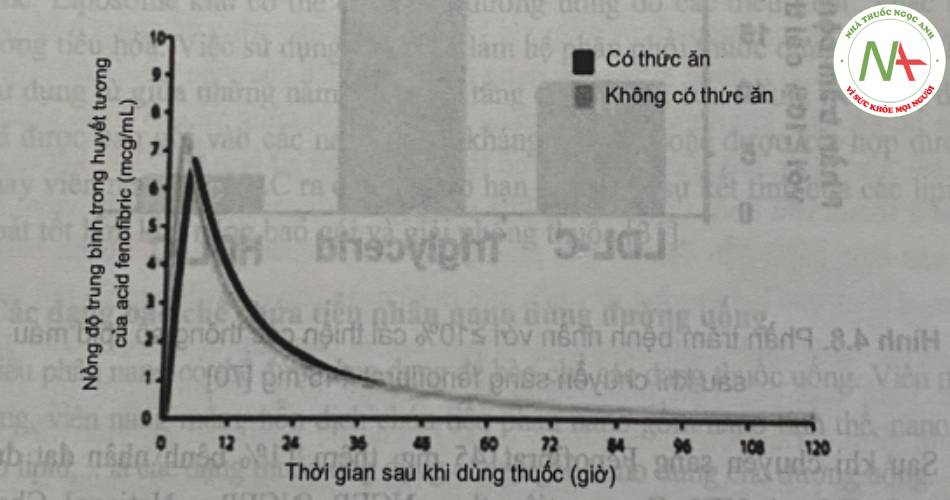
– Ngoài việc làm tăng và ổn định sinh khả dụng của viên nén chứa nano dược chất, tác dụng sinh học của dạng bào chế này đã được chứng minh ưu việt hơn viên chứa tiểu phân micron như trong nghiên cứu của Maciejewski và cộng sự (2008). Trong nghiên cứu này, các tác giả đã tiến hành đánh giá hiệu quả khi chuyển đổi từ fenofibrat 160mg (standard) sang 145mg (nanoparticle) với sơ đồ nghiên cứu có thể tóm tắt như sau:
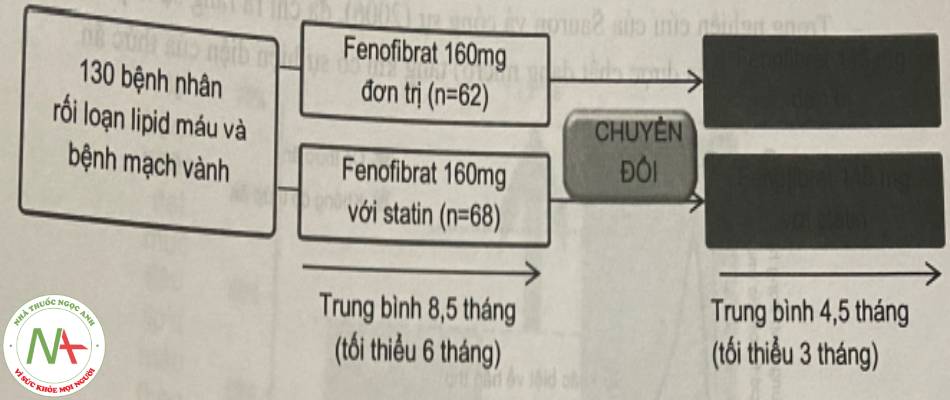
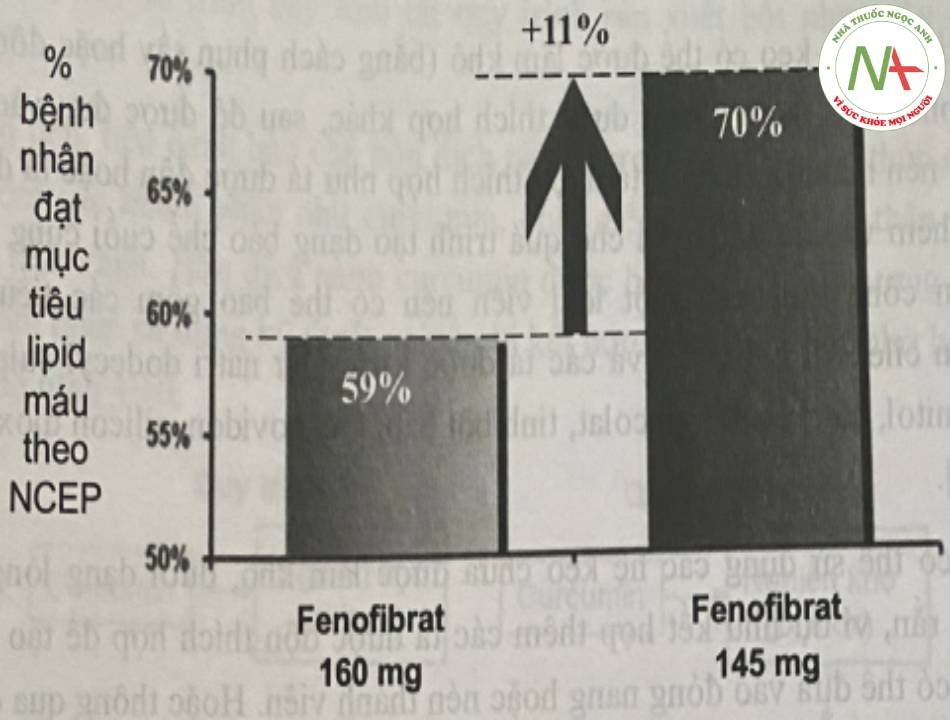
Biểu đồ sau biểu hiện sự cải thiện các thông sô lipid máu ở những bệnh nhân khi sang dùng Fenofibrat 145mg.
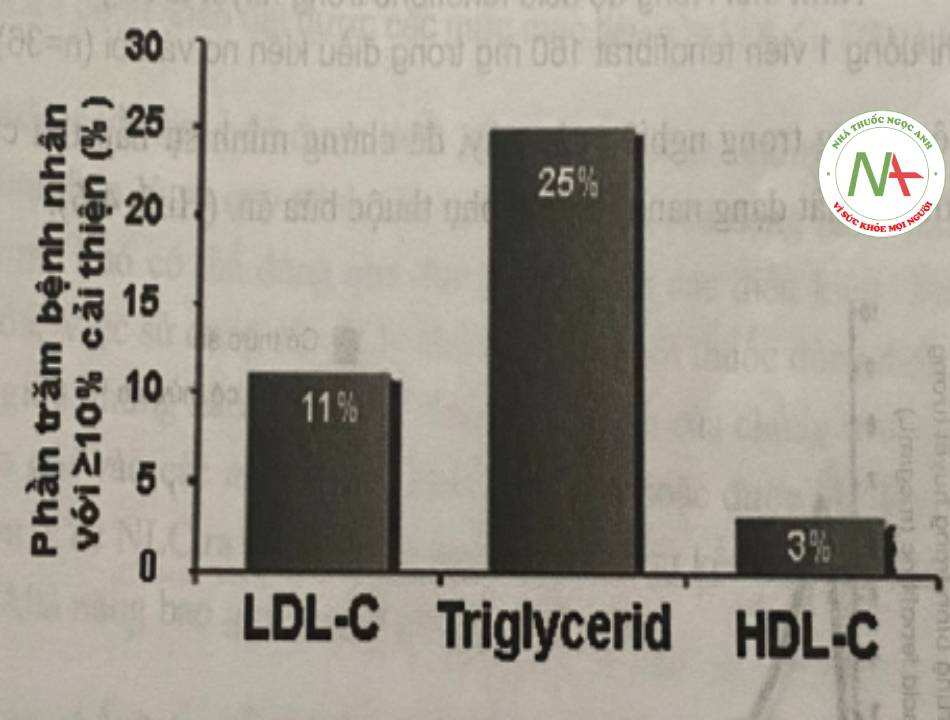
– Sau khi chuyển sang Fenofibrat 145 mg, thêm 11% bệnh nhân đạt được các mức LDL-C, TG và HDL-C mục tiêu theo NCEP (NCEP – National Cholesterol Education Program, mục tiêu lipid máu được định nghĩa là LDL-C <100 mg/dL, HDL-C >40 mg/dL và TGs <150 mg/dL).
Ngoài nano tinh thể hay sử dụng cho đường uống, do có khả năng ổn định các hoạt chất nhạy cảm, kéo dài thời gian giải phóng và tăng tính thấm qua màng, tăng sinh khả dụng và khả năng phân bố sinh học, cùng với liposome, các nano polyme đã thu hút rất nhiều nỗ lực nghiên cứu trong các thập kỷ vừa qua và đã thu được một số thành công nhất định khi đưa vào thử nghiệm lâm sàng. Thông qua đường uống, các nano polyme có thể tăng cường dược động học của hệ chất mang, phân phối thuốc đến vị trí tác dụng ở đường tiêu hóa hoặc tăng cường sự phân bố toàn thân.
Các tiểu phân nano lipid đã được thiết kế để khắc phục những bất lợi sinh dược học như độ ổn định hóa lý và quy trình sản xuất phức tạp của dạng nano phổ biến như liposome. Liposome khó có thể dùng qua đường uống do các điều kiện “khắc nghiệt” của đường tiêu hóa. Việc sử dụng các SLN làm hệ phân phối thuốc dùng đường uống đã được sử dụng từ giữa những năm 1990. Để tăng độ ổn định của chúng trong dạ dày, các SLN đã được bao gói vào các nang thuốc kháng dịch vị hoặc được kết hợp dưới dạng pellet hay viên nén. Các NLC ra đời đã giúp hạn chế được sự kết tinh của các lipid, giúp kiểm soát tốt hơn khả năng bao gói và giải phóng thuốc.
2.2. Các dạng bào chế chứa tiểu phân nano dùng đường uống
Tiểu phân nano có thể được ứng dụng để bào chế các dạng thuốc uống. Viên nén, viên nang cứng, viên nang mềm, hỗn dịch chứa tiểu phân nano gồm nano tinh thể, nano polyme hay nano lipid,… là các dạng thuốc ứng dụng công nghệ nano dùng cho đường uống.
Đối với hệ mang thuốc nano polyme hay lipid, công nghệ nano giúp mang lại nhiều thuận lợi đối với quá trình vận chuyển thuốc dùng đường uống như vận chuyển các thuốc có độ tan kém trong nước, đưa thuốc đến vị trí đích cụ thể của đường tiêu hóa,
vận chuyển thuốc xuyên bào qua lớp hàng rào đường ruột, vận chuyển nội bào hoặc xuyên bào các phân tử lớn.
Tiêu phân nano dùng qua đường uống có thể được dùng ở dạng thành phẩm là các hệ phân tán trong nước. Đây là cách sử dụng mà không cần các giai đoạn xử lý tiếp theo sau khi tạo thành nano. Tuy nhiên, do độ ổn định kém của dược chất và các polyme trong môi trường nước hoặc mùi vị khó chịu của dược chất, yêu cầu cần phải đưa các tiểu phân keo vào các dạng thuốc rắn như dạng viên nang hay viên nén.
2.3. Bào chế thuốc dùng đường uống chứa tiểu phân nano
Hệ tiểu phân keo có thể được làm khô (bằng cách phun sây hoặc đông khô), nếu cần thiết phối hợp thêm các tá dược thích hợp khác, sau đó được đưa vào nang cứng hoặc được nén thành viên. Các tá dược thích hợp như tá dược độn hoặc tá dược dính có thể được thêm vào để thuận lợi cho quá trình tạo dạng bào chê cuối cùng. Vi dụ, thành phần công thức của một loại viên nén có thể bao gồm các tiểu phân nano candesartan cilexetil phun sấy và các tá dược khác như natri dodecyl sulphat, HPMC (6cps), manitol, natri starch glycolat, tinh bột bắp, crospovidon, silicon dioxyd, magnesi stearat.
Hay có thể sử dụng các hệ keo chưa được làm khô, dưới dạng lỏng để tạo các dạng thuốc rắn, ví dụ như kết hợp thêm các tá dược độn thích hợp để tạo hạt. Các hạt này sau đó có thể đưa vào đóng nang hoặc nén thành viên. Hoặc thông qua quá trình bôi lớp lên các chất mang như các pellet trơ trong máy sấy tầng sôi, hoặc có thể thu được các tiểu phân nano. Các viên nhân này có thể được bao đê tạo viên bao phim hay viên nang chứa các hạt bao phim.
Các lực cơ học xuất hiện trong quá trình làm khô và/hoặc nén các công thức chứa các tiểu phân nano cần phải được xem xét khi lựa chọn quy trình để chuyển hệ phân tán chứa tiểu phân nano ở dạng lỏng sang dạng rắn. Mục đích của việc này là để duy trì tính chất của hệ keo sau khi được đưa vào dạng bào chế cuối cùng và quá trình phân tán lại sau khi sử dụng. Các hiện tượng bất lợi có thể xảy ra như sự hợp nhất hay kết tụ các tiểu phân nano thành các khối tập kết lớn, khả năng gắn với các tá dược dập viên, hoặc sự phá vỡ cấu trúc nano dẫn đến sự giải phóng sớm dược chất trong quá trình bào chế và bảo quản. Tất cả các hiện tượng này nếu xảy ra sẽ ngăn cản quá trình phân tán lại hệ keo sau khi uổng dạng thuốc rắn tương ứng. Hai thông số quan trọng cho quá trình phân tán lại hoàn toàn của các tiểu phân nano là nhiệt độ hình thành phim tối thiểu cao (minimum film formation temperature – MFT) của hệ phân tán polyme và khả năng thấm ướt tốt của các nano polyme khô. Giá trị MFT thấp dẫn đến sự dung hợp của các tiểu phân nano, tạo các kết tụ hoặc phim dính liền không thể phân tán lại khi tiếp xúc với các dịch của đường tiêu hóa. Khả năng thấm ướt thấp làm cản trở sự tái hoạt hóa diện tích bề mặt lớn của hệ phân tán do ái lực bị hạn chế của nước với bề mặt các tiểu phân nano khô. Thay vào đó, các liên kết kỵ nước giữa các tiểu phân nano có xu hướng giữ chúng lại với nhau dưới các kết tụ lớn. Đồng thời, cũng cần chú ý đến độ ổn đinh hóa học của dạng bào chế rắn chứa các tiểu phân nano ữong quá trình bảo quản.
Ngoài việc làm khô để đưa vào viên nang cứng hoặc viên nén, các hệ phân tán chứa tiểu phân nano dưới dạng lỏng như các hệ tự nhũ hóa có thể đưa trực tiếp vào viên nang mềm. Trên thị trường cũng đã có một số sản phẩm chứa hệ tự nhũ hóa được đóng vào nang mềm như Vesanoid (Roche), Accutane (Roche), Sandimmune (Novartis),…
Để minh họa việc ứng dụng công nghệ nano trong bào chế thuốc dùng đường uống, phần sau đây sẽ trinh bày tóm tắt quy trình sản xuất bột phun sấy chứa nano curcumin:
Đầu tiên tiến hành bào chế hỗn dịch nano curcumin với công thức cơ bản cho mẻ bao gồm các thành phần như curcumin, chất diện hoạt, polyme thân nước, chất mang, nước tinh khiết. Hỗn dịch nano curcumin được bào chế bằng phương pháp giảm kích thước tiêu phân sử dụng kỹ thuật nghiền bi kết hợp đồng nhất hóa nhờ lực phân cắt lớn theo sơ đồ hình 10.
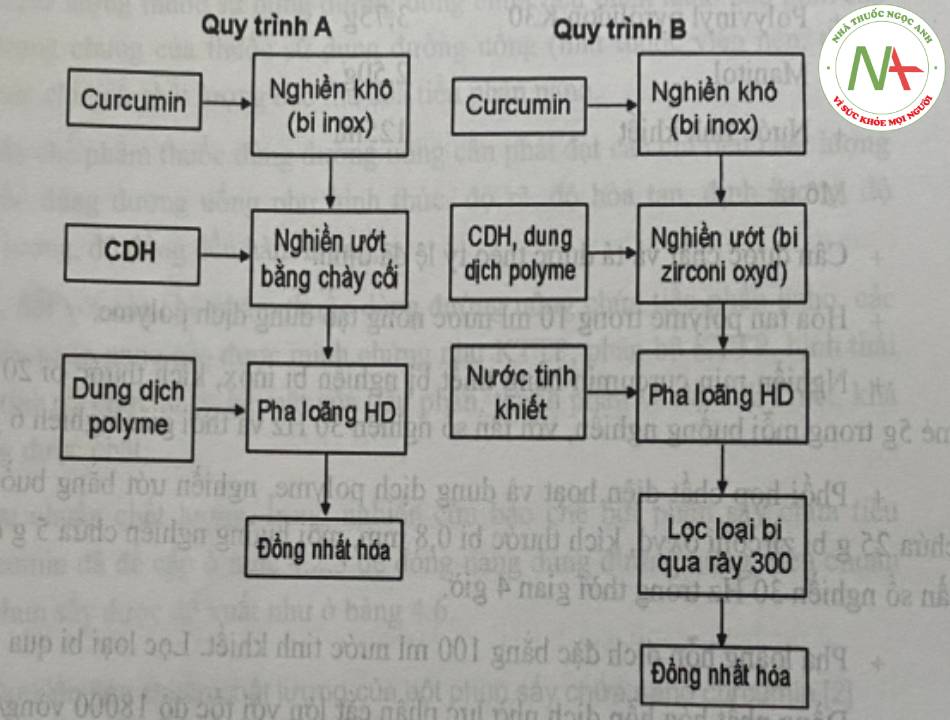
Ghi chú: CDH: chất diện hoạt, HD: hỗn dịch
Mô tả quy trình:
Quy trình A (áp dụng với mẻ 1 g)
– Cân dược chất và tá dược theo tỷ lệ đã định.
– Ngâm trương nở Na CMC hoặc hòa tan polyme (PVP hoặc PVA) trong 25 ml nước tạo dung dịch.
– Nghiền mịn curcumin bằng thiết bị nghiền bi inox, kích thước bị 20 mm, mỗi mẻ 1 g trong một buồng nghiền, thời gian nghiền 60 phút ở tần số 25 Hz,
– Phối hợp 0,10 g chất diện hoạt thể lỏng (Tween 80, Tween 60 hoặc Cremophor RH40) hoặc chất diện hoạt thể rắn Poloxame 188 hòa tan trong 1 ml dung dịch polyme trên và nghiền ướt tạo hỗn dịch đặc bằng chày cối, thời gian nghiền 15 phút.
– Thêm từ từ dung dịch polyme để tạo hỗn dịch curcumin.
– Đồng nhất hóa hỗn dịch nhờ lực phân cắt lớn với tốc độ 18000 vòng/phút trong thời gian 15 phút (có thể thay đổi phù hợp với điều kiện khảo sát) tạo hỗn dich nano.
Quy trình B (áp dụng với mẻ 5 g)
– Công thức:
+ Curcumin 5,0 g
+ Tween 80 0,6g
+ Polyvinyl pyrolidon K30 3,75g
+ Manitol 2,50g
+ Nước tinh khiết 125ml
– Mô tả:
+ Cân dược chất và tá dược theo tỷ lệ đã định.
+ Hòa tan polyme trong 10 ml nước nóng tạo dung dịch polyme.
+ Nghiền mịn curcumin bằng thiết bị nghiền bi inox, kích thước bi 20 mm, môi mẻ 5g trong mỗi buồng nghiền, với tần số nghiền 30 Hz và thời gian nghiên 6 giờ.
+ Phối hợp chất diện hoạt và dung dịch polyme, nghiền ướt bằng buồng nghiền chứa 25 g bi zừconi oxyd, kích thước bi 0,8 mm, mỗi buồng nghiền chứa 5 g dược chất, tần số nghiền 30 Hz trong thời gian 4 giờ.
+ Pha loãng hỗn dịch đặc bằng 100 ml nước tinh khiết. Lọc loại bi qua rây 300.
+ Đồng nhất hóa hỗn dịch nhờ lực phân cắt lớn với tốc độ 18000 vòng/phút trong thời gian 60 phút, cứ mỗi 15 phút lại cho máy nghỉ 5 phút.
+ Tiếp theo, tiến hành bào chế bột phun sấy chứa tiểu phân nano curcumin, cụ thể như sau:
Đối với mẻ 1 g, tiến hành phun sấy hỗn dịch nano thu được ở trên.
Đối với mẻ 5 g, hòa tan chất mang thân nước vào 15 mi nước còn lại, phối hợp với hỗn dịch nano. Quá trình phun sấy được tiến hành với các thông số: nhiệt độ đầu vào 96°C, tốc độ cấp dịch 2 ml/phút và tỷ lệ thông gió 99% (có thể thay đổi phù hợp với điều kiện khảo sát) trên thiết bị phun sấy Buchi mini spray dryer B-191. Hỗn dịch nano được khuấy từ liên tục trong thời gian phun sấy. Bột phun sấy được thu hồi trên cả cyclon và bộ phận thu hồi sản phẩm trong phòng kín với độ ẩm khoảng 30-40%. Bột phun sấy được đóng vào lọ thủy tinh, đậy nút cao su và chụp nắp nhôm. Các lọ thủy tinh được bọc km, tranh ánh sáng và bảo quản trong bình hút ẩm.
Trong quy trinh bào chế bột phun sấy chứa nano curcumin dùng cho đường uống ở phần trên, các yếu tố ảnh hưởng đến đặc tính lý hóa của tiểu phân nano đã được khảo sát bao gồm các thông số thuộc công thức như loại chất diện hoạt, tỉ lệ chất diện hoạt, loại polyme, tỉ lệ polyme,… và các thông số thuộc quy trình như tốc độ đồng nhất hóa, thời gian đồng nhất hóa, quy trình phun sấy như nhiệt độ khí vào, tốc độ phun dịch,…
2.4. Đánh giá các chí tiêu chất lượng thuốc dùng đường uống chứa tiểu phân nano
2.4.1. Chỉ tiêu chất lượng
Chỉ tiêu chất lượng thuốc sử dụng đường uống chứa tiểu phân nano bao gồm các chỉ tiêu chất lượng chung của thuốc sử dụng đường uông (như thuôc viên nén, thuốc viên nang) và các chỉ tiêu chất lượng đặc thù của tiểu phân nano.
Do đó, các chế phẩm thuốc dùng đường uống cần phải đạt các chỉ tiêu chất lượng chung của thuốc dùng đường uống như hình thức, độ rã, độ hòa tan, đinh lượng, độ đồng đều khối lượng, độ đồng đều hàm lượng,…
Ngoài ra, đối với các chế phẩm thuốc dùng đường uống chứa tiểu phân nano, các tính chất của tiểu phân nano cần được minh chứng như KTTP, phân bô KTTP, hình thai tiểu phân, đặc tính và chức năng bề mặt của tiểu phân, thành phần và độ tinh khiết, khả năng giải phóng dược chất,…
– Về tiêu chuẩn chất lượng, trong nghiên cứu bào chế bột phun sấy chứa tiểu phân nano curcumin đã đề cập ở mục 2.3 để đóng nang dùng đường uống, tiêu chủân cơ sở của bột phun sấy được đề xuất như ở bảng 6.
Bảng 6. Dự kiến tiêu chuẩn chất lượng của bột phun sấy chứa nano curcumin
<trĐịnh tínhSắc ký đồ có 1 pic với thời gian lưu trùng với thời gian lưu của pic curcumin chuẩn
| Chỉ tiêu | Dự kiến tiêu chuẩn |
| Hình thức | Bột màu vàng, tơi xốp |
| Kích thước tiểu phân (nm)
Hệ số đa phân tán PDI |
<500
<0,55 |
| Mất khối lượng do làm khô (%) | ≤12,0 |
| Khối lượng riêng biểu kiến (g/ml) | ≥0,25 |
| Hàm lượng curcumin trong bột phun sấy (%) | 40,00 – 43,50 |
| Độ hòa tan | ≥ 95,0 % sau 60 phút |
2.4.2. Phương pháp đánh giá
Các phương pháp đánh giá một số đặc tính lý hóa của tiểu phân nano như KTTP và phân bố KTTP, điện tích bề mặt, hình thái cấu trúc hạt, thành phần, tương tác hóa học và trạng thái kết tinh, khả năng nạp thuốc và hiệu suât nano hóa, khả năng giải phóng thuốc in vitro.
Áp dụng đối với bột phun sấy chứa nano curcumin trong mục 2.3, các phương pháp đánh giá một số tính chất của tiểu phân nano được trình bày cụ thể như sau:
Đánh giá hình thái và kích thước hệ tiểu phân nano bằng kính hiển vi điện tử quet (Scanning Electron Microscope-SEM)
Phân tán bột phun sấy chứa nano curcumin vào nước để tạo hỗn dịch nano. Hỗn dịch nano được ly tâm ở tốc độ 10000 vòng/phút trong 10 phút để thu lấy kết tủa, rửa tủa 3 lần bằng nước tinh khiết, làm khô ở nhiệt độ 40-50°C và chụp SEM. Bột phun sấy chứa nano curcumin được chụp SEM trực tiếp.
Tiến hành: phân tán mẫu bột curcumin trên một khung carbon, sau đó phun một lớp platin mỏng và đặt vào buồng soi mẫu của thiết bị. Sử dụng kính hiên vi điện tử FESEM Hitachi S-4800 có độ phóng đại M = 20-800000x, độ phân giải δ = 1,0 nm, điện áp gia tốc U = 10 kV.
Đánh giá kích thước tiểu phân trung bình và khoảng phân bố kích thước tiểu phân hoặc hệ số đa phân tán.
Tiến hành đánh giá KTTP và khoảng phân bố KTTP (Span) của mẫu curcumin trong giai đoạn nghiền khô và nghiền ướt bằng thiết bị đo Mastersizer 3000E. Đối với mẫu nghiền khô, tiến hành phân tán trong môi trường nước chứa 0,1% Tween 80. Đối với mẫu nghiền ướt, tiến hành phân tán trong nước tinh khiết. Mẫu được phân tán trong môi trường nước chứa 0,1% Tween 80, pha loãng hỗn dịch đến khi thu được hỗn dịch có độ che mờ khoảng 11-15% (xác định bởi thiết bị Mastersizer 3000E). Khuấy đồng nhất và siêu âm trên thiết bị đo để đảm bảo mẫu thử đồng nhất. Tiến hành đo khi mẫu thử không còn bọt khí. Từ các thông số thu được về kích thước tiểu phân, trung bình KTTP theo thể tích (d [4,3]) và hệ số Span được sử dụng để đánh giá KTTP và phân bố KTTP.
Hỗn dịch nano trước khi phun sấy và bột phun sấy chứa tiểu phân nano được tiến hành xác định kích thước và phân bố kích thước bằng thiết bị đo thế zeta và xác định phân bố KTTP Zetasizer Nano ZS90 Malvern. Hỗn dịch nano hoặc bột phun sấy chứa tiểu phân nano được phân tán trong nước tinh khiết đến nồng độ DC sao cho tốc độ đếm tiểu phân khoảng 150-250 kcps. Hệ số tán xạ ánh sáng của curcumin là 1,42. Ánh sáng tán xạ được đo ở góc 90°.
Phương pháp xác định thể zeta
Hỗn dịch được pha loãng đến nồng độ tương tự như mẫu đo KTTP trước khi đưa vào máy đo, sử dụng thiết bị Zetasizer ZS90 Malvern với cuvet nhựa có 2 lá điện cực bằng đồng.
Phương pháp xác định diện tích bề mặt và độ xốp
Nguyên tắc: dựa theo thuyết hấp phụ Brunauer-Emmet-Teller (BET) Khi bề mặt tiểu phân rắn tiếp xúc với chất khí, lớp hấp phụ được hình thành trên bề mặt. Lớp hấp phụ cũng được hình thành trên bề mặt lỗ xốp bên trong tiểu phân và khí bị ngưng tụ trong lỗ xốp ở nhiệt độ hằng định, lượng khí hấp phụ hoặc ngưng tụ trên bề mặt là hàm số của áp suất khí. Dựa vào sự thay đổi áp suất khí, tính toán được lượng khí hấp phụ hoặc ngưng tụ. Xây dựng đường hấp phụ đẳng nhiệt theo thuyết BET và xác định diện tích bề mặt theo thuyết BET. Thể tích lỗ xốp và đường kính trung bình của lỗ xốp được xác định dựa vào quá trinh hấp phụ và phản hấp phụ của khí nitrogen trên bề mặt lỗ xốp.
Tiến hành: hút chân không và cung cấp nhiệt để làm khô bột phun sấy chứa nano curcumin ở 100°C và làm sạch bề mặt tiểu phân, lỗ xốp. Khi bề mặt tiếp xúc với khí nitrogen, nitrogen sẽ hấp phụ lên bề mặt và hệ thống mao quản của mẫu tại nhiệt độ nitrogen lỏng (-196°C).
Định lượng
Hàm lượng curcumin trong các mẫu nghiên cứu được định lượng bằng phương pháp quang phổ hấp thụ ƯV-Vis hoặc HPLC.
Phương pháp quang phổ hấp thụ UV- VIS
Quét phổ dung dịch curcumin có nồng độ 5 μg/ml trong khoảng bước sóng từ 200 đến 600 nm, lựa chọn bước sóng tại đó curcumin đạt cực đại hấp thụ. Từ dung dịch A pha loãng thành các dung dịch curcumin chuẩn có nồng độ 1; 2; 2,5; 4; 4 5; 5 và 7,5 μg/ml. Đo độ hấp thụ của các dung dịch chuẩn tại bước sóng đã lựa chọn với mẫu trắng là dung môi pha loãng và xây dựng đường chuẩn biểu diễn mối tương quan giữa độ hấp thụ và nồng độ curcumin. Dung dịch thử được chuẩn bị bằng cách thay curcumin chuẩn bằng một lượng bột phun sấy chứa nano curcumin tương ứng với 10,0 mg curcumin.
Phương pháp sắc kỷ lỏng hiệu năng cao
– Dung môi pha loãng: hỗn hợp methanol: acid acetic băng (99:1, tt/tt).
– Dung dịch chuẩn: cân chính xác khoảng 10,0 mg curcumin chuẩn, hòa tan trong dung môi pha loãng, chuyển vào bình định mức 100 ml, thêm dung môi pha loãng tói vạch và lắc kỹ được dung dịch B. Hút chính xác một lượng dung dịch B, thêm dung môi pha loãng tạo thành dung dịch có nồng độ 5 pg/ml, lọc qua màng lọc kích thước lỗ lọc 0,45μm.
– Dung dịch thử được chuẩn bị tương tự như dung dịch chuẩn nhưng thay curcumin chuẩn bằng một lượng bột phun sấy chứa nano curcumin tương ứng với 10,0 mg curcumin.
– Pha động: Acetonitril : dung dịch acid acetic 2% (kl/tt) (58:42), được lọc qua màng lọc kích thước lỗ lọc 0,45 Ịim. Tốc độ dòng: 1,5 ml/phút. Thể tích tiêm mẫu: 20 μl. Detector UV-VIS phát hiện ở bước sóng 430 nm.
Phương pháp đánh giá độ hòa tan của curcumin
Mức độ và tốc độ hòa tan của bột phun sấy chứa nano curcumm được xác đinh bằng phép thử độ hòa tan với các điều kiện cụ thể như sau:
– Thiết bị: máy cánh khuấy, tốc độ quay 100 vòng/phút
– Môi trường hòa tan: 900 ml nước chứa 0,2% Tween 80
– Nhiệt độ môi trường hòa tan: 37 ± 0,5°c
– Khối lượng mẫu thử: Tương ứng với 5,0 mg curcumin
Cách tiến hành: cho các mẫu thử vào cốc có mỏ chứa một lượng môi trường thử độ hòa tan, siêu âm 3-4 giây và chuyển vào cốc chứa môi trường thử hòa tan. Sau các khoảng thời gian 10, 20, 30, 40, 50 và 60 phút, lấy khoảng 10 ml dung dịch thử, ly tâm 5 phút với tốc độ 12000 vòng/phút. Phần dịch trong được định lượng curcumin bằng phương pháp quang phổ hấp thụ UV-VIS ở bước sóng 427 nm, sử dụng mẫu trắng là dung dịch Tween 80 0,2%. Sau khi đo quang, rót toàn bộ phần cắn và phần dịch ly tâm vào cốc thử độ hòa tan.
Ngoài ra, thành phần, tương tác hóa học và trạng thái kết tinh của các thành phần trong công thức bột phun sấy chứa nano curcumin còn có thể được xác định thông qua phổ nhiễu xạ tia X, phổ hồng ngoại và phân tích nhiệt vi sai.
Đồng thời, bột phun sấy chứa nano curcumin đã được đánh giá sinh khả dụng đường uống trên mô hình chuột thí nghiệm và chứng tỏ dạng bào chế chứa nano curcumin có khả năng cải thiện sinh khả dụng của curcumin.
3. BÀO CHẾ THUỐC NHÃN KHOA
3.1. Các loại tiểu phân nano dùng bào chế thuốc nhãn khoa
Nhiều hệ đưa thuốc dựa vào công nghệ nano đã được nghiên cứu để điều trị các bệnh về mắt từ nano tinh thể đến các hệ chất mang như nano polyme, nano lipid. Các bệnh lý liên quan của mắt trong các nghiên cứu khá đa dạng bao gồm hội chứng khô mắt, glaucom, viêm mắt do dị ứng,…
3.2. Các dạng thuốc chứa tiểu phân nano dùng cho nhãn khoa
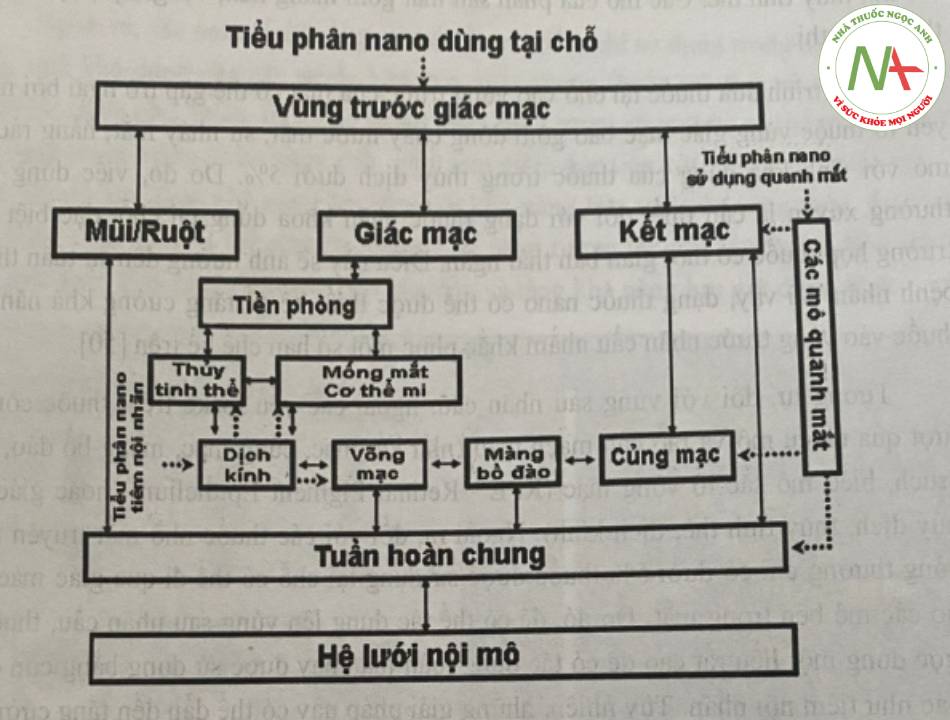
Về phương diện giải phẫu, đối với thuốc nhãn khoa sẽ đưa thuốc đến vùng trước hoặc vùng sau của măt. Các mô đích của phần trước mắt bao gồm giác mạc, mống mắt – thể mi, thủy tinh thể. Các mô của phần sau mắt gồm màng mắt, võng mạc, dịch kinh và thần kinh thị.
Quá trình đưa thuốc tại chỗ vào vùng trước của mắt có thể gặp trở ngại bởi một số yếu tố thuộc vùng giác mạc bao gồm dòng chảy nước mắt, sự nháy măt, hàng rào biểu mô với sinh khả dụng của thuốc trong thủy dịch dưới 5%. Do đó, việc dùng thuốc thường xuyên là cần thiết đối với dạng thuốc nhãn khoa dùng tại chỗ, đặc biệt trong trường hợp thuốc có thời gian bán thải ngắn. Điều này sẽ ảnh hưởng đến sự tuân thủ của bệnh nhân. Vì vậy, dạng thuốc nano có thể được thiết kế để tăng cường khả năng đưa thuốc vào vùng trước nhãn cầu nhằm khắc phục một số hạn chế kể trên.
Tương tự, đối với vùng sau nhãn cầu, ngoài các yếu tố kể trên, thuốc còn phải vượt qua nhiều mô và rào cản mạch máu (như kết mạc, củng mạc, màng bồ đào, màng Bruch, biểu mô sắc tố võng mạc (RPE – Retinal Pigment Epithelium) hoặc giác mạc, thủy dịch, thủy tinh thể, dịch kính). Ngoài ra, đối với các thuốc nhỏ mắt truyền thống, thông thường chỉ có dưới 5% thuốc được sử dụng tại chỗ có thể đi qua giác mạc để đi vào các mô bên trong mắt. Do đó, để có thể tác dụng lên vùng sau nhãn cầu, thuốc cần được dùng một liều rất cao để có tác dụng toàn thân hay được sử dụng bằng con đường khác như tiêm nội nhãn. Tuy nhiên, những giải pháp này có thể dẫn đến tăng cường độc tính hoặc ảnh hưởng đến sự an toàn và việc tuân thủ của bệnh nhân như cao huyêt áp, mạch nhanh, hen phế quản. Vì vậy, dạng nano có thể giúp duy trì khả năng đưa thuốc vào võng mạc cũng như đưa thuốc đi vào tế bào hướng đến vùng sau nhãn cầu. Ngoài ra, còn có một số hệ đưa thuốc thay thế để kéo dài khả năng đưa thuốc vào vùng sau nhãn cầu như cấy, gắn vào củng mạc,…
Khả năng phân bố của các tiểu phân nano dùng trong nhãn khoa có thể được hình dung qua phác thảo ở hình 11.
Ngoài các rào cản vật lý, các mô ở mắt còn chứa các men chuyển hóa (như esterase, aldehyd và ceton reductase) có thể phân hủy và làm giảm hiệu lực của thuốc.
Một trong những nguyên nhân chính để phát triển các hệ phân phối thuốc khác với dung dịch nhỏ mắt đó là việc cần thiết giảm tần suất dùng thuốc bằng cách kéo dài tác dụng của thuốc, đặc biệt trong điều trị các rối loạn mạn tính của mắt. Điều này có thể thực hiện được bằng cách phân phối thuốc kéo dài hoặc cung cấp một liều lớn hơn. Bởi vì các hạn chế của dung dịch nhỏ mắt trong việc đưa thuốc liều cao vào các mô ở tiền phòng và khả năng kéo dài tác dụng bị hạn chế khi tăng liều nên nhiều phương pháp giúp kéo dài khả năng phân phối thuốc khác nhau đã thu hút nhiều nghiên cứu. Trong các dạng hỗn dịch chứa thuốc với khả năng giải phóng chậm hơn so với dạng dung dịch thì hệ phân phối thuốc mới như tiểu phân nano hay micro sẽ giúp kéo dài khả năng đưa thuốc khi sử dụng tại chỗ hoặc khi dùng đường tiêm.
Các công thức nano giúp thuốc có thể duy trì nồng độ thuốc ở các mô tiền phòng đến vài giờ so với vài phút khi dùng các dung dịch nhỏ mắt. Thời gian lưu có thể tăng bằng cách tăng độ nhớt của công thức. Hay một cách khác, các tiểu phân nano có thể được bao gói bằng các polyme có khả năng bám dính màng nhầy hay bám dính sinh học. Các polyme này có khả năng tương tác với màng nhầy hay các tế bào trước giác mạc để tăng thời gian lưu, và từ đó tăng thời gian tác dụng của thuốc. Một số polyme thường được sử dụng trong công thức nano dùng trong nhãn khoa như Eudragit RS 100, RL 100, chitosan, polyisobutylcyanoacrylat, polybutylcyanoacrylat, PCL, albumin, gelatin, PLA. Ví dụ, đối với axitinib (một chất ức chế men tyrosin kinase) công thức sử dụng 2% axitinib-MPP (Mucus-penetrating nanoparticles, tiểu phân có khả năng thấm qua lớp màng nhầy) dùng đơn liều tại chỗ cho kết quả nồng độ thuốc tại chỗ cao gấp 10-200 lần so với giá trị IC50 (nồng độ tại đó thuốc có thể trung hòa 50% thụ thể đích) của VEGFR-2 (thụ thể VEGF đích của axitinib)
Các công thức nano sử dụng tại chỗ giúp tăng khả năng hấp thu thuốc và phân phối thuốc kéo dài. Các tiểu phân nano chứa PEG hoặc được bao bởi các polyme có khả năng bám dính màng nhầy dường như có nhiều ưu điểm hơn. Công thức nano trong các hỗn dịch dùng tại chỗ có thể kéo dài khả năng đưa thuốc đến vài giờ.
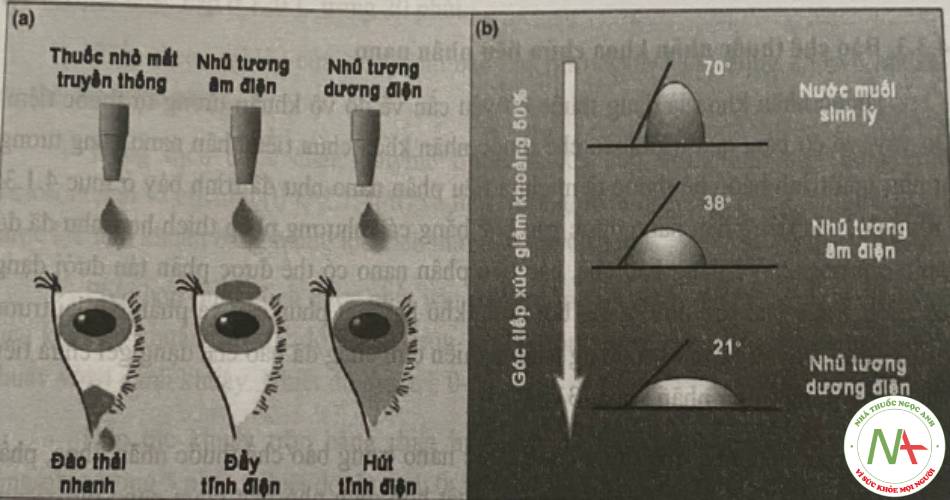
Ngoài ra, các nano lipid cũng có một số ưu điểm khi sử dụng trong nhãn khoa như tăng sinh khả dụng của các thuốc kém tan, giải phóng thuốc tại đích và có kiểm soát, giảm tác dụng phụ. Đồng thời, các thành phần lipid trong công thức có thể tương tác với lớp lipid trong màng phim nước mắt, giúp làm giảm góc tiếp xúc giữa giọt thuốc và giác mạc, do đó làm tăng khả năng lan rộng và khả năng làm ướt của công thức. Đặc biệt, các công thức có điện thế zeta dương có khả năng tương tác với bề mặt có điện thế âm của giác mạc giúp làm giảm góc tiếp xúc này và tăng khả năng lưu giữ dược chất.
Một vài phương pháp mới như kính áp tròng gắn thuốc hay nano có thể kéo dài thời gian đưa thuốc lên đến vài ngày. Sự hấp thu và vận chuyển của tiểu phân nano phụ thuộc vào đặc tính của tiêu phân cũng như điều kiện bệnh của bề mặt mắt. Các tiểu phân có khả năng bám dính màng nhây hoặc các tiểu phân được bao bởi PEG dường như đi vào các lớp tể bào tốt hơn. Sự hấp thu của các tiểu phân, và sau đó là quá trình đưa thuốc sẽ cao hơn trong trường họp mắt bị viêm nhiễm
Các công thức tiêm tiểu phân nano vào nội nhãn giúp kéo dài quá trình đưa thuốc tốt hơn các công thức dùng tại chỗ. Điều này liên quan đến sự đào thải chậm hơn của các tiêu phân nano ra khỏi các vị trí bên trong nhãn cầu so với sự đào thải của chúng ở khu vực trước giác mạc. Các công thức tiêm nội nhãn tăng khả năng tiếp cận lớp biểu mô sắc tố võng mạc.
.
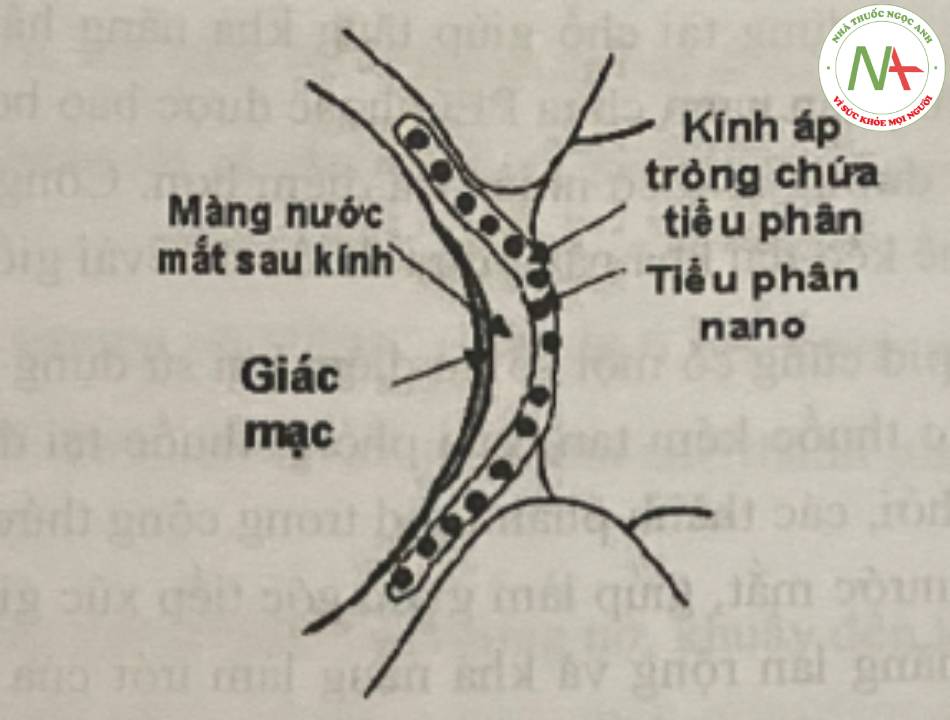
để đưa thuốc nhãn khoa dùng tại chỗ kéo dài
3.3. Bào chế thuốc nhãn khoa chứa tiểu phân nano
Thuốc nhãn khoa là dạng thuốc có yêu cầu về độ vô khuẩn tương tự thuốc tiêm. Do vậy, về cơ bản, quá trình bào chế thuốc nhãn khoa chứa tiểu phân nano cũng tương tự như quá trình bào chế thuốc tiêm chứa tiểu phân nano như đã trình bày ở mục 1.3. Trong đó, các tiểu phân nano được bào chế bằng các phương pháp thích hợp. Về dạng bào chế, các tiểu phân nano có thể được phân tán dưới dạng hỗn dịch, hoặc bào chế dưới dạng bột đông khô hay bột phun sấy và phân tán lại trước khi sử dụng. Ngoài ra, một số công trình nghiên cứu cũng đã bào chế dạng gel chứa tiểu phân nano dùng trong nhãn khoa.
Để minh họa việc ứng dụng công nghệ nano trong bào chế thuốc nhãn khoa, phần sau đây sẽ trình bày tóm tắt quy trình sản xuất hỗn dịch nhỏ mắt chứa nano piroxicam cụ thể như sau:
* Công thức:
Piroxicam nano polyme đông khô tương ứng với 0,50 g piroxicam (Eudragit RS 100, PVA)
Acid citric monohydrat: 0,21g
Manitol: 4,5g
Benzalkonium clorid: 0,02g
Hydroxypropyl methyl cellulose E6 vừa đủ: 6-12cps (0,1; 0,3; 0,8g)
Dung dịch NaOH 0,1 M: pH 6,0-6,2
Nước cất vừa đủ: 100ml
* Mô tả quy trình:
Đầu tiên, tiến hành bào chế môi trường phân tán vô khuẩn, cụ thể bao gồm các bước:
+ Tiệt khuẩn tất cả các dụng cụ, thiết bị sử dụng trong bào chế bằng các phương pháp thích hợp.
+ Ngâm trương nở HPMC nồng độ 0,1% trong nước cất pha tiêm.
+ Hòa tan trong nước cất pha tiêm các thành phần gồm: hệ đệm, chất bảo quản, chất đẳng trương.
+ Phối hợp với HPMC đã trương nở, khuấy đến khi đồng nhất.
+ Tiệt khuẩn bằng cách lọc dung dịch qua màng lọc cellulose acetat kích thước lỗ lọc 0,2 μm hoặc hấp ở 120°c trong 20 phút.
– Tiếp theo, nghiên cứu tiến hành bào chế piroxicam nano đông khô vô khuẩn, cụ thể các bước như sau:
+ Dung dịch dược chất, polyme Eudragit RS 100 trong hỗn hợp dung môi diclorometan và ethanol (tỉ lệ 2: Ị, tt/tt) và môi trường phân tán chứa dung dịch PVA 5% được lọc loại khuẩn bằng màng lọc kích thước lỗ lọc 0,2 μm.
+ Phối hợp dung dịch dược chất vào môi trường phân tán để tạo nhũ tương trong điều kiện vô khuẩn với tốc độ khuấy trộn 18000 vòng/phút trong 5 phút bằng thiết bị khuấy với 4 cánh khuấy. Nhiệt độ duy trì: 0-5°C.
+ Tiếp tục khuấy trộn bằng thiết bị đồng nhất hóa Unidrive ở tốc độ 15000 vòng/phút trong 5 phút. Nhiệt độ duy trì: 0-5°C.
+ Bốc hơi dung môi bằng máy khuấy từ với tốc độ 400 vòng/phút trong 24 giờ ở điều kiện vô khuẩn.
+ Ly tâm 15000 vòng/phút trong 15 phút, rửa tủa 3 lần bằng nước cất để pha tiêm.
Các thao tác trên được thực hiện dưới laminar flow (L.A.F).
+ Phân tán hệ tiểu phân nano vào dung dịch manitol đã lọc loại khuẩn sau đó đông khô với các thông số kỹ thuật như sau:
* Giai đoạn đông lạnh: nhiệt độ -70°C, thời gian 6 giờ.
* Giai đoạn làm khô sơ cấp: nhiệt độ -15°C, tốc độ gia nhiệt 0,5C/ phút, lưu 20 giờ.
* Giai đoạn làm khô thứ cấp: nhiệt độ 30°C với tốc độ gia nhiệt 0,25°C/ phút, lưu 8 giờ, áp suất 0,5-0,6 mbar.
Trong quy trình bào chế bột đông khô chứa nano piroxicam dùng cho nhãn khoa ở phần trên, các yếu tố ảnh hưởng đến đặc tính lý hóa của tiểu phân nano đã được khảo sát bao gồm các thông số thuộc công thức như loại polyme, loại chất diện hoạt, tỉ lệ chất ổn định, loại tá dược tạo bánh,… và các thông số thuộc quy trình như nhiệt độ thí nghiệm, lực gây phân tán, thời gian tác động lực gây phân tán, điều kiện ly tâm, quy trình đông khô.
3.4. Đánh giá các chỉ tiêu chất lượng thuốc nhãn khoa chứa tiểu phân nano
3.4.1. Chỉ tiêu chất lượng
Chỉ tiêu chất lượng thuốc nhãn khoa chứa tiểu phân nano bao gồm các chỉ tiêu chất lượng chung của thuốc nhỏ mắt dưới dạng hỗn dịch, bột, bột đông khô hay vien nén vô khuẩn được phân tán lại trước khi sử dụng và các chỉ tiêu chất lượng đặc thù của tiểu phân nano.
Do đó, các chế phẩm thuốc dùng cho nhãn khoa cần phải đạt các chỉ tiêu chất lượng chung của thuốc nhỏ mắt như giới hạn về KTTP, độ vô khuẩn, giới hạn cho phép về thể tích,…
Ngoài ra, đối với các chế phẩm thuốc nhãn khoa chứa tiểu phân nano, các tính chất của tiểu phân nano cần được minh chứng như KTTP, phân bô KTTP, hình thái tiểu phân, đặc tính và chức năng bề mặt của tiểu phân, thành phân và độ tinh khiết, khả năng giải phóng dược chất,…
Đối với nghiên cứu bào chế bột đông khô chứa tiểu phân nano piroxicam dùng cho nhãn khoa như đã đề cập ở mục 3.3, các đặc tính của chế phâm được đề cập như ở bảng 7.
| Chỉ tiêu | Kết quả |
| Hình thức | Bánh đông khô không nứt, vỡ,màu sắc đồng nhất, xốp, bề mặt mịn |
| Kích thước tiểu phân (nm)
Hệ số đa phân tán PDI |
347,2 ± 17,7
0,156 ± 0,028 |
| Hàm ẩm % | 1,2 ± 0,17 |
| pH sau khi phân tán lại | 6,25 ± 0,12 |
| Hàm lượng piroxicam (%) | 0,509 ± 0,011 |
| Độ hòa tan (sau 8 giờ, môi trường nước mắt nhân tạo) | 39,08 ± 1,52 |
| Độ vô khuẩn | Đảm bảo vô khuẩn |
3.4.2. Phương pháp đánh giá
Các phương pháp đánh giá một số đặc tính lý hóa của tiểu phân nano như KTTP và phân bố KTTP, điện tích bề mặt, hình thái cấu trúc hạt, thành phần, tương tác hóa học và trạng thái kết tinh, khả năng nạp thuốc và hiệu suất nano hóa, khả năng giải phóng thuốc in vitro.
Áp dụng đối với bào chế bột đông khô chứa tiểu phân nano piroxicam dùng cho nhãn khoa như đã đề cập ở mục 3.3, các phương pháp đánh giá một số tính chất của tiểu phân nano được trình bày cụ thể như sau:
Hình dạng, kích thước
Xác định hình dạng bằng kính hiển vi điện tử quét (SEM).
Sử dụng kính hiển vi điện tử quét FEI Quanta 200 có độ phóng đại M = 20x – 800000x, độ phân giải δ=1,0 nm, điện áp gia tốc U=0,5-30kV.
Chuẩn bị mẫu: piroxicam được sấy khô, mẫu sau đó được đưa lên khay nhom nho, và được bao phủ bởi một lớp platin mỏng trong môi trường khí argon băng thiết bị chuyên dụng.
Xác định kích thước bằng phương pháp tán xạ laser.
Thiết bị đo: máy phân tích Zetasizer NanoZS 90 (Malvem) đo KTTP trong khoảng 0,011-3,000.
Điều kiện đo: pha hỗn dịch đến nồng độ dược chất khoảng 0,005%. Hệ số tán xạ ánh sáng của Eudragit là 1,71, piroxicam là 1,33.
Phép đo cho kết quả kích thước trung bình của các tiểu phân, mức độ đồng đều KTTP thể hiện ở chỉ số đa phân tán (PDI).
Thế zeta
Hỗn dịch chứa piroxicam nano được pha loãng đến nồng độ 0,005% trước khi đưa vào máy đo.
Cấu trúc
Phân bố giữa dược chất và tá dược được xác định bằng hình ảnh chụp qua kính hiển vi điện tử truyền qua (áp dụng cho tiểu phân nano polyme).
Trạng thái kết tinh của dược chất được xác định bằng phương pháp nhiễu xạ tia (X-ray): các mẫu được nghiền mịn, đặt vào khay kim loại đưa vào thiết bị chiếu tia X với bước sóng tia tới từ bức xạ Ka của đồng kim loại (Cu) là Xcu = 1,5405A°, cường độ dòng điện 30 mA, điện áp 40 kV, góc quét từ 5° – 60°, tốc độ quét 2°/phút.
Hàm lượng dược chất
Phương pháp sắc ký lỏng hiệu năng cao được sử dụng để đinh lượng piroxicam.
– Mẫu chuẩn: cân chính xác khoảng 25,0 mg piroxicam chuẩn, hòa tan trong methanol vừa đủ 50 ml. Lấy 1 ml dung dịch này pha loãng 10 lần bằng methanol chứa 0,01 N acid hydrocloric được dung dịch có nồng độ khoảng 50 µ/ml. Lọc qua màng lọc 0,45 µm.
– Mẫu thử: cân chính xác lượng mẫu thử (bột đông khô piroxicam tương ứng với 25 mg piroxicam, hòa tan trong methanol vừa đủ 50 ml, siêu âm 5 phút. Lấy dung dịch này pha loãng 10 lần bằng dung dịch methanol chứa 0,01 N acid hydrocloric. Lọc qua màng lọc 0,45 µm.
– Pha động: Ethanol: dung dịch đệm citro-phosphat (55:45), pha động được lọc qua màng lọc 0,45 pm, siêu âm 15 phút. pH của pha động trong khoảng 4,9-5,0. Điều kiện sắc ký: tốc độ dòng: 1,0 ml phút, thể tích tiêm mẫu: 20 pi, detector uv, đo ở bước sóng 254 nm.
– Tiêm lần lượt dung dịch chuẩn và dung dịch thử lên hệ thống sắc ký, ghi lại sắc ký đồ. Dựa vào diện tích píc, lượng cân chuẩn, hàm lượng chuẩn, hệ số pha loãng tính ra hàm lượng piroxicam trong chế phẩm.
Thử nghiệm hòa tan
Sử dụng thiết bị cánh khuấy với tốc độ 100 vòng/phút. Môi trường 900 ml nước cất ở nhiệt độ: 37 ± 0,5°C.
Mẫu nano piroxicam sau đông khô được cân chính xác với lượng dược chất tương ứng khoảng 50 mg piroxicam. Sau từng khoảng thời gian nhất định trong vòng 6 giờ hút 5 ml dung dịch (có bổ sung 5 ml nước vào môi trường). Ly tâm 15000 vòng/phút trong 30 phút. Hút 1 ml dịch sau khi ly tâm, thêm dung dịch methanol chứa 0,01 N acid hydrochloric vừa đủ 10 ml. Định lượng piroxicam trong dịch pha loãng bằng phương pháp HPLC.
Ngoài ra, hỗn dịch chứa nano piroxicam đã được đánh giá sinh khả dụng trên mắt thỏ với kết quả chứng tỏ hỗn dịch nano chứa 0,5 % piroxicam có khả năng kéo dài tác dụng và tăng tính thấm của piroxicam nên cải thiện đáng kể sinh khả dụng của chế phẩm.
4. BÀO CHẾ THUỐC DÙNG NGOÀI DA
4.1. Các dạng thuốc chứa tiểu phân nano dùng ngoài da
Do có diện tích bề mặt lớn, da là cơ quan dễ tiếp cận của cơ thể người, là nơi thường được lựa chọn để sử dụng thuốc tại chỗ. Lớp biểu bì, lớp hạ bì, nang lông, tuyến mồ hôi bao gồm cả da chứa lớp sừng ngoài cùng, tạo thành lớp rào cản hiệu quả sự xâm nhập của các chất vào bên trong cơ thể. Con đường qua nang lông và lớp biểu bì (cả liên bào và xuyên bào) là các con đường chính để vận chuyển các phân tử đi qua lớp da còn nguyên vẹn (Hình 14).
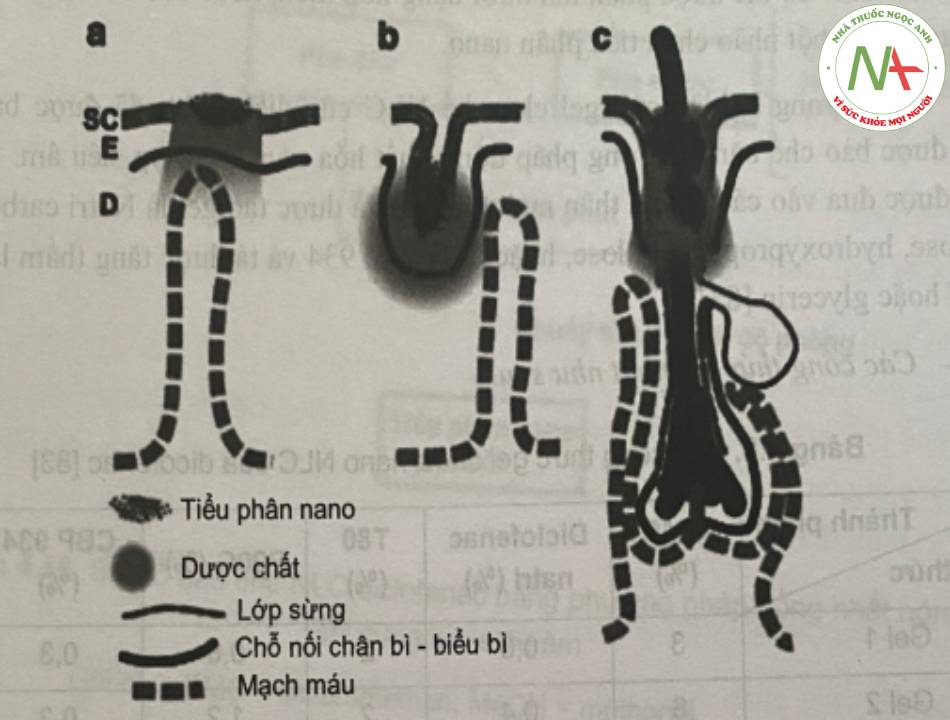
Các dạng bào chế truyền thống để bôi da thường có bản chất bán rắn và bao gồm các gel thân nước (như hydrogel), dầu và gel kỵ nước (như oleogel) hay hỗn hợp cả hai như kem dầu trong nước hoặc nước trong dầu.
Dựa vào chức năng,l ớp sừng là lớp rào cản chính của da đối với quá trình vận chuyển các thuốc. Một phương pháp tiếp cận khá hứa hẹn để tăng cường khả năng xâm nhập của các phân tử qua lớp sừng là sử dụng các nano lipid (như SLN hay NLC) bởi vì tính thân dầu của chúng tạo điều kiện thuận lợi cho các chất đi qua lớp sừng. Ngoài ra, các hệ chất mang này có thể giúp vận chuyển các phân tử đi vào các nang lông hoặc kiểm soát giải phóng bằng cách tạo các kho chứa trên bề mặt da.
Trong các dạng bào chế kể trên thì hydrogel và nanoemulgel (một hệ tương tự hydrogel) là các công thức bán rắn hứa hẹn nhất dùng để bôi da chứa SLN hay NLC. Tuy nhiên, việc đưa các nano lipid vào dạng kem dầu/nước sẽ thuận lợi hơn bởi vì tác dụng hydrat hóa hiệp đồng có thể thu được nhờ các lipid có ở hai hệ. Việc lựa chọn các tá dược, đặc biệt là lipid và chất diện hoạt đóng vai trò quan trọng đối với cơ chế tương tác giữa các nano lipid với lớp sừng và việc hấp thu các phân tử sau đó.
4.2. Bào chế thuốc chứa tiểu phân nano dùng ngoài da
Về cơ bản, quy trình bào chế thuốc chứa tiểu phân nano dùng ngoài da gồm quy trinh bao che tieu phan nano và quy trình đưa các tiểu phân này vào các dạng thuốc. Các tiểu phân nano có thể được phân tán dưới dạng hỗn dịch, hoặc bào chế dưới dạng thuốc mỡ, gel, kem, bột nhão chứa tiểu phân nano.
Ví dụ, trong nghiên cứu gel chứa hệ NLC của diclofenac đã được bào chế, hệ NLC được bào chế bằng phương pháp đồng nhất hóa nóng kết hợp siêu âm. Sau đó, hệ NLC được đưa vào các hệ gel thân nước với các tá dược tạo gel là Natri carboxymethyl cellulose, hydroxypropyl cellulose, hoặc Carbopol 934 và tá dược tăng thấm là propylen glycol hoặc glycerin.
– Các công thức tốt nhất như sau:
| Thành phần, công thức | GMS | Diclofenac (%) | T80 (%) | P90G (%) | CBP 934 (%) | PG (%) |
| Gel 1 | 3 | 0,5 | 2 | 0,6 | 0,3 | 5 |
| Gel 2 | 6 | 0,4 | 2 | 1,2 | 0,3 | 5 |
| Gel 3 | 3 | 0,2 | 2 | 0,6 | 0,3 | 5 |
– Quy trình bào chế:
NLC diclofenac natri được bào chế bằng phương pháp đồng nhất nóng, sử dụng lực siêu âm được thể hiện ở sơ đồ hình 15.
Mô tả quy trình bào chế tiểu phân nano NLC diclofenac:
+ Chuẩn bị pha dầu: dược chất, phospholipid, lipid được hòa tan trong một lượng hỗn hợp dung môi dieloromethan:methanol (tỉ lệ 6:2), khuấy từ ở nhiệt độ 60°C để thu được dung dịch đồng nhất. Tiếp tục duy trì nhiệt độ ở 70-80°C dưới tác dụng nhiệt của bể điều nhiệt đến khi dung môi bay hơi hoàn toàn tạo thành màng lipid và dược chất. Màng lipid được đun chảy lên quá nhiệt độ nóng chảy của lipid tạo pha dầu.
+ Chuẩn bị pha nước: dung dịch chất diện hoạt được đưa lên cùng nhiệt độ với nhiệt độ pha dầu, với pH pha ngoại bằng 3.
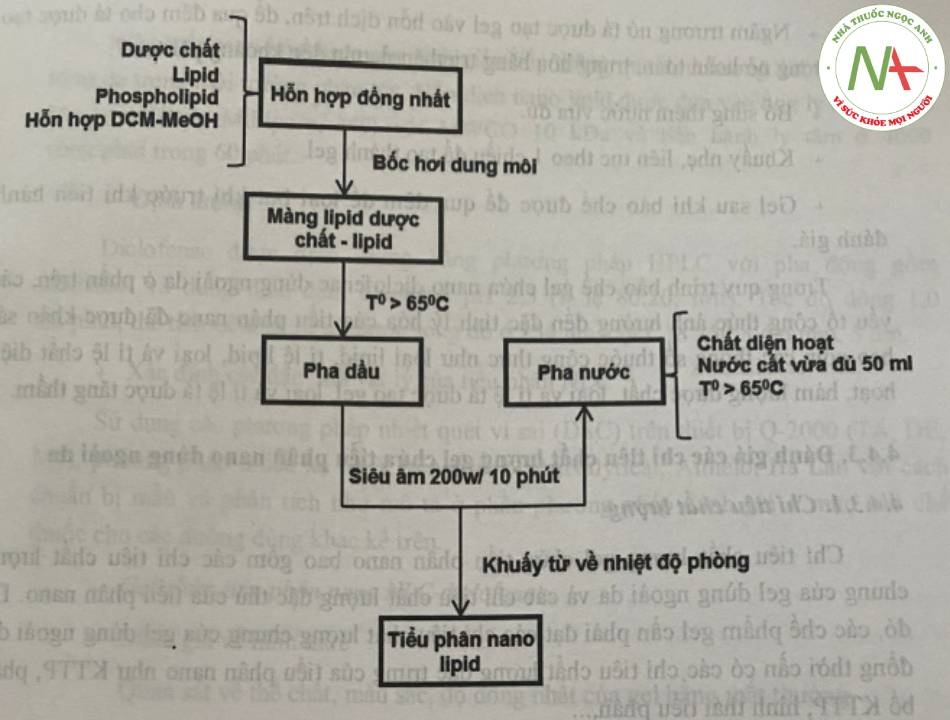
+ Nhũ hóa 2 pha: pha dầu được nhỏ từ từ vào pha nước dưới tác dụng của khuấy từ và lực siêu âm cường độ 200W và thời gian 10 phút để thu được nhũ tương đầu trong nước. Nhiệt độ trong quá trình nhũ hóa được duy trì ở nhiệt độ 70 -80°C. Bổ sung thêm lượng pha ngoại đã được đun nóng ở cùng nhiệt độ để duy trì vừa đủ 100 ml hệ. Kết thúc quá trình nhũ hóa, hệ được tiếp tục khuấy từ đến nhiệt độ phòng để hóa rắn các tiểu phân nano lipid.
– Bào chế gel chứa tiểu phẫn nano lipid diclofenac:
+ Cân hỗn dịch tiểu phân nano lipid (80 g), tá dược tạo gel (Carbopol 934), tá dược tăng thấm (propylen glycol – PG).
+ Phân tán tá dược tăng thấm vào hỗn dịch tiểu phẫn nano lipid tạo hỗn dịch đồng nhất.
+ Ngâm trương nở tá dược tạo gel vào hỗn dịch trên, để qua đêm cho tá dược tạo gel trương nở hòan toàn, trung hòa bằng triethanolamin đến khoảng pH 6 – 7.
+ Bổ sung thêm nước vừa đủ.
+ Khuấy nhẹ, liên tục theo 1 chiều để tạo thành gel.
+ Gel sau khi bào chế được để qua đêm để loại bọt khí trước khi tiến hành đánh giá.
Trong quy trình bào chế gel chứa nano diclofenac dùng ngoài da ở phần trên, các yếu tố công thức ảnh hưởng đến đặc tính lý hóa của tiểu phân nano đã được khảo sát bao gồm các thông số thuộc công thức như loại lipid, tỉ lệ lipid, loại và tỉ lệ chất diện hoạt, hàm lượng dược chất, loại và tỉ lệ tá dược tạo gel, loại và tỉ lệ tá dược tăng thấm.
4.3. Đánh giá các chỉ tiêu chất lượng gel chứa tiểu phân nano dùng ngoài da
4.3.1. Chỉ tiêu chất lượng
Chỉ tiêu chất lượng gel chứa tiểu phân nano bao gồm các chỉ tiêu chất lượng chung của gel dùng ngoài da và các chỉ tiêu chất lượng đặc thù của tiêu phân nano. Do đó, các chế phẩm gel cần phải đạt các chỉ tiêu chất lượng chung của gel dùng ngoài da, đồng thời cần có các chỉ tiêu chất lượng đặc trưng của tiểu phân nano như KTTP, phân bố KTTP, hình thái tiểu phân,…
4.3.2. Phương pháp đánh giá
Các phương pháp đánh giá một số đặc tính lý hóa của tiểu phân nano như KTTP và phân bố KTTP, điện tích bề mặt, hình thái cấu trúc hạt, thành phần, tương tác hóa học và trạng thái kết tinh, khả năng nạp thuốc và hiệu suất nano hóa, khả năng giải phóng thuốc in vitro.
– Hỗn dịch tiểu phân nano NLC diclofenac
+ Kích thước tiểu phân và hình thái
Các mẫu được pha loãng 10 lần trong nước cất trước khi tiến hành đo KTTP và phân bố KTTP bằng phương pháp tán xạ ánh sáng động trên máy Zetasizer Nano zs.
Hình thái của tiêu phân nano NLC chứa diclofenac được quan sát bằng thiết bị đo TEM (Hitachi 7600, Nhật Bản). Mẫu thử được đưa lên lưới đồng được bao với carbon cố định bằng acid phosphotungstic 2% (kl/tt), và để khô ngoài không khí trong vòng 15 phút trước khi đo.
+ Xác định hiệu suất nano hóa và khả năng nạp thuốc
Hiệu suất nano hóa được xác định gián tiếp thông qua đinh lượng dược chất phân tử tự do trong moi trường phân tán. Hỗn dịch nano lipid được đưa vào ống ly tâm màng (Amicon Ultra, Millipore, Mỹ) với MWCO 10 kDa và tiến hành ly tâm ở 4000 vòng/phút trong 60 phút.
+ Định lượng
Diclofenac được định lượng bằng phương pháp HPLC với pha động gồm methanol và dung dịch đệm phosphat pH 2,5 (tỉ lệ 80:20, tt/tt). Tốc độ dòng 1,0 ml/phút, thể tích tiêm là 20 μl, bước sóng đo ở 254 nm, cột C18 250 x 4.6 mm, 5 μm.
+ Xác định các đặc tính vật lý của tiểu phân NLC
Sử dụng các phương pháp nhiệt quét vi sai (DSC) trên thiết bị Q-2000 (TA, DE, Mỹ), phương pháp nhiễu xạ tia X trên thiết bị PANalytical, Almelo, Hà Lan với cách chuẩn bị mẫu và phân tích như mô tả ở phần phương pháp đánh giá ở mục bào chế thuốc cho các đường dùng khác kể trên.
– Gel chứa tiểu phân nano NLC diclofenac
+ Đánh giá về hình thức
Quan sát về thể chất, màu sắc, độ đồng nhất của gel bằng mắt thường.
+ Đo pH
Cân chính xác 1 g gel, pha loãng 10 lần bằng nước cất đã lọc qua màng 0,2 μm, sau đó tiến hành đo pH bằng máy đo pH.
+ Định lượng
Phân tán 1,0 g gel vào 15 ml ethanol, đun cách thủy ở khoảng 60°C trong 30 phút để phá vỡ cấu trúc hệ nano, làm lạnh về nhiệt độ phòng, thêm ethanol vừa đủ 20 ml, làm lạnh ở nhiệt độ thấp để lipid tủa lại. Tiến hành ly tâm ở 8000 vòng/phút trong 15 phút, hút lấy phần dịch trong, lọc qua màng 0,45 μm thu được dung dịch A. Xác định lượng dược chất trong dung dịch A bằng phương pháp HPLC với các thông số đã nêu.
Các phương pháp đánh giá một số đặc tính lý học của tiểu phân nano như KTTP và phân bố KTTP, điện tích bề mặt của tiểu phân nano NLC diclofenac trong gel cũng có thể được thực hiện sau khi phân tán gel vào nước, tinh chế bằng cách ly tâm sử dụng màng siêu lọc. Phân tán tiểu phân nano trên màng lọc vào nước trước khi đo KTTP, và thế zeta.
+ Khả năng giải phóng thuốc in vitro và khả năng thấm thuốc ex vivo
Khả năng giải phóng thuốc in vitro được xác định trong vòng 24 giờ sử dụng màng cellulose acetat với MWCO 12 kDa (Sigma-Aldrich, Mỹ) trên các tế bào Franz (Hason Research, Mỹ) với môi trường giải phóng là đệm phosphat salin pH 7,4. Môi trường được khuấy từ ở 400 vòng/phút và duy trì ở 37 ± 0,5°c. Ở các thời điểm nhất định, 1 ml môi trường được hút và thay thế bằng một thể tích tương ứng môi trương mới. Nồng độ diclofenac được định lượng bằng phương pháp HPLC.
Tương tự, khả năng thấm thuốc ex vivo cũng được xác định bằng phương pháp như trên, tuy nhiên màng cellulose acetat được thay thế bằng da chuột đực đã được loại bỏ lông và lớp mỡ. Ngoài ra, nồng độ thuốc lưu giữ trên da cũng được xác định băng cách chiết bằng ethanol kết hợp siêu âm và ly tâm.
– Kết quả đánh giá chỉ tiêu chất lượng của sản phẩm
Kết quả thu được các tiểu phân nano có kích thước từ 50-150 nm, có hình cầu. Về công thức tạo gel, Carbopol 934 được lựa chọn làm tá dược tạo gel và propylen glycol làm tá dược tăng thấm. Kết quả đánh giá tính thấm qua da chuột cho thấy ở cùng một nồng độ lipid, khi kích thước tiểu phân càng nhỏ và khả năng nạp thuôc càng cao thì càng làm tăng tính thấm của dược chất cũng như lượng dược chât lưu giữ ở da. Về hoạt tính chống viêm, kết quả đánh giá cho thấy xu hướng tương tự khi tiêu phân càng nhỏ và khả năng nạp thuốc càng lớn thì hiệu quả chống viêm vivo càng cao.
5. BÀO CHẾ THUỐC CHO ĐƯỜNG DÙNG KHÁC
Đối với các dạng thuốc dùng qua đường phổi, việc thiết kế công thức chứa tiểu phân nano có thể đưa các phân tử nhỏ và các phân tử lớn hơn như peptid qua đường phổi thông qua bộ phận khí dung, ví dụ như insulin dạng khí dung. Mặc dù có một số thuận lợi khi bào chế ở kích thước nano như đưa tiểu phân vào sâu trong phổi, giải phóng dược chất kéo dài và độc tính thấp, việc sử dụng các tiểu phân nano có chứa thuốc dùng theo đường phổi có hạn chế lớn bởi vì quán tính thấp của chúng có thể khiến chúng có thể bị tống ra sau khi xịt khí dung. Ngoài ra, kích thước nhỏ của chúng có thể dẫn đến sự kết tụ do có năng lượng bề mặt lớn, khiến cho việc xử lý các tiểu phân nano rất khó khăn. Vì vậy, các tiểu phân nano mang dược chất cần các hệ chất mang có đường kính khí động học trung bình khối lượng (MMAD) phù hợp cho việc đưa thuốc theo đường phổi hiệu quả. So với các loại nano khác, việc sử dụng nano lipid có nhiều triên vọng trong việc điều trị các bệnh ở phổi tại chỗ hoặc các bệnh toàn thân.
Ngoài ra, các tiêu phân nano có thể được bào chế để dùng theo đường trực tràng. Nano lipid răn có thê đưa vào dạng gel để sử dụng theo đường dùng này. Công thức gel chưa nano lipid rắn của flurbiprofen nhạy cảm bởi nhiệt giúp thuận lợi khi sử dụng đương trực trang, dê dàng gel hóa nhanh khi đưa vào trực tràng từ đó giúp làm giảm khả năng giải phóng dược chất ồ ạt ban đầu, kéo dài thời gian giải phóng, và tăng sinh khả dụng so với công thức chứa dược chất.
Như vậy, trong các thập kỷ gần đây, rất nhiều chiến lược mới đã và đang được phát triển để bào chế các hệ vận chuyển thuốc dựa trên công nghệ nano. Cho đến này, các hệ mang thuốc này đã bước đầu mang đến một số sản phẩm và ứng dụng trong lĩnh vực dược phẩm cũng như y sinh học. Tuy nhiên, vẫn còn nhiều vấn đề cần giải quyết để các ứng dụng này mang tính khả thi hơn nữa như việc nâng cấp quy mô bào chế, ổn định sản phẩm và minh chứng tính an toàn, ưu thế tác dụng sinh học. Trong tương lai, hy vọng sẽ có nhiều nghiên cứu chuyên sâu tập trung vào các tiểu phân nano đã thành phần có tác dụng hướng đích nhằm tận dụng tối đa các ưu điểm của hệ vận chuyển thuốc dựa trên công nghệ nano này.
CÂU HỎI LƯỢNG GIÁ
- Trình bày các ứng dụng của công nghệ nano trong sản xuất thuốc dùng đường tiêm, đường uống, dùng trong nhãn khoa, dùng ngoài da. Cho ví dụ.
- Trình bày các ứng dụng của công nghệ nano trong sản xuất thuốc dùng cho các đường dùng khác.
- Trình bày phương pháp đánh giá tiêu chuẩn chất lượng của các dạng thuốc chứa tiểu phẫn nano.
