Bệnh hô hấp, COVID-19, Thông Tin Thuốc
Thuốc kháng virus đã được phê duyệt hoặc đang được đánh giá để điều trị COVID-19
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tóm tắt khuyến nghị
Remdesivir là loại thuốc duy nhất được Cơ quan Quản lý Thực phẩm và Dược phẩm phê duyệt để điều trị COVID-19. Trong phần này, Ban Hướng dẫn Điều trị COVID-19 (Ban Hội thẩm) đưa ra các khuyến nghị về việc sử dụng thuốc kháng virus để điều trị COVID-19 dựa trên dữ liệu có sẵn. Như trong việc quản lý bất kỳ bệnh nào, quyết định điều trị cuối cùng nằm ở bệnh nhân và cơ sở cung cấp dịch vụ chăm sóc sức khỏe của họ. Để biết thêm thông tin về các tác nhân kháng virus này, hãy xem Bảng 2e.

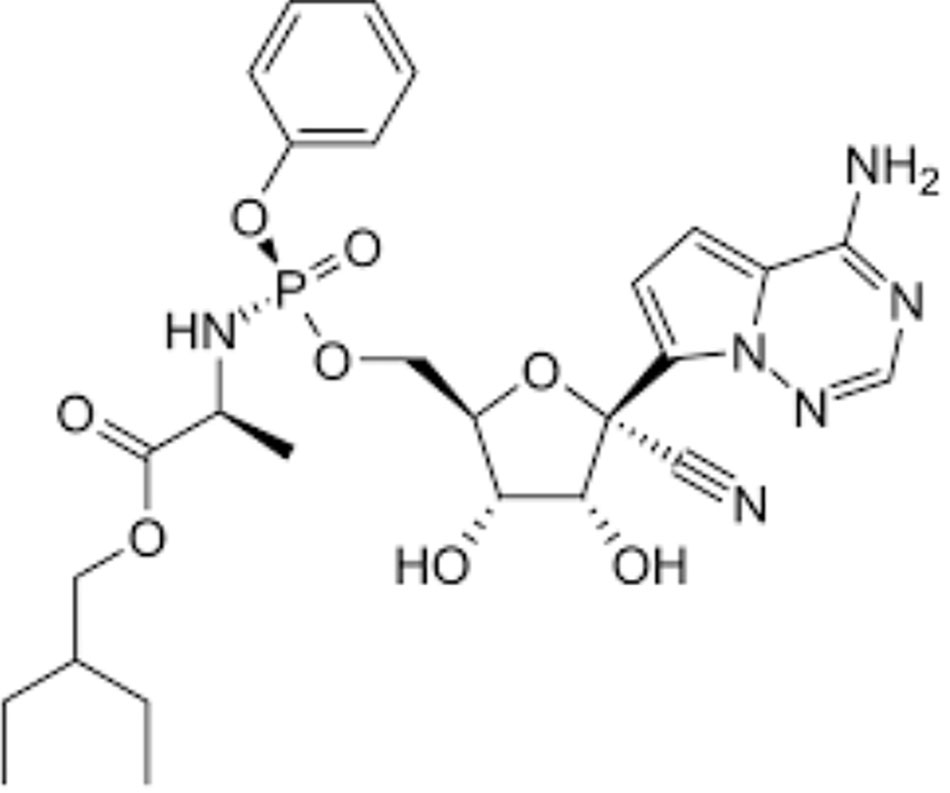
Remdesivir
Xem nội dung Quản lý Điều trị Người lớn Nhập viện với COVID-19 để biết các khuyến nghị về việc sử dụng remdesivir có hoặc không có dexamethasone.
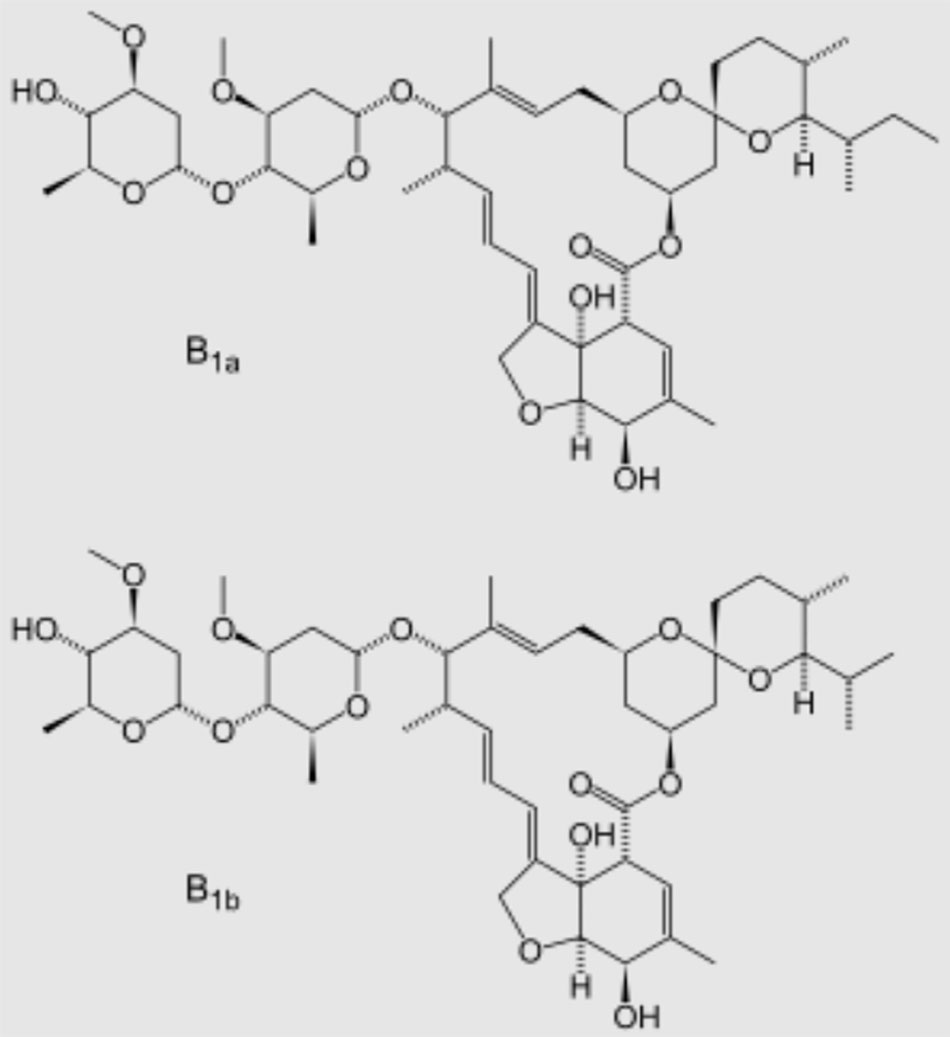
Ivermectin
Không có đủ bằng chứng để Ban hội thẩm khuyến nghị sử dụng hoặc không sử dụng ivermectin để điều trị COVID-19. Cần có kết quả từ các thử nghiệm lâm sàng được cung cấp đầy đủ, được thiết kế tốt và tiến hành tốt để cung cấp hướng dẫn cụ thể hơn, dựa trên bằng chứng về vai trò của ivermectin trong điều trị COVID-19.
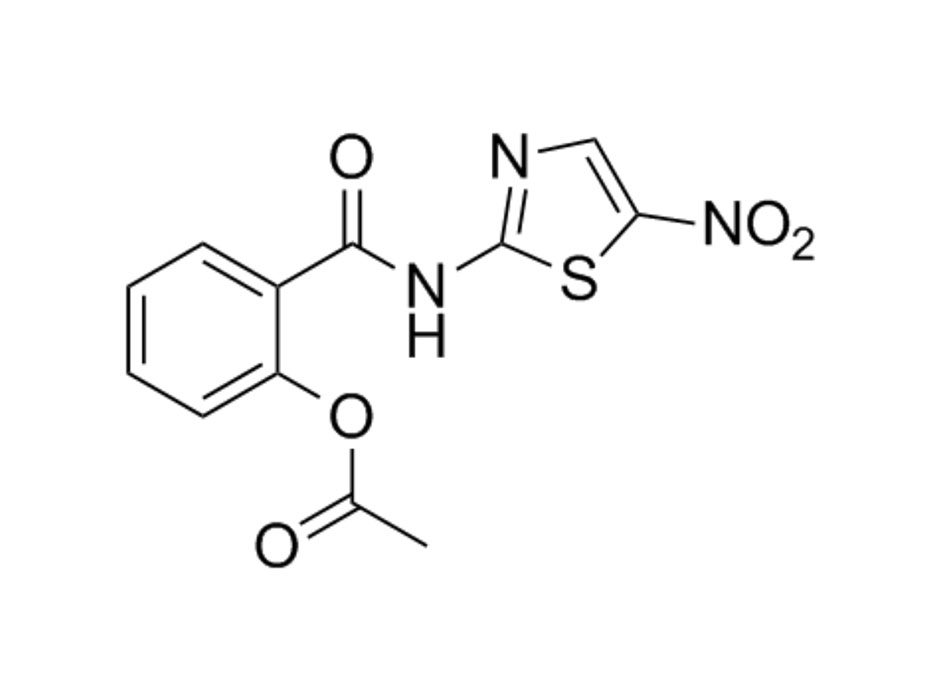
Nitazoxanide
Ban Hội thẩm khuyến cáo không nên sử dụng nitazoxanide để điều trị SARS-COV-2, ngoại trừ trong một thử nghiệm lâm sàng (BIIa). Hydroxychloroquine hoặc Chloroquine và/hoặc Azithromycin.
Ban Hội thẩm khuyến cáo không nên sử dụng chloroquine hoặc hydroxychloroquine và/ hoặc azithromycin để điều trị COVID-19 ở bệnh nhân nhập viện (AI) và bệnh nhân không nhập viện (AIIa). Lopinavir/Ritonavir và các chất ức chế HIV Protease khác.
Ban Hội thẩm khuyến cáo không nên sử dụng lopinavir/ritonavir và các chất ức chế protease HIV khác để điều trị COVID-19 ở bệnh nhân nhập viện (AI) và bệnh nhân không nhập viện (AIII).
Độ mạnh của khuyến nghị: A: Khuyến nghị mạnh mẽ cho tuyên bố; B: Khuyến nghị vừa phải cho tuyên bố; C: Khuyến nghị tùy chọn cho tuyên bố.
Chất lượng bằng chứng cho khuyến nghị: I: Một hoặc nhiều thử nghiệm ngẫu nhiên không có giới hạn lớn; IIa: Các thử nghiệm ngẫu nhiên khác hoặc phân tích nhóm con của các thử nghiệm ngẫu nhiên; IIb: Các thử nghiệm lâm sàng đối chứng không ngẫu nhiên hoặc các nghiên cứu thuần tập quan sát; III: Ý kiến chuyên gia.
Liệu pháp kháng virus
Vì sự tăng sinh của SARS-CoV-2 dẫn đến nhiều biểu hiện lâm sàng của COVID-19, các liệu pháp kháng virus đang được nghiên cứu để điều trị COVID-19. Những loại thuốc này ức chế sự xâm nhập của virus (thông qua thụ thể men chuyển 2 [ACE2] và protease serine xuyên màng 2 [TMPRSS2]), dung hợp màng virus và nội bào, hoặc hoạt động của protease 3-chymotrypsin giống SARS-CoV-2 (3CLpro) và RNA polymerase phụ thuộc RNA.1 Bởi vì sự sao chép của virus có thể hoạt động sớm trong quá trình bị COVID-19, liệu pháp kháng virus có thể có tác động lớn nhất trước khi bệnh tiến triển thành trạng thái tăng viêm có thể đặc trưng cho các giai đoạn sau của bệnh , bao gồm cả bệnh nặng. 2 Vì lý do này, cần phải hiểu vai trò của thuốc kháng virus trong điều trị bệnh nhẹ, trung bình, nặng và nguy kịch để tối ưu hóa việc điều trị cho những người bị COVID-19.
Các phần sau đây mô tả lý do cơ bản của việc sử dụng các loại thuốc kháng virus khác nhau, cung cấp các khuyến nghị của Ban Hội thẩm hướng dẫn điều trị COVID-19 về việc sử dụng các loại thuốc này để điều trị COVID-19 và tóm tắt dữ liệu thử nghiệm lâm sàng hiện có. Các liệu pháp kháng virus bổ sung sẽ được thêm vào phần này của Hướng dẫn khi có bằng chứng mới.
Bảng 2e. Đặc điểm của các loại thuốc chống virus đã được phê duyệt hoặc đang được đánh giá để điều trị COVID-19
Cập nhật lần cuối: ngày 8 tháng 7 năm 2021.
Thông tin trong bảng này được lấy từ dữ liệu về việc sử dụng các loại thuốc này cho các chỉ định được FDA chấp thuận hoặc trong các thử nghiệm điều tra, và nó được bổ sung với dữ liệu về việc sử dụng chúng ở bệnh nhân COVID-19, nếu có.
Thông tin về CQ, HCQ và LPV/RTV có sẵn hướng dẫn trong các phiên bản lưu trữ. Tuy nhiên, Ban Hội thẩm khuyến cáo không nên sử dụng các thuốc này để điều trị COVID-19.
Có giới hạn hoặc không có dữ liệu về việc thay đổi liều lượng cho bệnh nhân suy nội tạng hoặc những người cần thiết bị hỗ trợ bên ngoài cơ thể. Vui lòng tham khảo nhãn sản phẩm, khi có sẵn.
Hiện không có đủ dữ liệu để xác định liệu một số loại thuốc có thể được dùng chung một cách an toàn với các liệu pháp điều trị COVID-19 hay không. Khi sử dụng đồng thời các thuốc có cấu hình độc tính tương tự, hãy cân nhắc thực hiện giám sát an toàn bổ sung.
Các tác dụng phụ, đối kháng hoặc hiệp đồng tiềm ẩn và sự an toàn của việc sử dụng các liệu pháp phối hợp để điều trị COVID-19 vẫn chưa được biết rõ. Các bác sĩ lâm sàng được khuyến khích báo cáo AEs cho Chương trình MedWatch của FDA.
Để biết thông tin về tương tác thuốc, vui lòng tham khảo nhãn sản phẩm và truy cập trang web Tương tác thuốc Liverpool COVID-19.
Để biết các khuyến nghị của Ban hội thẩm về việc sử dụng các loại thuốc được liệt kê trong bảng này, vui lòng tham khảo các phần thuốc riêng lẻ hoặc Quản lý điều trị cho người lớn nhập viện với COVID-19.
| Phác đồ dùng thuốc
Các liều được liệt kê ở đây dành cho các chỉ định đã được phê duyệt hoặc từ các kinh nghiệm được báo cáo hoặc các thử nghiệm lâm sàng. |
Tác dụng bất lợi | Các thông số giám sát | Khả năng tương tác giữa các thuốc | Nhận xét và liên kết đến các thử nghiệm lâm sàng |
| Remdesivir | ||||
| Liều lượng và chỉ định được liệt kê dưới đây lấy từ thông tin sản phẩm của FDA. Vui lòng xem Quản lý điều trị cho người lớn nhập viện với COVID-19 để biết các khuyến nghị của Ban hội thẩm về thời điểm sử dụng RDV.
Dành cho người lớn và trẻ em nằm viện (> 12 tuổi và nặng > 40 kg) Đối với những bệnh nhân không được thở máy và/ hoặc sử dụng ECMO:
Đối với bệnh nhân thở máy và/ hoặc bệnh nhân điều trị ECMO:
Liều đề xuất trong EUAb cho trẻ em nhập viện Đối với bệnh nhân Cân nặng từ 3,5 kg đến <40 kg:
|
Buồn nôn.
Độ cao ALT và AST. Quá mẫn cảm. Tăng thời gian prothrombin. Thuốc dùng là SBECD, có liên quan đến nhiễm độc gan và thận. Sự tích tụ SBECD có thể xảy ra ở bệnh nhân suy thận vừa hoặc nặng. Mỗi lọ 100 mg bột đông khô RDV chứa 3 g SBECD, và mỗi lọ 100 mg/20 mL dung dịch RDV chứa 6 g SBECD. • Các bác sĩ có thể xem xét ưu tiên sử dụng công thức bột đông khô (chứa ít SBECD hơn) ở bệnh nhân suy thận. |
Phản ứng truyền dịch.
Cần theo dõi chức năng thận và chức năng gan trước và trong khi điều trị theo chỉ định lâm sàng. Trong thông tin sản phẩm của FDA, RDV không được khuyến nghị khi eGFR < 30 mL/phút. Xem phần Remdesivir để thảo luận về việc sử dụng RDV ở những người bị suy thận. Có thể phải ngừng RDV nếu mức ALT tăng lên > 10 lần ULN và nên ngừng nếu có sự gia tăng ở mức ALT và các dấu hiệu hoặc triệu chứng của viêm gan được quan sát thấy3 |
Các nghiên cứu về tương tác thuốc-thuốc trên lâm sàng của RDV chưa được thực hiện.
Trong ống nghiệm, RDV là chất nền của CYP3A4, OATP1B1 và P-gp và là chất ức chế CYP3A4, OATP1B1, OATP1B3 và MATE1.1 Mức độ phơi nhiễm RDV được kỳ vọng là tối thiểu đến không khi RDV được dùng chung với dexamethasone (Gilead Sciences, thông báo bằng văn bản, tháng 7 năm 2020). CQ hoặc HCQ có thể làm giảm hoạt tính kháng virus của RDV; Không nên dùng chung các loại thuốc này.3 Không có tương tác đáng kể nào được mong đợi giữa RDV và oseltamivir hoặc baloxavir (Khoa học Gilead, thông tin liên lạc bằng văn bản và cá nhân, tháng 8 và tháng 9 năm 2020). |
RDV nên được quản lý tại bệnh viện hoặc cơ sở chăm sóc sức khỏe có thể cung cấp mức độ chăm sóc tương tự như bệnh viện nội trú.
RDV được FDA chấp thuận để điều trị COVID-19 ở bệnh nhân người lớn và trẻ em nằm viện (12 tuổi và nặng 40 kg). EUAb có sẵn cho bệnh nhi nhập viện có cân nặng từ 3,5 kg đến < 40 kg trở lên, < 12 tuổi và cân nặng ≥ 3,5 kg. Danh sách các thử nghiệm lâm sàng có sẵn tại đây: Remdesivir |
| Phác đồ dùng thuốc
Các liều được liệt kê ở đây dành cho các chỉ định đã được phê duyệt hoặc từ các kinh nghiệm được báo cáo hoặc các thử nghiệm lâm sàng. |
Tác dụng bất lợi |
Các thông số giám sát |
Khả năng tương tác giữa các thuốc |
Nhận xét và liên kết đến các thử nghiệm lâm sàng |
| Đối với những bệnh nhân không được thở máy và/hoặc đang điều trị bằng ECMO, thời gian là 5 ngày. Nếu bệnh nhân không có cải thiện về mặt lâm sàng sau 5 ngày, có thể kéo dài thời gian điều trị lên đến 10 ngày.
Đối với bệnh nhân thở máy và/ hoặc bệnh nhân điều trị bằng ECMO, thời gian điều trị khuyến cáo là 10 ngày. Đối với bệnh nhân dưới 12 tuổi và cân nặng ≥ 40 kg: Liều tương tự như cho người lớn. |
||||
| Ivermectin | ||||
| Người lớn: Liều được sử dụng phổ biến nhất trong các thử nghiệm lâm sàng là IVM 0,2–0,6 mg/kg đường uống dùng một liều duy nhất hoặc một lần mỗi ngày trong tối đa 5 ngày. | Nói chung dung nạp tốt.
Viêm ngứa. Hiệu ứng GI (ví dụ, buồn nôn, tiêu chảy). Các AE thần kinh đã được báo cáo khi IVM được sử dụng để điều trị các bệnh ký sinh trùng, nhưng không rõ liệu các AE này là do IVM hay do các bệnh lý cơ bản gây ra. |
Giám sát các AE tiềm năng. | Chất nền CYP3A4 nhỏ.
Chất nền p-gp. |
Thường được cho uống khi bụng đói với nước; tuy nhiên, sử dụng IVM cùng với thức ăn sẽ làm tăng khả dụng sinh học của nó.4
Danh sách các thử nghiệm lâm sàng có sẵn tại đây: Ivermectin. |
| Phác đồ dùng thuốc
Các liều được liệt kê ở đây dành cho các chỉ định đã được phê duyệt hoặc từ các kinh nghiệm được báo cáo hoặc các thử nghiệm lâm sàng. |
Tác dụng bất lợi. | Các thông số giám sát. | Khả năng tương tác giữa các thuốc. | Nhận xét và liên kết đến các thử nghiệm lâm sàng. |
| Nitazoxanide | ||||
| Người lớn:
Liều lượng được báo cáo trong các nghiên cứu SARS-COV-2 dao động từ NTZ 500 mg PO 3 lần mỗi ngày đến 4 lần mỗi ngày.5,6 Liều cao hơn đang được nghiên cứu (ClinicalTrials.gov Định danh NCT04746183). Liều dùng cho các chỉ định chống động vật nguyên sinh nằm trong khoảng từ 500 mg NTZ đến 1 g PO hai lần mỗi ngày. |
Nói chung dung nạp tốt.
Đau bụng. Bệnh tiêu chảy. Buồn nôn. Nôn mửa. Nước tiểu đổi màu. Đổi màu mắt (hiếm gặp). |
Giám sát các AE tiềm năng. | Tương tác thuốc – thuốc có thể xảy ra nếu NTZ được sử dụng đồng thời với các thuốc liên kết cao với protein huyết tương khác do cạnh tranh về các vị trí liên kết.7
Nếu NTZ được dùng chung với các thuốc liên kết cao với protein khác có chỉ số điều trị hẹp, hãy theo dõi bệnh nhân về các tác dụng phụ. |
NTZ nên được dùng với thức ăn.
Hỗn dịch uống không tương đương sinh học với công thức viên nén. Danh sách các thử nghiệm lâm sàng có sẵn tại đây: Nitazoxanide. |
a Truyền trong 30–120 phút.
b FDA EUA cho phép sử dụng RDV khẩn cấp để điều trị nghi ngờ mắc COVID-19 hoặc SARS-CoV-2 đã được xét nghiệm xác nhận ở những bệnh nhi nhập viện có cân nặng từ 3,5 kg đến < 40 kg hoặc < 12 tuổi và nặng 3,5 kg. 8
Từ khóa: AE = phản ứng bất lợi; ALT = alanin transaminase; AST = aspartate aminotransferase; CQ = chloroquine; CYP = cytochrome P450; ECMO = oxy hóa màng ngoài cơ thể; eGFR = mức lọc cầu thận ước tính; EUA = Cấp phép Sử dụng Khẩn cấp; FDA = Cục Quản lý Thực phẩm và Dược phẩm; GI = đường tiêu hóa; HCQ = hydroxychloroquine; IV = tiêm tĩnh mạch; IVM = ivermectin; LPV/RTV = lopinavir/ritonavir; MATE = protein đùn đa lượng và độc tố; NTZ = nitazoxanide; OATP = polypeptit vận chuyển anion hữu cơ; the Panel = Ban Hướng dẫn Điều trị COVID-19; P-gp = P-glycoprotein; PO = bằng miệng; RDV = remdesivir; SBECD = sulfobutylether-beta-cyclodextrin; ULN = giới hạn trên của bình thường.
Thông tin tham khảo
1. Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Pharmacologic treatments for Coronavirus Disease2019 (COVID-19): a review. JAMA. 2020;323(18):1824- 1836. Available at: https://www.ncbi.nlm.nih.gov/pubmed/32282022.
2. Siddiqi HK, Mehra MR. COVID-19 illness in native and immunosuppressed states: a clinical-therapeuticstaging proposal. J Heart Lung Transplant. 2020;39(5):405-407. Available at: https://www.ncbi.nlm.nih.gov/pubmed/32362390.
3. Remdesivir (Veklury) [package insert]. Food and Drug Administration. 2020. Available at: https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/214787Orig1s000lbl.pdf.
4. Ivermectin (Stromectol) [package insert]. Food and Drug Administration. 2009. Available at: https://www.accessdata.fda.gov/drugsatfda_docs/label/2009/050742s024s025lbl.pdf.
5. Rocco PRM, Silvia PL, Cruz FF, et al. Early use of nitazoxanide in mild COVID-19 disease: randomised, placebo- controlled trial. Eur Respir J. 2021;Published online ahead of print. Available at: https://pubmed.ncbi.nlm.nih.gov/33361100/.
6. Silva M, Espejo A, Pereyra ML, et al. Efficacy of Nitazoxanide in reducing the viral load in COVID-19 patients: randomized, placebo-controlled, single-blinded, parallel-group, pilot study. MedRxiv. 2021;Preprint. Available at: https://www.medrxiv.org/content/10.1101/2021.03.03.21252509v1.full.pdf.
7. Nitazoxanide (Alinia) [package insert]. Food and Drug Administration. 2017. Available at: https://www.alinia.com/wp-content/uploads/2017/08/prescribing-information.pdf.
6. Food and Drug Administration. Fact sheet for health care providers emergency use authorization (EUA) of remdesivir (GS-5734TM). 2020. Available at: https://www.fda.gov/media/137566/download