Bệnh hô hấp
Oxy trị liệu trong thông khí hỗ trợ cho trẻ sơ sinh
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Bài viết Oxy trị liệu trong thông khí hỗ trợ cho trẻ sơ sinh của tác giả Maximo Vento được biên dịch bởi bác sĩ Đặng Thanh Tuấn.
Nội dung chính
- Quá trình chuyển hóa hiếu khí (aerobic metabolism), với sự có mặt của oxy, là yếu tố cần thiết cho sự sinh trưởng và phát triển của các sinh vật đa bào. Tuy nhiên, việc bổ sung quá nhiều oxy sẽ dẫn đến sự hình thành các gốc tự do oxy hóa (reactive oxygen specy), gây tổn hại lớn cho các thành phần tế bao như lipid, protein và axit nucleic. Các phương pháp khối phố (mass spectrometry) đã được phát triển để đo các dấu ấn sinh học của stress và tốn thương do oxy hóa trong các nghiên cứu làm sáng có kiểm soát.
- Khi bắt đầu thỏ trong khí trời, độ bão hòa oxy được đo bằng máy đo độ bảo hòa oxy mạch này (pulse oximetry), SpO, tăng nhanh để đạt đến giá trị 85% vào 5 phút sau khi sinh. Sau đó, SpO, tăng từ từ để đạt mức 90% đến 95% Sau 10 phút.
- Trẻ sơ sinh đủ tháng bị ngạt nên được thông khi ban đầu với nồng độ axy khi hút vào (FIO) ở mức 21% (không khi phỏng). FO, nên được chuẩn độ theo đáp ứng của trẻ sơ sinh được đánh giá bằng nhịp tim và SpO,.
- Trẻ sinh non, đặc biệt là trẻ rất non tháng (< 28 tuần tuổi thai) nên được thông khí trong phòng sinh với mức FIO, ban đầu là 30%. FIO, sau đó nên được chuẩn độ để đạt được SpO, trước ống ở mức 85% vào 5 phút sau khi sinh. Nếu việc đạt được độ bão hòa mục tiêu này bị chậm trễ sẽ làm tăng đáng kể nguy cơ tử vong và/hoặc xuất huyết trong não thất.
- Trẻ sinh non phải được giữ trong khoảng SpO, từ 90% đến 95% trong thời giãn ở phòng chăm sóc đặc biệt dành cho sơ sinh, nếu trẻ đang được điều trị bổ sung oxy. Cần tránh tình trạng thiếu oxy ngát quang kéo dài (SpO, < 80%) vì có thể gây chậm phát triển thần kinh. Các thiết bị vòng lập tự động để giữ Sp0, trong giới hạn được cái đặt trước đã trở thành một công cụ đầy hứa hẹn, giúp tránh tổn thương do tăng oxy mô hoặc thiếu oxy mô.
- Trẻ bị suy hô hấp nặng có thể cần được bổ sung oxy tại nhà để duy trì sự Tăng trưởng và phát triển đầy đủ. Các quy trình nghiêm ngặt và sự hợp tác của cha mẹ cũng như bác sĩ nhi khoa chăm sóc trẻ chính là yếu tố tiên quyết giúp phòng tránh các biến chứng.
Lịch sử ứng dụng oxy trong y học lâm sàng
Mặc dù đã có giai thoại chỉ ra rằng, oxy từng được người Trung Quốc biết đến vào thế kỷ XIII, nhưng kiến thức hiện tại của chúng tôi về các đặc điểm hoa học, sinh học cũng như ứng dụng lâm sàng của nó bắt nguồn từ những khám phả gần như đồng thời của C.W. Scheele (Thụy Điển), Joseph Priestley (Anh) và Antoine-Laurent de Lavoisier (Pháp). Bằng cách đốt nóng oxit thủy ngân, bạc cacbonat, magie nitrat và kali nitrat, tất cả đều cùng tạo ra một loại khí trước đây được gọi là phlogiston và sau đó được coi là nguồn sống, bởi nó cho phép một chủ chuột trong lọ kín có thể sống sót, trong khi nếu không được bổ sung khi này, chú chuột sẽ chết. Ngoài ra, Priestley đã chỉ ra rằng thực vật có khả năng tạo ra nó, và do đó, ông đã mở dường cho những nghiên cứu sâu hơn về quang hợp. Tên gọi “oxygen” (“oxy”) xuất phát từ tiếng Hy Lạp “oxys” (“axit”) và “gen” (“chất tạo ra thứ gì đó”), có nghĩa là “một chất tạo ra axit”. Ngày nay, trong tiếng Đức, oxy được biết đến với cái tên “sauosystem”, hay “chất có tính axit.
Oxy lần đầu tiên được sử dụng trong khoa sơ sinh từ thế kỷ XVIII để hối sức cho trẻ sơ sinh. Vào đầu thế kỷ XX, oxy được truyền vào mạch máu rốn của trẻ sơ sinh bị ngạt hoặc đưa trực tiếp vào hầu họng hoặc qua ống thông đạ dày. Vào thập niên 1930, oxy bắt đầu được ứng dụng rộng rãi trong điều trị trê sinh non bị suy hô hấp. Với việc sử dụng oxy, các nhà khoa học làm sàng bắt đầu mô tả những tác động tích cực và tiêu cực chắc chắn có liên quan đến việc sử dụng hạn chế hoặc tự do chất này trong điều trị bệnh nhân sơ sinh. Oxy, khi được sử dụng một cách tự do, được xác định là tác nhân gây ra tình trạng mà ban đầu gọi là xơ hóa sau thủy tinh thể (retrolental fibroplasia — RLF), đặc trưng bởi sự hình thành một lớp màng dày trong khoang sau thủy tinh thể, dẫn đến tổn thương, bong tróc võng mạc và thường gây mù lòa. Tình trạng nhân khoa nghiêm trọng này đã gây mù lòa cho khoảng 10.000 trẻ sơ sinh vào đấu những năm 1950. Các thử nghiệm ngẫu nhiên được thực hiện từ năm 1954 đến năm 1956 cho thấy rõ việc sử dụng oxygen tự do là nguyên nhân chính của RLF Điều quan trọng cần lưu ý là tại thời điểm đó, chỉ có thể theo dõi mức độ oxygen hoa của bệnh nhân bằng cách quan sát nhịp thở, nhịp tim và/hoặc màu sắc da. Bắt đầu từ thập niên 1960, việc theo dõi oxy khách quan, chẳng hạn như phân tích khí máu, theo dõi oxy qua da (transcutaneous oxygen monitoring), và sau đó là đo độ bão hòa oxy mạch này (pulse oximetry), đã được đưa vào quy trình chăm sóc trẻ sinh non thường quy cho phép thực hiện một phương pháp theo dõi tình trạng và bổ sung oxy chính xác hơn.
Không may là, việc thiết lập mối quan hệ nhân quả giữa quá nhiều oxy và RLF đã đẩy con lắc sang thái cực ngược lại, và oxy bị hạn chế đáng kể ngay cả trong những trường hợp suy hô hấp nghiêm trọng nhất. Tình trạng giảm oxy mau kéo dài cực độ dẫn đến tỷ lệ bại não và tử vong do suy hô hấp tăng theo cấp số nhân; vì vậy, cứ mỗi trẻ sơ sinh được cứu khỏi RLF thì có 16 trẻ chết vì suy hô hấp.
Kể từ năm 1995, nghiên cứu thực nghiệm và lâm sàng đã nâng cao kiến thức của chúng tôi về chuyển hóa oxy (oxygen metabolism) cũng như những hậu quả độc hại của nó trong giai đoạn sơ sinh. Tuyến đầu của nghiên cứu sơ sinh đặc biệt hướng vào ba giai đoạn khác nhau trong thời kỳ chu sinh, khi nhu cầu oxy là thường xuyên nhất:
- Giai đoạn chuyển tiếp từ bào thai sang sơ sinh và sự thích ứng sau sinh – nghĩa là nhu cầu oxy trong phòng sinh.
- Khoảng mục tiêu độ bão hòa oxy khi oxy được bổ sung trong đơn vị chăm sóc đặc biệt dành cho trẻ sơ sinh (NICU).
- Nhu cầu thở oxy tại nhà sau khi bệnh nhân mãn tính xuất viện. Chương này nhằm cung cấp một cách tiếp cận toàn diện về các khía cạnh cơ bản, chuyển hóa và lâm sàng liên quan đến liệu pháp oxy trong giai đoạn sơ sinh.
Các nguyên tắc cơ bản của sinh lý Oxygen
Chuyển hóa hiếu khí
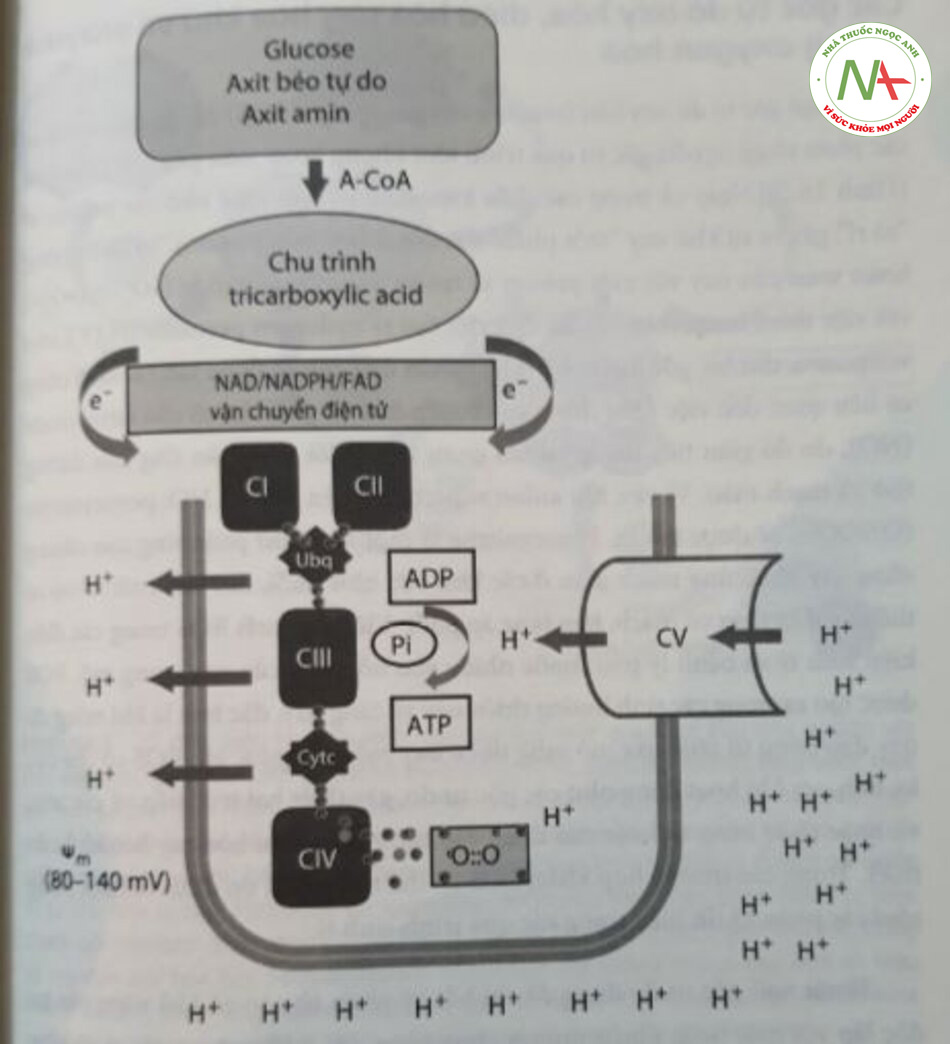
Oxy (O2) là một trong những nguyên tố phong phú nhất trong tự nhiên; là thành phần phong phú thứ hai của khi thờ (chiếm 21% thành phần của khí thở); và có lẽ là loại thuốc được sử dụng rộng rãi nhất trong ngành sơ sinh. Sự hiện diện của oxy sẽ cho phép đốt cháy hoàn toàn glucose, axit amin và axit béo tự do trong một quy trình hiệu quả cao, giúp tạo ra gấp khoảng 20 lần so với quá trình đốt cháy kỵ khí. Quá trình này diễn n trong ty thể, hoạt động như các nhà máy sản xuất năng lượng của tế bào (Hình 16.1). Chất nền được chuyển hóa thành acetyl coenzyme A, đi vào chu trình tricarboxylic acid (chu trình Krebs), nơi năng lượng ở dạng các electron có năng lượng cao được giải phóng và vận chuyển bởi các protein đặc biệt (NADH, NADPH, FADH) đến chuỗi vận chuyển điện tử (electron transport chain – ETC) ở màng trong ty thể. Các electron, được coi là đương lượng khử (reducing equivalent), cung cấp năng lượng cần thiết để duy trì sự chênh lệch điện hóa thúc đẩy quá trình tổng hợp adenosine triphosphate (ATP). Các thành phần của ETC bơm proton qua màng trong ty thể chống lại một sự chênh lệch điện hóa, và các proton lại được đưa vào bởi ATP synthase. Trong quá trình này, năng lượng được phục hồi và được sử dụng để biến đổi adenosine diphosphate thành ATP. Các electron bị oxy bắt giữ, do đó cho phép hình thành nước và tránh rò rỉ electron, hình thành các gốc tự do; do đó, mỗi phân tử dioxygen sẽ bị khử hoàn toàn bởi bốn electron. Chất nền chuyển hóa được dùng để cung cấp năng lượng là đặc hiệu cao theo cơ quan; do đó, hệ thần kinh trung ương và hồng cầu hầu như chỉ phụ thuộc vào glucose, trong khi hoạt động co bóp của tim sử dụng năng lượng được cung cấp tử quá trình đốt cháy chủ yếu là các axit béo tự do. Quá trình phosphoryl hóa oxy hóa cung cấp hầu hết ATP cần thiết cho cơ thể và đặc biệt có liên quan trong các mô phụ thuộc vào hiểu khi được gọi là cơ quan điều hòa oxy, chẳng hạn như não. Những cơ quan này không thể thích ứng trong một thời gian ngắn, thậm chí trong điều kiện thiếu oxy mà không bị hoại tử và/hoặc chết tế bào theo chương trình (apoptosis).
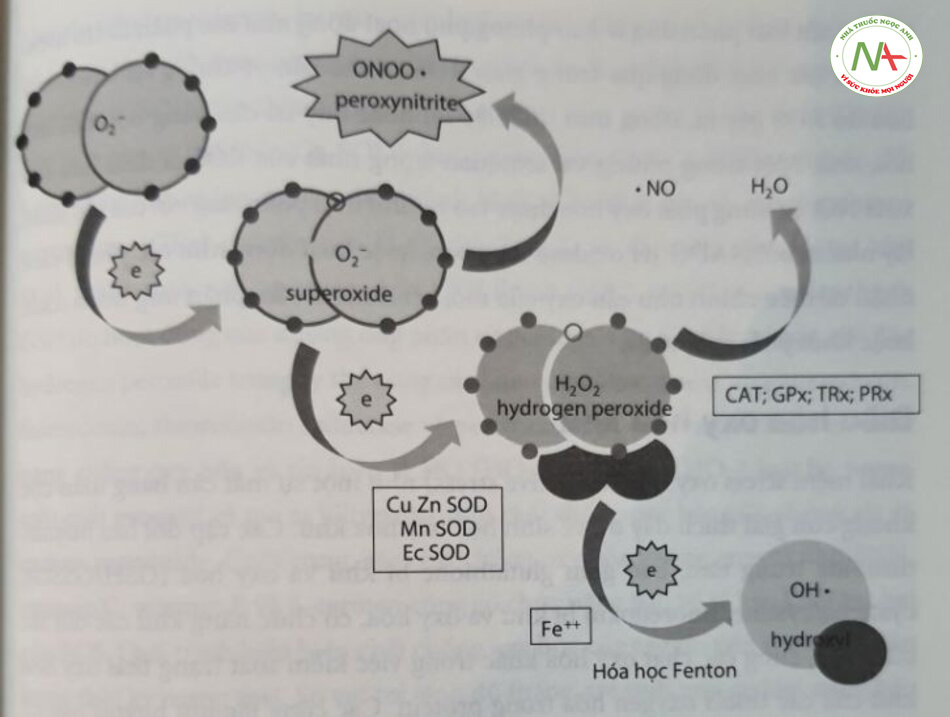
Các gốc tự do oxy hóa, điều hòa oxy hóa khử và enzyme chống oxygen hóa.
Thuật ngữ gốc tự do oxy hóa (reactive oxygen specy – ROS) đề cập đến một l các phân tử có nguồn gốc từ quá trình khử không hoàn toàn phân tử dioxyge (Hình 16.2). Ngay cả trong các điều kiện sinh lý, một tỷ lệ nhỏ các proton sa trò rỉ, gây ra sự khử oxy “một phần” (oxy có ít hơn bốn proton). Sự khử không hoàn toàn của oxy với một proton sẽ tạo ra anion superoxide (O;-);|•0- với việc thêm hai proton sẽ dẫn đến việc tạo ra hydrogen peroxide (H,O,); còn với proton thứ ba, gốc hydroxyl (OH) phản ứng cao sẽ được tạo ra. ROS cũng có liên quan đến việc điều chỉnh sự chuyển hóa và tính sẵn có của nitric oxide (NO), do đó gián tiếp đóng vai trò quan trọng đối với phản ứng của đường thở và mạch máu. Vì vậy, khi anion superoxide liên kết với NO, peroxynitrite (ONOO–) sẽ được tạo ra. Peroxynitrite là một loại nitơ phản ứng cao nhưng cũng gây phản ứng mạch máu ở các khu vực như phổi, nơi sản xuất ra nó có thể dẫn đến tăng co mạch, làm tăng áp phổi. Việc sản xuất ROS trong các điều kiện sinh lý và bệnh lý phụ thuộc nhiều vào nồng độ của oxy trong mô. ROS được tạo ra trong các tình huống thiếu oxy và tăng oxy, đặc biệt là khi nồng độ oxy dao động từ tăng oxy mô sang thiếu oxy mô, và ngược lại. ROS có thể cực kỳ tích cực khi hoạt động như các gốc tự do, gây thiệt hại trực tiếp về cấu trúc và/hoặc chức năng và/hoặc can thiệp vào các yếu tố điều hòa oxy hóa khử cán thiết. Trong các trường hợp khác, ROS có thể tương đối ổn định và hoạt động như các phân tử tin hiệu trong các quá trình sinh lý,
Thuật ngữ gốc tự do dùng để chỉ bất kỳ phân tử nào có khả năng tồn tại độc lập với một hoặc nhiều proton chưa ghép đôi ở lớp vỏ ngoài (ví dụ như anion superoxide, gốc hydroxyl). Các gốc tự do hình thành liên kết cộng hóa trị để chia sẻ một proton với các phân tử khác; tuy nhiên, phần tử tạo thành để bị phân hủy, dẫn đến hình thành các sản phẩm độc hại. Các gốc tự do cũng có thể phản ứng với các phân tử phi truyền thống trong các phản ứng dây chuyển điển hình, gây tổn thương cho DNA, protein và lipid, hoặc thúc đẩy sự hình thành các sản phẩm bổ sung với DNA. Trong những điều kiện rất stress (thiếu máu cục bộ tái tưới máu, tình trạng viêm hoặc tăng oxy), tổn thương do các gốc tự do gây ra có thể dẫn đến chết tế bào do hoại tử hoặc apoptosis hoặc rối loạn chức năng tế bào rõ rệt.
Ngoài hô hấp ở ty thể, ROS cũng được tạo ra bởi hệ thống cytochrome P450 monooxygenase, xanthine oxidoreductase, NO synthase, heme oxygenase (HO) và các enzym khác tham gia vào quá trình điều hòa. Ngoài ra, với sự hiện diện của các kim loại chuyển tiếp như sắt, đồng, kẽm và mangan, việc tạo ra ROS có thể tăng lên theo cấp số nhân.
ROS cũng đóng vai trò liên quan trọng sinh lý tế bào. Ở nồng độ thấp/trung bình, đặc biệt là những ROS không phải gốc tự do (ví dụ như hydrogen peroxide) tạo ra một loạt phản ứng tế bào phong phủ hoạt động như các phân tử thị hiệu Do đó, các hoạt động qua trung gian ROS có thể bảo vệ chống lại stress oxy h hoa do ROS gây ra, đồng thời thiết lập lại hoặc duy trì cân bằng nội mới oxy hóa khử. Một trong những vai trò quan trọng nhất của ROS là điều hoa săn c xuất NO, sự bùng phát oxy hóa được tạo ra như một phản ứng với các tác nhân lây nhiễm bởi NAD(P)H oxidase thực bào, hoặc hoạt động như các yếu tố cảm nhận để điều chỉnh nhu cầu oxy của mô, kết dính tế bào, phản ứng miễn dịch, hoặc khởi phát apoptosis.

Điều hòa oxy hóa khử
Khái niệm stress oxy hóa (oxidative stress) như một sự mất cân bằng toàn cục không còn giải thích đầy đủ về sinh học oxy hóa khử. Các cặp đôi lưu huỳnh- disulfide trung tâm, bao gồm glutathione bị khử và oxy hóa (GSH/G5SG), cysteine/cystine, thioredoxin bị khử và oxy hóa, có chức năng khử các đối tác của HO, cùng các chất oxy hóa khác trong việc kiểm soát trạng thái oxy hóa khử của các thiols oxygen hóa trong protein. Các công tắc lưu huỳnh này có hydrogen peroxide đóng vai trò liên quan được sử dụng để truyền tín hiệu tế bào, cấu trúc protein, theo dõi protein và điều chỉnh hoạt động của chất vận chuyển, chất nhận cũng như yếu tố phiên mã. Điều hòa oxy enzyme, kiểm soát tín hiệu tiềm viêm và tiền xơ hóa, sự tăng sinh tế bào, quá trình hóa khử apoptosis cùng một loạt quá trình sinh học khác, thông qua việc sửa đổi cấu trúc protein không liên quan đến các thay đổi cấu trúc hoặc chức năng oxy hóa. Khái niệm này khác với quan điểm trước đây, trong đó tám quan trọng của các cơ chế gốc tự do và tổn thương đại phân tử như một cơ chế cơ bản đã được nhấn mạnh quá mức.
Bảo vệ chống oxy hóa.
Sự cân bằng oxy hóa khử tại các vị trí khác nhau trong cơ thể chúng ta đời hỏi sự can thiệp của các biện pháp phòng thủ chống oxy hóa để đối trọng với việc tạo ra ROS. Các cơ chế này bao gồm cả quá trình enzym và không enzym. Các enzym chống oxy hóa, thông qua các phản ứng xúc tác, loại bỏ ROS và bảo vệ protein bằng cách sử dụng các chaperone, protein chứa kim loại chuyển tiếp (transferrin, ferritin, ceruloplasmin), cũng như các hợp chất phân t lượng thấp có chức năng như chất oxy hóa hoặc chất khử. Các superoxide dismutase (SOD) tạo thành một họ các enzym nằm trong tế bào chất (Cu/Zn SOD), trong ty thế (Mn/Cu SOD), hoặc ngoại bào (Zn/Cu SOD), chuyển đổi hoặc phân hủy anion superoxide thành H,O. Các chất xúc tác và glutathione peroxidase (GPx) chuyển hóa HO, thành HẠO và O. GPx cặp đôi sự khử HC thành nước với sự oxygen hóa GSH thành GSSG. GSSG lại bị giảm thành GSH do hoạt động của đường ống phân tử pentose. Các hệ thống khác giải độc hydrogen peroxide trong ty thể cùng các bào quan khác, bao gồm glutaredoxin, thioredoxin, thioredoxin reductase và peroxiredoxin. Các enzym khác có chức năng chống oxy hóa và tín hiệu là HỌ (HO-1 và HO-2). HO-1 loại bỏ heme, một chất prooxid và tạo ra biliverdin, một chất chống oxy hỏa giải phóng sát và carbon monoxide. Cuối cùng, các chất chống oxy hóa không enzym như GSE, vitamin C, vitamin E và B-caroten cũng có chức năng bảo vệ tế bào khỏi tác hại của ROS. Quá trình biểu hiện chất chống oxy hóa của enzym tiến triển dẫn dẫn trong thời kỳ mang thai. So với trẻ sinh đủ tháng, trẻ sinh non có khả năng bảo vệ chống oxy hóa chưa trưởng thành, dễ mắc các tình trạng liên quan đến ROS hơn do thiếu oxy-tái oxy hóa, trong tình trạng thiếu oxy hoặc nhiễm trùng. Ngoài ra, quá trình truyền chất chống oxy hóa qua nhau thai cũng xảy ra ở giai đoạn cuối của thai kỳ. Trong các thử nghiệm được thực hiện trên các vật liệu sảy thai ở người, người ta đã chỉ ra rằng: Các hoạt động của enzym chống oxy hóa để phản ứng lại sự tổn thương của chất oxy hóa tăng lên khi thai kỳ tiến triển. Do đó, các tình trạng xảy ra trong thai kỳ như tiến sản giật làm thay đổi đáng kể sự biểu hiện của enzym chống oxy hóa nhau thai, gây ra gánh nặng prooxid cho thai nhi.
Dấu ấn sinh học của stress oxy hóa
Stress oxy hóa có thể được đánh giá bằng nhiều phương pháp khác nhau. Có thể do mức độ tổn thương trực tiếp đối với các phân tử như protein, lipid và DNA, xác định kết quả của sự tương tác với các gốc tự do trên cấu trúc hóa học của chúng. Tuy nhiên, stress oxy hóa cũng có thể được đo gián tiếp bằng cách tăng hoạt tính của các enzym chống oxy hóa, hoặc gia tăng nồng độ của các chất chống oxy hóa bị oxy hóa như tỷ lệ GSH/GSSG. Trong nghiên cứu lần sàng, việc xác định nồng độ bắt nguồn từ sự tập hợp các gốc tự do trong cá dịch sinh học như máu, huyết tương, huyết thanh, nước tiểu, hoặc dịch não tu đã trở nên phổ biến.
Bảng 16.1 tóm tắt các dấu ấn sinh học được sử dụng rộng rãi nhất của stress oxy hóa. Tỷ lệ GSH/GSSG là một chỉ số toàn diện về tình trạng ox hóa khử và có thể được xác định trong máu toàn phần. Quá trình peroxygen hóa lipid được xác định bằng cách đo malondialdehyde trong máu hoặc nước tiểu. Tuy nhiên, isoprostane, phản ánh quá trình noncyclooxygenase oxy hóa của arachidonic acid, hiện đang được sử dụng rộng rãi vì chúng rất ổn định và không bị ảnh hưởng bởi chế độ ăn uống, dinh dưỡng ngoài đường tiêu hóa hay tuổi thai (gestational age – GA). Phương pháp được ưu tiên là sắc kỳ lỏng kết hợp với khối phó. Cac isofuran, chất chống lại quá trình oxy hóa axit arachidonic trong điều kiện tăng oxy, đã được sử dụng rất hiệu quả trong các nghiên cứu sơ sinh liên quan đến việc sử dụng oxy. Các dấu ấn sinh học tương tự khác là neuroprostane và neurofuran. Neurofuran kích hoạt quá trình oxy hóa docosahexaenoic acid hiện diện đặc biệt trong não, Vì vậy có thể phản ánh tổn thương do stress oxy hóa đối với mô não. Gần đây, các dấu ấn sinh học về tổn thương oxy hóa đối với adrenic acid, một thành phần chính của chất trắng não, đã được đưa vào kho vũ khí của các dấu ấn sinh học. Quá trình oxygen hóa adrenic acid dẫn đến sự hình thành Di-homo-isoprostane và Di-home- isofuran, cả hai đều là những chất chỉ thị có tính chọn lọc cao về sự phá hủy chất trắng não bởi các gốc tự do. Tổn thương đối với protein có thể được đánh giá bằng khối phố xác định ortho-tyrosine hoặc meta-tyrosine, thực hiện lại quá trình oxy hóa phenylalanin tuần hoàn trong một con đường chuyển hóa phi sinh lý. Cuối cùng, việc xác định quá trình oxy hóa của các gốc guanidine trong nước tiểu hoặc huyết tương sẽ đánh giá tổn thương DNA phản ánh quá trình oxy hóa của nhân tế bào. Có nhiều dấu ấn sinh học khác (RNA. glycoprotein, các hợp chất thở ra, V.V…) đang được dành gia, nhưng những dấu ấn này vẫn chỉ có thể ứng dùng được trong các nghiên cứu ở mức cơ bản hơn.
| BẢNG 16.1 Các dấu ăn sinh học oxy hóa chính được sử dụng trong môi trường làm sàng cũng như nghiên cứu con người và các kỹ thuật đáng tin cậy nhất để đo lường chúng | ||||
| Dấu ấn sinh học | Phân tử mục tiêu | Tác động sinh học | Loại dịch sinh học | Phương pháp phân tích |
| Dấu ấn sinh học | Phân tử mục tiêu | Tác động sinh học | Loại dịch sinh học | Phương pháp phân tích |
| Glutathione (tỷ lệ GSH/GSSG) | Antioxidant | Trạng thái oxy hóa khử chung | Máu toàn phần | LC-MS/MS |
| MDA | Lipid | Peroxy hóa PUFA | Huyết tương | HPLC (đầu dò UV) |
| HNE | Lipid | Peroxy hóa PUFA | Huyết tương | HPLC |
| o-Tyrosine (tỷ lệ o-Tyr/Phe) | Protein | Hedroxyl hóa tyrosine | Nước tiểu | LC-MS/MS |
| m-Tyrosine (tỷ lệ m-Tyr/Phe) | Protein | Hedroxyl hóa tyrosine | Nước tiểu | LC-MS/MS |
| 3N2-tyrosine | Protein | Nitrat hóa tyrosine | Nước tiểu | LC-MS/MS |
| 8OHdG (tỷ lệ 8OHdG/2dG) | Liquid | Peroxy hóa AA | Nước tiểu/huyết tương | LC-MS/MS |
| F2-IsoP | Liquid | Peroxy hóa AA | Nước tiểu/huyết tương | GC-MS/MS;LC-MS/MS |
| D2/F2-IsoP | Liquid | Peroxy hóa AA | Nước tiểu/huyết tương | GC-MS/MS;LC-MS/MS |
| IsoF | Liquid | Peroxy hóa AA | Nước tiểu/huyết tương | GC-MS/MS;LC-MS/MS |
| NeuP | Liquid | DHA peroxy hóa | Nước tiểu/huyết tương | GC-MS/MS;LC-MS/MS |
| NeuF | Liquid | DHA peroxy hóa | Nước tiểu/huyết tương | GC-MS/MS;LC-MS/MS |
AA, axit arachidonic; DHA, axit docosahexaenoic; 8OHdG, 8-hydroxy-29-deoxyguanosine; GC, sắc ký khí, GSH, giảm glutathione; GSSG, glutathione bị oxy hóa; HNE, 4-hydroxy- 2-nonenal, HPLC, sắc ký lỏng hiệu năng cao; Isof, isofuran, Iso, isoprostane, LC, sắc ký lỏng, MDA, malondialdehyde; MS/MS, khối phổ song song, m-Tyr, meta-tyrosine; Neuf, neurofuran; Neul, neuroprostane; PUFA, axit béo không bão hòa đa, o-Tyr, ortho- tyrosine; 3N2-tyrosine, 3-nitrotyrosine; 2dG, 29-deoxyguanosine; UV, tia cực tím.
Cơ chế cảm nhận oxy và đáp ứng sinh lý
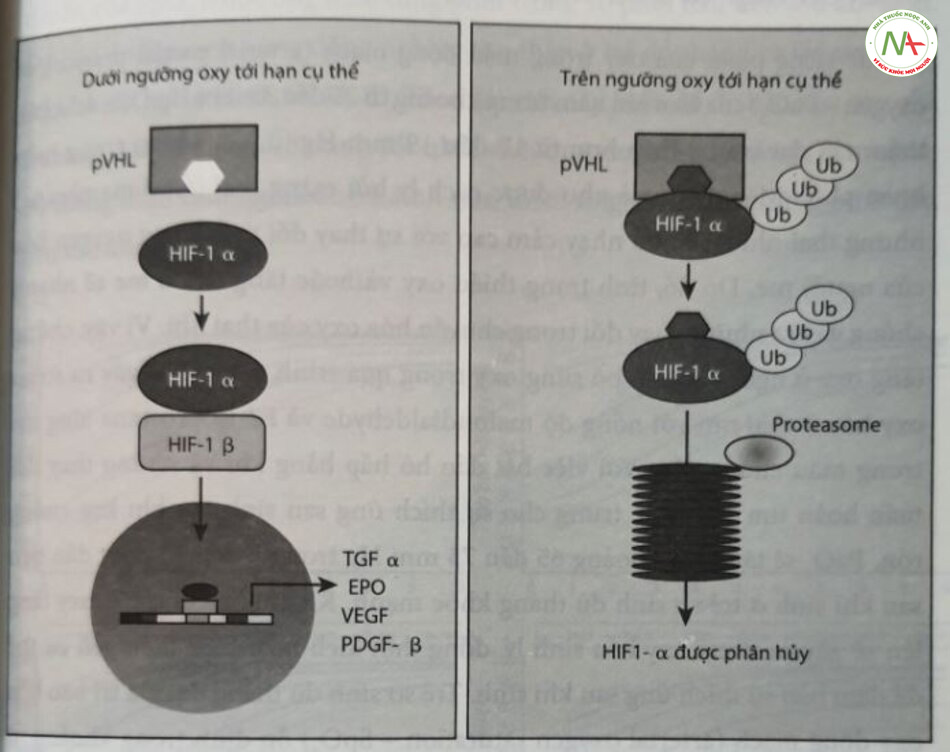
Sau đây là mô tả ngắn gọn về sự tương tác giữa oxy với yếu tố gây thiếu n (hypoxia-inducible factor – HIF-1) và biểu hiện của erythropoietin (EPO Cân bằng nội môi oxy rất quan trọng đối với sự tồn tại và chức năng của bào cũng như sinh vật. Một mặt, oxy dư thừa (hyperoxia) chắc chắn gây ra tình trạng sản xuất quả mức ROS, làm tổn thương tế bào. Mặt khác, sự thiếu hoàn toàn oxy (anoxia) có thể gây chết người. Do đó, các hệ thống sinh lý được điều chỉnh để đạt được sự cân bằng thích hợp giữa nhu cầu oxy và tính sản có, nhằm đảm bảo tế bào hoạt động chính xác. Một số yếu tố phiên mã nhạy cảm với oxy hóa khử, chẳng hạn như HIF-1, protein liên kết yếu tố phản ứng adenosine monophosphate vòng, yếu tố hạt nhân kB, protein hoạt hóa I và p53, điều chỉnh biểu hiện gen để đáp ứng với những thay đổi về nồng độ ROS.
Sự thay đổi nóng độ oxy trong cơ thể tạo ra hai loại phản ứng. Trong tỉnh trạng thiếu oxy cấp tính, co mạch máu phổi và chất tiết thần kinh ở thể đóng mạch cảnh phụ thuộc vào sự gia tăng nồng độ canxi nội bào qua trung gian ROS là rất cần thiết cho sự sống còn. Nếu tinh trạng thiếu oxy kéo dài sẽ kích hoạt các yếu tố phiên mã HIF. Mức oxy trong tử cung tại thời điểm làm tổ nằm trong khoảng 15 đến 20 mm Hg, đóng thời duy trì ở mức thấp này cho đến cuối tam cá nguyệt thứ nhất, cung cấp đầy đủ môi trường (khử) cho sự phát triển của bào thai và nhau thai. Sự tân sinh mạch máu được kích thích bởi nồng độ oxy thấp trong mô thông qua điều hòa phiên mã và sau phiên mã của các yếu tố tăng trưởng, chẳng hạn như yếu tố tăng trưởng nội mô mạch máu (vascular endothelial growth factor – VEGE), EPO, yếu tố tăng trưởng nhau thai angiopoietins I và 2. Chất điều hòa chính của phản ứng thích ứng của tế bào đối với tình trạng thiếu oxy là HIF-I, một yếu tố phiên mã dị số bao gồm các tiểu đơn vị HIF-la và HIF-1B, Protein HIF- là được tổng hợp liên tục; tuy nhiên, nếu nồng độ C, trong mô bình thường hoặc cao, nó sẽ trải qua quá trình phân hủy protein. Trong các điều kiện dưới ngưỡng oxy tới hạn cụ thể, protein HIF-1a sẽ được ổn định, đồng thời liên kết với yếu tố đáp ứng tình trạng thiếu oxy của DNA và gởi ra sự biểu hiện của nhiều gen (Hình 16.3), HIF-16 có trong nhân tế bào. Các gen được kích hoạt, đặc biệt là VEGF và EPO, có nghĩa là tăng cường cung cấp O, đến các mô.
Oxy trong chuyển tiếp từ bào thai sang sơ sinh và sự thích ứng sau khi sinh
Chuyển tiếp từ bào thai sang sơ sinh
Áp lực riêng phần của oxy trong máu động mạch (arterial partial pressure of oxygen – PaO,) của thai nhi nằm trong khoảng từ 25 đến 35 mm Hg (3,5–4,5 kPa) thậm chí đạt giá trị thấp hơn từ 17 đến 19 mm Hg (2,2–2,5 kPa) trong tuần hoàn phổi. Mặc dù có vẻ như được cách ly bởi màng thai (fetal membrane nhưng thai nhi lại có độ nhạy cảm cao với sự thay đổi tình trạng oxygen hoa của người mẹ. Do đó, tình trạng thiếu oxy và/hoặc tăng oxy ở mẹ sẽ nhanh chóng gây ra những thay đổi trong chuyển hóa oxy của thai nhi. Vì vậy, chứng tăng oxy ở người mẹ do bổ sung oxy trong quá trình gây mê sẽ gây ra stress oxy hóa ở thai nhi với nồng độ malondialdehyde và F2-isoprostane tăng lên trong máu cuống rốn. Với việc bắt đầu hô hấp bằng khí và những thay đổi tuần hoàn tim phổi đặc trưng cho sự thích ứng sau sinh sau khi kẹp cuống rốn, PaO, sẽ tăng lên khoảng 65 đến 75 mm Hg trong 5 đến 10 phút đầu tiên sau khi sinh ở trẻ sơ sinh đủ tháng khỏe mạnh. Khả năng cung cấp oxy tăng lên sẽ gây ra stress oxy hóa sinh lý, đồng thời kích hoạt biểu hiện gen cụ thể để đảm bảo sự thích ứng sau khi sinh. Trẻ sơ sinh đủ tháng đạt giá trị bão hòa oxy động mạch (arterial oxygen saturation – SpO,) ổn định trong khoảng từ 85% đến 90% sau 5 phút sau khi sinh. Tuy nhiên, một số trẻ sơ sinh khỏe mạnh binh thường thậm chí còn cần nhiều thời gian hơn, đặc biệt nếu chúng được sinh bằng phương pháp mổ lấy thai. Đáng chú ý là, trẻ sinh non, đặc biệt là trẻ cực non tháng, những trẻ có tuổi thai từ 28 tuần trở xuống, cần gần 10 phút để đạt SpO, trước ống khoảng 85%. Quá trình oxygen hóa sau khi sinh phụ thuộc nhiều vào tuổi thai, kiểu sinh, và việc trẻ có thể thở tự phát hay cần một số kiểu hỗ trợ hô hấp.
Biểu do bão hòa oxy động mạch
Bằng cách thu thập dữ liệu khách quan, áp dụng phương pháp đo độ bão hòa oxy mạch này trước ống với phương pháp giống hệt nhau ở 468 trẻ mới sinh có tuổi thai từ 25 đến 42 tuần không nhận được oxy khi sinh, có thể xây dựng hình ảnh biểu đồ độ bão hòa oxy trong 10 phút đầu tiên sau sinh. Dữ liệu được biểu diễn dưới dạng đồ thị được làm mịn, bao gồm trung bình và +3 độ lệch chuẩn của SpO, trước ống theo từng phút trong 10 phút đầu tiên sau khi sinh. Dữ liệu do Dawson cùng đồng nghiệp thu thập ở trẻ đủ tháng và trẻ sinh non được minh họa ở Hình 16.4A–D. Theo bài viết này, biểu đồ độ bão hòa oxy của Dawson đại diện cho ước tính tốt nhất về lượng oxy sinh lý xảy ra ở trẻ sinh đủ tháng bình thường, hoặc trẻ sinh non thích ứng tốt trong những phút đầu tiên sau khi sinh.
Trong thập kỷ trước, việc trì hoãn kẹp cuống rốn ít nhất 1 phút sau khi sinh đủ tháng và trẻ sinh non đã được khuyến cáo trong các tài liệu hướng dẫn quốc tế. Cuống rốn cho phép chuyển một lượng máu đáng kể từ nhau thai đến hệ tuần hoàn của trẻ mới sinh, góp phần tăng tiền tải thất phải, tăng cường lưu lượng máu phổi và ổn định huyết động. Gần đây, các phạm vi tham chiếu cho trẻ sinh đủ tháng, sinh bằng ngả âm đạo cho phép kẹp cuống rốn nhiều hơn 1 phút và không cẩn hồi sức hoặc thở oxy khi sinh đã được xây dựng. Dữ liệu từng phút về nhịp tim và độ bão hòa oxy (SpO,) trước ống được truy xuất trong 10 phút đầu tiên sau khi thai nhi được sinh ra. Các giá trị SpO, cao hơn đáng kể cho bách phân vị thứ 10, 50 và 90 khi so sánh với phạm vi tham chiếu của Dawson trong 5 phút đầu tiên và đối với nhịp tim trong 1–2 phút đầu tiên sau sinh đã được báo cáo. Do đó, ở trẻ khỏe mạnh được sinh bằng đường âm đạo và được kẹp cuống rốn muộn hơn 60 giây, SpO, và nhịp tim cao hơn đạt được trong 5 phút đầu sau sinh so với trẻ sinh đủ tháng được kẹp cuống rốn ngay lập tức (Hình 16.5).
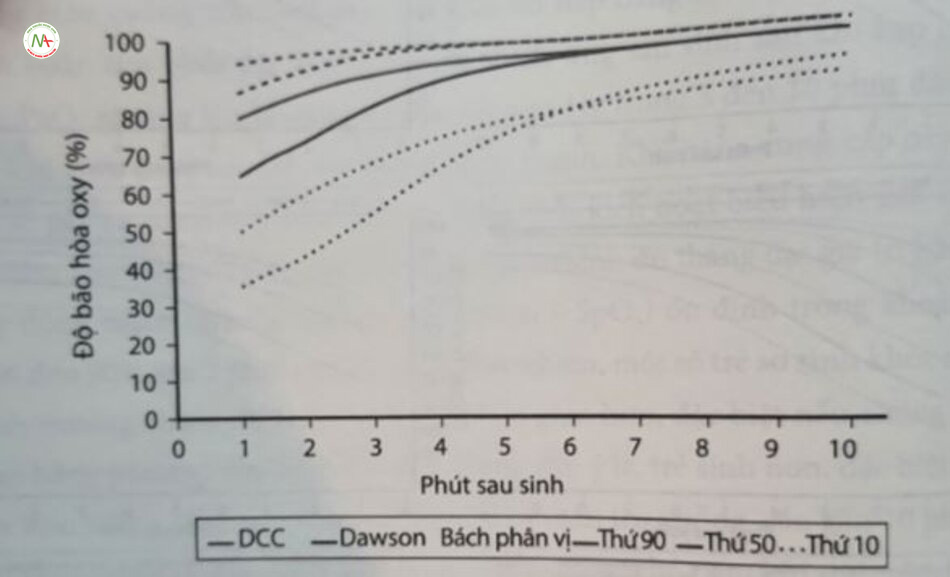
Độ bão hòa oxy ở các trẻ non tháng đang thông khí áp lực dương và không khí
Áp lực đường thở dương liên tục (continuous positive airway pressure – CPAP) được áp dụng ngay sau sinh với áp lực từ 5 đến 6 cm H,O, tạo điều kiện thuận lợi để đạt được dung tích căn chức năng (functional residual capacity – FRC) ở trẻ sinh non ngay lập tức, do đó cải thiện oxygen hóa và giảm công thở. Trẻ sinh rất non tháng với tuổi thai từ 28 tuần trở xuống được nhận CPAP và nồng độ oxy hít vào (FO,) ở mức 21% đã đạt được giá trị SpO, ổn định sớm hơn đáng kể so với những trẻ có tuổi thai tương tự đang thở tự phát mà không có CPAP Điều thú vị là trẻ sinh non nữ đạt được mục tiêu bão hòa nhanh hơn đáng kể so với trẻ sinh non nam. Những dữ liệu này chỉ ra rằng, việc sử dụng CPAP tạo điều kiện thuận lợi cho việc huy động thể tích phổi và thiết lập FRC đầy đủ, do đó làm giảm nhu cầu bổ sung oxy trong quá trình ổn định sau sinh. Điều này hoàn toàn nhất quán với nhiều nghiên cứu thực nghiệm đã cho thấy rõ lợi ích của áp lực dương cuối thì thở ra trong giai đoạn chuyển tiếp từ bào thai sang sơ sinh.
Sử dụng oxy trong phòng sinh
Việc sử dụng không khí phòng (21% oxy) trong hồi sức trẻ sơ sinh đủ tháng bị ngạt làm giảm thời gian cần thiết để đạt được hô hấp tự phát, cải thiện điểm Apgar sau 1 phút, giảm tải lượng oxy và stress oxy hóa, giảm tổn thương tim và thận; quan trọng nhất là giảm đáng kể tỷ lệ tử vong so với việc sử dụng oxy 100% ban đầu. Tài liệu hướng dẫn quốc tế năm 2015 đã khuyến cáo nên sử dụng không khí làm hỗn hợp khí ban đầu cho trẻ sơ sinh bị suy hô hấp. Ngoài lá, cả việc theo dõi đo oxy theo mạch nãy của SpO, lẫn chuẩn độ FiO nhằm tránh tổn thương do tăng oxy hoặc thiếu oxy cũng được khuyến nghị FiO, ban đầu cho trẻ sinh non trong phòng sinh hiện vẫn còn là vấn đề sĩ sơ sinh cách bắt đầu và cách chuẩn độ FC, trong quá trình ổn định sau gây nhiều tranh luận. Không có phạm vi tham chiếu nào để hướng dẫn bác sinh. Trong một đánh giá gần đây của Cochrane đã tiến hành so sánh việc sử dụng nồng độ oxy thấp hơn (< 40%) so với cao hơn (> 40%) để đạt được bão hòa mục tiêu trong quá trình hỏi sức trẻ rất non tháng 1 có sự khác biệt về các kết cục liên quan như từ vong, loạn sản phế quân phố (bronchopulmonary dysplasia – BPD), kết quả tử vong hoặc BPD kết hợp bệnh võng mạc ở trẻ sinh non (retinopathy of premature – ROP), xuất huyết trong/quanh nào thất (intral periventricular henorrhage – IPVH), hoặc vàn ruột hoại tử (necrotizing enterocolitis – NEC) khi sử dụng FiO, ban đầu tháp hơn 40% so với cao hơn 40%. Ngoài ra, báo cáo tổng quan hệ thống gần đây nhất và lớn nhất với phân tích gộp bao gồm 10 nghiên cứu và 5.607 trẻ sinh non dưới 35 tuần tuổi được thực hiện bởi Welsford và cộng sự cũng không chỉ ra được sự khác biệt giữa các trẻ nhận được FiO, ban đầu cao hơn (> 50%) và trẻ nhận được FiO, ban đầu thấp hơn (< 50%) trong phòng sinh.
Tuy nhiên, các tác giả chỉ ra rằng phần lớn trẻ sơ sinh 32 tuần tuổi thai trở xuống sẽ cần bổ sung oxy khi ổn định. Việc sử dụng FiO, ban đầu tháp hơn có thể đem lại lợi thế là giảm tải lượng oxy nhận được trong quá trình ổn định ban đầu, từ đó giảm stress oxy hóa. Hai nghiên cứu đều bắt đầu hói sức với mức FiO, ban đầu rất cao (90% hoặc 100%) với sự chuẩn độ tiếp theo, dẫn đến tăng stress oxy hóa và tần suất BPD so với khi bắt đầu với FIO, ở mức 21% hoặc 30%. Ngược lại, không tìm thấy sự khác biệt nào về kết quả lâm sàng hoặc dấu ấn sinh học của stress oxy hóa khi áp dụng FiO, ban đầu ở mức 30% so với mức 60% hoặc 65%. Tuy nhiên, các quan sát gần đây ở trẻ sinh cực non (thai 28 tuần tuổi) đã làm dấy lên nghi ngờ về chiến lược tối ưu để bổ sung oxy những bệnh nhân dễ bị tổn thương này trong những phút đầu tiên sau sinh. cho Nghiên cứu Oxy mục tiêu trong hồi sức trẻ sinh non (Targeted Oxygenation in the Resuscitation of Premature Infants – TORPIDO) đã chọn ngẫu nhiên các trẻ dưới 32 tuần tuổi thai với không khí hoặc 100% oxy. Trong một phân tích hậu kỷ, trẻ sơ sinh dưới 28 tuần tuổi thai có nguy cơ tử vong tương đối tăng lên gần 4 lần nếu ban đầu được cho tiếp xúc với không khí khi so với 100% O, (tỷ lệ rủi ro (risk ratio – RR| 3,9; 95% khoảng tin cậy (confidence interval – CI] 1,1–13,4). Oei và cộng sự, trong quá trình tìm lời giải thích cho kết quả của thử nghiệm TORPIDO, đã thực hiện một đánh giá có hệ thống về kết cục của trẻ sơ sinh S28 + 6 tuần tuổi thai được phân ngẫu nhiên vào hồi sức với FO thấp (< 30%) so với cao (2 60%) khi sinh. Họ không tìm thấy sự khác biệt về nguy cơ tử vong tổng thể hoặc các bệnh lý ở trẻ sinh non thông thường khác, bao gồm BPP, NEC, ROP, ông động mạch và xuất huyết não thất, sau khi bắt đầu hỏi sức khi sinh với FO, thấp hơn hoặc cao hơn. Chia khóa để giải quyết câu hỏi học bua này nằm ở việc đạt được độ bão hòa ít nhất 80% đến 85% trong 5 phút đầu tiên sau khi sinh một cách độc lập với FiO,, tuổi thai, giới tính hoặc kiểu sinh ban đầu. Tiếp cận đủ oxy và tránh các cơn nhịp tim chậm trong 5 phút đầu tiên sau khi sinh dường như là điều cần thiết để tăng cường sự ổn định sau sinh, đồng thời tránh tử vong hoặc các biến chứng nghiêm trọng như IVH.Do đó, Oei và cộng sự đã phân tích dữ liệu từ 768 trẻ dưới 32 tuần tuổi thai tham gia vào tám thử nghiệm ngẫu nhiên có đối chứng (randomized controlled trial _ RCT) được hồi sức ban đấu với FiO, cao hơn (≥ 60%) hoặc thấp hơn (5 30%). Những trẻ không phụ thuộc vào FiO, ban đầu, không đạt được SpO, ở mức 80% trong vòng 5 phút sau sinh có tỷ lệ tử vong cao hơn, IVH nghiêm trọng hơn và kết quả phát triển thần kinh kém hơn những trẻ đạt được mức này. Cho đến khi các nghiên cứu sâu hơn làm sáng tỏ vấn đề quan trọng nêu trên, cả các chuyên gia lẫn các tài liệu hướng dẫn đồng thuận đều khuyến cáo rằng: Nên bắt đầu hồi sức cho trẻ sơ sinh từ 28 đến 31 tuần với mức FiO, ban đầu từ 21% đến 30%, hướng dẫn chuẩn độ oxy lên và xuống với việc sử dụng máy đo độ bão hòa oxy mạch nẩy nhằm đạt được SpO, từ 80% đến 85% và nhịp tim hơn 100 nhịp mỗi phút trong vòng 5 phút.
Ứng dụng thiết bị đo độ bão hòa oxy mạch nãy đã trở thành công cụ thiết yếu trong phòng sinh. Đo độ bão hòa oxy mạch này trước ống phản ánh oxy cho máu đi đến não, do đó được ưu tiên trong quá trình ổn định sau sinh. Các chỉ số trước ống đáng tin cậy trong vòng 1 đến 2 phút sau sinh có thể nhanh chóng đạt được nếu được đào tạo đầy đủ. Dữ liệu được hiển thị nhanh chóng nếu thực hiện theo các bước sau:
- Bật máy đo độ bão hòa oxy.
- Áp cảm biến vào bàn tay hoặc cổ tay phải của trẻ sơ sinh.
- Kết nối cảm biến với cáp đo oxy.
- Che chắn cảm biến tránh ánh sáng.
Bằng cách gắn cảm biến vào trẻ trước khi kết nối cáp đo oxy với máy theo đôi, thời gian phản hồi các kết quả đo đáng tin cậy sẽ được rút ngắn. Sau khi đạt được kết quả đang tin cậy của máy đo độ bão hòa oxy mạch này và trẻ đang được thông khi, nên chuẩn độ FIO, dựa trên các kết quả của máy đo độ bão hòa oxy mạch này là nhịp tim và độ bão hòa. Nên điều chỉnh thiết bị trộn không khi/oxy phù hợp, nhằm tránh tăng oxy và thiếu oxy. Do đó, nếu SpO, ở dưới phân vị thứ 10, thì nên tăng FO, lên 10% sau mỗi 30 giây đến khi SpO, đạt đến phân vị thử 10 rồi tới 50, luôn tránh vượt quá phản vị thứ 90 của SpO. Những khuyến cáo này dựa trên ý kiến của các chuyên gia; không có thông tin dựa trên bằng chứng về cách tốt nhất để điều chỉnh nồng độ oxy theo kết quả đo độ bão hòa oxy mạch này. Hiệp hội Tim mạch Mỹ (American Heart Association) đã xác định phạm vi mục tiêu tương ứng cho 1, 2, 3, 4, 5 và 10 phút sau khi sinh là 60% đến 65%, 65% đến 70%, 70% đến 75%, 75% đến 80%, 80% đến 85% và 85% đến 90%. Do do, cho đến khi có đủ các nghiên cứu được cung cấp dãy
đủ, mục đích của chúng tôi là giảm tải lượng oxy trong quá trình hồi sức vào những phút đầu tiên của cuộc đời trẻ, cố gắng điều chỉnh SpO, về mức tham chiếu biểu đó, hiện là ước tính tốt nhất của chúng tôi về mục tiêu oxygen hóa tốt nhất ở trẻ sinh non. Cũng cần nhấn mạnh rằng, việc kẹp cuống rốn muộn có thể gây ra những thay đổi đáng kể trong phạm vi tham chiếu, hệ quả là làm thay đổi độ bão hòa mục tiêu trong những phút đầu tiên sau khi sinh.
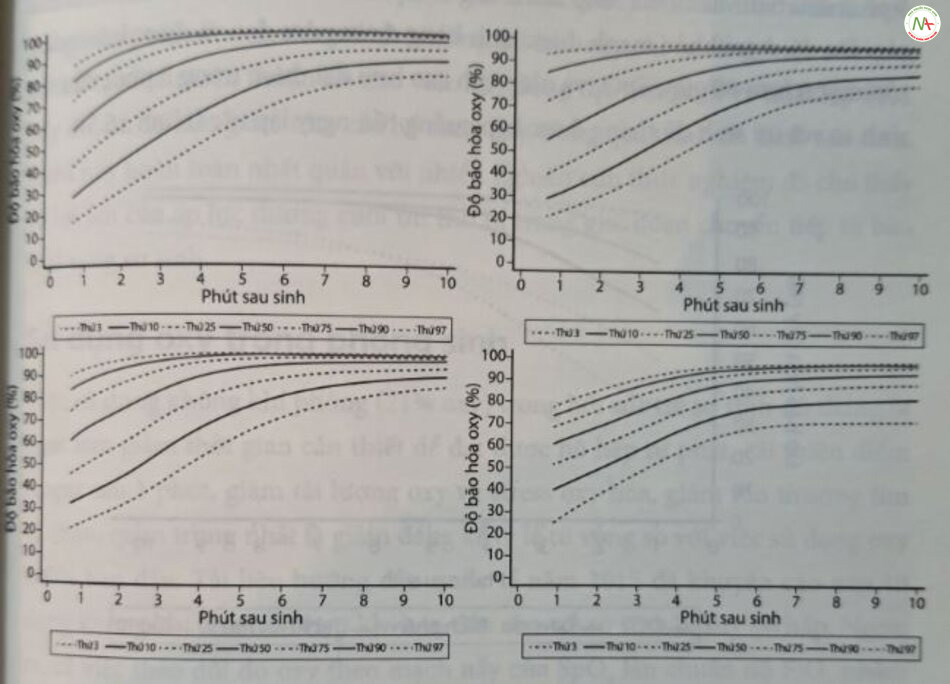
Oxy trong thời gian chăm sóc sơ sinh tại đơn vị chăm sóc đặc biệt dành cho trẻ sơ sinh (NICU)
Việc thiết lập các mục tiêu bão hòa oxy tối ưu cho trẻ sinh non cần bổ sung oxy trong NICU vẫn còn là vấn đề khó năm bắt. Trẻ sinh non rất nhạy cảm với tăng oxy mô, có thể dẫn đến tổn thương phổi và võng mạc, đồng thời cũng nhạy cảm với thiếu oxy mô, có thể gây tăng tỷ lệ tử vong, NEC hoặc tổn thương chất trắng. Phối của trẻ sinh non tháng có xu hướng bị stress oxy hóa và viêm do thiếu một hệ thống phòng thủ chống oxy hóa phát triển đầy đủ chưa trưởng thành về cấu trúc lẫn chức năng, thường đòi hỏi phải thở máy và bổ sung oxy. Ngoài ra, phổi dễ bị nhiễm trùng và tiếp xúc với lượng sắt tự do tăng trong tuần hoàn. Mối liên hệ giữa oxy, stress oxy hóa, thở máy và các yếu tố di truyền cũng như sự xuất hiện muộn hơn của BPD đã được chứng minh trong các nghiên cứu khác nhau. Do vậy, trẻ sơ sinh sinh non sau đó phát triển BPD biểu hiện nồng độ cao các sản phẩm bổ sung carbonyl trong máu và dịch hút khí quản, đại diện cho các sản phẩm phụ từ sự tấn công của các gốc tự do oxy lên các protein cấu trúc và chức năng của phối. Lượng oxy cao hơn và F2a-isoprostane trong tuần đầu tiên sau sinh cũng có liên quan đến sự phát triển sau này của BPD và bệnh nhuyễn hóa chất trắng quanh não thất, cho thấy rõ vai trò quan trọng đối với tổn thương oxy hóa. Ngoài các tác động trực tiếp và cấp tỉnh của các gốc tự do lên mô phổi, đã có bằng chứng cho thấy rằng: Các gốc oxy hóa đặc hiệu như hydroperoxide có thể hoạt động như các phân tử tín hiệu, gây ra sự biểu hiện của các yếu tố phiên mã có thể làm thay đổi sự phát triển, biệt hóa, điều hòa hóa học, phản ứng bắt đầu và/hoặc quá trình chết của tế bào.
Tiếp xúc với nồng độ oxy cao dẫn đến giải phóng các chất trung gian đặc hiệu như VEGF và angiopoietin 2 có khả năng phá vỡ màng phế nang-mao mạch, gây phù phổi và tổn thương phổi sau đó. Các cytokine khác cũng được giải phóng từ các tế bào phổi và thu hút các tế bào điều hòa đến phổi. Những chất này trong các tế bào kích thích, cũng như tăng oxy mô trên mỗi tế bào, giải phỏng ROS, có thể bắt đầu con đường chết tế bào phụ thuộc vào ty thể.
Một loạt các RCT đã cố gắng đánh giá khoảng SpO2 tối ưu cho trẻ sinh non cần bổ sung oxy sau khi ổn định sau sinh. Trong thử nghiệm Lợi ích của việc nhằm mục tiêu độ bão hòa oxy (Benefts of Oxygen Saturation Targeting – BOOST), chúng tôi đã so sánh hiệu quả của độ bão hòa mục tiêu cao hơn (95%–98%) so với thấp hơn (91%–94%) đối với trẻ có tuổi thai dưới 30 tuần. Việc sử dụng các giới hạn SpO, cao hơn có liên quan đến việc tăng thời gian điều trị oxy, tăng tỷ lệ mắc bệnh phổi mãn tính và tăng tần suất trẻ xuất viện cần điều trị oxy tại nhà, trong khi không cải thiện được sự phát triển thần kinh hoặc tăng trưởng của cơ thể. Trong một thử nghiệm ngẫu nhiên có đối chứng khác có tên Oxy điều trị bổ sung cho bệnh lý võng mạc trẻ sinh non trước nguong (Supplemental Therapeutic Oxygen for Prethreshold Retinopathy of Prematurity – STOP-ROP), một nhóm trẻ sinh non bị ROP trước ngưỡng (prethreshold ROP) được chọn ngẫu nhiên thành 2 nhóm giới hạn SpO, được đặt từ 84, đến 91, hoặc từ 95% đến 99% cho tối thiểu 2 tuần. Tác động có l của Sul), cao hơn đối với sự tiến triển của bệnh mắt là tối thiểu; trong khi đó các tác động tiêu cực như nằm viện kéo dài, bệnh đường hô hấp và nhu cầu bộ sung oxy kéo dài lại cao hơn đáng kể.
Năm nghiên cứu NeOProM đã trung tâm, quốc tế, có làm mủ, đã được thực hiện. Các thử nghiệm này đã huy động gần 5.000 trẻ sơ sinh cực nhẹ cân (extremely low birth weight – ELBW) dưới 28 tuần tuổi thai, nhằm tìm cách xác định mục tiêu bảo hòa tối ưu trong khi tuân theo các thiết kế gần như giống hệt nhau để cho phép phân tích bệnh nhân ở cấp độ cá nhân tiếp theo Tất cả các nghiên cứu này đều so sánh SpO, mục tiêu thấp (85%–89%) với trục tiêu cao (91%–95%). Thử nghiệm ngẫu nhiên với surfactant, áp lực dương và oxygen hóa (Surfactant, Positive Pressure, and Oxygenation Randomized Trial – SUPPORT) phỏng đoán rằng: Trẻ sơ sinh ELBW sống sót được chỉ định ngẫu nhiên cho phạm vi mục tiêu SpO, thấp hơn (85%–89%) có nguy cơ ROP thấp hơn (8,6% so với 17,9%; P < 0,01) so với những trẻ ở nhóm mục tiêu SpO cao hơn (91%–95%). Tuy nhiên, bất ngờ thay, tỷ lệ tử vong gia tăng đáng kể ở nhóm có độ bão hòa thấp (19,9% so với 16,2%; P < 0,04). Ngoài ra, thử nghiệm BOOST II được thực hiện ở Vương quốc Anh, Úc và New Zealand cũng cho thấy kết quả tương tự, với ROP cao hơn ở trẻ sơ sinh được duy trì trong phạm vi độ bão hòa cao, còn tỷ lệ tử vong cao hơn ở trẻ sơ sinh được giữ trong phạm vi độ bão hỏa thấp. Ngược lại, Thử nghiệm oxy Canada (Canadian Oxygen Trial), sử dụng kết quả chính là tổng hợp của tử vong, khuyết tật vận động thổ, nhận thức hoặc chậm phát triển ngôn ngữ, mất thính lực nghiêm trọng hoặc mủ hai bên ở độ tuổi đã điều chỉnh được 18 tháng, với kết quả thử phát là ROP và chấn thương não, đã không tạo ra sự khác biệt đáng kể về từ vong hoặc khuyết tật ở trẻ sơ sinh với phạm vi độ bão hòa thấp hơn so với cao hơn. Trong một phân tích gộp bao gồm tất cả các nghiên cứu NeOProM, với tổng số khoảng 5.000 trẻ sơ sinh, người ta kết luận rằng: Khi nhằm SpO, trong phạm vi thấp hơn sẽ làm tăng nguy cơ tử vong (RR 1,41; 95% Ch muc 1,14–1,74) và NEC (RR 1,25; 95% CI, 1,05–1,49), Tuy nhiên, trong phạm vi bảo tiêu hoa thấp hơn, nguy cơ ROP giảm đáng kể (RR 0,74; 95% CI, 0,59–0,92), Các tác giả của phân tích gộp này kết luận rằng: Mục tiêu SpO, từ 90% đến 95% đòi với trẻ sinh ra ở tuổi thai dưới 28 tuần cần bổ sung oxy được khuyến cáo áp dụng cho đến 36 tuần tuổi sau kỳ kinh cuối. Trong một phân tích góp gắn dây hơn sử dụng phương pháp Tổng quan Cochrane, 5 thử nghiệm NeoProm tương tự đã được phân tích. Khi sử dụng phương pháp xác định phù hợp về khuyết tật nặng, không có sự khác biệt đáng kể về kết cục chính tổng hợp là tử vong hoặc khuyết tật nặng ở trẻ sinh non tháng khi nhắm mục tiêu phạm vi bảo hòa oxy thấp hơn (SpO, ở mức 85%–89%) so với cao hơn (SpO, ở mức 21-95 %) (RR đặc hiệu, 1,04; 95% CI, 0,98–1,10; RD đặc hiệu, 0,02; 95% CI, 0,01 đến 0,05). Tuy nhiên, so với phạm vi mục tiêu cao hơn, phạm vi mục tiêu thấp hơn đã làm tăng đáng kể tỷ lệ tử vong ở độ tuổi điều chỉnh 19-24 tháng và NEC. Nhằm mục tiêu đến phạm vi thấp hơn đã làm giảm đáng kể tỷ lệ ROP cần điều trị. Không có sự khác biệt nào về mù, mất thính giác, bại não, hoặc các bệnh quan trọng khác ở trẻ sơ sinh được ghi nhận. Bên cạnh đó, trong một phân tích gộp theo kế hoạch khách quan về dữ liệu cá nhân tham gia bao gồm cả các bệnh nhân ở thử nghiệm NeoProM, kết quả đã xác nhận phương pháp Tổng quan Cochrane trước đây của Askie và cộng sự. Do đó, phạm vi mục tiêu SpO2 thấp hơn có liên quan đến nguy cơ tử vong và NEC cao hơn, nhưng nguy cơ điều trị ROP thấp hơn.
Mặc dù tất cả các thử nghiệm trên đều có thiết kế hoàn hảo song vẫn tồn tại một số lo ngại, đặc biệt là từ góc độ kỹ thuật đã làm dấy lên nghi ngờ về khả năng ứng dụng các kết luận của những thử nghiệm đó vào thực tế. Cũng cần biết rằng, độ chính xác của việc đọc các thiết bị đo độ bão hòa oxy mạch này được sử dụng là 2,9%. Do đó, nếu SpO2 hiển thị là 88%, độ bão hòa thực có thể nằm trong phạm vi từ 85% đến 91% trong 68% quan sát và trong phạm vi từ 82% đến 94% trong 95% quan sát. Ngoài ra, thuật toán được sử dụng trong những thử nghiệm này là kết quả của sự kết hợp giữa thuật toán dải cao và dải thấp. Hiệu quả của đường cong kép này là các giá trị SpO2 trong vùng từ 87% đến 90% (tại điểm giao nhau của đường cong thuật toán thấp hơn và cao hơn) đã được dịch báo hỏa trong phạm vi 90 %. Với sự phân tách tương đối nhỏ về SpO2 trung bình chuyển lên trên. Do đó, các trị số đo dễ dàng được nâng lên khoảng 2% khi gần giữa các nhóm mục tiêu cao và thấp, những cân nhạc kỹ thuật này khiến việc giải thích dữ liệu trở nên khó khăn, trong khi phạm vi bảo hòa tối ưu cho trẻ sinh nên tháng cần bổ sung oxy vẫn rất khó năm bắt. Khả năng là không có phạm vi SpO2 tổng hợp hoặc cung cấp oxy đáp ứng an toàn nhu cầu chuyển hóa của tất cả trẻ sinh ra ở các tuổi thai khác nhau. Ngoài ra, ngay cả đối với một tuổi thai nha định, tuổi sau sinh cũng là một yếu tố liên quan cần được xem xét khi thiết lập giới hạn bão hòa oxy. Mặc dù SpO2 được đo tương đối dễ dàng, nhưng lại không phản ánh trực tiếp việc cung cấp oxy cho mô. Ngoài độ bão hòa oxyhemoglobin việc cung cấp oxy ở cấp mộ bị ảnh hưởng bởi khả năng vận chuyển oxy (mức hemoglobin) và tuần hoàn, có thể phản ánh trực tiếp mức độ thiếu hoặc dư oxy của cơ thể. Cuối cùng, điều quan trọng cần lưu ý là phát hiện của các thử nghiệm này có thể liên quan phần lớn đến khả năng hạn chế của chúng tôi về việc duy trì SpO2 ở phạm vi mục tiêu trong quá trình chăm sóc thường quy. Việc tiếp xúc với mức SpO2 cực đoan có thể liên quan chặt chẽ đến các kết quả quan sát được hơn là phạm vi mục tiêu. Trong các thử nghiệm này, mức SpO2 thực tế không khớp chính xác với phạm vi mục tiêu, còn việc tiếp xúc với phạm vi SpO2 cực cao hoặc thấp có thể khác nhau giữa các phạm vi mục tiêu. Trong thực hành hàng ngày, suốt quá trình chăm sóc thường quy, mức SpO2 trên phạm vi mục tiêu thường được dung nạp để giảm tình trạng giảm oxy máu, nhưng phương pháp thực hành này làm tăng tiếp xúc với SpO2 cao. Ngược lại, nhằm mục tiêu đến các phạm vi SpO2 thấp hơn để tránh tăng oxy máu có thể làm tăng mức độ tiếp xúc với mức SpO2 rất thấp. Khả năng dung nạp SpO2 cao để ngăn chặn các đợt giảm oxy máu, hoặc nhằm mục tiêu vào khoảng SpO2 thấp nhằm tránh tăng oxy máu có thể không cần thiết, trong trường hợp cải thiện được việc duy trì khoảng SpO2 dự định và giảm thiếu được tiếp xúc với SpO2 cực cao hoặc cực thấp.
Cho đến khi có thêm bằng chứng, giữ trẻ sinh non trong phạm vi SpO2 từ 90% đến 95% có vẻ là một cách tiếp cận hợp lý. Giảm thiểu sự tăng giảm của SpO2 là điều rất đáng mong đợi, bởi tình trạng thiếu oxy và tăng oxy xen kẽ được biết đến là một kích thích tiến viêm. Để đạt được hiệu quả này, cần tâm đến việc cải thiện mục tiêu độ bão hòa oxy bằng cách kiểm soát tự động quan FO, (xem Chương 21).
Đánh giá nhu cầu Oxygen trong những tuần đầu tiên của của cuộc đời và các chỉ số chuyển số mới
Saugstad và cộng sự gợi ý rằng, có thể phân biệt giữa hai thời kỳ với các giới hạn oxy khác nhau. Trẻ rất non tháng dưới 32 tuần tuổi sau kỳ kinh cuối sẽ hưởng lợi từ giới hạn SpO, thấp hơn (ví dụ như 85%–95%) trong giai đoạn tăng trưởng mạch máu nhanh và cực nhạy cảm với tác hại của các gốc tự do, bởi hệ thống bảo vệ chống oxy hóa chưa trưởng thành. Trong giai đoạn này, việc sử dụng giới hạn oxy cao hơn sẽ dẫn đến stress oxy hóa và viêm trong phổi, ruột hoặc não, dẫn đến BPD, NEC hoặc IPVH. Tuy nhiên, trẻ sơ sinh lớn hơn (> 32 tuần tuổi sau kỳ kinh cuối) với hệ thống chống oxy hóa trưởng thành hơn và có xu hướng tăng sinh mạch máu của võng mạc do tình trạng thiếu oxy tương đối của mô võng mạc sẽ được hưởng lợi từ khoảng SpO, cao hơn (95%–97%). Cách tiếp cận thứ hai, mặc dù dựa trên các nguyên tắc sinh lý tốt, vẫn chưa được thiết lập chắc chắn. Do đó, trong giai đoạn ngay sau sinh và không phụ thuộc vào tuổi thai, độ bão hòa mục tiêu ở giai đoạn chuyển tiếp từ bào thai sang sơ sinh cho đến khi hoàn thành ổn định sau sinh phải là 90%. Tuy nhiên, dựa trên kết quả của các thử nghiệm SUPPORT và BOOST II, trong thời gian lưu trú tại NICU, việc giữ độ bão hòa oxy cho trẻ trong phạm vi từ 90% đến 95% có vẻ đầy đủ và an toàn.
Mặc dù vậy, mọi nỗ lực duy trì độ bão hòa oxy trong phạm vi hẹp đều phải cân băng với tình trạng mệt mỏi báo động, vì người phụ trách chăm sóc tại giường bệnh phải đáp ứng với các thay đổi về mức độ bão hòa ở từng trẻ sơ sinh. Bởi vì rất có thể có sự thay đổi đáng kể của tính nhạy cảm với tổn thương oxy hóa ở từng cá nhân, nên sẽ rất hữu ích nếu sử dụng các dấu ấn sinh học chức năng và không xâm lấn, cho phép các bác sĩ lâm sàng theo dõi chuyển hóa hiểu khi của tế bào và đánh giá phản ứng với can thiệp. Các dấu ấn sinh học truyền thống về tình trạng giảm oxy máu như lactic acid không có mối tương quan đáng kể với cường độ, nhưng lại đặc biệt tương quan với thời gian giảm oxy máu. Rõ ràng, tỷ lệ glycine/axit amin chuỗi nhánh hoặc alanin/axit amin chuỗi nhánh là những yếu tố dự báo tốt hơn nhiều về thời gian thiếu Ngoài ra, khi các chất chuyển hóa từ chu kỳ Krebs như succinate và propiony. l-carnitine cũng được xem xét, mối tương quan với thời gian thiếu oxy tế bào càng tăng thêm.
Trong một mô hình heo con bị bệnh não do thiếu tưới máu thiếu Kuligowski và cộng sự đã đề xuất điểm số chất chuyển hóa được tính toán dựa trên cường độ tương đối của choline, 6,8-dihydroxypurine và hypoxanthine cho thấy mối tương quan tối đa với thời gian thiếu oxy. Sự kết hợp của các chất chuyển hóa này được so sánh với hiệu suất của lactate, hiện được coi là tiêu chuẩn vàng. Trong giai đoạn tổn thương sau độc tố tức thì, cả lactate và điểm số chất chuyển hóa đều hoạt động tương tự lactate. Tuy nhiên, sau 2 giờ tổn thương, điểm số chất chuyển hóa hoạt động tốt hơn đáng kể và nâng cao khả năng dự đoán. Theo bài viết này, các nghiên cứu đang được thực hiện về mức độ của các yếu tố tăng trưởng, chẳng hạn như yếu tố tăng trưởng giống insulin và VEGF, cũng như tỷ lệ chất chuyển hóa, có thể được sử dụng tại giường bệnh trong tương lai, cho phép bác sĩ lâm sàng có thông tin đáng tin cậy liên quan đến oxy hóa tế bào, nhờ đó đảm bảo đủ lượng oxy và ngăn chặn sự bắt đầu tăng sinh mạch máu võng mạc.
Về nhà với oxy
Bệnh phổi mãn tính và nhu cầu oxy kéo dài sau khi xuất viện ở trẻ sinh cực non (tuổi thai ≤ 28 tuần) là một vấn đề lâm sàng cần quan tâm. Trong một nghiên cứu năm 2013 trên 48.877 trẻ sơ sinh từ 23 đến 43 tuần tuổi thai xuất viện từ NICU của 228 bệnh viện ở Mỹ, tỷ lệ BPD thay đổi theo tuổi thai, từ 37% ở trẻ cực non tháng đến 0,7% ở trẻ đủ tháng. Trong nhóm thuần tập này, có 1.286 trẻ (2,6%) được xuất viện với oxy tại nhà và 722 (56%) trẻ được xuất viện với oxy tại nhà là cực kỳ non tháng. Do đó, cho đến nay, tuổi thai vẫn là yếu tố nguy cơ quan trọng nhất đối với việc cần oxy tại nhà; tuy nhiên, các yếu tố liên quan khác là trẻ nhỏ so với tuổi thai, dị tật bẩm sinh, cần thở máy hoặc FiO, trên 40% trong 72 giờ đầu sau sinh và còn ống động mạch.
Mục tiêu của liệu pháp oxy tại nhà là ngăn ngừa các tác động của tỉnh trạng giảm oxy máu mãn tính, bao gồm: Co mạch phổi và tu sửa mạch máu phối dẫn đến tăng áp phối, co thắt phế quản gây tắc nghẽn đường thở và những thay đổi trong sự phát triển của mạch máu ở mắt. Cải thiện oxy có thể giúp cải thiện sự phát triển và sửa chữa phổi, cải thiện tình trạng dinh dưỡng tốt hơn và tăng trưởng cơ thể. Cần lưu ý rằng, mặc dù BPD là một yếu tố dự báo kết quả phát triển kém, song bệnh nhân bị BPD nặng được xuất viện về nhà với oxy không có điểm kém hơn trong các xét nghiệm phát triển thần kinh so với bệnh nhân BPD không cần bổ sung oxy tại nhà.
Quyết định cho trẻ về nhà thở oxy không phải là một quyết định dễ dàng. Trước khi xuất viện, trẻ phải đáp ứng một loạt yêu cầu hoặc tiêu chi, phổ biến đối với hầu hết các cơ sở (Hộp 16.1). Như một biện pháp an toàn, các thử nghiệm khử oxy (oxygen reduction test) có thể được thực hiện trước khi xuất viện. Mục đích của thử nghiệm khử oxy là để xem SpO, có đạt được trong không khí phòng sau khi ngừng cung cấp oxy bổ sung hay không. Ở hầu hết các đơn vị, cần duy trì SpO, tối thiểu lớn hơn 80% trong không khí trong 30 phút trước khi xuất viện; sau khi xuất viện, các dấu hiệu lâm sàng như tần số hô hấp và tăng trưởng kết hợp với đo độ bão hòa oxy liên tục qua đêm – hoặc đa ký giấc ngủ (polysomnography) – được theo dõi.
Điều thú vị là, việc bổ sung oxy sau khi xuất viện có thể đem lại một số lợi ích ở trẻ bị BPD. DeMauro và cộng sự đã so sánh các kết cục về y tế và phát triển trong 2 năm đầu đời giữa trẻ cực non tháng mắc chứng BPD được xuất viện với oxy bổ sung qua ống thông mũi và trẻ có mức độ nghiêm trọng tương tự nhưng được xuất viện khi thở trong không khí phòng. Bổ sung oxy có liên quan đến việc cải thiện một chút tình trạng tăng trưởng và tăng nguồn tài nguyên; tuy nhiên, trẻ có nhiều khả năng phải nhập viện lại vì bệnh hô hấp, có thể cần phải dùng thuốc và thiết bị hô hấp. Tỷ lệ suy giảm phát triển thần kinh tương tự nhau giữa các nhóm.
| Hộp 16.1 Các tiêu chí được thực hiện tại Viện của chúng tôi để ra quyết định về việc cho trẻ sinh non xuất viện và về nhà với oxy |
| A. Tuổi điều chỉnh trên 34 tuần tuổi thai. B. Có thể duy trì nhiệt độ cơ thể (37,0°C ở nách) trong cũi mở. C. Cho bú bình/bú mẹ hiệu quả mà không gây mệt mỏi hoặc ảnh hưởng đến hệ hô hấp-tim mạch. D. Tăng cân đầy đủ trong tuần trước khi xuất viện (10–15 g/kg/ngày). E. Trưởng thành về mặt sinh lý. F. Chức năng hô hấp ổn định với các giá trị theo dõi SpO2 liên tục thuộc phạm vi thiết lập (90%–95%) trong 12 đến 24 giờ trước. G. Không ngưng thở của trẻ sinh non (không cần điều trị bằng caffeine). H. Không có tình trạng sức khỏe đang diễn tiến cần điều trị tại bệnh viện. L Được chủng ngừa thích hợp. J. Kiểm tra chuyển hóa đã được thực hiện. K. Đào tạo gia đình cơ bản (sử dụng máy đo độ bão hòa oxy mạch nầy, các thao tác hồi sức cơ bản), gần bỏ với khoa cấp cứu và chương trình theo dõi phòng khám ngoại trú. L. Được gia đình chấp nhận. |
Khuyến cáo về độ bão hòa oxy
Chúng tôi gợi ý rằng, trẻ sinh non nên đạt SpO, từ 90% đến 95% trong phỏng sinh vào khoảng 5 đến 15 phút sau khi sinh, tùy thuộc vào tuổi thai, kiểu sinh. giới tính và đáp ứng với các thủ thuật ổn định. Khi ở trong NICU và cho đến khi trẻ đạt 36 tuần tuổi sau kỳ kinh cuối, phạm vi SpO, phải là 90% đến 95%, theo các ấn phẩm gần đây nhất tại thời điểm viết bài. Nếu BPD và/hoặc tăng áp động mạch phổi xuất hiện đồng thời, SpO, trung bình nên được phép là 94%. có nghĩa là trong hầu hết thời gian, trẻ sẽ bão hòa khoảng 95% đến 97%. Cuối cùng, đo độ bão hòa oxy nên được theo dõi tại nhà và lấy lại định kỳ trong thời gian kéo dài từ 8 đến 12 giờ. Trong các khoảng thời gian theo dõi này, phạm vi SpO, phải là 95% đến 97% vào hầu hết thời gian. Nếu tình trạng tăng áp động mạch phối được kiểm soát và bệnh nhân đang lớn, nên cân nhắc việc cai oxy.