Kỹ thuật y khoa
Dược mỹ phẩm và Cơ chế vận chuyển: Chức năng da và Hàng rào da
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: Rawaa M. Almukhtar, Sabrina G. Fabi
Biên dịch: Bác sĩ Trương Tấn Minh Vũ
nhathuocngocanh.com – Để tải file PDF của bài viết Dược mỹ phẩm và Cơ chế vận chuyển: Chức năng da và Hàng rào da, xin vui lòng click vào link ở đây.
Tóm tắt
Dược mỹ phẩm (cosmeceutical) đại diện cho một trong những phân khúc phát triển nhanh nhất của các sản phẩm chăm sóc cá nhân. Những tiến bộ trong lĩnh vực sinh học da và dược lý học đã tạo điều kiện cho sự phát triển của các hợp chất hoạt tính mới. Sự gia tăng số lượng các thành phần hoạt tính được cung cấp tại chỗ qua da dẫn đến làm tăng tầm quan trọng của việc hiểu rõ cơ chế vận chuyển của các thành phần hoạt tính đó. Việc vận chuyển hoạt chất lý tưởng nhằm mục đích đạt được khả năng vận chuyển cao, ổn định về công thức và giảm thiểu tác dụng phụ. Có hai con đường vận chuyển các dược mỹ phẩm: con đường xuyên qua biểu bì và con đường xuyên qua phần phụ. Hệ thống vận chuyển có thể được chia thành hệ thống chủ động và hệ thống thụ động. Các hệ thống chủ động sử dụng các phương pháp vật lý tăng cường như sóng âm, điện di, vi kim, vi mài da, và các phương pháp bằng laser bóc tách, không bóc tách và phân đoạn. Hệ thống thụ động sử dụng các phương pháp vận chuyển hóa học bao gồm hoá chất tăng cường xâm nhập, nhũ tương, hệ thống dựa trên túi nước lipid và hệ thống mang dạng hạt lipid. Ở đây chúng tôi xem xét các cơ chế vận chuyển các thành phần hoạt tính qua da và các hệ thống mà chúng được vận chuyển qua lớp biểu bì.
Lớp sừng (stratum corneum, SC) là một rào cản mạnh mẽ trong vận chuyển thuốc. Điều này đặc biệt có vấn đề đối với các phân tử tương đối lớn có khối lượng phân tử lớn hơn 500 Da [1]. Vượt qua hàng rào bảo vệ da một cách an toàn và hiệu quả là mục tiêu của hệ thống vận chuyển qua da [2]. Việc vận chuyển thuốc tại chỗ phụ thuộc nhiều vào khả năng của các thành phần hoạt tính để thấm qua da với số lượng đủ để đạt được hiệu quả điều trị mong muốn. Việc vận chuyển thuốc và thành phần hoạt tính qua da đã trở nên phổ biến chưa từng có trong thập kỷ qua do nhu cầu vận chuyển có mục tiêu và tại chỗ với các tác dụng phụ tối thiểu [3].
Các con đường thâm nhập da
Các con đường vận chuyển thuốc qua da bao gồm con đường xuyên biểu bì (gian bào và nội bào) và xuyên phần phụ (nang lông, ống mồ hôi và tuyến bã) [4] (Hình 1).
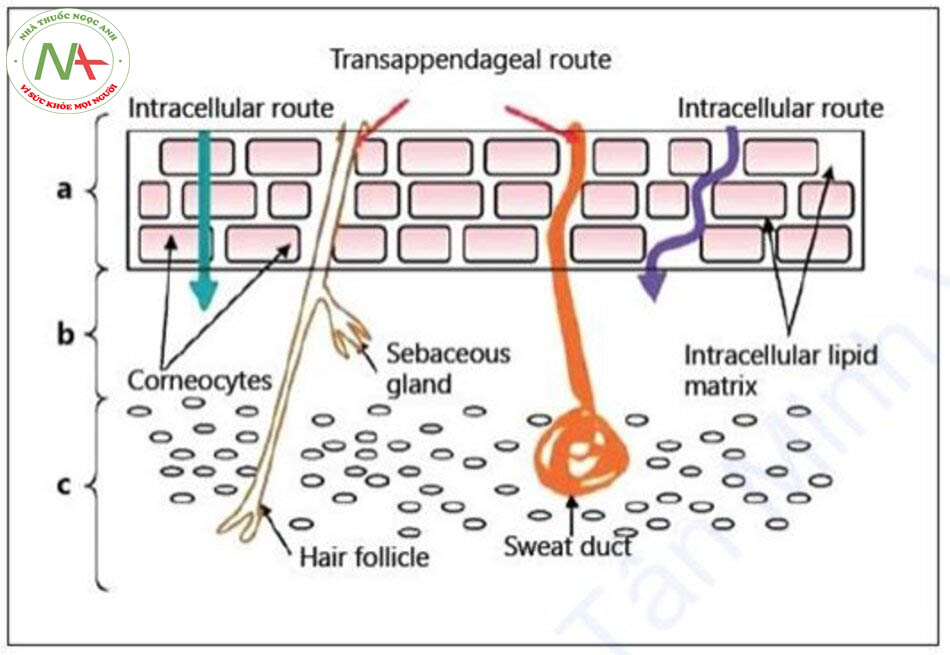
Con đường xuyên biểu bì (Transepidermal Pathway)
Con đường xuyên biểu bì bao gồm con đường gian bào và con đường nội bào. Con đường gian bào liên quan đến sự khuếch tán chất tan qua các miền lipid gian bào (Hình 1) [4]. Nhiều nghiên cứu báo cáo rằng lipid gian bào, chứ không phải protein của tế bào sừng hoá, là hàng rào thẩm thấu chính của biểu bì. Con đường nội bào (xuyên tế bào) liên quan đến sự thẩm thấu qua các tế bào sừng hoá, sau đó là các lipid gian bào [5]. Sự thẩm thấu qua các tế bào sừng hoá dẫn đến việc tạo ra một lỗ nước thông qua sự suy thoái của các corneodesmosomes. Do đó, tuyến đường này được cho là ưu tiên vận chuyển các hợp chất ưa nước hơn. Sự bít tắc, sóng siêu âm và điện di có thể làm tăng dạng thấm này [6].
Con đường xuyên phần phụ (Transappendageal Pathway)
Trong con đường xuyên phần phụ, sự xâm nhập của các hoạt chất xảy ra thông qua việc mở các nang lông và các tuyến mồ hôi [7]. Các nang lông đóng một vai trò quan trọng trong con đường này do độ sâu của nang kéo sâu vào lớp bì [8]. Số đơn vị nang, đường kính và thể tích nang là những cân nhắc quan trọng trong việc xác định mức độ vận chuyển qua con đường này.
Hệ thống vận chuyển
Cách tiếp cận chính đầu tiên để vượt qua hàng rào bảo vệ da là sử dụng các hệ thống vận chuyển hóa học nhưchấttăng cường thâm nhậphóa học (chemical penetration enhancers, CPE), nhũ tương, hệ thống dựa trên bóng nước gốc lipid và hệ thống mang dạng hạt lipid. Cách tiếp cận thứ hai là sử dụng các phương pháp vật lý tăng cường, trong đó động lực bên ngoài được sử dụng để thẩm thấu các thành phần hoạt tính. Các phương pháp này bao gồm siêu âm, electroporation, điện từ, vi kim, bóc tách bằng nhiệt, vi mài da, và iontophoresis [2, 4, 8–11]. Hơn nữa, laser bóc tách, không bóc tách và laser phân đoạn đã cho thấy hiệu quả như một phương tiện để tăng sự thẩm thấu qua da của các dược mỹ phẩm [4]. Cả hai cách tiếp cận nói trên, hóa học và vật lý, đều cho thấy sự vận chuyển thành công đối với nhiều loại dược mỹ phẩm. Bài viết này sẽ tập trung vào các hệ thống vận chuyển hóa học.
Hệ thống vận chuyển hóa học
Chất tăng cường thâm nhập hóa học (Chemical Penetration Enhancers)
Da cung cấp một con đường dễ dàng tiếp cận để vận chuyển thuốc mà không cần qua bước chuyển hóa đầu tiên. Để đạt được vận chuyển thuốc qua da, thường phải khắc phục tính thấm thấp của SC. Một chiến lược phổ biến là sử dụng các chất tăng cường xâm nhập có tác dụng làm tăng sự di chuyển của thuốc qua SC và làm giảm tính kháng của hàng rào.
CPE hoạt động theo nhiều cơ chế đã được công nhận; hòa tan lipid chất nền gian bào, phá vỡ thành phần protein của các vùng keratin nội bào, và tăng sự phân chia thuốc vào mô bằng cách hoạt động như một dung môi cho chất thấm trong màng tế bào [12]. Do đó, CPE có thể gây kích ứng da và gây lo ngại về an toàn liên quan đến sức khỏe của hàng rào bảo vệ da. Nhiều loại hợp chất khác nhau đã được đề xuất như là CPE, bao gồm axit béo (ví dụ, axit dodecanoic, axit stearic, axit oleic), chất hoạt động bề mặt (ví dụ, natri dodecyl sulfat), azone (ví dụ, laurocapram), osmolytes (ví dụ, urê và glycols, bao gồm propylene glycol), và monoterpenes (ví dụ: thymol, carvacrol và geraniol) [13, 14]. Các lớp hợp chất này khác nhau về các tính chất hóa học và vật lý, và do đó dự kiến sẽ ảnh hưởng đến các đặc tính phân tử SC theo những cách khác nhau. Các axit béo, chất hoạt động bề mặt và monoterpen chủ yếu ảnh hưởng đến lipid SC trong khi chất thẩm thấu ảnh hưởng đến cả thành phần lipid và protein SC [15]. Phản ứng kích ứng của CPE tương quan với khả năng làm biến tính protein SC của chúng [15]. Hơn nữa, hiệu ứng phân tử của các hợp chất được thêm vào trên SC phụ thuộc vào quá trình hydrat hóa SC. Việc bổ sung nước dẫn đến tăng tính di động của phân tử của cả thành phần protein và lipid của SC. Tăng ngậm nước được cho là sẽ dẫn đến tính thấm cao hơn đối với cả hợp chất phân cực và không phân cực [16]. Phần chính của cả lipid và các thành phần keratin đều ở thể rắn. Trong điều kiện ngậm nước, các phần nhỏ của thành phần lipid và protein SC trở nên lỏng. Hơn nữa, tính hoá lỏng trong các thành phần này cũng có thể bị thay đổi bằng cách bổ sung các hợp chất như urê hoặc glycerol là thành phần của yếu tố giữ ẩm tự nhiên.
Các peptide thâm nhập tế bào (Cell-penetrating peptides, CPP), còn được gọi là vùng dẫn truyền protein, đã thu hút được nhiều sự chú ý trong những năm gần đây và nổi lên như một chiến lược không xâm lấn đơn giản và hiệu quả để đưa phân tử kích thước lớn vào da [17]. Mặc dù CPP đã chứng tỏ tiềm năng của chúng trong việc tăng khả năng vận chuyển vào da, chúng vẫn đang phát triển như một loại chất tăng cường thẩm thấu qua da mới. CPP là những peptide tương đối ngắn (chiều dài lên đến 30 axit amin), tan trong nước, tích điện dương và/hoặc lưỡng tính có khả năng mang các phân tử lớn qua màng tế bào [17]. CPP ngày càng được sử dụng để làm trung gian vận chuyển các phân tử như phân tử nhỏ, nucleotide RNA can thiệp nhỏ, các hạt nano chứa thuốc, protein và peptide mà không sử dụng bất kỳ thụ thể nào và không gây ra bất kỳ tổn thương đáng kể nào cho màng tế bào [18]. Các peptit này có khả năng nội hóa tĩnh điện hoặc hoạt tính sinh học liên kết cộng hóa trị vật chất vận chuyển với hiệu suất cao và độc tính tối thiểu [19].
Nhũ tương
Nhũ tương là hỗn hợp của các chất lỏng thường không hòa trộn (nước và dầu): dầu trong nước (oil-in-water, O/W), trong đó các giọt dầu được phân tán trong nước, hoặc nước trong dầu (water-in-oil, W/O), trong đó các giọt nước được phân tán trong dầu [20]. Loại trước được sử dụng phổ biến hơn trong các công thức bôi ngoài da. Nhũ tương có màu trắng sữa với độ phân tán thô và kích thước giọt trong khoảng micromet. Chúng ổn định về mặt nhiệt động học nhưng không ổn định về mặt động học và do đó cuối cùng sẽ phân tách pha. Vi nhũ tương và nhũ tương nano là công thức của nước và dầu, tương tự như nhũ tương, nhưng có thêm chất hoạt động bề mặt.
Vi nhũ tương là những chất phân tán có kích thước giọt từ 10 đến 100 nm [21]. Chúng trong suốt hoặc mờ và ổn định về mặt nhiệt động lực học. Ưu điểm của vi nhũ tương bao gồm: dễ bào chế và chi phí thấp, khả năng kết hợp đồng thời cả thuốc ưa nước và thuốc ưa mỡ, tăng khả năng tải thuốc và tăng khả năng thâm nhập. Sự hấp thụ được cải thiện bằng cách sử dụng các chất tăng cường thẩm thấu trong pha dầu của vi nhũ tương, như axit oleic, hoặc bằng cách sử dụng các chất hoạt động bề mặt. Biểu hiện sạch và dễ sử dụng của chúng làm tăng khả năng được ưa chuộng và sử dụng trong nhiều loại mỹ phẩm, gồm kem dưỡng ẩm, chế phẩm chống nắng, sản phẩm nhuộm da, sản phẩm chống lão hóa, chất chống mồ hôi, chất khử mùi, chăm sóc tóc và sản phẩm tạo màu, và nước hoa. Mối quan tâm chung liên quan đến việc sử dụng vi nhũ tương để vận chuyển tại chỗ là các tác dụng phụ tiềm ẩn của chúng, chủ yếu là khả năng kích ứng da và tác dụng gây mụn. Những tác dụng phụ này thường liên quan đến thời gian tiếp xúc và thành phần và nồng độ của các thành phần, đặc biệt là các chất hoạt động bề mặt và các thành phần của pha dầu.
Nhũ tương nano là nhũ tương với các giọt nhỏ hơn 100 nm, có thể so sánh với kích thước của vi nhũ tương [22]. Nhũ tương nano có ưu điểm là được tạo thành với lượng nhỏ chất hoạt động bề mặt hơn, và do đó khả năng gây kích ứng da thấp hơn [23]. Việc chuẩn bị các nhũ tương nano ổn định thường đòi hỏi các phương pháp đầu vào tốn kém, năng lượng cao. Nhũ tương nano có tính ổn định về mặt động học, không phải về
mặt nhiệt động lực học [24]. Tính không ổn định của chúng dẫn đến việc sử dụng thuận lợi hơn các hệ thống vận chuyển có kích thước nano khác như nanosomes hoặc các hạt nano lipid rắn (SLN), sẽ được thảo luận ở phần sau. Nhũ tương nano được sử dụng để vận chuyển qua da nhiều thành phần, bao gồm gamma tocopherol, caffeine và DNA plasmid [25–27].
Hệ thống túi nước lipid
Trong vài năm qua, các hệ thống dựa trên túi nước ngày càng được sử dụng như một phương tiện hấp dẫn để vận chuyển các tác nhân điều trị khác nhau qua da. Một hệ thống dựa trên túi nước bao gồm một cấu trúc phiến đồng tâm với một lõi nước được bao quanh bởi một lớp kép phospholipid [28]. Các hệ thống này cung cấp nhiều cơ hội cho việc thu hút các loại thuốc ưa nước, ưa mỡ và lưỡng tính. Cơ chế vận chuyển thuốc liên quan đến việc cải thiện khả năng hòa tan của thuốc, phân chia thuốc vào da và lỏng hóa lipid SC[29]. Các hệ thống dựa trên túi nước bao gồm ba chất mang chính:liposome, transfersomes (liposome siêu biến dạng), và ethosome [30] (Bảng 1).
Bảng 1. Hệ thống vận chuyển dựa trên túi nước lipid
| Hệ thống túi nước | Thành phần | Ưu điểm | Nhược điểm |
| Liposome | Túi nước được hình thành bởi lipid phân hủy sinh học (phospholipid và cholesterol) bao quanh một lõi nước |
|
|
| Liposome siêu biến dạng | Tương tự như cấu trúc dạng túi nước của liposome thông thường nhưng về mặt chức năng, chúng biến dạng phù hợp với sự hiện diện của chất kích hoạt cạnh bên |
|
Chi phí của lipid cao
Việc tải thuốc kỵ nước có thể ảnh hưởng đến tính đàn hồi của túi nước – Độ thẩm thấu qua da hạn chế trong các điều kiện bí tắc |
| Ethosomes | Tương tự như liposome thông thường ở cấu trúc dạng túi nước nhưng về mặt chức năng chúng bị biến dạng phù hợp do sự hiện diện của etanol |
|
|
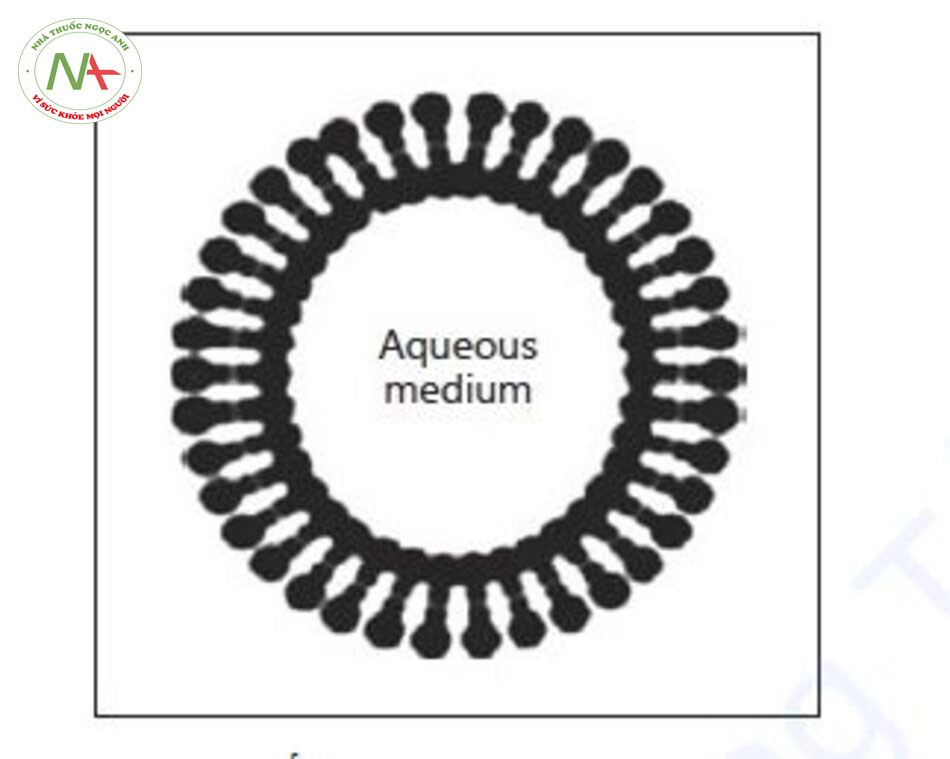
Liposome
Thế hệ đầu tiên của hệ thống dựa trên túi nước là liposome, được Mezei và Gulasekharam [31] mô tả lần đầu tiên vào năm 1980. Một liposome được hình thành bởi một lớp kép lipid bao quanh dung dịch nước (Hình 2) và có thể có kích thước từ 200 đến 800 nm [29, 32]. Việc vận chuyển thuốc sử dụng những chất mang này chủ yếu bị hạn chế bởi độ cứng và kích thước của chúng, có thể cản trở sự xâm nhập vào SC. Các liposome có kích thước hơn 600 nm không xâm nhập sâu và vẫn nằm trong SC. Lợi thế của chúng nằm ở nhiều loại thuốc có thể được kết hợp cũng như khả năng tương thích sinh học của chúng với các phospholipid tự nhiên. Ví dụ về các loại thuốc được vận chuyển qua da bằng cách sử dụng liposome là curcumin và axit retinoic [33–35]. Hơn nữa, liposome đã được sử dụng để vận chuyển siRNA qua da và tác động đến sự biểu hiện của protein ở các tế bào sừng lớp đáy [36].
Transfersomes
Nhu cầu về chất mang nhỏ hơn, đàn hồi hơn đã dẫn đến sự phát triển của thế hệ thứ hai của chất mang dựa trên túi nước lipid, transferosomes, còn được gọi là liposome siêu biến dạng [37]. Năm 1992, Cevc và Blume [38] đã giới thiệu các transferosomes, giống như liposome về hình thái nhưng ưa lipid hơn, nhỏ hơn 300 nm và đàn hồi hơn liposome ít nhất một bậc. Hơn nữa, khi so sánh với liposome, transferosomes chứa một hoặc nhiều các chất hoạt hóa cạnh bên (edge-activator), chất hoạt động bề mặt là chất hoạt hóa cạnh bên được sử dụng phổ biến nhất. Các chất hoạt hóa cạnh bên thường được sử dụng để tạo liposome siêu định dạng gồm natri cholate, natri deoxycholate, Span 60, Span 65, Span 80, Tween 20, Tween 60, Tween 80, và dipotassium glycyrrhizinate [37]. Có 2 cơ chế chính được đề xuất của việc vận chuyển qua da thông qua các liposome siêu biến dạng [37, 39]. Cơ chế đầu tiên được đề xuất rằng bản chất có thể biến dạng của các túi nguyên vẹn góp phần vào việc xâm nhập của chúng vào SC. Cơ chế thứ hai đề xuất rằng các túi hoạt động như chất tăng cường thâm nhập, theo đó các túi thay đổi lipid gian bào của SC. Bởi vì sự vận chuyển của chúng qua da được thúc đẩy bởi một gradient hydrat hóa, làm bít tắc có thể làm giảm hoạt động của các túi nước có thể biến dạng bằng cách loại bỏ lực gradient. Một nhược điểm của các túi này là khó khăn trong việc tải thuốc kỵ nước vào các túi mà không ảnh hưởng đến tính chất biến dạng và đàn hồi của chúng [39].
Ethosomes
Godin và Touitou [40] đã phát triển thế hệliposome thứba, được gọi là ethosomes. Một ethosome bao gồm một lõi nước, lớp kép phospholipid và ethanol (20–45%). Việc kết hợp nồng độ etanol cao, giúp phân biệt ethosome với các chất mang túi nước khác, tạo ra điện tích âm cho liposome làm cho kích thước túi nước giảm xuống phạm vi nanomet, do đó tăng cường khả năng thẩm thấu qua da của chúng. Chúng cũng có độ đàn hồi cao hơn,thường cao hơn 10–30 lần so với liposome thông thường [40, 41]. Không giống như transferosomes, ethosomes có thể cải thiện việc vận chuyển thuốc qua da cả trong điều kiện bít tắc và không bít tắc. Việc bổ sung ethanol trong ethosome có thể góp phần vào đặc tính vận chuyển vượt trội của chúng, có thể dẫn đến sự hấp thu toàn thân của các thuốc được bao bọc trong ethosome [41]. Khả năng của ethosomes đối với kích ứng và hấp thu toàn thân bên cạnh về tính an toàn lâu dài của chúng cần được nghiên cứu thêm. Hệ thống vận chuyển ethosome tăng cường đáng kể sự thẩm thấu qua da của minoxidil và đã được sử dụng để vận chuyển axit hyaluronic [42–44].
Các túi nước lipid mới nổi khác
Niosomes là những túi không tích điện gồm một lớp hoặc nhiều lớp, trong đó thành phần hoạt tính được bao bọc. Chúng đã cải thiện tính ổn định và tính sẵn sàng của các thành phần hoạt tính cũng như khả năng thâm nhập vào da so với liposome. Ví dụ về các loại thuốc được vận chuyển bằng niosomes là minoxidil và axit ellagic [44]. Tác dụng hiệp đồng của hai chất chống oxy hóa, α-tocopherol và curcumin, đã được chứng minh bằng cách sử dụng hệ thống vận chuyển niosome [45].
Ultrasome là liposome bao bọc một enzym UV-endonuclease [46]. Chúng giúp sửa chữa các tổn thương DNA do tia cực tím gây ra và ức chế sự biểu hiện của các cytokine gây viêm. Tương tự, photoomes giúp sửa chữa tổn thương DNA bằng cách bao bọc một enzyme kích hoạt bởi ánh sáng (photolyase) trong cấu trúc liposomal và do đó được đưa vào một số sản phẩm kem chống nắng nhất định.
Hệ thống mang dạng hạt lipid
Các hệ thống mang dạng hạt lipid đã thu hút các nhà nghiên cứu và trở nên phổ biến hơn các hệ thống vận chuyển khác trong những năm gần đây vì sự sẵn có của các thành phần lipid không độc hại và tương thích sinh học [47]. Các hệ thống mang dạng hạt lipid thường bao gồm các vi nang, vi bọt và các hạt lipid nano, như SLN và chất mang lipid có cấu trúc nano (NLC) [47].
Vi nang (Micro-Capsules)
Việc sử dụng vi nang trong các sản phẩm dược phẩm mỹ đã được quan tâm nhiều hơn trong những năm gần đây do nhu cầu kết hợp các thành phần hoạt tính khác nhau trong một sản phẩm [48]. Micro-capsulation được sử dụng để tránh sự tương kỵ của các hoạt chất, giảm mùi thành phần và bảo vệ các hoạt chất dễ bị oxy hóa bởi độ ẩm không khí. Vi nang được sử dụng trong việc vận chuyển có kiểm soát nhiều thành phần hoạt tính, bao gồm chất lọc ánh sáng mặt trời (octyl salicylat), chất chống oxy hóa (tocopherol), dầu (dầu khoáng), chất thơm, sản phẩm làm sạch (isopropyl palmitate), vitamin (vitamin A và D), và retinoids tại chỗ [46, 48].
Vi bọt (Micro-Sponges)
Vi bọt sử dụng công nghệ vi bọc trong đó lớp vỏ bao quanh thành phần hoạt tính có cấu trúc xốp hơn là cấu trúc vỏ liên tục như trong vi nang [49]. Lớp vỏ xốp giúp giải phóng (các) thành phần hoạt tính liên tục trong thời gian dài hơn. Các khối cầu có thể được lập trình để giải phóng (các) thành phần hoạt tính với việc sử dụng các tác nhân kích hoạt khác nhau như áp lực tác động hoặc đưa nước vào [49]. Hệ thống bao bọc có thể kiểm soát việc giải phóng các hoạt chất lên lớp biểu bì, do đó làm giảm kích ứng trong khi vẫn duy trì hiệu quả. Một ví dụ về việc tăng hiệu quả và giảm kích ứng khi sử dụng vi bọt được quan sát thấy với benzoyl peroxide được bọc trong hệ thống vi bọt [50]. Các vi bọt làm giảm các đặc tính khó chịu của thành phần chính, như được quan sát thấy với kẽm pyrithione và selen sulfide [51].
Hạt lipid nano (Lipid Nanoparticles)
Hạt nano lipid là những hạt keo có kích thước từ 10 đến 1.000 nm. Hiện nay, có hai thế hệ hạt lipid nano: SLNs và NLCs. SLNs có thể được coi là thế hệ đầu tiên của các hạt lipid nano, trong khi NLCs được coi là thế hệ thứ hai, khắc phục những thiếu sót của SLNs [47, 52, 53] (Bảng 2).
Bảng 2. So sánh giữa SLNs và NLCs
| SLNs | NLCs | |
| Thành phần | Chỉ gồm lipid rắn. Hàm lượng lipid dao động từ 1 đến 30%, chất nền lipid của lõi được xếp thứ tự cao | Được tạo thành từ sự pha trộn của chất béo lỏng và chất béo rắn theo tỷ lệ 7: 3 đến 9: 1, chất nền lipid của lõi được sắp xếp ít hơn |
| Khả năng bao bọc thuốc | Hiệu quả bao bọc thuốc thấp hơn | Hiệu quả bao bọc thuốc cao hơn |
| Tính gây bít tắc | Nhiều hơn | Ít tắc hơn |
| Thẩm thấu qua da | Hiệu quả tăng cường thẩm thấu qua da thấp hơn | Hiệu quả tăng cường thẩm thấu qua da cao hơn |
| Cấu trúc |  |
 |
Hạt lipid nano rắn (Solid Lipid Nanoparticles)
SLNs là hệ thống vận chuyển thuốc dạng keo bao gồm lipid sinh lý và phân hủy sinh học. Về mặt cấu trúc, chúng có dạng hình cầu với hàm lượng lipid từ 1 đến 30% [54]. SLN đã trở nên phổ biến và vượt trội hơn so với các hệ thống vận chuyển khác do sự giải phóng hoạt chất được kiểm soát của chúng, hiệu quả bao bọc thuốc cao hơn đối với các loại thuốc ưa mỡ, tăng cường độ ổn định của thuốc, cũng như bảo vệ các chất không bền khỏi sự phân hủy hóa học, phân hủy ánh sáng, thủy phân và oxy hóa [55]. Hơn nữa, kích thước nano của chúng đảm bảo tăng cường khả năng tiếp xúc và thâm nhập vào lớp biểu bì. SLN có khả năng chống tia cực tím và các đặc tính ngăn chặn sự mất nước qua biểu bì. Tất cả những đặc tính độc đáo này làm cho SLNs hấp dẫn để vận chuyển các thành phần dược phẩm mỹ cho da. Ví dụ về các hoạt chất được vận chuyển qua SLNs gồm hydroquinone, adapalene và curcuminoids [56–59].
Chất mang lipid có cấu trúc nano(Nanostructured Lipid Carriers)
NLCs là các hạt lipid nano thế hệ thứ hai [60]. Chúng là các dạng SLN đã biến đổi trong đó pha lipid bao gồm cả lipid lỏng và lipid rắn. NLC được phát triển để vượt qua một số thách thức với SLN, như kết tụ, rò rỉ thuốc, nguy cơ tạo gel, hàm lượng nước cao và tải thuốc kém. Việc bổ sung lipid lỏng vào cấu trúc của NLC khiến chúng có khả năng bọc thuốc cao hơn, khả năng thấm qua da cao hơn và khả năng gây bít tắc thấp hơn khi so sánh với SLN [61]. Cơ chế thẩm thấu qua da của NLC tương tự như SLN. Vì NLCs có khả năng tải thuốc cao hơn, nên có thể đạt được gradient nồng độ cao hơn so với SLN. Việc sử dụng NLCs trong kem chống nắng vật lý đã được chứng minh là có đặc tính bảo vệ tia cực tím tổng hợp. Tất cả các thuộc tính này làm cho các chất mang dạng NLC tuyệt vời để vận chuyển thuốc tại chỗ nhằm cải thiện quá trình hydrat hóa da, giải phóng thuốc được kiểm soát, khả năng thẩm thấu thuốc và độ ổn định của thuốc [62]. NLCs đã được sử dụng thành công trong việc vận chuyển tại chỗ các chất chống oxy hóa ánh sáng như axit alpha-lipoic và retinoids tại chỗ [62–65].
Tài liệu tham khảo
- Bos JD, Meinardi MM: The 500 Dalton rule for the skin penetration of chemical compounds and drugs. Exp Dermatol 2000; 9: 165–169.
- Naik A, Kalia YN, Guy RH: Transdermal drug delivery: overcoming the skin’s barrier function. Pharm Sci Technolo Today 2000; 3: 318–326.
- Paudel KS, et al: Challenges and opportunities in dermal/transdermal delivery. Ther Deliv 2010; 1: 109–131.
- Zaleski-Larsen LA, Fabi SG: Laser-assisted drug delivery. Dermatol Surg 2016; 42: 919–931.
- Feingold KR: Thematic review series: skin lipids. The role of epidermal lipids in cutaneous permeability barrier homeostasis. J Lipid Res 2007; 48: 2531–2546.
- Nino M, Calabro G, Santoianni P: Topical delivery of active principles: the field of dermatological research. Dermatol Online J 2010; 16: 4.
- Liu X, et al: Hair follicles contribute significantly to penetration through human skin only at times soon after application as a solvent deposited solid in man. Br J Clin Pharmacol 2011; 72: 768–774.
- Patel N, et al: Application of design of experiments for formulation development and mechanistic evaluation of iontophoretic tacrine hydrochloride delivery. Drug Dev Ind Pharm 2016; 42: 1894– 1902.
- Patel N, et al: Influence of electronic and formulation variables on transdermal iontophoresis of tacrine hydrochloride. Pharm Dev Technol 2015; 20: 442–457.
- Homick JL, et al: Transdermal scopolamine in the prevention of motion sickness: evaluation of the time course of efficacy. Aviat Space Environ Med 1983; 54: 994–1000.
- Kim YC, et al: Microneedle delivery of trivalent influenza vaccine to the skin induces long-term cross-protection. J Drug Target 2016; 24: 943–951.
- Jain S, et al: Quality by design approach for formulation, evaluation and statistical optimization of diclofenac-loaded ethosomes via transdermal route. Pharm Dev Technol 2015; 20: 473–489.
- Barry BW: Drug delivery routes in skin: a novel approach. Adv Drug Deliv Rev 2002; 54(suppl 1):S31–S40.
- Pyatski Y, et al: Effects of permeation enhancers on flufenamic acid delivery in ex vivo human skin by confocal Raman microscopy. Int J Pharm 2016; 505: 319– 328.
- Pham QD, et al: Chemical penetration enhancers in stratum corneum – relation between molecular effects and barrier function. J Control Release 2016; 232: 175–187.
- Southwell D, Barry BW: Penetration enhancers for human skin: mode of action of 2-pyrrolidone and dimethylformamide on partition and diffusion of model compounds water, n-alcohols, and caffeine. J Invest Dermatol 1983; 80: 507–514.
- Kumar S, et al: Peptides as skin penetration enhancers: mechanisms of action. J Control Release 2015; 199: 168–78.
- Lu SW, et al: Arginine-rich intracellular delivery peptides synchronously deliver covalently and noncovalently linked proteins into plant cells. J Agric Food Chem 2010; 58: 2288–2294.
- Venuganti VV, Perumal OP: Effect of poly(amidoamine) (PAMAM) dendrimer on skin permeation of 5-fluorouracil. Int J Pharm 2008; 361: 230–238.
- Piemi MP, et al: Positively and negatively charged submicron emulsions for enhanced topical delivery of antifungal drugs. J Control Release 1999; 58: 177– 187.
- Lawrence MJ, Rees GD: Microemulsionbased media as novel drug delivery systems. Adv Drug Deliv Rev 2000; 45: 89– 121.
- Kumar M, Pathak K, Misra A: Formulation and characterization of nanoemulsion- based drug delivery system of risperidone. Drug Dev Ind Pharm 2009; 35: 387–395.
Liu W, et al: Formation and stability of paraffin oil-in-water nano-emulsions prepared by the emulsion inversion point method. J Colloid Interface Sci 2006; 303: 557–563. - Paliwal R, Babu RJ, Palakurthi S: Nanomedicine scale-up technologies: feasibilities and challenges. AAPS PharmSci- Tech 2014; 15: 1527–1534.
- Jeengar MK, et al: Emu oil based nanoemulgel for topical delivery of curcumin. Int J Pharm 2016; 506: 222–236.
- Brownlow B, et al: Development and in vitro evaluation of vitamin E-enriched nanoemulsion vehicles loaded with genistein for chemoprevention against uvb-induced skin damage. J Pharm Sci 2015; 104: 3510–3523.
- Pham J, et al: Enhanced effectiveness of tocotrienol-based nano-emulsified system for topical delivery against skin carcinomas. Drug Deliv 2016; 23: 1514– 1524.
- Dayan N, Touitou E: Carriers for skin delivery of trihexyphenidyl HCl: ethosomes vs. liposomes. Biomaterials 2000; 21: 1879–1885.
- Hua S: Lipid-based nano-delivery systems for skin delivery of drugs and bioactives. Front Pharmacol 2015; 6: 219.
- Iqbal B, Ali J, Baboota S: Recent advances and development in epidermal and dermal drug deposition enhancement technology. Int J Dermatol 2018; 57: 646– 660.
- Mezei M, Gulasekharam V: Liposomes – a selective drug delivery system for the topical route of administration. Lotion dosage form. Life Sci 1980; 26: 1473– 1477.
- Jain S, et al: Recent advances in lipidbased vesicles and particulate carriers for topical and transdermal application. J Pharm Sci 2017; 106: 423–445.
- Hofland HE, et al: Interactions between liposomes and human stratum corneum in vitro: freeze fracture electron microscopicalvisualization and smallangleX-ray scattering studies. Br JDermatol 1995; 132: 853–866.
- Elsayed MM, et al: Lipid vesicles for skin delivery of drugs: reviewing three decades of research. Int J Pharm 2007; 332: 1–16.
- Kitagawa S, Kasamaki M: Enhanced delivery of retinoic acid to skin by cationic liposomes. Chem Pharm Bull 2006; 54: 242–244.
- Gershkovich P, Wasan KM, Barta CA: A review of the application of lipid-based systems in systemic, dermal/transdermal, and ocular drug delivery. Crit Rev Ther Drug Carrier Syst 2008; 25: 545– 584.
- Chen J, et al: Skin permeation behavior of elastic liposomes: role of formulation ingredients. Expert Opin Drug Deliv 2013; 10: 845–856.
- Cevc G, Blume G: Lipid vesicles penetrate into intact skin owing to the transdermal osmotic gradients and hydration force. Biochim Biophys Acta 1992; 1104: 226–232.
- Rajan R, et al: Transferosomes – a vesicular transdermal delivery system for enhanced drug permeation. J Adv Pharm Technol Res 2011; 2: 138–143.
- Godin B, Touitou E: Ethosomes: new prospects in transdermal delivery. Crit Rev Ther Drug Carrier Syst 2003; 20: 63–102.
- Verma P, Pathak K: Therapeutic and cosmeceutical potential of ethosomes: an overview. J Adv Pharm Technol Res 2010; 1: 274–282.
- Paolino D, et al: Ethosomes for skin delivery of ammonium glycyrrhizinate: in vitro percutaneous permeation through human skin and in vivo anti-inflammatory activity on human volunteers. J Control Release 2005; 106: 99–110.
- Kasetvatin C, Rujivipat S, Tiyaboonchai W: Combination of elastic liposomes and low frequency ultrasound for skin permeation enhancementof hyaluronicacid. ColloidsSurf B Biointerfaces2015; 135: 458–464.
Mura S, et al: Liposomes and niosomes as potential carriers for dermal delivery of minoxidil. J Drug Target 2007; 15: 101–108. - Tavano L, et al: Co-encapsulation of lipophilic antioxidants into niosomal carriers: percutaneous permeation studies for cosmeceutical applications. Colloids Surf B Biointerfaces 2014; 114: 144– 149.
- Hougeir FG, Kircik L: A review of delivery systems in cosmetics. Dermatol Ther 2012; 25: 234– 237.
- Mukherjee S, Ray S, Thakur RS: Solid lipid nanoparticles: a modern formulation approach in drug delivery system. Indian J Pharm Sci 2009; 71: 349–358.
- Vettor M, et al: Poly(D,L-lactide) nanoencapsulation to reduce photoinactivation of a sunscreen agent. Int J Cosmet Sci 2008; 30: 219–227.
- Kaity S, et al: Microsponges: a novel strategy for drug delivery system. J Adv Pharm Technol Res 2010; 1: 283–290.
- Embil K, Nacht S: The microsponge delivery system (MDS): a topical delivery system with reduced irritancy incorporating multiple triggering mechanisms for the release of actives. J Microencapsul 1996; 13: 575–588.
- Gangadharappa HV, et al: Current trends in microsponge drug delivery system. Curr Drug Deliv 2013; 10: 453– 465.
- Cooper DL, Conder CM, Harirforoosh S: Nanoparticles in drug delivery: mechanism of action, formulation and clinical application towards reduction in drugassociated nephrotoxicity. Expert Opin Drug Deliv 2014; 11: 1661–1680.
- Moinard-Checot D, et al: Nanoparticles for drug delivery: review of the formulation and process difficulties illustrated by the emulsion-diffusion process. J Nanosci Nanotechnol 2006; 6: 2664– 2681.
- Muller RH, Mader K, Gohla S: Solid lipid nanoparticles (SLN) for controlled drug delivery – a review of the state of the art. Eur J Pharm Biopharm 2000; 50: 161– 177.
- Mehnert W, Mader K: Solid lipid nanoparticles: production, characterization and applications. Adv Drug Deliv Rev 2001; 47: 165–196.
- Trombino S, et al: Stearyl ferulate-based solid lipid nanoparticles for the encapsulation and stabilization of beta-carotene and alpha-tocopherol. Colloids Surf B Biointerfaces 2009; 72: 181– 187.
- Souto EB, Muller RH, Gohla S: A novel approach based on lipid nanoparticles (SLN) for topical delivery of alpha-lipoic acid. J Microencapsul 2005; 22: 581–592.
- Souto EB, et al: Preparation and characterization of n-dodecyl-ferulate-loaded solid lipid nanoparticles (SLN). Int J Pharm 2005; 295: 261–268.
- Jee JP, et al: Stabilization of all-trans retinol by loading lipophilic antioxidants in solid lipid nanoparticles. Eur J Pharm Biopharm 2006; 63: 134–139.
- Bhagurkar AM, Repka MA, Murthy SN: A novel approach for the development of a nanostructured lipid carrier formulation by hot-melt extrusion technology. J Pharm Sci 2017; 106: 1085–1091.
- Fang CL, Al-Suwayeh SA, Fang JY: Nanostructured lipid carriers (NLCs) for drug delivery and targeting. Recent Pat Nanotechnol 2013; 7: 41–55.
- Li B, Ge ZQ: Nanostructured lipid carriers improve skin permeation and chemical stability of idebenone. AAPS PharmSciTech 2012; 13: 276–283.
- Uprit S, et al: Preparation and characterization of minoxidil loaded nanostructured lipid carrier gel for effective treatment of alopecia. Saudi Pharm J 2013; 21: 379–385.
- Kawadkar J, et al: Formulation, characterization and in vitro-in vivo evaluation of flurbiprofen-loaded nanostructured lipid carriers for transdermal delivery. Drug Dev Ind Pharm 2013; 39: 569– 578.
- Wang J, et al: Physicochemical characterization, identification and improved photo-stability of alpha-lipoic acid-loaded nanostructured lipid carrier. Drug Dev Ind Pharm 2014; 40: 201–210.
