Bệnh huyết học
Điều trị kháng sinh ban đầu đối với nhiễm trùng huyết
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh. Điều trị kháng sinh ban đầu đối với nhiễm trùng huyết
Để tải file PDF, hãy click Tại đây.
Michael S. Niederman1*, Rebecca M. Baron2, Lila Bouadma3,
Thierry Calandra4, Nick Daneman5, Jan DeWaele6, Marin H. Kollef7, Jeffrey Lipman8,9 and Girish B. Nair10
Biên dịch: Bác sĩ Huỳnh Phạm Hoàng Nam
Tổng quan
Nhiễm trùng huyết là hậu quả thường gặp của nhiễm trùng, liên quan tỷ lệ tử vong >25%. Mặc dù nhiễm trùng huyết mắc phải trong cộng đồng phổ biến, nhưng nhiễm trùng huyết mắc phải trong bệnh viện gây tử vong cao hơn. Vị trị nhiễm trùng thường gặp nhất là phổi, tiếp theo là ổ bụng, dòng máu liên quan đặt ống thông (catheter) và nhiễm trùng đường tiểu. Nhiễm trùng huyết do vi trùng gram âm thường gặp hơn gram dương, nhưng cũng có thể do nấm hoặc một số mầm bệnh virus. Để giảm tỷ lệ tử vong, vô cùng cần thiết khi dùng kháng sinh ngay lập tức, theo kinh nghiệm, phổ rộng đối với nhiễm trùng huyết nặng và/ hoặc sốc nhiễm trùng, nhưng cách tiếp cận này có thể khiến lạm dụng kháng sinh và gây đề kháng. Cho nên phải kèm cam kết xuống thang và quản lý kháng sinh. Các dấu ấn sinh học như procalcitonin giúp hỗ trợ quyết định dùng kháng sinh và xác định bệnh nhân có nguy cơ nhiễm trùng thấp và trong 1 số bệnh cảnh có thể hướng dẫn thời gian điều trị kháng sinh. Nhiễm trùng huyết có thể do mầm bệnh kháng thuốc, nên đòi hỏi cần phải có các thuốc kháng khuẩn mới.
Từ khóa: Nhiễm trùng huyết, liệu pháp kháng sinh, liệu pháp kháng khuẩn, nhiễm nấm, viêm phổi, nhiễm trùng trong ổ bụng, dược động học, nhiễm khuẩn huyết, các dấu ấn sinh học.
Giới thiệu
Nhiễm trùng huyết là bệnh thường gặp và đe dọa tính mạng trong ICU, yêu cầu điều trị kháng sinh kịp thời và hiệu quả. Mục tiêu của bài đánh giá này là xác định các vị trí nhiễm trùng huyết thường gặp nhất, các mầm bệnh và cách tiếp cận tối ưu cho liệu pháp kháng sinh. Điều trị hiệu quả phải cân bằng nhu cầu để tránh lạm dụng kháng sinh phổ rộng và do đó liên quan cam kết quản lý kháng sinh. Sử dụng vấn đề chuyên môn trong bài đánh giá này, chúng tôi xem xét các tài liệu liên quan điều trị kháng sinh trong nhiễm trùng huyết và khuyến cáo các nguyên tắc quan trọng cho quá trình điều trị.
Dịch tễ học nhiễm trùng huyết, vị trí nhiễm trùng và các mầm bệnh
Nhiễm trùng huyết là hội chứng rối loạn chức năng cơ quan đe dọa tính mạng, gây ra do rối loạn điều hòa của đáp ứng vật chủ với nhiễm trùng huyết, liên quan tỷ lệ tử vong >25%, được chỉ định là ưu tiên sức khỏe toàn cầu [1-3].
Phần lớn nhiễm trùng huyết do mắc phải trong cộng đồng và có thể diễn tiến âm thầm, khiến quá trình chẩn đoán gặp nhiều khó khăn [3, 4]. Tiên lượng phụ thuộc vào điều trị sớm kháng sinh phổ rộng và kiểm soát nguồn bệnh hiệu quả [5, 6].
Nhiễm trùng huyết ảnh hưởng đến 1.7 triệu người trưởng thành ở Hoa Kỳ hàng năm, với gần 270.000 bệnh nhân tử vong [7], và khoảng 19.4-31.5 triệu người mắc phải trên toàn thế giới, với 5.3 triệu người tử vong [8]. Một nghiên cứu toàn cầu báo cáo giảm 18.8% tỷ lệ mắc nhiễm trùng huyết trên toàn thế giới từ 60 triệu ca vào năm 1990 xuống còn 49 triệu ca vào năm 2017 [9]. Tuy nhiên, nhiễm trùng huyết liên quan nhập viện được chăm sóc y tế tăng từ 811.644 đến 1.136.889 vào năm 2012-2018, với sự gia tăng liên quan nhập viện và tăng chi phí chăm sóc điều dưỡng từ $27.7- $41.5 billion [10]. Tỷ lệ tử vong trong 6 tháng vẫn cao đối với sốc nhiễm khuẩn ở mức 60% và nhiễm trùng huyết nặng là 36% [10].
Nhiễm vi khuẩn là nguyên nhân thường gặp nhất, nhưng nhiễm siêu vi (virus) và nấm có thể xuất hiện ở bệnh nhân có bệnh đồng mắc và suy giảm miễn dịch. Điểm quan trọng thường gặp nhất đối với bệnh nhân nhập viện là nhiễm trùng đường hô hấp dưới, tiếp theo là nhiễm trùng ổ bụng, dòng máu, qua đường can thiệp nội mạch và nhiễm trùng đường tiểu [11].
The Author(s) 2021. Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Các vi khuẩn được phân lập chiếm đa số trong dòng máu gồm tụ cầu vàng (S. aureus), E. coli, Klebsiella spp., Pseudomonas aeruginosa, Enterococci, Streptococci và coagulase-negative staphylococci [12]. Trong nghiên cứu tỷ lệ nhiễm trùng tại đơn vị hồi sức tích cực mở rộng (EPIC III) trên 15.000 bệnh nhân ICU từ 88 quốc gia, trong số này có 65% bệnh nhân ít nhất 1 lần cấy máu ra vi trùng gram âm với mầm bệnh thường gặp nhất (67%, n = 3540), gồm các loài Klebsiella, E. coli, Pseudomonas, Enterobacteraceae, Proteus, Stenotrophomonas, Serratia và Acinetobacter.
Các vi sinh vật gram dương thường gặp khác (37%, n= 1946) là tụ cầu vàng (S. aureus), phế cầu (S. pneumoniae) và Enterococcus, Còn nhiễm nấm thì phổ biến nhất là Candida và Aspergillus (16%, n = 864) [13]. Nhiễm các mầm bệnh đa kháng thuốc đặc biệt trong ICU [Enterococcus kháng vancomycin (OR = 2.41), Klebsiella đề kháng kháng sinh nhóm β-lactam (OR = 1.29), Acinetobacter đề kháng carbapenem (OR= 1.40)] độc lập tăng nguy cơ tử vong so với nhiễm các vi sinh vật khác [13].
Trong một nghiên cứu trên 1072 bệnh nhân hầu hết khởi phát nhiễm trùng huyết trong cộng đồng, 61% bệnh nhân được tiếp nhận chăm sóc y tế, gồm dùng kháng sinh gần đây, hóa trị, chăm sóc vết thương, lọc máu hoặc phẫu thuật trong 30 ngày trước khi khởi phát nhiễm trùng huyết, 57% trường hợp xác định được bệnh nguyên [4]. Tăng tỷ lệ tử vong trong 30 ngày đối với những bệnh nhân có bệnh đồng mắc như xơ gan (OR = 3.59), suy giảm miễn dịch (OR = 2.52) và bệnh mạch máu (OR = 1.54) [4].
Trong một nghiên cứu trên 2.2 triệu bệnh nhân nhập viện, Rhee và các đồng nghiệp báo cáo nhiễm trùng huyết khởi phát trong cộng đồng thường xuyên gặp hơn (87.9%, n = 83,620) so với nhiễm trùng huyết khởi phát trong bệnh viện (12.1%, n = 11,534), nhưng lạităng tỷ lệ tử vong đối với nhiễm trùng huyết khởi phát trong bệnh viện (OR 2.1; 95% CI, 2.0–2.2) [14]. Trong một nghiên cứu đa phân tích gồm 51 nghiên cứu ở các nước phát triển và đang phát triển, bao gồm ICU sơ sinh, tỷ lệ tử vong là 52.3% (95% CI: 43.4–61.1%) ở bệnh nhân nhiễm trùng huyết mắc phải trong bệnh viện[15]. Trên toàn thế giới, tỷ lệ tử vong liên quan nhiễm trùng huyết được chuẩn hóa theo tuổi thì nam cao hơn nữ (164.2 so với 134.1 mỗi 100.000 ca) và bệnh tiêu chảy và nhiễm trùng đường hô hấp dưới được xếp lần lượt 1 và 2 trong số các nguyên nhân phổ biến nhất gây tử vong do nhiễm trùng huyết [9].
Tầm quan trọng của điều trị sớm và kịp thời
Điều trị kháng sinh ban đầu kịp thời (tức là hoạt hóa trong ống nghiệm chống lại mầm bệnh) là nền tảng của điều trị nhiễm trùng ICU nghiêm trọng [1]. Các nghiên cứu quan sát, tiền cứu và hồi cứu ủng hộ sử dụng kháng sinh phù hợp theo kinh nghiệm đối với nhiễm trùng huyết và sốc nhiễm trùng [16–19]. Sử dụng liệu pháp kháng sinh ban đầu không phù hợp làm tăng tỷ lệ tử vong cao hơn kể từ khi thực hiện nghiên cứu tiền cứu năm 1999, đánh giá trên 2000 bệnh nhân ICU [20]. Các thông tin này đã được xác nhận trong 1 nghiên cứu đa phân tích chứng minh giảm tỷ lệ tử vong (OR 0.44, 95% CI 0.38– 0.50) và rút ngắn đáng kể thời gian nằm viện, do đó giảm chi phí điều trị, trên những bệnh nhân nhiễm trùng nặng điều trị sớm kháng sinh thích hợp so với liệu pháp kháng sinh không phù hợp [21]. Các nhà khoa học cũng chứng minh kết quả tương tự với điều trị kháng nấm trên bệnh nhân nhiễm trùng dòng máu do Candida [22–24].
Một nghiên cứu đoàn hệ hồi cứu trên 21.608 người trưởng thành nhiễm trùng máu từ 131 bệnh viện khắp Hoa Kỳ thấy rằng 4165 (19%) bệnh nhân điều trị kháng sinh theo kinh nghiệm trái ngược nhau (dựa trên xét nghiệm trong phòng thí nghiệm phân lập cấy máu), liên quan một cách độc lập tăng nguy cơ tử vong (điều chỉnh tỷ số odds 1.46 [95% CI, 1.28– 1.66]) [25]. Một phân tích đoàn hệ hồi cứu trên dòng máu nhiễm trùng huyết nặng và sốc nhiễm trùng cho thấy nhiều bệnh nhân cần điều trị (NNT) kháng sinh ban đầu phù hợp để dự phòng tử vong trên 1 bệnh nhân là 4. (95% CI, 3.7–4.3) [26]. Tỷ lệ NNT được điều chỉnh theo mầm bệnh cụ thể cho liệu pháp phù hợp nhằm ngăn ngừa 1 ca tử vong là thấp nhất đối với vi khuẩn kháng đa thuốc (MDR) (NNT=20), và cao hơn với Candida spp, (NNT=34), tụ cầu vàng kháng methicillin (MRSA, NNT=38) và Pseudomonas aeruginosa (NNT = 38) [26].
Thử nghiệm tiền cứu ngẫu nhiên MERINO so sánh điều trị bằng piperacillin-tazobactam so với meropenem trên bệnh nhân nhiễm trùng máu nặng do Ecoli không nhạy cảm ceftriaxone hoặc K pneumoniae, đã ủng hộ điều trị kháng sinh sớm [27]. Mục đích piperacillin- tazobactam bậc thấp không thể thiết lập trên 23/187 bệnh nhân (12.3%) được phân bố ngẫu nhiên với piperacillin-tazobactam tử vong trong vòng 30 ngày so với 7/191 bệnh nhân (3.7%) được phân bố ngẫu nhiên với meropenem (nguy cơ khác biệt, 8.6%) [27].
Trì hoãn điều trị kháng sinh thích hợp có thể do cả xác định nhiễm trùng chậm trễ và phân vân lựa chọn kháng sinh, nhưng thời gian điều trị tối ưu phụ thuộc vào các nghiên cứu quần thể [28]. Một đánh giá gần đây cho thấy khung thời gian hợp lý sẽ không quá 3-5h sau khởi phát nhiễm trùng, nhưng phải điều trị kháng sinh ngay lập tức đối với sốc nhiễm trùng [29]. Điều trị kháng sinh ban đầu phù hợp phải cân bằng với sử dụng kháng sinh không cần thiết, đặc biệt các kháng sinh phổ rộng, trong trường hợp không chứng minh có nhiễm trùng, với tỷ lệ tử vong cao liên quan bệnh cảnh này, tăng nguy cơ xâm nhiễm và nhiễm các mầm bệnh đề kháng kháng sinh [30-33]. Do đó, sử dụng kháng sinh nhanh, theo kinh nghiệm, phổ rộng phải kèm theo cam kết xuống thang kháng sinh, nghĩa là thời gian dùng ngắn hơn, ít kháng sinh phổ rộng và ít thuốc hơn, một khi thông tin lâm sàng và dữ liệu kết quả vi sinh học đã có sẵn (hình 1).
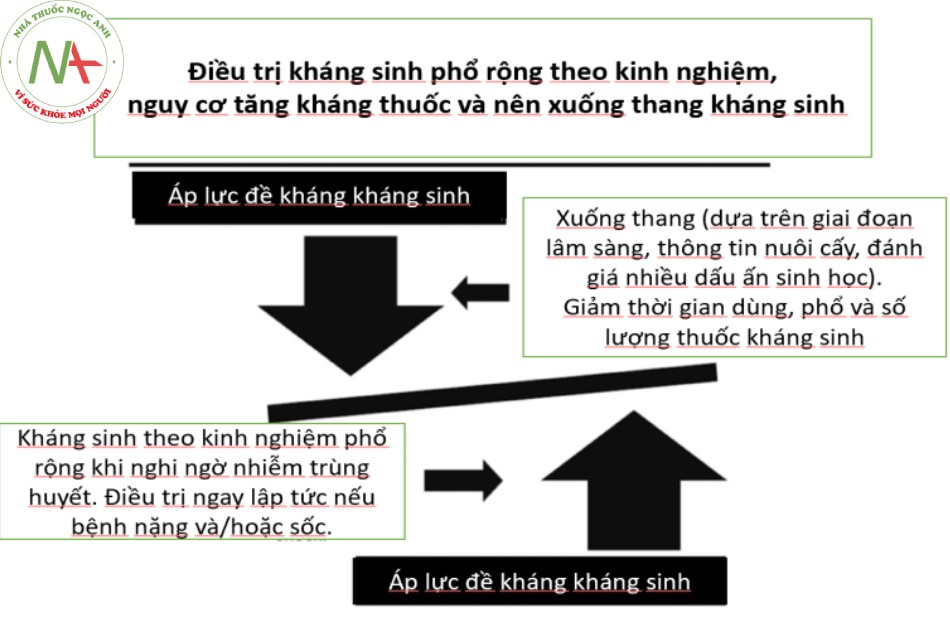
Hình 1: Sự cần thiết điều trị ngay lập tức kháng sinh phổ rộng theo kinh nghiệm trên những bệnh nhân nhiễm trùng huyết nặng được lựa chọn có thể cứu mạng họ, nhưng cũng có thể gây áp lực dùng quá liều kháng sinh và làm tăng đề kháng kháng sinh. Do đó, cách tiếp cận này đi kèm với nghĩa vụ cố gắng kiểm soát tình trạng đề kháng bằng liệu pháp xuống thang một khi dữ liệu lâm sàng, vi sinh học và cận lâm sàng có kết quả. Xuống thang có thể là rút ngắn thời gian điều trị, ít dùng các kháng sinh phổ rộng, ít thuốc hơn hoặc kết hợp các biện pháp can thiệp này.
Các dấu ấn sinh học để hướng dẫn điều trị nhiễm trùng huyết
Các triệu chứng thực thể và dấu hiệu sinh học của nhiễm trùng huyết không nhạy và không đặc hiệu, đặc biệt ở bệnh nhân lớn tuổi và suy giảm miễn dịch, khiến các quyết định bắt đầu khi nào và ngưng kháng sinh lúc nào đầy thách thức trên bệnh nhân ICU [5]. Các bác sĩ hồi sức đã tìm ra những dấu ấn sinh học nhằm xác định thời điểm an toàn trì hoãn kháng sinh trên bệnh nhân nhiễm trùng. Vào năm 1998, một dấu ấn sinh học gọi là “một đặc tính có thể đo lường và đánh giá khách quan như một chỉ số của quá trình sinh học bình thường, quá trình gây bệnh hoặc phản ứng dược học đối với một can thiệp điều trị” [34]. Lý tưởng nhất là một dấu ấn sinh học nên phân biệt nhiễm trùng huyết thật sự với tình trạng viêm một cách kịp thời và tiết kiệm chi phí, vừa có thể theo dõi đáp ứng điều trị, vừa hướng dẫn bắt đầu và dừng kháng sinh. Nhiễm trùng huyết kích hoạt nhiều cơ chế sinh hóa, con đường miễn dịch và giải phóng nhiều phân tử có khả năng đóng vai trò là dấu ấn sinh học tiềm năng [35]. Rất nhiều dấu ấn sinh học đầy hứa hẹn được đánh giá, nhưng protein C phản ứng (CRP) và procalcitonin được đánh giá phổ biến nhất, trong các thử nghiệm ngẫu nhiên có đối chứng trong quản lý kháng sinh [35].
Do tính không đồng nhất và phức tạp của nhiễm trùng huyết, không có dấu ấn sinh học nào hiệu quả chính xác để phân biệt nhiễm trùng huyết với các nguyên nhân không lây nhiễm khác của viêm toàn thân và các dấu ấn sinh hóa chỉ có thể dùng để bổ sung trong đánh giá lâm sàng, xác định thời điểm bắt đầu dùng kháng sinh [36]. Tuy nhiên, kết hợp thông tin thu được từ nhiều dấu ấn sinh học sẽ giá trị hơn [37]. Sự phát triển của sinh học phân tử gồm “omics” (hóa chỉ tế bào) có thể cho phép phát triển các dấu ấn nhiễm trùng huyết tốt hơn [38], tính hữu dụng của chúng sẽ tăng lên khi tích hợp vào các thang điểm sinh học [38]. Một số thử nghiệm biểu hiện gen đáp ứng vật chủ đã được phát triển. SetpticCyteTM LB, (Immun- express, Seattle, WA) đã được FDA Hoa Kỳ xóa sổ vì có sự sai biệt nhiễm trùng huyết với viêm toàn thân không do nhiễm trùng, trong một nhóm đoàn hệ không thống nhất trên 249 bệnh nhân trưởng thành cần chăm sóc đặc biệt [39].
Thời gian điều trị kháng sinh cá thể hóa sử dụng hướng dẫn từ dấu ấn sinh học dường như trực quan hơn so với thời gian cố định trên bệnh nhân nhiễm trùng huyết. Trong một phân tích tổng hợp cấp độ bệnh nhân, tập trung vào điều trị kháng sinh theo procalcitonin (11 thử nghiệm), sử dụng các phép đo tuần tự, ngừng kháng sinh sớm đối với giảm thời gian điều trị thì thuận lợi (9.3 ngày ở 2252 bệnh nhân theo dõi bằng procalcitonin so với 10.4 ngày ở 2230 bệnh nhân thuộc nhóm chứng; p<0.001), chứng minh giảm tỷ lệ tử vong đáng kể trong nhóm theo dõi bằng procalcitonin [40]. Điều quan trọng là CRP được chứng minh mang lại giá trị hữu ích như procalcitonin đối với giảm sử dụng kháng sinh trên những bệnh nhân nhiễm trùng huyết. Hỗ trợ quyết định bằng các dấu ấn sinh học điều trị nhiễm trùng huyết có giá trị hướng dẫn thời gian điều trị hơn là xác định khi nào dùng kháng sinh. Tuy nhiên, các dấu ấn sinh học có giá trị dự đoán âm tính cao, cùng với đánh giá lâm sàng, có thể giúp loại trừ nhiễm trùng và nhu cầu dùng kháng sinh ngay lập tức.
Điều trị kháng sinh: các nguyên tắc sử dụng và các thuốc mới
Trong khi điều trị kháng sinh thích hợp hướng đến sử dụng một thuốc kháng sinh nhạy cảm với mầm bệnh, cũng rất cần thiết sử dụng đúng liều, tối ưu hóa thời gian điều trị, tấn công vào vị trí nhiễm trùng. Điều này phải thực hiện sao cho không lạm dụng thuốc quá mức nhằm tránh làm tăng đề kháng kháng sinh toàn cầu, cũng như vi khuẩn thường trú trong đường ruột bệnh nhân, vốn thường là nguồn lây nhiễm trong ICU [41].
Sử dụng kháng sinh tối ưu nhằm tránh liều thuốc không đủ, cũng như ngăn ngừa các biến cố bất lợi do quá liều thuốc gây ra. Một liều nạp ban đầu yêu cầu phải “lấp đầy” lượng phân bố cao hơn thông thường trong nhiễm trùng huyết – gấp khoảng 1.5 lần so với liều tiêu chuẩn [42]. Sau đó điều chỉnh liều nên theo độ thanh thải của thuốc [42, 43]. Mức bằng chứng 1 và 2 cho thấy đánh bao phủ liều gấp đôi nhiễm vi trùng gram âm là không cần thiết [44, 45]. Tuy nhiên, một số người cho rằng ban đầu dùng một liều lớn aminoglycoside trên bệnh nhân ICU, cùng các thuốc khác, để đảm bảo bao phủ đủ rộng và tối ưu hóa tiêu diệt vi sinh vật nhanh chóng [42].
Đặc tính tiêu diệt vi sinh vật của các kháng sinh thường dùng trong ICU là khác nhau [43, 46]. Đối với betalactam, tác dụng tốt nhất liên quan đến cải thiện thời gian nồng độ ức chế tối thiểu (MIC) của các mầm bệnh mục tiêu, liều cao hàng ngày được sử dụng tốt nhất bằng cách truyền liên tục hoặc kéo dài.Trong khi cách điều trị trên có thể cải thiện kết cục bằng cách giữ nồng độ đáy cao đặc biệt khi có đề kháng [47], không phải tất cả dữ liệu đều ủng hộ [48]. Đối với aminoglycoside (một liều hoặc kháng sinh phụ thuộc nồng độ) nên điều trị bằng 1 liều lớn mỗi ngày (hoặc kéo dài thời gian dùng khi rối loạn chức năng thận) [49]. Đối với Quinolone, cũng có tác dụng tiêu diệt phụ thuộc liều lượng, dùng liều cao hơn và cách xa nhau.
Tăng độ thanh thải thận thường xuất hiện trên bệnh nhân trẻ tuổi không có trối loạn chức năng thận [50] và và cần phải dùng cao hơn liều tiêu chuẩn hàng ngày nhằm tránh nồng độ dưới liều điều trị. Với liệu pháp thay thế thận, không đủ liều và quá liều kháng sinh có thể xuất hiện, nhưng liều betalactam cao hơn có thể là lựa chọn tốt hơn dự phòng không đủ liều [46]. Theo dõi thuốc điều trị có thể sử dụng như cách hỗ trợ định lượng hầu hết các kháng sinh [51]. Khi lựa chọn kháng sinh, biết vị trí nhiễm trùng rất quan trọng. Các kháng sinh ưa mỡ (như quinolone) cung cấp nồng độ cao trong tất cả các mô [49]. Các kháng sinh ưa nước (như aminoglycosides) không xâm nhập tốt vào các mô (như phổi) nhưng ở các khoảng ngoại bào, mặc dù betalactam thâm nhập tốt hơn aminoglycosides [49].
Sử dụng kháng sinh trước đây khiến bệnh nhân nhiễm các vi khuẩn đề kháng với các thuốc đó và việc di chuyển đến những vùng có tỷ lệ vi sinh vật đề kháng cao có thể làm thâm nhiễm vi khuẩn đường ruột với các vi khuẩn đặc hữu đó [52]. Ngoài ra, điều trị ở ICU có tỷ lệ cao đề kháng tại chỗ có thể làm nhiễm trùng mầm bệnh kháng thuốc.
Một số kháng sinh mới có thể dùng để điều trị nhiễm trùng nặng do vi khuẩn gram âm và gram dương kháng thuốc [53, 54]. Ceftolozane- tazolactam có hoạt tính chống lại Pseudomonas aeruginosa đa kháng thuốc (MDR). Các thuốc mới khác, ceftazidime-avibactam, imipenem-relabactam, meropenem-vaborbactam và cefiderocol có thể dùng trên bệnh nhân có các yếu tố nguy cơ nhiễm mầm bệnh đề kháng đặc biệt nhạy cảm với các tác nhân này. Đối với Enterobacteriaceae đề kháng carbapenem, ceftazidime-avibactam, imipenem- relebactam và meropenem-vaborbactam có thể hiệu quả nhất. Đối với các vi sinh vật sản xuất metallo-betalactamases, ceftazidime-avibactam và cefiderocol sẽ là lựa chọn tốt hơn [53, 54]. Trong tương lai, điều trị thực khuẩn (phage) có thể là lựa chọn điều trị cần nghiên cứu thêm trong nhiễm trùng huyết [55].
Viêm phổi: điều trị kháng sinh ban đầu theo kinh nghiệm đối với CAP, HAP, VAP
Viêm phổi mắc phải trong cộng đồng (CAP) [56-59]. Đối với bệnh nhân không có yếu tố nguy cơ nhiễm MRSA hoặc Pseudomonas aeruginosa (PSA), điều trị kháng sinh ban đầu theo kinh nghiệm được khuyến cáo là (a) betalactam cộng macrolide hoặc (b) betalactam cộng 1 quinolone hô hấp (FQ), cả 2 cách đều được chấp thuận, mặc dù có bằng chứng ưa dùng beta- lactam/macrolide. Trong khi bằng chứng ủng hộ các khuyến cáo này dựa trên các nghiên cứu quan sát, một đánh giá hệ thống và đa phân tích cho thấy cải thiện tỷ lệ tử vong khi điều trị bằng betalactam/macrolide so với betalactam/FQ, đặc biệt với CAP nặng [60, 61]. Không có dữ liệu phù hợp để khuyến cáo đơn trị liệu bằng FQ hoặc betalactam cộng doxycycline trên CAP nặng.
Bệnh nhân có yếu tố nguy cơ mắc MRSA hoặc PSA có thể có đặc điểm như viêm phổi liên quan chăm sóc y tế (HCAP) trong quá khứ, nhưng người ta đã loại bỏ thuật ngữ này [56]. Nhiều nghiên cứu chứng minh các yếu tố nguy cơ HCAP không nhất thiết dự đoán sự hiện diện của các vi sinh vật kháng thuốc và đánh bao phủ các vi sinh vật này không cải thiện kết cục lâm sàng [62-64]. Hướng dẫn ATS/IDSA 2019 khuyến cáo đánh kháng sinh theo kinh nghiệm bao phủ MRSA và/hoặc PSA với bệnh nhân CAP có yếu tố nguy cơ nhiễm các mầm bệnh này, sau đó điều trị xuống thang kháng sinh, nếu cấy máu âm tính. Các yếu tố nguy cơ cao nhất của nhiễm MRSA và PSA là sự phát triển trước đó các mầm bệnh này [65-67], cũng như nhập viện gần đây và dùng kháng sinh tĩnh mạch (trong vòng 90 ngày) [68-70]. Sự phát triển của các hệ thống thang điểm có giá trị đã tiên lượng chính xác nguy cơ các mầm bệnh này, cũng như những nỗ lực xác định yếu tố nguy cơ khu trú. Điều trị bao phủ theo kinh nghiệm MRSA và/ hoặc PSA trong CAP nặng, có xuống thang, đã được chấp thuận là chiến lược an toàn [71-73]. Tuy nhiên, một nghiên cứu gần đây cho thấy tỷ lệ xuống thang nhìn chung thấp khi cấy máu âm tính, tạo cơ hội để sử dụng kháng sinh [74]. Các thuốc điều trị theo kinh nghiệm khuyến cáo dùng cho viêm phổi MRSA gồm vancomycine hoặc linezolid [75]. Điều trị PSA gồm piperacillin/ tazobactam, cefepine, ceftazidime, aztreonam, meropeem hoặc imipenem. Các thuốc mới cũng đóng vai trò nhất định.
Viêm phổi bệnh viện và viêm phổi do thở máy (HAP, VAP). Kháng sinh đồ tại chỗ được khuyến cáo để hướng dẫn điều trị kháng sinh phổ rộng theo kinh nghiệm [76]. Tất cả bệnh nhân VAP nên điều trị bao phủ theo kinh nghiệm tụ cầu vàng và PSA/ gram âm, với cân nhắc bổ sung các vi sinh vật kháng thuốc trên những người có nguy cơ mắc. Các nguy cơ này gồm ưu tiên sử dụng kháng sinh trong 90 ngày, sốc nhiễm trùng hoặc ARDS, ít nhất 5 ngày nhập viện trong 90 ngày và cần liệu pháp thay thế thận cấp tính, mặc dù không phải tất cả nghiên cứu đều xác nhận các nguy cơ này. Đánh bao phủ MRSA với VAP được khuyến cáo trên bệnh nhân có ít 1 trong số các yếu tố nguy cơ này và không biết tỷ lệ nhiễm MRSA tại địa phương, hoặc >10-20% các chủng tụ cầu vàng phân lập. Hai thuốc kháng pseudomonas từ các nhóm khác nhau được khuyến cáo điều trị bệnh nhân VAP có ít nhất 1 yếu tố nguy cơ nhiễm vi sinh vật đề kháng và tỷ lệ nhiễm tại chỗ vi sinh vật đề kháng gram âm với 1 thuốc duy nhất kháng pseudomonas chưa được biết đến, hoặc >10% các chủng gram âm được phân lập. Điều trị HAP giống với VAP. Các hướng dẫn ủng hộ đánh bao phủ theo kinh nghiệm những mầm bệnh kháng thuốc trên bệnh nhân có nguy cơ, sau đó xuống thang kháng sinh nếu cấy máu âm tính [76-79]. Đối với tất cả bệnh nhân có nhiều nguy cơ, kháng sinh ban đầu theo kinh nghiệm nên đánh bao phủ tụ cầu vàng nhạy cảm methicilline và PSA/gram âm (như piperacilline/tazobactam, cefepime, imipenem, meropenem, ceftolozane/ tazobactam). Các thuốc khuyến cáo điều trị MRSA và PSA kháng thuốc đều tương tự với các thuốc mô tả phía trên điều trị CAP nặng.
Nhiễm trùng trong ổ bụng
Nhiễm trùng ổ bụng có biến chứng (cIAI) – đề cập đến mở rộng diễn tiến bệnh vượt ra ngoài ổ nhiễm trùng tập trung ban đầu, như viêm phúc mạc sau viêm túi thừa – thường được chẩn đoán trước khi nhập ICU nhưng cũng có thể diễn tiến trong quá trình điều trị tại ICU, thường sau phẫu thuật (80). cIAI thường do nhiễm nhiều vi khuẩn, cả vi khuẩn kỵ kí và hiếu khí. Trong số các mầm bệnh gram âm, Enterobacterale gặp nhiều nhất và các mầm bệnh không lên men như Pseudomonas hoặc Acinetobater spp. không thường xuyên như trong nhiễm trùng đường hô hấp hay đường máu [13, 81]. Enterococci đặc biệt liên quan đến những bệnh nhân nguy kịch có cIAI – chúng đại diện cho phân nửa vi khuẩn gram dương được phân lập [13, 81]. Tuy nhiên, các vi khuẩn kỵ khí có thể gặp nhiều khó khăn khi nuôi cấy.
Trong khi các mẫu bệnh phẩm từ nguồn lây chỉ được lấy khi đã hoàn thành thủ thuật trong giai đoạn sau của bệnh nhằm kiểm soát nguồn lây nhiễm (dẫn lưu dưới da hoặc tiếp cận bằng đường mổ hở), điều trị kháng sinh theo kinh nghiệm không nên trì hoãn. Nên cấy máu nhưng mức độ phù hợp của lấy mẫu bệnh phẩm ổ bụng còn hạn chế. Điều trị theo kinh nghiệm nên đánh bao phủ phổ rộng các mầm bệnh như kết hợp thuốc ức chế betalactam/baetalactamase phổ rộng hoặc carbapenem, phù hợp với bệnh nguyên tại chỗ. Tuy nhiên, trong điều trị Enterococci, một số chủng không còn nhạy vớ chất ức chế betalactam, đặc biệt sau khi tiếp xúc với kháng sinh cùng nhóm này và điều trị theo kinh nghiệm bằng glycopepetides hoặc oxazolidinones nên cân nhắc. Khi sử dụng carbapenem để điều trị, cần phải xác định còn nhạy cảm với enterococcus.
Bệnh nhân nguy kịch có cIAI thường có nhiều yếu tố nguy cơ xâm nhiễm candidiasis và điều trị kháng nấm theo kinh nghiệm nhìn chung được khuyến cáo đối với hầu hết bệnh nhân nặng [82]. Trong một nghiên cứu toàn cầu gần đây, bệnh nhân nhiễm nấm chiếm 13% trong đó phân lập kết quả thu được Candida albicans chiếm 2/3 số bệnh nhân. Có thể dùng theo kinh nghiệm azoles hoặc echinocandins, dựa trên độ nặng của bệnh, dịch tễ học địa phương và tiếp xúc với thuốc kháng nấm trước đó.
Rất cần thiết kiểm soát nguồn lây nhiễm và nên làm càng sớm càng tốt về mặt logic [5, 80]. Dẫn lưu dưới da được ưu tiên hơn nếu nhiễm trùng khu trú và không có nhiễm trùng liên tục trong ổ bụng.
Điều trị theo kinh nghiệm nhiễm khuẩn huyết
Trong số bệnh nhân nhập viện vì nhiễm trùng huyết, gần 1/2 bệnh nhân cấy máu âm tính [83, 84]. Tuy nhiên, trong số bệnh nhân cấy máu dương tính, dữ liệu vi sinh học trong dòng máu là một cơ hội quan trọng phân tích nhằm điều chỉnh chiến lược điều trị.
Trong nhiễm khuẩn huyết, có 3 thời điểm ưu tiên theo kinh nghiệm trước khi có kết quả về độ nhạy: (1) điều trị theo theo hướng hội chứng, (2) điều trị theo hình thái học nhuộm gram, (3) điều trị theo mầm bệnh [85].
Kháng sinh đồ trong bệnh viện, đối với kết hợp mỗi tổ hợp thuốc cụ thể, có thể hỗ trợ lựa chọn điều trị kháng sinh theo kinh nghiệm trước khi có kết quả về tính nhạy cảm, trong điều trị theo mầm bệnh (thời điểm thứ 3 theo kinh nghiệm). Hiện nay, các thời điểm này đã mở rộng đến mốc thời gian sớm hơn, nhờ vào phương pháp xác định mầm bệnh nhanh chóng như giải hấp thụ laser ma trận/ ion hóa khối phổ thời gian bay (MALDI-TOF), đã vượt xa các phương pháp xét nghiệm nhạy cảm nhanh [85]. Trước thời điểm 3, kháng sinh đồ tại bệnh viện chiếm tỷ trọng cao có thể mang lại tỷ lệ nhạy cảm nhìn chung trong số tất cả vi khuẩn gram âm, có thể dùng để hướng dẫn điều trị với thời điểm thứ 2 theo kinh nghiệm. Thu thập thông tin lịch sử nhạy cảm theo hội chứng có một số thách thức, nhưng cũng đáng kể giúp cung cấp thông tin cho các hướng dẫn tại địa phương điều trị các hội chứng theo kinh nghiệm (thời điểm 1) như đường trung tâm liên quan nhiễm trùng dòng máu (CLBSI) [86] và nhiễm trùng trong ổ bụng/gan mật [87].
Để áp dụng kháng sinh đồ, chúng ta cần phải biết ngưỡng bao phủ mầm bệnh mục tiêu đối với điều trị theo kinh nghiệm. Trong 1 cuộc khảo sát bác sĩ, ngưỡng ưa thích trung bình bao phủ nhiễm trùng huyết nhẹ là 80% và nhiễm trùng huyết nặng là 90% [88]. Sử dụng ngưỡng ít nhất 90%, đối với nhiễm trùng như VAP và CLABSI, chúng ta sẽ cần khuyến cáo các kháng sinh gây độc tiềm tàng (như aminolycoside), lựa chọn cuối cùng (như carbapenem) hoặc kết hợp vừa gây độc vừa là lựa chọn cuối cùng (như colistin) đối với hầu hết bệnh nhân, làm tăng thêm tình trạng kháng thuốc. Giải pháp là sử dụng các công cụ dự đoán đề kháng kháng sinh đối với điều trị kháng sinh theo kinh nghiệm cá thể hóa do đó chúng ta có thể đơn trị liệu kháng sinh phổ hẹp hơn khi chúng đáp ứng và giới hạn kết hợp kháng sinh phổ rộng với những bệnh nhân cần điều trị (hình 2). Các mô hình hỗ trợ quyết định điều trị theo kinh nghiệm với vi khuẩn gram âm có thể kết hợp các yếu tố nguy cơ kháng thuốc (nhân khẩu học bệnh nhân, nhập viện gần đây, có dùng kháng sinh trước đó, có kết quả cấy vi sinh vật trước đó) và nhanh chóng xuống thang kháng sinh mà không ảnh hưởng thời đủ gian điều trị [89, 90]. Như đã bàn bạc về viêm phổi, kết quả vi sinh trước đó của bệnh nhân cung cấp thông tin vô cùng quan trọng để dự đoán tình trạng đề kháng thuốc hiện tại [91, 92]. Với tụ cầu vàng, kết quả phết gạc theo dõi MRSA dương tính trước đó đòi hỏi phải sử dụng điều trị kháng MRSA theo kinh nghiệm [93]. Với vi trùng gram âm, xác định vi sinh vật gram âm trước đó đề kháng với một thuốc cụ thể trong năm qua nên loại trừ sử dụng lại kháng sinh đó [91].

Hình. 2 Nhanh chóng điều trị theo kinh nghiệm và lựa chọn các thuốc cụ thể được xác định dựa trên tình huống lâm sàng của bệnh nhân nghi ngờ nhiễm trùng huyết. Điều trị ngay lập tức với bệnh nhân nguy cơ cao nhiễm trùng và mắc bệnh nặng hoặc sốc. Nếu các dấu ấn sinh học như procalcitonin không tăng, bệnh nhân không đang trong giai đoạn nặng thì không cần thiết điều trị ngay lập tức, thậm chí một số bệnh nhân còn không nhiễm trùng. Các thuốc đặc hiệu được lựa chọn nhờ vào xem xét vị trí nhiễm trùng (phổi>bụng>nhiễm trùng do catheter>đường tiểu).
Mỗi vị trí có một nhóm bệnh nguyên có thể gây bệnh, nhưng có thể thay đổi dựa trên các yếu tố nguy cơ đề kháng của bệnh nhân và các vi sinh vật kháng thuốc tại ICU địa phương. Trong nhiễm trùng huyết, gram âm thường gặp hơn gram dương, nhưng một số bệnh nhân có thể nhiễm nấm.
Tiếp cận nhiễm trùng huyết do nấm
Nhiễm nấm xâm nhập (IFI) tăng nhanh như một nguyên nhân nhiễm trùng huyết trong ICU và liên quan tỷ lệ tử vong là 40-60% [94]. Dữ liệu dịch tễ học, các yếu tố nguy cơ, các nguyên tắc dự đoán, các thang điểm, thông tin vi sinh học và các dấu ấn sinh học có thể giúp xác định bệnh nhân nhiễm trùng huyết do nấm.
Nấm chiếm 5% nguyên nhân tất cả các ca nhiễm trùng huyết. Candida là tác nhân gây bệnh chính, xếp thứ 6-10 những tác nhân thường gặp nhất gây nhiễm trùng dòng máu và thường biểu hiện dưới dạng nấm Candida hoặc candidiasis ăn sâu [95, 96]. 1/3 bệnh nhân nhiễm Candida trong ICU và 25-35% bệnh nhân nhiễm nấm candida có nhiễm trùng huyết học sốc nhiễm trùng [95, 97]. Pneumocystosis, cryptococco- sis, histoplasmosis, invasive aspergillosis, mucormycosis, fusariosis, penicilliosis và scedosporiosis đôi khi xuất hiện với nhiễm trùng lan tỏa và nhiễm trùng huyết.
Candida là một thành phần bình thường trong hệ sinh vật trên da, đường tiêu hóa, niệu đạo và âm đạo, gây nhiều khó khăn để phân biệt xâm nhiễm do nhiễm trùng khi phân lập từ các vị trí vô trùng của cơ thể. Vì là một mầm bệnh cơ hội, Candida không có khả năng gây nhiễm trùng nếu như không có sự thay đổi sâu sắc trên thảm vi sinh vật, tính toàn vẹn của da hoặc niêm mạc hoặc khả năng phòng vệ của vật chủ [94, 98]. Trên bệnh nhân ICU thở máy còn khả năng sinh miễn dịch, phân lập Candida từ bệnh phẩm đường hô hấp dưới gần như luôn luôn chứng minh có sự xâm nhiễm hơn nhiễm trùng [99]. Một chỉ số xâm nhiễm Candida ít nhất 0.5, được coi là tỷ lệ nuôi cấy sàng lọc dương tính đến âm tính của các vị trí trong cơ thể, có thể tăng khả năng nhiễm Candida xâm lấn và có thể kích hoạt điều trị trước hoặc theo kinh nghiệm [100, 101].
Những yếu tố nguy cơ xâm nhiễm Candida thì không đặc trưng và tương tự với nhiễm vi khuẩn, (xâm nhiễm trước đó, điều trị kháng sinh phổ rộng, các thiết bị xâm lấn vào tĩnh mạch, nuôi ăn qua tĩnh mạch, đái tháo đường, suy giảm chức năng thận, lọc máu, phẫu thuật ổ bụng, viêm tụy, giảm bạch cầu đa nhân trung tính, ghép tạng đặc và suy giảm miễn dịch) [94]. Các hệ thống tính điểm dựa trên sự kết hợp các yếu tố nguy cơ, bệnh nền và đặc điểm lâm sàng có thấy giá trị tiên lượng âm tính cao (>90%) đối với IFI và có thể hỗ trợ loại trừ nhiễm Candida xâm nhập [102–104].
Bảng 1 Tổng kết và các khuyến cáo quan trọng
- Nhiễm trùng huyết yêu cầu điều trị kháng sinh nhanh chóng và kiểm soát nguồn bệnh
- Vi khuẩn là nguyên nhân thường gặp nhất của nhiễm trùng huyết, nhưng virus và nấm cũng có vai trò gây bệnh. Các vi sinh vật gram âm thường gặp hơn gram dương, nhưng việc có nhiều vi khuẩn đa kháng thuốc (MDR) nên cân nhắc lựa chọn kháng sinh theo kinh nghiệm.
- Sử dụng kháng sinh phù hợp ban đầu giúp giảm tỷ lệ tử vong, giảm thởi gian nằm viện và giảm chi phí, nên chọn kháng sinh tùy vào nguồn nhiễm trùng nghi ngờ, cũng như nhiễm MDR, và xem xét kháng sinh còn nhạy cảm với vi sinh vật tại địa phương. Kháng sinh ban đầu không nên dùng muộn hơn 3-5h sau khi khởi phát nhiễm trùng, nhưng phải dùng ngay lập tức trên bệnh nhân sốc nhiễm trùng, những người bệnh nặng và có khả năng nhiễm trùng cao.
- Các dấu ấn sinh học như procalcitonin và protein C phản ứng có thể đóng vai trò quản lý kháng sinh, nhưng không nên chỉ dùng 1 cái để xác định khi nào bắt đầu dùng kháng sinh trên bệnh nhân nhiễm trùng huyết.
- Thậm chí với kháng sinh ban đầu phù hợp, rất cần thiết dùng đúng liều, thường cao hơn liều thông thường trên bệnh nhân nhiễm trùng huyết, những bệnh nhân có thể tăng kháng sinh thanh thải tại thận, cùng với thay đổi thể tích phân bố, cung lượng tim và sự xâm nhập vị trí nhiễm trùng.
- Điều trị theo kinh nghiệm trên bệnh nhân nhiễm trùng huyết có viêm phổi (CAP, HAP, VAP) không bao giờ dùng 1 thuốc và dựa trên các yếu tố nguy cơ nhiễm mầm bệnh MDR, tập trung điều trị kháng sinh phổ rộng ban đầu, sau đó xuống thang nếu cấy máu âm tính. Các yếu tố nguy cơ quan trọng nhất phải cân nhắc lựa chọn kháng sinh là vi sinh vật học tại địa phương, gần đây sử dụng kháng sinh phổ rộng trong vòng 90 ngày, nhập viện gần đây ít nhất 5 ngày trong vòng 90 ngày và ưu tiên xâm nhiễm hoặc nhiễm trùng MRSA hoặc Pseudomonas aeruginosa.
- Nhiễm trùng ổ bụng có biến chứng (cIAI) thường do nhiều vi khuẩn, như gram âm, kỵ khí và cầu khuẩn đường ruột. Kháng sinh ban đầu theo kinh nghiệm điều trị nhiễm trùng huyết nên dùng betalactam/ức chế betalactamse hoặc carbapenem, trên một số bệnh nhân, nên nhắm mục tiêu các chủng Candida điều trị bao phủ thêm. Điều trị cũng gồm kiểm soát nguồn lây bằng dẫn lưu dưới da hoặc phẫu thuật, cũng có thể lấy mẫu bệnh phẩm nuôi cấy.
- Điều trị kháng sinh ban đầu đối với nhiễm khuẩn huyết bắt đầu dựa trên cơ sở các hội chứng trước khi có kết quả cấy máu dương tính, và sau đó điều chỉnh kháng sinh khi đã nhuộm gram và xác định chính xác tác nhân gây bệnh. Cửa sổ điều trị sau đó trở nên khả thi hơn, dựa trên xét nghiệm vi sinh vật nhanh chóng. Các lựa chọn điều trị nên cá thể hóa dựa trên yếu tố nguy cơ trên từng bệnh nhân đối với mầm bệnh cụ thể, vi sinh vật tại địa phương và hoàn thành mục tiêu bao phủ bệnh nguyên ít nhất 90%.
- Nhiễm nấm chiếm 5% nguyên nhân nhiễm trùng huyết, thường gặp nhất là Candida spp và có thể dự đoán bằng các thang điểm tiên lượng, dữ liệu dịch tễ học, dữ liệu vi sinh học và các dấu ấn sinh học. Những yếu tố nguy cơ trùng lặp với các nguyên nhân khác gây nhiễm trùng huyết ICU. Điều trị trước và theo kinh nghiệm thường cần thiết, thuốc kháng nấm Echinocandins thích hợp điều trị candida, nhưng một vài chủng đang kháng thuốc.
Các xét nghiệm chẩn đoán dựa trên nuôi cấy IFI không nhạy và có thời gian xoay vòng dài, kết quả là trì hoãn điều trị ban đầu kháng nấm mục tiêu. Cấy máu âm tính 30-50% trên bệnh nhân nhiễm candida và 80-90% bệnh nhân chắc chắn nhiễm candida nguyên phát [105]. Độ nhạy và độ đặc hiệu của các xét nghiệm không cấy máu từ 75-95% đối với kháng thể mannan/ kháng mannan, β-D-glucan và phản ứng chuỗi polymerase và 45-95% đối với xét nghiệm Candida albicans [105-107]. Nhóm panel T2Candida trông rất hứa hẹn với các thử nghiệm lâm sàng ban đầu [108].
Do tăng tỷ lệ tử vong cao với IFI, đặc biệt bệnh nhân suy giảm miễn dịch, nhanh chóng điều trị bằng các thuốc kháng nấm ưu tiên hay theo kinh nghiệm là rất quan trọng [94, 98]. Các bệnh cảnh lâm sàng (vị trí đầu tiên nhiễm trùng, tình trạng miễn dịch của bệnh nhân), dịch tễ học địa phương, vi sinh học và thông tin dấu ấn sinh học nhiễm nấm, sử dụng các thuốc kháng nấm trước đó và tương tác thuốc tiềm năng sẽ hướng dẫn lựa chọn thuốc kháng nấm. Echinocandins là thuốc phù hợp điều trị nhiễm nấm Candida [109-111]. Tuy nhiên, người ta lo ngại sự bùng phát C. albicans, C. glabrata và C. auris đề kháng thuốc echinocandins [114]. Điều trị xuống thang dựa trên đáp ứng kháng nấm ban đầu và kết quả nuôi cấy. Kiểm soát nguồn lây thích hợp (dẫn lưu ổ lây nhiễm, tháo catheter hoặc các bộ phận giả, bất cứ khi nào có thể) là một yếu tố quan trọng trong điều trị.
Tổng kết
Điều trị nghi ngờ nhiễm trùng huyết yêu cầu chăm sóc y tế kỹ càng và cá thể hóa. Điều trị ban đầu theo kinh nghiệm ngay lập tức đối với bệnh nhân có khả năng nhiễm trùng, bệnh nặng và/hoặc sốc. Kháng sinh theo kinh nghiệm cụ thể nên được lựa chọn thông qua xem xét vị trí nhiễm trùng, các mầm bệnh thường gặp tại vị trí đó và điều chỉnh dựa vào cân nhắc yếu tố nguy cơ đặc biệt trên bệnh nhân đề kháng kháng sinh và sự hiểu biết về vi sinh vật tại địa phương. Trong khi điều trị kịp thời và phù hợp vô cùng cần thiết để giảm tỷ lệ tử vong, phải kèm theo cam kết xuống thang kháng sinh 1 khi có kết quả cấy máu, diễn tiến lâm sàng và kết quả cận lâm sàng, bởi vì sử dụng bừa bãi kháng sinh phổ rộng theo kinh nghiệm làm tăng đề kháng kháng sinh. Các khuyến cáo quan trọng trong điều trị được tổng hợp trong bảng 1.
Acknowledgements
We thank Ms. Colleen Devoti and Michelle LoPiccolo for assistance with preparing this manuscript. We thank Dr. Jean-Louis Vincent for critical input in the content of this manuscript.
Authors’ contributions
All authors have contributed to the content of this manuscript and have reviewed and approved it for accuracy and completeness. MSN developed the plan for the topics to cover, invited all the authors, reviewed and organized the manuscript, edited the manuscript and prepared the Table and Figures.GN prepared the section on Sepsis Epidemiology. MK prepared the section on Appropriate Antibiotic Therapy. LB prepared the section on Biomarkers in Sep- sis. JL prepared the section on Antibiotic Therapy. RB prepared the section on Pneumonia Therapy. JD prepared the section on Intra-abdominal Infections. ND prepared the section on Empiric Therapy of Bacteremia. TC prepared the section on Fungal Sepsis. All authors read and approved the final manuscript.
Funding
None.
Availability of data and material
Not applicable.
Declarations
Ethical approval and consent to participate
Not applicable.
Consent for publication
All authors have provided consent for publication.
Competing interests
The authors declare that they have no competing interests.
Author details
1Pulmonary and Critical Care Medicine, New York Presbyterian/Weill Cornell Medical Center, 425 East 61st St, New York, NY 10065, USA. 2Harvard Medical School; Division of Pulmonary and Critical Care Medicine, Brigham and Wom- en’s Hospital, Boston, MA 02115, USA. 3AP-HP, Bichat Claude Bernard, Medical and Infectious Diseas ICU, University of Paris, Paris, France. 4Infectious Diseases Service, Department of Medicine, Lusanne University Hospital, University of Lusanne, Lusanne, Switzerland. 5Division of Infectious Diseases, Sunnybrook Health Sciences Centre, University of Toronto, Toronto, Canada. 6Department of Critical Care Medicine, Surgical Intensive Care Unit, Ghent University, Ghent, Belgium. 7Division of Pulmonary and Critical Care Medicine, Washington University School of Medicine, St. Louis, MO, USA. 8Royal Brisbane and Wom- en’s Hospital and Jamieson Trauma Institute, The University of Queensland, Brisbane, Australia. 9Nimes University Hospital, University of Montpelier, Nimes, France. 10Oakland University William Beaumont School of Medicine, Royal Oak, MI, USA.
Received: 16 August 2021 Accepted: 18 August 2021
Tài liệu tham khảo
- Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Crit Care Med. 2017;45(3):486–552.
- Seymour CW, Liu VX, Iwashyna TJ, Brunkhorst FM, Rea TD, Scherag A, et al. Assessment of clinical criteria for sepsis: for the third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA. 2016;315(8):762–74.
- Reinhart K, Daniels R, Kissoon N, Machado FR, Schachter RD, Finfer S. recognizing sepsis as a global health priority—a WHO resolution. N Engl J Med. 2017;377(5):414–7.
- Fay K, Sapiano MRP, Gokhale R, Dantes R, Thompson N, Katz DE, et al. Assessment of health care exposures and outcomes in adult patients with sepsis and septic shock. JAMA Netw Open 2020;3(7):e206004.
- Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017;43(3):304–77.
- Martinez ML, Ferrer R, Torrents E, Guillamat-Prats R, Goma G, Suarez D, et al. Impact of source control in patients with severe sepsis and septic shock. Crit Care Med. 2017;45(1):11–9.
- @CDCgov. Clinical Information | Sepsis | CDC. 2021.
- Fleischmann C, Scherag A, Adhikari NK, Hartog CS, Tsaganos T, Schlatt- mann P, et al. Assessment of global incidence and mortality of hospital- treated sepsis. Current estimates and limitations. Am J Respir Crit Care Med. 2016;193(3):259–72.
- Rudd KE, Johnson SC, Agesa KM, Shackelford KA, Tsoi D, Kievlan DR, et al. Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the Global Burden of Disease Study. Lancet. 2020;395(10219):200–11.
- Buchman TG, Simpson SQ, Sciarretta KL, Finne KP, Sowers N, Collier M, et al. Sepsis among medicare beneficiaries: 1. The burdens of sepsis, 2012–2018. Crit Care Med. 2020;48(3):276–88.
- Llewelyn MJ, Cohen J. Tracking the microbes in sepsis: advancements in treatment bring challenges for microbial epidemiology. Clin Infect Dis. 2007;44(10):1343–8.
- Kern WV, Rieg S. Burden of bacterial bloodstream infection—a brief update on epidemiology and significance of multidrug-resistant patho- gens. Clin Microbiol Infect. 2020;26(2):151–7.
- Vincent JL, Sakr Y, Singer M, Martin-Loeches I, Machado FR, Marshall JC, et al. Prevalence and outcomes of infection among patients in intensive care units in 2017. JAMA. 2020;323(15):1478–87.
- Rhee C, Wang R, Zhang Z, Fram D, Kadri SS, Klompas M, et al. Epidemiol- ogy of hospital-onset versus community-onset Sepsis in U.S. hospitals and association with mortality: a retrospective analysis using electronic clinical data. Crit Care Med. 2019;47(9):1169–76.
- Markwart R, Saito H, Harder T, Tomczyk S, Cassini A, Fleischmann-Stru- zek C, et al. Epidemiology and burden of sepsis acquired in hospitals and intensive care units: a systematic review and meta-analysis. Inten- sive Care Med. 2020;46(8):1536–51.
- Kumar A, Ellis P, Arabi Y, Roberts D, Light B, Parrillo JE, et al. Initiation of inappropriate antimicrobial therapy results in a fivefold reduction of survival in human septic shock. Chest. 2009;136(5):1237–48.
- Zhang D, Micek ST, Kollef MH. Time to appropriate antibiotic therapy is an independent determinant of postinfection ICU and hospital lengths of stay in patients with sepsis. Crit Care Med. 2015;43(10):2133–40.
- Ibrahim EH, Sherman G, Ward S, Fraser VJ, Kollef MH. The influence of inadequate antimicrobial treatment of bloodstream infections on patient outcomes in the ICU setting. Chest. 2000;118(1):146–55.
- Paul M, Shani V, Muchtar E, Kariv G, Robenshtok E, Leibovici L. Systematic review and meta-analysis of the efficacy of appropriate empiric antibiotic therapy for sepsis. Antimicrob Agents Chemother. 2010;54(11):4851–63.
- Kollef MH, Sherman G, Ward S, Fraser VJ. Inadequate antimicrobial treat- ment of infections: a risk factor for hospital mortality among critically ill patients. Chest. 1999;115(2):462–74.
- Bassetti M, Rello J, Blasi F, Goossens H, Sotgiu G, Tavoschi L, et al. Systematic review of the impact of appropriate versus inappropriate initial antibiotic therapy on outcomes of patients with severe bacterial infections. Int J Antimicrob Agents. 2020;56(6):106184.
- Garnacho-Montero J, Diaz-Martin A, Canton-Bulnes L, Ramirez P, Sierra R, Arias-Verdu D, et al. Initial antifungal strategy reduces mortality in critically Ill patients with candidemia: a propensity score-adjusted analysis of a multicenter study. Crit Care Med. 2018;46(3):384–93.
- Bassetti M, Righi E, Ansaldi F, Merelli M, Trucchi C, De Pascale G, et al. A multicenter study of septic shock due to candidemia: outcomes and predictors of mortality. Intensive Care Med. 2014;40(6):839–45.
- Kollef M, Micek S, Hampton N, Doherty JA, Kumar A. Septic shock attrib- uted to Candida infection: importance of empiric therapy and source control. Clin Infect Dis. 2012;54(12):1739–46.
- Kadri SS, Lai YL, Warner S, Strich JR, Babiker A, Ricotta EE, et al. Inap- propriate empirical antibiotic therapy for bloodstream infections based on discordant in-vitro susceptibilities: a retrospective cohort analysis of prevalence, predictors, and mortality risk in US hospitals. Lancet Infect Dis. 2021;21(2):241–51.
- Vazquez-Guillamet C, Scolari M, Zilberberg MD, Shorr AF, Micek ST, Kollef M. Using the number needed to treat to assess appropriate antimicrobial therapy as a determinant of outcome in severe sepsis and septic shock. Crit Care Med. 2014;42(11):2342–9.
- Harris PNA, Tambyah PA, Lye DC, Mo Y, Lee TH, Yilmaz M, et al. Effect of piperacillin-tazobactam vs meropenem on 30-day mortality for patients with E. coli or klebsiella pneumoniae bloodstream infec- tion and ceftriaxone resistance: a randomized clinical trial. JAMA. 2018;320(10):984–94.
- Taylor SP, Anderson WE, Beam K, Taylor B, Ellerman J, Kowalkowski MA. The association between antibiotic delay intervals and hospital mortality among patients treated in the emergency department for suspected sepsis. Crit Care Med. 2021;49(5):741–7.
- Weinberger J, Rhee C, Klompas M. A critical analysis of the literature on time-to-antibiotics in suspected sepsis. J Infect Dis. 2020;222(Suppl 2):S110–8.
- Rhee C, Kadri SS, Dekker JP, Danner RL, Chen HC, Fram D, et al. Preva- lence of antibiotic-resistant pathogens in culture-proven sepsis and outcomes associated with inadequate and broad-spectrum empiric antibiotic use. JAMA Netw Open. 2020;3(4):e202899.
- Asner SA, Desgranges F, Schrijver IT, Calandra T. Impact of the timeliness of antibiotic therapy on the outcome of patients with sepsis and septic shock. J Infect. 2021;82(5):125–34.
- Teshome BF, Vouri SM, Hampton N, Kollef MH, Micek ST. Duration of exposure to antipseudomonal beta-lactam antibiotics in the critically Ill and development of new resistance. Pharmacotherapy. 2019;39(3):261–70.
- Teshome BF, Vouri SM, Hampton NB, Kollef MH, Micek ST. Evaluation of a ceiling effect on the association of new resistance development to antipseudomonal beta-lactam exposure in the critically ill. Infect Control Hosp Epidemiol. 2020;41(4):484–5.
- Biomarkers Definitions Working G. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther. 2001;69(3):89–95.
- Pierrakos C, Velissaris D, Bisdorff M, Marshall JC, Vincent JL. Biomarkers of sepsis: time for a reappraisal. Crit Care. 2020;24(1):287.
- Bouadma L, Luyt CE, Tubach F, Cracco C, Alvarez A, Schwebel C, et al. Use of procalcitonin to reduce patients’ exposure to antibiotics in inten- sive care units (PRORATA trial): a multicentre randomised controlled trial. Lancet. 2010;375(9713):463–74.
- Kofoed K, Andersen O, Kronborg G, Tvede M, Petersen J, Eugen-Olsen J, et al. Use of plasma C-reactive protein, procalcitonin, neutrophils, macrophage migration inhibitory factor, soluble urokinase-type plas- minogen activator receptor, and soluble triggering receptor expressed on myeloid cells-1 in combination to diagnose infections: a prospective study. Crit Care. 2007;11(2):R38.
- Skibsted S, Bhasin MK, Aird WC, Shapiro NI. Bench-to-bedside review: future novel diagnostics for sepsis—a systems biology approach. Crit Care. 2013;17(5):231.
- Miller RR 3rd, Lopansri BK, Burke JP, Levy M, Opal S, Rothman RE, et al. Validation of a host response assay, SeptiCyte LAB, for discriminating sepsis from systemic inflammatory response syndrome in the ICU. Am J Respir Crit Care Med. 2018;198(7):903–13.
- Wirz Y, Meier MA, Bouadma L, Luyt CE, Wolff M, Chastre J, et al. Effect of procalcitonin-guided antibiotic treatment on clinical outcomes in intensive care unit patients with infection and sepsis patients: a patient- level meta-analysis of randomized trials. Crit Care. 2018;22(1):191.
- Arulkumaran N, Routledge M, Schlebusch S, Lipman J, Conway MA. Antimicrobial-associated harm in critical care: a narrative review. Inten- sive Care Med. 2020;46(2):225–35.
- De Backer D, Cecconi M, Lipman J, Machado F, Myatra SN, Ostermann M, et al. Challenges in the management of septic shock: a narrative review. Intensive Care Med. 2019;45(4):420–33.
- Roberts JA, Taccone FS, Lipman J. Understanding PK/PD. Intensive Care Med. 2016;42(11):1797–800.
- Paul M, Benuri-Silbiger I, Soares-Weiser K, Leibovici L. Beta lactam monotherapy versus beta lactam-aminoglycoside combination therapy for sepsis in immunocompetent patients: systematic review and meta- analysis of randomised trials. BMJ. 2004;328(7441):668.
- Marcus R, Paul M, Elphick H, Leibovici L. Clinical implications of beta- lactam-aminoglycoside synergism: systematic review of randomised trials. Int J Antimicrob Agents. 2011;37(6):491–503.
- Blot S, Lipman J, Roberts DM, Roberts JA. The influence of acute kidney injury on antimicrobial dosing in critically ill patients: are dose reduc- tions always necessary? Diagn Microbiol Infect Dis. 2014;79(1):77–84.
- Roberts JA, Kruger P, Paterson DL, Lipman J. Antibiotic resistance– what’s dosing got to do with it? Crit Care Med. 2008;36(8):2433–40.
- Dulhunty JM, Roberts JA, Davis JS, Webb SA, Bellomo R, Gomersall C, et al. A multicenter randomized trial of continuous versus intermit- tent beta-lactam infusion in severe sepsis. Am J Respir Crit Care Med. 2015;192(11):1298–305.
- Blot SI, Pea F, Lipman J. The effect of pathophysiology on pharmacoki- netics in the critically ill patient–concepts appraised by the example of antimicrobial agents. Adv Drug Deliv Rev. 2014;77:3–11.
- Udy AA, Baptista JP, Lim NL, Joynt GM, Jarrett P, Wockner L, et al. Aug- mented renal clearance in the ICU: results of a multicenter observa- tional study of renal function in critically ill patients with normal plasma creatinine concentrations*. Crit Care Med. 2014;42(3):520–7.
- Huttner A, Harbarth S, Hope WW, Lipman J, Roberts JA. Therapeutic drug monitoring of the beta-lactam antibiotics: what is the evidence and which patients should we be using it for? J Antimicrob Chemother. 2015;70(12):3178–83.
- Armand-Lefevre L, Ruppe E, Andremont A. ESBL-producing Enterobac- teriaceae in travellers: doctors beware. Lancet Infect Dis. 2017;17(1):8–9.
- Hites M. Minireview on novel anti-infectious treatment options and optimized drug regimens for sepsis. Front Med (Lausanne). 2021;8:640740.
- Butler MS, Paterson DL. Antibiotics in the clinical pipeline in October 2019. J Antibiot (Tokyo). 2020;73(6):329–64.
- Kakasis A, Panitsa G. Bacteriophage therapy as an alternative treatment for human infections. A comprehensive review. Int J Antimicrob Agents. 2019;53(1):16–21.
- Metlay JP, Waterer GW, Long AC, Anzueto A, Brozek J, Crothers K, et al. Diagnosis and treatment of adults with community-acquired pneu- monia. An Official Clinical Practice Guideline of the American Thoracic Society and Infectious Diseases Society of America. Am J Respir Crit Care Med. 2019;200(7):e45–67.
- Carugati M, Aliberti S, Sotgiu G, Blasi F, Gori A, Menendez R, et al. Bacte- rial etiology of community-acquired pneumonia in immunocompetent hospitalized patients and appropriateness of empirical treatment recommendations: an international point-prevalence study. Eur J Clin Microbiol Infect Dis. 2020;39(8):1513–25.
- Pletz MW, Blasi F, Chalmers JD, Dela Cruz CS, Feldman C, Luna CM, et al. International perspective on the new 2019 American Thoracic Society/ infectious diseases society of america community-acquired pneu- monia guideline: a critical appraisal by a global expert panel. Chest. 2020;158(5):1912–8.
- Nair GB, Niederman MS. Updates on community acquired pneumonia management in the ICU. Pharmacol Ther. 2021;217:107663.
- Vardakas KZ, Trigkidis KK, Falagas ME. Fluoroquinolones or macrolides in combination with beta-lactams in adult patients hospitalized with community acquired pneumonia: a systematic review and meta-analy- sis. Clin Microbiol Infect. 2017;23(4):234–41.
- Sligl WI, Asadi L, Eurich DT, Tjosvold L, Marrie TJ, Majumdar SR. Mac- rolides and mortality in critically ill patients with community-acquired pneumonia: a systematic review and meta-analysis. Crit Care Med. 2014;42(2):420–32.
- Jones BE, Jones MM, Huttner B, Stoddard G, Brown KA, Stevens VW, et al. Trends in antibiotic use and nosocomial pathogens in hospital-ized veterans with pneumonia at 128 medical centers, 2006–2010. Clin Infect Dis. 2015;61(9):1403–10.
- Chalmers JD, Rother C, Salih W, Ewig S. Healthcare-associated pneu- monia does not accurately identify potentially resistant pathogens: a systematic review and meta-analysis. Clin Infect Dis. 2014;58(3):330–9.
- Attridge RT, Frei CR, Pugh MJ, Lawson KA, Ryan L, Anzueto A, et al. Health care-associated pneumonia in the intensive care unit: guideline- concordant antibiotics and outcomes. J Crit Care. 2016;36:265–71.
- Minejima E, Lou M, Nieberg P, Wong-Beringer A. Patients presenting to the hospital with MRSA pneumonia: differentiating characteristics and outcomes with empiric treatment. BMC Infect Dis. 2014;14:252.
- Aliberti S, Reyes LF, Faverio P, Sotgiu G, Dore S, Rodriguez AH, et al. Global initiative for meticillin-resistant Staphylococcus aureus pneumo- nia (GLIMP): an international, observational cohort study. Lancet Infect Dis. 2016;16(12):1364–76.
- Jung WJ, Kang YA, Park MS, Park SC, Leem AY, Kim EY, et al. Prediction of methicillin-resistant Staphylococcus aureus in patients with non-noso- comial pneumonia. BMC Infect Dis. 2013;13:370.
- Prina E, Ranzani OT, Polverino E, Cilloniz C, Ferrer M, Fernandez L, et al. Risk factors associated with potentially antibiotic-resistant pathogens in community-acquired pneumonia. Ann Am Thorac Soc. 2015;12(2):153–60.
- von Baum H, Welte T, Marre R, Suttorp N, Ewig S, Group Cs. Community- acquired pneumonia through Enterobacteriaceae and Pseudomonas aeruginosa: diagnosis, incidence and predictors. Eur Respir J. 2010;35(3):598–605.
- Shindo Y, Ito R, Kobayashi D, Ando M, Ichikawa M, Shiraki A, et al. Risk factors for drug-resistant pathogens in community-acquired and healthcare-associated pneumonia. Am J Respir Crit Care Med. 2013;188(8):985–95.
- Morel J, Casoetto J, Jospe R, Aubert G, Terrana R, Dumont A, et al. De-escalation as part of a global strategy of empiric antibiotherapy management. A retrospective study in a medico-surgical intensive care unit. Crit Care. 2010;14(6):R225.
- Leone M, Bechis C, Baumstarck K, Lefrant JY, Albanese J, Jaber S, et al. De-escalation versus continuation of empirical antimicrobial treatment in severe sepsis: a multicenter non-blinded randomized noninferiority trial. Intensive Care Med. 2014;40(10):1399–408.
- Buckel WR, Stenehjem E, Sorensen J, Dean N, Webb B. Broad- versus narrow-spectrum oral antibiotic transition and outcomes in health care-associated pneumonia. Ann Am Thorac Soc. 2017;14(2):200–5.
- Deshpande A, Richter SS, Haessler S, Lindenauer PK, Yu PC, Zilberberg MD, et al. De-escalation of empiric antibiotics following negative cultures in hospitalized patients with pneumonia: rates and outcomes. Clin Infect Dis. 2021;72(8):1314–22.
- Kato H, Hagihara M, Asai N, Shibata Y, Koizumi Y, Yamagishi Y, et al. Meta- analysis of vancomycin versus linezolid in pneumonia with proven methicillin-resistant Staphylococcus aureus. J Glob Antimicrob Resist. 2021;24:98–105.
- Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB, et al. Management of adults with hospital-acquired and ventilator- associated pneumonia: 2016 Clinical Practice Guidelines by the Infec- tious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016;63(5):e61–111.
- Luna CM, Aruj P, Niederman MS, Garzon J, Violi D, Prignoni A, et al. Appropriateness and delay to initiate therapy in ventilator-associated pneumonia. Eur Respir J. 2006;27(1):158–64.
- Kuti EL, Patel AA, Coleman CI. Impact of inappropriate antibiotic ther- apy on mortality in patients with ventilator-associated pneumonia and blood stream infection: a meta-analysis. J Crit Care. 2008;23(1):91–100.
- Muscedere JG, Shorr AF, Jiang X, Day A, Heyland DK, Canadian Critical Care Trials G. The adequacy of timely empiric antibiotic therapy for ventilator-associated pneumonia: an important determinant of out- come. J Crit Care. 2012;27(3):322 e7–14.
- Martin-Loeches I, Timsit JF, Leone M, de Waele J, Sartelli M, Kerrigan S, et al. Clinical controversies in abdominal sepsis. Insights for critical care settings. J Crit Care. 2019;53:53–8.
- Blot S, Antonelli M, Arvaniti K, Blot K, Creagh-Brown B, de Lange D, et al. Epidemiology of intra-abdominal infection and sepsis in critically ill patients: “AbSeS”, a multinational observational cohort study and ESICM Trials Group Project. Intensive Care Med. 2019;45(12):1703–17.
- Martin-Loeches I, Antonelli M, Cuenca-Estrella M, Dimopoulos G, Einav S, De Waele JJ, et al. ESICM/ESCMID task force on practical manage- ment of invasive candidiasis in critically ill patients. Intensive Care Med. 2019;45(6):789–805.
- Phua J, Ngerng W, See K, Tay C, Kiong T, Lim H, et al. Characteristics and outcomes of culture-negative versus culture-positive severe sepsis. Crit Care. 2013;17(5):R202.
- Gupta S, Sakhuja A, Kumar G, McGrath E, Nanchal RS, Kashani KB. Culture-negative severe sepsis: nationwide trends and outcomes. Chest. 2016;150(6):1251–9.
- MacFadden DR, Leis JA, Mubareka S, Daneman N. The opening and closing of empiric windows: the impact of rapid microbiologic diagnos- tics. Clin Infect Dis. 2014;59(8):1199–200.
- Randhawa V, Sarwar S, Walker S, Elligsen M, Palmay L, Daneman N. Weighted-incidence syndromic combination antibiograms to guide empiric treatment of critical care infections: a retrospective cohort study. Crit Care. 2014;18(3):R112.
- Hebert C, Ridgway J, Vekhter B, Brown EC, Weber SG, Robicsek A. Demonstration of the weighted-incidence syndromic combination antibiogram: an empiric prescribing decision aid. Infect Control Hosp Epidemiol. 2012;33(4):381–8.
- Cressman AM, MacFadden DR, Verma AA, Razak F, Daneman N. Empiric antibiotic treatment thresholds for serious bacterial infections: a scenario-based survey study. Clin Infect Dis. 2019;69(6):930–7.
- MacFadden DR, Coburn B, Shah N, Robicsek A, Savage R, Elligsen M,et al. Decision-support models for empiric antibiotic selection in Gram- negative bloodstream infections. Clin Microbiol Infect. 2019;25(1):108 e1–7.
- Elligsen M, Pinto R, Leis JA, Walker SAN, Daneman N, MacFadden DR. Improving decision-making in empiric antibiotic selection (IDEAS) for gram-negative bacteremia: a prospective clinical implementation study. Clin Infect Dis. 2020.
- MacFadden DR, Coburn B, Shah N, Robicsek A, Savage R, Elligsen M, et al. Utility of prior cultures in predicting antibiotic resistance of bloodstream infections due to Gram-negative pathogens: a multicentre observational cohort study. Clin Microbiol Infect. 2018;24(5):493–9.
- Elligsen M, Pinto R, Leis JA, Walker SAN, MacFadden DR, Daneman
- Using prior culture results to improve initial empiric antibiotic prescribing: an evaluation of a simple clinical heuristic. Clin Infect Dis. 2021;72(10):e630–8.
- MacFadden DR, Elligsen M, Robicsek A, Ricciuto DR, Daneman N. Utility of prior screening for methicillin-resistant Staphylococcus aureus in pre- dicting resistance of S. aureus infections. CMAJ. 2013;185(15):E725–30.
- Delaloye J, Calandra T. Invasive candidiasis as a cause of sepsis in the critically ill patient. Virulence. 2014;5(1):161–9.
- Marchetti O, Bille J, Fluckiger U, Eggimann P, Ruef C, Garbino J, et al. Epidemiology of candidemia in Swiss tertiary care hospitals: secular trends, 1991–2000. Clin Infect Dis. 2004;38(3):311–20.
- Pfaller MA, Carvalhaes CG, Smith CJ, Diekema DJ, Castanheira M. Bacte- rial and fungal pathogens isolated from patients with bloodstream infection: frequency of occurrence and antimicrobial susceptibility pat- terns from the SENTRY Antimicrobial Surveillance Program (2012–2017). Diagn Microbiol Infect Dis. 2020;97(2):115016.
- Bassetti M, Vena A, Meroi M, Cardozo C, Cuervo G, Giacobbe DR, et al. Factors associated with the development of septic shock in patients with candidemia: a post hoc analysis from two prospective cohorts. Crit Care. 2020;24(1):117.
- Pappas PG, Lionakis MS, Arendrup MC, Ostrosky-Zeichner L, Kullberg BJ. Invasive candidiasis. Nat Rev Dis Primers. 2018;4:18026.
- Meersseman W, Lagrou K, Spriet I, Maertens J, Verbeken E, Peetermans WE, et al. Significance of the isolation of Candida species from airway samples in critically ill patients: a prospective, autopsy study. Intensive Care Med. 2009;35(9):1526–31.
- Pittet D, Monod M, Suter PM, Frenk E, Auckenthaler R. Candida coloniza- tion and subsequent infections in critically ill surgical patients. Ann Surg. 1994;220(6):751–8.
- Charles PE, Doise JM, Quenot JP, Aube H, Dalle F, Chavanet P, et al. Can- didemia in critically ill patients: difference of outcome between medical and surgical patients. Intensive Care Med. 2003;29(12):2162–9.
- Paphitou NI, Ostrosky-Zeichner L, Rex JH. Rules for identifying patients at increased risk for candidal infections in the surgical intensive care unit: approach to developing practical criteria for systematic use in antifungal prophylaxis trials. Med Mycol. 2005;43(3):235–43.
- Leon C, Ruiz-Santana S, Saavedra P, Almirante B, Nolla-Salas J, Alvarez- Lerma F, et al. A bedside scoring system (“Candida score”) for early anti- fungal treatment in nonneutropenic critically ill patients with Candida colonization. Crit Care Med. 2006;34(3):730–7.
- Ostrosky-Zeichner L, Pappas PG, Shoham S, Reboli A, Barron MA, Sims C, et al. Improvement of a clinical prediction rule for clinical trials on prophylaxis for invasive candidiasis in the intensive care unit. Mycoses. 2011;54(1):46–51.
- Clancy CJ, Nguyen MH. Diagnosing invasive candidiasis. J Clin Micro- biol. 2018;56(5).
- Mikulska M, Calandra T, Sanguinetti M, Poulain D, Viscoli C, Third European Conference on Infections in Leukemia G. The use of man- nan antigen and anti-mannan antibodies in the diagnosis of invasive candidiasis: recommendations from the Third European Conference on Infections in Leukemia. Crit Care. 2010;14(6):R222.
- Lamoth F, Akan H, Andes D, Cruciani M, Marchetti O, Ostrosky- Zeichner L, et al. Assessment of the role of 1,3-beta-d-glucan testing for the diagnosis of invasive fungal infections in adults. Clin Infect Dis. 2021;72(Suppl 2):S102–8.
- Monday LM, Parraga Acosta T, Alangaden G. T2Candida for the diag- nosis and management of invasive candida infections. J Fungi (Basel). 2021;7(3).
- Mora-Duarte J, Betts R, Rotstein C, Colombo AL, Thompson-Moya L, Smietana J, et al. Comparison of caspofungin and amphotericin B for invasive candidiasis. N Engl J Med. 2002;347(25):2020–9.
- Reboli AC, Rotstein C, Pappas PG, Chapman SW, Kett DH, Kumar D, et al. Anidulafungin versus fluconazole for invasive candidiasis. N Engl J Med. 2007;356(24):2472–82.
- Pappas PG, Kauffman CA, Andes DR, Clancy CJ, Marr KA, Ostrosky- Zeichner L, et al. Clinical practice guideline for the management of candidiasis: 2016 update by the infectious diseases society of America. Clin Infect Dis. 2016;62(4):e1-50.
- Pristov KE, Ghannoum MA. Resistance of Candida to azoles and echino- candins worldwide. Clin Microbiol Infect. 2019;25(7):792–8.
- Du H, Bing J, Hu T, Ennis CL, Nobile CJ, Huang G. Candida auris: Epide- miology, biology, antifungal resistance, and virulence. PLoS Pathog. 2020;16(10):e1008921.
- Patterson TF, Thompson GR 3rd, Denning DW, Fishman JA, Hadley S, Herbrecht R, et al. Practice guidelines for the diagnosis and manage- ment of aspergillosis: 2016 update by the infectious diseases Society of America. Clin Infect Dis. 2016;63(4):e1–60.