Kỹ thuật y khoa
Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: Antoinette T. Nguyen, Jie Ding và Edward E. Tredget
Biên dịch: Bác sĩ Trương Tấn Minh Vũ
nhathuocngocanh.com – Để tải file PDF của bài viết Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại, xin vui lòng click vào link ở đây.
Giới thiệu
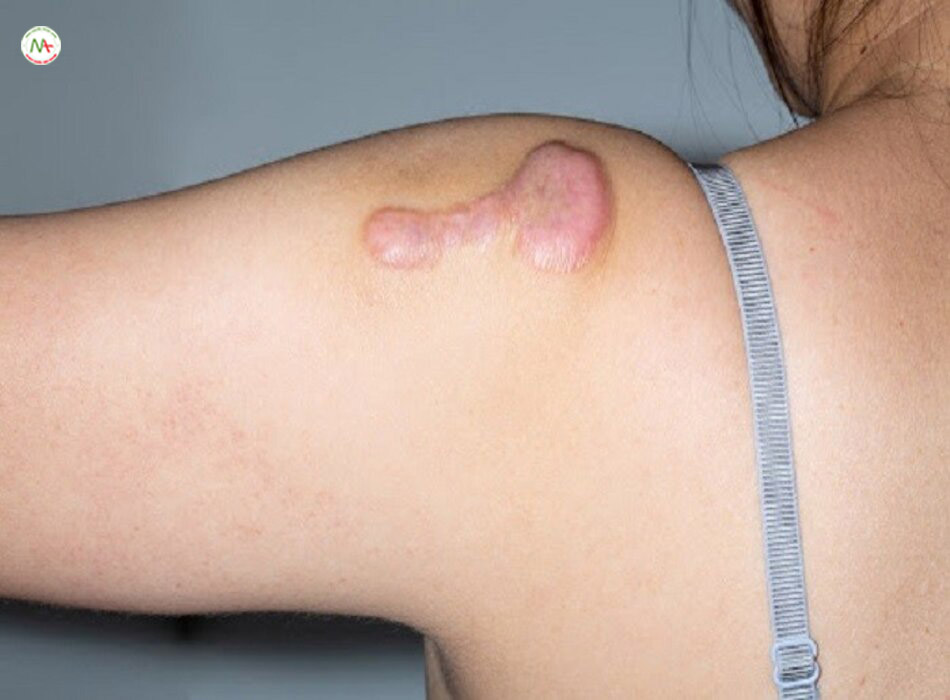
Da là cơ quan lớn nhất của cơ thể con người. Nó bảo vệ các cơ quan nội tạng khỏi môi trường bên ngoài; do đó nó phải có biện pháp để lành một cách hiệu quả sau khi bị chấn thương. Quá trình lành vết thương và hình thành sẹo là một quá trình động được điều chỉnh theo thời gian và không gian. Vết thương niêm mạc miệng trước khi sinh và sau khi sinh lành mà không để lại sẹo, trong khi vết thương sâu ở da sau khi sinh nhưng không ở bề mặt hoặc vết thương biểu bì dẫn đến hình thành sẹo [1, 2]. Do đó, khả năng phục hồi của da đang được nghiên cứu chuyên sâu để tìm ra cơ chế tế bào và phân tử của quá trình lành vết thương và hình thành sẹo. Quá trình lành vết thương xảy ra trong bốn giai đoạn và liên quan đến sự tương tác của một số thành phần bao gồm chất nền ngoại bào (ECM) (ví dụ: collagen, elastin và proteoglycans), tế bào trong hệ thống mạch máu (ví dụ: bạch cầu đơn nhân, tế bào lympho T và tế bào sợi), tế bào da ( ví dụ: tế bào sừng, tế bào nội mô và nguyên bào sợi), và các phân tử tín hiệu (cytokine, chemokine, yếu tố tăng trưởng và microRNAs (miR)) được tìm thấy trong môi trường tại chỗ. Việc lành vết thương không tốt có thể dẫn đến sẹo bệnh lý như sẹo phì đại (hypertrophic scars, HTS) và sẹo lồi (keloids) (Hình 3.1), cả hai đều được coi là rối loạn tăng sinh mô sợi ở da [3].
Quá trình lành thương và hình thành sẹo
Quá trình lành thương xảy ra theo 4 giai đoạn: cầm máu, viêm, tăng sinh và sửa chữa. Sau khi bị thương ở lớp biểu bì và lớp bì, các tiểu cầu và tế bào nội mô sẽ được kích hoạt, do đó kích hoạt quá trình đông máu để ngăn chặn sự mất máu. Trong thời gian này, một chất nền tạm thời, cục máu đông fibrin, được hình thành và đóng vai trò như một giá đỡ cho sự di chuyển của tế bào. Sau khi co mạch, tiểu cầu giải phóng một loạt các yếu tố bao gồm cytokine, chemokine và các yếu tố tăng trưởng có tác dụng thu hút các thành phần trung gian gây viêm như bạch cầu trung tính và bạch cầu đơn nhân đến vị trí tổn thương. Như vậy, giai đoạn lành vết thương ban đầu được hoàn thành trong vòng vài giờ kể từ thời điểm bị thương [4, 5].
![Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại 24 Hình 3.1 Hình dạng tổng quát của sẹo phì đại (a) và sẹo lồi (b) [3].](https://nhathuocngocanh.com/wp-content/uploads/2023/01/co-che-te-bao-va-phan-tu-cua-su-hinh-thanh-seo-phi-dai-anh-1.jpg)
Giai đoạn tăng sinh được đặc trưng bởi sự hình thành mô hạt, sau đó thay thế chất nền tạm thời. Sự hình thành mạch cũng xảy ra trong giai đoạn lành thương này thông qua việc kích hoạt một số yếu tố tăng trưởng như yếu tố tăng trưởng nội mô mạch máu (VEGF) [5, 7]. Các đại thực bào chống viêm tiết ra chemokine, cytokine và các yếu tố tăng trưởng để kích thích sự tăng sinh, di chuyển, kết dính và biệt hóa của tế bào. Các tế bào sừng và tế bào gốc biểu mô bao quanh trong các cấu trúc phụ của nang lông và tuyến bã nhờn và lớp đáy của biểu bì thực hiện tái biểu mô hóa [8]. Sự hình thành mô hạt là sự kiện cuối cùng trong giai đoạn tăng sinh và bao gồm hầu hết các nguyên bào sợi trong số các loại tế bào khác. Tế bào nguyên bào sợi chịu trách nhiệm cho sự lắng đọng của collagen và một số thành phần ECM khác.
Giai đoạn cuối cùng là sửa chữa, có thể kéo dài từ hàng tháng đến hàng năm. Trong giai đoạn này, sự gia tăng khiêm tốn của tỷ lệ collagen loại III so với loại I bị đảo ngược từ từ và collagen loại I trở thành dạng isoform chủ yếu của các vết sẹo trưởng thành. Sự co vết thương xảy ra và được thực hiện bởi các nguyên bào sợi cơ. Sẹo trưởng thành phẳng, mờ và không có các phần phụ như tuyến bã nhờn và nang lông. Khi độ sâu của tổn thương sâu hơn vào lớp bì, hình thành sẹo, ở bên hông xảy ra khi vết rách sâu 0,56 ± 0,03 mm (Hình 3.2) [9–11]. Điều này đã được phát hiện bằng cách sử dụng một dụng cụ để tạo ra một vết thương có độ sâu tăng dần, từ bề mặt đến sâu bên trong da, ở bên hông của con người [9]. Hơn nữa, sẹo mới hình thành bao gồm các mô kém hơn so với hình thức ban đầu. Ví dụ, lớp biểu bì mới hình thành của sẹo không thể bảo vệ chống lại bức xạ tia cực tím hiệu quả như da bình thường và lớp hạ bì bị giảm độ bền kéo.
![Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại 25 Hình 3.2 Dụng cụ (a) được sử dụng để tạo vết thương có độ sâu tăng dần (b và c) và vết thương lànhkhông sẹo ở đầu nông và có sẹo ở đầu sâu hơn [10]. Người ta cho rằng một khi tổn thương da vượt quá độ sâu tới hạn, một sẹo phì đại được hình thành (d) [11].](https://nhathuocngocanh.com/wp-content/uploads/2023/01/co-che-te-bao-va-phan-tu-cua-su-hinh-thanh-seo-phi-dai-anh-2.jpg)
Sẹo phì đại và sẹo lồi
Các vết thương ở bào thai và bề mặt da lành lại mà không để lại sẹo, liên quan đến sự tái tạo, trong khi sẹo phì đại và sẹo lồi đại diện cho việc lành thương dựa trên sự thay thế sau các vết thương sâu ở da (Hình 3.3) [12]. Sự gián đoạn trong các quá trình tế bào và phân tử bình thường của quá trình lành vết thương có thể gây ra sự lắng đọng quá mức và giảm sự suy thoái của các thành phần ECM, đặc biệt là collagen [12]. Cả sẹo phì đại và sẹo lồi đều là rối loạn tạo sợi xơ, và có các đặc điểm như tăng độ dày của da, tăng tế bào, lắng đọng quá nhiều collagen vô tổ chức và tăng sinh mạch máu. Mặc dù cả hai rối loạn đều giống nhau, sẹo phì đại biểu hiện ban đỏ, nổi lên, giới hạn trong ranh giới của chúng và có thể thoái triển theo thời gian. Sẹo lồi có biểu hiện tương tự, nhưng mở rộng ra bên ngoài ranh giới vết thương ban đầu, không thoái triển và thường nặng hơn. Sẹo phì đại có thể phát sinh từ vết rách sâu, phẫu thuật và ở những người bị bỏng. Sẹo lồi có thể phát sinh từ vết thương da lớn hoặc thậm chí nhỏ và có khuynh hướng di truyền mạnh nhưng chưa được biết rõ. Sẹo phì đại phát triển có thể dẫn đến co rút do mật độ cao các nguyên bào sợi cơ, được chỉ dấu bằng dương tính với phương pháp nhuộm actin cơ trơn alpha (α-SMA), một đặc điểm không có ở sẹo lồi [5]. Sẹo bệnh lý có thể phát sinh do viêm nhiễm kéo dài, vết thương chậm đóng và nhiễm trùng [13].
![Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại 26 Hình 3.3 Minh họa về vết thương tiếp theo là quá trình lành vết thương dựa trên tái tạo và thay thế. Lànhvết thương dựa trên tái tạo dẫn đến lành thương không để lại sẹo. Lành vết thương dựa trên thay thế gồm việc thay thế các cấu trúc bị mất và hình thành sẹo trưởng thành và bệnh lý [12].](https://nhathuocngocanh.com/wp-content/uploads/2023/01/co-che-te-bao-va-phan-tu-cua-su-hinh-thanh-seo-phi-dai-anh-3.jpg)
Cơ chế tế bào và phân tử của sẹo bệnh lý
Cơ chế phân tử và tế bào toàn thân và tại chỗ chính xác liên quan đến sự hình thành sẹo bệnh lý vẫn chưa được hiểu rõ hoàn toàn (Hình 3.4) [14]. Có một số yếu tố có thể ảnh hưởng đến kết quả của việc hình thành sẹo như chủng tộc, di truyền, tuổi tác, bệnh lý đi kèm và độ sâu của tổn thương. Do đó, một số nghiên cứu đang được tiến hành để làm sáng tỏ các thành phần tế bào và phân tử có liên quan đến sự hình thành sẹo.
![Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại 27 Hình 3.4 Quá trình lành thương và hình thành sẹo liên quan đến sự tương tác phức tạp giữa các yếu tố tại chỗ và toàn thân [14].](https://nhathuocngocanh.com/wp-content/uploads/2023/01/co-che-te-bao-va-phan-tu-cua-su-hinh-thanh-seo-phi-dai-anh-4.jpg)
Chất nền ngoại bào (Extracellular Matrix, ECM)
Trong mô bình thường, ECM được tìm thấy trong lớp dưới tế bào của da, cung cấp tính toàn vẹn của cấu trúc và tạo điều kiện cho tín hiệu tế bào. Các thành phần cấu trúc bao gồm collagen, sợi đàn hồi và glycosaminoglycans. Các thành phần tế bào cấu tạo của lớp bì bao gồm nguyên bào sợi, nguyên bào sợi cơ và tế bào nội mô. ECM có vai trò như một kho chứa cytokine, chemokine và các yếu tố tăng trưởng. ECM cũng có chức năng như một giá đỡ cho sự kết dính và di chuyển của tế bào, đồng thời có thể kích thích sự trao đổi chất của tế bào thông qua các con đường dẫn truyền tín hiệu liên quan đến tăng sinh, biệt hoá và apoptosis. Ở da bình thường và sẹo bệnh lý, sự hiện diện và thành phần của ECM khác nhau. Trong sẹo phì đại, các sợi collagen mỏng, thành cụm dày đặc và tỷ lệ collagen loại III so với loại I tăng hơn so với da bình thường [5]. Collagen có dạng dạng xoắn và dạng nốt, và có hướng song song với bề mặt da trong sẹo phì đại, không giống như dạng đan rổ điển hình thường thấy trong cấu trúc da bình thường [15, 16]. Không có nang lông, tuyến bã nhờn hoặc tuyến mồ hôi nào hiện diện trong cả sẹo phì đại và sẹo lồi [15, 16] và các gờ rete bình thường nhấp nhô giữa biểu bì và hạ bì bị phẳng [17]. Lớp dưới tế bào của da trở nên siêu tế bào do sự tăng sinh và di chuyển của nguyên bào sợi, nguyên bào sợi cơ, tế bào nội mô và tế bào miễn dịch. Sự gia tăng các tế bào cũng làm tăng sự lắng đọng của các thành phần ngoại bào, dẫn đến việc sản xuất không cân bằng các yếu tố ECM.
Collagen, thành phần chính trong ECM, là protein ngoại bào dạng xoắn ba trong lớp bì. Collagen có thể được chia thành hai nhóm, collagen dạng sợi và collagens liên quan dạng sợi. Collagen được tổng hợp bởi nguyên bào sợi dưới dạng tiền peptide và cần có sự phân cắt bằng enzym. Collagen loại I và III, cả hai đều là collagen dạng sợi, thường được tìm thấy ở lớp bì. Chúng cùng nhau tạo thành một kiểu hình giống như đan giỏ để cho sức mạnh và sự ổn định. Tỷ lệ collagen loại I trên loại III đã được chứng minh là phụ thuộc vào độ tuổi [18–20]. Tỷ lệ collagen loại I trên loại III cao hơn ở da bình thường, trong khi ở sẹo phì đại, tỷ lệ collagen loại I trên loại III thấp hơn [18–20]. Ở da bình thường, việc sản xuất và phân hủy collagen được cân bằng, tránh tích tụ trong ECM. Tuy nhiên, trong sẹo phì đại, có sự gia tăng đáng kể trong sản xuất và lắng đọng collagen nhưng lại thiếu sự phân hủy bởi enzyme metalloproteinase-1 chất nền (MMP-1, hoặc collagenase). MMP là các protease có liên quan đến sự phân hủy ECM. Thường hiện diện với lượng thấp và ở dạng tiền chất của chúng, MMP có thể được kích hoạt bởi các cytokine gây viêm hoặc bị ức chế bởi các chất ức chế mô của metalloproteinase (TIMPs) [21]. Trong sẹo phìđại, sựbiểu hiện của MMP phângiảiproteinvà chất ức chếcủa chúng, TIMP bị thay đổi [21].
Protein mục tiêu cho MMP-1, -2, -8 và -13 là collagen loại I, II và III, trong khi MMP-2 và -9 là gelatinase có khả năng phân hủy collagen biến tính [21]. Trong mô của bệnh nhân sẹo phì đại, mức mRNA của MMP-2, TIMP-1 và TIMP-2 cao hơn so với đối chứng; tuy nhiên, không thấy có sự khác biệt nào trong biểu hiện MMP-9 [21]. Điều thú vị là trong huyết thanh của bệnh nhân bị sẹo phì đại do hậu quả của chấn thương bỏng, chỉ có TIMP-1 được biểu hiện rõ rệt so với nhóm chứng [21]. Do đó, sự điều chỉnh không đúng tỷ lệ MMP và TIMP có thể góp phần làm lắng đọng quá nhiều collagen trong ECM [21]. Sự biểu hiện cao hơn của TIMP-1 được tìm thấy trong sẹo phì đại có thể do tế bào sừng góp phần [22]. Trong một nghiên cứu của Dasu và cộng sự, các nguyên bào sợi bình thường và phì đại được nuôi cấy với IL-6 dẫn đến tăng biểu hiện mRNA MMP-1 và MMP-3 và giá trị protein pro-MMP-1 và MMP-3 ở nguyên bào sợi bình thường nhưng không ở phì đại. [23]. Việc thiếu các thay đổi đối với biểu hiện MMP trong nguyên bào sợi sẹo phì đại có thể góp phần vào sự lắng đọng quá mức collagen được quan sát thấy trong ECM của sẹo phì đại.
Ghahary và cộng sự đã kiểm tra sự biểu hiện của collagenase trong các nguyên bào sợi ở da những bệnh nhân phát triển sẹo phì đại sau bỏng [24]. Sinh thiết punch của sẹo phì đại và môda bình thường cùng vị trí được lấy từcùng một bệnh nhân và tếbàonguyên bào sợi được nuôi cấy [24]. Các tác giả nhận thấy hoạt động của collagenase và biểu hiện mRNA giảm đáng kể, không có thay đổi trong chất ức chế enzym TIMP-1 trong nguyên bào sợi sẹo phì đại [24]. Những kết quả này một phần có thể do trung gian của sự gia tăng biểu hiện yếu tố tăng trưởng insulin-1 (IGF-1) được tìm thấy trong mô sẹo phì đại sau bỏng [24, 25]. Yếu tố tăng trưởng IGF-1 cũng được chứng minh là làm tăng cả phiên mã procollagen loại I và loại III [25]. Tổng hợp lại, dữ liệu cho thấy sự mất cân bằng giữa sảnxuất và suythoáicollagenđược quansátthấy ởbệnhnhân sẹophìđại. Ngoàicollagen, một protein cấu trúc khác được tìm thấy trong ECM là các sợi đàn hồi, cho khả năng phục hồi khỏi sự biến dạng của da bình thường. Cả elastin và fibrillin-1, các sợi đàn hồi, đều thấy bị hỗn loạn trong sẹo phì đại [26]. Thể tích của cả elastin và fibrillin-1 đều thấp hơn đáng kể trong lớp bì của sẹo phì đại [26, 27]. Sự tái cấu trúc và sửa chữa không bình thường này góp phần làm mất độ bền kéo và tăng sự co thắt so với da bình thường [28].
Ngoài collagen và sợi đàn hồi, ECM còn được cấu tạo bởi các proteoglycan. Proteoglycan là những protein có chứa chuỗi bên glycosaminoglycan [29]. Các proteoglycan nhỏ giàu leucine (SLRP) thường được tìm thấy trong da bao gồm decorin và fibromodulin [30]. Decorin là dạng SLRP chiếm ưu thế ở da bình thường. Lõi protein có thể gắn vào một số cấu trúc ECM như collagen, nơi nó có thể hỗ trợ tổ chức collagen và tạo sợi. Biểu hiện của cả mRNA và protein của decorin và fibromodulin, các chất điều chỉnh âm của yếu tố tăng trưởng biến đổi beta 1 (TGF-β1), đều giảm đáng kể trong mô sẹo phì đại so với bình thường [30]. Hơn nữa, Honardoust và cộng sự cũng tìm thấy sự biểu hiện thấp hơn của hai SLRP này trong các tế bào nguyên bào sợi từ sẹo phì đại [30]. Scott và cộng sự nuôi cấy tế bào nguyên bào sợi từ sinh thiết punch của sẹo phì đại và mô da bình thường từ cùng một bệnh nhân [31]. Decorin mRNA và biểu hiện protein từ tế bào nguyên bào sợi phì đại ít hơn đáng kể so với tế bào nguyên bào sợi bình thường [31]. Can thiệp các tế bào với yếu tố tăng trưởng TGF-β1 làm giảm biểu hiện cả protein và mRNA của decorin [31]. Các phân tích theo thời gian về biểu hiện decorin ở bệnh nhân sau bỏng cho thấy mức decorin duy trì ở mức thấp cho đến một năm, và tăng dần cho đến khi đạt mức tương tự như nhóm chứng sau 3 năm [32]. Trong sẹo phì đại, việc giảm decorin có thể góp phần tạo ra các sợi collagen vô tổ chức và tăng biểu hiện TGF-β1 được quan sát thấy ở bệnh nhân sẹo phì đại.
Các tế bào nguyên bào sợi từ các lớp sâu hơn của lớp bì giống với các tế bào nguyên bào sợi lấy từ mô sẹo phì đại [10, 33]. Honardoust và cộng sự đã đánh giá decorin và fibromodulin trong tế bào nguyên bào sợi từ lớp bì sâu bằng cách sử dụng mô hình vết thương tuyến tính ở người [10, 33]. Nhuộm miễn dịch huỳnh quang SLRP cho thấy decorin trong ECM, trong khi fibromodulin đồng khu trú với tế bào và cả hai đều cho thấy ít phản ứng miễn dịch hơn ở vết thương sâu so với vết thương nông [9, 10]. Trong tế bào nguyên bào sợi, cả tổng hợp SLRP đều bị giảm trong tế bào sâu cùng với tế bào nguyên bào sợi từ các lớp nông [9, 10]. SLRPs là chất điều chỉnh âm của TGF-β1; do đó, TGF-β1 và các thụ thể của nó đều được biểu hiện cao trong các vết thương sâu dưới da và trong các tế bào nguyên bào sợi ở các lớp bì sâu [9, 10]. Ngoài bổ sung tổ chức ECM và tác động điều chỉnh âm lên yếu tố tăng trưởng pro-fibrotic TGF-β1, decorin còn có thể kích thích quá trình apoptosis trong tế bào nguyên bào sợi để ngăn chặn quá trình tăng sinh [34]. Trong ống nghiệm, các nguyên bào sợi ở lớp bì sâu đã được chứng minh là có giảm mức độ decorin mRNA và protein so với các nguyên bào sợi ở bề mặt [34]. Nguyên bào sợi bề mặt biểu hiện nhiều decorin hơn có liên quan đến sự chết của tế bào apoptotic được chỉ ra bởi sự gia tăng biểu hiện mRNA của histone-1, cả caspase-1, -8 và p53, tất cả đều là các phân tử pro-apoptotic [34]. Mặt khác, các nguyên bào sợi ở lớp bì sâu không đáp ứng ở mức độ tương tự như nguyên bào sợi ở lớp nông, cho thấy rằng các tế bào trước đây không đáp ứng tốt với các tác động apoptotic của decorin [34]. Một nghiên cứu thử nghiệm đã được thực hiện tiếp theo để đánh giá mức độ toàn thân của decorin ở những bệnh nhân sau bỏng [35]. Kwan và cộng sự phát hiện ra rằng decorin toàn thân và IL-1β biểu hiện tạm thời sớm sau chấn thương bỏng và TGF-β1 trong huyết thanh trong giai đoạn sau là dự đoán về sự phát triển của sẹo [35]. Do đó, những thay đổi toàn thân trong cả ba chất đánh dấu decorin, IL-1β và TGF-β, có thể được sử dụng làm chất đánh dấu cho sự hình thành sẹo phì đại sau này [35].
Thu nhận các tế bào trong máu vào sẹo phì đại
Các tế bào trong máu được huy động và thu nhận khi vết thương được phát hiện. Yếu tố chemokine từ tế bào mô đệm 1 (SDF-1), còn được gọi là CXCL12, và thụ thể CXCR4 của nó đã được chứng minh là có liên quan đến quá trình xơ hóa. Mức độ của cả tế bào dương tính với SDF-1 và CXCR4+ đều tăng tương ứng trong huyết thanh và PBMCs sau vết thương bỏng (Hình 3.5) [36]. Phân tích trong thí nghiệm về con đường tín hiệu cho thấy rằng các nguyên bào sợi ở lớp bì sâu tiết ra mức SDF-1 cao hơn, sau đó làm tăng khả năng tính di động của các tế bào biểu hiện CXCR4 + [36]. Những kết quả này cho thấy trong thí nghiệm, biểu hiện của SDF-1 thu nhận các tế bào CXCR4+ trong tuần hoàn trực tiếp (thông qua các tế bào sợi) hoặc gián tiếp (thông qua các tế bào miễn dịch khác như bạch cầu đơn nhân và tế bào lympho) thúc đẩy quá trình xơ hóa [36]. Ở bệnh nhân bỏng, điều trị bằng interferon α2b làm giảm biểu hiện SDF-1/CXCR4 và hình thành sẹo sau đó [36]. Sự tham gia của trục tín hiệu SDF-1/CXCR4 đã được kiểm tra thêm bằng cách ức chế CXCR4 trên mô hình sẹo phì đại ở chuột bằng cách sử dụng chất đối kháng thụ thể cạnh tranh [37]. Việc cản trở trục truyền tín hiệu đã ngăn chặn sự di chuyển của các tế bào đến vị trí vết thương, giảm sự hình thành sẹo và giảm sự biểu hiện của các chất trung gian pro-fibrotic [37].
![Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại 28 Hình 3.5 Đường truyền tín hiệu SDF-1/CXCR4 có liên quan đến sự hình thành sẹo phì đại. Ở bệnh nhânbỏng, nồng độ SDF-1 huyết thanh tỷ lệ thuận với tổng diện tích bề mặt cơ thể (TBSA) (a) và tỷ lệ nghịch với tuổi bệnh nhân (b) [36].](https://nhathuocngocanh.com/wp-content/uploads/2023/01/co-che-te-bao-va-phan-tu-cua-su-hinh-thanh-seo-phi-dai-anh-5.jpg)
Một phần bạch cầu đơn nhân được thu nhận đến vị trí vết thương bởi protein hóa ứng động bạch cầu đơn nhân -1 (MCP-1), còn được gọi là phối tử chemokine motif C-C 2 (CCL2), trục truyền tín hiệu [39]. Bạch cầu đơn nhân là các tế bào máu trong tuần hoàn, chúng trưởng thành trở thành đại thực bào khi đến được vị trí mục tiêu trong các mô. Đại thực bào thực bào mảnh vụn và vật liệu lạ. Các đại thực bào cũng có thể ăn các bạch cầu trung tính bị chết, được hướng đến bắt đầu quá trình chuyển đổi các đại thực bào tiền viêm thành dạng phenotype chống viêm [6, 40, 41]. Khi đã qua giai đoạn viêm, các đại thực bào tiết ra các cytokine chống viêm, các yếu tố tăng trưởng và các yếu tố tạo mạch để cung cấp một môi trường sẽ kích thích tăng sinh và sửa chữa. Các đại thực bào có khả năng phân cực thành các phân nhóm khác nhau, M1 và M2. M1 là một subtype tiền viêm trong khi M2 được là dạng hoạt hóa khác. Sự biểu hiện của M1 hoặc M2 là phức tạp và con đường tín hiệu Notch có liên quan đến sự phân cực [42]. Đại thực bào M2 được phân loại thêm thành M2a, một phenotype chống viêm hoặc thay thế, M2b, một dạng điều hòa miễn dịch, M2c, một dạng bất hoạt, và M2d, có vai trò tạo mạch [43, 44]. Bởi vì M2 thúc đẩy một môi trường có lợi cho sự phát triển, các đại thực bào M2 có liên quan đến quá trình xơ hóa [45].
Để đánh giá những thay đổi trong bạch cầu đơn nhân và đại thực bào trong quá trình hình thành sẹo, da người có độ dày chẻ đôi được cấy lên lưng của chuột làm mô hình HTS [46]. Ban đầu, trong tuần đầu tiên sau khi ghép, các đại thực bào M1 trong mô được tìm thấy với số lượng cao hơn, trong khi các đại thực bào M2 bắt đầu tăng số lượng và đạt đỉnh điểm là 3 tuần sau khi ghép (Hình 3.6) [46]. Zhu và cộng sự đã tiêm mô hình sẹo phì đại ở chuột với chất clodronate ức chế đại thực bào trước khi đạt đỉnh của đại thực bào M2 [47]. Việc ức chế đại thực bào M2 làm giảm độ dày của sẹo, giảm số lượng nguyên bào sợi cơ và giảm sự lắng đọng collagen [47]. Ngoài ra, việc thu nhận các tế bào mast, thường đạt đỉnh điểm ở 4 tuần sau khi ghép, đã giảm [47]. Trong ống nghiệm, các tế bào THP-1 được biệt hóa thành các đại thực bào đang nghỉ, M1 và M2 [48]. Đại thực bào M2 được nuôi cấy cùng với nguyên bào sợi dẫn đến tăng sinh, tổng hợp collagen và biệt hóa nguyên bào sợi [48]. Nuôi cấy cùng lúc M2 và nguyên bào sợi cũng làm giảm sự biểu hiện của MMP-1 và decorin và tăng TGF-β1, COL1A1 và TIMP-1 [48]. Những phát hiện này hỗ trợ những phát hiện ban đầu về vai trò quan trọng của đại thực bào trong việc lành vết thương và chỉ ra vai trò của đại thực bào M2 trong sẹo phì đại.
![Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại 29 Hình 3.6 Sự hiện diện của đại thực bào M1 và M2 ở chuột được ghép da allografts và xenografts. Trongcả hai mô hình, đại thực bào M1 cho thấy xu hướng tương tự nhau, đạt đỉnh điểm sau khi ghép 1 tuần và giảm dần (a). Các đại thực bào M2 đạt đỉnh điểm trong mô hình allografts ở 2 tuần sau khi ghép, tuy nhiên, mô hình xenografts cho thấy mức đỉnh điểm ở 3 tuần sau khi ghép (b) [46].](https://nhathuocngocanh.com/wp-content/uploads/2023/01/co-che-te-bao-va-phan-tu-cua-su-hinh-thanh-seo-phi-dai-anh-6.jpg)
Tế bào sợi (fibrocyte) có nguồn gốc từ tủy xương và có các tính năng tương tự như nguyên bào sợi (fibroblast cell), như khả năng sản xuất collagen, nhưng ở mức độ thấp hơn [53]. Yang và cộng sự thu thập máu từ những bệnh nhân sau bỏng nơi các tế bào sợi được xác định trong quần thể PBMC [54]. Nồng độ TGF-β1 trong huyết thanh tăng cũng được xác định, cho thấy rằng yếu tố tăng trưởng này có thể kích thích PBMCs biệt hóa thành các tế bào sợi có khả năng sản xuất collagen loại I [54]. Hơn nữa, các tác giả xác định rằng tế bào CD14+ có thể biệt hóa thành tế bào sợi và sự biệt hóa này bị ức chế sau khi ủ bệnh với kháng thể trung hoà anti-TGF-β1 [54]. IL-4 và IL-13 từ tế bào lympho Th2 cũng có thể gây ra sự biệt hóa của tế bào CD14+ thành tế bào sợi [49]. Sự gia tăng số lượng tế bào sợi, được phát hiện bằng phương pháp nhuộm miễn dịch kép với protein-1 đặc hiệu leukocyte (LSP-1), một protein nội bào 52 kDa, và collagen loại I đã được nhìn thấy trong mô sẹo phì đại của bệnh nhân bỏng (Hình 3.7) [ 55]. Wang và cộng sự thu thập máu ngoại vi từ những bệnh nhân sau bỏng và những người bình thường để phân lập các tế bào sợi và đánh giá tác động của các tế bào này đối với việc điều chỉnh hoạt động của các nguyên bào sợi ở da người [53]. Môi trường điều hòa từ tế bào sợi chiết xuất từ bệnh nhân sau bỏng có thể kích thích tế bào nguyên bào sợi tăng sản xuất collagen và hoạt động tăng sinh, thúc đẩy di chuyển, kích thích biệt hóa thành tế bào nguyên bào sợi cơ, và tăng cường co rút [53]. Ngoài ra, tăng biểu hiện mRNA của cả TGF-β1 và CTGF đã được tìm thấy trong môi trường điều hòa từ các tế bào sợi của bệnh nhân bị bỏng [53]. Tác động của môi trường điều hòa tế bào sợi lên nguyên bào sợi bị đảo ngược khi bổ sung kháng thể TGF-β1, cho thấy vai trò điều hòa quan trọng của tế bào sợi đối với nguyên bào sợi [53].
![Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại 30 Hình 3.7 Nhuộm miễn dịch tế bào sợi. Nguyên bào sợi biểu hiện nhuộm collagen loại 1 (a), tuy nhiênkhông tìm thấy protein-1 đặc hiệu bạch cầu (LSP-1) (b). Phương pháp nhuộm miễn dịch kép khẳng định rằng nguyên bào sợi chỉ biểu hiện collagen loại I (c). Mặt khác, các tế bào sợi biểu hiện cả collagen loại I (d), LSP-1 (e), và miễn dịch huỳnh quang kép đã xác định sự hiện diện của cả hai protein (f) [55].](https://nhathuocngocanh.com/wp-content/uploads/2023/01/co-che-te-bao-va-phan-tu-cua-su-hinh-thanh-seo-phi-dai-anh-7.jpg)
Nguyên bào sợi(fibroblasts) và nguyên bào sợi cơ(myofibroblasts)
Nguyên bào sợi là các tế bào chính liên quan đến sản xuất ECM, một phần được kiểm soát bởi tín hiệu TGF-β. Trong sẹo phì đại, có sự gia tăng trong tăng sinh và giảm các nguyên bào sợi apoptotic [56]. Tín hiệu TGF-β làm cho nguyên bào sợi sản xuất collagen và biệt hóa thành nguyên bào sợi cơ. CTGF, một yếu tố tăng trưởng được gia tăng ở cuối nguồn của tín hiệu TGF-β, cũng được cho là có liên quan đến sản xuất collagen thông qua tín hiệu nguyên bào sợi. Ban đầu, các nguyên bào sợi được thu nhận vào nền vết thương bằng cách di chuyển dọc theo fibronectin và cần thụ thể bề mặt tế bào CD44H [57-59]. Nguyên bào sợi biệt hóa thành nguyên bào sợi cơ, và sự biệt hóa này được kích hoạt bởi PDGF, TGF-β1 và TGF-β2. Như đã đề cập, Wang và cộng sự cô lập nguyên bào sợi từ da bình thường và tách tế bào thành năm lớp [33]. Các tác giả nhận thấy rằng các nguyên bào sợi phân lập từ lớp bì sâu có kích thước lớn hơn, có tốc độ tăng sinh chậm và biểu hiện mức độ cao hơn của α-SMA, TGF-β1, CTGF, protein sốc nhiệt (HSP) 47, collagen và versican [33]. Tất cả những đặc điểm này là đặc trưng của nguyên bào sợi sẹo phì đại. Hơn nữa, các tế bào gốc trung mô có nguồn gốc từ tủy xương cũng được chứng minh là làm tăng tác dụng pro-fibrotic của các nguyên bào sợi ở sâu dưới da [60]. Do đó, những kết quả này cho thấy nguyên bào sợi từ lớp bì sâu góp phần vào sẹo phì đại (Bảng 3.1) [3].
Bảng 3.1. Đặc điểm của nguyên bào sợi da người có nguồn gốc từ da bình thường, sẹo phì đại, và lớp bì sâu của da bình thường [3].
Đặc điểm của nguyên bào sợi bình thường, sẹo phì đại và lớp bì sâu
| Nguyên bào sợi bình thường | Nguyên bào sợi ở sẹo phì đại | Nguyên bào sợi ở lớp bì sâu | |
| Kích thước tế bào | + | + | ++ |
| Tỷ lệ tăng sinh | ++ | ++ | + |
| Tổng hợp collagen | + | ++ | ++ |
| Hoạt động collagenase | ++++ | + | + |
| Biểu hiện α-SMA | + | +++ | +++ |
| Co rút collagen | + | +++ | +++ |
| TGF-β | + | + | + |
| Thụ thể TGF-β T II | + | +++ | +++ |
| CTGF | + | +++ | +++ |
| Osteopontin | + | +++ | +++ |
| Tổng hợp decorin | ++++ | + | + |
| Fibromodulin | ++++ | + | + |
| Biglycan | + | +++ | +++ |
| Versican | + | +++ | +++ |
| Thụ thể Toll-like | + | +++ | ? |
Nguyên bào sợi biệt hóa thành nguyên bào sợi cơ ngay sau khi hình thành mô hạt để tạo điều kiện đóng vết thương. Nguyên bào sợi cơ cũng có thể phát sinh từ các nguồn có nguồn gốc từ tủy xương và tế bào gốc trung mô [57]. Nguyên bào sợi cơ có liên quan đến sự co lại của vết thương và tu sửa lại ECM [57]. Nguyên bào sợi chuyển đổi thành nguyên bào sợi cơ ban đầu sau khi tiếp xúc với môi trường đặc trưng với mức độ cao của cytokine gây viêm và chemokine. Sau đó, nguyên bào sợi cơ ban đầu biệt hoá thành nguyên bào sợi cơ, tích hợp α-SMA sau đó, một dấu hiệu của nguyên bào sợi cơ. Trong điều kiện bình thường, nguyên bào sợi cơ tạo ra α-SMA và trải qua quá trình apoptosis sau khi vết thương khép lại. Tuy nhiên, nếu nguyên bào sợi cơ vẫn tồn tại trong nền vết thương, sự co rút có thể tăng lên. Tín hiệu TGF-β1 tạo điều kiện cho sự biệt hóa nguyên bào sợi cơ. Con đường tín hiệu này bao gồm phối tử TGF-β1, phức hợp thụ thể TGF-β1, và các protein truyền tín hiệu dưới dòng bao gồm Smad 2/3 và JNK, được gọi là con đường điển hình và không điển hình. Ngoài ra, IL-4 và IL-13 cũng có thể tạo điều kiện cho sự biệt hóa nguyên bào sợi cơ độc lập với con đường TGF-β.
Chemokine và Cytokine trong sẹo phì đại
Chemokine là chất hóa ứng động, và có thể được phân loại thành một trong bốn nhóm: C, CC, CXC và CX3C [61]. Các chemokine có thể thu nhận các tế bào viêm và các tế bào ở lân cận bằng cách liên kết với các thụ thể cognate của chúng trong quá trình lành thương và hình thành sẹo phì đại [61]. Như đã đề cập ở trên, con đường chemokine SDF-1/CXCR4 + đóng một vai trò trong sự phát triển của sẹo phì đại. Nói một cách ngắn gọn, sự biểu hiện của SDF-1 có liên quan đến việc thu nhận CXCR4 + PBMC [36]. Do đó, việc thu nhận các tế bào CXCR4 + PBMC vào vị trí tổn thương có thể dẫn đến sự biệt hóa các tế bào này thành các tế bào sợi, nguyên bào sợi hoặc nguyên bào sợi cơ, góp phần hình thành sẹo [36]. Ngoài ra, sự gia tăng nồng độ SDF-1α trong huyết thanh tỷ lệ thuận với tổng diện tích bề mặt cơ thể bị ảnh hưởng bởi chấn thương, cho thấy vùng bỏng lớn hơn có liên quan đến mức độ SDF-1α cao hơn [36]. Hơn nữa, nghiên cứu sâu hơn về con đường này cho thấy rằng sự ức chế trục tín hiệu này cải thiện sự hình thành sẹo [36, 37].
Một con đường chemokine được quan tâm là CCL2 (hoặc MCP-1), liên kết với CCR2. Các bạch cầu đơn nhântrong máu chuột được phân loại thành một trong hai nhóm: thụthểchemokine C–C loại2(CCR2)+ /lymphocyte Ag6C (Ly6C)+ và CCR2−/Ly6C−, tương ứng phản ánh kiểu phenotype viêm và không viêm [62, 63]. Bằng cách sử dụng CCR2-eGFP chuột, vết thương thu nhận mạnh các bạch cầu đơn nhân CCR2+ / Ly6C+ vào vị trí tổn thương [63]. Điều thú vị là một số bạch cầu đơn nhân được thu nhận này trưởng thành thành đại thực bào tiền tạo mạch, do đó góp phần chữa lành vết thương [63]. Ở chuột được loại bỏ MCP-1, quá trình tái tạo biểu mô, hình thành mạch ở vết thương và sản xuất collagen đều bị hoãn lại [64]. Trong một mô hình bleomycin của xơ hóa da giống với xơ cứng bì, cấu trúc collagen của chuột được loại bỏ MCP-1 được đánh giá sau khi tiêm bleomycin, và kiểu phenotype giống với kiểu hoang dã, cho thấy đáp ứng xơ hóa giảm [65]. Trong một nghiên cứu khác, các tế bào sợi CCR2+ của người và chuột có thể đáp ứng với CCL2, dẫn đến sự gia tăng sự di chuyển và biệt hóa của tế bào thành các nguyên bào sợi cơ, gợi ý về vai trò tạo xơ [66]. Những kết quả này liên quan đến việc lành vết thương và hình thành sẹo cho thấy rằng cần phải có các nghiên cứu sâu hơn để điều tra vai trò của CCL2 / CCR2 đối với sự hình thành sẹo phì đại. Điều thú vị là trục truyền tín hiệu này cũng có thể tham gia vào quá trình hình thành sẹo lồi [67].
Thụ thể chemokine CXC 3 (CXCR3), một thụ thể 9 được kết hợp với protein G, liên kết với các phối tử tương ứng của nó, bao gồm CXCL10 và CXCL11. Thụ thể chemokine đã được chứng minh là có liên quan đến quá trình tái biểu mô bằng cách thúc đẩy tế bào sừng và ngăn chặn sự di chuyển của nguyên bào sợi, cũng như làm giảm sự hình thành mạch [68–70]. Yates và cộng sự đã kiểm tra tác động của ức chế CXCR3 ở chuột và tìm thấy các đặc điểm của sự phát triển sẹo như lớp biểu bì và bì dày lên, tăng thành phần tế bào bao gồm nguyên bào sợi, collagen vô tổ chức, mức độ fibronectin cao hơn và sự gia tăng hình thành mạch máu [69, 71]. Hơn nữa, sự hiện diện của các tế bào viêm, bạch cầu và đại thực bào, được tìm thấy trong mô sẹo của chuột loại bỏ CXCR3 ở thời điểm 6 tháng sau khi bị thương [69, 71]. Các đặc điểm này phù hợp với sẹo phì đại và cho thấy rằng CXCR3 có thể là một mục tiêu điều trị tiềm năng để điều trị sẹo phì đại.
Chemokine CX3CL1, hoặc fractalkine, và thụ thể CX3CR1 của nó, một thụ thể fractalkine xuyên màng hoặc thụ thể 13 kết hợp với protein g, có liên quan đến việc lành vết thương và truyền tín hiệu sai lệch và có thể góp phần hình thành sẹo phì đại. CX3CL1 được tìm thấy trong da; trong khi CX3CR1 được tìm thấy trên các tế bào viêm [72]. Một biểu hiện CX3CR1 đánh dấu huỳnh quang ở chuột chuyển gen được sử dụng để đánh giá chức năng của thụ thể này trong việc lành vết thương [73]. Sự gia tăng tế bào CX3CR1+ được thấy sau chấn thương bỏng, cũng như đại thực bào và tế bào nội mô [73]. Clover và cộng sự phát hiện ra rằng những con chuột loại bỏ CX3CR1 dẫn đến chậm lành vết thương do giảm sự di chuyển của các tế bào tủy xương CX3CR1 vào nền vết thương, cũng như giảm sự hình thành mạch [73]. Do đó, kết quả cho thấy rằng tín hiệu CX3CR1 góp phần vào việc thu nhận đại thực bào và hình thành mạch máu trong quá trình lành thương [73]. Một vết cắt toàn bộ độ dày da được thực hiện trên chuột C57BL/6 để khảo sát vai trò của CX3CL1/CX3CR1 [72]. Biểu hiện gen cao của trục tín hiệu này được xác định sau chấn thương so với nhóm chứng [72]. Hơn nữa, sự biểu hiện protein của CX3CR1 trùng hợp với đại thực bào, nguyên bào sợi và tế bào nội mô, trong khi CX3CL1 được biểu hiện ở đại thực bào và tế bào nội mô [72]. Ở những con chuột loại bỏ CX3CR1, có sự chậm trễ trong quá trình đóng vết thương cũng như giảm sự xâm nhập của đại thực bào và giảm sự biểu hiện mRNA của collagen loại I [72]. Ngoài ra, sự vắng mặt của CX3CR1 làm giảm sự biểu hiện của TGF-β1 và sự hình thành mạch [72]. Do đó, những kết quả này cho thấy vai trò của CX3CL1/CX3CR1 trong việc lành vết thương.
Cytokine là các phân tử tín hiệu nhỏ, có kích thước từ 4 đến 60 kD và ảnh hưởng đến sự phát triển, di chuyển, biệt hóa, tăng sinh, phân cực và chức năng của tế bào. Trong quá trình lành vết thương, cả hai dạng IL-1, IL-1α và IL-1β, đều quan trọng. IL-1α có liên quan đến các hoạt động anti-fibrotic trong khi IL-1β là pro-fibrotic. Sự biểu hiện của IL-1α được tìm thấy khu trú ở tế bào sừng và bạch cầu trung tính ở da trong mô hình lành thương ở chuột, gợi ý về một vai trò tương ứng trong tái biểu mô hóa và điều hòa hóa học [74]. Shephard và cộng sự nuôi cấy tế bào sừng với nguyên bào sợi, và nhận thấy sự gia tăng α-SMA, dấu hiệu của nguyên bào sợi cơ được quan sát thấy bắt đầu từ ngày thứ 4 [75]. Sự biến đổi từ nguyên bào sợi thành nguyên bào sợi cơ được thực hiện qua trung gian một phần bởi TGF-β, được biểu hiện trong vòng hai ngày đầu tiên nuôi cấy, và do đó việc dùng kháng thể đơn dòng trung hòa TGF-β làm giảm sự biệt hóa của nguyên bào sợi cơ [75]. Sự biểu hiện của IL-1α trong cùng nuôi cấy cũng làm giảm sự biểu hiện của α-SMA, trong khi sự ức chế cytokine này thúc đẩy sự biểu hiện của α-SMA, gợi ý về vai trò điều hòa nghịch của IL-1α trên TGF-β1 thông qua sự hoạt hóa của yếu tố phiên mã NF-κB từ ngày thứ 2 đến ngày thứ 4 của nuôi cấy [75]. Tuy nhiên, con đường TGF-β1 và IL-1 đã được chứng minh là chia sẻ các phân tử tín hiệu xuôi dòng như kinase liên kết với thụ thể interleukin-1 (IRAK) và đáp ứng biệt hóa tủy xương ban đầu 88 (MyD88), làm phức tạp thêm cơ chế truyền tín hiệu của IL-1 và TGF-β về sự hình thành sẹo phì đại [76]. Trong sẹo phì đại, mức IL-1β cao và IL-1α thấp được phát hiện rõ nhất là ở lớp biểu bì [77, 78]. Nguyên bào sợi sẹo phì đại được kích thích bằng IL-1β làm giảm biểu hiện gen của NF-κB, p53 và cyclooxygenase-2 (Cox-2); do đó, giảm viêm và quá trình apoptosis tạo điều kiện cho sự tăng sinh nguyên bào sợi [79]. Điều thú vị là các tế bào nội mô cũng có thể biệt hóa thành nguyên bào sợi cơ sau khi được kích thích với IL-1β, được xác định bằng sự gia tăng biểu hiện của α-SMA và collagen [80]. Ngược lại, một nghiên cứu của Mia và cộng sự xác định IL-1β là chất anti-fibrotic [81]. IL-1β kết hợp với TGF-β1 làm giảm sự biệt hóa nguyên bào sợi cơ và sản xuất collagen thông qua điều hòa giảm yếu tố phiên mã tương đồng gen sinh ung thư liên quan đến u thần kinh đệm 1 [81]. Hơn nữa, các nguyên bào sợi được kích thích bằng IL-1β và TGF-β1 đã thúc đẩy sự biểu hiện của MMP, dẫn đến sự suy thoái của ECM [81]. Do đó, IL-1β có thể hoạt động cả 2 vai trò như một yếu tố pro-fibrotic và anti-fibrotic, có thể phụ thuộc vào thời gian và không gian.
IL-4 và IL-13, cả hai đều hoạt động trên cùng một thụ thể, được cho là gây ra sản xuất collagen trong nguyên bào sợi ở da người [82]. Các cytokine kích thích con đường kinase 1/2 điều hòa tín hiệu ngoại bào (ERK), sau đó kích hoạt protein miền ETS của yếu tố phiên mã (Elk-1) [82]. Sự đóng góp của con đường truyền tín hiệu đối với quá trình sản xuất collagen đã được xác nhận bằng cách truyền các tế bào nguyên bào sợi với plasmid âm tính chiếm ưu thế là ERK1/2 và Elk-1, dẫn đến giảm sản xuất collagen [82]. Do đó, ở bệnh nhân bỏng, mức IL-4 tăng lên so với nhóm chứng, cho thấy vai trò của IL-4 đối với sự hình thành sẹo thông qua việc tăng sản xuất collagen [83, 84].
IL-6 có thể điều chỉnh sự hình thành sẹo phì đại bằng cách liên kết với thụ thể IL-6, tiếp theo là liên kết với thụ thể glycoprotein 130, dẫn đến quá trình phosphoryl hóa yếu tố phiên mã STAT3, sau đó liên kết với trình tự DNA cognate của nó mã hóa gen ức chế tín hiệu cytokine 3 (SOCS3) [85]. Do đó, sự gia tăng STAT3 được phosphoryl hóa cũng như sự gia tăng của procollagen mRNA xuôi dòng và fibronectin đã được quan sát thấy trong các nguyên bào sợi sẹo phì đại [85]. Các phân tích biểu hiện gen trong sẹo phì đại và các nguyên bào sợi bình thường cho thấy MMP-1 và MMP-3 đã tăng lên trong các nguyên bào sợi bình thường sau khi kích thích IL-6, và sự gia tăng này không được quan sát thấy trong các nguyên bào sợi sẹo phì đại, cho thấy sự thiếu hụt ECM [23]. Nguyên bào sợi sẹo phì đại cũng được đánh giá về những thay đổi trong biểu hiện gen được kích thích khi có và không có IL-6 [23]. Các gen được biểu hiện cao (hơn gấp ba lần) bao gồm periplakin, tenascin XB, protein KIAA0306 và protein liên kết TGF-β tiềm ẩn 1 [23]. Mặt khác, các gen bị giảm mạnh (hơn gấp ba lần) bao gồm protein KIAA077, kinase điều chỉnh huyết thanh/glucocorticoid, CTGF, glycoprotein β-1 đặc hiệu cho thai kỳ và gen thromospondin-1 [23]. Do đó, điều trị nguyên bào sợi phì đại bằng IL-6 có thể thay đổi biểu hiện gen của các thành phần liên quan đến ECM và hàng rào biểu bì [23].
IL-10 là một cytokine chống viêm và chống xơ hóa. Vết thương của thai nhi lành mà không để lại sẹo, và điều này có thể là do thiếu phản ứng viêm. Do đó, IL-10, một cytokine chống viêm, đã được chứng minh là có liên quan đến việc không hình thành sẹo khi biểu hiện quá mức trên mô hình sẹo do sinh thiết punch ở chuột trưởng thành [86]. Để hỗ trợ điều này, ghép da từ bào thai chuột đã loại bỏ IL-10 đã phát triển sẹo [2]. IL-10 làm giảm α-SMA và cả collagen loại I và III thông qua quá trình phosphoryl hóa yếu tố phiên mã STAT3 và protein kinase B (AKT) [87]. Sự ức chế đường truyền tín hiệu và các thụ thể IL-10 đã đảo ngược tác dụng của IL-10 xác nhận kết quả chống xơ hóa [87]. Điều thú vị là nồng độ IL-10 trong huyết thanh tăng lên ở bệnh nhân bỏng [84] cho thấy vai trò của IL-10 trong việc hình thành hoặc sửa chữa sẹo phì đại.
Sự gia tăng các thụ thể của yếu tố hoại tử khối u (TNF)-α loại I được tìm thấy trong sẹo phì đại [77]. TNF-α đã được chứng minh là thúc đẩy sự biệt hóa của tế bào nội mô thành nguyên bào sợi cơ, và nguyên bào sợi cơ được xác nhận bằng sự gia tăng biểu hiện của α-SMA và collagen [80]. TNF-α cũng có vai trò chống xơ hóa [88]. Goldberg và cộng sự cho thấy TNF-α làm giảm biểu hiện α-SMA, và do đó làm giảm sự biệt hóa nguyên bào sợi thành nguyên bào sợi cơ [89]. Hơn nữa, TNF-α cũng có thể làm giảm các gen thường tăng do TGF-β1 như collagen và fibronectin [89]. Tác dụng chống xơ hóa của TNF-α trên α-SMA được trung gian bởi sự mất ổn định mRNA, kích hoạt con đường c-Jun N-terminal kinase (JNK), và TGF-β1 bằng cách ngăn chặn con đường phosphoryl hóa của Smad3 [89]. Do đó, TNF-α cũng ảnh hưởng đến sự hình thành sẹo.
Ảnh hưởng của IFN-γ, được sản xuất từ tế bào lympho T đã được đánh giá trong các nguyên bào sợi sẹo phì đại ở người bị bỏng [90]. Xử lý các nguyên bào sợi bình thường và ở sẹo phì đại bằng IFN-γ dẫn đến giảm số lượng tế bào, sản xuất protein collagen và nồng độ mRNA procollagen loại I và loại III trong nguyên bào sợi sẹo phì đại [90]. Một loại IFN khác, IFN α2b, được sản xuất bởi bạch cầu, cũng đã được nghiên cứu [91]. Tredget và cộng sự cũng phát hiện thấy sự giảm sản xuất protein collagen và mRNA procollagen loại I [91]. Do đó, những tác động này trái ngược với những gì được quan sát thấy khi tế bào được xử lý bằng TGF-β1, kết quả dẫn đến tăng sinh và tăng sản xuất mRNA collagen và protein. Các nghiên cứu sâu hơn về IFN trên collagenase và biểu thức TIMP-1 cho thấy kết quả đối lập [92]. Xử lý nguyên bào sợi bằng IFN-γ dẫn đến giảm collagenase và tăng biểu hiện mRNA TIMP-1 [92]. Mặt khác, điều trị bằng IFN α2b làm tăng cả mức độ biểu hiện mRNA của collagenase và TIMP-1 [92]. Do đó, việc sử dụng IFN α2b như một can thiệp điều trị được đánh giá tiếp theo [93–95]. Bệnh nhân bỏng được điều trị bằng IFN α2b có số lượng nguyên bào sợi và nguyên bào sợi cơ giảm đi so với ban đầu [95]. Hiệu quả của điều trị IFN α2b cũng được đánh giá trên các tế bào sợi [93, 94]. Wang và cộng sự nhận thấy sự giảm số lượng fibrocyte trong mô đối chứng và sẹo phì đại sau khi điều trị bằng IFN α2b in vivo [93, 94]. Các tác giả cũng nhận thấy sự giảm tất cả các chỉ số sau: biệt hóa PBMCs thành fibrocytes, fibrocyte biểu hiện α-SMA, và tăng sinh fibrocyte trong nuôi cấy [93, 94]. Wang và cộng sự cũng xác định giảm biểu hiện VEGF, và do đó hình thành mạch trong mô sẹo phì đại sau khi điều trị bằng IFN α2b [94]. Hơn nữa, bệnh nhân bỏng được điều trị bằng IFN α2b đã giảm biểu hiện SDF-1 và tế bào biểu hiện CXCR4+ CD14+ trong máu (Hình 3.8) [36]. Trong ống nghiệm, môi trường điều hòa từ các nguyên bào sợi ở da được xử lý bằng LPS làm tăng tính di động của PBMCs, và điều này giảm xuống khi các nguyên bào sợi được xử lý bằng IFN α2b [36]. Vì vậy, IFN α2b là một can thiệp điều trị tiềm năng hấp dẫn để điều trị sẹo phì đại vì nó cho thấy giảm tác dụng điều hòa hóa học và các đặc tính của sẹo phì đại.
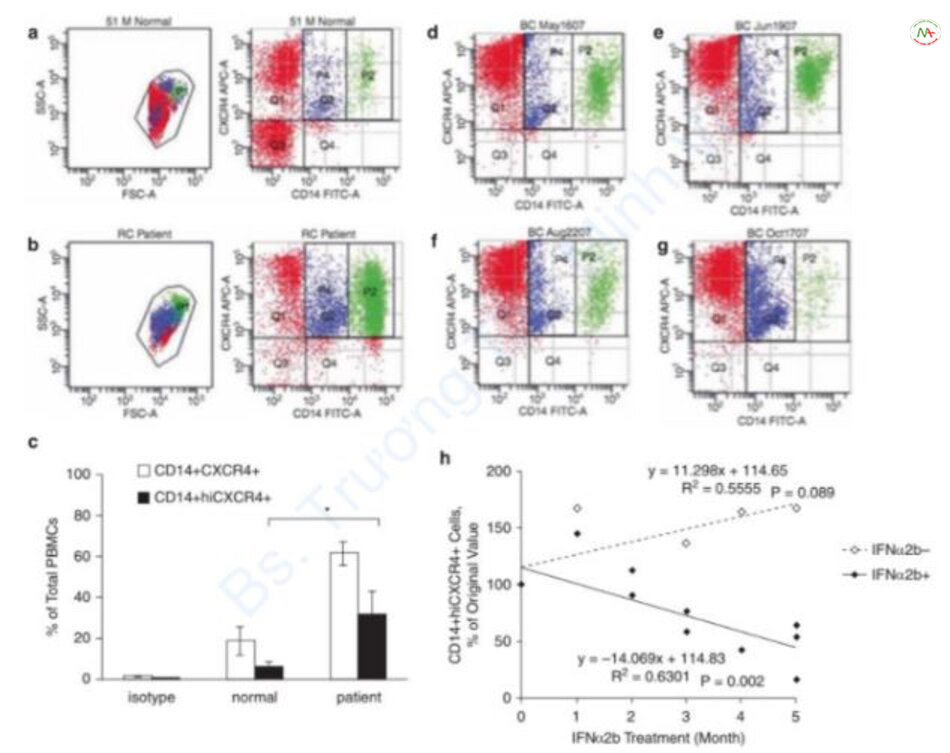
khi bắt đầu điều trị (d), 1 tháng sau điều trị (e), 3 tháng sau điều trị (f) và 5 tháng sau điều trị (g). Bệnh nhân dùng IFNα2b giảm CD14+ hiCXCR4+ tế bào theo thời gian so với những người không dùng (h).
MicroRNA (miR) trong sẹo phì đại
MicroRNA (miR) là các phân tử RNA không mã hóa, nội sinh, có khả năng điều hòa hoạt động biểu hiện của protein sau phiên mã. miR có liên quan đến việc lành thương sinh lý bình thường và hình thành sẹo phì đại. Một số miR có liên quan đến sự hình thành sẹo phì đại như miR-98, miR-29b, miR-185 và miR-145 [96–99]; tuy nhiên, chúng ta sẽ chỉ xem xét bốn miR và sự tham gia của chúng trong quá trình hình thành sẹo phì đại. miR-181b được xác định là một yếu tố pro-fibrotic [100]. Họ miR-181 bao gồm miR-181a, miR-181b, miR-181c và miR-181d. Kwan và cộng sự đã nghiên cứu các chất điều hòa miRs tiềm năng của sự biểu hiện decorin trong nguyên bào sợi ở sẹo phì đại và lớp bì sâu [100]. Mô từ những bệnh nhân bị bỏng và nguyên bào sợi ở da (bề mặt và sâu) từ những bệnh nhân đã qua phẫu thuật abdominoplasty được thu thập [100]. Sự biểu hiện decorin trong mô thu thập từ sẹo phì đại và lớp bì sâu ít hơn so với da bình thường và lớp bì nông, tương ứng với những phát hiện trước đó (Hình 3.9) [31, 33, 100]. Các tác giả suy đoán rằng những khác biệt này có thể là do quy định của miRs [100]. Các chất điều hòa miRs tiềm năng của sự biểu hiện decorin được thu hẹp còn miR-181b vì sự biểu hiện của nó cao ở lớp bì sâu và sự biểu hiện của miR-181b được điều chỉnh TGF-β1 ở cả nguyên bào sợi ở lớp bì nông và lớp bì sâu [100]. Phân tích biểu hiện của miR-181b cho thấy sự gia tăng ở cả mô sẹo phì đại và tế bào nguyên bào sợi ở lớp bì sâu so tương ứng với mô bình thường và nguyên bào sợi lớp bì nông [100]. Nguyên bào sợi lấy từ mô sẹo phì đại được xử lý bằng TGF-β1, giúp điều chỉnh sự biệt hóa nguyên bào sợi cơ và giảm sự biểu hiện decorin, và những tác động này được đảo ngược khi tế bào được điều trị bằng antagomiR-181b, một chất đối kháng miR-181b [100]. Những kết quả này hỗ trợ vai trò của miR-181b trong việc điều chỉnh decorin và hình thành sẹo [100]. Điều thú vị là, sự gia tăng biểu hiện của miR181a đã được chứng minh là có liên quan đến sự hình thành sẹo lồi [101].
![Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại 32 Hình 3.9 Sự biểu hiện của decorin được đánh giá bằng phương pháp miễn dịch huỳnh quang ở da bìnhthường (NS), sẹo phì đại (HTS), lớp bì nông và lớp bì sâu (a). Biểu hiện decorin giảm ở lớp bì sâu so với lớp bì nông trong các mẫu NS và trong HTS so với lớp bì nông bình thường (b) [100].](https://nhathuocngocanh.com/wp-content/uploads/2023/01/co-che-te-bao-va-phan-tu-cua-su-hinh-thanh-seo-phi-dai-anh-9.jpg)
Một miR khác được quan tâm là miR-200, bao gồm năm thành viên: miR-200a, miR-200b, miR-429, miR -200c và miR-141. Phân tích microarray của mô sẹo phì đại và nguyên bào sợi cũng cho thấy sự điều hòa giảm đáng kể của miR-200b [107]. Để xác định rằng miR-200b đóng một vai trò trong sự hình thành sẹo phì đại, một nghiên cứu chuyển gen với pre-miR-200b và anti-miR-200b đã được thực hiện [107]. Sự chuyển nạp với pre-miR200b thúc đẩy quá trình apoptosis tế bào và giảm sự tăng sinh bằng cách tăng caspase3và caspase8 trong khi điều chỉnh giảm tương ứng sựbiểu hiện của khángnguyên nhân tế bào tăng sinh (PCNA) và TGF-β1 [107]. Các tác động ngược lại đã được quan sát thấy khi các tế bào nguyên bào sợi phì đại được chuyển anti-miR-200b [107]. Hơn nữa, các đặc tính của sẹo phì đại, α-SMA, collagen loại I và fibronectin đã giảm sau khi chuyển gen pre-miR200b [107]. Sự biểu hiện TGF-β1 đã được chứng minh là điều chỉnh giảm miR-200 bằng cách điều chỉnh sự biểu hiện của yếu tố phiên mã kẽm E-box liên kết homeobox1 (zeb1) [104]. Nhìn chung, kết quả cho thấy miR-200 là một yếu tố chống xơ hóa (anti-fibrotic).
MiR-29b được xác định là một nhân tố có thể hình thành sẹo. MiR-29b được xác định là một ứng cử viên thông qua phân tích tính toán, và được chứng minh là điều chỉnh sự biểu hiện của collagen loại I [108]. Cheng và cộng sự đã xác định miR-29b là chất điều hòa nghịch của collagen, do đó sự gia tăng miR-29b dẫn đến giảm sản xuất collagen và ngược lại [108]. MiR-29b có thể điều chỉnh sản xuất collagen trong nguyên bào sợi thông qua quá trình sửa đổi sau phiên mã của protein sốc nhiệt (HSP) 47 [109]. HSP tham gia vào quá trình sinh tổng hợp protein và HSP47 tham gia vào quá trình sản xuất collagen [109, 110]. Zhu và cộng sự phát hiện ra rằng TGF-β1 ức chế miR-29b, dẫn đến sự gia tăng HSP47 và sau đó là collagen [109]. Ảnh hưởng của TGF-β1 trên HSP47 được trung gian thông qua con đường tín hiệu Smad [109], và vì TGF-β1 có thể làm giảm sự biểu hiện của miR-29b, các cytokine tiền viêm IL-1β và TNF-α có thể tăng sự biểu hiện của nó thông qua NF-κB [109]. Để ủng hộ miR-29b có vai trò anti-fibrotic, mô hình bỏng ở chuột được tiêm miR-29b làm giảm sự hình thành sẹo và tác dụng này có thể được điều chỉnh thông qua việc ức chế con đường tín hiệu TGF-β1 và sau đó là CTGF [99].
Các yếu tố tăng trưởng(Growth Factors) trong sẹo phì đại
TGF-β là yếu tố tăng trưởng pro-fibrotic được nghiên cứu nhiều nhất và được biết là đóng một vai trò quan trọng trong việc hình thành sẹo phì đại sau khi sinh và làm lành vết thương không sẹo ở thai nhi. Nó có ba đồng dạng: TGF-β1, TGF-β2 và TGF-β3 [111]. TGF-β1 và TGF-β2 có liên quan đến sự hình thành sẹo phì đại; trong khi đó, TGF-β3 được biểu hiện nhiều trong bào thai. TGF-β đầu tiên được tiết ra ở dạng tiền chất không hoạt động [111]. Dạng tiền chất là một phức hợp lớn bao gồm peptit liên kết tiềm ẩn (LAP) và protein liên kết TGF-β tiềm ẩn (LTBP), cùng nhau tạo thành phức hợp tiềm ẩn lớn (LLC) [111]. MMPs (MMP-2 và MMP-9), trong số các enzym khác, có thể tách TGF-β khỏi phức hợp này, giải phóng nó để liên kết với các thụ thể của nó [112]. TGF-β được giải phóng liên kết với hai thụ thể, TGFβRI và TGFβRII [111]. Sau khi liên kết, thụ thể được phosphoryl hóa tạo ra một dòng tín hiệu. Dòng thác tín hiệu này dẫn đến sự phosphoryl hóa các yếu tố phiên mã Smad 2 và 3 [111]. Smad 2/3 kết hợp với Smad 4, tạo thành phức hợp Smad 2/3/4 và bắt đầu phiên mã các gen pro-fibrotic như collagen loại I và III [111].
TGF-β điều chỉnh các khía cạnh của quá trình lành vết thương. Do đó, những xáo trộn trong biểu hiện hoặc tín hiệu TGF-β có thể dẫn đến sẹo. Nguyên bào sợi phì đại sản xuất TGF-β nhiều hơn đáng kể so với các tế bào nhóm chứng từ da bình thường cùng vị trí, dẫn đến điều hòa các yếu tố pro-fibrotic [113]. Wang và cộng sự đã đánh giá biểu hiện mRNA của TGF-β1 và thấy tăng biểu hiện gần gấp 5 lần ở sẹo phì đại so với da bình thường, và sự gia tăng này cũng được quan sát thấy ở các nguyên bào sợi lấy từ sẹo phì đại so với nguyên bào sợi bình thường [113]. Hơn nữa, các thụ thể TGFβRI và TGFβRII được thấy ở mức độ thấp trong nguyên bào sợi lớp bì của da bình thường; tuy nhiên, nguyên bào sợi sẹo phì đại biểu hiện mức độ cao của TβRI và TβRII [114]. Nhìn chung, có sự gia tăng biểu hiện mRNA, protein và thụ thể đối với TGF-β. TGF-β dẫn đến kích hoạt CTGF thông qua các con đường tín hiệu Smad và STAT [115, 116]. Sự biểu hiện CTGF cũng được kích thích bởi neuregulin-1, và thúc đẩy tăng sinh nguyên bào sợi và biệt hóa nguyên bào sợi cơ thông qua trung gian PI3K- hoặc Src và kích hoạt JAK1 và STAT1 [57, 117–120]. Mô sẹo có biểu hiện CTGF cao [119]. Do đó, việc phong bế sản xuất và tín hiệu TGF-β1 là một mục tiêu điều trị hấp dẫn. Sự ức chế con đường tín hiệu TGF-β đã được chứng minh là làm giảm sự hình thành sẹo phì đại [121]. Wang và cộng sự truyền TGFβRI siRNA vào nguyên bào sợi sẹo phì đại [122]. Điều này dẫn đến giảm sự tăng sinh của các nguyên bào sợi sẹo phì đại và sau đó là giảm sản xuất cả collagen và fibronectin [122]. Do đó, sự hình thành sẹo phì đại đã giảm sau khi ức chế TGFβRI [122]. Sự ức chế CTGF bằng cách cung cấp các oligo-nucleotide antisense trong mô hình sẹo phì đại ở thỏ dẫn đến giảm nguyên bào sợi, biểu hiện TIMP-1 và cả collagen loại I và III [123]. Nhìn chung, ức chế con đường TGF-β có thể làm giảm sự phát triển của sẹo.
VEGF (VEGF-A), một yếu tố tăng trưởng tiền tạo mạch (pro-angiogenic), có liên quan đến sẹo phì đại vì một trong những đặc điểm của sẹo phì đại là tăng sinh mạch. VEGF tham gia vào quá trình hình thành mạch kích thích, chủ yếu trong giai đoạn tăng sinh, và được tiết ra bởi một số loại tế bào khác nhau, bao gồm nguyên bào sợi, đại thực bào và tế bào nội mô [7]. VEGF cũng làm tăng tính thấm của mạch máu và thu nhận các tế bào viêm nhiễm đến vị trí tổn thương [124, 125]. Sự gia tăng hình thành mạch máu cung cấp oxy và chất dinh dưỡng cho các tế bào trao đổi chất cao đang trải qua quá trình tăng sinh, di chuyển và biệt hóa. Trong quá trình lành vết thương, mật độ mạch máu cao được quan sát thấy trong quá trình hình thành mô hạt, cuối cùng sẽ thoái triển khi vết thương trưởng thành. VEGF liên kết với các thụ thể VEGF là VEGF-1 và VEGF-2, dẫn đến một dòng tín hiệu dưới dòng. VEGF cũng có thể liên kết với một thụ thể hòa tan, sVEGFR-1, một chất điều hòa nghịch của quá trình hình thành mạch. Sự biểu hiện và tín hiệu VEGF không được kiểm soát có thể góp phần hình thành sẹo phì đại vì VEGF làm tăng sự hình thành mạch, thu nhận các tế bào viêm và hỗ trợ cung cấp oxy và chất dinh dưỡng để duy trì sự trao đổi chất của tế bào. Kwak và cộng sự đã khảo sát liệu sự ức chế VEGF bằng kháng thể đơn dòng, bevacizumab, có làm giảm sẹo phì đại hay không [126]. Sử dụng mô hình vết thương trên tai ở thỏ trắng New Zealand, tác giả nhận thấy ít ban đỏ hơn, độ dày sẹo giảm và ít khối collagen hơn [126]. Mức protein của VEGF và số lượng mạch giảm ở các nhóm điều trị, cho thấy rằng việc giảm VEGF có thể làm giảm sự hình thành sẹo phì đại [126]. Hơn nữa, để khẳng định vai trò của VEGF trong việc hình thành sẹo, các nghiên cứu về việc lành vết thương ở thai nhi cho thấy mức độ thấp của VEGF trong quá trình lành thương không sẹo và việc bổ sung VEGF dẫn đến hình thành sẹo [127].
PDGF liên quan đến nhiều khía cạnh của sẹo phì đại như thúc đẩy điều hòa hóa học, tăng sinh tế bào và sản xuất collagen. Có năm dạng đồng dạng của PDGF, AA, AB, BB, CC và DD. PDGF có thể kích thích con đường cyclooxygenase-2 và PI3K / JNK. PDGF làm trung gian cho các tác động của nó bằng cách liên kết với các thụ thể tyrosine kinase được gọi là PDGF-αR và -βR. Bằng cách liên kết với thụ thể, nó kích hoạt yếu tố phiên mã kinase điều hòa tín hiệu ngoại bào (ERK). PDGF cũng tham gia vào quá trình sản xuất osteopontin bởi đại thực bào, giúp thúc đẩy quá trình điều hòa hóa học, gắn kết collagen và biệt hóa nguyên bào sợi cơ [128]. Do đó, PDGF có thể đóng một vai trò nào đó trong sẹo phì đại vì nó được giải phóng từ tiểu cầu và ban đầu hoạt động như một chất hóa ứng động đối với bạch cầu đơn nhân và nguyên bào sợi, cũng như điều chỉnh sự tăng sinh nguyên bào sợi và sản xuất collagen sau đó.
Yếu tố tăng trưởng biểu bì (EGF) liên kết với thụ thể yếu tố tăng trưởng biểu bì (EGFR), dẫn đến quá trình phosphoryl hóa thành phần nội bào của thụ thể bởi protein tyrosine kinase. EGF đã được chứng minh là tham gia vào quá trình tái cấu trúc ECM bằng cách điều chỉnh sự biểu hiện MMP-1 thông qua ERK, JNK và p38 [57, 129]. Yếu tố tăng trưởng nguyên bào sợi cơ bản (bFGF) là một thành viên của họ FGF và có thể tham gia vào quá trình hình thành sẹo phì đại [130]. bFGF đã được chứng minh là anti-fibrotic, vì quản lý yếu tố tăng trưởng làm giảm sự hình thành sẹo và giảm biểu hiện của các yếu tố tạo xơ α-SMA, collagen, fibronectin và TIMP-1 thông qua con đường TGF-β1/Smad [131] . FGF cũng đã được chứng minh là làm tăng sự biểu hiện của enzym phân giải protein MMP-1 thông qua việc kích hoạt con đường tín hiệu ERK và JNK [132]. Nhìn chung, FGF có thể là một can thiệp điều trị tiềm năng để ngăn ngừa sẹo phì đại.
Mô hình người và động vật trong nghiên cứu cơ chế hình thành sẹo
Cơ chế của sẹo phì đại rất khó nghiên cứu ở bệnh nhân là con người. Các mô hình động vật sẽ tạo cơ hội để nghiên cứu những thay đổi theo thời gian và không gian của quá trình hình thành sẹo phì đại [133]. Mô hình sẹo phì đại của chuột ban đầu được thiết lập bởi Yang et al. [134]. Phòng thí nghiệm của chúng tôi đã nghiên cứu một mô hình điều chỉnh tạo xơ ở da chuột có những thay đổi về hình thái và tế bào đại diện cho sẹo phì đại ở người. Một cách ngắn gọn, da người có độ dày đầy đủ và độ dày tách lớp được ghép vào lưng của những con chuột nude [135]. Những con chuột nude là những con chuột khỏe mạnh, và do đó, việc thiếu tế bào T sẽ ngăn cản sự đào thải mô người.
Wang và cộng sự đã đánh giá miếng ghép da người có độ dày đầy đủ và độ dày tách lớp trên chuột nude và cơ chế liên quan đến sự hình thành sẹo phì đại [133]. Một tháng sau ghép, cả hai mô ghép đều cứng lại, lớp trên cùng (lớp biểu bì và lớp bì nông) bong ra, và phần da ghép còn lại trở nên sưng, đỏ và nhô cao [133]. Đến 4 tháng sau ghép, sẹo dày lên, sau đó bắt đầu thoái triển từ từ (Hình 3.10) [133]. Cả mảnh ghép có độ dày đầy đủ và độ dày tách lớp đều làm tăng sự lắng đọng collagen, mạch máu, tế bào mast, tế bào sợi, đại thực bào và nguyên bào sợi cơ [133]. Mức mRNA của COL1α1 và HSP 47 cũng được tăng cao sau khi ghép, cả hai đều đạt đỉnh vào 2 tháng sau khi ghép và giảm sau đó [133]. Cả nồng độ mRNA và protein của TGF-β1 và CTGF cũng đều tăng ở cả da ghép có độ dày đầy đủ và độ dày tách lớp [133]. Trong nghiên cứu này, cả da có độ dày đầy đủ và độ dày tách lớp được ghép vào chuột nude gây ra sẹo phì đại rất giống với da đã thấy ở người [133]. Đặc tính kỹ hơn của mô hình độ dày tách lớp cũng cho thấy rằng sẹo phì đại hình thành mà không có cả cấu trúc phần phụ và nang lông và mất móc rete, cũng như giảm sản xuất decorin và biglycan cao hơn ở 30 và 60 ngày sau khi ghép [ 136]. Hơn nữa, những thay đổi trong proteoglycan đã bị đảo ngược sau 180 ngày sau khi ghép, điều này cho thấy quá trình sửa chữa và trưởng thành [136]. Khả năng sống sót của các tế bào người trong mảnhghép da lên đến 180 ngàysau khi ghép được xác nhận với nhuộm huỳnh quang miễn dịch HLA-ABC [136].
![Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại 33 Hình 3.10 Cả mảnh ghép da người có độ dày đầy đủ (FTSG) và độ dày tách lớp (STSG) đều được ghépvào lưng của con chuột nude và sự tiến triển của sự hình thành sẹo được ghi lại vào thời điểm 1 tháng, 2 tháng, 4 tháng và 7 tháng sau ghép (a). Mảnh da chuột cũng được ghép tuy nhiên không hình thành sẹo (b) [133].](https://nhathuocngocanh.com/wp-content/uploads/2023/01/co-che-te-bao-va-phan-tu-cua-su-hinh-thanh-seo-phi-dai-anh-10.jpg)
Để khắc phục những hạn chế này trên mô hình động vật, mô hình vết rách trên da người là một mô hình khác có thể được sử dụng để đánh giá sinh lý bệnh và ảnh hưởng của các can thiệp điều trị (Hình 3.12). Các vết thương tuyến tính được tạo trên hông bắt đầu chỉ là nông và dần dần sâu hơn, dẫn đến sẹo phì đại. Như đã đề cập, vết thương ở người sâu hơn 0,5 mm có thể dẫn đến hình thành sẹo phì đại, như đã được quan sát thấy ở bên hông [9]. Ưu điểm của việc sử dụng mô hình rách da ở người là: cả sẹo trưởng thành và sẹo phì đại trong vùng nông và vùng sâu của cùng một vết thương đều được tạo ra, có thể tái tạo và nhất quán, và có thể tạo vết thương ở mỗi bên hông để kiểm tra hiệu quả của thuốc và giả dược, do đó làm giảm sự khác biệt giữa các cá thể. Nhìn chung, để hiểu đầy đủ về cơ chế bệnh sinh của việc tạo xơ ở da người, mô hình động vật và con người là cần thiết. Việc sử dụng cả hai mô hình có thể hỗ trợ và nâng cao hiểu biết của chúng ta về tạo xơ ở da người. Hơn nữa, hiểu được cơ chế bệnh sinh của sẹo phì đại sẽ hỗ trợ việc phát triển các can thiệp điều trị tiềm năng.
![Cơ chế tế bào và phân tử của sự hình thành sẹo phì đại 34 Hình 3.11 Một mô hình chuột có sẹo trên da đã được điều chỉnh. Các mảnh ghép da người có độ dàyđầy đủ (FTSG) với một vết thương sâu đã được cấy ghép lên những con chuột nude, được lấy từ mô da người có sắc tố. Da được ghép sống sót và phát triển sẹo phì đại với các đặc điểm hình thái và tế bào tương tự như sẹo phì đại của người ở thời điểm sau ghép 2 tuần và 1 năm [137]. Điều này cung cấp bằng chứng cho thấy mô da người có thể tồn tại trong mô hình chuột đến một năm.](https://nhathuocngocanh.com/wp-content/uploads/2023/01/co-che-te-bao-va-phan-tu-cua-su-hinh-thanh-seo-phi-dai-anh-11.jpg)
Kết luận
Sẹo phì đại là một quá trình phức tạp và biến động, liên quan đến một số tế bào khác nhau và các con đường tín hiệu xuôi dòng được điều chỉnh theo thời gian và không gian. Các cơ chế của sẹo phức tạp hơn với các bệnh đi kèm như bệnh tiểu đường. Hơn nữa, các mô hình in vitro và in vivo của sẹo và quá trình lành vết thương có thể không hoàn toàn giống với tình trạng của con người. Do đó, những nghiên cứu sâu hơn về con đường tế bào và phân tử của sẹo và sự khác biệt giữa các loài có thể cung cấp hiểu biết sâu hơn về sự hình thành sẹo và lành thương, từ đó cho phép phát triển các phương pháp điều trị hiệu quả.
Tài liệu tham khảo
- Soo C, Beanes SR, Hu FY, Zhang X, Dang C, Chang G, et al. Ontogenetic transition in fetal wound transforming growth factor-beta regulation correlates with collagen organization. Am J Pathol. 2003;163(6):2459–76.
- Liechty KW, Kim HB, Adzick NS, Crombleholme TM. Fetal wound repair results in scar formation in interleukin-10-deficient mice in a syngeneic murine model of scarless fetal wound repair. J Pediatr Surg. 2000;35(6):866–72. discussion 872-3.
- Tredget EE, Levi B, Donelan MB. Biology and principles of scar management and burn reconstruction. Surg Clin North Am. 2014;94(4):793–815.
- Robson MC, Steed DL, Franz MG. Wound healing: biologic features and approaches to maximize healing trajectories. Curr Probl Surg. 2001;38(2):A1–140.
- Zhu Z, Ding J, Tredget EE. The molecular basis of hypertrophic scars. Burns Trauma. 2016;4:2-015-0026-4. eCollection 2016.
- Fadok VA, Bratton DL, Konowal A, Freed PW, Westcott JY, Henson PM. Macrophages that have ingested apoptotic cells in vitro inhibit proinflammatory cytokine production through autocrine/paracrine mechanisms involving TGF-beta, PGE2, and PAF. J Clin Invest. 1998;101(4):890–8.
- Bao P, Kodra A, Tomic-Canic M, Golinko MS, Ehrlich HP, Brem H. The role of vascular endothelial growth factor in wound healing. J Surg Res. 2009;153(2):347–58.
- Santoro MM, Gaudino G. Cellular and molecular facets of keratinocyte reepithelization during wound healing. Exp Cell Res. 2005;304(1):274–86.
- Dunkin CS, Pleat JM, Gillespie PH, Tyler MP, Roberts AH, McGrouther DA. Scarring occurs at a critical depth of skin injury: precise measurement in a graduated dermal scratch in human volunteers. Plast Reconstr Surg. 2007;119(6):1722–32. Discussion 1733-4.
- Honardoust D, Varkey M, Marcoux Y, Shankowsky HA, Tredget EE. Reduced decorin, fibromodulin, and transforming growth factor-beta3 in deep dermis leads to hypertrophic scarring. J BurnCare Res. 2012;33(2):218–27.
- Kwan P, Hori K, Ding J, Tredget EE. Scar and contracture: biological principles. Hand Clin. 2009;25(4):511–28.
- Tredget EE. Pathophysiology and treatment of fibroproliferative disorders following thermal injury. Ann N Y Acad Sci. 1999;888:165–82.
- Rowan MP, Cancio LC, Elster EA, Burmeister DM, Rose LF, Natesan S, et al. Burn wound healing and treatment: review and advancements. Crit Care. 2015;19:243-015-0961-2.
- Armour A, Scott PG, Tredget EE. Cellular and molecular pathology of HTS: basis for treatment. Wound Repair Regend. 2007;15(Suppl 1):S6–17.
- Verhaegen PD, van Zuijlen PP, Pennings NM, van Marle J, Niessen FB, van der Horst CM, et al. Differences in collagen architecture between keloid, hypertrophic scar, normotrophic scar, and normal skin: an objective histopathological analysis. Wound Repair Regen. 2009;17(5):649–56.
- Linares HA, Kischer CW, Dobrkovsky M, Larson DL. The histiotypic organization of the hypertrophic scar in humans. J Invest Dermatol. 1972;59(4):323–31.
- Limandjaja GC, van den Broek LJ, Waaijman T, van Veen HA, Everts V, Monstrey S, et al. Increased epidermal thickness and abnormal epidermal differentiation in keloid scars. Br J Dermatol. 2017;176(1):116–26.
- Oliveira GV, Hawkins HK, Chinkes D, Burke A, Tavares AL, Ramos-e-Silva M, et al. Hypertrophic versus non hypertrophic scars compared by immunohistochemistry and laser confocal microscopy: type I and III collagens. Int Wound J. 2009;6(6):445–52.
- Bailey AJ, Bazin S, Sims TJ, Le Lous M, Nicoletis C, Delaunay A. Characterization of the collagen of human hypertrophic and normal scars. Biochim Biophys Acta. 1975;405(2):412–21.
- Hayakawa T, Hashimoto Y, Myokei Y, Aoyama H, Izawa Y. Changes in type of collagen during the development of human post-burn hypertrophic scars. Clin Chim Acta. 1979;93(1):119–25.
- Ulrich D, Ulrich F, Unglaub F, Piatkowski A, Pallua N. Matrix metalloproteinases and tissue inhibitors of metalloproteinases in patients with different types of scars and keloids. J Plast Reconstr Aesthet Surg. 2010;63(6):1015–21.
- SimonF, Bergeron D, Larochelle S, Lopez-Valle CA, Genest H, Armour A, et al. Enhanced secretion of TIMP-1 by human hypertrophic scar keratinocytes could contribute to fibrosis. Burns. 2012;38(3):421–7.
- Dasu MR, Hawkins HK, Barrow RE, Xue H, Herndon DN. Gene expression profiles from hypertrophic scar fibroblasts before and after IL-6 stimulation. J Pathol. 2004;202(4):476–85.
- Ghahary A, Shen YJ, Nedelec B, Wang R, Scott PG, Tredget EE. Collagenase production is lower in post-burn hypertrophic scar fibroblasts than in normal fibroblasts and is reduced by insulin-like growth factor-1. J Invest Dermatol. 1996;106(3):476–81.
- Ghahary A, Shen YJ, Nedelec B, Scott PG, Tredget EE. Enhanced expression of mRNA for insulin-like growth factor-1 in post-burn hypertrophic scar tissue and its fibrogenic role by dermal fibroblasts. Mol Cell Biochem. 1995;148(1):25–32.
- Amadeu TP, Braune AS, Porto LC, Desmouliere A, Costa AM. Fibrillin-1 and elastin are differentially expressed in hypertrophic scars and keloids. Wound Repair Regen. 2004;12(2):169– 74.
- Bhangoo KS, Quinlivan JK, Connelly JR. Elastin fibers in scar tissue. Plast Reconstr Surg. 1976;57(3):308–13.
- Schilling JA. Wound healing. Surg Clin North Am.1976;56(4):859–74.
- Papakonstantinou E, Roth M, Karakiulakis G. Hyaluronic acid: a key molecule in skin aging. Dermatoendocrinol. 2012;4(3):253–8.
- Honardoust D, Varkey M, Hori K, Ding J, Shankowsky HA, Tredget EE. Small leucine-rich proteoglycans, decorin and fibro-modulin, arereduced in postburn hypertrophic scar. Wound Repair Regen. 2011;19(3):368–78.
- Scott PG, Dodd CM, Ghahary A, Shen YJ, Tredget EE. Fibroblasts from post-burn hypertrophic scar tissue synthesize less decorin than normal dermal fibroblasts. Clin Sci (Lond). 1998;94(5):541–7.
- Sayani K, Dodd CM, Nedelec B, Shen YJ, Ghahary A, Tredget EE, et al. Delayed appearance of decorin in healing burn scars. Histopathology. 2000;36(3):262–72.
- Wang J, Dodd C, Shankowsky HA, Scott PG, Tredget EE, Wound Healing Research Group. Deep dermal fibroblasts contribute to hypertrophic scarring. Lab Invest. 2008;88(12):1278–90.
- Honardoust D, Ding J, Varkey M, Shankowsky HA, Tredget EE. Deep dermal fibroblasts refractory to migration and decorin-induced apoptosis contribute to hypertrophic scarring. J Burn Care Res. 2012;33(5):668–77.
- Kwan PO, Ding J, Tredget EE. Serum decorin, IL-1beta, and TGF-beta predict hypertrophic scarring postburn. J Burn Care Res. 2015;37:356–66.
- Ding J, Hori K, Zhang R, Marcoux Y, Honardoust D, Shankowsky HA, et al. Stromal cell-derived factor 1 (SDF-1) and its receptor CXCR4 in the formation of postburn hypertrophic scar (HTS). Wound Repair Regen. 2011;19(5):568–78.
- Ding J, Ma Z, Liu H, Kwan P, Iwashina T, Shankowsky HA, et al. The therapeutic potential of a C-X-C chemokine receptor type 4 (CXCR-4) antagonist on hypertrophic scarring in vivo. Wound Repair Regen. 2014;22(5):622–30.
- Liu H, Ding J, Ma Z, Zhu Z, Shankowsky HA, Tredget EE. A novel subpopulation of peripheral blood mononuclear cells presents in major burn patients. Burns. 2015;41(5):998–1007.
- Deshmane SL, Kremlev S, Amini S, Sawaya BE. Monocyte chemoattractant protein-1 (MCP-1): an overview. J Interferon Cytokine Res. 2009;29(6):313–26.
- Nakazawa D, Shida H, Kusunoki Y, Miyoshi A, Nishio S, Tomaru U, et al. The responses of macrophages in interaction with neutrophils that undergo NETosis. J Autoimmun. 2016;67:19–28.
- Selders GS, Fetz AE, Radic MZ, Bowlin GL. An overview of the role of neutrophils in innate immunity, inflammation and host-biomaterial integration. Regen Biomater. 2017;4(1):55–68.
- Zhang J, Zhou Q, Yuan G, Dong M, Shi W. Notch signaling regulates M2 type macrophage polarization during the development of proliferative vitreoretinopathy. Cell Immunol. 2015;298(1– 2):77–82.
- Ferrante CJ, Pinhal-Enfield G, Elson G, Cronstein BN, Hasko G, Outram S, et al. The adenosine-dependent angiogenic switch of macrophages to an M2-like phenotype is independent of interleukin-4 receptor alpha (IL-4Ralpha) signaling. Inflammation. 2013;36(4):921–31.
- Ferrante CJ, Leibovich SJ. Regulation of macrophage polarization and wound healing. Adv Wound Care (New Rochelle).2012;1(1):10–6.
- Braga TT, Agudelo JS, Camara NO. Macrophages during the fibrotic process: M2 as friend and foe. Front Immunol. 2015;6:602.
- Zhu Z, Ding J, Ma Z, Iwashina T, Tredget EE. The natural behavior of mononuclear phagocytes in HTS formation. Wound Repair Regen. 2016;24(1):14–25.
- Zhu Z, Ding J, Ma Z, Iwashina T, Tredget EE. Systemic depletion of macrophages in the subacute phase of wound healing reduces hypertrophic scar formation. Wound Repair Regen. 2016;24(4):644–56.
- Zhu Z, Ding J, Ma Z, Iwashina T, Tredget EE. Alternatively activated macrophages derived from THP-1 cells promote the fibrogenic activities of human dermal fibroblasts. Wound Repair Regen. 2017;25:377–88.
- Kryczka J, Boncela J. Leukocytes: the double-edged sword in fibrosis. Mediators Inflamm. 2015;2015:652035.
- Castagnoli C, Trombotto C, Ondei S, Stella M, Calcagni M, Magliacani G, et al. Characterization of T-cell subsets infiltrating post-burn hypertrophic scar tissues. Burns. 1997;23(7):565–72.
- Bernabei P, Rigamonti L, Ariotti S, Stella M, Castagnoli C, Novelli F. Functional analysis of T lymphocytes infiltrating the dermis and epidermis of post-burn hypertrophic scar tissues. Burns. 1999;25(1):43–8.
- Wang J, Jiao H, Stewart TL, Shankowsky HA, Scott PG, Tredget EE. Increased TGF-beta-producing CD4+ T lymphocytes in post-burn patients and their potential interaction with dermal fibroblasts in hypertrophic scarring. Wound Repair Regen. 2007;15(4):530–9.
- Wang JF, Jiao H, Stewart TL, Shankowsky HA, Scott PG, Tredget EE. Fibrocytes from burn patients regulate the activities of fibroblasts. Wound Repair Regen. 2007;15(1):113–21.
- Yang L, Scott PG, Giuffre J, Shankowsky HA, Ghahary A, Tredget EE. Peripheral blood fibrocytes from burn patients: identification and quantification of fibrocytes in adherent cells cultured from peripheral blood mononuclear cells. Lab Invest. 2002;82(9):1183–92.
- Yang L, Scott PG, Dodd C, Medina A, Jiao H, Shankowsky HA, et al. Identification of fibrocytes in postburn hypertrophic scar. Wound Repair Regen. 2005;13(4):398–404.
- Linge C, Richardson J, Vigor C, Clayton E, Hardas B, Rolfe KJ. Hypertrophic scar cells fail to undergo a form of apoptosis specific to contractile collagen—the role of tissue transglutaminase. J Invest Dermatol. 2005;125(1):72–82.
- Lian N, Li T. Growth factor pathways in hypertrophic scars: molecular pathogenesis and therapeutic implications. Biomed Pharmacother. 2016;84:42–50.
- Kirfel G, Rigort A, Borm B, Schulte C, Herzog V. Structural and compositional analysis of the keratinocyte migration track. Cell Motil Cytoskeleton. 2003;55(1):1–13.
- Clark RA, Lin F, Greiling D, An J, Couchman JR. Fibroblast invasive migration into fibronectin/fibrin gels requires a previously uncharacterized dermatan sulfate-CD44 proteoglycan. J Invest Dermatol. 2004;122(2):266–77.
- Ding J, Ma Z, Shankowsky HA, Medina A, Tredget EE. Deep dermal fibroblast profibrotic characteristics are enhanced by bone marrow-derived mesenchymal stem cells. Wound Repair Regen. 2013;21(3):448–55.
- Ding J, Tredget EE. The role of chemokines in fibrotic wound healing. Adv Wound Care (New Rochelle). 2015;4(11):673–86.
- Geissmann F, Jung S, Littman DR. Blood monocytes consist of two principal subsets with distinct migratory properties. Immunity. 2003;19(1):71–82.
- Willenborg S, Lucas T, van Loo G, Knipper JA, Krieg T, Haase I, et al. CCR2 recruits an inflammatory macrophage sub-population critical for angiogenesis in tissue repair. Blood. 2012;120(3):613–25.
- Low QEH, Drugea IA, Duffner LA, Quinn DG, Cook DN, Rollins BJ, et al. Wound Healing in MIP-1α−/− and MCP-1−/− Mice. Am J Pathol. 2001;159(2):457–63.
- Ferreira AM, Takagawa S, Fresco R, Zhu X, Varga J, DiPietro LA. Diminished induction of skin fibrosis in mice with MCP-1 deficiency. Journal of Investigative Dermatology. 2006;126(8):1900– 8.
- Ekert JE, Murray LA, Das AM, Sheng H, Giles-Komar J, Rycyzyn MA. Chemokine (C-C motif) ligand 2 mediates direct and indirect fibrotic responses in human and murine cultured fibrocytes. Fibrogenesis Tissue Repair. 2011;4(1):23. -1536-4-23.
- Liao WT, Yu HS, Arbiser JL, Hong CH, Govindarajan B, Chai CY, et al. Enhanced MCP-1 release by keloid CD14+cells augments fibroblast proliferation: roleof MCP-1 and Akt pathway in keloids. Exp Dermatol. 2010;19(8):e142–50.
- Bodnar RJ, Yates CC, Wells A. IP-10 blocks vascular endothelial growth factor-induced endothelial cell motility and tube formation via inhibition of calpain. Circ Res. 2006;98(5):617–25.
- Yates CC, Krishna P, Whaley D, Bodnar R, Turner T, Wells A. Lack of CXC chemokine receptor 3 signaling leads to hypertrophic and hypercellular scarring. Am J Pathol. 2010;176(4):1743–55.
- Satish L, Blair HC, Glading A, Wells A. Interferon-inducible protein 9 (CXCL11)-induced cell motility in keratinocytes requires calcium flux-dependent activation of mu-calpain. Mol Cell Biol. 2005;25(5):1922–41.
- Yates CC, Whaley D, Kulasekeran P, Hancock WW, Lu B, Bodnar R, et al. Delayed and deficient dermal maturation in mice lacking the CXCR3 ELR-negative CXC chemokine receptor. Am J Pathol. 2007;171(2):484–95.
- Ishida Y, Gao JL, Murphy PM. Chemokine receptor CX3CR1 mediates skin wound healing by promoting macrophage and fibroblast accumulation and function. J Immunol. 2008;180(1):569–79.
- Clover AJ, Kumar AH, Caplice NM. Deficiency of CX3CR1 delays burn wound healing and is associated with reduced myeloid cell recruitment and decreased sub-dermal angiogenesis. Burns. 2011;37(8):1386–93.
- Robertson FM, Pellegrini AE, Ross MS, Oberyszyn AS, Boros LG, Bijur GN, et al. Interleukin-1alpha gene expression during wound healing. Wound Repair Regen. 1995;3(4):473–84.
- Shephard P, Martin G, Smola-Hess S, Brunner G, Krieg T, Smola H. Myofibroblast differentiation is induced in keratinocyte -fibroblast co-cultures and is antagonistically regulated by endogenous transforming growth factor-β and interleukin-1. Am J Pathol. 2004;164(6):2055–66.
- Lu T, Tian L, Han Y, Vogelbaum M, Stark GR. Dose-dependent cross-talk between the transforming growth factor-beta and interleukin-1 signaling pathways. Proc Natl Acad Sci U S A. 2007;104(11):4365–70.
- Salgado RM, Alcantara L, Mendoza-Rodriguez CA, Cerbon M, Hidalgo-Gonzalez C, Mercadillo P, et al. Post-burn hypertrophic scars are characterized by high levels of IL-1beta mRNA and protein and TNF-alpha type I receptors. Burns. 2012;38(5):668–76.
- Niessen FB, Andriessen MP, Schalkwijk J, VisserL, TimensW. Keratinocyte-derived growth factors play a role in the formation of hypertrophic scars. J Pathol. 2001;194(2):207–16.
- Barrow RE, Dasu MR. Oxidative and heat stress gene changes in hypertrophic scar fibroblasts stimulated with interleukin-1beta. J Surg Res. 2005;126(1):59–65.
- Chaudhuri V, Zhou L, Karasek M. Inflammatory cytokines induce the transformation of human dermal microvascular endothelial cells into myofibroblasts: a potential role in skin fibrogenesis. J Cutan Pathol. 2007;34(2):146–53.
- Mia MM, Boersema M, Bank RA. Interleukin-1beta attenuates myofibroblast formation and extracellular matrix production in dermal and lung fibroblasts exposed to transforming growth factor-beta1. PLoS One. 2014;9(3):e91559.
- Bhogal RK, Bona CA. Regulatory effect of extracellular signal-regulated kinases (ERK) on type I collagen synthesis in human dermal fibroblasts stimulated by IL-4 and IL-13. Int Rev Immunol. 2008;27(6):472–96.
- Kilani RT, Delehanty M, Shankowsky HA, Ghahary A, Scott P, Tredget EE. Fluorescent-activated cell-sorting analysis of intra-cellular interferon-gamma and interleukin-4 in fresh and frozen human peripheral blood T-helper cells. Wound Repair Regen. 2005;13(4):441–9.
- Tredget EE, Yang L, Delehanty M, Shankowsky H, Scott PG. Polarized Th2 cytokine production in patients with hypertrophic scar following thermal injury. J Interferon Cytokine Res. 2006;26(3):179–89.
- Ray S, Ju X, Sun H, Finnerty CC, Herndon DN, Brasier AR. The IL-6 trans-signaling-STAT3 pathway mediates ECM and cellular proliferation in fibroblasts from hypertrophic scar. J Invest Dermatol. 2013;133(5):1212–20.
- Peranteau WH, Zhang L, Muvarak N, Badillo AT, Radu A, Zoltick PW, et al. IL-10 overexpression decreases inflammatory mediators and promotes regenerative healing in an adult model of scar formation. J Invest Dermatol. 2008;128(7):1852–60.
- Shi J, Li J, Guan H, Cai W, Bai X, Fang X, et al. Anti-fibrotic actions of interleukin-10 against hypertrophic scarring by activation of PI3K/AKT and STAT3 signaling pathways in scar-forming fibroblasts. PLoS One. 2014;9(5):e98228.
- Elliott CG, Forbes TL, Leask A, Hamilton DW. Inflammatory microenvironment and tumor necrosis factor alpha as modulators of periostin and CCN2 expression in human non-healing skin wounds and dermal fibroblasts. Matrix Biol. 2015;43:71–84.
- Goldberg MT, Han YP, Yan C, Shaw MC, Garner WL. TNF-alpha suppresses alpha-smooth muscle actin expression in human dermal fibroblasts: an implication for abnormal wound healing. J Invest Dermatol. 2007;127(11):2645–55.
- Harrop AR, Ghahary A, Scott PG, Forsyth N, Uji-Friedland RTA, Tredget EE. Regulation of collagen synthesis and mRNA3 Cellular and Molecular Mechanisms of Hypertrophic Scarring expression in normal and hypertrophic scar fibroblasts in vitro by interferon-γ. J Surg Res. 1995;58(5):471–7.
- Tredget EE, Shen YJ, Liu G, Forsyth N, Smith C, Robertson Harrop A, et al. Regulation of collagen synthesis and messenger RNA levels in normal and hypertrophic scar fibroblasts in vitro by interferon alfa-2b. Wound Repair Regen. 1993;1(3):156–65.
- Ghahary A, Shen YJ, Nedelec B, Scott PG, Tredget EE. Interferons gamma and alpha-2b differentially regulate the expression of collagenase and tissue inhibitor of metalloproteinase-1 messenger RNA in human hypertrophic and normal dermal fibroblasts. Wound Repair Regen. 1995;3(2):176–84.
- Wang J, Jiao H, Stewart TL, Shankowsky HA, Scott PG, Tredget EE. Improvement in postburn hypertrophic scar after treatment with IFN-alpha2b is associated with decreased fibrocytes. J Interferon Cytokine Res. 2007;27(11):921–30.
- Wang J, Chen H, Shankowsky HA, Scott PG, Tredget EE. Improved scar in postburn patients following interferon-alpha2b treatment is associated with decreased angiogenesis mediated by vascular endothelial cell growth factor. J Interferon Cytokine Res. 2008;28(7):423–34.
- Nedelec B, Shankowsky H, Scott PG, Ghahary A, Tredget EE. Myofibroblasts and apoptosis in human hypertrophic scars: the effect of interferon-α2b. Surgery. 2001;130(5):798–808.
- Bi S, Chai L, Yuan X, Cao C, Li S. MicroRNA-98 inhibits the cell proliferation of human hypertrophic scar fibroblasts via targeting Col1A1. Biol Res. 2017;50(1):22-017-0127-6.
- Gras C, Ratuszny D, Hadamitzky C, Zhang H, Blasczyk R, Figueiredo C. miR-145 Contributes to Hypertrophic Scarring of the Skin by Inducing Myofibroblast Activity. Mol Med. 2015;21:296– 304.
- Xiao K, Luo X, Wang X, Gao Z. MicroRNA185 regulates transforming growth factorbeta1 and collagen1 in hypertrophic scar fibroblasts. Mol Med Rep. 2017;15(4):1489–96.
- Guo J, Lin Q, Shao Y, Rong L, Zhang D. miR-29b promotes skin wound healing and reduces excessive scar formation by inhibition of the TGF-beta1/Smad/CTGF signaling pathway. Can J Physiol Pharmacol. 2017;95(4):437–42.
- Kwan P, Ding J, Tredget EE. MicroRNA 181b regulates decorin production by dermal fibroblasts and may be a potential therapy for hypertrophic scar. PLoS One. 2015;10(4):e0123054.
- Rang Z, Wang ZY, Pang QY, Wang YW, Yang G, Cui F. MiR-181a Targets PHLPP2 to Augment AKT Signaling and RegulateProliferation and Apoptosis in Human Keloid Fibroblasts. Cell Physiol Biochem. 2016;40(3–4):796–806.
- Guo L, Xu K, Yan H, Feng H, Wang T, Chai L, et al. MicroRNA expression signature and the therapeutic effect of the microRNA21 antagomir in hypertrophic scarring. Mol Med Rep. 2017;15(3):1211–21.
- Zhu HY, Li C, Bai WD, Su LL, Liu JQ, Li Y, et al. MicroRNA-21 regulates hTERT via PTEN in hypertrophic scar fibroblasts. PloS One. 2014;9(5):e97114.
- Zhou R, Zhang Q, Zhang Y, Fu S, Wang C. Aberrant miR-21 and miR-200b expression and its pro-fibrotic potential in hypertrophic scars. Exp Cell Res. 2015;339(2):360–6.
- Liu Y, Li Y, Li N, Teng W, Wang M, Zhang Y, et al. TGF-beta1 promotes scar fibroblasts proliferation and transdifferentiation via up-regulating MicroRNA-21. Sci Rep. 2016;6:32,231.
- Li G, Zhou R, Zhang Q, Jiang B, Wu Q, Wang C. Fibroproliferative effect of microRNA-21 in hypertrophic scar derived fibroblasts. Exp Cell Res. 2016;345(1):93–9.
- Li P, He QY, Luo CQ. Overexpression of miR-200b inhibits the cell proliferation and promotes apoptosis of human hypertrophic scar fibroblasts in vitro. J Dermatol. 2014;41(10):903–11.
- Cheng J, Wang Y, Wang D, Wu Y. Identification of collagen 1 as a post-transcriptional target of miR-29b in skin fibroblasts: therapeutic implication for scar reduction. Am J Med Sci. 2013;346(2):98–103.
- Zhu Y, Li Z, Wang Y, Li L, Wang D, Zhang W, et al. Overexpression of miR-29b reduces collagen biosynthesis by inhibiting heat shock protein 47 during skin wound healing. Transl Res. 2016;178: 38–53.e6.
- Nagata K. Expression and function of heat shock protein 47: a collagen-specific molecular chaperone in the endoplasmic reticulum. Matrix Biol. 1998;16(7):379–86.
- Penn JW, Grobbelaar AO, Rolfe KJ. The role of the TGF-beta family in wound healing, burns and scarring: a review. Int J Burns Trauma. 2012;2(1):18–28.
- Yu Q, Stamenkovic I. Cell surface-localized matrix metallopro-teinase-9 proteolytically activates TGF-beta and promotes tumor invasion and angiogenesis. Genes Dev. 2000;14(2):163–76.
- Wang R, Ghahary A, Shen Q, Scott PG, Roy K, Tredget EE. Hypertrophic scar tissues and fibroblasts produce more transforming growth factor-beta1 mRNA and protein than normal skin and cells. Wound Repair Regen. 2000;8(2):128–37.
- Schmid P, Itin P, Cherry G, Bi C, Cox DA. Enhanced expression of transforming growth factor-beta type I and type II receptors in wound granulation tissue and hypertrophic scar. Am J Pathol. 1998;152(2):485–93.
- Liu Y, Liu H, Meyer C, Li J, Nadalin S, Konigsrainer A, et al. Transforming growth factor-beta (TGF-beta)-mediated connective tissue growth factor (CTGF) expression in hepatic stellate cells requires Stat3 signaling activation. J Biol Chem. 2013;288(42):30,708–19.
- Tang LY, Heller M, Meng Z, Yu LR, Tang Y, Zhou M, et al. Transforming growth factor-beta (TGF-beta) directly activates the JAK1-STAT3 axis to induce hepatic fibrosis in coordination with the SMAD pathway. J Biol Chem. 2017;292(10):4302–12.
- Tao L, Liu J, Li Z, Dai X, Li S. Role of the JAK-STAT pathway in proliferation and differentiation of human hypertrophic scar fibroblasts induced by connective tissue growth factor. Mol Med Rep. 2010;3(6):941–5.
- Kim JS, Choi IG, Lee BC, Park JB, Kim JH, Jeong JH, et al. Neuregulin induces CTGF expression in hypertrophic scarring fibroblasts. Mol Cell Biochem. 2012;365(1-2):181–9.
- Colwell AS, Phan TT, Kong W, Longaker MT, Lorenz PH. Hypertrophic scar fibroblasts have increased connective tissue growth factor expression after transforming growth factor-beta stimulation. Plast Reconstr Surg. 2005;116(5):1387–90. discussion 1391-2.
- Hu X, Li N, Tao K, Fang X, Liu J, Wang Y, et al. Effects of integrin alphanubeta3 on differentiation and collagen synthesis induced by connective tissue growth factor in human hypertrophic scar fibroblasts. Int J Mol Med. 2014;34(5):1323–34.
- Bai X, He T, Liu J, Wang Y, Fan L, Tao K, et al. Loureirin B inhibits fibroblast proliferation and extracellular matrix deposition in hypertrophic scar via TGF-beta/Smad pathway. Exp Dermatol. 2015;24(5):355–60.
- Wang Y, Liou N, Cherng J, Chang S, Ma K, Fu E, et al. siRNA-targeting transforming growth factor-β type I receptor reduces wound scarring and extracellular matrix deposition of scar tissue. Journal of Investigative Dermatology. 2014;134(7):2016–25.
- Sisco M, Kryger ZB, O’Shaughnessy KD, Kim PS, Schultz GS, Ding XZ, et al. Antisense inhibition of connective tissue growth factor (CTGF/CCN2) mRNA limits hypertrophic scarring with- out affecting wound healing in vivo. Wound Repair Regen. 2008;16(5):661–73.
- Bates DO. Vascular endothelial growth factors and vascular permeability. Cardiovasc Res. 2010;87(2):262–71.
- Detmar M, Brown LF, Schon MP, Elicker BM, Velasco P, Richard L, et al. Increased microvascular density and enhanced leukocyte rolling and adhesion in the skin of VEGF transgenic mice. J Invest Dermatol. 1998;111(1):1–6.
- Kwak DH, Bae TH, Kim WS, Kim HK. Anti-vascular endothelial growth factor (bevacizumab) therapy reduces hypertrophic scar formation in a rabbit ear wounding model. Arch Plast Surg. 2016;43(6):491–7.
- Wilgus TA, Ferreira AM, Oberyszyn TM, Bergdall VK, Dipietro LA. Regulation of scar formation by vascular endothelial growth factor. Lab Invest. 2008;88(6):579–90.
- Lund SA, Giachelli CM, Scatena M. The role of osteopontin in inflammatory processes. J Cell Commun Signal. 2009;3(3-4):311–22.
- Park CH, Chung JH. Epidermal growth factor-induced matrix metalloproteinase-1 expression is negatively regulated by p38 MAPK in human skin fibroblasts. J Dermatol Sci. 2011;64(2):134–41.
- Song R, Bian HN, Lai W, Chen HD, Zhao KS. Normal skin and hypertrophic scar fibroblasts differentially regulate collagen and fibronectin expression as well as mitochondrial membrane potential in response to basic fibroblast growth factor. Braz J Med Biol Res. 2011;44(5):402–10.
- Shi HX, Lin C, LinBB, Wang ZG, Zhang HY, Wu FZ, et al. The anti-scar effects of basic fibroblast growth factor on the wound repair in vitro and in vivo. PLoS One. 2013;8(4):e59966.
- Eto H, Suga H, Aoi N, Kato H, Doi K, Kuno S, et al. Therapeutic potential of fibroblast growth factor-2 for hypertrophic scars: upregulation of MMP-1 and HGF expression. Lab Invest. 2012;92(2):214–23.
- Wang J, Ding J, Jiao H, Honardoust D, Momtazi M, Shankowsky HA, et al. Human hypertrophic scar-like nude mouse model: characterization of the molecular and cellular biology of the scar process. Wound Repair Regen. 2011;19(2):274–85.
- Yang DY, Li SR, Wu JL, Chen YQ, Li G, Bi S, et al. Establishment of a hypertrophic scar model by transplanting full-thickness human skin grafts onto the backs of nude mice. Plast Reconstr Surg. 2007;119(1):104–9. discussion 110-1.
- Ding J, Tredget EE. Transplanting Human skin grafts onto nude mice to model skin scars. Methods Mol Biol. 2017;1627:65–80.
- Momtazi M, Kwan P, Ding J, Anderson CC, Honardoust D, Goekjian S, et al. A nude mouse model of hypertrophic scar shows morphologic and histologic characteristics of human hypertrophic scar. Wound Repair Regen. 2013;21(1):77–87.
- Alrobaiea SM, Ding J, Ma Z, Tredget EE. A novel nude mouse model of hypertrophic scarring using scratched full thickness human skin grafts. Adv Wound Care (New Rochelle). 2016;5(7):299– 313.
- Momtazi M, Ding J, Kwan P, Anderson CC, Honardoust D, Goekjian S, et al. Morphologic and histologic comparison of hypertrophic scar in nude mice, T-cell receptor, and recombination activating gene knockout mice. Plast Reconstr Surg. 2015;136(6):1192–204.