Bệnh tim mạch
Cơ chế bản chất tăng huyết áp: liên quan thần kinh và không do thần kinh
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Bài viết Cơ chế bản chất tăng huyết áp: liên quan thần kinh và không do thần kinh của nhóm tác giả Scott H. Carlson, Sean Stocker, and J. Michael Wyss.
Hệ thống thần kinh giao cảm và tăng huyết áp
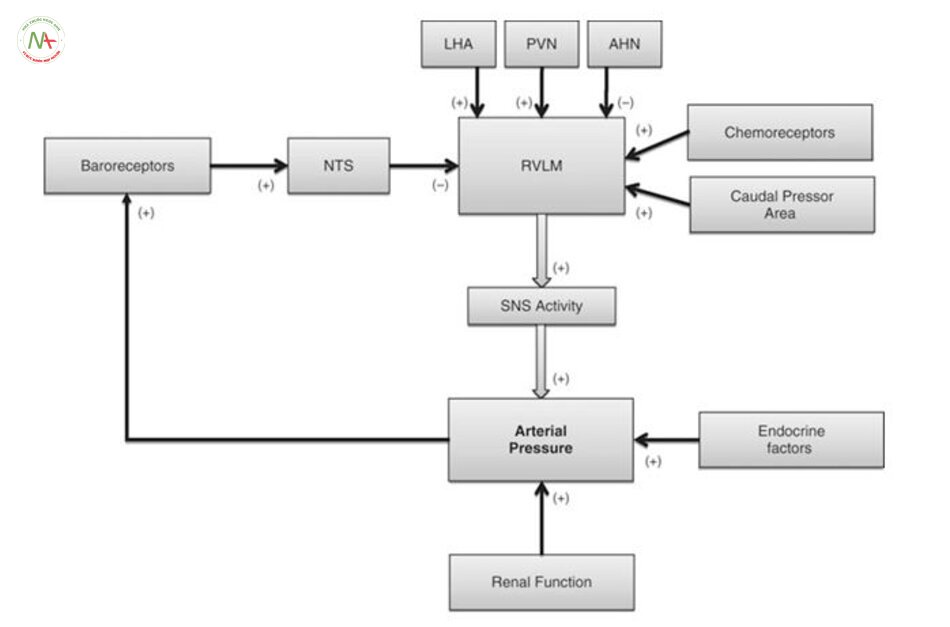
Trong 40 năm qua, các nghiên cứu lâm sàng và nghiên cứu trên động vật đã xác định rằng hệ giao cảm góp phần vào bản chất của tăng huyết áp [4, 5]. Tuy nhiên, những gì dẫn đến tăng hoạt động giao cảm cao này thì chưa rõ ràng. Tủy vùng bụng mỏ (RVLM) là nhân chính trong não dẫn truyền xung cho tế bào thần kinh trước hạch trong tủy sống nhân trước bên để hỗ trợ hoạt động của hệ thần kinh giao cảm. Các tế bào thần kinh RVLM rất nhạy cảm với bộ phận nhận cảm áp phản hồi tới thần kinh trung ương và tự điều hòa với tần số tương ứng với hoạt động của hệ thần kinh giao cảm [6]. Các chất hóa học kích thích tế bào thần kinh RVLM làm tăng hoạt động thần kinh giao cảm và huyết áp, nhiều nghiên cứu chỉ ra rằng tăng huyết áp do thần kinh xuất phát từ tính chất thần kinh RVLM bị Tăng huyết ápy đổi và / hoặc tăng kích thích đầu vào synaptdo đó làm tăng hoạt động của hệ thần kinh giao cảm, làm tăng co mạch làm cao huyết áp (xem [5, 8];. Hình 4.1). Tăng hướng kích thích trong tăng huyết áp do thần kinh có thể phát sinh ở một số vùng của não: các nhân ở vùng dưới đồi như nhân cận não thất và nhân lưng, nhân đuôi ở thân não [9, 10], receptor nhận cảm hóa học [11], natri kích thích tế bào thần kinh trong vùng AV3V của não trước [12], và kìm hãm receptor nhận cảm áp lực ở trung ương như vùng đuôi bụng bên. Các nghiên cứu cho thấy tăng kích thích bộ phận nhận cảm, giảm ức chế RVLM góp phần làm TĂNG HUYẾT ÁP do thần kinh [5, 6, 12-15].
Thận có chức năng ổn định nội môi, nhiều nghiên cứu đã tập trung vào các dây thần kinh giao cảm ở thận và quá trình tăng hoạt của chúng. Cắt dây thàn kinh ở thận làm giảm huyết áp ở một số mô hình động vật gặm nhấm [16-19] và ở những người tăng huyết áp không đáp ứng thuốc [17, 20]. Tuy nhiên, kiểm soát giao cảm của vùng mạch máu khác cũng có thể kiểm soát tăng huyết áp. hoạt động thần kinh nội tạng được nâng lên để đáp ứng với quá trình tăng huyết áp của angiotensin [21], và cắt bỏ các dây thần kinh tạng làm giảm huyết áp trong khi hoạt động thần kinh của thận giảm [24]. Những kết quả này gợi ý rằng hoạt động của thần kinh giao cảm được phân bố không đồng đều cho tất cả các cơ quan,. Khái niệm này được hỗ trợ bởi một số lượng ngày càng nhiều các nghiên cứu [25-27]
tăng hoạt động của hệ thần kinh giao cảm có thể là hậu quả của sự suy giảm các phản xạ thần kinh. Có lẽ hệ thống thông tin phản hồi được nghiên cứu nhiều nhất là receptor nhận cảm áp lực ở động mạch (nhằm đáp ứng với những Tăng huyết ápy đổi trong áp lực động mạch), các thụ thể phổi tim mạch (trong đó phát hiện những Tăng huyết ápy đổi về thể tích máu), và thụ thể nhận cảm hóa học (đáp ứng với những Tăng huyết ápy đổi khí máu và pH) . Tất cả những cơ chế phản hồi phản ứng cấp tính Tăng huyết ápy đổi theo các Tăng huyết ápm số theo dõi và làm Tăng huyết ápy đổi hoạt động của hệ thần kinh tự trị để duy trì áp lực động mạch cơ bản (Hình. 4.1). Bristow và cộng sự [28] là những người đầu tiên đề xuất rằng sự mất cân bằng bộ phận nhận cảm áp động mạch có thể làm Tăng huyết ápy đổi mạn tính quy định áp lực động mạch; Tuy nhiên, nghiên cứu mở rộng của Cowley và Guyton đã chứng minh rằng ở chó, việc loại bỏ phản xạ nhận áp lai làm tăng rối loạn nhận cảm huyết áp nhưng không làm tăng huyết áp trung bình [29]. Những nghiên cứu sau đó đã chứng minh để phản ứng lại quá trình TĂNG HUYẾT ÁP bền vững, receptor nhận cảm áp lực nhanh chóng thiết lập lại một điểm mới và sau đó, điều chỉnh hoạt động của hệ thần kinh tự trị để bảo vệ các điểm đặt áp lực động mạch mới. Những phát hiện này dẫn đến giả thuyết rằng receptor nhận áp chỉ điều chỉnh ngắn hạn hoạt động tự trị và không Tăng huyết ápm gia lâu dài vào tăng huyết áp do thần kinh (Cowley [30]).
Ngược lại thập kỷ trước đó, một số nghiên cứu gần đây cho thấy receptor nhận áp có vai trò mãn tính hơn trong việc điều tiết hoạt động của hệ thần kinh tự động, do đó, có thể góp phần vào làm tăng giao cảm và duy trì huyết áp ở một số cá nhân. Các nghiên cứu của Thrasher và Lohmeier thấy receptor nhận áp mạn tính có thể ức chế hệ thần kinh giao cảm và sự mất cân bằng trong cung phản xạ có thể dẫn đến tăng huyết áp duy trì [31-33].
Điều tiết hệ thống thần kinh chi phối huyết áp
Ngoài những Tăng huyết ápy đổi trong kiểm soát phản xạ của hoạt động tự trị, tăng hoạt động giao cảm có thể do điều tiết trung ương với áp lực động mạch. Trong khi RVLM đã được nghiên cứu rộng rãi bởi vì vai trò của nó như là loại thuốc giao cảm và điều chỉnh cấp tính áp lực động mạch. Vùng dưới đồi như 1 vùng chi phối chủ yếu của hệ thần kinh tự động (Hình. 4.1).
Quá trình deoxycorticosterone acetate steroid (quá trình khử oxy của corticosterone acetate) và chế độ ăn nhiều muối, kích thích vùng bên và hậu đồi làm tăng huyết áp động mạch và nhịp tim, trong khi tổn thương sau vùng dưới đồi làm giảm áp lực động mạch [38]. Hơn nữa, khu vực bên và lưng dưới đồi đáp ứng với nồng độ leptin có vai trò tăng hoạt động giao cảm và huyết áp, là nguyên nhân dẫn đến tăng huyết áp kèm theo béo phì [39, 40].
Tế bào nơ ron magnocellular tổng hợp và giải phóng vasopressin vào tuần hoàn, trong khi tế bào thần kinh parvocellular đơn hoặc đa synap kiểm soát hoạt động tim mạch của hệ, bao gồm cả các RVLM, khu vực nhận cảm sàn não thất 4 (area postrema), NTS và nhân sừng bên tủy sống. Thông qua sự liên quan với tế bào parvocellular làm Tăng huyết ápy đổi chức năng tim mạch.
Vùng trước đồi có 1 số khu vực kiểm soát tim mạch như vùng trước não thất 3 góp phần làm TĂNG HUYẾT ÁP ở một số mô hình động vật. nhân trung gian trước vùng giao thoa thị giác cũng liên quan tới 1 số tác động trên tim mạch ( [42, 43]). Nhân giao thoa thị giác cũng điều chỉnh giải phóng vasopressin và nước, tác động gián tiếp tới bộ phận nhận áp động mạch. Nhân trước vùng dưới đồi cùng nhân giao thoa thị giác tác động lớn tới giao cảm.
Một số vùng vỏ não cũng ảnh hưởng tới huyết áp, đặc biệt là liên quan đến ý thức[45] hoặc tình huống tâm lý [46]. Chúng bao gồm vùng trước vỏ thùy trán[45] thùy đảo và hạch nhân [47]. Cho dù các khu vực này đóng góp cho tăng huyết áp ít được biết đến.
Hệ Renin-Angiotensin và tăng huyết áp
Các yếu tố nội tiết đóng góp đáng kể vào việc điều chỉnh áp lực động mạch ngoại biên thông qua tác động trung gian và có thể là yếu tố gây bệnh trong tăng huyết áp. Trong số này, hệ thống renin-angiotensin-aldosterone (RAAS) có lẽ được nghiên cứu kỹ lưỡng nhất hormone, chủ yếu là do angiotensin II (AII) gây co mạch mạnh và liên quan nhiều đến thể tích tuần hoàn trong các loại thuốc hạ huyết áp hiện nay, ACEi như 1 thuốc hạ huyết áp hiệu quả nhất với phần lớn bệnh nhân. Hơn nữa, một số mô hình động vật gặm nhấm có tăng huyết áp liên quan chủ yếu tới AII [48]. Trong khi AII xuất hiện để tăng áp lực động mạch trong các nghiên cứu này, ít nhất là một phần, thông qua duy trì khối lượng tuần hoàn hoặc tăng kháng trở mạch máu do tăng hoạt động giao cảm. Điều này đã khiến các nhà nghiên cứu đưa ra giả thuyết rằng RAAS hoạt động quá mức có thể gây tăng huyết áp bằng cách trực tiếp làm tăng hoạt động của hệ thần kinh giao cảm.
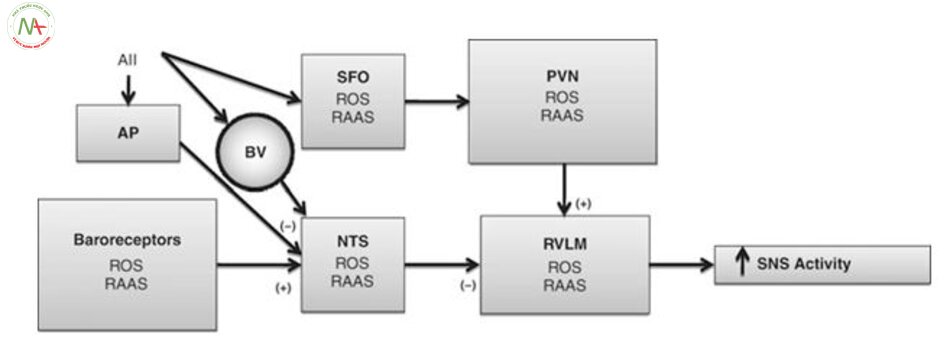
Một tác động trung tâm mà AII có thể Tăng huyết ápy đổi điều hòa dòng máu chảy là do ức chế chức năng bộ phận nhận cảm áp (Hình. 4.2). Một số nghiên cứu đã chứng minh rằng kiểm soát receptor nhận áp động mạch làm giảm huyết áp đáng kể sau khi dùng ARB AII 1 (AT1) receptor blocker [50]. Các quan sát sự lưu hành AII ức chế hoạt động phản xạ nhận áp do AII tác động vào các vị trí ở thần kinh trung ương để gây tác dụng . Tuy nhiên, AII không vượt qua hàng rào máu não còn nguyên vẹn, và hoạt động bằng cách gắn vào và kích thích các thụ thể ở khu vực quanh não thất, nơi không có hàng rào máu não liên kết với các thụ thể cảm biến mạch máu não sau đó truyền tín hiệu đến não [56]. cần lưu ý rằng một nghiên cứu gần đây cho thấy rằng hàng rào máu não có thể trở nên tăng tính thấm với AII trong tăng huyết áp [57]. Khu vực nền não thất là khu vực như vậy. Nó tiếp giáp với nhân tractus solitarius, là vị trí của đầu vào bộ phận nhận cảm áp đến vùng tủy, receptor AII [48].Một số quan sát hỗ trợ tiêm angiotensin vào khu vực nền não thất có receptor nhận áp làm tăng huyết áp, cắt bỏ khu vực nền não thất làm giảm huyết áp [59]. Hơn nữa, loại bỏ khu vực quanh nền não thất làm ngăn tác động của ACEi lên huyết áp và phong tỏa bộ phận nhận cảm áp trong SHR [60].
Nghiên cứu về vai trò của RAAS trong tăng huyết áp tập trung vào các tác động ngoại vi của AII (ví dụ, làm tăng giải phóng norepinephrine) hoặc tác động lên tuần hoàn qua tác dụng trung gian. Tuy nhiên, trong vòng 30 năm qua, các nghiên cứu chứng minh rằng tế bào thần kinh và các tế bào thần kinh đệm trong thần kinh trung ương bao gồm tất cả thành phần cuả hệ RAAS, bao gồm angiotensinogen, renin, men chuyển và tất cả các thụ thể angiotensin [48, 61]. gợi ý rằng angiotensin có thể hoạt động như một tác nhân điều biến hoặc tiết ra như 1 chất dẫn truyền thần kinh. thụ thể AII được phân bố ở hầu hết các nhân não liên quan tác động lên tim mạch [61], bao gồm PVN, nhân parabrachial, RVLM và NTS [48].
Sau khi angiotensin giải phóng sẽ liên kết với các thụ thể thần kinh dẫn đến tăng sản xuất vasopressin (từ PVN).
Nitric Oxide và tăng huyết áp
Nitric oxide (NO) là một thuốc thứ hai liên quan mạnh mẽ tới hoạt động của hệ thống thần kinh giao cảm và kiểm soát huyết áp. NO, được sản xuất từ các axit amin tiền thân arginine bởi nitric oxide (NOS), là một thuốc giãn mạch mạnh và có xu hướng làm giảm huyết áp khi được tạo ra trong các mạch máu. ức chế NOS bởi L-NAME gây tăng huyết áp do tăng kháng trở mạch máu ngoại vi và phản ứng mạch máu do kích thích adrenergic [72].
Điều thú vị là, L-NAME gây tăng huyết áp liên quan đến cả hệ thống renin-angiotensin và hệ thần kinh giao cảm[72].
Mặc dù cơ chế mà NO tác động trung tâm điều biến hoạt động thần kinh không rõ ràng, nghiên cứu cho thấy NO có thể làm Tăng huyết ápy đổi phản ứng thần kinh ở đuôi gai ở tế bào thần kinh và các yếu tố kích thích. Một khu vực đáng lưu ý ở đây là NTS, đó là nơi chuyển tiếp giữa đầu vào và bộ phận nhận cảm áp RVLM. Tiêm glutamate vào RVLM làm tăng thoáng qua áp lực động mạch. Điều này thường gây ra phản xạ giảm nhịp tim và hoạt động thần kinh giao cảm thận làm giảm áp lực động mạch [13]. Mifflin và các đồng nghiệp đã chỉ ra rằng tiêm đối kháng L-NAME vào RVLM trước khi tiêm glutamate làm giảm đáng kể phản xạ của huyết áp và nhịp tim. Những kết quả này ủng hộ giả thuyết rằng trong RVLM, NO tạo cơ chế phản hồi với glutamine trung gian qua receptor cảm áp và thụ thể ở tim phổi.
Phản ứng oxy hóa (ROS) và tăng huyết áp
Trong khi NO và angiotensin đóng vai trò tác động hệ thống thần kinh giao cảm trong tăng huyết áp làm tăng huyết áp. Các nghiên cứu gần đây đã tập trung vào sự cảm ứng với angiotensin của ROS, bao gồm các ion oxy, các gốc tự d, và peroxit, tất cả đều là sản phẩm phụ quá trình chuyển hóa bình thường của enzyme như NADPH-oxidase. ROS được tạo ra, chúng được chuyển đổi bởi superoxide dismutase nội bào (SOD) thành hydro peroxide. hydrogen peroxide tự nó là một gốc tự do mạnh, nó nhanh chóng bị phân hủy bởi các enzyme như catalase, glutathione peroxidase và peroxiredoxins.
Các nghiên cứu gần đây chỉ ra rằng ROS có vai trò trong tăng huyết áp, ROS đã được chứng minh góp phần tăng huyết áp do thần kinh bằng cách gây kích thích giao cảm. ROS tăng trong SHR [75], thậm chí trước khi bắt đầu có tăng huyết áp do mạch máu và thận, thì ROS đã được tiết ra [76, 77]. Những dữ liệu này hỗ trợ vai trò trung tâm của ROS trong tăng huyết áp.
Cơ chế mà ROS Tăng huyết ápy đổi kiểm soát tim mạch chưa rõ ràng. Một số ảnh hưởng của ROS xảy ra rõ ràng ở ngoại vi và Tăng huyết ápy đổi nội mô và chức năng thận. Tuy nhiên, nghiên cứu gần đây đã chỉ ra rằng ROS làm tăng hoạt động giao cảm, dẫn đến tăng huyết áp do thần kinh. Nhiều bằng chứng cho thấy ROS Tăng huyết ápm gia vào con đường truyền tín hiệu nội bào, bao gồm cả con dường dẫn truyền AII. truyền tĩnh mạch AII lăngm t áp lực động mạch và kích thích giao cảm [82]. Những kết quả này gợi ý rằng tăng AII có thể làm tăng áp lực động mạch bằng cách tăng hệ ROS trong tế bào thần kinh SFO, do đó làm tăng hoạt hóa của các trung tâm ở vùng dưới đồi kiểm soát hoạt động của hệ thần kinh.
Trong khi huyết áp có thể được điều khiển bởi các cơ chế trung ương mô tả ở trên, các yếu tố mạch máu cũng hoạt động đồng thời làm tăng huyết áp. Một đóng góp nghiên cứu là eicosanoid axit 20-hydroxyeicosatetraenoic (20-HETE), là một sản phẩm phụ của quá trình chuyển hóa acid arachidonic bởi enzym cytochrome (CYP). 20-HETE làm tăng phản ứng co mạch do kích thích giao cảm và hormone vận mạch như angiotensin và phenylephrine [85]. Những tác động trung gian bằng cách chặn dẫn truyền canxi qua các kênh kali (BKCa), dẫn đến quá trình khử cực và co cơ trơn mạch máu. 20-HETE cũng làm tăng lượng canxi bằng cách mở cổng protein kinase C-gated L-type Ca2+ [58, 85], và tăng độ nhạy canxi với myosin trong cơ trơn mạch máu [85].
Các hoạt động vận mạch của 20-HETE chỉ ra rằng nó là 1 nguyên nhân góp phần tăng huyết áp. Thật vậy, CYP tăng quá mức trong một số mô hình tăng huyết áp và góp phần vào sự phát triển và duy trì huyết áp cao ở động vật. Ví dụ, những Tăng huyết ápy đổi trong biểu hiện của CYP tương ứng với sự phát triển của bệnh cao huyết áp trong SHRs, và mức độ tăng huyết áp có thể hãm lại bằng cách ức chế các enzym [86]. CYP quá mức cũng gặp trong angiotensin gây tăng huyết áp [87-89]. Hơn nữa, oxit nitric có vẻ ức chế hoạt động CYP và 20-HETE [94], cho thấy khả năng tăng huyết áp do cạn kiệt NO dẫn đến tăng sản xuất 20-HETE và góp phần làm tăng huyết áp. Gộp chung lại, những kết quả này cho thấy sự Tăng huyết ápy đổi CYP và tương ứng với nồng độ 20-HETE góp phần làm đa dạng bệnh lý tăng huyết áp.
Ngoài khả năng giúp làm tăng mẫn cảm với các kích thích mạch máu ngoại sinh, nghiên cứu cho thấy 20-HETE Tăng huyết ápm gia điều chỉnh mô cơ liên quan kháng trở của tiểu động mạch[97]. Những Tăng huyết ápy đổi trong áp lực xuyên thành của động mạch kích thích sinh 20-HETE gây co động mạch bằng cách tăng canxi tràn qua các receptor vận chuyển (TRP) và đóng các kênh BKCa [97, 98]. Điều này chỉ ra vai trò liên quan tới mô cơ của 20-HETE trong nhiều loại mạch máu (ví dụ, mạc treo ruột, thận, tim) [99-101], và phong bế 20-HETE làm giảm cơ chế tự điều chỉnh của cả hai dòng máu tới thận và não trong cơ thể [102]. Có 1 chất là Eets kích hoạt kênh BKCa trong tế bào cơ trơn mạch máu, dẫn đến tăng phân cực và giãn mạch máu[105]. Eets được tổng hợp bởi tế bào hình sao trong hệ thống thần kinh trung ương, và những Tăng huyết ápy đổi trong hoạt động thần kinh dẫn đến hình thành EET ở tế bào hình sao và giãn mạch tương ứng [104, 106]. Hiệu ứng ròng của EET là để phù hợp với lưu lượng máu não tùy theo nhu cầu trao đổi chất từng khu vực. mức độ Tăng huyết ápy đổi của Eets cũng liên quan đến tăng huyết áp và chức năng của mạch; trong nhiều trường hợp tăng huyết áp, nồng độ của Eets giảm thông qua giảm trao đổi chất và mức độ huyết áp (xem [105]). Như vậy, huyết áp có thể được kiểm soát ở mức độ mạch máu bằng cán cân 20-HETE và EET.
Vai trò của CYP có nguồn gốc từ 20-HETE và Eets trong mạch máu não đã được quan tâm đặc biệt trong đột quỵ. Tương tự như mạch khác, lưu lượng máu não được tự điều chỉnh qua 2 quá trình kiểm soát này, trong điều kiện bình thường thì nó giúp bảo trì lưu lượng máu não không đổi. Tuy nhiên, ở trạng thái bệnh lý như TĂNG HUYẾT ÁP cao có thể hạn chế quá trình tự điều chỉnh gây giảm tác động tới mạch máu và Tăng huyết ápy đổi chức năng nội mô [85, 104]. Những rối loạn này có thể làm Tăng huyết ápy đổi cán cân 20-HETE và EET, do đó tăng co thắt mô cơ và giảm lưu lượng máu não trong khi cũng tăng nguy cơ đột quỵ thiếu máu cục bộ và suy giảm tri giác [104, 105]. 20-HETE tăng trong dịch não tủy ở chuột bị đột quỵ xuất huyết, và tăng nồng độ 20-HETE góp phần gây co thắt mạch [107]. dùng chất ức chế 20-HETE ngăn ngừa giảm thiếu máu cục bộ dựa trên lượng máu tới tim [108] và não [109], trong khi cũng làm giảm kích thước vùng nhồi máu. 20-HETE cũng tăng trong mạch máu não SHR [110] và đột quỵ SHR [111], góp phần giảm oxy hóa, rối loạn chức năng nội mô và tăng tổn thương do thiếu máu cục bộ.
References
- Mvundura M, McGruder H, Khoury MJ, Valdez R, Yoon PW. Family history as a risk factor for early-onset stroke/transient ischemic attack among adults in the United States. Public Health Genomics. 2010;13:13–20.
- Collins R, Peto R, Godwin J, MacMahon S. Blood pressure and coronary heart disease. Lancet. 1990;336:370–1.
- MacMahon S, et al. Blood pressure, stroke, and coronary heart disease. Part 1, Prolonged differences in blood pressure: prospective observational studies corrected for the regression dilution bias. Lancet. 1990;335:765–74.
- Grassi G, Quarti-Trevano F, Dell’oro R, Mancia G. Essential hypertension and the sympa- thetic nervous system. Neurol Sci. 2008;29 Suppl 1:S33–6.
- Guyenet PG. The sympathetic control of blood pressure. Nat Rev Neurosci. 2006;7:335–46.
- Dampney RA, et al. Medullary and supramedullary mechanisms regulating sympathetic vasomotor tone. Acta Physiol Scand. 2003;177:209–18.
- Kumagai H, et al. Importance of rostral ventrolateral medulla neurons in determining efferent sympathetic nerve activity and blood pressure. Hypertens Res. 2012;35:132–41.
- Sved AF, Ito S, Madden CJ, Stocker SD, Yajima Y. Excitatory inputs to the RVLM in the context of the baroreceptor reflex. Ann N Y Acad Sci. 2001;940:247–58.
- Yajima Y, et al. Enhanced response from the caudal pressor area in spontaneously hyperten- sive rats. Brain Res. 2008;1227:89–95.
- Potas JR, Dampney RA. Sympathoinhibitory pathway from caudal midline medulla to RVLM is independent of baroreceptor reflex pathway. Am J Physiol Regul Integr Comp Physiol. 2003;284:R1071–8.
- Moreira TS, Takakura AC, Colombari E, Guyenet PG. Central chemoreceptors and sympa- thetic vasomotor outflow. J Physiol. 2006;577:369–86.
- Simmonds SS, Lay J, Stocker SD. Dietary salt intake exaggerates sympathetic reflexes and increases blood pressure variability in normotensive rats. Hypertension. 2014;64:583–9.
- Dias AC, Vitela M, Colombari E, Mifflin SW. Nitric oxide modulation of glutamatergic, baroreflex, and cardiopulmonary transmission in the nucleus of the solitary tract. Am J Physiol Heart Circ Physiol. 2005;288:H256–62.
- Haywood JR, et al. gamma-Aminobutyric acid (GABA)—a function and binding in the para- ventricular nucleus of the hypoTăng huyết áplamus in chronic renal-wrap hypertension. Hypertension. 2001;37:614–8.
- Vitela M, Mifflin SW. gamma-Aminobutyric acid(B) receptor-mediated responses in the nucleus tractus solitarius are altered in acute and chronic hypertension. Hypertension. 2001;37:619–22.
- 4 Mechanisms Underlying Essential Hypertension: Neurogenic and Non-neurogenic… 75
- Pires NM, et al. Blood pressure decrease in spontaneously hypertensive rats following renal denervation or dopamine beta-hydroxylase inhibition with etamicastat. Hypertens Res. 2015;38:605–12.
- Briasoulis A, Bakris GL. A clinician’s perspective of the role of renal sympathetic nerves in hypertension. Front Physiol. 2015;6:75.
- Khan SA, et al. Obesity depresses baroreflex control of renal sympathetic nerve activity and heart rate in Sprague Dawley rats: role of the renal innervation. Acta Physiol (Oxf). 2015;214:390–401.
- Hendel MD, Collister JP. Renal denervation attenuates long-term hypertensive effects of Angiotensin II in the rat. Clin Exp Pharmacol Physiol. 2006;33:1225–30.
- Esler M. The sympathetic nervous system in hypertension: back to the future? Curr Hypertens Rep. 2015;17:11.
- Luft FC, et al. Angiotensin-induced hypertension in the rat. Sympathetic nerve activity and prostaglandins. Hypertension. 1989;14:396–403.
- Foss JD, Fink GD, Osborn JW. Reversal of genetic salt-sensitive hypertension by targeted sympathetic ablation. Hypertension. 2013;61:806–11.
- King AJ, Osborn JW, Fink GD. Splanchnic circulation is a critical neural target in angiotensin II salt hypertension in rats. Hypertension. 2007;50:547–56.
- Yoshimoto M, Miki K, Fink GD, King A, Osborn JW. Chronic angiotensin II infusion causes differential responses in regional sympathetic nerve activity in rats. Hypertension. 2010;55:644–51.
- Ramchandra R, Barrett CJ, Guild SJ, Malpas SC. Evidence of differential control of renal and lumbar sympathetic nerve activity in conscious rabbits. Am J Physiol Regul Integr Comp Physiol. 2006;290:R701–8.
- Yao Y, et al. The effect of losartan on differential reflex control of sympathetic nerve activity in chronic kidney disease. J Hypertens. 2015;33:1249–60.
- Shi Z, Brooks VL. Leptin differentially increases sympathetic nerve activity and its barore- flex regulation in female rats: role of oestrogen. J Physiol. 2015;593:1633–47.
- Bristow JD, et al. The influence of ventilation, carbon dioxide and hypoxia on the barorecep- tor reflex in man. J Physiol. 1968;198:102; passim-103.
- Cowley Jr AW, Liard JF, Guyton AC. Role of baroreceptor reflex in daily control of arterial blood pressure and other variables in dogs. Circ Res. 1973;32:564–76.
- Cowley Jr AW. Long-term control of arterial blood pressure. Physiol Rev. 1992;72:231–300.
- Thrasher TN. Arterial baroreceptor input contributes to long-term control of blood pressure. Curr Hypertens Rep. 2006;8:249–54.
- Lohmeier TE, Iliescu R. The baroreflex as a long-term controller of arterial pressure. Physiology (Bethesda). 2015;30:148–58.
- Iliescu R, Tudorancea I, Lohmeier TE. Baroreflex activation: from mechanisms to therapy for cardiovascular disease. Curr Hypertens Rep. 2014;16:453.
- Barrett CJ, Guild SJ, Ramchandra R, Malpas SC. Baroreceptor denervation prevents sympa- thoinhibition during angiotensin II-induced hypertension. Hypertension. 2005;46:168–72.
- Lohmeier TE. The sympathetic nervous system and long-term blood pressure regulation. Am J Hypertens. 2001;14:147S–54.
- Kuroki MT, Guzman PA, Fink GD, Osborn JW. Time-dependent changes in autonomic control of splanchnic vascular resistance and heart rate in ANG II-salt hypertension. Am J Physiol Heart Circ Physiol. 2012;302:H763–9.
- Rahman AA, Shahid IZ, Pilowsky PM. Differential cardiorespiratory and sympathetic reflex responses to microinjection of neuromedin U in rat rostral ventrolateral medulla. J Pharmacol Exp Ther. 2012;341:213–24.
- Oparil S, Chen YF, Berecek K, Calhoun DA, Wyss JM. The role of the central nervous sys- tem in hypertension. In Laragh J.H.M., Brenner, B.M. (eds.), Hypertension: pathophysiology, diagnosis and management. 2nd ed. New York: Raven; 1995.
- Esler M, et al. Mechanisms of sympathetic activation in obesity-related hypertension. Hypertension. 2006;48:787–96.
- Dampney RA. Arcuate nucleus—a gateway for insulin’s action on sympathetic activity. J Physiol. 2011;589:2109–10.Ferguson AV, Latchford KJ, Samson WK. The paraventricular nucleus of the hypoTăng huyết ápla- mus—a potential target for integrative treatment of autonomic dysfunction. Expert Opin Ther Targets. 2008;12:717–27.
- Osborn JW, et al. Effect of subfornical organ lesion on the development of mineralocorticoid- salt hypertension. Brain Res. 2006;1109:74–82.
- Ployngam T, Collister JP. An intact median preoptic nucleus is necessary for chronic angio- tensin II-induced hypertension. Brain Res. 2007;1162:69–75.
- Wyss JM, Yang RH, Oparil S. Lesions of the anterior hypoTăng huyết áplamic area increase arterial pres- sure in NaCl-sensitive spontaneously hypertensive rats. J Auton Nerv Syst. 1990;31:21–9.
- Shoemaker JK, Norton KN, Baker J, Luchyshyn T. Forebrain organization for autonomic cardiovascular control. Auton Neurosci. 2015;188:5–9.
- de Morree HM, Szabo BM, Rutten GJ, Kop WJ. Central nervous system involvement in the autonomic responses to psychological distress. Neth Heart J. 2013;21:64–9.
- Cechetto DF. Cortical control of the autonomic nervous system. Exp Physiol. 2014;99:326–31.
- Veerasingham SJ, Raizada MK. Brain renin-angiotensin system dysfunction in hypertension: recent advances and perspectives. Br J Pharmacol. 2003;139:191–202.
- Sanderford MG, Bishop VS. Central mechanisms of acute ANG II modulation of arterial baroreflex control of renal sympathetic nerve activity. Am J Physiol Heart Circ Physiol. 2002;282:H1592–602.
- Kawano Y, Yoshida K, Matsuoka H, Omae T. Chronic effects of central and systemic admin- istration of losartan on blood pressure and baroreceptor reflex in spontaneously hypertensive rats. Am J Hypertens. 1994;7:536–42.
- Schiffer S, Pummer S, Witte K, Lemmer B. Cardiovascular regulation in TGR(mREN2)27 rats: 24h variation in plasma catecholamines, angiotensin peptides, and telemetric heart rate variability. Chronobiol Int. 2001;18:461–74.
- Berenguer LM, Garcia-Estan J, Ubeda M, Ortiz AJ, Quesada T. Role of renin-angiotensin system in the impairment of baroreflex control of heart rate in renal hypertension. J Hypertens. 1991;9:1127–33.
- Heesch CM, Crandall ME, Turbek JA. Converting enzyme inhibitors cause pressure-independent resetting of baroreflex control of sympathetic outflow. Am J Physiol. 1996;270:R728–37.
- Lantelme P, Cerutti C, Lo M, Paultre CZ, Ducher M. Mechanisms of spontaneous baroreflex impairment in lyon hypertensive rats. Am J Physiol. 1998;275:R920–5.
- Baltatu O, et al. Alterations in blood pressure and heart rate variability in transgenic rats with low brain angiotensinogen. Hypertension. 2001;37:408–13.
- Paton JF, Waki H, Abdala AP, Dickinson J, Kasparov S. Vascular-brain signaling in hyperten- sion: role of angiotensin II and nitric oxide. Curr Hypertens Rep. 2007;9:242–7.
- Biancardi VC, Son SJ, Ahmadi S, Filosa JA, Stern JE. Circulating angiotensin II gains access to the hypoTăng huyết áplamus and brain stem during hypertension via breakdown of the blood-brain barrier. Hypertension. 2014;63:572–9.
- Tan PS, Killinger S, Horiuchi J, Dampney RA. Baroreceptor reflex modulation by circulating angiotensin II is mediated by AT1 receptors in the nucleus tractus solitarius. Am J Physiol Regul Integr Comp Physiol. 2007;293:R2267–78.
- Fink GD, Bruner CA, Mangiapane ML. Area postrema is critical for angiotensin-induced hypertension in rats. Hypertension. 1987;9:355–61.
- Matsumura K, Averill DB, Ferrario CM. Role of AT1 receptors in area postrema on barore- ceptor reflex in spontaneously hypertensive rats. Brain Res. 1999;850:166–72.
- Parsons KK, Coffman TM. The renin-angiotensin system: it’s all in your head. J Clin Invest. 2007;117:873–6.
- Davisson RL, et al. The brain renin-angiotensin system contributes to the hypertension in mice containing both the human renin and human angiotensinogen transgenes. Circ Res. 1998;83:1047–58.
- Sinnayah P, et al. Genetic ablation of angiotensinogen in the subfornical organ of the brain prevents the central angiotensinergic pressor response. Circ Res. 2006;99:1125–31.Doobay MF, et al. Differential expression of neuronal ACE2 in transgenic mice with overex- pression of the brain renin-angiotensin system. Am J Physiol Regul Integr Comp Physiol. 2007;292:R373–81.
- Sakai K, et al. Local production of angiotensin II in the subfornical organ causes elevated drinking. J Clin Invest. 2007;117:1088–95.
- Young CN, et al. ER stress in the brain subfornical organ mediates angiotensin-dependent hypertension. J Clin Invest. 2012;122:3960–4.
- Dai L, Smith PM, Kuksis M, Ferguson AV. Apelin acts in the subfornical organ to influence neuronal excitability and cardiovascular function. J Physiol. 2013;591:3421–32.
- Young CN, Morgan DA, Butler SD, Mark AL, Davisson RL. The brain subfornical organ mediates leptin-induced increases in renal sympathetic activity but not its metabolic effects. Hypertension. 2013;61:737–44.
- Tagawa T, Dampney RA. AT(1) receptors mediate excitatory inputs to rostral ventrolateral medulla pressor neurons from hypoTăng huyết áplamus. Hypertension. 1999;34:1301–7.
- Chen Q, Pan HL. Signaling mechanisms of angiotensin II-induced attenuation of GABAergic input to hypoTăng huyết áplamic presympathetic neurons. J Neurophysiol. 2007;97:3279–87.
- Walsh T, Donnelly T, Lyons D. Impaired endothelial nitric oxide bioavailability: a common link between aging, hypertension, and atherogenesis? J Am Geriatr Soc. 2009;57:140–5.
- Torok J. Participation of nitric oxide in different models of experimental hypertension. Physiol Res. 2008;57:813–25.
Pechanova O, Bernatova I, Pelouch V, Simko F. Protein remodelling of the heart in NO-deficient hypertension: the effect of captopril. J Mol Cell Cardiol. 1997;29:3365–74. - Zicha J, Dobesova Z, Kunes J. Antihypertensive mechanisms of chronic captopril or N-acetylcysteine treatment in L-NAME hypertensive rats. Hypertens Res. 2006;29:1021–7.
- Kimura Y, et al. Overexpression of inducible nitric oxide synTăng huyết ápse in rostral ventrolateral medulla causes hypertension and sympathoexcitation via an increase in oxidative stress. Circ Res. 2005;96:252–60.
- Zhang F, et al. Decreased levels of cytochrome P450 2E1-derived eicosanoids sensitize renal arteries to constrictor agonists in spontaneously hypertensive rats. Hypertension. 2005;45:103–8.
- Zalba G, et al. Vascular NADH/NADPH oxidase is involved in enhanced superoxide produc- tion in spontaneously hypertensive rats. Hypertension. 2000;35:1055–61.
- Callera GE, Tostes RC, Yogi A, Montezano AC, Touyz RM. Endothelin-1-induced oxidative stress in DOCA-salt hypertension involves NADPH-oxidase-independent mechanisms. Clin Sci (Lond). 2006;110:243–53.
- Paravicini TM, Touyz RM. NADPH oxidases, reactive oxygen species, and hypertension: clinical implications and therapeutic possibilities. Diabetes Care. 2008;31 Suppl 2:S170–80.
- Hirooka Y, et al. Amlodipine-induced reduction of oxidative stress in the brain is associated with sympatho-inhibitory effects in stroke-prone spontaneously hypertensive rats. Hypertens Res. 2006;29:49–56.
- Bolad I, Delafontaine P. Endothelial dysfunction: its role in hypertensive coronary disease. Curr Opin Cardiol. 2005;20:270–4.
- Campese VM, Shaohua Y, Huiquin Z. Oxidative stress mediates angiotensin II-dependent stimulation of sympathetic nerve activity. Hypertension. 2005;46:533–9.
- Zimmerman MC, et al. Superoxide mediates the actions of angiotensin II in the central ner- vous system. Circ Res. 2002;91:1038–45.
- Zimmerman MC, Lazartigues E, Sharma RV, Davisson RL. Hypertension caused by angio- tensin II infusion involves increased superoxide production in the central nervous system. Circ Res. 2004;95:210–6.
- Hoopes SL, Garcia V, Edin ML, Schwartzman ML, Zeldin DC. Vascular actions of 20-HETE. Prostaglandins Other Lipid Mediat. 2015;120:9–16.
- Capdevila JH, Falck JR, Imig JD. Roles of the cytochrome P450 arachidonic acid monooxy- genases in the control of systemic blood pressure and experimental hypertension. Kidney Int. 2007;72:683–9.
- Alonso-Galicia M, Maier KG, Greene AS, Cowley Jr AW, Roman RJ. Role of 20-hydroxyeicosatetraenoic acid in the renal and vasoconstrictor actions of angiotensin
- II. Am J Physiol Regul Integr Comp Physiol. 2002;283:R60–8.
- Moreno C, Maier KG, Hoagland KM, Yu M, Roman RJ. Abnormal pressure-natriuresis in hypertension: role of cytochrome P450 metabolites of arachidonic acid. Am J Hypertens. 2001;14:90S–7.
- MuTăng huyết áplif MM, et al. Angiotensin II-induced hypertension: contribution of Ras GTPase/mitogen- activated protein kinase and cytochrome P450 metabolites. Hypertension. 2000;36:604–9.
- Messer-Letienne I, Bernard N, Roman RJ, Sassard J, Benzoni D. 20-Hydroxyeicosatetraenoic acid and renal function in Lyon hypertensive rats. Eur J Pharmacol. 1999;378:291–7.
- Hoagland KM, Maier KG, Roman RJ. Contributions of 20-HETE to the antihypertensive effects of Tempol in Dahl salt-sensitive rats. Hypertension. 2003;41:697–702.
- Singh H, Schwartzman ML. Renal vascular cytochrome P450-derived eicosanoids in androgen-induced hypertension. Pharmacol Rep. 2008;60:29–37.
- Llinas MT, Alexander BT, Capparelli MF, Carroll MA, Granger JP. Cytochrome P-450 inhi- bition attenuates hypertension induced by reductions in uterine perfusion pressure in preg- nant rats. Hypertension. 2004;43:623–8.
- Miyata N, Roman RJ. Role of 20-hydroxyeicosatetraenoic acid (20-HETE) in vascular sys- tem. J Smooth Muscle Res. 2005;41:175–93.
- Berezan DJ, Dunn KM, Falck JR, Davidge ST. Aging increases cytochrome P450 4A modu- lation of alpha1-adrenergic vasoconstriction in mesenteric arteries. J Cardiovasc Pharmacol. 2008;51:327–30.
- Berezan DJ, Xu Y, Falck JR, Kundu AP, Davidge ST. Ovariectomy, but not estrogen defi- ciency, increases CYP4A modulation of alpha(1)-adrenergic vasoconstriction in aging female rats. Am J Hypertens. 2008;21:685–90.
- Bubb KJ, et al. Activation of neuronal transient receptor potential vanilloid 1 channel under- lies 20-hydroxyeicosatetraenoic acid-induced vasoactivity: role for protein kinase A. Hypertension. 2013;62:426–33.
- Toth P, et al. Role of 20-HETE, TRPC channels, and BKCa in dysregulation of pressure- induced Ca2+ signaling and myogenic constriction of cerebral arteries in aged hypertensive mice. Am J Physiol Heart Circ Physiol. 2013;305:H1698–708.
- Harder DR, et al. Formation and action of a P-450 4A metabolite of arachidonic acid in cat cerebral microvessels. Am J Physiol. 1994;266:H2098–107.
- Imig JD, Zou AP, Ortiz de Montellano PR, Sui Z, Roman RJ. Cytochrome P-450 inhibitors alter afferent arteriolar responses to elevations in pressure. Am J Physiol. 1994;266:H1879–85.
- Frisbee JC, Roman RJ, Murali Krishna U, Falck JR, Lombard JH. Altered mechanisms underlying hypoxic dilation of skeletal muscle resistance arteries of hypertensive versus nor- motensive Dahl rats. Microcirculation. 2001;8:115–27.
- Gebremedhin D, et al. Production of 20-HETE and its role in autoregulation of cerebral blood flow. Circ Res. 2000;87:60–5.
- Gordon GR, Mulligan SJ, MacVicar BA. Astrocyte control of the cerebrovasculature. Glia. 2007;55:1214–21.
- Imig JD, Simpkins AN, Renic M, Harder DR. Cytochrome P450 eicosanoids and cerebral vascular function. Expert Rev Mol Med. 2011;13, e7.
- Tacconelli S, Patrignani P. Inside epoxyeicosatrienoic acids and cardiovascular disease. Front Pharmacol. 2014;5:239.
- Metea MR, Newman EA. Signalling within the neurovascular unit in the mammalian retina. Exp Physiol. 2007;92:635–40.
Cambj-Sapunar L, Yu M, Harder DR, Roman RJ. Contribution of 5-hydroxytryptamine1B receptors and 20-hydroxyeiscosatetraenoic acid to fall in cerebral blood flow after subarach- noid hemorrhage. Stroke. 2003;34:1269–75. - Yousif MH, Benter IF, Roman RJ. Cytochrome P450 metabolites of arachidonic acid play a role in the enhanced cardiac dysfunction in diabetic rats following ischaemic reperfusion injury. Auton Autacoid Pharmacol. 2009;29:33–41.
- Renic M, et al. Effect of 20-HETE inhibition on infarct volume and cerebral blood flow after transient middle cerebral artery occlusion. J Cereb Blood Flow Metab. 2009;29:629–39.
- Toth P, et al. Treatment with the cytochrome P450 omega-hydroxylase inhibitor HET0016 attenuates cerebrovascular inflammation, oxidative stress and improves vasomotor function in spontaneously hypertensive rats. Br J Pharmacol. 2013;168:1878–88.
- Dunn KM, et al. Elevated production of 20-HETE in the cerebral vasculature contributes to severity of ischemic stroke and oxidative stress in spontaneously hypertensive rats. Am J Physiol Heart Circ Physiol. 2008;295:H2455–65.
- Ward NC, et al. Cytochrome P450 metabolites of arachidonic acid are elevated in stroke patients compared with healthy controls. Clin Sci (Lond). 2011;121:501–7.
- Deng S, et al. CYP4F2 gene V433M polymorphism is associated with ischemic stroke in the male Northern Chinese Han population. Prog Neuropsychopharmacol Biol Psychiatry. 2010;34:664–8.
