Bệnh da liễu
Cập nhật về Cutibacterium acnes – Bác sĩ Trương Tấn Minh Vũ
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: Marie-Ange Dagnelie, Stéphane Corvec, Amir Khammari, Brigitte Dréno.
Biên dịch: Bác sĩ Trương Tấn Minh Vũ.
Tải file PDF Tại đây
Các từ viết tắt
| AMP | (Antimicrobial peptide) |
| CAMP | (Christie-Atkins-Munch Petersen) |
| CRISPR | (Clustered regularly interspaced short palindromic repeats) |
| D/PAMP | (Damage-/pathogen-associated molecular pattern) |
| EVs | (Extracellular vesicles) |
| hBD2 | (Human β-defensin 2) |
| HYL-IA | (Variant of hyaluronidase found in phylotype IA) |
| HYL-IB and II | (Variant of hyaluronidase found in phylotypes IB and II) |
| IFN-γ | (Interferon- γ) |
| IL | (Interleukin, e.g. IL-8, IL-6,etc.) |
| MMPs | (Matrix metalloproteinases, e.g. MMP-9, MMP-13, etc.) |
| NK cells | (Natural killer cells) |
| NLRP3 | (NOD-like receptor family, pyrin domain containing 3) |
| PAR-2 | (Protease-activated receptor-2) |
| PCR | (Polymerase chain reaction) |
| QS | (Quorum sensing) |
| RIS-1/psoriasin | (Retinoic acid-inducible skinspecific gene) |
| RNA | (Ribonucleic acid) |
| Rnases | (Ribonucleases) |
| SCORAD | (Scoring atopic dermatitis) |
| SLST | (Single-locus sequence typing) |
| TGF-β | (Transforming growth factor-β) |
| Th17/Th1 | (T helper 17/T helper 1 cells) |
| TIMP-2 | (Tissue inhibitor of metalloproteinases, e.g. TIMP- 2, TIMP-4, etc.) |
| TLRs | (Toll-like receptors, e.g. TLR-2, TLR-4, etc.) |
| TNF-α | (Tumour necrosis factor-α) |
Giới thiệu
Chương này tập trung vào Cutibacterium acnes, một loại vi khuẩn hội sinh của hệ vi sinh vật ở da, đóng một vai trò quan trọng trong sự phát triển của mụn trứng cá [1–4]. Chương này đầu tiên sẽ mô tả chính xác đặc tính của vi khuẩn này và sau đó tập trung vào các tương tác hiện có giữa C. acnes và các vi sinh vật khác cư trú trên da người, chủ yếu là Staphylococcus epidermidis. Chương này sau đó sẽ mô tả các tương tác giữa C. acnes và hệ thống miễn dịch bẩm sinh của da và cuối cùng sẽ mở ra các phương pháp điều trị tiềm năng trong tương lai sẽ được phát triển trong những năm tới để điều trị mụn trứng cá.
Đặc tính của Cutibacterium acnes (Trước đây là Propionibacterium acnes)
Da đại diện cho một hệ sinh thái phức tạp [5]. Có một cộng đồng vi sinh vật lớn và đa dạng trên cơ thể. Tùy thuộc vào các vùng sinh thái thích hợp, sự phân bố của vi khuẩn có thể khác nhau [6]. Do đó, trong một khu vực nhiều lipid, nhóm Actinobacteria chiếm nhiều hơn, và Cutibacterium acnes có thể chiếm tới 70% [7]. Vi khuẩn Gram dương kỵ khí- ưa khí (aerotolerant anaerobes) này là một sinh vật hội sinh ở da, và vùng sinh thái của nó đại diện là các nang bã nhờn [8–10].
Mô tả vi khuẩn
Ban đầu, C. acnes được xếp vào nhóm vi khuẩn Corynebacterium [11]. Theo các tài liệu gần đây, hình thái dưới kính hiển vi có thể đa dạng dẫn đến các nhóm phụ khác nhau [12–14]. Bằng cách kiểm tra trực tiếp bằng kính hiển vi, các phylotype I, II và III có sự khác biệt nào đó [12,15, 16]. Những hiểu biết mới từ việc kết hợp phân tích quần thể, nghiên cứu bộ gen, các tương tác sinh hóa và ký chủ-vi sinh vật dẫn đến hiểu biết hơn về loại vi khuẩn này liên quan đến quá trình viêm [17, 18].
Vùng sinh thái
C. acnes là cư dân chính của hệ vi sinh vật trên da người bình thường và chiếm ưu thế trong các đơn vị nang lông tuyến bã, điều này có thể được giải thích bằng sự sản xuất các enzym khác nhau [19– 21]. Nó có thể tương tác với các vi sinh vật khác, đặc biệt là Staphylococcus epidermidis đóng một vai trò quan trọng đối với sức khỏe làn da, rèn luyện hệ thống miễn dịch bẩm sinh và duy trì cân bằng nội môi của da [22]. S. epidermidis có thể là một phần trong cơ chế bệnh sinh của mụn trứng cá, tạo ra các chất kháng khuẩn (bacteriocin) hoạt động chống lại C. acnes dẫn đến phá vỡ (dysbiosis) cân bằng nội môi bình thường của da [23]. Sự liên quan của nó đối với rối loạn da, đặc biệt là mụn trứng cá, đã được mô tả, nhưng chúng ta cũng có thể phục hồi vi khuẩn phân lập từ miệng, đường tiêu hóa, tuyến tiền liệt và các nhiễm trùng liên quan đến thiết bị [14].
Điều chỉnh phân loại
Từ khi được phát hiện ở một bệnh nhân bị mụn trứng cá, P. acnes, và nay là C. acnes, đã trải qua một loạt các thay đổi về phân loại. Nó được xếp vào chi Bacillus, tiếp theo là Corynebacterium [11]. Tuy nhiên, vào năm 1946, Douglas và Gunter đã có thể chứng minh rằng vi sinh vật này có liên quan chặt chẽ hơn với các thành viên chi Propionibacterium bởi vì, giống như các loài khác của chi này, nó lên men lactose thành axit propionic trong môi trường yếm khí duy trì độ pH axit trên bề mặt da và hạn chế sự phát triển của mầm bệnh [24, 25]. Gần đây, một điều chỉnh đáng kể về phân loại đã được đề xuất bởi Scholz và cộng sự, đặt tất cả các loài Propionibacterium từ hệ vi sinh vật ở da vào chi Cutibacterium mới này [25]. Do đó, tác nhân chính của nang bã nhờn nên được đặt tên là Cutibacterium acnes. Gần đây, theo ba phylotype chính được mô tả ở phần đầu, các phân loài đã được đề xuất. Do đó, phylotype I tương ứng với phân loài C. acnes subsp. acnes [26], phylotype II tương ứng với phân loài C. acnes subsp. defendens [27] (do sự hiện diện của hệ thống CRISPR hạn chế việc chuyển hoặc thu nhận gen) [28] và phylotype III tương ứng với phân loài C. acnes subsp. elongatum theo hình thái hiển vi của nó [26].
Phát sinh loài
Kể từ năm 2005, các nhóm nghiên cứu khác nhau đã phát triển các công cụ ở mức phân tử để xác định xem các nhóm hoặc họ có thể có liên quan nhiều hơn đến các bệnh cụ thể khác nhau hay không. Lúc đầu, vai trò của các phân nhóm C. acnes cụ thể trong sinh lý bệnh của các bệnh này đã được tiến hành với các kháng thể [15]. Sử dụng các mục tiêu khác nhau như gen tly hoặc gen recA, một số nhóm đã phát triển các phương pháp phân loại phân tử khác nhau [29]. Sau đó, xét nghiệm PCR nhiều phylotype, các sơ đồ trình tự vị trí nhiều loại khác nhau và một sơ đồ trình tự vị trí đơn loại có thể được thực hiện trực tiếp từ các mẫu đã được đề xuất [30–33]. Tuy nhiên, để so sánh khả năng phát sinh loài của các chủng được phân lập lâm sàng được phục hồi trong các bệnh khác nhau, chúng tôi đề xuất một sự đồng thuận với một thuật toán xác định các phân nhóm của C. acnes bằng phương pháp phân loại phân tử [34]. Do đó, đối với mụn trứng cá trung bình đến nặng, các nghiên cứu khác nhau đã chứng minh có tỷ lệ nhiễm cao của phylotype IA1 trong các mẫu tăm bông trên da viêm [35–41]. Ngược lại, chẳng hạn, một bệnh da khác có liên quan đến sự biểu hiện quá mức của phylotype III: dát giảm sắc tố tiến triển [42, 43].
Điều kiện phát triển trong nuôi cấy
Việc nuôi cấy C. acnes thông thường từ các mẫu da đòi hỏi một số chú ý, nhưng trong phòng thí nghiệm vi sinh được đào tạo tốt, việc này vẫn dễ dàng. Có thể sử dụng các phương tiện khác nhau, đôi khi có bổ sung tween chẳng hạn [14]. Các đĩa thạch Schaedler, thạch Brucella, hoặc thạch sôcôla có thể được gieo và ủ yếm khí ít nhất 7–10 ngày ở 37°C [13]. Trong tổn thương mụn trứng cá, các khía cạnh khác nhau của khuẩn lạc có thể được quan sát liên quan đến màu sắc và sự tan máu [44].
Các yếu tố độc lực
C. acnes có thể tạo ra nhiều yếu tố độc lực [45]. Do đó, nó tạo ra các axit béo chuỗi ngắn (dẫn đến tình trạng viêm cục bộ); thiopeptides; bacteriocin [46]; enzym phân hủy như lipase [20], endoglyceramidases, sialidase và hyaluronidase [21]; và các phân tử khác có đặc tính ức chế chống lại các yếu tố gây bệnh như Staphylococcus aureus hoặc Streptococcus pyogenes. C. acnes có thể kích hoạt hệ thống miễn dịch bẩm sinh thông qua kích hoạt thụ thể Toll-like 2 (TLR-2). Các phối tử TLR- 2 khác nhau có thể tham gia vào quá trình kích thích miễn dịch này: axit lipoteichoic và các đoạn peptidoglycan [45] cũng như các protein bề mặt tế bào như các yếu tố Christie-Atkins-Munch- Petersen (CAMP) có hoạt tính đồng tan huyết và đặc tính độc tế bào [47, 48] . C. acnes lipase có một vai trò quan trọng trong việc thủy phân triglyceride của bã nhờn, dẫn đến giải phóng các axit béo gây kích thích trong các đơn vị nang lông tuyến bã, điều này giải thích một phần cơ chế bệnh sinh của mụn trứng cá [13]. Điều thú vị là phylotype IA1 được phục hồi trong 80% tổn thương do mụn trứng cá tạo ra nhiều lipase hơn các loại phylotype khác [49].
Hyaluronidase là một enzym ngoại bào khác có liên quan đến quá trình sinh bệnh của vi khuẩn (tham gia vào quá trình thâm nhập vào chất nền ngoại bào) dẫn đến sự phân hủy axit hyaluronic toàn phần đối với biến thể HYL-IB/II so với sự phân hủy một phần đối với biến thể HLY-IA [13, 21, 50]. Một số chủng C. acnes nhất định, đặc biệt là những chủng có liên quan đến mụn trứng cá, thuộc phylotype I có thể tạo ra chất tán huyết với đặc tính độc tế bào. Valanne và cộng sự đã chứng minh sự hiện diện của năm yếu tố CAMP trong các phân nhóm C. acnes khác nhau. Tuy nhiên, gen camp2 dường như là yếu tố đồng tan huyết có liên quan và tích cực nhất nhưng trong nền tảng di truyền của C. acnes phylotype IA [13, 44, 47]. Cuối cùng, khả năng của các chủng C. acnes tạo màng sinh học trong lâm sàng phần lớn đã được nghiên cứu, đặc biệt là trong các nhiễm trùng liên quan đến thiết bị [51, 52]. Trong lĩnh vực mụn trứng cá, năm 2008, Coenye đề xuất tác động lên mụn trứng cá của các tế bào C. acnes không cuống hoặc có khả năng kháng cao với các chất kháng khuẩn hoặc chịu được với khả năng tăng sản xuất các yếu tố độc lực và điều hòa số lượng phân tử cảm ứng [53]. Trong điều kiện màng sinh học, lipase có hoạt tính ngoại bào lớn hơn [8]. Vào năm 2012, sự hiện diện của các nhóm lớn C. acnes trong các nang lông tuyến bã đã được mô tả. Điều thú vị là, các phylotype khác nhau đã được chứa và cùng tồn tại [54]. Gần đây, Kuehnast et al. gợi ý rằng sự hình thành màng sinh học tương quan với phylotype, hơn là vị trí giải phẫu phân lập. Trong mô hình của họ, phylotype IA1 (SLST loại A1 và A2) cho thấy tạo ra màng sinh học cao hơn [55].
Kháng thuốc trong tình trạng mụn trứng cá
C. acnes nhạy cảm với nhiều loại kháng sinh [14]. Tuy nhiên, đối với tình trạng mụn trứng cá, thuốc kháng sinh nên được sử dụng trong thời gian điều trị ngắn. Thật vậy, từ năm 1979, các chủng kháng thuốc đầu tiên đã được báo cáo [56]. Do đó, kháng erythromycin phần lớn cao hơn so với tetracyclin [57, 58]. Tuỳ theo thói quen điều trị kháng sinh, dịch tễ học kháng thuốc của C. acnes là khác nhau: điều trị tại chỗ hoặc toàn thân, liều lượng, phối hợp, thời gian … Vì vậy, tỷ lệ kháng macrolide có thể thay đổi từ dưới 25% ở Columbia đến gần 90% ở Tây Ban Nha [57]. Tình hình của tetracycline tốt hơn với thấp hơn 10% ở Pháp đến gần 50% ở Ấn Độ [57]. Cơ chế liên quan đến các kháng này là đột biến điểm một cách có hệ thống trên các gen mục tiêu của nhiễm sắc thể: gen mã hóa 23S và ở mức độ thấp hơn là các protein L4 hoặc L22 đối với các macrolide và gen mã hóa 16S đối với tetracyclin [14]. Gần đây, ở Nhật Bản, tác động của việc sử dụng fluoroquinolone bôi tại chỗ đã được báo cáo với sự xuất hiện của các chủng C. acnes kháng thuốc [59] nhưng cũng là một vấn đề đáng lo ngại liên quan đến các thiệt hại bên cạnh với tác động đến sự đề kháng trong hệ vi sinh vật và do đó lựa chọn fluoroquinolone của Staphylococcus epidermidis. [60].
Mụn trứng cá trong kỷ nguyên gen
Vì hệ sinh thái da là một môi trường động và phát triển với nhiều tương tác vi khuẩn, các phương pháp tiếp cận gen, phiên mã và chuyển hóa sẽ giúp chúng ta hiểu rõ hơn về vai trò của các cộng đồng vi khuẩn cụ thể này trong bệnh sinh mụn trứng cá và viêm (Bảng 1.1).
| Bảng 1.1 Tóm tắt danh pháp của các phylotype Cutibacterium acnes và các phức hợp loài dựa trên hai lược đồ MLST chính và các phương pháp phân loại SLST | |||
| Phân loại dựa trên PCR đa kênh | Lược đồ MLST9 Aarhus156 ST | Lược đồ MLST8 Belfast152 ST | Các loại SLST142 |
| IA1 | CC18 | CC1 | A1-45 |
| CC3 | CC3 | C1-6 | |
| CC28 | D1-5 | ||
| CC31 | CC4 | E1-11 | |
| IA2 | CC28 | CC2 | F1-18 |
| IB | CC36 | CC5 | H1-10 |
| IC | Singletons | CC107 | G1 |
| II | CC53 | CC6 | K1-27 |
| CC60 | CC72 | ||
| III | CC43 | CC77 | L1-10 |
Lưu ý rằng lược đồ MLST Aarhus có thể phát hiện CC28 trong các nhóm IA1 và IA2.
Phức hợp vô tính CC, phân loại trình tự đa vị trí MLST, phân loại trình tự đơn vị trí SLST, loại trình tự ST.
Cập nhật lần cuối MLST9: ngày 22 tháng 9 năm 2019.
Cập nhật lần cuối MLST8: ngày 22 tháng 9 năm 2019.
Cập nhật lần cuối SLST: ngày 22 tháng 9 năm 2019.
Tương tác giữa Cutibacterium acnes
và hệ vi sinh vật ở da Hệ vi sinh vật trên da người là một hỗn hợp độc đáo và phức tạp của các nhóm vi sinh vật khác nhau. Da người chứa vi khuẩn (kỵ khí, ưa khí hoặc kỵ khí dễ sinh sản), virus, nấm và bacteriophage. Tồn tại các tương tác chéo giữa các loài trong cộng đồng vi sinh vật trên da. Những tương tác này diễn ra thông qua các cách khác nhau, đặc biệt là điều hòa tăng trưởng, cảm ứng số lượng, điều hòa tổng hợp màng sinh học (biofilm) và trao đổi túi ngoại bào. Sự cân bằng mong manh giữa sự phát triển và ức chế của từng loài vi sinh vật trên da là yếu tố đảm bảo cân bằng nội môi của da và hàng rào chức năng của da.
Trước hết, điều hòa sinh trưởng có thể thực hiện được thông qua việc sản xuất một số loại phân tử hoạt tính sinh học có khả năng tiêu diệt và/hoặc ức chế sự phát triển của một số vi khuẩn nhất định. Để minh họa hiện tượng này, Christensen et al. cho thấy rằng các chủng Staphylococcus epidermidis sở hữu một kho các cơ chế để ức chế sự phát triển của C. acnes. Các điều hoà tăng trưởng này là kết quả của việc sản xuất các phân tử hoạt tính sinh học được gọi là bacteriocin, chẳng hạn như epidermin do S. epidermidis sản xuất [22]. Các phân tử này hoạt động trên màng tế bào chất của vi khuẩn Gram dương. Một ví dụ khác về phân tử hoạt tính sinh học là gallidermin. Phân tử này đã được thử nghiệm thành công trong một công thức bôi trên da chuột cho thấy khả năng kháng khuẩn chống lại C. acnes và S. aureus [61]. Một ví dụ khác được báo cáo bởi Wang et al. liên quan đến khả năng ức chế của C. acnes đối với sự phát triển của Staphylococcus aureus kháng methicillin trong mô hình in vitro [62].
Thứ hai, cảm ứng số lượng (quorum sensing, QS) là một cách để tương tác giữa các vi khuẩn cho phép điều chỉnh sự biểu hiện gen của vi khuẩn để đáp ứng với những thay đổi về mật độ tế bào. Nó cho phép chúng cảm ứng số lượng vi khuẩn trong quần thể của chúng (mật độ tế bào), tích hợp và xử lý các thông số môi trường và thay đổi đồng bộ hoạt động của chúng bằng cách biểu hiện các gen mục tiêu cụ thể [63, 64]. Ngày nay, ngày càng có nhiều bằng chứng liên quan đến tương tác giữa các loài, liên chi và liên miền sử dụng các phân tử nhỏ có khả năng khuếch tán được đặt tên là “quoromones” hoặc “autoinducers” [65]. Ở vi khuẩn Gram dương như Cutibacterium acnes, các phân tử này thường là oligopeptide [65]. Về quan điểm lâm sàng, gần đây có ý kiến cho rằng các đột biến QS của mầm bệnh ở người bị giảm độc lực [66, 67] nhanh chóng dẫn đến quan niệm sử dụng chất ức chế QS để kiểm soát một số bệnh [63].
Sau đó, QS biểu hiện như một cách để điều chỉnh các quần thể vi sinh vật giữa các hệ vi sinh vật trên da, như đã đề xuất trước đây [68], và thậm chí có thể liên quan đến sinh lý bệnh của các bệnh da như mụn trứng cá [69]. Sau đó, tương tác giữa các loài cũng được mô tả thông qua điều hoà tổng hợp màng sinh học. Loại cơ chế này đã được báo cáo trước đây giữa Staphylococcus aureus và C. acnes [70]. Trong nghiên cứu này, các tác giả đã chứng minh rằng C. acnes có thể có ảnh hưởng đến hoạt động của S.aureus. Nghiên cứu này gợi ý rằng C. acnes có thể tạo ra một yếu tố hoặc cung cấp một môi trường thúc đẩy sự hình thành màng sinh học tụ cầu. Vì coproporphyrin III được biết là gây ra sự kết tụ S. aureus ở các chủng được phân lập trên da, nên có thể phân tử này cũng có thể gây ra sự hình thành màng sinh học hoặc có thể có một cơ chế khác hiện chưa được mô tả [71].
Cuối cùng, trao đổi túi ngoại bào (EV) ngày nay được coi là một nhân tố quan trọng trong tương tác của vi khuẩn [72]. Tất cả các vi khuẩn đều có khả năng tạo ra loại chất truyền tin tự nhiên này, bao gồm cả vi khuẩn Gram dương [73]. Gần đây, C. acnes được mô tả là có thể tạo ra EV [74]. Các EV của vi khuẩn này cho phép tương tác giữa các vi khuẩn mà còn giữa chúng với các tế bào chủ như tế bào sừng trong môi trường da, đặc biệt là thông qua các con đường tín hiệu qua trung gian TLR2 [75]. Thật vậy, Choi et al. đã mô tả rằng sự xâm nhập của các EV có nguồn gốc từ C. acnes vào tế bào sừng là qua trung gian của quá trình nội bào phụ thuộc clathrin, và theo cách này, vật chất bên trong của các EV này có thể được đưa vào tế bào sừng. Trong ví dụ này, Choi et al. đã chứng minh rằng các EV có nguồn gốc từ C. acnes có thể tạo ra kiểu hình giống mụn trứng cá trong tế bào sừng và xác nhận kết quả của họ trong một mô hình biểu bì người được hoàn nguyên. Ngoài ra, một nghiên cứu cụ thể báo cáo sự có thể điều chỉnh giữa các quần thể vi khuẩn từ các vi sinh vật khác nhau bằng cách sử dụng con đường EV, để bảo vệ da khỏi tình trạng viêm do mầm bệnh gây ra. Thật vậy, trước đây đã có báo cáo rằng EVs từ Lactobacillus plantarum, một sinh vật hội sinh được tìm thấy trong đường tiêu hóa, có thể bảo vệ khỏi bệnh viêm da cơ địa dị ứng do EV có nguồn gốc S. aureus gây ra. Các ứng dụng lâm sàng sau đó được đề xuất sử dụng EV có nguồn gốc từ L. plantarum, dựa trên tiềm năng điều chỉnh của chúng đối với các mầm bệnh trên da như S. aureus. Một triển vọng lâm sàng khác đã được đề xuất trong y văn, dựa trên sự ức chế giải phóng EVs từ C. acnes để tránh giải phóng cytokine gây viêm từ tế bào sừng và sự xuất hiện kiểu hình mụn trứng cá [75].
Tổng hợp lại, các yếu tố của y văn nhấn mạnh tầm quan trọng của các tương tác chéo giữa các loài thích hợp. Thật vậy, sự mất cân bằng trong các tương tác vi sinh vật này có thể gây nguy hiểm cho các mối quan hệ giữa hệ vi sinh vật ở da và tế bào vật chủ và có thể dẫn đến các bệnh viêm da, nơi rối loạn sinh học thường được coi là một tác nhân mạnh.
Hệ vi sinh vật trên da hiện diện như một phần cơ quan phức tạp và đa yếu tố của da, mà quá trình điều chỉnh hiện nay được cho là có thể điều trị các bệnh viêm da, như đã được đề xuất gần đây trong tình trạng mụn trứng cá [76]. Thật vậy, vì tình trạng kháng kháng sinh đang ngày càng gia tăng, đặc biệt là trong bệnh trứng cá [77, 78], các giải pháp probiotic hiện nay được xem là một giải pháp thay thế thú vị cho các phương pháp điều trị bằng kháng sinh và cũng là lựa chọn mới được bổ sung vào kho điều trị hiện tại của các bác sĩ lâm sàng (Hình 1.1).
Cutibacterium acnes và khả năng miễn dịch tự nhiên
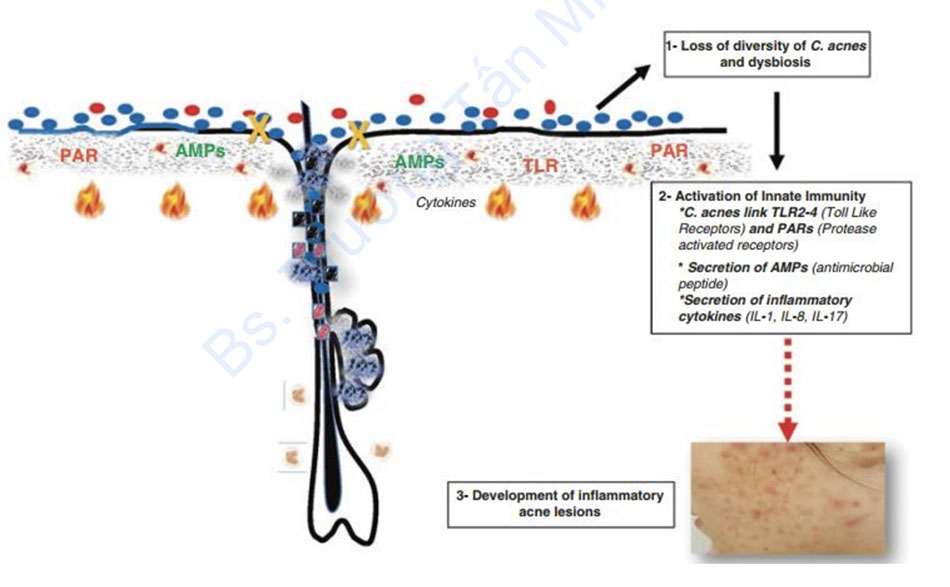
Da với hệ vi sinh vật của nó phát triển một loạt các phản ứng miễn dịch tự nhiên để bảo vệ cơ thể chống lại nhiễm trùng. Trái ngược với hệ vi sinh vật đường ruột được ngăn cách vật lý khỏi biểu mô bởi một lớp chất nhầy dày đặc trong ruột già, hệ vi sinh vật ở da tiếp xúc chặt chẽ với biểu bì. Điều quan trọng là phản ứng miễn dịch phải được chuẩn bị trước để nhận biết và điều chỉnh để đáp ứng với một mối đe dọa thích hợp, vì bất kỳ phản ứng miễn dịch nào đối với các tác nhân hội sinh có thể dẫn đến bệnh mãn tính. Tế bào sừng và tế bào tuyến bã (sebocyte) là các loại tế bào chính của lớp biểu bì và tích cực tham gia vào quá trình miễn dịch tự nhiên, là nguồn cung cấp peptit kháng khuẩn và cytokine kích hoạt phản ứng viêm khi biểu mô tiếp xúc với các loại phân tử liên quan đến tổn thương/gây bệnh (D/PAMP), chủ yếu đại diện bởi các phối tử Toll-like receptor 2, 4 và 6 (TLR) và các phối tử proteaseactiised receptor (PAR)-2 liên kết với các thụ thể tương ứng được biểu hiện trên/trong tế bào sừng và tế bào tuyến bã [79]. Việc kích hoạt miễn dịch tự nhiên có vẻ khác nhau tùy theo loại da và phylotype của C. acnes. Trong một nghiên cứu, loại IC được phân lập ở da bình thường sẽ gây tiết IL-8 trong tế bào sừng cao hơn loại IA [80]. Ngược lại, các loại IA và IB của C. acnes được tìm thấy tạo ra mức độ β-defensin 2 (hBD2) của người từ các tế bào tuyến bã được nuôi cấy cao hơn so với phân lập loại II [81, 82], chứng tỏ rằng C. acnes loại III có khả năng chống viêm cao nhất bằng cách điều chỉnh sự biểu hiện của PAR-2, TNF-alpha, MMP-13 và TIMP-2, trong khi Cutibacterium avidum có khả năng yếu nhất bằng cách chỉ điều hòa MMP-13 và TIMP-2 [82].
C. acnes có thể cảm ứng IFN-γ từ tế bào NK bằng cơ chế liên quan đến việc giải phóng RNA và một con đường tự nhiên phụ thuộc vào sự hoạt hóa TLR8 và sự tiết IL-12p40 và IL18 [83]. Ngoài IL-8, trong quá trình viêm do C. acnes kích hoạt, sự bài tiết IL-1β của bạch cầu đơn nhân và tế bào tuyến bã trong suốt quá trình kích hoạt gen viêm chính
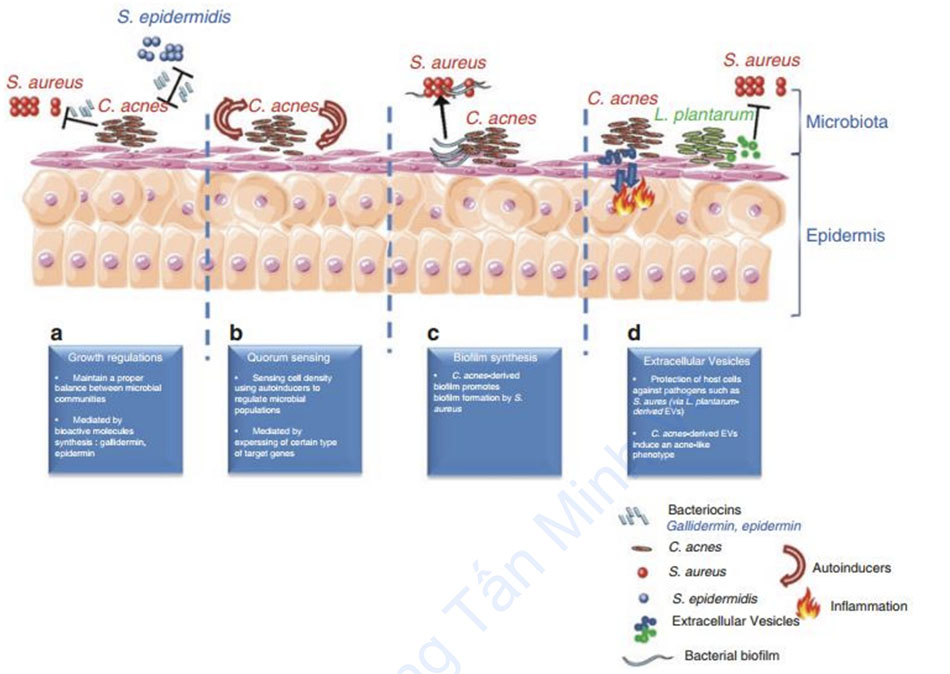
từ C. acnes có thể thúc đẩy sự tổng hợp màng sinh học của S. aureus. (d) Các túi ngoại bào có thể mang các tín hiệu thúc đẩy tương tác giữa các loài giữa các loài và cả vật chủ/hệ vi sinh vật.
NLRP3 đã được ghi nhận [84]. Cơ chế này được điều chỉnh bởi các protease và các loài phản ứng oxy. Hơn nữa, C. acnes thúc đẩy các phản ứng Th17 / Th1 hỗn hợp bằng cách gây ra sự tiết đồng thời IL-17A và IFN-γ từ các tế bào T CD4 + cụ thể trong ống nghiệm. Do đó, sự hiện diện của tế bào T nhạy cảm với IL-17 và sự kích hoạt các cytokine liên quan đến Th17 trong các tổn thương mụn trứng cá cho thấy con đường Th17 có thể đóng một vai trò quan trọng trong quá trình bệnh, có thể đưa ra các mục tiêu điều trị mới [85]. Gần đây, người ta đã chứng minh rằng IL-17 được tăng lên trong huyết thanh của bệnh nhân mụn trứng cá [86]. Ngoài các cytokine, các peptide kháng khuẩn (AMP) là chất điều hoà quan trọng đối với tình trạng viêm da và thuộc về khả năng miễn dịch tự nhiên. Có bằng chứng chắc chắn rằng AMP đóng một vai trò trong cơ chế bệnh sinh của các tổn thương mụn viêm. Các AMP có nguồn gốc từ da bao gồm họ β-defensins, protein S100, RNases và cathelicidin LL-37. Trong khi một số AMP được tiết ra một cách hợp lý, hBD- 2 và hBD-3 và LL-37 được điều tiết trong các tổn thương mụn trứng cá và được tạo ra bởi các bề mặt nuôi cấy của C. acnes in vitro cả trong tế bào sừng [48] và trong tế bào tuyến bã [87]. RIS-1/psoriasin là một peptide kháng khuẩn biểu mô, có biểu hiện được điều chỉnh trong các bệnh viêm da bao gồm mụn trứng cá và do retinoids gây ra. Tình trạng viêm điều chỉnh sự ngăn chặn của RIS-1 /psoriasin trong các tuyến bã nhờn và vỏ gốc nang lông với sự gia tăng biểu hiện của nó, do đó làm cho AMP này trở thành mục tiêu mới của phương pháp điều trị mụn trứng cá [88].
Mụn trứng cá có liên quan đến sự phát triển của sẹo ở nhiều bệnh nhân. Gần đây, chúng tôi cho thấy rằng trên da của những bệnh nhân bị mụn trứng cá dễ bị sẹo so với không dễ bị sẹo, TLR-4, IL-2, IL- 10, TIMP-2 và JUN bị biểu hiện quá mức và mức protein MMP-9 giảm. Kết quả tương tự cũng thu được ở các sẩn viêm, ngoại trừ TLR-4. Do đó, những kết quả này cho thấy mối liên hệ giữa các biểu hiện ban đầu của tình trạng viêm với mức độ kích hoạt miễn dịch tự nhiên trong lớp biểu bì bình thường của bệnh nhân mụn trứng cá và sự phát triển của sẹo cho thấy tầm quan trọng của việc điều trị viêm ở mụn trứng cá để ngăn ngừa sự phát triển của sẹo [89]. TGF-β1 cũng có thể đóng một vai trò trong sự phát triển của sẹo vì nó tăng cao ở các tổn thương của bệnh nhân mụn trứng cá, những người dễ bị sẹo [90].
Một câu hỏi quan trọng trong lĩnh vực vi sinh vật là tại sao các tế bào lại chuyển từ trạng thái dung nạp miễn dịch sang trạng thái viêm mãn tính trong trường hợp không bị nhiễm trùng. Trong trường hợp phát triển mụn trứng cá, sự thay đổi động trong vi môi trường của nang lông do tăng tiết bã nhờn có thể kích hoạt phản ứng phiên mã khác nhau của hệ vi sinh vật. Do đó, việc nuôi cấy C.acnes trong một môi trường giàu lipid, thiếu oxy tương tự như trong môi trường nang lông bít tắc sẽ thúc đẩy quá trình lên men kỵ khí và sản xuất các axit béo chuỗi ngắn kích hoạt cơ chế biểu sinh để tăng cường sản xuất IL-6, IL-8 và TNFα qua trung gian TLR2 trong tế bào sừng của người [91] (Hình 1.2).
Lựa chọn thay thế nào trong tương lai?
Việc phát triển các phương pháp điều trị mới chống lại bệnh lý đòi hỏi kiến thức tốt và vững vàng về sinh lý bệnh và các con đường liên quan để nhắm mục tiêu tốt hơn các yếu tố liên quan đến bệnh lý và ít gây ra tác dụng phụ. Hiện nay, cơ chế sinh lý bệnh chính xác của mụn trứng cá mới chỉ được biết một phần. Sự liên quan chủ yếu của C. acnes còn là một câu hỏi vì kiến thức mới nhất cho thấy rằng tình trạng mụn trứng cá và tình trạng viêm gây ra bị chi phối bởi sự kết hợp phức tạp của nhiều yếu tố. Những yếu tố này chủ yếu phụ thuộc vào hệ vi sinh, vi môi trường, giới tính, tuổi tác và các yếu tố nội tại của mỗi cá nhân.
Trong các phương pháp điều trị hiện nay, việc quản lý mụn trứng cá chủ yếu thay đổi tùy theo mức độ nghiêm trọng của mụn trứng cá. Các phác đồ kiểm soát được công bố [92] bao gồm điều trị tại chỗ (kháng sinh, retinoids, benzoyl peroxide và axit salicylic / azelaic) và điều trị toàn thân (kháng sinh, retinoids, kẽm) [93]. Một số nghiên cứu chỉ ra rằng mục tiêu nghiên cứu chính của điều trị mụn là nhắm vào C. acnes và tình trạng viêm gây ra, tăng tiết bã nhờn và tăng sừng hóa [94]. Song song đó, thuốc kháng sinh điều chỉnh C. acnes và có tác dụng chống viêm [95]. Benzoyl peroxide và axit azelaic ức chế sự xâm nhập của C. acnes và có tác dụng tiêu nhân mụn và chống viêm/ kháng khuẩn [96–98]. Retinoids dạng uống hoặc isotretinoin có khả năng được sử dụng để điều trị mụn trứng cá nặng. Các phân tử này tác động vào sản xuất bã nhờn và điều chỉnh phản ứng miễn dịch tự nhiên qua trung gian C. acnes/TLR-2- [99]. Retinoids toàn thân có thể gián tiếp điều chỉnh vi khuẩn da và giảm số lượng C. acnes, gây ra những thay đổi trong sự đa dạng của vi sinh vật [93, 100].
Mặc dù một số hiệu quả đã được chứng minh của các phương pháp điều trị hiện tại, tác dụng phụ trên da của các sản phẩm bôi ngoài da, tác dụng toàn thân của isotretinoin, sự kháng thuốc do vi khuẩn gây ra và bệnh mãn tính của mụn trứng cá khuyến khích nghiên cứu khám phá các liệu pháp nhắm mục tiêu, tôn trọng sự đa dạng của hệ vi sinh vật và gây ra ít tác dụng phụ hơn. Hiện nay, có 4 trục chính trong quá trình phát triển: chế phẩm sinh học, vắc xin, thể thực khuẩn (phages) và liệu pháp peptide kháng khuẩn.
Tiếp cận hệ vi sinh vật và Probiotics
Việc uu tiên sử dụng liệu pháp kháng sinh để loại bỏ C. acnes, được coi là tác nhân chính gây mụn trứng cá, trong một thời gian dài ngày càng ít được khuyến khích, đặc biệt là trong đơn trị liệu bằng đường uống [92] vì ít nhất hai lý do chính: phát triển khả năng kháng thuốc kháng sinh và phá vỡ hệ vi sinh của da và đường ruột (mất tính đa dạng của vi khuẩn), đây là một vấn đề quan trọng trong tình trạng khỏe mạnh bình thường. Hơn nữa, người ta biết rằng phylotype IA1 được biểu hiện quá mức và liên quan đến mụn trứng cá từ trung bình đến nặng [37–39]. Song song, rối loạn sinh học ở bệnh nhân mụn trứng cá có liên quan đến việc giảm số lượng S. epidermidis có khả năng kiểm soát sự sinh sôi của C. acnes thông qua việc giải phóng axit succinic và sản phẩm lên men axit béo [23]; bằng cách này, việc tiêu diệt C. acnes có hệ thống dường như không còn là một chiến lược phù hợp nữa. Do đó, bây giờ cần phải tính đến các loại vi khuẩn khác cấu thành hệ vi sinh vật trên da. Trạng thái ổn định của hệ vi sinh vật và việc giữ gìn nó rất phức tạp và ít được biết đến. Gần đây, dữ liệu từ một nghiên cứu lâm sàng cho thấy họ Propionibacteriaceae và họ Staphylococcaceae tương ứng bị đại diện quá mức đáng kể ở nhóm chứng khỏe mạnh và bệnh nhân bị mụn trứng cá [101].
Không chỉ nhắm mục tiêu C. acnes, các định hướng nghiên cứu mới nhằm phát triển các phương pháp điều trị mới cho mỗi chương trình hoặc các công thức bôi tại chỗ dựa trên chế phẩm sinh học. Các phương pháp tiếp cận sáng tạo này nhằm khôi phục sự đa dạng của hệ vi sinh vật trên da và loại bỏ các loài gây bệnh và gây ra tình trạng viêm ở mụn trứng cá và các bệnh viêm khác [79, 93, 102].
Những kiến thức gần đây đã chứng minh rằng sự rối loạn vi sinh vật trong da và ruột có liên quan đến nhiều bệnh viêm mãn tính. Việc cải thiện chứng loạn khuẩn và phục hồi hệ vi sinh vật bình thường trên da là những chiến lược điều trị đầy hứa hẹn đã được thử nghiệm trong chứng loạn khuẩn đường ruột bằng cách uống men vi sinh, các vi sinh vật sống có lợi cho sức khỏe của vật chủ hoặc bằng cách cấy phân với viên thuốc bao bọc phân của người khỏe mạnh có chứa hệ vi sinh vật đường ruột của người đó. Cấy phân đã được sử dụng trong các trường hợp nhiễm trùng do Clostridium difficile, trong hội chứng ruột kích thích hoặc trong bệnh viêm đại tràng. Việc cấy hệ vi sinh vật trong phân đã được chứng minh là an toàn và hiệu quả đối với bệnh nhân nhiễm trùng do Clostridium difficile [103].
Phương pháp điều trị cho bệnh loạn khuẩn da hiện chưa được phát triển và một số thử nghiệm đã được tiến hành trong các tình trạng viêm nhiễm như viêm da dị ứng, bệnh vẩy nến và mụn trứng cá [76, 104]. Điều trị tại chỗ bao gồm vi khuẩn hội sinh Vitreoscilla filiformis được sử dụng ở bệnh nhân viêm da cơ địa dị ứng cho thấy cải thiện lâm sàng đáng kể với giảm điểm SCORAD (thang điểm viêm da cơ địa dị ứng) và ngứa [104]. Hơn nữa, phương pháp dựa trên các chủng vi khuẩn cụ thể được chọn lọc từ hệ vi sinh vật trên da để điều trị bệnh nhân viêm da cơ địa dị ứng đã được chứng minh để loại bỏ S. aureus và khôi phục hệ vi sinh vật cân bằng [105].
Một số dữ liệu đã chỉ ra rằng probiotic có thể gây ra sự ức chế C. acnes với các protein kháng khuẩn như Streptococcus salivarius ngăn chặn sự phát triển của C. acnes bằng cách tiết ra một chất ức chế giống như bacteriocin [106]. Điều trị tại chỗ bằng kem có chứa Streptococcus thermophiles đã được chứng minh là có hoạt tính kháng khuẩn chống lại C. acnes bằng cách sản xuất ceramide [107]. Probiotics cũng có vai trò trên phản ứng miễn dịch bằng cách ức chế cytokine IL-8 gây viêm từ tế bào sừng [108], bằng cách ức chế tình trạng viêm da do chất P gây ra [109].
Một số thử nghiệm lâm sàng đã được thực hiện trên bệnh nhân mụn trứng cá để điều tra lợi ích lâm sàng của probiotic [93]. Bôi tại chỗ Enterococcus faecalis cho thấy giảm đáng kể tổn thương mụn viêm so với giả dược [110]. Điều trị bằng Lactobacillus plantarum cũng làm giảm mức độ nghiêm trọng của mụn trứng cá và ban đỏ liên quan [111]. Điều thú vị là, sự kết hợp của Bifidobacterium bifidum và L. acidophilus đông khô được sử dụng như một chất bổ sung để điều trị mụn trứng cá cho thấy khả năng giải quyết mụn trứng cá cao hơn so với nhóm không bổ sung [112].
Khái niệm mới trong phát triển thuốc trị mụn, mặc dù C. acnes được hàm ý trong mụn trứng cá, tính đến rằng C. acnes cũng có thể đóng vai trò bảo vệ da bằng cách duy trì lâu dài mức độ thấp của kích hoạt miễn dịch tự nhiên, và do đó các lựa chọn điều trị tôn trọng sự cân bằng của C. acnes là một giải pháp thay thế thích hợp để điều trị mụn trứng cá [94]. Một nghiên cứu lâm sàng đang tiến hành điều tra vai trò của hệ vi sinh vật trên da và khả năng sử dụng kem bôi lợi khuẩn (kem YUN ACN) để điều trị mụn trứng cá [113].
Gần đây, một số dữ liệu đã công nhận tác dụng có lợi của S.epidermidis trong sinh lý bệnh của mụn trứng cá bằng cách hạn chế sự xâm nhập của C. acnes trên da và tình trạng viêm [23]. Tuy nhiên, S.epidermidis biểu hiện quá mức có thể gây nhiễm trùng bệnh viện. Do đó, để tôn trọng cân bằng nội môi của da, các phương pháp điều trị trong tương lai có thể dựa trên chế phẩm sinh học có nguồn gốc từ S. epidermidis để cho phép phục hồi hệ vi sinh vật bình thường của da và nhắm mục tiêu điều hòa các chất trung gian AMP của vật chủ, mà không làm tăng quần thể S. epidermidis [23] .
Tiếp cận liệu pháp thể thực khuẩn (phage)
Sự phát triển của liệu pháp phage (thể thực khuẩn) trong mụn trứng cá sẽ phù hợp để nhắm mục tiêu vào chủng C. acnes cụ thể có liên quan đến mụn trứng cá và bảo tồn tính đa dạng của hệ vi sinh vật trên da khỏe mạnh. Điều này dựa trên thực tế là ở những bệnh nhân bị mụn trứng cá, thể thực khuẩn C. acnes trên da xuất hiện nhiều hơn ở da của những bệnh nhân khỏe mạnh [18] và rằng sự gia tăng số lượng phage khi tuổi càng cao sẽ liên quan đến sự biến mất của mụn trứng cá ở những người lớn tuổi. Bacteriophages, thành phần ít được hiểu biết nhất của hệ vi sinh vật ở người, là các loại virus có thể lây nhiễm và tiêu diệt vi khuẩn. Điều thú vị là người ta đã chỉ ra rằng các chủng C. acnes loại I dường như dễ bị nhiễm thể thực khuẩn hơn so với các chủng từ nhóm phylogroup loại II [114]. Tác động thú vị này của thể thực khuẩn lên C. acnes loại I gần đây đã được xác nhận và nêu chi tiết hơn bởi Liu và cộng sự, người đã thử các chủng C. acnes khác biệt về mặt di truyền với 15 phage khác nhau và nhận thấy rằng các chủng từ nhóm phylogroup loại IA1 và IA2 nhạy cảm hơn với sự lây nhiễm, trong khi những chủng từ nhóm phylogroup loại IB, II và III dường như kháng nhiều hơn [18].
Những dữ liệu này cho thấy rằng các chiến lược kháng virus trên một số chủng C. acnes nhất định có thể bình thường hóa hệ vi sinh vật trên da và cho phép một liệu pháp cá thể hóa tiềm năng dựa trên một thể thực khuẩn đã được chọn lọc tốt. Mặc dù cách tiếp cận này có vẻ hấp dẫn, nhưng ít dữ liệu có sẵn về các phương pháp điều trị với nền tảng là thực khuẩn thể cho mụn trứng cá.
Tiếp cận phương pháp
Vaccine C. acnes có khả năng tạo ra nhiều yếu tố độc lực được tiết ra hoặc cố định trong thành tế bào và kích thích các tế bào vật chủ lân cận, gây viêm và tổn thương tế bào. Trong số đó có yếu tố CAMP, một yếu tố độc lực bài tiết tạo thành nguồn viêm thiết yếu trong sinh lý bệnh mụn trứng cá [115].
Các phylotype C. acnes khác nhau giải phóng các yếu tố CAMP khác nhau có thể giải thích khả năng gây bệnh của các phylotype khác nhau. Bộ gen của C. acnes chứa năm gen mã hóa năm CAMP tương đồng bao gồm cả yếu tố CAMP 2, một yếu tố hoạt tính đồng tan huyết của C. acnes [116].
Nó đã được chứng minh rằng yếu tố CAMP của C. acnes có tính sinh miễn dịch [117] và những con chuột được tiêm chủng bởi yếu tố CAMP biểu hiện quá mức ở Escherichia coli đã được bảo vệ điều trị chống lại C. acnes [117–119]. Hơn nữa, sự đột biến của yếu tố CAMP dẫn đến ít ảnh hưởng hơn đến viêm do C. acnes gây ra ở chuột, chứng tỏ vai trò thiết yếu của yếu tố CAMP trong độc tính tế bào của C. acnes [115]. Việc ủ các mẫu cấy mụn ngoài cơ thể với kháng thể nhắm mục tiêu yếu tố CAMP đã cho thấy làm giảm IL-8 và IL-1β, thường biểu hiện ở mức độ cao hơn trong các tổn thương mụn. Nó cũng đã được công bố rằng phương pháp tiêm vaccine bằng cách sử dụng sialidase bề mặt [120] hoặc dùng C. acnes bị tiêu diệt bằng nhiệt [121] làm kháng nguyên làm giảm đáng kể tình trạng viêm do C.acnes gây ra.
Tất cả những dữ liệu này mang lại một lý do có giá trị để xem xét việc tiêm chủng sử dụng yếu tố CAMP C. acnes như một mục tiêu đầy hứa hẹn cho liệu pháp miễn dịch trị mụn trứng cá. Vì C. acnes phylotype IA1 được biết đến rộng rãi là có liên quan đến mụn trứng cá, song song, sự biểu hiện CAMP2 cao hơn được phát hiện ở phylotype IA so với các phylotype khác, CAMP2 dường như là yếu tố độc lực đạt chuẩn và hiệu quả nhất được nhắm mục tiêu bởi chiến lược vaccine.
Có ý kiến cho rằng vì CAMP2 được biểu hiện bởi tất cả các chủng khác, nên điều quan trọng đối với sự tồn tại bình thường của các loài hội sinh là việc tiêm vaccine nhắm mục tiêu CAMP2 cũng có thể ảnh hưởng đến các chủng C. acnes liên quan đến cân bằng nội môi trên da và có thể gây ra sự xâm nhập của các tác nhân gây bệnh. Do đó, các mục tiêu tiêm chủng lý tưởng phải có độ đặc hiệu cao để tránh các tác dụng phụ không mong muốn do loại bỏ các vi khuẩn cần thiết. Mặc dù hiện tại đã thừa nhận rằng C. acnes phylotype IA1 có liên quan nhiều đến mụn trứng cá, gần đây nhóm của chúng tôi đã chứng minh rằng mức độ nghiêm trọng của mụn trứng cá phụ thuộc vào mức độ cơ bản của khả năng miễn dịch tự nhiên ở những bệnh nhân dễ bị mụn trứng cá nặng [36, 89]. Hơn nữa, các nghiên cứu gần đây báo cáo rằng mụn trứng cá nghiêm trọng có liên quan đến sự mất đa dạng của phylotype C. acnes quan trọng và sự mất đa dạng này có khả năng gây ra phản ứng viêm da [37, 122]. Xem xét những dữ liệu này, nó có thể phù hợp và liên quan đến việc nhắm vào các yếu tố độc lực được tiết ra hơn là tập trung vào chiến lược tiêm vaccine nhằm tiêu diệt C. acnes hoặc nhắm vào một kháng nguyên bề mặt. Việc ức chế cụ thể các yếu tố độc lực được tiết ra sẽ hạn chế nguy cơ nhắm mục tiêu không mong muốn vào vi khuẩn không gây bệnh và khắc phục khả năng lựa chọn vi khuẩn kháng thuốc [116].
Mặc dù cách tiếp cận tiêm vaccine CAMP2 có vẻ hấp dẫn, nhưng vẫn cần có các nghiên cứu bổ sung để điều tra tác động của việc tiêm vaccine đối với hệ vi sinh vật và cũng để chứng minh rằng cách tiếp cận như vậy sẽ không gây ra loạn khuẩn, dẫn đến các bệnh lý ở da.
Phần kết luận
Trong 3 năm gần đây, nhiều dữ liệu mới liên quan đến C. acnes làm thay đổi sâu sắc sinh lý bệnh của mụn trứng cá. Đầu tiên, nó đổi tên từ P. acnes thành C. acnes. Vai trò của nó như vi khuẩn hội sinh ngày càng được biết đến nhiều hơn. Ngoài ra, cùng lúc đó, vai trò của nó trong sinh lý bệnh của mụn trứng cá cũng phát triển. C. acnes hiện đã được công nhận là có thể tạo ra nhiều yếu tố độc lực và do đó là một trong những vi khuẩn gây viêm da nhất. Hơn nữa, sáu phylotype chính khác nhau của C. acnes có thể kích hoạt khả năng miễn dịch tự nhiên khác nhau, liên tục tương tác với C. acnes thông qua cytokine, peptide kháng khuẩn và các thụ thể cụ thể được biểu hiện bởi tế bào sừng và các tế bào da khác (TLR, PAR). Cho đến gần đây, mức độ nghiêm trọng của các tổn thương viêm ở mụn trứng cá được coi là liên quan trực tiếp đến sự sinh sôi của vi khuẩn. Nhưng hiện nay, tình trạng viêm được coi là có liên quan đến mức độ nghiêm trọng của tình trạng rối loạn sinh học của hệ vi sinh vật với sự mất đa dạng của các phylotype C. acnes kết hợp với sự biểu hiện quá mức của phylotype IA1. Ở cấp độ điều trị, hậu quả là rất quan trọng vì mục tiêu của các phương pháp điều trị mới không phải là tiêu diệt C. acnes mà là tái cân bằng hệ vi sinh vật để làm cho nó càng gần với hệ vi sinh vật của da bình thường càng tốt. Do đó, các phương pháp tiếp cận mới với vaccine, peptit kháng khuẩn, probiotic và liệu pháp thể thực khuẩn được phát triển trong mụn trứng cá.
Tải về bài viết dưới dạng word: Cập nhật về Cutibacterium acnes – Bác sĩ Trương Tấn Minh Vũ.
Tài liệu tham khảo
1. Johnson MT, Roberts J. Skin conditions and related need for medical care among persons 1–74 years. United States, 1971–1974. Vital Health Stat 11. 1978;(212):i–v, 1–72.
2. Wolkenstein P, Grob J-J, Bastuji-Garin S, Ruszczynski S, Roujeau J-C, Revuz J, et al. French people and skin diseases: results of a survey using a representative sample. Arch Dermatol. 2003;139(12):1614–9; discussion 1619.
3. Rea JN, Newhouse ML, Halil T. Skin disease in Lambeth. A community study of prevalence and use of medical care. Br J Prev Soc Med. 1976;30(2):107–14.
4. Bhate K, Williams HC. Epidemiology of acne vulgaris. Br J Dermatol. 2013;168(3):474–85.
5. Oh J, Byrd AL, Deming C, Conlan S, NISC Comparative Sequencing Program, Kong HH, et al. Biogeography and individuality shape function in the human skin metagenome. Nature. 2014;514(7520):59–64.
6. Byrd AL, Belkaid Y, Segre JA. The human skin microbiome. Nat Rev Microbiol. 2018;16(3):143–55.
7. Grice EA, Segre JA. The skin microbiome. Nat Rev Microbiol. 2011;9(4):244–53.
8. Dréno B, Pécastaings S, Corvec S, Veraldi S, Khammari A, Roques C. Cutibacterium acnes (Propionibacterium acnes) and acne vulgaris: a brief look at the latest updates. J Eur Acad Dermatol Venereol. 2018;32(Suppl 2):5–14.
9. Dréno B. What is new in the pathophysiology of acne, an overview. J Eur Acad Dermatol Venereol. 2017;31(Suppl 5):8–12.
10. Rocha MA, Bagatin E. Skin barrier and microbiome in acne. Arch Dermatol Res. 2018;310(3):181–5.
11. Cummins CS, Johnson JL. Corynebacterium parvum: a synonym for Propionibacterium acnes? J Gen Microbiol. 1974;80(2):433–42.
12. Corvec S, Dagnelie M-A, Khammari A, Dréno B. Taxonomy and phylogeny of Cutibacterium (formerly Propionibacterium) acnes in inflammatory skin diseases. Ann Dermatol Venereol. 2019;146(1):26–30.
13. Corvec S. Clinical and biological features of cutibacterium (Formerly Propionibacterium) avidum, an underrecognized microorganism. Clin Microbiol Rev. 2018;31(3):e00064-17.
14. Aubin GG, Portillo ME, Trampuz A, Corvec S. Propionibacterium acnes, an emerging pathogen: from acne to implant-infections, from phylotype to resistance. Méd Mal Infect. 2014;44(6):241–50.
15. McDowell A, Valanne S, Ramage G, Tunney MM, Glenn JV, McLorinan GC, et al. Propionibacterium acnes types I and II represent phylogenetically distinct groups. J Clin Microbiol. 2005;43(1):326–34.
16. McDowell A, Perry AL, Lambert PA, Patrick S. A new phylogenetic group of Propionibacterium acnes. J Med Microbiol. 2008;57(Pt 2):218–24.
17. McDowell A, Nagy I, Magyari M, Barnard E, Patrick S. The opportunistic pathogen Propionibacterium acnes: insights into typing, human disease, clonal diversification and CAMP factor evolution. PloS One. 2013;8(9):e70897.
18. Liu J, Yan R, Zhong Q, Ngo S, Bangayan NJ, Nguyen L, et al. The diversity and host interactions of Propionibacterium acnes bacteriophages on human skin. ISME J. 2015;9(9):2078–93.
19. Allhorn M, Arve S, Brüggemann H, Lood R. A novel enzyme with antioxidant capacity produced by the ubiquitous skin colonizer Propionibacterium acnes. Sci Rep. 2016;6:36412.
20. Miskin JE, Farrell AM, Cunliffe WJ, Holland KT. Propionibacterium acnes, a resident of lipidrich human skin, produces a 33 kDa extracellular lipase encoded by gehA. Microbiol Read Engl. 1997;143(Pt 5):1745–55. 21. Nazipi S, Stødkilde-Jørgensen K, Scavenius C, Brüggemann H. The skin bacterium Propionibacterium acnes employs two variants of hyaluronate lyase with distinct properties. Microorganisms. 2017;5(3):57. 22. Christensen GJM, Scholz CFP, Enghild J, Rohde H, Kilian M, Thürmer A, et al. Antagonism between Staphylococcus epidermidis and Propionibacterium acnes and its genomic basis. BMC Genomics. 2016;17:152. 23. Claudel J-P, Auffret N, Leccia M-T, Poli F, Corvec S, Dréno B. Staphylococcus epidermidis: a potential new player in the physiopathology of acne? Dermatology. 2019;235(4):287–94. 24. Douglas HC, Gunter SE. The taxonomic position of corynebacterium acnes. J Bacteriol. 1946;52(1):15–23. 25. Scholz CFP, Kilian M. The natural history of cutaneous propionibacteria, and reclassification of selected species within the genus Propionibacterium to the proposed novel genera Acidipropionibacterium gen. nov., Cutibacterium gen. nov. and Pseudopropionibacterium gen. nov. Int J Syst Evol Microbiol. 2016;66(11):4422–32.
26. Dekio I, Culak R, Misra R, Gaulton T, Fang M, Sakamoto M, et al. Dissecting the taxonomic heterogeneity within Propionibacterium acnes: proposal for Propionibacterium acnes subsp. Acnes subsp. nov. and Propionibacterium acnes subsp. elongatum subsp. nov. Int J Syst Evol Microbiol. 2015;65(12):4776–87.
27. McDowell A, Barnard E, Liu J, Li H, Patrick S. Proposal to reclassify Propionibacterium acnes type I as Propionibacterium acnes subsp. acnes subsp. nov. and Propionibacterium acnes type II as Propionibacterium acnes subsp. defendens subsp. nov. Int J Syst Evol Microbiol. 2016;66(12):5358–65.
28. Brüggemann H, Lomholt HB, Tettelin H, Kilian M. CRISPR/cas loci of type II Propionibacterium acnes confer immunity against acquisition of mobile elements present in type I P. acnes. PLoS One. 2012;7(3):e34171.
29. McDowell A. Over a decade of recA and tly gene sequence typing of the skin bacterium Propionibacterium acnes: what have we learnt? Microorganisms. 2017;6(1):1.
30. Barnard E, Nagy I, Hunyadkürti J, Patrick S, McDowell A. Multiplex touchdown PCR for rapid typing of the opportunistic pathogen Propionibacterium acnes. J Clin Microbiol. 2015;53(4):1149–55.
31. McDowell A, Barnard E, Nagy I, Gao A, Tomida S, Li H, et al. An expanded multilocus sequence typing scheme for Propionibacterium acnes: investigation of “pathogenic”, “commensal” and antibiotic resistant strains. PLoS One. 2012;7(7):e41480.
32. Scholz CFP, Jensen A, Lomholt HB, Brüggemann H, Kilian M. A novel high-resolution single locus sequence typing scheme for mixed populations of Propionibacterium acnes in vivo. PLoS One. 2014;9(8):e104199.
33. Kilian M, Scholz CFP, Lomholt HB. Multilocus sequence typing and phylogenetic analysis of Propionibacterium acnes. J Clin Microbiol. 2012;50(4):1158–65.
34. Dagnelie M-A, Khammari A, Dréno B, Corvec S. Cutibacterium acnes molecular typing: time to standardize the method. Clin Microbiol Infect. 2018;24(11):1149–55.
35. Saint-Jean M, Frenard C, Le Bras M, Aubin GG, Corvec S, Dréno B. Testosterone-induced acne fulminans in twins with Kallmann’s syndrome. JAAD Case Rep. 2015;1(1):27–9.
36. Paugam C, Corvec S, Saint-Jean M, Le Moigne M, Khammari A, Boisrobert A, et al. Propionibacterium acnes phylotypes and acne severity: an observational prospective study. J Eur Acad Dermatol Venereol. 2017;31(9):e398–9.
37. Dagnelie M-A, Corvec S, Saint-Jean M, Bourdès V, Nguyen J-M, Khammari A, et al. Decrease in diversity of Propionibacterium acnes phylotypes in patients with severe acne on the back. Acta Derm Venereol. 2018;98(2):262–7.
38. Saint-Jean M, Corvec S, Nguyen J-M, Le Moigne M, Boisrobert A, Khammari A, et al. Adult acne in women is not associated with a specific type of Cutibacterium acnes. J Am Acad Dermatol. 2019;81(3):851–2.
39. Lomholt HB, Scholz CFP, Brüggemann H, Tettelin H, Kilian M. A comparative study of Cutibacterium (Propionibacterium) acnes clones from acne patients and healthy controls. Anaerobe. 2017;47:57–63.
40. Kwon HH, Yoon JY, Park SY, Suh DH. Analysis of distribution patterns of Propionibacterium acnes phylotypes and Peptostreptococcus species from acne lesions. Br J Dermatol. 2013;169(5):1152–5.
41. Sadhasivam S, Sinha M, Saini S, Kaur SP, Gupta T, Sengupta S, et al. Heterogeneity and antibiotic resistance in Propionibacterium acnes isolates and its therapeutic implications: blurring the lines between commensal and pathogenic phylotypes. Dermatol Ther. 2016;29(6):451– 4.
42. Barnard E, Liu J, Yankova E, Cavalcanti SM, Magalhães M, Li H, et al. Strains of the Propionibacterium acnes type III lineage are associated with the skin condition progressive macular hypomelanosis. Sci Rep. 2016;6:31968.
43. Petersen RLW, Scholz CFP, Jensen A, Brüggemann H, Lomholt HB. Propionibacterium Acnes phylogenetic type III is associated with progressive macular hypomelanosis. Eur J Microbiol Immunol. 2017;7(1):37– 45.
44. Corvec S, Luchetta J, Aubin GG. Is hemolysis a clinical marker of Propionibacterium acnes orthopedic infection or a phylogenetic marker? Am J Orthop Belle Mead NJ. 2015;44(3):E61–2.
45. Christensen GJM, Brüggemann H. Bacterial skin commensals and their role as host guardians. Benef Microbes. 2014;5(2):201–15.
46. Fujimura S, Nakamura T. Purification and properties of a bacteriocin-like substance (acnecin) of oral Propionibacterium acnes. Antimicrob Agents Chemother. 1978;14(6):893–8.
47. Valanne S, McDowell A, Ramage G, Tunney MM, Einarsson GG, O’Hagan S, et al. CAMP factor homologues in Propionibacterium acnes: a new protein family differentially expressed by types I and II. Microbiol Read Engl. 2005;151(Pt 5):1369–79.
48. Lheure C, Grange PA, Ollagnier G, Morand P, Désiré N, Sayon S, et al. TLR-2 recognizes Propionibacterium acnes CAMP factor 1 from highly inflammatory strains. PLoS One. 2016;11(11):e0167237.
49. Holland C, Mak TN, Zimny-Arndt U, Schmid M, Meyer TF, Jungblut PR, et al. Proteomic identification of secreted proteins of Propionibacterium acnes. BMC Microbiol. 2010;10:230.
50. Tyner H, Patel R. Hyaluronidase in clinical isolates of Propionibacterium acnes. Int J Bacteriol. 2015;2015:218918.
51. Furustrand Tafin U, Corvec S, Betrisey B, Zimmerli W, Trampuz A. Role of Rifampin against Propionibacterium acnes biofilm in vitro and in an experimental foreign- body infection model. Antimicrob Agents Chemother. 2012;56(4):1885–91.
52. Achermann Y, Goldstein EJC, Coenye T, Shirtliff ME. Propionibacterium acnes: from commensal to opportunistic biofilm-associated implant pathogen. Clin Microbiol Rev. 2014;27(3):419–40.
53. Coenye T, Peeters E, Nelis HJ. Biofilm formation by Propionibacterium acnes is associated with increasedresistance to antimicrobial agents and increased production of putative virulence factors. Res Microbiol.2007;158(4):386–92.
54. Jahns AC, Lundskog B, Ganceviciene R, PalmerRH, Golovleva I, Zouboulis CC, et al. An increased incidence of Propionibacterium acnes biofilms inacne vulgaris: a case-control study. Br J Dermatol. 2012;167(1):50–8.
55. Kuehnast T, Cakar F, Weinhäupl T, Pilz A, Selak S, Schmidt MA, et al. Comparative analyses of biofilm formation among different Cutibacterium acnes isolates. Int J Med Microbiol. 2018;308(8):1027–35.
56. Leyden JJ, McGinley KJ, Cavalieri S, Webster GF, Mills OH, Kligman AM. Propionibacterium acnes resistance to antibiotics in acne patients. J Am Acad Dermatol. 1983;8(1):41–5.
57. Sardana K, Gupta T, Garg VK, Ghunawat S. Antibiotic resistance to Propionobacterium acnes: worldwide scenario, diagnosis and management. Expert Rev Anti- Infect Ther. 2015;13(7):883–96.
58. Walsh TR, Efthimiou J, Dréno B. Systematic review of antibiotic resistance in acne: an increasing topical and oral threat. Lancet Infect Dis. 2016;16(3):e23–33.
59. Nakase K, Sakuma Y, Nakaminami H, Noguchi N. Emergence of fluoroquinolone-resistant Propionibacterium acnes caused by amino acid substitutions of DNA gyrase but not DNA topoisomerase IV. Anaerobe. 2016;42:166–71.
60. Nakase K, Yoshida A, Saita H, Hayashi N, Nishijima S, Nakaminami H, et al. Relationship between quinolone use and resistance of Staphylococcus epidermidis in patients with acne vulgaris. J Dermatol. 2019;46(9):782– 6.
61. Manosroi A, Khanrin P, Lohcharoenkal W, Werner RG, Götz F, Manosroi W, et al. Transdermal absorption enhancement through rat skin of gallidermin loaded in niosomes. Int J Pharm. 2010;392(1–2):304–10.
62. Wang Y, Dai A, Huang S, Kuo S, Shu M, Tapia CP, et al. Propionic acid and its esterified derivative suppress the growth of methicillin-resistant Staphylococcus aureus USA300. Benef Microbes. 2014;5(2):161–8.
63. Greenberg EP. Bacterial communication and group behavior. J Clin Invest. 2003;112(9):1288–90.
64. Nealson KH, Hastings JW. Bacterial bioluminescence: its control and ecological significance. Microbiol Rev. 1979;43(4):496–518.
65. Williams P. Quorum sensing, communication and cross- kingdom signalling in the bacterial world. Microbiol Read Engl. 2007;153(Pt 12):3923–38.
66. Pearson JP, Feldman M, Iglewski BH, Prince A. Pseudomonas aeruginosa cell-to-cell signaling is required for virulence in a model of acute pulmonary infection. Infect Immun. 2000;68(7):4331–4.
67. Pirhonen M, Flego D, Heikinheimo R, Palva ET. A small diffusible signal molecule is responsible for the global control of virulence and exoenzyme production in the plant pathogen Erwinia carotovora. EMBO J. 1993;12(6):2467–76.
68. Williams MR, Costa SK, Zaramela LS, Khalil S, Todd DA, Winter HL, et al. Quorum sensing between bacterial species on the skin protects against epidermal injury in atopic dermatitis. Sci Transl Med. 2019;11(490):eaat8329.

