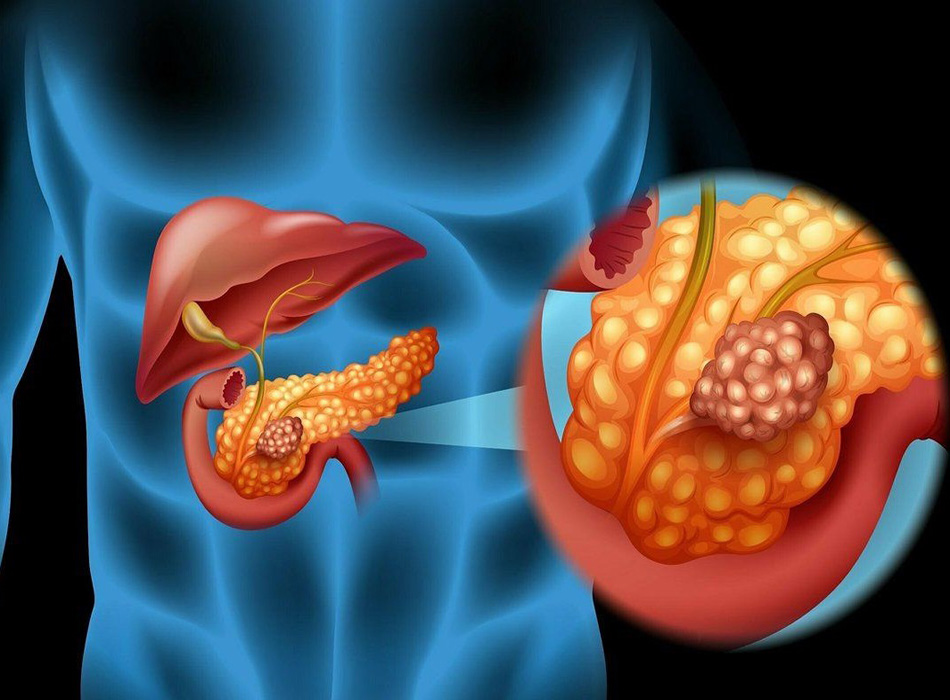
Ung thư
Ung thư tuyến tụy là gì? Phương pháp xét nghiệm chẩn đoán và điều trị
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Để tải file PDF của bài viết Ung thư tuyến tụy là gì? Phương pháp xét nghiệm chẩn đoán và điều trị, xin vui lòng click vào link ở đây.
Định nghĩa
‘Ung thư tụy’ thường là muốn nói đến ung thư biểu mô tuyến ống tụy nguyên phát (PDAC), chiếm >85% tất cả các trường hợp u tụy. Diễn tiến của ung thư tụy là theo một mô hình tiến triển tuyến tính xuất phát từ các tổn thương tăng sinh trong biểu mô tuyến tụy trước khi xâm lấn (PanIN) cho đến ung thư biểu mô tuyến xâm lấn. Hai tổn thương tiền ung thư khác được biết đến là u nhầy nhú trong ống tụy (IPMN) và u nang dịch nhầy (MCN).
Dịch tễ học
Ung thư tụy là bệnh có tiên lượng xấu. Năm 2017, ước tính có 53.670 ca mắc mới ung thư tụy tại Hoa Kỳ. Ước tính có 43.090 người sẽ không sống sót do bệnh, điều này khiến bệnh lý này trở thành nguyên nhân thường gặp thứ tư gây tử vong do ung thư gây ra tại Hoa Kỳ.
Từ năm 2010 đến 2014, độ tuổi trung vị lúc chẩn đoán là 70, và độ tuổi trung vị lúc tử vong do ung thư tụy là 72. Tỷ lệ mắc mới điều chỉnh theo độ tuổi trong khoảng thời gian này là 12,5 trên 100.000 nam giới và nữ giới mỗi năm.
Theo dữ liệu từ năm 2007 đến 2013, tỷ lệ sống sót chung là 8,2%. Năm 2012, có 78.654 ca mắc mới ung thư tụy tại Liên minh châu u, tỷ lệ mắc mới và tỷ lệ tử vong thay đổi theo quốc gia. Với số ca tử vong ước tính là 78.000 (chiếm 6,2% tổng số ca tử vong) trong thời gian này, ung thư tụy là nguyên nhân thường gặp thứ năm gây tử vong liên quan đến ung thư tại châu u.
Bệnh căn học
Ung thư tụy là bệnh của người già, với tỷ lệ mắc mới cao nhất ở những người từ 65 đến 75 tuổi. Yếu tố nguy cơ ngoại sinh duy nhất của ung thư tụy được báo cáo là hút thuốc lá. Ước tính 5% đến 10% tất cả các ca ung thư tụy đều có yếu tố di truyền. Hội chứng ung thư di truyền liên quan đến ung thư tụy là viêm tụy di truyền, hội chứng Peutz-Jeghers, u melanin đa nốt không điển hình có tính gia đình, hội chứng ung thư vú có tính gia đình và hội chứng ung thư đại trực tràng di truyền không phải đa polyp.
Sinh lý bệnh học
Sáu mươi lăm phần trăm các khối u nằm ở đầu tụy, 15% nằm ở phần thân, 10% nằm ở đuôi và 10% rải rác ở nhiều nơi. Đặc trưng là có mô đệm dạng xơ chắc, có thể chiếm >60% khối lượng khối u. Di căn hạch bạch huyết là thường gặp (40% đến 75% khối u <2 cm), cũng như xâm lấn mạch máu và các thần kinh xung quanh. Di căn xa thường gặp ở gan, phổi, da và não. Các phân tích phân tử và mô bệnh học đã phát hiện 3 tổn thương tiền ung thư khác biệt: u tân sinh trong biểu mô tụy (PanIN), u nhầy nhú trong ống tụy (IPMN) và u nang dịch nhầy (MCN). PanIN là các tổn thương tiền ung thư vi thể (<5 mm), được định nghĩa là tăng sinh các biểu mô tân sinh ở các ống tụy nhỏ, và được phân loại thành PanIN-1, PanIN-2 hoặc PanIN-3, dựa trên mức độ biệt hóa. Tiến triển từ biểu mô bình thường thành ung thư biểu mô xâm lấn là tuân theo mô hình tiến triển tuyến tính, liên quan đến sự tích tụ những thay đổi về mặt di truyền. Các biến đổi di truyền ở giai đoạn sớm bao gồm sự rút ngắn telomere và các đột biến ở gen sinh ung thư KRAS2 (xảy ra ở >90% tổn thương PanIN giai đoạn sớm), sau dó là làm bất hoạt các gen ức chế khối u p16/CDKN2A và các thay đổi ở giai đoạn trễ bao gồm bất hoạt của các gen ức chế khối u TP53 và SMAD4.
Phân loại
Phân loại mô học của ung thư biểu mô tuyến xâm lấn
Các đặc điểm mô học của ung thư biểu mô tuyến xâm lấn bao gồm.
- Ung thư biểu mô tuyến ống (dạng thường gặp nhất).
- Ung thư biểu mô tế bào vảy tuyến.
- Ung thư biểu mô tuyến dịch keo (không phải dạng nang dịch nhầy): gần như luôn kèm theo u nhầy nhú trong ống tụy (IPMN) và đặc trưng bởi các tế bào biểu mô tân sinh biệt hóa tốt nằm bên trong các lớp mô đệm lớn thâm nhiễm có dịch nhầy.
- Ung thư biểu mô tuyến dạng tế bào gan.
- Ung thư biểu mô thể tủy: đặc trưng bởi tính chất kém biệt hóa có sự mất ổn định vi vệ tinh, một hình thái tăng trưởng hợp bào và bờ đẩy.
- Ung thư biểu mô tế bào nhẫn.
- Ung thư biểu mô không biệt hóa: u biểu mô tân sinh có độ ác tính cao mà không có hướng biệt hóa rõ hơn, thường không có tính dính kết và đặc trưng bởi sự mất biểu hiện của E-cadherin.
- Ung thư biểu mô không biệt hóa có các tế bào khổng lồ giống tế bào hủy xương: thường có liên quan đến các khối u tân sinh tiền ung thư không xâm lấn như u nang dịch nhầy (MCN) và đặc trưng bởi một hỗn hợp của các tế bào đa hình không điển hình và tế bào khổng lồ đa nhân có nhân đồng nhất.
Ngăn ngừa sơ cấp
Có thể hạ thấp nguy cơ phát triển ung thư tụy bằng cách liên tục giáo dục sức khỏe về việc giảm sử dụng thuốc lá.
Khám sàng lọc
Nhóm có nguy cơ cao
Không có chương trình tầm soát thường quy; tuy nhiên, các bệnh nhân có nguy cơ cao cần được tầm soát như một phần của các thử nghiệm lâm sàng ở các trung tâm chuyên về tụy. Dựa trên kết quả ban đầu, khuyến cáo rằng nên bắt đầu tầm soát 10 năm trước khi ung thư tụy được chẩn đoán lần đầu ở thành viên gia đình có hội chứng này và sau 35 tuổi ở viêm tụy di truyền, được phối hợp thông qua các trung tâm chuyên về tụy. Dự án tầm soát ung thư tụy 2 (CAPS2) đã chứng minh vai trò đầy hứa hẹn của siêu âm nội soi trong tầm soát ung thư tụy.
Ngăn ngừa thứ cấp
Tất cả các bệnh nhân tăng nguy cơ phát triển ung thư tụy do di truyền cần được khuyến cáo đến trung tâm chuyên về tụy để được các chuyên gia tư vấn về lâm sàng, tư vấn di truyền và xét nghiệm di truyền. Điều này bao gồm các bệnh nhân bị ung thư tụy có tính gia đình hoặc bị các hội chứng ung thư di truyền khác.
Tiền sử ca bệnh
Tiền sử ca bệnh #1
Một người đàn ông 70 tuổi nghiện thuốc lá đến khám với tiền sử bị đau bụng và buồn nôn thành từng đợt trong 6 tháng. Bệnh nhân bị giảm 10 kg trong 2 tháng qua nghĩ là do chán ăn, và ông cũng than phiền là mình bị ngứa. Khám lâm sàng cho thấy ông có kết mạc mắt vàng và ấn đau đau thượng vị nhưng không có khối u bụng cũng không có hạch to. Xét nghiệm máu cho thấy tăng bilirubin và phosphatase kiềm; các chỉ số khác của xét nghiệm máu nằm trong giới hạn bình thường.
Tiền sử ca bệnh #2
Một phụ nữ 45 tuổi đến gặp bác sĩ do đau bụng trên (thượng vị) mơ hồ, không rõ ràng. Mặc dù đã điều trị bằng các thuốc ức chế bơm proton, thuốc giảm đau và thuốc kháng axit trong hơn 3 tháng, nhưng không có hiệu quả, bệnh nhân cũng bắt đầu bị đau lưng. Bệnh nhân được nội soi đường tiêu hóa trên (UGI), nhưng kết quả bình thường. Gần 4 tháng sau khi có triệu chứng, siêu âm bụng cho thấy khối ở tụy đã di căn vào gan.
Các bài trình bày khác
Do không có triệu chứng đặc hiệu hoặc dấu hiệu cảnh báo sớm về ung thư tụy, nên khó chẩn đoán lâm sàng và bệnh nhân thường đi khám khi bệnh đã tiến triển. Ung thư tụy cần được cân nhắc ở bệnh nhân từ 50 tuổi trở lên bị đái tháo đường mới khởi phát nhưng không có tiền sử gia đình dương tính hoặc các yếu tố nguy cơ khác đối với bệnh đái tháo đường. Đợt khởi phát viêm tụy cấp tính không giải thích được cũng có thể là biểu hiện đầu tiên của ung thư tụy. Do bệnh nhân bị ung thư tụy có nguy cơ gia tăng bị bệnh thuyên tắc huyết khối, chứng huyết khối tĩnh mạch hoặc viêm tĩnh mạch huyết khối chuyển vị (dấu hiệu Trousseau) cũng là biểu hiện đầu tiên của ung thư tụy.
Cách tiếp cận chẩn đoán từng bước
Ung thư tụy thường có biểu hiện trễ khi bệnh đã tiến triển. Các triệu chứng bao gồm đau bụng trên không rõ nguyên nhân, vàng da tắc mật không đau, giảm cân và ở các giai đoạn trễ là đau lưng. Tất cả các bệnh nhân nghi bị ung thư tụy cần được xét nghiệm và điều trị không được chậm trễ, theo một khuôn được xác định bởi các nhóm chuyên gia, để đảm bảo chẩn đoán kịp thời và điều trị sớm.
Tiền sử và khám lâm sàng
Các bác sĩ cần cân nhắc ung thư tụy ở bất kỳ bệnh nhân nào có biểu hiện đau bụng trên không rõ nguyên nhân, vàng da tắc mật không đau, giảm cân và đau lưng. Ung thư tụy có thể biểu hiện khi bệnh ở giai đoạn sớm hoặc giai đoạn tiến triển.
Giai đoạn sớm
- Ở giai đoạn sớm, khi không bị tắc nghẽn đường mật, bệnh biểu hiện các triệu chứng không đặc hiệu như tình trạng khó chịu, đau bụng, buồn nôn hoặc giảm cân.
Giai đoạn tiến triển
- Ở giai đoạn trễ hơn, các khối u ở đầu tụy thường gây tắc nghẽn ống mật chủ, biểu hiện với các triệu chứng vàng da tắc mật như phân bạc màu, nước tiểu sẫm màu và/hoặc ngứa. Các khối u ở thân và đuôi có xu hướng biểu hiện trễ hơn và hay kèm theo đau nhiều hơn, thường từ thượng vị lan ra sau lưng; tình trạng vàng da ở những bệnh nhân này thường do di căn gan hoặc rốn gan.
- Sự thâm nhiễm tụy lan tỏa hoặc tắc nghẽn các ống tụy chính cũng sẽ gây rối loạn chức năng ngoại tiết, dẫn đến chứng kém hấp thu và tiêu phân mỡ hoặc các đợt viêm tụy không rõ nguyên nhân. Rối loạn chức năng ngoại tiết, dẫn đến đái tháo đường mới khởi phát với biểu hiện khát nhiều, tiểu nhiều, tiểu đêm và giảm cân, xảy ra ở 20% đến 47% bệnh nhân. Ung thư tụy cần được cân nhắc ở bệnh nhân người lớn (từ 50 tuổi trở lên) bị đái tháo đường mới khởi phát nhưng không có triệu chứng bệnh hoặc tiền sử gia đình có người dương tính với đái tháo đường.
- Các dấu hiệu khác của bệnh tiến triển bao gồm giảm cân, biếng ăn, mệt mỏi, khối ở vùng bụng, gan to, dấu hiệu Courvoisier dương tính (túi mật có thể sờ chạm nhưng không đau và vàng da) hoặc các dấu hiệu đông máu nội mạch lan tỏa (DIC): chấm xuất huyết, ban xuất huyết, bầm tím.
- Do bệnh nhân bị ung thư tụy có tăng nguy cơ bị thuyên tắc mạch do huyết khối, chứng huyết khối tĩnh mạch hoặc viêm tĩnh mạch huyết khối chuyển vị (dấu hiệu Trousseau) cũng là biểu hiện đầu tiên của ung thư tụy.
Các xét nghiệm
Không có xét nghiệm máu nào để chẩn đoán ung thư tụy. Các xét nghiệm phù hợp để chẩn đoán bao gồm.
- Xét nghiệm chức năng gan (LFT): LFT bất thường có liên quan đến mức độ vàng da tắc mật nhưng không thể phân biệt được tắc nghẽn đường mật (do bất kỳ nguyên nhân nào) với di căn gan.
- Dấu ấn sinh học: các dấu ấn sinh học có sẵn như CA19-9 hoặc CEA, thiếu độ nhạy và độ đặc hiệu mong muốn để phát hiện sớm. CA19-9 có độ nhạy là 70% đến 90% và độ đặc hiệu là 90%. Các kết quả dương tính giả thường gặp khi bị vàng da tắc mật lành tính hoặc viêm tụy mạn tính. CA19-9 là một biện pháp hỗ trợ đặc biệt hữu ích để xác định giai đoạn trước khi phẫu thuật, xác định khả năng tái phát ở các ca bệnh đã được phẫu thuật cắt bỏ và đánh giá đáp ứng điều trị trong những trường hợp bệnh tiến triển.
- Xét nghiệm tình trạng đông máu và công thức máu: rối loạn các yếu tố đông máu phụ thuộc vào vitamin K sẽ gây kéo dài thời gian prothrombin (PT). Cần thực hiện xét nghiệm công thức máu và tình trạng đông máu trước bất kỳ thủ thuật chẩn đoán xâm lấn nào.
Các phương pháp chẩn đoán hình ảnh xâm lấn
Đánh giá ban đầu đối với bất kỳ bệnh nhân nào có biểu hiện lâm sàng gợi ý bị ung thư tụy là siêu âm bụng. Siêu âm bụng có thể phát hiện các khối u có kích thước >2 cm và có thể lan ra ngoài tụy (chủ yếu là di căn gan) hoặc giãn ống mật chủ, với độ nhạy được báo cáo là 80% đến 95%; độ nhạy thấp hơn khi bệnh ở giai đoạn sớm hoặc khi khối u ở thân hoặc đuôi tụy. Tuy nhiên, kết quả siêu âm bụng bình thường không giúp loại trừ ung thư tụy, do phương pháp này không thể đánh giá đầy đủ tuyến tụy.
Tất cả các bệnh nhân ban đầu bị nghi ung thư tụy cần được đánh giá bằng chụp CT xoắn ốc pha động theo quy trình đặc biệt dành cho tụy (tức là hình mặt cắt ngang ba pha và các lát cắt mỏng và hình đặc biệt của pha tĩnh mạch, là có cản quang trong tĩnh mạch). Phương pháp này đã được chứng minh là đạt được tỷ lệ chẩn đoán ung thư tụy 97% với khả năng dự đoán khả năng cắt bỏ chính xác ở 80% đến 90% bệnh nhân.
MRI cho kết quả tương tự với chụp CT và có thể hữu ích ở các bệnh nhân không thể sử dụng chất cản quang qua đường tĩnh mạch. MRI khuếch tán (DW) đã cho thấy độ đặc hiệu cao (91%) trong phân biệt các tổn thương tụy, và có thể được xem như một xét nghiệm hữu ích để phân biệt các tổn thương tụy ác tính với lành tính, đặc biệt khi sử dụng kết hợp với CT/chụp xạ hình cắt lớp positron (PET) có fluorine-18-fluorodeoxyglucose (FDG), có độ nhạy là 87% đến 90%. Tuy nhiên, cần có nhiều nghiên cứu hơn để thiết lập vai trò chính xác của DW-MRI và PET/CT trong chẩn đoán ung thư tụy. Chụp cộng hưởng từ mật tụy (MRCP) cung cấp thông tin chi tiết về ống tụy mà không có nguy cơ do thủ thuật xâm lấn của nội soi chụp mật tuỵ ngược dòng (ERCP) gây ra; chụp MR mạch máu (MRA) cho thấy rõ giải phẫu mạch máu. MRCP là phương pháp không xâm lấn để đánh giá đường mật nhưng không đánh giá bóng Vater rõ như ERCP.
Các phương pháp chẩn đoán hình ảnh xâm lấn
Nội soi siêu âm (EUS) có độ nhạy cao trong phát hiện các khối u nhỏ (cỡ 2-3 mm) và sự xâm lấn của các cấu trúc mạch máu lớn (mặc dù ít chính xác khi quan sát động mạch mạc treo tràng trên) và mô tả các tổn thương nang tụy. Chọc hút bằng kim nhỏ dưới hướng dẫn của EUS (FNA) để thực hiện xét nghiệm tế bào học đã được chứng minh là thủ thuật ít xâm lấn và an toàn, và có độ chính xác cao trong chẩn đoán ung thư tụy, với độ nhạy là 85% đến 91% và độ đặc hiệu là 94% đến 98%. Ngoài ra, đánh giá tế bào bệnh học nhanh ngay tại chỗ đã được chứng minh không làm cải thiện nhưng giúp duy trì độ chính xác trên những bệnh nhân được thực hiện EUS-FNA. Chỉ sử dụng ERCP như là một kỹ thuật chụp hình ảnh đơn thuần, có độ nhạy từ 70% đến 82% và độ đặc hiệu từ 88% đến 94%. ERCP có ưu điểm là có thể lấy mẫu để làm xét nghiệm tế bào hoặc mô học và có thể đặt stent để làm giảm tình trạng tắc nghẽn đường mật khi bệnh nhân không thể phẫu thuật hoặc phải trì hoãn phẫu thuật.
Soi ổ bụng, bao gồm siêu âm ổ bụng (LUS) và rửa khoang phúc mạc, có thể phát hiện tổn thương di căn ẩn ở gan và khoang phúc mạc mà các phương pháp chẩn đoán hình ảnh khác không phát hiện được (đặc biệt là các tổn thương ở thân hoặc đuôi tụy, hoặc ở những bệnh nhân có nguy cơ cao hơn bị bệnh lan tỏa: khối u nguyên phát lớn, có thể cắt bỏ bờ, CA19-9 cao). Tuy nhiên, các tiêu chuẩn để chọn lựa các bệnh nhân cần phải soi ổ bụng để xác định giai đoạn để có độ chính xác cao trong chẩn đoán cần phải được xác minh thêm bằng các nghiên cứu tiến cứu.
Không có sự đồng thuận thống nhất về việc sử dụng các kỹ thuật khác để xác định giai đoạn. Sử dụng ERCP và/hoặc MRCP (và đôi khi là MRA) một cách chọn lọc sẽ giúp xác định chính xác kích thước khối u, sự thâm nhiễm và có di căn hay không. EUS được chỉ định đặc biệt ở những bệnh nhân có kết quả chụp CT cho thấy không có tổn thương hoặc những người nghi có tổn thương hạch bạch huyết hoặc mạch máu. Tùy vào chuyên khoa của từng cơ sở, xác định giai đoạn bệnh bằng soi ổ bụng có thể phù hợp ở một số bệnh nhân.
Chẩn đoán mô học
Không cần chẩn đoán mô học trước khi phẫu thuật cắt bỏ; kết quả sinh thiết không đưa ra được chẩn đoán xác định không nên làm chậm trễ quá trình điều trị phẫu thuật phù hợp khi mức độ nghi ngờ cao ung thư tụy trên lâm sàng. Ngược lại, ở những bệnh nhân bị bệnh tiến tiển, không thể cắt bỏ được, được lựa chọn để điều trị giảm nhẹ, cần phải được chẩn đoán xác định bằng sinh thiết. Tất cả các bệnh nhân cần được giới thiệu đến cơ sở có chuyên môn về xử trí bệnh lý tụy, mà không cần chờ kết quả sinh thiết.
Sinh thiết dưới sự hướng dẫn hoặc FNA theo EUS, hoặc chải ống tụy, hoặc sinh thiết trong lúc thực hiện ERCP được ưu tiên sử dụng so với biện pháp tiếp cận qua phúc mạc được thực hiện qua da theo dẫn hướng của siêu âm hoặc CT. Hai mối lo ngại chính của kỹ thuật qua phúc mạc là nguy cơ âm tính giả và tế bào khối u có thể lây lan dọc theo đường kim đâm hoặc trong phúc mạc. Vì vậy, ở những bệnh nhân có khả năng phẫu thuật cắt bỏ được, cần tránh dùng kỹ thuật qua phúc mạc; trong trường hợp đã di căn, ưu tiên sinh thiết qua da tại vị trí bị di căn.
Các yếu tố nguy cơ
Mạnh
Hút thuốc
- Ước tính rằng 1 trong 4 ca ung thư tụy có thể là do hút thuốc lá. Bằng chứng gợi ý rằng những người hút thuốc có nguy cơ bị ung thư tụy tăng gấp 1,74 lần. Mặc dù mức tăng nguy cơ tương đối nhỏ, nhưng hút thuốc lá chắc chắn có liên quan đến ung thư tụy.
Tiền sử gia đình bị ung thư tụy
- Tiêu chí để xác định ung thư tụy có tính gia đình là ít nhất hai người thân trực hệ bị ung thư tụy, hoặc ít nhất hai người thân thế hệ thứ hai bị ung thư tụy, một trong số họ bị khởi phát ung thư tụy sớm (<50 tuổi) mà không có hội chứng di truyền khác liên quan đến ung thư. Nguy cơ bị ung thư tụy tăng theo số lượng người thân bị bệnh, cho thấy sự di truyền tính trạng trội của alen hiếm.[15] Mặc dù chưa xác định được gen chịu trách nhiệm chính, nhưng có thể phát hiện đột biến dòng tế bào mầm của gen BRCA2 ở 20% các hộ gia đình.[10]
Các hội chứng di truyền khác liên quan đến ung thư
- Xu hướng di truyền bị ung thư tụy có thể hiện diện ở 5% đến 10% bệnh nhân. Ở ung thư tụy có tính gia đình, nguy cơ bị ung thư tụy tăng theo số lượng người thân trực hệ bị bệnh.
- Viêm tụy di truyền: đột biến ở gen PRSS1 và ước tính nguy cơ bị ung thư tụy trong suốt đời là 35%.
- Hội chứng Peutz-Jeghers: đột biến ở gen STK11/LKB1 và ước tính nguy cơ bị ung thư tụy trong suốt đời là 36%.
- Hội chứng u melanin đa nốt không điển hình có tính gia đình: đột biến ở p16 và ước tính nguy cơ bị ung thư tụy trong suốt đời là 17%.
- Hội chứng ung thư vú có tính gia đình: đột biến ở gen BRCA1 và BRCA2; nguy cơ bị ung thư tụy phụ thuộc vào số người thân bị bệnh.
- Hội chứng ung thư đại trực tràng di truyền không phải đa polyp: đột biến ở gen hMLH1 hoặc hMSH2 và nguy cơ ước tính là khoảng 5%.
Yếu
Viêm tụy rải rác mạn tính
- Rất khó đánh giá nguy cơ bị ung thư tụy ở bệnh nhân bị viêm tụy mạn tính do thường có các yếu tố gây nhiễu như hút thuốc, uống nhiều bia rượu hoặc các yếu tố gây sai lệch khác. Tuy nhiên, nguy cơ tương đối bị ung thư tụy nằm trong khoảng 2,3% đến 18,5% đã được báo cáo.
Tiểu đường
- Một số bằng chứng gợi ý rằng có 1% khả năng phát triển ung thư tụy trong vòng 3 năm từ khi chẩn đoán ở những người được chẩn đoán bị đái tháo đường mới khởi phát.[4] Tuy nhiên, ước tính mức tăng nguy cơ bị ung thư tụy ở những người bị đái tháo đường sẽ khác nhau.
Béo phì
- Một bài đánh giá tổng quan hệ thống từ các nghiên cứu tiến cứu về mối liên quan giữa BMI, mỡ bụng và nguy cơ bị ung thư tụy ở những bệnh nhân bị ung thư biểu mô tuyến tụy đã phát hiện ra rằng bị thừa cân hoặc béo phì làm tăng nguy cơ bị ung thư tụy.[17] Béo phì khi lớn tuổi, hoặc ngay trước khi chẩn đoán ung thư, có liên quan đến giảm tỷ lệ sống sót chung;[18] tuy nhiên, các nguy cơ được báo cáo là khác nhau.
Các yếu tố dinh dưỡng
- Uống nhiều bia rượu, chế độ ăn nhiều thịt và mỡ, và nồng độ folate trong huyết thanh thấp đều đã được báo cáo là tăng nguy cơ bị ung thư tụy. Tuy nhiên, vai trò chính xác vẫn chưa rõ ràng do các kết quả không nhất quán.
Các yếu tố về tiền sử và thăm khám
Các yếu tố chẩn đoán chủ yếu
Có các yếu tố nguy cơ (thường gặp)
- Các yếu tố nguy cơ chính bao gồm sử dụng thuốc lá, tiền sử gia đình và các hội chứng ung thư di truyền khác.
Chứng vàng da (thường gặp)
- Gợi ý tắc mật, hoặc trong trường hợp rất hiếm gặp là di căn gan hoặc hạch ở rốn gan.
Đau hoặc khó chịu vùng bụng trên không đặc hiệu (thường gặp)
- Đau hoặc khó chịu bụng trên không đặc hiệu, không rõ nguyên nhân thường là một trong những triệu chứng đầu tiên và có thể bị bệnh nhân và bác sĩ bỏ qua. Đau lưng kéo dài liên quan đến di căn sau phúc mạc.
Sút cân và chán ăn (thường gặp)
- Các dấu hiệu khác của bệnh tiến triển bao gồm giảm cân và biếng ăn. Giảm cân nhanh thường liên quan đến khả năng không thể cắt bỏ được.
Các yếu tố chẩn đoán khác
Tuổi: 65 đến 75 (thường gặp)
- Ung thư tụy là bệnh của người già, với tỷ lệ mắc mới cao nhất ở những người từ 65 đến 75 tuổi.
Đi ngoài phân mỡ (không thường gặp)
- Sự thâm nhiễm tụy mở rộng hoặc tắc nghẽn các ống tụy chính cũng sẽ gây rối loạn chức năng ngoại tiết, dẫn đến chứng kém hấp thu và tiêu phân mỡ.
Khát nhiều, tiểu nhiều, tiểu đêm và giảm cân (không thường gặp)
- Rối loạn chức năng nội tiết, dẫn đến đái tháo đường mới khởi phát với biểu hiện khát nhiều, tiểu nhiều, tiểu đêm và giảm cân, xảy ra ở 20% đến 47% bệnh nhân.
- Ung thư tụy cần được cân nhắc ở bệnh nhân người lớn (từ 50 tuổi trở lên) bị đái tháo đường mới khởi phát nhưng không có đặc điểm gây bệnh hoặc tiền sử gia đình dương tính với đái tháo đường.
Buồn nôn, nôn, biếng ăn và đau giữa thượng vị (không thường gặp)
- Cần loại trừ ung thư tụy ở những bệnh nhân bị các đợt viêm tụy cấp tính không rõ nguyên nhân, đặc trưng bởi tình trạng buồn nôn, nôn, biếng ăn và đau giữa thượng vị.
Chứng gan to (không thường gặp)
- Dấu hiệu của bệnh tiến triển có di căn gan.
Khối u ở thượng vị (không thường gặp)
- Dấu hiệu của bệnh tiến triển.
Dấu hiệu Courvoisier dương tính (không thường gặp)
- Dấu hiệu của bệnh tiến triển (được biểu hiện bởi túi mật có thể sờ chạm nhưng không đau và vàng da).
Chấm xuất huyết, ban xuất huyết, bầm tím (không thường gặp)
- Các dấu hiệu của đông máu nội mạch lan tỏa (DIC) ở bệnh tiến triển.
Dấu hiệu Trousseau (không thường gặp)
- Do bệnh nhân bị ung thư tụy có tăng nguy cơ bị thuyên tắc mạch do huyết khối, chứng huyết khối tĩnh mạch hoặc viêm tĩnh mạch huyết khối chuyển vị (dấu hiệu Trousseau) cũng là biểu hiện đầu tiên của ung thư tụy.
Xét nghiệm chẩn đoán
Xét nghiệm thứ nhất cần yêu cầu
| Xét nghiệm | Kết quả |
Siêu âm ổ bụng
|
Khối u tụy, giãn ống mật, di căn gan |
Xét nghiệm chức năng gan (LFT)
|
Bilirubin, phosphatase kiềm và gamma-GT tăng ở chứng vàng da tắc mật; aminotransferase (ALT) bình thường hoặc tăng nhẹ |
Các xét nghiệm khác cần cân nhắc
| Xét nghiệm | Kết quả |
Thời gian prothrombin (PT)
|
Kéo dài |
Công thức máu
|
Tiểu cầu giảm ở DIC; thiếu máu trong xuất huyết tiêu hóa |
Dấu ấn sinh học CA19-9
|
Tăng |
Quy trình chụp CT tụy
|
Có thể cho thấy khối u tụy và mức độ khối u giới hạn tại chỗ hay lan ra xa |
Nội soi mật tụy ngược dòng (ERCP)
|
Có thể thấy khối u ở bóng Vater; tất cả các khối u tụy khác chỉ phát hiện được nếu có ảnh hưởng đến ống tụy. |
Chụp cộng hưởng từ mật tụy (MRCP)
|
Có thể cho thấy thông tin chi tiết về mức độ tổn thương ống tụy |
Siêu âm nội soi (EUS)
|
Có thể phát hiện khối u nhỏ trong tụy cũng như mức độ ảnh hưởng đến các tĩnh mạch: ví dụ như tĩnh mạch cửa |
Soi ổ bụng để xác định giai đoạn (kèm theo siêu âm qua soi ổ bụng)
|
Có thể xác định được sự ảnh hưởng đến phúc mạc, nang hoặc thanh mạc, hoặc các di căn gan nhỏ không thấy được trên CT |
Sinh thiết
|
Có thể xác nhận ung thư biểu mô tuyến ống tụy |
Chẩn đoán khác biệt
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| Viêm tụy mạn tính |
|
|
| Sỏi ống mật |
|
|
| Ung thư biểu mô bóng Vater |
|
|
| Ung thư đường mật |
|
|
| Viêm tụy tự miễn |
|
|
Các tiêu chí chẩn đoán
Xác định giai đoạn TNM của Ủy ban Phối hợp Ung thư Hoa Kỳ (AJCC), ấn bản lần thứ 8
Các định nghĩa TNM (khối u, hạch, di căn):
Khối u nguyên phát (T)
- Tx: Không thể đánh giá khối u nguyên phát
- T0: Không có bằng chứng về khối u nguyên phát
- Tis: ung thư biểu mô tại chỗ, bao gồm:
-
- U tân sinh trong biểu mô tụy mức độ nặng
- U nhầy nhú trong ống tụy có nghịch sản nặng
- U nhú trong ống tụy có nghịch sản nặng
- U nang dịch nhầy có nghịch sản nặng.
- T1: khối u có kích thước lớn nhất ≤2 cm
-
- T1a: khối u có kích thước lớn nhất ≤0,5 cm
- T1b: khối u có kích thước lớn nhất >0,5 cm và <1 cm
- T1c: khối u có kích thước lớn nhất 1 đến 2 cm
- T2: khối u có kích thước lớn nhất >2 cm và ≤4 cm
- T3: khối u có kích thước lớn nhất >4 cm
- T4: ung thư lan ra xa ngoài tuyến tụy và ảnh hưởng đến động mạch thân tạng hoặc động mạch mạc treo tràng trên và/hoặc động mạch gan chung, bất kể kích thước
Hạch bạch huyết vùng (N)
- Nx: không thể đánh giá được hạch bạch huyết vùng
- N0: không tổn thương hạch bạch huyết
- N1: Di căn 1 đến 3 hạch vùng
- N2: Di căn 4 hạch vùng trở lên
Di căn xa (M)
- M0: Không có di căn xa
- M1: có di căn xa
Phân nhóm giai đoạn
- Giai đoạn 0: Tis, N0, M0
- Giai đoạn IA: T1, N0, M0
- Giai đoạn IB: T2, N0, M0
- Giai đoạn IIA: T3, N0, M0
- Giai đoạn IIB: T1, N1, M0; T2, N1, M0; T3, N1, M0
- Giai đoạn III: T1, N2, M0: T3, N2, M0; T4, N bất kỳ; M0
- Giai đoạn IV: T bất kỳ, N bất kỳ, M1
Xác định giai đoạn mô học của Ủy ban Phối hợp Ung thư Hoa Kỳ (AJCC)
Gx: không thể đánh giá mức độ
G1: biệt hóa tốt
G2: biệt hóa mức độ trung bình
G3: biệt hóa kém
G4: không biệt hóa
Các giai đoạn lâm sàng
Bệnh có thể phẫu thuật cắt bỏ được: không có tiêu chuẩn nào được chấp nhận rộng rãi về trường hợp nào có thể phẫu cắt bỏ được, và việc đưa quyết định về khả năng cắt bỏ có thể được thực hiện bởi các nhóm đa ngành. Dựa vào kinh nghiệm lâm sàng, có thể định nghĩa ung thư tụy có thể phẫu thuật cắt bỏ được là khối u mà không có bằng chứng về sự ảnh hưởng đến động mạch mạc treo tràng trên (SMA) hoặc động mạch thân tạng, hợp lưu tĩnh mạch cửa-mạc treo tràng trên rõ ràng và không có bằng chứng di căn xa.
Bệnh có thể cắt bỏ gờ: các tiêu chí cho các khối u có thể cắt bỏ gờ bao gồm chèn ép tĩnh mạch mạc treo tràng trên (SMV) hoặc chèn ép tĩnh mạch cửa, bờ tiếp giáp khối u <180° trên SMA, bờ tiếp giáp hoặc bao bọc động mạch gan (nếu có thể tái tạo) sự tắc nghẽn SMV ở đoạn ngắn và có thể tái tạo, hoặc ở khối u nằm ở đuôi tụy, SMA hoặc bao bọc thân tạng <180°.
Bệnh tiến triển tại chỗ không thể cắt bỏ: các khối u ảnh hưởng đến các cấu trúc kế cận đến một phạm vi khiến không thể cắt bỏ được mặc dù không có bằng chứng về bệnh di căn. Di căn đến một hạch bạch huyết vùng vượt quá phạm vi cắt bỏ được xem xét là không thể cắt bỏ.
Bệnh di căn: bằng chứng của di căn xa (đến gan, phổi hoặc xương).
Mức độ cắt bỏ
R1: còn phần nhỏ bị bỏ sót lại sau khi phẫu thuật cắt bỏ (bác sĩ phẫu thuật không biết tại thời điểm phẫu thuật nhưng thông tin từ giải phẫu bệnh cho biết điều này).
R2: tổn thương đại thể còn sót lại sau khi phẫu thuật cắt bỏ (bác sĩ phẫu thuật biết tại cuối cuộc phẫu thuật rằng một phần khối u đã bị để lại, và điều này đã được xác minh lại bằng giải phẫu bệnh).
Cách tiếp cận điều trị từng bước
Tất cả các bệnh nhân nghi bị ung thư tụy cần được xét nghiệm và điều trị không được chậm trễ, theo một khuôn được xác định bởi các nhóm chuyên gia, để đảm bảo chẩn đoán kịp thời và điều trị sớm. Điều trị dựa vào mức độ bệnh, và biện pháp điều trị có khả năng dứt điểm duy nhất là phẫu thuật cắt bỏ. Phương án điều trị thay thế khi bệnh đã tiến triển, bao gồm phẫu thuật giảm nhẹ để giảm triệu chứng và đặt stent đường mật qua nội soi hoặc qua da để giảm vàng da. Hóa trị liệu và xạ trị có thể hữu ích như biện pháp điều trị giảm nhẹ cũng như biện pháp bổ trợ sau phẫu thuật. Việc đưa ra quyết định về việc điều trị và khả năng phẫu thuật cắt bỏ cần được đưa ra bởi một nhóm đa ngành. Do tiên lượng kém, các thử nghiệm lâm sàng là các biện pháp thay thế phù hợp cho điều trị các bệnh nhân bị bệnh ở bất kỳ giai đoạn nào và cần được cân nhắc trước khi chọn biện pháp điều trị giảm nhẹ.
Bệnh có thể cắt bỏ (giai đoạn I và II)
Tất cả các bệnh nhân bị ung thư tụy có thể phẫu thuật cắt bỏ (khoảng 15% đến 20% bệnh nhân) cần được giới thiệu đến trung tâm chuyên về phẫu thuật cắt bỏ nhằm tăng tỷ lệ cắt bỏ và giảm tỷ lệ mắc bệnh và tỷ lệ tử vong tại bệnh viện. Các tiêu chuẩn chung về phẫu thuật cắt bỏ được chấp nhận bao gồm: khối u mà không có bằng chứng về sự ảnh hưởng đến động mạch mạc treo tràng trên (SMA) hoặc động mạch thân tạng; hợp lưu tĩnh mạch cửa-mạc treo tràng trên rõ ràng; và không có bằng chứng di căn xa. Tuy nhiên, các biện pháp tiếp cận cho các bệnh nhân là khác nhau giữa các cơ sở. Các tiêu chuẩn cho các khối u có thể cắt bỏ gờ bao gồm chèn ép tĩnh mạch mạc treo tràng trên (SMV) hoặc chèn ép tĩnh mạch cửa, biên tiếp giáp khối u <180° trên SMA, biên tiếp giáp hoặc bao bọc động mạch gan (nếu có thể tái tạo) sự tắc nghẽn SMV ở đoạn ngắn và có thể tái tạo, hoặc ở khối u nằm ở đuôi tụy, SMA hoặc bao bọc thân tạng <180°.
Điều trị phẫu thuật
- Phẫu thuật cắt bỏ là biện pháp điều trị được ưu tiên ở những bệnh nhân bị bệnh có thể cắt bỏ được. Loại và mức độ phẫu thuật phụ thuộc vào vị trí khối u. Thủ thuật được sử dụng rộng rãi nhất là phẫu thuật cắt bỏ khối tá-tụy gần kèm cắt bỏ hang vị (thủ thuật Kausch-Whipple) hoặc phẫu thuật cắt bỏ khối tá-tụy bảo tồn môn vị (thủ thuật Traverso-Longmire) đối với các khối u đầu tụy. Phẫu thuật cắt bỏ khối tá-tụy bảo tồn môn vị có thể đem lại chất lượng cuộc sống và tỷ lệ sống sót tương tự với phẫu thuật cắt bỏ khối tá-tụy Kausch-Whipple. Phẫu thuật có cắt bỏ hạch bạch huyết mở rộng và/hoặc cắt bỏ một phần đám rối thần kinh xung quanh động mạch mạc treo tràng trên và động mạch thân tạng liên quan đến sự tăng các tác dụng bất lợi so với phương pháp phẫu thuật cắt bỏ tiêu chuẩn, mà không cho thấy bất kỳ lợi ích nào về tỷ lệ sống sót. Có thể cần cắt bỏ mở rộng, bao gồm cắt bỏ toàn bộ tuyến tụy hoặc tĩnh mạch cửa, ở một số ca bệnh tại trung tâm chuyên về tụy nhưng không làm tăng tỷ lệ sống sót khi được thực hiện thường qui. Cắt bỏ tụy trái (có cắt bỏ lá lách) phù hợp đối với các khối u cục bộ tại thân hoặc đuôi tụy (hiếm gặp). Một phân tích đánh giá tổng quan hệ thống so sánh phẫu thuật cắt bỏ tụy xa bằng mổ hở so với mổ nội soi cho thấy rằng phương pháp tiếp cận nội soi có thể an toàn hơn ở các bệnh nhân ung thư được lựa chọn. Tuy nhiên, cần đánh giá thêm về các kết quả ung thư trước khi biện pháp này trở thành thủ thuật được sử dụng rộng rãi hơn.
- Chưa có bằng chứng đáng kể về lợi ích của việc đặt stent thường quy ở bệnh nhân bị vàng da trước khi thực hiện phẫu thuật cắt bỏ; không có cải thiện kết quả phẫu thuật mà có thể làm tăng nguy cơ bị các biến chứng nhiễm trùng. Tuy nhiên, các bệnh nhân có triệu chứng viêm đường mật (hoặc phẫu thuật xác định cần trì hoãn >10 ngày do các lý do về chuẩn bị) có thể cần đặt stent trong đường mật. Nếu đặt stent trước phẫu thuật, nên đặt stent nhựa qua nội soi. Ngoài ra, khuyến cáo đặt stent tạm thời ở những bệnh nhân được điều trị bổ trợ để giảm kích thước khối u trước khi phẫu thuật trong các thử nghiệm lâm sàng.
Điều trị bổ trợ để giảm kích thước khối u
- Điều trị bổ trợ để làm giảm kích thước khối u (điều trị trước khi phẫu thuật để giảm kích thước hoặc phạm vi của khối u, để tăng cơ hội phẫu thuật cắt bỏ thành công tất cả mô u) vẫn còn đang được khảo sát đối với ung thư tụy; cho đến ngày nay, chưa có thử nghiệm ngẫu nhiên có đối chứng lớn nào được công bố.
- Hóa trị liệu kết hợp hoặc hóa xạ trị có fluorouracil bổ trợ để làm giảm kích thước khối u có thể được sử dụng cho: bệnh nhân có nghi ngờ trên lâm sàng (nhưng không có bằng chứng từ chụp X-quang) về di căn; bệnh nhân có tình trạng chức năng nằm ở ranh giới có thể cải thiện bằng điều trị toàn thân. Tuy nhiên, không có báo cáo nào về sự cải thiện đáng kể tỷ lệ sống sót.
- Các khối u không thể phẫu thuật cắt bỏ do các lí do về mặt kỹ thuật hiếm khi trở thành có thể cắt bỏ được sau khi điều trị bổ trợ làm giảm kích thước khối u.
- Các thử nghiệm tiến cứu ngẫu nhiên có đối chứng khảo sát các phác đồ điều trị bổ trợ khác nhau để làm giảm kích thước khối u đang được tiến hành, như hóa trị liệu có gemcitabine, FOLFIRINOX (axit folinic, fluorouracil, irinotecan và oxaliplatin) và hóa xạ trị (ví dụ: ESPAC-5 hoặc NEOPAC).
Điều trị bổ trợ
- Điều trị bổ trợ là biện pháp điều trị sau khi phẫu thuật để giảm thiểu nguy cơ tái phát do bệnh tiềm ẩn. Bệnh nhân bị ung thư tụy đã cắt bỏ không được điều trị bổ trợ để làm giảm kích thước khối u cần được hóa trị liệu bổ trợ trong 6 tháng.
- Phác đồ bổ trợ hai thuốc gemcitabine và capecitabine được Hiệp hội Ung thư Lâm sàng Hoa Kỳ (ASCO) khuyến cáo sử dụng khi không có mối lo ngại về nhiễm độc hoặc dung nạp. Hướng dẫn của ASCO dựa trên một thử nghiệm ngẫu nhiên đa trung tâm mở (không mù) trên 732 bệnh nhân bị ung thư biểu mô tuyến ống tụy đã phẫu thuật cắt bỏ (ESPAC-4). Nghiên cứu phát hiện ra rằng điều trị bổ trợ bằng capecitabine cộng với gemcitabine đã cải thiện đáng kể tỷ lệ sống sót so với đơn trị liệu bằng gemcitabine (28,0 so với 25,5 tháng). Nếu chống chỉ định sử dụng cách kết hợp này, ASCO khuyến cáo đơn trị liệu với gemcitabine hoặc fluorouracil cộng với axit folinic. Axit folinic làm tăng tác dụng của fluorouracil và do đó thường được cho dùng cùng thuốc này. Cả gemcitabine và fluorouracil đều ức chế thymidylate synthase, enzym cần thiết cho quá trình tổng hợp nucleotide thymidine.
- Hóa xạ trị bổ trợ vẫn còn gây tranh cãi trong phẫu thuật cắt bỏ ung thư không hoàn toàn. Dữ liệu từ ESPAC-1 và phân tích tổng hợp gợi ý rằng hóa xạ trị có vẻ kéo dài thời gian sống sót chỉ ở những ca ung thư cắt bỏ không hoàn toàn (cắt bỏ R1 hoặc R2). Khi lựa chọn điều trị là hóa xạ trị, khuyến cáo sử dụng hóa xạ trị có fluorouracil kèm bổ sung gemcitabine toàn thân.
- Chỉ nên cân nhắc hóa trị liệu hoặc hóa xạ trị bổ trợ ở những bệnh nhân đã hồi phục hoàn toàn sau phẫu thuật. Lý tưởng là, điều trị được bắt đầu trong vòng 4 đến 8 tuần sau phẫu thuật. Tuy nhiên, dữ liệu liên quan đến thời gian hóa trị liệu bổ trợ cho thấy rằng điều trị trễ sau phẫu thuật đến 12 tuần không ảnh hưởng xấu đến kết quả, miễn là hoàn thành đủ 6 chu kỳ hóa trị liệu.
- Không nên sử dụng hóa xạ trị bổ trợ ở những bệnh nhân được xạ trị hoặc hóa xạ trị bổ trợ để làm giảm kích thước khối u.
Bệnh tiến triển cục bộ không thể phẫu thuật (giai đoạn III)
Hai nghiên cứu đã so sánh biện pháp cắt bỏ tụy với điều trị giảm nhẹ toàn thân ở bệnh nhân bị bệnh tiến triển cục bộ. Mặc dù các bằng chứng còn kém thuyết phục với nguy cơ nhiễu cao, những bệnh nhân được lựa chọn cẩn thận có thể nhận được lợi ích từ phẫu thuật cắt bỏ khi có đủ chuyên khoa cần thiết và bệnh nhân sẵn sàng chấp nhận nguy cơ có thể xảy ra liên quan đến phẫu thuật.[67] Tuy nhiên, thực hiện một cách thường qui đối với những bệnh nhân bị ung thư tụy tiến triển cục bộ (khoảng 30%) là điều trị giảm nhẹ bằng đặt stent đường mật qua nội soi, và đôi khi là phẫu thuật bắc cầu nếu đặt stent qua nội soi thất bại hoặc nếu bệnh nhân được thấy là không thể cắt bỏ tại thời điểm phẫu thuật (nhưng có vẻ như có thể cắt bỏ trên hình ảnh trước phẫu thuật), sau đó là hóa trị hoặc hóa xạ trị. Bệnh tiến triển cục bộ không thể cắt bỏ bao gồm các khối u ảnh hưởng đến các cấu trúc kế cận đến một phạm vi khiến không thể cắt bỏ mặc dù không có bằng chứng về di căn. Di căn đến một hạch bạch huyết vùng nằm ngoài phạm vi cắt bỏ được xem là không thể cắt bỏ.
Phẫu thuật giảm nhẹ hoặc đặt stent qua nội soi
- Biện pháp giảm nhẹ bằng nội soi được ưu tiên hơn là phẫu thuật. Tuy nhiên, bệnh nhân thất bại trong quá trình thử nạo vét (cố gắng loại bỏ ung thư tiến triển tại chỗ) có thể nhận được lợi ích từ phẫu thuật bắc cầu đường mật và tắc nghẽn đường ra của dạ dày (thuật ngữ được gọi là ‘bắc cầu đôi’), trong đó bắc cầu qua đường mật nên được tạo ra với đường mật hơn là túi mật, hoặc từ thủ thuật nối vị tràng dự phòng.
- Đặt stent qua nội soi được ưu tiên hơn đặt stent nhựa qua gan. Lựa chọn giữa stent nhựa hoặc kim loại tự mở rộng phụ thuộc vào các yếu tố lâm sàng và tính sẵn có cũng như chuyên môn tại cơ sở. Vòng đời của stent nhựa là khoảng 3 tháng; vì vậy khuyến cáo dùng stent kim loại ở những bệnh nhân có đáp ứng và tiên lượng tốt. Stent kim loại có bọc thường có độ bền lâu hơn so với stent kim loại không bọc (khoảng 7 tháng so với 5 tháng) và ngày càng được sử dụng nhiều.
Hóa trị liệu hoặc hóa xạ trị hoặc xạ trị lập thể định vị thân
- Sau khi làm giảm tình trạng tắc nghẽn đường mật và nếu cần, là tình trạng tắc nghẽn dạ dày, điều trị toàn thân bằng hóa trị liệu kết hợp hoặc hóa xạ trị được sử dụng để kiểm soát khối u.
- Các bệnh nhân có đáp ứng tốt có vẻ nhận được lợi ích từ hóa trị liệu kết hợp có gemcitabine, với một thuốc tương tự platin (oxaliplatin hoặc cisplatin) hoặc fluoropyrimidine (fluorouracil hoặc capecitabine). Việc bổ sung erlotinib (thuốc ức chế tyrosine kinase HER1/EGFR dùng qua đường uống) vẫn còn gây tranh cãi. Các nghiên cứu ban đầu cho thấy lợi ích sống sót hạn chế nhưng đáng kể (2 tuần) nhưng không thấy có sự khác biệt đáng kể nào về tỷ lệ sống sót chung khi bệnh nhân bị ung thư tụy tiến triển cục bộ được chọn lựa ngẫu nhiên vào nhóm sử dụng gemcitabine hoặc gemcitabine cộng với erlotinib. Phác đồ FOLFIRINOX (axit folinic, fluorouracil, irinotecan và oxaliplatin) hoặc liệu pháp kết hợp paclitaxel liên kết với tiểu phân nano albumin (nab-paclitaxel) và gemcitabine là các biện pháp thay thế phù hợp cho liệu pháp kết hợp có gemcitabine ở bệnh nhân đã bị di căn. Axit folinic làm tăng tác dụng của fluorouracil và do đó thường được dùng cùng thuốc này. Cả hai thuốc đều ức chế thymidylate synthase, enzym cần thiết cho quá trình tổng hợp nucleotide thymidine.
- Hóa xạ trị hoặc xạ trị lập thể định vị thân (SBRT) thời gian ngắn có thể được sử dụng ở những bệnh nhân có đáp ứng tốt với sự tiến triển tại chỗ (không di căn xa) trong hoặc sau khi hóa trị liệu, hoặc ở những người đáp ứng với hóa trị liệu như liệu pháp củng cố nhằm cải thiện thêm khả năng kiểm soát tại chỗ. Các nghiên cứu khảo sát vai trò của hóa xạ trị hoặc SBRT trong kiểm soát ung thư tụy tiến triển cục bộ đang được tiến hành.
- Do bản chất của bệnh và số liệu thống kê về tỷ lệ sống sót thấp, nên các thử nghiệm về các lựa chọn điều trị bậc hai còn giới hạn, nhưng bệnh nhân chỉ điều trị bậc một với hóa trị bằng gemcitabine và tiếp tục có đáp ứng tốt có thể nhận được lợi ích từ liệu pháp kết hợp bậc hai gồm oxaliplatin, fluorouracil và axit folinic.
Bệnh di căn: giai đoạn IV
Mục tiêu chính đối với bệnh nhân bị di căn (50% đến 55%) là giảm nhẹ bệnh. Những bệnh nhân này có thời gian sống sót giới hạn (3-6 tháng) phụ thuộc vào mức độ khối u và đáp ứng với điều trị tại thời điểm khám. Bệnh di căn đặc trưng bởi bằng chứng của di căn xa đến gan, phổi hoặc xương.
Phẫu thuật giảm nhẹ hoặc đặt stent qua nội soi
- Biện pháp giảm nhẹ bằng nội soi được ưu tiên hơn là phẫu thuật. Tuy nhiên, bệnh nhân thất bại trong quá trình thử nạo vét (cố gắng loại bỏ ung thư tiến triển tại chỗ) có thể nhận được lợi ích từ phẫu thuật bắc cầu đường mật và tắc nghẽn đường ra của dạ dày (thuật ngữ được gọi là ‘bắc cầu đôi’), trong đó bắc cầu qua đường mật nên được tạo ra với đường mật hơn là túi mật, hoặc từ thủ thuật nối vị tràng dự phòng.
- Đặt stent qua nội soi được ưu tiên hơn đặt stent nhựa qua gan. Lựa chọn giữa stent nhựa hoặc kim loại tự mở rộng phụ thuộc vào các yếu tố lâm sàng và tính sẵn có cũng như chuyên môn tại cơ sở. Vòng đời của stent nhựa là khoảng 3 tháng; vì vậy khuyến cáo dùng stent kim loại ở những bệnh nhân có đáp ứng và tiên lượng tốt. Stent kim loại có bọc thường có độ bền lâu hơn so với stent kim loại không bọc (khoảng 7 tháng so với 5 tháng) và ngày càng được sử dụng nhiều.
Hóa trị liệu
- Đơn trị liệu bằng gemcitabine hàng tuần, 3 trong mỗi 4 tuần, vẫn là biện pháp điều trị giảm nhẹ được lựa chọn ở những bệnh nhân có đáp ứng kém. Các bệnh nhân có đáp ứng tốt có thể nhận được lợi ích từ liệu pháp kết hợp gemcitabine với thuốc tương tự platin (oxaliplatin hoặc cisplatin), fluoropyrimidine (fluorouracil hoặc capecitabine), erlotinib (thuốc ức chế tyrosine kinase HER1/EGFR dùng qua đường uống) hoặc kết hợp oxaliplatin với fluorouracil và axit folinic. Mặc dù thiếu lợi ích rõ ràng trong cải thiện tỷ lệ sống sót chung trong các nghiên cứu lâm sàng, các liệu pháp kết hợp này vẫn được sử dụng trong thực hành lâm sàng do các nhóm nhỏ bệnh nhân có đáp ứng rất tốt (và không có dấu ấn sinh học để lựa chọn ra những bệnh nhân này).
- Hóa trị liệu kết hợp giữa fluorouracil cộng với gemcitabine đã được cho thấy là không hiệu quả hơn sau 1 năm so với đơn trị liệu bằng gemcitabine trong việc giảm tỷ lệ tử vong hoặc thời gian tiến triển bệnh ở những người bị ung thư tụy không thể cắt bỏ. Tuy nhiên, hiện có sẵn 2 lựa chọn điều trị mới ở những bệnh nhân bị ung thư tụy di căn và có đáp ứng tốt: phác đồ FOLFIRINOX (axit folinic, fluorouracil, irinotecan, oxaliplatin);hoặc ab-paclitaxel kết hợp với gemcitabine. Cả hai phác đồ đều cải thiện thời gian sống sót so với chỉ dùng gemcitabine: thời gian trung vị sống sót chung là 11,1 tháng ở nhóm FOLFIRINOX so với 6,8 tháng ở nhóm gemcitabine, và 8,5 tháng ở nhóm nab-paclitaxel/gemcitabine so với 6,7 tháng ở nhóm gemcitabine. FOLFIRINOX và nab-paclitaxel kết hợp với gemcitabine không được so sánh trực tiếp và như vậy, một trong hai biện pháp điều trị có thể được sử dụng.
- Không có đủ bằng chứng để khuyến cáo sử dụng hóa xạ trị hơn là chỉ dùng hóa trị ở những người bị ung thư tụy đã di căn.
- Bệnh nhân được sử dụng hóa trị liệu có gemcitabine trong liệu pháp điều trị bậc một và tiếp tục có biểu hiện tốt có thể sử dụng tiếp liệu pháp điều trị bậc hai kết hợp bao gồm oxaliplatin, fluorouracil và axit folinic. Lựa chọn thay thế là kết hợp fluorouracil và liposomal irinotecan, giúp cải thiện thời gian sống sót chung so với chỉ sử dụng fluorouracil (lần lượt là 6,1 so với 4,2 tháng).
Điều trị hỗ trợ
Tất cả các bệnh nhân bị ung thư tụy cần được chuyển đến các chuyên gia về thuốc giảm nhẹ bệnh.
Đau tụy (đau bụng và lưng) có thể là triệu chứng khó chịu cần kiểm soát ở bệnh tiến triển cục bộ không thể phẫu thuật cắt bỏ được và đã di căn. Kiểm soát cơn đau nên bắt đầu theo ‘bậc thang giảm đau’, nhưng thường cần dùng opioid để kiểm soát đau. Liều dùng cần phải được điều chỉnh theo nhu cầu của từng cá nhân và sự cân bằng giữa việc giảm nhẹ triệu chứng so với tác dụng bất lợi của nó. Các lựa chọn khác bao gồm thuốc giảm đau opioid tác dụng kéo dài phù hợp, phong bế đám rối thân tạng qua da (hoặc dưới hướng dẫn của nội soi siêu âm) hoặc cắt bỏ dây thần kinh tạng.
Ở tất cả các bệnh nhân bị ung thư tụy, có thể sử dụng các chế phẩm bổ sung enzym tụy để duy trì cân nặng và gia tăng chất lượng sống, cùng với sự chú ý vào lượng thực phẩm hấp thụ vào và các sản phẩm bổ sung dinh dưỡng khác.
Tổng quan về các chi tiết điều trị
Tham khảo cơ sở dữ liệu dược địa phương của quý vị để biết thông tin toàn diện về thuốc, bao gồm các chống chỉ định, tương tác giữa các loại thuốc, và liều dùng thay thế. ( xem Tuyên bố miễn trách nhiệm )
| Cấp tính | ( tóm tắt ) | |
| có thể cắt bỏ (giai đoạn I và II) | ||
| 1 | Phẫu thuật cắt bỏ | |
| thêm | thay thế enzym tụy | |
| bổ sung | đặt stent đường mật trước phẫu thuật | |
| bổ sung | xạ trị hoặc hóa xạ trị bổ trợ để thu nhỏ kích thước khối u | |
| cắt bỏ hoàn toàn | thêm | hóa trị bổ trợ |
| cắt bỏ không hoàn toàn | bổ sung | hóa xạ trị bổ trợ |
| tiến triển cục bộ không thể phẫu thuật (giai đoạn III) | ||
| 1 | đặt sent qua nội soi hoặc phẫu thuật giảm nhẹ | |
| thêm | hóa trị liệu hoặc hóa xạ trị hoặc xạ trị lập thể định vị thân | |
| thêm | kiểm soát cơn đau + thay thế men tụy | |
| di căn (giai đoạn IV) | ||
| 1 | đặt sent qua nội soi hoặc phẫu thuật giảm nhẹ | |
| thêm | hóa trị liệu | |
| thêm | kiểm soát cơn đau + thay thế men tụy | |
Các lựa chọn điều trị
| Cấp tính | ||
| có thể cắt bỏ (giai đoạn I và II) | ||
| 1 | Phẫu thuật cắt bỏ
» Phẫu thuật cắt bỏ là biện pháp điều trị được ưu tiên ở những bệnh nhân bị bệnh có thể cắt bỏ được. » Loại và mức độ phẫu thuật phụ thuộc vào vị trí của khối u. » Thủ thuật được sử dụng rộng rãi nhất là phẫu thuật cắt bỏ khối tá-tụy gần kèm cắt bỏ hang vị (thủ thuật Kausch-Whipple) hoặc phẫu thuật cắt bỏ khối tá-tụy bảo tồn môn vị (thủ thuật Traverso-Longmire) đối với các khối u đầu tụy. » Phẫu thuật cắt bỏ khối tá-tụy bảo tồn môn vị có thể đem lại chất lượng cuộc sống và tỷ lệ sống sót tương tự với phẫu thuật cắt bỏ khối tá-tụy Kausch- Whipple. » Cắt bỏ hạch bạch huyết mở rộng làm tăng tác dụng bất lợi so với cắt bỏ hạch bạch huyết chuẩn, mà không cho thấy bất kỳ lợi ích nào về tỷ lệ sống sót. |
|
| thêm | thay thế enzym tụy
Các lựa chọn sơ cấp » pancreatin: liều dùng tùy thuộc vào loại thuốc; cần hội chẩn với chuyên gia về liều lượng sử dụng » Ở tất cả các bệnh nhân bị ung thư tụy, có thể sử dụng các chế phẩm bổ sung enzym tụy để duy trì cân nặng và gia tăng chất lượng sống, cùng với sự chú ý vào lượng thực phẩm hấp thụ vào và các sản phẩm bổ sung dinh dưỡng khác. |
|
| bổ sung | đặt stent đường mật trước phẫu thuật
» Chưa có bằng chứng đáng kể về lợi ích của việc đặt stent thường quy ở bệnh nhân bị vàng da trước khi thực hiện phẫu thuật cắt bỏ; không có cải thiện kết quả phẫu thuật mà có thể làm tăng nguy cơ bị các biến chứng nhiễm trùng. » Tuy nhiên, các bệnh nhân có triệu chứng viêm đường mật (hoặc phẫu thuật xác định cần trì hoãn >10 ngày do các lý do về chuẩn bị) có thể cần đặt stent trong đường mật. Nếu đặt stent trước phẫu thuật, nên đặt stent nhựa qua nội soi. » Ngoài ra, khuyến cáo đặt stent tạm thời ở những bệnh nhân được điều trị bổ trợ để làm thu nhỏ kích thước khối u trước khi phẫu thuật trong các thử nghiệm lâm sàng. |
|
| bổ sung | xạ trị hoặc hóa xạ trị bổ trợ để thu nhỏ kích thước khối u
» Điều trị bổ trợ để làm giảm kích thước khối u (điều trị trước khi phẫu thuật để giảm kích thước hoặc phạm vi của khối u, để tăng cơ hội phẫu thuật cắt bỏ thành công tất cả mô u) vẫn còn đang được khảo sát đối với ung thư tụy; cho đến ngày nay, chưa có thử nghiệm ngẫu nhiên có đối chứng lớn nào được công bố. » Hóa trị liệu kết hợp hoặc hóa xạ trị có fluorouracil bổ trợ để làm giảm kích thước khối u có thể được sử dụng cho: bệnh nhân có nghi ngờ trên lâm sàng (nhưng không có bằng chứng từ chụp X-quang) về di căn; bệnh nhân có tình trạng chức năng nằm ở ranh giới có thể cải thiện bằng điều trị toàn thân. Tuy nhiên, không có báo cáo nào về sự cải thiện đáng kể tỷ lệ sống sót. » Các khối u không thể phẫu thuật cắt bỏ do các lí do về mặt kỹ thuật hiếm khi trở thành có thể cắt bỏ được sau khi điều trị bổ trợ làm giảm kích thước khối u. » Các thử nghiệm tiến cứu ngẫu nhiên có đối chứng khảo sát các phương pháp bổ trợ khác nhau để làm thu nhỏ kích thước khối u đang được tiến hành, như hóa trị liệu kết hợp có gemcitabine, FOLFIRINOX (axit folinic, fluorouracil, irinotecan và oxaliplatin) và hóa xạ trị (ví dụ: ESPAC-5 hoặc NEOPAC). » Tham khảo hướng dẫn về phác đồ và liều lượng của quy trình chuyên môn tại chỗ. |
|
| cắt bỏ hoàn toàn | thêm | hóa trị bổ trợ
Các lựa chọn sơ cấp » gemcitabine HOẶC » gemcitabine HOẶC » fluorouracil » Điều trị bổ trợ là biện pháp điều trị sau khi phẫu thuật để giảm thiểu nguy cơ tái phát do bệnh tiềm ẩn. Bệnh nhân bị ung thư tụy đã cắt bỏ không được điều trị bổ trợ để làm giảm kích thước khối u cần được hóa trị liệu bổ trợ trong 6 tháng. » Phác đồ bổ trợ hai thuốc gemcitabine và capecitabine được Hiệp hội Ung thư Lâm sàng Hoa Kỳ (ASCO) khuyến cáo sử dụng khi không có mối lo ngại về nhiễm độc hoặc dung nạp. Hướng dẫn của ASCO dựa trên một thử nghiệm ngẫu nhiên đa trung tâm mở (không mù) trên 732 bệnh nhân bị ung thư biểu mô tuyến ống tụy đã phẫu thuật cắt bỏ (ESPAC-4). Nghiên cứu phát hiện ra rằng điều trị bổ trợ bằng capecitabine cộng với gemcitabine đã cải thiện đáng kể tỷ lệ sống sót so với đơn trị liệu bằng gemcitabine (28,0 so với 25,5 tháng). Nếu chống chỉ định sử dụng cách kết hợp này, ASCO khuyến cáo đơn trị liệu với gemcitabine hoặc fluorouracil cộng với axit folinic. Axit folinic làm tăng tác dụng của fluorouracil và do đó thường được cho dùng cùng thuốc này. Cả gemcitabine và fluorouracil đều ức chế thymidylate synthase, enzym cần thiết cho quá trình tổng hợp nucleotide thymidine. » Tham khảo quy tắc của chuyên gia địa phương để biết về hướng dẫn sử dụng liều lượng. |
| cắt bỏ không hoàn toàn | bổ sung | hóa xạ trị bổ trợ
Các lựa chọn sơ cấp » fluorouracil » Hóa xạ trị bổ trợ vẫn còn gây tranh cãi trong phẫu thuật cắt bỏ ung thư không hoàn toàn. Dữ liệu từ ESPAC-1 và phân tích tổng hợp gợi ý rằng hóa xạ trị có vẻ kéo dài thời gian sống sót chỉ ở những ca ung thư cắt bỏ không hoàn toàn (cắt bỏ R1 hoặc R2). Khi lựa chọn điều » Chỉ nên cân nhắc hóa trị liệu hoặc hóa xạ trị bổ trợ ở những bệnh nhân đã hồi phục hoàn toàn sau phẫu thuật. Lý tưởng là, điều trị được bắt đầu trong vòng 4 đến 8 tuần sau phẫu thuật. Tuy nhiên, dữ liệu liên quan đến thời gian hóa trị liệu bổ trợ cho thấy rằng điều trị trễ sau phẫu thuật đến 12 tuần không ảnh hưởng xấu đến kết quả, miễn là hoàn thành đủ 6 chu kỳ hóa trị liệu. » Không nên sử dụng hóa xạ trị bổ trợ ở những bệnh nhân được xạ trị hoặc hóa xạ trị bổ trợ để làm giảm kích thước khối u. » Tham khảo quy tắc của chuyên gia địa phương để biết về hướng dẫn sử dụng liều lượng. |
| tiến triển cục bộ không thể phẫu thuật (giai đoạn III) | ||
| 1 | đặt sent qua nội soi hoặc phẫu thuật giảm nhẹ
» Biện pháp giảm nhẹ bằng nội soi được ưu tiên hơn là phẫu thuật. » Tuy nhiên, bệnh nhân thất bại trong khi thử nạo vét (cố gắng loại bỏ ung thư tiến triển cục bộ) có thể nhận được lợi ích từ phẫu thuật bắc cầu đường mật và tắc nghẽn đường ra của dạ dày, thuật ngữ được gọi là ‘bắc cầu đôi’, trong đó bắc cầu qua đường mật cần được thiết kế với đường mật hơn là túi mật, hoặc từ thủ thuật nối vị tràng dự phòng. » Đặt stent qua nội soi được ưu tiên hơn đặt stent nhựa qua gan. » Lựa chọn giữa stent nhựa hoặc kim loại tự mở rộng phụ thuộc vào các yếu tố lâm sàng và tính sẵn có cũng như chuyên môn tại cơ sở. » Vòng đời của stent nhựa là khoảng 3 tháng; vì vậy khuyến cáo dùng stent kim loại ở những bệnh nhân có đáp ứng và tiên lượng tốt. |
|
| thêm | hóa trị liệu hoặc hóa xạ trị hoặc xạ trị lập thể định vị thân
Các lựa chọn sơ cấp » gemcitabine HOẶC » gemcitabine –VÀ– » oxaliplatin HOẶC » gemcitabine HOẶC » fluorouracil -và- Các lựa chọn thứ cấp » fluorouracil HOẶC » gemcitabine HOẶC » oxaliplatin » Sau khi làm giảm tình trạng tắc nghẽn đường mật và nếu cần, là tình trạng tắc nghẽn dạ dày, điều trị toàn thân bằng hóa trị liệu kết hợp hoặc hóa xạ trị được sử dụng để kiểm soát khối u. » Các bệnh nhân có đáp ứng tốt có vẻ nhận được lợi ích từ hóa trị liệu kết hợp có gemcitabine, với một thuốc tương tự platin (oxaliplatin hoặc cisplatin) hoặc fluoropyrimidine (fluorouracil hoặc capecitabine). Việc bổ sung erlotinib (thuốc ức chế tyrosine kinase HER1/EGFR dùng qua đường uống) vẫn còn gây tranh cãi. Các nghiên cứu ban đầu cho thấy lợi ích sống sót hạn chế nhưng đáng kể (2 tuần) nhưng không thấy có sự khác biệt đáng kể nào về tỷ lệ sống sót chung khi bệnh nhân bị ung thư tụy tiến triển cục bộ được chọn lựa ngẫu nhiên vào nhóm sử dụng gemcitabine hoặc gemcitabine cộng với erlotinib. » Phác đồ FOLFIRINOX (axit folinic, fluorouracil, irinotecan, oxaliplatin) hoặc liệu pháp kết hợp paclitaxel liên kết với tiểu phân nano albumin (nab- paclitaxel) và gemcitabine là các biện pháp thay thế phù hợp cho trường hợp đã có di căn. Axit folinic làm tăng tác dụng của fluorouracil và do đó thường được dùng cùng thuốc này. Cả hai thuốc đều ức chế thymidylate synthase, enzym cần thiết cho quá trình tổng hợp nucleotide thymidine. » Hóa xạ trị hoặc xạ trị lập thể định vị thân (SBRT) thời gian ngắn có thể được sử dụng ở những bệnh nhân có đáp ứng tốt với sự tiến triển tại chỗ (không di căn xa) trong hoặc sau khi hóa trị liệu, hoặc ở những người đáp ứng với hóa trị liệu như liệu pháp củng cố nhằm cải thiện thêm khả năng kiểm soát tại chỗ. Các nghiên cứu khảo sát vai trò của hóa xạ trị hoặc SBRT trong kiểm soát ung thư tụy tiến triển cục bộ đang được tiến hành. » Do bản chất của bệnh và số liệu thống kê về tỷ lệ sống sót thấp, nên các thử nghiệm về các lựa chọn điều trị bậc hai còn giới hạn, nhưng bệnh nhân chỉ điều trị bậc một với hóa trị bằng gemcitabine và tiếp tục có đáp ứng tốt có thể nhận được lợi ích từ liệu pháp kết hợp bậc hai gồm oxaliplatin, fluorouracil và axit folinic. » Tham khảo quy tắc của chuyên gia địa phương để biết về hướng dẫn sử dụng liều lượng. |
|
| thêm | kiểm soát cơn đau + thay thế men tụy
Các lựa chọn sơ cấp » pancreatin: liều dùng tùy thuộc vào loại thuốc; cần hội chẩn với chuyên gia về liều lượng sử dụng » Cơn đau tụy (đau bụng và lưng) có thể là triệu chứng cần phải được kiểm soát. » Kiểm soát cơn đau nên bắt đầu theo ‘bậc thang giảm đau’, nhưng thường cần dùng opioid để kiểm soát đau. » Cần tư vấn các phác đồ kiểm soát cơn đau tại chỗ với các thuốc giảm đau hiện có. Liều dùng cần phải được điều chỉnh theo nhu cầu của từng cá nhân và sự cân bằng giữa việc giảm nhẹ triệu chứng so với tác dụng bất lợi của nó. » Các lựa chọn khác bao gồm thuốc giảm đau opioid tác dụng kéo dài phù hợp, phong bế đám rối thân tạng qua da (hoặc dưới hướng dẫn của nội soi siêu âm) hoặc cắt bỏ dây thần kinh tạng. » Có thể sử dụng các sản phẩm bổ sung men tụy để duy trì cân nặng và tăng chất lượng cuộc sống, cùng với sự chú ý vào lượng thực phẩm hấp thu vào và các sản phẩm bổ sung dinh dưỡng khác. |
|
| di căn (giai đoạn IV) | ||
| 1 | đặt sent qua nội soi hoặc phẫu thuật giảm nhẹ
» Biện pháp giảm nhẹ bằng nội soi được ưu tiên hơn là phẫu thuật. » Tuy nhiên, bệnh nhân thất bại trong khi thử nạo vét (cố gắng loại bỏ ung thư tiến triển cục bộ) có thể nhận được lợi ích từ phẫu thuật bắc cầu đường mật và tắc nghẽn đường ra của dạ dày, thuật ngữ được gọi là ‘bắc cầu đôi’, trong đó bắc cầu qua đường mật cần được thiết kế với đường mật hơn là túi mật, hoặc từ thủ thuật nối vị tràng dự phòng. » Đặt stent qua nội soi được ưu tiên hơn đặt stent nhựa qua gan. » Lựa chọn giữa stent nhựa hoặc kim loại tự mở rộng phụ thuộc vào các yếu tố lâm sàng và tính sẵn có cũng như chuyên môn tại cơ sở. » Vòng đời của stent nhựa là khoảng 3 tháng; vì vậy khuyến cáo dùng stent kim loại ở những bệnh nhân có đáp ứng và tiên lượng tốt.
|
|
| thêm | hóa trị liệu
Các lựa chọn sơ cấp » gemcitabine HOẶC » gemcitabine –VÀ– » oxaliplatin HOẶC » gemcitabine HOẶC » gemcitabine HOẶC » oxaliplatin HOẶC » oxaliplatin HOẶC » fluorouracil » Đơn trị liệu bằng gemcitabine hàng tuần, 3 trong mỗi 4 tuần, vẫn là biện pháp điều trị giảm nhẹ được lựa chọn ở những bệnh nhân có đáp ứng kém. » Các bệnh nhân có đáp ứng tốt có thể nhận được lợi ích từ liệu pháp kết hợp gemcitabine với thuốc tương tự platin (oxaliplatin hoặc cisplatin), fluoropyrimidine (fluorouracil hoặc capecitabine), erlotinib (thuốc ức chế tyrosine kinase HER1/EGFR dùng qua đường uống) hoặc kết hợp oxaliplatin với fluorouracil và axit folinic. Mặc dù thiếu lợi ích rõ ràng trong cải thiện tỷ lệ sống sót chung trong các nghiên cứu lâm sàng, các liệu pháp kết hợp này vẫn được sử dụng trong thực hành lâm sàng do các nhóm nhỏ bệnh nhân có đáp ứng rất tốt (và không có dấu ấn sinh học để lựa chọn ra những bệnh nhân này). » Hóa trị liệu kết hợp giữa fluorouracil cộng với gemcitabine đã được cho thấy là không hiệu quả hơn sau 1 năm so với đơn trị liệu bằng gemcitabine trong việc giảm tỷ lệ tử vong hoặc thời gian tiến triển bệnh ở những người bị ung thư tụy không thể cắt bỏ. Tuy nhiên, hiện có sẵn 2 lựa chọn điều trị mới ở những bệnh nhân bị ung thư tụy di căn và có đáp ứng tốt: phác đồ FOLFIRINOX (axit folinic, fluorouracil, irinotecan, oxaliplatin); hoặc paclitaxel liên kết với tiểu phân nano albumin (nab- paclitaxel) kết hợp với gemcitabine. Cả hai phác đồ đều cải thiện thời gian sống sót so với chỉ dùng gemcitabine: thời gian trung vị sống sót chung là 11,1 tháng ở nhóm FOLFIRINOX so với 6,8 tháng ở nhóm gemcitabine, và 8,5 tháng ở nhóm nab- paclitaxel/gemcitabine so với 6,7 tháng ở nhóm gemcitabine. FOLFIRINOX và nab-paclitaxel kết hợp với gemcitabine không được so sánh trực tiếp và như vậy, một trong hai biện pháp điều trị có thể được sử dụng. » Không có đủ bằng chứng để khuyến cáo sử dụng hóa xạ trị hơn là chỉ dùng hóa trị ở những người bị ung thư tụy đã di căn. » Bệnh nhân nhận được sử dụng hóa trị liệu có gemcitabine trong liệu pháp điều trị bậc một và tiếp tục có đáp ứng tốt có thể nhận được lợi ích từ liệu pháp kết hợp bậc hai bao gồm oxaliplatin, fluorouracil và axit folinic. Một lựa chọn thay thế là kết hợp liposomal irinotecan và fluorouracil, cải thiện thời gian sống sót chung so với fluorouracil đơn trị liệu (lần lượt là 6,1 so với 4,2 tháng). » Tham khảo quy tắc của chuyên gia địa phương để biết về hướng dẫn sử dụng liều lượng. |
|
| thêm | kiểm soát cơn đau + thay thế men tụy
Các lựa chọn sơ cấp » pancreatin: liều dùng tùy thuộc vào loại thuốc; cần hội chẩn với chuyên gia về liều lượng sử dụng » Cơn đau tụy (đau bụng và lưng) có thể là triệu chứng cần phải được kiểm soát. » Kiểm soát cơn đau nên bắt đầu theo ‘bậc thang giảm đau’, nhưng thường cần dùng opioid để kiểm soát đau. » Cần tư vấn các phác đồ kiểm soát cơn đau tại chỗ với các thuốc giảm đau hiện có. Liều dùng cần phải được điều chỉnh theo nhu cầu của từng cá nhân và sự cân bằng giữa việc giảm nhẹ triệu chứng so với tác dụng bất lợi của nó. » Các lựa chọn khác bao gồm thuốc giảm đau opioid tác dụng kéo dài phù hợp, phong bế đám rối thân tạng qua da (hoặc dưới hướng dẫn của nội soi siêu âm) hoặc cắt bỏ dây thần kinh tạng. » Có thể sử dụng các sản phẩm bổ sung men tụy để duy trì cân nặng và tăng chất lượng cuộc sống, cùng với sự chú ý vào lượng thực phẩm hấp thu vào và các sản phẩm bổ sung dinh dưỡng khác. |
|
Giai đoạn đầu
Pembrolizumab
Pembrolizumab là thuốc ức chế điểm kháng thể kháng PD1. Thuốc này tác động bằng cách phong bế con đường dẫn đến dung nạp khối u. Pembrolizumab đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt để điều trị bệnh nhân có khối u đặc không thể phẫu thuật cắt bỏ được hoặc di căn đã được xác định là có dấu ấn sinh học được gọi là bất ổn vi vệ tinh-cao (MSI-H) hoặc thiếu khả năng sửa chữa ghép cặp sai (dMMR). Sự phê duyệt này là duy nhất vì đây là lần đầu tiên FDA chấp thuận một phương pháp điều trị ung thư dựa trên sự hiện diện của dấu ấn sinh học khối u chứ không phải là vị trí khối u trong cơ thể. Các thử nghiệm giai đoạn 1 và 2 về tính hiệu quả của pembrolizumab để điều trị ung thư tụy hiện đang được tiến hành.
Thử nghiệm lâm sàng
Nhiều thử nghiệm lâm sàng hiện đang được tiến hành cho tất cả các giai đoạn của bệnh. Nghiên cứu đã làm tăng đáng kể hiểu biết của chúng ta về bản chất phân tử của ung thư tụy: các tác nhân đặc hiệu được tạo ra để nhắm vào các con đường đặc biệt hoặc mô đệm dạng keo đặc là các quan tâm lớn và trọng tâm quan trọng của các thử nghiệm lâm sàng. Mặc dù các kết quả ban đầu trong thử nghiệm lâm sàng ở những bệnh nhân không được lựa chọn gây thất vọng về thời gian sống sót, sự phát triển của những liệu pháp đích này và các phác đồ kết hợp khác nhau (của cả các liệu pháp đích và gây độc tế bào), được kết hợp với lựa chọn bệnh nhân tốt hơn, tiếp tục nhận được sự ưu tiên cao.
Tegafur/gimeracil/oteracil (S-1)
Hóa trị liệu bổ trợ với S-1 đã cải thiện thời gian sống sót chung sau 5 năm so với gemcitabine ở các bệnh nhân Nhật Bản bị ung thư tụy đã được phẫu thuật cắt bỏ. Tegafur là tiền chất của fluorouracil. Thuốc kết hợp này đã được phê duyệt sử dụng tại Nhật Bản, nhưng chưa được phép tại các quốc gia khác.
Khuyến nghị
Giám sát
Còn ít dữ liệu về vai trò của việc theo dõi bệnh nhân bị ung thư tụy có thể phẫu thuật cắt bỏ. Dựa trên sự đồng thuận, ủy ban Mạng lưới Ung thư Toàn diện Quốc gia (NCCN) khuyến cáo đánh giá triệu chứng bằng bệnh sử và khám lâm sàng mỗi 3 đến 6 tháng một lần trong 2 năm sau khi cắt bỏ. Không có sự đồng thuật thống nhất nào về vai trò và tần suất xét nghiệm CA19-9 (được gợi ý để cho biết tỷ lệ sống sót chung ở bệnh nhân bị bệnh có thể phẫu thuật cắt bỏ) và chụp CT theo dõi.
Bệnh nhân bị bệnh di căn tiến triển được điều trị bằng hóa trị liệu cần được theo dõi chặt chẽ tình trạng nhiễm độc ở mỗi chu kỳ hóa trị liệu, và được đánh giá đáp ứng với hóa trị liệu 2 tháng một lần. Những bệnh nhân này có thể thay đổi đột ngột tình trạng lâm sàng do khối u tiến triển nhanh kèm theo tăng nguy cơ về biến chứng. Khi không còn cơ hội chữa khỏi, cần thảo luận lịch theo dõi với bệnh nhân và thiết kế lịch này để tránh cảm giác căng thẳng và gánh nặng kinh tế cho bệnh nhân.
Hướng dẫn dành cho bệnh nhân
Nên khuyến khích bệnh nhân tuân theo hướng dẫn đã thiết lập để có sức khỏe tốt, như duy trì cân nặng tốt cho sức khỏe, không hút thuốc, có chế độ ăn uống cân bằng và làm các xét nghiệm tầm soát ung thư được khuyến cáo. Nếu được chỉ định, bệnh nhân bị ung thư tụy tiến triển cục bộ hoặc di căn cần được đánh giá chính thức bởi một dịch vụ cung cấp thuốc có tác dụng giảm nhẹ. Có nhiều cách nhận hỗ trợ tại cộng đồng địa phương và ngoài cộng đồng: ví dụ, Hội Ung thư Hoa Kỳ có thông tin về nhiều nhóm hỗ trợ tại địa phương, và các nhân viên xã hội, tư vấn viên hoặc bác sĩ tâm thần. [American Cancer Society: support programs and services] có thể hữu ích trong việc cung cấp thông tin.
Các biến chứng
| Các biến chứng | Khung thời gian | Khả năng |
| các biến chứng phẫu thuật: dò tụy | ngắn hạn | trung bình |
| Tỷ lệ tử vong liên quan đến phẫu thuật cắt bỏ khối tá-tụy là <5% tại các trung tâm chuyên về tụy. Tuy nhiên, tỷ lệ mắc bệnh nằm trong khoảng 30% đến 60%. Do một trong những biến chứng chính và nguyên nhân gây tử vong sau khi phẫu thuật cắt bỏ khối tá-tụy là dò từ gốc tụy còn lại, tất cả những nỗ lực sử dụng kỹ thuật và thuốc đều đã được thử để ngăn các biến chứng liên quan đến gốc tụy. Biện pháp điều trị duy nhất cho thấy có hiệu quả trong phòng ngừa các biến chứng (rò rỉ tụy và tụ dịch trong ổ bụng) là dùng thuốc somatostatin và các thuốc tương đương, cụ thể là octreotide. Việc bít ống tụy không hỗ trợ trong ngăn ngừa các biến chứng liên quan đến dò tụy khi được tạo miệng nối bổ sung và không được khuyến cáo do có báo cáo tăng rò tụy và suy tụy nội tiết và ngoại tiết. Mặc dù một số nghiên cứu cho thấy rằng thủ thuật nối tụy-dạ dày làm giảm dò tụy sau phẫu thuật so với thủ thuật nối tụy-hỗng tràng, tuy nhiên bằng chứng kém thuyết phục do các nghiên cứu báo cáo các kết quả mâu thuẫn và nguy cơ gây nhiễu cao. Tái cấu trúc vòng kép (Roux-en-Y) với việc tách riêng thủ thuật nối tụy-hỗng tràng với dẫn lưu đường mật đã kéo dài đáng kể thời gian phẫu thuật nhưng không giảm các biến chứng sau phẫu thuật, và vì vậy không ưu việt hơn là tái cấu trúc vòng đơn thông thường. Không có bằng chứng rằng sử dụng keo fibrin có hiệu quả trong việc ngăn ngừa dò tụy. |
||
| các biến chứng phẫu thuật: chậm làm rỗng dạ dày giai đoạn đầu | ngắn hạn | trung bình |
| Chậm làm rỗng dạ dày giai đoạn đầu thường liên quan đến nhiễm trùng huyết trong bụng; quá trình điều trị cần nhắm trực tiếp đến việc điều trị nguyên nhân. Thuốc hỗ trợ nhu động ruột như erythromycin có thể có ích. Bằng chứng gợi ý rằng đặt miệng nối dạ dày-ruột, trước hoặc sau đại tràng, không tạo nên sự khác biệt. Hơn nữa, tái cấu trúc Billroth loại II có thể làm giảm quá trình chậm làm rỗng dạ dày giai đoạn đầu so với tái cấu trúc Roux-en-Y. | ||
| tắc nghẽn tá tràng | dài hạn | thấp |
| Khoảng 5% bệnh nhân bị tắc nghẽn tá tràng thứ phát sau ung thư biểu mô tụy. Bệnh nhân thường có biểu hiện đau bụng, nôn, táo bón hoàn toàn, và các mức độ trướng bụng khác nhau. Điều trị tắc nghẽn tá tràng có thể cần phẫu thuật bằng nối vị tràng hoặc đặt stent qua nội soi. | ||
| Viêm đường mật | biến thiên | trung bình |
| Bệnh nhân có biểu hiện sốt, vàng da, đau một phần tư trên phải (RUQ) và ở các ca bệnh nặng là nhiễm trùng huyết hoặc rối loạn tri giác. Viêm đường mật có khả năng đáng kể góp phần vào tỷ lệ tử vong và tỷ lệ mắc bệnh, với tỷ lệ tử vong được báo cáo từ 13% đến 88%.
Cần dùng thuốc kháng sinh để điều trị viêm đường mật, trong đó lựa chọn điều trị bằng thuốc kháng sinh phụ thuộc vào loại vi sinh vật được phát hiện và độ nhạy cảm với kháng sinh. Nhiều bệnh nhân đáp ứng với điều trị kháng sinh; những bệnh nhân không đáp ứng cần dẫn lưu đường mật khẩn cấp. |
||
| huyết khối tĩnh mạch sâu và thuyên tắc phổi | biến thiên | trung bình |
| Bệnh nhân bị ung thư tụy tăng nguy cơ phát triển thuyên tắc tĩnh mạch do huyết khối: tỷ lệ mắc mới nằm trong khoảng 17% đến 57%. Sử dụng dài hạn heparin trọng lượng phân tử thấp được ưu tiên hơn so với warfarin trong phòng ngừa bệnh thuyên tắc tĩnh mạch do huyết khối nguyên phát và thứ phát. | ||
| chảy máu | biến thiên | thấp |
| Nếu khối u tụy loét vào tá tràng và chảy máu, các phương án điều trị bao gồm làm thuyên tắc chọn lọc mạch máu đang chảy hoặc đặt stent kim loại có vỏ bọc. | ||
Tiên lượng
Bệnh có thể cắt bỏ (giai đoạn I, II)
Vào thời điểm chẩn đoán, 15% đến 20% bệnh nhân có thể thực hiện phẫu thuật cắt bỏ. Tuy nhiên, mặc dù ở những bệnh nhân đã được phẫu thuật cắt bỏ tụy triệt để, thời gian sống sót trung vị nằm trong khoảng từ 15 đến 19 tháng, với tỷ lệ sống sót sau 5 năm là 20%. Chỉ báo tiên lượng mạnh nhất cho thời gian sống sót lâu dài ở bệnh nhân là bờ phẫu thuật cắt bỏ âm tính, thành phần DNA khối u, kích thước khối u và không di căn hạch bạch huyết.
Bệnh tiến triển cục bộ không thể cắt bỏ (giai đoạn III)
Khoảng 30% bệnh nhân bị ung thư tụy tiến triển cục bộ. Mặc dù hóa trị liệu có hoặc không có xạ trị có thể đem lại chút cải thiện ở thời gian sống sót và giảm nhẹ bệnh, nhưng biện pháp này hiếm khi kiểm soát được ung thư. Trong vòng vài tháng sau khi hoàn thành quá trình điều trị, bệnh nhân thường có bằng chứng tiến triển khối u cục bộ hoặc di căn mới. Những bệnh nhân này nhiều khả năng có di căn dưới lâm sàng và cần được cân nhắc điều trị bằng các thuốc mới. Tác động tiên lượng của các yếu tố phân tử, như K-Ras, thụ thể yếu tố tăng trưởng biểu bì, PTEN hoặc AKT, và phát hiện các tế bào khối u trong tuần hoàn vẫn đang được đánh giá.
Bệnh di căn (giai đoạn IV)
Những bệnh nhân bị bệnh di căn (50% đến 55%) có thời gian sống sót giới hạn chỉ từ 3 đến 6 tháng. Thời gian sống sót phụ thuộc vào mức độ khối u và đáp ứng với điều trị tại thời điểm khám.
Câu hỏi lâm sàng
Câu 1
Bệnh nhân nam 65 tuổi đến phòng khám do cơn đau thượng vị và buồn nôn kéo dài 4 tuần qua. Đau liên tục và không giảm hay tăng khi hoạt động, thay đổi tư thế, hay chế độ ăn. Bệnh nhân sụt xấp xỉ 4.5 kg thời gian qua. Bệnh nhân không sốt, không nôn, không táo bón hoặc ỉa chảy. Bệnh nhân được chẩn đoán đái tháo đường type 2 từ 6 tháng trước và được kiểm soát bởi chế độ ăn ít tinh bột. Bệnh nhân chưa từng trải qua phẫu thuật hay mắc bệnh lý mạn tính nào. Bệnh nhân có tiền sử hút 45 bao thuốc 1 năm. Bệnh nhân không sử dụng rượu hay chất cấm. Nhiệt độ 36.5, huyết áp 122/72, mạch 68 l/p, nhịp thở 16 l/p. BMI 24 kg/mm2. Niêm mạc ẩm. Không có nổi hạch ở cổ hay hõm nách. m ruột bình thường, bụng mềm, đau thượng vị nhẹ khi ấn sâu. Không có gan lách to hoặc gõ đục vùng thấp. Thăm khám các bộ phận còn lại bình thường. Công thức máu, hóa sinh máu và xét nghiệm chức năng gan bình thường, tuy nhiên đường máu lúc đói là 130 mg/dL. Bước xử trí nào tiếp theo là tốt nhất ở bệnh nhân này?
- Siêu âm bụng
- B. CT bụng
- Kháng nguyên Hp phân
- Chụp hình phóng xạ nhu động dạ dày
- Nội soi đường tiêu hóa trên
Bệnh nhân cao tuổi, sụt cân, đau thượng vị kéo dài, tiền sử hút thuốc và được chẩn đoán đái tháo đường gần đây nghi ngờ nhiều khả năng mắc ung thư tụy, nguyên nhân gây tử vong do ung thư cao thứ 4 tại Mỹ. Yếu tố nguy cơ chính là hút thuốc, viêm tụy mạn, rối loạn chuyển hóa đường như đái tháo đường hoặc đề kháng insulin.
Khoảng 25% bệnh nhân ung thư tụy được chẩn đoán đái tháo đường <2 năm trước khi phát hiện khối u. Đặc biệt, đái tháo đường không điển hình (đái tháo đường ở người già, gầy) nghi ngờ nhiều khả năng ung thư tụy đặc biệt khi đi kèm dấu hiệu gợi ý (đau, sụt cân). Không chắc chắn liệu đái tháo đường thúc đẩy ung thư hay đái tháo đường xảy ra như một hệ quả của hội chứng cận u từ sự bài tiết của tủy thượng thận, dẫn đến rối loạn chức năng tế bào beta đảo tụy.
Tầm soát ung thư tụy không được khuyến cáo ở người lớn mới khởi phát đái tháo đường vì tỷ lệ mắc đái tháo đường cao hơn so với ung thư tụy. Tuy nhiên, những bệnh nhân có triệu chứng ung thư tụy như đau thượng vị âm ỉ, kéo dài và sụt cân cần đánh giá bằng chụp CT bụng. Siêu âm bụng được sử dụng để đánh giá ban đầu tình trạng vàng da không đau, chán ăn hoặc sụt cân. Tuy nhiên, đây không phải là biện pháp ưu tiên để tầm soát bệnh nhân có đau bụng không có vàng da; do nó thường bỏ sót các khối u nhỏ (có thể cắt bỏ); không đánh giá được mức độ lan rộng của khối u. (Ý A)
Ý C và E: Bệnh nhân với loét dạ dày tá tràng hoặc u dạ dày thường đau thượng vị âm ỉ mà gia tăng sau bữa ăn (khi thức ăn lót dạ dày hết). Những bệnh lý này thường được chẩn đoán nhờ nội soi dạ dày tá tràng kèm xét nghiệm kháng nguyên Helicobacter pylori trong phân. Tuy nhiên, loét dạ dày tá tràng hiếm khi gây đau thượng vị liên tục và sụt cân. Ung thư dạ dày thường gây thiếu máu (do chảy máu khối u ở dạ dày) và không liên quan đến đái tháo đường khởi phát gần đây.
Ý D: Chụp hình phóng xạ tháo rỗng dạ dày có thể chẩn đoán liệt dạ dày, thường phổ biến ở bệnh nhân đái tháo đường kém kiểm soát và thường biểu hiện chướng bụng sau ăn, buồn nôn và no sớm. Đau bụng liên tục thường không điển hình và đái tháo đường ở bệnh nhân này được kiểm soát với chế độ ăn.
Mục tiêu học tập: Khoảng 25% ung thư tụy có dấu hiệu báo trước bởi chẩn đoán đái tháo đường trước đó (<2 năm). Mặc dù tầm soát ung thư tụy không được khuyến cáo cho bệnh nhân mới khởi phát đái tháo đường, những bệnh nhân với triệu chứng (đau thượng vị kéo dài, sụt cân) của ung thư tụy nên được thực hiện CT bụng.
Câu 2
Bệnh nhân nữ 54 tuổi, đi khám vì đau thượng vị ngày càng nặng hơn trong 2 tháng qua. Cơn đau tăng vào ban đêm, ban đầu không liên tục nhưng bây giờ đôi khi liên tục và lan ra sau lưng. Cô ấy đã sụt 6,8 kg (15 lb) trong 3 tháng qua. Bệnh nhân cho biết không có sự thay đổi về màu sắc của phân hoặc nước tiểu. Hai năm trước, cô được chẩn đoán mắc bệnh viêm tụy mạn tính vô căn và bắt đầu điều trị bằng liệu pháp thay thế enzyme tuyến tụy. Ban đầu bệnh nhân bị tiêu chảy, khó chịu vùng thượng vị và đầy hơi, sau đó cải thiện bằng men tụy. Cô ấy không sử dụng thuốíc lá, rượu hoặc ma túy. Các dấu hiệu sinh tồn trong giới hạn bình thường. Chỉ số BMI của cô ấy là 21 kg/m2. Không vàng da. Khám bụng thấy đau nhẹ vùng thượng vị khi sờ sâu. Kết quả xét nghiệm như sau:
| Albumin | 3.3 g/dL |
| Total bilirubin | 0.9 mg/dL |
| Direct bilirubin | 0.4 mg/dL |
| Alkaline phosphatase | 54 U/L |
| Aspartate aminotransferase | 28 U/L |
| Alanine aminotransferase | 25 U/L |
| Amylase | 45 U/L |
| Lipase | 31 U/L (0.40 U/L) |
Bước tiếp theo nào là phù hợp nhất trong việc quản lý bệnh nhân này?
- Cancer-associated antigen testing
- CT scan bụng có cản quang
- Nội soi mật tụy ngược dòng
- Tăng cường liệu pháp thay thế men tụy
- X quang bụng
- Trấn an và liệu pháp opioid
- Kiểm tra chức năng tiết secretin của tuyến tụy
Bệnh nhân nữ, 54 tuổi, đi khám vì đau thượng vị
- Viêm tụy mạn đáp ứng với liệu pháp thay thế enzyme
- Sụt cân
Hỏi: Bước tiếp theo nào là phù hợp nhất trong việc quản lý bệnh nhân này?
Đáp án: CT scan bụng có cản quang
Bệnh nhân này đau vùng thượng vị ngày càng nặng và sụt cân trong bối cảnh viêm tụy mạn vô căn gợi ý ung thư tụy. Việc triệu chứng và chẩn đoán sẽ khác nhau tùy thuộc vào vị trí khối u. Các biểu hiện thường gặp bao gồm sụt cân và khởi phát đau bụng âm ỉ (thường ở vùng thượng vị và lan ra sau lưng), nặng hơn vào ban đêm, khi ăn hoặc khi nằm ngửa.
- Ung thư đầu tụy (60%-70%) thường có biểu hiện vàng da (tắc ống mật chủ, tăng phosphatase kiềm và bilirubin) và phân mỡ (suy tụy ngoại tiết hoặc tắc ống tụy). Ở những bệnh nhân có những dấu hiệu này, siêu âm bụng thường được lựa chọn hơn để phát hiện các khối u ở đầu tụy và loại trừ các nguyên nhân tiềm ẩn khác gây tắc mật (ví dụ, sỏi ống mật chủ).
- Ung thư ở thân và đuôi thường không có biểu hiện vàng da tắc mật. Chụp CT bụng có cản quang được ưu tiên hơn (nhạy và đặc hiệu hơn) vì nó có thể mô tả hoại tử bên trong tuyến tụy và xác định di căn xa; nó cũng giúp loại trừ các tình trạng khác. Siêu âm có độ nhạy thấp hơn trong việc hình dung thân và đuôi tụy (do khí trong ruột quá nhiều) và phát hiện các khối u nhỏ hơn (<3 cm).
(Lựa chọn A) Cancer-associated antigen 19-9, một turmor marker liên quan đến ung thư tuyến tụy, không được khuyến nghị sàng lọc do độ nhạy thay đổi và độ đặc hiệu thấp. Nồng độ bình thường không loại trừ ung thư tuyến tụy.
(Lựa chọn C) Chụp mật tụy ngược dòng qua nội soi xâm lấn hơn so với chụp CT và dành cho những bệnh nhân bị ứ mật (do khối u chèn ép hệ thốíng đường mật) có thể cần can thiệp (ví dụ: đặt stent).
(Lựa chọn D) Liệu pháp thay thế men tụy thường được chuẩn độ dựa trên các triệu chứng lâm sàng và hàm lượng chất béo trong phân của bệnh nhân. Tuy nhiên, bệnh nhân này không cần điều chỉnh liều vì các triệu chứng của cô ấy (ví dụ như đầy bụng, tiêu chảy) được cải thiện khi điều trị ban đầu.
(Lựa chọn E) X quang bụng có thể cho thấy vôi hóa trong viêm tụy mạn tính, nhưng không hữu ích để chẩn đoán ung thư tuyến tụy. Ngoài ra, vôi hóa hiếm khi được nhìn thấy trong viêm tụy vô căn.
(Lựa chọn F) Liệu pháp opioid có thể cần thiết ở một số bệnh nhân bị viêm tụy mạn tính. Tuy nhiên, trấn an và điều trị triệu chứng không phù hợp ở bệnh nhân nghi ngờ ung thư tuyến tụy này.
(Lựa chọn G) Xét nghiệm secretin đo lường trực tiếp khả năng sản xuất bicarbonate của tế bào ống tụy. Nó rất hữu ích trong chẩn đoán viêm tụy mạn tính, nhưng không hữu ích trong việc đánh giá khả năng ung thư tuyến tụy.