Bệnh da liễu
Ứng dụng liệu pháp ánh sáng Led trong thực hành da liễu
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: R. Glen Caderhead. Biên dịch: Bác sĩ Trương Tấn Minh Vũ.
Để tải bài viết: Ứng dụng liệu pháp ánh sáng Led trong thực hành da liễu pdf mời các bạn click vào link ở đây.
Giới thiệu
Lịch sử của phototherapy
Quang trị liệu (phototherapy) theo nghĩa rộng nhất có nghĩa là bất kỳ loại điều trị nào (therapeia tiếng Hy Lạp có nghĩa ‘chữa trị, chữa lành’) với bất kỳ loại ánh sáng nào (từ tiếng Hy Lạp phos, photos có nghĩa ‘ánh sáng’). Tuy nhiên, định nghĩa được chấp nhận hiện nay của phototherapy là “việc sử dụng ánh sáng mức năng lượng thấp để đạt được hiệu ứng không sinh nhiệt và không tổn thương nhưng có hiệu quả lâm sàng ở mô”. Theo định nghĩa cơ bản ban đầu, phototherapy là một nghệ thuật cổ đại vì nguồn ánh sáng lâu đời nhất trên thế giới là mặt trời, và trị liệu bằng ánh sáng mặt trời, hay liệu pháp mặt trời, đã được sử dụng hơn 4000 năm và được ghi nhận sử dụng sớm nhất ở người Ai Cập cổ đại (Giese, Sống với tia cực tím của Mặt trời, Springer, New York, 1976). Họ điều trị vấn đề có lẽ là bệnh bạch biến bằng cách chà xát vùng bị ảnh hưởng với một loại thảo mộc được nghiền nát giống như cần tây, sau đó để vùng cần điều trị tiếp xúc với ánh sáng mặt trời. Tính nhạy sáng của cần tây gây ra phản ứng với ánh sáng mạnh trên da dẫn đến cháy nắng rất khó chịu, để hy vọng xuất hiện tình trạng tăng sắc tố thứ cấp sau viêm, hay còn gọi là ‘rám nắng’ để tái tạo vùng da bị mất sắc tố. Đến lượt người Hy Lạp và La Mã cổ đại đã sử dụng sức mạnh chữa lành của mặt trời, và nó vẫn đang được sử dụng tích cực ở châu Âu vào thế kỷ 18, 19 và đầu thế kỷ 20, đặc biệt là liệu pháp ánh sáng đỏ được thực hiện với bệnh nhân được ở trong phòng có cửa sổ màu đỏ. Một bệnh nhân nổi tiếng là Vua George III của Vương quốc Anh và Bắc Ireland, trị vì từ năm 1760 đến năm 1801, được mọi người biết đến với cái tên sai lầm là ‘Mad King George’. Hiện nay chúng tôi nghi ngờ rằng ông ấy có thể bị bệnh rối loạn chuyển hóa porphyrin máu, vì vậy việc bị nhốt trong một căn phòng với những bức tường màu đỏ và cửa sổ màu đỏ để điều trị trầm cảm có lẽ chỉ khiến ông ấy trở nên điên cuồng hơn, vì chứng rối loạn chuyển hóa porphyrin thường liên quan đến sự nhạy sáng dữ dội! Các vấn đề được điều trị theo cách này bao gồm các tổn thương da bùng phát do rubella và rubeola, thậm chí là bệnh ‘melancholia’, như trường hợp của Vua George III, hiện được ghi nhận là trầm cảm lâm sàng. Hippocrates, cha đẻ của Y học, chắc chắn đồng tình với ứng dụng thứ hai khoảng hai thiên niên kỷ trước Vua George: Hippocrates điều trị bằng ánh sáng mặt trời cho bệnh nhân trầm cảm và tin rằng người Hy Lạp bình thường dễ chịu hơn người ở các nước láng giềng phía bắc vì tiếp xúc nhiều hơn với ánh nắng mặt trời.
Trong lĩnh vực nghiên cứu quang trị liệu theo bước sóng, liệu pháp ánh sáng đỏ đã được kiểm tra ở cấp độ tế bào dưới kính hiển vi mới được phát minh bởi Fubini và các đồng nghiệp vào cuối thế kỷ thứ mười tám [3], những người có thể chỉ ra ánh sáng màu đỏ đi qua thấu kính và bộ lọc từ ánh sáng mặt trời, kích hoạt có chọn lọc thành phần hô hấp của ty thể tế bào. Không có gì mới dưới ánh mặt trời. Tuy nhiên, mặt trời là một công cụ y tế hay thay đổi, đặc biệt là ở Bắc Âu, và quang trị liệu hiện đại như đã biết bắt đầu vào khoảng đầu thế kỷ trước với hệ thống đèn hồ quang điện của Finsen, cho phép quang trị liệu khi chuyển công tắc, không phụ thuộc vào mặt trời [4]. Tuy nhiên, ngoài liệu pháp ánh sáng xanh được sử dụng cho bệnh tăng bilirubin ở trẻ sơ sinh vẫn còn tiếp tục cho đến ngày nay, phần lớn các ứng dụng của quang trị liệu đã bị loại bỏ trong khoảng đầu thế kỷ 20 nhờ xuất hiện thuốc tốt hơn hoặc các kỹ thuật điều trị được cải tiến.
Sự phát triển của các hệ thống laser đầu tiên, cuộc đua mà Theodore Maiman đã giành chiến thắng trong gang tấc vào năm 1960 với tia laser dựa trên ruby được kích hoạt bởi đèn flash, mang đến cho các bác sĩ lâm sàng và các nhà nghiên cứu một nguồn ánh sáng hoàn toàn khác biệt và độc đáo. Trong 4 năm từ 1960 đến 1964, theo sau laser ruby là argon, helium-neon (HeNe), neodymium: yttrium-nhôm-garnet (Nd: YAG), laser bán dẫn trạng thái rắn (laser diode) và laser carbon dioxide (CO2), tất cả đều vẫn còn được sử dụng trong lĩnh vực y tế, và laser HeNe (632,8 nm) thực tế đã có một lượng lớn tài liệu về liệu pháp quang trị liệu trong ba thập kỷ qua. Đối với diode phát sáng (light-emitting diodes, LED), ánh sáng đầu tiên từ chất bán dẫn được tạo ra vào năm 1907 bởi nhà thí nghiệm người Anh H. J. Round. Một cách độc lập vào giữa những năm 1920, O-V Losev ở Nga tạo ra ánh sáng hồng ngoại không nhất quán từ một chất bán dẫn (diode). Những nghiên cứu này đã được xuất bản ở Nga, Đức và Anh, nhưng công việc của họ hoàn toàn bị bỏ qua ở Mỹ [5]. Mãi đến năm 1962, đèn LED quang phổ nhìn thấy (633 nm, màu đỏ) thương mại đầu tiên được phát triển tại Hoa Kỳ bởi Holonyak, được coi là ‘Cha đẻ của đèn LED’ khi làm việc với General Electric Company. Trong vài năm tiếp theo, đèn LED cho các bước sóng nhìn thấy khác đã được sản xuất, với công suất gấp mười lần hoặc hơn đèn LED ban đầu của Holonyak. Vì những lý do sẽ được thảo luận ở phần sau, những đèn LED này thực sự không thích hợp làm nguồn sáng trị liệu, mặc dù chúng cực kỳ sáng và rất rẻ so với laser diode, và phải đến cuối những năm 1990, một thế hệ đèn LED gần như đơn sắc (quasimonochromatic) cực kỳ mạnh mẽ mới được phát triển bởi Whelan và các đồng nghiệp như một sản phẩm phụ từ Chương trình Y học Không gian của Cơ quan Hàng không và Vũ trụ Quốc gia (NASA) [6]. Không giống như thế hệ trước rẻ tiền, những cái gọi là ‘Đèn LED NASA’ cuối cùng đã cung cấp cho các bác sĩ lâm sàng và các nhà nghiên cứu một công cụ điều trị mới và thiết thực [7].
Đèn LED là gì và tại sao dùng đèn LED?
LED là gì?
Diode phát quang (light-emitting diodes, LED) thuộc gia đình thiết bị trạng thái rắn được gọi là chất bán dẫn. Đây là những thiết bị nằm ở giữa vật liệu dẫn điện và cách điện, khi không có dòng điện nào được đưa vào chất bán dẫn, nó có các đặc tính gần giống như chất cách điện. Giải thích một cách đơn giản, chất bán dẫn hoặc diode phát sáng bao gồm vật liệu âm (loại N) và dương (loại P), được ‘pha tạp’ với các tạp chất cụ thể để tạo ra bước sóng mong muốn. Vùng n chứa các electron ở trạng thái cơ bản hoặc trạng thái nghỉ, và vùng p chứa các ‘lỗ trống’ tích điện dương, cả hai lỗ này đều ít nhiều ở trạng thái tĩnh (Hình 18.1a – c). Khi một điện thế dòng điện một chiều có phân cực chính xác được đặt vào một đèn LED, các electron trong vùng N được đẩy lên trạng thái năng lượng cao hơn, và chúng và các lỗ trống trong vùng P bắt đầu chuyển động về phía nhau (Hình 18.1d), gặp nhau tại điểm tiếp giáp N / P nơi các electron mang điện tích âm bị hút vào các lỗ trống mang điện tích dương. Sau đó, các electron trở lại trạng thái năng lượng nghỉ và khi làm như vậy, phát ra năng lượng dự trữ của chúng dưới dạng một photon, một hạt năng lượng ánh sáng (Hình 18.1e). Bước sóng được phát ra là không nhất quán, lý tưởng là dải rất hẹp và phụ thuộc vào cả vật liệu mà đèn LED được cấu tạo, chất nền và khoảng cách tiếp giáp p-n. Bảng 18.1 trình bày danh sách các chất nền chính và các màu liên quan. Đèn LED có hai hình dạng: có loại đèn LED dạng vòm cũ hơn và loại gần đây hơn và hiện đang được sử dụng nhiều hơn, “on board chip” (OBC), nhỏ gọn hơn và ít tốn kém hơn nhiều so với loại hình vòm cũ hơn. Chúng cũng hiệu quả hơn. Hình 18.2 mô tả cấu tạo của cả hai loại LED. Các loại hình vòm có thể được gắn trên bảng mạch in (printed circuit board, PCB) ở khoảng cách đều đặn và chính xác từ nhau để cung cấp một mảng LED, trong khi loại OBC đã là một phần của PCB, nói cách khác các nhà sản xuất hệ thống LED có thể mua PCB được làm sẵn với bất kỳ cấu hình và kích thước nào. Hình 18.3 cho thấy một ví dụ về cả hai kiểu trong thực tế.
Bảng 18.1 Các chất nền phổ biến và màu sắc được tạo ra.
| Chất nền | Công thức | Màu sắc được tạo ra |
| Aluminum gallium arsenide | (AlGaAs) | Đỏ, hồng ngoại |
| Aluminum gallium phosphide | (AlGaP) | Xanh lục |
| Aluminum gallium indium phosphide | (AlGaInP) | Xanh lục, vàng, cam, đỏ cam (tất cả cường độ cao) |
| Gallium arsenide phosphide | (GaAsP) | Vàng, cam, đỏ cam, đỏ |
| Gallium phosphide | (GaP) | Xanh lục, vàng, đỏ |
| Gallium nitride | (GaN) | Xanh lam, xanh lục, xanh lục thuần khiết (xanh lục bảo): cũng có màu trắng (nếu có rào cản lượng tử AlGaN, gọi là LED ‘ánh sáng trắng’) |
| Indium gallium nitride | (InGaN) | Gần tia cực tím, xanh lam, xanh lục hơi xanh |
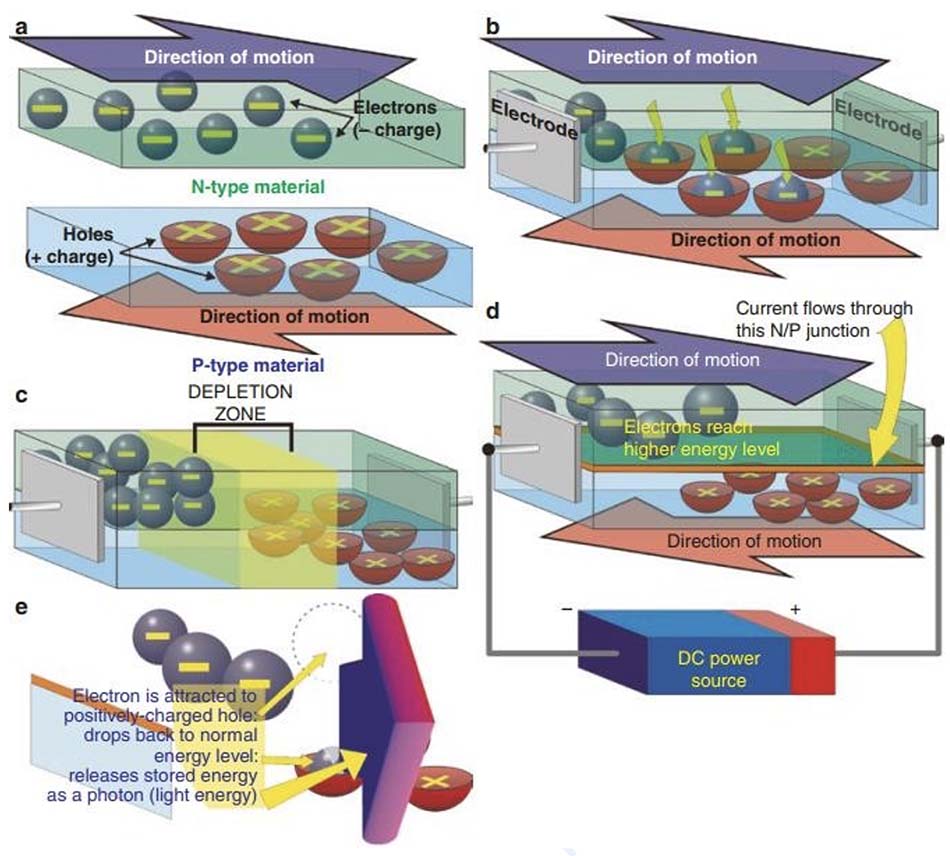
(a) Đèn LED về cơ bản được cấu tạo bởi hai vật liệu, vật liệu loại N hoặc vật liệu âm và vật liệu loại P hoặc vật liệu dương. Vật liệu N chứa các electron mang điện tích âm chuyển động như trong hình và vật liệu P chứa các lỗ trống mang điện tích dương chuyển động theo hướng ngược lại. Khi các vật liệu ở xa nhau và không được kết nối với bất kỳ nguồn điện nào, chuyển động vẫn tiếp tục, do đó cả hai vật liệu đều là chất dẫn điện. (b) Tuy nhiên, khi các vật liệu được gắn lại với nhau mà không có bất kỳ nguồn điện nào tác động lên các điện cực gắn với các đầu đối diện, các electron mang điện tích âm ở trung tâm của chip sẽ bị hút vào các lỗ trống và hình thành một khu vực được gọi là lớp suy giảm như đã thấy trong (c) và tất cả chuyển động ngừng ở cả vật liệu N và P: con chip bây giờ là một chất cách điện. (d) Nguồn điện được đặt vào các điện cực, với điện cực dương hoặc cực dương ở gốc chuyển động của các lỗ trống và điện cực âm hoặc cực âm ở gốc chuyển động của các electron. Quan sát cực khi kết nối nguồn điện một chiều (DC) là vô cùng quan trọng. Dòng điện chạy qua phần tiếp giáp giữa các vật liệu, được gọi là tiếp giáp N/P, và chuyển động của cả các electron và lỗ trống bắt đầu trở lại, nhưng với nguồn điện được đặt vào, các electron sẽ chuyển lên mức năng lượng cao hơn từ trạng thái cơ bản hoặc trạng thái nghỉ. (e) Như trong b ở trên, các điện tử N bị hút vào các lỗ trống P, nhưng khi di chuyển xuống dưới điểm tiếp giáp N / P, chúng phải trở về mức năng lượng cơ bản và mất năng lượng dự trữ bổ sung dưới dạng một photon, năng lượng ánh sáng nhỏ nhất. Tuy nhiên, không giống như tình huống ở b, khi sức mạnh được sử dụng, hành động này sẽ tiếp tục không ngừng và không có lớp suy giảm nào được hình thành. Vật liệu N và P được ‘pha tạp’ với các vật liệu khác, điều này quyết định khoảng cách ‘rơi’ giữa các điện tử và lỗ trống: khoảng cách mà các điện tử phải rơi càng lớn thì mức năng lượng của các photon phát ra càng cao. Các photon có mức năng lượng cao có bước sóng ngắn hơn các photon có mức năng lượng thấp hơn, do đó bước sóng của ánh sáng phát ra được xác định bởi vật liệu nền và sự pha tạp của chúng. Vật liệu N và P chất lượng cao và các chất pha tạp tinh khiết sẽ tạo ra các photon có bước sóng rất gần giống nhau, tức là ánh sáng gần như đơn sắc (quasimonochromatic).
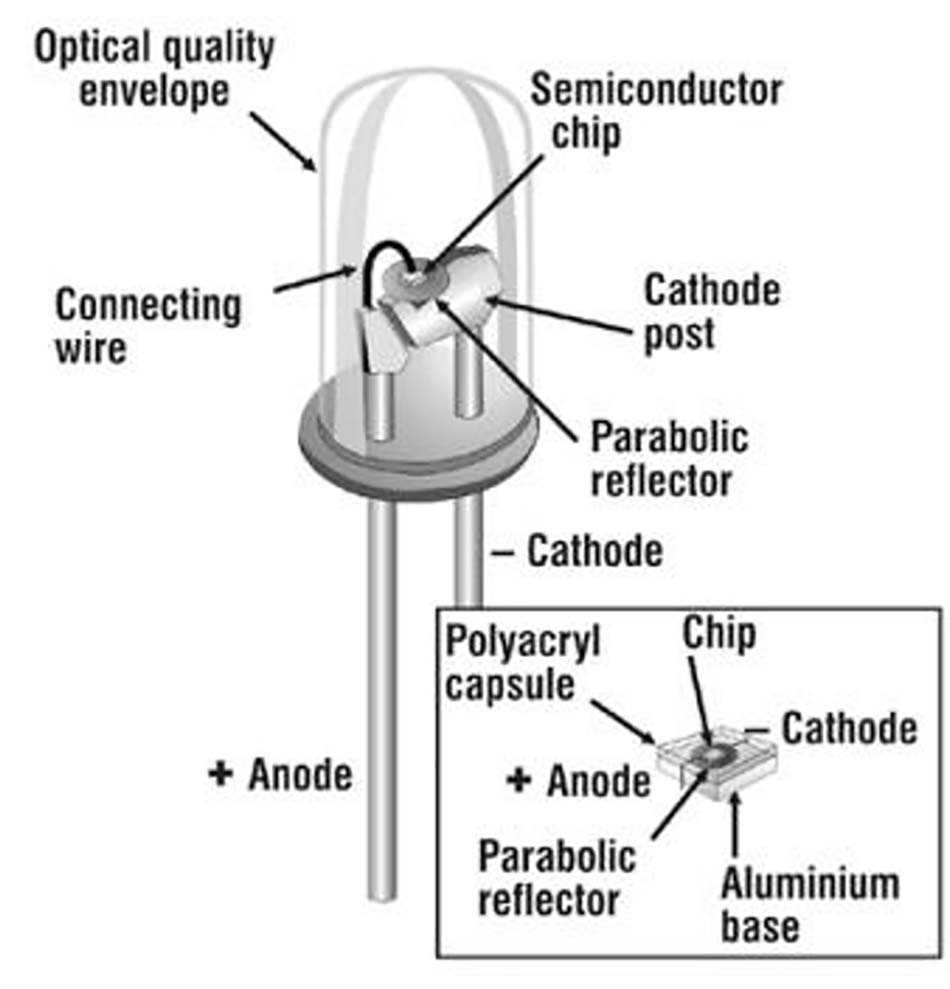
Trường hợp loại vòm, cực âm luôn ngắn hơn cực dương và có bề mặt phẳng ở đế đèn LED bởi cực âm có tính phân cực được xác định rõ khi kết nối với nguồn điện một chiều hoặc lắp trên bảng mạch in (PCB). Trên đỉnh của cực âm và phần tạo thành điện cực âm của chip LED là một bộ phản xạ hình parabol được gắn trong chip, do đó đảm bảo càng nhiều ánh sáng hướng về phía trước càng tốt, với góc phân kỳ nhất quán, thường là 60° độ hoặc ít hơn tùy thuộc vào thông số kỹ thuật của đèn LED. Một dây nhỏ kết nối điện cực dương của chip với cột cực dương để hoàn thành mạch. Toàn bộ cụm được bao bọc trong một lồng nhựa trong suốt có chất lượng quang học cao, chắc chắn. Trong loại OBC, chip được gắn trước với PCB, nhưng ít nhiều có cấu tạo giống như đèn LED kiểu vòm, với chip được gắn phía trên gương phản xạ hình parabol. Đèn LED loại OBC nhỏ gọn hơn nhiều so với loại hình vòm.

Bề mặt của PCB rất thường được phủ để phản chiếu ánh sáng của LED gắn trên nó. Một phần năng lượng ánh sáng phát ra từ dãy đèn LED sẽ bị phản xạ ngược lại khỏi lớp sừng của da và một phần ánh sáng tới khi đi vào da sẽ bị tán xạ ngược ra ngoài da. Lớp phủ phản chiếu trên PCB hứng các photon này, nếu không năng lượng của chúng sẽ bị mất vào không khí hoặc có thể bị PCB hấp thụ và tạo ra nhiệt không mong muốn, rồi phản xạ chúng trở lại da. Điều này có thể làm tăng đáng kể hiệu quả của bảng LED. Phần thân của thế hệ đèn LED mới nhất được thiết kế để phản xạ các photon mà đèn LED phát ra, do đó tăng thêm hiệu quả. Vì đèn LED sử dụng mức công suất thấp, mất một phần nhỏ công suất cũng có thể ảnh hưởng không tốt đến hiệu quả lâm sàng, do đó bảng LED có hiệu suất cao hơn, cho ra nhiều ánh sáng hơn với ít năng lượng điện hơn sẽ lý tưởng hơn.
Sự khác biệt giữa LED và Laser hoặc IPL
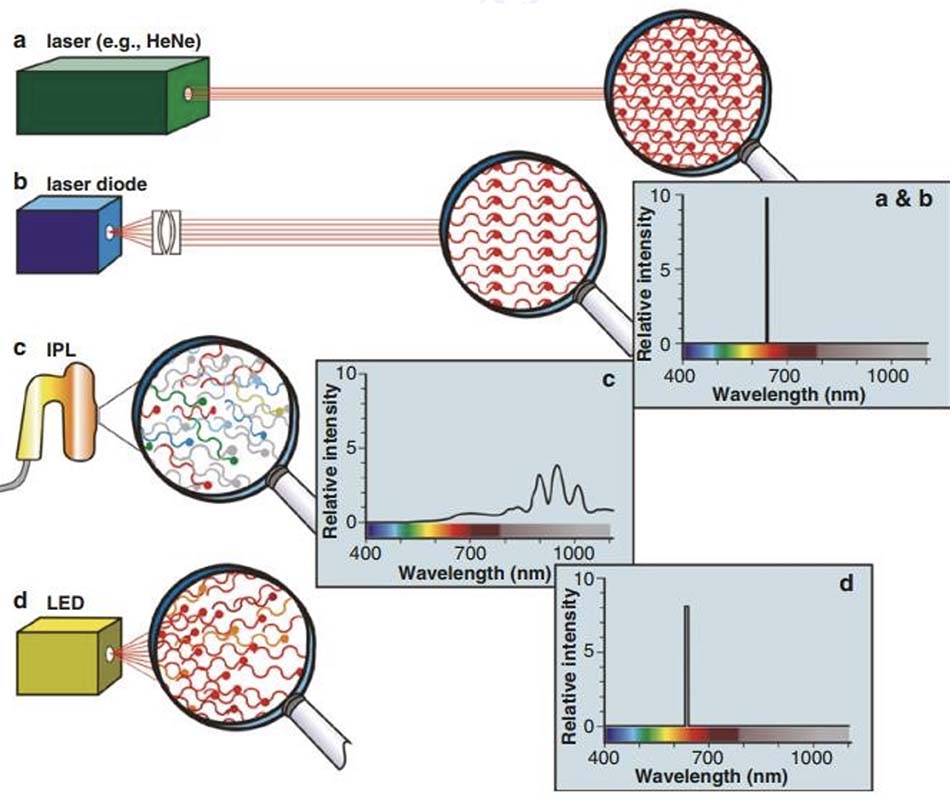
Laser là một dạng năng lượng ánh sáng độc đáo, có ba đặc tính đơn sắc, chuẩn trực và pha tạo nên tính chất tổng thể của ‘tính nhất quán”. Đơn sắc có nghĩa là tất cả các photon có cùng bước sóng hay màu sắc; chuẩn trực có nghĩa là quỹ đạo của chùm tia song song cùng nhau; và pha có nghĩa là tất cả các photon di chuyển cùng nhau cách đều nhau một cách chính xác trong thời gian và trong không gian. Laser diode không có tính chuẩn trực từ đầu, nhưng vì chúng vẫn là laser thực sự, và do đó được gọi là nguồn điểm, ánh sáng có thể được tập hợp và chuẩn trực về mặt quang học. Mặt khác, ánh sáng xung cường độ cao (IPL) hoàn toàn không nhất quán, với một dải lớn ánh sáng đa sắc (đa bước sóng) từ hồng ngoại gần cho đến màu xanh lam; không có khả năng chuẩn trực và phân kỳ rất nhiều; với rất nhiều photon hoàn toàn lệch pha. Thế hệ đèn LED mới có bước sóng đầu ra định mức cộng hoặc trừ một vài nanomet, và những đèn LED này được phân loại là gần đơn sắc; một số kính quang học chuẩn trực có thể dùng để tập hợp các photon phân kỳ; tuy nhiên chúng không cùng pha và vì vậy không bao giờ có thể hội tụ đến một điểm nhỏ. Năng lượng laser có thể dễ dàng tạo ra cường độ photon cao trên một đơn vị diện tích, IPL ít hơn nhiều, nhưng với các đèn LED trong điều kiện được bố trí chính xác, chúng có khả năng đạt cường độ tới gần giống như laser. Hình 18.4 minh họa bằng sơ đồ sự khác biệt giữa laser, IPL và LED. Tóm lại, LED dùng cho các ứng dụng điều trị phải là chuẩn sắc, có khả năng nhắm mục tiêu là các tế bào hoặc vật liệu với bước sóng cụ thể, có bức xạ đầu ra ổn định với cường độ photon có hiệu quả về mặt lâm sàng.
Tại sao dùng đèn LED
Có nhiều hệ thống laser và IPL tuyệt vời sẵn có cho bác sĩ da liễu. Tại sao đèn LED nên được coi là một nguồn quang trị liệu thay thế khả thi? Nếu tác giả được hỏi câu hỏi này trước những năm 1990, thì chắc sẽ cười thầm. Cho đến khi Giáo sư Harry Whelan và các đồng nghiệp NASA của ông trong Phòng thí nghiệm Y học Không gian phát triển “Đèn LED NASA” vào năm 1998, những đèn LED rẻ và sáng nhưng không thực sự phù hợp cho các ứng dụng lâm sàng vì ngoài tính phân kỳ cao, chúng còn là một dải sóng, chứ không phải là một bước sóng và do đó có độ chọn lọc chromophore cực kỳ kém. Như đã thảo luận ở trên, đèn LED của NASA cho tính chất chuẩn sắc, tức là phần lớn các photon có cùng bước sóng và công suất đầu ra cao hơn 5 bậc so với thế hệ đèn LED trước đó. Điều này làm cho đèn LED lần đầu tiên trở thành nguồn sáng trị liệu quang thích hợp (Hình 18.2 và 18.4). Ngoài công suất đầu ra và dải ánh sáng hẹp, các lý do khác để sử dụng đèn LED trong thực hành lâm sàng là hiệu quả và giá cả.
Tỷ lệ chuyển đổi điện-ánh sáng của một loại laser điển hình là rất thấp, cần hàng trăm hoặc thậm chí hàng nghìn watt để tạo ra công suất vài watt. Tương tự với IPL, trong đó đèn flash được cung cấp lượng lớn năng lượng để cho ra chùm ánh sáng đa sắc, tuy nhiên chùm ánh sáng này có thể bị lọc bớt. Ngay cả khi được lọc, năng lượng IPL được phân phối qua một dải sóng chứ không phải ở một bước sóng cụ thể (Hình 18.4). Trường hợp đèn LED cho ánh sáng chuẩn sắc và không cần lọc, hiệu suất chuyển đổi rất cao, do đó chỉ cần dòng điện với công suất và điện áp thấp để cho ra ánh sáng có tác dụng về mặt lâm sàng. Đèn LED rẻ hơn nhiều so với laser diode. Tùy thuộc vào chất lượng và bước sóng, có thể mua bất kỳ nơi nào từ 200 đèn LED thế hệ mới với chi phí của một laser diode. Chi phí của các hệ thống laser và IPL rất cao, do đó một hệ thống đèn LED rẻ hơn nhiều có thể hạn chế chi phí y tế ngày càng tăng cao cho cả bác sĩ và bệnh nhân. Một lợi thế nữa là bản chất trạng thái rắn của đèn LED. Không cần dây tóc và không cần đèn flash để tạo ra ánh sáng hoặc để cung cấp cho môi trường laser: do đó, đèn LED hoạt động mát hơn nhiều so với những loại còn lại có công suất cực cao, do đó, không yêu cầu về hệ thống làm mát chuyên dụng giúp giảm chi phí. Tuy nhiên, một số đèn LED vẫn cần phải được làm mát, đặc biệt là khi đèn LED loại OBC gắn thành nhiều mảng, vì các mạch trình điều khiển của LED mới tạo ra nhiệt chứ không phải chính đèn LED làm nhiệt độ của PCB tăng lên, nhiệt được chuyển đến các đèn LED OBC bằng cách dẫn điện làm nhiệt độ của đèn LED tăng lên, ánh sáng đầu ra sẽ lệch khỏi bước sóng được thiết kế. Nếu tế bào hoặc mô mục tiêu yêu cầu độ đặc hiệu của bước sóng thì đây có thể là một vấn đề lớn. Bản chất trạng thái rắn của đèn LED cũng làm cho chúng mạnh mẽ hơn nhiều so với hệ thống laser hoặc IPL, vì vậy chúng có thể thực hiện việc xử lý đôi khi không quá nhẹ nhàng rộn mà không bị tổn thất công suất đầu ra hoặc kết cấu. Đèn LED có thể được gắn trong các bảng điều khiển phẳng, được nối với nhau thành một đầu điều trị có thể điều chỉnh để phù hợp với đường viền của vùng mô lớn được điều trị, cho dù đó là mặt, cánh tay, ngực hay lưng , hoặc chân. Cuối cùng, nếu cần xử lý nhiều mục tiêu theo bước sóng cụ thể, các mảng LED với các bước sóng khác nhau có thể được thiết kế để có thể dễ dàng hoán đổi cho nhau, được điều khiển chung. Với công nghệ điều khiển bằng vi xử lý ‘set-it-and-forget-it’, bác sĩ chỉ cần đặt đầu chiếu lên khu vực được điều trị theo khuyến nghị của nhà sản xuất, bật hệ thống và sau đó có thể rời khỏi bệnh nhân trong thời gian điều trị để thực hiện vào công việc khác. Trong hầu hết các trường hợp, điều dưỡng hoặc kỹ thuật viên được đào tạo có thể thực hiện điều trị sau khi bác sĩ đã kê đơn vì hệ thống đèn LED vốn đã an toàn cho bệnh nhân hơn nhiều so với laser hoặc IPL. Hình 18.5 là ví dụ về một đèn chiếu LED thế hệ mới được thiết kế tốt, mạnh mẽ nhưng trang nhã, di động và rất linh hoạt.

Phản ứng quang nhiệt và không tạo nhiệt
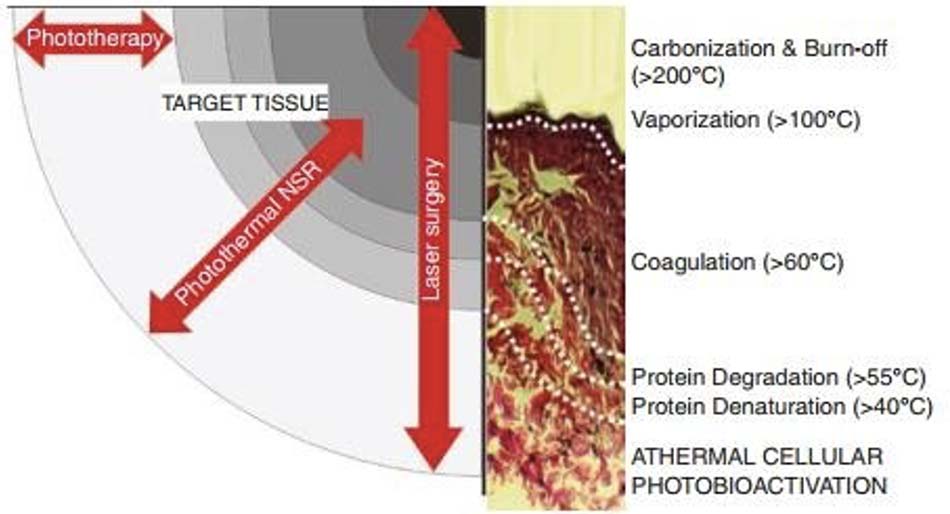
Mặc dù công suất đầu ra rất khác nhau, nhưng laser, IPL và đèn LED đều có chữ ‘L’ trong tên, viết tắt của từ “light”. Có thể nói chúng là những mặt khác nhau của một đồng tiền, nhưng ngay cả trong photosurgery, quang trị liệu cũng đóng một vai trò rất quan trọng. Nếu xem xét chùm tia laser CO2 phẫu thuật điển hình trong mô, chúng ta có thể thấy phạm vi hiệu ứng sinh học phụ thuộc nhiệt độ như trong Hình 18.6, từ cacbon hóa ở trên 200°C, hóa hơi ở trên 100°C, tới đông đặc ở khoảng 60– 85°C, giảm xuống đến quá trình quang điều biến, xảy ra không gây tổn thương khi không có sự gia tăng đáng kể nhiệt độ mô tại khu vực được điều trị. Những hiệu ứng này hầu như xảy ra đồng thời khi năng lượng ánh sáng truyền vào mô đích với cường độ photon giảm dần theo độ sâu, và có thể được chia thành các mức độ khác nhau của phá hủy do ánh sáng và tổn thương do ánh sáng có thể đảo ngược, và quang điều biến quang không gây tổn thương không sinh nhiệt. Vùng quang nhiệt và vùng không sinh nhiệt cũng được thể hiện trong một mẫu laser CO2 điển hình được nhuộm bằng hematoxylin và eosin (Hình 18.6).
Vật lý ánh sáng cho chúng ta biết rằng mỗi photon là một gói năng lượng tinh khiết không trọng lượng, với năng lượng có thể đo được bằng electron volts (eV). Quang sinh học cho chúng ta biết rằng vùng quang điều biến bao gồm các tế bào đã hấp thụ các photon tới, trực tiếp hoặc gián tiếp chuyển năng lượng của photon đến các kho dự trữ năng lượng của chính tế bào theo cách không sinh nhiệt và không tổn thương, và trở nên quang hoạt hóa. Các tế bào quang hoạt có liên quan đến ba phản ứng, một, hai hoặc cả ba phản ứng có thể xảy ra trong tế bào quang hoạt:
- nếu các tế bào bị tổn thương, chúng sẽ tự sửa chữa hoặc được sửa chữa.
- nếu các tế bào có một chức năng nào đó, chúng sẽ thực hiện nó một cách hiệu quả hơn.
- nếu cần nhiều tế bào hơn cho một trong hai điều trên, các tế bào sẽ tăng sinh, hoặc thu hút nhiều tế bào hơn vào khu vực cần thông qua quang điều hòa (photochemotaxis).
Laser phẫu thuật thường tạo ra tất cả các vùng trung gian quang nhiệt được đề cập, nhưng tầm quan trọng của vùng quang hoạt không được nhấn mạnh đủ. Chính sự tồn tại của vùng này làm cho laser phẫu thuật khác biệt với bất kỳ phương pháp điều trị dựa trên nhiệt khác, chẳng hạn như đốt điện, hoặc ngay cả rạch da bằng dao mổ thông thường, và chính các tế bào quang hoạt trong vùng này đã cho các kết quả sự quan tâm của việc sử dụng laser phẫu thuật so với dao mổ hoặc dao điện, tức là vết thương lành như nhau nhưng ít viêm hơn và ít đau sau phẫu thuật hơn nhiều. Hình 18.7 chứng minh điều này trong thực tế, với sự hỗ trợ của Tiến sĩ Y khoa Toshio Ohshiro, người tiên phong về laser phẫu thuật ở Nhật Bản và trên toàn thế giới. Vào cuối những năm 1970, Ohshiro bắt đầu sử dụng laser trong điều trị nevi bất thường mạch máu và hắc tố: tất cả những gì ông có khi đó là laser ruby xung 1 ms và laser argon C/W. Trong Hình 18.7a có thể thấy một trường hợp u mạch máu đơn giản (bớt rượu vang) đã điều trị không thành công trước đó bằng phương pháp điện phân kim: màu bất thường không được loại bỏ và vị trí của vết kim được đánh dấu bằng vết sẹo trắng nhô lên. Laser argon được sử dụng trong kỹ thuật zebra của Ohshiro, theo đó các vùng tuyến tính rộng 2 mm được điều trị để lại vùng mô 200 không được điều trị ở giữa [8]. Như trong Hình 18.7b, điều trị bằng laser argon không chỉ loại bỏ màu bớt rượu vang mà còn xử lý các sẹo bất thường do điều trị kim điện phân trước đó để lại. Bốn đến 6 tuần sau, khi các vùng điều trị đã hoàn toàn lành lại, các khu vực chưa được điều trị sẽ được chiếu tia để hoàn tất quá trình điều trị. Đây là sức mạnh của thành phần “L” của laser, ánh sáng, được hỗ trợ bởi vùng quang hoạt hóa, được Ohshiro gọi là “LLLT đồng thời” [8].
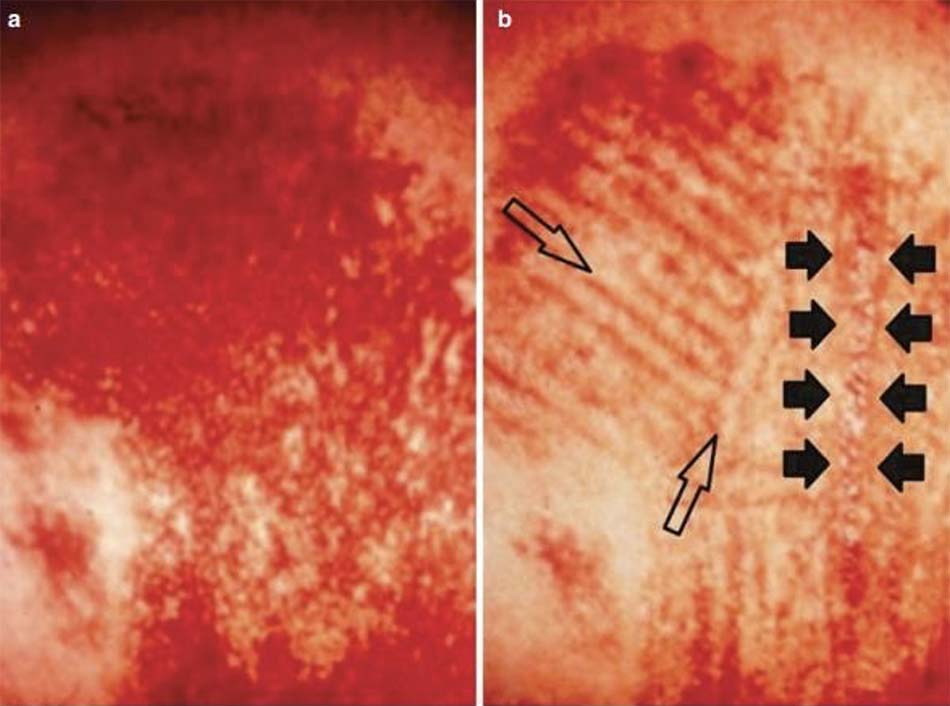
Hệ thống IPL, và laser không bóc tách, tạo ra các khu vực tổn thương đông đặc có chủ ý nhưng được kiểm soát bên dưới lớp biểu bì được làm mát và nguyên vẹn (Hình 18.8), tuy nhiên chúng cũng tạo ra vùng LLLT đồng thời để giúp đạt được hiệu quả mong muốn của tân tạo collagen và tân tạo elastin thông qua quá trình chữa lành vết thương trong chất nền ngoại bào da (ECM). Mặt khác, các hệ thống đèn chiếu LED chỉ gây ra quá trình kích hoạt quang tế bào không sinh nhiệt và không tổn thương, nhưng vẫn có khả năng bắt đầu quá trình chữa lành vết thương hiệu quả gần như IPL và laser không bóc tách.
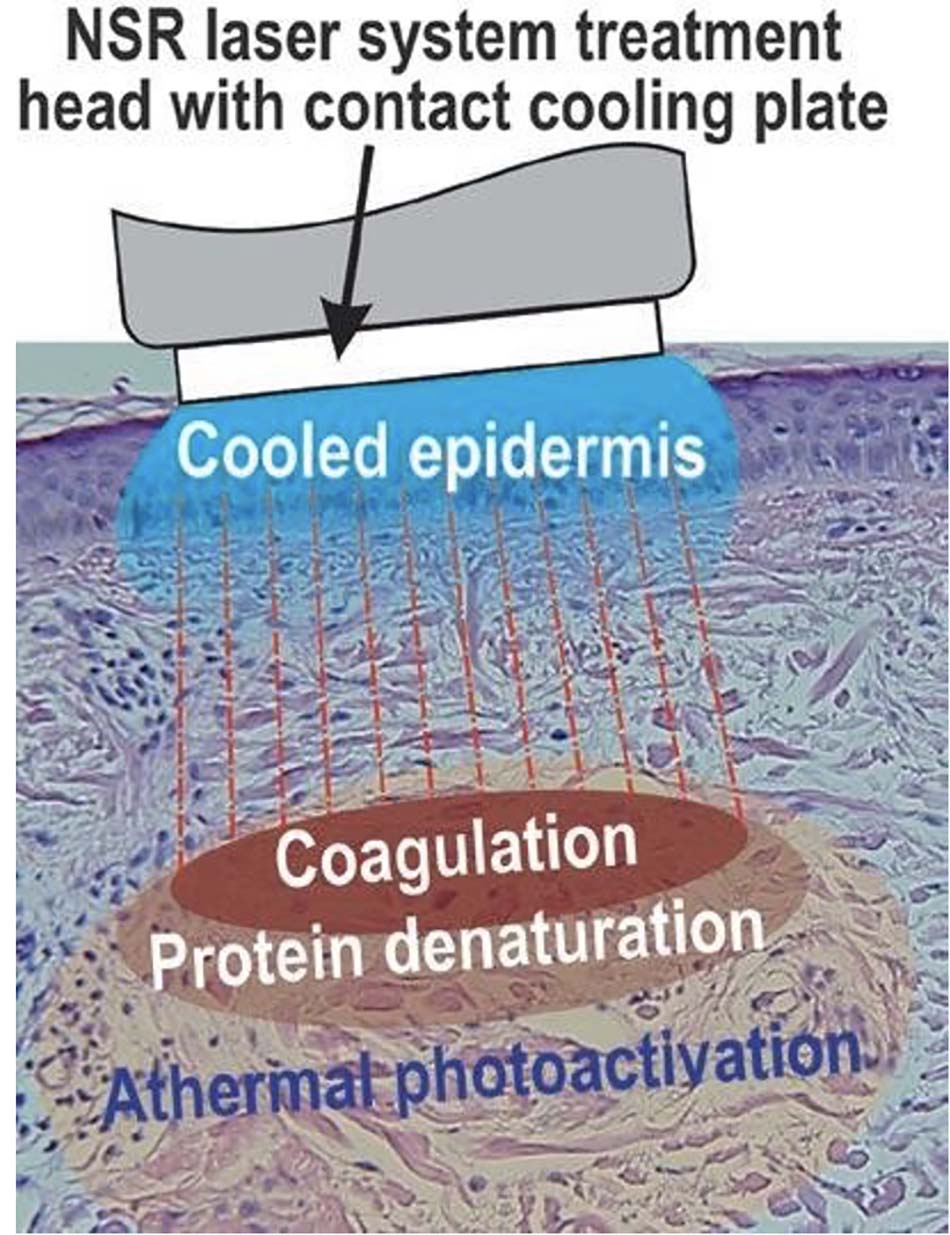
Bước sóng và tầm quan trọng của nó
Định luật quang sinh học đầu tiên, định luật Grotthuss- Draper, cho rằng chỉ năng lượng được hấp thụ trong một mục tiêu mới có thể tạo ra phản ứng quang hóa hoặc quang lý. Tuy nhiên, không phải bất kỳ phản ứng nào như vậy là hệ quả tự động của quá trình hấp thụ năng lượng. Nó có thể được chuyển đổi thành nhiệt, như trong các laser phẫu thuật và laser không bóc tách hoặc IPL, hoặc được phát xạ lại ở một bước sóng khác (huỳnh quang). Nguyên tắc chính của định luật “không hấp thụ-không có phản ứng” này không phải là công suất đầu ra của ánh sáng tới, mà là bước sóng của các photon tạo nên chùm tia, bao gồm hai vấn đề quan trọng: độ đặc trưng bước sóng của mục tiêu, chromophore mục tiêu; và độ sâu của mục tiêu. Dựa trên hai vấn đề này, bước sóng không chỉ phải thích hợp với chromophore được chọn mà còn phải xuyên qua đủ sâu để tiếp cận chromophore mục tiêu với mật độ photon đủ cao để gây ra phản ứng mong muốn. Về lý thuyết, một photon đơn lẻ có thể kích hoạt một tế bào, nhưng trong thực tế, cần phải hấp thụ nhiều photon để đạt được mức độ phản ứng mong muốn. Quang trị liệu không sinh nhiệt và không tổn thương, do đó việc đạt được quang nhiệt chọn lọc không đáng lo ngại như đối với các ứng dụng phẫu thuật hoặc quang nhiệt khác. Tuy nhiên, sự xâm nhập của ánh sáng vào mô sống là cực kỳ quan trọng trong quang trị liệu, và các đặc tính biểu hiện thường trái ngược với kết quả được tạo ra bởi các mô hình toán học, một điểm thường bị một số nhà nghiên cứu bỏ qua. Một tiên đề, nhưng sai về mặt quang sinh học, được yêu thích của những người phản đối phương pháp quang trị liệu, là “tất cả ánh sáng được hấp thụ trong một milimét đầu tiên của mô”. Những ai đã chiếu thử tia laser màu đỏ qua ngón tay thấy ánh sáng xuyên qua toàn bộ đầu ngón tay và hoàn toàn có thể nhìn thấy ở phía bên kia, đều đã bác bỏ tuyên bố đó. Tuy nhiên, một phát hiện khác được thấy với các laser màu xanh lá cây hoặc màu vàng, do đặc điểm tán xạ và xuyên thấu kém của chúng. Hình 18.9 dựa trên biểu đồ ánh sáng truyền qua của bàn tay người được chụp in vivo trên dải sóng từ 500 nm (xanh lam/ xanh lục khả kiến) đến 1100 nm trong vùng hồng ngoại gần [9]. Máy phát quang kế được đặt ở phía trên bàn tay, cho “quang phổ phẳng” của “ánh sáng trắng” và máy thu được đặt bên dưới nó. Bước sóng được hiển thị dọc theo trục x và mật độ quang học (optical density, OD) được tính toán nằm trên trục y, từ OD thấp hơn đến cao hơn. OD càng cao thì khả năng hấp thụ ánh sáng tới càng lớn và do đó độ truyền hoặc độ sâu thâm nhập vào mô càng thấp. Cũng cần phải nhớ rằng OD không phải là một cấp số cộng mà là một cấp số nhân logarit, do đó sự khác biệt giữa một OD 3 và một OD 8 không chỉ đơn giản là 5, mà là 5 độ lớn, tức là hệ số 10.000.
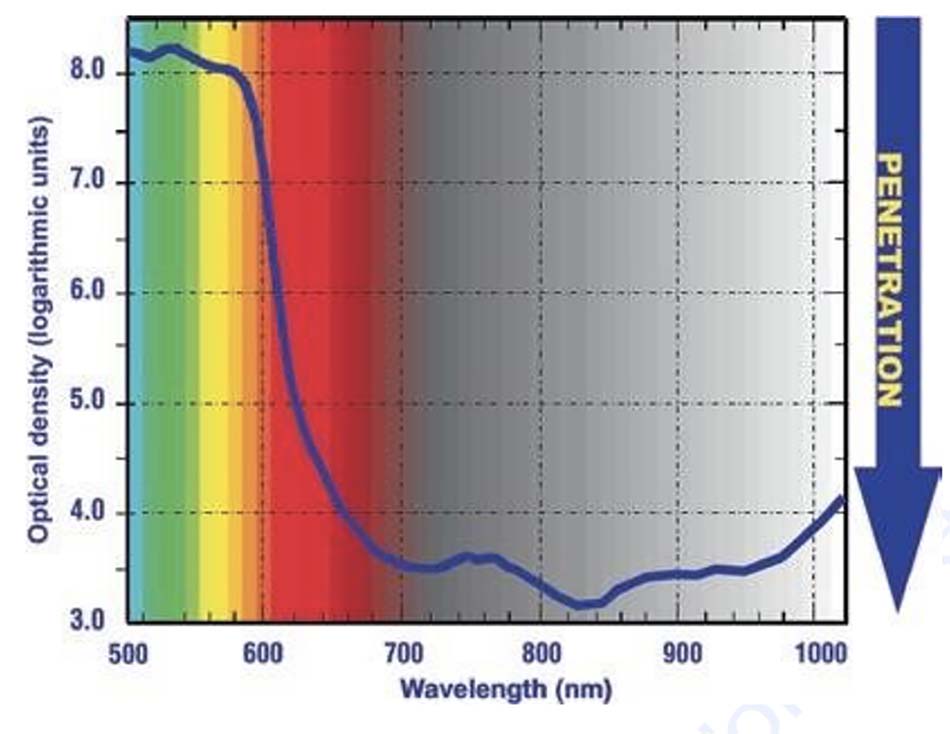
Từ 500 đến 595 nm (xanh lam-xanh lục đến vàng), OD lần lượt là từ 8,2 đến xấp xỉ 7,6, kết quả khả năng xuyên thấu kém. Ở bước sóng 633 nm, bước sóng gần đúng của laser HeNe, hiệu quả quang sinh học được ghi nhận rõ ràng, OD xấp xỉ 4,5. Nói cách khác, ánh sáng đỏ ở bước sóng 633 nm xuyên qua mô người sống tốt hơn 3 bậc độ lớn so với ánh sáng vàng ở bước sóng 595 nm, do đặc tính hấp thụ đặc hiệu sắc tố của 2 bước sóng. Màu vàng khả kiến ở bước sóng 595 nm ở đỉnh của đường cong hấp thụ oxyhaemoglobin, và cũng được hấp thụ mạnh hơn trong hắc tố ở biểu bì so với 633 nm, đó là lý do tại sao ánh sáng vàng trong biều đồ không truyền tốt vào mô do chromophore cạnh tranh của hắc tố biểu bì và máu bề mặt lớp bì. Do đó, tế bào và các mục tiêu khác ở lớp bì lưới từ giữa đến sâu không thể tiếp cận với ánh sáng vàng với cường độ photon đủ để đạt được sự hấp thụ nhiều photon trong các tế bào đích. Mặt khác, các tế bào mục tiêu biểu bì như tế bào sừng ở lớp đáy chắc chắn có thể tiếp cận được với ánh sáng vàng 595 nm. Độ xuyên sâu nhất trong thí nghiệm này đạt được ở bước sóng 820–840 nm trong vùng hồng ngoại gần. Tại dải sóng này, sắc tố không phải là chromophore chính với màng tế bào, và các flavonoid trong đó, là chromophore chính, và dải sóng 820–830 nm này trùng với đáy của đường cong hấp thụ nước. Thành công nhất của hệ thống diode laser được sử dụng trong liệu pháp laser khác biệt với laser phẫu thuật, đã phát ra bước sóng 830 nm vì lý do này [10], và được chứng minh là có thể xuyên qua bàn tay sống, và thậm chí cả xương, rất thành công [11]. Sau khoảng 1000 nm, sự hấp thụ bởi nước một lần nữa bắt đầu đóng một vai trò quan trọng, và trong đường cong trong Hình 18.9, OD đã tăng lên sau đó. Nói chung, các bước sóng khả kiến ngắn hơn xâm nhập ít hơn các bước sóng khả kiến dài hơn và hồng ngoại gần, cho đến một dải sóng nhất định, tùy thuộc vào chromophore hấp thụ. Sau những phát hiện này, các hệ thống đèn chiếu dựa trên LED ở các bước sóng đã được thử nghiệm, kiểm tra và chứng minh trong hơn ba thập kỷ ứng dụng và nghiên cứu liệu pháp laser. Hơn nữa, Karu đã chỉ ra rõ ràng rằng có một “tissue window” cho liệu pháp quang trị liệu giữa khoảng bước sóng 610 nm ánh sáng màu đỏ- cam khả kiến và hồng ngoại gần 860 nm [12]. Do đó, hệ thống đèn LED cho bước sóng 633 nm hoặc ở xung quanh màu đỏ khả kiến và 830 nm hồng ngoại gần, và ở mật độ photon đủ cao đã được báo cáo là có tác động đáng kể đến các mô mục tiêu ở độ sâu tốt ở lớp bì lưới trung bình và sâu, thậm chí vào cơ và xương. Tính hữu ích của quang trị liệu LED với ánh sáng đỏ khả kiến và hồng ngoại gần đã được báo cáo trong một loạt các chuyên khoa y tế, bao gồm da liễu. Ánh sáng vàng ở bước sóng 590–595 nm cũng thu hút sự chú ý, nhưng tính xuyên sâu của ánh sáng vàng phải được cân nhắc cẩn thận, như minh họa trong Hình 18.9. Từ quan điểm của lý thuyết quang sinh học, ánh sáng vàng có tiềm năng đặc hiệu rất tốt đối với một số mục tiêu dưới tế bào như cytochrome-c oxidase, và các mục tiêu liên quan đến mạch máu bề mặt, tuy nhiên sự xâm nhập rất kém của nó vào lớp bì giữa và sâu, nơi có các mục tiêu tế bào như nguyên bào sợi, hạn chế hiệu quả thực tế của ánh sáng vàng đối với những mục tiêu sâu hơn này. Mặt khác, có những mục tiêu thú vị trong và xung quanh lớp đáy của biểu bì phản ứng tốt với ánh sáng vàng khả kiến, chẳng hạn như tế bào sừng mẹ, tế bào hắc tố và tế bào Merkel biểu bì, tất cả đều giàu ti thể và do đó chứa cytochrome-c oxidase, một chromophore chính cho ánh sáng vàng, và là nguồn cung cấp adenosine triphosphat (ATP) trong và gian bào và tăng cường nồng độ của các hợp chất truyền tín hiệu tế bào như ion Ca2+ . Ánh sáng xanh ở bước sóng 415 nm có những đặc tính rất thú vị liên quan đến việc tiêu diệt vi khuẩn Propionibacterium acnes (P. acnes) thông qua liệu pháp quang động nội sinh (PDT) mặc dù phản ứng quang (photoreaction) khác với phản ứng quang hoạt (photoactivation) và sẽ được thảo luận ở phần sau của chương. Năng lượng LED ở bước sóng 1072 nm đã cho ra quang trị liệu LED tiện lợi và dễ sử dụng để điều trị hiệu quả herpes simplex labialis tại nhà [13]. Hệ thống đèn LED với nhiều bước sóng khác đã được sản xuất, có flash hay không, nhưng về cơ bản những bước sóng khác này có rất ít hoặc không có công trình nào được công bố để hỗ trợ các tuyên bố của nhà sản xuất và việc xem xét cẩn thận tỷ lệ bước sóng/ độ xuyên sâu sẽ loại trừ nhiều bước sóng ánh sáng khả kiến ngắn hơn. “Bất kỳ đèn LED thế hệ cũ nào cũng sẽ không hoạt động” là tiên đề mà bác sĩ da liễu phải ghi nhớ khi muốn kết hợp liệu pháp đèn LED vào quá trình thực hành của mình. Cuối cùng, các dải sóng khác nhau, ánh sáng khả kiến và ánh sáng hồng ngoại không nhìn thấy, có các cơ chế chính khác nhau mặc dù endpoint điều trị có thể giống nhau. Việc hấp thụ các photon ánh sáng khả kiến ở các mức độ thích hợp gây ra phản ứng quang hóa và dòng thác quang hóa ban đầu xảy ra trong tế bào chủ yếu do cytochrome-c oxidase gây ra, enzyme cuối của chuỗi hô hấp của ty thể là adenosine triphosphate ( ATP) -nhà sản xuất năng lượng của tế bào [14]. ATP không chỉ cần thiết để cung cấp nhiên liệu cho tế bào, mà năng lượng của toàn bộ cơ quan dựa trên mức độ đầy đủ của ATP. Các photon hồng ngoại, không giống như ánh sáng khả kiến, chủ yếu liên quan các phản ứng quang lý xảy ra chủ yếu ở màng tế bào, làm thay đổi các đặc tính quay và dao động của các phân tử màng. Thông qua việc kích hoạt tiếp theo các cơ chế vận chuyển khác nhau nằm ở màng tế bào, chẳng hạn như Na+ / K+ -ATPase (hay còn gọi là bơm Na+ / K+) và Ca+ -ATPase (bơm Ca+), tính thấm của tế bào được thay đổi cho phép các hợp chất ra vào tế bào. Sự cân bằng hóa học và thẩm thấu trong bào tương bị thay đổi nhanh chóng đến lượt nó làm tăng nhu cầu năng lượng của tế bào và năng lượng dưới dạng ATP được yêu cầu từ ty thể. Kết quả cuối cùng dẫn đến sự cảm ứng của một dòng thác sản xuất ATP hóa học thứ cấp có ít nhiều endpoint giống như các photon ánh sáng khả kiến, cụ thể là kích hoạt hoặc tăng sinh tế bào [15]. Các phản ứng quang này được minh họa trong Hình 18.10. Tóm lại, bước sóng của nguồn trị liệu có tầm quan trọng gấp đôi, đó là đảm bảo sự hấp thụ các photon tới bởi các chromophore đích ở độ sâu mà các chromophore này tồn tại. Dải sóng mà bước sóng của các photon tới không chỉ xác định phần nào của tế bào là mục tiêu, mà còn xác định phản ứng quang chính, quang hóa hoặc quang vật lý. Do đó, bước sóng có lẽ là yếu tố quan trọng nhất được xem xét trong quang trị liệu LED, bởi vì nếu không có sự hấp thụ thì không thể có phản ứng.
[caption id="attachment_51060" align="alignnone" width="950"]
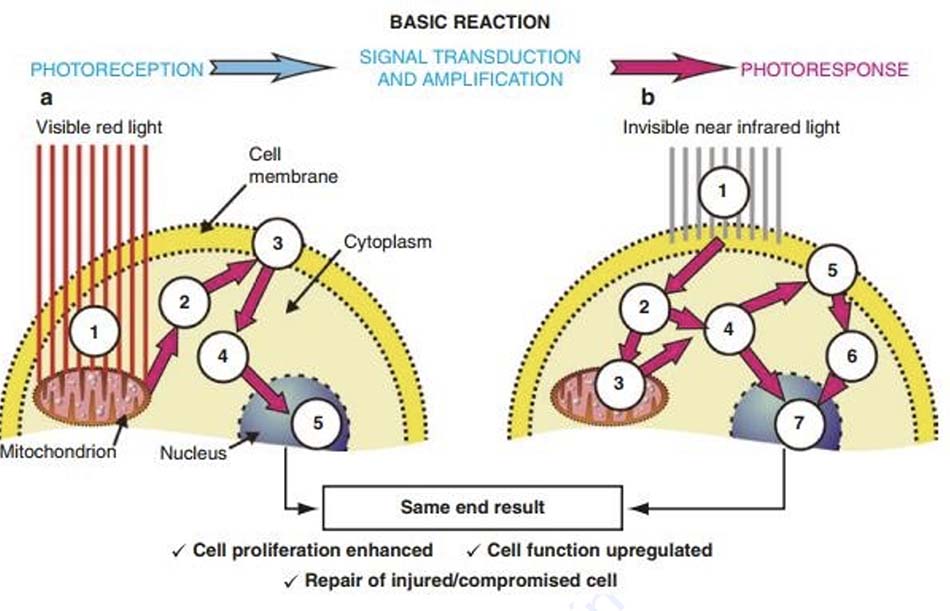 Hình 18.10 Sơ đồ mô tả quá trình thụ quang (hấp thụ ánh sáng) trong tế bào và phản ứng đặc hiệu sau đó theo bước sóng. Phản ứng cơ bản theo định nghĩa của Karu là sự hấp thụ, sau đó là sự truyền và khuếch đại tín hiệu trong bào tương, và dẫn đến phản ứng quang liên quan đến cơ chế vận chuyển nhân và màng.
Hình 18.10 Sơ đồ mô tả quá trình thụ quang (hấp thụ ánh sáng) trong tế bào và phản ứng đặc hiệu sau đó theo bước sóng. Phản ứng cơ bản theo định nghĩa của Karu là sự hấp thụ, sau đó là sự truyền và khuếch đại tín hiệu trong bào tương, và dẫn đến phản ứng quang liên quan đến cơ chế vận chuyển nhân và màng.(a) (1) Ánh sáng đỏ khả kiến tạo ra dòng thác quang hóa chính bắt đầu trong ti thể, nhà máy sản xuất năng lượng và nhà năng lượng tế bào, dẫn đến tăng nồng độ nicotinamide adenin dinucleotide (NAD) cực kỳ quan trọng trong một loạt các quá trình oxy hóa khử (khử- oxy hóa), một trong những kết quả của nó là tạo ra adenosine triphosphate (ATP) là ‘nhiên liệu’ cho tế bào. (2) Mức tăng của ATP trong tế bào chất cung cấp nhiên liệu cho các máy bơm vận chuyển màng, các máy bơm Na2+ K2+ và Ca2+ K2+ (3) tạo ra sự điều hòa bên ngoài và trong tế bào của các ion Ca2+ và proton (H+), là các hạt cơ bản mang điện tích dương, dòng được sử dụng để tạo ra năng lượng từ ATP thông qua ATPase. Nồng độ ion Ca2+ và H+ trong tế bào chất tăng lên đột ngột. (4) Điều này đến lượt nó điều chỉnh tín hiệu nội bào bao gồm sản xuất mRNA từ ribosome trên lưới nội chất thô, và cuối cùng (5) hoạt động hạt nhân cũng được điều chỉnh.
(b) Trong trường hợp ánh sáng hồng ngoại gần, cơ chế hấp thụ cơ bản hoàn toàn khác, (1) dẫn đến phản ứng quang lý làm thay đổi mức năng lượng của màng tế bào, trong đó năng lượng tia hồng ngoại gần được hấp thụ. Tác động này khởi động các máy bơm Na2+ K2+ và Ca2+ K2+ để mức độ Ca2+ và H+ trong tế bào chất tăng lên đột ngột (2) và (4), thúc đẩy ty thể sản xuất nhiều ATP hơn để cung cấp năng lượng cho nhu cầu năng lượng tăng lên (3), do đó nâng cao nồng độ ATP (4) trong tế bào chất một lần nữa tác động lên các cơ chế vận chuyển của màng không bị ảnh hưởng bởi ánh sáng hồng ngoại gần. Mặc dù các con đường hoàn toàn khác nhau, tuy nhiên, kết quả cuối cùng vẫn giống như trong trường hợp ánh sáng khả kiến, cụ thể là mức năng lượng tăng lên theo chu kỳ trong tế bào chất (6) và điều hòa hoạt động nhân (6).
Chiếu xạ (Cường độ Photon)
Năng lượng ánh sáng truyền đi dưới dạng photon. Càng nhiều photon tới trên một đơn vị diện tích mô, thì hiệu ứng sinh học sẽ càng lớn khi năng lượng được truyền đến các tế bào đích và các mô. Cường độ photon tới này được gọi là mật độ công suất, hay chiếu xạ, của một chùm ánh sáng. Mật độ công suất (power density, PD) là một yếu tố cực kỳ quan trọng trong laser phẫu thuật và y học, nhưng đứng thứ hai sau bước sóng và được tính theo công thức sau:
trong đó OP là công suất tới trên mục tiêu tính bằng watt (W) và TA là diện tích mục tiêu được chiếu xạ tính bằng cm vuông (cm2). PD thường được biểu thị bằng watt trên cm vuông (W/cm2) hoặc milliwatts (mW)/cm2. Mật độ công suất của chùm tia sẽ quyết định nhiều hơn các yếu tố khác (ngoài bước sóng) về độ lớn của hiệu ứng sinh học trong mô đích. Xem Bảng 18.2, trong đó một tia laser có công suất tới không đổi là 2 W nhắm mục tiêu vào mô có phạm vi kích thước điểm từ 100 μm đến 1 cm. Chỉ cần thay đổi kích thước điểm, và do đó thay đổi mật độ công suất, có thể có những tác động khác nhau đáng kể đến mô đích. Bởi vì mật độ công suất được tính trên một đơn vị diện tích, được tính theo công thức πr2, trong đó π là hằng số pi 3,142, và r là bán kính của vùng được chiếu xạ, nhớ rằng có một tỷ lệ nghịch giữa kích thước điểm và mật độ công suất đối với công suất đầu ra không đổi. Tăng gấp đôi kích thước điểm sẽ không làm giảm một nửa mật độ công suất, mà là một phần tư: tăng kích thước điểm lên một hệ số 10 sẽ làm giảm mật độ công suất đi một trăm và ngược lại.
Trong quang trị liệu LED, do đó cần phải đạt được cường độ photon tới đủ cao để đạt được mức độ hấp thụ mong muốn trong các tế bào đích, nhưng không quá cao để gây ra biến đổi qua trung gian quang nhiệt trong cấu trúc mô, nói cách khác quang trị liệu LED lý tưởng nên đạt được quá trình quang hoạt trên tế bào mục tiêu không sinh nhiệt và không tổn thương. Định luật Arndt-Schultz, lần đầu tiên xuất hiện vào giữa thế kỷ 19, nói rằng những kích thích yếu sẽ kích thích hoạt động sinh học, những kích thích mạnh hơn sẽ ủng hộ nó, những kích thích mạnh mẽ ngăn nó và những kích thích rất mạnh sẽ làm chậm nó. Điều này đã được Ohshiro và Calderhead điều chỉnh vào năm 1988 thành đường cong Arndt-Schultz để giải thích hiệu quả của LLLT (Hình 18.11) [10, 16] từ đó rõ ràng rằng cường độ photon không được quá yếu (không có phản ứng) hoặc quá mạnh (làm chậm hoặc chết tế bào) nhưng phải được điều chỉnh để đạt được quang điều biến tối ưu của tế bào hoặc vật liệu đích. Lưu ý cuối cùng về cường độ: một đèn LED đơn, thậm chí là đèn LED thế hệ mới, khi được sử dụng riêng, sẽ không đạt được ở bất kỳ đâu gần cường độ photon hữu ích về mặt lâm sàng trong mô đích (Hình 18.12a). Tuy nhiên, khi nhiều đèn LED được gắn gần nhau trong một mảng phẳng, như trong các ví dụ được hiển thị trong Hình 18.3 và được gắn chính xác theo góc phân kỳ của chùm tia, tương tác ở nơi các chùm tia giao nhau sẽ tạo ra mật độ photon cực kỳ mạnh do hiện tượng giao thoa photon. Khi điều này được kết hợp với các đặc tính tán xạ vật lý về phía trước, sang bên và phía sau của ánh sáng đỏ và hồng ngoại gần, kết quả là cường độ photon cao nhất nằm bên dưới bề mặt da, nơi chính xác cần có để đạt được hiệu quả điều trị tối ưu (Hình 18.12b). Tuy nhiên, nếu khoảng cách giữa các đèn LED quá lớn, thì cường độ sẽ giảm đáng kể vì thiếu sự tương tác giữa các bóng LED riêng lẻ (Hình 18.12c). Hơn nữa, một số nhà sản xuất hệ thống đèn LED kết hợp các đèn LED có bước sóng khác nhau, ví dụ: đỏ và vàng, sau đó tuyên bố rằng họ đang cho ra ánh sáng ‘cam’ (Hình 18.12d)… không chính xác! Các tế bào da sẽ không ‘nhìn thấy’ màu da cam từ hỗn hợp ánh sáng đỏ và vàng như mắt chúng ta, mà sẽ phản ứng riêng biệt với các photon đỏ và photon vàng. Karu đã chỉ ra rằng có nhiều cặp bước sóng thực sự ức chế hoạt động của tế bào khi được sử dụng cùng nhau, nhưng lại tăng cường hoạt động khi được áp dụng riêng lẻ [12]. Năng lượng ánh sáng đại diện cho thông tin cho các tế bào, và sau đó chúng hoạt động dựa trên thông tin đó. Hãy tưởng tượng một tế bào nhận được thông tin mâu thuẫn từ hai bước sóng khác nhau: một bước sóng ra lệnh cho tế bào “rẽ phải” và bước sóng kia “rẽ trái”. Cuối cùng là tế bào sẽ bối rối và không làm gì được. Tệ nhất, nó sẽ ngưng một phần hoặc hoàn toàn. Trừ khi có một lý do cụ thể nào đó dựa trên kiến thức về quang sinh học, thì một bước sóng tại một thời điểm phải được chỉ định trong ngày dùng quang trị liệu LED.
![Ứng dụng liệu pháp ánh sáng Led trong thực hành da liễu 45 Hình 18.11 Ohshiro và đường cong Calderhead’s Arndt-Schultz (1988) [10], dựa trên định luật Arnd-Schultz. Từ cường độ kích thích A đến B không xảy ra phản ứng: kích thích quá yếu. Từ B đến C, hiệu ứng sinh học tăng mạnh, cao nhất ở C – D. Đường cong này chủ yếu dựa trên mật độ công suất tới (cường độ photon), nhưng sự kết hợp lý tưởng giữa cường độ và liều lượng trong quang liệu pháp vì vậy phải đạt được hiệu ứng thể hiện bằng vùng bóng mờ màu xanh lá cây đậm, tốt nhất là càng nhiều càng tốt ở cao nguyên C – D. Từ điểm D trở đi, hiệu ứng giảm mạnh, mặc dù nó vẫn cao hơn mức bình thường cho đến điểm E. Cường độ B – E tương ứng với vùng của quá trình quang hoạt không sinh nhiệt trong Hình 18.5 ở trên. Ở cường độ kích thích E- F, hiệu ứng sinh học chậm dần, tương ứng với các vùng biến tính / phân huỷ protein trong Hình 18.5, và kết quả mục tiêu chết do cường độ F-G tương ứng với các vùng đông đặc và hoá hơi trong Hình 18.5](https://nhathuocngocanh.com/wp-content/uploads/2021/12/18.11.jpg)
[caption id="" align="alignnone" width="950"]
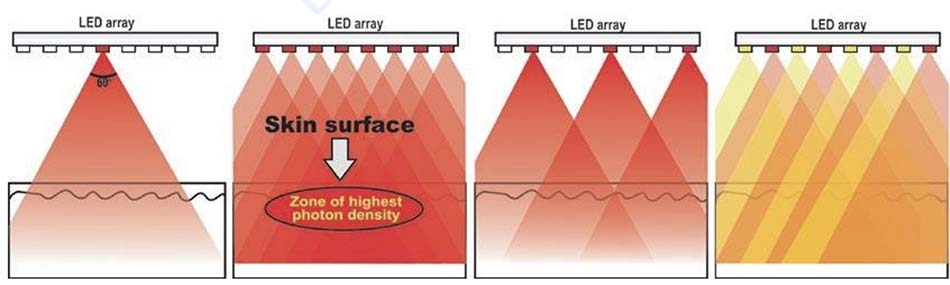 Hình 18.12 Các mảng gồm nhiều đèn LED cách nhau chính xác để đạt được mật độ photon hữu ích về mặt lâm sàng trong mô. Hình minh họa này được mô hình hóa trên dãy đèn LED thực tế trong Hình 18.3 ở trên, và được chia tỷ lệ. Khoảng cách từ đèn LED đến mô là khoảng 2,5 cm. (a) Một đèn LED đơn không đủ cường độ photon để đạt được bất kỳ hiệu quả lâm sàng nào có thể ghi lại được. (b) Mặt khác, khi các đèn LED có đặc tính đầu ra tương tự được gắn cách nhau một khoảng chính xác để tận dụng sự phân kỳ 60°, các chùm tia sẽ tương tác khi chúng giao nhau để tạo ra cường độ photon cực cao do hiện tượng giao thoa photon. Khi điều này được kết hợp với đặc điểm tán xạ thuận và ngược rất mạnh của ánh sáng đỏ, thậm chí còn mạnh hơn đối với năng lượng hồng ngoại gần, một vùng có mật độ photon cực cao, thậm chí lớn hơn cường độ của chính các đèn LED, được tạo ra dưới bề mặt của các mô đích. (c) Nếu các đèn LED được đặt quá xa nhau, cường độ photon sẽ bị mất và không hữu ích về mặt lâm sàng. (d) Đây là trường hợp của các đầu điều trị với các đèn LED riêng lẻ có bước sóng khác nhau, ví dụ: đỏ và vàng, được tuyên bố là mang lại ánh sáng “cam”… nhưng không phải vậy!
Hình 18.12 Các mảng gồm nhiều đèn LED cách nhau chính xác để đạt được mật độ photon hữu ích về mặt lâm sàng trong mô. Hình minh họa này được mô hình hóa trên dãy đèn LED thực tế trong Hình 18.3 ở trên, và được chia tỷ lệ. Khoảng cách từ đèn LED đến mô là khoảng 2,5 cm. (a) Một đèn LED đơn không đủ cường độ photon để đạt được bất kỳ hiệu quả lâm sàng nào có thể ghi lại được. (b) Mặt khác, khi các đèn LED có đặc tính đầu ra tương tự được gắn cách nhau một khoảng chính xác để tận dụng sự phân kỳ 60°, các chùm tia sẽ tương tác khi chúng giao nhau để tạo ra cường độ photon cực cao do hiện tượng giao thoa photon. Khi điều này được kết hợp với đặc điểm tán xạ thuận và ngược rất mạnh của ánh sáng đỏ, thậm chí còn mạnh hơn đối với năng lượng hồng ngoại gần, một vùng có mật độ photon cực cao, thậm chí lớn hơn cường độ của chính các đèn LED, được tạo ra dưới bề mặt của các mô đích. (c) Nếu các đèn LED được đặt quá xa nhau, cường độ photon sẽ bị mất và không hữu ích về mặt lâm sàng. (d) Đây là trường hợp của các đầu điều trị với các đèn LED riêng lẻ có bước sóng khác nhau, ví dụ: đỏ và vàng, được tuyên bố là mang lại ánh sáng “cam”… nhưng không phải vậy!
Như đã lưu ý ở trên, đèn LED phát ra năng lượng theo cách khác nhau, do đó gây ra sự sụt giảm theo cấp số nhân đối với cường độ photon khả dụng khi mục tiêu càng xa mảng LED. Có thể sử dụng thấu kính để tối đa hóa đầu ra của dãy đèn LED và một nhà sản xuất hệ thống đèn LED đã được FDA chứng nhận đã khắc phục điều này bằng cách thêm cái mà họ gọi là Công nghệ mảng thấu kính quang học, hoặc OLAT ™. Một thấu kính trong nhỏ chuẩn trực được đặt cố định chính xác trước các dãy đèn LED, mỗi thấu kính nằm trước một đèn LED trong dãy. Do đó, đầu ra từ mỗi đèn LED được chuẩn trực một phần để giảm góc phân kỳ khoảng 30%. Điều này có nghĩa là vẫn có các chùm tia giao nhau để sử dụng hiện tượng giao thoa photon, nhưng cường độ photon hiện cao hơn 30% tại bất kỳ mặt phẳng nhất định nào trong mẫu chùm tia LED. Do đó, đối với cùng một chiếu xạ, cường độ photon tại mục tiêu đã được tăng lên để cho phép mô mục tiêu được chiếu xạ hiệu quả hơn (Hình 18.13).
 Hình 18.13 Một ví dụ về cách một nhà sản xuất đã nâng cao cường độ chùm sáng mà không tăng công suất đầu ra của đèn LED. (a) Một tấm trong suốt kết hợp các thấu kính bán chuẩn trực được đặt chính xác (công nghệ mảng thấu kính quang học, OLAT ™) được đặt dưới cùng một dãy đèn LED sơ đồ như trong Hình 18.12b ở trên. Sự phân kỳ của mỗi bóng LED được giảm xuống, do đó làm tăng cường độ photon trong mỗi chùm tia. (b) Một mảng hồng ngoại gần (830 nm, 100 mW/cm2) được chụp bằng camera IR: lưu ý sự mất năng lượng truyền đến mục tiêu thông qua tán xạ bên. (c) Cùng một dãy đèn LED ở cùng một chiếu xạ LED nhưng được trang bị mảng thấu kính quang học có thể nhìn thấy ở phía trên dãy đèn LED. Cường độ photon cao hơn nhiều được tập trung và chuyển đến mục tiêu với năng lượng bị mất ít hơn đáng kể đối với tán xạ bên.
Hình 18.13 Một ví dụ về cách một nhà sản xuất đã nâng cao cường độ chùm sáng mà không tăng công suất đầu ra của đèn LED. (a) Một tấm trong suốt kết hợp các thấu kính bán chuẩn trực được đặt chính xác (công nghệ mảng thấu kính quang học, OLAT ™) được đặt dưới cùng một dãy đèn LED sơ đồ như trong Hình 18.12b ở trên. Sự phân kỳ của mỗi bóng LED được giảm xuống, do đó làm tăng cường độ photon trong mỗi chùm tia. (b) Một mảng hồng ngoại gần (830 nm, 100 mW/cm2) được chụp bằng camera IR: lưu ý sự mất năng lượng truyền đến mục tiêu thông qua tán xạ bên. (c) Cùng một dãy đèn LED ở cùng một chiếu xạ LED nhưng được trang bị mảng thấu kính quang học có thể nhìn thấy ở phía trên dãy đèn LED. Cường độ photon cao hơn nhiều được tập trung và chuyển đến mục tiêu với năng lượng bị mất ít hơn đáng kể đối với tán xạ bên.
Đo liều lượng
Cho đến thời điểm này trong chương, thời gian mà ánh sáng của một chiếu xạ hoặc mật độ công suất chiếu tới một mục tiêu vẫn chưa được đề cập. Khi thời gian điều trị được đưa vào phương trình trị liệu, nó sẽ định lượng liều lượng ánh sáng được cung cấp. Khi công suất 1 W tới mô mục tiêu trong 1 s, năng lượng được cung cấp là 1 joule (J). Bản thân joule là một thông số điều trị vô dụng vì nó chỉ thể hiện công suất theo thời gian và không tính đến đơn vị diện tích của mô được điều trị. Thông số quan trọng nhất đối với liều điều trị trong quang trị liệu LED là mật độ năng lượng (energy density, ED). ED được tính như sau:
trong đó OP là công suất đầu ra trên mục tiêu tính bằng watt, t là thời gian tính bằng giây và TA là diện tích bức xạ tính bằng cm2. ED được biểu thị bằng jun/cm2 (J/cm2). Tuy nhiên, nhiều người xem liều lượng là thông số quan trọng nhất trong liệu pháp quang trị liệu và những lời chỉ trích đối với hệ thống đèn LED rằng “liều lượng quá cao”. Trên thực tế, như đã nêu trong phần trước, mật độ công suất chứ không phải mật độ năng lượng, xác định phản ứng sinh học, và điều này được minh họa trong Bảng 18.3 khi với liều không đổi khoảng 25 J/cm2 có thể đạt được hiệu ứng sinh học từ quang điều chế không sinh nhiệt đơn thuần đến hiện tượng quang phá huỷ nghiêm trọng. Tổng số jun như một tham số vô dụng cũng được minh họa: lượng năng lượng lớn nhất trong bảng, 2000 J, tạo ra hiệu ứng quang trị liệu, trong khi nhỏ nhất, 8 mJ (0,008 J), tạo ra hiệu ứng quang phẫu thuật [17]. Trong một thí nghiệm được thực hiện cách đây 20 năm bởi tác giả của chương này, chiếu xạ khớp gối của chuột, cả bao bọc và không bao bọc, được chiếu xạ bằng tia laser diode GaAlAs cho mật độ công suất tới là 1 W/cm2. Một loạt các liều được áp dụng từ 20 J/cm2 (chiếu xạ 20 giây) đến 1800 J/cm2 (chiếu xạ 30 phút). Mô được kiểm tra bình thường và bằng kính hiển vi ngay sau khi chiếu xạ để tìm bất kỳ dấu hiệu tổn thương: không có dấu hiệu nào được tìm thấy. Các vết thương được đóng lại và được theo dõi vào các thời điểm khác nhau trong hơn 2 tuần. Không có sự khác biệt nào được nhận thấy trong các mẫu đã được mã hóa từ mỗi nhóm tại mọi thời điểm liên quan đến các thay đổi hình thái so với các mẫu đối chứng không được chiếu xạ [18]. Trong khoa học dược phẩm, thuốc phải đúng trước khi điều chỉnh liều lượng. Trong quang trị liệu, mật độ công suất tương tự với thuốc và mật độ năng lượng là liều lượng. Nếu loại thuốc không chính xác, tức là cường độ photon quá thấp (không có tác dụng) hoặc quá cao (tổn thương do quang nhiệt), thì không có sự thay đổi nào về liều lượng sẽ đạt được kết quả tối ưu [17].
Bảng 18.3 Minh họa nhiều loại hiệu ứng sinh học (Δα) đạt được với cùng một mật độ năng lượng, hoặc liều lượng, là 25 J/cm2
| P | S ∅ | cm2 | PD (W/cm2) | t | e | ED (J/cm2 ) | Δα |
| 100 W | 10.0 cm | 78.6 | 1.3 | 20 s | 2000 J | 25 | – |
| 50 W | 3.5 cm | 0.1 | 500 | 100 ms | 5 J | 25 | + |
| 10 W | 1.0 cm | 0.0008 | 1250 | 20 ns | 0.2 J | 25 | ++ |
| 1 W | 200 μm | 0.0003 | 3180 | 8 ms | 8 mJ | 25 | +++ |
| 75 mW | 3.0 mm | 0.07 | 1.1 | 23 s | 1.725 J | 25 | – |
Cấu hình thời gian của chùm tia
Cấu hình thời gian của chùm năng lượng ánh sáng đơn giản có nghĩa là chế độ đầu ra trong đó ánh sáng được cung cấp đến mục tiêu. Có hai chế độ, liên tục (CW) và xung, với Q- switching của công nghệ chùm xung giúp rút ngắn đáng kể độ rộng xung và tăng công suất đỉnh của chùm xung. Trong CW, khi nguồn sáng được kích hoạt, công suất đạt mức tối đa, từ mW đến 100 W hoặc hơn, và ở mức này cho đến khi hệ thống được tắt (Hình 18.14a, bảng bên trái). Một giải pháp thay thế cho CW là khi chùm tia được ‘điều chỉnh’ để tạo ra một đoàn sóng vuông: điều này thường được gọi không chính xác là ánh sáng ‘xung’ (Hình 18.14a, bảng bên phải). Việc kiểm soát ánh sáng có thể được thực hiện bằng màn trập cơ học hoặc đạt được bằng cách bật và tắt nguồn sáng một cách đơn giản. Tên chính xác của quá trình này là ‘điều chế tần số’, bởi vì một tần số ngoại sinh (chuỗi bật-tắt) đang được chồng lên tần số vốn có của chùm tia được xác định trước bởi bước sóng, mỗi bước sóng có một tần số cố định. Ví dụ: hồng ngoại gần ở bước sóng 830 nm, màu đỏ khả kiến ở bước sóng 633 nm và màu xanh lam khả kiến ở bước sóng 415 nm có tần số ‘tích hợp’ tương ứng là khoảng 3,6×108, 4,7×108 và 7,2×108 MHz. Từ đó có thể thấy rằng khi bước sóng giảm, tần số tăng. Tần số tăng cũng liên quan thuận với sự gia tăng năng lượng của từng photon, được biểu thị bằng electron volt (ev), và đối với ba bước sóng trước đó, năng lượng photon tương ứng xấp xỉ 1,49, 1,96 và 2,99 ev. Năng lượng photon xác định loại tương tác giữa ánh sáng tới và các tế bào da. Đối với bước sóng 830 nm, như đã giải thích ở trên, những thay đổi quay và dao động quang lý xảy ra trong các điện tử tạo nên màng tế bào, trong khi đối với ánh sáng khả kiến thì có sự cảm ứng trực tiếp của dòng thác quang hóa nội bào. Ở các giá trị ev rất cao, như các giá trị liên quan với bước sóng siêu ngắn, cụ thể là bức xạ X và γ, năng lượng photon rất lớn dẫn đến sự tách rời phân tử của các tế bào có đủ mức độ tiếp xúc, nói cách khác, các tế bào bị thổi bay theo nghĩa đen hoặc “ion hóa”. Các bước sóng siêu ngắn này được phân loại là bức xạ ion hóa và vốn dĩ cực kỳ có hại cho mô sống với khả năng gây ung thư mạnh. LED-LLLT là bức xạ rất không ion hóa. Trong chùm xung thực, từ laser công suất cao hoặc laser Q- switched, công suất đỉnh cực cao đạt được ở dạng sóng giống như tăng đột biến, với độ rộng xung rất ngắn, 1 ms trở xuống hoặc trong vùng nano giây đối với Q-switched. Công suất cực đại có thể tính bằng mega- hoặc thậm chí là gigawatt (Hình 18.14b, bảng bên trái). Nếu một nhóm các xung thực như vậy được cung cấp với một khoảng nghỉ được đặt thường dài hơn độ rộng xung, thì mô đích chỉ “thấy” công suất trung bình của chùm, thường là ở mức đầu ra CW. Cái này còn được gọi là ‘superpulsing’, hoặc đúng hơn, quasi-CW (Hình 18.14b, bảng bên phải). Không có hệ thống đèn LED trị liệu hiện tại nào có khả năng phân phối chùm xung thực, mặc dù các thiết bị LED-LLLT có sẵn trong đèn LED được bật và tắt để cung cấp năng lượng nhấp nháy trong một dải tần số được chồng lên tần số vốn có của bước sóng của ánh sáng phát ra. Đây là điều chế tần số, nhưng thường được gọi không chính xác là “xung” đèn LED.
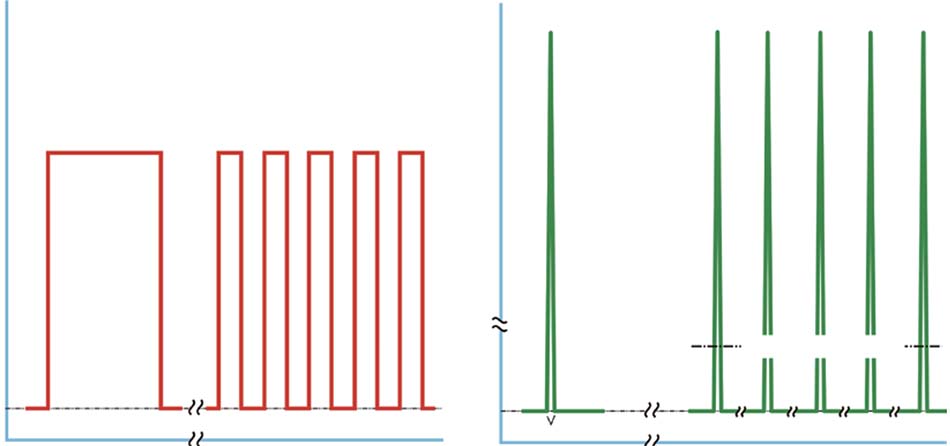 Hình 18.14 Cấu hình về thời gian của một chùm ánh sáng. Có hai cấu hình cơ bản, liên tục (CW) (a) hoặc xung (b). Trong CW (a, bảng bên trái), hệ thống được bật, đèn rất nhanh đạt đến cực đại và vẫn ở đó cho đến khi hệ thống tắt. Chùm CW này có thể được ‘điều khiển’ bằng cơ học hoặc bằng điện, tức là bật và tắt nhanh chóng (a, bảng bên phải), thường được gọi không chính xác là “xung”. Tên chính xác là điều tần. Điều này tạo ra một loạt các dạng sóng hình chữ nhật: chu kỳ 50% được minh họa. Khi chùm tia laser thực sự được phát xung, công suất cực đại cực cao, được đo bằng gigawatt (GW) được giải phóng trong khoảng xung siêu ngắn, được đo bằng nano giây (ns) (b, bảng bên trái). Nếu một nhóm các xung này được phát ra với khoảng thời gian xen kẽ tương đối dài là mili giây (ms) (b, bảng bên phải), thì mô đích chỉ ‘nhìn thấy’ công suất trung bình của chùm, được đo bằng watt. Điều này được gọi là quasi-CW, còn được gọi là chùm tia “superpulsing”
Hình 18.14 Cấu hình về thời gian của một chùm ánh sáng. Có hai cấu hình cơ bản, liên tục (CW) (a) hoặc xung (b). Trong CW (a, bảng bên trái), hệ thống được bật, đèn rất nhanh đạt đến cực đại và vẫn ở đó cho đến khi hệ thống tắt. Chùm CW này có thể được ‘điều khiển’ bằng cơ học hoặc bằng điện, tức là bật và tắt nhanh chóng (a, bảng bên phải), thường được gọi không chính xác là “xung”. Tên chính xác là điều tần. Điều này tạo ra một loạt các dạng sóng hình chữ nhật: chu kỳ 50% được minh họa. Khi chùm tia laser thực sự được phát xung, công suất cực đại cực cao, được đo bằng gigawatt (GW) được giải phóng trong khoảng xung siêu ngắn, được đo bằng nano giây (ns) (b, bảng bên trái). Nếu một nhóm các xung này được phát ra với khoảng thời gian xen kẽ tương đối dài là mili giây (ms) (b, bảng bên phải), thì mô đích chỉ ‘nhìn thấy’ công suất trung bình của chùm, được đo bằng watt. Điều này được gọi là quasi-CW, còn được gọi là chùm tia “superpulsing”

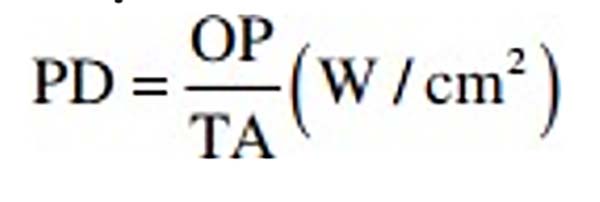
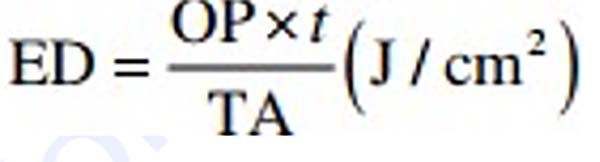
Led trị mụn rất hiệu quả