Tổng số phụ: 445.000 đ
COVID-19, Thông Tin Thuốc
Tác dụng Remdesivir trong việc điều trị Covid-19 trên lâm sàng
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Bài viết Tác dụng Remdesivir trong việc điều trị Covid-19 trên lâm sàng được dịch bởi sinh viên Hoàng Sơn – Học viện Quân Y, xin vui lòng click vào link ở đây.
Mặc dù một số phương pháp điều trị đã được đánh giá để điều trị bệnh do coronavirus 2019 (Covid-19), nhưng không có phương pháp sử dụng kháng vi-rút nào được chứng minh là có hiệu quả.
1. Phương pháp
Chúng tôi đã tiến hành một thử nghiệm mù đôi, ngẫu nhiên, có đối chứng với giả dược với remdesivir tiêm tĩnh mạch ở người lớn nhập viện do Covid-19 và xác định nhiễm trùng đường hô hấp dưới. Bệnh nhân được chỉ định ngẫu nhiên để sử dụng remdesivir (liều nạp 200mg vào ngày đầu tiên, tiếp theo là 100mg mỗi ngày trong tối đa 9 ngày bổ sung) hoặc giả dược trong tối đa 10 ngày. Kết quả chính là thời gian hồi phục, được xác định bằng việc xuất viện hoặc nhập viện vì mục đích kiểm soát lây nhiễm.
2. Kết quả
Tổng cộng có 1062 bệnh nhân được phân nhóm ngẫu nhiên (541 bệnh nhân được chỉ định dùng remdesivir và 521 bệnh nhân dùng giả dược). Những người dùng remdesivir có thời gian hồi phục trung bình là 10 ngày (khoảng tin cậy 95% [CI], 9 đến 11), so với 15 ngày (95% CI, 13 đến 18) ở những người dùng giả dược (tỷ lệ phục hồi , 1,29; KTC 95%, 1,12 đến 1,49; P <0,001,
bằng bài đánh giá hàng ngày). Trong một phân tích sử dụng mô hình tỷ lệ – chênh lệch với thang điểm tám bậc, những bệnh nhân được dùng remdesivir được phát hiện có nhiều khả năng cải thiện lâm sàng hơn những người dùng giả dược vào ngày thứ 15 (tỷ lệ chênh lệch, 1,5; KTC 95%; 1,2 đến 1,9, sau khi xác định mức độ nghiêm trọng của bệnh thực tế). Các ước tính của Kaplan – Meier về tỷ lệ tử vong là 6,7% ở remdesivir và 11,9% ở giả dược vào ngày 15 và 11,4% ở remdesivir và 15,2% ở giả dược vào ngày 29 (tỷ lệ nguy cơ, 0,73; KTC 95%, 0,52 đến 1,03). Các tác dụng ngoại ý nghiêm trọng được báo cáo ở 131 trong số 532 bệnh nhân dùng remdesivir (24,6%) và 163 trong số 516 bệnh nhân dùng giả dược (31,6%).
3. Kết luận
Dữ liệu của chúng tôi cho thấy rằng remdesivir vượt trội hơn giả dược trong việc rút ngắn thời gian hồi phục ở người lớn nhập viện do Covid-19 và xác định có nhiễm trùng đường hô hấp dưới. (Được tài trợ bởi Viện Dị ứng và Bệnh truyền nhiễm Quốc gia; số ACTT-1 ClinicalTrials.gov, NCT04280705.)
Một loại coronavirus mới, coronavirus gây hội chứng hô hấp cấp tính nghiêm trọng (SARS-CoV-2), lần đầu tiên được xác định vào tháng 12 năm 2019 là nguyên nhân gây ra bệnh đường hô hấp được gọi là bệnh coronavirus 2019, hoặc Covid-19. Một số phương pháp điều trị đã được đánh giá để điều trị Covid-19, nhưng không có phương pháp điều trị kháng vi-rút nào được chứng minh là có hiệu quả. (P <0,001), với hiệu quả lớn nhất được thấy ở những bệnh nhân được thở máy xâm nhập.
Remdesivir (GS-5734), một chất ức chế RNA polymerase virus, RNA có hoạt tính ức chế in vitro chống lại SARS-CoV-1 và hội chứng hô hấp Trung Đông (MERS- CoV), đã sớm được xác định là có triển vọng như một ứng cử viên điều trị cho Covid-19 vì khả năng ức chế SARS-CoV-2 trong ống nghiệm. Ngoài ra, trong các nghiên cứu về linh trưởng không phải con người, remdesivir hoạt động sau 12 giờ tiêm, đã làm giảm mức độ vi-rút trong phổi và tổn thương phổi.
Để đánh giá hiệu quả lâm sàng và tính an toàn của các tác nhân điều trị giả dược ở người lớn nhập viện do Covid-19 đã được phòng thí nghiệm xác nhận, chúng tôi đã thiết kế một thử nghiệm nền tảng thích ứng để nhanh chóng tiến hành một loạt các thử nghiệm giả dược ở giai đoạn 3, ngẫu nhiên, mù đôi, có đối chứng. Ở đây, chúng tôi mô tả giai đoạn đầu tiên của Thử nghiệm điều trị Adaptive Covid-19 (ACTT-1), trong đó chúng tôi đánh giá việc điều trị bằng remdesivir so với giả dược. Các kết quả được trình bày ở đây thể hiện bản cập nhật cho một báo cáo sơ bộ sau khi theo dõi đầy đủ.
4. Phương pháp
4.1 Thiết kế
Việc sử dụng ACTT-1 bắt đầu từ ngày 21 tháng 2 năm 2020 và kết thúc vào ngày 19 tháng 4 năm 2020. Có 60 địa điểm thử nghiệm và 13 địa điểm phụ ở Hoa Kỳ (45 địa điểm), Đan Mạch (8), Vương quốc Anh (5), Hy Lạp (4), Đức (3), Hàn Quốc (2),
Mexico (2), Tây Ban Nha (2), Nhật Bản (1) và Singapore (1). Các bệnh nhân đủ điều kiện được chỉ định ngẫu nhiên theo tỷ lệ 1:1 để nhận remdesivir hoặc giả dược. Sự ngẫu nhiên được phân tầng theo địa điểm nghiên cứu và mức độ bệnh tật khi nghiên cứu. Bệnh nhân được coi là bệnh nặng nếu họ phải thở máy, cần bổ sung oxy, độ bão hòa oxy (spO2) là 94% hoặc thấp hơn khi họ thở khí trời, hoặc nếu thở nhanh (tần số thở ≥24 lần mỗi phút). Remdesivir được tiêm tĩnh mạch với liều nạp 200mg vào ngày thứ nhất, sau đó là liều duy trì 100mg được dùng hàng ngày vào ngày thứ 2 đến ngày thứ 10 hoặc cho đến khi xuất viện hoặc tử vong. Một giả dược phù hợp đã được sử dụng theo cùng một lịch trình và cùng một khối lượng với thuốc hoạt động. Nước muối thông thường đã được sử dụng tại các cơ sở ở Châu Âu và ở một số cơ sở không ở Châu Âu do sự thiếu hụt về giả dược đối sánh; đối với những vị trí này, dịch truyền remdesivir và giả dược được che bằng một túi mờ và nắp ống để duy trì tình trạng ngẫu nhiên. Tất cả các bệnh nhân đều được chăm sóc hỗ trợ theo tiêu chuẩn chăm sóc của bệnh viện. Nếu bệnh viện có chính sách hoặc hướng dẫn bằng văn bản về việc sử dụng các phương pháp điều trị khác đối với Covid- 19, bệnh nhân có thể tiếp nhận các phương pháp điều trị đó. Trong trường hợp không có chính sách hoặc hướng dẫn bằng văn bản, việc điều trị thử nghiệm khác hoặc việc sử dụng thuốc ngoài nhãn hiệu được bán trên thị trường nhằm điều trị cụ thể cho Covid- 19 không được áp dụng từ ngày 1 đến ngày 29 (mặc dù những loại thuốc như vậy có thể đã được sử dụng trước khi đăng ký vào thử nghiệm này).
Nghiên cứu thử nghiệm đã được phê duyệt bởi hội đồng đánh giá cấp phép tại mỗi địa điểm (hoặc bởi một hội đồng đánh giá có năng lực nếu có) và được giám sát bởi ban giám sát an toàn và có dữ liệu độc lập. Thông báo được gửi bằng văn bản (hoặc sự đồng ý của hội đồng đánh giá khác – quy trình được phê duyệt) nhận được từ mỗi bệnh nhân hoặc từ đại diện được ủy quyền hợp pháp của bệnh nhân nếu bệnh nhân không thể đưa ra chấp thuận. Bạn có thể tìm thấy chi tiết đầy đủ về thiết kế thử nghiệm, quy trình, giám sát và phân tích, phân tích thống kê (có toàn văn của bài báo này tại NEJM.org).
4.2 Thủ tục
Bệnh nhân được đánh giá hàng ngày trong quá trình điều trị của họ, từ ngày 1 đến ngày 29. Tình trạng lâm sàng của bệnh nhân được đánh giá theo thang điểm tám bậc (được định nghĩa bên dưới) và Điểm cảnh báo sớm quốc gia (bao gồm sáu biện pháp sinh lý; tổng số điểm dao động từ 0 đến 20, với điểm số cao hơn cho thấy nguy cơ nghiêm trọng cao hơn) được ghi lại mỗi ngày. Tất cả các tác dụng phụ nghiêm trọng và các tác dụng phụ cấp 3 hoặc 4 thể hiện sự gia tăng mức độ nghiêm trọng so với ngày 1 và bất kỳ cấp độ 2 nào hoặc các phản ứng quá mẫn liên quan đến thuốc nghi ngờ cao hơn đã được ghi nhận. (Xem mô tả đầy đủ về các thủ tục thử nghiệm trong Phụ lục Bổ sung, có tại NEJM.org.)
4.3 Kết quả
Kết quả chính được bàn tới là thời gian hồi phục, được xác định là ngày đầu tiên, trong 28 ngày sau khi nhập viện, trên đó bệnh nhân đáp ứng các tiêu chuẩn cho loại 1, 2 hoặc 3 trong thang điểm tám bậc. Các danh mục như sau: (1) không nằm viện và không có hạn chế hoạt động; (2) không nằm viện, hạn chế các hoạt động, nhu cầu oxy tại nhà, hoặc cả hai; (3) nhập viện, không cần bổ sung oxy và không cần chăm sóc y tế liên tục (được sử dụng nếu thời gian nhập viện kéo dài vì nhiễm trùng hoặc các lý do ngoài y tế khác); (4) nhập viện, không yêu cầu bổ sung oxy nhưng yêu cầu chăm sóc y tế liên tục (liên quan đến Covid-19 hoặc các tình trạng y tế khác); (5) nhập viện, yêu cầu oxy bổ sung; (6) nhập viện, yêu cầu thông khí không xâm lấn (NIV) hoặc sử dụng các thiết bị oxy dòng cao (HFNO); (7) nhập viện, thở máy xâm nhập (MIV) hoặc oxy hóa màng ngoài cơ thể (ECMO); và (8) tử vong.
Kết quả phụ là diễn biến lâm sàng ở ngày thứ 15, được đánh giá trên thang thứ tự. Các kết quả phụ khác bao gồm thời gian để cải thiện một hạng mục và hai hạng mục so với điểm số thứ tự ban đầu; tình trạng lâm sàng được đánh giá theo thang thứ tự tại các ngày 3, 5, 8, 11, 15, 22 và 29; có nghĩa là thay đổi trạng thái theo thang thứ tự từ ngày 1 đến ngày 3, 5, 8, 11, 15, 22 và 29; thời gian xuất viện hoặc Điểm cảnh báo sớm Quốc gia theo mùa từ 2 trở xuống (có hiệu lực chính trong 24 giờ), tùy điều kiện nào xảy ra trước; thay đổi Điểm Cảnh báo Sớm Quốc gia từ ngày 1 tới ngày 3, 5, 8, 11, 15, 22 và 29; số ngày được thở oxy bổ sung, với thông khí không xâm lấn hoặc oxy lưu lượng cao (HFO), và với thông khí xâm nhập hoặc ECMO lên đến ngày 29 (nếu chúng được sử dụng ngay ban đầu); tần suất và thời gian sử dụng ôxy, thông khí không xâm nhập hoặc ôxy lưu lượng dòng cao, và thông khí xâm nhập hoặc ECMO; số ngày nằm viện đến ngày 29; và tử vong ở 14 và 28 ngày sau khi nhập viện. Các biện pháp kết quả phụ khác bao gồm các tác dụng phụ cấp 3 và 4 và các tác dụng phụ bất lợi nghiêm trọng xảy ra trong quá trình thử nghiệm, ngừng hoặc tạm ngừng truyền dịch, và những thay đổi trong các giá trị xét nghiệm được đánh giá theo thời gian.
4.4 Phân tích thống kê
Phân tích chính là một bài kiểm tra xếp hạng quá trình phân tầng về thời gian phục hồi với remdesivir so với giả dược, với sự phân tầng theo mức độ nghiêm trọng của bệnh (mức độ nghiêm trọng thực tế so với thời điểm ban đầu). (Xem Phụ lục Bổ sung để biết thêm thông tin về phân tích thống kê theo kế hoạch.) Đối với phân tích thời gian phục hồi và thời gian cải thiện, dữ liệu về bệnh nhân không hồi phục và dữ liệu về bệnh nhân tử vong được kiểm duyệt vào ngày 29.
Các nhóm phụ xác định trước trong các phân tích này được xác định theo giới tính, mức độ nghiêm trọng của bệnh cơ bản (theo tiêu chí phân tầng và dựa trên thang thứ tự), tuổi (18 đến 39 tuổi, 40 đến 64 tuổi hoặc ≥65 tuổi), chủng tộc, dân tộc, thời gian xuất hiện các triệu chứng trước khi phân nhóm ngẫu nhiên (được đo là ≤10 ngày hoặc >10 ngày), vị trí địa điểm và sự hiện diện của các điều kiện cùng tồn tại. (Xem phác đồ để biết thêm thông tin về các phương pháp thử nghiệm). Để đánh giá ảnh hưởng mức độ nghiêm trọng của bệnh đối với lợi ích điều trị (phục hồi và tử vong), các phân tích hậu kỳ đã đánh giá tương tác của hiệu quả với điểm số thứ tự ban đầu (như một biến số liên tục).
Kết quả chính ban đầu là so sánh tình trạng lâm sàng ở ngày thứ 15 trên thang điểm tám bậc. Tuy nhiên, kết quả chính đã được thay đổi thành so sánh thời gian phục hồi vào ngày 29, cho thấy rằng Covid-19 có thể là một quá trình kéo dài hơn so với dự đoán trước đây. Thay đổi được đề xuất vào ngày 22 tháng 3 năm 2020 (sau khi 72 bệnh nhân đã được ghi danh), bởi các nhà thống kê thử nghiệm, những người không biết về chỉ định điều trị và không biết về dữ liệu kết quả. Bản sửa đổi được hoàn thành vào ngày 2 tháng 4 năm 2020 và kết quả chính ban đầu được giữ lại làm kết quả quan trọng.
Vào ngày 27 tháng 4 năm 2020, ban giám sát dữ liệu và an toàn đã xem xét kết quả hiệu quả. Mặc dù ban đầu cuộc đánh giá này được lên kế hoạch như một cuộc phân tích tạm thời, vì tốc độ ghi danh nhanh chóng, cuộc đánh giá diễn ra sau khi hoàn thành việc ghi danh trong khi quá trình theo dõi vẫn đang diễn ra. Tại thời điểm báo cáo dữ liệu và ban giám sát an toàn, dựa trên ngày cắt dữ liệu là ngày 22 tháng 4 năm 2020, tổng số 482 lần phục hồi (vượt quá số lần phục hồi ước tính cần thiết cho thử nghiệm) và 81 trường hợp tử vong đã được nhập vào cơ sở dữ liệu. Vào thời điểm đó, ban giám sát dữ liệu và an toàn khuyến nghị rằng báo cáo phân tích sơ bộ sơ bộ và dữ liệu tử vong từ báo cáo an toàn khép kín được cung cấp cho các thành viên nhóm thử nghiệm từ Viện Dị ứng và Bệnh truyền nhiễm Quốc gia (NIAID). Những kết quả này sau đó đã được công bố rộng rãi. Bác sĩ điều trị có thể yêu cầu được biết về việc chỉ định điều trị cho những bệnh nhân chưa hoàn thành ngày 29 nếu được chỉ định lâm sàng (ví dụ: vì tình trạng lâm sàng xấu đi), và những bệnh nhân ban đầu trong nhóm giả dược có thể được dùng remdesivir.
4.5 Kết quả người bệnh
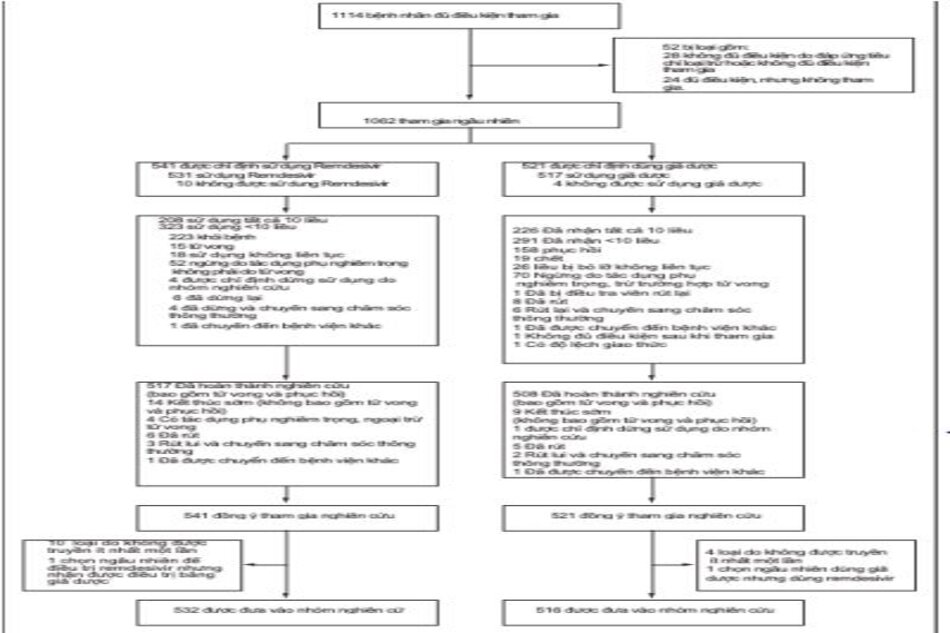
Trong số 1114 bệnh nhân được đánh giá đủ tiêu chuẩn, 1062 được thực hiện ngẫu nhiên; 541 được chỉ định cho nhóm remdesivir và 521 cho nhóm giả dược (Hình 1); 159 (15,0%) được phân loại là mắc bệnh từ nhẹ đến trung bình, và 903 (85,0%) thuộc phân loại bệnh nặng. Trong số những người được chỉ định dùng remdesivir, 531 bệnh nhân (98,2%) đã tiếp tục điều trị theo chỉ định. 52i bệnh nhân đã ngừng điều trị remdesivir trước ngày 10 vì tác dụng phụ hoặc tác dụng phụ nghiêm trọng không phải là tử vong và 10 bệnh nhân đã rút lại sự đồng ý. Trong số những người được chỉ định dùng giả dược, 517 bệnh nhân (99,2%) được chỉ định dùng giả dược. 70 bệnh nhân ngừng sử dụng giả dược trước ngày thứ 10 vì tác dụng phụ hoặc tác dụng phụ nghiêm trọng không phải là tử vong và 14 bệnh nhân đã rút lại sự đồng ý.
Tổng cộng 517 bệnh nhân trong nhóm remdesivir và 508 bệnh nhân trong nhóm giả dược đã hoàn thành thử nghiệm cho đến ngày 29, hồi phục hoặc tử vong. Mười bốn bệnh nhân nhận remdesivir và 9 bệnh nhân dùng giả dược đã chấm dứt tham gia thử nghiệm trước ngày 29. Tổng số 54 bệnh nhân trong nhóm từ nhẹ đến trung bình ngẫu nhiên sau đó được xác định đáp ứng các tiêu chí về mức độ nặng bệnh, kết quả là 105 bệnh nhân ở giai đoạn bệnh nhẹ đến trung bình và 957 bệnh nhân ở giai đoạn bệnh nặng. Bệnh nhân được điều trị bằng thuốc giảm đau bao gồm 1048 bệnh nhân được chỉ định (532 người trong nhóm remdesivir, bao gồm một bệnh nhân đã được chỉ định ngẫu nhiên cho giả dược và nhận remdesivir, và 516 người trong nhóm giả dược).
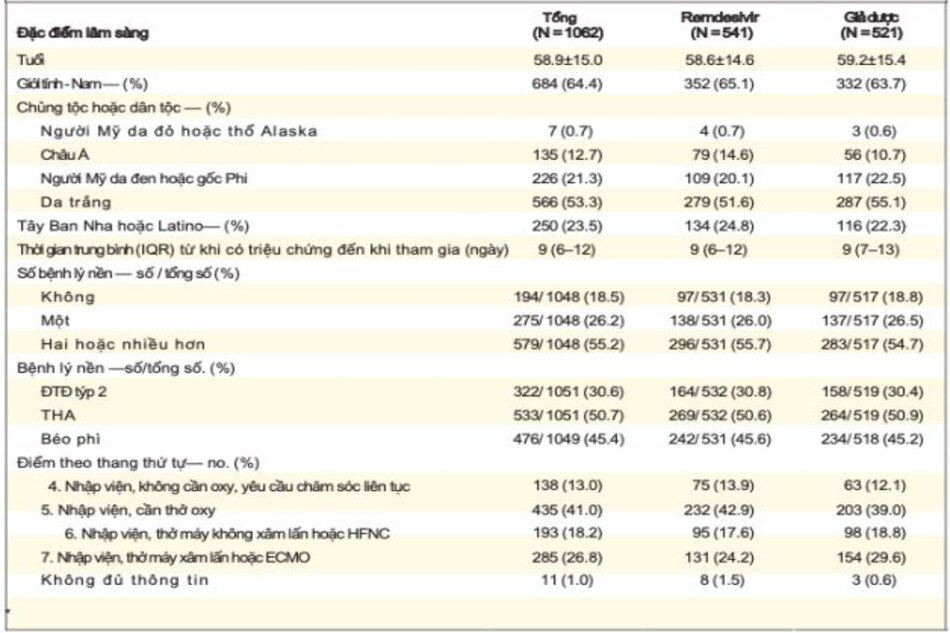
Tuổi trung bình của bệnh nhân là 58,9 tuổi và 64,4% là nam giới (Bảng 1). Trên cơ sở dịch tễ học của Covid-19 trong quá trình thử nghiệm, 79,8% bệnh nhân được ghi danh tại các địa điểm ở Bắc Mỹ, 15,3% ở châu Âu và 4,9% ở châu Á (Bảng S1 trong Phụ lục bổ sung). Nhìn chung, 53,3% bệnh nhân là người Da trắng, 21,3% người da đen, 12,7% người châu Á, và 12,7% được chỉ định là người khác hoặc không được báo cáo; 250 (23,5%) là người gốc Tây Ban Nha hoặc La tinh. Hầu hết bệnh nhân có một (25,9%) hoặc hai hoặc nhiều hơn (54,5%) các bệnh đồng thời đã được xác định trước khi nhập viện, phổ biến nhất là tăng huyết áp (50,2%), béo phì (44,8%) và đái tháo đường týp 2 (30,3%).
Số ngày trung bình giữa lúc bắt đầu và ngẫu nhiên là 9 (Bảng S2). Tổng số 957 bệnh nhân (90,1%) mắc bệnh nặng khi nhập viện; 285 bệnh nhân (26,8%) đáp ứng tiêu chí loại 7 trên thang thứ tự, 193 (18,2%) loại 6, 435 (41,0%) loại 5 và 138 (13,0%) loại 4. 11 bệnh nhân (1,0%) thiếu điểm thang thứ tự dữ liệu lúc nhập viện; tất cả những bệnh nhân này đã ngừng nghiên cứu trước khi điều trị.
Trong quá trình nghiên cứu, 373 bệnh nhân (35,6% trong số 1048 bệnh nhân trong dân số được điều trị bằng thuốc giảm đau) được dùng hydroxy- chloroquine và 241 (23,0%) được sử dụng glucocorticoid (Bảng S3).
4.6 Kết quả chính
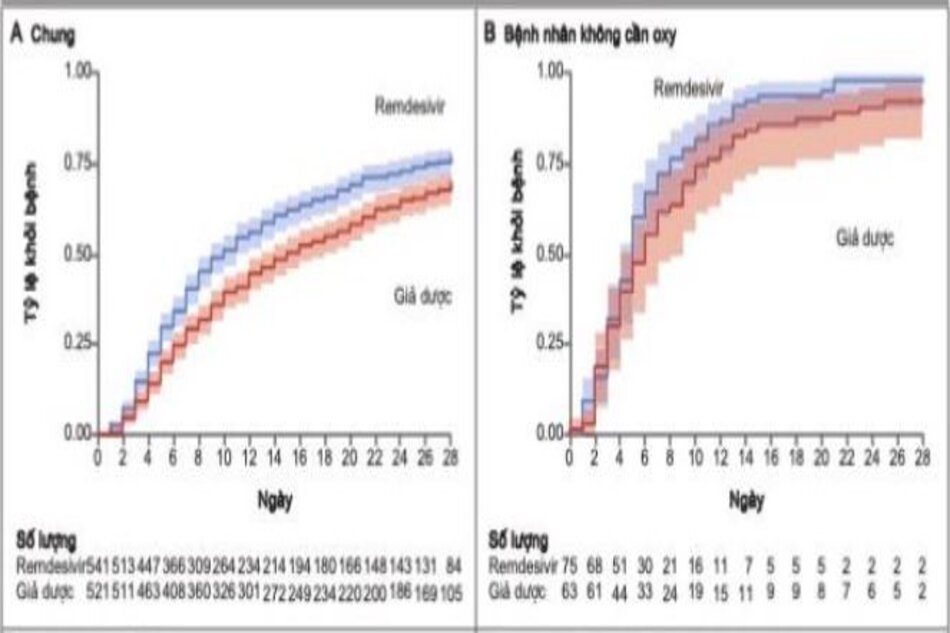
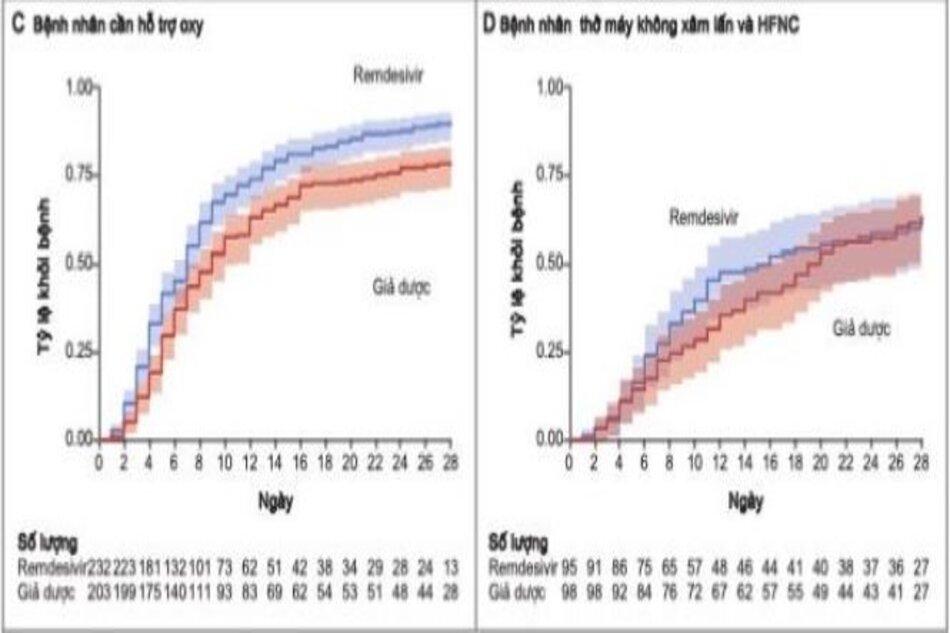
Bệnh nhân trong nhóm remdesivir có thời gian hồi phục ngắn hơn bệnh nhân trong nhóm giả dược (trung bình, 10 ngày, so với 15 ngày; tỷ lệ phục hồi, 1,29; khoảng tin cậy 95% [CI], 1,12 đến 1,49; P < 0,001) (Hình 2 và Bảng 2). Ở nhóm bệnh nặng (957 bệnh nhân), thời gian trung bình để hồi phục là 11 ngày, so với 18 ngày (tỷ lệ khỏi bệnh, 1,31; KTC 95%, 1,12 đến 1,52) (Bảng S4).
Tỷ lệ phục hồi là lớn nhất ở những bệnh nhân có điểm số thứ tự ban đầu là 5 (tỷ lệ phục hồi, 1,45; KTC 95%, 1,18- 1,79); giữa những bệnh nhân có điểm cơ bản là 4 và những người có điểm cơ bản là 6, tỷ lệ ước tính tỷ lệ hồi phục tương ứng là 1,29 (KTC 95%, 0,91-1,83) và 1,09 (KTC 95%, 0,76-1,57), tương ứng. Đối với những người được thở máy hoặc ECMO khi nhập viện (điểm số thứ tự ban đầu là 7), tỷ lệ hồi phục là 0,98 (KTC 95%, 0,70-1,36). Thông tin về tương tác của điều trị với điểm số thứ tự ban đầu như một biến số liên tục được cung cấp trong Bảng S11. Một phân tích điều chỉnh cho điểm số thứ tự ban đầu như một biến số được thực hiện để đánh giá ảnh hưởng tổng thể (của tỷ lệ phần trăm bệnh nhân trong mỗi loại điểm số thứ tự tại thời điểm ban đầu) đối với kết quả chính. Phân tích điều chỉnh này đưa ra một ước tính hiệu quả điều trị tương tự (tỷ lệ tỷ lệ hồi phục, 1,26; KTC 95%, 1,09 đến 1,46). Những bệnh nhân được phân nhóm ngẫu nhiên trong 10 ngày đầu tiên sau khi khởi phát triệu chứng có tỷ lệ hồi phục là 1,37 (KTC 95%, 1,14-1,64), trong khi những bệnh nhân được phân nhóm ngẫu nhiên hơn 10 ngày sau khi bắt đầu triệu chứng có tỷ lệ này. để phục hồi 1,20 (KTC 95%, 0,94 đến 1,52) (Hình 3). Lợi ích của remdesivir lớn hơn khi được sử dụng sớm hơn khi bị bệnh, mặc dù lợi ích này vẫn tồn tại trong hầu hết các phân tích về kéo dài các triệu chứng (Bảng S6). Các phân tích độ nhạy trong đó dữ liệu được kiểm duyệt báo cáo sớm nhất về việc sử dụng glucocorticoid hoặc hydroxychloroquine vẫn cho thấy hiệu quả của remdesivir (9,0 ngày để phục hồi với remdesivir so với 14,0 ngày để phục hồi với giả dược; tỷ lệ tỷ lệ, 1,28; 95% CI, 1,09 đến 1,50, và 10,0 so với 16,0 ngày để phục hồi; tỷ lệ tỷ lệ, 1,32; KTC 95%, 1,11 đến 1,58, tương ứng) (Bảng S8).
4.7 Kết quả phụ
Tỷ lệ cải thiện trong thang điểm thứ tự có tỷ lệ cao hơn trong nhóm sử dụng remdesivir, được xác định bằng mô hình đánh giá ở lần khám ngày thứ 15, so với nhóm giả dược (tỷ lệ chênh lệch để cải thiện, 1,5; KTC 95%, 1,2 đến 1,9, được điều chỉnh theo mức độ bệnh) (Bảng 2 và Hình S7).
4.8 Tử vong
Kaplan – Meier ước tính tỷ lệ tử vong vào ngày 15 là 6,7% ở nhóm dùng remdesivir và 11,9% ở nhóm giả dược (tỷ lệ nguy cơ, 0,55; KTC 95%, 0,36 đến 0,83); ước tính vào ngày 29 lần lượt là 11,4% và 15,2% ở hai nhóm (tỷ lệ nguy hiểm, 0,73; KTC 95%, 0,52 đến 1,03). Sự khác biệt giữa các nhóm về tỷ lệ tử vong thay đổi đáng kể theo mức độ nghiêm trọng ban đầu (Bảng 2), với sự khác biệt lớn nhất được thấy ở những bệnh nhân có điểm số thứ tự ban đầu là 5 (tỷ lệ nguy cơ, 0,30; KTC 95%, 0,14 đến 0,64).
Thông tin về tác dụng điều trị với điểm số thứ tự ban đầu liên quan đến tỷ lệ tử vong được cung cấp trong Bảng S11.
4.9 Kết quả phụ bổ sung
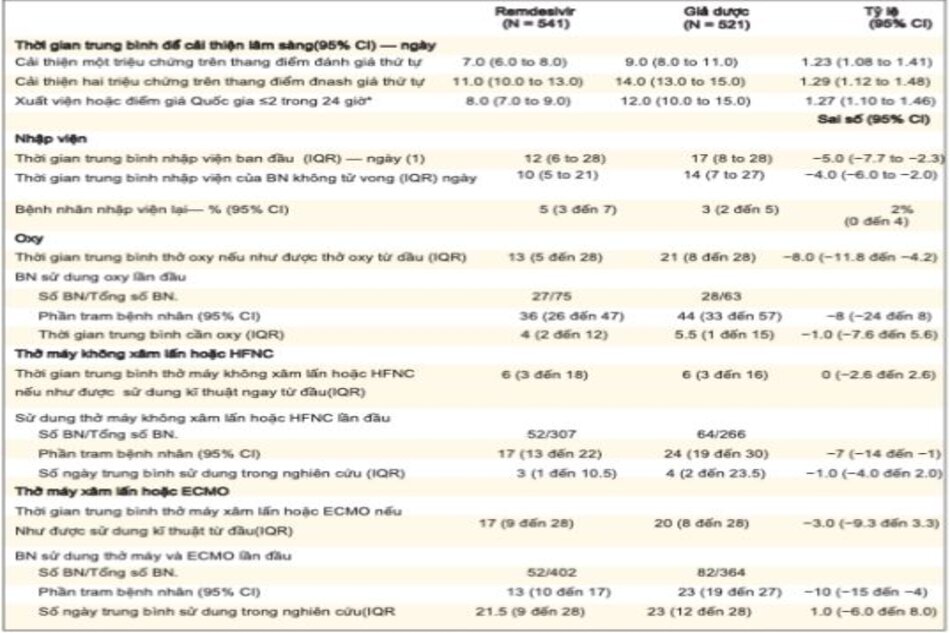
Bệnh nhân trong nhóm remdesivir có thời gian để cải thiện ngắn hơn so với bệnh nhân trong nhóm giả dược (cải thiện một loại: trung bình, 7 so với 9 ngày; tỷ lệ hồi phục, 1,23; KTC 95%, 1,08-1,41; cải thiện hai nhóm: trung vị, 11 so với 14 ngày; tỷ lệ, 1,29; KTC 95%, 1,12-1,48) (Bảng 3). Bệnh nhân trong nhóm dùng remdesivir có thời gian ra viện ngắn hơn hoặc có Điểm cảnh báo sớm là 2 hoặc thấp hơn so với nhóm dùng giả dược (trung bình, 8 ngày so với 12 ngày; tỷ lệ nguy cơ, 1,27; KTC 95%, 1,10 đến 1,46 ). Thời gian nằm viện ban đầu ở nhóm remdesivir ngắn hơn so với nhóm giả dược (trung bình, 12 ngày so với 17 ngày); 5% bệnh nhân trong nhóm remdesivir được đưa đến bệnh viện, so với 3% ở nhóm giả dược.
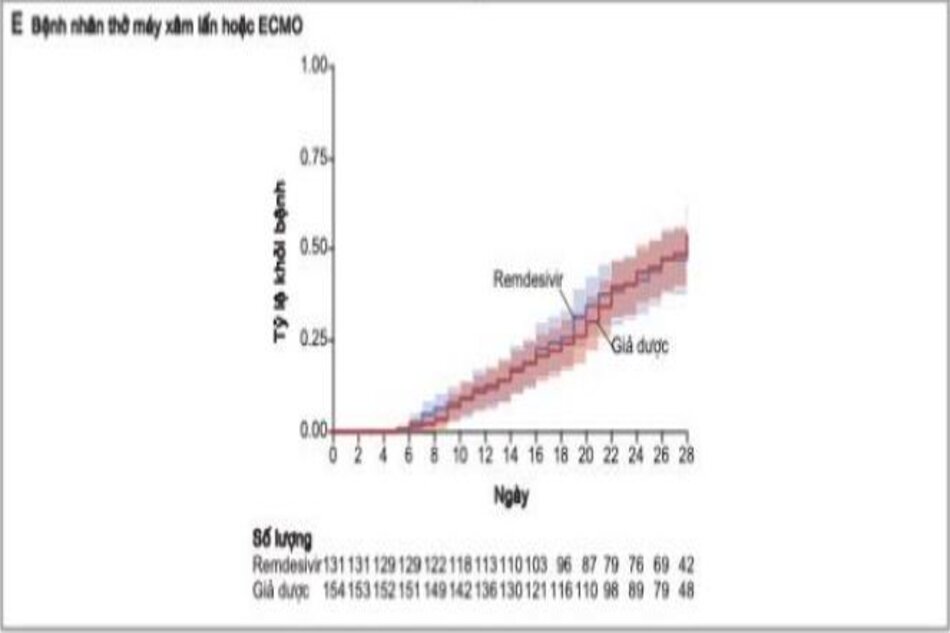
Trong số 913 bệnh nhân được thở oxy lúc nhập viện, những người ở nhóm remdesivir tiếp tục được thở oxy trong ít ngày hơn so với bệnh nhân ở nhóm giả dược (trung bình, 13 ngày so với 21 ngày), và tỷ lệ sử dụng oxy mới ở những bệnh nhân không nhận được oxy lúc nhập viện thấp hơn ở nhóm remdesivir so với nhóm giả dược (tỷ lệ mắc bệnh, 36% [95% CI, 26 đến 47] so với 44% [95% CI, 33 đến 57]). Đối với 193 bệnh nhân được thông khí không xâm lấn HFNC (oxy lưu lượng dòng cao) lúc nhập viện, thời gian sử dụng trung bình của các biện pháp can thiệp này là 6 ngày ở cả nhóm remdesivir và giả dược. Trong số 573 bệnh nhân không được thông khí không xâm lấn, ôxy lưu lượng cao, thông khí xâm lấn, hoặc ECMO lúc ban đầu, tỷ lệ thông khí không xâm lấn mới hoặc sử dụng ôxy lưu lượng cao ở nhóm remdesivir thấp hơn so với nhóm giả dược (17% [KTC 95%, 13 đến 22]so với 24% [KTC 95%, 19 đến 30]). Trong số 285 bệnh nhân đang được thở máy hoặc ECMO lúc nhập viện, bệnh nhân trong nhóm remdesivir được can thiệp những ngày tiếp theo ít hơn so với nhóm giả dược (trung bình, 17 ngày so với 20 ngày), và tỷ lệ mới thở máy; hoặc sử dụng ECMO trong số 766 bệnh nhân không nhận được những can thiệp này khi nhập viện thấp hơn ở nhóm remdesivir so với nhóm giả dược (13% [95% CI, 10 đến 17] so với 23% [95% CI,
19 đến 27 ]) (Bảng 3).
4.10 Kết quả
Trong dân số được điều trị, các tác dụng phụ nghiêm trọng xảy ra ở 131 trong số 532 bệnh nhân (24,6%) trong nhóm remdesivir và 163 trên 516 bệnh nhân (31,6%) trong Hình 2 nhóm giả dược (Bảng S17). Có 47 tác dụng phụ suy hô hấp nghiêm trọng ở nhóm dùng remdesivir (8,8% bệnh nhân), bao gồm suy hô hấp cấp và cần đặt nội khí quản, và 80 ở nhóm dùng giả dược (15,5% bệnh nhân) (Bảng S19). Không có trường hợp tử vong nào được các nhà điều tra cho là có liên quan đến việc chỉ định điều trị.
Các tác dụng phụ cấp 3 hoặc 4 xảy ra vào hoặc trước ngày 29 ở 273 bệnh nhân (51,3%) trong nhóm remdesivir và 295 (57,2%) ở nhóm giả dược (Bảng S18); 41 tác dụng được các nhà điều tra đánh giá là có liên quan đến remdesivir và 47 tác dụng liên quan đến giả dược (Bảng S17). Các tác dụng nghiêm trọng phổ biến nhất xảy ra ở ít nhất 5% tổng số bệnh nhân bao gồm giảm mức lọc cầu thận, giảm mức hemoglobin, giảm số lượng tế bào lympho, suy hô hấp, thiếu máu, sốt, tăng đường huyết, tăng mức creatinin máu và tăng mức đường huyết (Bảng S20). Tỷ lệ của các tác dụng phụ này nói chung là tương tự ở nhóm remdesivir và giả dược.

5. Bàn luận
Sau khi dữ liệu và ban giám sát an toàn thông báo rằng báo cáo phân tích sơ bộ đã được cung cấp cho nhà tài trợ, dữ liệu trên tổng số 51 bệnh nhân (4,8% tổng số đăng ký nghiên cứu) – 16 (3,0%) trong nhóm điều trị và 35 (6,7%) trong nhóm giả dược – không bị ràng buộc; 26 (74,3%) trong số những người trong nhóm giả dược có dữ liệu không bị ràng buộc đã được cho dùng remdesivir. Các phân tích độ nhạy đánh giá việc không liên kết (những bệnh nhân có chỉ định điều trị không được chỉ định đã được kiểm duyệt dữ liệu của họ tại thời điểm không có liên kết) và chéo (bệnh nhân trong nhóm giả dược được điều trị bằng remdesivir đã được kiểm duyệt dữ liệu của họ khi bắt đầu điều trị bằng remdesivir) cho kết quả tương tự như kết quả của phân tích sơ cấp (Bảng S9).
6. Thảo luận
Thử nghiệm mù đôi, ngẫu nhiên, có đối chứng với giả dược này đã xác định một liệu pháp kháng vi-rút có lợi trong việc điều trị Covid-19. Kết quả tổng thể của chúng tôi phù hợp với kết quả của báo cáo sơ bộ: liệu trình 10 ngày của remdesivir tốt hơn giả
dược trong điều trị bệnh nhân nhập viện với Covid-19. Những bệnh nhân được dùng remdesivir có thời gian hồi phục ngắn hơn so với những người dùng giả dược (trung bình, 10 ngày so với 15 ngày; tỷ lệ phục hồi, 1,29 [KTC 95%, 1,12 đến 1,49]) và khả
năng hơn về việc cải thiện điểm số theo thang thứ tự vào ngày 15 (điểm cuối phụ chính; tỷ lệ chênh lệch, 1,5; KTC 95%, 1,2 đến 1,9). Các điểm cuối phụ bổ sung hỗ trợ những phát hiện này bao gồm điều trị bằng remdesivir dẫn đến thời gian ngắn hơn để cải thiện một và hai điểm trong thang thứ tự, thời gian xuất viện ngắn hơn hoặc duy trì Điểm cảnh báo sớm quốc gia là 2 hoặc thấp hơn và thời gian ban đầu ngắn hơn thời gian nằm viện (trung bình, 12 ngày so với 17 ngày). Tử vong do mọi nguyên nhân là 11,4% với remdesivir và 15,2% với giả dược (tỷ lệ nguy cơ, 0,73; KTC 95%, 0,52 đến 1,03).
Dữ liệu của chúng tôi cũng cho thấy rằng điều trị bằng remdesivir có thể đã ngăn ngừa sự tiến triển thành bệnh hô hấp nặng hơn, thể hiện qua tỷ lệ các tác dụng phụ nghiêm trọng do suy hô hấp ở bệnh nhân trong nhóm dùng remdesivir thấp hơn, cũng như tỷ lệ sử dụng ôxy mới thấp hơn trong số bệnh nhân không được thở oxy lúc nhập viện và tỷ lệ bệnh nhân cần hỗ trợ hô hấp ở mức độ cao hơn trong nghiên cứu thấp hơn. Điều trị bằng remdesivir có liên quan đến việc sử dụng oxy ít ngày hơn đối với bệnh nhân được thở oxy khi nhập viện và thời gian thở máy hoặc ECMO tiếp theo ngắn hơn đối với những bệnh nhân được can thiệp này khi nhập viện. Tích lũy, những phát hiện này cho thấy rằng điều trị bằng remdesivir có thể không chỉ giảm gánh nặng bệnh tật mà còn có thể giảm việc sử dụng các nguồn lực chăm sóc sức khỏe khan hiếm trong đại dịch này. Lợi ích trong việc phục hồi vẫn tồn tại khi điều chỉnh được thực hiện đối với việc sử dụng glucocorticoid, điều này cho thấy rằng lợi ích của dexamethasone như được thể hiện trong thử nghiệm Đánh giá ngẫu nhiên về Liệu pháp Covid-19 (RECOVERY) có thể phụ thuộc vào lợi ích của remdesivir.
Lợi ích của remdesivir rõ ràng nhất ở những bệnh nhân có điểm số thứ tự ban đầu là 5 (nhận oxy lưu lượng thấp). Một số khác biệt này có thể là do kích thước mẫu lớn hơn trong danh mục này vì khoảng tin cậy cho điểm số thứ tự ban đầu là 4 (không nhận oxy), 6 (nhận oxy lưu lượng cao HFNC) và 7 (nhận ECMO hoặc thở máy) là rộng. Tuy nhiên, các thử nghiệm tương tác cho thấy lợi ích lớn hơn (liên quan đến phục hồi và tử vong) trong các loại điểm số thứ tự thấp hơn. Điều này không nên được kết luận là cho thấy sự thiếu hiệu quả trong các loại điểm số thứ tự cao hơn. Không thể ước tính được thời gian hồi phục trung bình cho những bệnh nhân thuộc nhóm 7, điều này cho thấy rằng thời gian theo dõi có thể quá ngắn để đánh giá phân nhóm đó.
Những phát hiện trong thử nghiệm của chúng tôi nên được so sánh với những phát hiện được quan sát trong các thử nghiệm ngẫu nhiên khác về remdesivir. Wang và cộng sự, thu nhận 237 bệnh nhân (158 người được chỉ định dùng remdesivir và 79 người dùng giả dược) ở Trung Quốc trong giai đoạn sớm của đại dịch và cho thấy thời gian cải thiện ngắn hơn (cải thiện hai điểm) với remdesivir: 21,0 ngày (KTC 95%, 13,0 đến 28,0) ở nhóm remdesivir và 23,0 ngày (KTC 95%, 15,0 đến 28,0) ở nhóm giả dược (tỷ lệ nguy cơ đối với cải thiện lâm sàng, 1,23; KTC 95%, 0,87 đến 1,75). Thử nghiệm đó không hoàn thành đầy đủ do sự kiểm soát của đợt bùng phát, có sức mạnh thấp hơn ACTT-1 do kích thước mẫu nhỏ hơn và ngẫu nhiên 2: 1, và không thể chứng minh bất kỳ lợi ích lâm sàng có ý nghĩa thống kê nào của remdesivir. Trong nghiên cứu ngẫu nhiên, nhãn mở, được công bố gần đây về remdesivir ở những bệnh nhân nhập viện với Covid-19 mức độ trung bình (83% không nhận được oxy ban đầu), những bệnh nhân được dùng remdesivir trong 5 ngày có tỷ lệ cải thiện lâm sàng cao hơn so với những bệnh nhân nhận được chăm sóc tiêu chuẩn (tỷ lệ chênh lệch, 1,65; KTC 95%, 1,09 đến 2,48; P = 0,02). Lợi ích này không được thấy với liệu trình 10 ngày (P = 0,18). Chúng tôi tin rằng những nghiên cứu khác này hỗ trợ những phát hiện của chúng tôi về hiệu quả của remdesivir; tuy nhiên, nghiên cứu của chúng tôi lớn hơn, ngẫu nhiên và được đăng ký đầy đủ.
Kết quả chính của thử nghiệm hiện tại đã được thay đổi sớm trong thử nghiệm, từ việc so sánh điểm số thứ tự phân loại gồm tám loại vào ngày 15 đến so sánh thời gian phục hồi cho đến ngày 29. Người ta biết rất ít về diễn biến lâm sàng tự nhiên của Covid -19 khi thử nghiệm được thiết kế vào tháng 2 năm 2020. Dữ liệu mới gợi ý rằng Covid- 19 có một quá trình kéo dài hơn so với những gì đã biết trước đây, điều này làm dấy lên lo ngại rằng sự khác biệt về kết quả sau ngày 15 sẽ bị bỏ qua bởi một đánh giá duy nhất vào ngày 15.
Sửa đổi được đề xuất vào ngày 22 tháng 3 năm 2020, bởi các nhà thống kê lâm sàng, những người không biết về chỉ định điều trị và không biết về dữ liệu kết quả; khi thay đổi này được đề xuất, 72 bệnh nhân đã được ghi danh. Mặc dù những thay đổi trong tổng quan không phổ biến trong các thử nghiệm đối với các bệnh đã được hiểu rõ, nhưng người ta nhận thấy rằng trong một số thử nghiệm, chẳng hạn như các thử nghiệm liên quan đến các bệnh chưa được hiểu rõ, các tình huống có thể yêu cầu thay đổi cách đánh giá kết quả hoặc có thể yêu cầu kết quả khác nhau. Kết quả chính ban đầu trở thành điểm cuối cùng quan trọng. Cuối cùng, kết quả cho cả điểm kết thúc chính và điểm cuối phụ quan trọng là khác biệt đáng kể giữa nhóm remdesivir và giả dược.
Nhiều thách thức đã gặp phải trong quá trình thử nghiệm này. Thử nghiệm được thực hiện trong thời gian hạn chế di chuyển và các bệnh viện hạn chế sự ra vào của những người không cần thiết. Các chuyến thăm quan đào tạo, bắt đầu trang web và giám sát thường được thực hiện từ xa. Các nhân viên nghiên cứu thường được giao các nhiệm vụ lâm sàng khác, và tình hình sức khoẻ của nhân viên đã làm căng thẳng các nguồn lực nghiên cứu. Nhiều địa điểm không có đủ nguồn cung cấp thiết bị bảo hộ cá nhân và các vật dụng liên quan đến thử nghiệm, chẳng hạn như tăm bông. Tuy nhiên, các nhóm nghiên cứu đã có động lực để tìm ra các giải pháp sáng tạo để vượt qua những thách thức này. Trong suốt quá trình thử nghiệm, chúng tôi có thể thu nhận một nhóm dân số đa dạng, tương tự như nhóm dân số đang bị nhiễm SARS-CoV-2 trong giai đoạn đó.
Với kết quả sơ bộ về remdesivir, Cục Quản lý Thực phẩm và Dược phẩm (FDA) đã ban hành Giấy phép Sử dụng Khẩn cấp vào ngày 1 tháng 5 năm 2020 (được sửa đổi vào ngày 28 tháng 8 năm 2020), để cho phép sử dụng remdesivir để điều trị ở người lớn và trẻ em nhập viện khi bị nghi ngờ hoặc đã được chẩn đoán xác Covid-19. Remdesivir cũng đã nhận được sự chấp thuận đầy đủ hoặc có điều kiện ở một số quốc gia khác kể từ thời điểm đó. Tuy nhiên, do tỷ lệ tử vong cao mặc dù đã sử dụng remdesivir, rõ ràng rằng việc điều trị chỉ bằng thuốc kháng vi-rút không có khả năng là đủ cho tất cả các bệnh nhân. Các chiến lược hiện tại đang đánh giá remdesivir kết hợp với các chất điều chỉnh đáp ứng miễn dịch (ví dụ: baricitinib ức chế Janus kinase [JAK] trong ACTT-2 và interferon beta-1a trong ACTT- 3). Cần có nhiều phương pháp điều trị khác nhau bao gồm thuốc kháng vi-rút mới, các chất điều chỉnh phản ứng miễn dịch hoặc các con đường nội tại khác, và các phương pháp kết hợp là cần thiết để tiếp tục cải thiện kết quả ở bệnh nhân Covid-19.
Xem thêm:
 Phyproxaden
Phyproxaden  Bảo Phế Nhất Long
Bảo Phế Nhất Long