Bệnh hô hấp, Thông Tin Thuốc
Nghiên cứu lâm sàng ứng dụng thuốc Vinsalpium trong điều trị COPD
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Nghiên cứu lâm sàng ứng dụng thuốc Vinsalpium trong điều trị COPD tải bản pdf Tại đây.
Nghiên cứu của Trung tâm Đào tạo và NCKH, Hội Phổi Việt Nam quản lý.
Nhóm tác giả: NV Thành; ĐN Sỹ; TV Ngọc; NT Hồi; CTM Thúy; NĐ Duy; VV Thành
Đặt vấn đề
- Bệnh phổi tắc nghẽn mạn tính (COPD) là nguyên nhân gây tử vong đứng thứ ba trên toàn thế giới, gây ra 3,23 triệu ca tử vong vào năm 2019. Gần 90% trường hợp tử vong do COPD ở những người dưới 70 tuổi xảy ra ở các nước có thu nhập thấp và trung bình (WHO). Việt Nam là nước đứng đầu prevalence COPD dự đoán trong 12 nước CA-TBD (6,7%) (Respirology, 2003).
- Chẩn đoán và điều trị sớm là cần thiết để làm chậm sự tiến triển của các triệu chứng và giảm đợt cấp. Thuốc điều trị triệu chứng của COPD có nền tảng là thuốc dãn phế quản và thuốc hít được ưu tiên lựa chọn so với thuốc uống. Ở giai đoạn ổn định, thuốc dãn quản tác dụng ngắn được chỉ định cho nhóm bệnh nhân ít triệu chứng và ít đợt cấp. Trong đợt cấp, thuốc dãn phế quản kết hợp kích thích beta2 và kháng muscarinic tác dụng ngắn là trị liệu ban đầu (GOLD 2023).
- Công thức kết hợp giúp cải thiện thông khí tốt hơn so với riêng từng thành phần và giảm số lần hít riêng biệt, đơn giản hóa liệu pháp và cải thiện sự tuân thủ so với sử dụng riêng lẻ (Expert Opin Drug Metab Toxicol. 2010 Mar; 6(3):381-92).
- Hiện nay trong thực hành, Combivent (dược chất Ipra./Salb. của Boehringer Ingelheim) đang được khuyến cáo sử dụng trong thực hành thường quy điều trị COPD và đợt cấp COPD (Tổng Hội Y học Việt Nam. Hướng dẫn Quản và Điều trị COPD Việt nam 2021). Thuốc cùng dạng (generic) với Combivent hiện đã được sản xuất trong nước với quy trình chuẩn quốc tế. Dạng dung dịch khí dung, hàm lượng giống với thuốc gốc có tên gọi là Vinsalpium đã được cấp phép lưu hành ở Việt Nam (SĐK: VD-33654-19).
- Nghiên cứu này nhằm đánh giá ngắn hạn hiệu quả của thuốc trên bệnh nhân COPD (đợt cấp và không đợt cấp) về hiệu quả sử dụng trên lâm sàng, bao gồm: Triệu chứng lâm sàng, chức năng hô hấp (spirometry) và tác dụng không mong muốn.
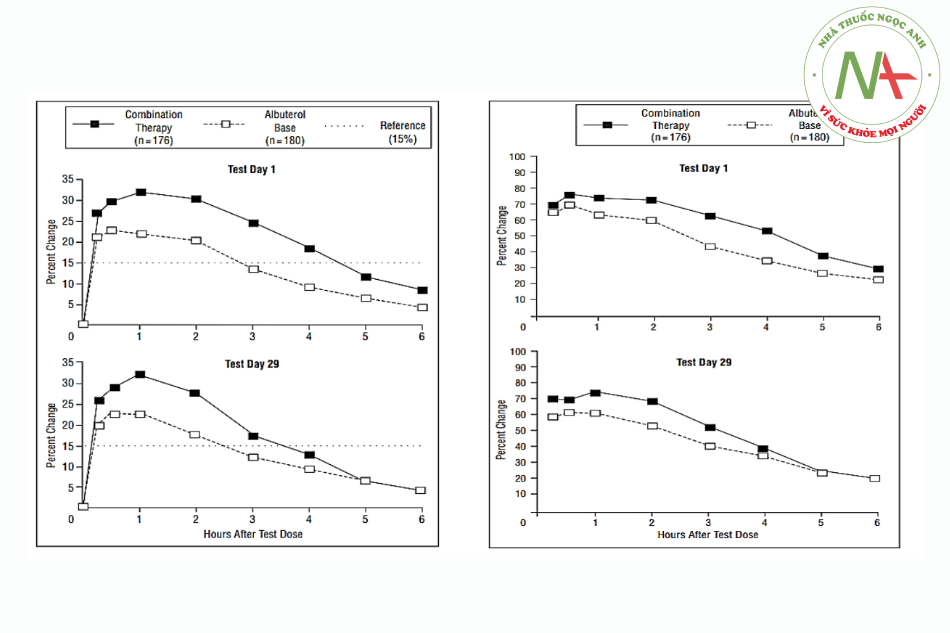
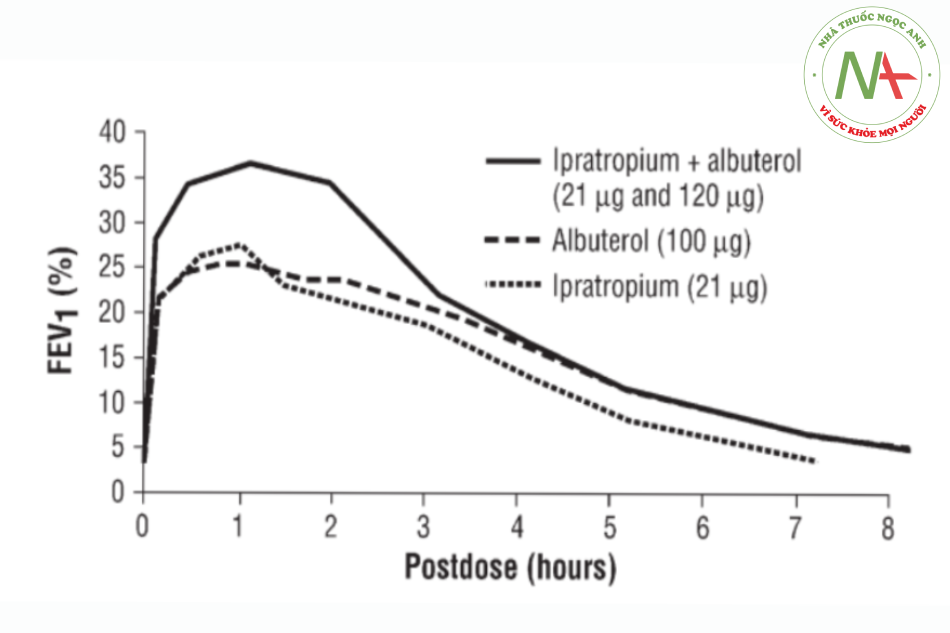
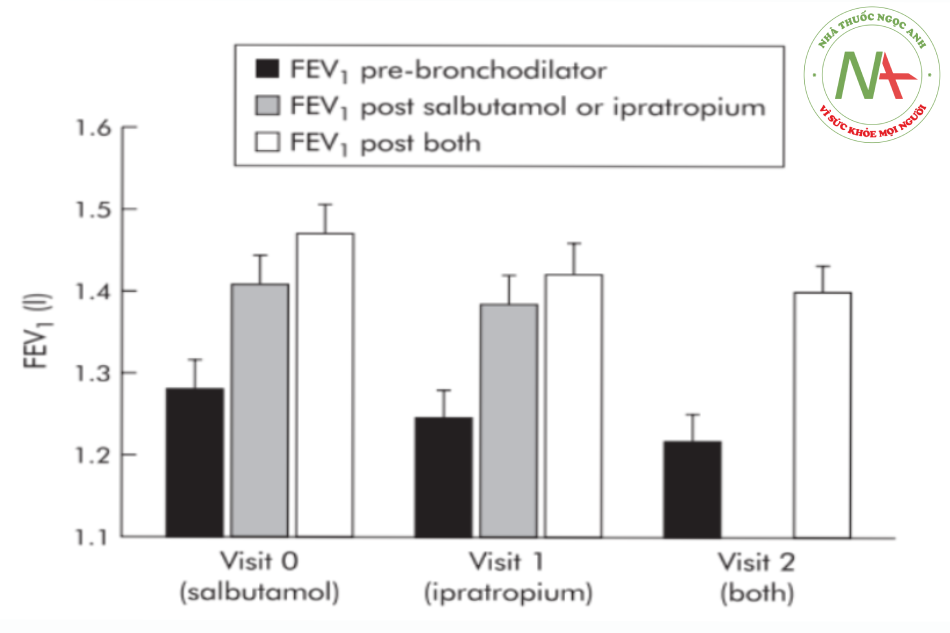
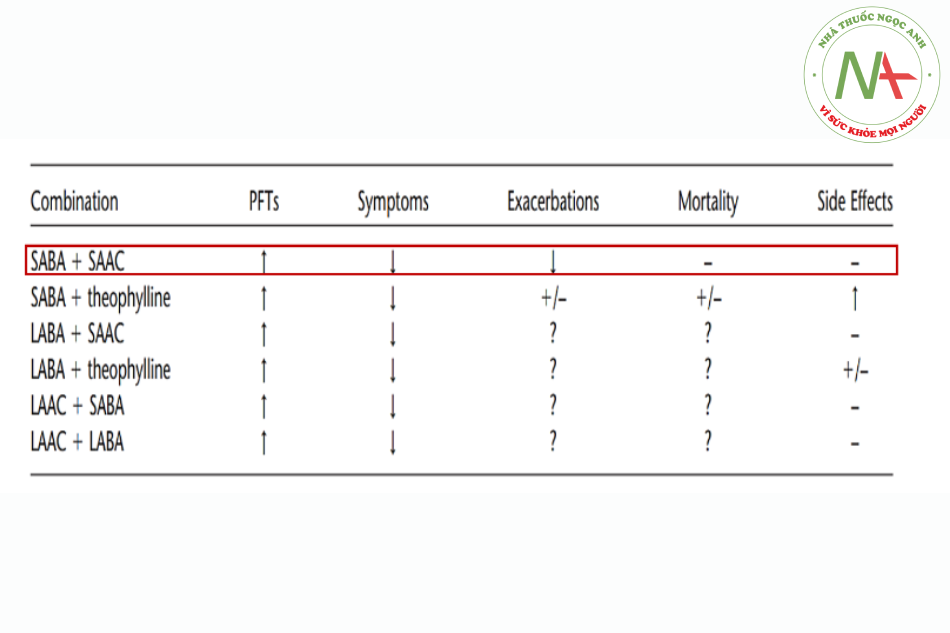
Cơ sở lý luận và pháp lý để nghiên cứu
- COPD là bệnh lý mạn tính, cần sử dụng thường xuyên thuốc dãn phế quản để duy trì tình trạng thông khí tốt nhất có thể và thuốc dãn phế quản là điều trị nền tảng trong COPD. Thuốc dãn phế quản tác dụng ngắn Ipra./Salb. là kết hợp được khuyến cáo sử dụng trong quản lý và điều trị COPD (Tổng Hội Y học Việt Nam. Hướng dẫn Quản và Điều trị COPD Việt Nam 2021).
- Thuốc giãn phế quản là trị liệu cơ bản trong COPD (GOLD 2023). Sử dụng thuốc giãn phế quản dạng khí dung là phương pháp trị liệu thuốc dễ sử dụng và thích hợp với bệnh lý người lớn tuổi như COPD cả trong xử trí cấp cứu và điều trị duy trì trong giai đoạn ổn định.
- Khuynh hướng sản xuất thuốc generic “là thuốc có cùng dược chất, hàm lượng, dạng bào chế với thuốc biệt dược gốc và thường được sử dụng thay thế biệt dược gốc.” (Luật Dược).
- Đây là khuynh hướng phát triển công nghiệp dược được khuyến cáo cho các nước có thu nhập thấp và Bộ Y tế Việt Nam cũng đề xuất chiến lược này: “Phát triển công nghiệp dược và ưu tiên sử dụng thuốc sản xuất trong nước: Ưu đãi đầu tư sản xuất thuốc, nguyên liệu làm thuốc, thuốc thiết yếu, Ưu đãi nghiên cứu khoa học về công nghệ bào chế, công nghệ sinh học để sản xuất các loại thuốc mới. Ưu tiên mua thuốc generic, sinh phẩm tương tự đầu tiên sản xuất trong nước được cấp giấy đăng ký lưu hành tại Việt Nam; thuốc dược liệu, thuốc cổ truyền được sản xuất từ nguồn dược liệu trong nước” (Chiến lược quốc gia phát triển ngành Dược Việt Nam giai đoạn đến năm 2030 và tầm nhìn đến năm 2045. https://moh.gov.vn › documents).
- Hội Phổi Việt Nam có nhiệm vụ tổ chức thực hiện các đề tài nghiên cứu khoa học, lập các dự án nghiên cứu ứng dụng, chuyển giao các kết quả nghiên cứu vào bảo vệ và nâng cao sức khoẻ nhân dân (Nhiệm vụ của Hội Phổi Việt Nam. Phê duyệt kèm theo Quyết định số 81 /QĐ-BNV ngày 25 tháng 01 năm 2019 của Bộ trưởng Bộ Nội vụ).
Mục tiêu nghiên cứu
- So sánh hiệu quả ngắn hạn đáp ứng lâm sàng, chức năng hô hấp và tác dụng ngoại ý khi sử dụng thuốc nghiên cứu Vinsalpium với Combivent.
- So sánh cảm nhận chủ quan của người bệnh khi sử dụng thuốc nghiên cứu Vinsalpium với Combivent.
Đối tượng nghiên cứu
- Thuốc nghiên cứu: Vinsalpium, dược chất salbutamol sulfat 2,5 mg/Ipratropium bromid monohydrat 0,5 mg (2,5 ml/ống thủy tinh đơn liều). Số đăng ký VD-33654-19 (QĐ-QLD 652/ngày 23/19/2019). Nguồn gốc: Vinphaco.
- Thuốc chứng: Combivent, dược chất salbutamol base 2,5 mg/Ipratropium bromid khan 0,5 mg (2,5 ml/ống đơn liều). Nguồn gốc: Boehringer Ingelheim. Bệnh nhân bị COPD tới khám ngoại trú tại các cơ sở quản lý COPD (không nhập viện).
Nguồn thuốc:
Vinsalpium: Nguồn từ Vinphaco cung cấp
Combivent: Nguồn mua từ các nhà thuốc (Nghiên cứu cung cấp)
Bệnh nhân nghiên cứu:
- Được chẩn đoán COPD: Đã được chẩn đoán COPD hoặc chẩn đoán COPD (trên 40 tuổi, hút thuốc lá ≥20 gói-năm, có triệu chứng hô hấp mạn tính, X-quang ngực không có bất thường có khả năng gợi ý bệnh lý khác, có biểu hiện rối loạn thông khí tắc nghẽn sau sử dụng thuốc dãn phế quản, thể hiện bằng FEV1/FVC <70% GTLT LLN.
- Không có chống chỉ định đo chức năng hô hấp bằng hô hấp kế (Spirometer) (Nguyễn Văn Thành và cs. Thực hành chức năng Hô hấp, hen và COPD).
- Không có chống chỉ định sử dụng thuốc: Đang điều trị các bệnh hoặc nghi ngờ đang có bệnh như Cường giáp, Tiểu đường, Huyết áp cao (Max: ≥140 mmHg, Min: ≥90 mmHg), Khoảng QT kéo dài trên ECG, Nhịp tim bất thường (nhịp nhanh ≥100 ck/ph), Tăng nhãn áp góc đóng, rối loạn tiểu tiện (bí tiểu, phì đại tuyến tiền liệt).
Tiêu chuẩn bệnh nhân không tuyển vào nghiên cứu:
- Không COPD.
- Có chống chỉ định đo chức năng hô hấp bằng spirometer và sử dụng thuốc như đã nói ở trên.
- Không đang sử dụng các thuốc: Dẫn chất xanthine, lợi tiểu, trợ tim, thuốc ức chế beta, thuốc chống trầm cảm 3 vòng.
- Không đồng ý tham gia nghiên cứu (không ký phiếu đồng ý tham gia, consent form).
Phương thức tuyển bệnh: Bệnh nhân được chọn và thực hiện lấy số liệu theo cách tiếp nối liên tục từ sau khi đề cương được phê duyệt, trong khoảng từ tháng 1/5/2023 tới hết 31 tháng 7 năm 2023.
Phương pháp nghiên cứu
Thiết kế nghiên cứu:
- Nghiên cứu so sánh không kém hơn (non-inferiority trial) về tác dụng ngắn hạn của thuốc Vinsalpium với một thuốc gốc. Thiết kế tiến cứu, so sánh với nhóm chứng chọn ngẫu nhiên (RCT). Mù đơn.
- Đa trung tâm.
Cỡ mẫu:
- Nghiên cứu sử dụng chỉ số FEV1 làm biến kết cục chính. Tham khảo thay đổi giá trị FEV1 theo nghiên cứu “Tashkin và cs. Bronchodilator responsiveness in patients with COPD D.P. Eur Respir J 2008; 31: 742 750”.
- Công thức tính cỡ mẫu cho nghiên cứu hai mẫu, so sánh ngẫu nhiên có đối chứng, biến liên tục.
- Kích thước mẫu:
- N nhóm chứng = 55 (làm tròn là 60)
- N nhóm nghiên cứu = 55 (làm tròn là 60)
- Cộng thêm 15 missing data cho mỗi nhóm = 75
- Tổng số bệnh nhân nghiên cứu cho 2 nhóm = 150
- Để đủ N phân tích subgroup: 250 (125/125)
N = 2 x ((Z1 – α + Z1 – β)/δ0)2 x S2
Trong đó:
- N: Cỡ mẫu mỗi nhóm
- Z: Độ lệch phân phối chuẩn đối với test một phía hoặc hai phía
- α : Sai số anpha (0.05)
- β: Sai số beta (0.20)
- δ0: Mức lệch chuẩn chấp nhận khi đo FEV1: 15 ml
- S2: Độ lệch chuẩn chung của hai nhóm so sánh: 18 ml
Phương pháp phân nhóm ngẫu nhiên: Ngẫu nhiên theo ngày chẵn – lẻ của ngày làm việc trên lịch khám để chia hai nhóm: Nhóm chứng và nhóm thuốc nghiên cứu.
Phương pháp thống kê: So sánh các biến phân loại giữa các nhóm bằng cách sử dụng test Pearson chi-squared và Fisher exact (hoặc test phi tham số Mann-Whitney và Kruskal-Wallis cho các biến định lượng). Sự khác biệt được coi là có ý nghĩa khi p<0,05. Các phân tích được thực hiện bằng phần mềm SPSS 16.0 (SPSS, Chicago, IL, USA).
Chọn site nghiên cứu:
- Các site tham gia nghiên cứu bằng hình thức tự nguyện.
- Cụ thể sẽ được lựa chọn thuận tiện dựa trên:
- Năng lực tiếp nhận bệnh nhân: Các nghiên cứu viên chính thống nhất tiêu chuẩn hóa thực hành chẩn đoán, thu thập và xử lý số liệu. Năng lực và chất lượng sẽ được đánh giá bằng checklist khả thi.
- Đã tham gia ít nhất 1 lần các nghiên cứu đa trung tâm do Hội tổ chủ trì.
- Tính tự nguyện và độ tin cậy được đánh giá chủ quan và có cam kết bằng văn bản.
Site nghiên cứu: Năm điểm được dự kiến chọn: BV Phổi TW, BV Phạm Ngọc Thạch (TP HCM), BV Quốc tế Hải Phòng, Phòng khám Ngọc Minh (TP HCM), BVĐK TW Cần Thơ.
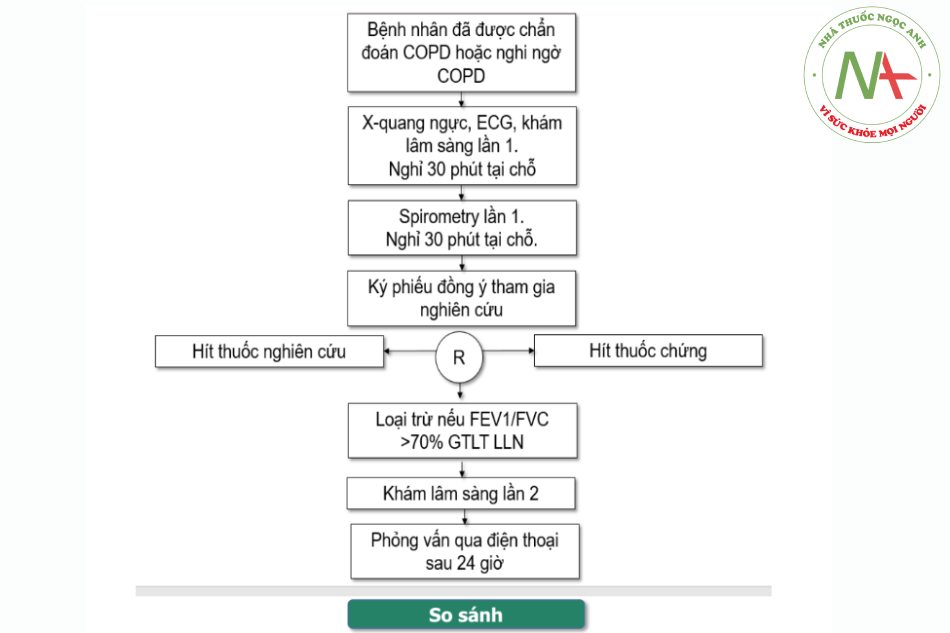
Phương pháp lâm sàng: Tất cả các bệnh nhân vào nghiên cứu:
- Được khám lâm sàng toàn thân và hô hấp. Ghi nhận: M, HA, SpO2, nhịp thở, thông tin về tiền sử, bệnh sử sau 30 phút ngồi nghỉ tại phòng khám bệnh, trước khi đo chức năng hô hấp trước thuốc.
- Được khám lâm sàng hô hấp. Ghi nhận: M, HA, SpO2, nhịp thở sau khi đo chức
năng hô hấp có sử dụng thuốc nghiên cứu sau 30 phút ngồi nghỉ tại phòng khám bệnh. - Được hỏi qua điện thoại các biểu hiện bất thường có liên quan tới tác dụng không mong muốn của thuốc nghiên cứu sau 24 giờ sử dụng thuốc: Quá mẫn, đau đầu, chóng mặt, khô miệng, hồi hộp, bí tiểu (theo quy trình thống nhất).
Phương pháp cận lâm sàng: Tất cả các bệnh nhân vào nghiên cứu:
- Được chụp X-quang ngực tư thế thẳng đứng (PA).
- Được đo ECG trước khi sử dụng thuốc.
- Được đo chức năng hô hấp (spirometry) theo quy trình đo của nghiệm pháp phục hồi phế quản (Nguyễn Văn Thành và cs. Thực hành chức năng Hô hấp, hen và COPD).
Phương pháp sử dụng thuốc và đo chức năng phổi:
- Tất cả bệnh nhân vào nghiên cứu đều được sử dụng một lần thuốc trước khi đo chức năng hô hấp lần thứ hai bằng 01 liều: 2,5 mL dung dịch Salbutamol 2,5 mg/Ipratropium 0,5 mg bằng máy khí dung khí nén (Omrion NE-C803) do nghiên cứu cung cấp và chỉ để sử dụng cho bệnh nhân trong nghiên cứu này. Thuốc nghiên cứu: Vimsalpium, thuốc chứng: Combivent.
- Bệnh nhân trong nghiên cứu được đo chức năng phổi bởi cùng 1 người đo và trên cùng một máy đo (spirometer).
- Phương pháp đánh giá kết quả (theo một quy trình và mẫu thống nhất).
- So sánh các biến lâm sàng, cận lâm sàng giữa hai nhóm sử dụng thuốc chứng và thuốc nghiên cứu dựa trên các biến kết cục. Các biến kết cục gồm:
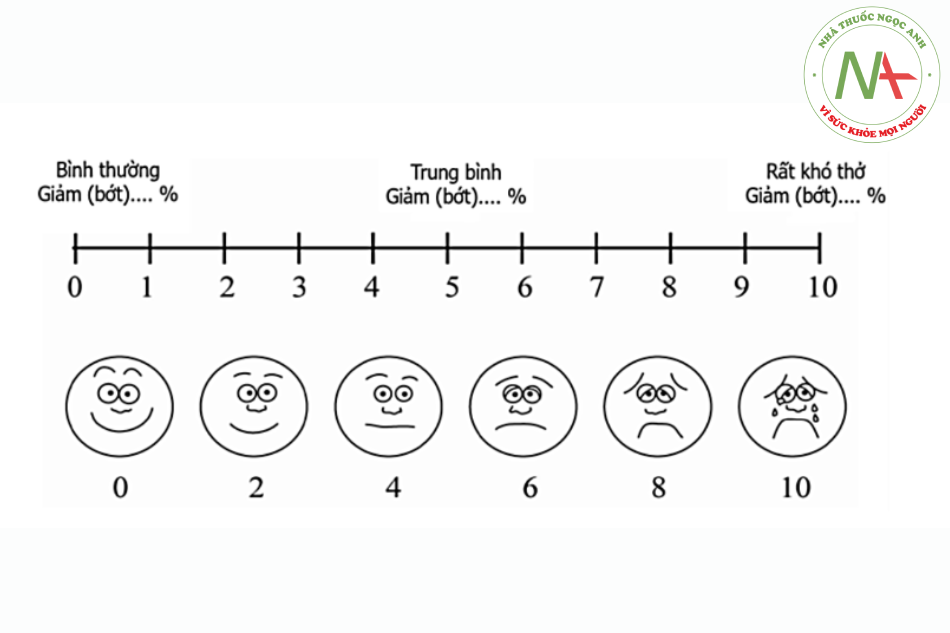
- Lâm sàng: M, HA, Nhịp thở, cảm giác hô hấp theo thang điểm Visual Analogue Scale (VAS).
- Chức năng hô hấp: FEV1 và các giá trị khác trong hai lần đo spirometry.
- Cảm giác chung sau dùng thuốc trong 24 giờ: Tác dụng phụ của thuốc.
KẾT QUẢ VÀ BÀN LUẬN
Đặc điểm chung của bệnh nhân nghiên cứu theo 2 nhóm (sử dụng thuốc nghiên cứu và thuốc chứng)
Tổng cộng có 260 bệnh nhân và được chia thành 2 nhóm, mỗi nhóm 130 bệnh nhân. Bảng số liệu dưới đây thể hiện các đặc điểm chung của bệnh nhân nghiên cứu về giới, tuổi, chẩn đoán COPD, quản lý và điều trị thuốc, khả năng gắng sức trước khi khám, lý do đi khám, điểm VAS, triệu chứng lâm sàng (mạch, huyết áp, nhịp thở), SpO2, BMI, hình ảnh X-quang ngực, ECG và sử dụng thuốc hô hấp trước khi khám theo nhóm (bảng 1), chức năng hô hấp trước và sau thuốc (bảng 2) và tác dụng phụ sau sử dụng thuốc (bảng 3).
Bảng 1. Đặc điểm lâm sàng và xét nghiệm bệnh nhân theo nhóm
| Đặc điểm | Nhóm sử dụng thuốc nghiên cứu | Nhóm sử dụng thuốc chứng | Giá trị p |
| Tuổi (TB, SD) | 66,62 (8,84) | 67,08 (9,35) | 0,84 |
| Sử dụng thuốc trước khám (N, %) | |||
| – Không thuốc | 21 (16,15) | 26 (20,00) | |
| -SABDs | 8 (6,15) | 9 (6,92) | 0,58 |
| – LABDs | 46 (33,38) | 37 (28,46) | |
| – CRS | 43 (33,10) | 40 (30,77) | |
| – LABDs + CRS | 12 (9,23) | 18 (13,85) | |
| Đợt cấp trong 12 tháng trước | |||
| – Số đợt cấp trung bình (TB, SD) | 1,31 (1,87) | 1,48 (1,88) | 0,47 |
| – Số đợt cấp nặng nhập viện trung bình (TB, SD) | 0,76 (1,38) | 0,86 (1,22) | 0,57 |
| – Số bệnh nhân có nhiều đợt cấp (N, %) | 58 (44,61) | 61 (46,92) | 0,71 |
| – Số bệnh nhân có ít nhất 1 đợt cấp nặng nhập viện (N, %) | 51 (39,23) | 53 (40,76) | 0,23 |
| Hạn chế khả năng gắng sức trước khi khám (N, %) | |||
| – Bình thường | 8 (6,15) | 5 (3,85) |
0,69
|
| – Hạn chế nhe | 51 (39,23) | 54 (41,54) | |
| – Hạn chế trung bình | 59 (45,38) | 55 (42,31) | |
| – Hạn chế nặng | 12 (9,23) | 16 (12,31) | |
| Lý do đi khám bệnh (N, %) | |||
| – Đi khám theo hẹn | 84 (64,62) | 79 (60,77) | 0,09 |
| – Đi khám không theo hẹn vì triệu chứng cấp tính | 23 (17,69) | 15 (11,54) | |
| – Đi khám không theo hẹn vì triệu chứng mạn tính | 23 (17,69) | 36 (27,69) | |
| Điểm VAS chung trước và sau thuốc (TB, SD) | 4,50 (1,80) vs 3,37 (1,73) | 0,0001 | |
| Điểm VAS trước thuốc theo nhóm thuốc (TB, SD) | 4,36 (1,92) | 4,65 (1,68) | 0,20 |
| Điểm VAS sau thuốc theo nhóm thuốc (TB, SD) | 3,14 (1,71) | 3,61 (1,73) | 0,028 |
| Điểm VAS hỏi qua điện thoại theo nhóm thuốc (TB, SD) | 3,3 (1,7) | 3,8 (1,7) | 0,013 |
| BMI (TB, SD) | 20,55 | 20,64 | 0,80 |
| X-quang ngực và ECG (N, %) | |||
| – Có khí phế thũng | 74 (56,69) | 81 (62,31) | 0,38 |
| – Có tổn thương lao cũ | 24 (18,46) | 9 (6,92) | 0,005 |
| – ECG có bất thường | 9 (6,92) | 13 (10,00) | 0,37 |
| Mạch trước và sau thuốc chung (TB, SD) | 84,07 (11,37) vs 84,18 (11,11), | 0,80 | |
| Mạch trước và sau thuốc theo nhóm thuốc | |||
| – Mạch trước thuốc (TB, SD) | 83,73 (11,20) | 83,66 (10,95) | 0,98 |
| – Mạch sau thuốc (TB, SD) | 84,42 (11,56) | 84,71 (11,27) | 0,93 |
| Tăng huyết áp trước và sau thuốc chung (N, %) | 38 (14,61) vs 29 (11,15) | 0,0001 | |
| Huyết áp trước và sau thuốc theo nhóm thuốc nghiên cứu | |||
| – Có tăng HA trước thuốc (N, %) | 18 (13,85) | 20 (15,38) | 0,43 |
| – Có tăng HA sau thuốc (N, %) | 9 (6,92) | 20 (15,38) | 0,03 |
| Tiếng ran trước và sau thuốc (N, %) | |||
| – Tiếng ran trước thuốc | 9 (6,92) | 12 (9,23) | 0,50 |
| – Tiếng ran sau thuốc | 3 (2,30) | 4 (3,07) | 0,70 |
| Co kéo cơ hô hấp phụ trước và sau thuốc (N, %) | |||
| – Có co kéo cơ hô hấp phụ trước thuốc | 4 (3,07) | 5 (3,85) | 0,73 |
| – Có co kéo cơ hô hấp phụ sau thuốc | 3 (2,30) | 1 (0,76) | 0,63 |
| SpO2 trước và sau thuốc (TB%, SD) | |||
| – SpO2 trước thuốc | 96,4 (1,80) | 96,4 (1,97) | 0,97 |
| – SpO2 sau thuốc | 96,65 (1,77) | 96,74 (1,48) | 0,65 |
Viết tắt: N, số bệnh nhân; TB, trung bình; SD, độ lệch chuẩn; SABDs, thuốc dãn phế quản tác dụng ngắn; LABDs, thuốc dãn phế quản tác dụng dài; ICS, thuốc corticosteroid dạng hít.
Nghiên cứu thực hiện lấy mẫu trên 5 đơn vị tham gia nghiên cứu là các đơn vị có hoạt động khám chữa bệnh chuyên khoa cho COPD, phân bố trên cả nước, nên đây có thể xem là mẫu đại diện cho đặc điểm bệnh nhân và tình hình quản lý điều trị chuyên khoa bệnh lý này hiện nay ở Việt Nam. Bảng 1 trình bày các đặc điểm bệnh nhân COPD đang được quản lý và điều trị với các điểm nổi bật như sau: tuyệt đại đa số là nam giới (95,00%), 78,07% đang được quản lý, hầu hết đã được chẩn đoán xác định bằng đo chức năng hô hấp và đang được điều trị theo hướng dẫn chuyên khoa (74,23% và 74,00% theo thứ tự). Điểm VAS ở mức không chấp nhận được (>5 điểm) là 30%. Số bệnh nhân đang điều trị bằng corticosteroid dạng hít (ICS) chiếm tỷ lệ cao 45%, tuy nhiên nếu so với nghiên cứu ENHANCE năm 2018, cũng ở các đơn vị nghiên cứu như trên, ghi nhận 92,7% bệnh nhân đang điều trị các phác đồ có ICS [4], thì tỷ lệ này đã giảm nhiều. Số đợt cấp trung bình/bệnh nhân/năm trong nghiên cứu là 1,39. Số đợt cấp này cao hơn so với một nghiên cứu ở Anh năm 2015, là 0,89 [5]. Theo phân loại ít hay nhiều đợt cấp của tài liệu GOLD [3] thì tỷ lệ bệnh nhân có nhiều đợt cấp trong nghiên cứu là 45,76%. Tỷ lệ này mặc dù còn cao so với y văn thế giới [6] nhưng đã giảm nhiều so với ghi nhận từ nghiên cứu ENHANCE như đã trích dẫn ở trên, là 77,3 % trên những hồ sơ có ghi nhận tiền sử đợt cấp [4]. Đáng chú ý tỷ lệ bệnh nhân có ít nhất 1 đợt cấp phải nhập viện trong 12 tháng trước trong nghiên cứu này là 40% và không có sự khác biệt có ý nghĩa về số đợt cấp giữa 2 nhóm đang được quản lý điều trị và đang tự điều trị (p=0,54). Tỷ lệ này cũng cao hơn so với nghiên cứu ở Anh như đã trích dẫn ở trên, là 22,6% [5]. Số bệnh nhân có di chứng tổn thương lao cũ trên X-quang ngực trong nghiên cứu là 33 (13,7%). Tỷ lệ này là tương đương với một nghiên cứu ở Thổ Nhĩ Kỳ (năm 2016) là 15,5% [7]. Tuy nhiên, cũng cần lưu ý, trong số 33 bệnh nhân có tổn thương di chứng lao phổi cũ trên X- quang có 12 bệnh nhân (tỷ lệ 36,36%) đang được điều trị duy trì bằng phác đồ có ICS.
So sánh tác động của thuốc nghiên cứu và thuốc chứng trên chức năng hô hấp
Bảng 2. So sánh chức năng hô hấp giữa 2 nhóm trước và sau thuốc
| Đặc điểm | Nhóm sử dụng thuốc nghiên cứu | Nhóm sử dụng thuốc chứng | Giá trị p |
| So sánh giá trị %FVC pred. và %FEV1 pred. trước và sau thuốc chung trong nghiên cứu (TB, SD) |
|||
| – %FVC pred. trước và sau thuốc | 79,81 (18,50) vs 108,37 (12,30) | 0,0001 | |
| – %FEV1 pred. trước và sau thuốc | 55,46 (18,19) vs 59,76 (18,80) | 0,0001 | |
| So sánh giá trị %FVC pred. trước và sau thuốc theo phân nhóm thuốc | |||
| – Giá trị %FVC pred. trước thuốc (TB, SD) | 79,78 (19,97) | 79,85 (16,97) | 0,98 |
| – Giá trị %FVC pred. sau thuốc (TB,SD) | 109,13 (13,18) | 107,60 (911,35) | 0,32 |
| So sánh giá trị %FEV1 pred. trước và sau thuốc theo phân nhóm thuốc | |||
| – Giá trị %FEV1 pred. trước thuốc (TB, SD) | 53,52 (18,75) | 56,56 (17,55) | 0,18 |
| – Giá trị %FEV1 pred. sau thuốc (TB, SD) | 109,93 (11,23) | 108,80 (11,51) | 0,46 |
| – Số bệnh nhân %FEV1 pred. sau thuốc >12% (N, %) | 50 (38,46) | 43 (33,08) | 0,37 |
Tất cả các trường hợp ghi nhận có tác dụng phụ đều ở mức độ nhẹ, cụ thể được trình bày trong bảng 3.
Bảng 3. So sánh tác dụng phụ sau sử dụng thuốc giữa 2 nhóm
| Đặc điểm | Nhóm sử dụng thuốc nghiên cứu | Nhóm sử dụng thuốc chứng | Tổng | Giá trị p |
| Có tác dụng phụ khi sử dụng thuốc (N, %) | ||||
| – Đau đầu
– Chóng mặt – Khô miệng – Hồi hộp |
14 (10,77)
1 1 9 3 |
29 (22,31)
1 5 21 2 |
43
(16,54) |
0,07 |
| Cảm nhận của bệnh nhân khi sử dụng thuốc (N, %) | ||||
| – Như các thuốc khác
– Khó chịu hơn các thuốc khác – Không có ý kiến |
90 (69,23)
1 (0,77) 39 (30,00) |
77 (59,23)
4 (3,08) 49 (37,69) |
0,13 | |
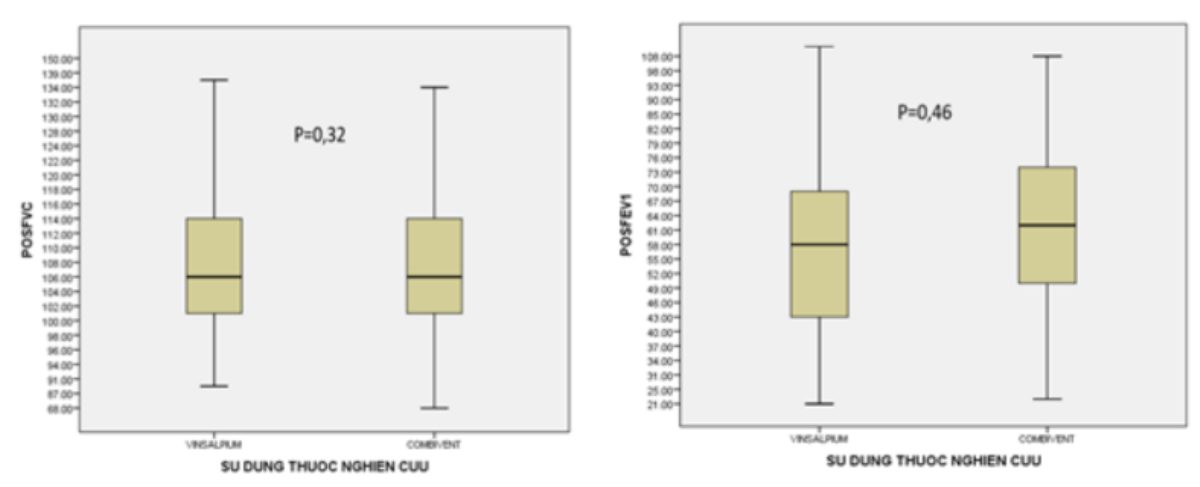
So sánh các đặc điểm lâm sàng, xét nghiệm, quản lý và điều trị giữa hai nhóm sử dụng thuốc nghiên cứu và thuốc chứng cho thấy cơ bản là không khác biệt (bảng 2) ngoại trừ bệnh nhân trong nhóm sử dụng thuốc nghiên cứu có tổn thương di chứng lao phổi nhiều hơn so với nhóm sử dụng thuốc chứng: 24 (18,46%) so với 9 (6,92%), p< 0,005. Điểm trung bình VAS trước thuốc giữa hai nhóm là không khác biệt (4,36 so với 4,65, p=0,20). Điểm trung bình VAS sau thuốc ở nhóm sử dụng thuốc nghiên cứu giảm nhiều hơn có ý nghĩa so với nhóm sử dụng thuốc chứng (3,14 so với 3,61, p=0,028). Tương tự điểm trung bình VAS sau thuốc nghiên cứu cũng thấp hơn có ý nghĩa so với nhóm sử dụng thuốc chứng (3,3 so với 3,8, p=0,013). Tỷ lệ bệnh nhân có tăng huyết áp trước thuốc giữa hai nhóm là không khác biệt (14% so với 15%, p=0,43) nhưng sau thuốc, tỷ lệ bệnh nhân có tăng huyết áp ở nhóm sử dụng thuốc nghiên cứu thấp hơn có ý nghĩa so với nhóm sử dụng thuốc chứng (6,9% so với 15,4%, p=0,03). So sánh thay đổi giá trị %FVC pred. và %FEV-1 pred. trước và sau thuốc giữa hai nhóm không cho thấy có sự khác biệt có có ý nghĩa. Thể hiện sự không kém hơn giá trị %FVC pred. và %FEVi pred. trước và sau thuốc của thuốc nghiên cứu so với thuốc chứng bằng biểu đồ hình 2.
Tác dụng phụ gặp phải khi sử dụng thuốc thấp và đều ở mức độ nhẹ. Trong nghiên cứu này, ngoài tác dụng phụ mà bệnh nhân phản ánh sau sử dụng thuốc như đã được trình bày trong bảng 3, chúng tôi cũng lưu ý tới tác dụng của thuốc kích thích thụ thể beta2 adrenergic kết hợp kháng thụ thể cholinergic của thuốc nghiên cứu và thuốc chứng trên tim-mạch, cụ thể là tần số mạch và tăng huyết áp. Tình trạng tăng huyết áp kết hợp trong COPD là phổ biến [1] tuy nhiên, trong nghiên cứu này không cho thấy việc sử dụng thuốc với chỉ định trong nghiên cứu có tác động tới tình trạng mạch và huyết áp, thậm trí số bệnh nhân tăng huyết áp trước sử dụng thuốc cao hơn có ý nghĩa so với sau sử dụng thuốc (p=0,0001). Rất tiếc do không thể thiết kế được việc đo lại ECG sau sử dụng thuốc nên nghiên cứu không đánh giá được tác động của thuốc trên nhịp tim và dẫn truyền.
KẾT LUẬN
Trên 260 bệnh nhân nghiên cứu trong đó hầu hết đã được chẩn đoán xác định, đang được quản lý và điều trị cho thấy có những đặc rất cần được lưu ý về chỉ định sử dụng thuốc, hiệu quả điều trị thể hiện trên điểm VAS và số đợt cấp.
Không có sự khác biệt về đặc điểm bệnh nhân vào nghiên cứu giữa hai nhóm (ngoại trừ số bệnh nhân có tổn thương lao cũ kết hợp nhiều hơn ở nhóm sử dụng thuốc nghiên cứu). Hiệu quả và tính an toàn của thuốc nghiên cứu (Vinsalpium) so với thuốc chứng (Combivent) là tương đương. Có khác biệt với mức độ không cao đối với tính ổn định của huyết áp trước và sau sử dụng thuốc, điểm VAS sau thuốc và điểm VAS phỏng vấn qua điện thoại mà lợi thế nghiêng về thuốc Vinsalpium.
Minh bạch: Nghiên cứu có nhận tài trợ kinh phí thực hiện từ công ty CPDP Vĩnh Phúc
Tài liệu tham khảo
- Global Initiative for Chronic Obstructive Lung Disease (GOLD) report 2023
- Tổng Hội Y học Việt Nam. Điều trị thuốc giai đoạn ổn định. (Trong) Hướng dẫn quản lý và điều trị Bệnh phổi tắc nghẽn mạn tính (COPD) Việt Nam 2021. NXB Y học 2021. Tr 65-81.
- CTM Thúy. Chức năng hô hấp: PEF (đo bằng lưu lượng đỉnh kế), và spirometry – Đo đánh giá chất lượng kết quả đo được và kết luận. (Trong) Thực hành chức năng hô hấp, hen và COPD (NV Thành chủ biên). NXB Khoa học và Kỹ thuật 2019, tr 38-56.
- NV Thành và cs. Thực trạng quản lý hen và COPD ở Việt Nam. Y học Việt Nam, 1-2018, tr. 149-153
- Lorcan McGarvey et al. Characterisation of the frequent exacerbator phenotype in COPD patients in a large UK primary care population. Respiratory Medicine (2015) 109, 228-237
- Terence AR Seemungal et al. Exacerbation rate, health status and mortality in COPD – a review of potential interventions. International Journal of COPD 2009:4 203-223
- Hakan Gunen et al. The Role of TB in COPD. Poster (Chest annual meeting 2016). DOI: http://dx.doi.org/10.1016Zj.chest.2016.08.956

