Bệnh tim mạch
Một số hội chứng thường gặp liên quan đến bất thường tim bẩm sinh
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nguồn: Sách Lâm sàng tim bẩm sinh
Chủ biên
PGS.TS.BS. Nguyễn Lân Hiếu
Tham gia biên soạn
Nguyễn Lân Hiếu
Trần Tiến Anh
Lê Nhật Cường
Nguyễn Văn Hiếu
Đỗ Quốc Hiển
Nhà thuốc Ngọc Anh xin gửi đến quý bạn đọc chủ đề: Một số hội chứng thường gặp liên quan đến bất thường tim bẩm sinh trong thực hành lâm sàng tim bẩm sinh.
HỘI CHỨNG MARFAN
ĐẠI CƯƠNG
Hội chứng Marfan (Marfan syndrome) là hội chứng do rối loạn mô liên kết có tính di truyền gây ảnh hưởng đến tim, mắt, phổi, mạch máu, dây chằng và xương. Tỷ lệ mắc hội chứng Marfan ước tính khoảng 2-3/10000 cá thể.
Hội chứng Marfan được đặt theo tên một bác sĩ nhi khoa người Pháp, bác sĩ Antoine Marfan. Năm 1896, bác sĩ Antoine Marfan lần đầu tiên mô tả những tổn thương ở một bé gái có tay và chân rất dài. Sau gần một thế kỷ, đến năm 1986, tiêu chuẩn Berlin ra đời đã mô tả chi tiết về hội chứng Marfan, chủ yếu theo kiểu hình lâm sàng của người bệnh.
Năm 1991, Dietz và cộng sự phát hiện ra mối liên hệ giữa hội chứng Marfan và đột biến gen FBN1, gen mã hóa protein fibrillin-1. Từ đó, cơ chế bệnh sinh của hội chứng Marfan được làm sáng tỏ. Đồng thời việc chẩn đoán hội chứng Marfan thay đổi theo tiêu chuẩn Ghent (1996) và gần đây là tiêu chuẩn Ghent sửa đổi (2010).
Trong hội chứng Marfan, đột biến gen gây ra khiếm khuyết trong sản xuất fibrillin-1, là thành phần của glycoprotein cần thiết cấu tạo nên sợi đàn hồi trong mô liên kết. Đột biến gen làm giảm số lượng, chất lượng của fibrillin-1 trong mô liên kết, dẫn đến sự suy yếu của cấu trúc mô liên kết. Đột biến gen fibrillin-1 trên nhiễm sắc thể số 15 được xác định liên quan đến hội chứng Marfan. Khoảng 75% người bị hội chứng Marfan do di truyền gen bất thường từ cha mẹ, còn lại 25% là kết quả của một đột biến mới xuất hiện. Một người có hội chứng Marfan có 50% nguy cơ truyền gen bệnh cho con.
CHẨN ĐOÁN
Lâm sàng
Khám lâm sàng tìm các biểu hiện của hội chứng Marfan theo các hệ cơ quan: tổn thương tại tim mạch, tổn thương mắt, bất thường về cơ xương khớp, biểu hiện ở da và các rối loạn khác.
Tổn thương tim mạch
Do tỷ lệ mô liên kết tập trung nhiều ở lớp áo giữa của động mạch chủ lên và gốc động mạch, đồng thời vị trí này thường xuyên chịu áp lực cao do gần tim nên biểu hiện thường gặp là giãn gốc động mạch chủ, động mạch chủ lên dẫn đến tách thành động mạch chủ lên (tách thành động mạch chủ Stanford A); tuy nhiên giãn quai động mạch chủ, động mạch chủ xuống hoặc tách thành động mạch chủ xuống (tách thành động mạch chủ Stanford B) cũng thường gặp. Các tổn thương tại tim khác bao gồm: sa van hai lá (70-90%), tuy nhiên tỷ lệ hở van hai lá nặng không cao; vôi hóa vòng van hai lá, hở van động mạch chủ do giãn gốc động mạch chủ; giãn thân động mạch phổi.
Tổn thương mắt
Thường là tật cận thị, thủy tinh thể lệch tâm, đục thủy tinh thể, hay bong võng mạc (tỷ lệ ít hơn) biểu hiện ngay khi còn trẻ.
Bất thường về hệ cơ xương khớp
Người mắc hội chứng Marfan thường cao gầy, chân tay dài, ngón tay, ngón chân dài. Tỷ lệ chiều dài nửa trên và nửa dưới cơ thể giảm. Dấu hiệu vòng cổ tay dương tính. Dấu hiệu ngón tay cái dương tính. Khớp lỏng, bàn chân phẳng, bất thường lồng ngực (lõm ngực, ngực gà); gù vẹo cột sống.
Biểu hiện ở da
Vết rạn da vùng ngực, cơ đen ta, lưng, đùi.
Các rối loạn khác
Tràn khí màng phổi tự phát (11%), rộng màng tủy thắt lưng cùng (dural ectasia) ít gặp hơn.
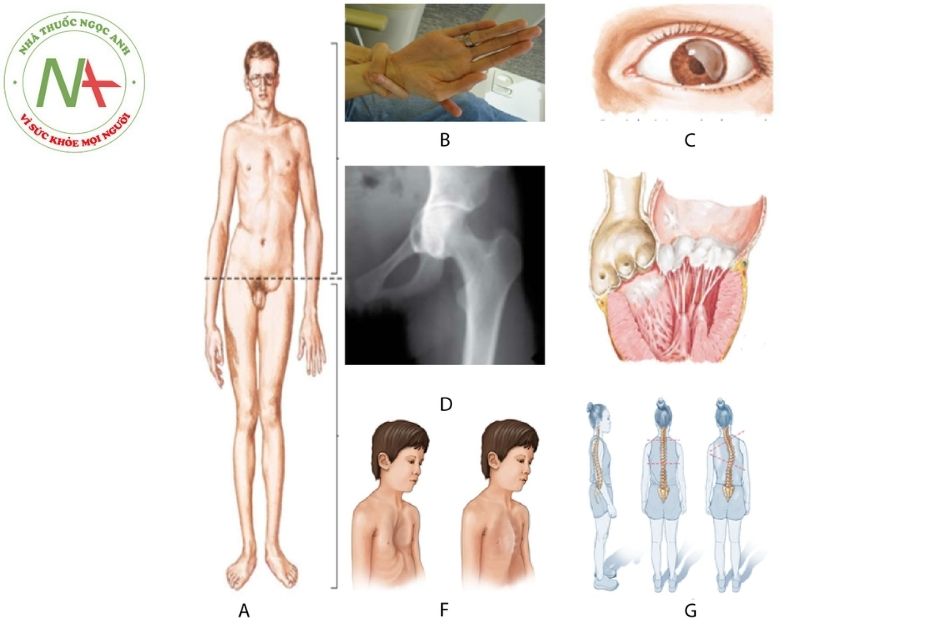
A. Chiều dài nửa trên/nửa dưới giảm; cao gầy, chân tay dài;
B. Dấu hiệu vòng cổ tay dương tính;
C. Thủy tinh thể lệch tâm;
D. Lồi ổ cối;
E. Giãn gốc động mạch chủ, sa van hai lá;
F. Ngực lõm, ngực gà;
G. Gù vẹo cột sống.
Giãn gốc động mạch chủ thường không biểu hiện triệu chứng lâm sàng, cần dựa vào các thăm khám cận lâm sàng.
Sốc trên bệnh nhân hội chứng Marfan là biểu hiện của vỡ hay tách thành động mạch chủ.
Triệu chứng hở van động mạch chủ (thổi tâm trương tại ổ van động mạch chủ, mạch nảy, huyết áp tâm trương thấp), triệu chứng hở van hai lá (thổi tâm thu tại ổ van hai lá).
Cận lâm sàng
Chụp Xquang, cắt lớp vi tính và cộng hưởng từ: để đánh giá xương cột sống, đùi, tay và chân.
Siêu âm tim
Đánh giá gốc động mạch chủ, bao gồm đường kính lớn nhất, các đường kính động mạch chủ đo tại vòng van, xoang Valsalva, đoạn nối xoang Valsalva với động mạch chủ lên và đoạn xa động mạch chủ lên. Siêu âm tim còn cung cấp thông tin về chức năng thất trái, van động mạch chủ và tình trạng hở van động mạch chủ, tình trạng sa van, hở van hai lá và/hoặc van ba lá.
Cắt lớp vi tính động mạch chủ hoặc cộng hưởng từ động mạch chủ
Cung cấp thông tin về toàn bộ động mạch chủ. Độ chun giãn của động mạch chủ xuống có thể đo được bằng chụp cộng hưởng từ, và là một yếu tố tiên lượng độc lập tiến triển giãn động mạch chủ xuống.
Chụp cắt lớp vi tính động mạch nên được sử dụng để loại trừ bệnh lý động mạch vành trước phẫu thuật, bởi chụp động mạch vành qua đường ống thông có thể gây tách thành động mạch chủ do thành mạch máu đã bị suy yếu.
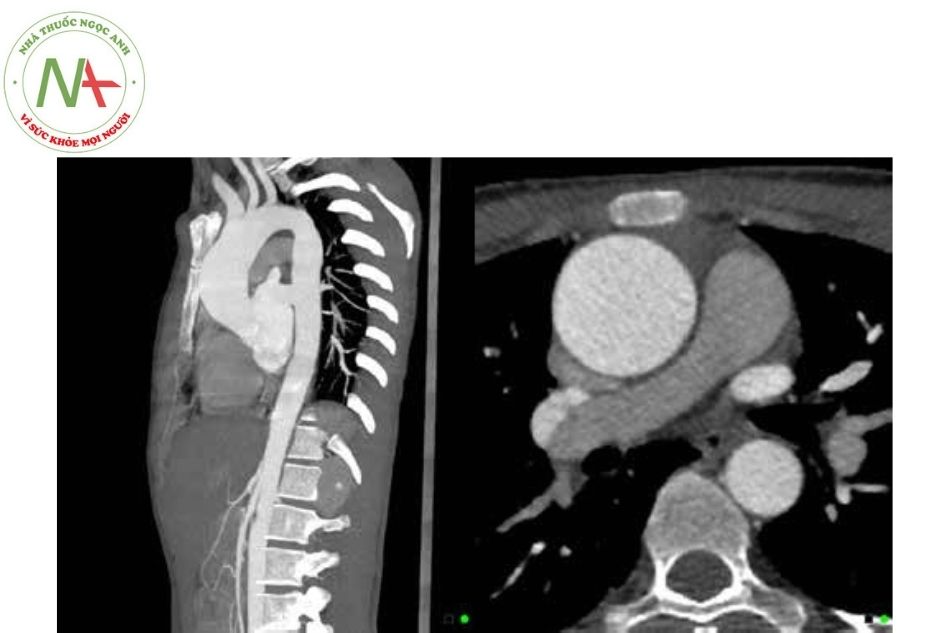
Holter điện tâm đồ: Bệnh nhân có triệu chứng nên được theo dõi Holter điện tâm đồ để phát hiện rối loạn nhịp tim và bất thường dẫn truyền nguy hiểm, có thể gây đột tử.
Soi đáy mắt: tìm bong võng mạc, lệch thủy tinh thể, cận thị nặng và tăng nhãn áp góc mở.
Xét nghiệm di truyền tìm đột biến gen FBN1: có vai trò hạn chế trong chẩn đoán, được sử dụng chủ yếu để chẩn đoán cho các thành viên trong gia đình nếu biết có đột biến gen, cũng như tư vấn di truyền trước hôn nhân, trước sinh.
Chẩn đoán xác định
Chẩn đoán xác định hiện nay dựa theo tiêu chuẩn Ghent sửa đổi năm 2010. Tiêu chuẩn này đặt trọng tâm vào những dấu hiệu lâm sàng quan trọng của hội chứng Marfan là giãn gốc động mạch chủ/tách thành động mạch chủ, lệch thủy tinh thể và các xét nghiệm về đột biến gen FBN1.
Tiêu chuẩn động mạch chủ: có giãn gốc động mạch chủ hoặc tách thành động mạch chủ. Có thể tính toán Z-score của gốc động mạch chủ tại địa chỉ https://www.marfan.org/dx/zscore#formtop, bằng các thông số về tuổi, chiều cao, cân nặng và đường kính gốc động mạch chủ đo tại vị trí xoang Valsalva. Nếu đường kính gốc động mạch chủ có Z-score ≥ 2 là có giãn gốc động mạch chủ.
Trường hợp không có tiền sử gia đình mắc hội chứng Marfan, chẩn đoán xác định hội chứng Marfan khi có 1 trong các tiêu chuẩn sau:
- Tiêu chuẩn động mạch chủ và lệch thủy tinh thể.
- Tiêu chuẩn động mạch chủ và đột biến gen FBN1.
- Tiêu chuẩn động mạch chủ và điểm hệ thống ≥ 7.
- Lệch thủy tinh thể và đột biến gen FBN1 đã được xác định ở bệnh nhân có phình động mạch chủ.
Trường hợp tiền sử gia đình có hội chứng Marfan, chẩn đoán xác định hội chứng Marfan khi có 1 trong các tiêu chuẩn sau:
- Lệch thủy tinh thể.
- Điểm hệ thống ≥ 7.
- Tiêu chuẩn động mạch chủ (đường kính gốc động mạch chủ có Z-score ≥ 2 nếu từ 20 tuổi trở lên, Z-score ≥ 3 nếu dưới 20 tuổi hoặc có tách thành động mạch chủ).
Bảng 1. Điểm hệ thống trong hội chứng Marfan
| Đặc điểm | Điểm |
| Dấu hiệu vòng cổ tay và ngón tay cái | 3 |
| Dấu hiệu vòng cổ tay hoặc ngón tay cái | 1 |
| Ngực hình ức gà | 2 |
| Ngực lõm | 1 |
| Vẹo xương gót | 2 |
| Bàn chân phẳng | 1 |
| Tràn khí màng phổi | 2 |
| Rộng màng tủy thắt lưng cùng | 2 |
| Di lệch chỏm xương đùi vào ổ cối | 2 |
| Giảm tỷ lệ nửa trên cơ thể/nửa dưới cơ thể và tăng tỷ lệ sải tay/chiều cao và không có cong vẹo cột sống nặng* | 1 |
| Gù hoặc vẹo cột sống ngực – lưng | 1 |
| Giảm biên độ duỗi khuỷu < 1700 | 1 |
| Đặc điểm khuôn mặt (ít nhất 3/5 đặc điểm sau: sọ dài, teo lõm tổ chức hốc mắt, mắt xếch xuống dưới, giảm sản xương gò má, thụt hàm dưới) | 1 |
| Rạn da | 1 |
| Cận thị > 3 diop | 1 |
| Sa van hai lá | 1 |
* Ngưỡng chẩn đoán bất thường thay đổi theo tuổi và chủng tộc: giảm tỷ lệ nửa trên cơ thể/nửa dưới cơ thể ở người trưởng thành là < 0,85 đối với người da trắng, < 0,78 đối với người da đen. Đối với trẻ em, giảm tỷ lệ nửa trên cơ thể/nửa dưới cơ thể là < 1,0 ở trẻ 0-5 tuổi, < 0,95 ở trẻ 6-7 tuổi, < 0,9 ở trẻ 8-9 tuổi, và < 0,85 ở trẻ từ 10 tuổi trở lên. Tăng tỷ lệ sải tay/chiều cao là > 1,05 ở người trưởng thành da trắng.
DIỄN BIẾN CỦA BỆNH
Hội chứng Marfan có thể được chẩn đoán hầu hết ở trẻ nhỏ trước khi trưởng thành. Trẻ nhỏ mắc hội chứng Marfan thường biểu hiện các dấu hiệu sa lá van gây hở van hai lá hơn là giãn động mạch chủ. Vòng van hai lá giãn và có thể vôi hóa. Biểu hiện hở van hai lá, hở van động mạch chủ do giãn gốc động mạch chủ thường gặp hơn biểu hiện tách thành động mạch chủ.
Đa số người trưởng thành có hội chứng Marfan không biểu hiện triệu chứng. Đột tử có thể là biểu hiện đầu tiên của bệnh. Nguyên nhân tử vong thường gặp nhất là do biến cố tim mạch như lóc, vỡ động mạch chủ. Triệu chứng đột ngột đau dữ dội, xuyên ra sau lưng, trước ngực, lan lên cổ hay đau bụng là các biểu hiện của biến chứng tách thành động mạch chủ. Sốc mất máu là biểu hiện của vỡ động mạch chủ. Biểu hiện ít gặp hơn là suy tim do hở van hai lá hay hở van động mạch chủ.
Tốc độ giãn động mạch chủ rất khác nhau giữa các cá thể và không dự đoán được trước, do vậy đánh giá kích thước gốc động mạch chủ thường xuyên là rất quan trọng. Thông thường các bệnh nhân được đánh giá hàng năm bằng siêu âm qua thành ngực, siêu âm thực quản, chụp cắt lớp vi tính hay chụp cộng hưởng từ. Tuy nhiên cần theo dõi thường xuyên hơn với các trường hợp có tốc độ tăng kích thước gốc động mạch chủ nhanh, kích thước động mạch chủ gần đến giới hạn phải thay. Ngoài kích thước gốc động mạch chủ, tiến triển hở van hai lá, van động mạch chủ cũng cần theo dõi sát.
ĐIỀU TRỊ
Điều trị phẫu thuật
Chỉ định điều trị và theo dõi bệnh nhân có hội chứng Marfan được tóm tắt trong Bảng 2.
Phẫu thuật cấp cứu được chỉ định trong trường hợp tách thành động mạch chủ type A hoặc vỡ động mạch chủ.
Chỉ định điều trị nội khoa cho đa số các trường hợp tách thành động mạch chủ type B. Chỉ định phẫu thuật trong trường hợp điều trị nội khoa không đáp ứng, đau không đáp ứng với thuốc giảm đau, không khống chế được huyết áp, thiếu máu tạng, dọa vỡ hoặc vỡ động mạch chủ; tiến triển đường kính động mạch chủ xuống lớn hơn 50 mm.
Chỉ định đặt stent graft trên bệnh nhân có hội chứng Marfan cần cân nhắc kỹ lưỡng vì tiến triển giãn động mạch chủ tiếp tục sau khi điều trị, thường được chỉ định trong các trường hợp không thể tiến hành phẫu thuật.
Biến chứng tách thành động mạch chủ thường hiếm khi xảy ra trên các bệnh nhân có đường kính động mạch chủ bình thường hoặc tăng nhẹ. Nguy cơ tách thành động mạch chủ càng cao khi động mạch chủ giãn càng lớn. Lựa chọn phẫu thuật thay đoạn động mạch chủ cần được xem xét với các trường hợp sau:
- Đường kính gốc động mạch chủ tối đa vượt quá 55 mm.
- Đường kính gốc động mạch chủ vượt quá 50 mm với bệnh nhân có tiền sử gia đình có người bị tách thành động mạch chủ cần phẫu thuật, hoặc giãn gốc động mạch chủ tăng lên lớn hơn 2 mm/năm.
- Đường kính gốc động mạch chủ vượt quá 45 mm ở bệnh nhân có mong muốn có thai hoặc tổn thương van tim phối hợp nặng cần phẫu thuật.
Bảng 2. Khuyến cáo phẫu thuật động mạch chủ trong hội chứng Marfan (Theo ESC 2020)
| Chỉ định | Khuyến cáo | Mức độ |
| Sửa van động mạch chủ, sử dụng kỹ thuật thay đoạn động mạch chủ bảo tồn gốc (reimplantation) hoặc tạo hình vòng van (remodelling with aortic annuloplasty) được khuyến cáo cho bệnh nhân trẻ bị hội chứng Marfan hoặc có bệnh lý di truyền đoạn động mạch chủ ngực. | I | C |
| Phẫu thuật được chỉ định cho bệnh nhân bị hội chứng Marfan có tổn thương ở gốc động mạch chủ với đường kính tối đa của xoang động mạch chủ ≥ 50 mm. (1) | I | C |
| Phẫu thuật nên được cân nhắc với bệnh nhân bị hội chứng Marfan có tổn thương ở gốc động mạch chủ với đường kính tối đa của xoang động mạch chủ ≥ 45 mm và kèm thêm các yếu tố nguy cơ. (2) | IIa | C |
| Phẫu thuật nên được cân nhắc với bệnh nhân mang đột biến gen TGFBR1 hoặc TGFBR2 (bao gồm hội chứng Loeys-Dietz) có tổn thương ở gốc động mạch chủ với đường kính tối đa ở xoang động mạch chủ ≥ 45 mm. (1) | IIa | C |
- Ở giá trị cuối trong khoảng diện tích bề mặt cơ thể (range of BSA) khuyến nghị điểm cut-offs nên được điều chỉnh phù hợp.
- Tiền sử gia đình bị tách thành động mạch chủ ở kích thước nhỏ (hoặc tiền sử cá nhân đột ngột bị tách thành mạch), hở van động mạch chủ tiến triển, phụ nữ mong muốn có con, THA không kiểm soát và/hoặc đường kính động mạch chủ tăng > 3mm/năm (lặp lại phép đo trong đó sử dụng cùng phương tiện chẩn đoán hình ảnh ở cùng mức động mạch chủ bên cạnh việc so sánh và xác định bằng 1 phương pháp khác).
Phẫu thuật Tirone David thay đoạn động mạch chủ bảo tồn van động mạch chủ là phẫu thuật lý tưởng hoặc phẫu thuật Bentall thay thế đoạn động mạch chủ phối hợp với thay van động mạch chủ (cơ học, sinh học, homograft). Đầu xa của đoạn mạch nhân tạo có thể lên đến sát thân động mạch cánh tay đầu bên phải. Các động mạch vành được cắm lại vào đoạn mạch nhân tạo.
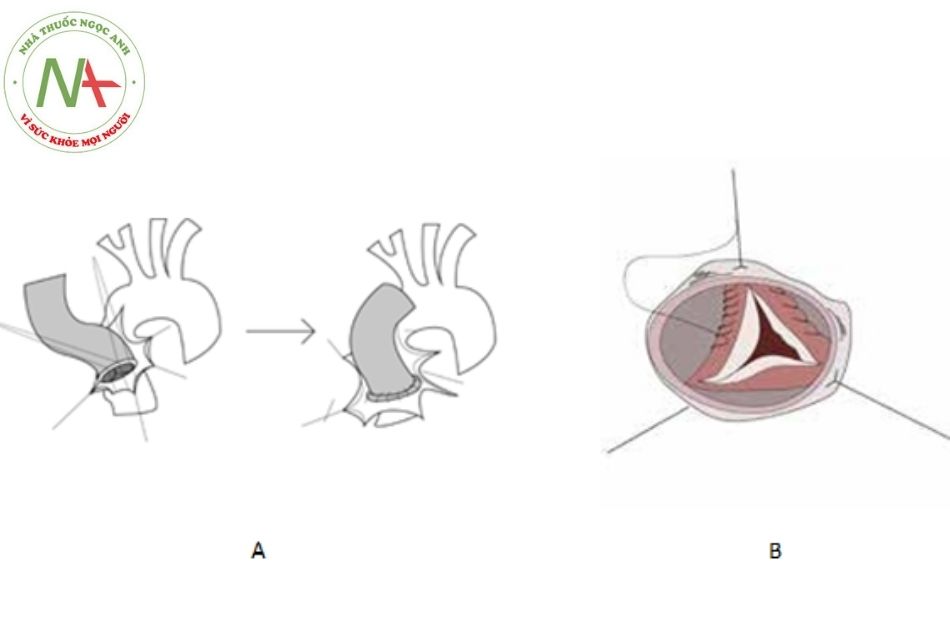
- Phẫu thuật thay đoạn động mạch chủ kèm theo van (Bentall).
- Phẫu thuật tái tạo lại gốc động mạch chủ, bảo tồn van động mạch chủ (Tirone David).
Điều trị nội khoa
Thuốc chẹn beta giao cảm được sử dụng để làm chậm tiến triển giãn động mạch chủ và làm giảm nguy cơ tách thành động mạch chủ. Chỉ định sử dụng ở tất cả các bệnh nhân Marfan ở mọi lứa tuổi khi đường kính gốc động mạch chủ ≥ 40 mm và có thể cân nhắc sử dụng ở cả những người có đường kính gốc động mạch chủ < 40 mm.
Ở những bệnh nhân không dung nạp với thuốc chẹn beta giao cảm, có thể cân nhắc sử thuốc ức chế men chuyển hoặc chẹn kênh canxi. Nếu thuốc chẹn beta không kiểm soát được huyết áp một cách hoàn toàn, nên sử dụng thêm các thuốc hạ áp khác. Thuốc chẹn beta có thể làm chậm quá trình tiến triển giãn động mạch chủ, tuy nhiên việc theo dõi và đánh giá thường xuyên đường kính động mạch chủ và chỉ định can thiệp đúng thời điểm vẫn đóng vai trò rất quan trọng.
Các biến chứng muộn
Tuổi thọ của các bệnh nhân có hội chứng Marfan giảm là do các biến chứng tim mạch, vỡ động mạch chủ hay tách thành động mạch chủ. Tuổi thọ trung bình theo các nghiên cứu ở những năm 1970 khoảng 32 tuổi. Đánh giá theo dõi định kỳ, liệu pháp điều trị thuốc chẹn beta giao cảm và điều trị phẫu thuật có chuẩn bị, tỷ lệ sống sót đã được cải thiện đáng kể với tuổi thọ trung bình khoảng 60 tuổi. Tỷ lệ tử vong do phẫu thuật có chuẩn bị là < 2%, trong khi đó ở các trường hợp mổ cấp cứu là 11,7%. Tỷ lệ sống trên 10 năm là 75%.
Theo dõi
Với các trường hợp chưa phẫu thuật, nên theo dõi hàng năm để đánh giá kích thước gốc động mạch chủ, và thường xuyên hơn với các trường hợp đường kính đạt tới 50 mm.
Nguy cơ tách thành và giãn động mạch chủ xuống, động mạch chủ bụng vẫn còn sau khi thay gốc động mạch chủ, vì vậy vẫn cần theo dõi hàng năm đối với các trường hợp đã phẫu thuật thay gốc động mạch chủ.
MỘT SỐ LƯU Ý
Dự phòng viêm nội tâm mạc nhiễm khuẩn
Dự phòng viêm nội tâm mạc nhiễm khuẩn được khuyến cáo khi có hở van hai lá do sa van, sau khi thay van động mạch chủ và gốc động mạch chủ (trong vòng 6 tháng).
Chế độ tập luyện
Tránh các môn thể thao gắng sức quá mức và đối kháng, tập các bài thể dục co cơ tĩnh được khuyến cáo để giảm áp lực lên động mạch chủ lên.
Mang thai và các vấn đề liên quan
Nguy cơ khi mang thai bao gồm cả cho mẹ và cho con, trong đó trẻ sinh ra có 50% khả năng bị hội chứng Marfan. Đối với người mẹ, có nguy cơ tiến triển những bệnh lý tim mạch, đặc biệt là giãn gốc động mạch chủ trong thai kỳ. Tăng huyết áp và tiền sản giật làm tăng nguy cơ xảy ra các biến cố tim mạch. Thuốc chẹn beta nên được duy trì trong suốt thai kỳ.
Mang thai tương đối an toàn đối với các trường hợp đường kính động mạch chủ nhỏ hơn 40 mm. Ngược lại, mang thai rất nguy hiểm đối với các trường hợp đường kính gốc động mạch chủ từ 45 mm trở lên. Phẫu thuật có chuẩn bị để thay thế gốc động mạch chủ nên được đặt ra trước khi mang thai đối với các trường hợp này. Đối với các trường hợp đường kính động mạch chủ 40-45 mm, nguy cơ giãn hoặc vỡ động mạch chủ khó lượng giá.
Nhìn chung, việc mang thai không được khuyến khích, đặc biệt nếu kích thước động mạch chủ tăng trong thời gian ngắn hoặc lịch sử gia đình có người bị vỡ hoặc tách thành động mạch chủ.
Phụ nữ mắc hội chứng Marfan nên theo dõi kích thước động mạch chủ cẩn thận trong thời gian mang thai, tần suất theo dõi được quyết định dựa trên từng cá thể với các yếu tố nguy cơ khác nhau.
Sau phẫu thuật Bentall thay gốc động mạch chủ, bệnh nhân vẫn cần được theo dõi suốt đời do nguy cơ giãn quai ĐMC hoặc giãn ĐMC xuống. Bên cạnh đó, hở van hai lá hoặc hở van động mạch chủ nặng vẫn có thể xảy ra, mặc dù ít gặp hơn.
Xem thêm: Chụp cắt lớp vi tính, cộng hưởng từ trong chẩn đoán bệnh tim bẩm sinh
KẾT LUẬN
Tử vong chủ yếu do tách thành hoặc vỡ động mạch chủ, thường là do tiến triển của giãn gốc động mạch chủ.
Tiến triển giãn gốc động mạch chủ thường không có triệu chứng, do đó cần phải đánh giá thường xuyên kích thước động mạch chủ.
Với trường hợp gốc động mạch chủ > 40 mm, thuốc chẹn beta giao cảm được chỉ định (có thể cân nhắc cho cả những người có kích thước động mạch chủ dưới 40 mm).
Phẫu thuật có chuẩn bị thay thế động mạch chủ khi đường kính động mạch chủ ≥ 55 mm hoặc 50 mm đối với bệnh nhân có nguy cơ cao.
Phẫu thuật chuẩn bị có tỷ lệ tử vong rất thấp và cải thiện rõ rệt tỷ lệ sống còn.
Sau khi phẫu thuật thay gốc động mạch chủ, bệnh nhân vẫn có nguy cơ tách thành hoặc giãn phần quai, động mạch chủ xuống, do đó vẫn cần phải theo dõi định kỳ hàng năm kích thước động mạch chủ.
HỘI CHỨNG DIGEORGE (DIGEORGE SYNDROME)
Hội chứng DiGeorge có tỉ lệ gặp khoảng 1/4000 trẻ em. Hội chứng được mô tả lần đầu tiên vào năm 1968 bởi bác sĩ người Mỹ Angelo DiGeorge. Cơ chế di truyền cơ bản đã được xác định vào năm 1981, trong đó đa số các trường hợp đều liên quan đến đột biến gây mất đoạn ở nhiễm sắc thể (NST) 22q11.2.
Trên lâm sàng, hội chứng DiGeorge là tập hợp các triệu chứng được thể hiện bằng tam chứng kinh điển bao gồm: Các dị tật tim bẩm sinh liên quan đến quá trình hình thành và phân chia thân – nón động mạch (thân chung động mạch, tứ chứng Fallot, gián đoạn quai động mạch chủ); thiểu sản tuyến ức và hạ canxi máu do hậu quả của thiểu sản tuyến cận giáp, gây ra do khiếm khuyết trong quá trình hình thành túi hầu họng.
Đột biến mất đoạn NST 22q11.2 gây nên hội chứng DiGeorge và một số hội chứng tương tự, ví dụ như hội chứng velocardiofacial (hội chứng đặc trưng bởi sự phát triển bất thường của vòm hầu họng dẫn đến sự phát triển khiếm khuyết của các tuyến cận giáp, tuyến ức và tim).
Thiểu sản tuyến ức trong hội chứng DiGeorge dẫn đến thiếu hụt các tế bào lympho T. Đa số bệnh nhân mắc hội chứng này có sự thiếu hụt tế bào lympho T mức độ nhẹ và không biểu hiện suy giảm miễn dịch trên lâm sàng. Tuy nhiên, khoảng 1% bệnh nhân hoàn toàn không có mô tuyến ức dẫn đến tình trạng suy giảm miễn dịch nặng. Thể này, được gọi là hội chứng Digeorge hoàn toàn, là thể phối hợp với tình trạng suy giảm miễn dịch nặng và đe dọa đến tính mạng nếu không điều trị bằng cấy ghép tế bào gốc tạo máu hoặc tuyến ức.
TRIỆU CHỨNG L M SÀNG VÀ CẬN L M SÀNG
Tam chứng kinh điển của hội chứng DiGeorge bao gồm các bất thường tim bẩm sinh liên quan đến thân – nón động mạch, thiểu sản tuyến ức, hạ canxi máu. Tuy nhiên, kiểu hình biến đổi rất đa dạng, thậm chí khác biệt nhau với từng cá thể ngay cả trong một gia đình. Đặc điểm và mức độ trầm trọng của các triệu chứng là không đồng nhất giữa các cá thể, và mức độ nặng của mỗi triệu chứng xuất hiện độc lập với các triệu chứng khác.
Các trẻ lớn bị hội chứng DiGeorge có thể được phát hiện thông qua các phòng khám dị tật tim bẩm sinh hoặc các phòng khám chuyên khoa sọ mặt, có thể được giới thiệu đến các bác sĩ chuyên khoa tâm bệnh vì kết quả học tập kém, hoặc có thể được chẩn đoán do nhiễm trùng thường xuyên.
Bất thường tim mạch
Dị tật liên quan đến thân – nón động mạch chiếm gần 80% các dị tật tim mạch ở bệnh nhân mắc hội chứng Digeorge, thường là những bất thường được ghi nhận đầu tiên. Thuật ngữ “thân – nón động mạch” dùng để chỉ phần xa của tim thai (túi động mạch chủ) ở giai đoạn đầu trong quá trình phát triển. Các rễ động mạch chủ và phổi sau đó phát triển từ khu vực này, và các khuyết tật trong các cấu trúc này được gọi là khuyết tật thân – nón động mạch.
Các dị tật tim phổ biến nhất chiếm 2/3 các dị tật tim gặp ở bệnh nhân hội chứng Digeorge, chúng bao gồm:
- Gián đoạn quai động mạch chủ (interrupted aortic arch)
- Thân chung động mạch (truncus arteriosus)
- Tứ chứng Fallot (tetralogy of Fallot)
- Thông liên nhĩ (atrial septal defect) hoặc thông liên thất (ventricular septal defect)
- Vòng động mạch (vascular ring)
Ba dị tật đầu tiên trong danh sách trên gây nên bệnh tim bẩm sinh có tím. Trong đó, bệnh nhân với gián đoạn quai động mạch chủ có tím khác biệt giữa chi trên và chi dưới (chi dưới tím hơn so với chi trên).
Đa số trẻ không biểu hiện triệu chứng với thông liên nhĩ hay liên thất nhỏ, tuy nhiên với những lỗ thông lớn có thể gây nên triệu chứng suy tim, chậm lớn, suy hô hấp.
Triệu chứng lâm sàng của vòng động mạch khác nhau tùy thuộc vào mức độ chèn ép khí quản và thực quản, khi tắc nghẽn đường thở nghiêm trọng dẫn đến các vấn đề khó thở, khò khè kéo dài, thở rít, suy hô hấp. Những bệnh nhân có vòng động mạch không hoàn chỉnh thậm chí có thể không biểu hiện triệu chứng.
Hạ canxi máu
Hạ canxi máu tình trạng lâm sàng có thể gây đe dọa tính mạng ở bệnh nhân hội chứng Digeorge, gây ra do thiểu sản tuyến cận giáp. Đặc biệt trên trẻ sơ sinh, hạ canxi máu thể gặp tới 60% số bệnh nhân với các biểu hiện run cơ, cơn tetany, co giật kèm phospho máu cao và nồng độ PTH rất thấp.
Biến chứng của hạ canxi máu hiếm khi xuất hiện ở giai đoạn muộn của đời sống, do mô cận giáp tăng sinh thứ phát để bù trừ. Tuy nhiên, tình trạng hạ canxi huyết có thể trở nên nghiêm trọng bởi tình trạng căng thẳng stress ở những bệnh nhân lớn tuổi. Hiếm khi các biến chứng của hạ canxi huyết là các triệu chứng xuất hiện ở người lớn với 22qDS không được chẩn đoán.
Thiểu sản tuyến ức/không có tuyến ức
Tuyến ức có thể vắng mặt ở những bệnh nhân hội chứng DiGeorge hoàn toàn. Ở bệnh nhân hội chứng DiGeorge một phần, tuyến ức có thể có, mặc dùng chúng đa phần là thiểu sản. Tuy nhiên, định nghĩa thiểu sản tuyến ức không rõ ràng vì không có đầy đủ các nghiên cứu (đặc biệt là ở trẻ em) chỉ ra kích thước của tuyến ức trong giới hạn bình thường và trong tình trạng giảm sản tuyến ức.
Các bất thường trên khuôn mặt
Các bất thường trên khuôn mặt có thể xảy ra bao gồm tai thấp và xoay ra sau, lồi mắt và chóp mũi hình củ hành.
Những phát hiện kiểu hình này không đặc hiệu cho hội chứng Digeorge. Các dấu hiệu tương tự có thể thấy ở những bệnh nhân mắc hội chứng thiếu hụt cánh ngắn nhiễm sắc thể số 22 khác, chẳng hạn như velocardiofacial, hội chứng Opitz G/BBB và hội chứng Cayler cardiofacial. Ví dụ, rối loạn hình thái mũi là một phát hiện nhất quán ở một loạt 225 bệnh nhân với đột biến mất đoạn 22q11.2. Các đặc điểm trên khuôn mặt ở hội chứng DiGeorge thường trở nên ít rõ ràng hơn theo tuổi tác.
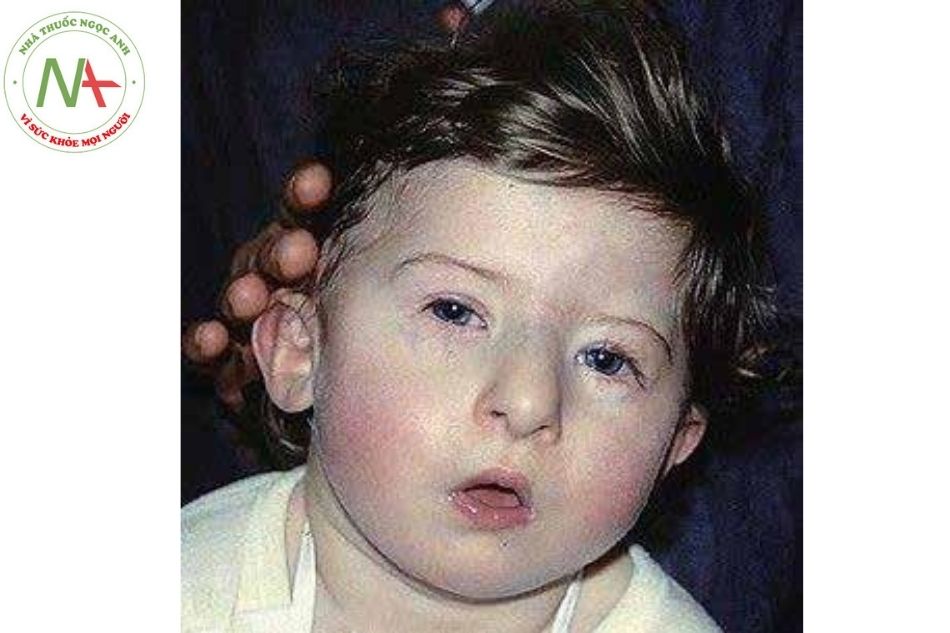
(Nguồn: Wikipedia.org)
Các vấn đề liên quan đến vòm miệng và các vấn đề liên quan
Các dấu hiệu khác ở trẻ mắc hội chứng DiGeorge bao gồm các bất thường ở vòm miệng và thanh quản cũng như các khó khăn khi bú. Các bất thường ở vòm họng bao gồm khe hở môi và khe hở vòm.
Những dấu hiệu bất thường phổ biến nhất của thiểu năng vận động hầu họng là giọng mũi nặng và trào ngược mũi.
Các vấn đề về phát triển và hành vi
Chậm phát triển xảy ra ở đại đa số bệnh nhân mắc hội chứng thiếu hụt cánh ngắn nhiễm sắc thể số 22, trong đó chậm nói đặc biệt phổ biến. Trí tuệ bệnh nhân có thể bình thường hoặc giảm tới mức thiểu năng trí tuệ nặng. Các vấn đề trong hoạt động cảm xúc xã hội và các rối loạn ức chế và chú ý có thể xảy ra.
Suy giảm miễn dịch
Thường gặp ở bệnh nhân hội chứng Digeorge, bệnh biểu hiện ở nhiều mức độ khác nhau có thể từ nhiễm trùng đường hô hấp tái phát (trong hội chứng DiGeorge một phần) đến suy giảm miễn dịch kết hợp nghiêm trọng (trong hội chứng DiGeorge hoàn toàn). Mức độ nghiêm trọng của tình trạng suy giảm miễn dịch có liên quan đến mức độ giảm sản tuyến ức.
Các vấn đề bệnh lý dị ứng và tự miễn khác
Bệnh tự miễn:
- Nhiều nghiên cứu tiến cứu và hồi cứu đã chứng minh tỷ lệ mắc các bệnh tự miễn gia tăng ở bệnh nhân hội chứng Digeorge, ước tính khoảng 10% bệnh nhân ghi nhận có một khiếm khuyết cơ bản trong điều hòa miễn dịch. Các nghiên cứu đang được tiến hành để xác định rõ hơn các cơ chế của rối loạn điều hòa miễn dịch. Suy giảm dung nạp trung ương và ngoại vi được coi là cơ chế cơ bản làm tăng bệnh tự miễn, nhưng hiện chưa được xác định rõ ràng.
- Một nghiên cứu bệnh chứng, đa trung tâm đã chứng minh các kiểu hình miễn dịch khác biệt ở những bệnh nhân bị hội chứng DiGeorge và thiếu máu tan máu tự miễn so với những người không có thiếu máu tan máu tự miễn, kết quả cho thấy sự khác biệt về miễn dịch có trước sự phát triển thiếu máu tan máu tự miễn. Quan sát này có thể chỉ ra rằng kiểu hình miễn dịch của bệnh nhân có thể cho phép tiên lượng về nguy cơ phát triển bệnh tự miễn.
- Các bệnh tự miễn khác được báo cáo với tần suất gia tăng bao gồm bệnh viêm khớp, bệnh lý ruột viêm và bệnh tuyến giáp tự miễn. Một số báo cáo đã ghi nhận rằng biểu hiện bệnh tự miễn là triệu chứng hướng đến chẩn đoán hội chứng thiếu hụt cánh ngắn nhiễm sắc thể số
Bệnh dị ứng: Bệnh dị ứng cũng có thể là một đặc điểm của hội chứng thiếu hụt cánh ngắn nhiễm sắc thể số 22. Một nghiên cứu đã chứng minh tỷ lệ mắc bệnh hen suyễn và bệnh chàm da (nhưng không bao gồm viêm mũi dị ứng) ở bệnh nhân thiếu hụt cánh ngắn nhiễm sắc thể số 22 tăng lên so với nhóm chứng anh chị em ruột. Cơ chế được nghĩ đến nhiều hơn do sự biệt hóa tế bào T hỗ trợ loại 2 (Th2).
Các bất thường khác
Bệnh nhân cũng có thể có biểu hiện bất thường về xương (ví dụ: vẹo cột sống) và cấu trúc đường sinh dục tiết niệu.
CHẨN ĐOÁN
Chẩn đoán hội chứng DiGeorge dựa trên số lượng tế bào lympho T CD3+ giảm, kết hợp với các dấu hiệu lâm sàng đặc trưng như dị tật tim bẩm sinh, hạ canxi huyết, suy giảm miễn dịch nặng hoặc chứng minh được mất đoạn nhiễm sắc thể 22q11.2 (22qDS).
Bảng dưới đây đề xuất những tiêu chí xác định ba chẩn đoán: hội chứng DiGeorge xác định, có thể mắc hội chứng DiGeorge và có khả năng mắc hội chứng Digeorge. Khoảng 90% bệnh nhân mắc hội chứng DiGeorge bị mất đoạn dị hợp tử ở nhiễm sắc thể 22q11.2, mặc dù sự mất đoạn này ít phổ biến hơn ở những người có hội chứng DiGeorge hoàn toàn.
Bảng 3. Tiêu chuẩn chẩn đoán hội chứng DiGeorge
| Chẩn đoán xác định: Bệnh nhân Nam hoặc Nữ có giảm tế bào T CD3+ dưới 500 TB/ml và ít nhất 2 trong 3 tiêu chuẩn sau:1. Bệnh lý tim bẩm sinh do bất thường quá trình hình thành thân nón động mạch
2. Hạ canxi máu xuất hiện trong 3 tuần đầu sau sinh yêu cầu phải điều trị 3. Mất đoạn trên cánh ngắn nhiễm sắc thể số 22 (22q11.2) |
| Chẩn đoán có thể: Bệnh nhân Nam hoặc Nữ có giảm tế bào T CD3+ dưới 1500 TB/ml và mất đoạn trên cánh ngắn nhiễm sắc thể số 22 (22q11.2) |
| Chẩn đoán nghi ngờ: Bệnh nhân Nam hoặc Nữ có giảm tế bào T CD3+ dưới 1500 TB/ml và ít nhất 1 trong 3 tiêu chuẩn sau:1. Bất thường tim bẩm sinh
2. Hạ canxi máu xuất hiện trong 3 tuần đầu sau sinh yêu cầu phải điều trị 3. Bộ mặt bất thường hoặc khe hở môi, khe hở vòm |
Chú thích: TB: Tế bào.
Đánh giá ở trẻ sơ sinh
Nên nghĩ đến hội chứng DiGeorge ở bất kỳ trẻ sơ sinh nào mắc dị tật tim bẩm sinh vùng thân – nón động mạch, hạ canxi huyết và/hoặc khe hở môi, khe hở vòm. Trẻ sơ sinh có các dấu hiệu và triệu chứng gợi ý nên được thực hiện các các thăm dò cận lâm sàng:
- Siêu âm tim cấp cứu nhằm phát hiện và điều trị kịp thời các tổn thương tim nghiêm trọng như gián đoạn quai động mạch chủ, chuyển gốc đại động mạch cần phá vách liên nhĩ cấp cứu.
- Nồng độ canxi và phốt pho trong huyết
- Tổng phân tích tế bào máu ngoại vi, trong đó chú ý đến số lượng bạch cầu và thành phần các dòng bạch cầu.
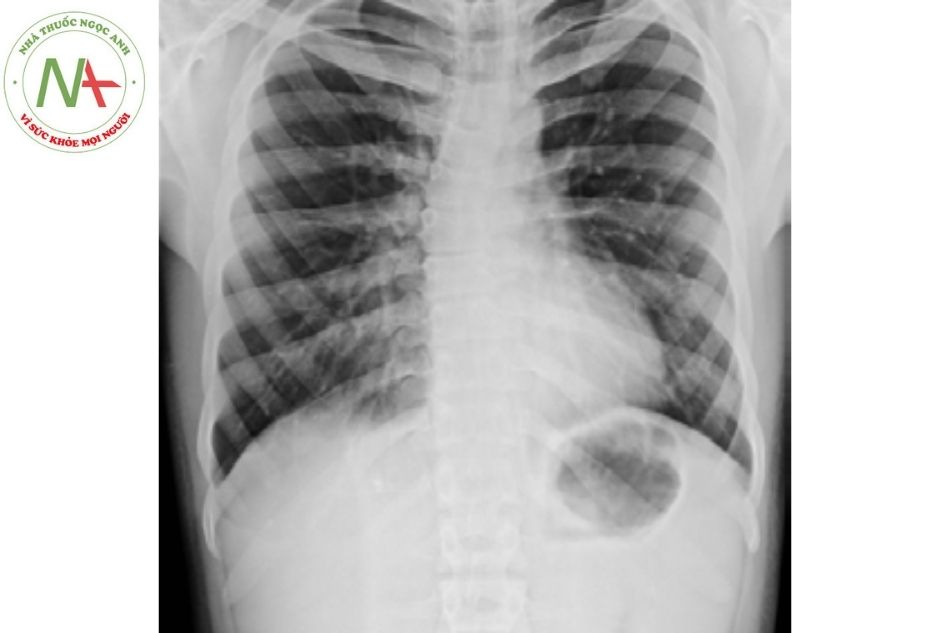
- Chụp Xquang ngực để đánh giá xem có bóng mờ tuyến ức không.
- Siêu âm thận để đánh giá các bất thường về cấu trúc thận và đường tiết niệu.
- Đếm số lượng thành phần các loại tế bào lympho: đánh giá suy giảm miễn dịch tế bào.
- Nồng độ Immunoglobulin trong máu: đánh giá suy giảm miễn dịch dịch thể.
Sự vắng mặt của bóng tuyến ức trên hình ảnh chụp ngực gợi ý suy giảm miễn dịch nghiêm trọng, mặc dù sự hiện diện của bóng tuyến ức bình thường không loại trừ hội chứng Digeorge. Mô tuyến ức nhỏ hơn bình thường là dấu hiệu của sự suy giảm miễn dịch. Tuy nhiên, dấu hiệu này không đặc hiệu vì có thể bị ảnh hưởng bởi các tình trạng nhiễm trùng mắc phải.
Khi bệnh nhân nghi ngờ suy giảm miễn dịch cần thực hiện những thăm dò chuyên sâu đánh giá chức năng của các dòng tế bào miễn dịch nhằm xác định tình trạng suy giảm miễn dịch cụ thể (suy giảm miễn dịch dịch thể, suy giảm miễn dịch tế bào,…).
Đánh giá ở người lớn
Bệnh nhân người lớn mắc hội chứng DiGeorge cần được đánh giá đầy đủ toàn diện các vấn đề sau:
- Đánh giá tâm thần và nhận thức.
- Tư vấn với nhà di truyền học y học hoặc phòng khám di truyền học có kinh nghiệm trong hội chứng Digeorge: thực hiện các xét nghiệm xác định chẩn đoán, tư vấn di truyền để bệnh nhân có kế hoạch kết hôn và sinh con (tư vấn di truyền tiền hôn nhân).
- Tổng phân tích tế bào máu trong đó chú ý đến số lượng bạch cầu và thành phần các loại tế bào bạch cầu.
- Xét nghiệm đánh giá hệ nội tiết, bao gồm định lượng hormone kích thích tuyến giáp, nồng độ canxi ion hóa trong máu được điều chỉnh pH, định lượng hormon tuyến cận giáp.
- Xét nghiệm nồng độ ure và creatinin huyết thanh đánh giá suy thận.
- Siêu âm tim đánh giá bất thường cấu trúc
- Siêu âm bụng để đánh giá các bất thường ở thận.
ĐIỀU TRỊ
Điều trị ở trẻ nhỏ
Trẻ sơ sinh với hội chứng DiGeorge thường bị đe dọa đến tính mạng bởi tổn thương tim mạch nghiêm trọng và hạ canxi máu. Ngoài ra, cần lưu ý thêm trong vấn đề ăn uống nhất là ở những trẻ có khe hở vòm (nguy cơ hít sặc, viêm phổi do trào ngược) và điều trị thiếu hụt miễn dịch ở trẻ.
Tổn thương tim mạch: với mỗi tổn thương tim mạch sẽ có các phương pháp cấp cứu và hồi sức ban đầu tùy thuộc vào giải phẫu tim mạch và toàn trạng chung của bệnh nhân.
Hạ canxi máu: điều trị sớm tình trạng hạ canxi máu ở trẻ sơ sinh giúp ổn định chức năng tim. Quản lý điều trị chung như đối với các trẻ sơ sinh khác có hạ canxi máu.
Vấn đề ăn uống: bệnh nhân được quản lý chặt chẽ vấn đề ăn uống do ở nhóm bệnh nhân này thường có các dị tật tim mạch nặng yêu cầu hạn chế lượng dịch vào cơ thể để tránh tình trạng quá tải dịch, nhưng đồng thời lại yêu cầu năng lượng cao hơn để trẻ bắt kịp tăng trưởng, đủ cân nặng có thể phẫu thuật sửa chữa các dị tật bẩm sinh. Ngoài ra khi trẻ có kèm theo khe hở môi, khe hở vòm, nguy cơ sặc khi ăn có thể gây viêm phổi do trào ngược. Do vậy vấn đề ăn uống ở các bệnh nhân hội chứng DiGeorge cần được thảo luận đa chuyên ngành bởi các bác sĩ hồi sức sơ sinh, tim mạch, dinh dưỡng và chỉnh hình nhi.
Vấn đề miễn dịch:
- Cần ghép tế bào gốc (tuyến ức hoặc tế bào gốc tạo máu) ở trẻ mắc hội chứng DiGeorge điển hình có suy giảm miễn dịch nặng .
- Các vấn đề điều trị chuyên sâu với bệnh nhân suy giảm miễn dịch cần được quản lý bởi các bác sĩ chuyên khoa về suy giảm miễn dịch. Các bệnh nhân có các vấn đề suy giảm miễn dịch khi phẫu thuật tim yêu cầu truyền máu cần lưu ý: máu truyền cho bệnh nhân cần được gạn bạch cầu tối đa, xét nghiệm loại trừ nhiễm virus CMV và chiếu xạ máu.
Quản lý điều trị lâu dài
Bệnh nhân cần được quản lý bởi nhóm các bác sĩ đa ngành trong các lĩnh vực như: tim mạch, di truyền, miễn dịch, răng hàm mặt, tai mũi họng và tâm thần.
Xem thêm: Những lưu ý và các phương pháp siêu âm tim trong thực hành lâm sàng tim bẩm sinh
TIÊN LƯỢNG
Sau ghép tế bào gốc, hầu hết các trường hợp tử vong ở bệnh nhân xảy ra trong năm đầu tiên sau ghép. Tỷ lệ sống khoảng 72% đối với bệnh nhân cấy ghép tuyến ức và cấy ghép tế bào gốc tạo máu với người cho là anh chị em ruột có hòa hợp HLA. Những bệnh nhân được ghép tế bào gốc có thời gian sống trung bình khoảng 5 năm sau ghép với tuổi thọ lớn nhất được báo cáo khoảng 20 tuổi. Tỷ lệ sống sót thấp hơn đối với ghép tế bào gốc tạo máu với nguồn cho không phải từ anh em ruột có hòa hợp HLA.
Với bệnh nhân hội chứng DiGeorge không điển hình, tiên lượng phụ thuộc vào tổn thương tim, mức độ suy cận giáp và sự phát triển trí tuệ. Tỉ lệ tử vong cao nhất thường gặp trong 6 tháng đầu do các tổn thương tim mạch nghiêm trọng.
TÀI LIỆU THAM KHẢO
1.Helmut Baumgartner, Julie De Backer, Sonya V Babu-Narayan et al, ESC Scientific Document Group, 2020 ESC Guidelines for the management of adult congenital heart disease: The Task 2. Force for the management of adult congenital heart disease of the European Society of Cardiology (ESC), European Heart Journal, https:// doi.org/10.1093/eurheartj/ehaa554.
2. Kasper, L., Fauci, A. S., Hauser, S. L., Longo, D. L. 1., Jameson, J. L., & Loscalzo, J. (2015). Harrison prin- ciples of internal medicine (19th edition.). New York: McGraw Hill Education.
3. Moss and Adams’. Heart disease in infants children and adolescents Including the fetus and young adult 8th (2013). Wolters
4. Phạm Mạnh Hùng. Lâm sàng tim mạch học (2019). Nhà xuất bản Y học.
5. Oxford Handbook of Cardiology 2.0, Oxford University Press (2012).
6. Christine M Seroogy, Jennifer M Puck, MD, DiGeorge (22q11.2 deletion) syndrome: Clinical features and diagnosis. Uptodate
7. Bassett AS, McDonald-McGinn DM, Devriendt K, et al. Practical guidelines for managing patients with 22q11.2 deletion J Pediatr 2011; 159:332.