Bệnh huyết học
Mô tả và thảo luận về sinh lý bệnh học của bệnh lý nội mô mạch máu do sốc (SHINE)
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Để tải bài viết Mô tả và thảo luận về sinh lý bệnh học của bệnh lý nội mô mạch máu do sốc (SHINE) PDF mời các bạn click vào link ở đây.
Shock induced endotheliopathy (SHINE) in acute critical illness – a unifying pathophysiologic mechanism
Các tác giả: PärIngemar Johansson1,2,3*, Jakob Stensballe1,4 and SisseRye Ostrowski1
Dịch: Nguyễn Tùng Long
Abstract
Một phần tư số bệnh nhân nặng, cấp tính như chấn thương nặng, nhiễm trùng huyết, nhồi máu cơ tim (MI) hoặc hội chứng sau ngừng tim (post cardiac arrest syndrome-PCAS) phát triển các rối loạn đông cầm máu và có liên quan đến tỷ lệ tử vong cao. Mặc dù có tình trạng bệnh không giống nhau, nhưng những bệnh nhân nặng có một số đặc điểm bệnh lý giống nhau có thể được gây ra bởi sốc. Đáp ứng này được cơ thể khởi động khi đối mặt với các tình trạng đe dọa tính mạng khác nhau, nó tương đối giống nhau và là một phần của quá trình thích nghi tiến hóa. Chúng tôi cho rằng tăng hoạt động hệ Sympatho-adrenal (kết nối giữa hệ giao cảm và tuyến thượng thận) do sốc là một yếu tố quan trọng gây ra tổn thương tế bào nội mô mạch máu và tổn thương lớp glycocalyx trong các bệnh lý nặng cấp tính, với mục đích đảm bảo tưới máu cơ quan thông qua hệ vi tuần hoàn bị tổn thương. Chúng tôi đã điều tra hơn 3000 bệnh nhân với các tình trạng khác nhau (chấn thương nặng, nhiễm trùng huyết, MI và PCAS) và đã tìm thấy mối liên hệ về mặt sinh lý bệnh giữa tăng hoạt động hệ Sympatho-adrenal, bệnh lý nội mô và kết cục kém. Bệnh này được đề xuất là bệnh lý nội mô mạch máu do sốc (SHINE). Dưới đây là các tài liệu và thảo luận về sinh lý bệnh của SHINE.
Background
Các bệnh nặng cấp tính như chấn thương, nhiễm trùng huyết, nhồi máu cơ tim (MI) và hội chứng sau ngừng tim (PCAS) ảnh hưởng đến hơn năm triệu bệnh nhân tại EU hàng năm [1]. Khoảng một phần tư số bệnh nhân nặng, cấp tính phát triển các rối loạn đông cầm máu nghiêm trọng [2, 4], ở những bệnh nhân bị chấn thương nặng được gọi là rối loạn đông máu do chấn thương (trauma induced coagulopathy-TIC) [4, 5] và ở bệnh nhân nhiễm trùng huyết và PCAS (và bởi một số bệnh nhân chấn thương [6]) có tên là đông máu nội mạch lan tỏa (disseminated intravascular coagulation-DIC) [7 trận10]. Bệnh nhân nguy kịch kèm theo rối loạn đông máu đã được báo cáo là có tỷ lệ tử vong cao gấp ba đến bốn lần so với các bệnh nhân không có rối loạn đông máu, tỷ lệ tử vong xấp xỉ 50% và gần như không đổi trong nhiều thập kỷ [4, 7, 10].
Trong các nghiên cứu trên bệnh nhân chấn thương, tăng điểm theo thang điểm Injury Severity Score (ISS) có liên quan đến sự giảm chức năng đông máu [11, 12]. Điều này có thể xem là phản quy luật tiến hóa, vì những bệnh nhân này có nguy cơ xuất huyết cao và do đó, sẽ cần một khả năng cầm máu nguyên vẹn hoặc thậm chí cải thiện lưu lượng máu. Chúng tôi đã đề xuất rằng rối loạn đông máu quan sát thấy ở những bệnh nhân này là một cơ chế bù trừ đối nghịch với pro-thrombotic nội mô mạch máu tại vi tuần hoàn do sốc (shock-induced pro thrombotic vascular endothelium) nhằm đảm bảo tưới đủ máu nội tạng trong điều kiện sốc [12, 13]. Điều quan trọng là, tổn thương nội mô hệ thống dường như là mấu chốt cho sự tiến triển của suy nội tạng và dẫn đến kết cục kém [14, 15], chỉ ra một lời giải thích có thể về mối liên hệ giữa rối loạn đông máu và kết cục kém ở bệnh nhân nặng, cấp tính [8, 10, 16 , 17].
Lớp nội mô mạch máu là một trong những cơ quan lớn nhất trong cơ thể, với tổng trọng lượng khoảng 1 kg và diện tích bề mặt khoảng 5000 m2 [18]. Các tế bào nội mô tạo thành lớp lót trong cùng của tất cả các mạch máu và bạch huyết trên toàn cơ thể của động vật có xương sống. Lớp nội mô tham gia hàng loạt các chức năng sinh lý, bao gồm kiểm soát trương lực mạch, duy trì tính lưu thông của máu (blood fluidity), điều hòa vận chuyển nước, chất dinh dưỡng và bạch cầu qua thành mạch, tham gia vào quá trình miễn dịch bẩm sinh và tập nhiễm, tạo mạch (angiogenesis) và thiết lập một hàng rào độc nhất giữa mô bên dưới và dòng máu [18]. Người ta cũng nhận ra rằng lớp nội mô đóng một vai trò quan trọng trong vô số bệnh, như xơ cứng động mạch (arteriosclerosis), các tình trạng viêm cấp tính và ác tính hoặc là yếu tố quyết định chính về sinh lý bệnh hoặc chỉ là tổn thương đi kèm [19, 20].
Trong điều kiện bình thường, lớp nội mô được chống đông bởi một loạt hệ thống chống đông máu tự nhiên bao gồm lớp bề mặt tích điện âm (negatively charged luminal surface layer), glycocalyx rất giàu heparonoid (là một glycosaminoglycans, dẫn xuất của heparin) và tương tác với antithrombin [21]. Hơn nữa, chất ức chế yếu tố mô (tissue factor pathway inhibitor-TFPI) và hệ thống protein C / thrombomodulin cũng góp phần chống đông máu nội mô cùng với sự giải phóng chất hoạt hóa plasminogen loại mô (tissue type plasminogen activator-tPA) và chất hoạt hóa plasminogen loại urokinase (urokinase-type plasminogen activator-uPA) giúp làm tan cục máu đông [22]. Do đó, chúng tôi cho rằng việc bong tróc, thoái triển và/ hoặc sự giải phóng lớp glycocalyx và các yếu tố chống đông máu tự nhiên và pro-fibrinolytic từ lớp nội mô bị tổn thương làm giảm trầm trọng khả năng đông máu ở bệnh nhân nặng, cấp tính với tình trạng sốc [12].
Ở những bệnh nhân chấn thương, TIC đã xảy ra tại hiện trường vụ tai nạn ở những bệnh nhân bị thương nặng nhất, hoặc có sốc [23] cho thấy sự đóng góp tiềm năng của hệ sympatho-adrenal với bệnh lý rối loạn đông máu “sớm” này. Cannon mô tả vào năm 1915 cách mà adrenaline, hormone được giải phóng ngay lập tức khi căng thẳng tột độ, tạo ra một đáp ứng khẩn cấp “fight or flight”, và hơn nữa hệ sympatho-adrenal kích hoạt hoạt động “điều phối các thay đổi trong việc cung cấp máu, lượng đường có sẵn và khả năng đông máu theo một sự sắp đặt là mấu chốt dẫn đến sự bộc lộ năng lượng một cách mạnh mẽ” [24]. Chúng tôi cho rằng sự tăng hoạt động hệ sympatho-adrenal và tăng quá mức nồng độ lưu hành của catecholamine gây ra do sốc không chỉ kích hoạt mà còn trực tiếp gây ra tổn thương toàn bộ lớp nội mô trên tuần hoàn hệ thống, bao gồm cả vi tuần hoàn [25, 26]. Ngoài việc tăng nguy cơ tắc mạch vi tuần hoàn thứ phát do huyết khối ở những bệnh nhân này, rò rỉ máu tại mao mạch cũng góp phần đáng kể vào sự tiến triển của bệnh do giảm thể tích máu, phù nề, thiếu oxy mô và sốc nặng, dẫn đến một vòng xoắn bệnh lý luẩn quẩn tăng hoạt động hệ sympatho-adrenal kéo dài và giải phóng một lượng lớn catecholamine, làm tổn hại thêm đến vi mạch [27] (Hình 1).
Ở đây chúng tôi mô tả và thảo luận về sinh lý bệnh học của bệnh lý nội mô mạch máu do sốc (SHINE), một bệnh thực thể mới được đề xuất với sự thay đổi về mặt sinh lý bệnh được quan sát thấy trên những bệnh nhân nặng, cấp tính đi kèm tình trạng sốc.
Shock-induced endotheliopathy (SHINE)
Chúng tôi cho rằng sốc và tác dụng của nó đối với hệ sympatho-adrenal, nội mô mạch máu, bao gồm glycocalyx và các tế bào phụ trách chức năng đông máu có trong máu lưu hành dẫn đến các đặc điểm bệnh lý đặc trưng trên lâm sàng của các bệnh nhân nặng, cấp tính dù cho bệnh lý của mỗi bệnh nhân là hoàn toàn khác nhau [6, 9, 15, 27 -30]. Tổn thương do catecholamine gây ra ở lớp nội mô mạch máu là sự phá vỡ các tế bào nội mô dẫn đến sự bong tróc lớp glycocalyx, phá vỡ các liên kết chặt cùng với sự rò rỉ máu tại giường mao mạch và tăng đông máu tại vi tuần hoàn, làm giảm quá trình trao đổi oxy do tăng áp lực tại mô và huyết khối vi mạch máu tạo ra một vòng luẩn quẩn rồi cuối cùng dẫn đến suy nội tạng. Các đáp ứng sớm mang tính tiến hóa đối với chấn thương nặng, tổn thương do bỏng và nhiễm nội độc tố là tương tự [31], cho thấy đáp ứng của cơ thể với các tình trạng nguy kịch cấp tính khác nhau có kèm theo sốc là tương đối giống nhau và là một phần của quá trình thích nghi tiến hóa [12].
Endotheliopathy of traumatic shock
Chúng tôi đã nghiên cứu các mức độ của rối loạn đông máu, sự kích hoạt hệ sympatho-adrenal (catecholamines huyết tương), tổn thương nội mô (biomarkers trong tuần hoàn của tế bào nội mô là thrombomodulin hòa tan (sTM)) và tổn thương glycocalyx (syndecan-1) trong ba nghiên cứu đoàn hệ độc lập trên bệnh nhân chấn thương nặng (n= 579) [5, 16, 32 -35]. Chúng tôi đã tìm thấy mối liên hệ chặt chẽ, độc lập giữa mức độ tổn thương cao, mức adrenaline huyết tương cao, sự suy giảm nghiêm trọng chức năng đông máu với mức syndecan-1 và sTM trong tuần hoàn cao. Adrenaline huyết tương cao là một yếu tố dự báo mạnh mẽ và độc lập với tăng tỷ lệ tử vong [32] và giảm chức năng đông máu [36] và quan trọng là, mặc dù mức độ tổn thương tương đương, bệnh nhân chấn thương có mức syndecan-1 cao nhất (phản ánh mức độ tổn thương lớp glycocalyx cao nhất) tỷ lệ tử vong cao hơn nhiều lần [16, 33]. Điều này nhấn mạnh tầm quan trọng cốt lõi về tình trạng của lớp tế bào nội mô đối với kết cục của những bệnh nhân này và cũng chỉ ra khuynh hướng liên quan đến di truyền có thể có về đáp ứng của các tế bào nội mô đối với sốc. Hơn nữa, chúng tôi đã tìm thấy một sự khác nhau đáng kể về đáp ứng của hệ sympatho-adrenal và nội mô ở những bệnh nhân chấn thương lớn tuổi và trẻ tuổi, cho thấy tuổi bệnh nhân cũng ảnh hưởng đến sự khởi động các đáp ứng, bao gồm cả mức độ của bệnh lý nội mô [37] . Điều này phù hợp với mối liên hệ được mô tả rõ ràng giữa tuổi cao và sự phá hủy kèm theo rối loạn chức năng tiến triển của lớp nội mô, với sự phá hủy nội mô nghiêm trọng nhất quan sát thấy ở những người hút thuốc và bệnh nhân mắc bệnh tiểu đường, tăng huyết áp hoặc xơ vữa động mạch [20, 38]. Ngoài tuổi tác, giới tính cũng ảnh hưởng đáng kể đến đáp ứng nội sinh của sốc chấn thương [39] và cả tuổi tác lẫn giới tính nam là những yếu tố dự báo mạnh mẽ và độc lập về suy đa tạng, một kết cục liên quan chặt chẽ đến bệnh lý nội mạc sau chấn thương nặng [40].
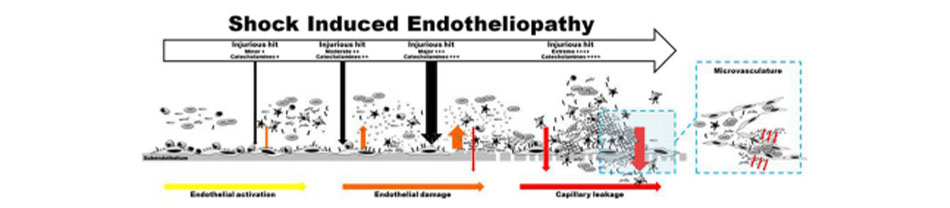
Tầm quan trọng của sự bong tróc lớp glycocalyx trong TIC đã được minh họa rõ hơn bằng phát hiện của chúng tôi rằng các bệnh nhân chấn thương nặng nhất cho thấy có bằng chứng về heparine hóa nội sinh, được đánh giá bằng phương pháp đo tính đàn hồi huyết khối toàn bộ các thành phần giống như heparin từ glycocalyx gây ra EH. Bệnh nhân với EH cũng có nhu cầu truyền máu cao hơn, nồng độ sTM cao hơn và nồng độ protein C thấp hơn so với bệnh nhân không EH. Điều này nhấn mạnh rằng bệnh lý nội mô mạch máu bao gồm tổn thương cả tế bào nội mô lẫn glycocalyx [35, 41-44]. Tuy nhiên, cần lưu ý rằng những dữ liệu thú vị này chỉ là những quan sát và do đó chỉ là giả thuyết tạo ra, và hiện tại không có bằng chứng chắc chắn nào có sẵn từ các RCT để làm rõ liệu bệnh lý nội mô mạch máu chỉ phản ánh mức độ nghiêm trọng của bệnh, lần lượt được biết là có liên quan đến rối loạn chức năng nội tạng, hoặc một mối liên quan độc lập với tổn thương nội tạng.
Endotheliopathy of septic shock
Rối loạn đông máu do nhiễm trùng huyết được biểu hiện bởi DIC trong nhiều thập kỷ có liên quan đến kết cục kém [7, 8] và rối loạn chức năng kèm theo tổn thương nội mô là dấu hiệu đưa đến kết cục kém [8, 29]. Dựa trên giả thuyết rằng rối loạn đông máu là một dấu hiệu mang tính đại diện và là kết quả của bệnh lý nội mô toàn thân, chúng tôi đã thực hiện một nghiên cứu điều tra bệnh nhân (n = 321) với các mức độ nhiễm trùng khác nhau từ hội chứng đáp ứng viêm toàn thân (SIRS) mà không có nhiễm trùng hoặc chỉ nhiễm trùng cục bộ, nhiễm trùng huyết, nhiễm trùng huyết nặng hoặc sốc nhiễm trùng [45]. Ở đây, chúng tôi thấy rằng syndecan-1 và sTM huyết tương tăng dần và đáng kể giữa các nhóm cùng với mức độ nghiêm trọng gia tăng của nhiễm trùng và tương quan đáng kể với suy nội tạng được đánh giá bằng SOFA trong tất cả các nhóm. Hơn nữa, nồng độ catecholamine trong huyết tương, syndecan-1 và sTM cao hơn đáng kể ở những bệnh nhân tử vong so với những bệnh nhân sống sót và mức độ cao của cả catecholamine, syndecan-1 và sTM đều là những yếu tố dự báo độc lập về tỷ lệ tử vong cao, liên quan đến hoạt động hệ sympathoadrenal và tổn thương nội mô với kết cục ở bệnh nhân nhiễm trùng huyết.
Bệnh nhân bị sốc nhiễm trùng theo quy định sẽ được điều trị bằng thuốc vận mạch, thường nhất là noradrenaline. Vì điều này, có thể suy đoán rằng liệu nồng độ noradrenaline điều trị cao có thúc đẩy thêm bệnh lý nội mô ở những bệnh nhân này hay không. Chúng tôi đã nghiên cứu điều này trong một nghiên cứu nhỏ trên bệnh nhân (n = 67) trong đó 21% được truyền noradrenaline tại thời điểm lấy mẫu máu [46]. Nghiên cứu đã chứng minh rằng mức độ của một loạt dấu ấn sinh học phản ánh sự tổn thương nội mô, bao gồm syndecan-1 và sTM, không khác biệt giữa bệnh nhân có hoặc không có truyền noradrenaline, cho thấy bệnh lý nội mô ở bệnh nhân sốc nhiễm trùng không bị nặng thêm do truyền catecholamine [46].
Tương tự, có một mối liên quan mạnh mẽ giữa bệnh lý nội mô và suy nội tạng trong một nghiên cứu đa trung tâm lớn trên 1103 bệnh nhân nặng chủ yếu bị nhiễm trùng huyết [47], chứng minh rằng bệnh nhân nhiễm trùng huyết có nồng độ syndecan-1 và sTM trong huyết tương cao hơn ( thể hiện mức độ tổn thương nội mô nghiêm trọng hơn ) bệnh nhân không nhiễm trùng huyết. Khi phân bệnh nhân thành bốn nhóm dựa trên mức độ sTM khi đăng ký nghiên cứu, dựa vào tỷ lệ tử vong có thể phân biệt được cả bốn nhóm trong toàn bộ thời gian nghiên cứu, với tỷ lệ tử vong cao nhất trong nhóm sTM cao nhất, ngay cả sau khi điều chỉnh các biến số khác. Quan trọng hơn, nồng độ syndecan-1 và sTM cao lần lượt dự đoán độc lập suy gan và thận, và sTM cao có liên quan nhiều hơn đến nguy cơ tiến triển suy đa tạng. Trong phân tích độ nhạy, kết cục suy tuần hoàn hoặc tử vong đã được tạo ra để khắc phục sai lệch có khả năng dẫn đến sự chủ quan trong nghiên cứu, vì thuốc tăng co bóp/ vận mạch thường được loại bỏ khỏi bệnh nhân chắc chắn sẽ tử vong. Sau khi điều chỉnh các yếu tố gây nhiễu, cả syndecan-1 và sTM đều dự đoán độc lập nguy cơ suy tuần hoàn hoặc tử vong, tiếp tục chỉ ra vai trò cốt lõi của bệnh lý nội mô đối với sinh lý bệnh liên quan đến kết cục ở bệnh nhân sốc nhiễm trùng [47].
Cuối cùng, trong một nghiên cứu đoàn hệ nhỏ hơn gồm 184 bệnh nhân nhiễm trùng huyết nặng hoặc sốc nhiễm trùng, chúng tôi đã tìm thấy một mối liên hệ độc lập giữa nồng độ syndecan-1 tuần hoàn cao và rối loạn đông máu được đánh giá bởi TEG, cho thấy rằng bệnh lý nội mô và rối loạn đông máu cũng có mặt trong nhiễm trùng huyết [45]. Mặc dù trong nhiều thập kỷ, người ta đã chứng minh rằng tổn thương nội mô là một dấu hiệu của nhiễm trùng huyết [8, 27, 29], các dữ liệu mới tiếp tục xuất hiện cho thấy thêm sinh lý bệnh học của tế bào nội mô và tổn thương lớp glycocalyx trong nhiễm trùng huyết và liên quan đến mức độ nghiêm trọng của bệnh, bao gồm việc ứng dụng các dấu ấn sinh học vào kết cục [48 -51]. Tương tự như bệnh lý nội mô do chấn thương, những phát hiện được mô tả ở đây là quan sát và do đó, không có mối quan hệ nhân quả nào được kết luận.
Endotheliopathy of cardiogenic shock and cardiac arrest
Ngừng tim là một “cú đánh trời giáng” của tình trạng thiếu máu cục bộ-tái tưới máu lên cơ thể. PCAS đại diện cho đáp ứng toàn thân đối với tổn thương thiếu máu cục bộ-tái tưới máu toàn thân [15], liên quan đến tổn thương nội mô nghiêm trọng và gây ra rối loạn chức năng vi tuần hoàn và suy tuần hoàn thứ phát do rò rỉ tại mao mạch, phù nề mô / cơ quan, thiếu oxy và tăng ái tính của tế bào máu với lớp nội mạc bị kích hoạt/ tổn thương. Hậu quả của tổn thương thiếu máu cục bộ-tái tưới máu đến lớp nội mô là đáp ứng viêm giống nhiễm trùng huyết [9, 15, 30] cuối cùng gây ra suy nội tạng tương tự như đã thấy trong nhiễm trùng huyết.
Năm 2007, Rehm và các đồng nghiệp đã cung cấp bằng chứng đầu tiên ở người về việc bong tróc lớp glycocalyx nội mô trên tình trạng thiếu máu cục bộ-tái tưới máu [52]. Trong ba nhóm bệnh nhân phẫu thuật (bệnh nhân phẫu thuật động mạch chủ ngực với ngừng tim hạ thân nhiệt sâu, bệnh nhân phẫu thuật tim với tuần hoàn ngoài cơ thể và bệnh nhân phẫu thuật phình động mạch chủ bụng) ta thấy rằng thiếu máu cục bộ toàn thể hay khu trú là kết quả của sự gia tăng ở cả syndecan-1 và heparan sulfate, là hai thành phần của glycocalyx nội mô [52], một phát hiện được xác nhận bởi các nghiên cứu sau này [53].
Bệnh nhân được cấp cứu sau khi ngừng tim thường xuyên biểu hiện sự giảm chức năng đông máu và tăng ly giải fibrin trầm trọng trong máu cùng với việc bong tróc lớp glycocalyx [54, 55]. Trong một phân tích post hoc trên 163 bệnh nhân tại trung tâm của chúng tôi, Rigshospitalet, trong thử nghiệm The Targeted Temperature Management at 33 degrees versus 36 degrees after Cardiac Arrest (TTM) [56], chúng tôi thấy rằng catecholamine tương quan mạnh với nồng độ syndecan-1 và sTM trong huyết tương, tức dấu ấn sinh học phản ánh glycocalyx nội mô và tổn thương tế bào [57]. Tỷ lệ tử vong chung trong 180 ngày là 35% và cả hai mức adrenaline và sTM huyết tương là yếu tố tiên lượng mạnh nhất và độc lập giúp dự đoán về tỷ lệ tử vong [57]. Phát hiện này phù hợp với nghiên cứu trước đây của chúng tôi trên 678 bệnh nhân bị nhồi máu cơ tim cấp ST chênh (STEMI), chứng minh rằng nồng độ adrenaline huyết tương, syndecan-1 và sTM lúc nhập viện có tương quan mạnh mẽ với nồng độ cao nhất của adrenaline và syndecan-1 trên bệnh nhân sốc tim [38]. Hơn nữa, bệnh nhân STEMI được nhận vào ICU cho thấy nồng độ syndecan-1 huyết tương cao nhất và nồng độ adrenaline, syndecan-1 và sTM cao là những yếu tố dự báo mạnh về kết cục xấu, bao gồm suy tim và tử vong [38].
Những phát hiện này cùng nhau cho thấy rằng tăng hoạt động hệ sympatho-adrenal và tổn thương nội mô là tương quan và dự đoán mạnh mẽ về tỷ lệ tử vong trên bệnh nhân sốc tim [38, 57], và hơn nữa, chỉ riêng nhồi máu cơ tim cũng gây ra tổn thương nội mô hệ thống đáng kể, có thể là do sự gia tăng song song của catecholamine trong tuần hoàn, mặc dù bằng chứng từ các thử nghiệm ngẫu nhiên tiền cứu đang thiếu [38]. Tuy nhiên, phát hiện này phù hợp với các nghiên cứu trước đây báo cáo rằng mức độ lưu hành trong tuần hoàn cao của các thành phần glycocalyx (syndecan-1, heparan sulphate) ở bệnh nhân sốc tim, với nồng độ cao là yếu tố dự báo mạnh của tăng tỷ lệ tử vong [58].
Discussion
Trong dữ liệu quan sát được trình bày ở đây từ hơn 3000 bệnh nhân mắc các loại bệnh nặng cấp tính khác nhau bao gồm các loại sốc khác nhau, nồng độ catecholamine lưu hành cao có liên quan độc lập với bệnh lý nội mô và dự đoán về kết cục xấu (cả tử vong ngắn hạn và tử vong dài hạn) và hơn nữa, bệnh lý nội mạc gây ra bởi sốc này liên quan có ý nghĩa thống kê với sự tiến triển của suy nội tạng và tử vong. Cho rằng sốc và rối loạn chức năng nội mô xảy ra ở những bệnh nhân nặng nhất, cấp tính nhất. Một cơ chế được đề xuất giữa tăng hoạt động hệ sympatho-adrenal, tình trạng lớp nội mô và bệnh lý nội mô do sốc này (SHINE) có thể là sự thống nhất về mặt sinh lý bệnh, liên quan đến kết cục, mặc dù điều này đang chờ xác nhận thêm [12, 28].
Gần đây, mối liên hệ giữa tăng hoạt động hệ sympathoadrenal và tổn thương nội mô đã được đề xuất trên mô hình động vật được gây sốc chấn thương chứng minh rằng cả thủ thuật cắt bỏ giao cảm hóa học (chemical sympathectomy ) và điều trị bằng β-blockade đều làm giảm tổn thương lớp glycocalyx nội mô và tế bào nội mô ở chuột bị rối loạn đông máu cấp tính do chấn thương. Điều này có thể cung cấp một lời giải thích cho sự thành công hạn chế của nhiều RCT lớn được tiến hành trên những bệnh nhân nặng, cấp tính trong những thập kỷ qua [60]. Trong số những bệnh nhân nhiễm trùng huyết/ sốc nhiễm trùng nghiêm trọng, hơn 30.000 bệnh nhân đã được tham gia vào các thử nghiệm lâm sàng để thử nghiệm các chất chống đông máu, chống viêm, chống nội độc tố và các chất điều chỉnh miễn dịch [60, 61]. Tuy nhiên, không một tác nhân nào có thể chứng minh hiệu quả một cách thuyết phục và vẫn chưa có thuốc mới trên thị trường dành cho nhiễm trùng huyết, mặc cho nhiều nỗ lực trên toàn thế giới. Tương tự, ở những bệnh nhân ngừng tim ngoại viện (out of hospital cardiac arrest-OHCA), hai RCT nhỏ (gồm lần lượt 77 và 136 bệnh nhân) được tiến hành vào năm 2002 đã báo cáo tỷ lệ sống sót được cải thiện ở những người được điều trị hạ thân nhiệt ở khoảng 33°C [62, 63]. Tuy nhiên, trong một RCT lớn bao gồm 939 bệnh nhân được phân ngẫu nhiên ở nhiệt độ 33°C hoặc 36°C, có sự khác biệt giữa các nhóm về tỷ lệ tử vong [56], và một metaanalysis RCT gần đây đã báo cáo không có lợi ích của hạ thân nhiệt nhẹ lên kết cục thần kinh hoặc tử vong ở những bệnh nhân OHCA [64].
Trong chấn thương, tỷ lệ tử vong đã giảm đáng kể trong khoảng 10 đến 15 năm nay do sự có mặt của phẫu thuật kiểm soát tổn thương và hồi sức cầm máu [65-67]. Một RCT đa trung tâm được thực hiện gần đây trên những bệnh nhân chấn thương có xuất huyết nặng đã cho thấy giảm đáng kể tỷ lệ tử vong sớm do xuất huyết với việc sử dụng chủ động huyết tương và tiểu cầu hơn [68]. Tương tự, một RCT gần đây đã phải dừng sớm do tỷ lệ sống sót tăng lên đáng kể trên những bệnh nhân được cấp cứu tích cực dựa trên xét nghiệm TEG máu toàn phần so với các xét nghiệm đông máu thông thường [69]. Thật không may, tỷ lệ tử vong cao ở bệnh nhân mắc TIC vẫn không thay đổi bởi những cải thiện này, làm nổi bật lên sự thất bại trong vấn đề điều trị.
Với sự thống nhất về cơ chế sinh lý bệnh tiềm năng của SHINE trên các bệnh nhân mắc các loại bệnh hiểm nghèo cấp tính khác nhau, có thể suy đoán liệu các can thiệp nhắm vào nội mạc và/ hoặc hệ sympatho-adrenal có thể có giá trị ở đây hay không. Vào năm 1978, liệu pháp β-blocker đã được báo cáo là có tác dụng có lợi đối với MI [70] và trong một phân tích tổng hợp sau đó về RCT đã nghiên cứu việc sử dụng β-blocker tiêm tĩnh mạch sớm ở bệnh nhân mắc hội chứng mạch vành cấp cho thấy có sự giảm đáng kể nguy cơ biến cố tim mạch ngắn hạn, bao gồm giảm tỷ lệ tử vong do mọi nguyên nhân [71].
Tác dụng có lợi của liệu pháp β-blocker ở những bệnh nhân này trong lịch sử đã được nhìn nhận là có liên quan đến việc giảm tỷ lệ rối loạn nhịp tim và cải thiện chức năng cơ tim. Tuy nhiên, chúng tôi suy đoán rằng việc phong bế các tác động của sự gia tăng catecholamine lên tế bào nội mô và do đó làm giảm bệnh lý nội mô hệ thống, cũng có thể góp phần cải thiện kết cục và điều này cần được nghiên cứu thêm. Trong một RCT nhỏ gần đây trên những bệnh nhân bị sốc nhiễm trùng có nhịp tim trên 95 nhịp mỗi phút, 77 bệnh nhân được chọn ngẫu nhiên để điều trị bằng βblocker IV tác dụng ngắn với Esmolol để duy trì nhịp tim từ 80 đến 94 nhịp mỗi phút trong thời gian ở ICU so với giả dược [72]. Những bệnh nhân được điều trị bằng β-blocker có tỷ lệ tử vong trong 28 ngày thấp hơn so với nhóm đối chứng (49% so với 81%, tỷ lệ rủi ro được điều chỉnh là 0,39).
Kết hợp những kết quả này có thể chỉ ra rằng tăng hoạt động hệ sympatho-adrenal có thể gây nguy hiểm cho những bệnh nhân nặng, cấp tính và theo giả thuyết được đề xuất của chúng tôi, sử dụng liệu pháp β-blocker trong các thử nghiệm trước đây có thể ngăn ngừa hoặc làm giảm nhẹ đi bệnh lý nội mô mạch máu do catecholamine, nghĩa là cải thiện tỷ lệ sống ở những bệnh nhân mắc bệnh tim bao gồm ngừng tim, chấn thương và nhiễm trùng huyết. Cần có đầy đủ những RCT mạnh để xác nhận hoặc bác bỏ giả thuyết này.
Conclusion
Bệnh lý nội mô mạch máu do sốc (SHINE) được quan sát thấy trên những bệnh nhân nặng, cấp tính và có sự thống nhất về cơ chế sinh lý bệnh tiềm năng liên quan đến kết cục kém. Tăng hoạt động hệ sympatho-adrenal dường như là yếu tố chính thúc đẩy tình trạng này.
Abbreviations
DIC: Disseminated intravascular coagulation;
MI: Myocardial infarction;
OHCA: Out-of-hospital cardiac arrest;
PCAS: Post cardiac arrest syndrome;
RCT: Randomized controlled trial;
SHINE: Shock-induced endotheliopathy;
SIRS: Systemic inflammatory response syndrome;
SOFA: Sequential organ failure assessment;
sTM: soluble Thrombomodulin;
TEG: Thrombelastography;
TFPI: Tissue actor pathway inhibitor;
TIC: Trauma-induced coagulopathy;
TTM: Targeted temperature management
Acknowledgements
Not applicable.
Funding
No funding was provided.
Availability of data and materials
Not applicable.
Authors’ contributions
PJ performed the literature review, wrote the manuscript and reviewed the final version. JS also wrote the manuscript and reviewed the final version. SO also participated in the literature review, wrote the manuscript and reviewed the final version. All authors read and approved the final manuscript.
Authors’ information
Not applicable.
Competing interests
The authors declare that they have no competing interests.
Consent for publication
Not applicable.
Ethics approval and consent to participate
Not applicable.
Author details
1 Capital Region Blood Bank, Rigshospitalet Section for Transfusion Medicine, Rigshospitalet, Copenhagen University Hospital, Blegdamsvej, 9DK-2100 Copenhagen, Denmark.
2 Department of Surgery, University of Texas Health Medical School, Houston, TX, USA.
3 Centre for Systems Biology, The School of Engineering and Natural Sciences, University of Iceland, Reykjavik, Iceland.
4 Department of Anesthesia, Centre of Head and Orthopedics, Rigshospitalet, Copenhagen University Hospital, Copenhagen, Denmark.
References
1. Mathers CD, Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med. 2006;3(11):e442.
2. Brohi K, Singh J, Heron M, Coats T. Acute traumatic coagulopathy. J Trauma. 2003;54(6):1127–30.
3. Holcomb JB, Minei KM, Scerbo ML, Radwan ZA, Wade CE, Kozar RA, Gill BS, Albarado R, McNutt MK, Khan S, et al. Admission rapid thrombelastography can replace conventional coagulation tests in the emergency department: experience with 1974 consecutive trauma patients. Ann Surg. 2012;256(3):476–86.
4. Hess JR, Brohi K, Dutton RP, Hauser CJ, Holcomb JB, Kluger Y, MackwayJones K, Parr MJ, Rizoli SB, Yukioka T, et al. The coagulopathy of trauma: a review of mechanisms. J Trauma. 2008;65(4):748–54.
5. Johansson PI, Sørensen AM, Perner A, Welling KL, Wanscher M, Larsen CF, Ostrowski SR. Disseminated intravascular coagulation or acute coagulopathy of trauma shock early after trauma? An observational study. Crit Care. 2011;15(6):R272.
6. Gando S, Sawamura A, Hayakawa M. Trauma, Shock and disseminated intravascular coagulation: lessons from the classical literature. Ann Surg. 2011;254(1):10–9.
7. Levi M, Toh CH, Thachil J, Watson HG. Guidelines for the diagnosis and management of disseminated intravascular coagulation. Br J Haematol. 2009;145(1):24–33.
8. Angus DC, van der Poll T. Severe sepsis and septic shock. N Engl J Med. 2013;369(9):840–51.
9. Adrie C, Laurent I, Monchi M, Cariou A, Dhainaou JF, Spaulding C. Post resuscitation disease after cardiac arrest: a sepsis-like syndrome? Curr Opin Crit Care. 2004;10(3):208–12.
10. Kim J, Kim K, Lee JH, Jo YH, Kim T, Rhee JE, Kang KW. Prognostic implication of initial coagulopathy in out-of-hospital cardiac arrest. Resuscitation. 2013; 84(1):48–53.
11. Johansson PI, Ostrowski SR, Secher NH. Management of major blood loss: an update. Acta Anaesthesiol Scand. 2010;54(9):1039–49.
12. Johansson PI, Ostrowski SR. Acute coagulopathy of trauma: balancing progressive catecholamine induced endothelial activation and damage by fluid phase anticoagulation. Med Hypotheses. 2010;75:564–7.
13. Faust SN, Levin M, Harrison OB, Goldin RD, Lockhart MS, Kondaveeti S, Laszik Z, Esmon CT, Heyderman RS. Dysfunction of endothelial protein C activation in severe meningococcal sepsis. N Engl J Med. 2001;345(6):408–16.
14. Levi M, van der PT, Schultz M. Systemic versus localized coagulation activation contributing to organ failure in critically ill patients. Semin Immunopathol. 2012;34(1):167–79. doi:10.1007/s00281-011-0283-7.
15. Neumar RW, Nolan JP, Adrie C, Aibiki M, Berg RA, Bottiger BW, Callaway C, Clark RS, Geocadin RG, Jauch EC, et al. Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication. A consensus statement from the International Liaison Committee on Resuscitation (American Heart Association, Australian and New Zealand Council on Resuscitation, European Resuscitation Council, Heart and Stroke Foundation of Canada, InterAmerican Heart Foundation, Resuscitation Council of Asia, and the Resuscitation Council of Southern Africa); the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology; and the Stroke Council. Circulation. 2008;118(23):2452–83.
16. Johansson PI, Henriksen HH, Stensballe J, Gybel-Brask M, Cardenas JC, Baer LA, Cotton BA, Holcomb JB, Wade CE, Ostrowski SR. Traumatic endotheliopathy: a prospective observational study of 424 severely injured patients. Ann Surg. 2016, in press.
17. Cohen MJ, Call M, Nelson M, Calfee CS, Esmon CT, Brohi K. Critical role of activated protein C in early coagulopathy and later organ failure, infection and death in trauma patients. Ann Surg. 2012;255(2):379–85.
18. Aird WC. Endothelial cells in health and disease. Florida: Taylor & Francis Group; 2005.
19. Hirase T, Node K. Endothelial dysfunction as a cellular mechanism for vascular failure. Am J Physiol Heart Circ Physiol. 2012;302(3):H499–505.
20. Broekhuizen LN, Mooij HL, Kastelein JJ, Stroes ES, Vink H, Nieuwdorp M. Endothelial glycocalyx as potential diagnostic and therapeutic target in cardiovascular disease. Curr Opin Lipidol. 2009;20(1):57–62.
21. Becker BF, Chappell D, Bruegger D, Annecke T, Jacob M. Therapeutic strategies targeting the endothelial glycocalyx: acute deficits, but great potential. Cardiovasc Res. 2010;87(2):300–10.
22. Levi M, van der Poll T. The role of natural anticoagulants in the pathogenesis and management of systemic activation of coagulation and inflammation in critically ill patients. Semin Thromb Hemost. 2008;34(5):459–68.
23. Carroll RC, Craft RM, Langdon RJ, Clanton CR, Snider CC, Wellons DD, Dakin PA, Lawson CM, Enderson BL, Kurek SJ. Early evaluation of acute traumatic coagulopathy by thrombelastography. Transl Res. 2009;154(1):34–9.
24. Cannon WB. Bodily changes in pain, hunger, fear and rage. An account of recent researches into the function of emotional excitement. 1st ed. New York and London: D. Appleton and Co; 1915.
25. Makhmudov RM, Mamedov Y, Dolgov VV, Repin VS. Catecholaminemediated injury to endothelium in rabbit perfused aorta: a quantitative analysis by scanning electron microscopy. Cor Vasa. 1985;27(6):456–63.
26. Dolgov VV, Makhmudov RM, Bondarenko MF, Repin VS. Deleterious action of adrenaline on the endothelial lining of the vessels. Arkh Patol. 1984;46(10):31–6.
27. Opal SM, van der Poll T. Endothelial barrier dysfunction in septic shock. J Intern Med. 2015;277(3):277–93.
28. Holcomb JB. A novel and potentially unifying mechanism for shock induced early coagulopathy. Ann Surg. 2011;254(2):201–2.
29. Cohen J, Vincent JL, Adhikari NK, Machado FR, Angus DC, Calandra T, Jaton K, Giulieri S, Delaloye J, Opal S, et al. Sepsis: a roadmap for future research. Lancet Infect Dis. 2015;15(5):581–614.
30. Adrie C, Adib-Conquy M, Laurent I, Monchi M, Vinsonneau C, Fitting C, Fraisse F, Dinh-Xuan AT, Carli P, Spaulding C, et al. Successful cardiopulmonary resuscitation after cardiac arrest as a “sepsis-like” syndrome. Circulation. 2002;106(5):562–8.
31. Xiao W, Mindrinos MN, Seok J, Cuschieri J, Cuenca AG, Gao H, Hayden DL, Hennessy L, Moore EE, Minei JP, et al. A genomic storm in critically injured humans. J Exp Med. 2011;208(13):2581–90.
32. Johansson PI, Stensballe J, Rasmussen LS, Ostrowski SR. High circulating adrenaline levels at admission predict increased mortality after trauma. J Trauma Acute Care Surg. 2012;72(2):428–36.
33. Johansson PI, Stensballe J, Rasmussen LS, Ostrowski SR. A high admission syndecan-1 level, a marker of endothelial glycocalyx degradation, is associated with inflammation, protein C depletion, fibrinolysis, and increased mortality in trauma patients. Ann Surg. 2011;254(2):194–200.
34. Ostrowski SR, Sorensen AM, Larsen CF, Johansson PI. Thrombelastography and biomarker profiles in acute coagulopathy of trauma: a prospective study. Scand J Trauma Resusc Emerg Med. 2011;19(1):64.
35. Ostrowski SR, Johansson PI. Endothelial glycocalyx degradation induces endogenous heparinization in patients with severe injury and early traumatic coagulopathy. J Trauma Acute Care Surg. 2012;73(1):60–6.
36. Ostrowski SR, Henriksen HH, Stensballe J, Gybel-Brask M, Cardenas JC, Baer LA, Cotton BA, Holcomb JB, Wade CE, Johansson PI: Sympathoadrenal activation and endotheliopathy are drivers of hypocoagulability and hyperfibrinolysis in trauma: A prospective observational study of 404 severely injured patients. J Trauma Acute Care Surg. 2016. In press.
37. Johansson PI, Sørensen AM, Perner A, Welling KL, Wanscher M, Larsen CF, Ostrowski SR. Elderly trauma patients have high circulating noradrenaline levels but attenuated release of adrenaline, platelets and leukocytes in response to increasing injury severity. Crit Care Med. 2012;40(6):1844–50.
38. Ostrowski SR, Pedersen SH, Jensen JS, Mogelvang R, Johansson PI. Acute myocardial infarction is associated with endothelial glycocalyx and cell damage and a parallel increase in circulating catecholamines. Crit Care. 2013;17(1):R32.
39. Schreiber MA, Differding J, Thorborg P, Mayberry JC, Mullins RJ. Hypercoagulability is most prevalent early after injury and in female patients. J Trauma. 2005;58(3):475–80.
40. Frohlich M, Lefering R, Probst C, Paffrath T, Schneider MM, Maegele M, Sakka SG, Bouillon B, Wafaisade A. Epidemiology and risk factors of multipleorgan failure after multiple trauma: an analysis of 31,154 patients from the TraumaRegister DGU. J Trauma Acute Care Surg. 2014;76(4):921–8.
41. Haywood-Watson R, Pati S, Kozar R, Faz J, Holcomb JB, Gonzalez E. Human micro-vascular barrier disruption after hemorrhagic shock. J Surg Res. 2010;158:313.
42. Haywood-Watson RJ, Holcomb JB, Gonzalez EA, Peng Z, Pati S, Park PW, Wang W, Zaske AM, Menge T, Kozar RA. Modulation of syndecan1 shedding after hemorrhagic shock and resuscitation. PLoS One. 2011;6(8):e23530.
43. Rahbar E, Cardenas JC, Baimukanova G, Usadi B, Bruhn R, Pati S, Ostrowski SR, Johansson PI, Holcomb JB, Wade CE. Endothelial glycocalyx shedding and vascular permeability in severely injured trauma patients. J Transl Med. 2015;13:117. doi:10.1186/s12967-015-0481-5.:117-0481.
44. Di Battista AP, Rizoli SB, Lejnieks B, Min A, Shiu MY, Peng HT, Baker AJ, Hutchison MG, Churchill N, Inaba K, et al. Sympathoadrenal activation is associated with acute traumatic coagulopathy and endotheliopathy in isolated brain injury. Shock. 2016;46:96–103.
45. Ostrowski SR, Haase N, Müller RB, Moller MH, Pott FC, Perner A, Johansson PI. Association between biomarkers of endothelial injury and hypocoagulability in patients with severe sepsis. A prospective study. Crit Care. 2015;19(1):191–200.
46. Johansson PI, Haase N, Perner A, Ostrowski SR. Association between sympathoadrenal activation, fibrinolysis and endothelial damage in septic patients: a prospective study. J Crit Care. 2014;29(3):327–33.
47. Johansen ME, Johansson PI, Ostrowski SR, Bestle MH, Hein L, Jensen ALG, Soe-Jensen P, Andersen MH, Steensen M, Mohr T, et al. Profound endothelial damage predicts impending organ failure and death in sepsis. Semin Thromb Hemost. 2015;41(1):16–25.
48. Hayashida K, Chen Y, Bartlett AH, Park PW. Syndecan-1 is an in vivo suppressor of Gram-positive toxic shock. J Biol Chem. 2008;283(29): 19895–903.
49. Steppan J, Hofer S, Funke B, Brenner T, Henrich M, Martin E, Weitz J, Hofmann U, Weigand MA. Sepsis and major abdominal surgery lead to flaking of the endothelial glycocalix. J Surg Res. 2011;165(1):136–41.
50. Connolly-Andersen AM, Thunberg T, Ahlm C. Endothelial activation and repair during hantavirus infection: association with disease outcome. Open Forum Infect Dis. 2014;1(1):ofu027.
51. Schmidt EP, Overdier KH, Sun X, Lin L, Liu X, Yang Y, Ammons LA, Hiller TD, Suflita MA, Yu Y, et al. Urinary glycosaminoglycans predict outcomes in septic shock and ARDS. Am J Respir Crit Care Med. 2016;194:439–49.
52. Rehm M, Bruegger D, Christ F, Conzen P, Thiel M, Jacob M, Chappell D, Stoeckelhuber M, Welsch U, Reichart B, et al. Shedding of the endothelial glycocalyx in patients undergoing major vascular surgery with global and regional ischemia. Circulation. 2007;116(17):1896–906.
53. Bruegger D, Rehm M, Abicht J, Paul JO, Stoeckelhuber M, Pfirrmann M, Reichart B, Becker BF, Christ F. Shedding of the endothelial glycocalyx during cardiac surgery: on-pump versus off-pump coronary artery bypass graft surgery. J Thorac Cardiovasc Surg. 2009;138(6):1445–7.
54. Schochl H, Cadamuro J, Seidl S, Franz A, Solomon C, Schlimp CJ, Ziegler B. Hyperfibrinolysis is common in out-of-hospital cardiac arrest: results from a prospective observational thromboelastometry study. Resuscitation. 2013; 84(4):454–9.
55. Grundmann S, Fink K, Rabadzhieva L, Bourgeois N, Schwab T, Moser M, Bode C, Busch HJ. Perturbation of the endothelial glycocalyx in post cardiac arrest syndrome. Resuscitation. 2012;83(6):715–20.
56. Nielsen N, Wetterslev J, Cronberg T, Erlinge D, Gasche Y, Hassager C, Horn J, Hovdenes J, Kjaergaard J, Kuiper M, et al. Targeted temperature management at 33 degrees C versus 36 degrees C after cardiac arrest. N Engl J Med. 2013;369(23):2197–206.
57. Johansson PI, Bro-Jeppesen J, Kjaergaard J, Wanscher M, Hassager C, Ostrowski SR. Sympathoadrenal activation and endothelial damage are inter correlated and predict increased mortality in patients resuscitated after out-of-hospital cardiac arrest: a post hoc sub-study of patients from the TTM-trial. PLoS One. 2015;10(3):e0120914.
58. Jung C, Fuernau G, Muench P, Desch S, Eitel I, Schuler G, Adams V, Figulla HR, Thiele H. Impairment of the endothelial glycocalyx in cardiogenic shock and its prognostic relevance. Shock. 2015;43(5):450–5.
59. Xu L, Yu WK, Lin ZL, Tan SJ, Bai XW, Ding K, Li N. Chemical sympathectomy attenuates inflammation, glycocalyx shedding and coagulation disorders in rats with acute traumatic coagulopathy. Blood Coagul Fibrinolysis. 2015;26:152–60.
60. Opal SM, Dellinger RP, Vincent JL, Masur H, Angus DC. The next generation of sepsis clinical trial designs: what is next after the demise of recombinant human activated protein C?*. Crit Care Med. 2014;42(7):1714–21.
61. Angus DC. The search for effective therapy for sepsis: back to the drawing board? JAMA. 2011;306(23):2614–5.
62. Bernard SA, Gray TW, Buist MD, Jones BM, Silvester W, Gutteridge G, Smith K. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med. 2002;346(8):557–63.
63. The Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med. 2002;346(8):549–56.
64. Villablanca PA, Makkiya M, Einsenberg E, Briceno DF, Panagiota C, Menegus M, Garcia M, Sims D, Ramakrishna H. Mild therapeutic hypothermia in patients resuscitated from out-of-hospital cardiac arrest: a meta-analysis of randomized controlled trials. Ann Card Anaesth. 2016;19(1):4–14.
65. Johansson PI, Sørensen AM, Larsen CF, Windeløv NA, Stensballe J, Perner A, Rasmussen LS, Ostrowski SR. Low hemorrhage-related mortality in trauma patients in a Level I Trauma Centre employing transfusion packages and early thrombelastography-directed hemostatic resuscitation with plasma and platelets. Transfusion. 2013;53(12):3088–99.
66. Johansson PI, Oliveri R, Ostrowski SR. Hemostatic resuscitation with plasma and platelets in trauma. A meta-analysis. J Emerg Trauma Shock. 2012;5(2):120–5.
67. Johansson PI, Stensballe J, Oliveri R, Wade CE, Ostrowski SR, Holcomb JB. How I treat patients with massive hemorrhage. Blood. 2014;124(20):352–8.
68. Holcomb JB, Tilley BC, Baraniuk S, Fox EE, Wade CE, Podbielski JM, del Junco DJ, Brasel KJ, Bulger EM, Callcut RA, et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: the PROPPR randomized clinical trial. JAMA. 2015;313(5):471–82.
69. Gonzalez E, Moore EE, Moore HB, Chapman MP, Chin TL, Ghasabyan A, Wohlauer MV, Barnett CC, Bensard DD, Biffl WL, et al. Goal-directed hemostatic resuscitation of trauma-induced coagulopathy: a pragmatic randomized clinical trial comparing a viscoelastic assay to conventional coagulation assays. Ann Surg. 2015;263(6):1051–9.
70. Norris RM, Clarke ED, Sammel NL, Smith WM, Williams B. Protective effect of propranolol in threatened myocardial infarction. Lancet. 1978;2(8096):907–9.
71. Chatterjee S, Chaudhuri D, Vedanthan R, Fuster V, Ibanez B, Bangalore S, Mukherjee D. Early intravenous beta-blockers in patients with acute coronary syndrome–a meta-analysis of randomized trials. Int J Cardiol. 2013;168(2):915–21.
72. Morelli A, Ertmer C, Westphal M, Rehberg S, Kampmeier T, Ligges S, Orecchioni A, D’Egidio A, D’Ippoliti F, Raffone C, et al. Effect of heart rate control with esmolol on hemodynamic and clinical outcomes in patients with septic shock: a randomized clinical trial. JAMA. 2013;310(16):1683–91.
Xem thêm:
Các nguyên nhân liên quan đến máy thở của chấn thương phổi sức mạnh
Thông khí không xâm lấn trong bệnh phổi tắc nghẽn mãn tính
Tiêu cơ vân và Tổn thương thận cấp
Những tranh cãi về liệu pháp điều trị ngoài cơ thể không do thận trên bệnh nhân COVID-19 nguy kịch.
