Bệnh huyết học
Làm thế nào để tích hợp các biến số huyết động trong quá trình hồi sức sốc nhiễm trùng?
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Làm thế nào để tích hợp các biến số huyết động trong quá trình hồi sức sốc nhiễm trùng? – Tải file PDF Tại đây.
Tác giả Jean-Louis Teboul.
Biên dịch: Ths. BS. Hồ Hoàng Kim.
Hồi sức sốc nhiễm trùng là một vấn đề phức tạp vì các rối loạn tim mạch đặc trưng cho sốc nhiễm trùng khác nhau ở mỗi bệnh nhân và cũng có thể thay đổi theo thời gian ở cùng một bệnh nhân. Do đó, các liệu pháp khác nhau (dịch truyền, thuốc vận mạch và thuốc tâng co bóp) nên được điều chỉnh riêng biệt và cẩn thận để cung cấp phương pháp điều trị phù hợp và cá nhân hóa. Việc thực hiện kịch bản này yêu cầu thu thập và đối chiếu tất cả thông tin khả thi, bao gồm nhiều biến số huyết động. Trong bài viết đánh giá này, chúng tôi đề xuất một cách tiếp cận hợp lý từng bước để tích hợp các biến số huyết động có liên quan và đưa ra phương pháp điều trị thích hợp nhất cho sốc nhiễm trùng.
Giới thiệu
Sốc nhiễm trùng được đặc trưng bởi sự thay đổi sâu sắc của hệ thống tim mạch ở cấp độ vi tuần hoàn và hệ thống. Các bất thường về tuần hoàn hệ thống bao gồm giảm thể tích tuần hoàn, giảm trương lực mạch máu và rối loạn chức năng cơ tim. Rối loạn huyết động cuối cùng dẫn đến tình trạng thiếu oxy mô và suy đa cơ quan. Mục đích của việc hồi sức bệnh nhân bị sốc nhiễm trùng là điều chỉnh tình trạng thiếu oxy ở mô, tình trạng này có thể liên quan đến việc giảm cung cấp oxy cho mô và/hoặc suy giảm khả năng chiết xuất oxy tại chỗ. Việc giảm cung cấp oxy cho mô có thể là thứ phát do giảm cung cấp oxy toàn bộ (DO2) và/hoặc giảm lưu lượng máu vi tuần hoàn và/hoặc do áp lực tưới máu cơ quan không đủ.
Việc điều chỉnh tình trạng thiếu oxy ở mô có thể đạt được thông qua việc tăng DO2 hoặc khôi phục đủ áp lực tưới máu cơ quan, vì hiện tại không có biện pháp can thiệp điều trị nào đối với vi tuần hoàn và/hoặc chiết xuất oxy. Trong tất cả các trường hợp sốc nhiễm trùng, tình trạng giảm thể tích máu tuyệt đối và/hoặc tương đối đều xuất hiện và góp phần gây ra tình trạng thiếu oxy mô. Vì vậy, việc truyền dịch tĩnh mạch (IV) cần được thực hiện khẩn cấp; tuy nhiên, trong hầu hết các trường hợp, điều này là không đủ để khôi phục lại tình trạng huyết động đầy đủ. Mức độ nghiêm trọng của từng thành phần của suy tuần hoàn (giảm thể tích máu, giảm trương lực mạch máu, suy yếu cơ tim, thay đổi vi tuần hoàn và suy giảm khả năng trích xuất oxy) khác nhau giữa các bệnh nhân và ở mỗi bệnh nhân theo thời gian. Vì vậy, điều quan trọng là phải đánh giá mức độ của từng rối loạn tim mạch. Khám lâm sàng không thể xác định đầy đủ thành phần chủ yếu của suy tuần hoàn, do đó cần phải xác định các biến số khác bằng phương pháp không xâm lấn hoặc xâm lấn.
Hơn nữa, việc tích hợp nhiều biến số huyết động có thể tạo điều kiện thuận lợi cho việc đánh giá cải thiện sự cân bằng lợi ích/nguy cơ của bất kỳ can thiệp huyết động nào và cho phép lựa chọn liệu pháp thích hợp nhất.
Các biến số huyết động có liên quan trong quá trình hồi sức sốc nhiễm trùng
Huyết áp động mạch
Ở những bệnh nhân bị sốc, nên đặt ống thông động mạch để theo dõi huyết áp theo thời gian thực [1,2]. Do đó, có thể thu được các giá trị đáng tin cậy liên tục của huyết áp tâm thu (SAP), huyết áp tâm trương (DAP), huyết áp trung bình (MAP) và áp lực mạch (PP), tất cả đều cung cấp thông tin quan trọng về tình trạng tim mạch.
SAP – huyết áp tâm thu
Trong số tất cả các thông số có sẵn tại giường, SAP là ước tính tốt nhất về hậu gánh thất trái. SAP thường được sử dụng trong một số định nghĩa về sốc hơn là mục tiêu điều trị ở trạng thái sốc. SAP ở khu vực trung tâm thấp hơn so với khu vực ngoại vi do hiện tượng khuếch đại sóng xung (PWA – pulse wave amplification); do đó, SAP đo được ở động mạch đùi thấp hơn ở động mạch quay. Tuy nhiên, hiện tượng PWA giảm dần ở bệnh nhân cao tuổi.[3]
DAP – huyết áp tâm trương
DAP có hai ý nghĩa chính đối với thực hành lâm sàng. Đầu tiên, DAP là một dấu hiệu tốt để đánh giá trương lực động mạch.[3] Trương lực động mạch giảm có liên quan đến giảm DAP và cũng có thể do nhịp tim chậm (thời gian tâm trương kéo dài) hoặc độ cứng động mạch rõ rệt. Ở bệnh nhân bị sốc và nhịp tim bình thường hoặc cao, DAP thấp biểu thị rõ ràng trương lực động mạch giảm rõ rệt, điều này rất cần thiết để xác định loại sốc và biết liệu có nên bắt đầu điều trị thuốc vận mạch sớm hay không. Giá trị DAP tùy ý <40 mmHg đã được đề xuất để xác định thời điểm thích hợp để bắt đầu sử dụng thuốc vận mạch.[4] Thứ hai, DAP là áp lực ngược dòng tưới máu thất trái. Ở những bệnh nhân mắc bệnh động mạch vành, DAP thấp có thể gây ra thiếu máu cục bộ cơ tim và do đó là một lý do khác để bắt đầu sử dụng thuốc vận mạch. Do hiện tượng PWA, DAP đo được ở động mạch đùi cao hơn một chút so với động mạch quay.
MAP – huyết áp động mạch trung bình
Không giống như SAP và DAP, MAP gần như không đổi trong lòng động mạch từ động mạch chủ đến các tiểu động mạch; về bản chất, ở động mạch chủ cao hơn một chút so với ở ngoại vi. Về mặt lâm sàng, MAP phản ánh áp lực tưới máu trên dòng của hầu hết các cơ quan quan trọng. Trong trường hợp MAP thấp hơn ngưỡng tự điều hòa, tưới máu đến các cơ quan như não và thận có thể bị giảm, ngay cả khi cung lượng tim cao. Trong điều kiện khỏe mạnh, MAP cao hơn rõ rệt so với áp lực tĩnh mạch trung tâm (CVP), phản ánh áp lực tưới máu hạ lưu của hầu hết các cơ quan, do đó MAP được coi là áp lực tưới máu cơ quan. Tuy nhiên, ở một số trạng thái sốc như sốc tim, MAP thấp và CVP cao, nghĩa là MAP ước tính dưới mức áp lực tưới máu cơ quan; trong những trường hợp như vậy, sự khác biệt giữa MAP và CVP (tức là MAP-CVP) được coi là áp lực tưới máu cơ quan.[5]
PP – áp lực mạch
PP ở mức độ động mạch chủ phụ thuộc vào thể tích nhát bóp và độ cứng của động mạch.[6] Ở bệnh nhân cao tuổi, PP ngoại vi phản ánh chính xác PP trung tâm do hiện tượng PWA suy giảm.[3] Ở những bệnh nhân như vậy, các động mạch lớn bị cứng và PP thường tăng trừ khi thể tích nhát bóp thấp. Do đó, PP bình thường (40-50 mmHg) và fortiori (PP thấp hơn bình thường) ở những bệnh nhân này là dấu hiệu của thể tích nhát bóp thấp.
Lactate máu
Nồng độ lactate trong máu tăng có thể là do sản xuất quá mức (do tăng chuyển hóa kỵ khí, tăng chuyển hóa hiếu khí hoặc rối loạn chức năng ty thể) hoặc do giảm độ thanh thải. Trong nhiễm trùng huyết và sốc nhiễm trùng, tất cả các cơ chế này có thể xảy ra và do đó, tăng lactate máu không phải lúc nào cũng do thiếu oxy mô. Tuy nhiên, tăng lactate máu có liên quan đến kết quả kém và việc giảm nồng độ lactate trong máu sau can thiệp cho thấy chiến lược điều trị được lựa chọn là có hiệu quả.
Độ bão hòa oxy trong máu tĩnh mạch hỗn hợp (SvO2) và độ bão hòa oxy trong tĩnh mạch trung tâm
SvO2 liên quan đến độ bão hòa oxy trong máu động mạch (SaO2), lượng oxy tiêu thụ (VO2), cung lượng tim và nồng độ hemoglobin (Hb) theo công thức rút ra từ phương trình Fick áp dụng cho oxy: SvO2 = SaO2 – [VO2/ (cung lượng tim) X Hb X 13,4)]. Như vậy, SvO2 là biến tích hợp phản ánh sự cân bằng giữa DO2 và VO2. Ở người khỏe mạnh, SvO2 dao động từ 70% đến 75%. SvO2 giảm có thể do giảm SaO2 hoặc Hb hoặc do tăng VO2 nếu cung lượng tim không bù đắp cho những thay đổi này. Ngoài ra, sự giảm SvO2 có thể là do chính sự giảm cung lượng tim và dự kiến sẽ không có sự bù đắp cấp tính nào từ các biến số khác xảy ra trong tình huống này.
Sự gia tăng SvO2 trên mức bình thường thường liên quan đến việc giảm khả năng chiết tách oxy dẫn đến giảm VO2. Trong bối cảnh này, giá trị SvO2 có thể rất cao, đặc biệt nếu DO2 cao do cung lượng tim tăng. Tình trạng sau này có thể gặp trong sốc nhiễm trùng tăng động. Những điểm này nhấn mạnh rằng (1) SvO2 không phải là dấu hiệu đáng tin cậy về mức độ phù hợp giữa DO2 và nhu cầu oxy toàn cầu ở trạng thái sốc khi VO2 thấp hơn nhu cầu oxy và (2) việc giải thích SvO2 có thể gây hiểu nhầm ở trạng thái sốc do khả năng trích xuất oxy bị suy giảm. Vì vậy, mức SvO2 bình thường cao không loại trừ sự hiện diện của tình trạng thiếu oxy ở mô.[8] Cuối cùng, trong quá trình hồi sức ở trạng thái sốc, sự gia tăng VO2 được cho là do sự gia tăng DO2 sao cho SvO2 không thay đổi rõ rệt cho đến khi DO2 vượt quá giá trị tới hạn. Trên giá trị này, việc tăng thêm DO2 sẽ không làm thay đổi VO2 nữa và SvO2 sẽ tăng song song với mức tăng DO2 [8].
SvO2 cần ống thông động mạch phổi, việc sử dụng loại ống này ngày càng giảm; do đó, người ta đã đề xuất thay thế SvO2 bằng độ bão hòa oxy trong máu tĩnh mạch trung tâm (ScvO2). Mặc dù cả hai biến đều đại diện cho các thực thể khác nhau, nhưng vẫn có sự thống nhất có thể chấp nhận được giữa các biến [9] và những thay đổi của chúng [10]. ScvO2 không còn được khuyến nghị làm mục tiêu điều trị trong việc hồi sức sốc nhiễm trùng do Surviving Sepsis Campin; tuy nhiên, không nên bỏ hoàn toàn việc sử dụng biến số này [1,11]. Thật vậy, ScvO2 bình thường hoặc ScvO2 cao hơn bình thường cho thấy khả năng chiết xuất oxy bị suy giảm hoặc suy giảm rõ rệt. Trong những điều kiện như vậy, thật viển vông khi mong đợi sự điều chỉnh tình trạng thiếu oxy ở mô sau khi tăng DO2. Ngược lại, ScvO2 thấp hơn bình thường gợi ý rõ ràng rằng DO2 không đủ và cần áp dụng các biện pháp để tăng chỉ số này, chủ yếu thông qua việc tăng cung lượng tim.[11] Vì vậy, kiến thức về ScvO2 sẽ rất hữu ích cho việc định hướng chiến lược hồi sức.
=> Đọc thêm: Chảy máu khi điều trị thuốc chống đông cần xử trí thế nào?.
Máu tĩnh mạch hỗn hợp (hoặc máu tĩnh mạch trung tâm); Độ khác biệt về áp lực CO2 trong máu tĩnh mạch – động mạch
Theo phương trình Fick áp dụng cho carbon dioxide (CO2), việc sản xuất CO2 (VCO2) bằng tích của cung lượng tim và sự khác biệt giữa hàm lượng CO2 hỗn hợp trong máu tĩnh mạch và hàm lượng CO2 trong máu động mạch. Giả sử rằng mối quan hệ giữa hàm lượng CO2 và áp suất CO2 (PCO2) gần như tuyến tính, người ta đã đề xuất thay thế áp suất CO2 bằng hàm lượng CO2 trong phương trình Fick. Do đó, sự khác biệt giữa PCO2 trong máu tĩnh mạch hỗn hợp và PCO2 trong máu động mạch (còn gọi là khoảng cách PCO2) bằng k X VCO2/cung lượng tim, trong đó k là yếu tố xác định mối quan hệ giữa hàm lượng CO2 và PCO2 [12]. Do đó, khoảng trống PCO2 sẽ tăng khi VCO2 tăng bất thường và cung lượng tim không thể bù đắp cho sự gia tăng này (ví dụ: khi tập thể dục nặng) hoặc khi lưu lượng tĩnh mạch (cung lượng tim) không đủ để loại bỏ CO2 được tạo ra ở ngoại vi (ứ đọng hiện tượng CO2). Ở điều kiện bình thường, khoảng cách PCO2 là 6 mmHg.
Trong trạng thái sốc giảm động lực (giảm cung lượng tim), khoảng cách PCO2 phải tăng lên, trong khi ở trạng thái sốc tăng động lực (cung lượng tim bình thường hoặc cao), khoảng cách PCO2 phải bình thường.[13]
Do đó, khoảng cách PCO2 bình thường cho thấy rằng mục tiêu tăng cung lượng tim không thể là ưu tiên trong chiến lược điều trị, trong khi khoảng cách PCO2 cao cho thấy rằng tăng cung lượng tim có thể là một lựa chọn điều trị thích hợp.
Các chỉ số đánh giá đáp ứng dịch truyền
Khoảng một nửa số bệnh nhân nguy kịch là những người có đáp ứng với dịch truyền, tức là cung lượng tim của họ tăng >15% sau khi truyền dịch.[14] Truyền dịch có thể dẫn đến những tác động có hại (ví dụ, phù phổi và phù mô kẽ mô) ở những người không đáp ứng với dịch truyền và tình trạng quá tải dịch nói chung có liên quan đến kết quả kém ở những bệnh nhân bị bệnh nặng [15-17]; do đó, điều quan trọng là phải dự đoán khả năng đáp ứng với dịch truyền trước khi truyền bất kỳ dịch truyền nào. Nhiều chỉ số hoặc test về khả năng đáp ứng dịch đã được phát triển trong hai thập kỷ qua. Một số chỉ số này sử dụng tương tác tim-phổi ở bệnh nhân thở máy. Nguyên tắc chung là nếu tim đáp ứng tiền tải, thể tích nhát bóp sẽ thay đổi rõ rệt trong chu kỳ hô hấp do những thay đổi về tiền tải.[18]
Vì những thay đổi về PP có thể phản ánh những thay đổi về thể tích nhát bóp, [19] những thay đổi về PP trong quá trình thở máy, được gọi là biến thiên PP (PPV), đã được đề xuất như một chỉ số về khả năng đáp ứng dịch, [20] và giá trị của chỉ số này trong nhiều trường hợp nghiên cứu đã được báo cáo trong các phân tích tổng hợp [21,22]. PPV có thể được tính toán tự động và hiển thị theo thời gian thực trên màn hình của thiết bị theo dõi huyết động đầu giường. Ưu điểm đáng chú ý của PPV là nó có thể được lấy từ một ống thông động mạch đơn giản mà không cần bất kỳ thiết bị theo dõi cung lượng tim phức tạp nào. Tuy nhiên, có nhiều yếu tố hạn chế việc sử dụng PPV để dự đoán khả năng đáp ứng dịch, chẳng hạn như sự hiện diện của rối loạn nhịp tim, hoạt động thở tự phát kéo dài, thông khí thể tích khí lưu thông thấp và độ giãn nở của hệ hô hấp thấp.[23]
Gần đây, người ta đã đề xuất tính toán những thay đổi về PPV trong thử thách thể tích khí lưu thông bao gồm việc tăng thể tích khí lưu thông tạm thời (từ 6 mL/kg lên 8 mL/kg) để khắc phục giới hạn của PPV trong trường hợp thông khí thể tích khí lưu thông thấp. [24] Kết quả tuyệt vời đã được báo cáo ở những bệnh nhân bị bệnh nặng ở tư thế nằm ngửa [25,26] và ở tư thế nằm sấp [27] và ở những bệnh nhân trải qua phẫu thuật [28,29].
Thử nghiệm tắc nghẽn cuối thì thở ra là một phương pháp khác sử dụng tương tác tim-phổi ở bệnh nhân thở máy và có thể dự đoán một cách đáng tin cậy khả năng đáp ứng dịch [30], ngay cả trong trường hợp hoạt động thở tự nhiên [31] hoặc độ giãn nở phổi thấp [32].
Thử nghiệm nâng cao chân thụ động (PLR), không sử dụng tương tác tim phổi, dự đoán khả năng đáp ứng dịch một cách đáng tin cậy trong mọi tình huống [33] ngoại trừ các trường hợp tăng áp lực trong ổ bụng [34]. Thử nghiệm PLR bao gồm việc di chuyển giường của bệnh nhân từ vị trí nửa nằm sang vị trí mà thân và đầu nằm ngang, và chi dưới nâng cao 45°. Thao tác này dẫn đến sự dịch chuyển máu tĩnh mạch từ chi dưới và bụng về phía ngực. Thử thách thể tích nội sinh này có tác dụng tương tự như việc nạp dịch lên các yếu tố quyết định lượng dịch hồi lưu tĩnh mạch (áp lực hệ thống trung bình, CVP và kháng trở hồi lưu tĩnh mạch) [35] và do đó là một thử nghiệm tuyệt vời để dự đoán khả năng đáp ứng dịch. Tuy nhiên, một số quy tắc phải được tôn trọng để kết quả kiểm tra PLR được diễn giải chính xác.[36] Nên tránh kích thích giao cảm để ngăn chặn sự gia tăng cung lượng tim không liên quan đến việc huy động thụ động máu tĩnh mạch và có thể dẫn đến giải thích sai lệch. Việc không tăng nhịp tim trong PLR đảm bảo rằng kết quả xét nghiệm có thể được diễn giải chính xác. Hơn nữa, vì tác dụng của PLR là nhất thời nên việc đánh giá huyết động theo thời gian thực là bắt buộc. Hầu hết các nghiên cứu cho thấy độ chính xác tuyệt vời của PLR trong việc dự đoán khả năng đáp ứng dịch truyền đã sử dụng những thay đổi theo thời gian thực của cung lượng tim trong PR [33]. Những thay đổi về cung lượng tim dựa trên dạng sóng áp lực động mạch [32] hoặc tích phân vận tốc-thời gian (VTI) bằng siêu âm tim [37] đặc biệt phù hợp. Gần đây hơn, có báo cáo rằng việc giảm PPV trong PLR là một chỉ số tốt về khả năng đáp ứng với dịch truyền ở bệnh nhân được thở máy.[26] Ưu điểm của phương pháp này là không cần đo cung lượng tim để diễn giải kết quả xét nghiệm.
Các biến số siêu âm tim
Kiểm tra siêu âm tim được khuyến cáo thực hiện càng sớm càng tốt ở bệnh nhân bị sốc vì nó có thể nhanh chóng cung cấp thông tin về chức năng tâm thu và tâm trương của tâm thất trái và tâm thất phải, và không có phương pháp tại giường nào khác tốt hơn cho mục đích đó. Các biến số siêu âm tim được sử dụng nhiều nhất ở bệnh nhân nguy kịch là phân suất tống máu thất trái (LVEF), VTI, kích thước thất trái, diện tích cuối tâm trương thất phải (RVEDA)/diện tích cuối tâm trương thất trái (LVEDA), sóng sớm lưu lượng máu tâm trương xuyên van 2 lá (E), sóng nhĩ của lưu lượng máu tâm trương xuyên van 2 lá (A), E/A, tốc độ sớm tâm trương tối đa bằng hình ảnh Doppler mô tại vòng van hai lá (E’), E/E’ , vòng tâm thu lệch ba lá (TAPSE), chuyển động nghịch thường của vách liên thất, áp lực tâm thu động mạch phổi (PAP), sức căng hoặc tốc độ căng của tâm thất trái và đường kính tĩnh mạch chủ dưới. Cung lượng tim có thể thu được từ VTI và diện tích mặt cắt ngang của đường ra thất trái. Ngoài ra, kiểm tra siêu âm tim có thể nhanh chóng phát hiện các rối loạn khác như tràn dịch màng ngoài tim và các bệnh về van tim, đôi khi có thể góp phần gây ra suy tuần hoàn. Hơn nữa, ngoài việc đánh giá chức năng tim và chẩn đoán bệnh tim, siêu âm tim cũng có thể đánh giá khả năng đáp ứng tiền tải. Ví dụ, những thay đổi về VTI trong PLR dự đoán khả năng đáp ứng truyền dịch một cách đáng tin cậy [37].
Các biến số pha loãng nhiệt xuyên phổi
Hiệp hội Y học Chăm sóc Tích cực Châu Âu [1,11] đã khuyến nghị sử dụng theo dõi pha loãng nhiệt qua phổi ở những bệnh nhân phức tạp, đặc biệt là những người bị sốc tuần hoàn và hội chứng suy hô hấp cấp tính liên quan (ARDS). Hệ thống pha loãng nhiệt xuyên phổi cung cấp các phép đo từng lúc cung lượng tim. Tuy nhiên, một giá trị duy nhất của cung lượng tim có giá trị hạn chế vì nó phụ thuộc vào điều kiện trao đổi chất; do đó, cung lượng tim có thể thấp nhưng đủ trong trường hợp nhu cầu oxy thấp hoặc có thể cao nhưng không đủ trong trường hợp nhu cầu oxy cao. Do đó, giá trị cung lượng tim phải luôn được diễn giải bằng ScvO2 hoặc độ chênh PCO2. Các biến số pha loãng nhiệt xuyên phổi quan trọng nhất là lượng nước phổi ngoài mạch (EVLW) và chỉ số thấm mạch máu phổi (PVPI), đại diện cho các thước đo định lượng về thể tích phù phổi và mức độ rò rỉ mao mạch phổi, tương ứng [38]. Hệ thống pha loãng nhiệt xuyên phổi cũng cung cấp các phép đo không liên tục về thể tích cuối tâm trương toàn phần (một dấu hiệu thể tích của tiền tải toàn phần của tim) và chỉ số chức năng tim (một dấu hiệu của chức năng tâm thu của toàn bộ tim). Phương pháp phân tích đường viền xung, được kết hợp với phương pháp pha loãng nhiệt qua phổi, cung cấp khả năng theo dõi PPV và cung lượng tim liên tục và theo thời gian thực. Phân tích đường viền xung có lợi cho việc theo dõi những thay đổi ngắn hạn về cung lượng tim trong các test đáp ứng tiền gánh như PLR hoặc test tắc nghẽn cuối thì thở ra, rất hữu ích khi PPV không đáng tin cậy.
Các biến số ống thông động mạch phổi
Ống thông động mạch phổi là một công cụ xâm lấn hiện được sử dụng ít thường xuyên hơn so với thế kỷ 20. Khi được sử dụng ở những bệnh nhân phức tạp, công cụ này có thể cung cấp các phép đo các biến số huyết động quan trọng như áp lực động mạch phổi, áp lực tắc động mạch phổi (PAOP), áp lực nhĩ phải, SvO2, PvCO2, cung lượng tim ngắt quãng và cung lượng tim liên tục. Tuy nhiên, theo dõi cung lượng tim liên tục được cung cấp bởi ống thông động mạch phổi không phải là theo dõi thời gian thực và do đó không thể được sử dụng để diễn giải các xét nghiệm đáp ứng tiền tải động như PLR hoặc xét nghiệm tắc nghẽn cuối thì thở ra.
Chúng ta nên tích hợp các biến số huyết động như thế nào để quản lý bệnh nhân bị sốc nhiễm trùng?
Bước 1: xác định sự hiện diện của sốc
Đánh giá lâm sàng là cần thiết để xác định bệnh nhân bị sốc. Khi xuất hiện, hạ huyết áp là dấu hiệu tốt của sốc mặc dù huyết áp động mạch có thể duy trì gần như bình thường trong giai đoạn đầu của sốc do cơ chế bù trừ. Các dấu hiệu lâm sàng của tình trạng giảm tưới máu ở da như lốm đốm và tăng thời gian làm đầy mao mạch (CRT) rất khác nhau nhưng khi xuất hiện thì chúng có giá trị vì chúng liên quan đến tình trạng sốc cung lượng tim thấp.[39] Tăng lactate máu là một dấu hiệu sinh học quan trọng của tình trạng thiếu oxy mô toàn phần, mặc dù nó có thể có nguồn gốc khác ngoài tình trạng thiếu oxy mô. Sự giảm tăng lactat máu theo thời gian là dấu hiệu của diễn biến thuận lợi của sốc và là mục tiêu quan trọng được công nhận để hồi sức huyết động ở trạng thái sốc [2,7]. Tuy nhiên, một thử nghiệm ngẫu nhiên có đối chứng đa trung tâm gần đây đã chứng minh rằng chiến lược hồi sức nhằm bình thường hóa CRT ít nhất cũng phù hợp như chiến lược nhắm đến mức lactate huyết thanh về kết quả của bệnh nhân bị sốc nhiễm trùng [40]. Một phân tích Bayesian của nghiên cứu cho thấy hồi sức nhắm mục tiêu CRT có thể dẫn đến tỷ lệ tử vong thấp hơn và giải quyết rối loạn chức năng cơ quan nhanh hơn khi so sánh với chiến lược hồi sức nhắm mục tiêu lactate [41]. Cuối cùng, trong cùng một nghiên cứu, những bệnh nhân có CRT bình thường lúc ban đầu nhận được nhiều can thiệp điều trị hơn và biểu hiện nhiều rối loạn chức năng cơ quan hơn khi được phân bổ vào nhóm lactate.[42] Nói chung, những dữ liệu này nhấn mạnh tầm quan trọng của các chỉ số tưới máu ngoại biên như CRT để chẩn đoán sốc, đánh giá mức độ nghiêm trọng của nó và theo dõi tác dụng của các liệu pháp.
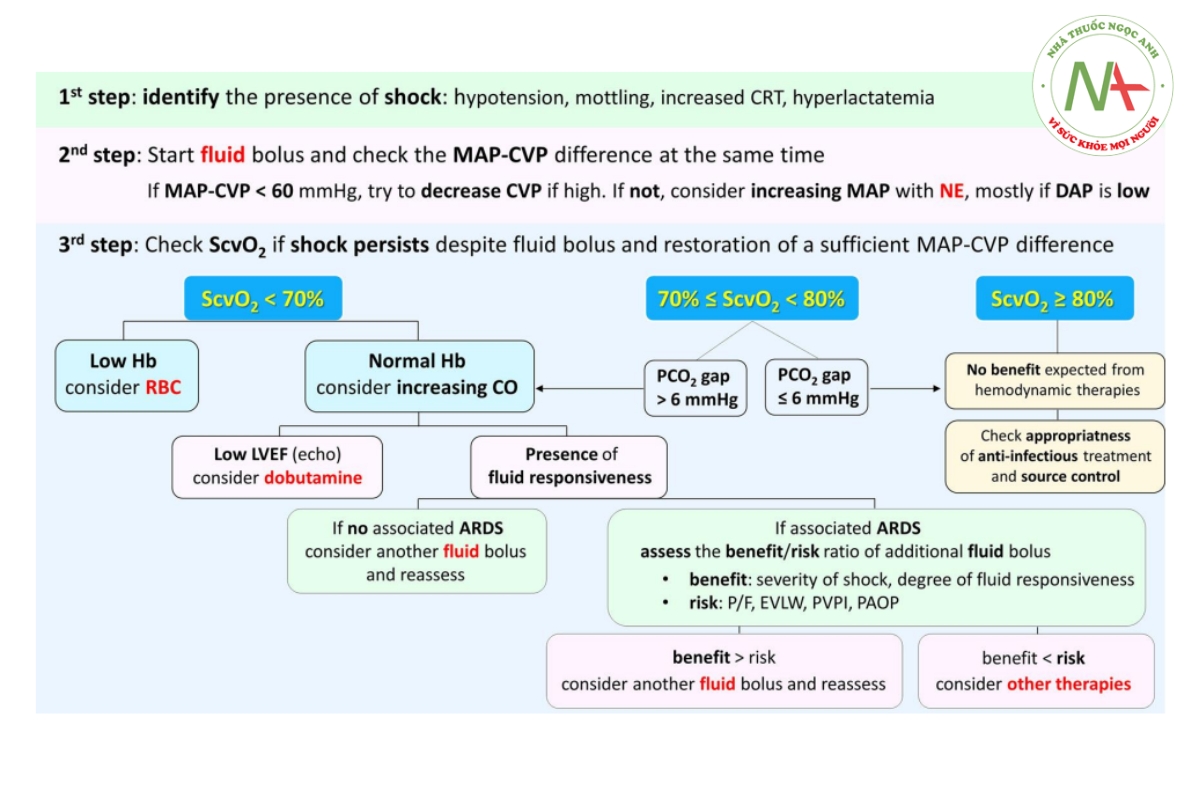
Bước 2: bắt đầu truyền dịch và đồng thời đo MAP-CVP
Hạ huyết áp nặng có thể là nguyên nhân gây giảm tưới máu cơ quan, không phụ thuộc vào cung lượng tim. Trong trường hợp sốc nhiễm trùng, nên đạt được mục tiêu MAP ít nhất là 65 mmHg để hạn chế tình trạng giảm tưới máu do hạ huyết áp [1,2]. Trong một số tình trạng bệnh lý, áp lực ngược đối với tưới máu cơ quan được tăng lên đủ để áp lực tưới máu cơ quan được phản ánh tốt hơn nhiều bởi sự khác biệt giữa MAP và CVP hơn là với MAP duy nhất. Vì vậy, nếu CVP cao, giá trị của nó cần được tính đến để ước tính áp lực tưới máu cơ quan thực tế. Ở những bệnh nhân bị bệnh nặng, người ta đã chứng minh rằng áp lực tưới máu trung bình (MAP-CVP) chứ không phải MAP có liên quan đến sự tiến triển của tổn thương thận cấp tính, với giá trị ngưỡng là 60 mmHg [43]. Do đó, nếu CVP là 0 mmHg, MAP 65 mmHg có thể đủ để duy trì tưới máu thận, nhưng CVP 15 mmHg thì không. Để đảm bảo đủ áp lực tưới máu cơ quan, lựa chọn tốt nhất là giảm CVP khi khả thi vì điều này cũng sẽ làm giảm hoặc ngăn ngừa sự phát triển của phù mô kẽ và do đó ngăn ngừa rối loạn chức năng cơ quan. Ví dụ, nếu một bệnh nhân được thở máy với áp lực dương cuối thì thở ra (PEEP), làm tăng CVP ở một mức độ thay đổi, thì câu hỏi về việc giảm nhẹ mức PEEP để cải thiện áp lực tưới máu trung bình nên được nghĩ tới. Vì nguy cơ giảm PEEP là suy giảm quá trình oxy hóa động mạch nên cần đánh giá cẩn thận lợi ích/nguy cơ của biện pháp can thiệp đó. Lựa chọn thay thế để tăng áp lực tưới máu trung bình là đạt được mục tiêu MAP cao hơn. Các tình trạng bệnh lý khác đòi hỏi mục tiêu MAP cao hơn cho chức năng thận là sự hiện diện của tăng áp lực vùng bụng hoặc sự tồn tại của bệnh tăng huyết áp mãn tính trước đó.[44]
Để chọn phương pháp điều trị thích hợp nhất nhằm tăng MAP, điều cần thiết là phải xem xét DAP. Như đã đề cập ở trên, DAP thấp thường là do trương lực mạch máu thấp [3] và điều này cần phải sử dụng thuốc vận mạch khẩn cấp, cụ thể là norepinephrine. Trong tình trạng trương lực mạch máu bình thường, DAP phải cao hơn bình thường trong trường hợp nhịp tim nhanh do thời gian tâm trương thấp. Do đó, DAP thấp khi có nhịp tim nhanh cho thấy trương lực động mạch bị suy giảm rõ rệt và cần sử dụng norepinephrine ngay lập tức.[45]
Nếu DAP không quá thấp, MAP thấp có thể liên quan đến cung lượng tim không đủ do thể tích nhát bóp thấp. Sự hiện diện của PP thấp có thể là một dấu hiệu bổ sung cho thể tích nhát bóp thấp, mặc dù thể tích nhát bóp thấp có thể liên quan đến PP bình thường ở bệnh nhân có động mạch cứng.
Bước 3: đo ScvO2, điểm đánh dấu cân bằng VO2/DO2
Nếu việc truyền dịch ban đầu và điều chỉnh tình trạng hạ huyết áp không đủ để đảo ngược các dấu hiệu sốc, điều quan trọng là phải kiểm tra ScvO2, một dấu hiệu của sự cân bằng VO2/DO2.
ScvO2 <70%
Nếu ScvO2 thấp (<70%), điều đó cho thấy DO2 không đủ để tạo ra VO2 và việc xem xét tăng DO2 là hợp lý. Ở giai đoạn này, có hai lựa chọn: (1) nếu Hb thấp thì có thể xem xét truyền máu và (2) nếu Hb không thấp thì DO2 không đủ là do cung lượng tim không đủ, liên quan đến không đủ tiền tải hoặc do thay đổi khả năng co bóp của tim. Nếu có, có thể sử dụng các chỉ số hoặc xét nghiệm về khả năng đáp ứng dịch truyền (xem ở trên). Siêu âm tim qua thành ngực có lợi ở chỗ nó có thể giúp phát hiện khả năng đáp ứng dịch truyền (những thay đổi về VTI trong PLR) và chẩn đoán rối loạn chức năng tim. Nếu vẫn còn đáp ứng với dịch truyền, có thể xem xét truyền dịch, đặc biệt nếu không có nguy cơ hình thành phù phổi. LVEF thấp (<45%) gợi ý rõ ràng rằng sốc nhiễm trùng có liên quan đến ức chế cơ tim, và trong bối cảnh này, có thể xem xét sử dụng thuốc tăng co bóp cơ tim, cụ thể là dobutamine. Rối loạn chức năng tâm thất phải có thể bị nghi ngờ khi tỷ lệ RVEDA/LVEDA cao (>0,6).[46] Một liệu pháp cụ thể có thể được thực hiện sau khi chẩn đoán cơ chế cơ bản bằng siêu âm tim.
Ở những bệnh nhân không đáp ứng đầy đủ với điều trị ban đầu hoặc ở những người bị ARDS nặng, nên thu thập thêm thông tin do tính phức tạp của tình huống.[1,8] Trong những trường hợp như vậy, các công nghệ theo dõi huyết động tiên tiến như hệ thống pha loãng nhiệt xuyên phổi hoặc đặt ống thông động mạch phổi có thể cung cấp thông tin quan trọng để đánh giá sự cân bằng lợi ích/nguy cơ của các biện pháp can thiệp điều trị như liệu pháp truyền dịch.[8] Trong trường hợp ARDS, kiến thức về EVLW và PVPI (pha loãng nhiệt xuyên phổi) hoặc PAOP (ống thông động mạch phổi) có thể tạo điều kiện thuận lợi cho việc đánh giá nguy cơ truyền dịch [38] và đôi khi hạn chế việc truyền dịch IV, ngay cả khi có phản ứng với dịch truyền. Để đưa ra quyết định phù hợp, các bác sĩ lâm sàng nên xem xét mức độ đáp ứng dịch, mức độ nghiêm trọng của suy tuần hoàn và các rối loạn chức năng cơ quan tiếp theo (ví dụ, rối loạn chức năng thận), mức độ nghiêm trọng của phù phổi dựa trên EVLW, PVPI và PAOP, và mức độ nghiêm trọng của tình trạng thiếu oxy máu.
ScvO2 từ 70% – 80%
Nếu ScvO2 nằm trong phạm vi bình thường (từ 70% đến 80%) khi có tình trạng thiếu oxy ở mô thì có khả năng do khả năng chiết xuất oxy bị suy giảm. Trong những trường hợp như vậy, kiến thức về khoảng cách PCO2 là rất cần thiết vì dấu hiệu này cho thấy cung lượng tim phù hợp với các điều kiện trao đổi chất toàn phần chỉ bị ảnh hưởng nhẹ do suy giảm khả năng trích xuất oxy. Nếu khoảng cách PCO2 tăng (>6 mmHg), tăng cung lượng tim là một lựa chọn điều trị. Nên chọn liệu pháp thích hợp để tăng cung lượng tim (dịch hoặc dobutamine) sau khi kiểm tra khả năng đáp ứng dịch bằng các chỉ số động và sau khi đánh giá chức năng tim bằng siêu âm tim, và trong một số trường hợp phức tạp, sau khi lắp các thiết bị theo dõi huyết động tiên tiến như chi tiết ở trên. Nếu khoảng cách PCO2 bình thường (<6 mmHg) trong bối cảnh sốc, có khả năng rối loạn vi tuần hoàn và chuyển hóa tế bào là nguyên nhân gây ra tình trạng thiếu oxy mô và việc tăng cung lượng tim không thể là ưu tiên hàng đầu.
ScvO2 >80%
Nếu ScvO2 cao hơn bình thường (>80%) trong trường hợp sốc, điều đó cho thấy có sự suy giảm rõ rệt về khả năng trích xuất oxy và điều này liên quan đến kết cuộc xấu [47]. Vì vậy, việc tăng cung lượng tim và DO2 là phi logic trong tình huống này. Tuy nhiên, điều quan trọng là phải đảm bảo điều trị chống nhiễm trùng và kiểm soát nguồn bệnh đầy đủ, đồng thời duy trì các liệu pháp hỗ trợ cơ quan thích hợp.
=> Tham khảo thêm: Bệnh não liên quan nhiễm trùng huyết: từ mê sảng đến mất trí nhớ.
Các kết luận
Sốc nhiễm trùng là một trạng thái bệnh lý phức tạp bao gồm nhiều rối loạn vi tuần hoàn và hệ thống có thể thay đổi theo thời gian và tùy từng bệnh nhân. Do đó, điều quan trọng là thu thập tất cả thông tin liên quan có thể giúp xác định sự hiện diện và mức độ của từng rối loạn này và sau đó chọn phương pháp điều trị huyết động thích hợp nhất. Việc tích hợp các biến số huyết động là điều cần thiết để đánh giá sự cân bằng lợi ích/nguy cơ của mỗi can thiệp điều trị.
Tài liệu tham khảo
- [1] Cecconi M, De Backer D, Antonelli M, Beale R, Bakker J, Hofer C, et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Med 2014;40(12):1795-815. doi:10.1007/s00134-014-3525-z.
- [2] Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French C, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med 2021;47(11):1181-247. doi:10.1007/s00134-021-06506-y.
- [3] Lamia B, Teboul JL, Monnet X, Osman D, Maizel J, Richard C, et al. Contribution of arterial stiffness and stroke volume to peripheral pulse pressure in ICU patients: an arterial tonometry study. Intensive Care Med 2007;33(11):1931-7. doi:10.1007/s00134-007-0738-4.
- [4] Pottecher T, Calvat S, Dupont H, Durand-Gasselin J, Gerbeaux P. Haemodynamic management of severe sepsis: recommendations of the French Intensive Care Societies (SFAR/SRLF) Consensus Conference, 13 October 2005, Paris, France. Crit Care 2006;10(4):311. doi:10.1186/cc4965.
- [5] Wong BT, Chan MJ, Glassford NJ, Mảrtensson J, Bion V, Chai SY, et al. Mean arterial pressure and mean perfusion pressure deficit in septic acute kidney injury. J Crit Care 2015;30(5):975-81. doi:10.1016/j.jcrc.2015.05.003.
- [6] Chemla D, Hébert JL, Coirault C, Zamani K, Suard I, Colin P, et al. Total arterial compliance estimated by stroke volume-to-aortic pulse pressure ratio in humans. Am J Physiol 1998;274(2):H500-5. doi:10.1152/ajpheart.1998.274.2.H500.
- [7] Vincent JL, Quintairos E, Silva A, Couto L Jr, Taccone FS. The value of blood lactate kinetics in critically ill patients: a systematic review. Crit Care 2016;20(1):257. doi:10.1186/s13054-016- 1403-5.
- [8] Teboul JL, Hamzaoui O, Monnet X. SvO2 to monitor resuscitation of septic patients: let’s just understand the basic physiology. Crit Care 2011;15(6):1005. doi:10.1186/cc10491.
- [9] Reinhart K, Kuhn HJ, Hartog C, Bredle DL. Continuous central venous and pulmonary artery oxygen saturation monitoring in the critically ill. Intensive Care Med 2004;30(8):1572-8. doi:10.1007/s00134-004-2337-y.
- [10] Dueck MH, Klimek M, Appenrodt S, Weigand C, Boerner U. Trends but not individual values of central venous oxygen saturation agree with mixed venous oxygen saturation during varying hemodynamic conditions. Anesthesiology 2005;103(2):249-57. doi:10.1097/00000542-200508000-00007.
- [11] Teboul JL, Saugel B, Cecconi M, De Backer D, Hofer CK, Monnet X, et al. Less invasive hemodynamic monitoring in critically ill patients. Intensive Care Med 2016;42(9):1350-9. doi:10.1007/s00134-016-4375-7.
- [12] Scheeren TWL, Wicke JN, Teboul JL. Understanding the carbon dioxide gaps. Curr Opin Crit Care 2018;24(3):181-9. doi:10.1097/MCC.0000000000000493.
- [13] Vallet B, Teboul JL, Cain S, Curtis S. Venoarterial CO (2) difference during regional ischemic or hypoxic hypoxia. J Appl Physiol 2000;89(4):1317-21 1985. doi:10.1152/jappl.2000.89.4.1317.
- [14] Michard F, Teboul JL. Predicting fluid responsiveness in ICU patients: a critical analysis of the evidence. Chest 2002;121(6):2000-8. doi:10.1378/chest.121.6.2000.
- [15] Vincent JL, Sakr Y, Sprung CL, Ranieri VM, Reinhart K, Gerlach H, et al. Sepsis in European intensive care units: results of the SOAP study. Crit Care Med 2006;34(2):344-53. doi:10.1097/01.ccm.0000194725.48928.3a.
- [16] Boyd JH, Forbes J, Nakada TA, Walley KR, Russell JA. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med 2011;39(2):259-65. doi:10.1097/CCM.0b013e3181feeb15.
- [17] Vaara ST, Korhonen AM, Kaukonen KM, Nisula S, Inkinen O, Hoppu S, et al. Fluid overload is associated with an increased risk for 90-day mortality in critically ill patients with renal replacement therapy: data from the prospective FINNAKI study. Crit Care 2012;16(5):R197. doi:10.1186/cc11682.
- [18] Michard F, Teboul JL. Using heart-lung interactions to assess fluid responsiveness during mechanical ventilation. Crit Care 2000;4(5):282-9. doi:10.1186/cc710.
- [19] Mesquida J, Kim HK, Pinsky MR. Effect of tidal volume, intrathoracic pressure, and cardiac contractility on variations in pulse pressure, stroke volume, and intrathoracic blood volume. Intensive Care Med 2011;37(10):1672-9. doi:10.1007/s00134-011-2304-3.
- [20] Michard F, Boussat S, Chemla D, Anguel N, Mercat A, Lecarpentier Y, et al. Relation between respiratory changes in arterial pulse pressure and fluid responsiveness in septic patients with acute circulatory failure. Am J Respir Crit Care Med 2000;162(1):134-8. doi:10.1164/ajrccm.162.1.9903035.
- [21] Marik PE, Cavallazzi R, Vasu T, Hirani A. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patients: a systematic review of the literature. Crit Care Med 2009;37(9):2642-7. doi:10.1097/CCM.0b013e3181a590da.
- [22] Yang X, Du B. Does pulse pressure variation predict fluid responsiveness in critically ill patients? A systematic review and meta-analysis. Crit Care 2014;18(6):650. doi:10.1186/s13054- 014-0650-6.
- [23] Michard F, Chemla D, Teboul JL. Applicability of pulse pressure variation: how many shades of grey. Crit Care 2015;19(1):144. doi:10.1186/s13054-015-0869-x.
- [24] Myatra SN, Monnet X, Teboul JL. Use of ‘tidal volume challenge’ to improve the reliability of pulse pressure variation. Crit Care 2017;21(1):60. doi:10.1186/s13054-017-1637-x.
- [25] Myatra SN, Prabu NR, Divatia JV, Monnet X, Kulkarni AP, Teboul JL. The changes in pulse pressure variation or stroke volume variation after a “tidal volume challenge” reliably predict fluid responsiveness during low tidal volume ventilation. Crit Care Med 2017;45(3):415-21. doi:10.1097/CCM.0000000000002183.
- [26] Taccheri T, Gavelli F, Teboul JL, Shi R, Monnet X. Do changes in pulse pressure variation and inferior vena cava distensibility during passive leg raising and tidal volume challenge detect preload responsiveness in case of low tidal volume ventilation. Crit Care 2021;25(1):110. doi:10.1186/s13054-021-03515-7.
- [27] Shi R, Ayed S, Moretto F, Azzolina D, De Vita N, Gavelli F, et al. Tidal volume challenge to predict preload responsiveness in patients with acute respiratory distress syndrome under prone position. Crit Care 2022;26(1):219. doi:10.1186/s13054-022-04087-w.
- [28] Messina A, Montagnini C, Cammarota G, De Rosa S, Giuliani F, Muratore L, et al. Tidal volume challenge to predict fluid responsiveness in the operating room: an observational study. Eur J Anaesthesiol 2019;36(8):583-91. doi:10.1097/EJA.0000000000000998.
- [29] Messina A, Montagnini C, Cammarota G, Giuliani F, Muratore L, Baggiani M, et al. Assessment of fluid responsiveness in prone neurosurgical patients undergoing protective ventilation: role of dynamic indices, tidal volume challenge, and end-expiratory occlusion test. Anesth Analg 2020;130(3):752-61. doi:10.1213/ANE.0000000000004494.
- [30] Gavelli F, Shi R, Teboul JL, Azzolina D, Monnet X. The end-expiratory occlusion test for detecting preload responsiveness: a systematic review and meta-analysis. Ann Intensive Care 2020;10(1):65. doi:10.1186/s13613-020-00682-8.
- [31] Monnet X, Osman D, Ridel C, Lamia B, Richard C, Teboul JL. Predicting volume responsiveness by using the end-expiratory occlusion in mechanically ventilated intensive care unit patients. Crit Care Med 2009;37(3):951-6. doi:10.1097/CCM.0b013e3181968fe1.
- [32] Monnet X, Bleibtreu A, Ferré A, Dres M, Gharbi R, Richard C, et al. Passive leg-raising and end-expiratory occlusion tests perform better than pulse pressure variation in patients with low respiratory system compliance. Crit Care Med 2012;40(1):152-7. doi:10.1097/CCM.0b013e31822f08d7.
- [33] Monnet X, Marik P, Teboul JL. Passive leg raising for predicting fluid responsiveness: a systematic review and meta-analysis. Intensive Care Med 2016;42(12):1935-47. doi:10.1007/s00134-015-4134-1.
- [34] Beurton A, Teboul JL, Girotto V, Galarza L, Anguel N, Richard C, et al. Intraabdominal hypertension is responsible for false negatives to the passive leg raising test. Crit Care Med 2019;47(8):e639-47. doi:10.1097/CCM.0000000000003808.
- [35] Guérin L, Teboul JL, Persichini R, Dres M, Richard C, Monnet X. Effects of passive leg raising and volume expansion on mean systemic pressure and venous return in shock in humans. Crit Care 2015;19: 411. doi:10.1186/s13054-015-1115-2.
- [36] Monnet X, Teboul JL. Passive leg raising: five rules, not a drop of fluid. Crit Care 2015;19(1):18. doi:10.1186/s13054-014-0708-5.
- [37] Lamia B, Ochagavia A, Monnet X, Chemla D, Richard C, Teboul JL. Echocardiographic prediction of volume responsiveness in critically ill patients with spontaneously breathing activity. Intensive Care Med 2007;33(7):1125-32. doi:10.1007/s00134-007-0646-7.
- [38] Jozwiak M, Teboul JL, Monnet X. Extravascular lung water in critical care: recent advances and clinical applications. Ann Intensive Care 2015;5(1):38. doi:10.1186/s13613-015-0081-9.
- [39] Hiemstra B, Eck RJ, Wiersema R, Kaufmann T, Koster G, Scheeren TWL, et al. Clinical examination for the prediction of mortality in the critically Ill: the simple intensive care studies-I. Crit Care Med 2019;47(10):1301-9. doi:10.1097/CCM.0000000000003897.
- [40] Hernández G, Ospina-Tascón GA, Damiani LP, Estenssoro E, Dubin A, Hurtado J, et al. Effect of a resuscitation strategy targeting peripheral perfusion status vs serum lactate levels on 28-day mortality among patients with septic shock: the ANDROMEDA-SHOCK randomized clinical trial. JAMA 2019;321(7):654-64. doi:10.1001/jama.2019.0071.
- [41] Zampieri FG, Damiani LP, Bakker J, Ospina-Tascón GA, Castro R, Cavalcanti AB, et al. Effects of a resuscitation strategy targeting peripheral perfusion status versus serum lactate levels among patients with septic shock. A bayesian reanalysis of the ANDROMEDA-SHOCK trial. Am J Respir Crit Care Med 2020;201(4):423-9. doi:10.1164/rccm.201905-0968OC.
- [42] Kattan E, Hernández G, Ospina-Tascón G, Valenzuela ED, Bakker J, Castro R, et al. A lactate- targeted resuscitation strategy may be associated with higher mortality in patients with septic shock and normal capillary refill time: a post hoc analysis of the ANDROMEDA-SHOCK study. Ann Intensive Care 2020;10(1):114. doi:10.1186/s13613-020-00732-1.
- [43] Ostermann M, Hall A, Crichton S. Low mean perfusion pressure is a risk factor for progression of acute kidney injury in critically ill patients – A retrospective analysis. BMC Nephrol 2017;18(1):151. doi:10.1186/s12882-017-0568-8.
- [44] Asfar P, Meziani F, Hamel JF, Grelon F, Megarbane B, Anguel N, et al. High versus low blood- pressure target in patients with septic shock. N Engl J Med 2014;370(17):1583-93. doi:10.1056/NEJMoa1312173.
- [45] Hamzaoui O, Teboul JL. Importance of diastolic arterial pressure in septic shock: PRO. J Crit Care 2019;51: 238-40. doi:10.1016/j.jcrc.2018.10.032.
- [46] Huang S, Sanfilippo F, Herpain A, Balik M, Chew M, Clau-Terré F, et al. Systematic review and literature appraisal on methodology of conducting and reporting critical-care echocardiography studies: a report from the European Society of Intensive Care Medicine PRICES expert panel. Ann Intensive Care 2020;10(1):49. doi:10.1186/s13613-020-00662-y.
- [47] Textoris J, Fouché L, Wiramus S, Antonini F, Tho S, Martin C, et al. High central venous oxygen saturation in the latter stages of septic shock is associated with increased mortality. Crit Care 2011;15(4): R176. doi:10.1186/cc10325.